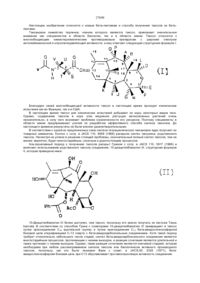
Лактам
Номер патенту: 74849
Опубліковано: 15.02.2006
Автори: Летімер Лі Х., ОДІА Джеймс Едмунд, Ніссен Джеффрі С., Торсет Юджін Д., Джон Варез, Танг Джей С., Макденіел Стейсі Л.
Формула / Реферат
1. Сполука формули І, (N)-((S)-2-гідрокси-3-метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он:
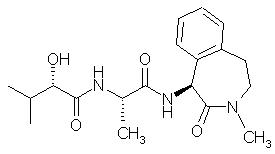 І .
І .
2. Фармацевтична композиція, яка містить сполуку за п.1 та фармацевтично прийнятний розріджувач.
3. Спосіб інгібування вивільнення ![]() -амілоїдного пептиду та/або його синтезу, при якому вводять в організм пацієнта, що потребує такого інгібування, ефективну кількість сполуки за п.1.
-амілоїдного пептиду та/або його синтезу, при якому вводять в організм пацієнта, що потребує такого інгібування, ефективну кількість сполуки за п.1.
4. Спосіб лікування хвороби Альцгеймера, при якому вводять в організм пацієнта, що потребує такого лікування, ефективну кількість сполуки за п.1.
5. Спосіб профілактики хвороби Альцгеймера, при якому вводять в організм пацієнта, що потребує такої профілактики, ефективну кількість сполуки за п.1.
6. Спосіб інгібування розвитку хвороби Альцгеймера, при якому вводять в організм пацієнта, що потребує такого інгібування, ефективну кількість сполуки за п.1.
Текст
1. Сполука формули І, (N)-((S)-2-гідрокси-3метилбутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он: O I N H N CH3 Цей винахід належить до галузі фармацевтичної та органічної хімії і стосується сполуки, яка інгібує вивільнення β-амілоїдного пептиду та/або його синтез. Певні лактами, які інгібують вивільнення βамілоїдного пептиду та/або його синтез і, відповідно, є корисними для лікування хвороби Альцгеймера, [описані в патентній заявці PCT/US97/22986]. Сполука згідно з цим винаходом, (N)-((S)-2гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепін2-он, є корисною для інгібування вивільнення βамілоїдного пептиду та/або його синтезу і, відповідно, є корисною при лікуванні хвороби Альцгеймера і має сприятливі характеристики ефективності 74849 O та безпечності. Цей винахід пропонує (N)-((S)-2-гідрокси-3метил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он. Згідно з одним із методичних аспектів, цей винахід стосується способу інгібування вивільнення β-амілоїдного пептиду та/або його синтезу, який включає введення в організм пацієнта, що потребує такого інгібування, ефективної кількості (N)((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3бензазепін-2-ону. Згідно з конкретним варіантом здійснення цього способу, цей винахід пропонує спосіб лікування хвороби Альцгеймера, який включає введення в організм пацієнта, що потребує такого лікування, ефективної кількості (N)-((S) (11) CH3 UA O H N (19) OH 2. Фармацевтична композиція, яка містить сполуку за п.1 та фармацевтично прийнятний розріджувач. 3. Спосіб інгібування вивільнення -амілоїдного пептиду та/або його синтезу, при якому вводять в організм пацієнта, що потребує такого інгібування, ефективну кількість сполуки за п.1. 4. Спосіб лікування хвороби Альцгеймера, при якому вводять в організм пацієнта, що потребує такого лікування, ефективну кількість сполуки за п.1. 5. Спосіб профілактики хвороби Альцгеймера, при якому вводять в організм пацієнта, що потребує такої профілактики, ефективну кількість сполуки за п.1. 6. Спосіб інгібування розвитку хвороби Альцгеймера, при якому вводять в організм пацієнта, що потребує такого інгібування, ефективну кількість сполуки за п.1. C2 2 (13) 1 3 74849 4 2-гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1ка, де R4 є С1-С4-алкіл і яка переносить бісалкокаміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінсикарбонілацетил до сполуки формули (1), напри2-ону. Цей винахід пропонує також спосіб профіклад, бісалкоксикарбонілоцтові кислоти та бісаллактики або інгібування розвитку хвороби Альцкоксикарбонілацетилхлориди [дивись Бен-Ішаї геймера, який включає введення в організм пацієBen-Ishai, Tetrahedron. 43, 439-450 (1987)]. нта, що потребує такої профілактики або Наприклад, сполуку формули (1) уводять у коінгібування, ефективної кількості (N)-((S)-2нтакт із придатною бісалкоксикарбонілоцтовою гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1кислотою й одержують сполуку формули (2). Такі аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінреакції сполучення є звичайними в синтезі пепти2-ону. дів, і при їх проведенні можна застосувати методи Згідно з іншим варіантом здійснення, цей висинтезу, використовувані в цій галузі. Наприклад, нахід пропонує фармацевтичну композицію, яка для полегшення цього ацилювання можна застомістить (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(Lсувати добре відомі агенти сполучення, наприаланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідроклад, карбодііміди, з використанням або без вико1Н-3-бензазепін-2-он та фармацевтично прийнятристання добре відомих домішок, наприклад, Nний розріджувач. Такі композиції є корисними для гідроксисукциніміду, 1-гідроксибензотриазолу тоінгібування вивільнення β-амілоїдного пептиду що. В таких реакціях сполучення часто застосовута/або його синтезу, в тому числі для лікування ють придатну основу для зв'язування кислоти, що хвороби Альцгеймера. вивільнюється при реакції. До придатних основ Терміни, вживані в цьому описі, мають знаналежать, наприклад, триетиламін, Ν,Νчення, вказані нижче. діізопропілетиламін, N-метилморфолін тощо. РеаТермін "ее", або "енантіомерний надлишок", кцію зручно проводити в інертному апротонному стосується надлишку процентного вмісту одного полярному розріджувачі, наприклад, в диметиленантіомера, Е1, в суміші обох енантіомерів формаміді, хлористому метилені, хлороформі, (Е1+Е2), обчисленого за рівнянням ((Е1ацетонітрилі, тетрагідрофурані тощо. Як правило, реакцію проводять при температурі від приблизно Е2)/(Е1+Е2)) 100=ее. Як добре відомо в практиці, 0°С до приблизно 60°С, і вона вимагає часу від енантіомерний надлишок можна визначити метоприблизно 1год. до приблизно 24год. Після заведом капілярного електрофорезу та рідинної хроршення реакції продукт формули (2) виділяють матографії високої ефективності (РХВЕ) згаданих звичайними способами, в тому числі екстракцією, сполук або їхніх похідних на хіральній нерухомій осадженням, хроматографією, фільтруванням, фазі. розтиранням, кристалізацією тощо. В цьому описі для позначення стереохімічної В альтернативному варіанті, наприклад, споконфігурації окремих ізомерів застосовано позналуку формули (1) уводять у контакт із придатним чення (R)- та (S)- за Каном-Прелогом-Інгольдом бісалкоксикарбонілацетилхлоридом і одержують (Cahn-Prelog-Inhold) та символи L- і D-. сполуку формули (2). Такі хлорангідриди кислот Сполуку згідно з цим винаходом можна одерлегко одержати з відповідних кислот способами, жати, як описано нижче. У поданих нижче Схемах добре відомими в практиці, наприклад, дією трихусі замісники, якщо не зазначено протилежне, відлористого фосфору, оксихлориду фосфору, п'ятиповідають поданим вище визначенням, а всі реахлористого фосфору, тіонілхлориду або оксалілхгенти є добре відомими й прийнятими в практиці. лориду з використанням або без використання Схема 1 незначної кількості диметилформаміду в інертному розчиннику, наприклад, в толуолі, хлористому метилені або хлороформі, при температурах приблизно від 0 до 80°С Реакцію, як правило, проводять протягом часу від 1год. до 24год. Хлорангідрид кислоти можна виділити та очистити, або його часто можна використати безпосередньо, тобто з виділенням та/або очищенням або без цих операцій. В таких реакціях ацилювання, як правило, застосовують придатну основу для зв'язування кислоти, що вивільнюється при реакції. До придатних основ належать, наприклад, піридин, триетиламін, Ν,Ν-діізопропілетиламін, N-метилморфолін тощо. Реакцію зручно проводити в інертному апротонному полярному розріджувачі, наприклад, у хлористому метилені, хлороформі, тетрагідрофурані Згідно зі Схемою 1, стадія 1, Nтощо. Як правило, реакцію проводять при темпеметилфенетиламін формули (1) ацилюють придаратурі від приблизно -20°С до приблизно 80°С, і тним реагентом переносу бісалкоксикарбонілацевона вимагає часу від приблизно 1год. до приблитату, одержуючи сполуку формули (2). Nзно 24год. Після завершення реакції продукт форметилфенетиламін є комерційно доступним, і його мули (2) виділяють звичайними способами, в тому легко одержати шляхом реакції 2-бром- або 2числі екстракцією, осадженням, хроматографією, хлоретилбензолу з метиламіном в умовах, добре фільтруванням, розтиранням, кристалізацією товідомих і прийнятих у практиці. Придатним реагенщо. том переносу бісалкоксикарбонілацетату є сполуЗгідно зі Схемою 1, стадія 2, сполуку формули 5 74849 6 (2) циклізують і одержують сполуку формули (3). наприклад, в метил-трет-бутиловому простому Наприклад, сполуку формули (2) уводять у коефірі, етилацетаті, тетрагідрофурані, ацетоні або нтакт із кислотою, наприклад, із метансульфокисдіетиловому ефірі з водою. Таку реакцію проволотою або сірчаною кислотою. Як правило, реакдять із використанням придатної основи, наприцію проводять із використанням вибраної кислоти клад, гідроксиду натрію, гідроксиду калію, карбояк розчинника. В типових випадках реагенти спонату натрію, карбонату калію, бікарбонату натрію чатку змішують при температурі від приблизно або бікарбонату калію. Як правило, реакцію про20°С до приблизно 0°С, після чого дають суміші водять при інтенсивному перемішуванні при темнагріватися до температури в межах від темперапературах від приблизно -20°С до приблизно 80°С, тури навколишнього середовища до приблизно і вона вимагає часу від приблизно 1год. до приб60°С. Реакція циклізації вимагає, як правило, часу лизно 24год. Після завершення реакції продукт від приблизно 12год. до приблизно 72год. Після формули (7) виділяють звичайними способами, в завершення реакції продукт формули (3) виділятому числі екстракцією, осадженням, хроматограють звичайними способами, в тому числі екстракфією, фільтруванням, розтиранням, кристалізаціцією, осадженням, хроматографією, фільтруванєю тощо. ням, розтиранням, кристалізацією тощо. Згідно зі Схемою 2, стадія 2, сполуку формули Згідно зі Схемою 1, стадія 3, від сполуки фор(7) циклізують і одержують сполуку формули (8). мули (3) відщеплюють групу захисту й одержують Такі реакції циклізації проводять у кислоті, наприсполуку формули (4). клад, у сірчаній кислоті. Як правило, цю кислоту Відщеплення таких алкоксикарбонільних груп використовують як розчинник. В типових випадках захисту аміну є добре відомим і прийнятим у пракзгадану реакцію проводять при температурі в метиці. Дивись, наприклад, монографію Т. Гріні "Гружах від приблизно -20°С до приблизно 150°С, і пи захисту в органічному синтезі" (Theodora вона вимагає, як правило, часу від приблизно Greene, Protecting Groups in Organic Synthesis. 1st 1год. до приблизно 24год. Після завершення реакand 2st Editions, Wiley-Interscience) і роботу Бенції продукт формули (8) виділяють звичайними Ішаї [Ben-Ishai, Tetrahedron. 43, 439-450 (1987)]. способами, в тому числі екстракцією, осадженням, Схема 2 хроматографією, фільтруванням, розтиранням, кристалізацією тощо. Згідно зі Схемою 2, стадія 3, сполуку формули (8) піддають реакції переносу аміну для одержання сполуки формули (9). На Схемі 2 показано оксимування. Таке оксимування проводять шляхом уведення еноляту сполуки формули (8) у реакцію з реагентами переносу оксиму, наприклад, складним ефіром - алкілнітритом. Енолят сполуки формули (8) можна одержати шляхом реакції сполуки формули (8) із придатною основою, наприклад, із трет-бутилатом калію, діізопропіл амідом літію, гексаметилсилазидом літію, гексаметил сил азидом натрію, гексаметилсилазидом калію тощо. Приклади таких реакцій оксимування наведені в монографії Уїлера та інших "Органічні синтези" [Wheeler et al., Organic Syntheses, Coll. Vol. VI, p.840], де описані реакції ізоамілнітриту з кетоном для одержання цільового оксиму. Цю реакцію, як правило, проводять у розчиннику, наприклад, в тетрагідрофурані. У типових випадках реакцію проводять при температурі від приблизно -20°С до приблизно 50°С, і вона, як правило, вимагає часу від приблизно 1год. до приблизно 24год. Після завершення реакції продукт формули (9) виділяЗгідно зі Схемою 2, стадія 1, придатну похідну ють звичайними способами, в тому числі екстракфенілоцтової кислоти формули (5) сполучають із цією, осадженням, хроматографією, фільтруванпридатним ацеталем формули (6) і одержують ням, розтиранням, кристалізацією тощо. сполуку формули (7). Придатною похідною феніВ альтернативному варіанті таку реакцію пелоцтової кислоти формули (5) є сполука, де А2 є реносу аміну можна проводити за участю азиду. активуюча група, наприклад, -ОН, -СІ або -Вr. Азид можна одержати шляхом реакції еноляту Придатним ацеталем формули (6) є сполука, де R5 сполуки формули (8) із реагентами переносу азиє С1-С4-алкіл. Такі реакції сполучення є звичайниду, наприклад, із толуолсульфонілазидом та трііми в синтезі пептидів, і при їх проведенні можна зопропілбензолсульфонілазидом. Приклади таких застосувати методи синтезу, використовувані в цій реакцій наведено в роботі Еванса та інших [Evans галузі, як описано для Схеми 1, стадія 1. et al., J. Am. Chem. Soc. 112:4011-4030 (1990)41]. Сполучення, показане на Схемі 2, стадія 1, Цю реакцію, як правило, проводять у розчиннику, можна також виконувати в умовах реакції Шоттенаприклад, в тетрагідрофурані. У типових випадна-Баумана (Schotten-Baumann), застосовуючи ках реакцію проводять при температурі від прибхлорангідрид кислоти формули (5) та придатний лизно -20°С до приблизно 50°С, і вона вимагає ацеталь формули (6) у змішаному розчиннику, 7 74849 8 часу від приблизно 1год. до приблизно 24год. Піс2-он можна одержати з умістом (S)-енантіомера ля завершення реакції продукт формули (9), який більше ніж 80%, у варіанті, якому віддається перемістить азидогрупу замість оксиму, виділяють звивага, більше ніж 90%, у варіанті, якому віддається чайними способами, в тому числі екстракцією, ще більша перевага, більше ніж 95%, у варіанті, осадженням, хроматографією, фільтруванням, якому віддається найбільша перевага, більше розтиранням, кристалізацією тощо. ніж 97%. Як показано на Схемі 2, стадія 4, оксим відноНаприклад, (S)-ізомер сполуки формули (4) влюють, одержуючи сполуку формули (4). Таке можна виділити шляхом фракційної кристалізації відновлення виконують шляхом оброблення водйого солей - дибензоїлтартрату, солей з (R)-(-)-dнем та відповідним каталізатором, наприклад, нікамфорасульфоновою кислотою і (D)-(-)келем Ренея або паладієвими каталізаторами, мигдалевою кислотою. Очікується, що для цієї наприклад, паладієм на вугіллі. Цю реакцію, як мети придатними є різноманітні дибензоїлтартраправило, проводять у розчиннику, наприклад, у ти. Зокрема, перевага віддається дибензоїльним тетрагідрофурані, етилацетаті або в нижчих спирскладним ефірам, які мають у яяря-положенні затах, наприклад, у метанолі, етанолі та ізопропаномісник, вибраний із групи, до якої входять водень, лі, в оцтовій кислоті, воді, водному розчині аміаку галоїд, C1-C4-алкіл та C1-C4-алкоксигрупа, а найбітощо або в їх сумішах. В типових випадках реакльша перевага віддається ди-n-толуїлтартрату. цію проводять під тиском водню в межах від атмоДля одержання (S)-ізомеру застосовують ди-nсферного тиску до приблизно 600 фунтів на кв. толуїл-L-тартрат. дюйм (4137кПа). Як правило, реакцію проводять Згідно із представленим способом, сполуку при температурі від приблизно 20°С до приблизно формули (4) уводять у контакт із вибраною кисло100°С, і вона, як правило, вимагає часу від прибтою. Як правило, можна використовувати кількість лизно 1год. до приблизно 24год. Після завершення кислоти в межах від приблизно 0,4 молярного екреакції продукт формули (4) виділяють звичайнивівалента до значного надлишку; перевага віддами способами, в тому числі екстракцією, осадженється кількості від приблизно 0,4 до 1,5 молярного ням, хроматографією, фільтруванням, розтиранеквівалента, а більша перевага - кількості від приням, кристалізацією тощо. близно 0,5 до 1,1 молярного еквівалента. В альтернативному варіанті, де амін переноПроцес проводять звичайно шляхом кристалісять за участю азиду, відновлюють азидогрупу. зації солі кислоти з розчину. При цьому придатниТакі реакції проводять шляхом гідрування, як опими є, зокрема, такі розчинники, як нижчі спирти, в сано вище. тому числі метанол, етанол, н-пропанол, ізопропаСпособи одержання (N)-((S)-2-гідрокси-3нол, бутанол, втор-бутанол, ізобутанол, третметил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилбутанол, аміловий спирт, ізоаміловий спирт, трет2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону показані аміловий спирт, гексанол, циклопентанол та цикна Схемі А. логексанол, а перевага віддається метанолу, етаСхема А нолу та ізопропанолу. Може виявитися доцільним застосування осаджувача. Термін "осаджувач" у вживаному значенні означає розчинник, в якому розчинність солі значно нижче, ніж у розчиннику. В разі застосування осаджувача перевага віддається речовинам, які змішуються з вибраним розчинником. До придатних осаджувачів належать прості ефіри, наприклад, діетиловий ефір, метил-третбутиловий ефір тощо, та нижчі алкілацетати, наприклад, метилацетат, етилацетат, ізопропілацетат, пропілацетат, ізобутилацетат, вторбутилацетат, бутилацетат, амілацетат, ізоамілацетат тощо, а також алкани, наприклад, пентан, гексан, гептан, циклогексан тощо. Якщо описаний процес здійснюють шляхом кристалізації солі кислоти з рацемічної суміші, то застосовувати осаджувач слід обережно для запобігання кристалізації небажаної діастереомерної солі. Як правило, кристалізацію виконують при початковій температурі від приблизно 40°С до температури кипіння (із зворотним холодильником) На Схемі А, стадія 1, представлено стереохівибраного розчинника (розчинників) і при початкомічне розділення придатного лактаму формули (4) вих концентраціях від приблизно 0,05Μ до приблиз одержанням лактаму формули (10), тобто пракзно 0,25М. Потім суміш охолоджують і одержують тично чистого (S)-1-аміно-3-метил-2,3,4,5згадану сіль. Може бути доцільним застосування тетрагідро-1Н-3-бензазепін-2-ону. Термін "практизатравки. Може бути доцільним перемішування чно чистий" у значенні, вживаному в цьому описі, початкового осаду протягом від приблизно 4год. стосується енантіомерної чистоти (S)-1-аміно-3до 48год. Кристалізаційний розчин у варіанті, якометил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону. му віддається перевага, охолоджують повільно. Згідно з цим винаходом, практично чистий (S)-1Найбільш зручно виконувати кристалізацію при аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінохолодженні до температур у межах від темпера 9 74849 10 тури навколишнього середовища до приблизно ності у виділеному продукті незначної кількості 20°С. Сіль можна відділити від маточного розчину, ароматичного альдегіду. Тому перевага віддається застосовуючи добре відомі в практиці способи, в виділенню (S)-1-аміно-3-метил-2,3,4,5-тетрагідротому числі фільтрування, декантацію, центрифугу1Н-3-бензазепін-2-ону після динамічного розділенвання, випаровування, сушіння тощо. Сполуку фоня шляхом сольового обміну, переважно у формі рмули (10) можна використовувати безпосередньо гідрохлориду, перед його використанням або одеу формі солі з вибраною кислотою. В альтернатиржанням основи. вному варіанті сполуку формули (10) перед викоНа Схемі А, стадія 2, показано реакцію сполуристанням можна виділити у формі солі з іншою чення придатного аланіну із захищеною аміногрукислотою після заміни кислоти або у формі основи пою формули PgNH-CHCH3-C(O)-A та придатного шляхом екстракції в основному середовищі, як лактаму формули (10). Придатними аланінами із добре відомо в практиці. захищеними аміногрупами є сполуки, де Pg є груУ варіанті здійснення, якому віддається перепа захисту аміну, стереохімія відповідає Lвага, цей спосіб забезпечує одержання (S)-1конфігурації, а А є активуюча група, наприклад, аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінОН або -СІ, здатна сполучатися з аміногрупою 2-ону високої енантіомерної чистоти шляхом криссполуки формули (10). Такі аланіни із захищеними талізації 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3аміногрупами легко одержати обізнаному фахівбензазепін-2-ону у формі його солі з кислотою, цеві. вибраною із групи, до якої входять ди-n-толіл-LРеакція сполучення, показана на Схемі А, ставинна кислота, (R)-(-)-d-камфорасульфонова кисдія 2, включає реакцію, яку звичайно проводять лота і (D)-(-)-мигдалева кислота, в динамічному при синтезі пептидів, і при її проведенні можна процесі у присутності ароматичного альдегіду. застосовувати методи синтезу, використовувані в Перевага цього динамічного процесу полягає в цій галузі. Такі методи детально описані для Схетому, що під час кристалізації 1-аміно-3-метилми 1, стадія 1. 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он зазнає Схема А, стадія 3, ілюструє відщеплення групи конверсії в індивідуальний ізомер, що забезпечує захисту від сполуки формули (11) з одержанням підвищення виходу та уникнення утворення відхосполуки формули (12). Відщеплення таких груп дів, які містять небажаний ізомер. захисту аміну є добре відомим і прийнятим у пракОчікується, що для згаданого динамічного тиці. процесу придатні різноманітні ароматичні альдегіСхема А, стадія 4, ілюструє реакцію сполученди; виявлено, що певні альдегіди є особливо приня придатної сполуки формули (13), (СН3)2СНдатними у практиці. Конкретно, з'ясовано, що пеСНОН-С(О)А1, зі сполукою формули (12) для одеревагу слід віддавати саліциловим кислотам і що ржання сполуки формули І. (S)-ізомер сполуки більшу перевагу при здійсненні цього динамічного формули (13) є комерційно доступним і добре віпроцесу розділення слід віддавати саліциловому домим у практиці; він описаний, в тому числі, в альдегіду, 5-нітро-саліциловому альдегіду та 3,5патентній заявці PCT/US97/22986, поданій 22 грудихлор-саліциловому альдегіду. дня 1997р. Реакцію сполучення, показану на стадії Відповідно, якщо згаданий процес здійснюєть3, проводять із використанням кислоти формули ся в режимі динамічного розділення, 1-аміно-3(13) (сполуки, де А1 є -ОН) або галоїдангідриду метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он такої кислоти (сполуки, де А1 є -СІ або -Вr) за меуводять у контакт із вибраною кислотою у присуттодикою, аналогічною описаній для Схеми 1, станості ароматичного альдегіду. Як правило, для дія 1. динамічного розділення використовують від прибАльтернативний спосіб одержання сполук фолизно 0,9 до 1,2 молярного еквівалента кислоти, рмули І показано на Схемі А, стадія 5, де ілюстроперевага віддається використанню приблизно 1 вана реакція сполучення придатної сполуки формолярного еквівалента. Ароматичний альдегід, як мули (10) із придатною сполукою формули (14), правило, застосовують у каталітичній кількості. В (CH3)2CH-CHOH-C(O)NH-CHCH3-C(O)-A2, із безпотипових випадках застосовують від приблизно 0,5 середнім одержанням сполуки формули І. Придатдо 0,001 молярного еквівалента ароматичного ною сполукою формули (10) є сполука, описана на альдегіду, перевага віддається використанню від стадії 2. Придатною сполукою формули (14) є споприблизно 0,1 до 0,01 молярного еквівалента. лука, що має стереохімічну структуру, бажану для Згаданий динамічний процес звичайно здійскінцевого продукту формули І. нюють у розчиннику без протирозчинника, як опиСполуки формули (14) легко одержати шляхом сано вище. Суміш 1-аміно-3-метил-2,3,4,5сполучення амінокислот із захищеною карбокситетрагідро-1Н-3-бензазепін-2-ону, вибраної кислольною групою, H2N-CHCH3-C(O)Opg1, зі сполуками ти та ароматичного альдегіду перемішують для формули (13), описаними вище. Такі реакції спозабезпечення конверсії в бажаний ізомер. Як пралучення також добре відомі в практиці і дають вило, цю конверсію здійснюють при температурах продукти, які після відщеплення групи захисту від температури навколишнього середовища до утворюють сполуки формули (14). температури кипіння розчинника. Конверсія вимаСполуку формули І можна виділити та очистигає часу, як правило, 6-48 год. ти численними способами, в тому числі кристаліДля обізнаного фахівця зрозуміло, що, в разі зацією. Можна застосовувати способи кристалізапроведення згаданого процесу в режимі динамічції з розчину та суспендування. Зокрема, сполуку ного розділення, використання солі (S)-1-аміно-3згідно з цим винаходом можна одержати кристаліметил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону з зацією з різноманітних неводних та водних розкислотою може ускладнюватися внаслідок присутчинників. До придатних розчинників належать аце 11 74849 12 тон, нижчі спирти (наприклад, метанол, етанол та (1,1екв., 1Μ у ТГФ). Після перемішування протягом ізопропанол), оцтова кислота й ацетонітрил із до1год. або до завершення реакції суміш концентрумішкою води або без неї, а також етилацетат, діевали, а потім підкислювали 1н. водною хлористотиловий ефір і метил-трет-бутиловий простий водневою кислотою й екстрагували етилацетатом. ефір. З'ясовано, що у практиці перевагу слід відОрганічний шар сушили й концентрували, одердавати водному ацетону. Для даного водного розжуючи неочищений продукт, який очищали хромачинника кількість застосовуваної води залежить тографією на силікагелі й одержували 1від відношення розчинності (N)-((S)-2-гідрокси-3гідроксііміно-3-метил-2,3,4,5-тетрагідро-1Н-3метил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метилбензазепін-2-он. Мас-спектр (М+Н)+ 205,1. 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону в розчин1-гідроксііміно-3-метил-2,3,4,5-тетрагідро-1Ннику й у воді і від застосовуваного способу (крис3-бензазепін-2-он розчиняли в EtOH/NH3 (20:1) і талізації або суспендування). гідрували в автоклаві із застосуванням нікелю РеКристалізацію, як правило, проводять шляхом нея і водню (500 фунтів на кв. дюйм, 3447кПа) при розчинення (N)-((S)-2-гідрокси-3-метил-бутирил)-1100°С протягом 10год. Одержану суміш фільтру(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідровали й концентрували, одержуючи масло, яке 1Н-3-бензазепін-2-ону у водному розчиннику, після очищали хроматографією на силікагелі й одержучого дають розчину охолоджуватися (із додаванвали сполуку, вказану в заголовку. ням або без додавання додаткової кількості води) Приклад 2 для утворення твердої речовини. В типових випаСинтез 1-аміно-3-метил-2,3,4,5-тетрагідро-1Ндках кристалізацію проводять при початкових тем3-бензазепін-2-ону пературах приблизно від 40°С до кипіння (із звороУ посудину Мортона місткістю 20л завантажутним холодильником) вибраного водного вали МТБЕ (5,52л, 7 об'ємів) і диметилацеталь (Nрозчинника. Потім суміш охолоджують, причому метиламіно)-ацетальдегіду (614г, 5моль) і одержуутворюється кристалічний дигідрат. Може бути вали розчин при кімнатній температурі. Додавали доцільним застосування затравки. Кристалізаційв реакційну посудину Мортона розчин бікарбонату ний розчин у варіанті, якому віддається перевага, натрію, приготований шляхом додавання бікарбоохолоджують повільно. Найбільш зручно виконунату натрію (546г, 6,5моль) до води (6,31л, 8 об'євати кристалізацію при охолодженні до темперамів). Одержану суміш охолоджували до температур у межах від температури навколишнього серетури нижче ніж 10°С і додавали до охолодженої довища до приблизно -20°С. суміші крапля за краплею протягом 1 год розчин Цей винахід додатково ілюстрований поданифенілацетилхлориду (789г, 5моль) в МТБЕ ми нижче прикладами та препаративними методи(789мл). Після завершення додавання реакційну ками. Ці приклади та препаративні методики масуміш перемішували при кімнатній температурі ють лише ілюстративний характер і не призначені протягом 1год. На цей час аналіз методом РХВЕ для будь-якого обмеження обсягу винаходу. посвідчив завершення реакції. Після екстракції Терміни, вживані в згаданих прикладах та МТБЕ (4 об'єми), висушування над безводним супрепаративних методиках, мають звичайні знальфатом магнію й концентрування в роторному чення, за винятком спеціально вказаних випадків. випарнику одержано 1,187кг (98%) N-метил-N-(2,2Наприклад, "°С" означає градуси за Цельсієм; диметоксіетил)фенілацетаміду у вигляді рідини. "ммоль" означає мілімоль або мілімолі; "г" означає (М+Н)+=237,9. грам або грами; "мл" означає мілілітр або мілілітУ посудину Мортона місткістю 5л завантажури; "розсіл" означає насичений водний розчин вали в сильному потоці азоту H2SO4 (1,42л) і крапхлориду натрію; "ТГФ" означає тетрагідрофуран; ля за краплею додавали в реакційну посудину N"РХВЕ" означає рідинну хроматографію високої метил-N-(2,2-диметоксіетил)фенілацетамід (712г, ефективності (під високим тиском); тощо. 3моль), при цьому за рахунок тепла реакції темпеПриклад 1 ратура суміші підвищувалася на 22-78°С. ОдержаСинтез 1-аміно-3-метил-2,3,4,5-тетрагідро-1Нну реакційну суміш потім нагрівали при 110°С про3-бензазепін-2-ону тягом 3год., після чого охолоджували до кімнатної До суспензії гідриду натрію (1,1екв.) в 15мл температури і переносили в посудину Мортона безводного ДМФ додавали 2,3,4,5-тетрагідро-1Нмісткістю 20л. При температурі нижче ніж 10°С 3-бензазепін-2-он (0,0042моль) у формі розчину в реакційну суміш гасили водним розчином гідрок10мл ДМФ. Потім додавали метилйодид (приблизсиду натрію (9,18л, 5н.). Після екстракції етилацено 2екв.). Після завершення реакції, посвідченого татом (двічі по 2,85л), висушування над сульфаТШХ (хроматографією в тонкому шарі), реакційну том натрію й концентруванням досуха одержано суміш виливали на лід і екстрагували етилацета520г (73,5%) 3-метил-6,7-дигідро-2Н-3-бензазепінтом. Органічний шар промивали водою, а потім 2-ону у вигляді твердої речовини. Цей матеріал розсолом. Потім органічний шар сушили над можна з метою додаткового очищення перекрисNa2SO4, фільтрували й концентрували під знижеталізувати із МТБЕ, одержуючи твердий продукт із ним тиском. Залишок очищали РХВЕ (LC 2000) т. пл. 81-82°С; (М+Н)+=174,2. при елююванні системою етилацетат/гексан і одеРозчин 3-метил-6,7-дигідро-2Н-3-бензазепін-2ржували 3-метил-2,3,4,5-тетрагідро-1Н-3ону (113,8г, 0,657моль) в ТГФ (0,5л) охолоджували бензазепін-2-он. до 0°С і додавали крапля за краплею ізоамілнітрит 3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2(100,75г, 0,86моль). До одержаної суміші додавали он (1екв.) розчиняли в ТГФ і додавали ізоамілнітLiHMDS (854мл, 1Μ розчин в ТГФ, 0,854моль) із рит (1,2екв.). Охолоджували суміш до 0°С у бані з такою швидкістю, щоб температура залишалася льодом. Додавали крапля за краплею NaHMDS нижче 10°С. Після завершення додавання реак 13 74849 14 ційну суміш перемішували при кімнатній темперанатрію (7,07л), сушили над сульфатом магнію, турі протягом 2-3год., контролюючи хід реакції за змішували із силікагелем (883г) і вносили в колондопомогою РХВЕ. Після завершення реакції суміш ку із силікагелем (3,53кг, колонка з пористим скляохолоджували до 0°С і знижували pH із 12 до 2-3, ним фільтром, заповнення за допомогою суспензії застосовуючи водну НСl (2н.) Одержаний осад в дихлорметані). Через колонку пропускали як перемішували протягом 12-16год., після чого віделюент дихлорметан до об'єму елюату 25л, а поділяли фільтруванням і сушили, одержуючи 86,3г тім етилацетат для елюювання продукту. Фракцію, (64,9%) 1-гідроксііміно-3-метил-6,7-дигідро-2Н-3що містила продукт, випаровували й одержували бензазепін-2-ону; т. пл. 225-226°С; (М+Н)+=203,0. 3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он у Розчин 1-гідроксііміно-3-метил-6,7-дигідро-2Нвигляді жовтувато-коричневої твердої речовини в 3-бензазепін-2-ону (35г, 0,173моль) в етанолі кількості 608г (83%). (525мл) завантажували в автоклав разом із палаУ посудину місткістю 22л в атмосфері азоту дієм на вугіллі (10%, 3,5г) у формі суспензії в роззавантажували 3-метил-2,3,4,5-тетрагідро-1Н-3бавленій НСl (17,5г концентрованої водної НСl у бензазепін-2-он (606г, 3,46моль) і ізоамілнітрит 17мл води). Одержану суміш гідрували при 50°С і (543г, 4,5моль) в ТГФ (7,88л). Суміш охолоджуватиску водню 250 фунтів на кв. дюйм (1723кПа) до ли приблизно до 0°С і додавали LiHMDS (1н. роззавершення реакції. Реакційну суміш фільтрували чин в ТГФ, 4,5л, 4,5моль) із такою швидкістю, щоб через шар целіту, використовуючи етанол як розтемпература залишалася нижче приблизно 7°С. чинник, і концентрували фільтрат до об'єму 90мл. Після завершення додавання реакційну суміш пеДодавали до концентрату воду (350мл) і знов конремішували при кімнатній температурі протягом центрували одержаний розчин до об'єму приблизприблизно 2год., контролюючи хід реакції за допоно 200мл. До цього водного розчину додавали могою РХВЕ. Після завершення реакції суміш оходихлорметан (350мл), після чого доводили pH до лоджували приблизно до 0°С і знижували pH із 12 11-11,5 водним розчином гідроксиду натрію (1н.). до 2-1, застосовуючи водну НСl (2н.) Одержаний Органічну фазу відділяли, а водну фазу екстрагуосад перемішували протягом приблизно 6год., вали дихлорметаном (175мл). Об'єднані екстракти після чого відділяли фільтруванням і сушили, одеконцентрували, одержуючи залишок, який при сторжуючи 1-гідроксііміно-3-метил-2,3,4,5-тетрагідроянні кристалізувався, і одержували сполуку, вказа1Н-3-бензазепін-2-он (604,7г, 85,6%). ну в заголовку: т. пл. 69-81°С; (М+Н)+=191,0. Розчин 1-гідроксііміно-3-метил-2,3,4,5Приклад 3 тетрагідро-1Н-3-бензазепін-2-ону (625г, 3,06моль) Синтез 1-аміно-3-метил-2,3,4,5-тетрагідро-1Нв етанолі сорту 3А (15,6л) завантажували в авток3-бензазепін-2-ону У посудину Мортона місткістю лав разом із паладієм на вугіллі (10%, 120г) у фо22л завантажували дихлорметан (4,73л, 8 об'ємів), рмі суспензії в розбавленій НСl (312г концентроN-метилфенетиламін (591г, 4,33моль) і водний ваної водної НСl у 320мл води). Одержану суміш розчин бікарбонату натрію (436,7г, 5,2ммоль в гідрували при 50°С і тиску водню 250 фунтів на кв. 4,73л води). Одержану суміш охолоджували до дюйм (1723кПа) при інтенсивному перемішуванні температури нижче ніж 5°С і додавали до охолодо завершення реакції (приблизно 4год). Реакційдженої суміші крапля за краплею розчин хлорацену суміш фільтрували через шар целіту, використилхлориду (513,7г, 4,55моль) у дихлорметані товуючи етанол як розчинник, і концентрували (887мл) на протязі 70хв. Після завершення додафільтрат, одержуючи тверду речовину. Цей твервання аналіз методом РХВЕ посвідчив завершендий продукт обробляли дихлорметаном (6л) і доня реакції. Розділяли шари й екстрагували водний давали 1н. водний розчин гідроксиду натрію до шар дихлорметаном. Об'єднані органічні фази значення pH водного шару в межах 11-11,5. Суміш сушили над безводним сульфатом магнію і концеперемішували, розділяли шари й екстрагували нтрували в роторному випарнику; одержано 915,7г водний шар дихлорметаном (2л). Органічні шари (99,8%) N-метил-N-(2-феніл етил)-1сушили над сульфатом магнію, фільтрували й вихлорацетаміду: (М+Н)=212,1. паровували в роторному випарнику, одержуючи У посудину місткістю 12л в атмосфері азоту сполуку, вказану в заголовку (477г, 81,9%). завантажували N-метил-N-(2-фенілетил)-1Приклад 4 хлорацетамід (883,3г, 4,17моль) і ортоСинтез (S)-1-аміно-3-метил-2,3,4,5-тетрагідродихлорбензол (6,18л). Додавали хлористий алю1Н-3-бензазепін-2-ону міній (1319г, 10,13моль), при цьому за рахунок 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3тепла реакції температура суміші підвищувалася бензазепін-2-он (1,544г, 8,12ммоль) обережно нана 22-50°С. Одержану реакційну суміш потім нагрівали в 15мл метанолу до розчинення. У другій грівали при 165°С протягом 2,5год., після чого склянці розчиняли ди-я-толуїл-L-винну кислоту охолоджували до кімнатної температури на протя(3,12г, 8,08ммоль) в 15мл метанолу й одержаний зі приблизно 14год. Охолоджували реакційну сурозчин додавали за допомогою піпетки до теплого міш приблизно до 0°С і додавали до холодної ворозчину аміну. Після випадання твердого продукту ди (8,86л, приблизно 5°С) чотирма частинами з в осад суміш підігрівали. Додавали ще 30мл метаметою підтримувати температуру, яка підвищуєтьнолу для одержання розчину, який нагрівали зі ся за рахунок тепла реакції, на рівні приблизно зворотним холодильником протягом 30-40хв., а 40°С. Розділяли шари, водний шар екстрагували потім повільно охолоджували до температури надихлорметаном (7,07л) і знов розділяли шари. вколишнього середовища, при цьому утворювався Органічні шари об'єднували й екстрагували водтвердий продукт. Після перемішування протягом ною хлористоводневою кислотою (8,83л, 1н.), а приблизно 18год. цей продукт відділяли фільтрупотім насиченим водним розчином бікарбонату ванням і промивали невеликою кількістю охоло 15 74849 16 дженого метанолу. Одержано 2,24г солі (S)-1рували й випаровували в роторному випарнику. аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінОдержано сполуку, вказану в заголовку (250г, 2-ону і ди-n-толуїл-L-винної кислоти (вихід 96%, ее 57,4%, ее 94,1%). 94,7%). Приклад 7 Сіль (S)-1-аміно-3-метил-2,3,4,5-тетрагідроСинтез гілрохлориду (S)-1-аміно-3-метил1Н-3-бензазепін-2-ону і ди-n-толуїл-L-винної кис2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону лоти (11,83г, 20,5ммоль) розчиняли в 45мл 1,0н. 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3водного розчину гідроксиду натрію й екстрагували бензазепін-2-он (31,9г, 168ммоль) суспендували хлористим метиленом (тричі по 25мл). Об'єднані приблизно в 300мл ізопропілацетату і нагрівали до розчини в хлористому метилені промивали 35мл 45°С. В окремій посудині нагрівали (R)-(-)-D1,0н. водного розчину гідроксиду натрію, потім мигдалеву кислоту (25,0г, 164ммоль) приблизно в розсолом і сушили над безводним MgSO4. Після 130мл ізопропілового спирту до утворення розчину видалення розчинника у вакуумі одержано сполуі додавали цей розчин до вищезгаданої суспензії ку, вказану в заголовку (3,38г) у вигляді безбарв1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3ного масла (вихід 87%, ее 93,2%). бензазепін-2-ону в ізопропілацетаті, одержуючи Приклад 5 розчин, з якого швидко випадав осад. Суміш пеСинтез (S)-1-аміно-3-метил-2,3,4,5-тетрагідроремішували при 45°С протягом приблизно 3год. До 1Н-3-бензазепін-2-ону 1-аміно-3-метил-2,3,4,5теплого розчину додавали 5-нітросаліциловий тетрагідро-1Н-3-бензазепін-2-он (6,0г, 31,5ммоль) альдегід (2-гідрокси-5-нітробензальдегід) (1,40г, обережно нагрівали в 75мл метанолу для розчи8,38ммоль, 5% (моль)) і перемішували суміш при нення і поєднували з розчином ди-n-толуїл-L45°С. Приблизно через 14год. суспензію охоловинної кислоти (12,2г, 31,5ммоль) в 75мл теплого джували до температури навколишнього середометанолу. В розчин вносили затравку, причому вища і перемішували протягом 2год., після чого утворювався твердий продукт. Додавали ще відділяли твердий продукт фільтруванням, проми100мл метанолу і перемішували суміш. Після певали 70мл охолодженого ізопропілацетату і суширемішування протягом приблизно 18год. твердий ли у вакуумній шафі при 40°С. Одержано 46,62г продукт відділяли фільтруванням і промивали несолі (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3великою кількістю охолодженого метанолу. Одербензазепін-2-ону і (R)-мигдалевої кислоти (вихід жано 6,7г твердої речовини. Цю речовину змішу82,9%, ее 98,4%). вали з метанолом (200мл) і перемішували. Через Сіль (S)-1-аміно-3-метил-2,3,4,5-тетрагідро18год. відділяли твердий продукт, одержуючи сіль 1Н-3-бензазепін-2-ону і (R)-мигдалевої кислоти (S)-1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3(2,42г, 7,06ммоль, ее 98,4%) суспендували в 25мл бензазепін-2-ону і ди-n-толуїл-L-винної кислоти етилацетату при температурі навколишнього се(4,4г). Виділення основи за методикою, описаною редовища. Додавали концентровану водну хлорив Прикладі 4, дало сполуку, вказану в заголовку стоводневу кислоту (1,1мл, приблизно 11,2ммоль) (ее 96%). і при інтенсивному перемішуванні нагрівали суміш Приклад 6 при 50°С протягом 3,5год. Охолоджували суспенСинтез (S)-1-аміно-3-метил-2,3,4,5-тетрагідрозію до температури навколишнього середовища, 1Н-3-бензазепін-2-ону В апараті місткістю 22л нафільтрували й промивали осад метил-третгрівали в атмосфері азоту 1-аміно-3-метил-2,3,4,5бутиловим простим ефіром (приблизно 10мл). тетрагідро-1Н-3-бензазепін-2-он (438г, 2,3моль) Одержано 1,48г сполуки, вказаної в заголовку (виприблизно до 40°С для одержання його розчину в хід 92,5%, ее 97,9%). метанолі (4,38л). У другій посудині розчиняли диПриклад 8 n-толуїл-L-винну кислоту (889,7г, 2,3моль) в 4,38л Синтез (N-((S)-2-гідрокси-3-метил-бутирил)-1метанолу, одержаний розчин нагрівали приблизно (L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідродо 40°С і додавали до нього розчин 1-аміно-31Н-3-бензазепін-2-ону метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону. У круглодонну колбу завантажували N-третПродовжували нагрівання і додавали ще 6,13л Boc-L-аланін (1,0екв.), гідрат гідроксибензотриазометанолу, після чого суміш нагрівали зі зворотним лу (приблизно 1,1екв.) і (S)-1-аміно-3-метилхолодильником протягом приблизно 45хв., а потім 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он (1,0екв.) в повільно охолоджували до температури навколиТГФ в атмосфері азоту. До цієї суміші при ефектишнього середовища, причому утворювався твервному перемішуванні додавали основу Хуніга дий продукт. Після перемішування протягом приб(Hunig) (Ν,Ν-діізопропілетиламін, 1,1екв.), а потім лизно 18год. цей продукт відділяли фільтруванням EDC (1,1екв.). Після перемішування протягом 4і промивали невеликою кількістю маточного роз17год. при температурі навколишнього середовичину, сушили на повітрі і промивали приблизно 2л ща розчинник видаляли під зниженим тиском, заетилацетату. Одержано 561,6г солі (S)-1-аміно-3лишок розчиняли в етилацетаті та воді, промивали метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону і насиченим водним розчином бікарбонату натрію, ди-я-толуїл-L-винної кислоти. Змішували сіль (S)1н. водною НСl, розсолом, сушили над безводним 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3сульфатом натрію, фільтрували й видаляли розбензазепін-2-ону і ди-n-толуїл-L-винної кислоти, чинник під зниженим тиском. Одержано 1-(N-третдихлорметан (6,57л) і 1н. водний розчин гідроксиBoc-L-aлaнiнiл)aмiнo-3-мeтил-2,3,4,5-тетрагідроду натрію (6,57л) і перемішували. Розділяли шари і 1Н-3-бeнзaзeпiн-2-он: мас-спектр (М+Н)+ 362,3. двічі екстрагували органічний шар 1н. водним розЧерез перемішуваний розчин 1-(N-трет-Вос-Lчином гідроксиду натрію (3,28л), один раз розсоаланініл)аміно-3-метил-2,3,4,5-тетрагідро-1Н-3лом (2,46л), сушили над сульфатом магнію, фільтбензазепін-2-ону в 1,4-діоксані (0,03-0,09М), охо 17 74849 18 лоджений у бані з льодом приблизно до 10°С в продукт суспендували в ацетонітрилі (5л), нагріваатмосфері N2, пропускали протягом 10-15хв. потік ли до кипіння зі зворотним холодильником, після газоподібного безводного НСl. Закривали колбу з чого охолоджували приблизно до 60°С, фільтрурозчином, відстороняли охолоджувальну баню і вали й сушили осад, одержуючи 1-(L-аланініл)-(S)давали розчину нагріватися до температури нааміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінвколишнього середовища при перемішуванні про2-он (389,8г, 94,7%). тягом 2-8год., контролюючи витрачання вихідного 1-(L-аланініл)-(S)-аміно-3-метил-2,3,4,5матеріалу за допомогою ТШХ. Розчин концентрутетрагідро-3-метил-1Н-3-бензазепін-2-он (369,5г, вали й одержували 1-(L-аланініл)-(S)-аміно-31,18моль), гідрат гідроксибензотриазолу (207,6г, метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он, 1,36моль), основу Хуніга (Ν,Ν-діізопропілетиламін, який використовували без додаткового очищення. 352,2г, 2,71моль) і (S)-2-гідрокси-3-метилмасляну 1-(L-аланініл)-(S)-аміно-3-метил-2,3,4,5кислоту (140,6г, 1,18моль) змішували в ТГФ (4,8л) тетрагідро-3-метил-1Н-3-бензазепін-2-он (1,0екв.), в атмосфері азоту і охолоджували до температури гідрат гідроксибензотриазолу (ІД екв.) і (S)-2нижче ніж 5°С. Додавали EDC (253,7г, 1,3моль) і гідрокси-3-метилмасляну кислоту (1,0екв.) змішудавали реакційній суміші нагріватися до темперавали в ТГФ в атмосфері азоту. Додавали основу тури навколишнього середовища при перемішуХуніга (Ν,Ν-діізопропілетиламін, 1,1екв.), а потім ванні. Приблизно через 25год. реакційну суміш EDC (1,1екв.). Після перемішування протягом 4розбавляли дихлорметаном (5,54л) і екстрагували 17год. при температурі навколишнього середовиводою (2,22л). Органічний шар екстрагували воща розчинник видаляли під зниженим тиском, задою (2,22л), водні шари об'єднували й екстрагувалишок розчиняли в етилацетаті (або аналогічному ли дихлорметаном (5,54л). Органічні шари об'єдрозчиннику) та воді, промивали насиченим водним нували, екстрагували двічі водою (2,22л), розчином бікарбонату натрію, 1н. НСl, розсолом, насиченим водним розчином бікарбонату натрію сушили над безводним сульфатом натрію і вида(2,22л), сушили над безводним сульфатом натрію, ляли розчинник під зниженим тиском, одержуючи фільтрували й випаровували в роторному випарсполуку, вказану в заголовку. нику. Одержано тверду речовину (428г, 100%). Приклад 9 Цей твердий продукт розчиняли у змішаному розСинтез (N-((S)-2-гідрокси-3-метил-бутирил)-1чиннику, що містив ацетон (3,42л) і воду (0,856л) (L-аланініл)-(S)-аміно-3-метил-2,3,4,5-тетрагідропри слабкому нагріванні (40°С). Одержаний розчин 1Н-3-бензазепін-2-ону ділили на порції об'ємом приблизно по 2л і додаУ круглодонну колбу завантажували N-третвали до кожної воду (7,19л) при нагріванні каламуBoc-L-аланін (249,5г, 1,32моль), гідрат гідроксибетного розчину до 50°С. Після додавання всієї води нзотриазолу (232,2г, 1,52моль) і (S)-1-аміно-3каламутному розчину давали охолодитися до темметил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он ператури навколишнього середовища й одержу(250,8г, 1,32моль) в ТГФ (3,76л) в атмосфері азовали твердий продукт, суспензію якого перемішуту. Суміш охолоджували до температури нижче вали при температурі навколишнього середовища ніж 5°С і додавали основу Хуніга (Ν,Νпротягом приблизно 14год., після чого фільтрувадіізопропілетиламін, 188,4г, 1,45моль), а потім ли й сушили, одержуючи сполуку, вказану в загоEDC (283,7г, 1,45моль). Після перемішування проловку (310,6г, 66,2%) у формі дигідрату. тягом б год реакційну суміш нагрівали до темпераПри застосуванні сполуки згідно з цим винахотури навколишнього середовища і перемішували дом як лікарський засіб її звичайно вводять в орпротягом приблизно 14год. Видаляли розчинник ганізм у формі фармацевтичної композиції. Таким під зниженим тиском, залишок розчиняли в етилачином, згідно з іншим варіантом здійснення, цей цетаті (3,76л) та воді (1,76л), розділяли шари, орвинахід пропонує фармацевтичні композиції, які ганічний шар екстрагували водою (1,76л), водні містять ефективну кількість (N)-((S)-2-гідрокси-3шари об'єднували й екстрагували етилацетатом метил-бутирил)-1-(L-аланініл)-(S)-1-аміно-3-метил(1,76л). Органічні шари об'єднували, екстрагували 2,3,4,5-тетрагідро-1Н-3-бензазепін-2-ону та фарнасиченим водним розчином бікарбонату натрію мацевтично прийнятний розріджувач. Такі компо(1,76л), сушили над безводним сульфатом натрію, зиції застосовують для інгібування вивільнення βфільтрували й випаровували в роторному випарамілоїдного пептиду та/або його синтезу, в тому нику. Одержано 1-(N-трет-Вос-L-аланініл)аміно-3числі при лікуванні хвороби Альцгеймера. Таким метил-2,3,4,5-тетрагідро-1Н-3-бензазепін-2-он чином, цей винахід охоплює використання (N)-((S)(463г, 97,2%). 2-гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1Готували розчин НСl в етилацетаті шляхом аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінпропускання газоподібного безводного НСl через 2-ону для виготовлення лікарського засобу для етилацетат (1,76л), охолоджений приблизно до інгібування вивільнення β-амілоїдного пептиду 0°С, із використанням диспергувальної трубки, та/або його синтезу, зокрема, при лікуванні хворозануреної в рідину. Виготовлений таким чином би Альцгеймера. розчин НСl в етилацетаті додавали до інтенсивно (N)-((S)-2-гідрокси-3-метил-бутирил)-1-(Lпереміщуваної суспензії 1-(N-трет-Вос-Lаланініл)-(S)-1-аміно-3-метил-2,3,4,5-тетрагідроаланініл)аміно-3-метил-2,3,4,5-тетрагідро-1Н-31Н-3-бензазепін-2-он можна вводити в організм бензазепін-2-ону (462г, 1,28моль) в етилацетаті різноманітними шляхами. Сполуку згідно з цим (3,7л). Додавали ще 1л етилацетату і давали реавинаходом можна вводити в організм в будь-яких кційній суміші нагрітися до кімнатної температури і формах або різновидах, які забезпечують біодосперемішували протягом 22год. Фільтрували реактупність сполуки в ефективній кількості, у тому ційну суміш і одержували твердий продукт. Цей числі пероральними та парентеральними шляха 19 74849 20 ми. Наприклад, сполуку згідно з цим винаходом нелетку олію. Інші форми дозованих одиниць моможна вводити в організм пероральним, інгаляційжуть містити різноманітні інші матеріали, які моним, підшкірним, внутрішньом'язовим, внутрішньодифікують фізичну форму дозованої одиниці, навенним, черезшкірним, назальним, ректальним, приклад, у вигляді оболонок. Так, таблетки або внутрішньоочним, місцевим шляхами, способом пілюлі можуть мати оболонки з цукру, шелаку або розсмоктування під язиком або за щокою тощо. інших покривних матеріалів. Сироп, окрім сполук При виготовленні композицій згідно з цим визгідно з винаходом, може містити сахарозу як піднаходом активний інгредієнт звичайно змішують із солоджувач та деякі консерванти, фарбники та наповнювачем, розбавляють наповнювачем або смакові домішки. Матеріали, використовувані при вміщують у носій, який може мати форму капсули, виготовленні згаданих різноманітних композицій, пакета-саше, паперового пакетика або іншого конмають бути фармацевтично чистими й нетоксичтейнера. Сполуку згідно з цим винаходом можна ними у застосовуваних кількостях. вводити в організм окремо або у формі фармацевДля цілей парентерального застосування спотичної композиції, тобто в комбінації з фармацевлука згідно з винаходом може бути введена в розтично прийнятними розріджувачами, наприклад, із чин або суспензію. Такі препарати, як правило, носіями або наповнювачами, частка та природа містять щонайменше 0,1% сполуки згідно з винаяких визначаються розчинністю та хімічними власходом, проте її вміст може варіювати й становити тивостями згаданої сполуки, вибраного шляху від 0,1% до приблизно 90% маси композиції. Кільвведення та стандартною фармацевтичною праккість згаданої сполуки, присутня в композиції, є тикою [дивись "Фармацевтичні науки" Ремінгтона – такою, що забезпечує відповідне дозування. ЗгаRemington’s Pharmaceutical Sciences, 18th Edition, дані розчини або суспензії можуть також містити Mack Publ. Co., 1990]. одну або кілька перелічених нижче допоміжних Фармацевтичні композиції згідно з цим винаречовин: стерильні розріджувачі, наприклад, воду ходом виготовляють способами, добре відомими у для ін'єкцій, сольовий розчин, нелеткі олії, поліефармацевтичній практиці. Носієм або наповнюватиленгліколі, гліцерин, пропіленгліколь або інші чем може бути твердий, напівтвердий або рідкий синтетичні розчинники; протимікробні агенти, наматеріал, який може бути носієм або середовиприклад, бензиловий спирт або метилпарабен; щем для активного інгредієнта. Придатні для цього антиоксиданти, наприклад, аскорбінову кислоту носії або наповнювачі добре відомі в практиці. або бісульфіт натрію; хелатоутворювальні агенти, Фармацевтична композиція може бути пристосонаприклад, етилендіамінтетраоцтову кислоту; бувана для перорального, інгаляційного, парентераферні сполуки, наприклад, ацетати, цитрати або льного або місцевого застосування і може бути фосфати; та агенти для забезпечення ізотонічносвведена в організм пацієнта у формі таблеток, ті, наприклад, хлорид натрію або декстрозу. Парекапсул, аерозолів, інгаляційних препаратів, супонтеральні композиції можуть бути вміщені в ампузиторіїв, розчинів, суспензій тощо. ли, одноразові шприци або багатодозові Для цілей перорального терапевтичного запляшечки, виготовлені зі скла або пластмаси. стосування сполуки можуть бути поєднані з наповКомпозиції та препарати, яким слід віддавати пенювачами і застосовуватися у формі таблеток, ревагу, може визначити обізнаний фахівець. пастилок, капсул, еліксирів, суспензій, сиропів, Сполуку згідно з цим винаходом можна вводивафель, жувальних гумок тощо. Такі препарати ти в організм також місцевим способом; в такому мають містити щонайменше 4% сполуки згідно з разі носій може містити розчин, основу мазі або цим винаходом як активний інгредієнт, проте його гелю. Згадана основа може містити, наприклад, вміст може варіювати залежно від конкретної фоодну або кілька таких речовин: вазелін, ланолін, рми і може складати від 2% до приблизно 90% поліетиленгліколі, бджолиний віск, мінеральне маси дозованої одиниці. Кількість згаданої сполумасло, розріджувачі, наприклад, воду або спирт, а ки, присутня в композиції, є такою, що забезпечує також емульгатори та стабілізатори. Композиції відповідне дозування. Композиції та препарати для місцевого застосування можуть містити сполузгідно з цим винаходом, яким слід віддавати переку формули І або її фармацевтичну сіль у конценвагу, може визначити обізнаний фахівець. трації від приблизно 0,1% до приблизно 10% (маси Згадані таблетки, пілюлі, капсули, пастилки на одиницю об'єму). тощо можуть також містити одну або кілька переІншою композицією згідно з цим винаходом, лічених нижче допоміжних речовин: в'яжучі агенти, якій віддається перевага, є засоби для черезшкірнаприклад, мікрокристалічну целюлозу, камедь, ного постачання ("пластирі"). Такі пластирі для трагант або желатин; наповнювачі, наприклад, черезшкірного постачання можна застосовувати крохмаль або лактозу; дезінтегратори, наприклад, для забезпечення безперервної або періодичної альгінову кислоту, препарат "Primogel", кукурудзяінфузії сполуки згідно з цим винаходом у контроний крохмаль тощо; змащувальні агенти, наприльованих кількостях. Будова та застосування плаклад, стеарат магнію, силіконове масло або престирів для черезшкірного постачання фармацевпарат "Sterotex"; ковзні агенти, наприклад, тичних агентів добре відомі в практиці. [Дивись, колоїдний діоксид кремнію; та підсолоджувачі, наприклад, патент США №5,023,252, виданий 11 наприклад, сахарозу або сахарин, або ароматизачервня 1991p.,] включений до цього опису за потори та смакові домішки, наприклад, м'яту, метилсиланням. Такі пластирі можуть мати будову, розсаліцилат або апельсиновий ароматизатор. Якщо раховану на безперервне, імпульсне постачання формою дозованої одиниці є капсула, то вона мофармацевтичних агентів або на їх уведення за же містити, окрім матеріалів вищезгаданих типів, потребою. рідкий носій, наприклад, поліетиленгліколь або З метою більш повної ілюстрації здійснення 21 74849 22 цього винаходу нижче подано опис типових фарІнгредієнт Кількість, мг/капсулу мацевтичних композицій. Ці приклади є лише ілюАктивний інгредієнт 40,0 стративними і не призначені для будь-якого обмеКрохмаль 109,0 ження обсягу винаходу. Стеарат магнію 1,0 Приклад композиції 1 Разом 150,0 Виготовляють тверді желатинові капсули, які Активний інгредієнт, крохмаль та стеарат магвміщують такі інгредієнти: нію змішують, пропускають через сито 20меш за Інгредієнт Кількість, мг/капсулу стандартом США (розмір отворів 0,84мм) і заповАктивний інгредієнт 30,0 нюють сумішшю тверді желатинові капсули (по Крохмаль 305,0 150мг). Стеарат магнію 5,0 Приклад композиції 6 Вищезгадані інгредієнти змішують і заповнюСупозиторії з умістом у кожному 25мг активноють сумішшю тверді желатинові капсули (по го інгредієнта виготовляють, як описано нижче: 340мг). Інгредієнт Кількість Приклад композиції 2 Активний інгредієнт 25 Композицію для таблеток виготовляють, заГліцериди насичених жирних кислот до 2000 стосовуючи такі інгредієнти: Активний інгредієнт пропускають через сито Інгредієнт Кількість, 60меш за стандартом США (розмір отворів мг/таблетку 0,25мм) і суспендують у гліцеридах насичених жиАктивний інгредієнт 25,0 рних кислот, попередньо розплавлених із застосуЦелюлоза мікрокристалічна 200,0 ванням мінімальної необхідної кількості тепла. Колоїдний діоксид кремнію 10,0 Потім суміш розливають у форму для супозиторіїв Стеаринова кислота 5,0 номінальною місткістю 2г і дають захолонути. Вищезгадані компоненти змішують і пресують Приклад композиції 7 у таблетки масою по 240 мг кожна. Суспензію з умістом лікарської речовини 50мг Приклад композиції З у дозі 5мл виготовляють, як описано нижче: Композицію для інгаляції сухого порошку вигоІнгредієнт Кількість товляють, застосовуючи такі інгредієнти: Активний інгредієнт 50,0мг Інгредієнт Маса, % Ксантанова камедь 4,0мг Активний інгредієнт 5 Натрієва сіль карбоксиметилЛактоза 95 целюлози (11%) 50,0мг Активний інгредієнт змішують із лактозою й Целюлоза мікрокристалічна (89%) одержану суміш уміщують у пристрій для інгаляції Сахароза 1,75мг сухого порошку. Бензоат натрію 10,0мг Приклад композиції 4 Ароматизатор та барвник за потребою Таблетки з умістом у кожній 30мг активного інВода очищена до 5,0мл гредієнта виготовляють, як описано нижче: Активний інгредієнт, сахарозу та ксантанову Інгредієнт Кількість, камедь змішують, пропускають через сито 10меш мг/таблетку за стандартом США (розмір отворів 2,0мм), після Активний інгредієнт 30,0 чого змішують із попередньо приготованим розчиКрохмаль 45,0 ном мікрокристалічної целюлози та натрієвої солі Целюлоза мікрокристалічна 35,0 карбоксиметилцелюлози у воді. Бензоат натрію, Полівінілпіролідон (у формі 10%ароматизатор і барвник розбавляють частиною ного розчину в стерильній воді) води і додають при перемішуванні. Потім додають 4,0 воду в кількості, необхідній для забезпечення баНатрієва сіль карбоксиметильожаного об'єму. ваного крохмалю 4,5 Приклад композиції 8 Стеарат магнію 0,5 Капсули з умістом у кожній 15мг лікарської реТальк 1,0 човини виготовляють, як описано нижче: Разом 120 Інгредієнт Кількість, мг/капсулу Активний інгредієнт, крохмаль та целюлозу Активний інгредієнт 15,0 пропускають через сито 20меш за стандартом Крохмаль 407,0 США (розмір отворів 0,84мм) і ретельно переміСтеарат магнію 3,0 шують. З одержаним порошком змішують розчин Разом 425,0 полівінілпіролідону і пропускають суміш через сито Активний інгредієнт, крохмаль та стеарат маг16меш за стандартом США (розмір отворів 1,2мм). нію змішують, пропускають через сито 20меш за Одержані таким чином гранули сушать при 50стандартом США (розмір отворів 0,84мм) і запов60°С і пропускають через сито 16меш за стандарнюють сумішшю тверді желатинові капсули (по том США. Натрієву сіль карбоксиметильованого 560мг). крохмалю, стеарат магнію й тальк, попередньо Приклад композиції 9 пропущені через сито 30меш за стандартом США Композицію для підшкірного введення можна (розмір отворів 0,6мм), додають до гранул і після виготовити, як описано нижче: перемішування пресують на таблетувальній маІнгредієнт Кількість шині в таблетки масою по 150мг кожна. Активний інгредієнт 1,0мг Приклад композиції 5 Кукурудзяна олія 1мл Капсули з умістом у кожній 40мг лікарської реЗалежно від розчинності активного інгредієнта човини виготовляють, як описано нижче: 23 74849 24 в кукурудзяній олії, в цю композицію в разі потреби куратору як обізнаному фахівцеві, шляхом застоможна вводити до приблизно 5,0мг або більше сування звичайних способів та спостереження активного інгредієнта. результатів, одержаних в аналогічних випадках. Приклад композиції 10 При визначенні ефективної кількості — дози (NКомпозицію для місцевого застосування мож((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)на виготовити, як описано нижче: 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3Інгредієнт Кількість бензазепін-2-ону - діагност-куратор має брати до Активний інгредієнт 1-10г уваги численні фактори, в тому числі (але не тільЕмульгувальний віск 30г ки) ефективність та характеристики (N)-((S)-2Вазелінове масло 20г гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1М'який безбарвний парафін до 100г аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінМ'який безбарвний парафін нагрівають до ро2-ону, вид пацієнта, його масу тіла, вік та загальзплавлений. Додають вазелінове масло та емульний стан здоров'я; ступінь розвитку або тяжкість гувальний віск і перемішують до розчинення. Дозахворювання; індивідуальну реакцію пацієнта; дають активний інгредієнт і продовжують шлях введення лікарського засобу; характеристики перемішування до утворення дисперсії. Потім охобіодоступності застосовуваного препарату; обралоджують суміш до затвердіння. ний режим дозування; застосування інших спосоЗгідно з одним із методичних аспектів, цей вибів лікування при комплексній терапії; та інші обнахід стосується способу інгібування вивільнення ставини. β-амілоїдного пептиду та/або його синтезу, який Очікується, що ефективна кількість (N)-((S)-2включає введення в організм пацієнта, що потрегідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1бує такого інгібування, ефективної кількості (N)аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепін((S)-2-гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)2-ону варіює від приблизно 0,1мг на кілограм маси 1-аміно-3-метил-2,3,4,5-тетрагідро-1Н-3тіла на день (мг/кг/день) до приблизно бензазепін-2-ону. Згідно з конкретним варіантом 100мг/кг/день. Кількості, яким слід віддавати перездійснення цього способу, цей винахід пропонує вагу, має визначати обізнаний фахівець. спосіб лікування хвороби Альцгеймера, який Дигідрат (N)-((S)-2-гідрокси-3-метил-бутирил)включає введення в організм пацієнта, що потре1-(L-аланініл)-(S)-1-аміно-3-метил-2,3,4,5бує такого лікування, ефективної кількості (N)-((S)тетрагідро-1Н-3-бензазепін-2-ону згідно з цим ви2-гідрокси-3-метил-бутирил)-1-(L-аланініл)-(S)-1находом можна випробовувати в різноманітних аміно-3-метил-2,3,4,5-тетрагідро-1Н-3-бензазепінбіологічних системах, в тому числі в описаних ни2-ону. жче. Мається також на увазі, що обізнаний фахіПриклад А вець може вплинути на хворобу Альцгеймера Скринінг на культурах клітин для виявлення іншляхом лікування пацієнта, який на даний час гібіторів продукування β-амілоїду уражений цим захворюванням, або ж шляхом Численні сполуки вищезазначеної формули І профілактичного лікування пацієнта, у якого має випробовували для з'ясування їх здатності інгібумісце ризик розвитку цього захворювання. Таким вати продукування β-амілоїду в лінії клітин, що чином, терміни "лікування", "лікувати" стосуються зазнали шведської мутації. При цьому скринінгоусіх процесів, де може мати місце уповільнення, вому випробуванні застосовували клітини (K293, переривання, припинення, регулювання або залінія клітин нирок людини), які були стабільно тратримання розвитку хвороби Альцгеймера, але не нсфіковані геном попередника амілоїду - протеїобов'язково вказують на повне усунення всіх симном 751 (АРР751), що містив подвійну мутацію із птомів. Таким чином, пропоновані способи охопзаміною Lys651Met652 на Asn651Leu652 (нумерація люють запобігання початку хвороби Альцгеймера АРР751), способом, [описаним у міжнародній заяу пацієнта, в якого має місце ризик розвитку хвовці №94/105698 та в роботі Цитрона та ін.12 (Citron роби Альцгеймера, інгібування розвитку хвороби et al.)]. Цю мутацію звичайно називають "шведсьАльцгеймера та лікування прогресуючої хвороби кою мутацією". Згадані клітини, позначені "293 751 Альцгеймера. SWE", висівали на 96-лункових планшетах Термін "пацієнт" у значенні, вживаному в цьо"Coming" по 2-4 104 клітин на лунку в мінімальному описі, стосується теплокровної тварини, наприму необхідному середовищі за Дюльбекко (DMEM) клад, ссавця, яка уражена розладом, пов'язаним із (фірма Sigma, St. Louis, МО) із додаванням 10% підвищеним вивільненням β-амілоїдного пептиду сироватки плоду корови. Кількість клітин має важта/або його синтезом, в тому числі хворобою Альливе значення з точки зору досягнення результацгеймера. Мається на увазі, що прикладами тватів визначення β-амілоїду методом ELISA (імунорин, які охоплюються цим терміном, є морські свиферментного твердофазного аналізу), які лежать у нки, собаки, коти, пацюки, миші, коні, велика лінійному діапазоні (від приблизно 0,2нг/мл до рогата худоба, вівці та люди. Пацієнтів, які потре2,5нг/мл). бують згаданого лікування, легко діагностувати. Після інкубування протягом ночі при 37°С в інТермін "ефективна кількість" сполуки формули кубаторі з рівноважною атмосферою з умістом І у значенні, вживаному в цьому описі, стосується СО2 10% живильне середовище видаляли, замікількості, яка забезпечує ефективне інгібування нювали на 200мкл на лунку середовища, яке місвивільнення β-амілоїдного пептиду та/або його тило сполуку формули І (лікарську речовину), для синтезу і, особливо, лікування хвороби Альцгей2-годинного попереднього оброблення, і інкубувамера. ли клітини, як описано вище. Вихідні розчини ліЕфективну кількість легко визначити діагностукарських речовин були виготовлені в 100%-ному 25 74849 26 диметилсульфоксиді з таким розрахунком, щоб них сполук, їх розчини можна готувати із застосупри кінцевій концентрації лікарської речовини, заванням різних носіїв, наприклад, кукурудзяної олії стосованій при випробуванні, концентрація диме(фірма Safeway, South San Francisco, CA); 10% тил сульфоксиду не перевищувала 0,5%, а реальетанолу в кукурудзяній олії; 2-гідроксипропіл-βно дорівнювала, як правило, 0,1%. циклодекстрині (фірма Research Biochemicals Після закінчення попереднього оброблення International, Natick, ΜΑ) та карбоксиметилцелюложивильні середовища знов видаляли й замінювазі (фірма Sigma Chem. Co., St. Louis, MO). ли на свіжі вищевказані середовища, що містили Мишам уводили випробовувані речовини підлікарські речовини, і інкубували клітини додатково шкірно із застосуванням голки 26 калібру. Через протягом 2год. Після оброблення планшети 3год. тварин умертвляли за допомогою СО2 і відцентрифугували в центрифузі "Beckman GPR" при бирали проби крові шляхом серцевої пункції із 1200об/хв. протягом 5хв. при кімнатній температузастосуванням туберкулінового шприца місткістю рі для відділення залишків клітин від кондиціоно1см3 і голки 25 калібру довжиною 5/8 дюйма ваного середовища. По 100мкл кондиціонованого (16мм), попередньо промитих розчином ЕДТА середовища з кожної лунки або відповідного роз(0,5М, pH8,0). Кров переносили у вакутейнер Бекведення такого середовища переносили на плантона-Дікінсона, який містив ЕДТА, і центрифугувашет для ELISA, попередньо покритий антитілом ли при 1500 g протягом 15хв. при 5°С. Потім ви266 [див. С'юберт - Р.Seubert, Nature (1992) даляли мозки мишей, відділяли кору та гіпокамп і 359:325-327] до амінокислот 13-28 β-амілоїдного зберігали на льоду. пептиду, як описано в публікації [міжнародної зая1. Дослідження мозку вки №94/105698], і зберігали при 4°С протягом ноДля підготовки тканин гіпокампу та кори до чі. Наступного дня виконували аналіз методом імуноферментного твердофазного аналізу (ELISA) ELISA з застосуванням міченого антитіла 3D6 кожну згадану частину мозку гомогенізували в 10 [Р.Seubert, Nature (1992) 359:325-327] до амінокиоб'ємах охолодженого льодом гуанідинового буслот 1-5 β-амілоїдного пептиду для вимірювання феру (5,0Μ гуанідин-НСІ, 50мМ Трис-HCl, pH8,0), кількості продукованого β-амілоїдного пептиду. застосовуючи механічну ступку "Kontes" (фірма Цитотоксичний ефект згаданих сполук вимірюFisher, Pittsburgh, PA). Гомогенати злегка струшували модифікованим методом Гансена та інших вали на обертовій платформі протягом 3-4год. при (Hansen et al.) До клітин, які залишалися на планкімнатній температурі і зберігали при -20°С до вишеті з культурою тканини, додавали 25мкл вихідконання кількісного аналізу на β-амілоїд. ного розчину (5мг/мл) 3-(4,5-диметилтіазол-2-іл)Гомогенати мозку розводили (1:10) охолодже2,5-дифенілтетразолійброміду (МТТ) (фірма ним льодом казеїновим буфером (0,25% казеїну, Sigma, St. Louis, МО) до кінцевої концентрації сольовий розчин із фосфатним буфером (PBS), 1мг/мл. Інкубували клітини при 37°С протягом 0,05% азиду натрію, 20мкг/мл апротиніну, 5мМ 1год. і припиняли активність клітин додаванням ЕДТА, pH8,0, 10мкг/мл лейпептину), знижуючи тим рівного об'єму буфера лізису МТТ (20%(мас.) досамим кінцеву концентрацію гуанідину до 0,5М, децилсульфату натрію на об'єм 50%-ного диметипісля чого центрифугували при 4°С протягом 20хв. лформаміду, pH4,7). Повну екстракцію забезпечупри 16000 g. В разі потреби проби додатково розвали струшуванням протягом ночі при кімнатній водили казеїновим буфером із доданням 0,5Μ температурі. Різницю між значеннями оптичної гуанідин-гідрохлориду з метою досягнення оптигустини на довжинах хвиль 562нм і 650нм (OD562нм мального діапазону концентрацій для визначень і OD650нм) як індикатор життєздатності клітин виміметодом ELISA. Готували стандартні проби βрювали із застосуванням пристрою для зчитуванамілоїду (амінокислоти 1-40 або 1-42) таким чиня мікропланшетів UVmax фірми "Molecular Device". ном, щоб кінцевий склад був еквівалентний 0,5Μ Результати визначення β-амілоїдного пептиду гуанідину в присутності 0,1% бичачого сироваткометодом ELISA зіставляли зі стандартною кривою вого альбуміну (BSA). і виражали як концентрацію β-амілоїдного пептиду Реагент для визначення загального β-амілоїду в нг/мл. З метою нормалізації на цитотоксичність методом сендвічевого ELISA, який забезпечує ці результати ділили на результати проби із МТТ і кількісний аналіз як β-амілоїду (амінокислоти 1виражали в процентах від результатів для контро40), так і β-амілоїду (амінокислоти 1-42), складальних проб, які не містили лікарських речовин. Усі ється із двох моноклональних антитіл (mAb) до βрезультати є середніми значеннями для щонайамілоїду. Антитіло захоплення, 266 [P.Seubert, менше шести паралельних проб із визначенням Nature (1992) 359:325-327] є специфічним до амістандартного відхилення. нокислот 13-28 β-амілоїду. Антитіло 3D6 [ДжонсонПриклад В Вуд та інші - Johnson-Wood et al., Proc. Nat. Acad. Пригнічення вивільнення та/або синтезу βSei. USA, 94:1550-1555, 1997], специфічне до аміамілоїдного пептиду in vivo нокислот 1-5 β-амілоїду, біотинілували і викорисЦей приклад ілюструє можливий спосіб витовували в аналізі як репортер-антитіло. При біопробування сполук згідно з цим винаходом на притинілуванні 3D6 застосовували методику гнічення вивільнення та/або синтезу β-амілоїдного виробника (фірми Pierce, Rockibrd, IL) для мічення пептиду in vivo. Для цих дослідів використовували імуноглобуліну NHS-біотином за тим винятком, що мишей лінії PDAPP [Гейме та інші - Games et al., як буфер використовували 100мМ розчин бікарбоNature 373:523-527, 1995] у віці 3-4 місяців. Залежнату натрію, pH8,5. Антитіло 3D6 не розпізнає ні но від конкретної випробовуваної сполуки, її розпродукований протеїн-попередник амілоїду (АРР), чин звичайно готували в концентрації від 1мг/мл ні повну послідовність АРР, а детектує лише різдо 10мг/мл. У зв'язку з низькою розчинністю згадановид β-амілоїду з амінотермінальною аспарагіно 27 74849 28 вою кислотою. Аналіз має нижню границю чутликімнатній температурі. Додавали в лунки авідинвості приблизно 50пг/мл (11пМ) і не виявляє переHRP (фірма Vector, Burlinggame, CA), розведений хресної реакційної здатності відносно ендогенного 1:4000 інкубаційним казеїновим буфером, і інкубумуринового β-амілоїдного пептиду в концентраціях вали протягом 1год. при кімнатній температурі. до 1нг/мл. Додавали колориметричний субстрат Slow TMBВ конфігурації сендвічевого кількісного визнаELISA (фірма Pierce, Cambridge, MA) і витримувачення β-амілоїду (амінокислоти 1-42) методом ли 15хв. для проходження реакції, після чого приELISA як антитіло захоплення використовували пиняли ензиматичну реакцію додаванням 2н. mAb 21F12 [Johnson-Wood et al., Proc. Nat. Acad. H2SO4. Продукт реакції кількісно визначали, застоSei. USA, 94:1550-1555, 1997], яке розпізнає аміносовуючи пристрій UVmax (фірми Molecular Devices, кислоти 33-42 β-амілоїду. Біотильоване антитіло Menlo Park, CA) для вимірювання різниці погли3D6 використовували як репортер-антитіло також і нання на довжинах хвиль 450нм і 650нм. в цьому аналізі, який має нижню границю чутливо2. Дослідження крові сті приблизно 125пг/мл (28пМ). Оброблену ЕДТА плазму розводили 1:1 розріАнтитіла захоплення 266 та 21F12 наносили в джувачем для проб (0,2г/л фосфату натрію Н2О концентрації 10мкг/мл на 96-лункові планшети для (одноосновного), 2,16г/л фосфату натрію 7Н2О імунного аналізу (фірми Costar, Cambridge, MA) і (двоосновного), 0,5г/л тимеросалу, 8,5г/л хлориду інкубували протягом ночі при кімнатній температунатрію, 0,5мл Тритон Х-405, 6,0г/л бичачого сирорі. Потім планшети піддавали аспірації і блокували ваткового альбуміну, вільного від глобуліну; і во0,25%-ним розчином сироваткового альбуміну да). Проби та стандартні зразки в розріджувачі для людини в PBS-буфері протягом щонайменше 1год. проб аналізували на загальний уміст β-амілоїду при кімнатній температурі, після чого зберігали у (266 як антитіло захоплення/3D6 як репортер) за висушеному вигляді при 4°С до використання. Пеметодикою, описаною вище, за тим винятком, що ред використанням планшети знову зволожували замість казеїнових буферів застосовували розріпромивальним буфером (сольовим розчином із джувач для проб. Трис-буфером, 0,05% Tween-20). На планшети На основі поданого вище опису обізнані фахінаносили проби та стандартні зразки й інкубували вці можуть вносити у згадані композиції та способи протягом ночі при 4°С. Після кожної стадії аналізу різноманітні модифікації та зміни. Мається на увапланшети тричі промивали промивальним буфезі, що винахід охоплює всі такі модифікації, які не ром. Біотинільоване антитіло 3D6, розведене до виходять за межі обсягу пунктів формули виконцентрації 0,5мкг/мл інкубаційним казеїновим находу. буфером (0,25% казеїну, PBS, 0,05% Tween-20, pH7,4), інкубували в лунках протягом 1год. при Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП ―Український інститут промислової власності‖, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюLactam
Автори англійськоюAudia, James, Edmund, John Varghese
Назва патенту російськоюЛактам
Автори російськоюДжон Варез
МПК / Мітки
МПК: C07D 223/00, A61P 25/28, C07K 5/06, A61K 31/55
Мітки: лактам
Код посилання
<a href="https://ua.patents.su/14-74849-laktam.html" target="_blank" rel="follow" title="База патентів України">Лактам</a>
Попередній патент: Застосування бромідпентатіофосфату міді та твердих розчинів на його основі як матеріалу для оптичного реле температур
Наступний патент: Амідні похідні як антагоністи nmda рецептора
Випадковий патент: Дисковий фільтр