Амідні похідні як антагоністи nmda рецептора
Номер патенту: 74850
Опубліковано: 15.02.2006
Автори: Колок Шандор, Домані Дьйордь, Борза Іштван, Бартане Салаі Гізелла, Надь Йожеф, Фаркаш Шандор, Норват Чілла
Формула / Реферат
1. Амідні похідні карбонової кислоти, що є антагоністами NMDA рецептора, формули (І):
 , (I)
, (I)
де
один з R1, R2, R3 і R4 являє собою -ОН, -NО2 або -NH2групу, а інші є атомами водню або
дві із сусідніх R1, R2, R3 і R4 груп разом з одним або двома ідентичними або різними додатковими гетероатомами з групи азоту й кисню та -СН= і/або -СН2- групами утворюють 5-6-членне гетероциклічне кільце,
та інші дві з R1, R2, R3 і R4 груп є атомами водню,
R5 і R6 разом з атомом азоту, що знаходиться між ними, утворюють піперидинове кільце, що є заміщеним фенокси, феніл-(С1-С4-алкіл), феніл-(С1-С4-алкокси), феноксі-(С1-С4-алкіл)групою, необов'язково заміщеною на ароматичному кільці одним або більше атомами галогену, C1-C4-алкільною групою,
значення Х і Y незалежно є або атомом кисню, або атомом азоту, або один з них є -СН= групою,
і їх солі, утворені з кислотами і основами.
2. Амідні похідні карбонової кислоти за п. 1, що являють собою обмежену групу амідних похідних карбонової кислоти формули (Іа):
 , (Іа)
, (Іа)
де значення R1, R2, R3, R4, R5 і R6 ті ж, що визначено в пункті 1 і їх солі, утворені з кислотами і основами.
3. Амідні похідні карбонової кислоти за п. 1, вибрані з групи:
6-(4-бензилпіперидин-1-карбоніл)-1,5-дигідро-оксазол[4,5-f]індол-2-он,
6-[4-(4-фторбензилпіперидин-1-карбоніл)]-1,5-дигідро-оксазол[4,5-f]індол-2-он,
(4-бензилпіперидин-1-іл)-(3,6-дигідропірол[3,2-е]індазол-7-іл)метанон,
[4-(4-фторбензилпіперидин-1-іл)]-(3,6-дигідропірол[3,2-е]індазол-7-іл)метанон,
(4-п-толілоксипіперидин-1-іл)-(3,6-дигідропірол[3,2-е]індазол-7-іл)метанон,
(4-бензилпіперидин-1-іл)-(3,6-дигідроімідазо[4,5-е]індол-7-іл)метанон,
і їх солі, утворені з кислотами і основами.
4. Фармацевтична композиція, що має активність селективного антагоніста NR2B рецептора, яка відрізняється тим, що містить біологічно ефективну дозу амідної похідної карбонової кислоти формули (I):
 , (I)
, (I)
де значення R1, R2, R3, R4, R5, R6, X і Y ті ж, які визначено в пункті 1, і/або її фармацевтично прийнятні солі, утворені з кислотами або основами, як активний інгредієнт, і носії, наповнювачі і їм подібні домішки, звичайно застосовувані у фармацевтиці.
5. Спосіб одержання амідних похідних карбонової кислоти формули (I):
 , (I)
, (I)
де значення R1, R2, R3, R4, R5, R6, Х і Y ті ж, як визначено в пункті 1, і їх солі, утворені з кислотами й основами, який відрізняється тим, що передбачає утворення амідного зв'язку між карбоновою кислотою формули (ІІ)
 , (II)
, (II)
де значення R1, R2, R3, R4, Х і Y ті ж, що вказано в пункті 1, та аміном формули (ІІІ)
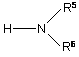 , (III)
, (III)
де значення R5 і R6 ті ж, що наведені в пункті 1,
після чого отриману в такий спосіб амідну похідну карбонової кислоти формули (I), де значення R1, R2, R3, R4, R5, R6, Х і Y ті ж, що визначені в пункті 1, за необхідністю, перетворюють на інші сполуки формули (I) за допомогою введення нових замісників і/або модифікуючи або видаляючи існуючі, і/або формуючи сіль, і/або вивільняючи сполуки із солі за допомогою відомих способів.
6. Спосіб за п. 5, який відрізняється тим, що в ньому беруть участь кислоти формули (ІІ), де значення R1, R2, R3, R4, Х і Y ті ж, що визначені в пункті 1, як активні похідні в реакції амідування.
7. Спосіб за п. 5, який відрізняється тим, що в ньому беруть участь кислоти формули (ІІ), де значення R1, R2, R3, R4, Х і Y ті ж, які визначені в пункті 1, у вигляді активного ефіру, утвореного з О-бензотриазол-1-іл-N,N,N',N'-тетраметилуронійгексафторфосфатом, у реакції амідування.
8. Спосіб за п. 5, який відрізняється тим, що в ньому беруть участь кислоти формули (ІІ), де значення R1, R2, R3, R4, Х і Y ті ж, що визначені в пункті 1, у вигляді галогенангідриду кислоти у реакції амідування.
9. Спосіб за п. 8, який відрізняється тим, що в ньому беруть участь кислоти формули (ІІ), де значення R1, R2, R3, R4, Х і Y ті ж, що визначені в пункті 1, у вигляді хлорангідриду кислоти в реакції амідування.
10. Спосіб одержання фармацевтичної композиції, яка має активність селективного антагоніста NR2B рецепторів, який відрізняється тим, що полягає у змішуванні амідної похідної карбонової кислоти формули (I)
 , (I)
, (I)
де значення R1, R2, R3, R4, R5, R6, Х і Y ті ж, що визначені в пункті 1, і/або її фармацевтично прийнятних солей, утворених з кислотами або основами, з носіями, наповнювачами і їм подібними домішками, звичайно застосовуваними у фармацевтиці.
11. Спосіб лікування й полегшення симптомів наступних захворювань ссавців, включаючи людину: хронічні нейродегенеративні захворювання, такі як інсульт, хвороба Альцгеймера, хвороба Паркінсона, хвороба Хантингтона, травма спинного мозку, епілепсія, занепокоєння, депресія, ішемія мозку будь-якого походження, м'язові спазми, мультиінфарктне слабоумство, травма мозку, біль (наприклад, посттравматичний або післяопераційний) і хронічні болючі стани, такі як нейропатичний біль або біль, пов'язаний з раком, мігрень, нейрональні ушкодження, пов'язані з вірусом імунодефіциту людини (ВІЛ), гіпоглікемія, аміотрофічний латеральний склероз (ALS), бактеріальні склерози, макуладегенерація, дегенеративні захворювання сітківки (наприклад, викликаний CMV ретиніт), астма, дзенькіт у вухах, втрата слуху, викликана аміноглікозидними антибіотиками, бактеріальні й вірусні інфекції; для зниження звикання і/або залежності до наркотиків і алкоголю і лікування синдрому абстиненції, пов'язаного з наркотиками й алкоголем, психозів, слабості сечового міхура, що включає введення ефективної кількості/кількостей амідної похідної карбонової кислоти формули (I):
 , (I)
, (I)
де значення R1, R2, R3, R4, R5, R6, Х і Y ті ж, що визначені в пункті 1, і/або її фармацевтично прийнятних солей, утворених з кислотами або основами, ссавцю, включаючи людину, що потребує лікування, у вигляді сполуки як такої або відповідно у формі фармацевтичної композиції, отриманої на відомому допоміжному устаткуванні, звичайно застосовуваному у фармацевтиці.
Текст
1. Амідні похідні карбонової кислоти, що є антагоністами NMDA рецептора, формули (І): 2 3 74850 4 R1 R1 R2 R2 Y R5 R3 R6 R4 , де значення R1, R2, R3, R4, R5 і R6 ті ж, що визначено в пункті 1 і їх солі, утворені з кислотами і основами. 3. Амідні похідні карбонової кислоти за п. 1, вибрані з групи: 6-(4-бензилпіперидин-1-карбоніл)-1,5-дигідрооксазол[4,5-f]індол-2-он, 6-[4-(4-фторбензилпіперидин-1-карбоніл)]-1,5дигідро-оксазол[4,5-f]індол-2-он, (4-бензилпіперидин-1-іл)-(3,6-дигідропірол[3,2е]індазол-7-іл)метанон, [4-(4-фторбензилпіперидин-1-іл)]-(3,6дигідропірол[3,2-е]індазол-7-іл)метанон, (4-п-толілоксипіперидин-1-іл)-(3,6-дигідропірол[3,2е]індазол-7-іл)метанон, (4-бензилпіперидин-1-іл)-(3,6-дигідроімідазо[4,5е]індол-7-іл)метанон, і їх солі, утворені з кислотами і основами. 4. Фармацевтична композиція, що має активність селективного антагоніста NR2B рецептора, яка відрізняється тим, що містить біологічно ефективну дозу амідної похідної карбонової кислоти формули (I): R1 R2 R5 Y CO N X R3 (I) R6 R4 де значення R1, R2, R3, R4, R5, R6, X і Y ті ж, які визначено в пункті 1, і/або її фармацевтично прийнятні солі, утворені з кислотами або основами, як активний інгредієнт, і носії, наповнювачі і їм подібні домішки, звичайно застосовувані у фармацевтиці. 5. Спосіб одержання амідних похідних карбонової кислоти формули (I): R1 R2 R5 Y CO X R3 (II) X R3 O R4 COOH (Іа) N N H N (I) , де значення R1, R2, R3, R4, Х і Y ті ж, що вказано в пункті 1, та аміном формули (ІІІ) R5 H N , де значення R5 і R6 ті ж, що наведені в пункті 1, після чого отриману в такий спосіб амідну похідну карбонової кислоти формули (I), де значення R1, R2, R3, R4, R5, R6, Х і Y ті ж, що визначені в пункті 1, за необхідністю, перетворюють на інші сполуки формули (I) за допомогою введення нових замісників і/або модифікуючи або видаляючи існуючі, і/або формуючи сіль, і/або вивільняючи сполуки із солі за допомогою відомих способів. 6. Спосіб за п. 5, який відрізняється тим, що в ньому беруть участь кислоти формули (ІІ), де значення R1, R2, R3, R4, Х і Y ті ж, що визначені в пункті 1, як активні похідні в реакції амідування. 7. Спосіб за п. 5, який відрізняється тим, що в ньому беруть участь кислоти формули (ІІ), де значення R1, R2, R3, R4, Х і Y ті ж, які визначені в пункті 1, у вигляді активного ефіру, утвореного з Обензотриазол-1-іл-N,N,N',N'тетраметилуронійгексафторфосфатом, у реакції амідування. 8. Спосіб за п. 5, який відрізняється тим, що в ньому беруть участь кислоти формули (ІІ), де значення R1, R2, R3, R4, Х і Y ті ж, що визначені в пункті 1, у вигляді галогенангідриду кислоти у реакції амідування. 9. Спосіб за п. 8, який відрізняється тим, що в ньому беруть участь кислоти формули (ІІ), де значення R1, R2, R3, R4, Х і Y ті ж, що визначені в пункті 1, у вигляді хлорангідриду кислоти в реакції амідування. 10. Спосіб одержання фармацевтичної композиції, яка має активність селективного антагоніста NR2B рецепторів, який відрізняється тим, що полягає у змішуванні амідної похідної карбонової кислоти формули (I) R1 R6 R2 R5 Y R4 де значення R1, R2, R3, R4, R5, R6, Х і Y ті ж, як визначено в пункті 1, і їх солі, утворені з кислотами й основами, який відрізняється тим, що передбачає утворення амідного зв'язку між карбоновою кислотою формули (ІІ) (III) R6 CO X R3 N (I) R6 R4 де значення R1, R2, R3, R4, R5, R6, Х і Y ті ж, що визначені в пункті 1, і/або її фармацевтично прийнятних солей, утворених з кислотами або основами, з носіями, наповнювачами і їм подібними домішками, звичайно застосовуваними у фармацевтиці. 11. Спосіб лікування й полегшення симптомів наступних захворювань ссавців, включаючи людину: 5 74850 6 хронічні нейродегенеративні захворювання, такі як введення ефективної кількості/кількостей амідної інсульт, хвороба Альцгеймера, хвороба Паркінсопохідної карбонової кислоти формули (I): R1 на, хвороба Хантингтона, травма спинного мозку, епілепсія, занепокоєння, депресія, ішемія мозку R2 R5 Y будь-якого походження, м'язові спазми, мультиінCO N фарктне слабоумство, травма мозку, біль (напри(I) X клад, посттравматичний або післяопераційний) і R6 R3 хронічні болючі стани, такі як нейропатичний біль або біль, пов'язаний з раком, мігрень, нейрональні R4 ушкодження, пов'язані з вірусом імунодефіциту , людини (ВІЛ), гіпоглікемія, аміотрофічний латераде значення R1, R2, R3, R4, R5, R6, Х і Y ті ж, що льний склероз (ALS), бактеріальні склерози, макувизначені в пункті 1, і/або її фармацевтично приладегенерація, дегенеративні захворювання сітківйнятних солей, утворених з кислотами або осноки (наприклад, викликаний CMV ретиніт), астма, вами, ссавцю, включаючи людину, що потребує дзенькіт у вухах, втрата слуху, викликана аміноглілікування, у вигляді сполуки як такої або відповідкозидними антибіотиками, бактеріальні й вірусні но у формі фармацевтичної композиції, отриманої інфекції; для зниження звикання і/або залежності на відомому допоміжному устаткуванні, звичайно до наркотиків і алкоголю і лікування синдрому абсзастосовуваному у фармацевтиці. тиненції, пов'язаного з наркотиками й алкоголем, психозів, слабості сечового міхура, що включає Винахід відноситься до нових антагоністів NMDA рецептора, що представляє собою амідні похідні карбонової кислоти, формули (l) де один з R1, R2, R3 і R4 являє собою ОН або NH2 групу, а інші є атомами водню або 1 2 3 4 дві сусідні R , R , R і R групи разом з одним або більш ідентичними або різними додатковими гетероатомами і -СН= і/або -СН2- групами утворюють 5-6-членне гомо- або гетероциклічне кільце, переважно пірольне, піразодьне, імідазольне, оксазольне, оксооксазолідинове або 3-оксо-1,4оксазинове кільце, і дві інші R1, R2, R3 і R4 групи є атомами водню, R5 і R6 разом з атомом азоту між ними утворюють насичене або ненасичене 4-6 членне гетероциклічне кільце, що є заміщеним гідроксильною групою, і/або, у даному випадку, фенільною або групами фенокси, феніл-(С1-С4-алкіл), феніл-(С1С4-алкокси), фенокси-(С1-С4-алкіл), аніліно, феніл(С1-С4-алкіламіно), [феніл-(С1-С4-алкіл)]-аміно, бензоїл, гідроксидифенілметил, С1-С4алкоксикарбонілфеноксиметил або бензгідриліденовою групою, необов'язково заміщеними на ароматичному кільці одним або більш атомами галогену, ціано або гідроксильною групою, С1-С4алкільною або С1-С4-алкоксигрупою, X і Υ незалежно являють собою атом або кисню або азоту -СН= групу, і до їхніх солей, утворених з кислотами і основами. Оскільки даний винахід відноситься також до солей сполук формули (l), утворених з кислотами або основами, особливо солям, утворених з фармацевтично прийнятними кислотами або основами, приведені значення для сполуки формули (ί) відносяться або до вільної сполуки, або до солі, якщо не обговорено окремо. Особливо значною групою сполук даного винаходу є сполуки формули (lа), де значення R1, R2, R3, R4, R5 і R6 ті ж, що описано для сполук формули (l). Особливо, важливими амідними похідними карбонової кислоти формули (l) є наступні: 6-(4-бензилпіперидин-1-карбоніл)]-1,5дигідрооксазол[4,5-f]індол-2-он, 6-[4-(4-фторбензилпіперидин-1-карбоніл)]-1,5дигідрооксазол[4,5-f]індол-2-он, (4-бензилпіперидин-1-іл)-(3,6-дигідропірол[3,2е]індазол-7-іл)метанон, [4-(4-фторбензилпіперидин-1-іл)]-(3,6дигідропірол[3,2-е]індазол-7-іл)метанон, (4-п-толілоксипіперидин-1-іл)]-(3,6дигідропірол[3,2-е]індазол-7-іл)метанон, (4-бензилпіперидин-1-іл)-(3,6дигідроімідазо[4,5-е]індол-7-іл)метанон. Винахід також відноситься до фармацевтичних композицій, що містять як активний інгредієнт сполуки формули (l). Крім того, об'єктами даного винаходу є спосіб одержання сполук формули (l) і хімічне і фармацевтичне виробництво лікарських засобів, що містять зазначені сполуки, а також спосіб лікування за 7 74850 8 допомогою зазначених сполук, який полягає у введенні ссавцям, що підлягають лікуванню, включаючи людину - ефективної кількості/кількостей сполук формули ()) даного винаходу як такого або у виді лікарського засобу. Термін "галоген" як заступник - як визначено раніше - означає фтор, хлор, бром або йод, переважно фтор і хлор. Термін С1-С4-алкільна група, використовуваний у даному описі, означає метиде значення R1, R2, R3, R4, X і Υ є такими, як льну, етильну, лінійну і ізопропільну і різні бутильні описано вище для сполуки формули (l) - і аміну групи. Зазначені С1-С4-алкільні групи можуть бути формули (lll) у складі С1-С4-алкоксигруп. Термін С1-С4алканоілоксигрупа означає одновалентну ацилоксигрупу, що містить атом водню, також як і С1-С6 алкільну групу і оксигрупу (-СО-О-), приєднану до неї, переважно формілокси, ацетокси, пропіонілокси, різні бутирілокси, валероілокси і капроілоксигрупи. де значення R5 і R6 є такими, як описано вище Винахід відноситься також до солей сполук для сполуки формули (l), і потім отримана амідна формули (!), утворених з кислотами або основами. похідна карбонової кислоти формули (l) - де знаЯк органічні, так і неорганічні кислоти можуть чення R1, R2, R3, R4, R5, R6, X і Υ є такими, як опибути використані для формування кислотносано вище для сполуки формули (l) - при необхідадитивних солей. Придатними неорганічними кисності переводять в іншу сполуку формули (l) лотами можуть бути, наприклад, соляна кислота, введенням нових замісників і/або модифікацією сірчана кислота і фосфорна кислота. Представниабо видаленням існуючих замісників, і/або утвоками одновалентних органічних кислот можуть ренням солі і/або виділенням сполуки із солей, бути, наприклад, мурашина кислота, оцтова кисі/або отримані рацемати розщеплюють на ізомери лота, пропіонова кислота і різні масляні кислоти, за допомогою оптично активних кислот або основ валеріанові кислоти і капринові кислоти. Представідомими способами. вниками двовалентних органічних кислот можуть Утворення амідного зв'язку переважно здійсбути, наприклад, щавлева кислота, малонова киснюють шляхом одержання активної похідної карлота, малеїнова кислота, фумарова кислота і бубонової кислоти формули (ll), з наступною її взаєрштинова кислота, інші органічні кислоти також модією з аміном формули (lll), переважно в можуть бути використані, такі як гідроксикислоти, присутності основи. наприклад, лимонна кислота, винна кислота або У розчині карбонову кислоту переводять в акароматичні карбонові кислоти, наприклад бензойтивну похідну in stru під час утворення амідного на кислота або саліцилова кислота, також як алізв'язку в придатному розчиннику (наприклад, дифатичні й ароматичні сульфонові кислоти, наприметилформаміді, ацетонітрилі, хлорованих вуглеклад, метансульфонова кислота і пводнях або вуглеводнях). Активними похідними толуолсульфонова кислота. Особливо цінною груможуть бути хлорангідриди кислот (наприклад, пою кислотно-адитивних солей є та, у якій сам отримані з карбонової кислоти з тіонілхлоридом), кислотний компонент не має терапевтичного ефезмішані ангідриди (наприклад, отримані з карбонокту у застосовуваній дозі, або вона несприятливо вої кислоти з ізобутилхлороформіатом у присутноне впливає на ефективність активного компонента. сті основи, наприклад, триетиламіну), активні ефіЗазначені кислотно-адитивні солі є фармацевтичри (наприклад, отримані з карбонової кислоти з но прийнятними кислотно-адитивними солями. гідроксибензотриазолом і дициклогексилкарбодиіПричина, чому кислотно-адитивні солі, які не намидом або О-бензотриазол-1-іл-N,N,N',N'лежать до фармацевтично прийнятних кислотнотетраметилуронійгексафторфосфатом (HBTU) у адитивних солей, але відносяться до даного винаприсутності основи, наприклад, триетиламіну). ходу, полягає в тому, що при необхідності, вони Активні похідні одержують при температурі між можуть бути корисними при очищенні і виділенні кімнатною і 0°С. До отриманого розчину або субажаної сполуки. спензії додають відповідний амін формули (III) у Серед солей, утворених з основами, особливо виді основи або у виді солі, утвореної з неорганічважливими є солі, утворені з лужними металами, ною кислотою, так, що основа, наприклад, триетинаприклад, натрієм, калієм, лужноземельними ламін, необхідний для виділення аміну, додають у металами наприклад, кальцієм і магнієм, а також з реакційну суміш окремо. Реакції конденсації відсаміаком або органічними амінами. Останні основи лідковують тонкошаровою хроматографією. Необможуть мати додаткові замісники, наприклад гідхідний час реакції складає 6-20год. Обробку реакрокси або аміногрупи, що можуть впливати, наприційної суміші проводять різними способами. клад, на розчинність і обробку продукту. Коли реакційна суміш являє собою суспензію, Відповідно до винаходу сполуки формули (l) осад відфільтровують і перекристалізовують із одержують утворенням амідного зв'язку між карпридатного розчинника з одержанням чистого боновою кислотою формули (ll) продукту. Якщо кристалізація не приводить до чистого продукту, то для його очищення можна потім застосувати колоночну хроматографію. Колоночну хроматографію проводять або в норма 9 74850 10 льній фазі за допомогою кизельгеля 60, як адсорний інгредієнт відповідно до даного винаходу, звибенту і в різних системах розчинників, наприклад чайно містять від 0,01 до 100мг активного інгредієтолуол/метанол, хлороформ/метанол або толунта в одній дозованій одиниці. Звичайно, можливо, ол/ацетон, у якості елюентів, або на обертальній що кількість активного інгредієнта в деяких компофазі за допомогою наповнювачів типу Prep-Pakзиціях є більшою або меншою границь, визначених 500/318 (що випускаються Waters Associates) і вище. суміші ацетонітрил/вода/трифтороцтова кислота в Твердими формами фармацевтичних компоякості елюенту. Якщо реакційна суміш наприкінці зицій можуть бути, наприклад, таблетки, драже, реакції ацилювання являє собою розчин, його конкапсули, або пігулки, ліофілізованні порошки в центрують і залишок або кристалізують або очиампулах, придатні для одержання ін'єкцій. Рідкими щають за допомогою хроматографії на колоні, як композиціями є ін'єкційні і інфузіонні композиції, описано вище. Структури продуктів визначають за рідкі лікарські засоби, запаяні рідини і краплі. Напідопомогою IK, ЯМР і мас-спектрометрії. врідкими композиціями можуть бути мазі, бальзаАльтернативно, реакційна суміш може бути ми, креми, мікстури, що струшуються і супозиторії. очищена за допомогою колоночної хроматографії Для простого введення бажано, щоб фармабез концентрування наприкінці реакції. Фракції, що цевтичні композиції включали дозовані одиниці, містять бажану сполуку, концентрують, залишки що містять кількість активного інгредієнта, яку варрозчиняють у диметилсульфоксиді і структуру, то ввести одноразово або за кілька разів, або почистоту, а також як і концентрацію продукту визналовину, третю або четверту частину від них. Такичають за допомогою ВЕРХ/MC (колоночної хромами дозованими одиницями є, наприклад, таблетки, тографії високого тиску, з наступної мас спектроякі можна розділити за допомогою канавок, відометрією). кремлюючи половину або чверть таблетки для Отримані амідні похідні карбонової кислоти точного введення необхідної кількості активного формули (I) - незалежно від способу одержання інгредієнта. при необхідності можуть бути перетворені в інші Таблетки можуть бути покриті оболонкою, розсполуки формули (I) введенням інших замісникічинною в кислоті, для забезпечення вивільнення ві/або модифікацією і/або видаленням існуючих вмісту активного інгредієнта після проходження замісників і/або утворенням солей з кислотами шлунка. Такі таблетки є покритими ентеросолюбіі/або виділенням амідного похідного карбонової льною оболонкою. Подібна дія може також досягакислоти формули (I) з отриманих кислотнотися інкапсулюванням активного інгредієнта. адитивних солей обробкою основою, і/або вільне Фармацевтичні композиції для орального ввеамідне похідне карбонової кислоти формули (I) дення можуть містити, наприклад, лактозу або може бути перетворено в сіль обробкою основою. крохмаль у якості наповнювачів, карбоксиметилКарбонові кислоти формули (II) і первинні або целюлозу натрію, метилцелюлозу, полівінілпіролівторинні аміни формули (III) є або комерційно досдин або крохмальну пасту як зв'язуючи речовини тупними, або можуть бути отримані різними відоабо гранулюючи агенти. Додають картопляний мими способами. Синтези деяких комерційно некрохмаль або мікрокристалічну целюлозу в якості доступних карбонових кислот формули (II) описані розпушуючих агентів, а також можуть використов прикладах. Завдяки зазначеним способам, мовуватися або ультраамілопектин або формальдежуть бути також отримані інші комерційно недогідний казеїн. У якості антиадгезійних засобів і луступні карбонові кислоти формули (II). брикантів можуть використовуватися тальк, Сполуки по винаходу, також як і їх фармацевколоїдна кремнієва кислота, стеарин, стеарат катично прийнятні солі, можуть використовуватися льцію магнію. окремо або відповідно у формі фармацевтичних Таблетка може бути отримана, наприклад, вокомпозицій. Зазначені композиції (лікарські засоби) логим гранулюванням з наступним пресуванням. можуть знаходитися у твердій, рідкій або напіврідЗмішані активні інгредієнти і наповнювачі, а також кій формі і можуть додаватися до них фармацевпри необхідності, частину розпушуючих агентів тичний ад'ювант і допоміжні речовини, які широко гранулюють у водяному, спиртовому або водновідомі в практиці, такі як носії, наповнювачі, розріспиртовому розчині зв'язуючої речовини з викориджувачі, стабілізатори, зволожувачі або емульгуюстанням придатного устаткування, потім гранулят чі агенти, речовини, що впливають на значення pH висушують. До сухого грануляту додають інші розі осмотичний тиск, віддушки або ароматизатори, а пушуючи агенти, лубриканти й антиадгезійні агентакож добавки, такі як розпушувачі або наповнюти і суміш пресують у таблетку. У даному випадку вачі. таблетки виготовляють з канавками, що поділяють Доза, необхідна для терапевтичної дії, може таблетку навпіл, для кожного введення. варіюватися в широких межах і відповідає індивіТаблетки можуть бути виготовлені пресувандуальним вимогам у кожному конкретному випадням прямо із суміші активного інгредієнта і потрібку, у залежності від стадії хвороби, стану і ваги них допоміжних речовин. При необхідності таблеттіла пацієнта, що знаходиться на лікуванні, а таки можуть бути покриті шаром з добавок, широко кож від чутливості пацієнта до активного інгредієнвідомих у фармацевтичній практиці, наприклад, та, способу введення і числа обробок у день. Точтаких як стабілізатори, віддушки, барвники, таких на використовувана доза активного інгредієнта як цукор, похідні целюлози (метил- або етилцелюможе бути благополучно визначена лікуючим лікалоза, карбоксиметилцелюлоза натрію і т.д.), полірем на підставі знань рівня, а також - пацієнта, що вінілпіролидон, фосфат кальцію, карбонат кальзнаходиться на лікуванні. цію, харчові барвники, харчові настойки, Фармацевтичні композиції, що містять активароматизатори, пігменти на основі оксиду заліза і 11 74850 12 т.д. У випадку капсул суміш активного інгредієнта і які, як відомо, мають тільки різні інгібуючі дії на допоміжних речовин поміщають у капсули. фермент - нові амідні похідні карбонової кислоти Рідкі оральні композиції, наприклад суспензії, формули (І) даного винаходу є високо ефективнисиропи, еліксири, можуть бути виготовлені за доми і селективними антагоністами NMDA (N-метилпомогою води, гліколей, олій, спиртів, барвників і D-аспартат) рецепторів, і більш того, більшість віддушок. сполук є селективними антагоністами NR2B підтиДля ректального введення композицію поміпи NMDA рецептора. Ця селективність є особливо щають в супозиторій або клізму. Супозиторії, крім важливою для зниження небажаних побічних ефеактивного інгредієнта, можуть містити носій, так ктів сполук. названий просупозиторій на основі свинячого жиАнтагоністи NMDA рецепторів можуть викориру. Носіями можуть бути овочеві олії, такі як гідростовуватися при багатьох захворюваннях, що сувані овочеві олії, триглицериди С12-С18 жирних проводжуються надлишком вивільнення глутамакислот (переважно, носії, що мають товарне нату, головного збуджувального нейронпереносника йменування WitepsoI). Активний інгредієнт гомов центральній нервовій системі. Надактивація генно змішують з розплавленими просупозиторіяNMDA рецепторів глутаматом може приводити до ми на основі свинячого жиру і формують нагромадження кальцію в клітках. Це може запуссупозиторії. кати каскад внутрішньоклітинних процесів, що моДля парентерального введення композицію жуть змінювати клітинну функцію і навіть приводискладають у виді ін'єкційного розчину. Для одерти до загибелі нейронів [TINS, 10, 299-302 (1987)]. жання ін'єкції розчин активних інгредієнтів розчиРозпізнавання структури NMDA рецептора, няють у дистильованій воді і/або в різних органічфункції і фармакології обумовлюють останні досяних розчинниках, таких як гліколеві ефіри, у гнення молекулярної біології. NMDA рецептори даному випадку в присутності розчинників, наприявляють собою гетеромерні комплекси, побудоваклад, поліоксиетиленсорбітан-монолаурату, ні, принаймні, з однієї NR1 субодиниці і принаймні моноолеату або моностеарату (Tween 20, Tween однієї з чотирьох NR2 субодиниць (NR2A-D). Як 60, Tween 80). ін'єкційний розчин може також міспросторові конструкції CNS, так і фармакологічна тити різні допоміжні речовини, такі як консерванти, чутливість NMDA рецепторів, побудованих з різних наприклад, тетраацетатетилендіамін, а також агеNR2 субодиниць, є різними. Особливий інтерес нти, що підтримують значення pH, і буфери, і, у представляє NR2B субодиниця через її обмежену даному випадку, місцеву анестезуючу речовину, конструкцію, (найвища щільність спостерігається в наприклад лідокаін. lн'єкційний розчин, що містить передмозговій і основній желатиноподібній речоактивний інгредієнт по винаходові, фільтрують до вині спинної зв'язки). Сполуки, селективні для цьойого внесення в ампули, і стерилізують після внего підтипу, відомі [Curr. Pharm. Des. 5, 381-404 сення. (1999)] і, як доведено, є ефективними на тваринЯкщо активний інгредієнт гігроскопічний, він них моделях з паралічем [Stroke 28, 2244-2251 може бути потім стабілізований ліофілізацією. (1997)], травматичним ударом мозку [Brain Res. Близькі структурні аналоги амідних похідних 792, 291-298 (1998)], хворобою Паркінсона [Exp. карбонової кислоти формули (l) відомі з рівня техNeuroI. 163, 239-243 (2000)], нейропатичним і заніки. пальним болем [Neuropharmacotogy 38, 611-623 Заміщені похідні індол-2-ілкарбонілпіперидина, (1999)]. Підтип селективних антагоністів NMDA аналогічні сполукам по винаходові, описані в WO рецепторів, як очікується, виявляє невеликі або 9618628 і двох публікаціях [J. Med. Chem., 39, 3769 несприятливі побічні ефекти, викликані дією несе(1996), і J. Med. Chem., 42, 4140 (1999)]. Зазначені лективних антагоністів NMDA рецепторів на сайт сполуки, що мають інгібуючу активність зворотної зв'язування глутамату або в проході тунелю. транскриптази, можуть використовуватися для Захворюваннями, що, як відомо, зв'язані з лікування пацієнтів зі СПИДом. NMDA антагоністами [Drug News Perspect 11, 523Аміди індол-2-карбонової кислоти є також ві569 (1998) і WO 00/00197], є церебральна ішемія домими [Bioorg. Med. Chem. Letters, 10, 483. будь-якого походження (наприклад, удар, тепло(2000)], інгібують рр603-src тирозинкиназу,і, отже, вий вплив), хронічні нейродегенеративні захворювони можуть використовуватися для лікування вання, такі як хвороба Альцгеймера, хвороба Парпацієнтів, що страждають онкологічними захворюкінсона, аміотрофічний латеральний склероз ваннями. Зазначені публікації не описують антаго(ALS), хвороба Хантингтона, вірус імунодефіциту ністичної дії на NMDA рецептор. людини (ВІЛ), зв'язаний з ушкодженням нейрона, Похідні бензофуран-2-іл-піперидину описані в травматичний ушиб мозку або спинної зв'язки, біль WO 2000012074. Зазначені сполуки мають інгібую(наприклад, посттравматичний або післяопераційчу дію на р38-а кіназу, і, отже, можуть використоний) і хронічні болі, такі як нейропатичний біль або вуватися для лікування інфекційних хвороб, вибіль, зв'язаний з раком. Антагоністи NMDA рецепкликаних грам-негативними бактеріями, а також тора можуть також використовуватися для лікупацієнтів з респіраторним хворобливим синдровання епілепсії, занепокоєнь, депресії, мігрені, мом. психозу, м'язових спазм, мультиінфарктного слаПохідне метанону, описане в [Protein Sci, 6(7), боумства і слабоумства іншого походження, гіпог1412 (1997)], є інгібітором тромбіну. Ці публікації лікемії, дегенеративних захворювань сітківки (нане описують антагоністичної дії на NMDA рецепприклад, CMV ретиніт), астми, дзенькоту у вухах, тор. утрати слуху, викликаної аміноглікозидним антибіНесподівано було виявлено, що на противагу отиком. NMDA антагоніст може використовуватися відомим сполукам, структурно аналогічні сполуки для зниження толерантності і/або залежності від 13 74850 14 опіоідного лікування болю і для лікування синдроProtocots for Neural Cell Culture, eds: Fedoroff, S.; му залежності, наприклад, від алкоголю, опіоідів і Richardson A., The Humana Press lnc, 13-38]. Після кокаїну. виділення клітки поміщають у стандартні 96Так як сполуки, що заявляються, мають вищечарункові мікропланшети і культури підтримують в визначено біологічні активності, об'єктами даного атмосфері 95% повітря-5% СО2 при 37°С до вимівинаходу також є способи лікування амідними порів кальцію. хідними карбонової кислоти формули (ί) або їх Культури використовують для вимірів кальцію солями, що припускає введення ссавцю, що знаусередині клітки через 4-7 днів in vitro. До виміру в ходиться на лікуванні - включаючи людину - ефекклітки вводять флуоресцентний Са2+-чуттєвий бативної кількості/кількостей сполук формули (l) дарвник, Ftuo-4/AM (2-2,5мкМ). Для припинення ввеного винаходу окремо або у виді лікарського дення клітки промивають двічі розчином, що викозасобу. ристовується для виміру (140мМ NaCl, 5мМ КСl, Відомо, що протягом постнатального розвитку 2мМ СаСІ2, 5мМ HEPES, 5мМ HEPES-Na, 20мМ субодинична композиція ней-ронних NMDA рецепглюкози, 10мкМ гліцину, рН=7.4). Після промиванторів змінюється. Подібні зміни виявлені в клітиння до кліток додають тестуємі сполуки в зазначених культурах нейронів [Eur. J. Neurosci. 10, 1704ному вище розчині (90мкл/на чарунку). Вимір ка1715 (1998)]. Відповідно до літературних даних і з льцію усередині клітки проводять чарунковим власними имуно - цитохімічними дослідженнями флуориметричним лічильником: підвищення Fiuoнейронних кліток, культуруємих протягом 4-7 днів 4-флуоресценції і, отже, кальцію усередині клітки, in vitro, авторами даного винаходу, переважно викликають введенням 40мкМ NMDA. інгібуюча експресуеться NR2B субодиниця разом з NR1 суактивність тестуємих сполук оцінюється виміром бодиницею. Такий функціональний тест на NMDA зниження в підвищенні рівня кальцію в присутності антагонізм у зазначених клітках головним чином різних концентрацій сполук. Після виміру викорисвідображає дія NR2B субодиниці, що містить ретовують стандартну калібровану процедуру з нецептори. Так як NMDA рецептори, як відомо, є великими змінами для перетворення флуоресценпроникливими для іонів кальцію в процесі збутних даних у значення концентрації кальцію [Meth. дження, автори охарактеризували активацію Cell. Bio!. 40, 155-181 (1994)]. NMDA рецептора за допомогою виміру збільшення Криві доза-відгук і IC50-величини розраховують концентрації кальцію усередині клітки після додаза допомогою даних, отриманих принаймні з трьох вання до кліток агоністу (NMDA). незалежних експериментів. Iнгібуюча активність Визначення активності NMDA антагоніста in сполуки в крапці одиничної концентрації виражаvitro за допомогою виміру концентрації кальцію ється як інгібування у відсотках відгуку NMDA. Сігусередині клітки чарунковим флуориметричним моідальні криві концентрація-інгібування відповілічильником дають даним і визначають IC50 величини як Вимір кальцію усередині клітки проводять на концентрацію, що проявляє половину від максипервинних неокортикальних культурах клітки, мального інгібування, викликаного сполукою. отриманих від ембріонів Chartes River пацюка у У Таблиці 1 представлені IC50 величини для віці 17 днів [для більш докладного опису одержанбільшості ефективних сполук даного винаходу, ня неокортикальної культури клітки дивися вимірювані в цьому тесті (стовпчики 1-2), разом з Johnson, Μ.i.; Bunge, R.P. (1992): Primary cell найефективнішими дослідженими сполуками з cultures of peripheral and central neurons and gila. ln: рівня техніки (стовпчики 3-4). Таблиця 1 Кодовий номер сполуки 4570001461 4570001689 4570001690 4570001484 4570002260 4570001779 4570001662 4570001462 4570001688 4570002340 4570001661 4570001972 4570001971 45 14305 4570002045 45 13579 45 13848 4570001103 4570001378 NMDA IK50 [мкМ] 0,017 0,020 0,022 0,041 0,042 0,050 0,058 0,079 0,088 0,127 0,150 0,193 0,328 0,392 0,44 0,018 0,090 0,0022 0,009 Код сполуки з рівня техніки Со-101244 EMD 95885 СР 101,606 Со-111103 Ro 25.6981 іфенпродил NMDA IK50 [мкМ] 0,023 0,035 0,041 0,060 0,159 0,483 Сполуками з рівня техніки є наступні: Co 101244: 1-[2-(4-гідроксифенокси)етил]-4гідрокси-4-(4-метилбензил)піперидин EMD 95885: 6-[3-(4-фторбензил)піперидин-1іл]пропіоніл]-2,3-дигідробензоксазол-2-он СР-101,606: (13,28)-1-(4-гідроксифеніл)-2-(4гідрокси-4-фенілпіперидин-1-іл)-1-пропанол Со-111103: 1-[2-(4-гідроксифенокси)етил]-4-(4фторбензил)піперидин Ro 25.6981: R-(R*, S*)-1-(4-гідроксифеніл)-2метил-3-[4-(фенілметил)піперидин-1-іл]-1пропанол. Як показує Таблиця 1, більшість сполук даного винаходу, підданих дослідженню, перевищують по активності сполуки, відомі з рівня техніки. Тест на субодиничну селективність на клітках, експерсуючих рекомбінан-тні NMDA рецептори пацюків Для підтвердження селективності NR2B субодиниці сполук, використовують клітки, трансфіцируваних з ДНК пацюка NR1a і NR2A або NR2B субодиниці. Гени, клоновані відповідно до відомих послідовностей [gi508809 (NR1a пацюка), ді205738 (NR2B пацюка), ді2905805 (NR2A пацюка)] вбудовують в індуковані вектори експресії ссавця, що несуть різні стійкі гени (гігроміцин у випадку NR1a або неоміцин у випадку NR2 субодиниць). Конструкції векторів вводять у НЕКО293 клітки за допомогою катіонного ліпідного способу трансфекції. Експресію білка викликають за допомогою 3мкМ Муристерона А. Клітки підтримують у присутності 365мкМ кетаміну протягом 48-72 годин в атмосфері 95% повітря-5% СO2 при 37°С до експериментів. Оцінка NMDA антагоністичної активності на клітках, трасфікованих NR1a/NR2B субодиницямифлуориметричним методом Для введення клітинних клонів, стабільно експресуючих NR1a/NR2B рецептори, трансфіцирувані клітки обробляють обраними антибіотиками протягом 4 тижнів, потім вирощують стійкі клони. Експресію білка NR2B субодиниці здійснюють за допомогою потокового імуноцитохімічного методу, заснованого на цитометрії. Далі позитивні клони тестують на функціональну активність в експериментах з фіксованим розподілом. Кращий клон, продуцируючий найбільший іонний потік, викликаний NMDA, використовують для тестування NMDA антагонізму за допомогою виміру NMDA, що викликає підвищення концентрації кальцію в цитозолі. Індукція експресії протеїну і вирощування кліток були такими ж, як описано вище. Клітки поміщають у стандартні 96-чарункові мікропланшети. Для виміру NMDA антагонізму використовують флуориметричні випробування за допомогою лічильника на підкладці. Власне кажучи спосіб є таким же, як спосіб, описаний вище для тестування первинних культур кортикальних нейронів пацюків. Оцінка NMDA антагоністичної активності на клітках, трасфікованих NR1a/NR2А субодиницями, методом з фіксованим розподілом В експериментах з фіксованою плямою використовують клітки, швидко експресуючі NR1a/NR2A рецептори і вирощені під покривними стеклами. Суцільноклетинний записуючий пристрій з фіксованим розподілом виготовляють у відповідності зі стандартними способами. Клітинні культури постійно промивають позаклітинним розчином (140мМ NaCl, 5мМ КСl, 5мМ Hepes, 5мМ Na-Hepes, 2мМ СаСІ2, 20мМ глюкози, 10мкМ гліцину, pH 7,35) при кімнатній температурі. Ділильні піпетки опором між 3 і 6 Μ наповнюють позаклітинним розчином (140мМ CsCl, 11мМ EGTA і 10мМ Hepes, pH 7,3). Записують внутрішній потік, викликаний 100мкМ NMDA, від кліток при фіксованій напрузі -70мВ. Сполуки пропускають через мультибаррельний виштовкуючий пристрій, контрольований електромагнітними клапанами. Перший NMDA вводять повторно до стабілізації відгуків, потім вводять тестуєму сполуку. Ступінь інгібування - виражену у відсотках розраховують з піка потоків, викликаних NMDA, у присутності і відсутності тестуємо сполуки. Співвідношення селективності (NR2B/NR2A) розраховують як співвідношення тестуємо! дози на NR1/2A трансфікування клітки і IK50 величини NMDA антагонізму на NR1/NR2B експресирування клітки. Результати представлені в Таблиці 2. Таблиця 2 Оцінка селективності для NR2B від NR2A субодиниці, що містить рецептори Сполуки 4570001461 4570002260 СР-101,606 NR1/NR2B* IKС50 [мкМ] 0,015 0,030 0,033 NR1/NR2A** % інгібування NMDA Ca+ - відгук 15мкМ 14,9 3,3 -8,8 Селективність >1000 >500 >1200 *: Дані, отримані на НЕК293 клітках, стабільно експресуючих NR1a/NR2B субодиниці, виміром внутрішньоклітинної концентрації кальцію лічильниковим флуориметром на підкладці. Представлено значення 3 експериментів. **: Результати експериментів з фіксованим розподілом на NR1a/NR2A швидко трансфікованих НЕК клітках. Представлена тестуєма концентрація. Приведено значення 3, 6, 2 експериментів для 4570001461, 45070002260 і СР-101,606, відповідно. Селективність: співвідношення селективності (NR2B/NR2A), розраховане як співвідношення тестуємої концентрації на NR1/2A трансфікування клітки і IK50 величини на NR1/NR2B експресуючи клітки. Відповідно до результатів, представлених в Таблиці 2, сполуки 4570001461 і 4570002260 також як і СР-101,606, є високо селективними у відношенні NR2B субодиниці, що містить NMDA рецептори. Синтез сполук і фармацевтичних композицій відповідно до винаходу представлений наступними не обмежуючими прикладами. Кодові номери сполук, що приведені в біологічних тестах, зазначені після назви сполук, одержуваних у Прикладах. Приклад 1 6-(4-Бензилпіперидин-1-карбоніл-3Нфуро[3',2':4,5]бензо[1,2-d]оксазол-2-он (45 14255) a) Етил 3Н-фуро[2,3-f]бензоксазол-2-он-6карбоксилат Суміш 0,9 г (4,2ммоль) етил 5-гідрокси-6амінобензофуран-2-карбоксилата [Hetv. Chim. Acta 77, 100 (1994)], 60мл тетрагідрофурану, 3,1мл 20% водяного розчину фосгену в толуолі і 2,0мл триетиламіну перемішують при кімнатній температурі протягом години. Тетрагідрофуран відганяють у вакуумі, до залишку додають воду і продукт екстрагують етилацетатом. Об'єднані органічні шари промивають 5% водяним розчином гідрокарбонату натрію, водою, 1N розчином соляної кислоти і знову водою, сушать над сульфатом натрію і концентрують, що дає 1,0г (96%) названої сполуки у виді олії. b) 3Н-Фуро[2,3-f]бензоксазол-2-он-6-карбонова кислота Суміш, що перемішується, 1,0г (4ммоль) етил 3Н-фуро[2,3-f]-бензоксазол-2-он-6-карбоксилату, 100мл етанолу і 0,5г гідроксиду калію нагрівають при кипінні зі зворотним холодильником протягом години. Суміш концентрують, залишок розчиняють у воді і підкислюють 20% водяним розчином сірчаної кислоти. Осаджені кристали відфільтровують і промивають водою, що дає 0,84г (95%) названої сполуки. Т.пл.: 190-192°С (вода). с) 6-(4-Бензилпіперидин-1-карбоніл )-3Нфуро[3',2':4,5]бензо[1,2-d]оксазол-2-он Суміш 0,42г (1,9ммоль) 3Н-фуро[2,3f]бензоксазол-2-он-6-карбонової кислоти, 0,3мл (2,1ммоль) триетиламіну, 0,35мл (2,0ммоль) 4бензилпіперидину, 0,76г (2,0ммоль) HBTU (Advanced Chem. Tech.) і 10мл диметилформаміду перемішують при кімнатній температурі протягом 6 годин. Реакційну суміш концентрують і залишок очищають за допомогою хроматографічної колонки, використовуючи кизельгель 60 як адсорбент (Merck) і суміш - толуол: ацетон = 2:1 як елюент, потім продукт кристалізують з діетилового ефіру, що дає 0,39г (54%) названої сполуки. Т.пл.: 205210°С (діетиловий ефір). Приклад 2 6-(4-Бензилоксипіперидин-1-карбоніл)-3Нфуро[3',2';4,5]бензо[1,2-d]оксазол-2-он (45 14254) Названу сполуку одержують з 3Н-фуро[2,3f]бензоксазол-2-он-6-карбонової кислоти і 4бензилоксипіперидину у відповідності зі способом, описаним у прикладі 1/с. Т.пл.: 217-219°С (діетиловий ефір). Приклад 3 1-(4-бензилпіперидин-1-іл)-1-(1,6-діаза-азіндацен-2-іл)метанон (45 14305) а) Метил (Z)-2-азидо-3-(1Н-індол-5-іл)акрилат В атмосфері азоту, до розчину метоксиду на трію (отриманого з 15мл метанолу і 0,66г (29ммоль) натрію) додають по краплях при температурі 0°С суміш 1,02г (7ммоль) індол-5карбальдегиду [Heiv. Chim. Acta, 1616 (1968)], 3,34г (29ммоль) метил азидо-ацетату і 7мл метанолу й таким чином отриману суміш перемішують при тій же самій температурі протягом 5 годин. Потім реакційну суміш розбавляють 50мл води й екстрагують тричі 50мл хлороформу. Об'єднані органічні шари промивають 20мл води, відфільтровують за допомогою розділяючої фази пористого паперу і концентрують, що дає 1,3г (77%) названої сполуки. Т.пл.: 130-133°С (хлороформ). b) Метиловий ефір 1,6-дигідро-1,6-діаза-азіндацен-2-карбонової кислоти До киплячого розчину 36мл ксилолу додають невеликими дозами 1,09г (4,5ммоль) метилового ефіру (2)-2-азидо-3-(1Н-індол-5-іл)акрилової кислоти. Реакційну суміш нагрівають при кипінні зі зворотним холодильником, поки не закінчиться виділення азоту, потім концентрують і залишок кристалізують гексаном, продукт відфільтровують і промивають гексаном, що дає 0,6г (62%) названої сполуки. Т.пл.: 183-184°С (гексан). c) 1,6-дигідро-1,6-діаза-аз-індацен-2карбонова кислота Суміш 0,53г (2,5ммоль) метилового ефіру 1,6дигідро-1,6-діаза-аз-індацен-2-карбонової кислоти, 0,36г (2,5ммоль) триметилсиланоляту калію (Atdrich) і 6,0мл тетрагідрофурану нагрівають при кипінні зі зворотним холодильником протягом години, потім додають ще 0,18г (1,25ммоль) триметилсиланоляту калію і, після 5 годин нагрівання при кипінні зі зворотним холодильником, реакційну суміш концентрують. Залишок перемішують з 20мл води, нерозчинений залишок відфільтровують, до фільтрату додають 0,32мл соляної кислоти, осаджений сирий продукт відфільтровують і очищають за допомогою хроматографічної колонки, використовуючи кизельгель 60 (Merck) як адсорбент і суміш - хлороформ: метанол = 9:1 як елюент. Продукт кристалізують з діетилового ефіру, що дає 0,22г (44%) названої сполуки. Т.пл.: 248250°С (діетиловий ефір). d) 1-(4-Бензилпіперидин-1-іл)-1-(1,6-дигідро1,6-діаза-аз-індацен-2-іл)метанон Названу сполуку одержують з 1,6-дигідро-1,6діаза-аз-індацен-2-карбонової кислоти і 4бензилпіперидину у відповідності зі способом, описаним у прикладі 1/с. Т.пл.: 186-188°С (діетиловий ефір). Приклад 4 (4-Бензилпіперидин-1-іл)-(2-пропіл-8Ноксазол[5,4-g]індол-7-іл)метанон (4570001079) a) 1-(4-Бензилпіперидин-1-іл)-1-(6-гідрокси-1Ніндол-2-іл)метанон Суміш 5,0г (28,2ммоль) 6-гідроксиіндол-2карбонової кислоти [J. Chem. Soc. 1605-1608 (1948)], 4,4мл (31,6ммоль) триетиламіну, 5,0г (28,5ммоль) 4-бензил-піперидину, 12,0г (31,6ммоль) HBTU (Advanced Chem. Tech.) і 50мл диметилформаміду перемішують при кімнатній температурі протягом 6 годин. Продукт, що випав в осадок, відфільтровують і перекристалізовують з етанолом, що дає 6,75г (71%) названої сполуки. Т.пл.: 214-215°С (етанол). 19 74850 20 b) (4-Бензилпіперидин-1-іл)-(2-пропіл-8ННазвану сполуку одержують з 2-оксо-1,5оказол[5,4-g]індол-7-іл)метанон дигідро-2Н-оказол[4,5-f]індол-6-карбонової кислоти В атмосфері аргону до розчину 0,5г і 4-бензилпіперидину у відповідності зі способом, (1,49ммоль) 1-(4-бензилпіперидин-1-іл)-1-(6описаним у прикладі 1/с. Т.пл.: 270-271°С (діетигідрокси-1Н-індол-2-іл)метанону і 0,14г (0,2ммоль) ловий ефір). н-бутиламіну в 100мл диметилового ефіру етиленПриклад 6 гліколю додають порціями по краплях при темпе6-(4-Бензилоксипіперидин-1-карбоніл)-1,5ратурі 0°С 10г (115ммоль) діоксиду марганцю. Пісдигідрооксазол[4,5-f]індол-2-он (4570001462) ля перемішування протягом години реакційну Названу сполуку одержують з 2-оксо-1,5суміш відфільтровують, фільтрат концентрують і дигідро-2Н-оказол[4,5-f]індол-6-карбо-нові кислоти залишок очищають за допомогою хроматографічі 4-бензилоксипіперидину [Tetpahedron 54, 13981, ної колонки, використовуючи кизельгель 60 як ад(1998)] у відповідності зі способом, описаним у сорбент (Merck) і суміш - гексан:етилацетат = 2:1 прикладі 1/с. Т.пл.: 258-261°С (діетиловий ефір). як елюент, що дає 0,1г (17.3%) названої сполуки. Приклад 7 Т.пл.: 195-196°С (гексан-етилацетат). 6-[4-(4-Фторбензилпіперидин-1-карбоніл]-1,5Приклад 5 дигідрооксазол[4,5-f]індол-2-он (4570001484) 6-(4-Бензилпіперидин-1-карбоніл)-1,5-дигідроНазвану сполуку одержують з 2-оксо-1,5оказол[4,5-f]індол-2-он (4570001461) дигідро-2Н-оказол[4,5-f]індол-6-карбо-нової кислоа) Метиловий ефір (Z)-2-азидо-3-(4ти і 4-(4-фторбензил)піперидину [J. Med. Chem., бензилокси-3-нітрофеніл)акрилової кислоти 35, 4903, (1992)] у відповідності зі способом, опиВ атмосфері аргону до розчину метоксиду насаним у прикладі 1/с. Т.пл.: 244-247°С (діетиловий трію (отриманого з 2,5г (108,7ммоль) натрію і 70мл ефір). метанолу) додають при температурі 0°С суміш 6,1г Приклад 8 (23,7ммоль) 4-бензилокси-3-нітробензальдегиду і [4-(4-фторбензил)піперидин-1-іл]-(1,611,2г (97,3ммоль) метилазидоацетату в 100мл дигідропірол[2,3-g]індазол-7-іл)-метанон (інша тауметанолу. Суміш перемішують при 0°С протягом 5 томерна форма сполуки [4-(4годин, потім розбавляють 350мл води, осаджені фторбензил)піперидин-1-іл]-(3,6-дигідропірол[2,3кристали відфільтровують, промивають водою і g]індазол-7-іл)метанон) (4570001661) сушать, що дає 4,93г (59%) названої сполуки. а) Етиловий ефір 2-[(1Н-індазол-6-іл)Т.пл.: 95-96°С (вода). гідразоно]-пропіонової кислоти (інша таутомерна b) Метиловий ефір 6-бензилокси-5-нітро-індолформа сполуки - етиловий ефір 2-[(3Н-індазол-62-карбонової кислоти іл)-гідразоно]-пропіонової кислоти) До перемішуваного розчину 200мл киплячого До перемішуваної суміші, 6,66г (50ммоль) 6ксилолу 4,93г (13,9ммоль) додають невеликими аміноіндазолу, 40мл води і 25мл концентрованого дозами метиловий ефір (Z)-2-азидо-3-(4розчину соляної кислоти додають по краплях при бензилокси-3-нітро-феніл)акрилової кислоти. Пістемпературі 0°С 3,5г нітрит натрію в 10мл води і ля завершення додавання реакційну суміш нагріперемішування продовжують при тій же темперавають при кипінні зі зворотним холодильником, турі протягом 0,5 годин. Потім, у такий спосіб поки не закінчиться утворення газу (приблизно 0,5 отриманий розчин, додають до наступної перемігодини), потім її охолоджують до кімнатної темпешуваної суміші: 86мл води, 15г гідроксиду калію, ратури, продукт, що випав в осадок відфільтрову15г ацетату натрію, 60мл етанолу і 8мл етилового ють і промивають н-гексаном, що дає 0,67г (15%) ефіру 2-метилацетооцтової кислоти (чистота 90%). названої сполуки. Т.пл.. 184-187°С (ксилол). Після додавання реакційну суміш перемішують c) Метиловий ефір 5-аміно-6-гідроксиіндол-2при температурі 0°С на протязі години продукт, що карбонової кислоти випав в осадок відфільтровують, промивають воСуміш 0,67г (2,0ммоль) метилового ефіру 6дою і сушать, що дає 8,16г (66%) названої сполубензилокси-5-нітро-індол-2-карбонової кислоти, ки. Т.пл.: 210-211°С (етанол). 60мл тетрагідрофурану гідрують протягом 5 годин b) Етиловий ефір 1,6-дигідро-пірол[2,3за допомогою 0,1г 10% Pd/C. Каталізатор відфільg]індазол-7-карбонової кислоти (інша таутомерна тровують і фільтрат, що містить названу сполуку, форма сполуки етиловий ефір 3,6використовують безпосередньо на наступному дигідропірол[2,3-g]індазол-7-карбонової кислоти) етапі. Суміш 4,0г (16,2ммоль) етилового ефіру 2d) Метиловий ефір 2-оксо-1,5-дигідро-2Н[(1Н-індазол-6-іл)-гідразоно]-пропіонової кислоти і оказол[4,5-f]індол-6-карбонова кислота 20г поліфосфорної кислоти повільно нагрівають до Названу сполуку одержують з метилового 120°С і витримують при цій температурі протягом ефіру 5-аміно-6-гідроксиіндол-2-карбонової кисло0,5 годин. Потім реакційну суміш охолоджують до ти у відповідності зі способом, описаним у приклакімнатної температури, додають 30мл води і 15мл ді 1/a. Т.пл.: 267-277°С (вода). концентрованої соляної кислоти. У такий спосіб е) 2-Оксо-1,5-дигідро-2Н-оказол[4,5-f]індол-6отриману суміш екстрагують етилацетатом, сукарбонова кислота шать над сульфатом натрію і концентрують, що Названу сполуку одержують з метилового дає 1,6г (43%) названої сполуки. Т.пл.: 120-121°С ефіру 2-оксо-1,5-дигідро-2Н-оказол [4,5-f]індол-6(етилацетат). карбонові кислоти у відповідності зі способом, c) 1,6-Дигiдропірол[2,3-г]індазол-7-карбонова описаним у прикладі 1/b. Т.пл.: 288-290°С (вода). кислота (інша таутомерна форма сполуки - 3,6f) 6-(4-Бензилпіперидин-1-карбоніл)-1,5дигідро-пірол[2,3-г]індазол-7-карбонова кислота) дигідрооказол[4,5-f]індол-2-он Названу сполуку одержують з етилового ефіру 21 74850 22 1,6-дигідро-пірол[2,3-г]індазол-7-карбонової кислоформа сполуки - (4-бензилпіперидин-1-іл)-(1,6ти у відповідності зі способом, описаним у прикладигідропірол[3,2-е]індазол-7-іл)метанон) ді 1/b. Т.пл.: 270-275°С (вода). (4570001689) d) [4-(4-Фторбензил)піперидин-1-іл)-(1,6a) Етиловий ефір 2-[(1Н-індазол-5-іл)дигідропірол[2,3-g]індазол-7-іл)метанон (інша таугідразоно]-пропіонової кислоти (інша таутомерна томерна форма сполуки [4-(4форма сполуки - етиловий ефір 2-[(3Н-індазол-5фторбензил)піперидин-1-іл)-(3.6-дигідропірол[2,3іл)-гідразоно]-пропіонової кислоти) g]індазол-7-іл)метанон) Названу сполуку одержують з 5-аміноіндазолу Названу сполуку одержують з 1,6у відповідності зі способом, описаним у прикладі дигідропірол[2,3-g]індазол-7-карбонової кислоти і 8/а. Т.пл.: 111-113°С (вода). 4-(4-фторбензил)піперидину у відповідності зі споb) Етиловий ефір 3.6-дигідропірол[3,2собом, описаним у прикладі 1/с. Т.пл.: 162-165°С е]індазол-7-карбонової кислоти (інша таутомерна (діетиловий ефір). форма сполуки етиловий ефір 1,6Приклад 9 дигідропірол[3,2-е]індазол-7-карбонової кислоти) (4-Бензилпіперидин-1-іл)-(1,6-дигідропірол[2,3Названу сполуку одержують з етилового ефіру g]індазол-7-іл)метанон (інша та-утомерна форма 2-[(1Н-індазол-5-іл)-гідразоно]-пропіонової кислоти сполуки (4-бензилпіперидин-1-іл)-(3,6у відповідності зі способом, описаним у прикладі дигідропірол[2,3-g]індазол-7-іл)метанон) 8/b. Т.пл.: 220-221°С (метанол). (4570001662) c) 3,6-Дигідро-пірол[3,2-е]індазол-7-карбонова Названу сполуку одержують з 1,6кислота (інша таутомерна форма сполуки - 1.6дигідропірол[2,3-g]індазол-7-карбонової кислоти і дигідропірол[3,2-е]індазол-7-карбонова кислота) 4-бензилпіперидину у відповідності зі способом, Названу сполуку одержують з етилового ефіру описаним у прикладі 1/с. Т.пл.: 209-210°С (діети3,6-дигідропірол[3,2-е]індазол-7-карбонової кислоловий ефір). ти у відповідності зі способом, описаним у приклаПриклад 10 ді 1/b. Т.пл.: 183-189°С(вода). [4-(4-Фторбензил)піперидин-1-іл1-(3,6d) (4-Бензилпіперидин-1-іл)-(3.6-дигідродигідроімідазо[4,5-е]індол-7-іл)метанон (інша таупірол[3,2-е]індазол-7-іл)метанон (інша таутомерна томерна форма сполуки - [4-(4-фторбензил)піформа сполуки - (4-бензилпіперидин-1-іл)-(1,6перидин-1-іл]-(1,6-дигідроімідазо[4,5-е]індол-7дигідропірол[3,2-е]індазол-7-іл)метанон) іл)метанон) (4570001688) Названу сполуку одержують з 3,6a) Етиловий ефір 2-[(1Н-бензимідазол-5-іл)дигідропірол[3,2-е]індазол-7-карбонової кислоти і гідразоно]-пропіонової кислоти (інша таутомерна 4-бензилпіперидину у відповідності зі способом, форма сполуки - етиловий ефір 2-[(3Нописаним у прикладі 1/с. Т.пл.: 205-207°С (діетибензимідазол-5-іл)-гідразоно]-пропіонової кислоти) ловий ефір). Названу сполуку одержують з 5-аміноПриклад 12 бензимідазолу [Hetv. Chim. Acta, 32, 135 (1949)] у [4-(4-Фторбензил)піперидин-1-іл]-(3,6відповідності зі способом, описаним у Прикладі дигідропірол[3,2-е]індазол-7-іл)метанон (інша тау8/а. Т.пл.: 121-127°С (вода). томерна форма сполуки [4-(4b) Етиловий ефір 3,6-дигідро-імідазоГ4,5фторбензил)піперидин-1-іл]-(1,6-дигідропірол[3,2е]індол-7-карбонової кислоти (інша таутомерна е]індазол-7-іл)метанон) (4570001690) форма сполуки - етиловий ефір 1,6-дигідроНазвану сполуку одержують з 3,6-дигідроімідазо[4,5-е]індол-7-карбо-нової кислоти) пірол[3,2-е]індазол-7-карбонової кислоти і 4-(4Названу сполуку одержують з етилового ефіру фторбензил)піперидину у відповідності зі спосо2-[(1Н-бензимідазол-5-іл)-гідразоно]-пропіонової бом, описаним у прикладі 1/с. Т.пл.: 169-173°С кислоти у відповідності зі способом, описаним у (діетиловий ефір). прикладі 8/b. Т.пл.: піна. Приклад 13 c) 3,6-Дигідро-імідазо[4,5-е]індол-7-карбонова (4-Бензилпіперидин-1-іл)-(3,6кислота (інша таутомерна фор-ма сполуки -1,6дигідроімідазо[4,5-е]індол-7-іл)метанон (інша таудигідроімідазо[4,5-е]індол-7-карбонова кислота) томерна Форма сполуки - (4-бензилпіперидин-1Названу сполуку одержують з етилового ефіру іл)-(1,6-дигідроімідазо[4,5-е]індол-7-іл)метанон) (45 3,6-дигідро-імідазо[4,5-е]індол-7-карбонової кисло70001779) ти у відповідності зі способом, описаним у приклаНазвану сполуку одержують з 3,6-дигідроді 1/b. Т.пл.: 185-190°С(вода). імідазо[4,5-е]індол-7-карбонової кислоти і 4d) [4-(4-Фторбензил)піперидин-1-іл]-(3,6бензилпіперидину у відповідності зі способом, дигідроімідазо[4,5-е]індол-7-іл)метанон (інша тауописаним у прикладі 1/с. Т.пл.: 256-257°С (діетитомерна форма сполуки [4-(4ловий ефір). фторбензил)піперидин-1-іл-(1,6-дигідроПриклад 14 імідазо[4,5-е]індол-7-іл)метанон] 7-(4-Бензилпіперидин-1-карбоніл)-1,6-дипдроНазвану сполуку одержують з 3,6-дигідро3-окса-1,6,8-триаза-аз-індацен-2-он (інша таутомеімідазо[4,5-е]індол-7-карбонової кислоти і 4-(4рна форма сполуки - 7-(4-бензилпіперидин-1фторбензил)піперидину у відповідності зі спосокарбоніл)-1,8-дигідро-3-окса-1,6,8-триаза-азбом, описаним у прикладі 1/с. Т.пл.: 283-287°С індацен-2-он) (4570001971) (діетиловий ефір). a) N-Бутил-N'-(4-метокси-2-нітрофеніл)Приклад 11 оксаламід (4-Бензилпіперидин-1-іл)-(3,6-дигідроДо суспензії 44,0г (164ммоль) етилового ефіру пірол[3,2-е]індазол-7-іл)метанон (інша таутомерна N-(4-метокси-2-нітрофеніл)-оксаламової кислоти 23 74850 24 [J. Med. Chem., 18, 926 (1975)] у 330мл толуолу g) (7-Аміно-6-гідрокси-1Н-бензимідазол-2-іл)додають по краплях, підтримуючи температуру (4-бензилпіперидин-1-іл)метанон (інша таутомерна нижче 20°С, 16,8мл (170ммоль) н-бутиламіну, поформа сполуки (4-аміно-5-гідрокси-1Нтім суміш перемішують при кімнатній температурі бензимідазол-2-іл)-(4-бен-зилпіперидин-1протягом ночі. Реакційну суміш концентрують і іл)метанон) додають до залишку 200мл діетилового ефіру. У Суміш 1,0г (4-бензилпіперидин-1-іл)-(6такий спосіб отриману суспензію відфільтровують, гідрокси-7-нітро-1Н-бензимідазол-2-іл) метанону, промивають діетиловим ефіром і сушать, що дає 30мл метанолу гідрують протягом 2 годин за до45,3г (93%) названої сполуки. Т.пл.: 127-128°С помогою 0,4г 10% Pd/C каталізатора. Каталізатор (діетиловий ефір). відфільтровують і фільтрат концентрують. Залиb) N-(2-Аміно-4-метоксифеніл)-N'-бутилшок обробляють діетиловим ефіром, кристалічний оксаламід продукт відфільтровують, промивають діетиловим Суміш 27,0г (91ммоль) N-бутил-N'-(4-метоксиефіром і сушать, що дає 0,5г (54%) названої спо2-нітрофеніл)-оксаламіду, 1200мл метанолу і 7,3г луки. Т.пл.: 108°С (діетиловий ефір). 10% Pd/C каталізатора гідрують протягом 3 годин. h) 7-(4-бензилпіперидин-1-карбоніл)-1,6Каталізатор відфільтровують, промивають ацетодигідро-3-окса-1,6,8-триаза-аз-індацен-2-он (інша ном, фільтрат концентрують і залишок оброблятаутомерна форма сполуки 7-(4ють 100мл діетилового ефіру. Отриманий продукт 6ензилпіперидин-1-карбоніл)-1,8-дигідро-3-оксавідфільтровують, промивають діетиловим ефіром і 1,6,8-триаза-аз-індацен-2-он) сушать, що дає 21,8г (90%) названої сполуки. До розчину 0,45г (1,28ммоль) (7-аміно-6Т.пл.: 180-181°С (діетиловий ефір). гідрокси-1Н-бензимідазол-2-іл)-(4c) Бутиламід 6-метокси-1Н-бензимідазол-2бензилпіперидин-1-іл)метанону в 5мл тетрагідрокаобонової кислоти (інша таутомерна форма спофурану додають при температурі 20°С 0,2г луки - бутиламід 5-метокси-1Н-бензимідазол-2(1,37ммоль) 1,1'-карбонілдиімідазолу. Реакційну карбонової кислоти) суміш перемішують при кімнатній температурі проВ атмосфері азоту 41,0г (154ммоль) N-(2тягом 2 годин, потім концентрують. Залишок очиаміно-4-метоксифеніл)-N'-бутилоксаламіду нагріщають за допомогою хроматографічної колонки, вають до 240°С протягом 10хв. Після охолодження використовуючи кизельгель 60 як адсорбент залишок обробляють 300мл ацетону, відфільтро(Merck) і суміш - толуол:метанол = 4:1 як елюент. вують і фільтрат концентрують. У такий спосіб У такий спосіб отриманий продукт кристалізують з отриманий залишок кристалізують з 150мл гексаізопропанолу, відфільтровують і сушать, що дає ну, відфільтровують і сушать, що дає 26,5г (69.5%) 0,45г (93.5%) названої сполуки. Т.пл.: >270°С (ізоназваної сполуки. Т.пл.: 125-126°С (гексан). пропанол). d) 6-Гідрокси-1Н-бензимідазол-2-карбонова Приклад 15 кислота (інша таутомерна форма сполуки - 56-(4-Бензилптеридин-1-карбоніл)-3,5-дигідрогідрокси-1Н-бензимідазол-2-карбонова кислота) iмідазо[4',5';4,5]бензо[1,2-а]оксазол-2-он (інша тауРозчин 26,0г (105ммоль) бутиламіду 6томерна форма сполуки - 6-(4-бензилпіперидин-1метокси-1Н-бензимідазол-2-карбонової кислоти в карбоніл)-3,7-дигідро-імідазо[4',5':4,5]бензо[1,2780мл 48% бромистого водню перемішують при d]оксазол-2-он) (4570001972) 90°С протягом 12 годин, потім при 125°С протягом а) 6-Аміно-5-нітро-3Н-бензоксазол-2-он 12 годин. Реакційну суміш охолоджують продукт, До розчину 2,0г (13,3ммоль) 6-аміно-3Нщо випав в осадок відфільтровують, промивають бензоксазол-2-ону [J. Chem. Soc, 321 (1938)] у водою і сушать, що дає 14,4г (76%) названої спо20мл трифтороцтової кислоти додають при темпелуки. Т.пл.: 206-207°С (вода). ратурі нижче 20°С 1,2г (14,1ммоль) нітрату натрію. е) 6-Гідрокси-7-нітро-1-Н-бензимідазол-2Реакційну суміш перемішують при кімнатній темкарбонова кислота (інша таутомерна форма спопературі протягом ночі, потім концентрують. Залуки 5-гідрокси-4-нітро-1Н-бензимідазол-2лишок очищають за допомогою хроматографічної карбонова кислота) колонки, використовуючи кизельгель 60 як адсорДо розчину 2,0г (11,2ммоль) 6-гідрокси-1-Нбент (Merck) і суміш - толуол: метанол = 4:1 як бензимідазол-2-карбонової кислоти в 25мл триелюент, що дає 2,50г (96%) названої сполуки. фтороцтової кислоті додають при температурі ниТ.пл.: 198°С (толуол-метанол). жче 20°С 1,0г (11,7ммоль) нітрату натрію і суміш b) Етиловий ефір (4-бензилпіперидин-1перемішують при 20°С протягом 2 годин. Реакційіл)оксооцтової кислоти ну суміш виливають у крижану воду продукт, що До розчину 10г (57ммоль) 4-бензилпіперидину випал в осадок відфільтровують, промивають воі 10мл (57,4ммоль) N-етиловий ефір діізопропіладою і сушать, що дає 1,7г (68%) названої сполуки. міну в 100мл дихлорметану додають по краплях Т.пл.: 218°С (вода). при температурі 0°С 7,05мл (63,1ммоль) етилокf) (4-Бензилпіперидин-1-іл)-(6-гідрокси-7-нітросалилхлориду, потім суміш перемішують при тій 1Н-бензимідазол-2-іл)метанон (інша таутомерна же температурі протягом 30хв. Реакційну суміш Форма сполуки - (4-бензилпіперидин-1-іл)-(5розбавляють водою, розділяють, органічний шар гідрокси-4-нітро-1Н-бензимідазол-2-іл)метанон) сушать і концентрують, що дає 15,5г (99%) назваНазвану сполуку одержують з 6-гідрокси-7ної сполуки у виді олії. нітро-1Н-бензимідазол-2-карбонової кислоти і 4c) (4-Бензилпіперидин-1-іл)оксооцтова кислота бензилпіперидину у відповідності зі способом, Суміш 15,5г (56ммоль) етилового ефіру (4описаним у прикладі 1/с. Т.пл.:102°С (діетиловий бензилпіперидин-1-іл)оксооцтової кислоти, 5г ефір). (79,4ммоль) гідроксиду калію і 250мл метанолу 25 74850 26 перемішують при кімнатній температурі протягом 6 2-[(2-оксо-2,3-дигідро-1Н-бензимідазол-5-іл)годин. Потім реакційну суміш концентрують залигідразоно]-пропіонової кислоти у відповідності зі шок переносять у воду, підкисляють 1N соляною способом, описаним у прикладі 8/b. Т.пл.: 196кислотою, що випала в осадок продукт відфільт197°С (етилацетат). ровують, промивають водою і сушать, що дає c) 2-Оксо-1,2,3,5-тетрагідро-імідазо[4,5-f]індол11,95г (85%) названої сполуки. Т.пл.: 115°С (вода). 6-карбонова кислота d) (4-Бензилпіперидин-1-іл)оксоацетилхлорид Названу сполуку одержують з етилового ефіру Суміш 26,2г (106ммоль) (4-бензилпіперидин-12-оксо-1,2,3,5-тетрагідро-імідазо[4,5-f]індол-6іл)оксооцтової кислоти і 50мл тіонілхлориду нагрікарбонової кислоти у відповідності зі способом, вають при кипінні зі зворотним холодильником описаним у прикладі 1/b. Т.пл.: >270°С (вода). протягом 2 годин, потім охолоджують і концентруd) 6-(4-Бензилпіперидин-1-карбоніл)-3,5ють, що дає 28,0г (99,5%) названої сполуки у виді дигідро-1Н-імідазо[4,5-f]індол-2-он олії. Названу сполуку одержують з 2-оксо-1,2,3,5e) 2-(4-Бензилпіперидин-1-іл)-Н-(5-нітоо-2тетрагідроімідазо[4,5-f]індол-6-карбонової кислоти оксо-2.3-дигідро-бензоксазол-6-іл)-2-оксо-ацетамід і 4-бензилпіперидину у відповідності зі способом, До розчину 3,23г (16,56ммоль) 6-аміно-5-нітроописаним у прикладі 1/с. Т.пл.: >270°С (ацетоніт3Н-бензоксазол-2-ону (етап а), 2,58мл (18,5ммоль) рил). триетиламіну і 100мл хлороформу додають по Приклад 17 краплях при температурі 20°С 5,25г (19,75ммоль) 2-(4-Бензилпіперидин-1-карбоніл)-1,5-дигідро(4-бензилпіперидин-1-іл)оксоацетилхлориду в 3-окса-1,5-діазациклопентан[b]нафталін-6-он 20мл хлороформу, потім суміш перемішують при (4570002185) кімнатній температурі протягом 2 годин. Суміш а) Метиловий ефір 6-оксо-1,5,6,7-тетрагідро-8промивають водою, органічний шар сушать і конокса-1,5-діаза-циклопента[b]нафталін-2центрують. Залишок очищають за допомогою хрокарбонової кислоти матографічної колонки, використовуючи кизельДо розчину 2,0г (9,7ммоль) метилового ефіру гель 60 як адсорбент (Merck) і суміш - толуол: 5-аміно-6-гідроксиіндол-2-карбонової кислоти метанол = 4:1 як елюент, що дає 3,3г (47%) назва(Приклад 5/с) у 300мл тетрагідрофурану додають ної сполуки. Т.пл.: піна. 2,45г (29,2ммоль) гідрокарбонату натрію і 1,3мл f) N-(5-aмiнo-2-oкco-2,3-дигiдpoбeнзoкcaзoл-6(16,3ммоль) хлорацетилхлориду і суміш перемііл)-2-(4-бeнзилпіпepидин-1-іл-2-оксо-ацетамід шують при кімнатній температурі протягом ночі. Суміш 3,3г (7,7ммоль) 2-(4-бензилпіперидин-1Реакційну суміш концентрують і до залишку додаіл)-М-(5-нітро-2-оксо-2,3-дигід-робензоксазол-6-іл)ють 100мл води. Осаджені кристали відфільтро2-оксо-ацетаміду, 100мл метанолу гідрують протявують, промивають водою і суспендують у 120мл гом 8 годин за допомогою 0,3г 10% Pd/C каталізаацетонітрилу. До суспензії додають 4,05г тора. Каталізатор відфільтровують і фільтрат кон(29,3ммоль) карбонату калію й отриману суміш центрують. Залишок очищають за допомогою перемішують при кімнатній температурі протягом хроматографічної колонки, використовуючи кизеночі. Реакційну суміш концентрують і до залишку льгель 60 як адсорбент (Merck) і суміш - толуол: додають 100мл води. Продукт відфільтровують, ацетон = 2:1 як елюент, що дає 1,06г (34,5%) напромивають водою і сушать, що дає 1,7г (71%) званої сполуки. Т.пл.: 296°С (толуол-ацетон). названої сполуки. Т.пл.: 188-196°С(вода). g) 6-(4-Бензилпіперидин-1-карбоніл)-3,5b) 6-оксо-1,5,6,7-тетрагідро-8-окса-1,5дигідроімідазо[4',5';4,5]бензо[1,2-d]оксазол-2-он діазациклопента[b]нафталін-2-каобонова кислота (інша таутомерна форма сполуки - 6-(4Названу сполуку одержують з метилового бензилпіперидин-1-карбоніл)-3,7ефіру 6-оксо-1,5,6,7-тетрагідро-8-окса-1,5-діазадигідроімідазо[4',5':4,5]бензо[1,2-d]оксазол-2-он) циклопента[b]нафталін-2-карбонової кислоти у 1,0г (2,5ммоль) N-(5-аміно-2-оксо-2,3-дигідровідповідності зі способом, описаним у прикладі 8/b. бензоксазол-6-іл)-2-(4-бензилпіперидин-1-іл)-2Т.пл.: 231-237°С (вода). оксо-ацетаміда нагрівають до 240°С протягом c) 2-(4-Бензилпіперидин-1-карбоніл)-1,510хв., потім охолоджують. Отриману суміш очидигідро-8-окса-1,5-діазациклопента[b]нафталін-6щають за допомогою хроматографічної колонки, он використовуючи кизельгель 60 як адсорбент Названу сполуку одержують з 6-оксо-1,5,6,7(Merck) і суміш - толуол: ацетон = 1:1 як елюент, тетрагідро-8-окса-1,5-діаза-циклощо дає 0,16г (17%) названої сполуки. Т.пл.: >290°С пента[b]нафталін-2-карбонової кислоти і 4(толуол-ацетон). бензилпіперидину у відповідності зі способом, Приклад 16 описаним у прикладі 1/с. Т.пл.: 225-231 °С (діети6-(4-Бензил піперидин-1-карбоніл )-3,5ловий ефір). дигідро-1Н-імідазо[4,5-f]індол-2-он (45 70002045) Приклад 18 а) Етиловий ефір-[(2-оксо-2,3-дигідро-1Н2-[4-(4-Фторбензил)піперидин-1-карбоніл]-1,5бензимідазол-5-іл)гідразоно]-пропіонової кислоти дигідро-8-окса-1,5-діаза-циклопента[b]нафталін-6Названу сполуку одержують з 5-аміно-1,3он (4570002193) дигідро-бензимідазол-2-ону [J. Am. Chem. Soc, 80, Названу сполуку одержують з 6-оксо-1,5,6,71657 (1958)] у відповідності зі способом, описаним тетрагідро-8-окса-1,5-діазау прикладі 8/а. Т.пл.: 220°С (вода). циклопента[b]нафталін-2-карбонової кислоти і 4b) Етиловий ефір 2-оксо-1,2,3,5(4-фторбензил) піперидину у відповідності зі спотетрагідроімідазо[4,5-f]індол-6-карбонової кислоти собом, описаним у прикладі 1/с. Т.пл.: 219-226°С Названу сполуку одержують з етилового ефіру (діетиловий ефір). 27 74850 28 Приклад 19 одержати 0,27г (59%) названої сполуки. Т.пл.: 175(3,6-Дигідро-пірол[3,2-е]індазол-7-іл)-(4-п180°С (діетиловий ефір). толілоксипіперидин-1-іл)метанон (інша таутомерна Приклад 25 Форма сполуки - (1,6-дигідро-пірол[3,2-е]індазол-7(4-Бензилпіперидин-1-іл)-(6-гідрокси-1Ніл)-(4-п-толілоксипіперидин-1-іл)метанон) бензоімідазол-2-іл)-метанон (4570001103) (4570002260) a) N-Бутил-N'-(4-метокси-2Названу сполуку одержують з 3,6-дигідронітрофеніл)оксаламід пірол[3,2-е]імідазол-7-карбонові кислоти (Приклад До суспензії 44,0г (164ммоль) етилового ефіру 11/с) і 4-п-толілоксипіперидину [J. Med. Chem., 21, N-(4-метокси-2-нітро-феніл)оксаламової кислоти 309 (1978)] у відповідності зі способом, описаним у [J. Med. Chem., 18, 926 (1975)] і 330мл толуолу прикладі 1/с. Т.пл.: 218-222°С (діетиловий ефір). додають 16,8мл (170ммоль) н-бутиламіну при теПриклад 20 мпературі близько 20°С. Реакційну суміш перемі(3,6-Дигідро-пірол[3,2-е]індазол-7-іл)-[4-(4шують при кімнатній температурі протягом 10 гометилбензил)піперидин-1-ил]метанон (інша таутодин, потім концентрують і залишок кристалізують з мерна форма сполуки - (1,6-дигідро-пірол[3,2діетилового ефіру, продукт, що випав в осадок е]індазол-7-іл)-[4-(4-метилбензил)піперидин-1відфільтровують, промивають діетиловим ефіром і іл]метанон) (4570002340) сушать, щоб одержати 45,3г (93.3%) названої споНазвану сполуку одержують з 3,6луки. Т.пл.: 127-128°С (діетиловий ефір). дигідропірол[3,2-е]індазол-7-карбонової кислоти b) N-(2-Аміно-4-метоксифеніл)-N'-бутил(Приклад 11/с) і 4-(4-метилбензил)піперидину [J. оксаламід Org. Chem., 64, 3763 (1999)] у відповідності зі споСуміш 27,0г (91ммоль) N-бутил-N'-(4-метоксисобом, описаним у прикладі 1/с. Т.пл.: 253-255°С 2-нітрофеніл)оксаламіду, 1200мл метанолу і 7,3г (діетиловий ефір). 5% Pd/C каталізатора гідрують протягом 3 годин. Приклад 21 До реакційної суміші додають 600мл ацетону. Ка1-(4-Бензилпіперидин-1-іл)-1-(6-гідрокси-1Нталізатор відфільтровують, промивають ацетоном, індол-2-іл)метанон (45 13579) фільтрат концентрують і залишок кристалізують з Суміш 5,0г (28,2ммоль) 6-гідроксиіндол-2діетилового ефіру, щоб одержати 21,8г (90,1%) карбонової кислоти [J. Chem. Soc. 1605-1608 названої сполуки. Т.пл.: 180-181°С (діетиловий (1948)], 4,4мл (31,6ммоль) триетиламіну, 5,0г ефір). (28,5ммоль) 4-бензилпіперидину, 12,0г c) Бутиламід 6-метокси-1Н-бензоімідазол-2(31,6ммоль) HBTU (Advanced Chem. Tech.) і 50мл карбонової кислоти диметилформаміду перемішують при кімнатній В атмосфері азоту при температурі 240°С протемпературі протягом 6 годин. Отриманий продукт тягом 10хв. перемішують 41,0г (154ммоль) N-(2відфільтровують і перекристалізовують з етанолу, аміно-4-метоксифеніл)-N'-бутилоксаламіду. Суміш щоб одержати 6,75г (71%) названої сполуки. Т.пл.: охолоджують до кімнатної температури, потім до214-215°С (етанол). дають 300мл ацетону і перемішують протягом гоПриклад 22 дини. Отриманий продукт відфільтровують. Фільт1-[4-(4-фторбензил)піперидин-1-іл]-1-(6рат концентрують і залишок змішують з 150мл нгідрокси-1Н-індол-2-іл)метанон (45 13848) гексану. Отриманий продукт відфільтровують, Названу сполуку одержують з 4-(4промивають гексаном і сушать, щоб одержати фторбензил)піперидину [J. Med. Chem., 35, 4903 26,5г (69,5%) названої сполуки. Т.пл.: 125-126°С (1992)] і 6-гідрокси-1Н-індол-2-карбонової кислоти (н-гексан). в ацетонітрилі при кімнатній температурі. Реакційd) 6-Гідрокси-1Н-бензоімідазол-2-карбонова ну суміш концентрують і залишок очищають за кислота допомогою хроматографії на колонці, використоСуміш 26,0г (105ммоль) 6-метокси-1Нвуючи кизельгель 60 як адсорбент (Merck) і суміш бензоімідазол-2-карбонової кислоти бутиламіду і толуол:метанол = 4:1 як елюент. Т.пл.: 180-182°С 780мл 48% водяного розчину бромистоводневої (толуол). кислоти перемішують при температурі 110°С проПриклад 23 тягом 8 годин, потім нагрівають при кипінні зі зво1-(4-Бензилпіперидин-1-іл)-1-(5-нітро-1Нротним холодильником протягом 12 годин. Суміш індол-2-іл)метанон (45 14205) охолоджують до кімнатної температур продукт, що Названу сполуку одержують з 5-нітроіндол-2випав в осадок відфільтровують, промивають вокарбонової кислоти [J. Am. Chem. Soc, 4621 (1958)] дою, доти, поки значення pH не буде нейтральним і 4-бензилпіперидину у відповідності зі способом, і сушать, щоб одержати 14,3 (76,2%) названої описаним у прикладі 1/с. Т.пл.: 220-224°С (діетисполуки. Т.пл.: 206-207°С (вода). ловий ефір). e) (4-Бензилпіперидин-1-іл)-(6-гідрокси-1НПриклад 24 бензоімідазол-2-іл)метанон (4570001103) 1-(5-Аміно-1Н-індол-2-іл)-1-(4-бензил піпериСуміш 3,0г (16,75ммоль) 6-гідрокси-1Ндин-1-іл )метанон (45 14244) бензоімідазол-2 карбонової кислоти, 2,4мл Суміш 0,5г (1,38ммоль) 1-(4-бензилпіперидин(17,2ммоль) триетиламіну, 3,0г (17,1ммоль) 41-іл)-1-(5-нітро-1Н-індол-2-іл) метанону, 20мл мебензилпіперидину, 7,0г (18,5ммоль) HBTU і 100мл танолу і 0,1г 10 % Pd/C каталізатора гідрують продиметилформаміду перемішують при кімнатній тягом 5 годин. Каталізатор відфільтровують, протемпературі протягом 16 годин. Реакційну суміш мивають метанолом і фільтрат концентрують. концентрують і залишок очищають за допомогою Залишок обробляють діетиловим ефіром і кристахроматографічної колонки, використовуючи кизели, що випали в осадок, відфільтровують, щоб льгель 60 як адсорбент (Merck) і суміш - толу 29 74850 30 ол:метанол = 4:1 - як елюент, потім продукт перекполу (поліакрилова кислота), 0,1-5% етилового ристалізовують з толуолу, щоб одержати 3,58г спирту 96%, 0,1-1% віддушки, 20-70% сорбіту (70% (63,5%) названої сполуки. Т.пл.: 186°С (толуол). водяний розчин) і 30-50% дистильованої води. Приклад 26 До розчину нипагину і лимонної кислоти в (6-Гідрокси-1Н-бензоімідазол-2-іл-[4-(420мл дистильованої води, додають невеликими метилбензил)-піперидин-1-іл]метанон дозами карбопол при енергійному перемішуванні і (4570001378) розчин залишають стояти протягом 10-12 годин. Названу сполуку одержують з 6-гідрокси-1НПотім при перемішуванні додають гідроксид набензоімідазол-2-карбонової кислоти [приклад 25d] трію в 1мл дистильованої води, водяний розчин і 4-(4-метилбензил)піперидину [J.Org. Chem., 64, сорбіту, а потім екстракт із присмаком малини. 3763 (1999)] у відповідності зі способом, описаним Активний інгредієнт додають до отриманого носія у прикладі 25. Т.пл.: 93°С (диізопропіловий ефір). невеликими дозами і суспендують із зануренням у Приклад 27 гомогенізатор. Під кінець суспензію розбавляють Одержання фармацевтичних композицій: до необхідного остаточного обсягу дистильованою a) Таблетки: водою і суспензію у виді сиропу пропускають через 0,01-50% активного інгредієнта, 15-50% лактоколоїдне мірошницьке устаткування. зи, 15-50% картопляного крохмалю, 5-15% полівіe) Свічі: нілпіролідону, 1-5% тальку, 0,01-3% стеарату магДля кожної свічі 0,01-15% активного компоненнію, 1-3% колоїдного діоксиду кремнію і 2-7% та і 1-20% лактози ретельно перемішують, потім ультраамілопектину перемішують, потім гранулюрозплавляють 50-95% адепса на свічу (наприклад, ють за допомогою вологої грануляції і пресують у Witepsol 4), охолоджують до 35°С і суміш з активтаблетки. ного компонента і лактози перемішують за допоb) Драже, таблетки, покриті плівкою: могою гомогенізатора. Отриману суміш формують Таблетки, виготовлені у відповідності зі спосов охолоджуваних формах. бом, описаним вище, покривають шаром, що f) Ліофілізовані порошкові композиції в ампускладається з ентеро- або гастророзчинної плівки лах: або із цукру і тальку. Драже шліфують за допомоГотують 5% розчин маннитолу або лактози з гою суміші з бджолиного воску і карнаубського бідистильованою водою для ін'єкційного застосувоску. вання, після чого розчин відфільтровують так, щоб c) Капсули: зробити його стерильним. Готують 0,01-5% розчин 0,01-50% активного інгредієнта, 1-5% лаурилактивного компонента також з бідистильованою сульфату натрію, 15-50% крохмалю, 15-50% лакводою для застосування в ін'єкції й отриманий този, 1-3% колоїдного діоксиду кремнію і 0,01-3% розчин відфільтровують так, щоб зробити його стеарату магнію ретельно перемішують, суміш стерильним. Отримані два розчини змішують в пропускають через сито і наповнюють нею тверді асептичних умовах, наповняють в ампули дозою желатинові капсули. 1мл, вміст ампул ліофілізують і ампули запаюють d) Суспензії: в атмосфері азоту. Вміст ампул розчиняють у стеінгредієнти: 0,01-15% активного компоненту, рильній або воді 0,9% (фізіологічному) стерильно0,1-2% гідроксиду натрію, 0,1-3% лимонної кислому водяному розчині хлориду натрію перед увети, 0,05-0,2% нипагину (метил 4-гідроксибензоат денням. натрію), 0,005-0,02% нипазолу, 0,01-0,5% карбо Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAmide derivatives as nmda receptor antagonists
Автори англійськоюFarkash Shandor, Borza Istvan, Nagy Jozsef, Kolok Sandor
Назва патенту російськоюАмидные производные как антагонисты nmda рецептора
Автори російськоюФаркаш Шандор, Борза Иштван, Надь Йожеф, Колок Шандор
МПК / Мітки
МПК: A61P 25/02, A61P 25/32, A61P 25/28, C07D 487/04, A61P 9/10, C07D 417/06, A61K 31/4523, A61K 31/445, A61P 25/16, A61P 27/02, C07D 401/06, A61P 25/00, A61P 21/02, C07D 211/16, A61P 25/22, A61P 13/10, A61P 29/00, A61P 27/16, A61P 25/18, C07D 409/06, A61P 25/14, A61P 25/30, A61P 9/00, A61P 31/10, A61K 31/454, A61P 11/06, A61P 25/08, A61K 31/405, A61P 3/08, A61P 25/06, A61P 43/00, A61P 31/12, C07D 498/04, A61K 31/4439, C07D 401/14, A61P 25/24, C07D 405/06, C07D 403/06, C07D 209/42, A61P 21/04, A61K 31/404
Мітки: похідні, рецептора, антагоністи, амідні
Код посилання
<a href="https://ua.patents.su/15-74850-amidni-pokhidni-yak-antagonisti-nmda-receptora.html" target="_blank" rel="follow" title="База патентів України">Амідні похідні як антагоністи nmda рецептора</a>
Попередній патент: Лактам
Наступний патент: Еколого-технологічний газоаналітичний комплекс
Випадковий патент: Спосіб та пристрій для оперативного визначення параметрів рідких та сипучих речовин












