Похідні тіоксантину, спосіб їх отримання (варіанти), їх застосування та фармацевтична композиція, що містить їх
Номер патенту: 78986
Опубліковано: 10.05.2007
Автори: Тіден Анна-Карін, Нордвалль Ґуннар, Гансон Сверкер
Формула / Реферат
1. Застосування сполуки формули (Ia) або (Ib)
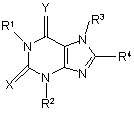 (Ia)
(Ia)
або
 , (Ib)
, (Ib)
де:
Х є S, a Y представляє О;
R1 представляє гідроген або С1-6алкіл;
R2 представляє гідроген або С1-6алкіл; вказаний алкіл, як варіант, заміщено
і) насиченим або частково ненасиченим 3-7-членним кільцем, як варіант, з уведеним одним або двома гетероатомами, що вибрані незалежно з О, N та S та як варіант, з уведеною карбонільною групою; вказане кільце, як варіант, заміщено одним або більше замісниками, вибраними з групи: галоген, гідрокси, С1-6алкокси та C1-6алкіл; вказаний алкіл, як варіант, крім того заміщено гідрокси або С1-6алкокси; або
іі) С1-6алкокси; або
ііі) ароматичне кільце, вибране з фенілу, фурилу або тієнілу; вказане ароматичне кільце, як варіант, крім того заміщено замісником з групи: галоген, С1-6алкіл або С1-6алкокси;
R3 представляє гідроген або С1-6алкіл та R4 представляє гідроген;
або її фармацевтично прийнятної солі у виробництві медикаменту для лікування або профілактики хвороб або станів, в яких є корисним інгібування ферменту МРО.
2. Застосування за п. 1, при якому хвороба або стан є нейрозапальним розладом.
3. Застосування за п. 1 або п. 2, при якому R3 представляє Н.
4. Застосування за будь-яким одним з пп. 1-3, при якому R2 представляє, як варіант, заміщений С1-6алкіл.
5. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки формули (Іа) або (Ib) за п. 1 або її фармацевтично прийнятну сіль у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм, для застосування у лікуванні або профілактиці нейрозапальних розладів.
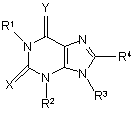
6. Сполука формули (Іа) або (Ib)
 (Ia)
(Ia)
або
 , (Ib)
, (Ib)
де:
X представляє S, a Y представляє О;
R1 представляє гідроген або С1-6алкіл;
R2 представляє гідроген або С1-6алкіл, що заміщено насиченим або частково ненасиченим 3-7-членним кільцем, як варіант, з уведеним одним або двома гетероатомами, що вибрані незалежно з О, N та S, та, як варіант, з уведеною карбонільною групою; вказане кільце, як варіант, заміщено одним або більше замісниками, вибраними з групи: галоген, гідрокси, С1-6алкокси та С1-6алкіл; вказаний алкіл, як варіант, крім того заміщено гідрокси або С1-6алкокси;
R3 та R4 незалежно представляють гідроген або С1-6алкіл;
або її фармацевтично прийнятна сіль.
7. Сполука формули (Іа) або (Іb), якою є:
1,3-діізобутил-8-метил-6-тіоксантин;
1,3-дибутил-8-метил-6-тіоксантин;
3-ізобутил-1,8-диметил-6-тіоксантин;
3-(2-метилбутил)-6-тіоксантин;
3-ізобутил-8-метил-6-тіоксантин;
3-ізобутил-2-тіоксантин;
3-ізобутил-2,6-дитіоксантин;
3-ізобутил-8-метил-2-тіоксантин;
3-ізобутил-7-метил-2-тіоксантин;
3-циклогексилметил-2-тіоксантин;
3-(3-метоксипропіл)-2-тіоксантин;
3-циклопропілметил-2-тіоксантин;
3-ізобутил-1-метил-2-тіоксантин;
3-(2-тетрагідрофурил-метил)-2-тіоксантин;
3-(2-метоксіетил)-2-тіоксантин;
3-(3-(1-морфолініл)пропіл)-2-тіоксантин;
3-(2-фурилметил)-2-тіоксантин;
3-(4-метоксибензил)-2-тіоксантин;
3-(4-флуорбензил)-2-тіоксантин;
3-фенетил-2-тіоксантин;
(+)-3-(2-тетрагідрофурилметил)-2-тіоксантин;
(-)-3-(2-тетрагідрофурилметил)-2-тіоксантин;
3-н-бутил-2-тіоксантин;
або її фармацевтично прийнятна сіль.
8. Застосування сполуки за п. 6 або 7 як медикаменту.
9. Фармацевтична композиція, що містить сполуку формули (Іа) або (Іb) за п. 6 або 7 або її фармацевтично прийнятну сіль, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
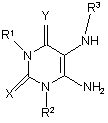
10. Спосіб отримання сполуки формули (Іа) або (Іb), яку визначено у п. 6 або 7, або її фармацевтично прийнятної солі, енантіомера, діастереомеру або рацемату,
у якому здійснюють реакцію сполуки формули (IIа) або (ІІb)
 (IIa)
(IIa)
або
 , (IIb)
, (IIb)
де R1, R2, R3 та R4 визначено у п. 1; Х представляє О або S; a Y представляє О;
з сульфуруванням сполуки таким реагентом, як реагент Лоусона або пентасульфід фосфору; отримуючи відповідну сполуку, де Y представляє S;
а коли необхідно, перетворюють утворену сполуку формули (Іа) або (Іb), або іншу її сіль, в її фармацевтично прийнятну сіль;
або перетворюють утворену сполуку (Іа) або (Іb) у наступну сполуку формули (Іа) або (Іb); а коли потрібно, перетворюють утворену сполуку формули (Іа) або (Іb) в її оптичний ізомер.
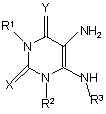
11. Спосіб отримання сполуки формули (Іа) або (Іb), яку визначено у п. 6 або 7, або її фармацевтично прийнятної солі, енантіомера, діастереомеру або рацемату,
у якому здійснюють реакцію діаміну формули (ІIIа) або (ІІІb)
 (IIIa)
(IIIa)
або
 , (IIIb)
, (IIIb)
де R1, R2, R3, Х та Y визначено у п. 1;
з мурашиною кислотою або триалкілортоестером;
а коли необхідно, перетворюють утворену сполуку формули (Іа) або (Іb), або іншу її сіль, в її фармацевтично прийнятну сіль;
або перетворюють утворену сполуку (Іа) або (Іb) у наступну сполуку формули (Іа) або (Іb); а коли потрібно, перетворюють утворену сполуку формули (Іа) або (Іb) в її оптичний ізомер.
Текст
Представлений винахід стосується застосування похідних тіоксантину як інгібіторів ферменту мієлопероксидази (МРО). Деякі нові похідні тіоксантину також розкрито разом зі способами їх отримання, композиціями, що містять їх, та їх застосуванням у терапії. Мієлопероксидаза (МРО) є ферментом з вмістом гему, знайденим переважно у поліморфонуклеарних лейкоцитах (PMN). МРО є одним членом різноманітної родини білків пероксидаз ссавців, що також залучає еозинофільну пероксидазу, тироїдну пероксидазу, пероксидазу слини, лактопероксидазу, простагландин-Нсинтазу та інші. Розвинений фермент є димером ідентичних половинок. Кожна половина молекули містить ковалентно зв'язаний гем, що виявляє незвичайні спектральні властивості, відповідні за зелений колір МРО. Розщеплення дисульфідного зв'язку, що з'єднує дві половинки МРО, дає напівфермент, що виявляє спектральні та каталітичні властивості, нерозрізнені від властивостей цілого ферменту. Фермент використовує гідроген пероксид для окиснення хлориду до гіпохлоритної кислоти. Інші галогеніди та псевдогалогеніди (типу тіоціанату) є також фізіологічними субстратами МРО. PMN є особливо важливими для боротьби з інфекціями. Ці клітини містять МРО з добре підтвердженою мікробіцидною дією. PMN діють неспецифічно фагоцитозом для поглинання мікроорганізмів, уведення їх у вакуолі під назвою фагосоми, які зливаються з гранули, що містять мієлопероксидазу, з утворенням фаголізосом. У фаголізосомах ферментна активність мієлопероксидази призводить до утворення гіпохлоритної кислоти, потужної бактерицидної сполуки. Гіпохлоритна кислота є окисником сама по собі та інтенсивно реагує з тіолами та тіоетерами, але також перетворює аміни у хлораміни та хлорує ароматичні амінокислоти. Макрофагами є великі фагоцитарні клітини, типу PMN, здатні до фагоцитозу мікроорганізмів. Макрофаги можуть утворювати гідроген пероксид та при активації також продукують мієлопероксидазу. МРО та гідроген пероксид можуть також вивільнятися назовні клітин, де реакція з хлоридом може індукувати пошкодження сусідніх тканин. Зв'язок мієлопероксидазної активності з хворобою залучено у неврологічні хвороби з нейрозапальною реакцією, залучаючи розсіяний склероз, хворобу Альцгеймера, хворобу Паркінсона та інсульт, а також інші запальні хвороби або стани типу астми, хронічної обструктивної хвороби легенів, кістозного фіброзу, атеросклерозу, запальної хвороби кишечнику, ренального гломерулярного пошкодження та ревматоїдного артриту. Рак легенів також асоційовано з високими рівнями МРО. [WO 01/85146] розкриває різні сполуки, що є інгібіторами МРО та є тому корисними у лікуванні хронічної обструктивної хвороби легенів (COPD). 3-н-пропіл-2-тіоксантин розкрито у [Drug Development Research, 1999, 47, 45-53]. 3-Ізобутил-6-тіоксантин розкрито у [J. Chem. Soc, 1962,1863]. 2-Тіоксантин є комерційно доступним. Представлений винахід стосується груп похідних тіоксантину, що несподівано виявляють корисні властивості як інгібітори ферменту МРО. Згідно з представленим винаходом запропоновано застосування сполуки формул (Іа) або (Іb) де: один з X та Υ представляє S, а інший представляє О або S; R1 представляє гідроген або C1-6алкіл; R2 представляє гідроген або C1-6алкіл; вказаний алкіл, як варіант, заміщено: і) насиченим або частково ненасиченим 3-7-членним кільцем, як варіант, з уведеним одним або двома гетероатомами, що вибрані незалежно з О, N та S та, як варіант, з уведеною карбонільною групою; вказане кільце, як варіант, заміщено одним або більше замісниками, вибраними з групи: галоген, гідрокси, C16алкокси та C1-6 алкіл; вказаний алкіл, як варіант, крім того заміщено гідрокси або C1-6алкокси; або іі) C1-6алкокси; або ііі) ароматичне кільце, вибране з фенілу, фурилу або тієнілу; вказане ароматичне кільце, як варіант, крім того заміщено замісником з групи: галоген, C1-6алкіл або C1-6алкокси; І R3 та R4 незалежно представляють гідроген або C1-6алкіл; або її фармацевтично прийнятну сіль, у виробництві медикаменту, для лікування або профілактики хвороб або станів, в яких інгібування ферменту МРО є корисним. Сполуки формули (Іа) або (Іb) можуть існувати у формах енантіомерів. Тому усі енантіомери, діастереомери, рацемати та їх суміші залучено у рамки винаходу. Слід розуміти, що коли R3 у формулах (Іа) та (Іb) представляє гідроген, дві альтернативні форми (Іа) та (Іb) є таутомерами одної сполуки. Усі такі таутомери та суміші таутомерів залучено у рамки представленого винаходу. Особливий аспект винаходу стосується застосування сполуки формули (Іа) або (Іb) чи її фармацевтично прийнятної солі у виробництві медикаменту для лікування або профілактики нейрозапальних .розладів. Згідно з винаходом також запропоновано спосіб лікування або зменшення ризику хвороб або станів, при яких є корисним інгібування ферменту МРО, спосіб залучає застосування до особи, що потерпає від вказаної хвороби або стану, або при її ризику, терапевтично ефективної кількості сполуки формули (Іа) або (Іb), або її фармацевтично прийнятної солі. Конкретніше, також запропоновано спосіб лікування або зменшення ризику нейрозапальних розладів у особи, що потерпає від вказаної хвороби або стану, або при її ризику, спосіб залучає застосування до особи терапевтично ефективної кількості сполуки формули (Іа) або (Іb), або її фармацевтично прийнятної солі. Ще один аспект винаходу стосується рецептури фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули (Іа) або (Іb), або її фармацевтично прийнятної солі, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм, для застосування у лікуванні або профілактиці хвороб або станів, в яких є корисним інгібування ферменту МРО. Ще один особливий аспект винаходу стосується рецептури фармацевтичної композиції, що містить терапевтично ефективну кількість сполуки формули (Іа) або (Іb), або її фармацевтично прийнятної солі, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм, для застосування у лікуванні або профілактиці нейрозапальних .розладів. В одному втіленні запропоновано застосування сполуки формули (Іа) або (Іb), де принаймні один з X та Υ представляє S, а інший представляє О або S; R1 представляє гідроген або C1-6алкіл; R2 представляє гідроген або C1-6алкіл; вказаний алкіл, як варіант, заміщено групою: С3-7Циклоалкіл, С1-4алкокси, або ароматичне кільце, вибране з фенілу, фурилу або тієнілу; вказане ароматичне кільце, як варіант, крім того заміщено замісником з групи: галоген, С1-4алкіл або С1-4алкокси; R3 та R4 незалежно представляють гідроген або C1-6алкіл; або її фармацевтично прийнятної солі, енантіомеру або рацемату у виробництві медикаменту для лікування або профілактики хвороб або станів, в яких є корисним інгібування ферменту МРО. У ще одному втіленні запропоновано застосування сполуки формули (Іа) або (Іb), де принаймні один з X та Υ представляє S, а інший представляє О або S; R1 представляє гідроген або C1-6алкіл; R2 представляє гідроген або C1-6алкіл; вказаний алкіл, як варіант, заміщено: і) насиченим або частково ненасиченим 3-7членним кільцем, як варіант, з уведеними одним або двома гетероатомами, що вибрані незалежно з О, N та S та, як варіант, з уведеною карбонільною групою; вказане кільце, як варіант, заміщено одним або більше замісниками, вибраними з групи: галоген, гідрокси, C1-6алкокси та C1-6алкіл; вказаний алкіл, як варіант, крім того заміщено гідрокси або С1-4алкокси; або іі) С1-4алкокси; або ііі) ароматичне кільце, вибране з фенілу, фурилу або тієнілу; вказане ароматичне кільце, як варіант, крім того заміщено замісником з групи: галоген, С1-4алкіл або С1-4алкокси; R3 та R4 незалежно представляють гідроген або C1-6алкіл; або її фармацевтично прийнятної солі у виробництві медикаменту для лікування або профілактики хвороб або станів, в яких є корисним інгібування ферменту МРО. В одному втіленні винахід стосується застосування сполук формул (Іа) або (Іb), де X представляє S, a Y представляє О. У ще одному втіленні R3 у формулі (Іа) або (Іb) представляє гідроген. У ще одному втіленні R4 у формулі (la) або (Ib) представляє, як варіант, заміщений C1-6алкіл. У ще одному втіленні R2 у формулі (Іа) або (Іb) представляє C1-6алкіл, що заміщено насиченим або частково ненасиченим 3-7-членним кільцем, як варіант, з уведеним одним або двома гетероатомами, що вибрані незалежно з О, N та S та, як варіант, з уведеною карбонільною групою; вказане кільце, як варіант, заміщено одним або більше замісниками, вибраними з групи: галоген, гідрокси, C1-6алкокси та C1-6алкіл; вказаний алкіл, як варіант, крім того заміщено гідрокси або C1-6алкокси. У ще одному втіленні R2 у формулі (Іа) або (Іb) представляє метилен, етилен або триметилен, що заміщено групою: циклопропіл, циклогексил, тетрагідрофураніл або морфолініл. У ще одному втіленні R2 у формулі (Іа) або (Іb) представляє C1-6алкіл заміщено групою: C1-6алкокси. У ще одному втіленні R2 у формулі (Іа) або (Іb) представляє етилен або триметилен, що заміщено групою: метокси або етокси. Коли X представляє S, a Y представляє О, наступне втілення залучає сполуки формули (Іа) або (Іb), де R1 представляє гідроген. Коли X представляє S, a Y представляє О, подальше втілення залучає сполуки формули (Іа) або (Іb), де R4 представляє гідроген. Коли X представляє О, a Y представляє S, наступне втілення залучає сполуки формули (Іа) або (Іb), де R1 представляє Сі_балкіл. Коли X представляє О, a Y представляє S, подальше втілення залучає сполуки формули (Іа) або (Іb), де R4 представляє С1-4алкіл. В одному втіленні винахід стосується застосування сполук формули (Іа) або (Іb), де X представляє S, a Y представляє О; R2 представляє, як варіант, заміщений C1-6алкіл; a R1, R3 та R4, кожний, представляють гідроген. В одному втіленні винахід стосується застосування сполук формули (Іа) або (Іb), де X представляє S, a Y представляє О; R2 представляє C1-6алкіл заміщено насиченим або частково ненасиченим 3-7-членним кільцем, як варіант, з уведеним одним або двома гетероатомами, що вибрані незалежно з О, N та S та, як варіант, з уведеною карбонільною групою; вказане кільце, як варіант, заміщено одним або більше замісниками, вибраними з групи: галоген, гідрокси, C1-6алкокси та C1-6алкіл; вказаний алкіл, як варіант, крім того заміщено гідрокси або C1-6алкокси; a R1, R3 та R4, кожний, представляють гідроген. В одному втіленні винахід стосується застосування сполук формули (Іа) або (Іb), де X представляє S, а Υ представляє О; R2 представляє C1-6алкіл, що заміщено групою: C1-6алкокси; R1, R3 та R4, кожний, представляють гідроген. Особливий аспект винаходу стосується застосування таких сполук формули (Іа) або (Іb): 1,3-діізобутил-8-метил-6-тіоксантин; 1,3-дибутил-8-метил-6-тіоксантин; ,3-ізобутил-1,8-диметил-6-тіоксантин; 3-(2-метилбутил)-6-тіоксантин; 3-ізобутил-8-метил-6-тіоксантин; 3-ізобутил-2-тіоксантин; 3-ізобутил-2,6-дитіоксантин; 3-ізобутил-8-метил-2-тіоксантин; 3-ізобутил-7-метил-2-тіоксантин; 3-циклогексилметил-2-тіоксантин; 3-(3-метоксипропіл)-2-тіоксантин; 3-циклопропілметил-2-тіоксантин; 3-ізобутил-1-метил-2-тіоксантин; 3-(2-тетрагідрофурил-метил)-2-тіоксантин; 3-(2-метокси-етил)-2-тіоксантин; 3-(3-(1-морфолініл)пропіл)-2-тіоксантин; 3-(2-фурил-метил)-2-тіоксантин; 3-(4-метоксибензил)-2-тіоксантин; 3-(4-флуорбензил)-2-тіоксантин; 3-фенетил-2-тіоксантин;. (+)-3-(2-тетрагідрофурил-метил)-2-тіоксантин; (-)-3-(2-тетрагідрофурил-метил)-2-тіоксантин; 3-н-бутил-2-тіоксантин; 3-н-пропіл-2-тіоксантин; 3-ізобутил-6-тіоксантин; 2-тіоксантин; та їх фармацевтично прийнятних солей. Якщо не вказано інше, термін "C1-6алкіл" означає алкіл з лінійним або розгалуженим ланцюгом, що має від 1 до 6 атомів карбону. Приклади таких груп залучають метил, етил, 1-пропіл, н-бутил, ізо-бутил, третбутил, пентил та гексил. Термін "C1-6алкіл" слід розуміти аналогічно. Якщо не вказано інше, термін "С3-7циклоалкіл" означає циклічний алкіл, що має від 3 до 7 атомів карбону. Приклади таких груп залучають циклопропіл, циклопентил та циклогексил. Якщо не вказано інше, термін "C1-6алкокси" означає алкоксигрупу з лінійним або розгалуженим ланцюгом, що має від 1 до 6 атомів карбону. Приклади таких груп залучають метокси, етокси, 1-пропокси, 2пропокси та трет-бутокси. Термін "С1-4алкокси" слід розуміти аналогічно. Якщо не вказано інше, термін "галоген" означає флуор, хлор, бром та йод. Приклади насиченого або частково ненасиченого 3-7-членного кільця, як варіант, з уведеним одним або двома гетероатомами, що вибрані незалежно з О, N та S та, як варіант, з уведеною карбонільною групою залучають циклопропіл, циклопентил, циклогексил, циклопентанон, тетрагідрофуран, піролідин, піперидин, морфолін, піперазин, піролідинон та піперидинон. Конкретні приклади залучають циклопропіл, циклогексил, тетрагідрофураніл (тетрагідрофурил) та морфолініл. Деякі сполуки формули (Іа) або (Іb) є новими. Відтак наступний аспект винаходу стосується таких нових сполук формули (Іа) або (Іb) де: X представляє S, a Y представляє О; R1 представляє гідроген або C1-6алкіл; R2 представляє C1-6алкіл, що заміщено насиченим або частково ненасиченим 3-7-членним кільцем, як варіант, з уведеним одним або двома гетероатомами, що вибрані незалежно з О, N та S та, як варіант, з уведеною карбонільною групою; вказане кільце, як варіант, заміщено одним або більше замісниками, вибраними з групи: галоген, гідрокси, C1-6алкокси та C1-6алкіл; вказаний алкіл, як варіант, крім того заміщено гідрокси або C1-6алкокси; R3 та R4 незалежно представляють гідроген або C1-6алкіл; та їх фармацевтично прийнятних солей. Наступний аспект винаходу стосується таких нових сполук формули (Іа) або (Іb) 1,3-діізобутил-8-метил-6-тіоксантин; 1,3-дибутил-8-метил-6-тіоксантин; 3-ізобутил-1,8-диметил-6-тіоксантин; 3-(2-метилбутил)-6-тіоксантин; 3-ізобутил-8-метил-6-тіоксантин; 3-ізобутил-2-тіоксантин; 3-ізобутил-2,6-дитіоксантин; 3-ізобутил-8-метил-2-тіоксантин; 3-ізобутил-7-метил-2-тіоксантин; 3-циклогексилметил-2-тіоксантин; 3-(3-метоксипропіл)-2-тіоксантин; 3-циклопропілметил-2-тіоксантин; 3-ізобутил-1-метил-2-тіоксантин; 3-(2-тетрапдрофурил-метил)-2-тіоксантин; 3-(2-метокси-етил)-2-тіоксантин; 3-(3-(1-морфолініл)-пропіл)-2-тіоксантин; 3-(2-фурил-метил)-2-тіоксантин; 3-(4-метоксибензил)-2-тіоксантин; 3-(4-флуорбензил)-2-тіоксантин; 3-фенетил-2-тіоксантин; (+)-3-(2-тетрагідрофурил-метил)-2-тіоксантин; (-)-3-(2-тетрагідрофурил-метил)-2-тіоксантин; 3-н-бутил-2-тіоксантин; та їх фармацевтично прийнятних солей. Наступний аспект винаходу стосується застосування нових сполук формули (Іа) або (Іb) як медикаменту. Згідно з винаходом нами крім того запропоновано спосіб отримання нової сполуки формули (Іа) або (Іb), або їх фармацевтично прийнятних солі, енантіомеру, діастереомеру або рацемату, який залучає: (a) реакцію сполуки формули (llа) або (llb) де R1, R2, R3 та R4 визначено у формулі (Іа) або (Іb), X представляє О або S, a Y представляє О; з сульфуруванням сполуки, як-то реагентом Лоусона або пентасульфідом фосфору; отримуючи відповідну сполуку, де Υ представляє S; або (b) реакцію діаміну формули (ІІІа) або (ІІІb) де R1, R2, R3, X та Υ визначено у формулі (Іа) або (Іb); з мурашиною кислотою або з триалкілортоестером; а коли необхідно, перетворення утвореної сполуки формули (Іа) або (Іb), або ще одної її солі, в її фармацевтично прийнятну сіль; або перетворення утвореної сполуки формули (Іа) або (Іb) у наступну сполуку формули (Іа) або (Іb); а коли потрібно, перетворення утвореної сполуки формули (Іа) або (Іb) в її оптичний ізомер. На етапі (а), сполуку формули (llа) або (llb) та засіб сульфурування, як-то реагент Лоусона або пентасульфід фосфору, розчиняють або суспендують у придатному сухому органічному розчиннику як-то бензол, толуол, ксилол, тетрагідрофуран, дихлорметан або діоксан, а тоді гріють до температури між 30°С та температурою кипіння під зворотним холодильником розчиннику до закінчення реакції, звичайно протягом 1-30 годин. Реакційну суміш тоді охолоджують та фільтрують для видалення нерозчинних твердих продуктів. Розчинник видаляють під зменшеним тиском та сирий продукт очищають хроматографією на колонці або перекристалізацією. На етапі (b), діамін формули (ІІІа) або (ІІІb) обробляють при придатній температурі і надлишком підхожого ортоестеру, як-то триетилортоформіат, триетилортоацетат, триетилортопропіонат, триетилортобутаноат, трипропілортоформіат, трибутилортоформіат та триізопропілортоформіат, як варіант, у присутності придатного розчиннику, як-то спирт, до закінчення реакції. Температуру звичайно доводять до температури кипіння реакційної суміші під зворотним холодильником та час реакції складає загалом від 30 хвилин до протягом ночі. В одному втіленні ортоестер є триетилортоформіатом з етанолом як необов'язковим розчинником. Альтернативно на етапі (b), діамін формули (ІІІа) або (ІІІb) обробляють 98% мурашиною кислотою при придатній температурі між температурою довкілля та температурою кипіння реакційної суміші під зворотним холодильником. Процес продовжують протягом придатного періоду часу, звичайно протягом 0,55 годин. Після видалення мурашиної кислоти обробка придатною водною основою, наприклад, 10% водним розчином натрій гідроксиду, тоді дає сполуку формули (І). Обробку основою проводять протягом придатного часу при придатній температурі, наприклад, протягом приблизно 10 хвилин - 4 годин при температурі між температурою довкілля та температурою кипіння реакційної суміші під зворотним холодильником. Інші способи перетворення діаміну формули (ІІІа) або (lllb) у сполуку формули (Іа) або (Іb) описано у літературі та добре відомі фахівцям. Представлений винахід стосується сполуки формули (Іа) або (Іb) у формі солей, зокрема кислотноадитивних солей. Придатні солі залучають солі, утворені як органічними, так і неорганічними кислотами. Такі кислотно-адитивні солі звичайно є фармацевтично прийнятними, хоча солі фармацевтично неприйнятних кислот можна застосовувати для отримання та очистки даних сполук. Отже, кращі солі залучають солі, утворені гідрохлоридною, гідробромідною, сульфатною, фосфатною, лимонною, винною, молочною, піровиноградною, оцтовою, бурштиновою, фумаровою, малеїновою, метансульфоновою та бензолсуль-фоновою кислотами. Солі сполук формули (Іа) або (Іb) можна утворювати реагуванням вільної основи або її солі, енантіомеру або рацемату з одним або більше еквівалентами підхожої кислоти. Реакцію можна проводити у розчиннику або середовищі, в яких сіль є нерозчинною, або у розчиннику, в якому сіль є розчинною, наприклад, вода, діоксан, етанол, тетрагідрофуран або діетилетер, або суміші розчинників, які можна видалити у вакуумі або сушкою сублімацією. Реакція може також бути обмінною, або її можна проводити на іонообмінній смолі. Сполуки формули (llа) або (llb) та сполуки формули (ІІІа) або (ІІІb) є відомими у літературі або їх можна отримувати, застосовуючи відомі способи, що добре відомі фахівцям. Сполуки винаходу та їх інтермедіати можна виділяти з їх реакційної суміші, а коли необхідно, їх крім того очищають, застосовуючи стандартні способи. Сполуки формули (Іа) або (Іb) можуть існувати у формах енантіомерів. Відтак, усі енантіомери, діастереомери, рацемати та їх суміші залучено у рамки винаходу. Відмінні оптичні ізомери можна виділяти розділенням рацемічної суміші сполук, застосовуючи звичайні способи, наприклад, фракційну кристалізацію, або ВЕРХ. Альтернативно, відмінні оптичні ізомери можна отримувати безпосередньо, застосовуючи оптично активні вихідні матеріали. Інтермедіати можуть також бути у формах енантіомерів та їх можна застосовувати як очищені енантіомери, діастереомери, рацемати або суміші. Сполуки формули (Іа) або (Іb) та їх фармацевтично прийнятні солі є корисними, оскільки вони виявляють фармакологічну активність як інгібітори ферменту МРО. Сполуки формули (Іа) та (Іb) та їх фармацевтично прийнятні солі показані для застосування у лікуванні або профілактиці хвороб або станів, в яких є потрібною модуляція активності ферменту мієлопероксидази (МРО). Зокрема, зв'язок активності МРО з хворобою залучено у нейрозапальних хворобах. Відтак сполуки представленого винаходу особливо показані для застосування у лікуванні нейрозапальних станів або розладів у ссавців, залучаючи людину. Так стани або розлади добре відомі фахівцям. Стани або розлади, які можна конкретно згадати, залучають розсіяний склероз, хворобу Альцгеймера, хворобу Паркінсона, аміотрофічний бічний склероз та інсульт, а також інші запальні хвороби або стани, якто астма, хронічна обструктивна хвороба легенів, кістозний фіброз, ідіопатичний фіброз легенів, гострий респіраторний дистрес-синдром, синусит, риніт, псоріаз, дерматит, увеїт, гінгівіт, атеросклероз, запальна хвороба кишечнику, ренальні гломерулярні пошкодження, фіброз печінки, сепсис, проктит, ревматоїдний артрит та запалення, асоційовані з реперфузійним пораненням, пораненням спинного хребта та пошкодженням/рубцеванням/рубцовим зрощенням/відторгненням тканин. Рак легенів, як повідомлено, також асоційований з високими рівнями МРО. Сполуки, як очікують, є також корисними у лікуванні болю. Профілактика, як очікують, є особливо обґрунтованою для лікування осіб, які постраждали від вищезазначених чинників, або мають збільшений ризик стосовно даних хвороби або стану. Особи при ризику розвинення конкретної хвороби або стану загалом залучають тих, що мають родину історію хвороби або стану, або тих, що могли б бути ідентифіковані генетичним тестуванням або скринінгом як особливо сприйнятливі до розвинення хвороби або стану. Для вищенаведених терапевтичних показань, вживане дозування, безумовно, залежатиме від застосовуваної сполуки, режиму застосування та потрібного лікування. Однак, загалом, задовільні результати отримують, коли сполуки вживають при дозуванні твердої форми 1-2000мг на добу. Сполуки формул (Іа) або (Іb) та їх фармацевтично прийнятні похідні, можна застосовувати самі по собі, або у формі підхожої фармацевтичної композиції, в якій сполука або похідне є у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. Отже, ще один аспект винаходу стосується фармацевтичної композиції, що містить нову сполуку формули (Іа) або (Іb), або її фармацевтично прийнятну сіль, у суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. Застосування може бути, але без обмеження, ентеральним (залучаючи пероральне, під'язичне або ректальне), інтраназальним, інгаляцією, внутрішньовенним, місцевим або іншими парентеральними шляхами. Звичайні процедури вибору та отримання придатної рецептури фармацевтичної композиції описано, наприклад, у ["Pharmaceuticals - The Science of Dosage Form Designs", Μ. Ε. Aulton, Churchill Livingstone, 1988]. Фармацевтична композиція переважно залучає менше 80% та більш переважно менше 50% сполуки формул (Іа) або (Іb), чи її фармацевтично прийнятної солі. Також запропоновано спосіб отримання такої, фармацевтичної композиції, який залучає змішування інгредієнтів. Винахід ілюстровано, але без обмеження, наступними прикладами: Спектр 1Н та 1ЗС ЯМР реєструють на спектрометрі Bruker DPX при 300МГц або на Varian Unity при 400МГц при 25°С. Використано опорні сигнали: центральна лінія ДMCO-d6 d 39,5 (13C); ДМСО-d6 d 2,50 (1Η). Усі мас-спектри реєструють на приладі Waters LCMS (2790). Тонко-шарову хроматографію (ТШХ) проводять на попередньо покритих силікагелем алюмінієвих листах Merck TLC 60 F254 (товщина шару 0,2мм). Силікагель Merck Silica gel 60 (0,063-0,200мм) застосовують для хроматографії на колонці. ВЕРХ-аналіз проводять на Gynkotek P580 HPG, gradient pump з детектором Gynkotek UVD 170S UV-vis. Column; Waters symmetry C18, 5мкм, 3,9´150мм. Препаративну рідинну хроматографію проводять на Gynkotek P580 HPG, gradient pump з детектором Gynkotek UVD 170S UV-vis. Column; Waters symmetry C18, 5мкм, 19´100мм. Вихідні матеріали отримують згідно з посиланнями: [Merlos, Μ.; Gomez, L.; Vericat, Μ. L; Bartroli, J.; Garcia-Rafanell, J.; Forn, J.; Eur. J. Med.Chem. Chim. Then; 25; 8; 1990; 653-658. Kjellin.P. G.; Persson, С G. Α., ΕΡ 0010531. 1 Katritzky, A. R.; Drewniak, M., Tet. Lett. (1988), 29(15), 1755-1758. Van der Goot, H; Schepers, M. J. P.; Sterk, G. J.; Timmerman, H., Eur. J. Med. Chem. (1992), 27(5), 511517]. Приклад 1 1,3-Діізобутил-8-метил-6-тіоксантин 1,3-Діізобутил-8-метил-ксантин1 (0,20г, 0,72ммоль) та реагент Лоусона (1,5г, 3,6ммоль) суспендують у толуолі (8мл) та тоді гріють при 100°С протягом 21 години. Реакційну суміш охолоджують та фільтрують для видалення нерозчинних твердих продуктів. Розчинник видаляють під зменшеним тиском та сирий продукт очищають хроматографією на колонці, застосовуючи силікагель та елюючи сумішшю етилацетат/гептан (1:1), отримуючи названу сполуку (90мг, 43 % виходу). 1 Н ЯМР (ДMCO-d6): d 13,1 (s, 1Н), 4,28 (d, 2Н, J=7,2Гц), 3,84 (d, 2H, J=7,5Гц), 2,40 (s, 3Н), 2,28-2,35 (m, 1H), 2,17-2,25 (m, 1H), 0,85-0,88 (m, 12Η). MC (EP) m/z 295 (M+1). Приклад 2 1,3-Дибутил-8-метил-6-тіоксантин 1,3-Діізобутил-8-метил-ксантин1 (0,20г, 0,72ммоль) та реагент Лоусона (0,87г, 2,2ммоль) суспендують у толуолі (8мл) та гріють при 120°С протягом 30 годин. Утворену коричневу суміш охолоджують та розчинник випарюють під зменшеним тиском. Коричнюватий твердий залишок суспендують у 10% натрій гідроксиді (25мл) та перемішують протягом ночі. Тоді рН розчину доводять до рН 4 10% оцтовою кислотою. Осад збирають фільтруванням та промивають водою. Сирий продукт очищають хроматографією на колонці, застосовуючи силікагель та елюють сумішшю етилацетат/гептан (9:1), отримуючи названу сполуку (0,15г, 69% виходу). 1 Н ЯМР (ДMCO-d6): d 13,1 (s, 1Н), 4,40 (t, 2Н, J=7,6Гц), 3,99 (t, 2H, J=7,3Гц), 2,40 (s, 3Н), 1,57-1,69 (m, 4H), 1,28-1,35 (m, 4H), 0,88-0,93 (m, 6H). 13 С ЯМР (ДMCO-d6): d 173,5, 154,2, 148,9, 143,2, 118,9, 45,61, 43,13, 29,24, 28,37, 19,51, 19,31, 14,42, 13,60. MC(EP)m/z295(M+1). Приклад 3 3-Ізобутил-1,8-диметил-6-тіоксантин 3-Ізобутил-1,8-диметил-ксантин1 (0,150г, 6,35ммоль, 1,0екв.) та реагент Лоусона (0,128г, 3,17ммоль, 0,5екв.) розчиняють у толуолі (10мл) та реакційну суміш гріють до температури кипіння під зворотним холодильником протягом 3,5 годин. Перетворення є менше 10% згідно з ВЕРХ. Реагент Лоусона (0,5г) додають та реакційну суміш гріють до температури кипіння під зворотним холодильником протягом ночі. Розчинник випарюють та коричневий твердий залишок очищають препаративною ВЕРХ, отримуючи названу сполуку (78мг, 49%). 1 Н ЯМР (ДMCO-d6): d 13,16 (s, 1Н), 3,92 (d, 2Н), 3,77 (s, 3Η), 2,50 (s, 3Н), 2,35 (m, 1H), 0,97 (d, 6H). Приклад 4 3-(2-Метилбутил)-6-тіоксантин 3-(2-Метилбутил)-ксантин2 (3г, 0,013моль) та пентасульфід фосфору (5г, 0,025моль) у діоксані (250мл) гріють при температурі кипіння під зворотним холодильником протягом 3 годин. Майже 150мл діоксану відганяють та розчин охолоджують. Воду (100мл) додають та суміш перемішують при кімнатній температурі протягом 2 годин. 2Η Натрій гідроксид (75мл) додають, розчин фільтрують та нейтралізують 5Η гідрохлоридною кислотою. Сирі кристали відфільтровують та перекристалізовують з етанолу, отримуючи названу сполуку (1,6г, 51%). 1 Н ЯМР (ДMCO-d6): d 13,53 (s, 1Н), 12,32 (s, 1Н), 8,11 (s, 1Н), 3,85 (dd, 1Н, 2J 13,1Гц, 3J 1,1Гц), 3,78 (dd, 2 1H, J 13,1Гц, 3J 8,1Гц), 2,00 (m, 1H), 1,36 (m, 1H), 1,14 (m, 1H), 0,87 (t, 3Н, J 7,6), 0,82 (d, 3Н, J 6,6). 13 C ЯМР (ДMCO-d6): d 175,11, 149,19, 145,73, 143,62, 118,32, 48,11, 32,93, 26,40, 16,57, 11,05. Приклад 5 3-Ізобутил-8-метил-6-тіоксантин. З-Ізобутил-8-метил-ксантин2 (4,5г, 0,02моль) та пентасульфід фосфору (8г, 0,04моль) у діоксані (400мл) гріють при температурі кипіння під зворотним холодильником протягом 5 годин. Майже 200мл діоксану відганяють та розчин охолоджують. Воду (250мл) додають та суміш перемішують при кімнатній температурі протягом 2 годин. 2Η Натрій гідроксид (150мл) додають, розчин фільтрують та нейтралізують 5Η гідрохлоридною кислотою та розчин залишають протягом ночі. Сирі кристали відфільтровують та промивають водою, отримуючи потрібний продукт (4,3г). Порцію (2,3г) перекристалізовують з оцтової кислоти, отримуючи чистий продукт (1,5 , 31% сумарно). 1 Н ЯМР (ДMCO-d6): d 13,13 (s, 1Н), 12,16 (s, 1Н), 3,77 (d, 2Н, 8,1Гц), 2,38 (s, 3Н), 2,20 (m, 1Н), 0,86 (d, 3H, J=7,1). 13 C ЯМР (ДMCO-d6): d 173,19, 154,23, 149,14, 146,11, 118,56, 49,29, 26,63, 19,73, 14,54. Приклад 6 3-Ізобутил-2-тіоксантин а) 6-Аміно-1-ізобутил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Ізобутилтіосечовину3 (3,8г, 29ммоль) та етилціаноацетат (3,9г, 34ммоль) додають до розчину натрій етоксиду [зроблено з натрію (0,72г, 32ммоль) та абсолютного етанолу (30мл)]. Утворену суміш гріють при температурі кипіння під зворотним холодильником протягом 4 годин. Після охолодження до кімнатної температури розчинник випарюють під зменшеним тиском. 10% Оцтову кислоту (45мл) додають до в'язкого сиропу. Утворений осад збирають фільтруванням та твердий продукт промивають водою. Перекристалізація з суміші метанол/вода дає потрібний продукт (4,0г, 70%). 1 Н ЯМР (ДMCO-d6): d 11,8 (s, 1H), 6,99 (s, 2H), 4,85 (m, 2H), 4,61 (br. s, 1H), 2,29 (m, 1H), 0,87 (d, 6H, J=6,6Гц). MC (EP) m/z 200 (M+1). b) 6-Аміно-1-ізобутил-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он 6-Аміно-1-ізобутил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,0г, 5,0ммоль) суспендують у 10% оцтовій кислоті (20мл). Натрій нітрит (0,38г, 5,5ммоль) додають та утворену суміш гріють при 75°С протягом 1 години. Реакційна суміш стає спершу рожевою, а тоді пурпурною. Пурпурну суміш охолоджують до кімнатної температури. Тоді додають воду (20мл) та пурпурний твердий продукт збирають фільтруванням та промивають водою, отримуючи названу сполуку (1,1г, 92% виходу). Цей твердий продукт застосовують на наступному етапі без подальшої очистки. 1 Н ЯМР (ДMCO-d6) d 13,1 (br. s, 1Н), 12,8 (br. s, 1H), 9,1 (br. s, JH),4,80 (br. s, 1H), 3,78 (br. s, 1H), 2,21 (m, 1H), 0,88 (d, 6H, J 6,3Гц). MC (EP) m/z 229 (M+1). c) 5,6-Діаміно-1-ізобутил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он 6-Аміно-1-ізобутил-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,1г, 4,5ммоль) суспендують у 32% водному аміаку (10мл) та додають воду (10мл). Цю червону суміш гріють при 75°С. Натрій дитіоніт додають малими порціями. Коли 1,8г (10ммоль) дитіоніту додано, колір . розчину змінюється від червоного до блідожовтого. При цьому увесь твердий продукт розчиняється. Після нагрівання протягом ще 5 хвилин у розчині утворюється осад. Реакційну суміш видаляють з масляної бані та перемішують при температурі довкілля протягом 45 хвилин. рН розчину доводять до нейтрального рН з 10% оцтовою кислотою. Жовтий осад збирають фільтруванням та промивають водою та сушать, отримуючи діамін (0,76г, 77%). Цей продукт застосовують без подальшої очистки. 1 Н ЯМР (ДMCO-d6): d 11,3 (br. s, 1Н), 6,19 (s, 2 Η), 4,94 (br. s, 1H), 3,70 (br. s, 1H), 3,43 (s, 2H), 2,27-2,35 (m, 1H), 0,88 (d, 6H, ,76,1 Гц). MC (EP) m/z 215 (M+1). d) 3-Ізобутил-2-тіоксантин 5,6-Діаміно-1-ізобутил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,22г, 1,0ммоль) суспендують у мурашиній кислоті (1,5мл) та цей розчин гріють при 100°С протягом 1 години. Надлишок мурашиної кислоти випарюють під зменшеним тиском. 10% натрій гідроксид (1,5мл) додають до оранжевого твердого продукту та утворений розчин гріють при 100°С протягом 15 хвилин. Воду додають та рН розчину доводять до рН 4 розбавленою оцтовою кислотою. Утворену суспензію перемішують протягом 0,5 години при температурі довкілля, тоді осад збирають фільтруванням та промивають водою. Вихід: (0,21г, 90 %). 1 Н ЯМР (ДMCO-d6): d 13,82 (s, 1H), 12,42 (s, 1H), 8,15 (s, 1H), 4,31 (d, 2H, J 7,6Гц), 2,50 (m, 1H), 0,88 (d, 6H, J 6,6Гц). 13 C ЯМР (ДMCO-d6): d 173,81, 152,57, 149,79, 141,19, 110,68, 54,04, 26,11, 19,79. MC (EP) m/z 225 (M+1). Приклад 7 3-Ізобутил-2,6-дитіоксантин 3-Ізобутил-2-тіоксантин (0,20г, 0,89ммоль) та реагент Лоусона (1,1г, 2,7ммоль) суспендують у толуолі (8мл). Цю суміш гріють при 120°С протягом 17 годин. Реакційну суміш охолоджують та розчинник видаляють під зменшеним тиском, 10% натрій гідроксид (20мл) додають . та суміш перемішують протягом 10 хвилин. Цей розчин фільтрують для видалення нерозчинних твердих продуктів та твердий продукт промивають 10% розчином натрій гідроксиду. Основний фільтрат обробляють розбавленою оцтовою кислотою до рН 4. Утворений осад збирають фільтруванням та промивають водою. Сушкою речовини отримують названу сполуку (0,16г, 73%). 1 Н ЯМР (ДMCO-d6): d 13,9 (br. s, 1Н), 13,5 (br. s, 1H), 8,27 (s, 1H), 4,32 (d, 2H, J 7,5Гц), 2,48-2,55 (m, 1H), 0,89 (d, 6H, J 6,7Гц). 13 C ЯМР (ДMCO-d6): d 173,3, 172,0, 144,9, 144,5, 122,8, 54,9, 26,3, 20,2. MC (EP) m/z 241 (M+1). Приклад 8 3-Ізобутил-8-метил-2-тіоксантин Суміш 5,6-діаміно-1-ізобутил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-ону (Приклад 6 (с), 0,70г, 3,26ммоль) та триетилортоацетату (10мл) гріють при 130°С протягом 2 годин та 40 хвилин. Тоді реакційну суміш охолоджують на льодяній бані, твердий продукт відфільтровують та промивають етанолом (4´2мл), твердий продукт сушать у вакуумі, отримуючи названу сполуку (0,71г, 95%). 1 Н ЯМР (ДMCO-d6): d 13,45 (s, 1Н), 12,33 (s, 1Н), 4,28 (d, 2Н, J=7,6Гц), 2,50 (m, 1H), 2,39 (s, 3Н), 0,87 (d, 6H, J 6,6Гц). 13 С ЯМР (ДMCO-d6): d 173,47, 152,09, 151,18, 150,01, 110,62, 53,96, 26,08, 19,75, 14,41. MC (EP) m/z 239 (M+1). Приклад 9 3-Ізобутил-7-метил-2-тіоксантин а) N-(6-Аміно-1-ізобутил-4-оксо-2-тіоксо-1,2,3,4-тетрагідро-піримідин-5-іл)-формамід 5,6-Діаміно-1-ізобутил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (Приклад 6 (с), 0,25г, 1,2ммоль) розчиняють у мурашиній кислоті (1,5мл) та перемішують при температурі довкілля протягом 0,5 години. Рожевий осад починає утворюватися через кілька хвилин. Воду додають та утворену суміш перемішують протягом 10 хвилин. Рожевий твердий продукт збирають фільтруванням, промивають водою та сушать, отримуючи названу сполуку (0,25г, 86 %). Цей матеріал застосовують без подальшої очистки. ЯМР показує, що продукт отримують як суміш двох таутомерів: формамід (головний) та іміно (другорядний). 1 Н ЯМР (ДMCO-d6): d 12,0 (br. s, 1Н), 8,73 (s, 1Н), 8,07 (s, 1Н), 6,85 (s, 2Η), 4,94 (br. s, 1H), 3,71 (br. s, 1H), 2,22-2,32 (m, 1H), 0,88 (d, 6H, J 6,5Гц). Додаткові піки походять від іміноізомеру: 8,12 (d, 1H, ,711,5Гц), 7,77 (d, 1H, ,711,5Гц), 7,13 (s, 2H). MC (EP) m/z 243 (M+1). b) 6-Аміно-1-ізобутил-5-метиламіно-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Н-(6-Аміно-1-ізобутил-4-оксо-2-тіоксо-1,2,3,4-тетрагідро-1Н-піримідин-5-ол (0,25г, 1,0ммоль) суспендують у сухому тетрагідрофурані (5мл) та комплекс боран-диметилсульфід (1М у дихлорметан, 2,5мл, 2,5ммоль) додають краплями. Реакційну суміш перемішують при температурі довкілля протягом 2,5 годин. До утвореного прозорого жовтого розчину додають кілька крапель 2Μ гідрохлоридної кислоти для видалення непрореагованого борану. Воду додають та утворений водний розчин екстрагують дихлорметаном (3´15мл). Поєднані органічні фази промивають розсолом та сушать сульфатом натрію. Розчинник випарюють під зменшеним тиском, отримуючи названу сполуку (0,12г, 54 % виходу). Цей матеріал застосовують без подальшої очистки. 1 Н ЯМР (ДMCO-d6): d 11,9 (br. s, 1Н), 5,75 (s, 2Η), 4,94 (br. s, 1H), 3,70 (br. s, 1H), 3,43 (s, 2H), 2,38 (s, 3H), 2,24-2,32 (m, 1H), 0,87 (d, 6H, 76,8Гц). MC (EP) m/z 229 (M+1). с) 3-Ізобутил-7-метил-2-тіоксантин 6-Аміно-1-ізобутил-5-метиламіно-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,11г, 0,48ммоль) розчиняють у мурашиній кислоті (1мл) та гріють при 85°С протягом 1 години. Надлишок мурашиної кислоти випарюють під зменшеним тиском. 10% Розчин натрій гідроксиду (2мл) додають та гріють при 85°С протягом 20 хвилин. Воду додають та рН доводять до 4 розбавленою оцтовою кислотою, при чому білий твердий продукт осаджується. Білий твердий продукт збирають фільтруванням, промивають водою та сушать, отримуючи названу сполуку (85мг, 74 %). 1 Н ЯМР (ДMCO-d6): d 12,4 (s, 1Н), 8,10 (s, 1Н), 4,28 (d, 2Н, J 7,5Гц), 3,89 (s, 3Н), 2,44-2,50 (m, 1H), 0,88 (d, 6H, J 6,7Гц). 13 С ЯМР (ДMCO-d6): d 174,3, 153,2, 150,1, 143,7, 111,2, 54,1, 33,6, 26,4, 20,1. МС (ЕР) m/z 239 (M+1). Приклад 10 3-Циклогексилметил-2-тіоксантин; а) 6-Аміно-1-циклогексилметил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 6 (а), застосовуючи циклогексилметилтіосечовину4 (3,92г, 22,7ммоль), отримуючи названу сполуку як білий твердий продукт (4,87г, 90%). 1 Н ЯМР (ДMCO-d6): d 11,75 (s, 1H), 6,93 (s, 2H), 5,1-4,7 (brm, 1H), 4,83 (s, 1H), 3,55 (br., 1H),1,93(br, 1H), 1,75-1,30 (brm, 5H), 1,10 (br, 5H). b) 6-Аміно-1-циклогексилметил-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 6 (b) з 6-аміно-1-циклогексилметил-2тіоксо-2,3-дигідро-1Н-піримідин-4-ону (3,75г, 15,7ммоль), отримуючи 3,60г (85%) пурпурного твердого продукту. 1 Н ЯМР: d 13,5 (br s, 1Н), 12,7 (br s, 1H), 9,1 (br s, 1H), 4,84 (br s, 1H), 3,82 (br s, 1H), 1,80 (br, 1H), 1,641,59 (brm, 5H), 1,07 (br, 5H). c) 5,6-Діаміно-1-циклогексилметил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 6 (с) з 6-аміно-1-циклогексилметил-5нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-ону (3,60г, 13,4ммоль) та застосовують без очистки на наступному етапі. 1 Н ЯМР (ДMCO-d6): d 6,17 (s, 2Η), 5,01 (br, 1H), 4,0-3,0 (дуже широкий, 3Н), 1,97 (br, 1 Η), 1,8-1,3 (brm, 5H)3 1,09 (br m, 5H). d) 3-Циклогексилметил-2-тіоксантин 5,6-Діаміно-1-циклогексилметил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он, (1,44г, 5,67ммоль) разом з триетилортоформіатом (15мл) гріють при 146°С протягом 2 годин та 10 хвилин. Суміші дають охолонути до температури довкілля та тоді охолоджують на льодяній бані, а далі додають гептан (5мл). Після фільтрування суспензії та промивання гептаном (20мл), отриманий твердий продукт сушать у вакуумі. Суспендування твердого продукту (1,2г) у гарячій суміші 2-пропанолу (125мл), води (5мл) та третбутилметил-етеру (25мл) дає, після охолодження та фільтрування білий осад, який промивають ще третбутилметил-етером (5мл). Твердий продукт сушать у вакуумі, отримуючи названу сполуку (0,95г, 63%). 1 Н ЯМР (ДMCO-d6): d 13,69 (s, 1H), 12,35 (s, 1H), 8,12 (s, 1H), 4,33 (d, 2H, J=7,1Гц), 2,18 (m, 1H), 1,491,50 (m, 5H), 1,02-1,17 (m, 5H). 13 С ЯМР (ДMCO-d6): d 173,65, 152,68, 149,90, 141,41, 110,96, 52,97, 35,31, 30,09, 25,88, 25,32. MC (EP) m/z 265 (M+1). Приклад 11 3-(3-Метоксипропіл)-2-тіоксантин а) 6-Аміно-1-(3-метоксипропіл)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Натрій метоксид (0,81г, 21,2ммоль, 1,05екв.) додають до розчину 3-метоксипропілтіосечовини (3,00г, 20,2ммоль) в етанолі (10мл). Етилціаноацетат (2,18мл, 20,2ммоль) в етанолі (10мл) додають та утворену білу кашку гріють до температури кипіння під зворотним холодильником протягом 2,5 годин. Розчинник випарюють та залишок коричневого масла обробляють 2Μ оцтовою кислотою (15мл). Білі кристали відфільтровують та промивають оцтовою кислотою, отримуючи названу сполуку (2,10г, 48%). 1 Н ЯМР (ДMCO-d6): d 1,77 (s, 1 Η), 6,95 (s, 2Η), 4,86 (s, 1H), 3,39 (t, 2H), 3,24 (s, 3Н), 1,88 (m, 2H). b) 3-(3-Метоксипропіл)-2-тіоксантин Оцтову кислоту (25мл) додають до 6-аміно-1-(3-метоксипропіл)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-ону (2,00г, 9,29ммоль) та червону реакційну суміш гріють до 90°С. Натрій нітрит (0,71г, 10,2ммоль) у воді (7мл) додають, масляну баню видаляють та реакційну суміш перемішують протягом 20 хвилин. Розчинники співвипарюють з етанолом та червоний твердий залишок (1,8г, 79%) застосовують на наступному етапі без подальшої очистки. Платину на вугіллі (0,5g) додають до розчину сирого 6-аміно-1-(3-метоксипропіл)-5-нітрозо-2-тіоксо-2,3дигідро-1Н-піримідин-4-ону (1,80г, 7,38ммоль) у тетрагідрофуран (80мл) та вод (20мл) та реакційну суміш гідрують при атмосферному тиску протягом 2 годин. Каталізатор відфільтровують та блідо-коричневий фільтрат співвипарюють з етанолом (250мл). Утворений коричневий твердий продукт (1,6г) застосовують на наступному етапі без подальшої очистки. 5,6-Діаміно-1-циклогексилметил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,6г, 12,2ммоль) розчиняють в етанолі (10мл) та триетилортоформіаті (10мл) і реакційну суміш гріють при температурі кипіння під зворотним холодильником протягом 2,5 годин. Розчинники випарюють та утворений коричневий твердий продукт очищають флеш-хроматографією (гептан/етилацетат, 4:1-1:1), отримуючи названу сполуку (110мг, 9%). 1 Н ЯМР (ДMCO-d6): d 13,78 (s, 1Н), 12,40 (s, 1Η), 8,16 (s, 1H), 4,52 (t, 2H, J=7,1Гц), 3,41 (t, 2H, ,77,1Гц), 3,21 (s, 3Н), 1,98 (m, 2H). 13 С ЯМР (ДMCO-d6): d 173,27, 152,63, 149,30, 141,50, 110,94, 69,51, 57,82, 45,47, 26,68. Приклад 12 3-Циклопропілметил-2-тіоксантині а) 6-Аміно-1-циклопропілметил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он До 1-циклопропілметил-2-тіосечовини (0,60г, 4,6ммоль) в етанолі (10мл) додають натрій метоксид (0,26г, 4,8ммоль) та після 5 хвилин етилціаноацетат (0,50мл, 4,6ммоль). Утворену суміш гріють до температури кипіння під зворотним холодильником протягом 2 годин та 40 хвилин, а далі випарюють розчинник під зменшеним тиском та обробляють утворений жовтий твердий продукт 2Μ водною оцтовою кислотою (10мл), отримуючи білий твердий продукт. Твердий продукт збирають фільтруванням та промивають 2Μ водною оцтовою кислотою (10мл), перемішують з етанолом (10мл), а далі випарюють та сушать під зменшеним тиском, отримуючи названу сполуку (0,51г,56%). МС (ЕР) m/z 198 (M+1). b) 3-Циклопропілметил-2-тіоксантин 6-аміно-1-циішопропілметил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,50г, 2,5ммоль) суспендують в оцтовій кислоті (8мл) та після нагрівання при 90°С протягом 15 хвилин додають до розчину натрій нітрит (0,19г, 2,8ммоль) у воді (1мл). Після 15 хвилин нагрівання припиняють та реакційну суміш перемішують при температурі довкілля протягом 3 годин. Етанол (30мл) додають та розчинники видаляють під зменшеним тиском. Утворене масло обробляють етанолом (30мл), отримуючи, після випарювання та сушки 6-аміно-1циклопропілміетил-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,61г) як червоно-коричневий твердий продукт. Сирий продукт (0,61г) з попередньої реакції розчиняють у воді (10мл) та додають тетрагідрофуран (30мл) та платину на вугіллі (0,30г). Суміш гідрують при атмосферному тиску протягом 4 годин, каталізатор видаляють фільтруванням та розчинники видаляють під зменшеним тиском. Випарювання доданого етанолу (50мл) дає оранжевий твердий продукт. Залишок розчиняють в етанолі (10мл) та додають триетилортоформіат (5мл) і утворену суміш гріють при температурі кипіння під зворотним холодильником протягом ночі. Випарювання розчиннику та очистка, застосовуючи препаративну ВЕРХ, дає потрібну сполуку (38мг, 6,2% виходу стосовно 6-аміно-1-циклопропілметил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-ону). 1 Н ЯМР (ДMCO-d6): d 13,78 (s, 1H), 12,43 (s, 1H), 8,15 (s, 1H), 4,37 (d, 2H, J=7,1Гц), 1,50 (m, 1Н), 0,52 (m,2H), 0,45 (m, 2Н). 13 С ЯМР (ДMCO-d6): d 173,52, 152,62,149,52, 141,48, 111,02, 51,71, 9,27, 3,50. MC (EP) m/z 223 (M+1). Приклад 13 3-Ізобутил-1-метил-2-тіоксантин, a) 1-Ізобутил-3-метилтіосечовина Метиламін (2Μ у метанолі, 20,0мл, 40,2ммоль) додають краплями до ізобутилізотіоціанату (2,00мл, 16,5ммоль) протягом 15 хвилин при кімнатній температурі. Реакційну суміш гріють до температури кипіння під зворотним холодильником протягом 3,5 годин та розчинник випарюють, отримуючи названу сполуку (2,37г, 98%) як безбарвне масло. 1 Н ЯМР (ДMCO-d6): d 7,40 (s, 1H), 7,29 (s, 1H), 3,15 (br. s, 2H), 2,80 (d, 2H), 1,81 (m, 1H), 0,83 (d, 6H). b) 6-Аміно-1-ізобутил-3-метил-5-нітрозо-2-тіоксо-1Н-піримідин-4-он Розчин ціанооцтової кислоти (1,52г, 17,8ммоль) в оцтовому ангідриді (2,45мл, 25,9ммоль) додають до 1ізобутил-3-метилтіосечовини (2,37г, 16,2ммоль). Реакційну суміш гріють до 60°С протягом 1,5 годин. Розчинник випарюють та утворене червоне масло знов розчиняють в етанолі (5мл) та додають 5Μ натрій гідроксид (1,6мл, 8,1ммоль). Реакційну суміш гріють при температурі кипіння під зворотним холодильником протягом 2 годин, розчинник співвипарюють з етанолом та утворений блідо-коричневий твердий продукт очищають флеш-хроматографією (етилацетат), отримуючи 6-аміно-1-ізобутил-3-метил-2-тіоксо-1Нпіримідин-4-он (1,0г, 29%) як жовтий твердий продукт. Натрій нітрит (0,34г, 4,9ммоль) у воді (1,5мл) додають до розчину аміну (1,00г, 4,7ммоль) в етанолі (7,0мл) при кімнатній температурі. 5Μ гідрохлоридну кислоту (1,0мл, 4,9ммоль) додають та утворену темночервону реакційну суміш перемішують при кімнатній температурі протягом 2 годин. Етанол (20мл) додають та червоні кристали відфільтровують та промивають діетилетером. Сушка кристалів дає названу сполуку (0,68г, 60%). 1 Н ЯМР (ДMCO-d6): d 12,87 (s, 1Н), 9,35 (s, 1Н), 4,28 (dd, 2Н), 3,75 (s, 3Н), 2,34 (m, 1H), 0,90 (d, 6H). с) 3-Ізобутил-1-метил-2-тіоксантин Паладій на вугіллі (3,70г) додають до розчину 6-аміно-1-ізобутил-3-метил-5-нітрозо-2-тіоксо-1Нпіримідин-4-ону (6,0г, 24,8ммоль) у тетрагідрофурані (1200мл) та воді (300мл) та реакційну суміш гідрують (2,5бар) протягом 21 години. Каталізатор відфільтровують та тетрагідрофуран випарюють під зменшеним тиском. Залишок екстрагують етилацетатом (3´200мл). Органічну фазу концентрують та додають до залишку етанол (100мл) і випарюють. Коричневий діаміновий інтермедіат розчиняють у триетилортоформіаті (50мл) та реакційну суміш гріють до 140°С протягом 40 хвилин. Реакційну суміш концентрують та співвипарювання з етанолом дає коричневий твердий продукт. Залишок очищають флеш-хроматографією (гептан/етилацетат, 2:1етилацетат), а далі твердий продукт промивають діетилетером та гексаном, отримуючи названу сполуку (160мг, 2,7%). 1 Н ЯМР (ДMCO-d6): d 13,86 (s, 1Н), 8,21 (s, 1Н), 4,34 (d, 2Н, J 7,1Гц), 3,89 (s, ЗН), 2,40 (m, 1H), 0,86 (d, 6H, J 7,1Гц). 1З С ЯМР (ДMCO-d6): d 174,68, 153,33, 148,41, 141,73, 109,92, 52,83, 37,17, 25,77, 19,92. Приклад 14: 3-(2-Тетрагідрофурил-метил)-2-тіоксантин a) 6-Аміно-1-(2-тетрагідрофурил-метил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он 2-Тетрагідрофурил-метил-тіосечовину (1,0г, 6,2ммоль) та етилціаноацетат (0,85г, 7,5ммоль) додають до розчину натрій етоксиду [свіжо-зробленого з натрію (0,16г, 6,9ммоль) та абсолютного етанолу (4мл)]. Утворену суміш гріють при температурі кипіння під зворотним холодильником протягом 3,5 годин. Після охолодження до кімнатної температури, розчинник випарюють під зменшеним тиском та утворений в'язкий сироп знов розчиняють у воді (30мл). Цей основний розчин нейтралізують 2Μ гідрохлоридною кислотою. Утворений осад збирають фільтруванням та твердий продукт промивають водою. Сирий продукт (1,3г, 90%) застосовують без подальшої очистки. 1 Н ЯМР (ДMCO-d6): d 11,9 (s, 1H), 6,79 (s, 2H), 4,91 (s, 1H), 4,62-4,65 (m, 1H), 4,21-4,31 (m, 3Н), 3,81-3,87 (m, 1H), 3,63-3,68 (m, 1H), 1,77-2,01 (m, 3Н), 1,57-1,65 (m, 1H). МС (ЕР) m/z 228 (M+1). b) 6-Аміно-1-(2-тетрагідрофурил-метил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он 6-Аміно-1-(2-тетрагідрофурил-метил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,3г, 5,6ммоль) суспендують у 10% водній оцтовій кислоті (25мл). Натрій нітрит (0,43г, 6,2ммоль) додають та суміш гріють при 75 9С протягом 1 години. Пурпурний твердий продукт збирають фільтруванням, промивають та сушать, отримуючи названий продукт (1,3г, 90%). 1 Н ЯМР: d 13,3 (br s, 1H), 12,8 (br s, 1H), 8,93 (br s, 1H), 4,57 (br s, 1H), 4,45 (br s, 1H), 4,18-4,24 (m, 1Н), 3,74-3,79 (m, 1Н), 3,59-3,64 (m, 1Н), 1,86-2,01 (m, 2Н), 1,74-1,82 (m, 1Н), 1,59-1,67 (m, 1Н). c) 5,6-Діаміно-1-(2-тетрагідрофурил-метил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он 6-Аміно-1-(2-тетрагідрофурил-метил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,3г, 5,1ммоль) розчиняють у 32% водному аміаку (15мл) та додають воду (15мл). Червоний розчин гріють при 70°С і додають малими порціями натрій дитіоніт (2,2г, 13ммоль). Нагрівання продовжують ще 15 хвилин та тоді жовтий розчин перемішують при температурі довкілля протягом 1 години. Розчин нейтралізують 2Μ гідрохлоридною кислотою, жовтий осад збирають фільтруванням, промивають водою та сушать, отримуючи названий продукт (0,90г, 73%). Цей матеріал застосовують на наступному етапі без подальшої очистки. 1 Н ЯМР (ДMCO-d6): d 5,96 (s, 2 Η), 4,74 (brd, 1H), 4,35 (brs, 1H), 4,21-4,28 (m, 1H), 3,84-3,89 (m, 1Η), 3,643,69 (m, 1Η), 3,49 (br s, 2H), 1,78-2,01 (m, 4H), 1,60-1,67 (1H). MC (EP) m/z 243 (M+1). d) 3-(2-Тетрагідрофурил-метил)-2-тіоксантин 5,6-Діаміно-1-(2-тетрагідрофурил-метил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,25г, 1,0ммоль) розчиняють у мурашиній кислоті (1мл) та гріють при 70°С протягом 0,5 години. Після кількох хвилин у розчині утворюється рожевий твердий продукт. Надлишок мурашиної кислоти випарюють та утворений твердий продукт розчиняють у 10% розчині натрій гідроксиду (4мл). Цей розчин гріють при 70°С протягом 40 хвилин, тоді нейтралізують 2Μ гідрохлоридною кислотою. Утворений осад збирають фільтруванням, промивають водою та сушать, отримуючи чистий продукт (0,23г, 87%). 1 Н ЯМР (ДMCO-d6): d 13,8 (brs, 1H), 12,4 (brs, 1H), 8,16 (s, 1H), 4,53461 (m, 2H),4,38-4,44 (m, 1H), 3,793,84 (m, 1H), 3,58-3,63 (m, 1H), 1,72-1,98 (m, 4H). 13 С ЯМР (ДMCO-d6): d 173,65, 152,68, 149,90, 141,41, 110,96, 52,97, 35,31, 30,09, 25,88, 25,32. MC (EP) m/z 253 (M+1). Приклад 15 3-[2-Метокси-етил)-2-тіоксантин a) 6-аміно-1-(2-метокси-етил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 14 (а), але застосовуючи (2-метокси-етил)тіосечовину (1,5г, 11ммоль), отримуючи названу сполуку як білий твердий продукт (2,1г, 93%). 1 Н ЯМР (ДMCO-d6): d 11,9 (s, 1Н), 6,82 (s, 2Н), 4,89 (s, 1Н), 4,53 (br. s, 2Н), 3,62 (t, 2H,J 5,9Гц), 3,29 (s, 3H). MC (EP) m/z 202 (M+1). b) 6-Аміно-1-(2-метокси-етил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-Піримідин-4-он 6-Аміно-1-(2-метокси-етил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,0г, 5,0ммоль) суспендують у 10% оцтовій кислоті (20мл). Натрій нітрит (0,38г, 5,5ммоль) додають та утворену суміш гріють при 75°С протягом 1 години. Реакційна суміш стає спершу рожевою, а тоді пурпурною. Воду (20мл) додають та реакційну суміш тримають у холодильнику протягом ночі. Пурпурний твердий продукт збирають фільтруванням та промивають водою, отримуючи названу сполуку (0,42г, 37%). Другу партію продукту (0,22г, 19%) отримують зменшенням об'єму пурпурного фільтрату. Сирий продукт застосовують на наступному етапі без подальшої очистки. 1 Н ЯМР (ДMCO-d6): d 13,4 (brs, 1H), 12,8 (brs, 1H), 9,06 (brs, 1H), 4,54 (brs, 2H), 3,60 (t, 2H, J 5,8Гц), 3,24 (s, 3Н). c) 5,6-Діаміно-1-(2-метокси-етил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 14 (с), але застосовуючи 6-аміно-1-(2метокси-етил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,42г, 1,8ммоль), отримуючи названу сполуку як жовтий твердий продукт (0,28г, 68%). 1 Н ЯМР (ДMCO-d6): d 11,9 (br s, 1Н), 5,94 (s, 2 Η), 4,58 (br s, 2H), 3,64 (t, 2H, J 5,6Гц), 3,47 (brs, 2H), 3,28 (s, 3Н). MC (EP) m/z 217 (M+1). d) 3-(2-Метокси-етил)-2-тіоксантин 5,6-Діаміно-1-(2-метокси-етил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,27г, 1,3ммоль) суспендують у мурашиній кислоті (2мл) та цей розчин гріють при 90°С протягом 1,5 годин. Надлишок мурашиної кислоти випарюють під зменшеним тиском. 10% розчин натрій гідроксиду (5мл) додають до оранжевого твердого продукту та утворений розчин гріють при 90°С протягом 2 годин. Реакційну суміш нейтралізують розбавленою оцтовою кислотою. Утворений розчин тримають у холодильнику протягом кількох діб, тоді оранжеві кристали голчатого типу, що утворилися, збирають фільтруванням та промивають водою. Вихід: (0,11г, 40 %). 1 Н ЯМР (ДMCO-d6): d 13,8 (br. s, 1Н), 12,5 (br. s, 1H), 8,16 (s, 1H), 4,65 (t, 2H, J 6,4Гц), 3,73 (t, 2H, J 6,4Гц), 3,28 (s, 3Н). 13 C ЯМР (ДMCO-d6): d 172,14, 151,06, 148,02, 139,85, 109,20, 66,04, 56,65, 44,72. MC (EP) m/z 227 (M+1) Приклад 16 3-(3-(1-Морфолініл)-пропіл)-2-тіоксантин а) 6-Аміно-1-[3-(1-морфолініл)-пропіл)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 14 (а), але застосовуючи 1-(3-(1морфолініл)-пропіл)-2-тіосечовину (1,1г, 5,3ммоль), отримуючи названу сполуку як білий твердий продукт (1,2г, 87%). 1 Н ЯМР (ДMCO-d6): d 11,8 (s, 1H), 7,24 (s, 2H), 4,84 (s, 1H), 4,33 (br s, 2H), 3,55-3,57 (m, 4H), 2,30-2,36 (m, 6H), 1,82-1,89 (m, 2H). MC (EP) m/z 271 (M+1). c) 5,6-Діаміно-1-(3-(1-морфолініл)-пропіл)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он 6-Аміно-1-[3-(1-морфолініл)-пропіл)-2-тіоксо-2,3-дигідро-1Н-піримщин-4-он 2,1ммоль) розчиняють у 10% оцтовій кислоті (10мл). Натрій нітрит (0,16г, 2,3ммоль) додають та кашку перемішують при температурі довкілля. Після 2 годин ще є залишок вихідного матеріалу. Ще додають натрій нітрит (0,32г, 4,6ммоль) та розчин перемішують протягом ночі. Осад збирають фільтруванням та промивають водою. Цей надзвичайно нерозчинний твердий продукт відновлюють без аналізу. Твердий продукт розчиняють у 32% водному аміаку (6мл) та тоді додають воду (6мл). Утворений червоний розчин гріють при 70°С та додають малими порціями натрій дитіоніт (0,91г, 5,2ммоль). Тоді розчин перемішують при 70°С протягом 1,5 годин. Ще додають натрій дитіоніт (0,91г, 5,2ммоль) та розчин перемішують при 70°С ще 2,5 годин. Нейтральний розчин фільтрують для видалення нерозчинного продукту. Фільтрат концентрують та утворений жовтий твердий продукт суспендують у воді. Твердий продукт збирають фільтруванням, промивають водою та сушать, отримуючи названий продукт (0,068г, 11%). 1 Н ЯМР: d 12,0 (brs, 1Н), 6,48 (s, 2Η), 3,59 (m, 4H), 2,30-2,45 (m, 6H), 1,88-1,91 (m, 2H), MC (EP) m/z 286 (M+1). d) 3-(3-(1-морфолініл)-пропіл)-2-тіоксантин 5,6-Діаміно-1-(3-(1-морфолініл)-пропіл)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,068г, 0,24ммоль) розчиняють у мурашиній кислоті (0,4мл) та перемішують при температурі довкілля протягом 1 години. Надлишок мурашиної кислоти випарюють та додають 10% розчин натрій гідроксиду (1,5мл) і жовтий розчин гріють при 70°С протягом 40 хвилин. Охолоджений розчин нейтралізують 2Μ гідрохлоридною кислотою та тримають у холодильнику протягом кількох годин. Осад збирають фільтруванням, промивають водою та сушать, отримуючи названу сполуку як білуватий твердий продукт (0,025г, 36%). 1 Н ЯМР (ДMCO-d6): d 13,7 (br. s, 1H), 12,4 (s, 1H), 8,17 (s, 1H), 4,53 (t, 2H, 77,5Гц), 3,52 (m, 4H), 2,31-2,46 (m, 6H), 1,91-1,99 (m, 2H). 13 C ЯМР (ДMCO-d6): d 173,68, 152,99, 149,82, 141,75, 111,24, 66,39, 55,70, 53,43, 46,58, 23,35. MC (EP) m/z 296 (M+1). Приклад 17 3-(2-Фурил-метил)- 2-тіоксантин. а) 6-Аміно-1-(2-фурил-метил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 14 (а) за винятком того, що час реакції зменшують до 1,5 годин та продукт осаджують розбавленою оцтовою кислотою. Застосовуючи 2-фурилметилтіосечовину (1,0г, 6,4ммоль), отримують названий продукт (0,95г, 66%). 1 Н ЯМР (ДMCO-d6): d 11,8 (br s, 1Н), 7,58-7,62 (m, 1Н), 7,05 (br s, 2H), 6,38-6,42 (m, 1H), 6,31-6,36 (m, 1H), 5,68 (brs, 2H), 4,85 (s, 1H). MC (EP) m/z 224 (M+1). b) 6-Аміно-1-[2-фурил-метил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 14 (b) за винятком того, що реакційну суміш спочатку гріють при 60°С протягом 1 години та тоді перемішують при температурі довкілля протягом 1 години. Продукт (0,25г, 60%) отримують як коричневий твердий, коли застосовують 6-аміно-1-(2фурилметил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,37г, 1,6ммоль) та 2 еквіваленти натрій нітриту (0,23г, 3,3ммоль). 1 Н ЯМР: d 12,1 (br s, 1Н), 7,54-7,57 (m, 1H), 7,45-7,47 (m, 1H), 6,37-6,40 (m, 1H), 6,32-6,38 (m, 1Н), 6,306,32 (m, 1H), 5,62 (s, 2H), 5,48 (s, 2H). c) 5,6-Діаміно-1-(2-фурил-метил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку (0,12г, 52%) отримують загальним способом з прикладу 14 (с), починаючи з 6-аміно-1(2-фурил-метил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-ону (0,25г, 0,99ммоль) та застосовують без очистки на наступному етапі. 1 Н ЯМР (ДMCO-d6): d 12,5 (brs, 1H), 12,2 (s, 1H), 7,58-7,60 (m, 1H), 7,55-7,57 (m, 1H), 6,38-6,41 (m, 2Н), 6,34-6,37 (m, 1Η), 6,30 (br s, 2H), 5,77 (s, 2H), 5,63 (s, 2H). MC (EP) m/z 239 (M+1). d) 3-(2-Фурил-метил)-2-тіоксантин 5,6-Діаміно-1-(2-фурил-метил)-2-тіоксо-2,3-дигідро-1Н-піримідин (0,12г, 0,51ммоль) у мурашиній кислоті (0,5мл) перемішують при температурі довкілля протягом 0,5 години. Надлишок мурашиної кислоти випарюють та утворений твердий продукт розчиняють у 10% розчині натрій гідроксиду (3мл). Цей розчин гріють при 70°С протягом 0,5 години. Реакційну суміш нейтралізують 2Μ гідрохлоридною кислотою. Утворений осад збирають фільтруванням, промивають водою та сушать. Вихід: (0,047г, 37%). 1 Н ЯМР (ДMCO-d6): d 13,9 (s, 1H), 12,5 (s, 1H), 8,18 (s, 1H), 7,55-7,57 (m, 1H), 6,36-6,39 (m, 2H), 5,69 (s, 2H). 13 С ЯМР (ДMCO-d6): d 174,14, 152,85, 149,56, 149,33, 142,77, 141,80, 110,93, 109,40, 44,26. MC (EP) m/z 249 (M+1). Приклад 18 3-(4-Метоксибензил)-2-тіоксантин а) 6-Аміно-1-(4-метоксибензил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом прикладу 14 (а) за винятком того, що реакцію проводять протягом 2,5 годин при температурі кипіння під зворотним холодильником, а далі протягом 16 годин при температурі довкілля та для осадження продукту застосовують розбавлену оцтову кислоту. Починаючи з (4-метоксибензил)-тіосечовини (1,0 3, 5,1ммоль), отримують потрібний продукт. (1,2г, 92%). 1 Н ЯМР (CD3OD): d 7,19 (d, 2Н, J 8,6Гц), 6,89 (d, 2Н, J 8,6Гц), 5,72 (br s, 2H), 5,06 (s, 1H), 3,77 (s, 3Н). MC (EP) m/z 264 (M+1). b) 6-Аміно-1-(4-метоксибензил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом прикладу 14 (b), але протягом 2,5 годин реакції. Застосовуючи 6-аміно-1-(4-метоксибензил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,2г, 4,7ммоль) отримують блакитно-зелений твердий продукт (1,2г, 88%), що застосовують у наступній реакції без подальшої очистки. 1 Н ЯМР (ДMCO-d6): d 11,9 (s, 1Н), 7,18-7,12 (m, 2Н), 6,95-6,83 (m, 2Н), 5,58 (brs, 2Н), 3,70 (s, 3Н). c) 5,6-Діаміно-1-(4-метоксибензил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом прикладу 14 (с) за винятком того, що розбавлену оцтову кислоту застосовують для нейтралізації реакційної суміші. Потрібний продукт (0,83г, 73%) отримують як жовтий твердий, починаючи з 6-аміно-1-(4-метоксибензил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Нпіримідин-4-ону (1,2г, 4,1ммоль). 1 Н ЯМР (ДMCO-d6): d 11,7 (brs, 2H), 7,20-7,12 (m, 2H), 6,92,6,85 (m, 2H), 6,06 (s, 2H), 5,73 (brs, 2H), 3,71 (s, 3Н). MC (EP) m/z 279 (M+1). d) 3-(4-Метоксибензил)-2-тіоксантин 5,6-Діаміно-1-(4-метоксибензил)-2-тіоксо-2,3-дигідро-1Н-піримідин4-он (0,83г, 3,0ммоль) розчиняють у мурашиній кислоті (3,0мл) та утворений розчин гріють при 100°С протягом 1 години. Надлишок мурашиної кислоти видаляють під зменшеним тиском та залишок розчиняють у 10% розчині калій гідроксиду (8мл) та гріють при 100°С протягом 15 хвилин. Реакційну суміш нейтралізують 10% оцтовою кислотою та утворений осад збирають фільтруванням. Осад перекристалізовують з суміші етанол:диметилформамід та виділені кристали розчиняють у 1Μ розчині калій гідроксиду, осаджують нейтралізацією 10% оцтовою кислотою та збирають фільтруванням. Після сушки отримують названу сполуку (0,14г, 16%). 1 Н ЯМР (ДMCO-d6): d 13,9 (brs, 1H), 12,5 (s, 1H), 8,15 (s, 1H), 7,36 (d, 2H, J 8,6Гц), 6,84 (d, 2H, J 8,9Гц), 5,63 (s, 2H), 3,70 (s, 3Н). 13 C ЯМР (ДMCO-d6): d 173,85, 158,52, 152,45, 149,36, 141,41, 129,35, 127,97, 113,58, 110,83, 55,01, 49,63. MC (EP) m/z 289 (M+1). Приклад 19 3-(4-Флуорбензил)-2-тіоксантин а) 6-Аміно-1-(4-флуорбензил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он; Названу сполуку отримують загальним способом прикладу 14 (а) за винятком того, що час реакції 16 годин, а осаджують продукт обробкою розбавленою оцтовою кислотою. (4-Флуорбензил)-тіосечовина (1,0г, 5,4ммоль) дає білий твердий продукт (1,2г, 86%). 1 Н ЯМР (ДMCO-d6): d 11,9 (brs, 1H), 7,27-7,11 (m, 4H), 6,91 (s, 2H), 5,67 (brs, 2H), 4,89 (s, 1H). MC (EP) m/z 252 (M+1). b) 6-Аміно-1-[4-флуорбензил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом прикладу 14 (b) за винятком збільшення часу реакції до 8 годин. 6-Аміно-1-(4-флуорбензил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,2г, 4,7ммоль) представляє потрібний продукт (0,88г, 67%). 1 Н ЯМР (ДMCO-d6): d 13,1 (brs, 1H), 12,8 (br s, 1H), 7,33-7,08 (m, 2H), 7,13 (t, 2H, J 8,7Гц), 5,62 (brs, 2H). c) 5,6-Діаміно-1-(4-флуорбензил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 14 (с), за винятком того, що реакцію проводять при 75°С протягом 1 години, а далі 20 хвилин при температурі довкілля та нейтралізують реакційну суміш розбавленою оцтовою кислотою. Застосування 6-аміно-1-(4-флуорбензил)-5-нітрозо-2-тіоксо-2,3-дигідро-1Н-піримідин-4-ону (0,88г, 3,1ммоль) дає потрібний продукт (0,55г, 66%). 1 Н ЯМР (ДMCO-d6): d 12,1 (brs, 2H), 7,29-7,12 (m, 4H), 6,08 (s, 2H), 5,75 (brs, 2H). MC (EP) m/z 267 (M+1). d) 3-(4-Флуор-бензил)-2-тіоксантин Названу сполуку отримують загальним способом з прикладу 18 (d), але застосовуючи 5,6-діаміно-1-(4флуорбензил)-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,55г, 2,1ммоль), отримуючи потрібний продукт (0,24г, 41%). 1 Н ЯМР (ДMCO-d6): d 13,9 (br s, 1Н), 12,5 (s, 1H), 8,15 (s, 1H), 7,44 (dd, 2H,J 8,6, 8,6Гц), 7,12 (t, 2H, J 8,9Гц), 5,68 (s, 2H). 13 C ЯМР (ДMCO-d6): d 173,96, 160,14, 152,48, 149,28, 141,44, 132,19, 129,83 (d, J 8,0Гц), 115,00 (d, J 22Гц), 110,82, 49,49. MC (EP) m/z 277 (M+1). Приклад 20 3-Фенетил-2-тіоксантин. a) 6-Аміно-1-Фенетил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом прикладу 14 (а) протягом часу реакції 3,5 годин при температурі кипіння під зворотним холодильником, а далі реакцією при температурі довкілля протягом 16 годин. Продукт осаджують обробкою розбавленою оцтовою кислотою. Фенетилтіосечовина (1,0г, 5,6ммоль) дає білий твердий продукт (1,3г, 95 %). 1 Н ЯМР (ДMCO-d6): d 11,8 (brs, 1Н), 7,37 (d, 2Н, J=7,1Гц), 7,31 (t, 2H, J1A Гц), 7,22 (t, 1Н, J=7,2Гц), 7,08 (brs, 2H), 4,88 (s, 2H), 4,52 (brs, 1H), 3,32 (brs, 1H), 2,92 (t, 2H, J 8,3Гц). MC (EP) m/z 248 (M+1). b) 6-Аміно-5-нітрозо-1-фенетил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом прикладу 14 (b) за винятком збільшення часу реакції до 1,5 годин. 6-Аміно-1-фенетил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,3г, 5,3ммоль) представляє потрібний продукт (1,3г, 92 %). 1 Н ЯМР (ДMCO-d6): d 13,5 (br s, 1Н), 12,8 (br s, 1H), 9,34 (br s, 1H), 7,37-7,28 (m, 4H), 7,25-7,20 (m, 1H), 4,55 (br s, 2H), 2,90 (t, 2H, J 8,4Гц). с) 5,6-Діаміно-1-фенетил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он Названу сполуку отримують загальним способом з прикладу 14 (с) за винятком того, що реакцію проводять при 75°С протягом 15 хвилин, а далі 1 годину та 20 хвилин при температурі довкілля та нейтралізують реакційну суміш розбавленою оцтовою кислотою. Застосовуючи 6-аміно-5-нітрозо-1фенетил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (1,3г, 4,8ммоль), виділяють потрібний продукт (1,1г, 88 %). 1 Н ЯМР (ДMCO-d6): d 10,1 (brs, 2H), 7,46-7,16 (m, 5H), 6,25 (s, 2H), 4,56 (br s, 2H), 2,94 (t, 2Н, J 8,3Гц). MC (EP) m/z 263 (M+1). d) 3-Фенетил-2-тіоксантин Названу сполуку отримують загальним способом з прикладу 18 (d) за винятком того, що нейтралізують 1Μ гідрохлоридною кислотою. Застосовуючи 5,6-діаміно-1-фенетил-2-тіоксо-2,3-дигідро-1Н-піримідин-4-он (0,55г, 2,1ммоль) отримують потрібний продукт (0,39г, 34%). 1 Н ЯМР (ДMCO-d6): d 7,53 (s, 1Н), 7,32 (d, 4Н, J 4,5Гц), 7,22 (m, 1H), 4,63 (m, 2H), 3,01 (m, 2H), 1,88 (brs, 2H). 13 C ЯМР (ДMCO-d6): d 170,56, 155,20, 150,51, 146,41, 138,54, 128,58, 128,46, 126,34, 117,49, 48,82, 32,59. MC (EP) m/z 273 (M+1). Приклад 21 Енантіомери 3-(2-тетрагідрофурил-метил)-2-тіоксантину Розчин рацемічного 3-(2-тетрагідрофурил-метил)-2-тіоксантину (3мг/мл) розділяють за допомогою хіральної ВЕРХ на колонці Chiralpak AD-RH (4,6´150мм; 5мкм). Рухомою фазою є метанол: оцтова кислота: триетиламін (100:0,1:0,1), а швидкість потоку 1мл/хвил. Уведений об'єм 20мкл. Енантіомер 1 е.н. 93,6%; МС (ЕР) m/z 253 (М+1). Енантіомер 2 е.н. 97,3%; МС (ЕР) m/z 253 (М+1). Приклад 22 3-н-бутил-2-тіоксантин Названу сполуку отримують, застосовуючи процедуру, описану у прикладі 6. 1 Н ЯМР (ДMCO-d6): d 13,82 (s, 1H), 12,40 (s, 1H), 8,15 (s, 1H), 4,45 (m, 2H), 1,73 (m, 2H), 1,34 (секстет, 2Н, J=7,5), 0,92 (t, 3Н, J=7,5). 13 С ЯМР (ДMCO-d6): d 173,31, 152,62, 149,30, 141,47, 110,84, 47,37, 28,61, 19,48, 13,72. МС (ЕР) m/z 225 (М+1). Випробування Способи визначення інгібіторної активності МРО розкрито у співподаній патентній заявці [WO 02/090575]. Фармакологічну активність сполук згідно з винаходом досліджують так: Буфер для аналізу: 20мМ натрій/калій фосфатний буфер рН 6,5, що містить 10мМ таурин та 100мМ NaCI. Реагент для розвинення: 2мМ 3,3',5,S'-тетраметилбензидин (ТМВ), 200мкМ КІ, 200мМ ацетатний буфер рН 5,4 20% ДМФ. До 10мкл розбавлених сполук у буфері для аналізу, додають протягом 10 хвилин при кімнатній температурі 40мкл МРО людини (кінцева концентрація 2,5нМ). Тоді 50мкл пероксиду гідрогену (кінцева концентрація 100мкМ), або буфер для аналізу поодинці як контроль, додають протягом 10 хвилин при кімнатній температурі. Реакцію зупиняють додаванням 10мкл 0,2мкг/мл каталази (кінцева концентрація 18нг/мл) протягом 5 хвилин перед додаванням 100мкл ТМВ реагенту для розвинення (2мМ ТМВ у 200мМ ацетатному буфері з рН 5,4, що містить 20% диметилформаміду (ДМФ) та 200мкМ КІ). Планшети перемішують та кількість окисненого 3,3',5,5'-тетраметилбензидину тоді вимірюють після приблизно 5 хвилин, застосовуючи абсорбційну спектроскопію при приблизно 650нм. Величини IK50 тоді визначають, застосовуючи стандартні процедури. При тестуванні у вищенаведеному дослідженні сполуки прикладів 1-22 дають величини IK50 менше 60мкМ, показуючи, що вони, як очікують, показують корисну терапевтичну активність. Представлені результати показані у наступній таблиці: Сполука Приклад 6 Приклад 10 Приклад 14 Приклад 15 Приклад 16 Приклад 17 Приклад 18 Інгібування МРО (IK50 мкМ) 0,87 0,53 0,51 0,44 2,94 7,57 0,49 Приклад 20 0,96
ДивитисяДодаткова інформація
Назва патенту англійськоюThioxanthine derivatives, process for their preparation (variants), their use and composition containing them
Автори англійськоюTiden Anna-Karin
Назва патенту російськоюПроизводные тиоксантина, способ их получения (варианты), их применение и содержащая их фармацевтическая композиция
Автори російськоюТиден Анна-Карин
МПК / Мітки
МПК: A61P 1/02, A61P 25/00, A61P 29/00, A61K 31/5377, A61P 35/00, A61P 1/04, A61P 11/06, A61K 31/52, C07D 473/22, A61P 19/02, A61P 25/28, A61P 17/02, A61P 27/16, C07D 473/38, C07D 473/20, A61P 1/16, A61P 17/06, A61P 25/16, A61P 13/00, A61K 31/522
Мітки: композиція, похідні, спосіб, містить, варіанти, отримання, застосування, тіоксантину, фармацевтична
Код посилання
<a href="https://ua.patents.su/14-78986-pokhidni-tioksantinu-sposib-kh-otrimannya-varianti-kh-zastosuvannya-ta-farmacevtichna-kompoziciya-shho-mistit-kh.html" target="_blank" rel="follow" title="База патентів України">Похідні тіоксантину, спосіб їх отримання (варіанти), їх застосування та фармацевтична композиція, що містить їх</a>
Попередній патент: Підбирач-навантажувач соломи і сіна
Наступний патент: Азаспіросполуки для лікування болів
Випадковий патент: Опалювальний прилад


















