Похідні оксазолідинонкарбонової кислоти, спосіб їх одержання, фармацевтична композиція і спосіб її одержання
Номер патенту: 35607
Опубліковано: 16.04.2001
Автори: Ганте Йоахім, Бернотат-Данієловскі Сабіне, Мельцер Гвідо, Юрасцук Хорст, Вурціге Ханнс
Формула / Реферат
1. Производные оксазолидинонкарбоновой кислоты формулы (I):
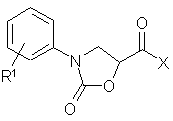 ,
,
где:
R1 обозначает NО2, NR6R7, CN, CONR6R7, CSNR6R7, C(=NH)NHOH, C(=NH)SA, C(=NH)OA, C(=NH)SAr, C(=NH)NRбR7, CH2NR6R7, CH2NCH(=NH)NR6R7, NHC(=NH)NR6R7, CH2NHCO-aлк-NR6R7, CH2NHCO-Ph-E, CH2NHCO-Ph-CH2-NR6R7, CH2NHCONH-Ph-E или D,
X обозначает ОН, OA, AS, AS-AS', 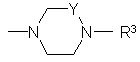 или
или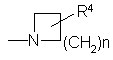
D обозначает 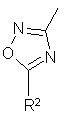 ,
,
E обозначает CN, C(=NH)OA, CSNH2, C(=NH)SA или С(=NН)NН2,
Y обозначает CH2, CHOR5 или С=O,
R2 обозначает H, А, Аг, ОН, OA, СF, ССl3, NR6R7, -алк-NR6R7, -aлк(CH2Ar)NR6R7,
R3 обозначает -(CH2)m -COOR5,
R4 обозначает -(CH2)p-COOR5 или -(CH2)q-O-(CH2)r-COOR5,
AS или AS', каждый независимо друг от друга, обозначают аминокислотный остаток, выбираемый из группы, состоящей из Ala, β-Ala, Arg, Asn, Asp, Gln, Glu, Gly, Sar, Leu, Lys, Orn, Phe, Pro, Ser, Thr, Tyr, Tyr(OMe), Val, С-аллил-Gly, С-пропаргил-Gly, N-бензил-Gly, М-фенетил-СІу, N-бензил-β-Аlа, N-метил-β-Ala и N-фенетил-β-Аlа, причем свободные амино и карбоксильные группы также могут содержать обычные защитные группы,
R5, R6 и R7, каждый независимо друг от друга обозначают водород или А,
"m" обозначает 1,2 или 3;
"n" обозначает 1,2,3 или 4;
"р" обозначает 0,1 или 2;
"q" обозначает 0 или 1;
"r" обозначает 1 или 2;
А обозначает алкил с 1-6 С-атомами;
-алк- обозначает алкилен с 1-6 С-атомами,
Аr обозначает фенил или бензил, и
Ph обозначает фенилен,
а также их физиологически приемлемые соли и/или сольваты.
2. Энантиомеры или диастереомеры соединений формулы (I) по п. 1.
3. Соединения формулы (I) по п. 1, в которых свободные амино-, амидино- или гуанидино-группы частично или полностью защищены обычными для амино-функции защитными группами.
4. Производные оксазолидинонкарбоновой кислоты по п.1, представляющие собой:
(а) 2-[1-{3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбонил} пиперидин-4-ил-окси]уксусная кислота;
(б) (2R)-2-[3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбониламино]-янтарная кислота;
(в) 3-[3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбониламино]пропионовая кислота;
(г) трет-бутиловый эфир 1-[3-(4-амидинофенил)-2-оксо-5-оксазолидинил-карбонил]пиперидин-4-карбоновой кислоты;
(д) ди-трет-бутиловый эфир (2R)-2-[3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбониламино]янтарной кислоты;
(е) трет-бутиловый эфир 1-[3-(4-(5-оксо-1, 2, 4-оксадиазолин-3-ил)-фенил)-2-оксо-5-оксозолидинил]-пиперидин-4-карбоновой кислоты;
(ж) 3-[4-(амино(гидроксиимино)метил)-фенил]-2-оксо-5-оксазолидинкарбоновая кислота;
(з) (2R)-2-[3-(4-цианофенил)-2-оксо-5-оксазолидинилкарбониламино]-3-фенилпропионовая кислота;
(й) 3-[3-(4-(5-оксо-1,2,4-оксазолидин-3-ил)-фенил)-2-оксо-5-оксазолидинил-карбониламино]пропионовая кислота.
5. Производные оксазолидинонкарбоновой кислоты формулы (I) по пп. 1-4, применяемые в качестве антагонистов рецепторов адгезии.
6. Способ получения соединений формулы (I) по п. 1, отличающийся тем, что
а) соединение формулы (1) высвобождают из одного из его функциональных производных путем обработки сольволизирующим или гидрогенолизирующим средством; или
б) соединение формулы (II):
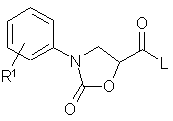 , (II)
, (II)
где;
R1 имеет указанное значение и
L обозначает С1, Вr, ОА, ОН или реакционноспособную этерифицированную до сложноэфирной ОН-группу, соответственно, легко нуклеофильно замещаемую уходящую группу;
вводят во взаимодействие с соединением формулы (III):
Н-Х', (III)
где:
X' обозначает AS, AS-AS',  или
или  ,
,
причем Y, R3, R4 и n имеют указанные значения; или
в) остаток Х превращают в другой остаток Х тем, что омыляют сложный эфир формулы (I) или этерифицируют до сложного эфира карбоновую кислоту формулы (I);
или
г) остаток R1 превращают в другой остаток R1 тем, что
- каталитически гидрируют NO2 и/или CN-группу; или
- нитрильную группу путем введения во взаимодействие с аммиаком превращают в C(=NH)-NH2-группу; или
- нитрильную группу превращают в тиокарбамоильную группу; или
- тиокарбамоильную группу переводят в алкилсульфимидогруппу;
или
- карбамоильную группу переводят в алкилимидогруппу; или
- метилсульфимидсигруппу переводят в амидиногруппу; или
- нитрильную группу путем введения во взаимодействие с NH2OH превращают в C(=NH)NHOH группу; или
-NH2 группу превращают в гуанидильную группу; или
- C(=NH)NHOH группу превращают в амидиновую группу; или
-CH2NH2 группу превращают в алканоиламинометильную группу, CH2NCH(=NH)NR6R7 группу, CH2NHCO-Ph-C(=NН)NR6R7 группу, CH2NHCO-Ph-CH2-NR6R7 группу или CH2NHCONH-Ph-E группу; или 1,2,4-оксадиазольную, соответственно, 1,2,4-оксадиазолиноновую группу, превращают в амидиновую группу;
д) или соединение формулы (IV):
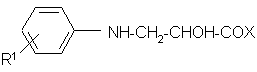 (V)
(V)
где: R1 и Х имеют указанные значения, вводят во взаимодействие с реакционноспособным производным угольной кислоты;
и/или
е) соединение формулы (V):
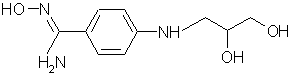 (V)
(V)
вводят во взаимодействие с 2-мя эквивалентами реакционноспособного производного угольной кислоты и затем окисляют;
или
ж) соединение формулы (I) путем обработки кислотой или основанием переводят в одну из его солей.
7. Фармацевтическая композиция, отличающаяся тем, что она содержит поменьшей мере одно соединение формулы (I) по п. 1 и/или одну из его физиологически приемлемых солей в эффективном количестве.
8. Способ получения фармацевтической композиции, отличающийся тем, что соединение формулы (I) по п.1 и/или одну из его физиологически приемлемых солей вместе по меньшей мере с одним твердым, жидким или полужидким носителем или вспомогательным веществом доводят до пригодной формы введения.
Текст
1. Производные оксазолидинонкарбоновой кислоты формулы (I): С2 (54) ПОХІДНІ ОКСАЗОЛІДИНОНКАРБОНОВОЇ КИСЛОТИ, СПОСІБ ЇХ ОДЕРЖАННЯ, ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ І СПОСІБ ЇЇ ОДЕРЖАННЯ 35607 боновой кислоты; (д) ди-трет-бутиловый эфир (2К) - 2 - [3-(4-амидинофенил) - 2 - оксо-5-оксазолидинилкарбониламино]янтарной кислоты; (е) трет-бутиловый эфир 1-[3-(4-(5-оксо-1,2,4-оксадиазолин-3-ил)-фенил)-2-оксо- 5 - оксозолидинил]пиперидин-4-карбоновой кислоты; (ж) 3-[4 - (амино(гидроксиамино)метил)-фенил] - 2оксо-5-оксазолидинкарбоновая кислота; (з) (2R) -2- [3-(4-цианофенил)-2-оксо-5-оксазолидинилкарбониламино]-3-фенилпропионовая кислота; (и) 3-[3-(4- (5-оксо-1,2,4-оксазолидин-3-ил)-фенил)2-оксо- 5-оксазолидинилкарбониламино]пропионовая кислота. 5. Производные оксазолидинонкарбоновой кислоты формулы (I) по пп. 1-4, применяемые в качестве антагонистов рецепторов адгезии. 6. Способ получения соединений формулы (I) по п. 1, отличающийся тем, что: а) соединение формулы (I) высвобождают из одного из его функциональных производных путем обработки сольволизирующим или гидрогенолизирующим средством; или б) соединение формулы (II): модействие с аммиаком превращают в C(=NH)NH2-групу; или - нитрильную группу превращают в тиокарбамоильную группу; или - тиокарбамоильную группу переводят в алкилсульфимидогруппу; или - карбамоильную группу переводят в алкилимидогруппу; или - метилсульфимидоигруппу переводят в амидиногруппу; или - нитрильную группу путем введения во взаимодействие с NH2OH превращают в C(=NH)NHOH группу; или -NH2 группу превращают в гуанидильную группу; или - C(=NH)NHOH группу превращают в амидиновую группу; или -CH2NH2 группу превращают в алканоиламинометильную группу, CH2NCH(=NH)NR6R7 группу, CH2NHCO-Ph-C(=NH)NR6R7 группу, CH2NHCO-PhCH2-NR6R7 группу или CH2NHCONH-Ph-E группу; или 1,2,4-оксадиазольную, соответственно, 1,2,4оксадиазолиноновую группу, превращают в амидиновую группу; д) или соединение формулы (IV): (IV) , где; R1 и Х имеют указанные значения, вводят во взаимодействие с реакционноспособньм проиводным угольной кислоты; и/или е) соединение формулы (V): (II) где: R1 имеет указанное значение и L обозначает С1, Вг, ОА, ОН или реакционноспособную этерифицированную до сложноэфирной ОН-группу, соответственно, легко нуклеофильно замещаемую уходящую группу; вводят во взаимодействие с соединением формулы (III): Н - Х¢ , (III) (V) вводят во взаимодействие с 2-мя эквивалентами реакционноспособного производного угольной кислоты и затем окисляют; или ж) соединение формулы (I) путем обработки кислотой или основанием переводят в одну из его солей. 7. Фармацевтическая композиция, отличающаяся тем, что она содержит, по меньшей мере, одно соединение формулы (I), по п. 1, и/или одну из его физиологически приемлемых солей в эффективном количестве. 8. Способ получения фармацевтической композиции, отличающийся тем, что соединение формулы (I), по п. 1, и/или одну из его физиологически приемлемых солей вместе, по меньшей мере, с одним твердым, жидким или полужидким носителем или вспомогательным веществом доводят до пригодной формы введения. где: X' обозначает AS, AS-AS', или , причем Y, R3, R4 и n имеют указанные значения; или в) остаток Х превращают в другой остаток Х тем, что омыляют сложный эфир формулы (I) или этерифицируют до сложного эфира карбоновую кислоту формулы (I); или г) остаток R1 превращают в другой остаток R1 тем, что: - каталитически гидрируют NO2 и/или CNгруппу; или - нитрильную группу путем введения во взаи 2 35607 " q' " обозначает 0 или 1; " r" обозначает 1 или 2; А обозначает алкил с 1-6 С-атомами; -алк- обозначает алкилен с 1-6 С-атомами; Аr обозначает фенил или бензин; и Ph обозначает фенилен; а также к их физиологически приемлемым солям и/или сольватам. Соединения с подобной активностью известны из европейского патента ЕР-А 1-0 381 033. В основу изобретения положена задача получения новых соединений с ценными свойствами, в особенности таких, которые можно применять для получения лекарственных средств. Эта задача решается, согласно изобретению. Найдено, что соединения формулы (I), а также их сольваты и соли, при хорошей переносимости обладают ценными фармакологическими свойствами. В частности, они подавляют связывание фибриногена, фибронектина и фактора Виллебранда с фибриногенным рецептором тромбоцитов (гликопротеин Пв/Ша), также как связывание тх и других адгезивных протеинов, как витронектин, коллаген и ламинин, с соответствующими рецепторами на поверхности различных типов клеток. Соединения, таким образом, оказывают влияние на активность обмена клетка-клетка и клетка-ма-трица. В особенности они предотвращают появление тромбов и тромбоцитов, и поэтому их мож-но применять для лечения тромбозов, апоплексии, инфаркта сердца, воспалений и артериосклероза. Далее, соединения оказывают воздействие на опухолевые клетки тем, что они подавляют их метастазирование. Таким образом, их можно также использовать в качестве противоопухолевых средств. Далее, соединения пригодны для профилактики и лечения остеолитических заболеваний, в особенности остеопороза и рестеноза после ангиопластии. Далее, они обладают антиангиогенетическими свойствами. Кроме того, соединения обладают антимикробным действием и могут использоваться при лечении и вмешательствах, где нужно предотвратить поражение микробами. Свойства соединений могут быть согласны способам, которые описаны в европейском патенте ЕР-А 1-0 462 960. Подавление связывания фибриногена с фибриногенным рецептором можно доказать, согласно методу, который указан в европейском патенте ЕР-А 1-0 381 033. Подавляющее огрегацию тромбоцитов действие можно обнаружить ин витро по методу Борна (Nature, 4832, 927929, 1962). Подавление взаимодействий рецепторов b 3 - интегрина с пригодными лигандами можно определить по методу J.W.Smith и др., J.Biol. Chem., 265, 12267-12271 (1990). Предметом изобретения являются соединения указанной формулы (I), их соли и сольваты, а также способ получения этих соединений, отличающийся тем, что: а) соединение формулы (I) высвобождает из одного из его функциональных производных путем обработки с помощью сольволизирующего или гидрогенолизирующего средства; или б) соединение формулы (II): Изобретение относится к производным оксазолидинонкарбоновой кислоты формулы (I): , (I) где: R1 обозначает NO2, NR6R7, CN, CONR6R7, CSNR6R7, C(=NH)SA, C(=NH)OA, C(=NH)SAr, C(=NH)NHOH, C(=NH)NR6R7, CH2NR6R7, CH2NHC(=NH)NR6R7, NHC(=NH)NR6R7, CH2NHCO-alk-NR6R7, CH2NHCOPh-E, CH2NHCO-Ph-CH2-NR6R7, CH2NHCONH-Ph-E или D; X обозначает OH, OA, AS, AS-AS', или , D обозначает E обозначает -СN, -C(=NH)OA, -CSNH2, -C(=NH)SA или -C(NH)NH2 Y обозначает CH2, CHOR5 или С=0; R2 обозначает H, A, Ar, OH, OA, CF3, CCl3, 6 7 NR R , -aлк-NR6R'7, -алк(СН2Аг) NR6R7; ; R3 обозначает -(CH2)m-COOR5; R4 обозначает -(CH2)p-COOR5 -(CH2)q-O-(CH2)rCOOR5 ; AS или AS' каждый, независимо друг от друга, обозначают аминокислотный остаток, выбираемый из группы, состоящей из Аlа, b-Ala, Arg, Asn, Asp, Glu, Gly, Leu, Lys, Orn, Phe, Pro, Sar, Ser, Thr, Tyr, Tyr(OMe), Val, С-аллилGly, С-пропаргил-Gly, N-бензил-b-Аlа , N-метил-bAla и N-фенетил-b-Ala, причем свободные аминоили карбоксильные группы также могут содержать сами по себе известные обычные защитные группы; R5, R6 м R7 , каждый, независимо друг от друга, обозначают Н или А; "m" обозначает 1, 2 или 3; "n" обозначает 1, 2, 3 или 4; "р" обозначает 0,1 или 2; 3 35607 водным угольной кислоты; и/или е) соединение формулы (V): , (II) (V) где R1- имеет указанное значение и обозначает С1, Вr , OН или реакционноспособную, этерифицированную до сложноэфирной ОН-группу, соответственно, легко нуклеофильно заметаемую удаляемую группу; вводят во взаимодействие с соединением формулы (III): вводят во взаимодействие с 2-мя эквивалентами реакционноспособного производного угольной кислоты и затем окисляют; или ж) соединение формулы (I) путем обработки с помощью кислоты или основания переводят в одну из его солей. Выше- и нижеуказанные сокращения аминокислотных остатков обозначают остатки следующих аминокислот: Аlа = аланин; b-Аlа = b-аланин; Аwg = аргинин; ASn = аспарагин; ASp = аспарагиновая кислота; ASp(0 Вut) = b-бутиловый эфир аспарагиновой кислоты; Glп = глутамин; Glu = глутаминовая кислота; Glу = глицин; Leu = лейцин; Lys = лизин; Orn = орнитин; Phe = фенилаланин; Рro = пролин; Sar = саркозин (N-метилглицин) ; Ser = серин; Тhr = треонин; Туr = тирозин; Туr(ОМе) = 2-амино3-п-метоксифенил-пропионовая кислота; Val = валин. Далее, указанные ниже сокращения обозначают: ВОС = трет.-бутоксикарбонил; СВZ = бензилоксикарбонил; DСС1 = дициклогексилкарбодиимид; ДМФ = диметилформамид; ЕDС1 = N-этилN' - (3-диметиламинопропил) - карбодиимидгидрохлорид; Еt = этил; Me = метил; ОМе = сложный метиловый эфир; ОЕT = сложный этиловый эфир; ТФК = трифторуксусная кислота. Выше- и нижеуказанные остатки R1 и Х имеют указанное в формуле (I) значение. Если соединение формулы (I) содержит хиральный центр, оно может находиться в нескольких энантиомерных формах. Все эти формы и их смеси, в особенности рацематы, входят в рамки изобретения. В выше- и нижеприведенных формулах группа А содержит 1-6, предпочтительно 1, 2, 3 или 4 Сатома. В особенности, А обозначает предпочтительно метил, этил, пропил, изопропил, бутил, изобутил, втор.-бутил или трет.-бутил; далее, также пентил, 1-, 2- или 3-метилбутил; 1,1-, 1,2- или 2,2-диметилпропил; 1-этилпропил; гексил; 1-, 2или 3-метилпентил. Х предпочтительно обозначает -ОН, -ОСН3, -O-CH2-CH3, 4-карбоксипиперидино-, 4-карбоксиалкилпиперидино-, 4-карбоксиалкоксипиперидиногруппу, а также соответствующие группы сложных алкиловых эфиров указанных остатков; 4-алкоксикарбонилпиперидино-, 4-карбоксиметилпиперазино-, 4-карбоксиэтилпиперазино-группу или, особенно предпочтительно, аминокислотный или дипептидный остаток, который через амидную связь соединен с карбонильной группой. Если Х обозначает аминокислотный или дипептидный остаток, то особенно предпочтительны остатки: Ala, b- Ala, Glу, Аrg, а также b-Ala-ASp, Рhе, N-фенетилглицин, N-фенетил-b-аланин или Sar . С-концевой аминокислотный остаток при этом также может быть связан с обычной защитной группой. Особенно принимают во внимание эте Н - X' , (III) где X' обозначает АS , AS -AS', или , причем Y, R3, R4 и "n" имеют указанные значения; или в) остаток Х превращает в другой остаток Х тем, что сложный эфир формулы (I) омыляют или этерифицируют до сложного эфира карбоновую кислоту формулы (I); или г) остаток R превращают в другой остаток R1, тем, что: - NO2- и/или CN-группу каталитически гидрируют; или - нитро-группу путем взаимодействия с аммиаком превращают в C(=NH)-NH2 -группу; или - нитрильную группу превращают в тиокарбамоильную группу; или - тиокарбамоильную группу переводят в алкилсульфимидо-группу; или - карбамоильную группу переводят в алкилимидо-группу; или - метилсульфимидо-группу переводят в амидиновую группу; или - нитрильную группу, путем взаимодействия с NН2ОН, превращают в С(=NН)- NHOH-группу; или -NН2-группу превращают в гуанидинильную группу; или - С(=NH)- NHOH-группу превращают в амидиновую группу; или - СН2NН2-группу превращают в алканоиламинометильную группу, СН2NHC(= NH)NR6R7-гpyппy, СН2NHCO-Рh-С(=NН)NН2-группу, СН2NHCO-Ph СН2NR6R7-группу или СН2NHCONH-Ph-Е-группу; или - 1,2,4-оксадиазольную группу, соответственно, 1, 2, 4-оксадиазолиновую группу превращают в амидиновую группу; д) или соединение формулы (IV): (IV) где: R1 и Х имеют указанные значения, вводят во взаимодействие с реакционноспособным произ 4 35607 рификацию до сложного эфира. Группа R1 предпочтительно обозначает: -NН2, -С(=NН)-NH2, -СН2-NН2, -СН2- NН-СО-алк-NН2, -СН2-NН-СО-Рh-С(=NН)-NН2, -СН2-NН-СО-алкC(=NН)-NН2, -СН2-NН-CO-Ph-CH2-NH2, NO2 или СN. Далее, R1, кроме того, предпочтительно обозначает -С(=NН)-S-А, -СSNН2, -C(=NH)-NНОН или что их высвобождают из функциональных производных путем сольволиза, в особенности, гидролиза или гидрогенолиза. Предпочтительными исходными веществами для сольволиза, соответственно, гидрогенолиза, являются такие, которые обычно соответствуют формуле (I), однако, вместо одной или нескольких свободных амино- и/или гидроксильных групп, содержат соответствующие защищенные аминои/или гидроксильные группы, предпочтительно такие, которые вместо Н-атома, который связан с Nатомом, содержат защитную для амино-функции группу, в особенности, такие, которые вместо HNгруппы содержат R'-N-группу, где R' обозначает защитную для амино-функции группу и/или такие, которые вместо Н-атома гидроксильной группы содержат защитную для гидроксильной функции группу, например, такие, которые соответствуют формуле (I), однако вместо группы -СООН содержат группу -COOR", где R" обозначает защитную для гидроксильной функции группу. В молекуле исходного вещества также могут присутствовать несколько одинаковых или разных защищенных амино- и/или гидроксильных групп. Если имеющиеся защитные группы отличаются друг от друга, то во многих случаях их можно отщеплять селективно. Выражение "защитная для амино-функции группа" общеизвестно и относится к группам, которые пригодны для защиты (блокирования) амино-группы от химических взаимодействий, которые, однако, легко удаляются после того, как в другом месте молекулы прошла желательная химическая реакция. Типичными для таких групп являются, в особенности незамещенные, или замещенные ацильные, арильные (например, 2,4динитрофенильная (DNP)), аралкоксиметильные (например, бензилоксиметильная (ВОМ)) или аралкильные группы (например, бензил, 4-нитробензил, трифенилметил). Так как защитные для амино-функции группы удаляются после желательной реакции (или последовательности реакций), их род и величина, впрочем, не критические; однако предпочтительны группы с 1-20, в особенности, c 1-8 С-атомами. Выражение "ацильная группа", в связи с настоящим способом, нужно понимать в cамом широком смысле. Оно охватывает производимые от алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфокислот ацильные группы, а также, в особенности, алкоксикарбонильные, арилоксикарбонильные и, прежде всего, аралкоксикарбонильные группы. Примерами такого рода ацильных групп являются: алканоил, как ацетил, пропионил, бутирил; аралканоил, как фенилацетил; ароил, как бензоил или толуил; арилоксиалканоил, как феноксиацетил; алкоксикарбонил, как метоксикарбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, изопропоксикарбонил, трет.-бутоксикарбонил (ВОС), 2-иодэтоксикарбонил; аралкилоксикарбонил, как бензилоксикарбонил (СВZ), 4метоксибензилоксикарбонил, 9-флуоренилметоксикарбонил (FМОС). Предпочтительными защитными для амино-функции группами являются ВОС, DNР и ВОМ, далее, СВZ , бензил и ацетил. Выражение "защитная для гидроксильной функции группа" также общеизвестно и относится . Остаток Аr обозначает незамещенный бензил или фенил. Параметры "m" и "п", предпочтительно, обозначают 1, далее, однако, также предпочтительно 2 или 3. Переменная "р", предпочтительно, обозначает 0 или 1, в то время как "q" и "r", предпочтительно, равны 1. Из соединений формулы (I) предпочтительны такие, в которых, по меньшей мере, один из указанных остатков, групп и/или параметров имеет одно из указанных предпочтительных значений. Некоторые группы предпочтительных соединений представляют собой таковые формулы (Iа)¸(If), которые соответствуют формуле (I), где, однако, в Iа: R1 обозначает С(=NН)NН2 и Х обозначает ОН или ОА; в lв: R1 обозначает C(=NH)NН2 и Х обозначает 4-карбоксипиперидино-, 4-карбоксиалкилпиперидино- или 4-карбоксиалкоксипиперидино-группу; в Iс: R1 обозначает С(=NН)NН2 и Х обозначает b-Ala, ASp , Tyr, Tyr(ОМе), N-фенетил-b-Ala или Рhе, а также соответствующие этерифицированные до сложных эфиров производные; в Id: R1 обозначает С(=NH)NН2 и Х обозначает 4-алкоксикарбонилпиперидино-, 4-алкоксикарбонилпиперазино-, 4-алкоксикарбонилалкилпиперидино-, 4-алкоксикарбонилалкилпиперазино- или 4алкоксикарбонилалкоксипиперидино-группу; в Iе: R1 обозначает С(=NН)NH2 и Х обозначает 4-карбоксипиперазино- или 4-карбоксиалкилпиперазино-группу; в lf: R1- обозначает C(=NH)NНОН и Х обозначает один из указанных в п.п. (la) - (Iе) остатков. Далее, в изобретение входят все те соединения, которые содержат NН2-группу, причем эта NH2-группа, однако, включает, cамo по себе, известную защитную группу. Соединения формулы (I), а также исходные вещества для их получения, впрочем, получают, само по себе, известными способами, которые описаны в литературе (например, в стандартных работах: Губен-Вейл. Методы органической химии. - Изд.: Georg-Thieme, Штутгарт; J.March, Adv. Org. Chem., 3-е изд. (1985), J.Wiley and Sons), a именно, - при реакционных условиях, которые известны и пригодны для указанных взаимодействий. При этом также можно использовать, само по себе, известные, здесь подробнее не упомянутые, варианты. Исходные вещества, если желательно, также можно получать in situ тем, что их не выделяют из реакционной смеси, а тотчас вводят во взаимодействие далее, до получения соединений формулы (I). Соединения формулы (I) можно получать тем, 5 35607 к группам, которые пригодны для защиты гидроксильной группы от химических взаимодействий, которые, однако, легко удаляются после того, как в другом месте молекулы прошла желательная химическая реакция. Типичными для таких групп являются вышеуказанные незамещенные или замещенные арильные, аралкильные или ацильные группы; далее, также алкильные группы. Природа и величина защитных для гидроксильной функции групп не критические, так как после протекания желательной химической реакции или последовательности реакций они снова удаляются; предпочтительны группы с 1-20, в особенности, 1-10 Сатомами. Примерами защитных для гидроксильной функции групп являются, между прочим, трет.бутил, бензил, п-нитробензоил, п-толуолсульфонил и ацетил, причем, особенно предпочтительны, бензил и ацетил. Используемые в качестве исходных веществ функциональные производные соединений формулы (I) можно получать обычными способами, которые, например, описаны в указанных справочных изданиях и заявках на патенты, например, путем взаимодействия соединений, которые соответствуют формулам (II) и (III), причем, однако, по меньшей мере, одно из этих соединений вместо Н-атома содержит защитную группу. Высвобождение соединений формулы (I) из их функциональных производных осуществляют, в зависимости от используемой защитной группы, например, с помощью сильных кислот, целесообразно, с помощью трифторуксусной кислоты или хлорной кислоты, однако, также с помощью других сильных неорганических кислот, как соляная кислота или серная кислота; сильных органических карбоновых кислот, как трихлоруксусная кислота, или сульфокислот, как бензол- или п-толуолсульфокислота. Присутствие дополнительного инертного растворителя возможно, однако, не всегда необходимо. В качестве инертных растворителей, предпочтительно, пригодны органические, например, карбоновые кислоты, как уксусная кислота; простые эфиры, как тетрагидрофуран (ТГФ) или диоксан; амиды, как диметилформамид (ДМФ); галогенированные углеводороды, как дихлорметан; далее, также спирты, как метанол, этанол или изопропанол; а также вода. Далее, принимают во внимание смеси вышеуказанных растворителей. Трифторуксусную кислоту, предпочтительно, применяют в избытке без добавки другого растворителя; хлорную кислоту используют в форме смеси из уксусной кислоты и 70%-ной хлорной кислоты в соотношении 9:1. Температуры реакции расщепления составляют, целесообразно, примерно 0-50°С; предпочтительно работают при температуре в пределах 15-30°С (комнатная температура). ВОС-группу можно отщеплять, например, предпочтительно с помощью 40%-ной трифторуксусной кислоты в дихлорметане или с помощью, примерно 3-5 н НС1 в диоксане при 15-60°С; FMOC-группу можно отщеплять, например, предпочтительно, с помощью примерно 5-20%-ного раствора диметиламина, диэтиламина или пиперидина в ДМФ при 15-50°С. Отщепление DNPгруппы осуществляют, например, также с помощью, примерно 2-10%-ного раствора 2-меркапто этанола в смеси ДМФ с водой при 15-30°С. Гидрогенолитически удаляемые защитные группы (например, ВОМ, СВ или бензил) можно отщеплять, например, путем обработки водородом в присутствии катализатора (например, катализатора на основе благородного металла, как палладий, целесообразно - на носителе, как уголь). В качестве растворителя при этом пригодны вышеуказанные, в особенности, например, спирты, как метанол или этанол, или амиды, как ДМФ. Гидрогенолиз, как правило, осуществляют при температурах 0-100°С и давлениях - примерно 1-200 бар, предпочтительно при 20-30°С и 110 бар. Гидрогенолиз СВZ-группы хорошо протекает, например, в присутствии 5-10%-ного палладия-на-угле в метаноле при 20-30°С. Далее, гидрогенолитическое превращение 1, 2,4-оксадиазолин-5-он-3-ильной группы, соответственно, 5-алкил-1,2,4-оксадиазол-3-ильной группы, в амидиновую группу можно осуществлять, например, путем каталитического гидрирования. Соединения формулы (I) также предпочтительно можно получать путем взаимодействия оксазолидинона формулы (II) с соединением формулы (III). При этом используют, целесообразно, само по себе, известные методы нуклеофильного замещения и/или N-алкилирования аминов, соответственно, реакции, приводящие к получению амидов. Удаляемая группа L в формуле (II) предпочтительно обозначает Сl, Вr или ОН, соответственно, производимую от них удаляемую группу, как, например, трифторметансульфонилокси-, толуолсульфонилокси- или метансульфонилокси-группа. Реакцию предпочтительно осуществляют в присутствии дополнительного основания, например, гидроксида щелочного или щелочноземельного металла или карбоната щелочного или щелочноземельного металла, как гидроксид натрия, калия или кальция, карбонат натрия, калия или кальция, в инертном растворителе, например, в галогенированном углеводороде, как дихлорметан; простом эфире, как ТГФ или диоксан; амиде, как ДМФ или диметилацетамид, нитриле, как ацетонитрил; при температурах от, примерно, -10°С до 200°С, предпочтительно - при 0-120°С. Добавка иодида, например, как иодид калия, может благоприятствовать протеканию реакции. Исходные вещества формулы (II), как правило, известны, или их можно получать по аналогии с известными соединениями. Их получение описано, например, в патенте ФРГ 37 23 797 (европейский патент 300272). Их можно получать, например, путем взаимодействия, соответственно, замещенного анилина с аллилхлоридом, затем превращения двойной связи в диол, введения во взаимодействие с реакционноспособным производным угольной кислоты, как, например, фосген, N,N-карбонилдиимидазол, сложный алкиловый эфир угольной кислоты или дифосген, окисления продукта до 5-оксазолидинонкарбоновой кислоты и, в случае необходимости, дальнейшего активирования за счет дериватизации кислотной группы. В соединении формулы (II) остаток L можно превращать в другой остаток L, например, тем, что ОН-группу (Y=ОН) вводят во взаимодействие с SOCl2, SОВr2, метансульфонилхлоридом или п 6 35607 толуолсульфонилхлoридом. Соединения формулы (III), как правило, известны и выпускаются в продажу. Взаимодействие оксазолидинонов формулы (II) с соединениями формулы (II) осуществляют, само по себе, известным образом, предпочтительно, - в протонном или апротонном полярном инертном растворителе, при температурах от 20°С до температуры кипения растворителя. Времена реакции составляют от 10 минут до 24-х часов, предпочтительно, - 2-10 часов. В качестве растворителя пригодны, в особенности, также спирты, как метанол, этанол, изопропанол, н-бутанол или трет.-бутанол; простые эфиры, как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; простые гликолевые эфиры, как этиленгликольмонометиловый или -моноэтиловый эфир (метилгликоль или этилгликоль), простой этиленгликольдиметиловый эфир (диглим); кетоны, как ацетон или бутанон; нитрилы, как ацетонитрил; нитросоединения, как нитрометан или нитробензол; сложные эфиры, как этилацетат или гексаметилтриамид фосфорной кислоты; сульфоксиды, как диметилсульфоксид (ДМСО); хлорированные углеводороды, как дихлорметан, хлороформ, трихлорэтилен, 1,2-дихлорэтан или четыреххлористый углерод; углеводороды, как бензол, толуол или ксилол. Далее, пригодны смеси этих растворителей друг с другом. Особенно пригоден N-метилпирролидон. Производные со свободной первичной или вторичной аминогруппой целесообразно вводят во взаимодействие в защищенной форме. В качестве защитных групп принимают во внимание вышеуказанные. Далее, соединение формулы (I) можно получать тем, что остаток Х превращают в другой остаток X. Например, можно этерифицировать до сложноэфирной (X = ОА) свободную кислотную группу (X = ОН) или через пептидную связь связывать с аминокислотой или дипептидом. Кроме того, можно также превращать, например, кислоту в амид. Далее, соединение формулы (I) можно получать тем, что остаток R1 в соединении формулы (II) превращают в другой остаток R1. В особенности, циано-группы можно восстанавливать до аминометильных групп или превращать в амидино-группы; бензильные группы можно удалять гидрогенолитически; аминометильные группы можно переводить в гуанидинометильные группы или нитрильные группы можно переводить в тиокарбамоильные группы. Восстановление циано-групп до аминометильных групп целесообразнее осуществлять путем каталитического гидрирования, например, на никеле Ренея, при температурах 0-100°С, предпочтительно - 10-30°С, и при давлениях 1-200 бар, предпочтительно - при нормальном давлении, в инертном растворителе, например, в низшем спирте, как метанол или этанол, целесообразно в присутствии аммиака. Если работают, например, примерно при 20°С и давлении 1 бар, то сохраняют имеющиеся в исходном материале сложноэфирные бензильные или N-бензильные группы. Если хотят их отщепить гидрогенолитически, то целесообразно применяют катализатор на основе благородного металла, предпочтительно - палладий-на-угле, причем можно добавлять в раствор кислоту, как уксусная кислота, а также воду. Для получения соединений формулы (I), где R1 обозначает гуанидино-фенильную группу, соответствующее аминофенильное соединение можно обрабатывать амидинирующим средством. В качестве амидинирующего средства предпочтителен 1-амидино-3,5-диметилпиразол, который используют, в особенности, в форме его нитрата. Целесообразно работать при добавке основания, как триэтиламин или этилдиизопропиламин, в инертном растворителе или смеси растворителей, например, воды с диоксаном, при температурах 0120°С, предпочтительно - 60-120°С. Для получения амидина формулы (I) к нитрилу формулы (I) можно присоединять аммиак. Присоединение, предпочтительно, осуществляют многостадийно, тем, что, само по себе, известным образом: а) нитрил с помощью Н2S превращают в тиоамид, который с помощью алкилирующего средства, например, СH3I, переводят в соответствующий сложный S-алкил-имидотиоэфир, который, со своей стороны, вводят во взаимодействие с NН3 с получением амидина; б) нитрил с помощью спирта, например, этанола, в присутствии НСl, превращают в соответствующий сложный имидоэфир и его обрабатывают аммиаком; или в) нитрил вводят во взаимодействие с бис-(триметилсилил)-амидом лития, и продукт затем гидролизуют. Аналогичным образом, соответствующие N-гидрокси-амидины формулы (I) получают из нитрилов, когда работают по п.п. а) или б), однако, вместо аммиака используют гидроксиламин. Далее, N-гидрокси-амидины путем введения во взаимодействие с хлорангидридами алифатических карбоновых кислот можно переводить в 1,2,4-оксадиазолы, соответственно, 1,2,4-оксадиазолиноны, и их затем путем каталитического гидрирования, например, в присутствии никеля Релея, Pd (С или PtO2, предпочтительно - в метаноле, диоксане, ледяной уксусной кислоте, смеси ледяной уксусной кислоты с уксусным ангидридом или ДМФ, переводить в амидины. Далее, соединение формулы (I) можно получать тем, что соединение формулы (IV) вводят во взаимодействие с реакционноспособным производным угольной кислоты. Реакционноспособные производные угольной кислоты могут представлять собой, например, вышеуказанные, причем, особенно предпочтительны, фосген и дифосген, а также N,N-карбонилдиимидазол. В качестве производных угольной кислоты, далее, особенно пригодны диалкилкарбонаты, как диэтилкарбонат, далее также, сложные алкиловые эфиры хлормуравьиной кислоты, как этилхлорформиат. Предпочтительно производное угольной кислоты, которое, целесообразно, используется в избытке, также служит в качестве растворителя, соответственно, суспендирующего агента. Однако также может присутствовать один из указанных растворителей, если он инертен при этом взаимодействии. Далее рекомендуется добавка основания, в особенности, алкоголята щелочного металла, как трет.-бутилат калия. Целесообразно работают при реакционной температуре 0-150°С, предпочти 7 35607 тельно - 70-120°С. Исходные вещества формулы (IV), как правило, являются новыми. Их получают, например, тем, что замещенный на ароматическом кольце анилин вводят во взаимодействие с a-гидрокси-bгалоген-карбоновой кислотой. Кроме того, соединение формулы (I) можно получать тем, что диол формулы (V) вводят во взаимодействие с избытком реакционноспособного производного угольной кислоты, а именно, предпочтительно при вышеуказанных условиях. В то время как производные угольной кислоты имеются в продаже, соединения формулы (V) можно получать, например, путем взаимодействия аллилхлорида с п-аминобензонитрилом, превращения двойной связи в дигидрокси-группу и введения во взаимодействие с гидроксиламином. Основание формулы (I), с помощью кислоты, можно переводить в соответствующую соль присоединения кислоты. Для этого взаимодействия, в частности, применяют кислоты, которые дают физиологически приемлемые соли. Так, можно применять неорганические кислоты, например, серную кислоту, азотную кислоту; галогенводородные кислоты, как соляная кислота или бромоводородная кислота; фосфорные кислоты, как ортофосфорная кислота, сульфаминовую кислоту; далее, органические кислоты, в особенности алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- или многоосновные карбоновые, сульфоновые или серные кислоты, например, как муравьиная кислота, уксусная кислота, трифторуксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метанили этансульфокислота, этандисульфокислота, 2гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталин-моно- и дисульфокислоты, лаурилсерная кислота. Свободные основания формулы (I), если желательно, можно высвобождать из их солей путем обработки с помощью сильных оснований, как гидроксид натрия или калия, карбонат натрия или калия. Также можно карбоновые кислоты формулы (I), путем введения во взаимодействие с соответствующими основаниями, превращать в их металлические или аммониевые соли, например, их соли натрия, калия или кальция. Соединения формулы (I) могут содержать один или несколько хиральных центров и поэтому могут быть в рацемической или оптически активной форме. Полученные рацематы можно разделять, само по себе, известными методами, механически или химически, на энантиомеры. Предпочтительно, из рацемической смеси, за счет взаимодействия с оптически активным разделяющим агентом, образуются диастереомеры. В качестве разделительного агента пригодны, например, оптически активные кислоты, как D- и Lформы винной кислоты, диацетилвинной кислоты, дибензоилвинной кислоты, миндальной кислоты, яблочной кислоты, молочной кислоты или различных оптически активных камфорсульфокислот, как b-камфорсульфокислота. Предпочтительно также, разделение энантиомеров осуществляют с помощью заполненной оптически активным разделительным агентом (например, динитробензоил-фенил-глицин) колонки, в качестве элюирующего средства пригодна, например, смесь гексана с изопропанолом и ацетонитрилом. Естественно, также можно получать оптически активные соединения формулы (I) по вышеописанным способам тем, что применяют исходные вещества (например, таковые формулы (II), которые уже оптически активны. Новые соединения формулы (I) и их физиологически приемлемые соли можно применять для приготовления фармацевтических препаратов тем, что их вместе с, по меньшей мере, одним носителем или вспомогательным веществом и, если желательно, вместе с одним или несколькими другими биологически активными веществами доводят до пригодной дозировочной формы. Таким образом, полученные композиции можно использовать в качестве лекарственного средства в медицине или ветеринарии. В качестве носителей применяют органические или неорганические вещества, которые пригодны для кишечного (например, орального или ректального) или парентерального введения или для введения в форме ингаляционных распылителей, и не реагируют с новыми соединениями, например, как вода, растительные масла, бензиловые спирты, полиэтиленгликоли, триацетат глицерина и другие глицериды жирных кислот, желатин, соевый лецитин, углеводы, как лактоза или крахмал, стеарат магния, тальк, целлюлоза. Для орального применения, в особенности, служат таблетки, драже, капсулы, сиропы, соки или капли; представляют интерес специальные покрытые лаком таблетки и капсулы с резистентными к желудочному соку покрытиями, соответственно, оболочками капсул. Для ректального применения служат свечи, для парентерального применения растворы, предпочтительно - масляные или водные растворы, далее, суспензии, эмульсии или имплантаты. Для введения в виде ингаляционных распылителей применяют распылители, которые содержат биологически активное вещество, либо растворенным, либо суспендированным в смеси рабочих газов. Целесообразно при этом, биологически активное вещество применяют в микронизированной форме, причем могут быть добавлены один или несколько дополнительных физиологически приемлемых растворителей, например, как этанол. Растворы для ингаляций можно вводить с помощью обычных ингаляторов. Новые соединения также можно лиофилизировать, и полученные лиофилизаты использовать, например, для приготовления препаратов для инъекции. Указанные композиции могут быть стерилизованы и/или могут содержать вспомогательные вещества, как консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для влияния на осмотическое давление, буферные вещества, красители и/или ароматизирующие вещества. Если желательно, они могут содержать также одно или несколько 8 35607 других биологически активных веществ, например, один или несколько витаминов. Предлагаемые, согласно изобретению, вещества, как правило, вводят по аналогии с другими известными, имеющимися в продаже фармацевтическими препаратами, в особенности, по аналогии с описанными в европейском патенте ЕР-А459256 соединениями, предпочтительно - в дозах от 5 мг до 1 г, в особенности, 50-500 мг на дозировочную единицу. Суточная доза предпочтительно составляет примерно 0,1-20 мг/кг, в особенности, 1-10 мг/кг веса тела. Специальная доза для каждого определенного пациента, однако, зависит от самых различных факторов, например, от эффективности используемого специального соединения, возраста, веса тела, общего состояния здоровья, пола, стоимости, момента и пути введения, скорости выделения, комбинации лекарственных средств и тяжести соответствующего заболевания, которое имеет значение для терапии. Предпочтительно - оральное введение. Все выше- и нижеприведенные температуры указаны в °С. В нижеследующих примерах "обычная обработка" обозначает: добавляют, если необходимо, воду; в зависимости от строения целевого продукта, устанавливают рН-значение при 2-8; экстрагируют этилацетатом или дихлорметаном; разделяют; органическую фазу сушат над сульфатом натрия; выпаривают и очищают путем хроматографии на силикагеле и/или путем кристаллизации. Если указываются молекулярные массы, то их обозначают обычными в масс-спектрометрии величинами "М" и значениями FAB (бомбардировка быстрыми атомами), так называемыми, "М + 1". Пример 1. К раствору 3,6 г дигидрата дигидрофосфата натрия, 3,9 г метапериодата натрия и 36 мг RuCl3 в 23 мл воды с 2,3 мл дихлорметана при 16°С добавляют 1 г 4-(2-оксо-5-гидроксиметилоксазолидин-3-ил)-бензонитрила (получают, согласно европейскому патенту 300272), растворенный в 12 мл ацетонитрила. Реакционную смесь перемешивают при комнатной температуре в течение 12 часов, отфильтровывают и обрабатывают как обычно. После концентрирования досуха в вакууме получают 3-(4-цианфенил)-2-оксо-5-оксазолидинкарбоновую кислоту. Т.пл. = 204°С. Пример 2. 27,9 г 3-(4-цианфенил) -2-оксо-5-оксазолидинкарбоновой кислоты (получают, согласно примеру 1) и 26,4 г гидроксиаммонийхлорида в смеси из 750 мл метанола и 30 мл воды в присутствии 53,4 г карбоната натрия кипятят в течение 5 часов. Образовавшийся осадок отсасывают, промывают метанолом и высушивают. Получают, после обработки соляной кислотой, гидрохлорид 3-/4-(амино(гидроксилимино)метил)-фенил/-2-оксо - 5 -оксазолидинкарбоновой кислоты. Т.пл. 205-208°С. Пример 3. 13,9 г 3-/4-(амино-(гидроксилимино)метил)-фенил/-2-оксо-5-оксазолидинкарбоновой кислоты (получают, согласно примеру 2) растворяют в 210 мл ледяной уксусной кислоты добавляют 11,3 г трихлорметилового сложного эфира хлормуравьиной кислоты и кипятят 3 часа. Затем охлаждают до комнатной температуры и обрабатывают как обы чно. Получают 3-/4-(5-оксо-1,2,4-оксадиазолин-3ил)-фенил/-2-оксо-5-оксазолидинкарбоновую кислоту. Т.пл. 250-253°С. Пример 4. К раствору 2,91 г 3-/4-(5-оксо-1,2,4-оксадиазолин-3-ил)-фенил/-2-оксо-5-оксазолидинкарбоновой кислоты (получают, согласно примеру 3), 2,77 г трет.-бутилового эфира пиперидин-4-карбоновой кислоты, 2,02 г 1-гидроксибензотриазола и 2,86 г N-(3-диметиламинопропил)- N'-этилкарбодиимида, в виде гидрохлорида, в 20 мл ДМФ добавляют 3,03 г N-метилморфолина и перемешивают в течение 5 часов при комнатной температуре. Затем прикапывают, при интенсивном перемешивании, 200 мл воды, образовавшийся кристаллический осадок отделяют, обрабатывают его с помощью 90 мл дихлорметана и сушат над сульфатом натрия. Раствор концентрируют в вакууме, полученное масло растирают с диэтиловым эфиром и получают трет.-бутиловый эфир 1-{3-/4-(5-oкco-1,2,4оксадиазолин-3-ил)-фенил/2 -оксо-5-оксазолидинилкарбонил}-пиперидин-4-карбоновой кислоты. Т.пл. 171-175°С. Аналогичным образом, путем взаимодействия 3-/4-(5-оксо-1,2,4-оксадиазолин-З-ил)-фенил/-2- оксо-5-оксазолидинкарбоновой кислоты с трет.-бутиловым эфиром 2-(пиперидин-4-ил)-уксусной кислоты получают трет.-бутиловый эфир 2-{1-/3- (4(5-oкco-1,2,4-оксадиазолин-3-ил)-фенил) -2-оксо-5оксазолидинилкарбонил/-пиперидин -4 - ил}-уксусной кислоты; с этиловым эфиром 2-(пиперидин-4-ил)-уксусной кислоты получают этиловый эфир 2-{1-/3-(4(5-оксо-1,2,4-оксадиазолин-3-ил) -фенил)-2-оксо-5оксазолидинилкарбонил/-пиперидин - 4 -ил}-уксусной кислоты; т.пл. 178-181°С; с трет.-бутиловым эфиром 2-(пиперидин-4-илокси)-уксусной кислоты получают трет.-бутиловый эфир 2-{1-/3-(4-(5-оксо-1,2,4-оксадиазолин-3-ил)фенил)- 2-оксо-5-оксазолидинилкарбонил/-пиперидин-4-ил-окси}-уксусной кислоты; т.пл. 180-181°С; с трет.-бутиловым эфиром 2-(пиперидин-3-илокси)-уксусной кислоты получают трет.-бутиловый эфир 2-{1-/3-(4-(5-оксо-1,2,4-оксадиазолин-3-ил)фенил) -2-оксо-5-оксазолидинилкарбонил/-пиперидин-3-ил-окси}-уксусной кислоты, т.пл. 92-95°С; с трет.-бутиловым эфиром 2-(2-оксо-пиперазино)-уксусной кислоты получают трет.-бутиловый эфир 2-{4-/3-(4-(5-оксо-1,2,4-оксадиазолин-3-ил)фенил)-2-оксо-5-оксазолидинилкарбонил/- 2 -оксопиперазино}-уксусной кислоты; т.пл. 155-157°С; с трет.-бутиловым эфиром (2R)-2-аминопропионовой кислоты (H-Ala-O But) получают трет.бутиловый эфир (2R)-2-{3-/4-(5-окco-1,2,4-оксадиазолин-3-ил)-фенил/-2-оксо-5-оксазолидинилкарбониламино}-пропионовой кислоты, т.пл. 105-107°С; с метиловым эфиром (2R)-2-аминопропионовой кислоты (H-Ala-OMe) получают метиловый эфир (2R)-2-{3-/4-(5-окco-1,2,4-оксадиазолин-3-ил)фенил/-2-оксо -5 - оксазолидинилкарбониламино}пропионовой кислоты, т.пл. 199-201°С; с ди-трет.-бутиловым эфиром (2R)-2-аминоянтарной кислоты (Н-АSp (OBut)-OBut) получают ди-трет.-бутиловый эфир (2R)-2-{3-/4-(5-окco-1,2,4оксадиазолин-3-ил)-фенил/- 2 -оксо-5-оксазолидинилкарбониламино}-янтарной кислоты, т.пл. 175176°С; 9 35607 кислоты получают трет.-бутиловый эфир 2-{1-/3(4 - амидинофенил)-2-оксо-5-оксазолидинилкарбонил/-пиперидин-4-ил-окси}-уксусной кислоты, т.пл. 100°С; из трет.-бутилового эфира 2-{1-/3-(4-(5-оксо1,2,4-оксадиазолин-3-ил) - фенил)-2-оксо-5-оксазолидинилкарбонил/-пиперидин-3-ил- окси}-уксусной кислоты получают трет.-бутиловый эфир 2-{1-/3(4-амидинофенил)- 2 -оксо-5-оксазолидинилкарбонил/-пиперидин - 3-ил-окси)-уксусной кислоты, т. пл. = 139-144°С; из трет.-бутилового эфира 2-{4-/3-(4-(5-оксо1,2,4-оксадиазолин-3-ил)-фенил)-2-оксо -5- оксазолидинилкарбонил/- 2 - оксо-пиперазино}-уксусной кислоты получают трет.-бутиловый эфир 2-{4-/3(4-амидинофенил)-2-оксо- 5 -оксазолидинилкарбонил/-2-оксо-пиперазино}-уксусной кислоты, т.пл. = = 165-167°С; из трет.-бутилового эфира (2R)-2-{3-/4-(5-оксо1,2,4-оксадиазолин-3-ил)-фенил/ -2- оксо-5-оксазолидинилкарбонил - амино} - пропионовой кислоты получают трет.-бутиловый эфир (2R)-2-/3-(4-амидинофенил)-2-оксо - 5 - оксазолидинилкарбониламино/-пропионовой кислоты, т.пл. = 173-175°С; из метилового эфира (2R)-2-{3-/4-(5-оксо-1,2, 4-оксадиазолин-3-ил)-фенил/-2-оксо-5-оксазолидинилкарбониламино}-пропионовой кислоты получают метиловый эфир (2R)-2-/3-(4-амидинофенил) 2-оксо-5-оксазолидинилкарбониламино/-пропионовой кислоты в виде ацетата, т.пл. 190-192°С; из ди-трет.-бутилового эфира (2R)-2-/3-/4-(5оксо-1,2,4 -оксадиазолин-3-ил)-фенил/-2-оксо-5-оксазолидинилкарбониламино/ - янтарной кислоты получают ди-трет.-бутиловый эфир (2R)-2-/3-(4амидинофенил)-2-оксо-5-оксазолидинилкарбониламино/-янтарной кислоты в виде ацетата, т.пл. = = 242°С; из трет.-бутилового эфира 3-{3-/4-(5-оксо-1,2, 4-оксадиазолин-3-ил)-фенил/-2-оксо-5-оксазолидинилкарбониламино}-пропионовой кислоты получают трет.-бутиловый эфир 3-{3-(4-амидинофенил)2-оксо-5-оксазолидинилкарбониламино}-пропионовой кислоты, т.пл. = 164-167°С; из метилового эфира 3-{3-/4-(5-оксо-1,2,4-оксадиазолин-3-ил)-фенил/-2-оксо-5-оксазолидинилкарбониламино}-пропионовой кислоты получают метиловый эфир 3-/3-(4-амидинофенил)-2-оксо-5оксазолидинилкарбонил-амино/-пропионовой кислоты в виде ацетата, т.пл. = 207-209°С; из трет.-бутилового эфира (2R)-2-{3-/4-(5-оксо1,2,4-оксадиазолин-3-ил)-фенил/-2-оксо- 5 -окcазолидинилкарбониламино/-3-(4-гидроксифенил)-пропионовой кислоты получают трет.-бутиловый эфир (2R)- 2 -/3(4-амидинофенил)-2-оксо-5-оксазолидинилкарбониламино/- 3 -(4-гидроксифенил)-пропионовой кислоты; из трет.-бутилового эфира (2R)-2-{3-/4-(5-оксо1,2,4-оксадиазолин-3-ил)-фенил/-2-оксо- 5 -оксазолидинилкарбониламино/-3 -(4-метоксифенил)-пропионовой кислоты получают трет.-бутиловый эфир (2R)-2-/3-(4-амидинофенил)-2-оксо- 5 -оксазолидинилкарбониламино/- 3 -(4-метоксифенил)-пропионовой кислоты; из трет.-бутилового эфира 3-{3-/4-(5-оксо-1,2, 4-оксадиазолин-3-ил)-фенил/-2-оксо-5-оксазолидинилкарбонил-(N-фенетил)амино}-пропионовой кислоты получают трет.-бутиловый эфир 3-/3-(4-ами с трет.-бутиловым эфиром 3-аминопропионовой кислоты (Н-b-Ala-OBut) получают трет.-бутиловый эфир 3-{3-/4- (5-окco-l,2,4-оксадиазолин-3-ил)фенил/-2-оксо -5 - оксазолидинилкарбониламино}пропионовой кислоты, т.пл. 143-146°С; с трет.-метиловым эфиром 3-аминопропионовой кислоты (Н-b-Ala-OMe) получают метиловый эфир 3-(3-/4-(5-окco-1,2,4-оксадиазолин-3-ил)-фенил/-2 -оксо-5-оксазолидинилкарбониламино)-пропионовой кислоты, т.пл. 230-232°С; с трет.-бутиловым эфиром (2R)-2-амино-3-(4гидроксифенил)-пропионовой кислоты (Н - Туr ОВut) получают трет.-бутиловый эфир (2R)-2-(3-/4(5-окco-1,2,4-оксадиазолин-3-ил)--фенил/-2-оксо-5оксазолидинилкарбониламино) -3- (4-гидроксифенил)-пропионовой кислоты; с трет.-бутиловым эфиром (2R)-2-амино-3-(4метоксифенил)-пропионовой кислоты (Н-Туr(ОМе)OВut) получают трет.-бутиловый эфир (2R)-2-{3-/4(5-оксо-1,2,4-оксадиазолин-3-ил)-фенил/-2-оксо- 5оксазолидинилкарбониламино} - 3 - (4-метоксифенил)-пропионовой кислоты; с трет.-бутиловым эфиром 3-N-фенетил-аминопропионовой кислоты получают трет.-бутиловый эфир 3-{3-/4-(5-оксо-1,2,4-оксадиазолин-3ил)-фенил/-2-оксо –5 - оксазолидинилкарбонил-(Nфенетил)-амино}-пропионовой кислоты; с бензиловым эфиром 2-пиперазино-уксусной кислоты получают бензиловый эфир 2-{1-/3(4-(5оксо-1,2,4-оксадиазолин-3-ил)-фенил)-2 -оксо-5-оксазолидинилкарбонил/-пиперазин - 4-ил}-уксусной кислоты, т.пл. 165-170°С; с бензиловым эфиром 3-пиперазино-пропионовой кислоты получают бензиловый эфир 3-{1-/3(4-(5-оксо-1,2,4-оксадиазолин-3-ил)-фенил)-2-оксо5-оксазолидинилкарбонил/-пиперазин-4-ил}-пропионовой кислоты, т.пл. 150-153°С. Пример 5. 1,37 г трет.бутилового эфира 1-{ 3-/4(5-оксо1,2,4-оксадиазолин-3-ил)-фенил/-2-оксо- 5 -оксазолидинилкарбонил}-пиперидин-4-карбоновой кислоты растворяют в 50 мл метанола и гидрируют в присутствии никеля Ренея. Затем реакционную смесь фильтруют, и фильтрат концентрируют в вакууме. Полученный продукт при нагревании обрабатывают с помощью 20 мл этил-ацетата, и продукт после охлаждения отсасывают. Получают трет.-бутиловый эфир 1-{3-/4-амидинофенил/-2-оксо- 5-оксазолидинилкарбонил}-пиперидин-4-ил-карбоновой кислоты, т.пл. 160°С. Аналогичным образом, путем восстановительного отщепления 5-оксо-1,2,4-оксадиазолиновой группы, из трет.-бутилового эфира 2- { 1-/3-(4(5-оксо-1,2,4-оксадиазолин-3-ил)-фенил)-2-оксо- 5оксазолидинилкарбонил/-пиперидин-4 -ил} - уксусной кислоты получают трет.-бутиловый эфир 2{1-/3-(4 - амидинофенил)- 2-оксо-5-оксазолидинилкарбонил/-пиперидин-4-ил}-уксусной кислоты; из этилового эфира 2-{1-/3-(4-(5-оксo-1,2,4-оксадиазолин-3-ил)-фенил)-2-оксо-5-оксазолидинилкарбонил/-пиперидин-4-ил}-уксусной кислоты получают этиловый эфир 2-{1-/3-(4-амидинофенил)-2-оксо-5оксазолидинилкарбонил/-пиперидин- 4 - ил}-уксусной кислоты, т.пл. = 210-211°С; из трет.-бутилового эфира 2-{1-/3-(4-(5-оксо-1, 2,4-оксадиазолин-3-ил)-фенил)-2-оксо- 5-оксазолидинилкарбонил/-пиперидин - 4 - ил -окси}-уксусной 10 35607 динофенил)-2-оксо- 5 -оксазолидинилкарбонил-(Nфенетил)-амино/-пропионовой кислоты; из бензилового эфира 2-{1-/3-(4-(5-оксо-1,2,4оксадиазолин - 3-ил)-фенил)-2-оксо-5-оксазолидинилкарбонил/-пиперазин - 4-ил}-уксусной кислоты получают бензиловый эфир 2-{1-/3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбонил/-пиперазин4-ил}-уксусной кислоты; из бензилового эфира 3-{1-/3-[4-(5-оксо-1,2,4оксадиазолин-3-ил)-фенил]- 2 -оксо-5-оксазолидинилкарбонил/-пиперазин-4-ил}-пропионовой кислоты получают бензиловый эфир 3-{1-/3-(4-амидинофенил)- 2-оксо-5-оксазолидинилкарбонил/-пиперазин-4-ил}-пропионовой кислоты. Пример 6. 0,41 г трет.-бутилового эфира 1-/3-(4-амидинофенил)-2 -оксо-5-оксазолидинилкарбонил/-пиперидин-4-ил-карбоновой кислоты в 40 мл эфирного раствора НСl перемешивают 2 часа при комнатной температуре. Образовавшийся осадок отсасывают и промывают с помощью 20 мл эфира. Затем продукт обрабатывают с помощью 5 мл ацетонитрила в течение 10 минут при 60°С, после охлаждения до комнатной температуры отсасывают и прoмывают небольшим количеством ацетонитрила. Получают 1--/3(4-амидинофенил)-2-оксо-5оксазолидинилкарбонил)-пиперидин-4-карбоновую кислоту в виде гидрохлорида. Т.пл. = 184°С (разложение). Аналогичным образом, путем омыления соответствующих сложных эфиров, из трет.-бутилового эфира 2-1-/3-(4-амидинофенил)-2-оксо-5оксазолидинилкарбонил/ - пиперидин -4-ил}-уксусной кислоты получают 2-{1-/3-(4-амидинофенил)2-оксо - 5 - оксазолидинилкарбонил/-пиперидин-4ил}-уксусную кислоту в виде гидрохлорида; из трет.-бутилового эфира 2-{1-/3-(4-амидинофенил)-2-оксо- 5-оксазолидинилкарбонил/-пиперидин-4-ил-окси}-уксусной кислоты получают 2-{1-/3(4-амидинофенил)- 2 -оксо-5-оксазолидинилкарбонил/-пиперидин-4-ил-окси}-уксусную кислоту в виде гидрохлорида, т.пл. = 170-175°С (разложение); из трет.-бутилового эфира 2-{1-/3-(4-амидинофенил)- 2-оксо-5-оксазолидинилкарбонил/-пиперидин- 3 -ил-окси}-уксусной кислоты получают 2{1-/3(4- амидинофенил)-2-оксо-5-оксазолидинилкарбонил/-пиперидин-3-ил-окси}-уксусную кислоту в виде гидрохлорида, т.пл. = 127-129°С; из трет.-бутилового эфира 2-{4-/3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбонил/- 2 -оксопиперазино}-уксусной кислоты получают 2-{ 4-/3(4-амидинофенил)-2-оксо- 5 -оксазолидинилкарбонил/-2-оксо-пиперазино}-уксусную кислоту в виде гидрохлорида, т.пл. 63-70°С; из трет.-бутилового эфира (2R)-2-/3-(4-амидинофенил)- 2 -оксо-5-оксазолидинилкарбониламино/-пропионовой кислоты получают (2R)-2-/3-(4амидинофенил)-2-оксо-5-оксазолидинилкарбониламино/-пропионовую кислоту в виде гидрохлорида, т.пл. 190-194°С; из ди-трет.-бутилового эфира (2R)-2-/3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбониламино/-янтарной кислоты получают (2R)-2-/3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбониламино/-янтарную кислоту в виде гидрохлорида, т.пл. 308 - 310°С (разложение); из трет.-бутилового эфира 3-/3-(4-амидино фенил)-2-оксо- 5 -оксазолидинилкарбониламино/пропионовой кислоты получают 3-/3-(4-амидинофенил)- 2 -оксо-5-оксазолидинилкарбониламино/пропионовую кислоту в виде гидрохлорида, т.пл. 243-244°С (разложение); из.трет.-бутилового эфира (2R)-2-/3-(4-амидинофенил)-2-оксо-5-оксазолидинкарбониламино/-3(4-гидроксифенил)-пропионовой кислоты получают (2R)-2-/3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбониламино/-3-(4-гидроксифенил)-пропионовую кислоту в виде гидрохлорида; из трет.-бутилового эфира (2R)-2-/3-(4-амидинофенил)-2-оксо- 5 - оксазолидинилкарбониламино/-3-(4-метоксифенил)-пропионовой кислоты получают (2R)-2-/3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбониламино/- 3 - (4-метоксифенил)пропионовую кислоту в виде гидрохлорида; из трет.-бутилового эфира (2R)-2-/3-(4-амидинофенил)- 2-оксо-5-оксазолидинилкарбонил-(N фенетил)-амино/-пропионовой кислоты получают (2R)- 2-/3 -(4-амидинофенил)-2-оксо-5-оксазолидинилкарбонил-(N-фенетил)-амино/-пропионовую кислоту в виде гидрохлорида. Пример 7. 1,0 г бензилового эфира 2-{1-/3-(4-амидинофенил)- 2-оксо-5-оксазолидинилкарбонил/-пиперазин-4-ил-уксусной кислоты в смеси из 100 мл метанола и 50 мл ДМФ каталитически гидрируют в присутствии палладия-на-угле, вплоть до прекращения поглощения водорода. Затем реакционную смесь отфильтровывают и обрабатывают как обычно. После растирания сырого продукта с эфиром и высушивания получают 2-{ 1-/3-(4-амидинофенил)- 2-оксо-5-оксазолидинилкарбонил/-пиперазин-4-ил}-уксусную кислоту. Т.пл. 220-225°С (разложение). Аналогичным образом из бензилового эфира 3-{1-/3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбонил/-пиперазин-4-ил}-пропионовой кислоты получают 3-{1-/3-(4-амидинофенил)-2-оксо-5-оксазолидинилкарбонил/-пиперазин- 4 - ил}-пропионовую кислоту, т.пл. 255 -258°С (разложение). Пример 8. Аналогично примеру 4, путем взаимодействия трет.-бутилового эфира фенилаланина с 3-(4-цианфенил)-2-оксо-5-оксазолидин-карбоновой кислотой (получают, согласно примеру 1), получают трет.-бутиловый эфир (2R)-2-/3-(4-цианфенил)-2оксо - 5 - оксазолидинилкарбониламино/-3-фенилпропионовой кислоты. Т.пл. 72°С. Аналогичным образом, путем взаимодействия 3-(4-цианфенил)-2-оксо-5-оксазолидин-карбоновой кислоты с бензиловым эфиром пиперидин-4-карбоновой кислоты получают бензиловый эфир 1-/3(4-цианфенил)- 2-оксо-5-оксазолидинилкарбонил/пиперидин-4-карбоновой кислоты, FАВ (М+1) :434; с трет.-бутиловым эфиром 2-(4-пиперидинилокси)-уксусной кислоты получают трет.-бутиловый эфир 2-/1-/3-(4-цианфенил)--2-оксо-5-оксазолидинилкарбонил/- 4 -пиперидинил-окси/-уксусной кислоты, т.пл. 126-127°С. Пример 9. 2,3 г хлорангидрида 3-(4-цианфенил)-2-оксо-5оксазолидинкарбоновой кислоты (т.пл. 148-150°С) получают из кислоты путем введения во взаимодействие с оксалилхлоридом) вводят во взаимодействие с 1 эквивалентом бензилового эфира 1 11 35607 пиперазинилуксусной кислоты в виде гидрохлорида в 100 мл дихлорметана в присутствии 5 мл триэтиламина при комнатной температуре. После обычной обработки получают бензиловый эфир 2-{1-/3-(4-цианфенил)-2-оксо-5 -оксазолидинилкарбонил/-4-пиперазинил}-уксусной кислоты. Т.пл. = =131-132°С. Пример 10. 2,6 г трет.-бутилового эфира (2R)-2-/3-(4-цианфенил)-2-оксо-5-оксазолидинилкарбониламино/-3фенилпропионовой кислоты (получают, согласно примеру 8) растворяют в смеси растворителей, состоящей из 30 мл пиридина и 5 мл триэтиламина, и перемешивают 1,5 часа при охлаждении льдом, причем во время этой фазы непрерывно вводят газообразный сероводород. Затем реакционную смесь перемешивают еще 24 часа при комнатной температуре. После выпаривания и обычной обработки получают трет.-бутиловый эфир (2Е)-2-/3-(4-тиокарбамоил-фенил)-2-оксо-5-оксазолидинилкарбониламино/ - 3 - фенил-пропионовой кислоты. Т.пл. = 185-186°С. Аналогичным образом из бензилового эфира 1-/3-(4-цианфенил)-2-оксо-5 -оксазолидинилкарбонил/-пиперидин-4-карбоновой кислоты получают бензиловый эфир 1-/3-(4-тиокарбамоил-фенил)-2оксо- 5-оксазолидинилкарбонил/-пиперидин-4-карбоновой кислоты, т.пл. = 167-169°С; из трет.-бутилового эфира 2-{1-/3-(4-цианфенил)- 2 -оксо-5-оксазолидинилкарбонил/-4-пиперидинилокси}-уксусной кислоты получают трет.-бутиловый эфир 2-{ 1-/3- (4-тиокарбамоил-фенил)-2оксо-5-оксазолидинилкарбонил/-4-пиперидинилокси}-уксусной кислоты, т.пл. 190-191 С; из бензилового эфира 2-{1-/3-(4-цианфенил)2-оксо-5-оксазолидинилкарбонил/-4-пиперазинил}уксусной кислоты получают бензиловый эфир 2{1-/3-(4-тиокарбамоил-фенил)- 2 - оксо-5-оксазолидинил-карбонил}-4-пиперазинил/-уксусной кислоты. Пример 11. 0,92 г трет.-бутилового эфира (2R)-2-/3-(4-тиокарбамоил-фенил)- 2 -оксо-5-оксазолидинилкарбониламино/-3-фенилпропионовой кислоты (получают, согласно примеру 10) растворяют в 15 мл ацетона и смешивают с 1,75 мл метилиодида. Раствор перемешивают 2 часа при комнатной температуре и обрабатывают как обычно. Получают трет.-бутиловый эфир (2R)-2-/3-(4-имино-(метилино)-метилфенил)-2-оксо- 5 - оксазолидинилкарбониламино/-3-фенилпропионовой кислоты в виде гидрохлорида, т.пл. 140°С. Аналогичным образом из бензилового эфира 1-/3-(4-тиокарбамоил-фенил)-2-оксо-5-оксазолидинилкарбонил/-пиперидин- 4 -карбоновой кислоты получают бензиловый эфир 1-/3-(4-имино-(метилино)-метилфенил)-2-оксо-5-оксазолидинилкарбонил/-пиперидин-4-карбоновой кислоты в виде гидроиодида, т.пл. 86-91°С; из трет.-бутилового эфира 2-{1-/3-(4-тиокарбамоил-фенил) - 2 - оксо- 5 -оксазолидинилкарбонил/-4-пиперидинилокси}-уксусной кислоты получают трет.-бутиловый эфир 2-{1--/3-(4-имино-(метилтио)-метилфенил/-2-оксо- 5-оксазолидинилкарбонил/-4-пиперидинилокси}-уксусной кислоты, т. пл. 157°С, из бензилового эфира 2-{1-/3-(4-тиокарба моил-фенил)-2-оксо-5-оксазолидинилкарбонил/- 4пиперазинил}-уксусной кислоты получают бензиловый эфир 2-{1-/3-(4-имино-(метилтио) – метилфенил)- 2-оксо-5-оксазолидинилкарбонил/-4-пиперазинил}-уксусной кислоты. Пример 12. 0,45 г трет.-бутилового эфира (2R)-2-/3-(4имино- (метилтио)-метилфенил)-2-оксо-5-оксазолидинилкарбониламино/-3-фенилпропионовой кислоты (получают, согласно примеру 11) суспендируют в 5 мл метанола, добавляют 0,47 г ацетата аммония и перемешивают 24 часа при комнатной температуре. Затем реакционную смесь смешивают с 10 мл эфира, и отделяют образовавшийся осадок. После выпаривания фильтрата и обычной обработки, а также обработки ледяной уксусной кислотой, получают трет.-бутиловый эфир (2R)2 - /3 - (4-амидинофенил)-2-оксо-5-оксазолидинилкарбониламино/-3-фенилпропионовой кислоты в виде ацетата, т.пл. 191-192°С. Аналогичным образом из бензилового эфира 1-/3-(4-имино-(метилтио)-метилфенил) - 2 -оксо-5оксазолидинилкарбонил/-пиперидин-4-карбоновой кислоты получают бензиловый эфир 1-/3-(4-амидинофенил)- 2-оксо-5-оксазолидинилкарбонил/-пиперидин-4-карбоновой кислоты в виде ацетата, т.пл. 197-199°С; из трет.-бутилового эфира 2-{1-/3-(4-имино(метилтио)--метилфенил)-2-оксо-5-оксазолидинилкарбонил/- 4 -пиперидинилокси}-уксусной кислоты получают трет.-бутиловый эфир 2-{1-/3- (4-амидинофенил) -2-оксо-5-оксазолидинилкарбонил/-4-пиперидинилокси}-уксусной кислоты в виде ацетата, т.пл. 127-125°С; из бензилового эфира 2-{ 1-/3-(4-имино-(метилтио)-метилфенил) - 2 - оксо-оксазолидинилкарбонил/-4-пиперазинил}-уксусной кислоты получают бензиловый эфир 2-{1-/3-(4-амидино-фенил)-2оксо-5-оксазолидинилкарбонил/- 4 - пиперазинил}уксусной кислоты в виде ацетата. Пример 13. 0,25 г трет-бутиловогоэфира (2R)-2-/3- (4-амидинофенил) - 2 - оксо - 5-оксазолидинилкарбониламино/-3-фенилпропионовой кислоты (получают, согласно примеру 12) в 10 мл трифторуксусной кислоты перемешивают при комнатной температуре вплоть до полного гидролиза. Затем реакционную смесь концентрируют, и остаток многократно промывают толуолом. После обработки с помощью этилацетата получают (2R)-2-/3-(4-амидинофенил)- 2 -оксо-5-оксазолидинилкарбониламино/-3-фенилпропионовую кислоту в виде трифторацетата. FAB (М + 1): 397. Аналогичным образом, путем омыления соответствующих сложных эфиров из примера 12, получают: трифторацетат 1-/3-(4-амидинофенил)-2-оксо5-оксазолидинилкарбонил/-пиперидин- 4 -карбоновой кислоты; трифторацетат 2-{1-/3-(4-амидинофенил)-2-оксо- 5 - оксазолидинилкарбонил/-4-пиперидинилокси}-уксусной кислоты; трифторацетат 2-{1-/3-(4-амидинофенил)-2-оксо- 5 -оксазолидинилкарбонил/-4-пиперазинил}–уксусной кислоты. Пример 14. 12 35607 23,2 г 3-(4-цианфенил)-2-оксо-5-оксазолидинкарбоновой кислоты (получают, согласно примеру 1) вместе с 33,0 г дитрет.-бутилдикарбоната в 1000 мл метанола и 110 мл раствора гидроксида натрия гидрируют в присутствии палладия-на-угле вплоть до прекращения поглощения водорода. Затем раствор концентрируют в вакууме. После обычной обработки получают 3-(4-трет.-бутоксикарбониламинометилфенил) - 2 -оксо- 5-оксазолидинкарбоновую кислоту. Т.пл. 166°С. Пример 15. Аналогично примеру 4, путем взаимодействия бензилового эфира 3-(1-пиперазинил)-пропионовой кислоты с 3-(4-трет.-бутоксикарбониламинометилфенил)-2-оксо-5-оксазолидинкарбоновой кислотой получают бензиловый эфир 3-{1-/3-(4трет.-бутоксикарбониламинометилфенил)- 2 -оксо5-оксазолидинилкарбонил/-4 -пиперазинил}-пропионовой кислоты. Т.пл. 128-130°С. Аналогичным образом, путем введения во взаимодействие 3-(4-трет.-бутоксикарбониламинометилфенил)- 2 -оксо-5-оксазолидинкарбоновой кислоты с бензиловым эфиром пипередин-4-карбоновой кислоты получают бензиловый эфир 1-/3(4-трет.-бутоксикарбониламинометилфенил)- 2-оксо-5 -оксазолидинилкарбонил/-пипередин-4-карбоновой кислоты; с трет.-бутиловым эфиром 2-(4-пиперидинилокси)-уксусной кислоты получают трет.-бутиловый эфир 2-{1-/3-(4-трет.-бутоксикарбониламинометилфенил)-2-оксо-5-оксазолидинилкарбонил/- 4пиперидинилокси}-уксусной кислоты, т.пл. = 115 119°С; с бензиловым эфиром 2-(4-пиперазинил)-уксусной кислоты получают бензиловый эфир 2{1-/3-(4-трет.-бутоксикарбониламинометилфенил)2-оксо-5-оксазолидинилкарбонил/-4-пиперазинил}уксусной кислоты, т.пл. 121°С; с трет.-бутиловым эфиром 4-пиперидин-карбоновой кислоты получают трет.-бутиловый эфир 1-/3- (4-трет.-бутоксикарбониламинометилфенил)2-оксо- 5-оксазолидинилкарбонил/-4-пиперидинкарбоновой кислоты., т.пл. 63,6°С; с трет.-бутиловым эфиром (2R)-2-амино-3-фенилпропионовой кислоты получают трет.-бутиловый эфир (2R)-2-/3-(4-трет.-бутоксикарбониламинометилфенил)-2-оксо-5 -оксазолидинилкарбониламино/-3-фенилпропионовой кислоты, т.пл. 6869°С. Пример 16. 1,5 г бензилового эфира 3-{1-/3-(4-трет.-бутоксикарбониламинометилфенил)- 2 -оксо-5-оксазолидинилкарбонил/ - 4 - пиперазинил}-пропионовой кислоты в 50 мл ДМФ гидрируют в присутствии 5%-ного палладия-на-угле. После обычной обработки сырой продукт растворяют в смеси растворителей, состоящей из дихлорметана с метанолом и ледяной уксусной кислотой (70:30:2), и хроматографируют через силикагель. Получают, после растирания продукта с эфиром, 3-{1-/3-(4трет.-бутоксикарбониламинометилфенил)- 2 -оксо5 -оксазолидинилкарбонил/-4-пиперазинил}-пропионовую кислоту. Т.пл. 76-78°С. Пример 17. 0,53 г трет.-бутилового эфира 2-{1-/3-(4-трет.бутоксикарбониламинометилфенил)-2-оксо- 5 - оксазолидинилкарбонил/-4-пиперидинил-окси} –уксу сной кислоты в 10 мл трифторуксусной кислоты перемешивают при комнатной температуре. После обычной обработки сырой продукт растирают с эфиром и высушивают. Получают 2-{1-/3-(4-аминометилфенил)-2-оксо-5-оксазолидинилкарбонил/4-пиперидинилокси}-уксусную кислоту в виде трифторацетата. FAB (М + 1):378. Аналогичным образом из трет.-бутилового эфира (2R)-2-/3-(4-трет.-бутоксикарбониламинометиофенил)- 2-оксо-5-оксазолидинилкарбонил/-3фенилпропионовой кислоты получают (2R)-2-/3-(4аминометилфенил)-2-оксо-5-оксазолидинилкарбонил/-3-фенилпропионовую кислоту в виде трифторацетата, т.пл. 178-185°С. Пример 18. 0,5 г трет.-бутилового эфира 1-/3-(4-трет.-бутоксикарбониламинометилфенил)-2-оксо - 5 -оксазолидинилкарбонил/-пиперидин-4-карбоновой кислоты в 10 мл трифторуксусной кислоты перемешивают при комнатной температуре. Раствор концентрируют в вакууме. Сырой продукт затем обрабатывают с помощью эфирного раствора хлороводорода, отсасывают и высушивают. Получают гидрохлорид 1-/3-(4-аминометилфенил)-2-оксо5-оксазолидинилкарбонил/-пиперидин- 4 -карбоновой кислоты, т.пл. 256-258°С (разложение). Пример 19. 0,43 н ацетата 3-(1-/3-(4-трет.-бутоксикарбониламинометилфенил)-2-оксо-5-оксазолидинилкарбонил/-4-пиперазинил/-пропионовой кислоты в 30 мл эфирного раствора НСl перемешивают при комнатной температуре. Образовавшийся осадок отсасывают, промывают небольшим количеством эфира и высушивают. Получают дигидрохлорид 3{1 -/3-(4-аминометилфенил)-2-оксо-5-оксазолидинилкарбонил-4-пиперазинил}-пропионовой кислоты. Т.пл. 184-185°С. Пример 20. 0,74 г бензилового эфира 2-{1-/3-(4-трет.-бутоксикарбониламинометилфенил)-2-оксо - 5 -оксазоли-динилкарбонил/-4-пиперазинил}-уксусной кислоты в 30 мл раствора НСl в этилацетате перемешивают при комнатной температуре. Образовавшийся осадок отсасывают, промывают небольшим количеством этилацетата и высушивают. Получают дигидрохлорид бензилового эфира 2-{1/3-(4-аминометилфенил)-2-оксо-5 -оксазолидинилкарбонил/-4-пиперазинил}-уксусной кислоты. Т.пл. 224-226°С. Пример 21. 0.6 г дигидрохлорида бензилового эфира 2-{1/3 - (4-аминометилфенил-2-оксо-5-оксазолидинилкарбонил/-4-пиперазинил}-уксусной кислоты в смеси из 30 мл метанола, 5 мл воды и 5 мл ледяной уксусной кислоты гидрируют в присутствии палладия-на-угле. Реакционную смесь отфильтровывают, и фильтрат концентрируют в вакууме. После растирания сырого продукта с этилацетатом получают дигидрохлорид 2-{1-/3-(4-аминометилфенил)-2-оксо-5-оксазолидинилкарбонил/- 4пиперазинил}-уксусной кислоты, т.пл. 91°С (разложение). Пример 22. 5,4 г 3-(4-аминометилфенил)-2-оксо-5-оксазолидинкарбоновой кислоты суспендируют в 70 мл ТГФ. При перемешивании прикапывают 35 мл 1 н раствора NаОH. После этого прикапывают рас 13 35607 твор 6,6 г 4-цианбензоилхлорида в 60 мл ТГФ. рНзначение раствора поддерживают равным 9-10,5 за счет добавки 1 н раствора NаОН. После окончания взаимодействия подкисляют с помощью 2 н раствора НСl до рН = 1. Растворитель удаляют, остаток отсасывают и промывают водой. Получают 3-/4-(4-циaнбензамидометил)-фенил/-2-оксо-оксазолидинкарбоновую кислоту. Т.пл. = 234°С. Аналогичным образом, путем взаимодействия 3-(4-аминометилфенил) -2-оксо-5-оксазолидинкарбоновой кислоты с п-хлоркарбониламинобензонитрилом получают 3-{4-/3-(4-цианфенил)уреидометил/-фенил} -2-оксо-5-оксазолидин-карбоновую кислоту. Пример 23. Аналогично примеру 10, путем взаимодействия 3-/4-(4-цианбензамидометил)-фенил/-2-оксо-5оксазолидинилкарбоновой кислоты с сероводородом получают 3-/4-(4-тиокарбамоилбензамидометил)-фенил/-2-оксо-5-оксазолидинкарбоновую кислоту. Т.пл. 105-110°С. Аналогичным образом, путем взаимодействия 3-{4-/3-(4-цианфенил)-уреидометил/-фенил}- 2 -оксо-5-оксазолидинилкарбоновой кислоты с сероводородом получают 3-{4-/3-(4-тиокарбамоилфенил)-уреидометил/-фенил} - 2 - оксо-5-оксазолидинилкарбоновую кислоту. Пример 24. Аналогично примеру 11, путем взаимодействия 3- /4 - (4-тиокарбамоилбензамидометил)-фенил/-2-оксо-5-окcазолидинилкарбоновой кислоты с метилиодидом получают гидрохлорид 3-/4-(4-имино-(метилтио)-метилбензамидометил)-фенил/ - 2 оксо-5-оксазолидинкарбоновой кислоты. Т.пл. = =209°С. Аналогичным образом, путем взаимодействия 3-{4-/3 - (4-тиокарбамоилфенил)-уреидометил/-фенил}-2-оксо-5-оксазолидинкарбоновой кислоты с метилиодидом получают бензиловый эфир 3-{4-/3(4-имино-(метилтио) - метилфенил)-уреидометил/фенил}-2-оксо-5-оксазолидинкарбоновой кислоты. Пример 25. Аналогично примеру 12, путем взаимодействия 3-/4-(4-имино(метилтио)-метилбензамидо-метил)-фенил/ - 2 - оксо-5-оксазолидинилкарбоновой кислоты с ацетатом аммония получают ацетат 3-/4-(4-амидинобензамидометил)-фенил/-2-оксо-5оксазолидинкарбоновой кислоты, т.пл. 294°С. Аналогичным образом, путем взаимодействия бензилового эфира 3-{3-/3-(4-имино-(метилтио)метилфенил) -уреидометил/-фенил}-2-оксо-5-оксазолидинкарбоновой кислоты с ацетатом аммония получают ацетат 3-{4-/3-(4-амидинофенил)-уреидометил/-фенил}-2-оксо-5-оксазолидинкарбоновой кислоты. Пример 26. Аналогично примеру 21, путем отщепления сложноэфирной бензильной группы, исходя из бензилового эфира 3-[4-(4-амидинобензамидометил)-фенил]-2-оксо-5-оксазолидинкарбоновой кислоты, получают 3-/4-(4-амидинобензамидометил)-фенил/-2-оксо-5-оксазолидинкарбоновую кислоту. Аналогичным образом, путем отщепления сложноэфирной бензильной группы, исходя из бензилового эфира 3-{4-/3-(4-амидино-фенил)уреидометил-/-фенил}-2-оксо-5-оксазолидинилкар боновой кислоты, получают 3-{4-/3-(4-амидинофенил)-уреидометил/-фенил} - 2 -оксо-5-оксазолидинилкарбоновую кислоту. Пример 27. 3,36 г 3-(4-трет.-бутоксикарбониламинометилфенил)-2--оксо-5-оксазолидинкарбоновой кислоты (получают, согласно примеру 16, т.пл. = 166°С) в смеси из 30 мл эфира и 30 мл диоксана, которая предварительно насыщена газообразным НСl, перемешивают в течение 1 часа при комнатной температуре. Затем осадок отсасывают и промывают эфиром. Получают 3-(4-аминометилфенил)-2-оксо-5-оксазолидинкарбоновую кислоту. Т.пл. = 211212°С. Пример 28. 0,22 г трет.-бутилового эфира (2R)-2-/3-(4-цианфенил)- 2 -оксо-5-оксазолидинилкарбониламино/-3-фенилпропионовой кислоты (получают, согласно примеру 8) в 5 мл трифторуксусной кислоты перемешивают 1 час при комнатной температуре. Затем раствор концентрируют в вакууме и остаток растирают с эфиром. Получают трифторацетат (2R)-2-/3-(4-цианфенил)-2-оксо-5-оксазолидинилкарбониламино/-3-фенилпропионовой кислоты. Пример 29. 0,26 г 3-/4-амино-(гидроксиимино)-метилфенил/-2-оксо-оксо-5-оксазолидинкарбоновой кислоты (получают, согласно примеру 2) в смеси из 10 мл ледяной уксусной кислоты и 10 мл уксусного ангидрида кипятят в течение 2-х часов. Реакционный раствор концентрируют в вакууме и остаток кристаллизуют из эфира. Получают 3-/4-(5-метил1, 2, 4-оксадиазол-3-ил)-фенил/-2-оксо-5-оксазолидинкарбоновую кислоту. Т.пл. = 215-218°С. Пример 30. 1,06 г 3-/4-амино-(гидроксиимино)-метилфенил/-2-оксо-5-оксазолидинкарбоновой кислоты (получают, согласно примеру 2) и 1,47 г хлорацетилхлорида в 20 мл ледяной уксусной кислоты кипятят в течение 2-х часов. Реакционный раствор концентрируют в вакууме, и остаток кристаллизуют из эфира. Получают 3-/4-(5-хлорметил-1, 2,4-оксадиазол-3-ил)-фенил/ - 2 - оксо-5-оксазолидинкарбоновую кислоту. Т.пл. 178-181°С. Пример 31. 1,32 г 3-/4-амино-(гидроксиимино)-метилфенил/-2-оксо-5-оксазолидинкарбоновой кислоты (получают, согласно примеру 2) и 4,44 г N-(хлоркарбонилметил)-фталимида в 20 мл ледяной уксусной кислоты кипятят в течение 2-х часов. Реакционный раствор охлаждают до комнатной температуры, и осадок отсасывают, промывают эфиром и перекристаллизуют из этанола. Получают 3-/4(5-фталимидометил- 1, 2, 4 - оксадиазол-3-ил)-фенил/-2-оксо-5-оксазолидинкарбоновую кислоту. Т. пл. 130 -135°С. Пример 32. 15 г 3-/4-амино-(гидроксиимино)-метилфенил)2-оксо-5-оксазолидинкарбоновой кислоты (получают, согласно примеру 2) в 370 мл ледяной уксусной кислоты при добавке 13 мл уксусного ангидрида гидрируют в присутствии палладия-наугле до прекращения поглощения водорода. Отфильтровывают от катализатора, и фильтрат отбрасывают. Затем остаток обрабатывают с помощью 100 мл 1 н раствора НСl и 200 мл концентри 14 35607 рованного раствора НС1 и отфильтровывают. Солянокислый фильтрат концентрируют в вакууме, и выделяющийся при этом кристаллический остаток отфильтровывают. После промывки небольшим количеством воды и высушивания по-лучают гидрохлорид 3-(4-амидинофенил)-2-оксо-5-оксазолидинкарбоновой кислоты. Т.пл. 253-254°С. Пример 33. 0,87 г бензилового эфира 1-/3-(4-цианфенил)2-оксо - 5 - оксазолидинилкарбонил/-пиперидин-4карбоновой кислоты (получают, согласно примеру 8), 0,43 г гидроксиламмонийхлорида и 0,89 г карбоната натрия в 12,5 мл метанола при добавке 0,5 мл воды кипятят в течение 3-х часов. Реакционный раствор затем обрабатывают как обычно. Получают смесь бензилового эфира 1-{3-/4-амино(гидроксиимино)-метилфенил/-2-оксо- 5 -оксазолидинилкарбонил/-пиперидин-4-карбоновой кислоты; FAB (М+1):467; и метилового эфира 1-{3-/4-амино(гидроксиимино)-метилфенил/- 2 -оксо-5-оксазолидинилкарбонил}-пиперидин-4-карбоновой кислоты; FAB (М+1):391. Разделение обоих веществ осуществляют с помощью колоночной хроматографии (силикагель; дихлорметан/метанол = 93:7). Пример 34 1,12 г метилового эфира 3-{ 3-/4-(5-оксо-1,2,4оксадиазолин - 3 -ил)-фенил/-2-оксо-5-оксазолидинилкарбониламино}-пропионовой кислоты (получают, согласно примеру 4) в 13,5 мл воды и 30 мл метанола при добавке 1,35 г карбоната калия перемешивают 3 часа при комнатной температуре. Реакционный раствор затем обрабатывают как обычно. Получают 3-{3-/4-(5-оксо-1,2,4-оксадиазолин-3-ил)-фенил/- 2 - оксо-5-оксазолидинилкарбониламино} -пропионовую кислоту. Т.пл. 221-223°С. Нижеследующие примеры относятся к фармацевтическим композициям. Пример А: Стеклянные пузырьки с препаратом для инъекции. В растворе из 100 г биологически активного вещества формулы (I) и 5 г динатрийгидрофосфата в 3 л бидистиллированной воды с помоцью 2 н соляной кислоты устанавливают рН = 6,5, раствор стерильно фильтруют, заполняют им стеклянные пузырьки для препарата для инъекции, лиофили зируют в стерильных условиях и стерильно закрывают. Каждый пузырек с препаратом для инъекции содержит 5 мг биологически активного вещества. Пример Б: Свечи. Расплавляют смесь из 20 г биологически активного вещества формулы (I) со 100 г соевого лецитина и 1400 г масла какао, выливают в формы и оставляют охлаждаться. Каждая свеча содержит 20 мг биологически активного вещества. Пример В: Раствор. Готовят раствор из 1 г биологически активного вещества формулы (I), 9,38 г NаН2РO4. 2Н2О; 28,48 г Nа2НРO4. 12 Н2О и 0,1 г бензальконийхлорида в 940 мл дважды перегнанной воды. Устанавливают рН = 6,8, доливают до 1 л и стерилизуют путем облучения. Этот раствор можно применять в форме глазных капель. Пример Г: Мазь. 500 мг биологически активного вещества формулы (I) смешивают с 99,5 г вазелина в асептических условиях. Пример Д: Таблетки. Смесь из 1 кг биологически активного вещества формулы (I), 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния обычным образом прессуют в таблетки таким образом, что каждая таблетка содержит 10 мг биологически активного вещества. Пример Е: Драже. Аналогично примеру Д, прессуют таблетки, на которые затем обычным образом наносят покрытие из сахарозы, картофельного крахмала, талька, траганта и красителя. Пример Ж: Капсулы. 2 кг биологически активного вещества формулы (I) обычным образом вносят в капсулы из твердого желатина так, что каждая капсула содержит 20 мг биологически активного вещества. Пример З: Ампулы. Раствор из 1 кг биологически активного вещества формулы (I) в 60 л дважды перегнанной воды стерильно фильтруют, заполняют им ампулы, лиофилизируют в стерильных условиях и стерильно закрывают. Каждая ампула содержит 10 мг биологически активного вещества. __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 15
ДивитисяДодаткова інформація
Назва патенту англійськоюOxazolidinonecarboxylic acid derivatives, a process for the preparation thereof, pharmaceutical composition and a method for the preparation thereof
Автори англійськоюJurascuk Horst, Gante Joachim, Wurzciger Hanns, Bernotat-Danielowski Sabine, Melzer Guido
Назва патенту російськоюПроизводные оксазолидинонкарбоновой кислоты, способ их получения, фармацевтическая композиция и способ ее получения
Автори російськоюЮрасцук Хорст, Ганте Йоахим, Вурциге Ханнс, Бернотат-Даниеловски Сабине, Мельцер Гвидо
МПК / Мітки
МПК: C07D 413/06, A61P 19/10, A61K 31/496, C07D 263/20, A61P 35/00, A61P 43/00, C07D 413/10, A61K 31/42, C07D 413/14, A61K 31/421, A61P 7/02, A61P 9/00, C07D 263/24, A61K 31/495, A61P 9/10, A61K 31/445
Мітки: одержання, похідні, фармацевтична, оксазолідинонкарбонової, композиція, спосіб, кислоти
Код посилання
<a href="https://ua.patents.su/15-35607-pokhidni-oksazolidinonkarbonovo-kisloti-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-i-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні оксазолідинонкарбонової кислоти, спосіб їх одержання, фармацевтична композиція і спосіб її одержання</a>
Попередній патент: Спосіб лікування гнійно-септичних захворювань м’яких тканин
Наступний патент: Механізм повороту лопаток осьової турбомашини
Випадковий патент: Спосіб отримання діагностичних сироваток до фітопатогенних вірусів



















