Похідна морфоліну або її фармацевтично прийнятна сіль та фармацевтична композиція на її основі
Номер патенту: 41350
Опубліковано: 17.09.2001
Автори: Цукамото Сін-іті, Хаясібе Сатосі, Ямагуті Токіо, Сузукі Такаюкі, Яцугі Сін-іті, Фудзі Міцуо
Формула / Реферат
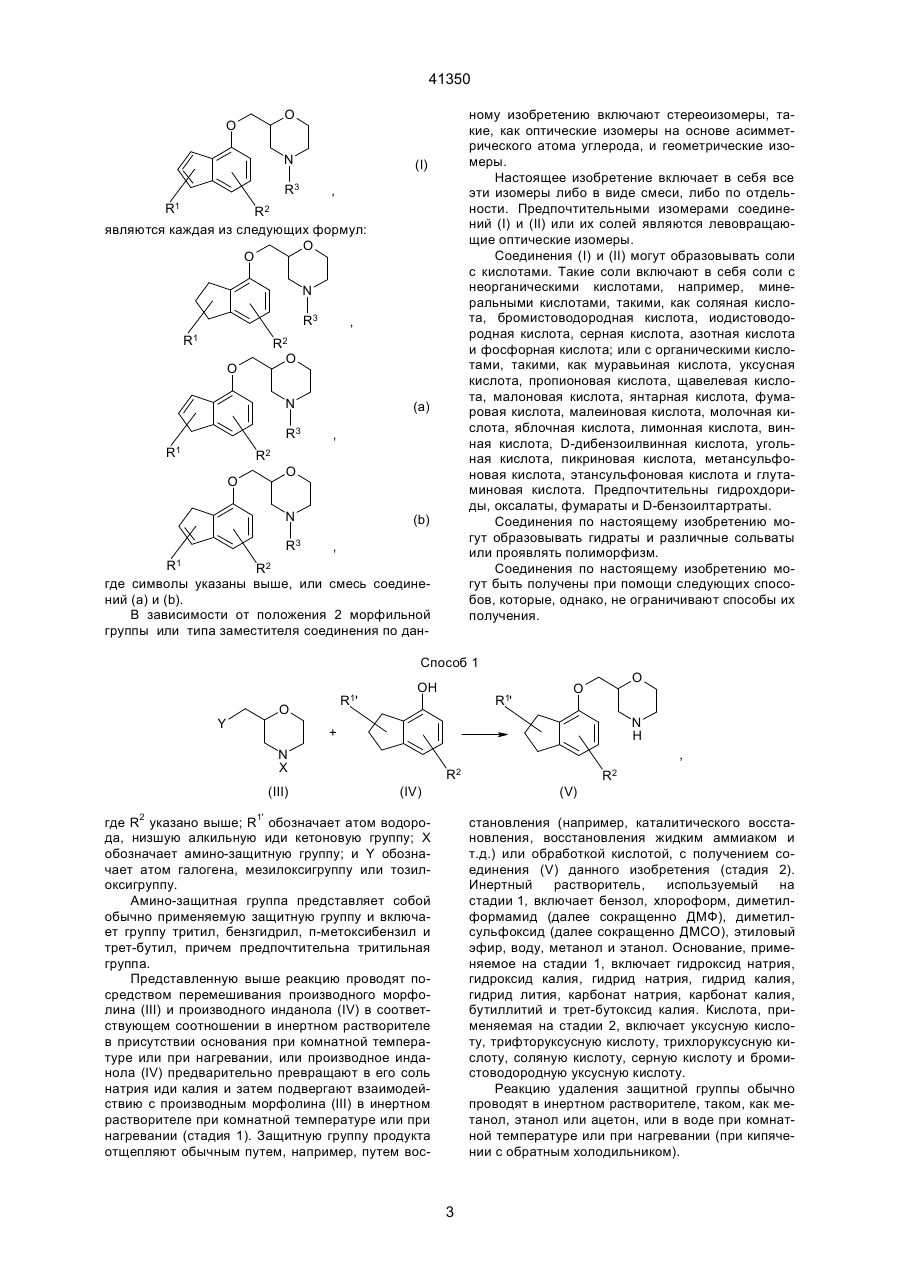
I. Производное морфолина, представленное формулой (1):
где R1 и К3, которые могут быть одинаковыми или различными, каждый, обозначают атом водорода или низшую алкильную группу;
R2 обозначает атом галогена; и пунктирная линия обозначает необязательную двойную связь, или его фармацевтически приемлемая, соль.
2. Производное морфолина по п.1 или его фармацевтически приемлемая соль, отличающееся тем, что производным морфолина является левовращающий оптический изомер.
3. Производное морфолина по п.1, отличающееся тем, что производным морфолина является 2 - {[(7- фтор-4-инданил) окси] - метил} морфолин.
4. Производное морфолина по п.2, отличающееся тем, что производным морфолина является (-)-2- {[( 7- фтор-4- инданил) окси ]- метил} морфолин.
5. Производное морфолина по п.1, отличающееся тем, что производным морфолина является фумарат (-)-2- {[(7-фтор-4-инданил)окси]метил } морфолин.
6. Производное морфолина по п.1, отличающееся тем, что производным морфолина является гидрохлорид(-)-2- {[7-фтор-4-инданил) окси] метил} морфолин.
7. Фармацевтическая композиция, обладающая антагонизмом в отношении рецепторов 5-НТ2 и ингибирующей реассимиляцию 5-НТ активностью, содержащая в качестве активного ингредиента производное морфолина и фармацевтически приемлемый носитель, отличающаяся тем, что в качестве производного морфолина она содержит соединение по любому из п.п. 1-6 или его фармацевтически приемлемую соль.
Текст
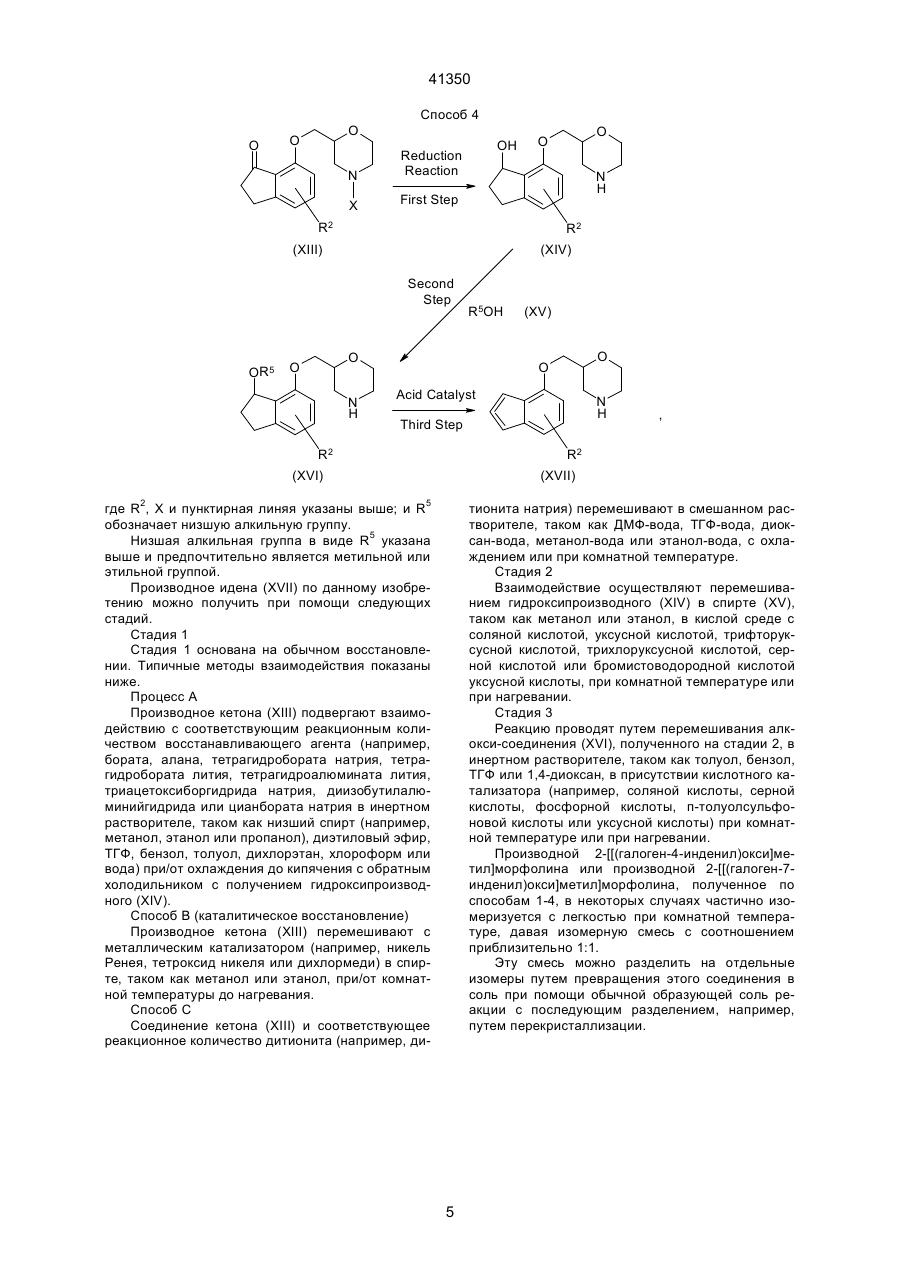
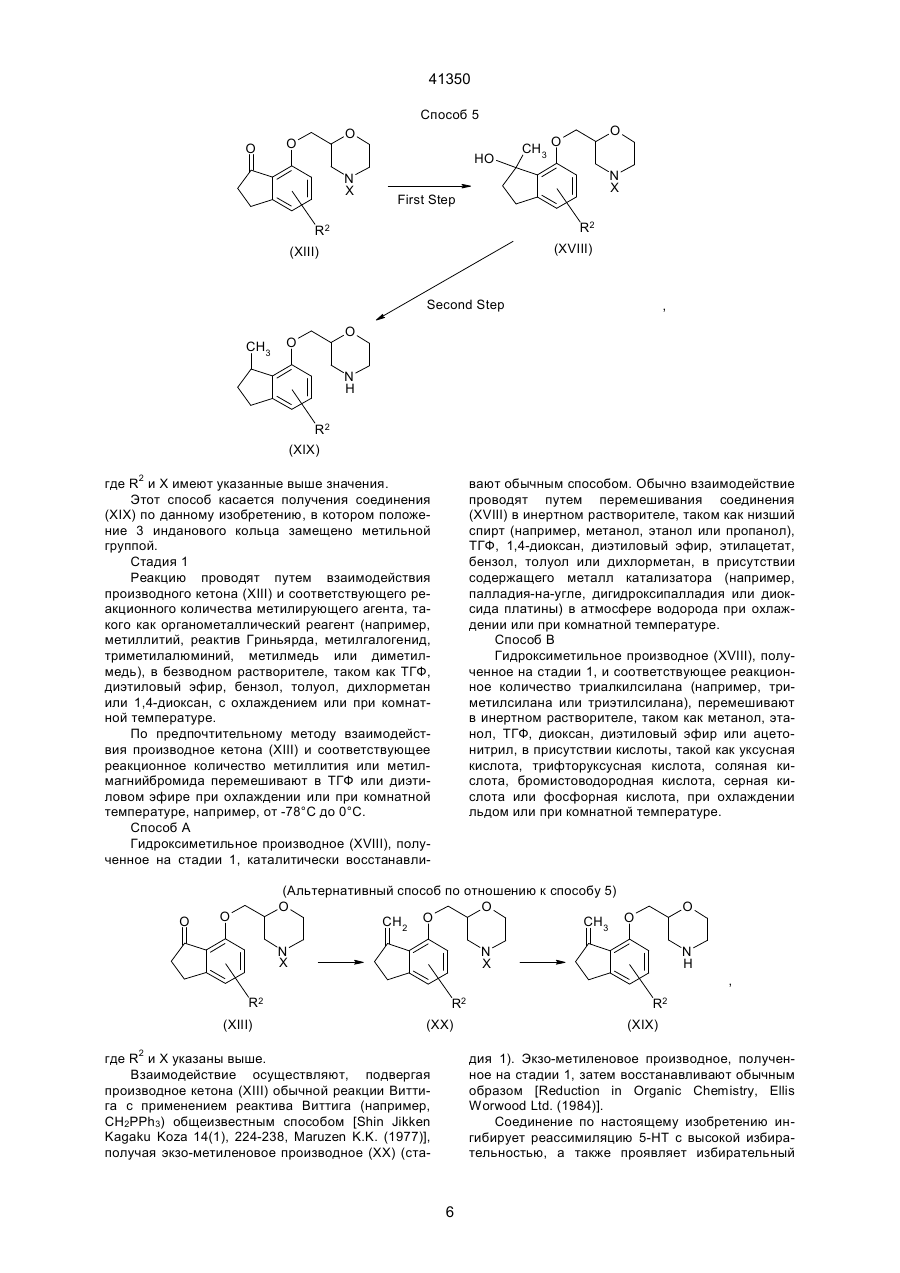
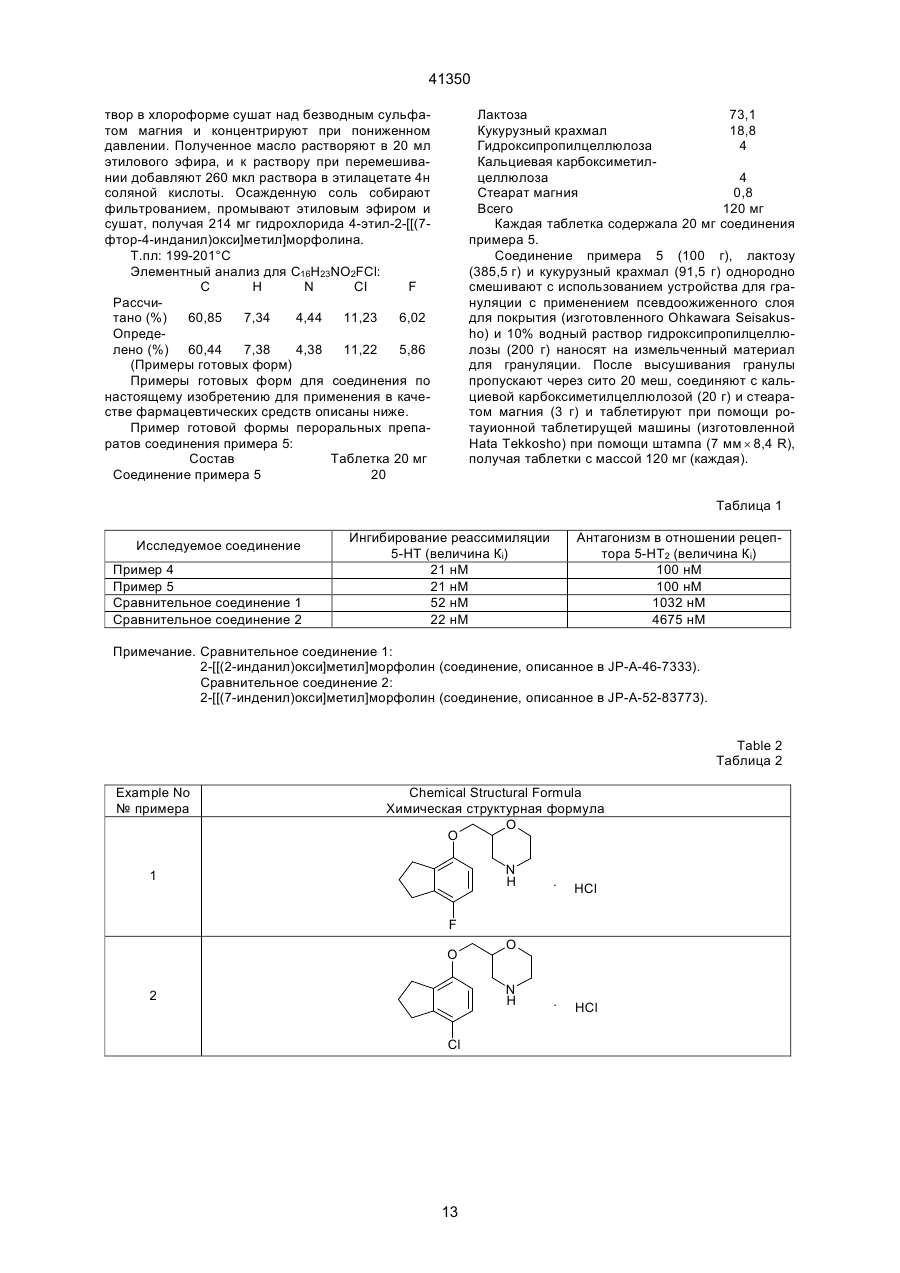
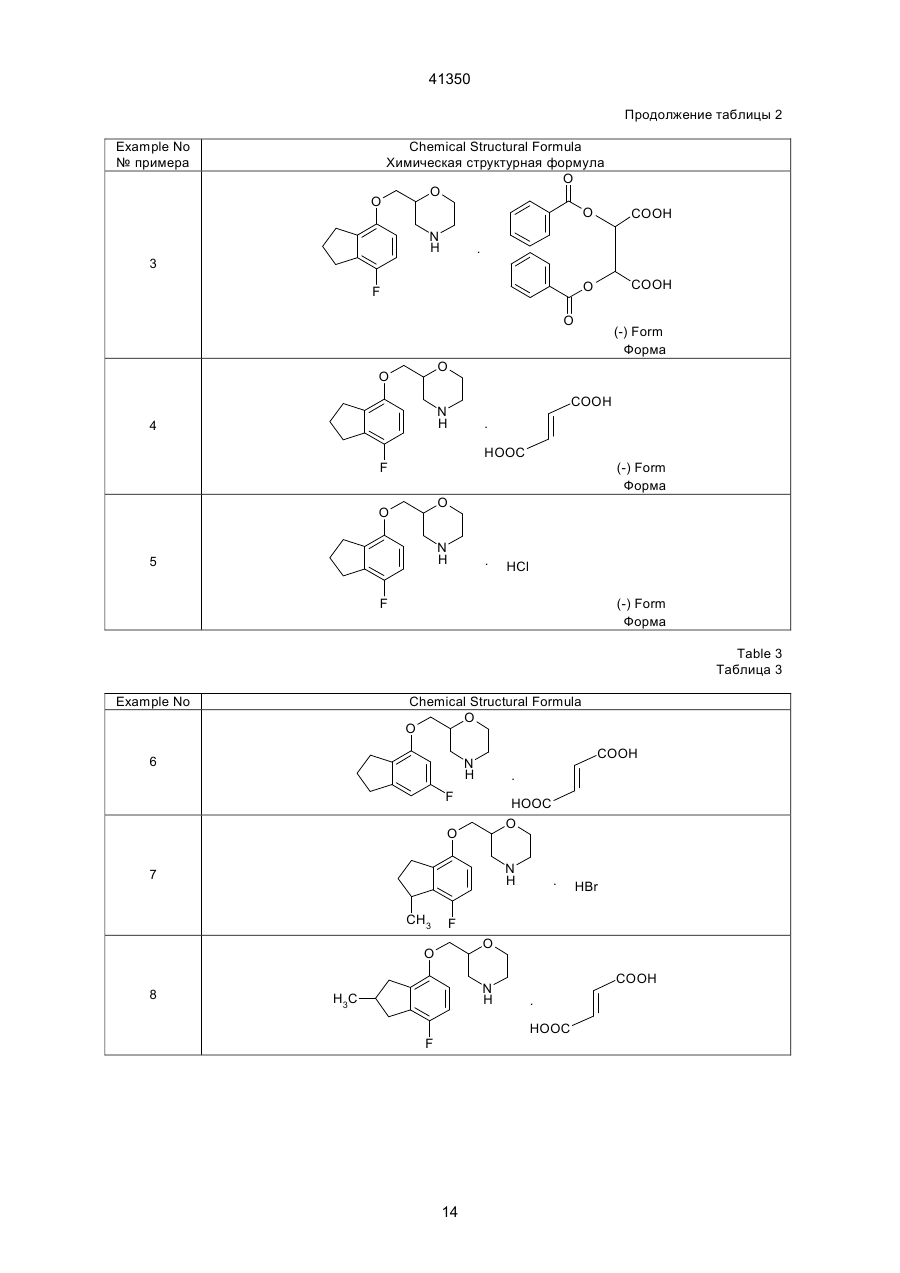
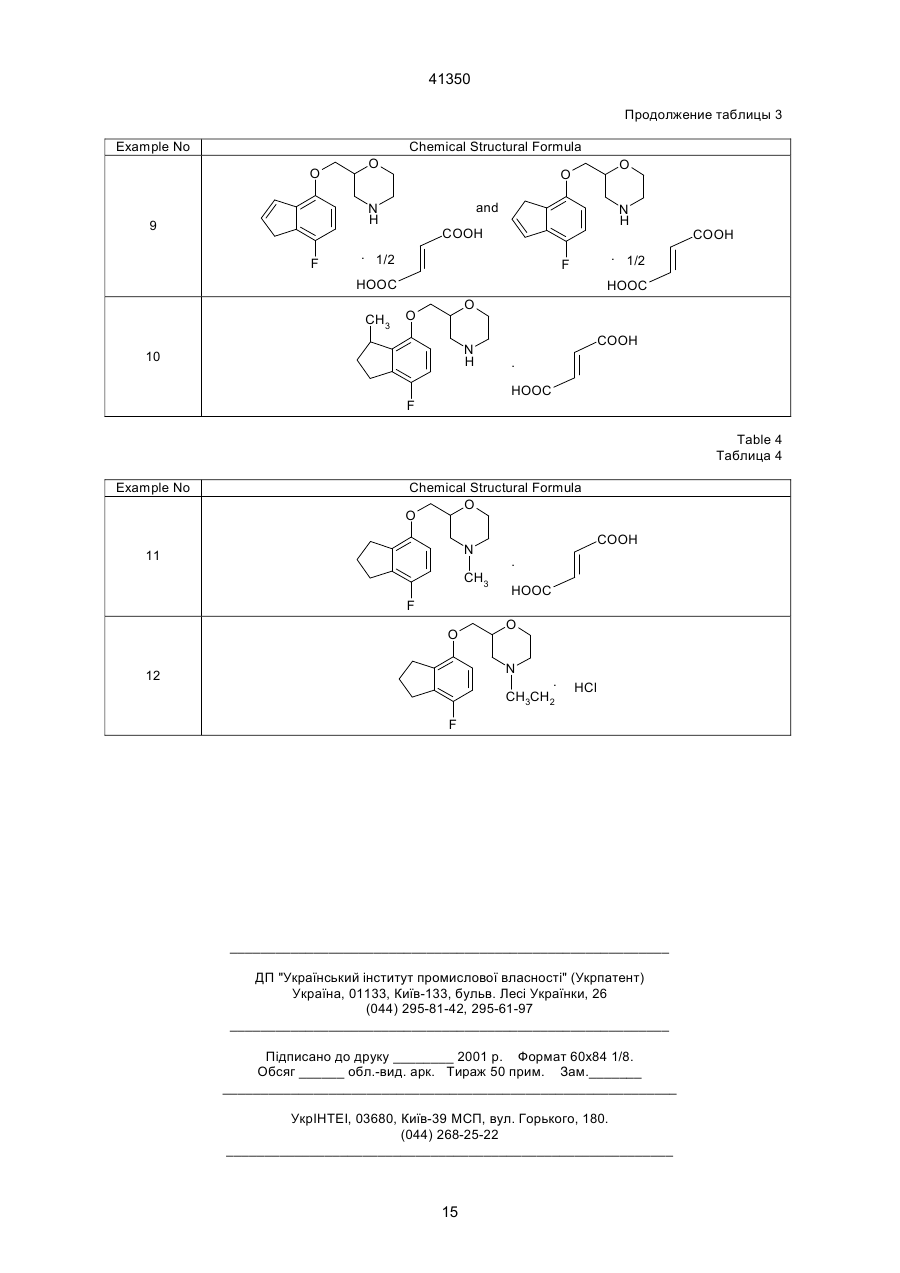
1. Производное морфолина, представленное формулой (1): O O C2 (54) ПОХІДНА МОРФОЛІНУ АБО ЇЇ ФАРМАЦЕВТИЧНО ПРИЙНЯТНА СІЛЬ ТА ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ НА ЇЇ ОСНОВІ 41350 пользовались клинически, включают, например, флуоксетин. Однако сообщалось, что флуоксетин вызывает тревогу или бессонницу во время курса лечения [Physician's Desk Reference, Medical Economics Company, Oradell, NJ (1990)]. Лекарственные средства, являющиеся избирательными антагонистами рецепторов 5-НТ2, включают, например, миансерин, который известен как антидепрессант. В последних различных исследованиях отражена необходимость в соединении, имеющем избирательную ингибирующую активность в отношении реассимиляции 5-НТ вместе с избирательной антагонистической активностью в отношении рецептора 5-НТ2 [Cell Biology to Pharmacology and Therapeutics, 488-504 (1990), Psychopathology, 22 (Suppl. I), 22-36 (1989), J. Chin. Psychiatry, 52, 3438 (1991), Psychopharmaticol. Bill, 26, 168-171 (1990), и Br. Pharmacolo., 100, 793-799 (1990)]. Лекарственные средства, обладающие как ингибирущей активностью в отношении реассимиляции 5-НТ, так и антагонистической активностью в отношении рецепторов 5-НТ2, включают в себя, например, тразодон. Однако ингибирующая реассимиляция 5-НТ активность тразодона очень слаба, и сообщалось, что антидепрессивная активность и успокаивающая активность тразодона основаны на его антагонизме в отношении рецепторов 5-НТ2 [Marec G.J., et al., Psychopharmacology, 109, 2-11 (1992)]. Далее, кроме двух вышеназванных активностей, тразодон также проявляет действенность в отношении d1-рецепторов и поэтому вызывает побочные эффекты, основанные на этой особенности. JР-А-46-7333 (термин "JР-А" обозначает "неподвергнутая экспертизе опубликованная японская патентная заявка") описывает 2-[[(4-инданил)окси]метил]морфолин и JР-А-52-83773 описывает 2-[[(7-инденил)окси]метил]морфолин. Однако эти соединения не имеют заместителя на инданилоксигруппе или на инденилокcигруппе. Данное изобретение касается производного морфолина, которое структурно характеризуется наличием атома галогена в бензольном кольце инданилоксигруппы или инденилоксигруппы и, следовательно, совершенно отлично по химической структуре от обычных соединений. Производное морфолина данного изобретения проявляет избирательную ингибирущую реассимиляцию 5-НТ активность и избирательную антагонистическую активность в отношении рецептора 5-НТ2, и обе активности дают превосходные эффекты. Целью данного изобретения является создание нового производного морфолина, представленного формулой (I), показанной ниже, или его соли. Другой целью данного изобретения является разработка лекарственного средства, обладающего избирательной ингибирущей реассимяляцией 5-НТ активностью вместе с избирательной антагонистической активностью в отношении рецепторов 5-НТ2, которое содержит в качестве активного ингредиента соединение (I) по данному изобретению или его соль, и разработка фармацевтической композиции, содержащей соединение (I) по дан ному изобретению или его соль и фармацевтически приемлемый носитель. Данное изобретение включает соединение, представленное формулой (II), показанной ниже, которое входит в соединение (I) по данному изобретению, bли его соль и, следовательно, дальнейшей целью данного изобретения является разработка соединения (II). 1) Производное морфолина, представленное формулой (I), и его соль: O O N R3 (I) , R1 R2 где R1 и R3, которые могут быть одинаковыми или различными, каждый обозначает атом водорода или низшую алкильную группу; R2 обозначает атом галогена; и пунктирная линия может указывать на необязательную двойную связь. 2) Производное морфолина, представленное формулой (II), или его соль: O O N R3 R1 (II) , R2 где R1 и R3, которые могут быть одинаковыми или различными, каждый обозначает атом водорода или низшую алкильную группу, и R2 обозначает атом галогена. Соединения по данному изобретению описаны ниже более детально. Если нет других указаний, терминология "низший" применяется для общих формул при обозначении прямой или разветвленной углеродной цепи, содержащей от 1 до 6 атомов углерода. Конкретными примерами "низшей алкильной группы" являются метил, этил, пропил, изопропил, бутил, изобутил, вторбутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, 1-метилбутил, 2-метилбутил, 1,2-диметилпропил, гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2диметилбутил, 1,3-диметибутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1этил-1-метилпропил и 1-этил-2-метилпропил. Предпочтительна низшая алкильная группа, имеющая от 1 до 3 атома углерода, такая, как метил, этил, пропил или изопропил. "Атом галогена" включает атом фтора, атом хлора, атом брома и атом йода, причем предпочтителен атом фтора. Пунктирная линия подразумевает, что кольцо индана может иметь двойную связь. Т.е., в соответствии с этим значением пунктирной линии, примерами структуры формулы (I): 2 41350 ному изобретению включают стереоизомеры, такие, как оптические изомеры на основе асимметрического атома углерода, и геометрические изомеры. Настоящее изобретение включает в себя все эти изомеры либо в виде смеси, либо по отдельности. Предпочтительными изомерами соединений (I) и (II) или их солей являются левовращающие оптические изомеры. Соединения (I) и (II) могут образовывать соли с кислотами. Такие соли включают в себя соли с неорганическими кислотами, например, минеральными кислотами, такими, как соляная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; или с органическими кислотами, такими, как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, D-дибензоилвинная кислота, угольная кислота, пикриновая кислота, метансульфоновая кислота, этансульфоновая кислота и глутаминовая кислота. Предпочтительны гидрохдориды, оксалаты, фумараты и D-бензоилтартраты. Соединения по настоящему изобретению могут образовывать гидраты и различные сольваты или проявлять полиморфизм. Соединения по настоящему изобретению могут быть получены при помощи следующих способов, которые, однако, не ограничивают способы их получения. O O N (I) R3 , R1 R2 являются каждая из следующих формул: O O N R3 R1 , R2 O O N R3 R1 (a) , R2 O O N R3 (b) , R1 R2 где символы указаны выше, или смесь соединений (а) и (b). В зависимости от положения 2 морфильной группы или типа заместителя соединения по дан Способ 1 Y R1' O OH R1' O O N H + , N X (III) R2 (IV) R2 (V) где R2 указано выше; R1' обозначает атом водорода, низшую алкильную иди кетоновую группу; Х обозначает амино-защитную группу; и Y обозначает атом галогена, мезилокcигруппу или тозилоксигруппу. Амино-защитная группа представляет собой обычно применяемую защитную группу и включает группу тритил, бензгидрил, п-метоксибензил и трет-бутил, причем предпочтительна тритильная группа. Представленную выше реакцию проводят посредством перемешивания производного морфолина (III) и производного инданола (ІV) в соответствующем соотношении в инертном растворителе в присутствии основания при комнатной температуре или при нагревании, или производное инданола (ІV) предварительно превращают в его соль натрия иди калия и затем подвергают взаимодействию c производным морфолина (III) в инертном растворителе при комнатной температуре или при нагревании (стадия 1). Защитную группу продукта отщепляют обычным путем, например, путем вос становления (например, каталитического восстановления, восстановления жидким аммиаком и т.д.) или обработкой кислотой, с получением соединения (V) данного изобретения (стадия 2). Инертный растворитель, используемый на стадии 1, включает бензол, хлороформ, диметилформамид (далее сокращенно ДМФ), диметилсульфоксид (далее сокращенно ДМСО), этиловый эфир, воду, метанол и этанол. Основание, применяемое на стадии 1, включает гидроксид натрия, гидроксид калия, гидрид натрия, гидрид калия, гидрид лития, карбонат натрия, карбонат калия, бутиллитий и трет-бутоксид калия. Кислота, применяемая на стадии 2, включает уксусную кислоту, трифторуксусную кислоту, трихлоруксусную кислоту, соляную кислоту, серную кислоту и бромистоводородную уксусную кислоту. Реакцию удаления защитной группы обычно проводят в инертном растворителе, таком, как метанол, этанол или ацетон, или в воде при комнатной температуре или при нагревании (при кипячении с обратным холодильником). 3 41350 Способ 2 First Step OH Y Second Step O (VII) O H2N O Base R1 OSO3H O O (IX) N H Base R2 R1 R1 R2 (VI) (X) (VIII) где R1, R2, Y и пунктирная линия указаны выше. Стадия 1: синтез галоген-4-инданил (или инденил)глицидилового эфира Галоген-4-инданил (или инденил)глицидиловый эфир (VIII) можно синтезировать взаимодействием производного инданола (или инденола (VI) и производного пропиленоксида (VII) в растворителе, таком как вода, ацетон или ацетонитрил, в присутствии основания, такого как гидроксид натрия, гидроксид калия или карбонат калия, в условиях от 0°С до кипячения с обратным холодильником. Стадия 2: синтез 2-[[галоген-4-инданил (или инденил)окси]метил]-морфолина 2-[[(Галоген-4-инданил(или инденил)окси]метил]морфолин (X) можно синтезировать взаимодействием галоген-4-инданил (или инденил) глицидилового эфира (VIII) и аминоэтилсерной кислоты (IX) в смешанном растворителе, таком как вода-метанол или вода-этанол, в присутствии основания, такого как гидроксид натрия или гидроксид R2 калия, при условиях от 0°С до кипячения с обратным холодильником. Полученное таким образом соединение (X) по данному изобретению может быть преобразовано в соль с кислотой, такой как соляная кислота, фумаровая кислота, янтарная кислота, щавелевая кислота, Д-дибензоилвинная кислота и т.д. По способам 1 и 2, в которых используют оптически активное соединение морфолина (III) или оптически активное производное пропиленоксида (VII), может быть получен соответствующий оптически активный 2-[[(галоген-4-инданил (или инденил))окси]метил]морфолин. Соединение, полученное по способам 1-5, может быть очищено для повышения оптической чистоты перекристаллизацией с применением Ддибензоилвинной кислоты, Д-дитолуоилвинной кислоты, Д-винной кислоты и т.д. в качестве разделяющих агентов и смеси ацетонитрил-вода, метанол, диметилформамид и т.д, в качестве растворителя перекристаллизации. Способ 3 O O O O R4 N H Z (XI) N R4 R1 (X) R1 R2 , R2 (XII) где R1, R2 и пунктирная линия имеют указанное выше значение; R4 обозначает низшую алкильную группу; Z обозначает атом галогена, арилсульфонилоксигруппу, низшую алкилсульфонилоксигруппу или алкилсульфатную группу. Арилсульфонилоксигруппа включает фенилсульфонилоксигруппу и п-толуолсульфонилоксигруппу; низшая алкилсульфонилоксигруппа включает метилсульфонилоксигруппу, этилсульфонилоксигруппу и пропилсульфонилоксигруппу; и алкилсульфатная группа включает метилсульфатную группу, этилсульфатную группу и пропилсульфатную группу. Соединения по данному изобретению могут быть получены N-алкилированием обычным способом. N-алкилирование проводят взаимодействием незамещенного производного морфолина (X) с соответствующим реакционным количеством алкилирующего агента (ХI) в инертном растворите ле, таком как ацетон, ацетонитрил, тетрагидрофуран (далее сокращенно ТГФ), этиловый эфир или ДМФ, в присутствии основания, такого как карбонат калия, гидрид натрия или гидрид калия, при комнатной температуре или при повышенной температуре (или при кипячении о обратным холодильником). (Альтернативный способ) Альтернативно, N-алкилирование можно проводить перемешиванием незамещенного производного морфолина (X) в присутствии соответствующего реакционного количества низшего алкилальдегида и боргидрида натрия, триацетоксиборгидрида натрия, цианоборгидрида натрия и т.д. в инертном растворителе, таком как матенол, этанол, ТГФ или диоксан, при комнатной температуре или при повышенной температуре. Это взаимодействие предпочтительно осуществляют в кислой среде с добавлением соляной кислоты, уксусной кислоты, муравьиной кислоты и т.д. 4 41350 Способ 4 O O O N Reduction Reaction X OH First Step N H R2 R2 (XIII) (XIV) Second Step OR5 R5OH O O O O N H (XV) O O Acid Catalyst N H Third Step , R2 R2 (XVI) (XVII) где R2, X и пунктирная линяя указаны выше; и R5 обозначает низшую алкильную группу. Низшая алкильная группа в виде R5 указана выше и предпочтительно является метильной или этильной группой. Производное идена (ХVII) по данному изобретению можно получить при помощи следующих стадий. Стадия 1 Стадия 1 основана на обычном восстановлении. Типичные методы взаимодействия показаны ниже. Процесс А Производное кетона (ХIII) подвергают взаимодействию с соответствующим реакционным количеством восстанавливающего агента (например, бората, алана, тетрагидробората натрия, тетрагидробората лития, тетрагидроалюмината лития, триацетоксиборгидрида натрия, диизобутилалюминийгидрида или цианбората натрия в инертном растворителе, таком как низший спирт (например, метанол, этанол или пропанол), диэтиловый эфир, ТГФ, бензол, толуол, дихлорэтан, хлороформ или вода) при/от охлаждения до кипячения с обратным холодильником с получением гидроксипроизводного (XIV). Способ В (каталитическое восстановление) Производное кетона (XIII) перемешивают с металлическим катализатором (например, никель Ренея, тетроксид никеля или дихлормеди) в спирте, таком как метанол или этанол, при/от комнатной температуры до нагревания. Способ С Соединение кетона (ХIII) и соответствующее реакционное количество дитионита (например, ди тионита натрия) перемешивают в смешанном растворителе, таком как ДМФ-вода, ТГФ-вода, диоксан-вода, метанол-вода или этанол-вода, с охлаждением или при комнатной температуре. Стадия 2 Взаимодействие осуществляют перемешиванием гидроксипроизводного (XIV) в спирте (ХV), таком как метанол или этанол, в кислой среде с соляной кислотой, уксусной кислотой, трифторуксусной кислотой, трихлоруксусной кислотой, серной кислотой или бромистоводородной кислотой уксусной кислоты, при комнатной температуре или при нагревании. Стадия 3 Реакцию проводят путем перемешивания алкокси-соединения (ХVІ), полученного на стадии 2, в инертном растворителе, таком как толуол, бензол, ТГФ или 1,4-диоксан, в присутствии кислотного катализатора (например, соляной кислоты, серной кислоты, фосфорной кислоты, п-толуолсульфоновой кислоты или уксусной кислоты) при комнатной температуре или при нагревании. Производной 2-[[(галоген-4-инденил)окси]метил]морфолина или производной 2-[[(галоген-7инденил)окси]метил]морфолина, полученное по способам 1-4, в некоторых случаях частично изомеризуется с легкостью при комнатной температуре, давая изомерную смесь с соотношением приблизительно 1:1. Эту смесь можно разделить на отдельные изомеры путем превращения этого соединения в соль при помощи обычной образующей соль реакции с последующим разделением, например, путем перекристаллизации. 5 41350 Способ 5 O O O HO N X CH3 O O N X First Step R2 R2 (XVIII) (XIII) Second Step CH3 , O O N H R2 (XIX) где R2 и Х имеют указанные выше значения. Этот способ касается получения соединения (XIX) по данному изобретению, в котором положение 3 инданового кольца замещено метильной группой. Стадия 1 Реакцию проводят путем взаимодействия производного кетона (XIII) и соответствующего реакционного количества метилирующего агента, такого как органометаллический реагент (например, метиллитий, реактив Гриньярда, метилгалогенид, триметилалюминий, метилмедь или диметилмедь), в безводном растворителе, таком как ТГФ, диэтиловый эфир, бензол, толуол, дихлорметан или 1,4-диоксан, с охлаждением или при комнатной температуре. По предпочтительному методу взаимодействия производное кетона (XIII) и соответствующее реакционное количество метиллития или метилмагнийбромида перемешивают в ТГФ или диэтиловом эфире при охлаждении или при комнатной температуре, например, от -78°С до 0°С. Способ А Гидроксиметильное производное (XVIII), полученное на стадии 1, каталитически восстанавли вают обычным способом. Обычно взаимодействие проводят путем перемешивания соединения (ХVIII) в инертном растворителе, таком как низший спирт (например, метанол, этанол или пропанол), ТГФ, 1,4-диоксан, диэтиловый эфир, этилацетат, бензол, толуол или дихлорметан, в присутствии содержащего металл катализатора (например, палладия-на-угле, дигидроксипалладия или диоксида платины) в атмосфере водорода при охлаждении или при комнатной температуре. Способ В Гидроксиметильное производное (XVIII), полученное на стадии 1, и соответствующее реакционное количество триалкилсилана (например, триметилсилана или триэтилсилана), перемешивают в инертном растворителе, таком как метанол, этанол, ТГФ, диоксан, диэтиловый эфир или ацетонитрил, в присутствии кислоты, такой как уксусная кислота, трифторуксусная кислота, соляная кислота, бромистоводородная кислота, серная кислота или фосфорная кислота, при охлаждении льдом или при комнатной температуре. O O N X O (Альтернативный способ по отношению к способу 5) O O CH2 O CH3 O N H N X , R2 (XIII) R2 (XX) где R2 и Х указаны выше. Взаимодействие осуществляют, подвергая производное кетона (XIII) обычной реакции Виттига с применением реактива Виттига (например, СН2РРh3) общеизвестным способом [Shin Jikken Kagaku Koza 14(1), 224-238, Maruzen K.K. (1977)], получая экзо-метиленовое производное (XX) (ста R2 (XIX) дия 1). Экзо-метиленовое производное, полученное на стадии 1, затем восстанавливают обычным образом [Reduction in Organic Chemistry, Ellis Worwood Ltd. (1984)]. Соединение по настоящему изобретению ингибирует реассимиляцию 5-НТ с высокой избирательностью, а также проявляет избирательный 6 41350 антагонизм в отношении 5-НТ2-рецепторов. Поэтому это соединение применимо в качестве терапевтического средства для лечения депрессии, тревоги, психосоматических заболеваний, нарушения вегетативной регуляции или беспокойства с уменьшенными побочными действиями и в качестве терапевтического средства для лечения критических проявлений, связанных с цереброваскулярными нарушениями или болезнью Альцгеймера, таких как снижение спонтанности, дистимия, беспокойство и нетерпение, галлюцинация и иллюзии, гипохондрия, нарушение сна и т.п. Далее, соединение по настоящему изобретению обладает антирезерпиновым действием, улучшающим вязкость кровидействием, обладает антигипоксическим действием, является антиоксидантом и применимо в качестве средства для мозгового кровоснабжения и улучшения метаболизма или в качестве средства для улучшения функции мозга, а также применимо в качестве аналгетика. Кроме того, соединение по настоящему изобретению можно использовать для лечения церебральной дисфункции дли деменции (слабоумия), сопровождающих болезнь Альцгеймера. Далее подробно описано исследование ингибирования реассимиляции 5-НТ и изучение антагонизма в отношении рецептора 5-НТ2 для демонстрации эффектов соединения по настоящему изобретению. 1) Исследование ингибирования реассимиляции 5-НТ Исследование in vitro Ингибирущую реассимиляцию 5-НТ активность исследуют путем изучения степени ингибирования испытуемым соединением связывания [3Н]-циталопрама сайтами реассимиляция 5-НТ. Используют метод D'amato R.J. et al., описанный в J. Pharmacol. Exp. Ther., 242, 364 (1987). Буферному раствору (0,5 мл), содержащему приблизительно 1,0 нМ [3Н]-циталопрама, мембранного препарата коры крысиного головного мозга (приблизительно 0,4 мг белка), и испытуемому соединению дают взаимодействовать при 25°С в течение 60 минут. После этого меченый лиганд связанной формы отделяют от меченого лиганда свободной формы фильтрованием с отсасыванием. Количество лиганда, связанного неспецифически с сайтами реассимиляции 5-НТ, которое получают добавлением избытка немеченного флуоксетина (10 мкМ), вычитают из общего количества связавшегося лиганда, получая количество лиганда, специфически связанного с сайтами реассимиляции 5-НТ. IC50 (концентрацию, которая уменьшает количество специфически связанного лиганда на 50%) рассчитывают для каждого соединения и превращают в константу диссоциации (величину Кi). Исследование in vivo Изучают усиление действия L-5-гидрокситриптофана, который является предшественником 5-НТ [Naunyn-Schmildeberg's Archives of Pharmacology, 311, 185-192 (1980)]. Используют самцов 1СR мышей весом 30-40 г. Исследуемое лекарственное средство вводят внутрибрюшинно и, спустя 30 минут, инъецируют внутривенно 90 мг/кг L-5-гидрокситриптофана. Спустя 5 минут после инъекций, животных наблюдают в течение 5 минут в отношении тремора, трясения головы и абдукции задних конечностей. Исследуемые лекарственные средства оценивали по ED50 в проявлении каждого действия. 2) Тест на избирательность в ингибировании реассимиляции 5-НТ Определяют степень ингибирования тестсоединением поглощения [3Н]-5-НТ, [3H]-норадреналина и [3Н]-допамина в синаптосомы. Используют способ Harada and Maeno, описанный в Biochem. Pharmacol., 28, 2645 (1979). Самца крысы Wistar декапитируют и извлекают кору головного мозга и полосатое тело (corpus striatum). Фракцию синаптосом коры головного мозга готовят для поглощения 5-НТ и норадреналина, а фракцию синаптосом полосатого тела готовят для поглощения допамина. Каждую фракцию синаптосом инкубируют при 37°С в течение 3 минут и в соответствующие фракции добавляют [3H]-5-HT, [3Н]-норадреналин и [3Н]-допамин (10-7 М). После дальнейшей инкубации в течение 2 минут систему охлаждают льдом (0°С) для остановки реакции. Затем реакционную систему фильтруют через стеклянные фильтры Whatman CF/B и уловленную на фильтрах радиоактивность измеряют в жидкостном сцинтилляционном счетчике. Неспецифическую активность получают с применением реакционной системы, не содержащей лекарственного средства и инкубированной при 0°С. Тестируемое лекарственное средство оценивают по IС50 (концентрации, при которой поглощение каждого радиоактивного лиганда уменьшается на 50%). 3) Тест на антагонизм в отношении 5-НТ2рецепторов (in vitro) Определяют степень ингибирования тестсоединением связывания [3Н]-Кетансерина. Используют способ Leysen J.E. et al., описанный в Моl. Pharmacol., 21, 301 (1982). Буферному раствору (0,5 мл в целом), содержащему приблизительно 1,0 нМ [3Н]-Кетансерин, мембранный препарат коры крысиного головного мозга (приблизительно 0,2 мг белка), и тест-соединение, дают взаимодействовать при 25°С в течение 30 минут. После этого связанный меченый лиганд отделяют фильтрованием с отсасыванием. Количество лиганда, связанного неспецифически с 5-НТ2-рецепторами, которое получают добавлением избытка немеченого Метерголина (10 мкМ), вычитают из общего количества связанного лиганда, получая количество лиганда, связанного специфически с 5НТ2-рецепторами. C50 (концентрацию, при которой количество специфически связанного лиганда уменьшается на 50%) рассчитывают для каждого соединения и превращают в константу диссоциации (величину К). (Результаты тестов) Описанные выше исследования показывают, что соединение по настоящему изобретению обладает как ингибирующей peaссимиляцию 5-НТ активностью, так и антагонистической активностью в отношении рецепторов 5-НТ2 in vitro и обе активности дают превосходные эффекты. В противоположность этому, сравниваемые соединения обнаруживают очень слабый антагонизм в отношении рецептора 5-НT2, проявляя ингибирующую 7 41350 реассимиляцию 5-НТ активность (см. табл. 1 ниже). Далее в испытаниях in vivo на ингибирование реассимиляции 5-НТ ED50 соединения, например, примера 4, в проявлении тремора, трясения головы и абдукции задних ног, составляет 6,3 мг/кг, 7,2 мг/кг и 14,1 мг/кг, соответственно, что свидетельствует о сильной ингибиторной активности в отношении реассимиляции (повторного включения) 5-НТ. В тесте на избирательное ингибирование реассимиляции 5-НТ IС50 для соединения, например, примера 1, в ингибировании поглощения [3Н]-5-НТ, [3Н]-норадреналина и поглощения [3H]-допамина составляет 227 нМ, 6722 нМ и 10000 нМ или более, соответственно. Эти результаты показывают, что ингибирующая поглощение [3H]-5-НT активность соединения примера 1 приблизительно в 30 раз или более выше ингибирущей поглощение [3H]-норадреналина активности, а ингибирущая поглощение [3H]-допамина активность показывает, следовательно, избирательность в отношении поглощения 5-НТ. В соответствии с этим можно ожидать, что соединение по настоящему изобретению не будет вызывать побочного действия, наблюдаемого с соединениями, имеющими неизбирательные ингибирующие поглощение активности, например, побочные действия на сердечно-сосудистую систему (например, учащенное сердцебиение), и другие побочные эффекты, такие, как жажда и задержка мочи. Препараты, содержащие, по меньшей мере, одно из соединений по настоящему изобретению или его соль в качестве активного ингредиента, могут быть приготовлены с применением носителей, наполнителей и других добавок, применяемых в фармацевтических препаратах. Носителями или наполнителями, применяемыми в препаратах, могут быть твердые или жидкие носители, включающие лактозу, стеарат магния, крахмал, тальк, желатин, агар, пектин, аравийскую камедь (гуммиарабик), оливковое масло, кунжутное масло, какао-масло, этиленгликоль и другие, применяемые обычно. Соединения по настоящему изобретению можно вводить перорально в дозированной форме таблеток, пилюль, капсул, гранул, порошков, жидкостей и т.д. или парентерально в дозированной форме инъекций, например, для внутривенного или внутримышечного введения, суппозиториев или препаратов для чрескожного введения. Обычно доза находится в диапазоне от 1 до 1000 мг, предпочтительно 10-300 мг, в день для взрослых, даваемая обычно в однократной дозе или в виде нескольких разделенных доз, которые изменяются в зависимости от возраста, веса тела и состояния больных, терапевтического действия, периода лечения, способа введения и т.п. Само собой разумеется, что более низкие дозы могут быть достаточными в некоторых случаях, поскольку доза может варьировать в зависимости от различных условий, как упомянуто выше. Наилучший вариант выполнения данного изобретения Далее настоящее изобретение будет более подробно иллюстрировано примерами, но следует учесть, что изобретение не ограничивается этими примерами. Получение исходных соединений, применяемых в примерах, объясняется в справочных примерах. Химические структуры полученных в примерах соединений показаны в табл. 2-4. Справочный пример 1 (i) Аминоэтилсульфат (423,6 г, 3,00 моля) растворяют в 70% водном растворе гидроксида натрия (360 мл) и добавляют к нему метанольный раствор (400 мл) аллилглицидилового эфира (68,4 мг, 0,60 моля) по каплям при 50°С. После перемешивания смеси при этой температуре в течение 1 часа к ней добавляют 70% водный раствор гидроксида натрия (600 мл) с последующим перемешиванием при той же температуре в течение 13 часов. После завершения реакции к реакционной смеси добавляют воду при комнатной температуре и смесь экстрагируют хлороформом (6 ´ 1000 мл). Экстракт промывают водным раствором хлорида натрия (2 ´ 200 мл) и сушат над сульфатом магния. Растворитель удаляют упариванием, и остаток перегоняют при пониженном давлении, получая 2-(аллилоксиметил)морфолин (75,2 г) в виде бесцветного маслянистого вещества. Физико-химические свойства: 1 Н-ЯМР (CDCI3) d: 2,65 (дд, J=10,3 Гц, J=12,2 Гц, 1Н), 2,74-2,93 (м, 3Н), 3,36-3,49 (М, 2Н), 3,59-3,70 (м, 2Н), 3,90 (дд, J=1,9 Гц, J=11,7 Гц, 1Н), 4,01 (дд, J=0,96 Гц, 5,84 Гц, 9Н), 5,17-5,25 (м, 1Н, 11-Н), 5,28-5,30 (м, 1Н, 11-Н), 5,86-5,96 (м, 1Н, 10-Н) МS (GС/MS): m/z 157 (M+). (ii) 2-(аллилоксиметил)морфолин (39,5 г, 0,25 моля) растворяют в 1,4-диоксане (500 мл) и добавляют к раствору тертбутоксид калия (28,2 г, 0,25 моля) при комнатной температуре с последующим кипячением с обратным холодильникам в течение 3 часов. После завершения реакции к реакционной смеси добавляют воду при комнатной температуре, и реакционную смесь экстрагируют хлороформом (3 ´ 1000 мл). Экстракт промывают насыщенным водным раствором хлорида натрия (1000 мл) и сушат над сульфатом магния. Растворитель удаляют, получая 2-(1-пропенил-оксиметил)морфолин (40,0 г) в виде бледно-желтого маслянистого вещества. Физико-химические свойства: 1 Н-ЯМР (CDCI3) d: 1,58 (дд, J=1,80 Гц, J=6,84 Гц, 3Н, 10-Н), 2,752,92 (м, 2Н), 3,46-4,10 (м, 7Н), 4,42 (дк, J=1,70 Гц, J=6,57 Гц, 1H), 5,96 (дк, J=1,70 Гц, 6,21 Гц, 1H) МS (GC/MS): m/z 157 (М+). (ііi) Неочищенный 2-(1-пропенилоксиметил) морфолин (32,7 г) растворяют в ацетон-водном (9:1) смешанном растворителе, содержащем 2,0 NHCI, c последующим нагреванием при дифлегмации в течение 4 часов. После завершения реакции растворитель выпаривают, получая неочищенное спиртовое соединение (41,8 г) в виде бледно-желтого маслянистого вещества. Триэтиламин (300 мл) добавляют по каплям к раствору в метиленхлориде (300 мл) неочищенного спиртового соединения (41,8 г) при охлаждения на льду и 8 41350 и реакционную смесь экстрагируют хлороформом. Экстракт промывают насыщенным водным раствором хлорида натрия и сушат над сульфатом магния. Растворитель выпаривают, и образующийся остаток очищают при помощи колоночной хроматографии на силикагеле. Из элюата, полученного с применением смеси гексан-этилацетат (9:1), получают 4-фтор-7-гидрокси-1-инданон (5,75 г) в виде бледно-желтого порошка. Физико-химические свойства: 1 Н-ЯМР (CDCI3) d: 2,68-2,82 (м, 2Н), 3,08-3,20 (м, 2Н), 6,73 (дд, J=3,06 и 8,91 Гц, 1Н), 7,13 (д, J=8,91 Гц, 1Н) 8,79 (с, 1Н) МS (GС/MS): m/z 166 (М+). (iii) 4-фтор-7-гидрокси-1-инданон (1,0 г) растворяют в уксусной кислоте (15 мл), и раствор перемешивают с 10% палладием-на-угле (0,5 г) в атмосфере водорода при атмосферном давлении в течение 12 часов. Использованный катализатор удаляют фильтрованием при помощи целита, и фильтрат концентрируют, получая 7-фтор-4инданол (0,783 г), Физико-химические свойства: 1 Н-ЯМР (СDСІ3) d: 1,95-2,32 (м, 2Н), 2,75-3,10 (м, 4Н), 4,55 (шир. с, 1H), 6,54 (дд, J=4,05 и 8,46 Гц, 1H), 8,46 (т, J=8,46 Гц, 1Н) МS (GC/MS): m/z 152 (M+). Пример 1 (i) 7-фтор-4-инданол (0,30 г) растворяют в водном растворе (5 мл) гидродсида калия (0,157 г), и раствор перемешивают при комнатной температуре в течение 1 часа. После завершения реакции растворитель выпаривают. К раствору полученного остатка в диметилформамиде (20 мл) добавляют 2-п-толуолсульфонилоксиметил-4-тритилморфолин (1,69 г) с последующим перемешиванием при 105°С в течение 12 часов. После завершения реакции добавляют насыщенный водный раствор гидрокарбоната натрия при охлаждении на льду, и реакционную смесь экстрагируют хлороформом. Экстракт промывают насыщенным водным раствором хлорида натрия (100 мл) и сушат над сульфатом магния. Растворитель удаляют выпариванием, и остаток очищают при помощи колоночной хроматографии на силикагеле. После элюирования смесью гексан-этилацетат (9:1) получают 2-[[(7-фтор-4-инданил)окси]-метил]-4-тритилморфолин (0,54 г). Физико-химические свойства: 1 Н-ЯМР (СDСl3) d: 1,40-2,25 (м, 2Н), 2,60-3,20 (м, 6Н), 3,75-4,05 (м, 5Н), 6,50-7,65 (м, 17H) МS (FAB/рos.): m/z 494 (М++1) (ii) К 20 мл раствора в метаноле 0,54 г 2-[[(7фтор-4-инданил)окси]метил]-4-тритилморфолина добавляют раствор в метаноле (5 мл) концентрированной соляной кислоты (1,30 г, 12,8 ммоля) при комнатной температуре с последующим перемешиванием в течение 30 минут. После завершения реакции реакционную смесь нейтрализуют насыщенным раствором кислого карбоната натрия. Растворитель выпаривают, и к полученному остатку добавляют насыщенный водный раствор хлорида натрия с последующей экстракцией хлороформом. Экстракт промывают насыщенным добавляют трифенилхлорметан (41,5 г, 0,208 моля) при той же температуре с последующим перемешиванием в течение 2 часов. После завершения реакции к реакционной смеси добавляют насыщенный водный раствор кислого карбоната натрия (150 мл), и смесь экстрагируют хлороформом. Экстракт сушат над сульфатом магния, растворитель выпаривают, и остаток перекристаллизовывают из смеси метиленхлорид-гексан, получая 2-гидроксиметил-4-тритилморфолин (48,0 г). Физико-химические свойства: ИК (КВr): 3450 см-1 1 Н-ЯМР (СDCІ3) d: 1,12-1,90 (м, 2Н), 2,80-2,98 (м, 2Н), 3,28-3,56 (м, 3Н), 3,80-4,05 (м, 3Н) 7,06-7,58 (м, 15Н, С(С6Н3)3) МS (FАВ/рos.): m/z 350 [(M+1)+]. (іv) Пиридин (20,3 мл, 0,251 моля) добавляют по каплям к раствору в метиленхлориде (100 мл) содержащего тритильное производное (15,0 г) при охлаждении на льду и к нему добавляют по каплям раствор в метиленхлориде (100 мл) птолуолсульфонилхлорида (15,9 г) при той же температуре с последующим перемешиванием в течение 13 часов. После завершения реакции добавляют водный раствор кислого карбоната натрия при охлаждении на льду с последующей экстракцией хлороформом. Экстракт промывают насыщенным водным раствором хлорида натрия исушат над сульфатом магния. Растворитель выпаривают, и остаток перекристаллизовывают из 1,2-дихлорэтана, получая 2-п-толуол-сульфонилметил-4-тритилморфолин (14,0 г). Физико-химические свойства: ИК (КВr): 1730 см-1 1 H-ЯМР (СDСІ3) d: 1,34-1,70 (м, 2Н), 2,43 (c, 3Н, PhCH3), 2,75-2,94 (м, 2Н), 3,72-4,04 (м, 5Н), 7,10-7,40 (м, 17H), 7,70 (д, J=2,10 Гц, 2Н) МS (FАВ/роs.): m/z 514 [(M+1)+]. Справочный пример 2 (і) Фенол (8,00 г) добавляют к смешанному раствору водного раствора (50 мл) гидроксида натрия (3,43 г) и метиленхлорида (60 мл) при комнатной температуре. Затем добавляют тетрабутиламмонийгидрогенсульфат (0,48 г) и акрилхлорид (7,75 г) по каплям при 0°С с последующим перемешиванием при комнатной температуре в течение 20 минут. После завершения реакции органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия и сушат над сульфатом магния. Растворитель удаляют выпариванием, получая 4-фторфенилакрилат (13,5 г), который используют на следующей стадии без очистки. Физико-химические свойства: 1 Н-ЯМР (CDCI3) d: 5,99 (дд, J=2,43 и 9,81 Гц, 1H), 6,28 (дд, J=9,81 и 16,7 Гц, 1H) 6,62 (дд, J=2,43 и 16,7 Гц, 1Н), 7,08 (д, J=5,94 Гц, 4Н) МS (GС/MS): m/z 166 (M+). (ii) 4-фторфенилакрилат (12,0 г) добавляют к смеси хлорида алюминия (33,7 г) и хлорида натрия (14,8 г), и смесь перемешивают при 80°С в течение 2 часов и затем при 160°С в течение 1 часа. После завершения реакции добавляют ледяную воду и концентрированную соляную кислоту, 9 41350 экстрагируют тремя порциями по 1 л этилового эфира. Этиловый эфир сушат над безводным сульфатом магния и концентрируют при пониженном давления, получая 97 г маслянистого вещества. К 670,4 г аминоэтилсерной кислоты добавляют водный раствор гидроксида калия (гидроксид калия: 313,5 г; вода: 186 мл), и затем к раствору добавляют полученное выше маслянистое вещество, растворенное в 600 мл метанола. Смесь перемешивают при 50°С в течение 4 часов и добавляют водный раствор гидроксида калия (гидроксид калия: 627 г; вода: 380 мл) с последующим дальнейшим перемешиванием при 50°С в течение 18 часов. К реакционной смеси добавляют 2 л воды и 2 л этилового эфира. Весь нерастворенный материал удаляют фильтрованием, и фильтрат экстрагируют трижды порциями по 2 л этилового эфира. Раствор в этиловом эфире сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая 114 г маслянистого вещества. D-дибензоилвинную кислоту растворяют в смешанном растворителе, состоящем из 1 л ацетонитрила и 1,3 л воды, и полученное выше маслянистое вещество, растворенное в 0,5 л ацетонитрила, добавляли при кипячении с обратным холодильником. После кипячения с обратным холодильником в течение 1 часа реакционную смесь охлаждают при перемешивании в ледяной бане. Осажденную соль собирают фильтрованием, промывают ацетонитрилом и сушат, получая 140 г Dдибензоилтартрата (-)-2-[[(7-фтор-4-инданил)окси]-метил]морфолина с оптической чистотой 99,9% е.е. Физико-химические свойства: 1 H-ЯМР (DMSO) d: 2,09 (тт, J=7,2 Гц, 2Н), 2,76 (т, J=7,6 Гц, 2Н), 2,81-2,94 (м, 6Н), 3,09 (д, J=12,4 Гц, 1Н), 3,21 (д, J=12,4 Гц, 1Н), 3,64-3,69 (м, 1Н), 3,84-3,95 (м, 4H), 5,65 (с, 2Н), 6,69 (дд, J=3,6 Гц, J=8,8 Гц, 1Н), 6,89 (дд, J=8,8 Гц, 1Н), 7,51 (дд, J=7,2 Гц, 4Н), 7,64 (дд, J=8 Гц, 2Н), 7,97 (д, J=7,6 Гц, 4Н) MS (FAB/pos.): m/z 252 (M+1)+. Пример 4 К 10 г D-дибензоилтертрата (-)-2-[[(7-фтор-4инданил)окси]метил]морфолина добавляют водный раствор гидроксида натрия (гидроксид натрия: 4 г; вода: 200 мл), и смесь экстрагируют тремя порциями по 200 мл метиленхлорида. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. К остатку добавляют 1,91 г фумаровой кислоты и 110 мл 2-пропанола, и смесь нагревают до полного растворения. Раствор охлаждают на бане со льдом, и осажденную соль собирают фильтрованием, промывают 2-пропанолом и сушат, получая 5,04 г фумарата (-)-2[[(7-фтор-4-инданил)окси]метил]морфолина с оптической чистотой 99,9% е.е. Физико-химические свойства: т.пл.: 141-142°С. Элементный анализ для C18H22NO6F: С Н N F Рассчитано (%) 58,85 6,04 3,81 5,17 Найдено (%) 58,85 6,07 3,84 5,23 водным раствором хлорида натрия и сушкой над сульфатом натрия. Растворитель выпаривают, и полученный остаток очищают на хроматографической колонке с силикагелем, получая 2-[[(7-фтор-4инданил)окси]метил]морфолин (0,236 г) в виде бесцветного маслянистого вещества из элюата, полученного с применением смеси хлороформметанол-концентрированный аммиак (10:1:0,1). Физико-химические свойства: 1 Н-ЯМР (CDCI3) d: 1,90-2,28 (м, 2Н), 2,55-3,17 (м, 8Н), 3,50-4,04 (м, 5Н), 6,56 (дд, J=4,23 и 8,55 Гц, 1H), 6,76 (т, J=8,55 Гц, 1Н) МS (GC/MS): m/z 251 (M+). Полученный 2-[[(7-фтор-4-инданил)окси]метил]морфолин превращают в гидрохлорид, который перекристаллизовывают из смеси метанолдиэтиловый эфир-изопропиловый эфир, получая белые кристаллы. Физико-химические свойства: т.пл.: 169-171°C 1 Н-ЯМР (CDCl3) d: 2,06 (кв., J=7,6 Гц, 2Н), 2,78-3,02 (м, 5Н), 3,153,36 (м,3Н), 3,81 (дт, J=2,0 Гц и 10 Гц, 1Н), 3,904,25 (м, 4Н), 6,76 (дд, J=3,60 и 8,80 Гц, 1H), 6,90 (т, J=8,80 Гц, 1Н) МS (GС/MS): m/z 251 (M+). Элементный анализ для C14H18NO2F·HCI·0,2H2O: C H N Cl F Рассчитано (%) 57,71 6,71 4,81 12,17 6,52 Найдено (%) 57,77 6,67 4,71 12,44 6,50 Пример 2 (i) Тем же самым способом, что и в примере 1(i), за исключением того, что берут 7-хлор-4инданол (0,300 г), получают 2-[[(7-хлор-4-инданил)окси]метил]-4-тритилморфолин (0,790 г) в виде бледно-желтого порошка. Физико-химические свойства 2-[[(7-хлор-4-инданил)окси]метил]-4-тритилморфолин: 1 Н-ЯМР (СDСІ3) d: 1,25-2,23 (м, 6H), 2,66-3,18 (м, 4Н), 3,72-4,31 (м, 5Н), 6,55 (д, J=9,00 Гц, 1H), 7,04 (д, J=9,00 Гц, 1H), 7,12-7,65 (м, 15H) МS (FAB/роs.): m/z 522 [(M+1)+]. (ii) Тем же способом, что и в примере 1-(ii), за исключением того, что берут 2-[[(7-хлор-4-инданил)окси]метил]-морфолин (0,55 г), получают гидрохлорид 1-[[(7-хлор-4-инданил)окси]метил]морфолина в виде бледно-желтого маслянистого вещества. Физико-химические свойства: 1 Н-ЯМР (СDCI3) d: 1,95-2,28 (м, 4Н), 2,85-3,10 (м, 6Н), 3,50-4,15 (м, 5Н), 6,59 (д, J=8,64 Гц, 1H), 7,06 (д, J=8,64 Гц, 1H) MS (EI): m/z 267 (M+), 269 [(М+2)+]. Пример 3 К 72,3 г 7-фтор-4-инданола добавляют водный раствор гидроксида калия (гадроксид калия: 72,3; вода: 150 мл) с последующим перемешиванием до растворения инданола. К этому раствору добавляют 40,8 мл (R)-(-)-эпихлоргидрина с последующим перемешиванием в течение 8 часов. К реакционной смеси добавляют 1 л воды, и смесь 10 41350 ИК (КВr) см-1: 1496, 1246 Н-ЯМР (DMSO) d: 1,23 (д, J=6,8 Гц, 3Н), 1,62-1,70 (м, 1H), 2,222,31 (м, 1H), 2,70-2,78 (м, 1H), 2,83-3,05 (м, 3Н), 3,24 (д, J=12,4 Гц, 1H), 3,33-3,41 (м, 2Н), 3,73-3,78 (м, 1H), 4,01-4,03 (м, 4Н), 6,77 (ДД, J=3,6 Гц, J=8,8 Гц, 1H), 6,90 (дд, J=8,8 Гц, 1H). Пример 8 Фумарат 2-[[(7-фтор-2-метил-4-инданил)окси] метил]морфолина Физико-химические свойства: т.пл.: 146-148°С MS (m/z): 265 (М+-C4H4O4) 1 H-ЯМР (DМSО) d: 1,18 (3Н, д, 7,33 Гц), 1,64-1,71 (1H, м), 2,202,29 (1H, м), 2,60-2,83 (4Н, м), 2,89-2,97 (1H, м), 3,00 (1H, д, 12,2 Гц), 3,05-3,70 (5Н, м), 3,76-3,83 (2Н, м), 3,88-3,97 (2Н, м), 6,51 (2H, с), 6,73-6,76 (1Н, м), 6,87-6,81 (1Н, м). Пример 9 (i) Так же, как в примере 1-(і), за исключением того, что берут 4-фтор-7-гидрокси-1-инданон и 2-птолуолсульфонилоксиметил-4-тритилморфолин, получают 2-[[4-(7-фтор-3-оксиинданил)окси]метил)-4-тритилморфолин. 1 Н-ЯМР (CDCI3) d: 1,40-1,70 (2H, м), 2,62-2,80 (2H, м), 3,03-3,25 (2H, м), 3,28-3,53 (1Н, м), 3,55-3,72 (1Н, м), 3,844,22 (4H, м), 4,31-4,57 (1Н, м), 6,68-6,78 (1Н, м), 7,10-7,60 (16H, м) МS (m/z): 507 (M+). (ii) 2-[[4-(7-фтор-3-оксоинданил)окси]метил]-4тритилморфолин (507 мг, 1,00 ммоль) растворяют в метаноле (30 мл) и добавляют боргидрид натрия (37,8 мг, 1,00 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. После завершения реакции осажденные бесцветные кристаллы собирают фильтрованием, получая 2-[[(7-фтор-3-гидрокси-4-инданил)окси]метил]-4-тритилморфолин (220 мг). К фильтрату добавляют воду, смесь экстрагируют хлороформом, экстракт сушат над безводным сульфатом натрия, и растворитель удаляют выпариванием при пониженном давлении, получая 2-[[4-(7-фтор-3гидрокcи-4-инданил)окси]метил]-4-тритилморфолин (282 мг) в виде бесцветных кристаллов. Полученные кристаллы объединяют с собранными прежде кристаллами, получая 2-[[4-(7-фтор-3гидрокси-4-инданил)окси]метил]-4-тритилморфолин (502 мг, 0,986 ммоля, 99%). Продукт растворяют в этаноле (100 мл), и к раствору добавляют концентрированную соляную кислоту (300 мл) с последующим нагреванием при дефлегмации в течение 1 часа. Реакционную смесь делают слабощелочной путем добавления насыщенного водного раствора гидрокарбоната натрия, этанол удаляют выпариванием при пониженном давлении, и остаток экстрагируют хлороформом. Экстракт сушат над безводным сульфатом натрия, и остаток очищают хромагографически на колонке с силикагелем (хлороформ:метанол=10:1), получая 2-[[4-(3-этокси-7-фтор-4-инданил)окси]метил]-морфолин (257 мг, 93%) в виде бесцветного маслянистого вещества. МS (m/z): 295 (M+) 1 H-ЯМР (CDCl3) d: 1 H-ЯМР (ДМSО) d: 2,05 (тт, J=7,6 Гц, 2H), 2,75-2,89 (м, 8Н), 3,00 (д, J=12,4 Гц, 1H), 3,16 (д, J=12,4 Гц, 1H), 3,63-3,69 (м, 1H), 3,88-4,01 (м, 4Н), 6,51 (c, 2Н), 6,76 (дд, J=3,6 Гц, J=8,8 Гц, 1H), 6,89 (дд, J=8,8 Гц, 1H) MS (GC/MS): m/z 251 (M)+. Пример 5 К 107 г D-дибензоилтартрата (-)-2-[[(7-фтор-4инданил)окси]метил]морфолина добавляют водный раствор гидроксида натрия (гидроксид натрия: 21 г; вода: 1 л), и смесь экстрагируют трижды порциями по 500 мл этилового эфира. Органический слой сушат над безводным сульфатом магния, концентрируют при пониженном давлении и растворяют в 1,2 л этилового эфира. К раствору добавляют 53 мл смеси 4н соляная кислота этилацетат. Осажденную соль собирают фильтрованием, промывают этиловым эфиром и сушат при пониженном давлении, получая 47,8 г гидрохлорида (-)-2-[[(7-фтор-4-инданил)окси]метил]морфолина. Физико-химические свойства гидрохпорида (-)-2-[[(7-фтор-2-инданил) окси]метил]морфолина: т.пл.: 170-171°C ИК (KBr): 1284 см-1, 1492 см-1 1 H-ЯМР (DМSО) d: 2,05 (тт, J=7,6 Гц, 2Н), 2,80-3,00 (м, 8Н), 3,19 (д, J=12,4 Гц, 1H), 3,33 (д, J=12,4 Гц, 1H), 3,87 (т, J=10,4 Гц, 1H), 3,98-4,04 (м, 3Н), 4,13-4,15 (м, 1H), 6,77 (дд, J=3,6 Гц, J=8,8 Гц, 1H), 6,90 (дд, J=8,8 Гц, 1H) МS (GС/MS): m/z 251 (M+). Элементный анализ для С14H19NO2FCl·0,05H2O: С Н N Cl F Рассчитано (%) 58,25 6,67 4,85 12,28 6,58 Определено (%) 58,14 6,72 4,84 12,18 6,36 1 [d]20= D -3,00. Соединение по примеру 6 получают способом, описанным в примере 1. Пример 6 Фумарат 2-[[(6-фтор-4-инданил)окси]метил] морфолина Исходное соединение: 6-фтор-4-инданол Физико-химические свойства: т.пл.: 173-174°С Элементный анализ для C18H22NO6F: C H N F Рассчитано (%) 58,85 6,04 3,81 5,17 Определено (%) 58,70 5,99 3,77 5,06 MS (GC/MS): m/z 251 (M+) 1 H-ЯМР (DМSО) d: 2,01 (2Н, тт, J=7,32 Гц), 2,68-2,73 (3Н, м), 2,772,86 (3Н, м), 2,93 (1H, д, J=12,21 Гц), 3,09 (1H, д, J=11,72), 3,61 (1H, дт, J=2,44, 11,72 Гц), 3,85-3,88 (2Н, м), 3,95-4,03 (2Н, м), 6,52 (2Н, с), 6,64 (2Н, д, J=10,7 Гц). Таким же способом, который описан в примере 2, получают соединения примеров 7 и 8. Пример 7 Гидробромид 2-[[(7-фтор-1-метил-4-инданил) окси]метил]морфолина Физико-химические свойства: МS (m/z): 265 (М+) 11 41350 1,20 (3Н, т, J=7,1 Гц), 1,88 (1Н, шир. c), 2,132,27 (2Н, м), 2,50-3,25 (6Н, м), 3,35-4,20 (5Н, м), 3,60 (2H, к, J=7,1 Гц), 4,49-5,15 (1H, м) 6,62 (1Н, дд, J=8,4, 3,8 Гц), 6,83 (1Н, дд, J=8,4, 8,4 Гц). (iii) 2-[[4-(3-этокси-7-фтор-4-инданил)окси]метил]морфолин (230 мг, 0,824 ммоля) растворяют в 1,4-диоксане (150 мл), и к раствору добавляют птолуолсульфоновую кислоту (231 мг, 1,65 ммоля) с последующим нагреванием при 105°С в течение 4 часов при перемешивании. Реакцию проводят без конденсатора с реактором для выпаривания образующегося этанола, и потерю растворителя (1,4-диоксана) при выпаривании медленно восполняют для того, чтобы поддерживать постоянную концентрацию. После завершения реакции добавляют кислый карбонат натрия к реакционной смеси и растворитель удаляют выпариванием при пониженном давлении. Остаток растворяют в хлороформе, промывают водой и сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении, и остаток сушат хроматографически на колонке с силикагелем (хлороформ:метанол=10:1), получая 2-[[(7-фтор-4инденил)окси]метил]морфолин (134 мг, 0,526 ммоля, 65%) в виде бледно-желтого маслянистого вещества. Этот продукт растворяют в смешанном растворителе этиловый эфир – метанол, и к раствору медленно добавляют по каплям метанольный раствор фумаровой кислоты (30 мг, 0,259 ммоля) при перемешивании с последующим дальнейшим перемешиванием в течение 30 минут. Осажденные бесцветные кристаллы собирают фильтрованием, получая смесь фумарата 1-[[(7-фтор-4-инденил)окси]метил]-морфолина (1/2) и фумарата 2-[[(4-фтор-7-инденил)окси]метил]морфолина (1/2) (115 мг, 45% в расчете на 2[[4-(3-этокси-7-фтор-4-инданил)окси]метил]морфолин. Соотношение олефиновых изомеров по положению составляет приблизительно 1:1 на основании 1Н-ЯМР. MS (m/z): 249 (M+-1/2C4H4O4) 1 H-ЯМР (DMSO-d6) d: 2,68-2,81 (2Н, м), 2,90 (1Н, д, 12,2 Гц), 1,10 (1Н, д, 12,2 Гц), 3,38-3,41 (1H, м), 3,45-3,49 (1Н, м), 3,58-3,64 (1Н, м), 3,85-3,88 (2Н, м), 3,99-4,08 (2Н, м), 6,50 (1Н, с), 6,59-6,66 (1Н, м), 6,82-7,06 (3Н, м). Элементный анализ для C16H18NO4F·0,4H2O: С Н N F Рассчитано (%) 61,13 5,77 4,31 5,79 Определено (%) 61,10 6,02 4,45 6,04 Пример 10 В 10 мл сухого ТГФ растворяют 320 мг (0,68 ммоля) 2-[[(7-фтор-3-оксо-4-инданил)окси] метил]-4-тритилморфолина, добавляют к раствору раствор в диэтиловом эфире 1,16 М метиллития (3,27 мл, 3,78 ммоля) в атмосфере спирта при -78°С с последующим перемешиванием в течение 2 часов. После завершения реакции температуру повышают до комнатной температуры и добавляют насыщенный водный раствор хлористого аммония. Смесь экстрагируют хлороформом, экстракт сушат над безводным сульфатом натрия и растворитель удаляют выпариванием при пониженном давлении. Остаток растворяют в смешанном растворителе, состоящем из этилацетата (5 мл) и уксусной кислоты (5 мл) и к раствору добавляют палладий-на-угле (500 мг). Раствор пе ремешивают при комнатной температуре в течение 12 часов в атмосфере водорода. После завершения реакции нерастворимый материал удаляют фильтрованием и растворитель удаляют из фильтрата выпариванием при пониженном давлении. К остатку добавляют 1 н водный раствор гидроксида натрия, и раствор экстрагируют хлороформом. Экстракт сушат над безводным сульфатом натрия, и растворитель выпаривают при пониженном давлении. Остаток очищают хроматографически на колонке с силикагелем (хлороформ:метанол:водный аммиак= =20:1:0,1), получая 2-[[(7-фтор-3-метил-4-инданил) окси]метил]морфолин (73 мг, 0,28 ммоля, 44%) в виде бледно-коричневого маслянистого вещества. Этот продукт растворяют в смешанном растворителе этиловый эфир-метанол, и к раствору медленно добавляют при перемешивании метанольный раствор фумаровой кислоты (15 мг, 0,129 ммоля). Осадок собирают фильтрованием, получая фумарат 2-[[(7-фтор-3-метил-4-инданил)окси]метил]морфолина (66 мг, 33% в расчете на 2-[[(7-фтор-3-оксо-4-инданил)окси]метил]-4-тритилморфолин) в виде бесцветных кристаллов. Т.пл.: 133-134°C, 143-144°С МS (m/z): 265 (M+-1/2C4H4O4) 1 H-ЯМР (DMSO-d6) d: 1,19 (3Н, д, 7,33 Гц), 1,64-1,72 (1Н, м), 2,192,29 (1Н, м), 2,62-3,04 (6Н, м), 3,30 (1Н, шир. с), 3,53-3,59 (1Н, м), 3,73-3,88 (2Н, м), 3,88-4,00 (2Н, м), 6,49 (1Н, с), 6,73-6,76 (1Н, м), 6,89-6,91 (1Н, м). Элементный анализ для C17H22NO4F: С Н N F Рассчитано (%) 62,99 6,78 4,26 5,63 Определено (%) 63,14 6,86 4,33 5,88 Пример 11 К 180 мг 2-[[(7-фтор-4-инданил)окси]метил] морфолина добавляют 1 мл 35% водного раствора формальдегида и 1 мл муравьиной кислоты и смесь перемешивают при 80°С в течение 7 часов с последующим концентрированием при пониженном давлении. Концентрат нейтрализуют путем добавления 20 мл насыщенного водного раствора кислого карбоната натрия. Смесь экстрагируют трижды порциями по 20 мл этилового эфира. Раствор в этиловом эфире сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученное масло растворяют в 20 мл этилового эфира, и к раствору при перемешивании добавляют раствор 42 мг фумаровой кислоты в 1 мл метанола. Осажденную соль собирают фильтрованием, промывают этиловым эфиром и сушат, получая 123 мг фумарата 4-метил-2[[(7-фтор-4-инданил)окси]метил]морфолина. Т.пл.: 157-159°С Элементный анализ для C19H24NO6F: С Н F Рассчитано (%) 59,63 6,34 3,67 Определено (%) 59,63 6,31 3,69 Пример 12 В 3 мл ацетона растворяют 220 мг 2-[[(7-фтор4-инданил)окси]метил]морфолина, и к раствору добавляют 121 мг карбоната калия и 70 мкл этилиодида с последующей реакцией при нагревании с дефлегмацией в течение 3 часов. К реакционной смеси добавляют 20 мл воды, и смесь экстрагируют тремя порциями по 20 мл хлороформа. Рас 12 41350 твор в хлороформе сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученное масло растворяют в 20 мл этилового эфира, и к раствору при перемешивании добавляют 260 мкл раствора в этилацетате 4н соляной кислоты. Осажденную соль собирают фильтрованием, промывают этиловым эфиром и сушат, получая 214 мг гидрохлорида 4-этил-2-[[(7фтор-4-инданил)окси]метил]морфолина. Т.пл: 199-201°С Элементный анализ для C16H23NO2FCl: С Н N CI F Рассчитано (%) 60,85 7,34 4,44 11,23 6,02 Определено (%) 60,44 7,38 4,38 11,22 5,86 (Примеры готовых форм) Примеры готовых форм для соединения по настоящему изобретению для применения в качестве фармацевтических средств описаны ниже. Пример готовой формы пероральных препаратов соединения примера 5: Состав Таблетка 20 мг Соединение примера 5 20 Лактоза 73,1 Кукурузный крахмал 18,8 Гидроксипропилцеллюлоза 4 Кальциевая карбоксиметилцеллюлоза 4 Стеарат магния 0,8 Всего 120 мг Каждая таблетка содержала 20 мг соединения примера 5. Соединение примера 5 (100 г), лактозу (385,5 г) и кукурузный крахмал (91,5 г) однородно смешивают с использованием устройства для грануляции с применением псевдоожиженного слоя для покрытия (изготовленного Ohkawara Seisakusho) и 10% водный раствор гидроксипропилцеллюлозы (200 г) наносят на измельченный материал для грануляции. После высушивания гранулы пропускают через сито 20 меш, соединяют с кальциевой карбоксиметилцеллюлозой (20 г) и стеаратом магния (3 г) и таблетируют при помощи ротауионной таблетирущей машины (изготовленной Hata Tekkosho) при помощи штампа (7 мм ´ 8,4 R), получая таблетки с массой 120 мг (каждая). Таблица 1 Исследуемое соединение Пример 4 Пример 5 Сравнительное соединение 1 Сравнительное соединение 2 Ингибирование реассимиляции 5-НТ (величина Кi) 21 нМ 21 нМ 52 нМ 22 нМ Антагонизм в отношении рецептора 5-НТ2 (величина Кi) 100 нМ 100 нМ 1032 нМ 4675 нМ Примечание. Сравнительное соединение 1: 2-[[(2-инданил)окси]метил]морфолин (соединение, описанное в JP-A-46-7333). Сравнительное соединение 2: 2-[[(7-инденил)окси]метил]морфолин (соединение, описанное в JP-A-52-83773). Table 2 Таблица 2 Example No № примера Chemical Structural Formula Химическая структурная формула O O N H 1 . HCl . HCl F O O N H 2 Cl 13 41350 Продолжение таблицы 2 Example No № примера O Chemical Structural Formula Химическая структурная формула O O O COOH O N H COOH . 3 F O (-) Form Форма O O COOH N H 4 . HOOC F (-) Form Форма O O N H 5 . HCl F (-) Form Форма Table 3 Таблица 3 Example No Chemical Structural Formula O O 6 COOH N H . F HOOC O O N H 7 CH3 HBr F O O 8 . N H H3C COOH . HOOC F 14 41350 Продолжение таблицы 3 Example No Chemical Structural Formula O O and N H 9 F O O N H COOH . 1/2 . 1/2 F HOOC CH3 COOH HOOC O O N H 10 COOH . HOOC F Table 4 Таблица 4 Example No Chemical Structural Formula O O N 11 CH3 F O COOH . HOOC O N 12 . CH3CH2 HCl F __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 15
ДивитисяДодаткова інформація
Назва патенту англійськоюMorpholine derivative or its pharmaceutically acceptable salt and pharmaceutical composition on its base
Автори англійськоюFudzi Mitsuo, Suzuki Takauki, Haiasibe Satoshi, Tsukamoto Sin-iti, Yatsugi Sin-iti, Yamaguchi Tokyo
Назва патенту російськоюПроизводная морфолина или ее фармацевтически приемлемая соль и фармацевтическая композиция на ее основе
Автори російськоюФудзи Мицуо, Сузуки Такаюки, Хаясибе Сатоси, Цукамото Син-ити, Яцуги Син-ити, Ямагути Токио
МПК / Мітки
МПК: C07D 265/30
Мітки: фармацевтично, морфоліну, основі, прийнятна, фармацевтична, сіль, композиція, похідна
Код посилання
<a href="https://ua.patents.su/15-41350-pokhidna-morfolinu-abo-farmacevtichno-prijjnyatna-sil-ta-farmacevtichna-kompoziciya-na-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідна морфоліну або її фармацевтично прийнятна сіль та фармацевтична композиція на її основі</a>
Попередній патент: Спосіб одержання карбаміду
Наступний патент: Рідинно-кільцева машина
Випадковий патент: Універсальна гігієнічна лікувально-оздоровча парта