Спосіб одержання лозартану
Номер патенту: 90131
Опубліковано: 12.04.2010
Автори: Ванг Япінг, Лі Юлін, Лі Ї, Лі Йонгганг, Женг Гуоюн
Формула / Реферат
1. Спосіб одержання сполуки загальної формули І
 , (I)
, (I)
в якій R1 означає залишок R1a або залишок R1b, причому
R1a означає залишок загальної формули II
 , (II)
, (II)
в якій R2 означає тетразольну захисну групу, а
R1b означає залишок, здатний зв'язувати феніленову групу сполуки загальної формули І шляхом реакції з комплементарним залишком R3, який є компонентом сполуки загальної формули III, що містить іншу феніленову одиницю,
R3-R4, (III)
в якій R4 означає залишок загальної формули II,
з утворенням С-С-зв'язку між феніленовою групою сполуки загальної формули І та
феніленовою групою сполуки загальної формули III,
який проводять шляхом взаємодії сполуки загальної формули IV
 , (IV)
, (IV)
в якій
у випадку, якщо R1 у формулі І означає залишок R1a, то R5 означає залишок загальної формули II, та
у випадку, якщо R1 у формулі І означає залишок R1b, то R5 має таке ж значення, що і залишок R1b y формулі І,
зі сполукою загальної формули V
 , (V)
, (V)
в якій R6 означає галоген із групи Сl, Вr, І, переважно Вr, та R7 означає розгалужену або нерозгалужену С1-С6-алкільну групу, переважно ізопропільну групу.
2. Спосіб за п. 1, який відрізняється тим, що тетразольна захисна група R2 у формулі II означає трифенілметил або трет-бутил.
3. Спосіб за одним із пп. 1 або 2, який відрізняється тим, що реакцію здійснюють в присутності основи Бренстеда.
4. Спосіб за одним із пп. 1-3, який відрізняється тим, що залишок R1b у сполуці загальної формули І або залишок R5 у сполуці загальної формули IV означає залишок, здатний реагувати із залишком R3 при здійсненні реакції Сузукі, Штілле або Гриньяра.
5. Спосіб за одним із пп. 1-4, який відрізняється тим, що залишок R1b у сполуці загальної формули І або залишок R5 у сполуці загальної формули IV має такі значення:
галоген,
залишок загальної формули VI
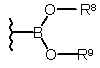 , (VI)
, (VI)
в якій R8 та R9 означають водень, С1-С6-алкільну групу або разом означають С1-С6-алкандіїльну групу,
залишок триалкілолова або,
якщо у способі використовують сполуку загальної формули І, що містить
залишок R1b, то залишок галогеніду магнію (II),
та, причому,
якщо R1b або R5 означають галоген, то R3 означає залишок загальної формули VI,
залишок триалкілолова або,
якщо у способі використовують сполуку загальної формули І, що містить залишок R1b, то залишок галогеніду магнію (II), і навпаки.
6. Спосіб за п. 1, який відрізняється тим, що залишок R1b у формулі І або відповідно залишок R5 у формулі IV означає бром.
7. Спосіб за п. 5, причому R8 та R9 у формулі VI разом означають 2,3-диметилбутан-2,3-діїл.
8. Спосіб за одним із пп. 1-7, який відрізняється тим, що використовують один або кілька каталізаторів, які включають один або кілька перехідних металів, переважно вибраних із МnСl2, СrСl3, FeCl2, Fе(асас)3, FеСl3, Fe(salen)Cl, NіСl2(РРh3)2, CoCl2(dppe), CoCl2(dpph), Co(acac)2, CoCl2(dppb), PdCl2(PPh3)2 або Pd(PPh3)4.
9. Спосіб одержання лозартану формули

або однієї з його фармакологічно прийнятних солей, у якому
а) зі сполуки загальної формули І
 , (I)
, (I)
у якій R1 є радикалом загальної формули II
 , (II)
, (II)
у якій R2 є захисною групою тетразолу,
отримують сполуку загальної формули XI
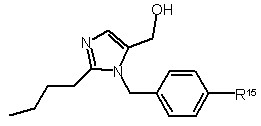 , (XI)
, (XI)
у якій R15 є радикалом вищенаведеної загальної формули II,
шляхом, при якому відновлюють формільну групу, якою заміщена імідазольна група, до гідроксиметильної групи,
b) єдиний атом водню, який ще залишивсяв імідазольній групі одержаної на стадії (а) сполуки, звичайним способом замінюють хлором, та
(c) відщеплюють тетразольну захисну групу, та, в разі потреби,
(d) із лозартану одержують одну з його фармакологічно прийнятних солей.
10. Спосіб за п. 9, який відрізняється тим, що на стадії (b) єдиний атом водню, який ще залишився в імідазольній групі одержаної на стадії (а) сполуки, звичайним способом замінюють хлором шляхом взаємодії одержаної на стадії (а) сполуки з СеСl3 та сіллю лужного металу і гіпогалогенової кислоти як реагентами.
11. Спосіб за пунктом 9 або 10, який відрізняється тим, що використовують один або кілька каталізаторів, які включають один або кілька перехідних металів, переважно вибраних із МnСl2, СrСl3, FeCl2, Fе(асас)3, FеСl3, Fe(salen)Cl, NіСl2(РРh3)2, CoCl2(dppe), CoCl2(dpph), Co(acac)2, CoCl2(dppb), PdCl2(PPh3)2 або Pd(PPh3)4.
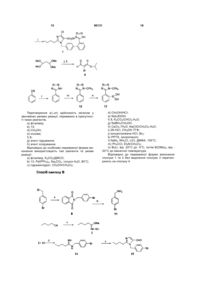
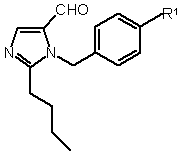
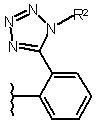
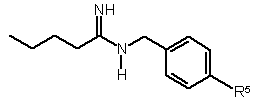
Текст
1. Спосіб одержання сполуки загальної формули І 3 90131 4 жену С1-С6-алкільну групу, переважно ізопропільну або однієї з його фармакологічно прийнятних согрупу. лей, у якому 2. Спосіб за п. 1, який відрізняється тим, що тета) зі сполуки загальної формули І разольна захисна група R2 у формулі II означає CHO R1 трифенілметил або трет-бутил. 3. Спосіб за одним із пп. 1 або 2, який відрізняN N ється тим, що реакцію здійснюють в присутності основи Бренстеда. (I) 4. Спосіб за одним із пп. 1-3, який відрізняється тим, що залишок R1b у сполуці загальної формули І або залишок R5 у сполуці загальної формули IV означає залишок, здатний реагувати із залишком , R3 при здійсненні реакції Сузукі, Штілле або Гриу якій R1 є радикалом загальної формули II ньяра. N R2 5. Спосіб за одним із пп. 1-4, який відрізняється N N тим, що залишок R1b у сполуці загальної формули N І або залишок R5 у сполуці загальної формули IV (II) має такі значення: галоген, залишок загальної формули VI R8 O , у якій R2 є захисною групою тетразолу, B (VI) отримують сполуку загальної формули XI O R9 , OH в якій R8 та R9 означають водень, С1-С6-алкільну групу або разом означають С1-С6-алкандіїльну N групу, (XI) N залишок триалкілолова або, якщо у способі використовують сполуку загальної R15 формули І, що містить , залишок R1b, то залишок галогеніду магнію (II), у якій R15 є радикалом вищенаведеної загальної та, причому, 1b 5 3 формули II, якщо R або R означають галоген, то R означає шляхом, при якому відновлюють формільну групу, залишок загальної формули VI, якою заміщена імідазольна група, до гідроксимезалишок триалкілолова або, тильної групи, якщо у способі використовують сполуку загальної 1b b) єдиний атом водню, який ще залишився в імідаформули І, що містить залишок R , то залишок зольній групі одержаної на стадії (а) сполуки, звигалогеніду магнію (II), і навпаки. чайним способом замінюють хлором, та 6. Спосіб за п. 1, який відрізняється тим, що за1b 5 (c) відщеплюють тетразольну захисну групу, та, в лишок R у формулі І або відповідно залишок R у разі потреби, формулі IV означає бром. 8 9 (d) із лозартану одержують одну з його фармако7. Спосіб за п. 5, причому R та R у формулі VI логічно прийнятних солей. разом означають 2,3-диметилбутан-2,3-діїл. 10. Спосіб за п. 9, який відрізняється тим, що на 8. Спосіб за одним із пп. 1-7, який відрізняється стадії (b) єдиний атом водню, який ще залишився тим, що використовують один або кілька каталізав імідазольній групі одержаної на стадії (а) сполуторів, які включають один або кілька перехідних ки, звичайним способом замінюють хлором шляметалів, переважно вибраних із МnСl2, СrСl3, хом взаємодії одержаної на стадії (а) сполуки з FeCl2, Fе(асас)3, FеСl3, Fe(salen)Cl, NіСl2(РРh3)2, СеСl3 та сіллю лужного металу і гіпогалогенової CoCl2(dppe), CoCl2(dpph), Co(acac)2, CoCl2(dppb), кислоти як реагентами. PdCl2(PPh3)2 або Pd(PPh3)4. 11. Спосіб за пунктом 9 або 10, який відрізняєть9. Спосіб одержання лозартану формули ся тим, що використовують один або кілька каталіH N N заторів, які включають один або кілька перехідних металів, переважно вибраних із МnСl2, СrСl3, N FeCl2, Fе(асас)3, FеСl3, Fe(salen)Cl, NіСl2(РРh3)2, N CoCl2(dppe), CoCl2(dpph), Co(acac)2, CoCl2(dppb), PdCl2(PPh3)2 або Pd(PPh3)4. N OH N Cl 5 Даний винахід стосується нового способу одержання лозартану, похідної імідазолу з хімічною назвою 2-н-бутил-4-хлоро-5-гідроксиметил-1-{[2'(1Н-тетразол-5-іл)біфеніл-4-]метил}імідазол, а також його фармакологічно активних солей. Крім того винахід стосується нових проміжних продуктів, які є придатними для одержання лозартану, а також нових способів одержання проміжних сполук, придатних для одержання лозартану. Лозартан, а також ефективні та економічні способи його одержання представляють великий інтерес, оскільки лозартан виявився ефективною активною речовиною для боротьби з підвищеним кров'яним тиском у ссавців, включаючи людей, та всіма подальшими захворюваннями, які з цього витікають. Лозартан та його одержання вперше були описані в ЕР-А-253310. Синтез як важливу стадію включав N-алкілування, реакцію імідазолу, наприклад, з бромометилбіфенільною похідною (ЕР 253310 В1, стор. 213, пункт 6). В ЕР-А-291969 описані тритил-захищені похідні тетразолу, придатні для одержання лозартану. WO 03/093262 стосується одержання лозартану, виходячи із тритил-захищених похідних тетразолу шляхом відщеплення захисної групи. Одержання лозартан-калію, звичайної наявної у продажу форми, із лозартану також детально описано (див., наприклад, ЕР 324377 А, стор. 191, приклад 316, частина D та WO 95/17396, стор. 18, приклад 4 і стор. 24, приклад 9, стадія С). Однак згадані вище способи синтезу потребують удосконалення з метою одержання лозартану у промислових масштабах, оскільки загальний вихід досі залишається незадовільним. Спільною рисою всіх способів синтезу є те, що спочатку одержують похідну 1-Н-імідазолу, яку потім алкілюють в положенні 1. Однак при здійсненні такої реакції існує можливість утворення двох ізомерів, залежно від того, який із двох атомів азоту буде алкільований. Із J. Org. Chem. 1997, 62(24), 8449-8454 (див. таблицю 1) відоме цілеспрямоване одержання алкільованою в положенні 1 похідною імідазолу із N-монозаміщеного амідину. Однак одержання придатних проміжних сполук для синтезу лозартану не було описане. Тому задача даного винаходу полягала у розробці нових способів синтезу та проміжних продуктів для одержання лозартану i його фармакологічно активних солей. Зокрема задача винаходу полягала у розробці нових способів синтезу та проміжних продуктів для одержання лозартану і його фармакологічно активних солей, які дають можливість одержати велику загальну кількість лозартану на виході. Крім того задача даного винаходу полягала у розробці нових способів синтезу та проміжних продуктів для одержання лозартану і його фармакологічно активних солей, що при незначних витратах на обладнання можуть бути одержані і в промислових масштабах. Крім того необхідно було використовувати промислово доступні вихідні речовини та уникати використання токсичних речо 90131 6 вин або речовин, наявність яких необхідно обов'язково вказувати на етикетках. Таким чином були одержані описані вище об'єкти. Головним аспектом даного винаходу є одержання сполуки загальною формули І в якій R1 означає залишок R1a або залишок R1b. Під R1a розуміють залишок загальної формули II в якій R2 означає тетразольну захисну групу. У загальній формулі II "хвиляста лінія" вказує на точку приєднання, наприклад, до сполуки відповідно до загальної формули І. Придатні тетразольні захисні групи у залишку вказаної вище загальної формули II відомі із ЕР-А291969 та WO 03/093262 (див. там триарилметильні замісники у сполуці загальної формули (II)). Придатними тетразольними захисними групами є зокрема трифенілметил або трет-бутил. Під залишком R1b загальної формули І розуміють залишок, здатний зв'язувати С-С-зв'язком феніленову групу сполуки загальної формули І з іншою арильною групою. Зокрема під залишком R1b загальної формули І розуміють залишок, здатний зв'язувати феніленову групу сполуки загальної формули І шляхом реакції з додатковим залишком R3, який є компонентом сполуки загальної формули III, що містить іншу феніленову одиницю, в якій R4 означає залишок загальної формули II, з утворення С-С-зв'язку між феніленовою групою сполуки загальної формули І та феніленовою групою сполуки загальної формули III. При цьому С-С-зв'язок одержують зазвичай шляхом відщеплення залишків R1b та R3. Сполуку загальної формули І одержують шляхом взаємодії сполуки загальної формули IV 7 в якій - у випадку якщо R1 у формулі І означає залишок R1a, то R5 означає залишок загальної формули II, та - у випадку якщо R1 у формулі І означає залишок R1b, то R5 має таке ж значення, що і залишок R1b y формулі І, зі сполукою загальної формули V в якій R6 означає галоген із групи СІ, Br, І, переважно Br, та R7 означає розгалужену або нерозгалужену C1-С6-алкільну групу, переважно ізопропільну групу. Описану вище реакцію (взаємодію сполуки загальної формули IV зі сполукою загальної формули V) здійснюють переважно у присутності основи Бренстеда, зокрема слабко. Основи Бренстеда. Придатними основами Бренстеда є карбонати або гідрокарбонати лужних металів, такі як, наприклад, карбонат натрію, карбонат калію або гідрокарбонат натрію Перевагу надають карбонату калію. Переважно реакцію здійснюють в 2-фазовій системі, в якій перша фаза утворюється із водного розчину, а друга фаза - із розчину, що включає обмежено змішуваний з водою органічний розчинник. Прикладами придатних розчинників є толуол, метиленхлорид, хлороформ або їх суміші. Взаємодію сполуки загальної формули IV та сполуки загальної формули V здійснюють зазвичай у молярному співвідношенні 0,5-2:1, у перерахунку на співвідношення молярних кількостей сполуки загальної формули IV та сполуки загальної формули V. Тривалість реакції становить, як правило, від 0,1 до 20 годин, переважно від 5 до 15 годин. Нижче більш детально описаний залишок R1b, який може входити до складу як сполук загальної формули І, так і сполук загальної формули IV (як залишок R5): Переважно залишок R1b сполуки загальної формули І або залишок R5 сполуки загальної формули IV означає залишок, здатний вступати у реакцію із залишком R3 з утворенням С-С-зв'язку. Зокрема залишок R1b сполуки загальної формули І або залишок R5 сполуки загальної формули IV означає залишок, здатний вступати у реакцію Сузукі, Штіллє або Гриньяра із залишком R3. Поняття "реакція Сузукі", "реакція Штіллє" або "реакція Гриньяра" загалом відомі фахівцям та описані, наприклад, в Chem. Rev. 2002, 102(5), 1359-1470. Особливо переважно залишок R1b у сполуці загальної формули І або залишок R5 у сполуці загальної формули IV мають такі значення: - галоген, зокрема бром, 90131 8 - залишок загальної формули VI в якій R8 та R9 означають водень, C1-С6алкільну групу або разом означають C1-С6алкандіїльну групу, - залишок триалкілолова, причому переважно "алкіл" означає С1-С12 зокрема C1-С6-алкільний залишок, або - якщо у способі використовують сполуку загальної формули І, що містить залишок R1b, то залишок галогеніду магнію (II), та причому якщо R1b або R5 означають галоген, то R3 означає залишок загальної формули VI, залишок триалкілолова або, якщо у способі використовують сполуку загальної формули І, що містить залишок R1b, то залишок галогеніду магнію (II), і навпаки. У залишку загальної формули VI залишки R8 та R9 переважно разом означають 2,3диметилбутан-2,3-діїл. Особливо переважно залишок R3 загальної формули III вибраний із групи, що включає такі залишки: - галоген, зокрема бром, - залишок загальної формули VI, - залишок триалкілолова, причому переважно "алкіл" означає С1-С12, зокрема C1-С6-алкільний залишок, або - залишок галогеніду магнію (II), переважно залишок броміду магнію (II), однак за такої умови, що залишок R1b і залишок R5 з одного боку та залишок R3 з іншого боку вибрані таким чином, що залишок R1b і залишок R5 з одного боку та залишок R3 з іншого боку є комплементарними залишками, тобто утворюють комплементарні пари, які бажаним чином можуть реагувати одна з одною при здійсненні реакції сполучення. Таким чином залишки R1b та R3 або R5 та R3 слід вибирати таким чином, щоб вони утворювали комплементарні пари. Переважними комплементарними парами є: a) галоген і залишок загальної формули VI; оскільки вони можуть, наприклад, реагувати один з одним при здійсненні реакції Сузукі, b) галоген і залишок триалкілолова, причому "алкіл" означає переважно С1-С12, зокрема C1-С6алкільний залишок; оскільки вони можуть, наприклад, реагувати один з одним при здійсненні реакції Штіллє, та с) галоген і залишок галогеніду магнію (II); оскільки вони можуть, наприклад, реагувати один з одним при здійсненні реакції Гриньяра. Галоген означає переважно бром, а залишок галогеніду магнію (II) - залишок броміду магнію (II). При здійсненні реакцій Сузукі, Штіллє або Гриньяра, які проводять в рамках способів одержання згідно з винаходом, використовують переважно один або кілька каталізаторів. Каталізатори можуть включати один або кілька перехідних металів, 9 90131 10 зокрема марганець, хром, залізо, кобальт, нікель або паладій. Переважно використовувані сполуки вибирають із МnСІ2, CrCI3, FeCI2, Fe(acac)3, FeCI3, Fe(salen)CI, NiCI2(PPh3)2, CoCI2(dppe), CoCI2(dpph), Co(acac)2, CoCI2(dppb), PdCI2(PPh3)2 або Pd(PPh3)4. в якій R10 означає залишок формули II, Переважно каталізатори використовують разі сполукою загальної формули VIII зом із активатором та/або стабілізатором. Активатор переводить атоми металу каталізаторів у ступінь окислення 0, а стабілізатор стабілізує атоми металу каталізаторів у ступеню окислення 0. Прикладами таких активаторів є цинк (переважно у формі цинкового порошку), боргідрид натрію, в якій R11 означає С1-С12-алкільний залишок, а алюмінійгідрид літію або органічні сполуки алюміΧ означає аніон мінеральної кислоти, нію, магнію або літію (переважно бутиллітій або переважно в присутності основи Бренстеда. DIBAH). Прикладами таких стабілізаторів є основи Реакцію здійснюють зазвичай в придатному Льюїса, переважно фосфани, особливо переважно інертному розріджувачі, наприклад, аліфатичному триарилфосфани та триалкілфосфани, зокрема спирті, такому як етанол. Як основу Бренстеда для трифенілфосфан. нейтралізації використовують, наприклад, третинПри здійсненні реакції Сузукі особливо вигідно ний аліфатичний амін, такий як триетиламін. використовувати паладієвий каталізатор, такий як Взаємодію здійснюють зазвичай у молярному Pd(PPh3)4. Цю реакцію здійснюють переважно в співвідношенні 0,3-3:1, у перерахунку на співвідприсутності слабкої основи Бренстеда, такої як ношенню молярних кількостей сполуки загальної карбонат лужного металу. Переважно реакцію формули VII та сполуки загальної формули VIII. здійснюють в 2-фазовій системі, в якій перша фаза Тривалість реакції становить загалом від 0,1 до 20 утворюється із водного розчину, а друга фаза - із годин, переважно від 5 до 15 годин. розчину, що включає обмежено змішуваний з воОсобливо переважно сполукузагальної фордою органічний розчинник, такий як бензол, толумули VII одержують таким чином: ол, ксилол, метиленхлорид або хлороформ. І. беруть сполуку загальної формули IX При здійсненні реакції Штіллє особливо вигідно використовувати паладієвий каталізатор, такий як Pd(PPh3)4 або PdCI2(PPh3)2. Реакцію здійснюють переважно при підвищеній температурі від 50°С до температури кипіння розчинника. Переважно реакцію здійснюють в присутності співкаталізатора, такого як Cul (йодид міді) або CuО (оксид міді). Реакцію здійснюють переважно в інертних розчинниках, таких як, наприклад, толуол, ксилол, диметоксиетан, диметилформамід, тетрагідрофуран або діоксан. При здійсненні реакції Гриньяра особливо вив якій R12 означає залишок загальної формули гідно використовувати паладієвий каталізатор, II, а такий як Pd(PPh3)4, PdCI2(PPh3)2 або NiCI2(PPh3)2. II. зі сполуки загальної формули IX в умовах, Реакцію здійснюють переважно в полярних апрозвичайних для реакції Габріеля, одержують сполутонних розчинниках, таких як, наприклад, тетрагідку загальної формули VII. З цією метою сполуку рофуран, діетиловий етер або діоксан. загальної формули IX піддають взаємодії, наприСполуки загальних формул І загалом одержуклад, з гідразингідратом у спиртовому розчині. ють, як описано вище, взаємодією сполук загальОдержання сполуки загальної формули IX віної формули (IV) зі сполуками загальної формули доме, наприклад, із Віооrgаnіс & Medicinal (V). Залежно від виду залишків R1 та R5 перевагу Chemistry Letters 1993, 3(4), 757-760 (що позначенадають різних способам синтезу. на там як сполука 20). В рамках даного винаходу більш детально Одержання сполуки загальної формули VIII віописані 3 способи синтезу, позначені як спосіб доме, наприклад, із J. Оrg. Сhеm. 1999, 64(22), синтезу А, спосіб синтезу В та спосіб синтезу С 8084-8089. Спосіб синтезу А описує той випадок, в якому 5 Спосіб синтезу В описує той випадок, в якому R у сполуках загальної формули IV означає заR5 у сполуках загальної формули IV означає атом лишок загальної формули II (тобто залишок форгалогену, наприклад, бром (тобто залишок R5 у мули R5 у формулі IV відповідає залишку R1a у формулі IV відповідає залишку R1b у формулі І). формулі І). Для одержання сполуки загальної формули IV, Загалом сполуку загальної формули IV, в якій 5 в якій R5 означає галоген, переважно похідну бенR означає залишок загальної формули II, одерзиламіну, яка в пара-положенні заміщена атомом жують взаємодією сполуки загальної формули VII галогену (тобто сполуку, що відповідає загальній формулі VII), піддають взаємодії зі сполукою загальної формули VIII переважно в присутності основи Бренстеда. Цю взаємодію здійснюють в тих 11 90131 12 самих умовах, що і для одержання сполуки загаважно бром, в умовах, звичайних для здійснення льної формули IV, в якій R5 означає залишок загареакції Сузукі. льної формули II. У випадку, якщо в загальній формулі IV R5 Заміщену у пара-положенні атомом галогену означає триалкілолово або залишок MgHal, то похідну бензиламіну одержують дуже просто реареакцію переважно здійснюють також відповідно кцією Габріеля в звичайних для такої реакції умодо способу синтезу С. вах в присутності фталіміду із заміщеного у параІншим аспектом винаходу є одержання похідположенні атомом галогену, переважно брому, ної імідазолу, яка біля щонайменше одного атому бензилгалогеніду, переважно паравуглецю імідазольного кільця заміщена хлором бромбензилброміду. (похідна імідазолу А), шляхом взаємодії імідазолу В рамках способу синтезу В взаємодію сполуабо похідної імідазолу, що біля щонайменше одноки загальної формули IV зі сполукою загальної го атому вуглецю імідазольного кільця містить формули V здійснюють до одержання сполуки заатом водню (похідна імідазолу В), з СеСІ3 та сіллю гальної формули І, причому під залишком R1 ролужного металу і гіпогалогенової кислоти. зуміють залишок R1b. Переважно як похідну імідазолу (А) одержують Відповідно до переважної форми виконання сполуку, яка біля атому вуглецю імідазольного винаходу одержану сполуку загальної формули І, кільця в положенні 4 або 5 або в обох положеннях що містить залишок R1b, за допомогою описаної заміщена хлором, причому як похідну імідазолу (В) вище реакції С-С-сполучення перетворюють на використовують сполуку, яка біля атому вуглецю сполуку загальної формули І, що містить залишок імідазольного кільця в положенні 4 або 5 або в R1a. обох положеннях містить ще один атом водню. Одержання сполуки загальної формули І, що Особливо переважно такий метод хлорування містить залишок R1a, здійснюють переважно шляє придатним для одержання похідної лозартану, в хом взаємодії сполуки загальної формули І, в якій якій атом водню тетразольної групи замінений R1b означає галоген, переважно бромід, зі сполутетразольною захисною групою, причому як похідкою загальної формули III, в якій R3 означає залину імідазолу (В) використовують сполуку загальної шок загальної формули VI, залишок триалкілолова формули XI. або залишок галогеніду магнію (II), в умовах, звиПереважно СеСІ3 та сіль лужного металу і гічайних для реакції Сузукі, Штіллє або Гриньяра. погалогенової кислоти використовують у стехіомеСпосіб синтезу С описує той випадок, в якому тричних кількостях або у надлишку. Переважно як R5 у сполуках загальної формули IV означає засіль лужного металу використовують калієву або лишок загальної формули VI (тобто залишок R5 у натрієву сіль. Переважно як сіль лужного металу і 1b формулі IV відповідає залишку R у формулі І.) гіпогалогенової кислоти використовують сіль лужОдержання сполуки загальної формули IV, в ного металу і гіпохлористої кислоти. якій R5 означає залишок загальної формули VI, Реакцію хлорування згідно з винаходом зазвиздійснюють переважно шляхом взаємодії заміщечай здійснюють в 2-фазовій системі, в якій перша ної в пара-положення залишком R5 загальної фофаза утворюється із водного розчину, а друга фармули VI похідної бензиламіну зі сполукою загальза - із розчину, що включає обмежено змішуваний ної формули VIII переважно в присутності основи з водою органічний розчинник, такий як метиленхБренстеда. лорид, хлороформ або толуол. Заміщену у пара-положенні залишком R5 загаВиходячи зі сполуки загальної формули І, що льної формули VI похідну бензиламіну одержують містить залишок R1a, лозартан або його фармакозагалом реакцією Габріеля в звичайних для такої логічно прийнятні солі можуть бути одержані дуже реакції умовах в присутності фталіміду із заміщепросто таким чином: ного у пара-положенні залишком R5 загальної фоa) на стадії (а), виходячи зі сполуки загальної рмули VI бензилгалогеніду, переважно із заміщеформули І, що містить залишок R1a, одержують ного у пара-положенні залишком R5 загальної сполуку загальної формули XI формули VI бензилброміду. В рамках способу синтезу С взаємодію сполуки загальної формули IV зі сполукою загальної формули V здійснюють до одержання сполуки загальної формули І, причому під залишком R1 розуміють залишок R1b. Відповідно до переважної форми виконання винаходу одержану сполуку загальної формули І, що містить залишок R1b, за допомогою описаної в якій R15 означає залишок загальної формули вище реакції С-С-сполучення перетворюють на II, шляхом відновлення формільної групи, якою сполуку загальної формули І, що містить залишок заміщена імідазольна група, до гідроксиметильної R1a. 1 групи, Сполуку загальної формули І, в якій R ознаb) на стадії (b) єдиний атом водню, який ще чає залишок загальної формули II, одержують залишився, в імідазольній групі одержаної на стаособливо переважним методом шляхом взаємодії дії (а) сполуки замінюють хлором та сполуки загальної формули І, в якій R1b означає (c) на стадії (с) від одержаної на стадії (b) спозалишок загальної формули VI, зі сполукою загалуки відщеплюють тетразольну захисну групу та, в льної формули III, в якій R3 означає галоген, переразі потреби, 13 90131 14 (d) із лозартану одержують одну з його фарСполуки, які використовують та/або одержумакологічно прийнятних солей, наприклад, калієву ють при здійсненні відповідних способів синтезу, сіль. позначають арабськими цифрами. При цьому зоВідновлення формільної групи на стадії (а) бражені нижче на схемах сполуки відповідають можна здійснювати звичайним способом. Переватаким цифрам: жно відновлення формільної групи на стадії (а) - 4 означає сполуку загальної формули І, що здійснюють боргідридом натрію або алюмінійгідмістить залишок R1 загальної формули II (тобто під ридом літію. R1 розуміють залишок R1a), Хлорування на стадії (b) можна здійснювати - 15 та 21 означають сполуки загальної форзвичайним способом. Переважно стадію (b) здійсмули І, що містять залишок R1b, нюють при застосуванні описаного вище методу - 13, 23 означають сполуки загальної формули хлорування, тобто при використанні СеСІ3. III, Стадію (с) здійснюють зазвичай, як описано в - 3, 14 означають сполуки загальної формули WO 03/093262. Відщеплення особливо переважної IV, трифенілметильної захисної групи відбувається, - 8 означає сполуку загальної формули V, наприклад, шляхом обробки розчину одержаної на - 21 означає сполуку загальної формули IV, що стадії (b) сполуки розрідженою мінеральною кисмістить залишок R5 загальної формули VI, лотою, переважно хлорводневою кислотою. - 1 означає сполуку загальної формули VII, Одержання фармакологічно прийнятної солі - 2 означає сполуку загальної формули VIII та лозартан, наприклад, лозартан-калію (стадія d), - 9, 10 означають сполуки загальної формули відбувається, наприклад, як описано в ЕР 324377 IX. А, стор. 191, приклад 316, частина D та в WO Одночасно вони представляють собою пере95/17396, стор. 18, приклад 4 і стор. 24, приклад 9, важні приклади виконання групи сполук, визначестадія С. ної відповідною загальною формулою. Нижче більш детально описані способи синтезу А, В і С. 15 Перетворення а) n) здійснюють загалом у звичайних умовах реакції, переважно в присутності таких реагентів. а) фталімід; b) 13; d) СН3ОН; e) основа; f) 8; g) агент гідрування; h) агент хлорування. Відповідно до особливо переважної форми виконання використовують такі реагенти та умови реакції: a) фталімід, K2СО3/ДМСО; b) 13, Pd(PPh3)4, Na2CO3, толуол-Н2О, 80°С; c) гідразингідрат, СН3ОН/СН2СІ2; 90131 16 d) СН3ОН/НСІ; e) Net3/ЕtOН; f) 8, K2СО3/СНСІ3-Н2О; g) NaBH4/СН3ОН; h) CeCI3.7H2O, NaCIO/СН2СІ2-Н2О; і) 2N НСІ, СН3ОН-ТГФ; j) концентрована НСІ, Br2; k) PPTS, ізопропанол; І) NaN3, NH4CI, LiCI, ДМФА, 100°С; m) Ph3CCI, Et3N/CH2CI2; n) BuLi, від -20°С до -5°С, потім В(ОМе)3, від 20°С до кімнатної температури. Відповідно до переважної форми виконання сполуки 1 та 2 без виділення сполуки 3 перетворюють на сполуку 4. 17 Перетворення а) k) здійснюють загалом у звичайних умовах реакції, переважно в присутності таких реагентів: а) фталімід; с) СН3ОН; d) основа; e) 8; f) 13; g) агент гідрування; h) агент хлорування. Відповідно до особливо переважної форми виконання використовують такі реагенти та умови реакції: 90131 18 a) фталімід, K2СО3/ДМСО; b) гідразингідрат, СН3СН2ОН/Н2О; c) СН3ОН/НСІ; d) Net3/EtOH; e) 8, K2СО3/СНСІ3-Н2О; f) 13, Pd(PPh3)4, Na2CO3, толуол-Н2O, 80°С; g) NaBH4/CH3OH; h) CeCI3.7H2O, NaCIO/CH2CI2-H2O; i) 2N НСІ, СН3ОН-ТГФ; j) концентрована НСІ, Br2; k) PPTS, ізопропанол. 19 Перетворення а) о) здійснюють загалом у звичайних умовах реакції, переважно в присутності таких реагентів: d) фталімід; e) СН3ОН; g) 2, основа, потім 8; h) 13; і) агент гідрування, j) агент хлорування. Відповідно до особливо переважної форми виконання використовують такі реагенти та умови реакції: a) Мg, І2, ТГФ, кип'ятіння зі зворотнім холодильником протягом 1 годин, потім -78°С, В(ОМе)3; b) пінакол, циклогексан, кип'ятіння зі зворотнім холодильником до видалення води; c) NBS, циклогексан, кип'ятіння зі зворотнім холодильником; d) фталімід, K2СО3/ацетон, кип'ятіння зі зворотнім холодильником; e) СН3ОН/НСІ; f) гідразингідрат, СН3СН2ОН, кип'ятіння зі зворотнім холодильником; g) 2, Net3/ СН3ОН, потім K2СО3, 8; h) 13, Pd(PPh3)4, K2СО3, толуол-Н2О, 80°С; i) NaBH4/CH3OH; j) CeCI3.7H2O, NaCIO/СН2СІ2-Н2О; k) 2N НСІ, СН3ОН-ТГФ; І) концентрована НСІ, Br2; m) PPTS, ізопропанол; n) NaN3, NH4CI, LiCI, ДМФА, 100°С; о) Ph3CCI, Et3N/СН2СІ2. Експериментальна частина: В експериментальній частині більш детально описане одержання сполук, які використовують у способах синтезу А, В або С. 90131 20 Умови досліджень Прилади та реагенти Всі сухі розчинники (СН2СІ2, ТГФ, Et2O, бензол, толуол, ДМФА, MeCN) висушують стандартними методами, тобто шляхом видалення води і кисню та шляхом дистиляції перед використанням. Якщо необхідно, реакції здійснюють і атмосфері інертних газів (N2 або Ar) та спостерігають за допомогою ТШХ. Як розчинники для екстрагування використовують, наприклад, діетиловий етер, етилацетат або хлороформ Якщо не вказано нічого іншого, екстракти сушать, наприклад, безводною MgSO4. Продукти реакції, якщо необхідно, очищують, наприклад, колонковою хроматографією з використанням петролейного ефіру (6090°С)/етилацетату та хлороформу/метанолу як елюенту. У випадку використання пластин типу GF254 для ТШХ як проявник використовують йод або етанольний розчин фосформолібденової кислоти. Силікагель для хроматографії (зернистість 200-300) та ТШХ (GF254) одержують від Qingdao Sea Chemical Factory та Yantan Chemical Factory. Всі розчинники та реагенти мають аналітичну або хімічну чистоту. Температуру плавлення визначають за допомогою ХТ4-100x micro-melting point tester. Спектрометри Nicolet AVATAR 360 FT-IR та Nicolet NEXUS 670 FT-IR використовують для запису інфрачервоних спектрів KBr-прес-виробів або РЕ-плівок. Спектрометри Меrсurу-300 (Varian) та АМ-400 (Bruker) використовують для вимірювання ЯМР з SiMe4 як внутрішнім стандартом та CDCI3 як розчинником, якщо не зазначено нічого іншого. МС-НР3 визначають мас-спектрометром НР-5988 з використанням ЕІ при 70еВ, якщо не зазначено нічого іншого. 21 90131 22 1 МС-ВР3 вимірюють мас-спектрометром Bruker Н ЯМР (CDCI3, 300МГц): 0,84 (т, J=7,2Гц, Daltonics APEX II 47е FT-ICR. 3H, СН3), 1,26-1,34 (м, 2Н, СН2), 1,57-1,67 (м, 2Н, Одержання сполуки 9 СН2), 2,68 (т, J=7,5Гц, 2Н, СН2), 4,19 (с, 3H, ОМе), Фталімід (11г, 75,6ммоль) розчиняють в 80мл 7,43 (с, 1Н, NH), 11,12 (с, ш, 1Н, HCI), 13С ЯМР ДМСО в атмосфері захисного газу аргону. Після (CDCI3, 75МГц): 13,2, 21,7, 27,3, 32,5, 60,4, 180,6. додавання K2СО3 (20г, 144ммоль) реакційну суміш Одержання сполуки 8 нагрівають протягом 2 годин до 120°С. Потім реаКонцентровану НСІ (3,6мл) по краплях додакційну суміш охолоджують до приблизно 50°С та ють у суміш 1,1,3,3-тетраметоксипропану (6,5г, додають п-бромбензилбромід (18г, 72ммоль). Че40ммоль) та води (64мл). Реакційну суміш гомогерез 10 годин перемішування додають 100мл Н2О. нізують при перемішуванні, охолоджують до 0°С Безбарвний осад відфільтровують, промивають та та по краплях додають бром (2,1мл, 40ммоль). сушать, одержуючи сполуку 9 (18,6г). Вихід станоПотім перемішують ще протягом 10 хвилин, більвить 82%. шу частину води видаляють у вакуумі при 70°С. 1 Н ЯМР (CDCI3, 300МГц): 4,77 (с, 2Н, NCH2), Після повторного охолодження до 0°С фільтрують. 7,29 (д, J=8,4Гц, 2Н, ArН), 7,41 (д, J=8,4Гц, 2Н, Одержану таким чином тверду речовину сушать, ArН), 7,67-7,70 (м, 2Н, ArН), 7,80-7,83 (м, 2Н, ArН); потім розчиняють у суміші 65мл циклогексану і 13 С ЯМР (CDCI3, 75МГц): 40,9, 121,8, 123,3 (2С), 10мл ізопропанолу та додають каталітичну кіль130,3 (2С), 131,7 (2С), 131,9 (2С), 134,0 (2С), 135,2, кість PPTS. Реакційну суміш протягом 90 хвилин 167,8 (2С); МС (FAB): М+=315, знайдено: 316 кип'ятять зі зворотнім холодильником, а одержану (М++1), 318 (М++3); ІЧ (плівка, см-1) vмакс.=3460, воду відокремлюють. Інші розчинники видаляють у 3100, 3045, 2938, 1771, 1702, 1612, 1486, 1464, вакуумі. Одержують сполуку 8 у вигляді жовтого 1430, 1399, 1332, 1298, 1173, 1077, 1010, 957, 935, масла. Чистота становить понад 95%, так що спо845, 796, 731, 713, 528. луку можна використовувати безпосередньо після Одержання сполуки 10 одержання без попереднього очищення Вихід стаСполуку 9 (1,45г, 4,6ммоль), сполуку 13 (3,4г, новить 65%. 1 1,2екв.) та Na2CO3 (1,46г, 3екв.) розчиняють у суН ЯМР (CDCI3, 300МГц): 1,38 (д, J=6Гц, 6Н, міші 20мл толуолу/Н2О (7:3). Потім через систему 2СН3), 4,45-4,50 (м, 1Н, СН), 7,70 (с, 1Н, СН=), 9,07 тричі пропускають аргон та додають Pd(PPh3)4 (с, 1Н, СНО); 13С ЯМР (CDCI3, 75МГц): 22,3 (2С), (266мг, 0,05екв.). Реакційну суміш протягом 13 80,6, 105,1, 166,2, 184,0; МС (ΕΙ) m/z (%):194 (М+, годин нагрівають до 80 °С та потім екстрагують 5), 192 (М+, 5), 166 (2), 152 (95), 150 (100), 121 (13), етилацетатом. Органічні фази концентрують, а 93 (16), 71 (30), 43 (59). тверду речовину очищують колонковою хроматогОдержання сполуки 3 рафією, одержують сполуку 10 як білу тверду реСполуку 2 (6,4г, 40ммоль) розчиняють в 75мл човину (2,43г). Вихід становить 86%. абсолютного етанолу та 20мл Net3. Потім додають 1 Н ЯМР (CDCI3, 300МГц): 4,73 (с, 2Н), 6,87сполуку 1 (10г, 20ммоль) при 10°С, та реакційну 6,90 (м, 6Н), 7,06 (д, J=8,1Гц, 2Н), 7,18-7,33 (м, суміш перемішують протягом 5 годин, в результаті 12Н), 7,42-7,46 (м, 2Н), 7,67-7,70 (м, 2Н), 7,82-7,84 чого одержують розчин, який перемішують протя(м, 2Н), 7,92-7,95 (м, 1Н); 13С ЯМР (CDCI3, 75МГц): гом наступних 8 годин при кімнатній температурі. 41,2, 82,8, 123,3, 126,2, 127,6, 128,2, 129,5, 129,8, Потім розріджують хлороформом та промивають 130,2, 130,7, 132,1, 133,9, 134,8, 140,7, 141,2, водою. Органічну фазу відділяють, сушать та кон141,7, 163,9, 167,9; МС (FAB): М+=623, знайдено: центрують при температурі нижче 45°С. Сполуку 3 662 (М++K); ІЧ (плівка, см-1) vмакс.=3467, 3061, 3032, одержують у вигляді масла. Вихід становить 80%. 1 2249, 1770, 1714, 1603, 1492, 1469, 1446, 1429, Н ЯМР (CDCI3, 300МГц): 0,67-0,80 (м, 3H, 1393, 1349, 1187, 1159, 1087, 1031, 1004, 937, 909, СН3), 1,09-1,24 (м, 2Н, СН2), 1,58 (с, ш, 2Н, СН2), 880, 733, 700, 633, 406. 2,51 (с, ш, 2Н, СН2), 4,53 (с, ш, 2Н, NCH2), 6,89Одержання сполуки 1 7,08 (м, 8Н, ArН), 7,21-7,44 (м, 14Н, ArН), 7,87 (д, Сполуку 10 (37,3г, 60ммоль) розчиняють у суJ=3,9Гц, 1Н, ArН); 13С ЯМР (CDCI3, 75МГц): 13,3, міші 200мл метанолу та 300мл СН2СІ2. Сюди до21,6, 28,0, 32,3, 45,4, 82,9, 125,5, 126,0, 127,5, дають гідразингідрат (600ммоль, 10екв.), та реак128,2, 129,2, 129,8, 133,3, 140,3, 140,7, 141,0, ційну суміш протягом 10 годин перемішують при 163,9, 167,7; MC (FAB): M+=576, знайдено: 577 кімнатній температурі. Потім фільтрують, а фільт(М++1); ІЧ (плівка, см-1) vмакс.=3222, 3057, 3030, рат розріджують СНСІ3 та промивають водою. Ор2962, 2933, 2210, 1677, 1636, 1531, 1493, 1449, ганічну фазу сушать над MgSO4 та концентрують, 1190, 1004, 910, 732, 700, 639. одержуючи сполуку 1 як жовту тверду речовину Одержання сполуки 4 (23,7г). Вихід становить 80%. Метод А-1 (з виділенням сполуки 3): 1 Н ЯМР (CDCI3, 200МГц): 3,80 (с, 2Н), 4,52 (с, Сполуку 3 (8г, 13,9ммоль) розчиняють в 60мл ш, 2Н), 6,89-6,92 (м, 6Н), 7,04-7,14 (м, 4Н), 7,24хлороформу та 7,5мл води після додавання K2СО3 7,31 (м, 10H), 7,43 (с, ш, 2Н), 7,90-7,93 (м, 1Н); МС (2,69г, 19,5ммоль) та сполуки 8 (3,73г, 19,5ммоль) (FAB): М+=493, знайдено: 494 (М++1), 516 (М++Na). реакційну суміш протягом 12 годин перемішують Одержання сполуки 2 при кімнатній температурі. Потім екстрагують хлоГазоподібну НСІ поміщають у розчин 8,3г роформом, а органічну фазу концентрують. Одер(100ммоль) валеронітрилу в 8мл метанолу при жаний таким чином продукт очищують колонковою охолодженні крижаною ванною. При цьому постійхроматографією, одержуючи сполуку 4 як білу но підтримують температуру 10°С. Через 2 години тверду речовину (3,67г). Вихід становить 42 %. реакцію завершують, одержують сполуку 2 як білу Метод А-2 (без виділення сполуки 3): тверду речовину. 23 90131 24 Сполуку 2 (4,5г, 1,5екв., 30ммоль) розчиняють 163,8, 178,5; МС (FAB): М+=628, знайдено: 629 у суміші 50мл абсолютного етанолу і Net3 (8,3мл, (М++1), 651 (М++Na); ІЧ (плівка, см-1) vмакс.=3060, 3екв.) при 0°С та додають сполуку 1 (10г, 1екв., 3031, 2959, 2932, 2868, 1670, 1619, 1597, 1532, 20ммоль). Реакційну суміш перемішують протягом 1466, 1446, 1187, 1160, 1030, 1003, 909, 880, 824, приблизно 5 годин з метою одержання прозорого 762, 733, 701, 640. розчину та потім ще протягом 16 годин при кімнатОдержання сполуки 5 ній температурі. Після цього додають K2СО3 (4,14г, Сполуку 4 (6,3г, 10ммоль) суспендують в 30мл 30ммоль, 1,5екв.) і сполуку 8 (4,6г, 1,2екв., метанолу та додають 3мл СНСІ3 до повного роз24ммоль) та переміщують ще протягом 12 годин чинення. Реакційну суміш охолоджують у крижаній при кімнатній температурі. Реакційну суміш екстванні та додають NaBH4 (760мг, 20ммоль). Через 1 рагують СНСІ3, а органічну фазу концентрують. годину перемішування суміш екстрагують СНСІ3. Одержану тверду речовину очищують колонковою Органічну фазу концентрують, одержуючи сполуку хроматографією, одержуючи сполуку 4 як білу 5 (6г) як масло. Вихід становить 95%. 1 тверду речовину. Н ЯМР (CDCI3, 300МГц): 0,85 (т, J=7,5Гц, Метод А-3 (без виділення сполуки 3): 3H, СН3), 1,27-1,32 (м, 2Н, СН2), 1,61-1,66 (м, 2Н, Сполуку 1 (563г) розчиняють у суміші 3,6л абСН2), 2,50 (т, J=7,5Гц, 2Н, СН2), 4,32 (с, 2Н, солютного етанолу та 1,2л триетиламіну. РеакційСН2ОН), 5,12 (с, 2Н, NCH2), 6,74 (д, J=8,1Гц, 2Н, ну суміш охолоджують до 0°С та повільно додають ArН), 6,84 (с, 1Н, СН=), 6,93 (д, J=7,2Гц, 6Н, ArН), сполуку 2 (350г). Протягом 1 години перемішують 7,08 (д, J=8,1Гц, 2Н, ArН), 7,23-7,36 (м, 10H, ArН), при 0°С, після чого реакційну суміш розріджують 7,44-7,48 (м, 2Н, ArН), 7,90-7,93 (м, 1Н, ArН); 13С хлороформом та водою. Органічну фазу відокремЯМР (CDCI3, 75МГц): 13,7, 22,3, 26,7, 29,7, 46,3, люють, а водну фазу знову екстрагують хлорофо54,4, 82,8, 125,2, 126,2, 126,6, 127,6, 128,2, 129,7, рмом. До об'єднаних органічних фаз при кімнатній 130,2, 130,7, 131,0, 135,3, 140,5, 141,2, 141,4, температурі додають K2СО3 (180г), 560мл води та 150,1, 163,9; МС (FAB): М+=630, знайдено: 631 330г сполуки 8. Потім протягом ночі перемішують (M++1), 653 (М++Na); ІЧ (плівка, см-1) vмакс.=3060, при кімнатній температурі, після чого реакційну 2956, 2927, 2865, 1493, 1464, 1448, 1355, 1272, суміш розріджують хлороформом та водою. Орга1189, 1153, 1026, 906, 880, 822, 753, 699, 636. нічну фазу відокремлюють, а водну фазу знову Одержання сполуки 6 екстрагують хлороформом. Об'єднані органічні Сполуку 5 (6,3г, 10ммоль) розчиняють у суміші фази сушіть над MgSO4, фільтрують та концентрозчинників із 40мл СН2СІ2 та води (1:1). Після рують. Одержаний таким чином залишок перекридодавання СеСІ3.7Н2О (7,44г, 20ммоль) та подасталізовують із етилацетату, одержуючи сполуку 4 льшого 2-хвилинного перемішування по краплях (530г). Вихід становить 74%. додають 10%-ний розчин NaCIO (37мл). Потім пеМетод В: ремішують ще протягом 10 хвилин та додають Сполуку 15 (1,47г, 4,6ммоль), сполуку 13 (3,4г, насичений водний розчин Na2SO3. Реакційну суміш 1,2екв.) та Na2CO3 (1,46г, 3екв.) розчиняють в екстрагують СНСІ3, органічні фази концентрують, 20мл суміші толуолу та води (7:3) Потім через сиса одержану тверду речовину очищують колонкотему тричі пропускають аргон та додають вою хроматографією, одержуючи сполуку 6 (4,65г). Pd(PPh3)4 (266мг, 0,05екв.). Реакційну суміш проВихід становить 70%. 1 тягом 10 годин нагрівають до 80°С та потім екстраН ЯМР (CDCI3, 300МГц): 0,86 (т, J=7,2Гц, гують етилацетатом. Органічні фази концентру3H, СН3), 1,23-1,33 (м, 2Н, СН2), 1,58-1,69 (м, 2Н, ють, а залишок очищують колонковою СН2), 2,49 (т, J=7,8Гц, 2Н, СН2), 3,30 (с, ш, 1Н, ОН), хроматографією, одержуючи сполуку 4 як тверду 4,32 (с, 2Н, СН2ОН), 5,14 (с, 2Н, NCH2), 6,78 (д, речовину (2,1г). Вихід становить 74%. J=7,8Гц, 2Н, ArН), 6,94 (д, J=7,5Гц, 6Н, ArН), 7,12 Метод С: (д, J=7,8Гц, 2Н, ArН), 7,23-7,37 (м, 10H, ArН), 7,43Сполуку 21 (40мг, 0,11ммоль), сполуку 23 7,51 (м, 2Н, ArН), 7,94-7,97 (м, 1Н, ArН); 13С ЯМР (151мг, 0,33ммоль) та K2СО3 (45мг, 0,33ммоль) (CDCI3, 75МГц): 13,6, 22,3, 26,5, 29,5, 47,0, 52,7, розчиняють в 3мл суміші толуолу та води (7:3). 82,8, 124,9, 125,2, 126,1, 126,8, 127,5, 128,2, 129,7, Потім через систему тричі пропускають аргон та 130,1, 130,6, 134,5, 140,7, 141,1, 141,2, 148,3, додають Pd(PPh3)4 (6мг, 0,05екв.). Реакційну суміш 163,8; МС (FAB): М+=664, знайдено: 665 (М++1), протягом 10 годин нагрівають до 80°С, після чого 687 (М++Na); ІЧ (плівка, см-1) vмакс.=3184, 3061, екстрагують етилацетатом. Органічні фази конце2958, 2931, 2869, 2244, 1577, 1492, 1466, 1447, нтрують, а залишок очищують колонковою хрома1356, 1255, 1189, 1160, 1078, 1028, 1005, 909, 881, тографією, одержуючи сполуку 4 як тверду речо756, 733, 701, 640. вину (48мг). Вихід становить 72%. Одержання сполуки 7 1 Н ЯМР (CDCI3, 400МГц): 0,86 (т, J=7,2Гц, Сполуку 6 (6,64г, 10ммоль) розчиняють в 20мл 3H, СН3), 1,25-1,32 (м, 2Н, СН2), 1,64-1,68 (м, 2Н, ТГФ та додають 20мл 2N розчину НСІ. Реакційну СН2), 2,55 (т, J=7,6Гц, 2Н, СН2), 5,48 (с, 2Н, NCH2), суміш протягом 4 годин перемішують при кімнатній 6,82 (д, J=8,4Гц, 2Н, ArН), 6,91-6,93 (м, 6Н, ArН), температурі, потім розріджують СНСІ3, промива7,09 (д, J=8,4Гц, 2Н, ArН), 7,23-7,27 (м, 6Н, ArН), ють водою та сушать. Органічні фази концентру7,31-7,35 (м, 4Н, ArН), 7,41-7,49 (м, 2Н, ArН), 7,78 ють, а одержану тверду речовину очищують коло(с, 1Н, СН=), 7,91 (дд, J=1,2Гц, 7,2Гц, ArН), 9,64 (с, нковою хроматографією, одержуючи сполуку 7 1Н, СНО); 13С ЯМР (CDCI3, 100МГц): 13,7, 22,3, (3,8г). Вихід становить 90%. 1 26,4, 29,2, 47,8, 82,8, 125,9, 126,2, 127,6, 127,8, Н ЯМР ( -ДМСО, 300МГц): 0,78 (т, J=7,2Гц, 127,9, 128,2, 129,7, 129,9, 130,1, 130,2, 130,7, 3H, СН3), 1,18-1,25 (м, 2Н, СН2), 1,41-1,46 (м, 2Н, 131,3, 134,7, 140,7, 141,2, 141,4, 143,6, 156,7, СН2), 2,44 (т, J=7,5Гц, 2Н, СН2), 4,32 (с, 2Н, 25 90131 26 СН2ОН), 5,23 (с, 2Н, NCH2), 7,01 (д, J=8,1Гц, 2Н, Залишок очищують колонковою хроматографією, ArН), 7,07 (д, J=8,1Гц, 2Н, ArН), 7,49-7,58 (м, 2Н, одержуючи сполуку 16 (10,2г) як безбарвних кристалів. Вихід становить 75%. ArН), 7,63-7,65 (м, 2Н, ArН); 13С ЯМР ( -ДМСО, 1 Н ЯМР (CDCI2, 300МГц) 2,41 (с, 3H, СН3), 75МГц): 13,5, 21,5, 25,7, 28,9, 46,4, 51,3, 123,5, 7,28 (д, J=7,5Гц, 2Н, ArН), 8,09 (d, J=7,5Гц, 2Н, 125,2, 125,6, 126,2 (2С), 127,7, 129,1 (2С), 130,5 13 (2С), 131,0, 136,1, 138,4, 141,0, 147,3, 155,0; МС ArН); С ЯМР (CDCI3, 75МГц): 21,9, 128,8 (2С), (FAB): М+=422, знайдено: 423 (М++1), 445 (М++Na); 135,7 (3C), 142,9; МС (ΕΙ): m/z (%): 354 (М+, 100), ІЧ (плівка, см-1) vмакс.=3351, 2959, 2932, 2870, 1936, 262 (19), 193 (17), 145 (18), 119 (36), 91 (39), 43 1709, 1575, 1464, 1422, 1361, 1257, 1226, 1078, (47); ІЧ (плівка, см-1) vмакс.=3045, 3022, 2918, 1920, 1007, 824, 758. 1613, 1517, 1406, 1367, 1347, 1307, 1179, 1109, Одержання сполуки 11 1081, 818, 736, 685, 528, 477. Сполуку 9 (9,5г, 30ммоль) розчиняють у суміші Одержання сполуки 17 100мл етанолу та 30мл води. Потім додають гідТримеризовану борну кислоту 16 (5г, разингідрат (9мл) та кип'ятять зі зворотнім холо14,1ммоль), пінаколгексагідрат (11,5г, 50,8ммоль) дильником. Через приблизно 1 годину в осад вирозчиняють в 100мл циклогексану, та з метою випадає біла тверда речовина, після цього через 9 далення води розчин протягом 10 годин кип'ятять годин перемішування при кип'ятінні зі зворотнім зі зворотнім холодильником. Потім циклогексан холодильником охолоджують до кімнатної темпевідганяють при пониженому тиску, а залишок очиратури. Додають розчин NaOH (4,88Μ, 100мл), та щують колонковою хроматографією, одержуючи реакційну суміш екстрагують діетиловим етером. сполуку 17 (7,8г) як масло. Вихід становить 84%. 1 Органічну фазу сушать над MgSO4 та концентруН ЯМР (CDCI2, 300МГц): 1,37 (с, 12Н, 4СН3), ють, одержуючи сполуку 11 (5г). Вихід становить 2,40 (с, 3H, СН3), 7,22 (д, J=7,5Гц, 2Н, Ar), 7,75 (д, 90%. J=7,5Гц, 2Н, Ar), 13С ЯМР (CDCI3, 75МГц) 21,7, 1 Н ЯМР (CDCI2, 300МГц): 1,36 (с, 2Н, ΝΗ2), 24,8 (4С), 83,5 (2С), 128,5 (2С), 134,8 (3C), 141,3; 3,75 (с, 2Н, NCH2), 7,12 (д, J=8,1Гц, 2Н, ArН), 7,38 МС (ΕΙ): m/z (%): 218 (М+, 23), 203 (33), 132 (52), 13 (д, J=8,1Гц, 2Н, ArН); С ЯМР (CDCI3, 75МГц): 119 (100), 91 (22), 43 (58), ІЧ (плівка, см-1) 45,5, 120,2, 128,6 (2С), 131,2 (2С), 142,0; ІЧ (плівка, vмакс.=3046, 2979, 2928, 1613, 1519, 1448, 1398, см-1) vмакс.=3380, 2924, 2854, 2645, 2210, 1653, 1361, 1320, 1268, 1214, 1146, 1089, 1023, 962, 859, 1562, 1529, 1481, 1441, 1410, 1380, 1332, 1072, 816, 726, 656. 1007, 905, 812, 789, 645, 618. Одержання сполуки 18 Одержання сполуки 15 Сполуку 17 (5г, 22,9ммоль), NBS (5,3г, Сполуку 2 (6,8г, 1,5екв., 45ммоль) розчиняють 29,8ммоль) та AIBN (200мг) розчиняють в 40мл у суміші 60мл абсолютного етанолу та Net3 циклогексану, та розчин протягом 5,5 годин кип'я(12,5мл, 3екв.) при 0°С, після чого додають сполутять зі зворотнім холодильником. Потім фільтруку 11 (5,6г, 1екв., 30ммоль). Реакційну суміш проють при пониженому тиску, а фільтрат концентрутягом 10 годин перемішують при кімнатній темпеють. Залишок очищують колонковою ратурі, потім додають K2СО3 (6,2г, 45ммоль, хроматографією, одержуючи сполуку 17 (5,86г) як 1,5екв.) і сполуку 8 (6,9г, 1,3екв., 36моль) та протямасло. Вихід становить 86%. 1 гом 12 годин перемішують при кімнатній темпераН ЯМР (CDCI2, 300МГц): 1,35 (с, 12Н, 4СН3), турі. Після цього екстрагують СНСІ3, органічні фа4,45 (с, 2Н, СН2), 7,40 (д, J=7,2Гц, 2Н, ArН), 7,81 (д, зи концентрують, а залишок очищують колонковою J=7,2Гц, 2Н, ArН); 13С ЯМР (CDCI3, 75МГц): 24,8 хроматографією, одержуючи сполуку 15 (3,74г). (4С), 33,2, 83,8 (2С), 125,6,128,2 (2С), 135,2 (2С), Вихід становить 39%. 140,6; МС (ΕΙ): m/z (%): 297 (М++1, 5), 295 (М+-1,5), 1 Н ЯМР (CDCI2, 300МГц): 0,88 (т, J=7,2Гц, 281 (3), 283 (3), 217 (100), 197 (15), 131 (13), 117 3H, СН3), 1,31-1,38 (м, 2Н, СН2), 1,63-1,71 (м, 2Н, (50), 91 (12), 43 (39); ІЧ (плівка, см-1) vмакс.=3044, СН2), 2,63 (т, J=8,1Гц, 2Н, СН2), 5,50 (с, 2Н, NCH2), 2974, 2919, 1937, 1609, 1512, 1396, 1356, 1320, 6,88 (д, J=8,4Гц, 2Н, ArН), 7,42 (д, J=8,4Гц, 2Н, 1269, 1217, 1143, 1085, 1017, 960, 845, 784, 655, ArН), 7,77 (с, 1Н, СН=), 9,64 (с, 1Н, СНО); 13С ЯМР 602. (CDCI3, 75МГц): 13,6, 22,4, 26,4, 29,3, 47,5, 121,7, Одержання сполуки 19 128,0 (2С), 131,2, 131,9 (2С), 135,2, 143,7, 156,6, Сполуку 18 (16г, 53,9ммоль), фталімід (10,3г, 178,7; МС (FAB): М+=320, знайдено: 321 (М++1), 72ммоль) та K2СО3 (9,7г, 72ммоль) протягом 12 323 (М++3), ІЧ (плівка, см-1) vмакс.=2958, 2932, 2868, годин кип'ятять зі зворотнім холодильником в 1671, 1533, 1485, 1463, 1407, 1373, 1161, 1072, 60мл сухого ацетону. Потім ацетон відганяють при 1011, 813, 769, 648. пониженому тиску, а для розчинення неорганічної Одержання сполуки 16 солі додають 100мл води. Реакційну суміш фільтРозчин п-бромтолуолу (17г, 100ммоль) в рують при пониженому тиску, промивають водою 100мл висушеного ТГФ протягом однієї години по та сушать, одержуючи сполуку 19 (17,6г) як білу краплях додають у суміш магнієвого порошку (3,6г, тверду речовину. Вихід становить 90%. 1 150ммоль), йоду (200мг) та 4 крапель 1,2Н ЯМР (CDCI2, 300МГц): 1,31 (с, 12Н, 4СН3), диброметану. Потім протягом години кип'ятять зі 4,85 (с, 2Н,СН2), 7,42 (д, J=6,6Гц, 2Н, ArН), 7,67зворотнім холодильником, охолоджують до -78°С 7,70 (м, 2Н, ArН), 7,76 (д, J=6,6Гц, 2Н, ArН), 7,81та додають триметилборат (10,3г 10ммоль). Реак7,84 (м, 2Н, ArН); 13С ЯМР (CDCI3, 75МГц): 24,8 ційну суміш перемішують протягом наступних 2 (4С), 41,6, 83,7 (2С), 123,3 (2С), 127,8 (2С), 132,1, годин, після чого розкладають шляхом додавання 133,9 (2С), 135,1 (3C), 139,3 (2С), 167,9 (2С); МС води. Після екстрагування етилацетатом органічну (ΕΙ): m/z (%): 363 (М+, 100), 348 (17), 264 (37), 217 фазу промивають водою, сушать та концентрують. 27 90131 28 1 (34), 160 (31), 130 (29), 117 (92), 91 (16), 76 (36), 43 Н ЯМР (CDCI2, 300МГц): 7,18-7,36 (м ,17Н, (78); ІЧ (плівка, см-1) vмакс.=2989, 2941, 1772, 1718, ArН), 7,66 (д, J=7,8Гц, 1Н, ArН), 7,88 (д, J=7,8Гц, 1610, 1429, 1393, 1358, 1342, 1141, 1087, 1020, 1Н, ArН); 13С ЯМР (CDCI3, 75МГц): 83,3, 122,2, 962, 938, 856, 786, 718, 659. 127,3, 127,7, 128,3, 128,7, 130,3, 131,1, 131,6, Одержання сполуки 21 133,9, 141,2, 162,9. Сполуку 19 (2,5г, 6,9ммоль) та гідразингідрат Одержання сполуки 12 (0,47мл, 80%, 7ммоль) при кімнатній температурі Бензонітрил (10,3г, 100ммоль), NH4CI (6,9г, розчиняють в 30мл метанолу, та суміш кип'ятять зі 1,3екв.), NaN3 (8,5г, 1,3екв.) і LiCI (300мг) розчинязворотнім холодильником. Через 12 годин охолоють в 100мг ДМФА, та реакційну суміш протягом джують до кімнатної температури фільтрують при 12 годин перемішують при 100°С. Потім більшу пониженому тиску. Білу тверду речовину викидачастину розчинника видаляють при пониженому ють, а фільтрат концентрують досуха. При цьому тиску. Залишок підлужують 10%-ним водним розводу видаляють за допомогою сухого бензолу в чином NaOH до значення рН=12. Після екстрагуатмосфері захисного газу. Потім додають NEt3 вання етилацетатом водну фазу відокремлюють (2,9мл), сухий метанол (10мл) і сполуку 2 (2,1г, та підкислюють концентрованим розчином соляної 14ммоль), та реакційну суміш протягом 10 годин кислоти до значення рН=2. Осад відфільтровують перемішують при кімнатній температурі. Після через лійку Бюхнера, промивають водою та суцього додають K2СО3 (952мг, 7ммоль) і сполуку 8 шать, одержуючи 5-фенілтетразол (13,5г, темпе(1,6г, 8,3ммоль) та протягом наступних 10 годин ратура плавлення 208-209°С). Вихід становить перемішують при кімнатній температурі. Потім у 96%. 1 реакційну суміш додають незначну кількість води Н ЯМР ( -ДМСО, 300МГц) 7,55-7,57 (3H, м), та екстрагують СНСІ3. Промивають водою, а орга8,01-8,03 (2Н, м); 13С ЯМР ( -ДМСО, 75МГц) нічну фазу відокремлюють, сушать і концентрують. 129,5, 132,4, 134,8, 136,7, 160,7; МС (El) m/z (%): Залишок очищують колонковою хроматографією, 146 (М+, 42), 118 (100), 103 (17), 91 (46), 77 (32), 63 одержуючи сполуку 21 (85мг) як масло. Вихід ста(48); ІЧ (плівка, cm-1) vмакс.=3055, 2982, 2837, 2607, новить 4%. 2545, 1607, 1562, 1485, 11463, 1409, 1163, 1 Н ЯМР (CDCI2, 300МГц): 0,88 (т, J=7,5Гц, 1056,1013, 725, 703, 686. 3H, СН3), 1,25-1,38 (м, 14Н, СН2 і 4СН3), 1,63-1,73 5-фенілтетразол (6,6г, 45ммоль) розчиняють в (м, 2Н, СН2), 2,62 (т, J=7,5Гц, 2Н, СН2), 5,59 (с, 2Н, 20мл СН2СІ2 та додають NEt3 (8мл, 1,3екв.). РеакArСН2), 6,99 (д, J=7,8Гц, 2Н, ArН), 7,73 (д, J=7,8Гц, ційну суміш у крижаній ванні охолоджують до 0°С 2Н, ArН), 7,78 (с, 1Н, NCH=), 9,66 (с, 1Н, СНО); 13С та протягом 10 хвилин трьома порціями додають ЯМР (CDCI3, 75МГц): 13,7, 22,4, 24,8 (4С), 26,5, Рh3ССІ (13,2г, 1,05екв.). Потім нагрівають до кім29,3, 48,2, 83,9 (2С), 125,5 (2С), 131,4, 135,3 (3C), натної температури та перемішують протягом 3 139,2, 143,6, 156,8, 178,7; МС (FAB): М+=368, годин. Реакційну суміш фільтрують, промивають знайдено: 369 (М++1); ІЧ (плівка, см-1) vмакс.=3044, водою та сушать, одержуючи сполуку 12 (16,5г, 2975, 2933, 2870, 1671, 1614, 1533, 1464, 1405, температура плавлення 163-164°С). Вихід стано1362, 1326, 1270, 1160, 1145, 1089, 1021, 963, 858, вить 94%. 1 821, 793, 721, 654. Н ЯМР (CDCI3, 300МГц) 7,21-7,24 (6Н, м), Одержання сполуки 22 і 23 7,37-7,39 (9Н, м), 7,47-7,49 (3H, м), 8,19-8,20 (2Н, Суспензію о-бромбензонітрилу (9,1г, м); 13С ЯМР (CDCI3, 75МГц) 83,0, 127,0, 127,5, 50ммоль), NH4CI (3,5г, 65ммоль), NaN3 (4,3г, 127,7, 128,3, 128,7, 130,3, 141,3, 164,0; ІЧ (плівка, 65ммоль) і LiCI в 80мл ДМФА нагрівають до 100°С см-1) vмакс.=3058, 1490, 1465, 1445, 1186, 1028, 874, та перемішують протягом 12 годин. Велику части763, 748, 697, 635. ну розчинника відганяють при 120°С при понижеОдержання сполуки 13 ному тиску. Залишок підлужують 10%-ним водним Розчин сполуки 12 (10г, 25,8моль) в ТГФ розчином NaOH до значення рН=12. Реакційну (30мл) в атмосфері аргону охолоджують до -20°С. суміш екстрагують етилацетатом, а органічну фазу Потім додають BuLi (1Μ, 27мл, 1,05екв.). Темперапідкислюють концентрованим розчином НСІ до туру підвищують до -5°С та перемішують протягом значення рН=2, причому в осад випадає біла тве1 години. В цей час в осад випадає велика кільрда речовина. Цю речовину відфільтровують чекість твердої речовини. Знову охолоджують до рез лійку Бюхнера при пониженому тиску, проми25°С та шприцом повільно додають В(ОМе)3 вають водою та сушать, одержуючи сполуку 22 (4,3мл, 1,5екв.). Після цього реакційну суміш за(10г, вихід 90%). лишають нагріватися до 20°С та перемішують Сполуку 22 розчиняють в 30мл СН2СІ2, суміш в протягом 0,5 години. При пониженому тиску кількрижаній ванні охолоджують до 0°С та додають кість розчинника зменшують до 1/3 від первинної NEt3 (8мл). Потім протягом 10 хвилин трьома поркількості, при цьому утворюється біла тверда реціями додають Ph3CCI (13,2г, 47ммоль), та реакчовина. Тверду речовина відфільтровують, промиційну суміш нагрівають до кімнатної температури. вають 20% розчином ТГФ в Н2О (40мл) і водою Через 3 години перемішування фільтрують через (40мл) та сушать, одержуючи сполуку 13 (10,4г). лійку Бюхнера при пониженому тиску, промивають Вихід становить 94%. Сполуку 13 можна викорисводою та сушать, одержуючи сполуку 23 (18,9г). товувати безпосередньо після одержання без поВихід становить 90%. переднього очищення. 29 Комп’ютерна верстка О. Гапоненко 90131 Підписне 30 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the production of losartan
Автори англійськоюWang Yaping, Li Yonggang, Li Yulin, Zheng Guojun, Li Yi
Назва патенту російськоюСпособ получения лозартана
Автори російськоюВанг Япинг, Ли Йонгганг, Ли Юлин, Женг Гуоюн, Ли И
МПК / Мітки
МПК: C07D 403/10, C07D 233/54, C07D 257/00, C07D 251/08
Мітки: лозартану, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/15-90131-sposib-oderzhannya-lozartanu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання лозартану</a>
Попередній патент: Аморфний лерканідипіну гідрохлорид і фармацевтична композиція на його основі
Наступний патент: Упаковка, що зберігає свіжість, для довгастих виробів та спосіб її виготовлення
Випадковий патент: Спосіб рекламування та/або інформування