Інгібітор p38 map-кінази
Номер патенту: 105014
Опубліковано: 10.04.2014
Автори: Мюррей Пітер Джон, Уільямс Джонатан Гарет, Оніонс Стюарт Томас, Чаррон Кетрін Елізабет, Іто Казухіро, Стронг Пітер, Рейппорт Уільям Гарт, Кінг-Андервуд Джон
Формула / Реферат
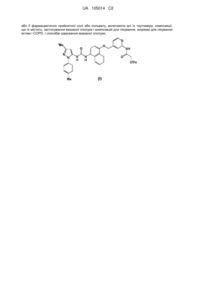
1. Сполука формули (І)
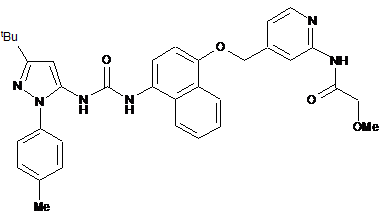 (І)
(І)
або її фармацевтично прийнятна сіль або сольват, включаючи всі її таутомери.
2. Фармацевтична композиція, яка містить сполуку за п. 1 в комбінації з одним або більше фармацевтично прийнятними розріджувачами або носіями.
3. Спосіб лікування стану, вибраного з:
COPD (включаючи хронічний бронхіт і емфізему), астми, педіатричної астми, муковісцидозу, саркоїдозу, ідіопатичного пневмосклерозу, алергічного риніту, риніту, синуситу,
алергічного кон'юнктивіту, кон'юнктивіту, алергічного дерматиту, контактного дерматиту, псоріазу, виразкового коліту, запального стану суглобів, викликаного ревматоїдним артритом або остеоартритом,
ревматоїдного артриту, панкреатиту, кахексії, інгібування росту і метастазування пухлин, включаючи недрібноклітинну карциному легень, карциному молочних залоз, карциному шлунка, колоректальні карциноми і злоякісну меланому,
який включає введення суб'єкту ефективної кількості сполуки формули (І) за п. 1 або фармацевтичної композиції за п. 2, наприклад введення терапевтично ефективної кількості, потребуючому цього пацієнту.
Текст
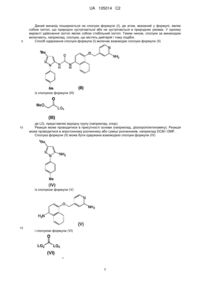
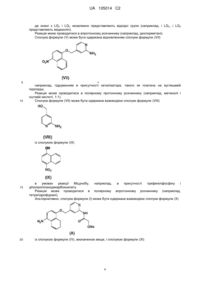
Реферат: Даний винахід стосується сполуки формули (І) N tBu O O N N N H NH N H O OMe Me (І) UA 105014 C2 (12) UA 105014 C2 або її фармацевтично прийнятної солі або сольвату, включаючи всі їх таутомери, композиції, що їх містить, застосування вказаної сполуки і композицій для лікування, зокрема для лікування астми і COPD, і способів одержання вказаної сполуки. UA 105014 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь, до якої належить винахід Винахід стосується сполук, які являють собою інгібітори активованих мітогеном р38 ферментів протеїнкіназ (які називаються в даному описі інгібіторами р38 МАР-кінази), зокрема їх підтипів альфа і гамма кінази, і їх застосування при лікуванні, зокрема при лікуванні запальних захворювань, включаючи запальні захворювання легень. Передумови винаходу Були ідентифіковані 4 ізоформи р38 МАРК (відповідно, альфа, бета, гамма і дельта). Ізоформи альфа і бета р38 МАРК повсюдно експресовані по всьому організму і виявляються в багатьох різних типах клітин. Ізоформи альфа і бета р38 МАРК інгібуються певними відомими низькомолекулярними інгібіторами р38 МАРК. Більш ранні покоління цих сполук були високотоксичними внаслідок типів повсюдної експресії даних ізоформ і побічних ефектів сполук. Більш пізні інгібітори вдосконалені для вияву високої селективності відносно альфа- і бетаізоформ р38 МАРК і мають більш широкі межі безпеки. Менше відомо про гамма- і дельта-ізоформи р38 МАРК. Дані ізоформи експресовані в певних тканинах/клітинах (на відміну від ізоформ р38 альфа і р38 бета). Ізоформа р38 МАРКдельта більш експресована в підшлунковій залозі, сім'яниках, легенях, тонкій кишці і нирках. Велика кількість його також виявляється в макрофагах (Smith S.J. (2006) Br. J. Pharmacol. 149: 393-404), і він виявляється в нейтрофілах, CD4+ Т-клітинах і ендотеліальних клітинах (www.genecard.org, Каrin К. (1999) J. Immunol.). Дуже мало відомо про експресію р38 МАРКгамма, але вона більше експресована в мозку, скелетних м'язах і серці, а також в лімфоцитах і макрофагах (www.genecard.org). На даний час немає селективних низькомолекулярних інгібіторів р38 МАРК-гамма і -дельта, але один існуючий інгібітор надає інгібуючу дію на всі ізоформи. BIRB 796 інгібує всі ізоформи, але інгібує р38-гамма і р38-дельта в більш високих концентраціях, ніж інгібує р38-альфа і р38бета (Kuma Y. (2005) J. Biol. Chem. 280: 19472-19479). BIRB 796 також порушував фосфорилування р38 МАРК або JNK (з Jun N-кінцевих протеїнкіназ), що знаходиться вище по ходу транскрипції кіназою МКК6 або МКК4. Автори обговорювали можливість того, що конформаційна зміна, викликана зв'язуванням інгібітору з МАРК, може впливати на структуру і сайта його фосфорилування, і сайта докініу для активатора, що знаходиться вище по ходу транскрипції, порушуючи фосфорилування МАРК або JNK. Вважають, що р38 МАР-кіназа грає основну роль в багатьох шляхах передачі сигналів, які беруть участь в ініціації і підтриманні хронічного, персистуючого запалення при захворюваннях людини, наприклад важкій астмі і COPD. На даний час є велика кількість літератури, яка демонструє, що р38 МАР-кіназа активується діапазоном прозапальних цитокінів і що її активація приводить до вироблення і вивільнення інших прозапальних цитокінів. Дійсно, дані деяких клінічних досліджень демонструють сприятливі зміни активності захворювання у пацієнтів під час лікування інгібіторами р38 МАР-кінази. Наприклад, Smith S.J. (2006; Br. J. Pharmacol. 149: 393-404) описує інгібуючий ефект інгібіторів р38 МАР-кінази на вивільнення цитокіну з людських макрофагів. Пропонується застосування інгібіторів р38 МАР-кінази при лікуванні хронічного обструктивного легеневого захворювання (COPD). Виявилося, що низькомолекулярні інгібітори, націлені на р38 МАРКα/, ефективні в зменшенні різних параметрів запалення в клітинах і тканинах, одержаних у пацієнтів з COPD, які загалом нечутливі до кортикостероїдів (Smith S.J. (2006) Br. J. Pharmacol. 149: 393-404), і на моделях у тварин in vivo (Underwood D.C. et al. (2000) 279: 895-902; Nath P. et al. (2006) Eur. J. Pharmacol. 544: 160-167). Irusen зі співробітниками також висловили припущення про можливість участі р38 МАРКα/ в нечутливості до кортикостероїдів за допомогою зниження спорідненості зв'язування рецепторів глюкокортикоїдів (GR) в ядрах (Irusen E. et al., (2002) J. Allergy Clin. Immunol., 109: 649-657). Досвід клінічного застосування діапазону інгібіторів р38 МАР-кінази, включаючи AMG548, BIRB 796, VX702, SCIO469 і SCIO323, описаний в публікації Lee et al. (2005) Current Med. Chem. 12: 2979-2994. COPD являє собою стан, при якому, як повідомлялося, запалення, що лежить в його основі, по суті стійке до протизапальних ефектів інгаляційних кортикостероїдів. Отже, ефективною стратегією лікування COPD цілком може бути розробка втручання, яке і надає властивий йому протизапальний ефект, і здатне підвищити чутливість легеневих тканин у пацієнтів з COPD до інгаляційних кортикостероїдів. Нещодавня публікація Mercado et al. (2007; American Thoracic Society Abstract A56) демонструє, що сайленсинг р38-гамма здатний відновити чутливість до кортикостероїдів. Однак, основною перешкодою, що заважає визначенню і використанню потенційних можливостей застосування інгібіторів р38 МАР-кінази при лікуванні хронічних запальних захворювань людини, була токсичність, що спостерігалася у пацієнтів. Вона була досить важкою для того, щоб відмінити клінічну розробку багатьох сполук, яка проводилася. 1 UA 105014 C2 5 10 15 20 25 30 35 40 45 Розроблені до теперішнього часу сполуки були призначені для перорального введення. Ця стратегія включає оптимізацію сполук, які досягають тривалості своєї дії відповідним фармакокінетичним профілем. Це забезпечує те, що є достатня одержана концентрація лікарського засобу і її підтримання після і між введенням доз для забезпечення клінічного ефекту. Неминучим наслідком такого підходу є те, що є імовірність впливу терапевтично активних концентрацій лікарського засобу на всі тканини організму, зокрема печінку і кишечник, незалежно від того, що захворювання, яке піддається лікуванню, здійснює на них несприятливий вплив. Альтернативною стратегією є розробка підходів до лікування, при яких лікарський засіб вводиться безпосередньо до запаленого органа (місцеве лікування). Хоч даний підхід непридатний для лікування всіх хронічних запальних захворювань, він активно використовувався для лікування легеневих захворюваннях (астма, COPD), шкірних захворювань (атопічний дерматит і псоріаз), захворювань носової порожнини (алергічний риніт) і шлунково-кишкових захворювань (виразковий коліт). При місцевому лікуванні ефективність може бути досягнута або (і) забезпеченням того, щоб лікарський засіб мав тривалу дію і утримувався в релевантному органі для мінімізації ризиків системної токсичності, або (іі) одержанням препаративної форми, яка створює "резервуар" активного лікарського засобу, який доступний для підтримання бажаних ефектів лікарського засобу. Підхід (і) ілюструється антихолінергічним лікарським засобом тіотропій (Spiriva), який вводиться місцево в легені як засіб для лікування COPD і який має виключно високу спорідненість з його рецептором-мішенню, приводячи до дуже повільної дисоціації і, як наслідок, до тривалої дії. Залишається потреба в ідентифікації і розробці нових сполук, які є інгібіторами р38 МАРкінази, які мають поліпшений терапевтичний потенціал, зокрема, які є більш ефективними, тривалодіючими і/або менш токсичними. Метою даного дослідження є надання сполук, які інгібують р38 МАР-кіназу з певною підтиповою специфічністю і які виявляють хороший протизапальний потенціал. Короткий опис суті винаходу Відповідно до винаходу надається сполука фомули (І) або її фармацевтично прийнятна сіль або сольват, включаючи всі її таутомери. Короткий опис креслень На фіг. 1 показаний графік залежності числа нейтрофілів в BALF від часу перед введенням сполуки формули (І) в тесті накопичення нейтрофілів, викликаного LPS. На фіг. 2 показаний графік залежності % інгібування нейтрофілів від часу перед введенням сполуки формули (І) в тесті накопичення нейтрофілів, викликаного LPS. На фіг. 3 показані впливи дози сполуки формули (І) на число активованих макрофагів в BAL мишей, підданих впливу сигаретного диму. На фіг. 4 показані впливи дози сполуки формули (І) на число нейтрофілів в BAL мишей, підданих впливу сигаретного диму. На фіг. 5 показаний вплив дози сполуки формули (І) на легеневу функцію у сенсибілізованих яєчним альбуміном, заражених парагрипом морських свинок після антигенної стимуляції яєчним альбуміном. Детальний опис винаходу Приклади солей сполуки (І) включають кислотно-адитивні солі сильних мінеральних кислот, такі як солі НСд і НВr, і кислотно-адитивні солі сильних органічних кислот, такі як сіль метансульфонової кислоти. Даний винахід також поширюється на сольвати сполук формули (І). Приклади сольватів включають гідрати. 2 UA 105014 C2 5 Даний винахід поширюється на сполуки формули (І), де атом, вказаний у формулі, являє собою ізотоп, що природно зустрічається або не зустрічається в природних умовах. У одному варіанті здійснення ізотоп являє собою стабільний ізотоп. Таким чином, сполуки за винаходом включають, наприклад, сполуки, що містять дейтерій і тому подібні. Спосіб одержання сполуки формули (І) включає взаємодію сполуки формули (II) із сполукою формули (III) 10 де LG1 представляє відхідну групу (наприклад, хлор). Реакція може проводитися в присутності основи (наприклад, діізопропілетиламіну). Реакція може проводитися в апротонному розчиннику або суміші розчинників, наприклад DCM і DMF. Сполука формули (II) може бути одержана взаємодією сполуки формули (IV) із сполукою формули (V) 15 і сполукою формули (VI) 3 UA 105014 C2 де кожні з LG2 і LG3 незалежно представляють відхідні групи (наприклад, і LG2, і LG3 представляють імідазоліл). Реакція може проводитися в апротонному розчиннику (наприклад, дихлорметані). Сполука формули (V) може бути одержана відновленням сполуки формули (VII) 5 10 наприклад, гідруванням в присутності каталізатора, такого як платина на вуглецевій підкладці. Реакція може проводитися в полярному протонному розчиннику (наприклад, метанолі і оцтовій кислоті, 1:1). Сполука формули (VII) може бути одержана взаємодією сполуки формули (VIII) із сполукою формули (IX) 15 20 в умовах реакції Міцунобу, наприклад, в присутності трифенілфосфіну і діізопропілазодикарбоксилату. Реакція може проводитися в полярному апротонному розчиннику (наприклад, тетрагідрофурані). Альтернативно, сполука формули (І) може бути одержана взаємодією сполуки формули (X) із сполукою формули (IV), визначеною вище, і сполукою формули (XI) 4 UA 105014 C2 5 де кожні з LG4 і LG5 незалежно представляють відхідні групи (наприклад, і LG4, і LG5 представляють імідазоліл). Реакція може проводитися в повному апротонному розчиннику. Сполука формули (X) може бути одержана відновленням сполуки формули (XII) наприклад, гідруванням в присутності каталізатора, такого як платина на вуглецевій підкладці. Сполука формули (XII) може бути одержана взаємодією сполуки формули (XIII) 10 15 20 25 30 35 де LG6 представляє відхідну групу (наприклад, хлор), і сполуки формули (VII), визначеної вище. Реакція може проводитися в присутності основи (наприклад, діізопропілетиламіну). Реакція може проводитися в полярному розчиннику, наприклад суміші DCM і DMF. Сполуки формул (III), (IV), (VI), (VIII), (IX), (XI) і (XIII) або випускаються промисловістю, або відомі і можуть бути одержані звичайними способами. Див., наприклад, Regan J. et al.; J. Med. Chem., 2003, 46, 4676-4686, WO 00/043384. WO 2007/087448 і WO 2007/089512. При бажанні або необхідності проміжні сполуки можуть бути захищені використанням звичайних захисних груп. Захисні групи і засоби для їх видалення описані в керівництві "Protective Groups in Organic Synthesis", Theodora W. Greene and Peter G.M. Wuts, виданому th John Wiley & Sons Inc.; 4 Rev Ed., 2006, ISBN-10: 0471697540. Нові проміжні сполуки заявлені як один аспект винаходу. Крім того, даний винахід стосується фармацевтичної композиції, яка містить сполуку формули (І), можливо в комбінації з одним або більше фармацевтично прийнятними розріджувачами або носіями. Розріджувачі і носії можуть включати ті, які придатні для парентерального, перорального, місцевого, через слизові оболонки і ректального введення. Як указано вище, такі композиції можуть бути одержані, наприклад, для парентерального, підшкірного, внутрішньом'язового, внутрішньовенного, внутрішньосуглобового або навколосуглобового введення, зокрема, у формі рідких розчинів або суспензій; для перорального введення, зокрема, у формі таблеток або капсул; для місцевого, наприклад внутрішньолегеневого або інтраназального введення, зокрема, у формі порошків, носових крапель або аерозолів, і трансдермального введення; для введення через слизові оболонки, наприклад в щічну, під'язикову або вагінальну слизову оболонку, і для ректального введення, наприклад, у формі супозиторіїв. Композиції можуть для зручності вводитися в стандартній лікарській формі будь-якими способами, добре відомими в фармацевтичній галузі, наприклад, як описано в Remington's 5 UA 105014 C2 5 10 15 20 25 30 35 40 45 50 55 60 Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA. (1985). Препаративні форми для парентерального введення можуть містити як ексципієнти стерильну воду або сольовий розчин, алкіленгліколі, такі як пропіленгліколь, поліалкіленгліколі, такі як поліетиленгліколь, олії рослинного походження, гідровані нафталіни і тому подібні. Препаративні форми для інтраназального введення можуть бути твердими і можуть містити ексципієнти, наприклад лактозу або декстран, або можуть являти собою водні або масляні розчини для застосування у формі носових крапель або дозованого спрею. Для букального введення звичайні ексципієнти включають цукри, стеарат кальцію, стеарат магнію, попередньо желатинізований крохмаль і тому подібні. Композиції, що вводяться перорально, можуть містити один або більше фізіологічно сумісних носіїв і/або ексципієнтів і можуть бути представлені в твердій або рідкій формі.Таблетки і капсули можуть бути одержані зі зв'язуючими агентами, наприклад сиропом, аравійською камеддю, желатином, сорбітом, трагакантом або полівінілпіролідоном; наповнювачами, такими як лактоза, сахароза, кукурудзяний крохмаль, фосфат кальцію, сорбіт або гліцин; мастильними речовинами, такими як стеарат магнію, тальк, поліетиленгліколь або діоксид кремнію; і ПАР, такими як лаурилсульфат натрію. Рідкі композиції можуть містити звичайні добавки, такі як суспендуючі агенти, наприклад сироп сорбіту, метилцелюлозу, цукровий сироп, желатин, карбоксиметилцелюлозу, або харчові жири; емульгуючі агенти, такі як лецитин або аравійська камедь; рослинні олії, такі як мигдалева олія, кокосова олія, масло печінки тріски або арахісова олія; консерванти, такі як бутильований гідроксіанізол (ВНА) і бутильований гідрокситолуол (ВНТ). Рідкі композиції можуть бути інкапсульовані, наприклад, в желатин з одержанням стандартної лікарської форми. Тверді лікарські форми включають таблетки, капсули, що складаються з двох раковин, і м'які еластичні желатинові (SEG) капсули. Склад сухої раковини капсули звичайно включає желатин в концентрації приблизно 40-60 %, пластифікатор (такий як гліцерин, сорбіт або пропіленгліколь) в концентрації приблизно 20-30 % і воду в концентрації приблизно 30-40 %. Можуть також бути присутніми інші матеріали, такі як консерванти, барвні агенти, речовини, що надають непрозорість, і ароматизатори. Рідкий заповнюючий матеріал містить твердий лікарський засіб, який був розчинений, солюбілізований або диспергований (суспендуючими агентами, такими як бджолиний віск, гідратована касторова олія або поліетиленгліколь 4000), або рідкий лікарський засіб в носіях або комбінаціях носіїв, таких як мінеральне масло, рослинні олії, тригліцериди, гліколі, поліоли і поверхнево-активні речовини. Сполука формули (І) може вводитися місцево в легені. Отже, відповідно до винаходу, надається фармацевтична композиція, яка містить сполуку формули (І), можливо, в комбінації з одним або більше місцево доступними розріджувачами або носіями. Місцеве введення в легені може досягатися використанням аерозольної препаративної форми. Аерозольні препаративні форми звичайно містять активний інгредієнт, суспендований або розчинений у придатному аерозольному газі-витискувачі, такому як хлорфторвуглець (CFC) або гідрофторвуглець (HFC). Придатні CFC гази-витискувачі включають трихлормонофторметан (газ-витискувач 11), дихлортетрафторметан (газ-витискувач 114) і дихлордифторметан (газ-витискувач 12). Придатні HFC гази-витискувачі включають тетрафторетан (HFC-134a) і гептафторетан (HFC227). Газ-витискувач звичайно складає від 40 до 99,5 % мас, наприклад від 40 до 90 % мас, всієї інгаляційної композиції. Препаративна форма може міс. і и ги ексципієнти, включаючи спільні розчинники (наприклад, етанол) і ПАР (наприклад, лецитин, сорбітантриолеат і тому подібні). Аерозольні препаративні форми упаковані в контейнери, і придатна доза доставляється за допомогою мірного клапана (наприклад, такі, як випускаються компанією Bespak, Valois або 3М). Місцеве введення в легені може також досягатися використанням нестисненої препаративної форми, такої як водний розчин або суспензія. Вона може вводитися за допомогою розпилювача. Місцеве введення в легені може бути також досягнуте використанням препаративної форми у вигляді сухого порошку. Препаративна форма у вигляді сухого порошку містить сполуку формули (І) в дрібно подрібненому вигляді з середньомасовим діаметром (MMAD) 1-10 мікрон. Препаративна форма звичайно містить місцево прийнятний розріджувач, такий як лактоза, звичайно з великим розміром частинок, наприклад з середньомасовим діаметром (MMAD) 100 мкм або більше. Приклади пристроїв для доставки сухого порошку включають SPINHALER, DISKHALER, TURBOHALER, DISKUS і CLICKHALER. Сполуки формули (І) призначені для надання терапевтичного ефекту. У ще одному аспекті даний винахід стосується композиції формули (І) для застосування як лікарського препарату. Очікується, що сполуки формули (І) можуть застосовуватися при лікуванні респіраторних розладів, включаючи COPD (включаючи хронічний бронхіт і емфізему), астму, педіатричну 6 UA 105014 C2 5 10 15 20 25 30 35 40 астму, муковісцидоз, саркоїдоз, ідіопатичний пневмосклероз, алергічний риніт, риніт, синусит, особливо астму, хронічний бронхіт і COPD. Очікується також, що сполуки формули (І) можуть застосовуватися при лікуванні певних станів, які можна лікувати місцевим або локальним застосуванням, включаючи алергічний кон'юнктивіт, кон'юнктивіт, алергічний дерматит, контактний дерматит, псоріаз, виразковий коліт, запальні ураження суглобів, викликані ревматоїдним артритом або остеоартритом. Очікується також, що сполуки формули (І) можуть застосовуватися при лікуванні певних інших станів, включаючи ревматоїдний артрит, панкреатит, кахексію, інгібування росту і метастазування пухлин, включаючи недрібноклітинну карциному легень, карциному молочних залоз, карциному шлунка, колоректальні карциноми і злоякісну меланому. Таким чином, в ще одному аспекті даний винахід стосується сполуки формули (І) для застосування при лікуванні вказаних вище станів, наприклад, введенням терапевтично ефективної кількості вказаної сполуки потребуючому цього пацієнту. У ще одному аспекті даний винахід стосується застосування сполуки формули (І) з одержанням лікарського препарату для лікування вказаних вище станів. У ще одному аспекті даний винахід стосується способу лікування вказаних вище станів, який включає введення суб'єкту ефективної кількості сполуки формули (І) або фармацевтичної композиції, що її містить. Винахід також поширюється на застосування фармацевтичних композицій/препаративних форм при лікуванні одного або більше з вказаних станів. Слово "лікування" призначене для охоплення профілактики, а також терапевтичного лікування. Сполука формули (І) може також вводитися в комбінації з одним або більше іншими активними інгредієнтами, наприклад активними інгредієнтами, придатними для лікування вказаних вище станів. Наприклад, можливі комбінації для лікування респіраторних розладів включають комбінації зі стероїдами (наприклад, будезонідом, бекламетазону дипропіонатом, флутиказону пропіонатом, мометазону фуроатом, флутиказону фуроатом), бета-агоністами (наприклад, тербуталіном, сальбутамолом, сальметеролом, форме геролом) і/або ксантинами (наприклад, теофіліном). Приклади Приклад 1: N-[4-({4-[3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо]-нафталін-1ілокси}метил)піридин-2-іл]-2-метоксіацетамід (1) 2-Аміно-4-[(4-нітронафталін-1-ілокси)метил]піридин (3) До розчину 4-нітронафтолу (5,17 г, 27,3 ммоль), трифенілфосфіну (10,75 г. 41,0 ммоль) і 2амінопіридин-4-метанолу (2) (5,09 г, 41,0 ммоль) в THF (50 мл), при -15 °C, по краплях додавали діізопропілазодикарбоксилат (DIAD) (8,07 мл, 41,0 ммоль). Суміш перемішували протягом ночі при кімнатній температурі і потім видаляли леткі речовини у вакуумі. Неочищений продукт тритурували з ЕЮ Ас (150 мл), відфільтровували і промивали ЕЮ Ас (100 мл). Друге тритурування з МеОН (100 мл) дало 2-аміно-4-[(4-нітронафталін-1-ілокси)метил]піридин (3) + + (4,54 г, 56 %) у вигляді жовтої твердої речовини: m/z 296 (М+Н) (ES ). 2-Аміно-4-[(4-амінонафталін-1-ілокси)метил]піридин (4) 7 UA 105014 C2 5 10 15 20 25 30 35 Розчин 2-аміно-4-[(4-нітронафталін-1-ілокси)метил]піридину (3) (4,50 г, 15,24 ммоль) в метанолі (200 мл) і льодяній оцтовій кислоті (200 мл) пропускали через проточний реактор Thales 'H-cube' (2 мл/хв., 40 °C, 55 мм 10 % Pt/C Cat-Cart®, повний Н2) і леткі речовини потім видаляли у вакуумі. Неочищений продукт піддавали захопленню в SCX і вивільняючому елююванню 1 % аміаком в розчині МеОН і розчинник видаляли у вакуумі з одержанням 2-аміно4-[(4-амінонафталін-1-ілокси)метил]піридину (4) (3,82 г, 94 %) у вигляді блідо-рожево-бузкової + + твердої речовини: m/z 266 (М+Н) (ES ). 1-{4-[(2-Амшопіридин-4-іл)метокси]нафталін-1-іл} -3-(3-трет-бутил-1-п-толіл-1Н-піразол-5іл)сечовина (5) До розчину 1,1’-карбонілдіімідазолу (CDI) (4,18 г, 25,80 ммоль) в DCM (15 мл) по краплях додавали в атмосфері азоту розчин 3-трет-бутил-1-п-толіл-1Н-піразол-5-аміну (6) (5,91 г, 25,80 ммоль) в DCM (15 мл) протягом 40 хв. Одержаний розчин перемішували при кімнатній температурі протягом 1 год. і потім додавали по краплях в атмосфері азоту до розчину 2-аміно4-[(4-амінонафталін-1-ілокси)метил]піридин (4) (3,80 г, 12.89 ммоль). Суміш перемішували протягом ночі і леткі речовини видаляли у вакуумі. Неочищений матеріал очищали флешхроматографією (Biotage 120 г); елюювали 0-6 % МеОН в DCM з одержанням 1-{4-[(2амінопіридин-4-іл)метокси]нафталін-1-іл}-3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)сечовини (5) 1 + (4,27 г, 63 %): m/z 521 (М+Н) (ES ). N-[4-({4-[3-(3-трет-бутил-1-п-толіл-1Н-піразол-5-іл)уреїдо]нафталін-1-ілокси)метил)-2-іл]-2метоксіацетамід (1) До перемішаного розчину 1-{4-[(2-амінопіридин-4-іл)метокси]нафталін-1-іл}-3-(3-трет-бутил1-п-толіл-1Н-піразол-5-іл)сечовини (5) (526 мг, 0,96 ммоль) і DIPEA (184 мкл, 1,06 ммоль) в суміші DCM і DMF (10:1, 11 мл) додавали метоксіацетилхлорид (92 мкл, 1,01 ммоль). Через 1 год. при кімнатній температурі послідовно додавали додаткові аліквоти DIPEA (184 мкл, 1,06 ммоль) і метоксіацетилхлориду (92 мкл, 1,01 ммоль) і перемішування продовжували протягом 1 год. Додавали розчин 1 % аміаку в МеОН (40 мл), і суміш перемішували протягом 15 хв. і потім концентрували у вакуумі. Неочищений продукт очищали колонковою флеш-хроматографією (Biotage 40 г); елюювали 0-6 % МеОН в DCM з одержанням N-[4-({4-[3-(3-трет-бутил-1-п-толіл1Н-піразол-5-іл)уреїдо]нафталін-1-ілокси}метил)піридин-2-іл]-2-метоксіацетаміду (1) (286 мг, + + 1 49 %): m/z 593 (М+Н) (ES ). Н-ЯМР (400 МГц, ДМСО-d6) 5: 1,27 (9Н, с), 2,39 (3Н, с), 3,32 (3Н, с), 4,08 (2Н, с), 5,39 (2Н, с), 6,36 (1Н, с), 7,03 (1Н, д), 7,28 (Ш, дд), 7,36 (2Н, м), 7,44 (2Н, м), 7,567,64 (3Н, м), 7,93 (1Н, м), 8,30-8,35 (3Н, м), 8,58 (1H, с), 8,79 (1Н, с) і 10,02 (1Н, с). Біологічне тестування Тестування in vitro 8 UA 105014 C2 Фермент IC50 (нМ) підтип підтип 1 альфа гамма 5,3 402 Диференційовані клітини U937; вивільнення TNFa, викликане LPS ІС50 (нМ) Аналіз МТТ 4,24 год. (10 мкл/мл) 2 негативний 0,88 1 5 10 15 20 25 30 35 40 45 50 Клітини ТНР1; вивільнення TNFa, викликане LPS ІС50 (нМ) 2,3 Аналіз на основі р38 МАРК альфа клітин шляхом виявлення фосфорилування МАРКАР-К2 (активованої МАР-кіназою протеїнкінази 2). Відсутність значущого токсичного ефекту, спостережуваного за допомогою аналізу МТТ. Вказані аналізи описані нижче: Аналіз інгібування ферментів Активність інгібування ферментів сполукою визначали передачею енергії флуоресцентного резонансу (FRET) з використанням синтетичних пептидів, мічених і донорських, і акцепторних флуорофорів (Z-LYTE, Invitrogen). Коротко, рекомбінантну, фосфориловану р38 МАРК гамма (МАРК12: Millipore) розбавляли в буфері HEPES, змішували із сполукою в бажаних кінцевих концентраціях і інкубували протягом 2 год. при кімнатній температурі. Потім до суміші ферменту/сполуки додавали пептид FRET (2 мкМ) і АТФ (10 мкМ) і інкубували протягом однієї години. Реагент проявлення (протеазу) додавали протягом однієї години перед виявленням в ридері флуоресценції мікропланшет. Сайт-специфічна протеаза розщеплює тільки нефосфорилований пептид і усуває сигнал FRET. Рівні фосфорилування кожної реакції розраховували з використанням співвідношення між емісією кумарину (донора) і емісією флуоресцеїну (акцептора), високі співвідношення вказують на високе фосфорилування, а низькі співвідношення - на низькі рівні фосфорилування. Процентну частку інгібування кожної реакції розраховували відносно неінгібованого контролю і потім розраховували інгібуючу на 50 % концентрацію (величина ІС50) по кривій залежності реакції від концентрації. Для р38 МАРК альфа (МАРК 14: Invitrogen) ферментну активність оцінювали непрямо шляхом визначення активації/фосфорилування молекули, що знаходиться нижче по ходу транскрипції, МАРКАР-К2. Білок р38 МАРК альфа змішували з його неактивною мішенню МАРКАР-К2 (Invitrogen) і сполукою протягом двох годин при кімнатній температурі. Пептид FRET (2 мкМ). який являє собою мішень фосфорилування для МАРКАР-К2, і потім АТФ (10 мкМ) додавали до суміші ферментів/сполуки і інкубували протягом однієї години. Потім додавали реагент проявлення і суміш інкубували протягом однієї години перед тим, як виявлення за допомогою флуоресценції завершувало протокол аналізу. Викликане LPS вивільнення TNFa: активність Клітини U937, лінія моноцитарних клітин людини, диференціювали в клітини типу макрофагів інкубацією з форбол-міристат-ацетатом (РМА; 100 нг/мл) протягом 48-72 годин. При доцільності клітини попередньо інкубували із сполукою в кінцевій концентрації протягом 2 годин. Потім клітини стимулювали 0,1 мкг/мл LPS (з Е.соlі: 0111:В4, Sigma) протягом 4 год. і супернатант збирали для визначення концентрації TNFα, сендвіч ELISA (Duo-set, R&D systems). THP-1, лінію моноцитарних клітин людини, також використовували для цього аналізу. Клітини ТНР-1 стимулювали 1 мкг/мл LPS (з Е.соlі: 0111: В4. Sigma) протягом 4 год. і супернатант збирали для визначення концентрації TNFα. Процентне інгібування продукції TNFα розраховували при кожній концентрації тестованої сполуки порівнянням з контролем носія і величину концентрації, інгібуючої на 50 % (ІС50), визначали по одержаній кривій залежності реакції від концентрації. Аналіз МТТ Диференційовані клітини U937 попередньо інкубували із сполукою протягом 4 год. в 5 % FCS або 10 % FCS протягом 24 год. і 72 год. Супернатант заміняли 200 мл нового середовища і в кожну ямку додавали 10 мкл основного розчину МТТ (5 мг/мл). Після 1 год. інкубації середовища видаляли, в кожну ямку додавали 200 мкл DMSO (ДМСО) і планшети злегка струшували протягом 1 год. перед зчитуванням величин спектральної поглинальної здатності при 550 нм. Втрату життєздатності клітин в процентах розраховували для кожної ямки відносно обробки носієм (0,5 % DMSO). Отже, видиме збільшення життєздатності клітин при використанні лікарського засобу відносно носія представлене в таблиці у вигляді негативної процентної частки. Тестування in vivo Викликана LPS нейтрофілія у мишей 9 UA 105014 C2 5 10 15 20 25 30 35 40 45 50 55 60 Мишам, що не голодували, інтратрахеально вводили або носій, або тестовану речовину в точки часу ("попередня доза"), вказані відносно початку обробки LPS. При Т=0 мишей поміщали в клітку для впливу і піддавали контакту з LPS. Через 8 год. після антигенної стимуляції LPS тварин анестезували, канюлювали трахею і проводили екстракцію BALF вливанням і відсмоктуванням 1 мл PBS в легені через трахеальний катетер. Загальну кількість лейкоцитів і лейкоцитарну формулу в зразках BALF вимірювали з використанням гемоцитометра Neubaur. Цитоспінові мазки зразків BALF одержували центрифугуванням при 200 об./хв. протягом 5 хв. при кімнатній температурі і забарвлювали з використанням системи забарвлювання DiffQuik (Dade Behring). Клітини підраховували з використанням імерсійної мікроскопії із зануренням лінзи в масло. Результати показані на фіг. 1 і 2. Дані про кількості нейтрофілів представлені у вигляді загальних і диференціальних кількостей (тестована речовина відносно носія) клітин на мл BALF, середня величина ± S.E.M. (n=8). Модель впливу сигаретного диму Мишей A/J (самці, вік 5 тижнів) піддавали впливу сигаретного диму (4 % сигаретного диму, розведеного стисненим повітрям) протягом 30 хв. на день протягом 11 днів з використанням Системи експерименту інгаляції тютюнового диму для дрібних тварин (Модель SIS-CS; Sibata Scientific Technology, Tokyo, Japan). Тестовані речовини вводили інтраназально (35 мкл розчину в 50 % DMSO/PBS) і в лікувальних цілях двічі на день протягом 3 днів після останнього впливу сигаретного диму. Через 12 годин після останнього введення тварин анестезували, трахею канюлювали і збирали рідину бронхоальвеолярного лаважу (BALF). Кількості альвеолярних макрофагів і нейтрофілів визначали аналізом FACS (сортувальником клітин, що активується флуоресценцією) (EPICS® ALTRA II, Beckman Coulter, Inc., Fullerton, CA, USA) з використанням антимишачого антитіла М0МА2 (до макрофагів) або антимишачого антитіла 7/4 (до нейтрофілів). Результати показані на фіг. З для активованих макрофагів і на фіг. 4 для нейтрофілів. Дані по кількості клітин показані у вигляді середньої величини ± SEM. Модель впливу сигаретного диму, використана в даному дослідженні, представлена у вигляді системи, рефракторної до кортикостероїдів (Medicherla S. et al. (2008); J. Pharmacol. Exp. Ther. 324(3): 921-9), і було підтверджено, що флутиказону пропіонат не інгібував накопичення ні нейтрофілів, ні макрофагів в дихальних шляхах в концентрації 50 мкг/мл (35 мкл, 2 рази на день), в такій же дозі, яка викликала інгібування >80 % викликаного LPS накопичення нейтрофілів. На фіг. 3: ###Значуща відмінність між впливом повітря і впливом сигаретного диму. ***Р
ДивитисяДодаткова інформація
Назва патенту англійськоюP38 map kinase inhibitors
Автори російськоюIto, Kazuhiro, Strong, Peter, Rapeport, William, Garth, King-Underwood, John, Williams, Jonathan, Gareth, Onions, Stuart, Thomas, Murray, Peter, John, Charron, Catherine, Elizabeth
МПК / Мітки
МПК: A61P 11/00, C07D 401/12, A61K 31/415, A61P 29/00
Мітки: map-кінази, інгібітор
Код посилання
<a href="https://ua.patents.su/16-105014-ingibitor-p38-map-kinazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітор p38 map-кінази</a>
Попередній патент: Спосіб оцінки корозійного розтріскування сплавів
Наступний патент: Сорбуючі композиції й способи видалення ртуті з потоків відхідних топкових газів
Випадковий патент: Пристрій для подрібнення твердих органічних добрив і формування бурту