Інгібітор кінази
Номер патенту: 94622
Опубліковано: 25.05.2011
Автори: Ю Кін Т., Зілберстейн Ешер, Ейнотт Пол, Гіллеспі Тімоті А., Аллен Елізабет М.
Формула / Реферат
1. Сполука формули (І):
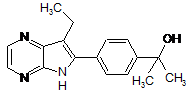 (І)
(І)
або відповідний N-оксид, або проліки, або фармацевтично прийнятна сіль, або сольват такої сполуки і N-оксид і проліки солі і сольвату.
2. Фармацевтична композиція, що містить сполуку за п. 1 разом із щонайменше одним фармацевтично прийнятним носієм або наповнювачем.
3. Спосіб лікування запалення суглобів у пацієнта, який включає введення пацієнту, що потребує цього, ефективної кількості сполуки за п. 1.
4. Спосіб лікування ревматоїдного артриту у пацієнта, який включає введення пацієнту, що потребує цього, ефективної кількості сполуки за п. 1.
5. Спосіб лікування запалення суглобів у пацієнта, який включає введення пацієнту, що потребує цього, ефективної кількості сполуки за п. 1 у сполученні з метотрексатом.
6. Спосіб лікування ревматоїдного артриту у пацієнта, який включає введення пацієнту, що потребує цього, ефективної кількості сполуки за п. 1 у сполученні з метотрексатом.
7. Спосіб лікування пухлини у пацієнта, який включає введення пацієнту, що потребує цього, ефективної кількості сполуки за п. 1.
8. Спосіб лікування лімфоми з клітин мантійної зони у пацієнта, який включає введення пацієнту, що потребує цього, ефективної кількості сполуки за п. 1.
9. Спосіб інгібування ангіогенезу у пацієнта, який включає введення пацієнту, що потребує цього, ефективної кількості сполуки за п. 1.
10. Сполука за п. 1, де сіль вибирають із гідрохлориду, гідроброміду, сульфату, фосфату, нітрату, сульфамату, ацетату, цитрату, лактату, тартрату, малонату, оксалату, саліцилату, пропіонату, сукцинату, фумарату, малеату, метилен-біс-b-гідроксинафтоату, гентизату, ізетіонату, ди-n-толуолтартрату, метансульфонату, етансульфонату, бензолсульфонату, n-толуолсульфонату, циклогексилсульфамату і хінату.
11. Сполука за п. 1, де сіль являє собою гідрохлорид.
12. Сполука за п. 1, де сіль являє собою ацетат.
13. Сполука за п. 1, де сіль являє собою цитрат.
Текст
1. Сполука формули (І): H3C C2 2 (11) 1 Даний винахід стосується заміщених азаіндолів, їхнього одержання, фармацевтичних композицій, що містять ці сполуки, а також їхнього використання в лікуванні патологічних станів, які можна контролювати інгібуванням протеїнкіназ. Протеїнкінази беруть участь у сигнальних процесах, які керують активацією, ростом і диференціацією клітин у відповідь на сигнали, що переда ються позаклітинними медіаторами, а також на зміни в навколишньому середовищі. У цілому такі кінази можуть бути віднесені до декількох груп: ті, які вибірково фосфорилують серинові і/або треонінові залишки, і ті, які вибірково фосфорилують тирозинові залишки [S.K.Hanks and T.Hunter, FASEB. J., 1995, 9, стор. 576-596]. Серин/треонінкінази включають, наприклад, ізофор 3 ми протеїнкінази С [A.C.Newton, J. Biol. Chem., 1995, 270, стор. 28495-28498] і групу циклінзалежної кінази, такої як cdc2 [J.Pines, Trends in Biochemical Sciences, 1995, 18, стор. 195-197]. Тирозинкінази включають мембранні рецептори фактору росту, такі як рецептор епідермального фактора росту [S.Iwashita and M.Kobayashi, Cellular Signalling, 1992, 4, стор. 123-132], і цитозольні кінази, що не містять рецептор, такі як кінази p56tck, p59fYn, ZAP-70 і csk [C.Chan et. al., Ann. Rev. Immunol., 1994, 12, стор. 555-592]. Незвичайно висока активність протеїнкіназ відмічалася в клінічних картинах багатьох захворювань, викликаних порушеннями клітинних функцій. Прямо або непрямо це могло бути викликане, наприклад, порушенням відповідного механізму контролю кінази, пов'язаним, наприклад, із мутацією, надпродукцією або порушенням активації ферменту, або надмірним або недостатнім виробленням цитокінів або факторів росту, що також беруть участь у трансдукції сигналів до або після синтезу кінази. У всіх цих випадках можна чекати позитивного ефекту селективного інгібування дії кінази. Syk являє собою цитоплазматичну протеїнтирозинкіназу з молекулярною масою 72 кДа, експресія якої здійснюється в різних гематопоетичних клітинах, і є важливим елементом декількох каскадів, що зв'язують рецептори антигенів із клітинною відповіддю. Тому Syk грає найважливішу роль у передачі сигналу високоафінного рецептора IgE, FcsRl в опасистих клітинах і в передачі сигналу рецептор-антиген у Т- і В-лімфоцитах. Канали передачі сигналу в опасистих, Т- і В-клітинах мають загальні характеристики. Ліганд-зв'язувальний домен рецептора не виявляє активності, властивої тирозинкіназі. Проте, вони взаємодіють із тими субодиницями, що передають сигнал, які містять мотиви активації імунорецептора на основі тирозину (ІТАМ) [M.Reth, Nature, 1989, 338, стор. 383384]. Такі мотиви присутні у β- і -субодиницях FcsRl, у -субодиниці рецептора Т-клітин (TCR) і у β-субодиницях IgGa і IgG рецептора В-клітин (BCR). [N.S.van Oers and A.Weiss, Seminars in Immunology, 1995, 7, стор. 227-236] Після зв'язування антигену і мультимеризації залишки ІТАМ фосфорилуються протеїнтирозинкіназами сімейства Src. Syk стосується унікального класу тирозинкіназ, що мають два тандемні домени Src гомології 2 (SH2) і С-термінального каталітичного домену. Ці домени SH2 з високою афінністю зв'язуються з ІТАМ, і така опосередкована SH2 асоціація Syk з активованим рецептором стимулює активність Syk кінази і локалізує Syk у плазматичній мембрані. У Syk-дефіцитних мишей інгібується дегрануляція опасистих клітин, вказуючи на неї як на значущий об'єкт для розробки стабілізаторів опасистих клітин [P.S.Costello, Oncogene, 1996, 13, стор. 2595-2605]. Аналогічні дослідження продемонстрували важливу роль Syk у передачі сигналу в BCR і TCR [A.M.Cheng, Nature, 1995, 378, стор. 303-306, (1995) and D.H.Chu et. al., Immune-logical Reviews, 1998, 165, стор. 167-180]. Мабуть, Syk також задіяний у забезпеченні виживаності еозинофілів у відповідь на IL-5 і GM-CSF [S.Yousefi et. al., J. Exp. Med., 1996, 183, стор. 1407-1414]. Не 94622 4 зважаючи на ключову роль Syk у передачі сигналу в опасистих клітинах, BCR і Т-клітинах, у літературі є мало відомостей про механізм, за допомогою якого Syk передає сигнал подальшим ефекторам. Було показано, що два адапторних білки, BLNK (лінкерний білок В-клітин, SLP-65) і SLP-76, є субстратами Syk у В-клітинах і опасистих клітинах, відповідно, і постулювалася їхня проміжна роль у ланцюжку між Syk і подальшими ефекторами [M.Ishiai et. al., Immunity, 1999, 10, стор. 117-125 and L.R.Hendricks-Taylor et. al, J. Biol. Chem, 1997, 272, стор. 1363-1367]. Крім того, очевидно, що Syk відіграє важливу роль у каналі передачі сигналу CD40, який має істотне значення для проліферації В-клітин [M.Faris et. al., J.Exp. Med., 1994, 179, стор. 1923-1931]. Syk також бере участь в активації тромбоцитів, стимульованій низькоафінним рецептором IgG (Fc гамма-RIIA) або колагеном [F.Yanaga et. al., Biochem. J., 1995, 311, (Pt. 2) стор. 471-478]. Кіназа фокальної адгезії (FAK) стосується нерецепторних тирозинкіназ, задіяних у каналі передачі сигналу, опосередкованому інтегрином. FAK зв'язується з інтегринами в сайтах фокальних контактів, і було показано, що активація FAK і фосфорилування ним тирозину в багатьох типах клітин залежить від інтегринів, зв'язаних з їхніми позаклітинними лігандами. Результати ряду досліджень свідчать на користь гіпотези про те, що інгібітори FAK можуть використовуватися для лікування раку. Наприклад, FAK-дефіцитні клітини слабко мігрують у відповідь на хемотактичні сигнали, і надекспресія С-термінального домену FAK блокує поширення клітин, а також хемотактичну міграцію (Sieg et. al., J. Cell Science, 1999, 112, 2677-2691; Richardson A. and Parsons Т., Cell, 1997, 97, 221231); крім того, клітини пухлини, оброблені антисенсовими олігонуклеотидами FAK, втрачають здатність до зв'язування і зазнають апоптозу (Xu et. al., Cell Growth Differ. 1996, 4, 413-418). Повідомлялося про надекспресію FAK у разі раку простати, молочної залози, щитовидної залози, товстої кишки і легень. Рівень експресії FAK напряму корелює з пухлинами, що виявляють найбільш агресивний фенотип. Ангіогенез, або формування нових кровоносних судин за рахунок розростання уже існуючої судинної сітки, має центральне значення для розвитку ембріона та органогенезу. Аномальна посилена неоваскуляризація спостерігається при ревматоїдному артриті, діабетичній ретинопатії і в процесі розвитку пухлин (Folkman, Nat. Med., 1995, 1, 27-31.). Ангіогенез являє собою складний багатоступінчастий процес, який включає активацію, міграцію, проліферацію і виживання ендотеліальних клітин. Детальні дослідження в галузі ангіогенезу пухлин в останні два десятиріччя дозволили виявити ряд терапевтичних мішеней, у тому числі кінази, протеази та інтегрини, які призвели до відкриття багатьох нових антиангіогенних агентів, у тому числі інгібіторів KDR; деякі з них у цей час проходять клінічні випробування (Jekunen, et. al. Cancer Treatment Rev. 1997, 23, 263-286.). Інгібітори ангіогенезу можуть використовуватися як основні, допоміжні або навіть профілактичні препарати 5 проти формування або повторного росту злоякісних утворень. У дріжджах та у дрозофіл було виявлено декілька білків, задіяних у розділенні хромосом і формуванні веретена. Порушення у функціях цих білків призводять до невірного розділення хромосом і утворення монополярних або зруйнованих веретен. Таких кіназ стосуються Ір11 і авроракінази з S.cerevisiae і дрозофіли відповідно, які необхідні для розділення центросом і сегрегації хромосом. У декількох лабораторіях недавно був клонований і охарактеризований один людський гомолог дріжджової Ірії. Ця кіназа, що одержала назву Aurora2, STK15 або ВТАК, стосується сімейства серин/треонінкіназ. У роботі Бішофа (Bischoff) зі співробітниками було показано, що Aurora2 є онкогенною і ампліфікується при колоректальному ракові людини (ЕМВО J, 1998, 17, 3052-3065). Вона також була охарактеризована у випадку раку з формуванням епітеліальних пухлин, наприклад раку молочної залози. У цей час нами виявлений новий заміщений азаіндол, що має цінні фармацевтичні властивості, зокрема, здатність інгібувати протеїнкінази, а точніше, здатність селективно інгібувати Syk кіназу. Дана азаіндольна похідна подібно сполукам, що розкривають у патенті США 6770643, однак у зазначеному патенті відсутня конкретна інформація про нього. Даний винахід стосується сполуки формули І: її фармацевтично прийнятної солі або проліків або сольвату такої сполуки, її солі або її проліків. Винахід також стосується фармацевтичної композиції, що містить сполуку формули І, і способу застосування сполуки формули І для лікування або профілактики фізіологічного стану, пов'язаного з присутністю Syk у пацієнта. Винахід також стосується способу одержання сполуки, що є проміжною сполукою і корисної при одержанні сполуки формули І. Ще в одному аспекті даний винахід стосується фармацевтичних композицій, що містять сполуки загальної формули (І): відповідний N-оксид і проліки; і фармацевтично прийнятна сіль і сольват (наприклад, гідрат) такої сполуки; і N-оксид і проліки; разом з одним 94622 6 або декількома фармацевтично прийнятними носіями або наповнювачами. Фіг. 1. Схема реакції одержання сполуки формули І. Фіг. 2. Середній діаметр скакального суглоба щурів після ін'єкції колагену типу II з бичачого носового хряща в неповному ад'юванті Фройнда і введення А003397769, сполуки формули І (3,0; 10 або 30 мг/кг 2 р/д) з дня 6 по день 21. Середній діаметр скакального суглоба самок щурів LEW, сенсибілізованих підшкірною ін'єкцією колагену в неповному ад'юванті Фройнда (400 мкг/400 мкл/щур) у дні 0 і 7. Тварини одержували дозу в період з 6 по 21 день. Фіг. 3. Аналіз кісткової ерозії (співвідношення площі кістки до її об'єму) у п'ятковій кістці щурів СІА, що одержували А003397769 (3,0; 10 або 30 мг/кг). Фіг. 4. Середній діаметр скакального суглоба щурів після ін'єкції колагену типу II із бичачого носового хряща в неповному ад'юванті Фройнда і введення тільки А003397769 (3,0 мг/кг) або в поєднанні з метотрексатом (0,1 або 0,2 мг/кг) із дня 6 по день 20 або 21 і в порівнянні з тваринами, що одержували носій. Вплив інгібітора SYK, A003397769, (3,0 мг/кг 2 р/д) на щурів СІА в умовах монотерапії або в поєднанні з метотрексатом. Фіг. 5. Середній діаметр скакального суглоба щурів після ін'єкції колагену типу II з бичачого носового хряща в неповному ад'юванті Фройнда і введення тільки А003397769 (10 мг/кг) або в поєднанні з метотрексатом (0,1 або 0,2 мг/кг) із дня 6 по день 20 або 21 і в зіставленні з тваринами, що одержували носій. Вплив інгібітора SYK, A003397769, (10 мг/кг 2 р/д) на щурів СІА в умовах монотерапії або в поєднанні з метотрексатом. Фіг. 6. Аналіз кісткової ерозії (співвідношення площі кістки до її об'єму) у п'ятковій кістці щурів СІА, що одержували тільки А003397769 (3,0 або 10 мг/кг) або в поєднанні з метотрексатом (0,1 або 0,2 мг/кг). Фіг. 7. Середній діаметр скакального суглоба щурів після ін'єкції колагену типу II з бичачого носового хряща в неповному ад'юванті Фройнда і введення А003397769А, (10 або 30 мг/кг 2 р/д) із дня 12 по день 21. Середній діаметр скакального суглоба самок щурів Lewis, сенсибілізованих підшкірною ін'єкцією колагену в неповному ад'юванті Фройнда (400 мкг/400 мкл/щур) у дні 0 і 7. Середнє для обох лап. Фіг. 8. Аналіз кісткової ерозії (співвідношення площі кістки до її об'єму) у п'ятковій кістці щурів СІА, що одержували А003397769А (10 або 30 мг/кг 2 р/д). Фіг. 9. Вплив сполуки формули І на масу щурів. Фіг. 10. Вплив сполуки формули І на концентрацію гемоглобіну. Таким чином, в одному аспекті даний винахід стосується фармацевтичних композицій, що містять сполуки загальної формули (І): 7 також відомих як: 2-[4-(7-етил-5Н-піроло[2,3b]піразин-6-іл)-феніл]-пропан-2-ол. У даному описі мається на увазі, що термін "сполуки даного винаходу" та аналогічні вирази включають описану вище в цьому документі сполуку загальної формули (І), котрий вираз включає проліки, фармацевтично прийнятні солі і сольвати, наприклад гідрати, де це допускається контекстом. Точно так само посилання на проміжні сполуки, незалежно від того, чи є вони самі предметом даного винаходу, розповсюджується і на їхні солі і сольвати, де це допускається контекстом. Для внесення ясності конкретні випадки, якщо це допускається контекстом, іноді відмічені в тексті, однак ці випадки мають виключно ілюстративний характер і не виключають інші випадки, якщо це допускається контекстом. Скорочення, що використовуються: АТР - аденозин трифосфат DTT - дитіотреїтол PBS - фізіологічний розчин у фосфатному буфері Наступні терміни, що використовують для опису винаходу вище та у всьому тексті, якщо не зазначено інакше, мають такі значення: "Пацієнт" означає людину та інших ссавців. "Проліки" означає сполуку, яка in vivo перетворюється метаболічними шляхами (наприклад, гідролізом) у сполуку з формулою (І), включаючи її Nоксиди. Наприклад, ефір сполуки формули (І), що містить гідроксильну групу, може бути перетворений гідролізом in vivo у початкову молекулу. В альтернативному варіанті ефір сполуки формули (І), що містить карбоксильну групу, може бути перетворений гідролізом in vivo в початкову молекулу. Відповідним ефірами сполук формули (І), що містять гідроксильну групу, є, наприклад, ацетати, цитрати, лактати, тартрати, малонати, оксалати, саліцилати, пропіонати, сукцинати, фумарати, малеати, метилен-біс--гідроксинафтоати, гентизати, ізетіонати, ди-п-толуоїлтартрати, метансульфонати, етансульфонати, бензолсульфонати, птолуолсульфонати, циклогексилсульфамати і хінати. Особливо корисний клас ефіру сполук формули (І), що містить гідроксильну групу, може бути одержаний із кислотних сполук, вибраних з описаних у роботі Bundgaard et. al., J. Med. Chem., 1989, 32, стор. 2503-2507, і включає заміщені (амінометил)-бензоати, наприклад діалкіламінометилбензоати, в яких дві алкільні групи можуть бути об'єднані разом і (або) розділені атомом кисню або можливо заміщеним атомом азоту, наприклад алкілованим атомом азоту, точніше (морфолінометил)бензоати, наприклад 3або 4(морфолінометил)бензоати, і (4-алкілпіперазин-1 94622 8 іл)бензоати, наприклад 3- або 4-(4-алкілпіперазин1-іл)бензоати. Деякі сполуки даного винаходу є основними, і такі сполуки корисні у формі вільної основи або у формі фармацевтично прийнятної солі, одержаної при додаванні такої сполуки. Солі, що утворюються при приєднанні кислот, зручніші при використанні; і на практиці використання солі, по суті, полягає у використанні форми вільної основи. Кислоти, які можуть бути використані для приготування солей, включають, переважно, ті, які в результаті їхньої реакції з вільною основою утворюють фармацевтично прийнятні солі, тобто солі, аніони яких не токсичні для пацієнта у фармацевтичних дозах солей, і позитивний інгібуючий ефект, властивий вільній основі, не порушується побічними ефектами, що приписуються аніонам. Незважаючи на те що фармацевтично прийнятні солі зазначених основних сполук є переважними, всі солі, утворені при додаванні кислот, корисні як джерела форм вільної основи, навіть якщо конкретна сіль, як така, необхідна тільки як проміжний продукт, як, наприклад, у випадку, коли сіль утворюється тільки з метою очищення та ідентифікації, або коли вона використовується як проміжна сполука в приготуванні фармацевтично прийнятної солі шляхом іонообмінних процесів. Фармацевтично прийнятні солі, що охоплюються даним винаходом, включають солі, одержані з мінеральних кислот і органічних кислот, і включають гідрогаліди, наприклад гідрохлориди і гідроброміди, сульфати, фосфати, нітрат, сульфамати, ацетати, цитрати, лактати, тартрати, малонати, оксалати, саліцилати, пропіонати, сукцинати, фумарати, малеати, метилен-біс-гідроксинафтоати, гентизати, ізетіонати, ди-птолуотартрати, метансульфонати, етансульфонати, бензолсульфонати, п-толуолсульфонати, циклогексилсульфамати і хінати. Крім застосування у ролі активних сполук, солі сполук за винаходом можуть бути використані з метою очищення сполук, наприклад на основі різниці розчинностей між солями і вихідними сполуками, побічними продуктами і (або) вихідними матеріалами, способами, добре відомими фахівцям у даній галузі. Сполуки даного винаходу мають корисну фармакологічну дію і, відповідно, вводяться у фармацевтичні композиції і використовуються при лікуванні пацієнтів, що страждають на певні медичні розлади. Таким чином, даний винахід забезпечує, відповідно до подальшого аспекту, сполуки винаходу і склади, що містять сполуки винаходу, для використання в терапії. Сполуки, що охоплюються даним винаходом, інгібують або блокують каталітичну активність кіназ, відповідно до тестів, описаних у літературі, і процедур in vitro, описаних нижче, результати яких повинні корелювати з фармакологічною дією в організмі людини та інших ссавців. Таким чином, у ще одному здійсненні даного винаходу представлені сполуки, що складають предмет даного винаходу і склади, що їх містять, які можуть використовуватися в лікуванні пацієнтів, що страждають на захворювання або схильних до захворювань, які 9 можна полегшити введенням інгібіторів протеїнкінази (наприклад, Syk, FAK, KDR або Aurora2). Наприклад, сполуки даного винаходу корисні при лікуванні запальних захворювань, таких як астма; запальних дерматозів (наприклад псоріазу, герпетиформного дерматиту, екземи, некротичного і шкірного васкуліту, бульозного порушення); алергічного риніту та алергічного кон'юнктивіту; запалення суглобів, включаючи артрит, ревматоїдний артрит та інші артритичні стани, такі як ревматоїдний спондиліт, подагричний артрит, травматичний артрит, краснушний артрит, псоріатичний артрит і остеоартрит. Зазначені сполуки також корисні при лікуванні хронічного обструктивного захворювання легень (ХОЗЛ), гострого синвоїту, автоімунного діабету, автоімунного енцефаломієліту, коліту, атеросклерозу, хвороби периферичних судин, серцево-судинного захворювання, розсіяного склерозу, рестенозу, міокардиту, В-клітинних лімфом, системного червоного вовчака, реакції відторгнення трансплантата та інших випадків відторгнення трансплантата, різних форм раку і пухлин (таких як колоректальний рак, рак передміхурової залози, рак молочної залози, рак щитовидної залози, рак прямої кишки і рак легень) і запальної хвороби кишечника. Зазначені сполуки також корисні як антиангіогенні препарати для лікування пухлин. Крім того, сполуки даного винаходу корисні як препарати для контролювання пухлинних клітин. Спеціальним здійсненням терапевтичних методів, що складають предмет даного винаходу, є лікування запалення суглобів. Додатковим спеціальним здійсненням терапевтичних методів, що складають предмет даного винаходу, є лікування ревматоїдного артриту. Спеціальним здійсненням терапевтичних методів, що складають предмет даного винаходу, є лікування форм раку, пухлин та інших проліферативних розладів. Ще одним конкретним застосуванням терапевтичних методів, що складають предмет даного винаходу, є лікування раку, що супроводжується утворенням рідких пухлин. Додатковим спеціальним здійсненням терапевтичних методів, що складають предмет даного винаходу, є лікування лімфоми з клітин мантійної зони. Додатковим спеціальним здійсненням терапевтичних методів, що складають предмет даного винаходу, є лікування розладів шляхом інгібування ангіогенезу. Відповідно до ще одного пункту даного винаходу пропонується спосіб лікування пацієнта (людини або тварини), страждаючого на захворювання або схильного до захворювань, які можуть бути полегшені введенням інгібітора протеїнкінази (наприклад, Syk, FAK, KDR або Aurora2), наприклад станів, описаних вище, що включає введення пацієнту ефективної кількості сполуки, що складає предмет даного винаходу, або препарату, що містить сполуку даного винаходу. Під "ефективною кількістю" мається на увазі кількість сполуки, що складає предмет даного винаходу, яка є ефективною у ролі інгібітора каталітичної активності протеїнкінази, наприклад Syk, FAK, KDR або Aurora2, і 94622 10 таким чином здатна дати бажаний терапевтичний ефект. Включені в даний опис посилання на лікування розповсюджуються як на профілактичну терапію, так і на лікування діагностованих патологічних станів. Даний винахід розповсюджується також на фармацевтичні композиції, що включають сполуки, які складають предмет даного винаходу, у сполученні з фармацевтично прийнятним носієм або наповнювачем. Сполука даного винаходу може вводитися будь-яким придатним способом. На практиці сполука даного винаходу може, у загальному випадку, вводитися парентерально, місцево, ректально, перорально або за допомогою інгаляції; особливо, перорально або за допомогою інгаляції. Відповідно до даного винаходу препарати можуть готуватися за загальноприйнятими методами з використанням однієї або декількох фармацевтично прийнятних допоміжних речовин або наповнювачів. Допоміжних речовин, серед іншого, стосуються розріджувачі, стерильні водні середовища і різні нетоксичні органічні розчинники. Склади можуть готуватися у вигляді таблеток, пілюль, гранул, порошків, водних розчинів або суспензій, ін'єкційних розчинів, еліксирів або сиропів, і можуть містити один або декілька агентів, що вибирають із групи, що містить підсолоджувальні речовини, віддушки, барвники і стабілізатори для одержання фармацевтично прийнятних препаратів. Вибір носія і вміст активної речовини в носії звичайно визначається відповідно до розчинності і хімічних властивостей активної сполуки, конкретного способу введення і положень, які повинні додержуватися у фармацевтичній практиці. Наприклад, для приготування таблеток можуть використовуватися наповнювачі, такі як лактоза, цитрат натрію, карбонат кальцію, дикальційфосфат і дезінтегрувальні агенти, такі як крохмаль, альгінова кислота і деякі складні силікати в поєднанні з ковзними речовинами, такими як стеарат магнію, лаурилсульфат натрію і тальк. Для приготування капсули зручно використовувати лактозу і поліетиленгліколі з високою молекулярною масою. При використанні водних суспензій вони можуть містити емульгатори або речовини, які сприяють утворенню суспензій. Можуть також використовуватися розріджувачі, наприклад сахароза, етанол, поліетиленгліколь, пропіленгліколь, гліцерин і хлороформ або їхні суміші. Для парентерального застосування використовуються емульсії, суспензії або розчини сполук винаходу в рослинних оліях, наприклад у кунжутній, арахісовій або оливковій, або водно-органічні розчини, такі як вода і пропіленгліколь, органічні ефіри, що вводять шляхом ін'єкції, як, наприклад, етил олеат, поряд зі стерильними водними розчинами фармакологічно прийнятних солей. Сольові розчини сполук, що використовують у даному винаході, особливо підходять для введення у вигляді внутрішньом'язових або підшкірних ін'єкцій. Водні розчини, що включають також розчини солей у чистій дистильованій воді, можуть використовуватися внутрішньовенно з умовою, що їхній рН дове 11 дений до відповідного рівня, що вони забуферені відповідним чином і зроблені ізотонічними додаванням достатньої кількості глюкози або хлориду натрію, і що вони стерилізовані шляхом теплової обробки, опромінення або мікрофільтрації. Для місцевого застосування можуть використовуватися гелі (на водній або спиртовій основі), креми або мазі, що містять сполуки винаходу. Сполуки винаходу можуть також входити в склад гелю або матричної основи для застосування в пластирі, які будуть забезпечувати вивільнення сполуки, що контролюється через трансдермальний бар'єр. При застосуванні у вигляді інгаляцій сполуки винаходу можуть бути розчинені або приведені в стан суспензії у придатному носії для використання в розпилювачі або аерозольному балончику, або можуть бути абсорбовані або адсорбовані на придатний твердий носій для використання в сухому порошковому інгаляторі. Тверді склади для ректального введення включають супозиторії, приготовані відповідно до відомих методів, і що містять щонайменше один компонент винаходу. Відсоток активного компонента в складах винаходу може відрізнятися, при цьому необхідно, щоб він містив таку частку, яка забезпечувала б відповідне дозування. Очевидно, що декілька стандартних лікарських форм, можуть вводитися приблизно одночасно. Доза, що застосовується, буде визначатися лікарем і залежить від бажаного терапевтичного ефекту, способу введення і тривалості лікування, а також стану пацієнта. Для дорослих дози звичайно складають від приблизно 0,001 до приблизно 50, переважно від приблизно 0,001 до приблизно 5 мг/кг маси тіла при введенні за допомогою інгаляцій, від приблизно 0,01 до приблизно 100, переважно від 0,1 до 70, точніше від 0,5 до 10 мг/кг маси тіла на день при пероральному застосуванні, і від приблизно 0,001 до приблизно 10, переважно від 0,01 до 1 мг/кг ваги тіла на день при внутрішньовенному введенні. У кожному конкретному випадку дози будуть визначатися відповідно до факторів, характерних для пацієнта, що проходить лікування, наприклад віку, маси, загального стану здоров'я та інших особливостей, які можуть впливати на ефективність фармацевтичної композиції. Відповідно до винаходу сполуки можуть вводитися так часто, як це є необхідним для досягнення бажаного терапевтичного ефекту. Деякі пацієнти можуть виявляти швидку реакцію у відповідь на вищу або більш низьку дозу, і для них можуть виявитися достатніми набагато слабкіші дози. Для інших пацієнтів можуть знадобитися довгострокові курси лікування з частотою від 1 до 4 доз на день, відповідно до фізіологічних потреб кожного конкретного пацієнта. Загалом діюча речовина може застосовуватися перорально від 1 до 4 разів на день. Зрозуміло, для деяких пацієнтів необхідно буде прописати не більше однієї або двох доз на день. Сполуки даного винаходу можуть бути одержані за допомогою застосування або адаптації відомих методів, під якими мають на увазі методи, 94622 12 що використовувалися раніше або описані в літературі, наприклад, викладені в роботі R.C. Larock, Comprehensive Organic Transformations, VCH publishers, 1989. В описаних нижче реакціях може виникати необхідність захистити реакційні функціональні групи, наприклад гідроксильні групи, аміногрупи, іміногрупи, тіогрупи або карбоксильні групи, у випадках коли ці групи необхідні в кінцевому продукті, щоб уникнути їх небажаної участі в реакціях. Можуть використовуватися традиційні захисні групи відповідно до прийнятої практики, приклади див. у T.W. Greene and P. G. M. Wuts в "Protective Groups in Organic Chemistry", John Wiley and Sons, 1991. Очевидно, що сполуки, які складають предмет даного винаходу, можуть містити асиметричні центри. Ці асиметричні центри можуть незалежно один від одного бути в R або в S конфігурації. Для фахівця у галузі очевидно, що певні сполуки, що складають предмет даного винаходу, можуть також виявляти геометричну ізомерію. Потрібно розуміти, що даний винахід розповсюджується на окремі геометричні ізомери і стереоізомери та їхні суміші, у тому числі рацемічні суміші наведених вище сполук із формулою (І). Такі ізомери можна виділити з їхніх сумішей за допомогою відомих методів або їхніх модифікацій, наприклад хроматографічних методів або методів перекристалізації, або одержати окремо з відповідних ізомерів проміжних сполук. Згідно з ще одним пунктом винаходу, утворені при додаванні кислоти солі сполук, що складають предмет даного винаходу, можна одержати внаслідок реакції вільної основи з відповідною кислотою за допомогою відомих способів або їхніх модифікацій. Наприклад, утворені при додаванні кислоти солі сполук, що складають предмет даного винаходу, можна одержати або розчиненням вільної основи у воді, водному розчині спирту або інших придатних розчинниках, що містять відповідну кислоту, і виділенням солі випарюванням розчину, або внаслідок реакції вільної основи і кислоти в органічному розчиннику, де сіль випадає в осад або випарюється з розчину. Сполуки, що складають предмет даного винаходу, можна регенерувати з їхніх солей, утворених при приєднанні кислоти, за допомогою відомих способів або їхніх модифікацій. Наприклад, вихідні сполуки, що складають предмет даного винаходу, можна регенерувати з їхніх солей, одержаних при приєднанні кислоти, лугами, наприклад водним розчином бікарбонату натрію або водним розчином амонію. Сполуки, що складають предмет даного винаходу, молена регенерувати з їхніх солей, одержаних при приєднанні основи, за допомогою відомих способів або їхніх модифікацій. Наприклад, вихідні сполуки, що складають предмет даного винаходу, можна регенерувати з їхніх солей, одержаних при приєднанні основи, обробкою кислотою, наприклад соляною кислотою. Сполуки, що складають предмет даного винаходу, можуть бути без великих зусиль одержані або утворені в процесі, що складає предмет дано 13 го винаходу, у ролі сольватів (наприклад гідратів). Гідрати сполук, що складають предмет даного винаходу, можуть бути без великих зусиль одержані шляхом перекристалізації з суміші водного/органічного розчинника за допомогою таких органічних розчинників, як діоксан, тетрагідрофуран або метанол. Згідно з ще однією відмітною ознакою винаходу, утворені при додаванні основи солі сполук, що складають предмет даного винаходу, можна одержати внаслідок реакції вільної кислоти з відповідною основою за допомогою відомих способів або їхніх модифікацій. Наприклад, утворені при додаванні основи солі сполук, що складають предмет даного винаходу, можна одержати або розчиненням вільної кислоти у воді, або водному розчині спирту або інших придатних розчинниках, що містить відповідну основу, і виділенням солі випарюванням розчину, або внаслідок реакції вільної кислоти та основи в органічному розчиннику, де сіль випадає в осад або випарюється з розчину. Вихідні матеріали і проміжні сполуки можна одержати шляхом застосування або модифікації відомих способів, наприклад способів, описаних у прикладі, або їхніх очевидних хімічних еквівалентів. Даний винахід далі ілюструється, серед іншого, наступним наочним прикладом. Спектри ядерного магнітного резонансу (ЯМР) 1 300 МГЦ H були записані на приладах Varian Mercury. У спектрах ядерного магнітного резонансу (ЯМР) величини хімічного зсуву (δ) зазначені в мільйонних частках (мч) стосовно тетраметилсилану. Скорочення мають наступні значення: "с" = синглет, "д" = дублет; "т" = триплет; "кв" = квартет; "м" = мультиплет, "дд" = дублет дублетів, "ддд" = дублет подвійних дублетів. Експерименти з рідинної хроматографії високого тиску і мас-спектрометрії (РХМС) для визначення часу утримування (RT) і відповідних мас іонів проводилися з використанням одного з наступних методів. Мас-спектри (МС) записуються на часопролітному мас-спектрометрі Micromass LCT. Метод включає іонізацію електророзпилюванням позитивних іонів і сканування маси м/z від 100 до 1000. Рідинна хроматографія здійснюється за допомогою бінарного насоса і дегазатора Agilent™ серії 1100; нерухома фаза: колонка Phenomenex Synergi™ 2μ Hydro-RP 20×4,0 мм, рухома фаза: А=0,1% мурашина кислота (FA) у воді, В=0,1% FA в ацетонітрилі. Об'єм введення 5 мкл за допомогою системи СТС Analytical PAL. Швидкість потоку становить 1 мл/хв. Градієнт складає від 5% В до 90% В за З хвилини і від 90% В до 100% В за 2 хвилини. Допоміжні детектори: УФ детектор Agilent серії 1100, довжина хвилі =220 нм і випарний детектор світлорозсіювання (ELS) Sedere SEDEX™ 75, температура детектора =46°С, тиск азоту= 4 бар. Час утримування тонкошарової хроматографії (ТШХ) RF визначався за допомогою планшетів із силікагелем компанії Merck™. Приклад 1 2-[4-(7-етил-5Н-піроло[2,3-b]піразин-6-іл)феніл]-пропан-2-ол 94622 14 Всього одержали 6,0 г 2-[4-(7-етил-5Нпіроло[2,3-b]піразин-6-іл)феніл]пропан-2-олу (сполука 1) у два етапи з n-пропілпіразину (сполука 2) і 4-ацетилбензонітрилу (сполука 3). Синтез сполуки 1 здійснювали таким чином: поєднання n-пропілпіразину (сполука 2) і 4ацетилбензонітрилу (сполука 3) із біс(триметилсиліл)-амідом натрію в тетрагідрофурані при 40°С дало проміжну сполуку 4 із виходом 30%. Реакція сполуки 4 із хлоридом метилмагнію в тетрагідрофурані при 0°С дала бажану сполуку 1 із виходом 74% після рекристалізації з 2-пропанолу. Синтез показаний на Фіг. 1. Експериментальна частина 2-[4-(7-етил-5Н-піроло[2,3-b]піразин-6іл)феніл]етанон (сполука 4). Розчин nпропілпіразину (сполуки 2, 912 мг, 7,46 ммоль) у тетрагідрофурані (5 мл) додавали піпеткою протягом семи хвилин до розчину біс(триметилсиліл)аміду натрію (2М розчину в THF; 13 мл, 26 ммоль, 3,5 еквів.) при 20°С. Одержали розчин темного пурпурно-червоного кольору, і температура опустилася до 16,4°С. Розчин 4ацетилбензонітрилу (сполука 3, 1,08 г, 7,4 ммоль) у тетрагідрофурані (5 мл) додавали протягом 18 хвилин при 13,3°С. Температура опустилася до 12,6°С, з одержанням розчину коричневого кольору. Суміш перемішували при кімнатній температурі протягом 1 години, нагрівали приблизно до 35°С протягом 6 годин, а потім залишили перемішуватися при кімнатній температурі протягом приблизно 60 годин. Суміш влили в насичений водний розчин бікарбонату натрію (200 мл) і екстрагували етилацетатом (2×150 мл). Етилацетат промивали водою (100 мл) і концентрували на приладі Buchi при температурі бані 40°С і при тиску від 80 до 10 торр для одержання твердої речовини темножовтого кольору. Тверду речовину стирали в порошок у діетиловому ефірі (25 мл), відфільтровували і промивали в ефірі (25 мл). Тверду речовину сушили на повітрі для одержання 600 мг (30,3%) сполуки 4 у вигляді твердої речовини жовтого кольору: 1 H ЯМР (300 мГц, CDCI3, Фіг. 1) δ 8,5 (1Н, д, J=2 Гц), 8,15 (2Н, д, J=8 Гц), 8,1 (1Н, д, J=3 Гц), 7,9 (2Н, д, J=8 Гц), 3,1 (2Н, кв., J=9 Гц), 2,7 (3Н, с), 1,4 (3Н, т, J=9 Гц). 1-[4-(7-етил-5Н-піроло[2,3-b]піразин-6іл)феніл]пропан-2-ол (сполуки 1). До охолодженого (~5°С) розчину хлориду метилмагнію (3М у THF; 81,3 мл, 244 ммоль, 10 еквів.) у тетрагідрофурані (116 мл) додавали розчин сполуки 4 (6,5 г, 24,4 ммоль) у тетрагідрофурані (348 мл) піпеткою протягом 90 хвилин, підтримуючи температуру близько 0°С по мірі додавання розчину. У процесі додавання спостерігалося утворення яскраво-жовтого розчину. Після закінчення однієї години ТШХ (етилацетат/n-гептан 1/1) не показувала присутності вихідного матеріалу, і нова точка переміщувалася при більш низькому Rf. Партію погасили шляхом обережного додавання насиченого водного розчину бікарбонату натрію (близько 660 мл). До одержаної густої маси додали етилацетат (250 мл) і воду (250 мл). Водну фазу видаляли і реекстрагували етилацетатом (2×250 мл). Фракції етилацета 15 94622 ту об'єднали, промили водою (2×200 мл) і сконцентрували на приладі Buchi при температурі бані 40°С і при тиску від 80 до 10 торр для одержання 7,5 г (109%) 1 у вигляді твердої речовини ясно1 бежевого кольору: Н ЯМР (DMSO-d6, Фіг. 2) δ 12,0 (1H, с), 8,35 (1Н, д, J=3,5 Гц), 8,2 (1H, д, J=3,5 Гц), 7,6 (4Н, с) 5,1 (1H, с), 2,9 (2Н, кв., J=8 Гц), 1,5 (6Н, с), 1,3 (3Н, т, J=8 Гц). Даний матеріал об'єднували з матеріалом із попереднього експерименту. Об'єднаний матеріал (8,5 г) нагрівали зі зворотним холодильником із 2пропанолом (150 мл) для одержання прозорого розчину ясно-коричневого кольору, який фільтрували в гарячому стані через нагріту лійку Бюхнера під вакуумом. У колбі для фільтрування утворився осад, і суміш нагрівали до температури кипіння для одержання прозорого розчину. Матеріал охолоджували до кімнатної температури при помішуванні для одержання твердої речовини ясножовтого кольору, яку фільтрували, промивали холодним 2-пропанолом і сушили у вакуумній печі при 50°С для одержання 6,0 г (71%) сполуки 1 у вигляді твердої речовини ясно-жовтого кольору: 1 ЖX/MC:RT=2,55 хв., МС: 282 (М+Н); Н ЯМР (DMSO-d6, Фіг. 3) δ 12,0 (1H, с), 8,35 (1Н, д, J=3 Гц), 8,2 (1H, д, J=3 Гц), 7,6 (4Н, с) 5,1 (1H, с), 2,9 (2Н, кв., J=9 Гц), 1,5 (6Н, с), 1,3 (3Н, т, 3=9 Гц). Елементний аналіз сполуки 1 показаний у ТАБЛИЦІ 1. Теоретичні відсоткові частки елементів: С 72,57%, Η 6,81%, Ν 14,93%, О 5,69% Експеримент 1: С 72,46%, Η 7,05%, Ν 15,07% Таблиця 1 Порядок проведення випробувань in vitro для Syk Об'єкт аналізу: Коротка назва: Формат аналізу: Формат детектування Модулювання Тирозин(У)кіназа селезінки Syk Фосфорилування субстрату FlashPlate зі стрептавідином Інгібування 16 Мікропланшети FlashPlate Plus із покриттям зі стрептавідину (PerkinElmer Life Sciences™) призначені для проведення радіометричного аналізу всередині планшета. Внутрішня поверхня кожної ямки покрита стійким тонким шаром сцинтилятору на основі полістиролу, на який нанесений ковалентно-зв'язаний шар стрептавідину. Ці планшети придатні для широкого кола аналітичних додатків, в яких використовуються біотиніловані молекулизахоплювачі. Poly (Glu, Туr) 4:1 (PGT) являє собою статистичний співполімер, який може виступати як субстрат для тирозин-специфічних протеїнкіназ. У ході аналізу оцінюється ступінь фосфорилування субстрату PGT-біотину за допомогою Syk. Фер33 33 мент переносить [ Р]-фосфат із [ Ρ]-ΑΤΦ на полімерний субстрат. Аналіз проводили в розчині у не зв'язувальному 384-ямковому планшеті. Після зупинки реакції за допомогою фосфорної кислоти реакційну суміш переносили на 384-ямковий стрептавідиновий планшет FlashPlate. Біотинілований субстрат фіксувався на планшеті, а інші реагенти, у тому числі гарячу АТФ, змивали водою. Потім проводили вимірювання радіоактивності в кожній ямці. Ферментативну реакцію проводили у не зв'язувальному 384-ямковому планшеті. Кінцева концентрація реагентів у кожній ямці складала: 7,77 33 нМ Syk, 15,5 нМ субстрат PGT-біотину, 0,1 мКі РАТФ, 50 мМ Tris, pH 7,5, 10 мМ MgCl2, 3 мМ МnСl2, 1 мМ DTT, 0,1 мг/мл -глобулінів. Реакційний об'єм становив 22 мкл. Час реакції: 120 хвилин. Температура: кімнатна температура. Реакцію зупиняли додаванням 20 мкл 9% фосфорної кислоти, і 30 мкл реакційної суміші переносили в 384-ямковий стрептавідиновий планшет FlashPlate. Через 90 хвилин інкубації при кімнатній температурі планшет відмивали 0,02% Tween-20 у 50 мМ Tris, pH 7,5. Підрахунок радіоактивності вели на сцинтиляційному лічильнику Тор Count™. Розведені розчини ферменту перед використанням готували і тримали на льоду. Свіжоприготовані розчини МnСІ2 і DTT додавали в аналітичний буфер безпосередньо перед використанням. Матеріали для аналізу наводяться в таблиці 2. Таблиця 2 Матеріали Постачальник 1 Μ Tris, pH 7,5 1 Μ MgCl2 1 MnCl2 DTT -Глобуліни ДМСО Стауроспорин Фосфорна кислота (85%) 33 1 мКи [ Ρ]-ΑΤΦ 10×PBS,pH7,4 Tween 20 384-ямковий поліпропіленовий планшет Fisher Sigma Sigma Sigma Sigma Sigma-Aldrich Sigma Sigma PerkinElmer Fisher Fisher Corning Номер за катаМол. маса логом BP1757-500 Μ-1028 95,2 Μ-1787 125,8 D-5545 154,2 G-5009 15 493-9 S-4400 466,5 Ρ-6560 98,0 NEG6xx ΒΡ399 1 ΒΡ337-500 1227,54 3657 Призначення Буфер Кофактор ферменту Кофактор ферменту Антиоксидант Стабілізатор білка Розчинник Стандартний інгібітор Стоп-розчин Субстрат Промивний буфер Детергент Планшет для сполуки 17 94622 18 Продовження таблиці 2 Не зв'язувальний 384-ямковий планшет Corning 384-ямковий стрептавідиновий план- PerkinElmer шет Flashplate Герметизуюча плівка Top Seal A Packard Мийний автомат Е1×405 Top Count Станція FX Beckman 2000 Реакційний планшет Планшет захоплення 3652 SMP-410(A) Запечатування планшета Миття планшета Лічильник Дозатор рідин Дозатор рідин 6005185 Bio-Tek Packard Beckman Beckman Фермент: Syk із FLAG-епітопом (0,184 мг/мл, MW=35531,81 а.о.м.) була одержана та очищена за допомогою відомих фахівцям методів. Субстрат: Біотин-кон'югований Poly (Glu, Туr) 4:1 придбаний у Cisbio international™ (№ за каталогом 61GT0BLB, партія № 16). Використані розчини для аналізу наводяться в таблиці 3. Таблиця 3\ Реагент Хімічні реактиви Аналітичний буфер свіжододані МnСl2 і Tris, pH 7,5 DTT МnСl2 MgCl2 DTT -глобуліни Розчин ферменту і субстрат Syk Зберігати в незв'язувальних планшетах Субстрат PGT-біотин 33 33P Розчин АТФ/ Р-АТФ АТФ/ -АТФ Стоп-розчин Фосфорна кислота Промивний буфер Tween -20 Розведення сполуки: 1. Сполуки надходили у вигляді 10 мМ/ямку розчину по 10 мкл/ямку в 100% ДМСО у 96ямковому поліпропіленовому планшеті з Uподібним дном із незаповненим рядом Н. Додавали по 90 мкл/ямку 100% ДМСО, щоб одержати 100 мкл 1 мМ розчину сполуки, запечатували і зберігали планшет при кімнатній температурі в темряві. 2. Готували кінцевий планшет: у 384-ямковий поліпропіленовий планшет із круглим дном (планшет для зберігання Corning) додавали 23 мкл/ямку Н2О до колонок 3 і 13, 20 мкл/ямку 30% ДМСО до колонок з 4 по 12 і колонок з 14 по 22 (залишаючи пустими ряди О і Р). 3. Готували розведення сполук (10 розведень, 300 мкМ, 100 мкМ, 30 мкМ і т.д.) на Biomek 2000™ із використанням програми аналізу кінази: за допомогою багатоканальної піпетки з носиками на 20 мкл при знятому 8 (ряд Н) переносили 10 мкл/ямку 1 мМ сполуки з колонки 1 у вихідному планшеті в колонку 3 в кінцевому планшеті для приготування першого розведення 300 мкМ. Після цього у кінцевому планшеті змішували і переносили 10 мкл/ямку розведення 300 мкМ із колонки 3 в колонку 4 для приготування розведення 100 мкМ. Перемішували і переносили 10 мкл/ямку розведення 100 мкМ із колонки 4 в колонку 5, щоб одержати розведення 30 мкМ і т.д. Готували дублікати розведень для кожної сполуки, наприклад переносили 10 мкл/ямку сполуки з А1 вихідного планшета в A3 Розчинник Н2О Аналітичний буфер Аналітичний буфер Н2О 1×PBS, pH7,4 Концентрація 50 мМ 3 мМ 10 мМ 1 мМ 0,1% 7,77 нМ 15,5 нМ 0,1 мкКі/ямку 9% 0,02% і В3 у кінцевий планшет. Змішування і перенесення повторювали. Потім переносили 10 мкл/ямку 1 мМ сполуки з колонки 2 у вихідному планшеті в колонку 13 у кінцевий планшет для приготування розведення 300 мкМ. Після цього в кінцевому планшеті змішували і переносили 10 мкл/ямку розведення 300 мкМ з колонки 13 у колонку 14 для приготування розведення 100 мкМ і т.д. З одного повного 96-ямкового вихідного планшета з пустим рядом Η можна приготувати до шести кінцевих планшетів. 4. Готували стандартний материнський планшет для сполуки: додавали 5 мкл/ямку 10 мМ розчину росковитину в 100% ДМСО у ряди Н1 і Н2 у 96-ямковий поліпропіленовий планшет з Uподібним дном, потім розводили до 1 мМ розчину 45 мкл/ямку 100% ДМСО. 5. Готували стандартний планшет для нанесення сполуки: у 384-ямковий поліпропіленовий планшет із круглим дном (планшет для зберігання Corning™) додавали 23 мкл/ямку Н2О до колонок Зі 13, 20 мкл/ямку 30% ДМСО до колонок з 4 по 12 і колонок із 14 по 22 (залишаючи порожніми ряди О і Р). 6. Готували стандартні розведення сполук (10 розведень, 300 мкМ, 100 мкМ, 30 мкМ і т.д.) на Biomek 2000™ із використанням стандартної програми аналізу: одноканальною 20 мкл піпеткою переносили 10 мкл/ямку 1 мМ стандартної сполуки з колонки НІ у материнському планшеті в колонку 19 01 у кінцевий планшет для приготування першого розведення 300 мкМ. Після цього в кінцевому планшеті змішували і переносили 10 мкл/ямку розведення 300 мкМ із колонки 03 у колонку 04 для приготування розведення 100 мкМ. Перемішували і переносили 10 мкл/ямку розведення 100 мкМ із колонки 04 у колонку 05, щоб одержати розведення 30 мкМ і т.д. Готували дублікати розведень для кожної стандартної сполуки, наприклад переносили 10 мкл/ямку сполуки з НІ материнського планшета в O3 і Р3 у кінцевий планшет. Змішування і перенесення повторювали. Потім переносили 10 мкл/ямку 1 мМ сполуки з колонки Н2 в материнському планшеті в колонку O13 у кінцевому планшеті для приготування розведення 300 мкМ. Після цього в кінцевому планшеті змішували і переносили 10 мкл/ямку розведення 300 мкМ із колонки 013 у колонку 014 для приготування розведення 100 мкМ і т.д. 7. У кінцевий планшет стандартної сполуки додавали 20 мкл/ямку 30% ДМСО (верхній контроль) з А до Η і 20 мкл/ямку 45% Н3РО4 (нижній контроль) з І до J у колонці 23. Порядок проведення аналізу: 1. У планшет для аналізу (незв'язувальний 384-ямковий планшет Corning™) додавали 10 мкл розчину ферменту і субстрату, 2 мкл сполуки, що тестуються, інкубували при кімнатній температурі протягом 30 хв (стадія попереднього інкубування ферменту/сполуки). 2. Реакцію починали додаванням 10 мкл роз33 чину АТФ/ Р-АТФ. 3. Інкубували при кімнатній температурі 120 хвилин. 4. Реакцію зупиняли додаванням 20 мкл стопбуфера. 5. Переносили 30 мкл реакційної суміші в 384ямковий стрептавідиновий планшет Flashplate. 8. Інкубували при кімнатній температурі 90 хвилин. 9. Двічі промивали стрептавідиновий планшет Flashplate 100 мкл/ямку промивним буфером за допомогою автоматичного дозатора Е1×405. 10. Запечатували і зчитували планшет (40 с/ямку) на сцинтиляційному лічильнику Top Count™. * Аналіз із пункту 1 по пункт 5 проводився з використанням станції Biomek™ FX. Рівняння для обробки кривої при визначенні ІС50: Y=нижня межа+(верхня межа - нижня межа)/(1+10^(LogІС50-Х*Нахил)) X - логарифм концентрації. Υ - відгук. Υ починає змінюватися з нижньої межі і досягає верхньої межі; крива має сигмоїдальну форму. Даний підхід ідентичний "чотирьохпараметричному логістичному" рівнянню. За результатами даного аналізу концентрація ІС50 у сполученні з формулою І становила 1,7 наномоль. Аналіз життєздатності гематологічних злоякісних клітинних ліній за допомогою реагенту MTS 94622 20 1. Мета Даний метод використовується для визначення життєздатності лінії клітин рідкої пухлини після лікування сполукою, що тестується. Клітини пухлини містять у суспензії в логарифмічній фазі росту. У день використання клітини ресуспендують до густини від 0,05 до 0,1 млн/мл та інкубують у 96ямковому планшеті із сполукою, що тестується, протягом 96 годин. Життєздатність клітин вимірювали інкубуванням клітин із реагентом MTS компанії Promega. Життєздатність клітин пропорційна зміні поглинання при довжині хвилі 490 нм. Вплив сполук, що тестують, на життєздатність клітин визначається за допомогою зіставлення поглинання контрольних і оброблених сполукою клітин як відсоток від життєздатності контрольних клітин. 2. Порядок проведення А. Матеріали 1. Клітини: Лінії клітин рідкої пухлини були одержані або з набору American Tissue Culture Collection або від DSMZ (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH). 2. Клітинне середовище: Повна RPMI: середовище RPMI-1640 з 25 мМ HEPES (4-(2-гідроксіетил)-1піперазинетансульфонова кислота) і L-глутамін (Gibco/Invitrogen™, № за кат. 22400 089)+10% термоінактивованої фетальної бичачої сироватки (FBS) (Gibco/Invitrogen™, № за кат. 16140 071)+1× пеніцилін/стрептоміцин (Gibco/Invitrogen, № за кат. 15070 063) + 50 мкг/мл плазмоцин (Invivogen™, № за кат. ant-mpt). cRPMI без фенолового червоного: середовище RPMI-1640 без фенолового червоного, Lглутамін (Gibco/Invitrogen™, № за кат. Gibco/Invitrogen, 11835 030)+10% термоінактивованої фетальної бичачої сироватки (FBS) (Gibco/Invitrogen, № за кат. 16140 071)+1× пеніцилін/стрептоміцин (Gibco/Invitrogen™, № за кат. 15070 063). 3. Інші рідкі реагенти: Реагент Promega™ MTS (клітинний водний титр 96 № за кат. G358B) Диметилсульфоксид (ДМСО) (Sigma™, № за кат. D2650) 4. Витратні матеріали: Стерильні 96-ямкові полістирольні прозорі оброблені планшети для культур тканин із кришкою (Falcon™, № за кат. 3072) 5. Обладнання: Пристрій для читання 96-ямкових планшетів (SpectraMAX GeminiEM™, Molecular Devices, США) В. Метод День 1. Підготовка сполук, що тестують Розчинити і послідовно розвести сполуки, що тестують, у ДМСО у 1000-кратній концентрації. Розвести сполуки, що тестують, 1:100 у середовищі cRPMI без фенолового червоного в стерильних 96-ямкових планшетах для культур тканин. 12-канальною піпеткою перенести 10 мкл розведеного розчину сполуки в чистий 96-ямковий планшет, який буде використовуватися для інкубування клітин. 21 94622 Після додавання 100 мкл клітинних культур кінцева концентрація сполук, що тестуються стане дорівнювати 1. День 1. Підготовка клітин рідкої пухлини для обробки сполуками Зібрати клітини в повній RPMI із культури з логарифмічною фазою росту при густині приблизно 0,3-0,7 млн/мл. Провести підрахунок клітин і коректувати їхню кількість до 0,1 млн/мл у cRPMI без фенолового червоного (для клітин, що швидко ростуть, із часом подвоєння, що дорівнює або менше 24 годин, наприклад K562, використати 0,05 млн/мл, щоб уникнути надмірного росту). Перенести тричі по 100 мкл клітин в ямку 96ямкових прозорих планшетів до загальної кількості 10 000 клітин/ямку. Зауважимо, що кожна ямка вже містить 10 мкл 10-кратно концентрованої сполуки, що тестують, приготованої, як показано вище. Інкубування клітин Інкубувати клітини протягом 72-96 годин при 370°С в інкубаторі тканинних культур в атмосфері 5% СО2. C. Вимірювання: визначення життєздатності клітин 1. Розморозити реагент MTS компанії Promega і додати по 20 мкл у кожну комірку піпетдозатором. 2. Змішати реагенти в ямках струшуванням планшета і вмістити планшет в інкубатор культур тканин при температурі 370°С. 3. Приготувати холостий контроль "без клітин", додаючи реагент MTS до ряду ямку, що містять 100 мкл cRPMI без фенолового червоного. 22 4. Інкубувати при 370°С, поки поглинання при 490 нм для контрольних клітин не становитиме >1,5. 5. Перемісити клітинну культуру струшуванням, щоб забезпечити рівномірність забарвлення в ямках, пересвідчитися у відсутності пухирців повітря. Якщо вони присутні, планшет центрифугувати в настільній центрифузі при 1000g, щоб видалити повітряні пухирці. 6. Рахувати поглинання на пристрої для читання 96-ямкових планшетів Molecular Devices. D. Аналіз результатів: 1. Скопіювати і вставити текстові дані в електронну таблицю Excel. 2. Усереднити холості дані "без клітин" і відняти одержане значення з поглинання кожної ямки, що містить клітини. 3. Усереднити дані потрійних ямок, скоректовані з урахуванням холостого досліду, і розрахувати стандартне відхилення для коливань відтворюваності. 4. Усереднити дані для контрольних клітин: 5. Розрахувати усереднені дані для клітин, оброблених сполукою, у відсотках від усереднених даних для контрольних клітин таким чином: (Значення для оброблених клітин/значення для контролю)*100=% від контрольного значення Результати: Нами встановлена антипроліферативна активність сполуки з формулою І. Як показано в таблиці 4, сполука з формулою І виявляє стабільну активність щодо двох клітинних ліній ЛКМ Jeko-1 і Granta-519. Крім того, сполука з формулою І виявляє пригнічуючий вплив на порівняно широкий спектр гематологічних клітинних ліній (6 з 15). Таблиця 4 Вплив сполуки Syk на життєздатність IC50 (mkM) Захворювання ГМЛ ГМЛ ГМЛ В-ГЛЛ В-ХЛЛ В-ХЛЛ В-НХЛ В-НХЛ ХМЛ ХМЛ ЛКМ ЛКМ MM MM Т-ГЛЛ Лінія клітин HL-60 KG-1 ML-2 Nalm-6 JVM-2 JVM-2 DLCL-2 DOHH-2 Jurl-MK 1 K562 Jeko-1 Granta-519 L-363 RPMI8226 Jurkat Інгібування колаген-індукованого артриту у щурів A003397769 N=4 3,7;8,1; >10; >10 1,9 >10 5,5 3,5; 3,6; 7,7; >10 6,8; 7,0; 8,4; >10 1,4; >10; >10; >10 4,5 1,2; >10; >10; >10 3,9; >10; >10; >10 3,1 3,4 5,5 >10 6,8; >10; >10; >10 % інгібування при макс. конц. (10 мкМ) А003397769 N=4 35 91 28 84 60 59 0 75 28 21 97 67 61 36 43 Вступ Колаген-індукований артрит (CIA) є добре описаною моделлю ревматоїдного артриту (РА) людини, який може бути індукований у генетично 23 чутливих гризунів після імунізації колагеном II типу (сll) в ад'юванті. Як СІА, так і РА призводять до сильного опухання/запалення суглобів, синовіальної гіперплазії та ерозії хряща і кістки. Такий хронічний запальний артрит, викликаний імунізацією сll, включає як компонент Т-клітин, що продемонстровано при ослабленій формі СІА у Т-дефіцитних мишей, так і компонент В-клітин. У В-дефіцитних мишей, мишей із X-зчепленим імунодефіцитом або мишей із нульовою мутацією в CXCR5 не розвивається СІА. Методи: Імунізація і стимулювання: самки щурів Lewis імунізувалися в день 0 і стимулювалися в день 7 введенням сll з бичачого носового хряща в суміші з неповним ад'ювантом Фройнда з кінцевою концентрацією колагену 1,0мг/мл. Тваринам в основу хвоста вводили 400 мкг сll. Схема профілактичного введення: сполуку з формулою І (3,0; 10 і 30 мг/кг) вводили перорально (п/о) двічі на день (2 р/д), починаючи з дня 6 і до дня 21, включно. Схема комбінованого введення: щурам вводили сполуку з формулою І (3,0 і 10 мг/кг, п/о, 2 р/д) або метотрексат (МТХ, 0,1 і 0,2 мг/кг, п/о, 1 р/д) у ролі монотерапії або в різних поєднаннях разової дози сполуки із формулою І з разовою дозою МТХ, починаючи з дня 6 і до дня 21, включно. Схема терапевтичного введення: сполуку з формулою І (10 і 30 мг/кг, п/о, 2 р/д) вводили перорально, починаючи з дня 12 і до дня 21, включно. Патологія суглоба: опухання суглоба вимірювали з округленням до найближчих 0,01 мм із використанням електронного циркуля. Результати вимірювання фіксували 7 разів протягом дослідження, починаючи з дня 6 і закінчуючи днем 21. Масу тіла реєстрували в ті ж дні. У день 21 задні лапи видаляли на межі волосяного покриву трохи вище скакального суглоба і фіксували в 10% нейтральному буферному розчині формаліну. МікроКТ аналіз: скакальні суглоби досліджували за допомогою мікроКТ сканера з конічним фокусуванням променя. Спочатку здійснювали загальне сканування для вибору об'єму зразків для аналізу, а потім проводилася фіксація положення, вимірювання і комп'ютерна реконструкція. У скакальних суглобах аналізували співвідношення поверхні кістки до її об'єму, що визначає рівень складності поверхні для заданого об'єму. Статистичний аналіз: для визначення опухання/запалення суглоба дані аналізували за допомогою програми Everstat v.5 і двофакторного аналізу, що повторюється ANOVA з післяекспериментальним тестом Данета. Дані мікроКТ аналізували за допомогою програми Everstat із використанням однофакторного ANOVA і критерію множинного порівняння Ньюмана-Койлса. Дані представлені в формі середнє ± СОС, і значення р
ДивитисяДодаткова інформація
Назва патенту англійськоюKinase innhibitor
Автори англійськоюGillespy Timothy A., Eynott, Paul, Allen, Elizabeth M., Yu, Kin T., Zilberstein, Asher
Назва патенту російськоюИнгибитор киназы
Автори російськоюГиллеспи Тимоти А., Эйнотт Пол, Аллен Элизабет М., Ю Кин Т., Зилберстейн Эшер
МПК / Мітки
МПК: A61P 19/02, C07D 487/04, A61K 31/4985
Код посилання
<a href="https://ua.patents.su/18-94622-ingibitor-kinazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітор кінази</a>
Попередній патент: Пристрій для індукційного розпресовування деталей
Наступний патент: Спосіб і пристрій для виготовлення розплавленого чавуну
Випадковий патент: Стопорний гвинт












