Композиція 1-[2-(2,4-диметилфенілсульфаніл)феніл]-піперазину
Номер патенту: 105057
Опубліковано: 10.04.2014
Автори: Древіс Пернілле Ґуннорф, Катеб Йєнс, Хьоєр Астрід Марія
Формула / Реферат
1. Фармацевтична композиція для перорального введення, яка містить сполуку 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазин і його фармацевтично прийнятні кислотно-адитивні солі (сполука І), де вказана композиція виготовлена так, щоб виключити вивільнення вказаної сполуки в шлунку.
2. Композиція за п. 1, де вказана композиція являє собою композицію уповільненого вивільнення.
3. Композиція за п. 1, де вказана композиція являє собою композицію відстроченого вивільнення.
4. Композиція за п. 3, де вказана композиція містить рН-чутливе покриття.
5. Композиція за п. 4, де дана композиція являє собою пігулку з ентеросолюбільним покриттям.
6. Композиція за п. 4, де дана композиція являє собою композицію, що містить безліч частинок, в якій по суті кожна частинка покрита ентеросолюбільним покриттям.
7. Композиція за п. 1, де дана композиція являє собою пігулку, що містить сполуку І, маніт, мікрокристалічну целюлозу, натрію крохмальгліколят, гідроксипропілцелюлозу і стеарат магнію, де дана пігулка покрита співполімером метакрилової кислоти і етилакрилату (1:1).
8. Композиція за будь-яким з пп. 1-7, в якій сполука І являє собою 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазин НВr в кількості 1-50 мг.
9. Спосіб лікування захворювання, вибраного з розладів настрою; великого депресивного розладу; генералізованого тривожного розладу; панічного розладу; посттравматичного стресового розладу; депресії, пов'язаної з когнітивними порушеннями, хворобою Альцгеймера або тривогою; депресії із залишковими симптомами; хронічного болю; розладу харчової поведінки або зловживання різними речовинами, причому вказаний спосіб передбачає введення терапевтично ефективної кількості фармацевтичної композиції за будь-яким з пп. 1-8 пацієнтові, що потребує цього.
10. Застосування 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину і його фармацевтично прийнятних кислотно-адитивних солей для виробництва фармацевтичної композиції для перорального введення для лікування захворювання, вибраного з розладів настрою; великого депресивного розладу; генералізованого тривожного розладу; панічного розладу; посттравматичного стресового розладу; депресії, пов'язаної з когнітивними порушеннями, хворобою Альцгеймера або тривогою; депресії із залишковими симптомами; хронічного болю; розладу харчової поведінки або зловживання різними речовинами, де вказана фармацевтична композиція являє собою пігулку або композицію, що містить безліч частинок, що покриті ентеросолюбільним покриттям.
11. Застосування за п. 10, де вказана композиція виготовлена так, що вивільнення сполуки І має місце в тонкій кишці.
12. Застосування за будь-яким з пп. 10, 11, де вказана композиція містить 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазин НВr в кількості 1-50 мг.
Текст
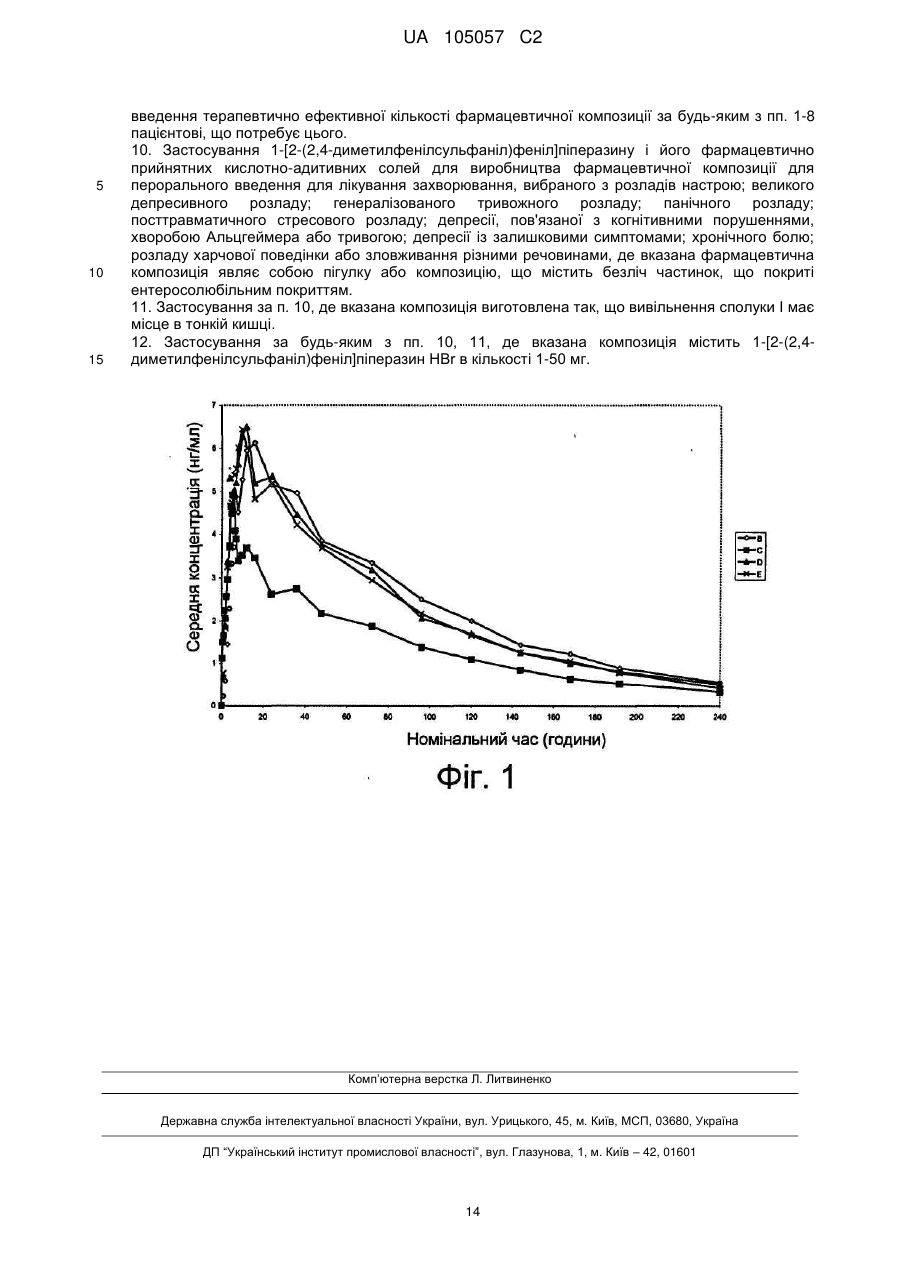
Реферат: Винахід стосується фармацевтичної композиції для перорального введення, що містить сполуку 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазин і його фармацевтично прийнятні кислотноадитивні солі (сполука І), де композиція виготовлена так, щоб виключити вивільнення вказаної сполуки в шлунку. UA 105057 C2 (12) UA 105057 C2 UA 105057 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої відноситься винахід Цей винахід відноситься до фармацевтичних композицій, що містять 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазин і його фармацевтично прийнятні кислотно-адитивні солі. Попередній рівень техніки Сполуку 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазин було вперше розкрито в міжнародній патентній заявці, опублікованій як WO 03/029232. Подальші публікації WO 2007/144005, WO 2008/113359 і WO 2009/062517 розкривають додаткові застосування, фармацевтичні композиції і способи отримання. Тут і далі 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазин і його фармацевтично прийнятні кислотно-адитивні солі іменуються як "сполука I" або "сполука I XX", якщо посилання на конкретну XX-сіль сполуки I є бажаним. Показано, що сполука I має унікальний фармакологічний профіль, будучи 5HTпідсилювачем з дією антагоніста відносно 5HT 3-рецепторів (Ki: 4,5 нМ), дією агоніста відносно 5HT1A-рецепторів (EC50: 200 нМ) і інгібуючою дією відносно транспортера серотоніну (IC 50: 5,4 th нМ). [Soc. Biol. Psych. 64 annual meeting, May 14-16, 2009 Vancouver, Canada, Poster #260]. Додатково, в неклінічних дослідженнях in vivo показано, що сполука I викликає значне зростання концентрацій ацетилхоліну, норепінефрину, дофаміну і серотоніну в ділянках мозку, пов'язаних th з регуляцією настрою. [World Federation of Societies of Biological Psychiatry, 9 World Congress of Biological Psychiatry, 28 June-2 July, 2009, Paris, France, Poster P-29-005]. Ґрунтуючись на цьому фармакологічному профілі, вважають, що сполука I ефективна в лікуванні розладів настрою, таких як депресія, тривога, а також підходить для лікування когнітивного порушення і болю. Дана думка, мабуть, підтверджується першим клінічним випробуванням, представленим для сполуки I, яке показує, що сполука I, що вводиться в дозах 5 і 10 мг, безпечно і добре переноситься і ефективна при лікуванні великого депресивного розладу [American Psychiatric nd Association, 162 Annual Meeting, 16-21 May, 2009, San Francisco, USA, Poster NR4-024]. Лікування антидепресантами пацієнтів з депресією, такими як селективні інгібітори зворотного захоплення серотоніну (SSRI) або інгібітори зворотного захоплення серотоніну і норадреналіну (SNRI), зазвичай пов'язано з небажаними явищами, такими як нудота, порушення сну, сексуальна дисфункція, збільшення маси тіла, головний біль і сухість в роті [Int. J. Psych. Clin. Pract., 10, 31-37, 2006]. Зменшення числа або тяжкості небажаних явищ, пов'язаних з лікуванням антидепресантами, є, безумовно, бажаним, оскільки воно приводитиме до більшого комфорту пацієнта, сприятиме більшій поступливості пацієнта відносно терапії і, таким чином, кінець кінцем, покращуватиме результат лікування. Порівнювалося лікування депресії пароксетином, що являє собою SSRI, що вводиться у вигляді пігулки з негайним вивільненням (IR) і у вигляді пігулки, покритою ентеросолюбільною оболонкою, із уповільненим вивільненням [J. Clin. Psych., 63, 577-584, 2002]. Лікування покритими ентеросолюбільною оболонкою пігулками супроводжувалося меншою нудотою. Інші типи небажаних явищ з боку шлунково-кишкового (ШК) тракту, такі як діарея, проте, очевидно, посилювалися, також як і кількість патологічних еякуляцій, про які повідомлялося, розладів жіночих статевих органів і запаморочень. Суть винаходу Автори цього винаходу виявили, що введення 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину і його фармацевтично прийнятних кислотно-адитивних солей (сполука I) таким чином, що виключає вивільнення сполуки I в шлунку, зменшує кількість небажаних явищ і, зокрема, кількість небажаних явищ з боку шлунково-кишкового тракту. Відповідно, в одному варіанті здійснення винахід відноситься до фармацевтичної композиції для перорального введення, яка містить 1-[2-(2,4-диметилфенілсульфаніл)-феніл]піперазин і його фармацевтично прийнятні кислотно-адитивні солі як активну сполуку, де вказана композиція виготовлена так, щоб виключити вивільнення вказаної активної сполуки в шлунку. У одному варіанті здійснення винахід відноситься до способу лікування захворювання, причому вказаний спосіб передбачає введення фармацевтичної композиції цього винаходу пацієнтові, що потребує цього. У одному варіанті здійснення винахід відноситься до застосування сполуки 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину і його фармацевтично прийнятних кислотноадитивних солей для виробництва лікарського засобу для перорального введення для лікування захворювання, де вказаний лікарський засіб виготовлений так, щоб виключити вивільнення вказаної сполуки в шлунку. У одному варіанті здійснення винахід відноситься до сполуки 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину і його фармацевтично прийнятних кислотноадитивних солей для застосування при лікуванні захворювання, де вказана сполука 1 UA 105057 C2 5 10 15 20 25 30 35 40 45 50 55 60 знаходиться у фармацевтичній композиції для перорального введення, виготовленій так, щоб виключити вивільнення вказаної сполуки в шлунку. Стислий опис ілюстративних матеріалів На фіг. 1 представлені криві "концентрація в плазмі - час", отримані при введенні сполуки I HBr. B: 20 мг сполуки I HBr IR; C: 9 мг сполуки I HBr внутрішньовенно; D: 20 мг сполуки I HBr, що вивільняється в проксимальному відділі кишечника; E: 20 мг сполуки I HBr, що вивільняється в дистальному відділі кишечника. Докладний опис винаходу У одному варіанті здійснення винахід відноситься до фармацевтичної композиції для перорального введення, яка містить 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазин і його фармацевтично прийнятні кислотно-адитивні солі як активну сполуку, де вказана композиція виготовлена так, щоб виключити вивільнення вказаної активної сполуки в шлунку. Зокрема, сполука I вивільняється в кишечнику і, зокрема, в тонкій кишці. У цьому контексті вираз "виключає вивільнення в шлунку" призначено указувати на те, що сполука I при введенні суб'єктові по суті не присутня в шлунку в розчиненій формі. Присутність сполуки I в шлунку в розчиненій формі, в принципі, може бути визначена in vivo з використанням таких методів, як рентгенівська оцінка, ЯМР-візуалізація, гамма-сцинтиграфія або, безумовно, безпосередній відбір проби з шлунку. Дані тести, проте, трудно здійснити на людях. Зручнішим тестом для визначення присутності сполуки I в шлунку є двостадійний in vitro тест на розчинення, який включає першу фазу, в якій фармацевтичну композицію піддають дії низьких значень pH, що імітують середовище в шлунку, за яким слідує друга стадія з дією вищих значень pH, що імітують середовище в тонкій кишці. Критерії аналізу визначаються значеннями pH в різних частинах шлунково-кишкового тракту і часом, який потрібний, наприклад пігулці або капсулі, для того, щоб пройти через шлунок і потрапити в кишечник, як описано нижче. Відповідний двостадійний in vitro тест на розчинення полягає в наступному. Устаткування: Стандартний за USP (Фармакопея США) апарат з лопатями, що обертаються; швидкість обертання лопатей 75 об./хв.; 37 °C. Перша стадія: стандартну дозу піддають дії 600 мл 0,1 М HCl протягом 2 годин; друга стадія: стандартну дозу переносять до 900 мл TRIS-буфера (0,6 M), pH=6,8. Стандартна доза зазвичай включає 1-50 мг сполуки I, як, наприклад, 10, 20 або 30 мг сполуки I. У тексті даної заявки посилання на певну кількість сполуки I (наприклад, 1-50 мг) слід розуміти як посилання на кількість сполуки I, відповідну вказаній певній кількості вільної основи. У одному варіанті здійснення фармацевтична композиція для перорального введення, що містить сполуку I, визначається як виготовлена так, щоб виключити вивільнення сполуки I в шлунку, якщо менше 30 %, як, наприклад, менше 20 %, як, наприклад, менше 10 % сполуки I вивільняється на стадії I, визначеній вище. У додатковому варіанті здійснення фармацевтична композиція для перорального введення визначається як виготовлена так, щоб виключити вивільнення сполуки I в шлунку, якщо вона, на додаток до вищезгаданого критерію, вивільняє щонайменше 20 %, як, наприклад, щонайменше 30 %, як, наприклад, щонайменше 50 % на стадії 2, визначеній вище, через 3 години. У додатковому варіанті здійснення фармацевтична композиція для перорального введення, яка містить сполуку I, визначається як виготовлена так, щоб виключити вивільнення сполуки I в шлунку, якщо вона, на додаток до вищезгаданих критеріїв, вивільняє щонайменше 60 %, як, наприклад, щонайменше 70 %, як, наприклад, щонайменше 80 % сполуки I на стадії 2, визначеній вище, через 5 годин. У додатковому варіанті здійснення фармацевтична композиція для перорального введення, яка містить сполуку I, визначається як виготовлена так, щоб виключити вивільнення сполуки I в шлунку, якщо вона, на додаток до вищезгаданих критеріїв, вивільняє щонайменше 80 %, як, наприклад, щонайменше 90 %, як, наприклад, щонайменше 95 % сполуки I на стадії 2, визначеній вище, через 8 годин. У одному конкретному варіанті здійснення фармацевтична композиція для перорального введення, що містить сполуку I, визначається як виготовлена так, щоб виключити вивільнення сполуки I в шлунку, якщо менше 30 % сполуки I вивільняється на стадії 1, визначеній вище, і щонайменше 20 % вивільняється на стадії 2, визначеній вище, через 3 години і щонайменше 60 % сполуки I вивільняється на стадії 2, визначеній вище, через 5 годин і щонайменше 80 % сполуки I вивільняється на стадії 2, визначеній вище, через 8 годин. У конкретному варіанті здійснення фармацевтична композиція для перорального введення, що містить сполуку I, визначається як виготовлена так, щоб виключити вивільнення сполуки I в шлунку, якщо менше 10 % сполуки I вивільняється на стадії 1, визначеній вище, і щонайменше 60 % вивільняється на стадії 2, визначеній вище, через 1 годину і щонайменше 80 % сполуки I вивільняється на стадії 2, визначеній вище, через 2 години, і щонайменше 95 % сполуки I вивільняється на стадії 2, визначеній вище, через 3 години. Час розчинення і кількість, 2 UA 105057 C2 5 10 15 20 25 30 35 40 45 вивільнена на стадії 1, включені в час розчинення і кількість, вивільнену на стадії 2, в наведених вище критеріях аналізу. Приклади дають опис випробування для аналізу сполуки I. У людини шлунково-кишковий тракт включає, зокрема, шлунок, тонку кишку і товсту кишку. Шлунок пов'язаний з глоткою за допомогою стравоходу, і в шлунку їжа перемішується перед тим, як вона переміститься в тонку кишку. Шлунок може вміщати 1-1,5 літра їжі. У цьому контексті важливо, що значення pH в шлунку є низьким, тобто складає близько 1-2. Тонка кишка включає три відділи, тобто дванадцятипалу кишку, порожню кишку і клубову кишку, що в сукупності мають довжину аж до 7 метрів при діаметрі 2,5-3 см. Головна частина хімічного переварювання їжі відбувається в тонкій кишці. Травні ферменти, такі як протеази, ліпази і амілази, гідролізують їжу до амінокислот, жирних кислот і гліцерину і моносахаридів (наприклад, глюкози). Дані поживні речовини потім поступають через стінку тонкої кишки в кров. Головна частина поживних речовин з їжі абсорбується з тонкої кишки. У тонкій кишці значення pH помітно вище, ніж в шлунку, тобто складає близько 5,5 або вище. Товста кишка має довжину приблизно 1,5 метра, і тут вода абсорбується з їжі, а фекалії ущільнюються і залишаються в прямій кишці до видалення через задній прохід. Бактерії, присутні в товстій кишці, продукують вітаміни, наприклад, вітамін B і K, які також абсорбуються. У товстій кишці значення pH збільшується від близько 5,5 до 7. Натще неперетравлювані тверді компоненти, що не розпадаються, виводяться з шлунку в ході фази III травного мігруючого міоелектричного комплексу (IMMC), який у людини відбувається приблизно кожні 2 години. Залежно від стадії IMMC під час введення дози натще пігулка або капсула може покинути шлунок майже негайно після введення дози або протягом 2 годин після введення дози. Після прийому їжі мала пігулка або капсула повільно покидатиме шлунок з вмістом прийнятої їжі. Пігулки або капсули більшого розміру затримуватимуться в шлунку впродовж переварювання прийнятої їжі і поступатимуть в дванадцятипалу кишку в ході фази III IMMC після того, як вся прийнята їжа буде переварена і покине шлунок. Структура сполуки I зображена нижче У одному варіанті здійснення вказаними фармацевтично прийнятними кислотно-адитивними солями є солі кислот, які є нетоксичними. Вказані солі включають солі, отримані з органічних кислот, таких як малеїнова, фумарова, бензойна, аскорбінова, бурштинова, щавлева, бісметиленсаліцилова, метансульфонова, етандисульфонова, оцтова, пропіонова, винна, саліцилова, лимонна, глюконова, молочна, яблучна, мигдалева, корична, цитраконова, аспарагінова, стеаринова, пальмітинова, ітаконова, гліколева, п-амінобензойна, глутамінова, бензолсульфонова, теофіліноцтова кислоти, а також 8-галогентеофіліни, наприклад, 8бромтеофілін. Вказані солі можуть бути отримані також з неорганічних кислот, таких як хлористоводнева, бромистоводнева, сірчана, сульфамінова, фосфорна і азотна кислоти. Особливо слід згадати солі, отримані з метансульфонової кислоти, малеїнової кислоти, фумарової кислоти, мезо-винної кислоти, (+)-винної кислоти, (-)-винної кислоти, хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти і азотної кислоти. Окремо слід згадати гідробромідну сіль. Способи отримання сполуки I відомі в даній галузі. Наприклад, у WO 03/032292 і WO 2007/144005 розкриті відповідні шляхи синтезу. Фармацевтичні композиції, що включають сполуку I, відомі в даній галузі. У WO 2007/144005 (стор. 16) розкрито, що сполука I може бути введена перорально у формі пігулок або парентерально у формі розчинів для ін'єкцій. Проте нічого не розкрито щодо взаємозв'язку між формою для введення і профілем небажаних явищ. У одному варіанті здійснення фармацевтична композиція цього винаходу є композицією уповільненого вивільнення. У цьому контексті мається на увазі, що "уповільнене вивільнення" вказує на те, що сполука I повільно вивільняється з вказаної композиції. 3 UA 105057 C2 5 10 15 20 25 30 35 40 45 50 55 60 У одному варіанті здійснення фармацевтична композиція цього винаходу є композицією відстроченого вивільнення. У цьому контексті мається на увазі, що "відстрочене вивільнення" вказує на те, що сполука I трохи або зовсім не вивільняється з вказаної композиції протягом заданого часу, після закінчення якого сполука I вивільняється або швидко (негайне вивільнення, IR), або уповільненим чином. Композиції уповільненого вивільнення відомі в даній галузі, і в нижченаведеному описі наведені приклади того, як отримати композицію уповільненого вивільнення, що містить сполуку I. Конкретні приклади також представлені в частині "Приклади". У одному варіанті здійснення композиція уповільненого вивільнення досягається за допомогою матричної композиції, в якій сполуку I вставлено або розподілено в матриці, яка уповільнює вивільнення сполуки I у водне середовище, наприклад рідину шлунково-кишкового тракту. Сполука I вивільняється, головним чином, з поверхні вказаної матриці після дифузії через матрицю. Альтернативно, матриця повільно еродує, оголяючи свіжу поверхню, з якою вивільняється сполука I. У деяких матрицях одночасно діють обидва механізми. Швидкість вивільнення з матриці залежить, серед іншого, від розміру частинок матриці. Малі частинки приводитимуть до швидкого вивільнення сполуки I, тоді як великі частинки приводитимуть до повільного вивільнення сполуки I. Швидкість вивільнення також залежить від матеріалу матриці, тобто коефіцієнта дифузії сполуки I в матеріалі вказаної матриці. Загалом, полімери, такі як ацетат целюлози, мають низькі коефіцієнти дифузії, тоді як гідрогелі мають високі коефіцієнти дифузії. Таким чином, вибором матеріалу матриці і регулюванням розміру частинок матриці можна контролювати швидкість вивільнення сполуки I. Крім того, пластифікатори, пори і добавки, що приводять до утворення пор, можуть бути використані для регулювання швидкості вивільнення. У одному варіанті здійснення фармацевтична композиція цього винаходу являє собою матричну композицію, що містить безліч частинок, тобто композицію, що містить безліч частинок, що містять сполуку I, в матриці, яка уповільнює вивільнення сполуки I. Частинки в композиції, що містить безліч частинок, типово мають діаметри в діапазоні від 50 мкм до 3 мм. Матеріал матриці, відповідний для даного варіанту здійснення, включає мікрокристалічну целюлозу, таку як Avicel, включаючи сорти мікрокристалічної целюлози, до якої додані зв'язувальні агенти, такі як гідроксипропілметилцелюлоза, різновиди воску, такі як парафін, модифіковані рослинні олії, карнаубський віск, гідрогенована касторова олія, бджолиний віск, полівінілхлорид, полівінілацетат, сополімери вінілацетату і етилену і полістирол. Водорозчинні зв'язувальні агенти або агенти, що модифікують вивільнення, які необов'язково можуть бути введені до складу матриці, включають водорозчинні полімери, такі як гідроксипропілцелюлоза (HPC), гідроксипропілметилцелюлоза (HPMC), метилцелюлоза, PVP, полі(етиленоксид) (PEO), PVA, ксантанова камедь, карагенан. Крім того, матеріали, які функціонують як агенти, що модифікують вивільнення, включають водорозчинні матеріали, такі як цукри або солі. Матричні композиції, що містять безліч частинок, можуть бути отримані екструзією/сферонізацією, при якій сполуку I змішують в масі вологим способом зі зв'язувальною речовиною, екструдують через перфоровану пластину і, зрештою, поміщають на диск, що обертається, який розламує екструдати на округлі сфери. Альтернативно, вказана композиція є продуктом гранулювання на основі воску. Продукт гранулювання на основі воску може бути отриманий розчиненням сполуки I в рідкому воску, який при охолоджуванні (і твердінні) пропускають через екран, щоб сформувати гранули. Відповідні різновиди воску включають гідрогеновану касторову олію, карнаубський віск і стеариловий спирт. Якщо точка плавлення воску дуже висока, то цей віск і сполука I можуть бути змішані в органічному розчиннику з формуванням пасти, яку пропускають через екран, щоб сформувати гранули. Після формування частинки матричної композиції, що містить безліч частинок, можуть бути змішані, наприклад, з лактозою, мікрокристалічною целюлозою або дикальційфосфатом і спресовані в пігулки. Також можуть застосовуватися розпушувачі. При введенні такої пігулки вона розпадається під дією водного середовища, такого як середовище в кишково-шлунковому тракті, оголяючи матричну композицію, що містить безліч частинок, що містять сполуку I, яка потім повільно вивільняється. Альтернативно, частинки матричної композиції, що містить безліч частинок, можуть бути введені в капсулі, в саше або у вигляді порошку. У одному варіанті здійснення вказана матрична композиція містить сполуку I і гідрофільний полімер. Даний варіант здійснення також включає матричні композиції, що містять безліч частинок. Відповідні полімери включають гідроксипропілметилцелюлозу (HPMC), гідроксипропілцелюлозу (HPC), полі(етиленоксид), PVA, ксантанову камедь, карбомер, карагенан і зооглан. При введенні гідрофільний полімер набухає під дією водного середовища, наприклад в кишково-шлунковому тракті, і, кінець кінцем, розчиняється в ньому. Сполука I 4 UA 105057 C2 5 10 15 20 25 30 35 40 45 50 55 60 вивільняється як за рахунок дифузії з матриці, так і за рахунок ерозії матриці. Швидкість вивільнення сполуки I можна регулювати кількістю і молекулярною масою використаного гідрофільного полімеру. Загалом, застосування більшої кількості гідрофільного полімеру зменшує швидкість розчинення, також як і застосування полімеру з вищою молекулярною масою. Застосування полімеру з меншою молекулярною масою збільшує швидкість розчинення. Швидкість розчинення можна також регулювати, використовуючи водорозчинні добавки, такі як цукри, солі або розчинні полімери. Прикладами даних добавок є цукри, такі як лактоза, сахароза або маніт, солі, такі як NaCl, KCl, NaHCO3, і водорозчинні полімери, такі як PNVP або PVP, низькомолекулярні HPC або HMPC або метилцелюлоза. У одному варіанті здійснення матрична композиція містить сполуку I, дисперговану в гідрогелі. Гідрогелі являють собою сітчасті полімери, що набухають у воді. Як обговорено вище, гідрогелі характеризуються відносно високими коефіцієнтами дифузії, що допускає можливість отримання відносно крупних дозованих форм, наприклад, пігулок, а не матриць, що містять безліч частинок. Пігулки на основі гідрогелів можуть бути отримані і можуть продаватися у вигляді набухлих гелів або, альтернативно, можуть бути отримані і можуть продаватися в сухій ненабухлій формі. У одному варіанті здійснення, і як альтернатива матричним композиціям, цим винаходом пропонується композиція уповільненого вивільнення, яка є композицією з мембранним регулюванням, де резервуар сполуки I покритий мембраною, при цьому дана мембрана уповільнює вивільнення сполуки I. Така форма композиції може бути великою, наприклад, пігулками, покритими мембраною, або малою, наприклад, частинками, покритими мембраною, присутніми, наприклад, в капсулі, у вигляді порошку або в саше, або спресованими в пігулки. Покриття для уповільненого вивільнення включають полімерні покриття, такі як етилцелюлоза, ацетат целюлози і ацетат-бутират целюлози. Полімер може бути нанесений у вигляді розчину в органічному розчиннику або у вигляді водної дисперсії або латексу. Операція нанесення покриття може бути проведена на стандартному устаткуванні, такому як пристрій для нанесення покриття в псевдозрідженому шарі, пристрій Вурстера для нанесення покриття або пристрій для нанесення покриття в шарі, що обертається. У одному варіанті здійснення композиція цього винаходу є капсулою, яка містить сполуку I, причому вказана капсула має оболонку, що включає мембрану, де дана мембрана уповільнює вивільнення сполуки I. У одному варіанті здійснення композиція цього винаходу, що містить безліч частинок, отримана нанесенням сполуки I на інертне ядро технологією нашаровування лікарського засобу, такою як нанесення порошкового покриття, або розпилюванням розчину сполуки I і підхожого зв'язувального агента на ядро, наприклад, в пристрої для нанесення покриття в псевдозрідженому шарі або в роторному змішувачі. Альтернативно, ядра, що містять сполуку I, можуть бути отримані способом екструзії/сферонізації, описаним вище, або гранулюванням, наприклад, в псевдозрідженому шарі. Додаткові подробиці відносно отримання пігулок (або ядер) наведені нижче. Отримані частинки потім покривають відповідною мембраною, яка уповільнює вивільнення сполуки I. Композиція уповільненого вивільнення цього винаходу може також здійснюватися з використанням осмотичних систем доставки. Така система включає ядро, що містить осмотично ефективну композицію і сполуку I, оточену (повністю або частково) напівпроникною мембраною. Через напівпроникну мембрану може проходити вода, але не речовини, розчинені у воді. При розміщенні у водному середовищі (наприклад, в шлунково-кишковому тракті) ядро абсорбує воду, що породжує підвищений тиск усередині системи доставки. Даний підвищений тиск витіснятиме сполуку I з системи доставки, наприклад, через заздалегідь створений отвір. Альтернативно, система доставки може розриватися, коли тиск досягне певного рівня. Відповідні осмотично ефективні сполуки включають солі, цукор і полімери, що набухають у воді. Матеріали, придатні для отримання напівпроникних мембран, включають поліаміди, поліестери і похідні целюлози, такі як ацетат целюлози, ацетат-бутират целюлози і етилцелюлоза. Як згадано вище, фармацевтична композиція цього винаходу може також досягатися за допомогою композиції відстроченого вивільнення. Наступний опис дає приклади того, як можуть бути отримані композиції відстроченого вивільнення. Конкретні приклади наведені в частині "Приклади". У одному варіанті здійснення відстрочення досягається за допомогою pH-чутливого покриття. Зокрема, вказане покриття по суті залишається непошкодженим, наприклад, не розчиняється або не руйнується, при значенні pH, що виявляється в шлунку, тим самим по суті запобігаючи вивільненню сполуки I. Більш того, вказане покриття руйнується або розчиняється (або зазнає подібні названим зміни) при вищому pH, що виявляється в кишечнику, наприклад, в 5 UA 105057 C2 5 10 15 20 25 30 35 40 45 50 55 60 тонкій кишці, дозволяючи вивільнення сполуки I. У одному варіанті здійснення композиція цього винаходу покрита pH-чутливим покриттям, яке по суті дозволяє вивільнення сполуки I лише в тонкій кишці. Така композиція часто іменується ентеросолюбільною композицією, і, подібно до цього, покриття іменується ентеросолюбільним покриттям. pH-чутливі покриття включають pH-чутливі полімери, такі як поліакриламіди, фталатні похідні, такі як кислі фталати вуглеводів, фталат ацетату амілози, фталат ацетату целюлози, інші фталати естерів целюлози, фталати етерів целюлози, фталат гідроксипропілцелюлози, фталат гідроксипропілетилцелюлози, фталат гідроксипропілметилцелюлози, фталат метилцелюлози, фталат полівінілацетату, гідрофталат полівінілацетату, фталат ацетату натрійцелюлози, кислий фталат крохмалю, сополімер стирол-дибутилфталат малеїнової кислоти, сополімер стирол-полівінілацетат-фталат малеїнової кислоти, сополімери стиролу і малеїнової кислоти, похідні поліакрилової кислоти, такі як сополімери акрилової кислоти і естерів акрилової кислоти, поліметакрилова кислота і її естери, сополімери поліакрилової і поліметакрилової кислоти, шелак і сополімери вінілацетату і кротонової кислоти. Аніонними акриловими сополімерами метакрилової кислоти і метилметакрилату є особливо відповідні pH-залежні матеріали для нанесення покриття. Ентеросолюбільні покриття даного типу доступні від Degussa під торговим найменуванням Eudragit. Особливо відповідними є продукти Eudragit L, які включають сополімер (1:1) метакрилової кислоти-етилакрилату, і Eudragit S, який включає сополімер (1:2) метакрилової кислоти-етилакрилату. Eudragit L розчиняється при pH близько 5,5, а Eudragit S розчиняється при pH близько 7. Таким чином, застосовуючи полімери Eudragit або в чистій формі, або у вигляді їх сумішей, можна контролювати те, в якому відділі кишечника відбуватиметься вивільнення. У одному варіанті здійснення цим винаходом пропонується композиція, що містить безліч частинок, в якій кожна частинка покрита pH-чутливим покриттям, таким як ентеросолюбільне покриття. Дані частинки можуть бути отримані нанесенням сполуки I на інертне ядро технологією нашаровування лікарського засобу, такою як нанесення порошкового покриття, або розпилюванням розчину сполуки I і підхожого зв'язувального агента на ядро, наприклад, в пристрої для нанесення покриття в псевдозрідженому шарі або в роторному змішувачі. Альтернативно, частинки із диспергованою в них сполукою I можуть бути отримані, як описано вище. Отримані частинки потім покривають відповідним pH-чутливим покриттям, наприклад ентеросолюбільним покриттям. Дані частинки можуть бути спресовані в пігулки, як описано вище, або можуть бути присутніми в капсулах у вигляді порошку або в саше. У одному варіанті здійснення цим винаходом пропонується пігулка, покрита pH-чутливим покриттям, наприклад ентеросолюбільним покриттям. Пігулка може бути отримана рядом способів, доступних фахівцеві. Пігулки можуть бути отримані змішуванням сполуки I із звичайними допоміжними компонентами і/або розріджувачами і потім пресуванням суміші в звичайній таблетувальній машині. Приклади допоміжних компонентів або розріджувачів включають PVP, сополімери PVP-VA, мікрокристалічну целюлозу, натрій-крохмаль гліколят, кукурудзяний крохмаль, маніт, картопляний крохмаль, тальк, стеарат магнію, желатин, лактозу, камедь і тому подібне. Будь-які інші допоміжні компоненти або добавки, зазвичай використовувані для відповідних цілей, такі як барвники, ароматизатори, консерванти тощо, можуть бути використані, за умови, що вони сумісні з активними інгредієнтами. Альтернативно, пігулки, що містять сполуку I, можуть бути легко отримані вологим гранулюванням. Застосовуючи даний спосіб, тверді компоненти (активні інгредієнти, наповнювач, зв'язувальний агент тощо) змішують і зволожують водою або іншим зволожуючим агентом (наприклад, спиртом), і агломерати або гранули формуються із зволожених частинок. Вологе змішування маси продовжують до досягнення бажаного однорідного розміру частинок, після чого гранульований продукт сушать. Сполуку I типово змішують разом з водою з моногідратом лактози, кукурудзяним крохмалем і коповідоном в змішувачі з великими зусиллями зсуву. Услід за формуванням продукту гранулювання даний продукт гранулювання може бути просіяний в ситі з відповідним розміром отворів і висушений. Отриманий висушений продукт гранулювання потім змішують, наприклад, з мікрокристалічною целюлозою, кроскармелозою натрію і стеаратом магнію, після чого пігулки пресують. Альтернативно, пігулки можуть бути виготовлені змішуванням і гранулюванням сполуки I в псевдозрідженому шарі разом з відповідними допоміжними добавками, такими як маніт, мікрокристалічна целюлоза, натрій-крохмаль гліколят, гідроксипропілцелюлоза і стеарат магнію. Отриманий продукт гранулювання потім пресують в пігулки. Отримані пігулки потім покривають відповідним pH-чутливим покриттям, наприклад, ентеросолюбільним покриттям, наприклад, розпилюванням розчину, що містить матеріал для 6 UA 105057 C2 5 10 15 20 25 30 35 40 45 50 55 60 нанесення покриття, на пігулки. У одному варіанті здійснення цим винаходом пропонується композиція відстроченого вивільнення, яка містить сполуку I, маніт, мікрокристалічну целюлозу, натрій-крохмаль гліколят, гідроксипропілцелюлозу і стеарат магнію, в пігулці, де дана пігулка покрита полімером метакрилової кислоти і етилакрилату (1:1), наприклад з Mw близько 250000. Може бути бажаним нанести підшар між ядром, що містить сполуку I, і pH-чутливим покриттям, наприклад ентеросолюбільним покриттям. Такий підшар може бути бажаним в тому випадку, якщо сполука I і сполука в pH-чутливому покритті реагують, тим самим загрожуючи стабільності фармацевтичної композиції. Приклади матеріалу підшару включають поліетиленгліколь, полівінілпіролідон, полівініловий спирт, гідроксипропілцелюлозу і гідроксиметилцелюлозу. Як альтернатива pH-чутливому покриттю може бути використана осмотична система доставки, описана вище. Вибором мембрани, геометрії системи і осмотично активної сполуки можливо відстрочити осмотичний розрив до того моменту, як система мине шлунок. Альтернативно, композиція відстроченого вивільнення може бути виготовлена з використанням ядра, що містить сполуку I і здатний до набухання матеріал, такий як гідрогель, де дане ядро покрите напівпроникною мембраною. Відповідні мембрани і гідрогелі обговорені вище. При введенні у водне середовище (наприклад, в шлунково-кишковий тракт) вода проходить через мембрану, викликаючи набухання гідрогелю. Відповідним вибором матеріалу мембрани, гідрогелю і геометрії можна відстрочити розрив до того моменту, як ядро мине шлунок. Профіль "концентрація в плазмі - час", отриманий при введенні сполуки I в IR-композиції, відрізняється відносно пізнім tmax і наявністю плато концентрації в плазмі поблизу t max. Вважають, що такий профіль є сприятливим, оскільки приводить до менших флуктуацій концентрації в плазмі в стаціонарній, багатодозовій ситуації, тобто ситуації, в якій знаходяться пацієнти. Багато небажаних явищ обумовлено Cmax, і низький рівень, зокрема, небажаних явищ, пов'язаних зі сном і сексуальною сферою, спостережуваний в клінічних випробуваннях сполуки I (див. нижче), як вважають, пов'язаний з даним профілем. Терапевтичний ефект сполуки також залежить від профілю "концентрація в плазмі - час", який вона дає. Таким чином, можна було б чекати, що дві форми для введення, що дають однаковий профіль "концентрація в плазмі - час", дають однаковий терапевтичний ефект. Несподівано те, що сполука I при вивільненні в тонкій кишці і, насправді, введена внутрішньовенно, зберігає сприятливі характеристики профілю "концентрація в плазмі - час" IR-композиції. Вважають, що завдяки збереженому профілю "концентрація в плазмі - час" введення фармацевтичної композиції цього винаходу приводитиме до низького рівня небажаних явищ з боку шлунково-кишкового тракту при збереженні низького рівня небажаних явищ, пов'язаних зі сном і сексуальною сферою, і збереженні сприятливого терапевтичного ефекту. Таким чином, якщо доза сполуки I підтримується (порівняно з введенням в IR-пігулці), то очікується, що фармацевтична композиція цього винаходу забезпечить ті ж терапевтичні переваги, проте при помітно нижчому рівні небажаних явищ. З іншого боку, доза може бути збільшена, що, як можна було б чекати, забезпечить більшу терапевтичну перевагу при збереженні прийнятного рівня небажаних явищ. Іншими словами, фармацевтична композиція цього винаходу розширює терапевтичне вікно (тобто дозволяє збільшити дозу лікарського засобу між кількістю, яка дає терапевтичний ефект, і кількістю, яка дає неприйнятний рівень небажаних явищ) для сполуки I. У більшості фармацевтичних розробок в початкових випробуваннях і експериментах застосовуються IR-композиції по причинах зручності і простоти. З позицій регламентації додатковою перевагою композицій цього винаходу є те, що вони зберігають профіль "концентрація в плазмі - час" IR-композицій. Завдяки даній біоеквівалентності можливо використовувати дані, отримані в ранніх дослідженнях, що використовують IR-композицію, на підтримку заявки на схвалення збуту композиції цього винаходу. Як обговорено вище, показано, що сполука I має унікальний фармакологічний профіль, будучи 5HT-підсилювачем, інгібітором серотонінового рецептора 3 (5HT 3-антагоніст), агоністом серотонінового рецептора 1A (5HT 1A-агоніст) і інгібітором зворотного захоплення серотоніну. Крім того, сполука I викликає збільшення позаклітинних концентрацій серотоніну, норадреналіну, дофаміну і ацетилхоліну в мозку щурів. Міжнародна заявка WO 2008/113359 також розкриває результати клінічних випробувань у разі пацієнтів з депресією з використанням сполуки I, яка показує несподівано низький рівень небажаних явищ, пов'язаних зі сном і сексуальною сферою. Враховуючи дані факти, очікується, що сполука I буде корисною в лікуванні розладів настрою, таких як великий депресивний розлад, генералізований тривожний розлад, панічний 7 UA 105057 C2 5 10 15 20 25 30 35 40 45 50 55 60 розлад, посттравматичний стресовий розлад, і депресія, пов'язана з тривогою, тобто співіснуючі депресія і тривога. Очікується, що вплив на позаклітинні рівні ацетилхоліну перетворюватиметься на вплив на пізнавальну здатність, що можна порівняти із застосуванням інгібіторів ацетилхолінестерази при лікуванні хвороби Альцгеймера. Таким чином, сполука I може також бути використана для лікування депресії, пов'язаної з когнітивним порушенням і хворобою Альцгеймера. Частина пацієнтів з великим депресивним розладом відповідатиме на лікування, наприклад селективним інгібітором транспорту серотоніну, в тому сенсі, що вони показуватимуть поліпшення у відповідній клінічній шкалі, такій як шкала Гамільтона (HAMD) або МонтгомеріАсберга для оцінки депресії (MADRS), але інші симптоми, такі як когнітивні симптоми і/або симптоми, пов'язані з порушенням сну, залишаються. У цьому контексті дані пацієнти іменуються страждаючими депресією із залишковими симптомами. Очікується, що сполука I підходитиме для лікування таких пацієнтів. Дані доклінічних випробувань, представлені, наприклад, у WO 2008/113359, підтверджують зауваження про те, що сполука I може бути використана для лікування болю. У одному варіанті здійснення біль є хронічним болем, що включає фантомний біль в ампутованій кінцівці, невропатичний біль, діабетичну невропатію, постгерпетичну невралгію (PHN), синдром каналу зап'ястка (CTS), невропатію при ВІЧ, рефлекторну симпатичну дистрофію (комплексний регіональний больовий синдром) (CPRS), невралгію трійчастого нерва, tic douloureux (хворобливий тик), біль при хірургічному втручанні (наприклад, болезаспокійливі засоби після операції), діабетичну ангіопатію, резистентність капілярів, діабетичні симптоми, що асоціюються з інсулітом, біль, що асоціюється з менструаціями, біль, що асоціюється з раком, зубний біль, головний біль, мігрень, головний біль напруги, тригемінальну невралгію, скроневонижньощелепний синдром, міофасціальний біль, пошкодження м'язів, синдром фіброміалгії, біль в кістках і суглобах (остеоартрит), ревматоїдний артрит, ревматоїдний артрит і набряк, що виникає в результаті травми, пов'язаної з опіками, розтягуванням або переломом кістки, біль, викликаний остеоартритом, остеопорозом, метастазами в кістці, або за невідомих причин, подагру, фіброзит, міофасціальний біль, компресійний синдром верхньої апертури грудної клітки, хребетний біль у верхній або нижній частині хребта (де хребетний біль виникає в результаті систематичного, місцевого або первинного захворювання хребта (радикулопатія)), тазовий біль, кардіальний грудний біль, некардіальний грудний біль, біль, що асоціюється з пошкодженням спинного мозку (SCI), центральний постінсультний біль, ракову невропатію, біль при СНІД, біль при серповидно-клітинній анемії або геріатричний біль. У одному варіанті здійснення біль викликаний синдромом подразненої товстої кишки (IBS) або фіброміалгією. На основі фармакологічного профілю також очікується, що сполука I може бути корисною при лікуванні розладів харчової поведінки, таких як ожиріння, компульсивне переїдання, анорексія і невротична булімія, і зловживання різними речовинами, такими як спирт, нікотин і лікарські засоби. Отже, в одному варіанті здійснення цей винахід відноситься до способу лікування захворювання, вибраного з розладів настрою; великого депресивного розладу; генералізованого тривожного розладу; панічного розладу; посттравматичного стресового розладу; депресії, пов'язаної з когнітивними порушеннями, хворобою Альцгеймера або тривогою; депресії із залишковими симптомами; хронічного болю; розладу харчової поведінки або зловживання різними речовинами, причому вказаний спосіб передбачає введення терапевтично ефективної кількості композиції цього винаходу пацієнтові, що потребує цього. У одному варіанті здійснення вказана композиція є пігулкою або композицію, що містить безліч частинок, що покриті pH-чутливим покриттям, таким як ентеросолюбільне покриття. У одному варіанті здійснення вказана композиція і, зокрема, вказана пігулка або композиція, що містить безліч частинок, виготовлена так, що вивільнення сполуки I має місце в тонкій кишці. Завдяки дуже низькому рівню небажаних явищ, пов'язаних зі сном, сексуальною сферою і з боку шлунково-кишкового тракту, спостережуваних при лікуванні із застосуванням сполуки I, композиція цього винаходу також може підходити як терапія другого ряду у випадку пацієнтів, які не можуть використовувати інші лікарські засоби, такі як інші антидепресанти, такі як селективні інгібітори зворотного захоплення серотоніну (SSRI), селективні інгібітори зворотного захоплення норадреналіну (NRI), інгібітори зворотного захоплення норадреналіну/серотоніну (SNRI) або трициклічні антидепресанти (TCA), унаслідок небажаних явищ, пов'язаних зі сном, сексуальною сферою або з боку шлунково-кишкового тракту. У даному варіанті здійснення пацієнт, що підлягає лікуванню, раніше отримував інший лікарський засіб (або все ще продовжує отримувати його), застосування якого припинили або скоротили (або повинні були припинити або скоротити) внаслідок небажаних явищ, пов'язаних зі сном, сексуальною сферою 8 UA 105057 C2 5 10 15 20 25 30 35 40 45 50 55 60 або з боку шлунково-кишкового тракту. В одному варіанті здійснення пацієнтові, що підлягає лікуванню, був поставлений діагноз захворювання, від якого лікували вказаного пацієнта. Типова доза перорального складу знаходиться в діапазоні від приблизно 0,01 до приблизно 5 мг/кг маси тіла на добу, переважно від приблизно 0,01 до приблизно 1 мг/кг маси тіла на добу, яку вводять однією або декількома дозами, наприклад від 1 до 3 доз. Точна доза залежить від частоти і способу введення, статі, віку, маси тіла і загального стану суб'єкта, що підлягає лікуванню, природи і тяжкості стану, що підлягає лікуванню, і будь-яких супутніх захворювань, що підлягають лікуванню, і інших чинників, очевидних для фахівців в даній галузі. Завдяки низькому рівню небажаних явищ з боку шлунково-кишкового тракту при використанні композиції цього винаходу пацієнт може приймати збільшену кількість сполуки I, що тим самим підсилює терапевтичний ефект при збереженні рівня небажаних явищ на прийнятному рівні. Типова доза перорального складу для дорослих знаходиться в діапазоні 550 мг/добу сполуки I, як наприклад 5-40 мг/добу. Як правило, цього досягають введенням 5-50 мг, як, наприклад, 10-30 мг, як, наприклад, 5, 10, 15, 20, 25, 30 або 40 мг сполуки I одноразово або двічі на добу. У разі лікування дітей дозу можна зменшувати згідно з віком і/або масою тіла. Як застосовується в цьому описі, термін "терапевтично ефективна кількість" сполуки означає кількість, достатню для лікування, пом'якшення або часткового пригнічення клінічних проявів даного захворювання і його ускладнень при терапевтичній дії, що включає введення вказаної сполуки. Кількість, достатню для забезпечення цього, визначають як "терапевтично ефективна кількість". Цей термін також включає кількості, достатні для лікування, пом'якшення або часткового пригнічення клінічних проявів даного захворювання і його ускладнень при терапевтичній дії, що включає введення вказаної сполуки. Ефективні кількості для кожної мети залежать від тяжкості захворювання або пошкодження, а також від маси тіла і загального стану пацієнта. Зрозуміло, що визначення відповідної дози можна проводити із застосуванням рутинних досліджень, шляхом створення матриці значень і перевірки різних точок цієї матриці, що входить в звичайні навики навченого лікаря. Як застосовується в цьому описі, терміни "лікування" і "лікувати" означають ведення пацієнта і догляд за ним з метою боротьби із станом, таким як захворювання або порушення. Термін повинен включати повний спектр способів лікування для даного стану, від якого страждає пацієнт, таких як введення активної сполуки для пом'якшення симптомів або ускладнень, для затримки розвитку захворювання, порушення або стану, для пом'якшення або полегшення симптомів і ускладнень і/або для лікування або усунення захворювання, розладу або стану, а також для профілактики стану, де "профілактика" має на увазі ведення пацієнта і догляд за ним з метою боротьби із захворюванням, патологічним станом або розладом, і де вказана профілактика включає введення активної сполуки, для запобігання появі симптомів або ускладнень. При цьому профілактичний (превентивний) і терапевтичний (лікувальний) підходи в лікуванні є двома окремими аспектами цього винаходу. Пацієнт, що підлягає лікуванню, є переважно ссавцем, зокрема людиною. У одному варіанті здійснення цей винахід відноситься до застосування сполуки І для виготовлення композиції для перорального введення для лікування захворювання, вибраного з розладів настрою; великого депресивного розладу; генералізованого тривожного розладу; панічного розладу; посттравматичного стресового розладу; депресії, пов'язаної з когнітивними порушеннями, хворобою Альцгеймера або тривогою; депресії із залишковими симптомами; хронічного болю; розладу харчової поведінки або зловживання різними речовинами, де вказана композиція виготовлена так, що виключає вивільнення сполуки I в шлунку. У одному варіанті здійснення вказана композиція є пігулкою або композицію, що містить безліч частинок, що покриті pH-чутливим покриттям, таким як ентеросолюбільне покриття. У одному варіанті здійснення вказана композиція і, зокрема, вказана пігулка або композиція, що містить безліч частинок, виготовлена так, що вивільнення сполуки I має місце в тонкій кишці. У одному варіанті здійснення цей винахід відноситься до сполуки I для використання при лікуванні захворювання, вибраного з розладів настрою; великого депресивного розладу; генералізованого тривожного розладу; панічного розладу; посттравматичного стресового розладу; депресії, пов'язаної з когнітивними порушеннями, хворобою Альцгеймера або тривогою; депресії із залишковими симптомами; хронічного болю; розладу харчової поведінки або зловживання різними речовинами, де сполука I знаходиться у фармацевтичній композиції для перорального введення, яка виключає вивільнення сполуки I в шлунку. У одному варіанті здійснення вказана композиція і, зокрема, вказана пігулка або композиція, що містить безліч частинок, є пігулкою або композицією, яка містить безліч частинок, що покриті pH-чутливим покриттям, таким як ентеросолюбільне покриття. У одному варіанті здійснення вказана 9 UA 105057 C2 5 10 15 20 25 30 композиція і, зокрема, вказана пігулка або композиція, що містить безліч частинок, виготовлена так, що вивільнення сполуки I має місце в тонкій кишці. Всі посилання, включаючи публікації, патентні заявки і патенти, процитовані в цьому описі, включені в цей опис шляхом посилання в повному їх обсязі і в тому ступені, мовби для кожного посилання було вказано окремо і конкретно, що воно включено шляхом посилання і наведено в його повному обсязі в цьому описі (до максимального ступеня, що допускається законом), незалежно від будь-якого окремо наданого включення конкретних документів, зробленого будьде в цьому описі винаходу. Застосування форм однини і множини (застосування термінів з артиклями "a", "an" і "the") і подібних референтів в контексті опису цього винаходу слід тлумачити як такі, що охоплюють як форму однини, так і форму множини, якщо в цьому описі нема інших вказівок або якщо контекст явно не суперечить цьому. Наприклад, вираз "сполука" слід розуміти як вказівку на різноманітні сполуки цього винаходу або на конкретний описаний аспект, якщо нема інших вказівок. Якщо нема інших вказівок, всі точні значення, представлені в цьому описі, є репрезентативними для відповідних приблизних значень (наприклад, можна вважати, що всі приклади точних значень, представлені відносно конкретного чинника або вимірювання, також відносяться до відповідного приблизного значення, модифікованого за допомогою слова "приблизно", коли це доцільно). В цьому описі винаходу опис будь-якого аспекту або аспекту цього винаходу, зроблений із застосуванням термінів, таких як "що містить", "що має", "що включає" або "що охоплює" щодо елементу або елементів, призначений для підтвердження аналогічного аспекту або аспекту цього винаходу, зробленого із застосуванням термінів "що складається з", "що в основному складається з" або "що по суті є" щодо даного конкретного елементу або елементів, якщо інше не вказано в даному описі або безсумнівно суперечить контексту (наприклад, композицію, описану в даному винаході, як таку, що містить конкретний елемент, слід розуміти також як опис композиції, що складається з даного елементу, якщо інше не вказано в даному описі або безсумнівно суперечить контексту). Приклад 1. Форми для введення, профіль "концентрація в плазмі - час" і небажані явища Гідробромід 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину (сполуку I HBr) вводили здоровим добровольцям на 5-етапному перехресному дослідженні для вивчення профілю абсорбції і типу і тяжкості небажаних явищ. У випробуванні брали участь 23 суб'єкти (12 чоловіків і 11 жінок), але не всі 23 суб'єкти прийняли всі п'ять етапів лікування, унаслідок наявності суб'єктів, що залишили дослідження, див. детальніше нижче. 35 Режим A B C D E 40 45 50 99m 111 Мічена Tc-DTPA вода при t=0 годин і мічена In-DTPA вода при t=6 годин 20 мг сполуки I HBr, введених у вигляді єдиної пероральної дози з двох IR-пігулок по 99m 10 мг з міченою Tc-DTPA водою (t=0 годин) з наступною через 6 годин пост-дозою 111 (t=6 годин), міченою In-DTPA водою 9 мг сполуки I HBr у вигляді внутрішньовенної інфузії протягом 6 годин TM Розчин 20 мг сполуки I HBr, введений за допомогою капсули Enterion в 99m проксимальний відділ тонкої кишки з міченим Tc-DTPA напоєм TM Розчин 20 мг сполуки I HBr, введений за допомогою капсули Enterion в дистальний 99m відділ тонкої кишки з міченим Tc-DTPA напоєм. Проксимальний відділ тонкої кишки є приблизно першим метром порожньої кишки, а дистальний відділ тонкої кишки є приблизно останнім метром клубової кишки, включаючи термінальну клубову кишку аж до ілеоцекального з'єднання. TM Капсула Enterion дозволяє здійснити націлену доставку активної речовини в будь-яку ділянку шлунково-кишкового тракту. Капсула містить резервуар лікарського засобу і окремий відсік для радіоактивного індикатора. Дно резервуара діє як поршень, який утримується проти дії пружини полімерною ниткою. За допомогою гамма-сцинтиграфії (технологія візуалізації) в реальному часі може бути визначене точне розташування капсули в шлунково-кишковому тракті. Коли капсула досягла бажаного розташування в шлунково-кишковому тракті, тоді прикладають магнітне поле, яке викликає неухильне нагрівання антени в капсулі. Нагріта антена знаходиться у контакті з полімерною ниткою, яка розм'якшується і, кінець кінцем, розривається, що звільняє поршень (дно резервуара) і швидко вивільняє лікарський засіб. TM Капсула Enterion доступна від Partner Tech, Великобританія. Зразки крові отримували через рівні проміжки часу в 240 годин після введення дози IR 10 UA 105057 C2 TM 5 пігулки, після початку інфузії і після активації капсули Enterion . Дані зразки потім аналізували для отримання профілю "концентрація в плазмі - час" для сполуки I HBr. Крім того, реєстрували небажані явища. Їжу (суп) давали через 4 години після введення дози, а обід - через 10 годин після введення дози. Усі 23 суб'єкти отримували лікування A і B; 22 суб'єкти отримували лікування C; 20 суб'єктів отримували лікування D і 19 суб'єктів отримували лікування E. У наведеній нижче таблиці узагальнені небажані явища, зареєстровані в ході проведення даного випробування. Небажане явище Нудота Блювота Позиви до блювоти Часте рідке випорожнення/діарея Біль в животі Запаморочення/ постуральне запаморочення (без падіння кров'яного тиску) Постуральна гіпотензія Головний біль Втома Висип Свербіння Тести, що вказують на порушення функції печінки Режим B Режим C Режим D Режим E (число суб'єктів) (число суб'єктів) (число суб'єктів) (число суб'єктів) 9 1 3 2 2 1 1 6 1 2 3 2 1 1 5 1 2 2 3 2 1 1 3 1 1 1 10 15 20 25 Наведені вище дані ясно вказують, що кількість небажаних явищ, і, зокрема, небажаних явищ з боку шлунково-кишкового тракту, залежить від лікарської форми для введення і конкретніше від того, де вивільняється сполука I. Більшість небажаних явищ відбуваються в режимі B, тобто при введенні сполуки I в IR-пігулці. Помітно менше число небажаних явищ відбувається в режимах C, D і E, тобто коли сполуку I введено внутрішньовенною інфузією і вивільнено в проксимальному або дистальному відділах тонкої кишки, відповідно. З цих даних можна з очевидністю зробити висновок, що введення сполуки I, при якому уникається вивільнення в шлунку, таке як внутрівенне введення або з вивільненням сполуки I в тонкій кишці (наприклад, з використанням пігулки з ентеросолюбільним покриттям або композиції, що містить безліч частинок з ентеросолюбільним покриттям), пов'язано з меншими небажаними явищами. Профілі "концентрація в плазмі - час" зображені на фіг. 1. З цих даних ясно, що плазмовий профіль сполуки I фактично не залежить від того, чи введено сполуку І в IR-пігулці, чи вивільняється вона в тонкій кишці. Внутрівенна інфузія сполуки I також дає схожий плазмовий профіль. Приклад 2. Пігулка з набухаючою матрицею з модифікованим вивільненням на основі гідроколоїдної матриці з HPMC (гідроксипропілметилцелюлози) Речовина Сполука I Avicel PH200 (мікрокристалічна целюлоза) Metolose 90SH100SR (гідроксипропілметилцелюлоза) Маніт Стеарат магнію 30 мг 30 118,7 70 30 1,3 250 % 12,0 47,5 28,0 12,0 0,5 100 Сполуку I в кількості 240 г змішують з 950 г Avicel PH200 (мікрокристалічна целюлоза), 560 г Metolose 90SH100SR і 240 г маніту протягом 3 хвилин в змішувачі Turbula. Після цього домішують протягом 0,5 хвилини 10,4 г стеарату магнію в змішувачі Turbula. Пігулки діаметром 8 мм з компаундною формою пресують в одноштамповій таблетувальній машині Korsch EK0. Твердість пігулок 85 Н. 11 UA 105057 C2 5 Приклад 3. Пігулка з набухаючою матрицею з модифікованим вивільненням на основі гідроколоїдної матриці з HPMC (гідроксипропілметилцелюлози), що включає ентеросолюбільне покриття (акриловий полімер) Пігулки з Прикладу 2 покриті ентеросолюбільним покриттям на основі рецептури для нанесення покриття згідно з наступною композицією. Речовина Eudragit L30D-55 (сополімер метакрилової кислоти - етилакрилату (1:1) у водній суспензії латексу) Очищена вода Триетилцитрат Симетиконова антиспінювальна емульсія Тальк (тонкопомелений) 10 15 20 30 35 40 40 52 1,8 0,2 6 Суспензію для нанесення покриття отримують змішуванням триетилцитрату, антиспінювальної емульсії і очищеної води в апараті Ultra Turrax при 9500 об./хв. протягом 10 хвилин. Через 1 хвилину додають тальк. Суспензію Eudragit додають потім при легкому перемішуванні і в кінці суспензію пропускають через сито 0,3 мм. У судині, що обертається, з отворами (CombuLab) наносять покриття на 1,2 кг пігулок. Температура вхідного повітря 40 °C, 3 500 м /годину. Температура випускного повітря 33 °C. Швидкість розпилювання 8-10 г/хв. Тиск розпилювання: 2 бар. Нанесення покриття продовжують до тих пір, поки збільшення маси не досягне 8 % через приблизно 1 годину. Приклад 4. Композиція, що містить безліч частинок, на основі гранул, що мають ентеросолюбільне покриття Сполуку I нашаровують на гранули плацебо (сфери MCC, Celphere CP-203) у вигляді суспензії лікарського засобу. Композиція гранул, покритих шаром лікарського засобу, є наступною. Речовина Сполука I Celphere-203 (гранули, утворені мікрокристалічною целюлозою, діаметр 250 мкм) PVP 30 (полівінілпіролідон) 25 % мг 30 300 10 340 % 8,8 88,2 2,9 100 Водну суспензію сполуки I з PVP 30 як зв'язувальним агентом при співвідношенні вода/лікарський засіб/PVP, що становить 85/11,25/3,75, розпилюють на 1,76 кг гранул в апараті з псевдозрідженим шаром Aeromatic MP-1, використовуючи вставку Вурстера. Температура 3 вхідного повітря 60-70 °C, 80 м /годину. Температура випускного повітря 35-45 °C. Швидкість розпилювання 10-15 г/хв. протягом 2 годин. Тиск розпилювання: 1 бар. На гранули, покриті шаром лікарського засобу, потім наносять ентеросолюбільне покриття з Прикладу 3. У апарат з псевдозрідженим шаром Aeromatic MP-1 завантажують 2 кг гранул, 3 використовуючи вставку Вурстера. Температура вхідного повітря 60 °C, 90 м /годину. Температура випускного повітря 30 °C. Швидкість розпилювання 10-15 г/хв. Тиск розпилювання: 1 бар. Нанесення покриття продовжують до тих пір, поки збільшення маси не досягне 20 % через приблизно 2,5 години. Гранулами, покритими ентеросолюбільним покриттям, наповнюють тверді желатинові капсули. Приклад 5. Композиція відстроченого вивільнення у 30 мг на основі пігулок з ядрами, покритими ентеросолюбільним покриттям Спочатку виготовляли гранули шляхом змішування, гранулювання і висушування в апараті з псевдозрідженим шаром Aeromatic MP-1. Водну суспензію 6 % (мас./мас.) Klucel EXF розпилювали на 26500 г суміші (сполука I HBr, маніт 50c, Avicel PH 101 і натрій-крохмаль гліколят (тип A)). Речовина Сполука I HBr Маніт 50c Avicel PH 101 (мікрокристалічна целюлоза, розмір частинок ~70 мкм) Primojel (натрій-крохмаль гліколят) Klucel EXF (гідроксипропілцелюлоза) Стеарат магнію 12 мг 38,13 195,87 45,00 9 9 3 % 12,71 65,29 15 3 3 1 UA 105057 C2 3 5 Температура вхідного повітря 60 °C, 500 м /годину. Температура випускного повітря 26 °C. Швидкість розпилювання 500-700 г/хв. Тиск розпилювання: 3 бар. Після цього гранули висушували до отримання відносної вологості продукту гранулювання 25-55 % RH: температура 3 вхідного повітря: 60 °C, 500 м /годину. Потім отримані гранули пропускали через екран 1,5748 мм і змішували з 1500 г Avicel PH 101 і 900 г Klucel EXF в змішувачі Bohle (8 хв., 7 об./хв.). Потім додавали 300 г стеарату магнію і суміш перемішували протягом 3 хвилин із швидкістю 7 об./хв. Використовуючи прес Korsch, обладнаний пуансонами 9 мм, суміш пресували в ядра пігулок. Потім на пігулки наносили ентеросолюбільне покриття з використанням рецептури для нанесення плівкового покриття згідно з наступною композицією. 10 Речовина ACRYL-EZE (сополімер метакрилової кислоти - етилакрилату (1:1) у водній суспензії латексу) Очищена вода Триетилцитрат Симетиконова антиспінювальна емульсія 15 20 40 52 1,8 0,2 Суспензію для нанесення покриття отримували змішуванням триетилцитрату, антиспінювальної емульсії і очищеної води в судині змішувача. Після цього додавали суспензію ACRYL-EZE при легкому перемішуванні і наприкінці суспензію пропускали через сито 0,3 мм. У судині, що обертається, з отворами (CombuLab) наносили покриття на 1,2 кг пігулок. 3 Температура вхідного повітря 40 °C, 500 м /годину. Температура випускного повітря 33 °C. Швидкість розпилювання 8-12 г/хв. Тиск розпилювання: 2 бар. Нанесення покриття продовжували до тих пір, поки збільшення маси не досягало 12 % через приблизно 90 хвилин. При проведенні вищеописаного тесту на розчинення покриті пігулки мали наступний профіль розчинення. Час % Вивільнення 25 % Стадія 1 2 години 0 +10 хв. 0 +20 хв. 47 Стадія 2 +30 хв. 77 +45 хв. 88 +60 хв. 91 Сполуку I аналізували з використанням системи HLPC, обладнаною колонкою Symmetry Shield RP18, 2,1 × 20 мм ID, 3,5 мкм. Рухома фаза була 20 мМ ацетатний буфер з pH 4,8/ацетонітрил (72/25). Витрата потоку 2,0 мл/хв, детектування в УФ-детекторі при 226 нм. ФОРМУЛА ВИНАХОДУ 30 35 40 45 50 1. Фармацевтична композиція для перорального введення, яка містить сполуку 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазин і його фармацевтично прийнятні кислотно-адитивні солі (сполука І), де вказана композиція виготовлена так, щоб виключити вивільнення вказаної сполуки в шлунку. 2. Композиція за п. 1, де вказана композиція являє собою композицію уповільненого вивільнення. 3. Композиція за п. 1, де вказана композиція являє собою композицію відстроченого вивільнення. 4. Композиція за п. 3, де вказана композиція містить рН-чутливе покриття. 5. Композиція за п. 4, де дана композиція являє собою пігулку з ентеросолюбільним покриттям. 6. Композиція за п. 4, де дана композиція являє собою композицію, що містить безліч частинок, в якій по суті кожна частинка покрита ентеросолюбільним покриттям. 7. Композиція за п. 1, де дана композиція являє собою пігулку, що містить сполуку І, маніт, мікрокристалічну целюлозу, натрію крохмальгліколят, гідроксипропілцелюлозу і стеарат магнію, де дана пігулка покрита співполімером метакрилової кислоти і етилакрилату (1:1). 8. Композиція за будь-яким з пп. 1-7, в якій сполука І являє собою 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазин НВr в кількості 1-50 мг. 9. Спосіб лікування захворювання, вибраного з розладів настрою; великого депресивного розладу; генералізованого тривожного розладу; панічного розладу; посттравматичного стресового розладу; депресії, пов'язаної з когнітивними порушеннями, хворобою Альцгеймера або тривогою; депресії із залишковими симптомами; хронічного болю; розладу харчової поведінки або зловживання різними речовинами, причому вказаний спосіб передбачає 13 UA 105057 C2 5 10 15 введення терапевтично ефективної кількості фармацевтичної композиції за будь-яким з пп. 1-8 пацієнтові, що потребує цього. 10. Застосування 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину і його фармацевтично прийнятних кислотно-адитивних солей для виробництва фармацевтичної композиції для перорального введення для лікування захворювання, вибраного з розладів настрою; великого депресивного розладу; генералізованого тривожного розладу; панічного розладу; посттравматичного стресового розладу; депресії, пов'язаної з когнітивними порушеннями, хворобою Альцгеймера або тривогою; депресії із залишковими симптомами; хронічного болю; розладу харчової поведінки або зловживання різними речовинами, де вказана фармацевтична композиція являє собою пігулку або композицію, що містить безліч частинок, що покриті ентеросолюбільним покриттям. 11. Застосування за п. 10, де вказана композиція виготовлена так, що вивільнення сполуки І має місце в тонкій кишці. 12. Застосування за будь-яким з пп. 10, 11, де вказана композиція містить 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазин НВr в кількості 1-50 мг. Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Назва патенту англійськоюNew compositions of 1-[2-(2,4-dimethyl-phenylsulfanyl)-phenyl]piperazine
Автори англійськоюHojer, Astrid Maria, Drewes, Pernille, Gundorf, Kateb, Jens
Автори російськоюХёер Астрид Мария, Древис Пернилле Гуннорф, Катеб Йенс
МПК / Мітки
МПК: A61K 9/50, A61K 9/20, A61K 31/495, A61K 9/16, A61P 25/00, A61K 9/28
Мітки: 1-[2-(2,4-диметилфенілсульфаніл)феніл]-піперазину, композиція
Код посилання
<a href="https://ua.patents.su/16-105057-kompoziciya-1-2-24-dimetilfenilsulfanilfenil-piperazinu.html" target="_blank" rel="follow" title="База патентів України">Композиція 1-[2-(2,4-диметилфенілсульфаніл)феніл]-піперазину</a>
Попередній патент: Контейнер великого об’єму для бітуму
Наступний патент: Фармацевтична композиція у формі таблеток з імуностимулюючою дією
Випадковий патент: Спосіб прогнозування розвитку запальних ускладнень після сфінктерозберігаючих операцій у хворих раком прямої кишки