2,4-дисульфоніл-5-циклоамінозаміщені тіазоли і їх застосування як антиракових препаратів
Номер патенту: 109165
Опубліковано: 27.07.2015
Автори: Василенко Олександр Миколайович, Туров Костянтин Володимирович, Бабій Сергій Богданович, Виноградова Тетяна Костянтинівна, Зябрєв Володимир Стефанович, Броварець Володимир Сергійович
Формула / Реферат
2,4-Дисульфоніл-5-циклоамінозаміщені тіазоли загальної формули А або їх солі, що придатні для застосування як антиракових препаратів:
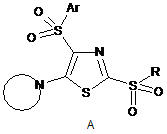 ,
,
де
![]()
![]()
![]()
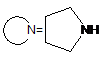 ,
, 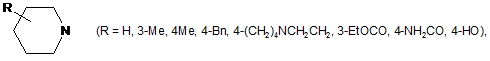
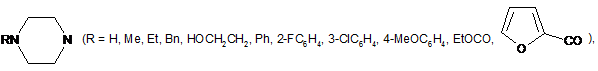
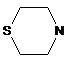 ,
, 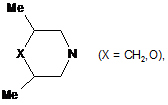 ,
, 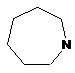 ,
,  ,
, 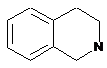 .
.
Текст
Реферат: Винахід належить до області синтезу органічних речовин та фармацевтичних препаратів. Предметом його є похідні тіазолу загальної формули А і їх солі, які можуть бути використані як протиракові засоби. UA 109165 C2 (12) UA 109165 C2 Ar O O S N N S A S R O O Описано новий спосіб отримання сполук А на основі 3-(арилсульфоніл)-1,1,4,4-тетрахлор-2азабута-1,3-дієнів і 1-(арилсульфоніл)-2,2-дихлоретенілізотіоціанату. Показано in vitro, що тіазоли А проявляють антиракову активність з параметром GI50 в мікромолярному діапазоні. r OA S O N N S A R S O O UA 109165 C2 Винахід належить до області синтезу органічних речовин та фармацевтичних препаратів. Предметом його є похідні тіазолу загальної формули А і їх солі, які можуть бути використані як протиракові засоби. Ar O S O N N R S S O O A Ar = p-MeC6H4, p-ClC6H4; 5 NCH2CH2, cyclo-C6H11, Ph, p-MeC6H4, p-ClC6H4; R = Me, Et, Pr, Bn, HOCH2CH2, NH N= , R N (R = H, 3-Me, 4Me, 4-Bn, 4-(CH2)4NCH2CH2, 3-EtOCO, 4-NH2CO, 4-HO), N (R = H, Me, Et, Bn, HOCH 2CH2, Ph, 2-FC6H4, 3-ClC6H4, 4-MeOC6H4, EtOCO, RN CO ), O 10 Me X S N O (X = CH2,O), N N N N O 15 , Me , , , . Серед органічних речовин, структури яких включають тіазольний цикл з сульфонільною групою в положенні 2, відомі сполуки Б і В як селективні інгібітори ізоформи р110 кінази РI3, що мають протипухлинні властивості. Сполука Б пригнічує ріст ракових клітин ліній A375 і HeLa [1], а сполука В - ліній NZB5 і NZOV9 [2]. N N NO2 NO2 N N Cl N HCl S Б 20 N Br S O O S Me S O O B , Про сполуки з 4-сульфонілзаміщеним тіазольним циклом, що виявляють антиракову активність, повідомлень немає. Відсутні також публікації, що містять відомості про будь-які фармакологічні властивості похідних тіазолу з двома сульфонільними групами. Відомим є метод синтезу двох аналогів сполук А, заснований на циклізації 1-тозил-2,2дихлороетенілізотіоціанату з бензилмеркаптаном або n-тіокрезолом в присутності піридину (схема 1) [3]. Недоліком цього методу є необхідність роботи з меркаптанами, що особливо незручно при введенні в положення 2 тіазольного кільця нижчих алкілсульфонільних груп. 1 UA 109165 C2 Ts Ts C Cl Ts S N RSH, Py N Cl SR S Cl N H 2 O2 Cl O(CH2CH2)2NH SO2R S Ts N N O R=Bn, p-MeC6H4 SO2R S Схема 1 5 10 В основі даного винаходу лежить універсальний спосіб отримання сполук з протипухлинними властивостями загальної формули А, що включає три підходи, представлених на схемі 2. Для їх реалізації спочатку синтезуються ациклічні реагенти 1-5, ключовими з яких є хлоровмісні 2-азабута-1,3-дієни 4 і вінілізотіоціанати 5. Суть нового методу синтезу гетероциклічних прекурсорів сполук А полягає в циклоконденсації реагентів 4 або 5 з сульфідом натрію в мольному співвідношенні, відповідно, 1:2 або 1:1, що приводить до натрієвих солей 2меркаптотіазолів 6. Останні при дії алкіл- або бензилгалогенідів дають сполуки 7. Ті ж похідні тіазолу 7, які містять в положенні 2 циклогексил- або арилтіогрупи зручніше отримувати безпосередньо із ізотіоціанатів 5. Для окиснення 7→8 використовується, як правило, надлишок пероксиду водню в оцтовій кислоті, а для нуклеофільного заміщення 8→А - два еквіваленти аміну. O Cl Cl N H Cl ArSO2 Cl ArSO2+M H Cl Cl 1 ArSO2 Cl Cl Cl Cl 2 Cl ArSO2 Cl N Et3N Cl Cl N (H2N)2CS S 6 SNa Cl Na2S 5 Base ArSO2 N RHlg S N Cl RSH ArSO2 N C Cl 4 2Na2s ArSO2 ArSO2 Cl Cl 3 Cl PCl5 H N H Cl Cl O [O] SR S NH N Cl S 8 7 SO2R ArSO2 N N S SO2R A Схема 2 15 20 Тестування сполук A in vitro показало, що деякі з них проявляють виражену антиракову активність з концентраційним параметром GI50 в мікромолярному діапазоні стосовно 60 ліній ракових клітин людини. Винахід підтверджується наведеними нижче прикладами. 1. Синтез сполук А 2-(Метилсульфоніл)-5-(піролідин-1-іл)-4-тозилтіазол (A1). 2 UA 109165 C2 Ts N N 5 10 15 20 25 30 Ms S 1. 2-(Метилтіо)-4-тозил-5-хлоротіазол (7а). Метод А. До суспензії 151,31 г (0,63 моль) наногідрата сульфіду натрію в 300 мл етанолу додавали порціями 104,11 г (0,30 моль) 3-тозил-1,1,4,4-тетрахлор-2-азабута-1,3-дієн (4а) [4] при охолодженні до 5-10 °C і перемішуванні протягом 1 год. Суміш перемішували ще 3 год., а потім додавали до неї по краплях 20,55 мл (0,33 моль) метилйодиду при 8-10 °C протягом 2,5 год. Реакційну суміш розбавляли 300 мл води, декантували, до смолоподібного залишку додавали 60 мл ізопропанолу і після закінчення кристалізації сполуку 7а відфільтровували; вихід 70 % (66,81 г). Метод Б. До суспензії 47,32 г (197 ммоль) наногідрату сульфіду натрію в 200 мл етанолу додавали порціями 56,74 г (184 ммоль) 1-тозил-2,2-дихлороетенілізотіоціанат (5а) [4] при охолодженні до 5-10 °C і перемішуванні протягом 1 год. Суміш перемішували ще 2 год., а потім додавали до неї по краплях розчин 12,58 мл (202 ммоль) метилйодиду в 20 мл етанолу при 1015 °C протягом 2,5 год. Реакційну суміш розбавляли 300 мл води і сполуку 7а відфільтровували; вихід 99 % (58,06 г). 1 Безбарвні кристали, Тпл. 98 °C (МеОН) [3 (Тпл. 94-95 °C)]. Спектр ЯМР Н (400 МГц, ДМСОd6), , м. ч.: 2,41 (с, 3Н), 2,65 (с, 3Н), 7,49 (д, J=8,2 Гц, 2Н), 7,87 (д, J=8,2 Гц, 2Н). 2. 2-(Метилсульфоніл)-4-тозил-5-хлоротіазол (8а). До суспензії 13,97 г (43,7 ммоль) сполуки 7а в 45 мл оцтової кислоти додавали 12 мл 35 %-ного водного розчину пероксиду водню, суміш нагрівали до кипіння 1 год., потім додавали до неї ще 6 мл 35 %-ного водного розчину пероксиду водню, кип'ятили 0,5 год., охолоджували до кімнатної температури і відфільтровували осад сполуки 8а; вихід 89 % (13,70 г). Безбарвні кристали, Тпл. 179 °C 1 (AcOEt). Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 2,46 (с, 3Н), 3,33 (с, 3Н), 7,38 (д, J=8,4 Гц, 2Н), 7,96 (д, J=8,4 Гц, 2Н). 3. Суміш 1,58 г (4,5 ммоль) сполуки 8а і 0,83 мл (10 ммоль) піролідину в 30 мл ацетонітрилу кип'ятили 2 год., розчин охолоджували до кімнатної температури, осад, що утворився, відфільтровували, промивали водою і отримували 1,28 г (74 %) сполуки А1. З фільтрату розчинник видаляли у вакуумі, залишок промивали ізопропанолом і отримували додатково 0,19 1 г сполуки А1; загальний вихід 85 %. Безбарвні кристали, Тпл. 212 °C розкл. Спектр ЯМР Н (400 МГц, ДMCO-d6), , м. ч.: 2,01 (т, J=6,5 Гц, 4Н), 2,41 (с, 3Н), 3,24 (с, 3Н), 3,54 (т, J=6,5 Гц, 4Н), 7,43 (д, J=8.1 Гц, 2Н), 7,78 (д, J=8.3 Гц, 2Н). 5-(4-Бензилпіперідин-1-іл)-2-(метилсульфоніл)-4-тозилтіазол (А2). Ts N N Ms S Bn 35 Сполуку А2 отримували з 1,06 г (3,0 ммоль) сполуки 8а (див. приклад А1) і 1,16 мл (6,6 ммоль) 4-бензилпіперидину подібно сполуці А1; вихід 95 % (1,39 г). Безбарвні кристали, Тпл. 1 142 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,31-1,47 (м, 2Н), 1,62-1,80 (м, 3Н), 2,41 (с, 3Н), 2,58 (д, J=7,0 Гц, 2Н), 2,99 (т, J= 11,3 Гц, 2Н), 3,30 (с, 3Н), 3,64 (д, J=12,0 Гц, 2Н), 7,17-7,24 (м, 3Н), 7,28-7,34 (м, 2Н), 7,44 (д, J= 8.0 Гц, 2Н), 7,80 (д, J=8.3 Гц, 2Н). 2-(Метилсульфоніл)-4-тозил-5-(4-фенілпіперазин-1-іл)тіазол (A3). Ts N N Ph 40 N S Ms Сполуку A3 отримували з 1,23 г (3,5 ммоль) сполуки 8а (див. приклад А1) і 1,18 мл (7,7 ммоль) 1-фенілпіперазину подібно сполуці А1; вихід 85 % (1,42 г). Кремовий порошок, Тпл. 3 UA 109165 C2 167 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,39 (с, 3Н), 3,29-3,32 (м, 4Н), 3,32 (с, 3Н), 3,43-3,54 (м, 4Н), 6,82 (т, J=7,2 Гц, 1Н), 6,99 (д, J=8.5 Гц, 2Н), 7,24 (т, J=7,9 Гц, 2Н), 7,45 (д, J=8.2 Гц, 2Н), 7,84 (д, J= 8.2 Гц, 2Н). 5-(3,4-Дигідроізохінолін-2(1H)-іл)-2-(метилсульфоніл)-4-тозилтіазол (А4). 1 Ts N N 5 10 Ms S Суміш 1,23 г (3,5 ммоль) сполуки 8а (див. приклад А1), 0,48 мл (3,8 ммоль) 1,2,3,4тетрагідроізохіноліну і 0,49 мл (3,5 ммоль) триетиламіну у 8 мл етанолу кип'ятили 1 год., розчин охолоджували до кімнатної температури, осад, що утворився сполуки А4, відфільтровували; 1 вихід 86 % (1,35 г). Безбарвні кристали, Тпл. 143 °C (MeCN). Спектр ЯМР Н (400 МГц, ДМСOd6), , м. ч.: 2,40 (с, 3Н), 3,03 (т, J=5,7 Гц, 2Н), 3,31 (с, 3Н), 3,76 (т, J=5,8 Гц, 2Н), 4,55 (с, 2Н), 7,14-7,19 (м, 1Н), 7,21-7,26 (м, 3Н), 7,44 (д, J=8.1 Гц, 2Н), 7,83(д, J=8.3Гц, 2Н). 5-(Піролідин-1-іл)-2-(пропілсульфоніл)-4-тозилтіазол (А5). Ts N N 15 20 25 30 SO2Pr S 1. 2-(Пропілсульфоніл)-4-тозил-5-хлоротіазол (86). До розчину 47,44 г (198 ммоль) наногідрата сульфіду натрію в 250 мл метанолу додавали порціями 57,94 г (188 ммоль) 1-тозил2,2-дихлороетенілізотіоціанату (5а) [4] при охолодженні до 5-10 °C і перемішуванні протягом 1,5 год. Реакційну суміш перемішували ще 2 год., а потім додавали до неї по краплях розчин 19.08 мл (210 ммоль) пропілброміду в 20 мл метанолу при 10-15 °C протягом 2,5 год. Суміш розбавляли 400 мл води, декантували. Смолоподібний органічний залишок розчиняли в 200 мл оцтової кислоти, розчин нагрівали до 80-100 °C і додавали до нього порціями 110 мл 33 %-ного водного розчину пероксиду водню, підтримуючи екзотермічну реакцію, протягом 1,5 год. Реакційну суміш кип'ятили ще 1 год., потім охолоджували до кімнатної температури і відфільтровували осад сполуки 86; вихід 59 % (42,14 г). Безбарвні кристали, Тпл. 114 °C. Спектр 1 ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,92 (т, J= 7,4 Гц, 3Н), 1,66 (м 2Н), 2,43 (с, 3Н), 3,50-3,68 (м, 2Н), 7,52 (д, J=7,9 Гц, 2Н), 7,91 (д, J=8.0 Гц, 2Н). 2. Сполуку А5 отримували з 1,71 г (4,5 ммоль) сполуки 8б і 0,83 мл (10 ммоль) піролідину 1 подібно сполуки А1; вихід 81 % (1,51 г). Безбарвні кристали, Тпл. 153 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,82 (т, J=7,3 Гц, 3Н), 1,33-1,52 (м, 2Н), 1,93-2,09 (м, 4Н), 2,41 (с, 3Н), 13 3,25-3,31 (м, 2Н), 3,48-3,63 (м, 4Н), 7,45 (д, J=8.0 Гц, 2Н), 7,78 (д, J=8,0 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,80, 16,60, 21,54, 26,55, 56,31, 56,70, 127,91, 128,73, 130,17, 139,60, 142,46, 144,47, 159,85. 5-(Піперидин-1-іл)-2-(пропілсульфоніл)-4-тозилтіазол (А6). Ts N N 35 40 S SO2Pr Суміш 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,76 мл (7,7 ммоль) піперидину у 8 мл етанолу кип'ятили 2 год., розчин охолоджували до кімнатної температури, осад, що утворився сполуки А6, відфільтровували; вихід 76 % (1,14 г). Безбарвні кристали, Тпл. 111 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,77 (т, J=7,3 Гц, 3Н), 1,28-1,43 (м, 2Н), 1,51-1,63 (м, 2Н), 1,63-1,77 (м, 4Н), 2,41 (с, 3Н), 3,25-3,32 (м, 2Н), 3,35-3,42 (м, 4Н), 7,45 (д, J=8,0 Гц, 2Н), 7,79 13 (д, J=8,0 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,74, 16,52, 21,56, 22,97, 25,18, 56,08, 56,90, 128,13, 130,19, 134,26, 138,39, 144,97, 148,31,164,45. 4 UA 109165 C2 Амід 1-(2-(пропілсульфоніл)-4-тозилтіазол-5-іл)піперидин-4-карбонової кислоти (А7). Ts N N O SO2Pr S H 2N 5 10 Суміш 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5), 0,47 г (3,7 ммоль) аміду піперидин-4карбонової кислоти, 0,72 мл (5,2 ммоль) триетиламіну у 30 мл ацетонітрилу кип'ятили 2 год., розчин охолоджували до кімнатної температури, осад, що утворився, відфільтровували, промивали етанолом і отримували 1,02 г (62 %) сполуки А7. З фільтрату розчинник видаляли у вакуумі, до маслоподібного залишку додавали для кристалізації етанол і відфільтровували додатково 0,22 г сполуки А7; загальний вихід 75 %. Безбарвний порошок, 1 Тпл. 166 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,78 (т, J=7,4 Гц, 3Н), 1,29-1,45 (м, 2Н), 1,69-1,92 (м, 4Н), 2,29-2,43 (м, 4Н), 3,14 (т, J=11,3 Гц, 2Н), 3,26-3,30 (м, 2Н), 3,72 (д, J= 11,8 Гц, 2Н), 6,87 (с, 1Н), 7,36 (с, 1Н), 7,46 (д, J= 8,1 Гц, 2Н), 7,80 (д, J=8.1 Гц, 2Н). Спектр 13 ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,73, 16,52, 21,56, 28,11, 55,59,56,07, 128,14, 130,22, 134,53, 138.32, 145,03, 148,06, 148,67, 164,19, 176,06. 5-(Піперазин-1 -іл)-2-(пропілсульфоніл)-4-тозилтіазол (А8). Ts N N 15 20 SO2Pr S HN Сполуку А8 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,66 г (7,7 ммоль) піперазину подібно сполуки А6; вихід 68 % (1,02 г). Безбарвні кристали, Тпл. 153 °C. ІЧ спектр -1 1 (KBr), , см : 3319 (NH). Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,78 (т, J= 7,4 Гц, 3Н), 1,301,46 (м, 2Н), 2,41 (с, 3Н), 2,82-2,91 (м, 4Н), 3,29-3,32 (м, 6Н), 7,46 (д, J=8,3 Гц, 2Н), 7,80 (д, J=8,3 13 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,74, 16,51, 21,57, 45,16, 56,06, 56,69, 128,19, 130,22, 134,59, 138,25, 145,04, 148,90, 164,46, Знайдено, %: N - 10,03, S - 22,76, С17Н23N3О4S3. Обчислено, %: N - 9.78, S - 22. 5-(4-Метилпіперазин-1-іл)-2-(пропілсульфоніл)-4-тозилтіазол (А9). Ts N N Me 25 30 N SO2Pr S Сполуку А9 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,91 мл (7,7 ммоль) 1-метилпіперазин подібно сполуці А6; вихід 84 % (1,30 г). Кремові кристали, Тпл. 147 °C. 1 Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,79 (т, J=7,4 Гц, 3Н), 1,31-1,47 (м, 2Н), 2,25 (с, 3Н), 2,41 (с, 3Н), 3,29-3,31 (м, 6Н), 3,38-3,45 (м, 4Н), 7,46 (д, J=7,9 Гц, 2Н), 7,80 (д, J=8,0 Гц, 2Н). 13 Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,74, 16,52, 21,57, 45,89, 53,98, 55,36, 56,05, 128,19, 130,24, 135,12, 138,16, 145,11, 149,41, 164,02. 2-(4-(2-(Пропілсульфоніл)-4-тозилтіазол-5-іл)піперазин-1-іл)етанол (А10). Ts N N HO N S SO2Pr Сполуку А10 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,94 мл (7,7 ммоль) 2-(піперазин-1-іл)етанолу подібно сполуці А6; вихід 64 % (1,06 г). Безбарвні кристали, 5 UA 109165 C2 Тпл. 90 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,78 (т, J=7,4 Гц, 3Н), 1,31-1,46 (м, 2Н), 2,41 (с, 3Н), 2,45-2,50 (м, 2Н), 2,59-2,67 (м, 4Н), 3,29-3,33 (м, 2Н), 3,38-3,43 (м, 4Н), 3,54 (к, J=5,5 13 Гц, 2Н), 4,48 (т, J=5,3 Гц, 1Н), 7,46 (д, J=8.1 Гц, 2Н), 7,80 (д, J=8.2 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,74, 16,51, 21,57, 52,53, 55,49, 56,06, 59,02, 60,26, 128,19, 130,24, 135,04, 138,18, 145,1, 149,33, 164,03. 4-(2-(Пропілсульфоніл)-4-тозилтіазол-5-іл)тиоморфолін (A11). 1 5 Ts N N 10 SO2Pr S S Сполуку A11 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,77 мл (7,7 ммоль) тиоморфоліну подібно сполуці А6; вихід 86 % (1,34 г). Безбарвні кристали, Тпл. 149 °C. 1 Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,79 (т, J=7,4 Гц, 3Н), 1,33-1,45 (м, 2Н), 2,41 (с, 3Н), 3,32-3,33 (м, 2Н), 3,38-3,43 (м, 4Н), 3,73-3,84 (м, 4Н), 7,46 (д, J=8,0 Гц, 2Н), 7,82 (д, J= 8,0 Гц, ІЗ 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 12,73, 16,53, 21,58, 55,29, 56,02, 65,79, 128.24, 130,28, 135,61, 138.03, 145,21, 150,11, 164,09. 2,6-Диметил-4-(2-(пропілсульфоніл)-4-тозилтіазол-5-іл)морфолін (А12). Ts N Me N 15 20 SO2Pr S O Me Сполуку A12 отримували з 1,33 г (3,5 ммоль) сполуки 8б (див. приклад А5) і 0,95 мл (7,7 ммоль) 2,6-диметилморфоліну подібно сполуці А6; вихід 88 % (1,41 г). Безбарвні кристали, Тпл. 1 121 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 0,80 (т, J=7,4 Гц, 3Н), 1,13 (д, J=6,2 Гц, 6Н), 1,35-1,46 (м, 2Н), 2,41 (с, 3Н), 2,78 (т, J=11,2 Гц, 2Н), 3,63 (д,.J= 11,3 Гц, 2Н), 3,70-3,86 (м, 2Н), ІЗ 7,47 (д, J=8,0 Гц, 2Н), 7,80 (д, J=8,0 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , 5, м. ч.: 12,74, 16,55, 18,72, 21,57, 56,05, 59,96, 70,96, 119,40, 128,11, 130,31, 135,02, 138,16, 145,18, 163,51. 2-(Бензилсульфоніл)-5-(4-метилпіперидин-1-іл)-4-тозилтіазол (А13). Ts N N S SO2Bn Me 25 30 35 1. 2-(Бензилтіо)-4-тозил-5-хлоротіазол (7в). Сполуку 7в отримували з 18,49 г (60 ммоль) 1тозил-2,2-дихлороетенілізотіоціанату (5а), 15,13 г (63 ммоль) наногідрата сульфіду натрію і 7,49 мл (63 ммоль) бензилброміду подібно сполуці 7а (див. приклад А1); вихід 91 % (21,72 г). 1 Безбарвні кристали, Тпл. 86 °C (МеОН) [3 (Тпл. 69-70 °C)]. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,42 (с, 3Н), 4,43 (с, 2Н), 7,19-7,35 (м, 5Н), 7,51 (д, J=7,7 Гц, 2Н), 7,88 (д,.J=8.0 Гц, 2Н). 2. 2-(Бензилсульфоніл)-4-тозил-5-хлоротіазол (8в). Сполуку 8в отримували із сполуки 7в як описано в роботі [З]. 3. Сполуку А13 отримували з 1,93 г (4,5 ммоль) сполуки 8в і 1,18 мл (10 ммоль) 4метилпіперидину подібно сполуці А6; вихід 86 % (1,90 г). Безбарвні кристали, Тпл. 142 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,94 (д, J-6,4 Гц, 3Н), 1,21-1,39 (м, 2Н), 1,46-1,61 (м, 1Н), 1,67 (д, J=12,4 Гц, 2Н), 2,42 (с, 3Н), 2,97 (т, J=11,3 Гц, 2Н), 3,52 (д, J=11,7 Гц, 2Н), 4,76 (с, 2Н), 6,89 (д, J=7,3 Гц, 2Н), 7,20 (т, J=7,5 Гц, 2Н), 7,31 (т, J=7,3 Гц, 1Н), 7,52 (д, J=8,0 Гц, 2Н), 7,88 (д, J=8,1 Гц, 2Н). 5-(Азепан-1-іл)-2-(бензилсульфоніл)-4-тозилтіазол (А14). 6 UA 109165 C2 Ts N N 5 S SO2Bn Сполуку А14 отримували з 1,93 г (4,5 ммоль) сполуки 8в (див. приклад А13) і 1,09 мл (9.7 ммоль) азепана подібно сполуці А6; вихід 86 % (1,89 г). Кремові кристали, Тпл. 130 °C 1 (AcOEt/EtOH). Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,41-1,57 (м, 4Н), 1,61-1,76 (м, 4Н), 2,42 (с, 3Н), 3,50-3,64 (м, 4Н), 4,69 (с, 2Н), 6,99 (д, J=7,1 Гц, 2Н), 7,27 (т, J=7,2 Гц, 2Н), 7,34 (т, J=7,2 Гц, 1H), 7,50 (д, J=8,0 Гц, 2Н), 7,84 (д, J=8,1 Гц, 2Н). 2-((5-(Тиоморфолін-4-іл)-4-тозилтіазол-2-іл)сульфоніл)етанол (А15). Ts N N 10 15 20 25 30 SO2 S S OH 1. 2-((4-Тозил-5-хлоротіазол-2-іл)тіо)етанол (7г). До суміші 20,03 г (65 ммоль) 1-тозил-2,2дихлороетенілізотіоціанату (5а) [4] і 5,03 мл (72 ммоль) 2-меркаптоетанолу в 50 мл етанолу додавали 10,04 мл (72 ммоль) триетиламін при охолодженні до 10-15 °C і перемішуванні протягом 1 год. Суміш перемішували при кімнатній температурі ще 2 год., розбавляли 100 мл води, осад сполуки 7г відфільтровували; вихід кількісний. Безбарвні кристали, Тпл. 63 °C 1 (МеОН). Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,45 с (3Н), 3,25 т (J=6,2 Гц, 2Н), 3,64 т (J=6,2 Гц, 2Н), 4,98 ш. с (1Н), 7,43 д (J=7,8 Гц, 2Н), 7,85 д (J=7,8Гц, 2Н). 2. 2-((4-Тозил-5-хлоротіазол-2-іл)сульфоніл)етанол (8г). Розчиняли 1,12 г (3,2 ммоль) сполуки 7 г і 1,70 г (7,6 ммоль) -хлоронадбензойної кислоти 77 %-ної чистоти (Aldrich, 273031) в 12 мл хлорооформу. Реакційну суміш витримували при кімнатній температурі 48 год., осад, що утворився, відфільтровували. Фільтрат промивали 10 мл насиченого водного розчину NaHCО3, органічний шар відокремлювали і видаляли з нього розчинник у вакуумі. До маслоподібного залишку додавали етанол і після закінчення кристалізації відфільтровували 1 сполуку 8г; вихід 61 % (0,74 г). Безбарвні кристали, Тпл. 120 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,42 (с, 3Н), 3,76-3,80 (м, 4Н), 5,09 (с, 1Н), 7,51 (д, J=8.2 Гц, 2Н), 7,90 (д, J=8.2 Гц, 2Н). 3. Суміш 0,50 г (1,3 ммоль) сполуки 8 г і 0,57 мл (5,7 ммоль) тиоморфоліну в 5 мл етанолу кип'ятили 1 год., розчин охолоджували до кімнатної температури, додавали до нього 2 мл води, осад, що утворився сполуки А15, відфільтровували; вихід 66 % (0,38 г). Безбарвні кристали, 1 Тпл. 109 °C. Спектр ЯМР Н (400 МГц ДМСО-d6), , м. ч.: 2,45 (с, 3Н), 3,33 (с, 4Н), 3,46 (т, J=6,0 Гц, 2Н), 3,67 (т, J= 6,0 Гц, 2Н), 3,77 (с, 4Н), 4,82 (с, 1Н), 7,41 (д, J=8.0 Гц, 2Н),7,80(д, J=8.0Гц, 2Н). 4-(2-((2-(Тіоморфолін-4-іл)етил)сульфоніл)-4-тозилтіазол-5-іл)тіоморфолін (А16). Ts S N N S 35 40 S N SO2 1. 2-((4-Тозил-5-хлоротіазол-2-іл)сульфоніл)етилацетат (8д). До киплячого розчину 20,38 г (58,2 ммоль) сполуки 7г (див. приклад А15) в 150 мл оцтової кислоти додавали по краплях 24 мл 35 %-ного водного розчину пероксиду водню протягом 2 год. Леткі речовини з реакційної суміші видаляли у вакуумі, до залишку додавали етанол і після закінчення кристалізації відфільтровували сполуку 8д; вихід 74 % (18.14 г). Безбарвні кристали, Тпл. 116 °C 1 (MeCN/EtOH). Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,66 с (3Н), 2,43 с (3Н), 4,04 т (J=5,2 Гц, 2Н), 4,32 т (J=5,2 Гц, 2Н), 7,51 д (J=7,8 Гц, 2Н), 7,90 д(J=7,8Гц, 2Н). 2. Суміш 0,70 г (1,65 ммоль) сполуки 8д і 0,54 мл (5,40 ммоль) тиоморфоліну у 4 мл ТГФ перемішували 72 год., потім додавали до неї 10 мл води і відфільтровували осад сполуки А16; 7 UA 109165 C2 вихід 81 % (0,71 г). Безбарвні кристали, Тпл. 139 °C (EtOН). Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 2,16-2,30 (м, 4Н), 2,41 (с, 3Н), 2,63-2,79 (м, 2Н), 3,27-3,35 (м, 4Н), 3,35-3,42 (м, 4Н), 3,423,51 (м, 2Н), 3,81-3,96 (м, 4Н), 7,31 (д, J=7,6 Гц, 2Н), 7,88 (д, J=7,9 Гц, 2Н). Знайдено, %: С 44,61, Н 5,12, S 30,40, C20H27N3O4S5. Обчислено, %: С 45,00, Н 5,10, S 30,04. 2,6-Диметил-4-(4-тозил-2-(циклогексилсульфоніл)тіазол-5-іл)морфолін (А 17). 1 5 Ts N Me N SO2 S O Me 10 15 20 25 1. 4-Тозил-5-хлоро-2-(циклогексилтіо)тіазол (7е). До розчину 11,77 г (38,2 ммоль) 1-тозил2,2-дихлороетенілізотіоціанату (5а) [4] і 4,68 мл (38,3 ммоль) циклогексилмеркаптану в 40 мл бензолу додавали розчин 5,35 мл (38.4 ммоль) триетиламіну в 5 мл бензолу при охолодженні до 10-15 °C і перемішуванні протягом 40 хв. Реакційну суміш перемішували при кімнатній температурі ще 1 год., додавали до неї 60 мл води, органічний шар відокремлювали і видаляли з нього розчинник у вакуумі. До маслоподібного залишку додавали етанол і після закінчення кристалізації відфільтровували сполуку 7є; вихід 82 % (12,22 г). Безбарвні кристали, Тпл. 75 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,11-1,48 (м, 5Н), 1,47-1,73 (м, 3Н), 1,79-2,00 (м, 2Н), 2,41 (с, 3Н), 3,45-3,66 (м, 1H), 7,49 (д, J= 7,8 Гц, 2Н), 7,87 (д, J=8,0 Гц, 2Н). 2. 4-Тозил-5-хлоро-2-(циклогексилсульфоніл)тіазол (8е). Сполуку 8е отримували окисненням 12,22 г (31,5 ммоль) сполуки 7е 19 мл 31 %-ним водним розчином пероксиду водню подібно сполуці 8а (див. приклад А1); вихід 90 % (11,93 г). Безбарвні кристали, Тпл. 146 °C. Спектр ЯМР 1 Н (500 МГц, ДМСО-d6), , м. ч.: 0,92-1,08 (м, 1Н), 1,13-1,34 (м, 4Н), 1,57 (д, J= 13,0 Гц, 1Н), 1,71 (д, J=12,7 Гц, 2Н), 1,85-1,97 (м, 2Н), 2,40 (с, 3Н), 3,44-3,59 (м, 1H), 7,50 (д, J=8,0 Гц, 2Н), 7,88 (д, J=8,3 Гц, 2Н). 3. Сполуку А17 отримували з 1,01 г (2,4 ммоль) сполуки 8е і 0,65 мл (5,6 ммоль) 2,6диметилморфоліну подібно сполуці А6; вихід 78 % (0,93 г). Безбарвні кристали, Тпл. 121 °C. 1 Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 0,88-1,15 (м, 4Н), 1,24 (д, J=6,3 Гц, 6Н), 1,64 (д, J= 11,4 Гц, 1Н), 1,75 (д, J= 10,6 Гц, 2Н), 1,90 (д, J= 12,1 Гц, 3Н), 2,43 (с, 3Н), 2,76 (т, J=11,2 Гц, 2Н), 3,06 (т, J=12,0 Гц, 1Н), 3,61 (д, J=12,5 Гц, 2Н), 3,80-4,03 (м, 2Н), 7,32 (д, J=8.5 Гц, 2Н), 7,87 (д, J=8.3 Гц, 2Н). 5-(Азепан-1-іл)-4-тозил-2-(циклогексилсульфоніл)тіазол (А18). Ts N N 30 35 S SO2 Сполуку А18 отримували з 1,05 г (2,5 ммоль) сполуки 8е (див. приклад А17) і 0,62 мл (5,5 ммоль) азепану подібно сполуці А6; вихід 90 % (1,09 г). Безбарвні кристали, Тпл. 153 °C. Спектр 1 ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,80-1,19 (м, 5Н), 1,45-1,65 (м, 7Н), 1,71 (д, J=11,3 Гц, 2Н), 1,77-1,92 (м, 4Н), 2,41 (с, 3Н), 3,09 (т, J=11,1 Гц, 1Н), 3,53-3,83 (м, 4Н), 7,44 (д, J=7,6 Гц, 2Н), 7,77 (д, J=7,2 Гц, 2Н). 5-(Піперидин-1-іл)-2,4-дитозилтіазол (А19). Ts N N S Ts Сполуку А19 отримували з 1,03 г (2,4 ммоль) 2,4-дитозил-5-хлоротіазолу (8ж) [3] і 0,52 мл (5,3 ммоль) піперидину подібно сполуці А6; вихід 90 % (1,03 г). Безбарвні кристали, Тпл. 151 °C. 1 Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 7,66 (д, J=8.0 Гц, 2Н), 7,62 (д, J=8.2 Гц, 2Н), 7,39 (д, 8 UA 109165 C2 J=7,9 Гц, 4Н), 3,35-3,41 (м, 4Н), 2,43 (с, 3Н), 2,41 (с, 3Н), 1,62-1,72 (м, 4Н), 1,50-1,61 (м, 2Н). ІЗ Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 21,59, 21,63, 22,93, 25,14, 56,87, 128,06, 128,16, 130,10, 130,68, 135,82, 138.30, 144,88, 145,96, 149,08, 164,35. 5-(Піперазин-1-іл)-2,4-дитозилтіазол (А20). Ts N N 5 10 Ts S HN Сполуку А20 отримували з 1,03 г (2,4 ммоль) 2,4-дитозил-5-хлоротіазолу (8ж) [3] і 0,46 г (5,3 ммоль) піперазину подібно сполуці А6; вихід 72 % (0,83 г). Безбарвні кристали, Тпл. 133 °C. 1 Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 2,44 (с, 3Н), 2,47 (с, 3Н), 3,03-3,14 (м, 4Н), 3,32-3,43 (м, ІЗ 4Н), 7,24-7,29 (м, 4Н), 7,70 (д, J=8.1 Гц, 2Н), 7,80 (д, J=8.1 Гц, 2Н). Спектр ЯМР С (100 МГц, CDCl3), , м. ч.: 21,45, 21, 57, 45,19, 56,60, 127,69, 128.87, 130,71, 131,28, 131,29, 134,25, 137,33, 141,74, 145,16, 148.97, 163,18. Знайдено, %: N 8.43, S 20,04. C 21H23N3O4S3. Обчисленого: N 8,80, S - 20,14. (4-(2,4-Дитозилтіазол-5-іл)піперазин-1-іл)(фуран-2-іл)метанон (А21). Ts N N O S N Ts O 15 20 Сполуку А21 отримували з 0,86 г (2,0 ммоль) 2,4-дитозил-5-хлоротіазолу (8ж) [3] і 0,76 г (4,2 ммоль) 1-(2-фуро)піперазину подібно сполуці А6; вихід 83 % (0,95 г). Безбарвні кристали, Тпл. 1 93 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,42 (s, 3Н), 2,43 (с, 2Н), 3,39-3,60 (м, 4Н), 3,76-3,99 (м, 4Н), 6,59-6,72 (м, 1Н), 7,03-7,12 (м, 1Н), 7,40 (д, J=5,7 Гц, 4Н), 7,68 (д, J= 7,9 Гц, 2Н), 7,73 (д, J=7,8 Гц, 2Н), 7,80-7,92 (м, 1Н). 5-(Піперазин-1-іл)-4-тозил-2-((4-хлорофеніл)сульфоніл)тіазол (А22). Cl Ts N N HN 25 30 35 S SO2 1. 4-Тозил-5-хлоро-2-((4-хлорофеніл)сульфоніл)тіазол (8з). Сполуку 8з отримували окисненням 5,62 г (13,5 ммоль) 4-тозил-5-хлоро-2-((4-хлорофеніл)тіо)тіазолу (7з) [3] 8 мл 32 %ного водного розчину пероксиду водню подібно сполуці 8а (див. приклад А1); вихід 89 % (5,37 г). 1 Безбарвні кристали, Тпл. 142 °C (AcOEt). Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 2,40 (с, 3Н), 7,46 (д, J=8.0 Гц, 2Н), 7,79 (д, J=8.6 Гц, 2Н), 7,82 (д, J=8.2 Гц, 2Н), 8.02(д, J=8.6Гц, 2Н). 2. Суміш 0,49 г (1,1 ммоль) сполуки 8з і 0,19 г (2,2 ммоль) піперазину в 10 мл ацетонітрилу кип'ятили 2 год., розчин охолоджували до кімнатної температури, розчинник видаляли у вакуумі, залишок промивали водою, перекристалізовували з етанолу і отримували 0,39 г (71 %) сполуки -1: 1 А22. Кремові кристали, Тпл. 186 °C. 14 спектр (KBr), , см 3277, 3349 (NH). Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 2,44 (с, 3Н), 2,53-2,54 (м, 7Н), 2,80-2,90 (м, 4Н), 7,36 (д, J=8.1 Гц, 2Н), 13 7,64 (д, J= 7,9 Гц, 2Н), 7,65 (д, J=8.5 Гц, 2Н), 7,74 (д, J=8.6 Гц, 2Н). Спектр ЯМР С (126 МГц, ДМСО-d6), , м. ч.: 21,60, 45,09, 56,71, 128,10, 130,06, 130,40, 134,60, 137,43, 138,15, 140,26, 144,98, 148,33, 164,49. 2-(Метилсульфоніл)-5-(3,5-диметилпіперидин-1-іл)-4-((4-хлорофеніл)сульфоніл)тіазол (А23). 9 UA 109165 C2 SO2 Cl N Me N S Ms Me 5 10 15 20 25 30 35 40 45 50 1. N-(2,2,2-трихлоро-1-((4-хлорофеніл) сульфоніл)етил)формамід (2б). Метод А. Суспензію 325 г (1,54 моль) N-(1,2,2,2-тетрахлороетил)формаміду (1) [5] і 366 г (1,56 моль) дигідрату n-хлоробензолсульфінату натрію [6] в 1300 мл ацетону кип'ятили при перемішуванні 3 год., осад відфільтровували. З фільтрату ацетон видаляли у вакуумі, до маслоподібного залишку додавали 400 мл ізопропанолу і після закінчення кристалізації сполуку 2б відфільтровували; вихід 67 % (361 г). Метод Б. До суспензії 4,64 г (22 ммоль) N-(1,2,2,2-тетрахлороетил)формаміду (1) [5] і 3,89 г (22 ммоль) n-хлоробензолсульфінової кислоти [6] в 35 мл діетилового етеру додавали розчин 3,07 мл (22 ммоль) триетиламіну в 20 мл діетилового етеру при охолодженні до 10-15 °C і перемішуванні протягом 40 хв. Суміш перемішували при кімнатній температурі ще 4 год., додавали до неї 30 мл води, сполуку 26 (1,82 г) відфільтровували. Фільтрат розділяли, з органічного шару розчинник видаляли у вакуумі, до маслоподібного залишку додавали 10 мл етанолу і після закінчення кристалізації відфільтровували основну кількість сполуки 26 (2,30 г); 1 сумарний вихід 53 %. Безбарвні кристали, Тпл. 124 °C (ЕtOН). Спектр ЯМР Н (300 МГц, CDCl3), , м. ч.: 6,01 д (J= 11,1 Гц, 1Н), 7,23 ш. с (1Н), 7,58 д (J= 8.7 Гц, 2Н), 7,92 д (J=8.7 Гц, 2Н), 8.30 с (1Н). 2. (2,2,2-Трихлоро-1-((4-хлорофеніл)сульфоніл)eтил)карбонімідоїлдихлорид (3б). Суміш 108.61 г (0,309 моль) сполуки 26 і 128.86 г (0,619 моль) пентахлориду фосфору нагрівали до 120-130 °C 6 год., потім залишали при кімнатній температурі на 48 год. Утворений осад відфільтровували, промивали тетрахлорметаном і отримували 71,72 г (57 %) сполуки 36. Фільтрат концентрували у вакуумі, осад відфільтровували, промивали тетрахлорметаном і отримували ще 20,49 г сполуки 36; сумарний вихід 74 %. Безбарвні кристали, Тпл. 115 °C 1 (бензол). Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 5,45 с (1Н), 7,59 д (J= 8.0 Гц, 2Н), 7,89дJ=8.0Гц, 2Н). 3. 1-((4-Хлорофеніл)сульфоніл)-2,2-дихлороетенілізотіоціанат (5б). До суспензії 30,70 г (76 ммоль) сполуки 3б в 100 мл ацетонітрилу додавали розчин 11,64 мл (84 ммоль) триетиламіну у 10 мл ацетонітрилу при охолодженні до 10-15 °C і перемішуванні протягом 1,5 год., потім додавали 5,77 г (76 ммоль) тіосечовини і суміш кип'ятили при перемішуванні 1 год. Осад відфільтровували, фільтрат охолоджували до 0 °C, осад, що утворився, відфільтровували, промивали охолодженим до 0 °C ацетонітрилом, теплою водою і отримували 10,72 г (43 %) сполуки 5б. Фільтрат концентрували у вакуумі і виділяли додатково 2,94 г сполуки 5б; сумарний -1: вихід 55 %. Блідо-жовті кристали, Тпл. 86 °C (Ме2О). ІЧ спектр (СН2Сl2), , см 2011 (NCS). 1 Спектр ЯМР Н (500 МГц, CDCl3), , м. ч.: 7,63 д (J= 8.5 Гц, 2Н), 7,94 д (J= 8.5 Гц, 2Н). 4. 2-(Метилтіо)-5-хлоро-4-((4-хлорофеніл)сульфоніл)тіазол (7и). Сполуку 7и отримували з 24,48 г (74,5 ммоль) ізотіоціанату 56, 19.14 г (79.7 ммоль) наногідрата сульфіду натрію і 4,97 мл (79.8 ммоль) метилйодиду подібно сполуці 7а (див. приклад А1, метод Б); вихід 93 % (23,58 г). 1 Світло-коричневий порошок, Тпл. 126 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 2,51 с (ЗН), 7,77 д (J=8.5 Гц, 2Н), 8.00 д (.J=8.5 Гц, 2Н). 5. 2-(Метилсульфоніл)-5-хлоро-4-((4-хлорофеніл)сульфоніл)тіазол (8и). Сполуку 8и отримували окисненням 11,57 г (34 ммоль) сполуки 7и 20 мл 31 %-ного водного розчину пероксиду водню подібно сполуці 8а (див. приклад А1); вихід 88 % (11,14 г). Безбарвні кристали, 1 Тпл. 146 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 3,30 (с, 3Н), 7,75 (д, J=8,3 Гц, 2Н), 8,00 (д, J=8,3 Гц, 2Н). 6. Сполуку А23 отримували з 1,19 г (3,2 ммоль) сполуки 8и і 0,93 мл (7,0 ммоль) 3,5диметилпіперидину подібно сполуці А6; вихід 79 % (1,14 г). Безбарвні кристали, Тпл. 116 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,68-0,83 (м, 1Н), 0,86 (д, J=6,4 Гц, 6Н), 1,68-1,90 (м, 3Н), 2,65 (т, J=11,7 Гц, 2Н), 3,31 (с, 3Н), 3,58 (д, J=11,7 Гц, 2Н), 7,74 (д, J=8.7 Гц, 2Н), 7,92 (д, J=8,7 Гц, 2Н). 8-(2-(Метилсульфоніл)-4-((4-хлорофеніл)сульфоніл)тіазол-5-іл)-1,4-діокса-8азаспіро[4,5]декан (А24). 10 UA 109165 C2 SO2 Cl N N Ms S O O 5 Сполуку А24 отримували з 1,19 г (3,2 ммоль) сполуки 8и (див. приклад А23) і 0,90 мл (7,0 ммоль) 1,4-діокса-8-азаспіро[4,5]декану подібно сполуці А6; вихід 78 % (1,20 г). Безбарвні 1 кристали, Тпл. 141 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 1,71-1,90 (м, 2Н), 2,00-2,23 (м, 2Н), 3,34-3,54 (м, 2Н), 3,35 (с, 3Н), 3,65-3,82 (м, 2Н), 3,82-4,07 (м, 4Н), 7,63 (д, J=8.5 Гц, 2Н), 7,90 (д, J=8,5 Гц, 2Н). 5-(3-Метилпіперидин-1-іл)-4-((4-хлорофеніл)сульфоніл)-2-(eтилсульфоніл)тіазол (А25). SO2 Cl N Me N 10 15 20 SO2Et S 1. 5-Хлоро-4-((4-хлорофеніл)сульфоніл)-2-(етилсульфоніл)тіазол (8к). Сполуку 8к отримували з 61,86 г (188 ммоль) ізотіоціанату 56 (див. приклад А23), 47,44 г (198 ммоль) наногідрата сульфіду натрію, 15,67 мл (210 ммоль) етилброміду і 110 мл 33 %-ного водного розчину пероксиду водню подібно сполуці 8б (див. приклад А5); вихід 49 % (35,36 г). Безбарвні 1 кристали, Тпл. 135 °C. Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 1,00 (т,J=7,1 Гц, 3Н), 3,37 (д, J=7,3 Гц, 2Н), 7,76 (д, J=8.4 Гц, 2Н), 8.01 (д, J=8.3 Гц, 2Н). 2. Сполуку А25 отримували з 1,24 г (3,2 ммоль) сполуки 8к і 0,82 мл (7,0 ммоль) 3метилпіперидину подібно сполуці А6; вихід 89 % (1,28 г). Безбарвні кристали, Тпл. 130 °C. 1 Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 0,96 (д, J=6,6 Гц, 3Н), 1,06-1,16 (м, 1H), 1,18 (т, J=7,4 Гц, 3Н), 1,74-2,08 (м, 4Н), 2,71 (т,.J=11,3 Гц, 1Н), 2,95-3,12 (м, 1Н), 3,21 (к,.J=7,4 Гц, 2Н), 3,63 (д, J=11,5 Гц, 1Н), 3,71 (д, J= 11,8 Гц, 1Н), 7,50 (д, J=8,7 Гц, 2Н), 7,93(д, J=8.6Гц, 2Н). 5-(Піперазин-1-іл)-4-((4-хлорофеніл)сульфоніл)-2-(етилсульфоніл)тіазол (А26). SO2 Cl N N 25 SO2Et S HN Сполуку А26 отримували з 0,50 г (1,3 ммоль) сполуки 8к і 0,22 г (2,6 ммоль) піперазину подібно сполуці А22; вихід 56 % (0,32 г). Безбарвні кристали, Тпл. 136 °C. ІЧ спектр (KBr), , см 1: 1 3207 (NH). Спектр ЯМР Н (500 МГц, ДМСО-d6), , м. ч.: 1,00 (т, J=7,1 Гц, 3Н), 2,53-2,54 (м, 4Н), 2,82-2,91 (м, 4Н), 3,37 (д, J=7,6 Гц, 2Н), 7,73 (д, J=8.5 Гц, 2Н), 7,93 (д, J=8.4 Гц, 2Н). Спектр ЯМР 13 С (126 МГц, ДМСО-d6), , м. ч.: 7,35, 45,16, 49,34, 56,75, 130,01, 130,08, 133,65, 139,48, 139,87, 148,65, 165,02. 1-(2-(Фенілсульфоніл)-4-((4-хлорофеніл)сульфоніл)тіазол-5-іл)піперидин-4-ол (А27). SO2 Cl N N S SO2Et HO 11 UA 109165 C2 5 10 15 20 1. 2-(Фенілтіо)-5-хлоро-4-((4-хлорофеніл)сульфоніл)тіазол (7л). До розчину 18.07 г (55 ммоль) ізотіоціанату 5б (див. приклад А23) і 5,65 мл (55 ммоль) тіофенолу в 50 мл бензолу додавали розчин 4,45 мл (55 ммоль) піридину в 5 мл бензолу при охолодженні до 10-15 °C і перемішуванні протягом 30 хв. Реакційну суміш перемішували при кімнатній температурі ще 2 год., додавали до неї 70 мл води, осад відфільтровували, промивали ізопропанолом і отримували 8.78 г сполуки 7л. Фільтрат розділяли, з органічного шару розчинник видаляли у вакуумі, залишок промивали ізопропанолом і отримували 11,89 г сполуки 7л; сумарний вихід 1 93 %. Безбарвні кристали, Тпл. 117 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 7,55 (т, J=6,8 Гц, 2Н), 7,61 (т, J=6,8 Гц, Ш), 7,71 (д, J=7,7 Гц, 2Н), 7,76 (д, J=7,4 Гц, 2Н), 7,97 (д, J=7,4 Гц, 2Н). 2. 2-(Фенілсульфоніл)-5-хлоро-4-((4-хлорофеніл)сульфоніл)тіазол (8л). Сполуку 8л отримували окисненням 19.00 г (47,2 ммоль) сполуки 7л 28 мл 31 %-ного водного розчина пероксиду водню подібно сполуці 8а (див. приклад А1); вихід 96 % (19.62 г). Безбарвні кристали, 1 Тпл. 108 °C. Спектр ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 7,67-7,77 (м, 4Н), 7,86 (т, J=1А Гц, 1Н), 7,94 (д, J=8.2 Гц, 2Н), 8.01 (д, J=8.1 Гц, 2Н). 3. Сполуку А27 отримували з 1,04 г (2,4 ммоль) сполуки 8л і 0,53 г (5,2 ммоль) 4піперидинолу подібно сполуці А6; вихід 88 % (1,05 г). Безбарвні кристали, Тпл. 174 °C. Спектр 1 ЯМР Н (400 МГц, ДМСО-d6), , м. ч.: 1,46-1,72 (м, 2Н), 1,76-1,98 (м, 2Н), 3,24-3,31 (м, 2Н), 3,513,66 (м, 2Н), 3,65-3,79 (м, 1Н), 4,87 (с, 1H), 7,55-7,63 (м, 4Н), 7,70-7,77 (м, 5Н). 5-(4-Метилпіперазин-1-іл)-2-(фенілсульфоніл)-4-((4-хлорофеніл)сульфоніл)тіазол (А28). SO2 Cl N N Me 25 30 35 40 45 50 N S SO2Ph Сполуку А28 отримували з 1,04 г (2,4 ммоль) сполуки 8л (див. приклад А27) і 0,59 мл (5,3 ммоль) 1-метилпіперазину подібно сполуці А6; вихід 88 % (1,05 г). Кремовий порошок, Тпл. 1 163 °C. Спектр ЯМР Н (400 МГц, CDCl3), , м. ч.: 2,36 (с, 3Н), 2,51-2,73 (м, 4Н), 3,34-3,58 (м, 4Н), 7,36-7,50 (м, 4Н), 7,62 (т, J=7,4 Гц, 1Н), 7,75 (д, J=7,4 Гц, 2Н), 7,80 (д, J=8.4 Гц, 2Н). 2. Тестування сполук A in vitro Протипухлинні властивості сполук загальної формули А досліджували в Національному інституті раку США (National Cancer Institute, Bethesda, Maryland, USA) на 60 лініях ракових клітин - представників лейкемії (лінії CCRF-CEM, HL-60 (ТВ), К-562, MOLT-4, RPMI-8226, SR), меланоми (лінії LOX IМVI, MALME-3M, М14, MDA-MB-435, SK-MEL-2, SK-MEL-28, SK-MEL-5, UACC-257, UACC-62); раку легенів (лінії А549/АТСС, EKVX, НОР-62, НОР-92, NCI-H226, NC1H23, NCI-H322M, NCI-H460, NCI-H522), товстої кишки (лінії COLO 205, НСС-2998, НСТ-116, НСТ-15, НТ29, КМ12, SW-620), мозку (лінії SF-268, SF-295, SF-539, SNB-19, SNB-75, U251), яєчників (лінії IGROV1, OVCAR-3, OVCAR-4, OVCAR-5, OVCAR-8, NCI/ADR-RES, SK-OV-3), нирок (лінії 786-0, А498, ACHN, САКІ-1, RXF 393, SN12C, ТК-10, UO-31), простати (лінії РС-3, DU-145) і грудей (лінії MCF7, MDA-MB-231/ATCC, HS 578T, ВТ-549, Т- 47D, MDA-MB-468). Ракові клітини вирощували в середовищі RPMI 1640, що містить 5 % ембріональної сироватки великої рогатої худоби і 2 ммоль/л L-глутаміну, в платах для мікротитрування з 96 лунками. Об'єм середовища в кожній лунці становив 100 мкл, а кількість клітин – від 5000 до 40000 в залежності від часу подвоєння конкретної лінії. Після інокуляції плати інкубували при 37 °C 24 год. і частину лунок кожної лінії обробляли трихлорооцтовою кислотою для визначення популяції клітин до моменту додавання досліджуваної сполуки (Tz) як описано нижче. Заздалегідь готували 4 мМ (для однодозового випробування) або 40 мМ (для п'ятидозового випробування) розчин однієї із сполук А в ДМСО, перед випробуванням його розбавляли середовищем, що містить 50 мкг/мл гентаміцину, до концентрації, вдвічі більше необхідної. Додавали 100 мкл такого розчину в лунки з клітинами (поряд з контрольним розчином без сполуки) та плати інкубували 48 год. при 37 °C. Випробування закінчували додаванням 50 мкл концентрованого (0,5 г/мл для скоагульованих клітин і 0,8 г/мл для суспендованих) розчину трихлорооцтової кислоти і інкубуванням плат при 4 °C протягом 1 год. Надосадову рідину з лунок видаляли, залишок промивали водою. У кожну лунку додавали 100 мкл розчину сульфородаміна Б концентрацією 4 мг/мл в 1 %-ній оцтовій кислоті, плати витримували 10 хвилин при кімнатній температурі. Лунки промивали п'ять разів 1 %-ним розчином оцтової кислоти для видалення незв'язаного барвника і висушували. 12 UA 109165 C2 5 10 15 20 Для вилучення пов'язаного речовиною клітин барвника в лунки додавали 10 мМ розчину Trizma ® Base (2-аміно-2-(гідроксиметил)-1,3-пропандіол) і визначали величину поглинання екстрактом світла довжиною хвилі 515 нм (Ті). Ступінь пригнічення росту клітин розраховували за формулами: [(Ti-Tz) / (C-Tz)] х 100 % при Ті Tz, [(Ti-Tz) / Tz] х 100 % при Ті < Tz, де Ті - поглинання після дії хімічної сполуки заданої концентрації; Tz - поглинання до додавання сполуки; С - поглинання лунки з контрольним розчином. [7-9]. -5 В табл. 1 представлені результати однодозового випробування (10 М розчин) ряду сполук А у вигляді середніх значень величин приросту клітин. При цьому величина 100 % означає відсутність інгібування, 0 % - повне інгібування (відсутність приросту клітин після додавання сполуки), 100 % - повну загибель клітин. Найбільш активною виявилася сполука А20, яка була -4 випробувана додатково на тих же 60 лініях ракових клітин в п'яти різних концентраціях: 10 , 10 5 -6 -7 -8 , 10 , 10 і 10 моль/л. На основі даних такого експерименту для сполуки А20 були розраховані три концентраційних параметра, середні значення яких наведено в табл. 2: GI50 - концентрація, при якій приріст клітин зменшується на 50 % порівняно з контролем; TGI - концентрація повного інгібування росту і LC50 - концентрація, яка призводить до загибелі половини клітин. Таблиця 1 Середні значення величин зростання/загибелі клітин (%) Лейкемія Рак легенів Рак товстої кишки Рак мозку Меланома Рак яєчників Рак нирок Рак простати Рак грудей Сполука А5 А6 82 86 93 99 97 104 102 103 98 95 100 103 94 96 92 101 87 88 А7 91 100 108 107 96 113 114 101 95 А8 83 94 105 103 82 116 99 100 84 А9 88 96 105 108 89 107 108 107 96 А10 A11 А12 А19 А20 94 97 88 83 -4 97 101 99 93 -1 107 113 107 98 -15 108 110 107 100 -1 91 94 94 90 -9 109 114 114 99 -2 109 113 109 91 -6 102 100 105 96 -13 93 100 97 82 -5 А22 -6 21 2 34 -1 21 6 24 5 А24 А26 92 86 100 87 111 96 108 102 94 72 119 103 111 93 113 95 93 82 Таблиця 2 Концентраційні параметри сполуки А20 (моль/л) Лейкемія Рак легенів Рак товстої кишки Рак мозку Меланома Рак яєчників Рак нирок Рак простати Рак грудей 25 Log10GI50 -5,68 -5,63 -5,68 -5,56 -5,82 -5,55 -5,59 -5,58 -5,86 Log10TGI -5,18 -5,18 -5,24 -5,09 -5,45 -5,03 -5,18 -5,08 -5.26 Log10LC50 -4,47 -4,61 -4,74 -4,55 -5,06 -4,46 -4,75 -4,58 -4,54 Перелік посилань 1 Hayakawa M., Kaizawa H., Kawaguchi К, Ishikawa N., Koizumi Т., Ohishi Т., Yamano M., Okada M., Ohta M., Tsukamoto S., Raynaud F. I., Waterfield M. D., Parkerd P., Workman P. Bioorg. Med. Chem., 2007, 75 (1), 403-412. 2 Auckland Uniservices Limited, WO 2009/008748 Al, 15.01.2009. 3 Бабий С. Б., Зябрев B.C., Драч Б. С. Журн. общ. хим., 2002, 72(11), 1834-1839. 13 UA 109165 C2 5 10 4 Харченко А. В., Сеферов С. О., Зябрев В. С, Червоный В. А., Вдовенко С. И., Драч Б. С. Укр. хим. журн., 1993, 59 (6), 637-642. 5 Vrabel V., Pavelcik F., Kelloe E., Miertus S., Konecny V., Lokaj J. Collect. Czech. Chem. Commun., 1985, 50 (8), 1619-1628. 6 Muth F., in Houben-Weyl-Muller, Methoden der Organischen Chemie, 4 Aufl., G. Thieme Verlag, Stuttgart, 1955, Bd 9, 306. 7 Alley M. C, Scudiero D. A., Monks P. A., Hursey M. L., Czerwinski M. J., Fine D. L., Abbott B. J., Mayo J. G., Shoemaker R. H., Boyd M. R. Cancer Res., 1988, 48, 589-601. 8 Grever M. R., Schepartz S. A., Chabner B. A. Seminars in Oncology, 1992, 19 (6), 622-638. 9 Boyd M. R., Paull K. D. Drug Develop. Res., 1995, 34, 91-109. ФОРМУЛА ВИНАХОДУ 15 2,4-Дисульфоніл-5-циклоамінозаміщені тіазоли загальної формули А або їх солі, що придатні для застосування як антиракових препаратів: Ar O O S N N S S R O O A , де Ar = p-MeC6H4, p-ClC6H4; NCH2CH2, cyclo-C6H11, Ph, p-MeC6H4, p-ClC6H4; R = Me, Et, Pr, Bn, HOCH2CH2, R N NH N= (R = H, 3-Me, 4Me, 4-Bn, 4-(CH2)4NCH2CH2, 3-EtOCO, 4-NH2CO, 4-HO), , 20 N (R = H, Me, Et, Bn, HOCH 2CH2, Ph, 2-FC6H4, 3-ClC6H4, 4-MeOC6H4, EtOCO, RN CO ), O Me X S N O (X = CH2,O), N N N , Me , , O N , . Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
Автори англійськоюVasylenko Oleksandr Mykolaiovych, Brovarets Volodymyr Serhiiovych
Автори російськоюВасиленко Александр Николаевич, Броварец Владимир Сергеевич
МПК / Мітки
МПК: C07D 277/32, A61P 35/00, C07D 417/04
Мітки: тіазоли, антиракових, препаратів, 2,4-дисульфоніл-5-циклоамінозаміщені, застосування
Код посилання
<a href="https://ua.patents.su/16-109165-24-disulfonil-5-cikloaminozamishheni-tiazoli-i-kh-zastosuvannya-yak-antirakovikh-preparativ.html" target="_blank" rel="follow" title="База патентів України">2,4-дисульфоніл-5-циклоамінозаміщені тіазоли і їх застосування як антиракових препаратів</a>
Попередній патент: Безводна композиція, що містить пестицид і співполімери з групами сульфонових кислот
Наступний патент: Спосіб отримання холестерину
Випадковий патент: Спосіб прогнозування перебігу панкреатиту за поліморфізмом гена tnf-a












