Моногідрат гідрохлориду 1-циклопропіл-7-([s,s]-2,8-діазабіцикло[4.3.0]нон-8-іл)- 6-фтор-1,4-дигідро-8-метокси-4-оксо-3-хінолінкарбонової кислоти та фармацевтична композиція з антибактеріальною активністю
Формула / Реферат
1. Моногидрат гидрохлорида 1-циклопропил-7-([S,S]-2,8- диазабицикло[4.3.0]нон-8-ил)-6-фтор-1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновой кислоты формулы
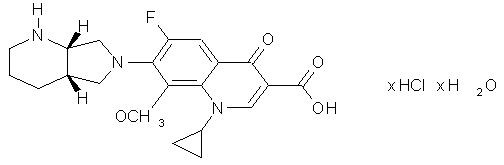 в 13С-ЯМР- спектре которого имеется характеристический пик при 168,1 н.д. и на рентгеновской дифрактограмме имеется линия при угле 2Θ = 26,7.
в 13С-ЯМР- спектре которого имеется характеристический пик при 168,1 н.д. и на рентгеновской дифрактограмме имеется линия при угле 2Θ = 26,7.
2. Моногидрат по п. 1 в кристаллической форме в виде призм.
3. Фармацевтическая композиция с антибактериальной активностью, содержащая гидрохлорид 1-циклопропил-7-([S,S]-2,8-диазабицикло[4.3.0]нон-8-ил)-6-фтор-1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновой кислоты в качестве действующего начала и, по крайней мере, один фармацевтически приемлемый носитель, отличающаяся тем, что в качестве действующего начала она содержит в эффективном количестве моногидрат указанного гидрохлорида формулы
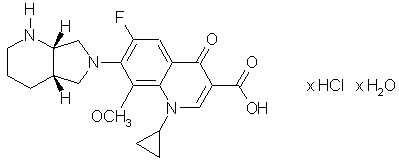 в "С-ЯМР-спектре которого имеется характеристический пик при 168,1 м.д. и на рентгеновской дифрактограмме имеется линия при угле 2Θ=26,7.
в "С-ЯМР-спектре которого имеется характеристический пик при 168,1 м.д. и на рентгеновской дифрактограмме имеется линия при угле 2Θ=26,7.
4. Фармацевтическая композиция по п. 3, отличающаяся тем, что она содержит моногидрат в кристаллической форме в виде призм.
Текст
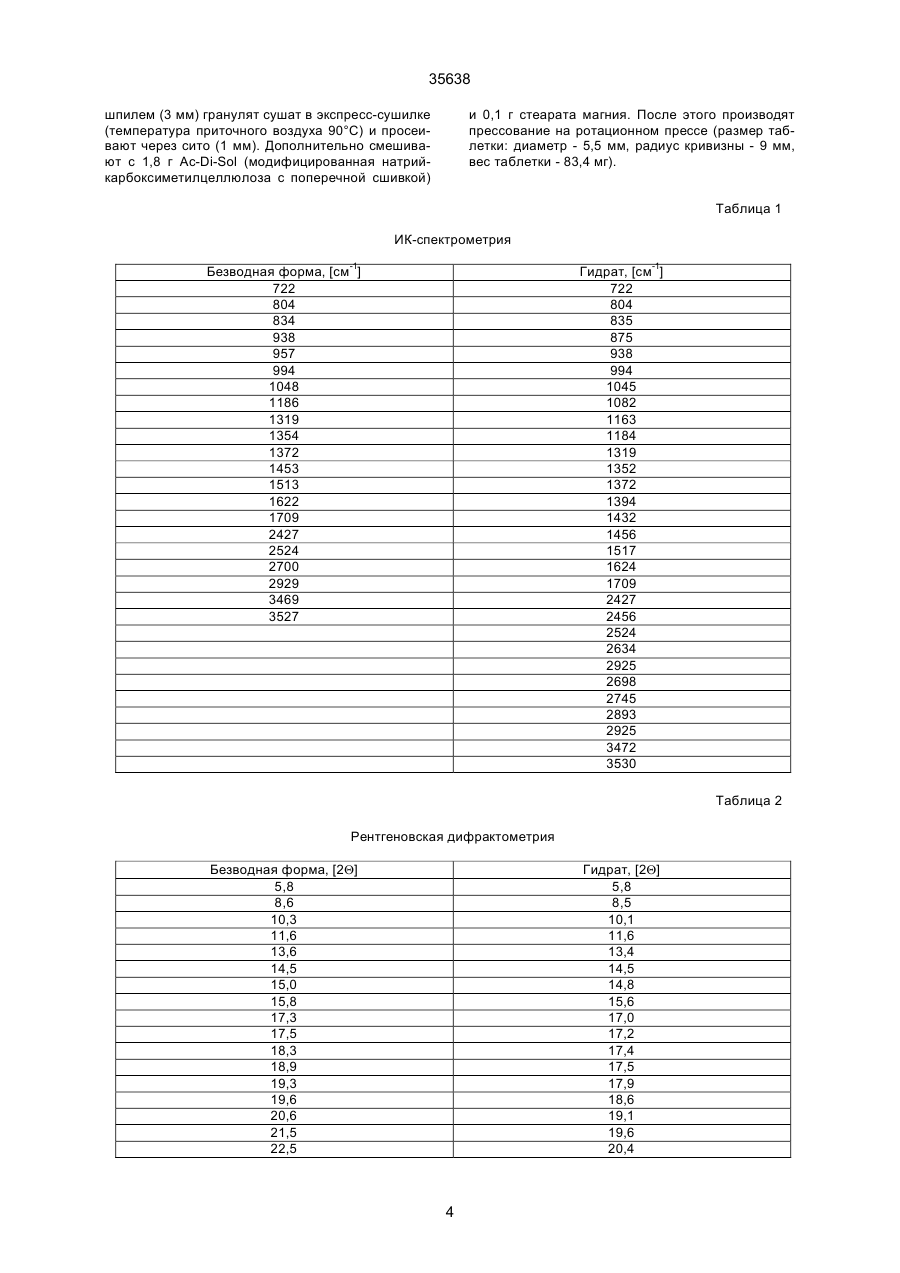
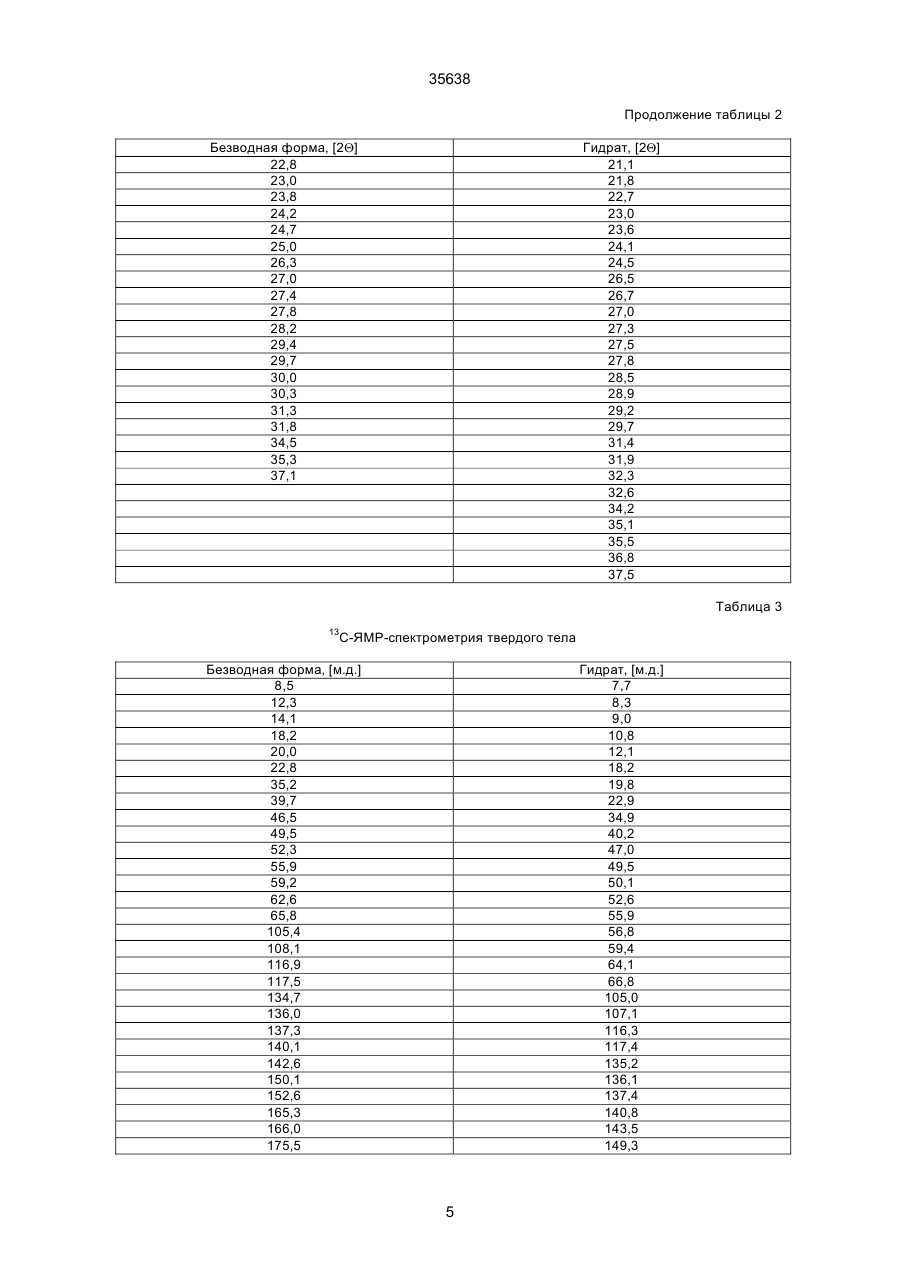
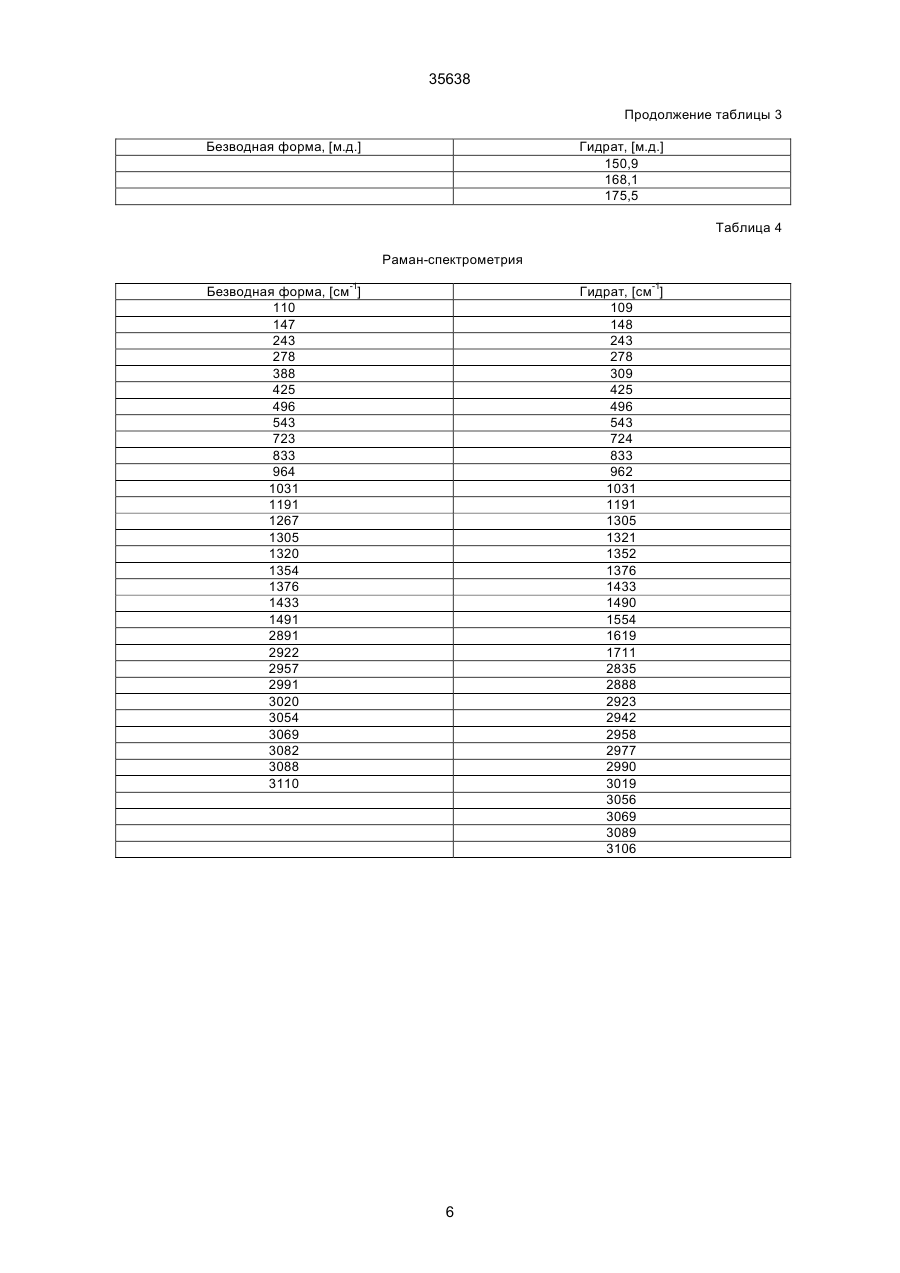
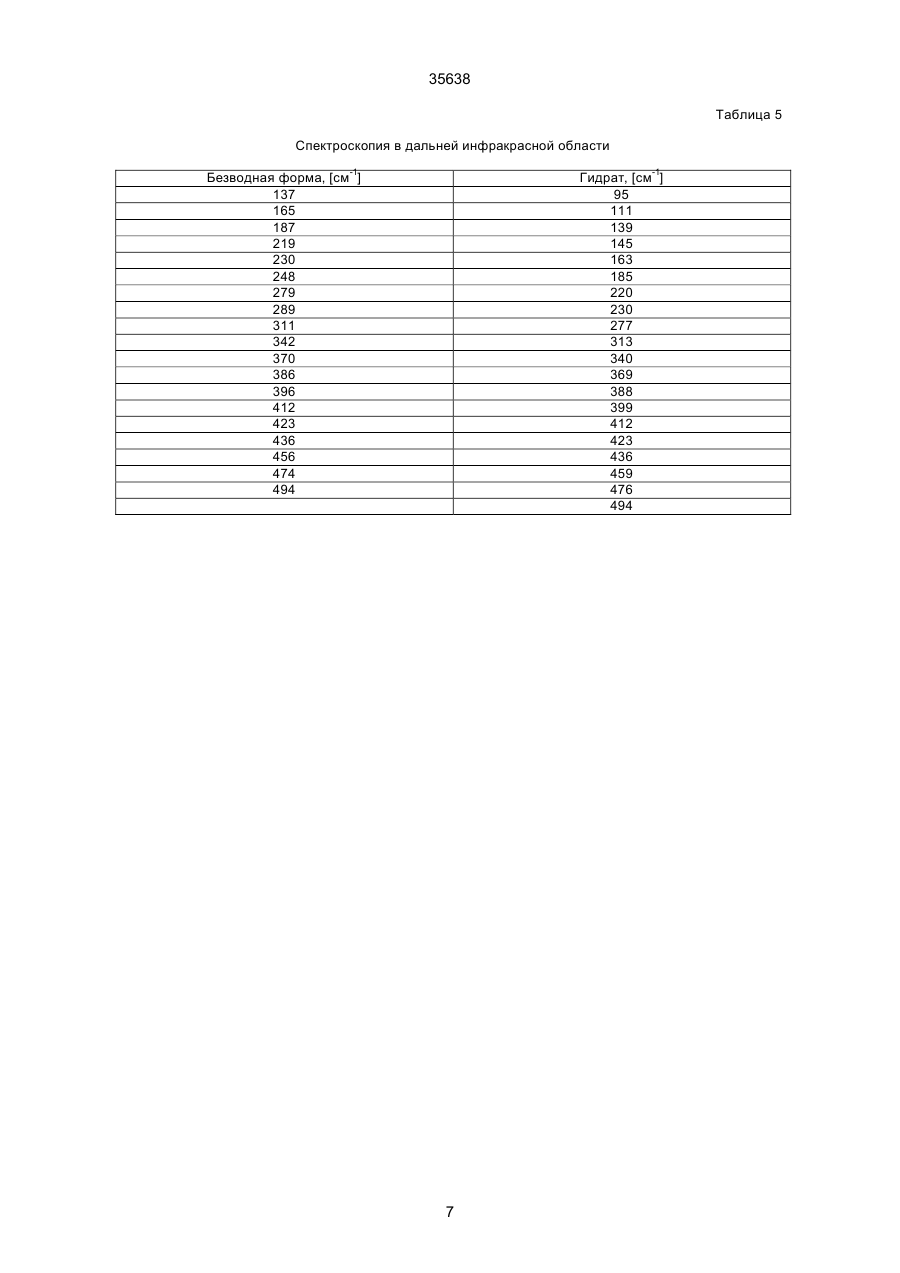
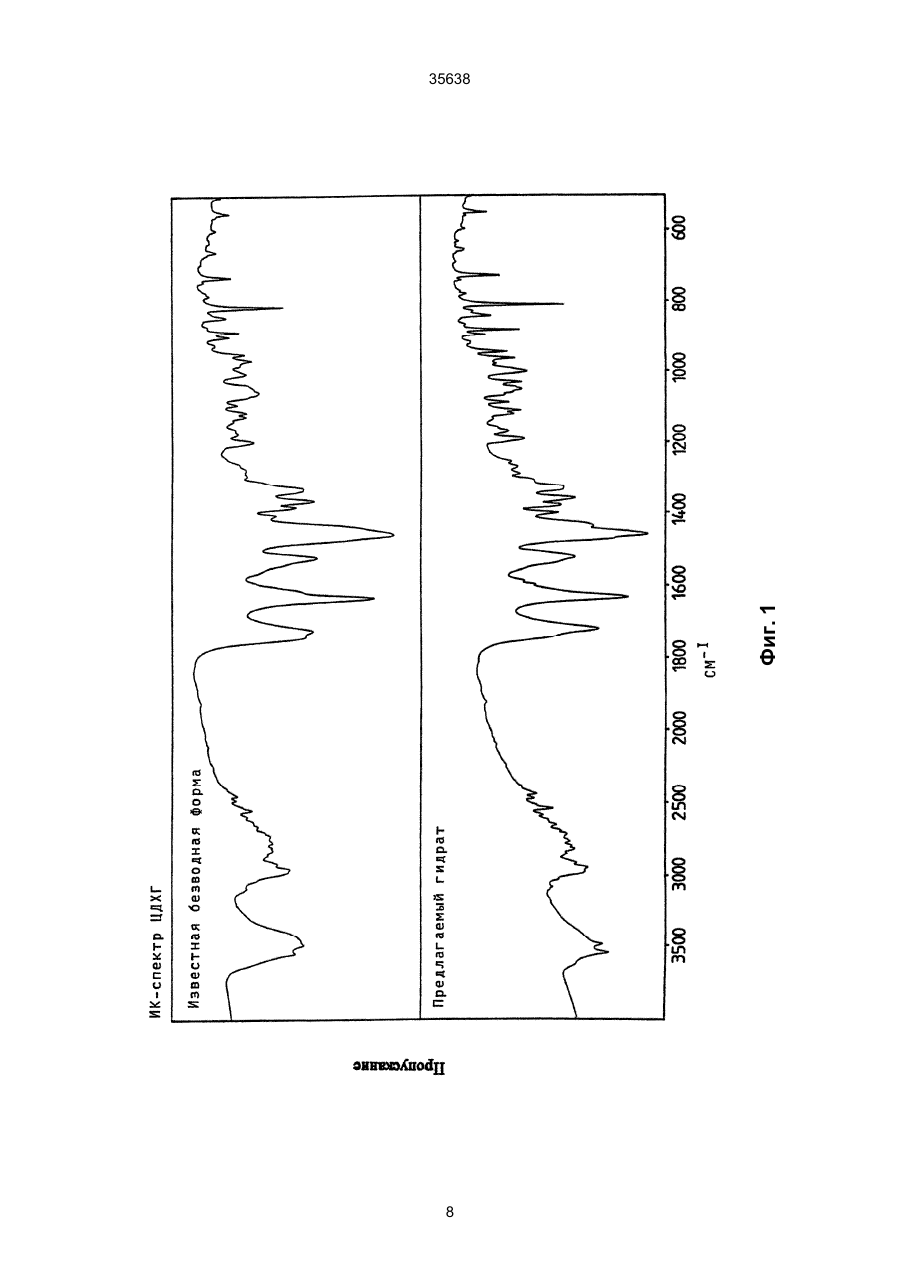
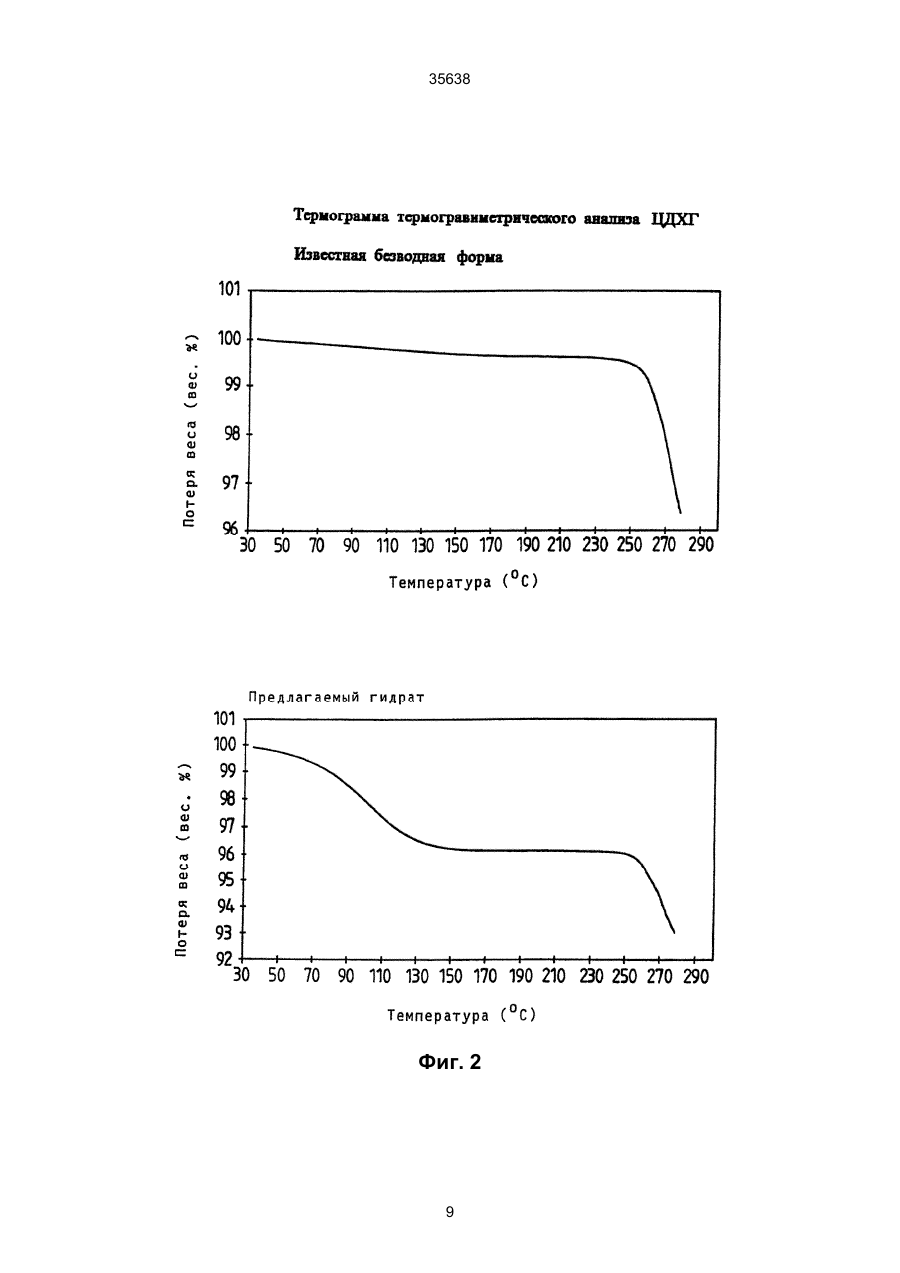
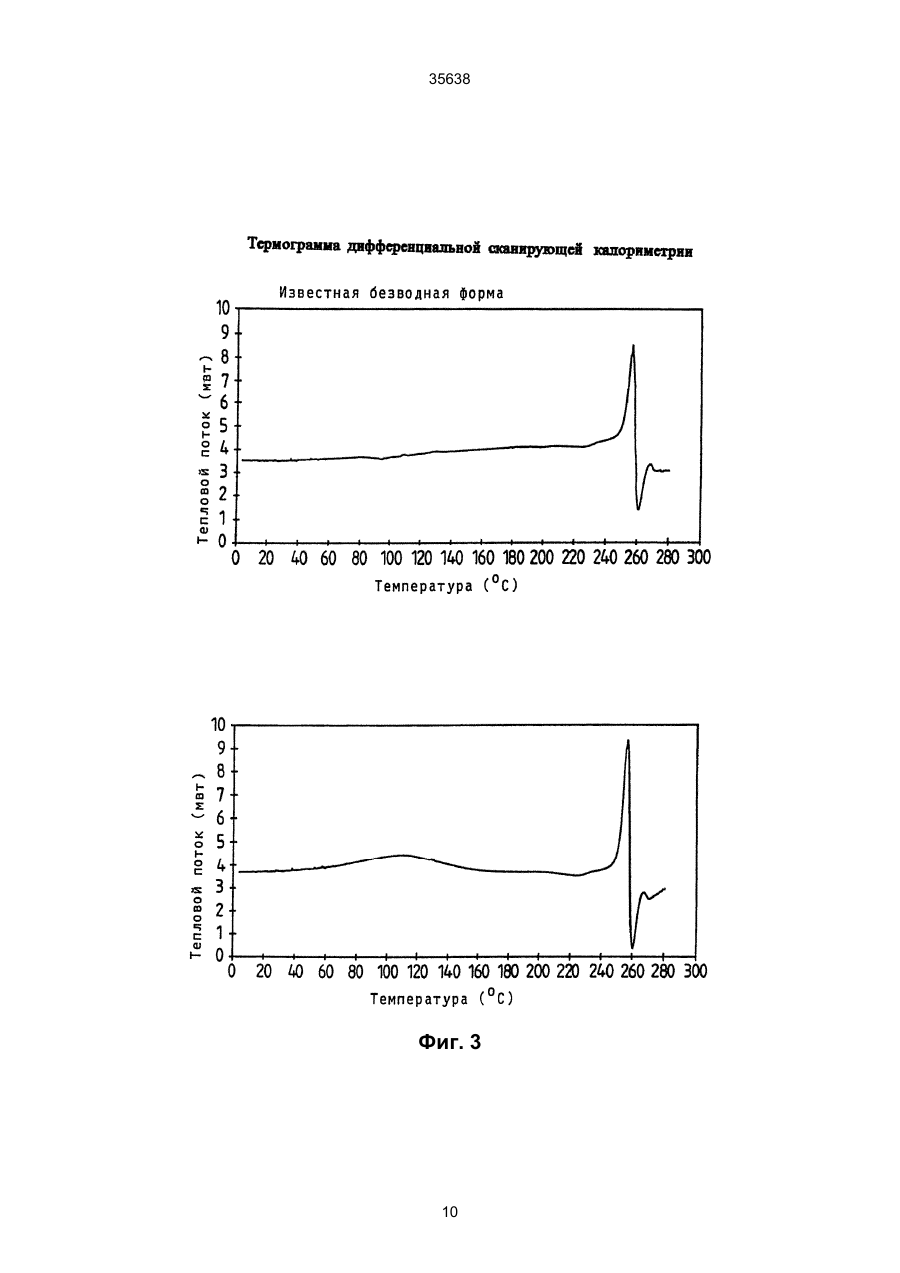
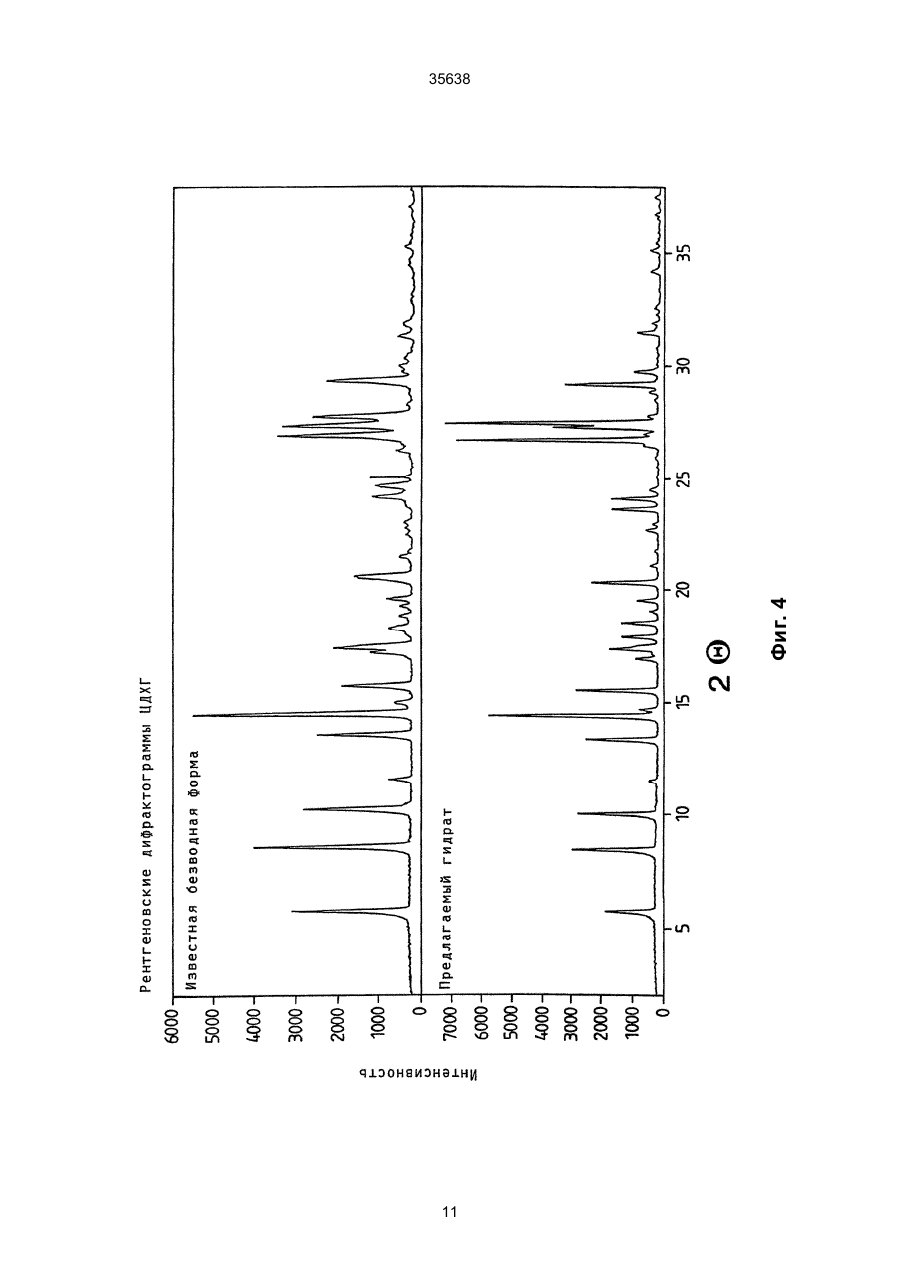
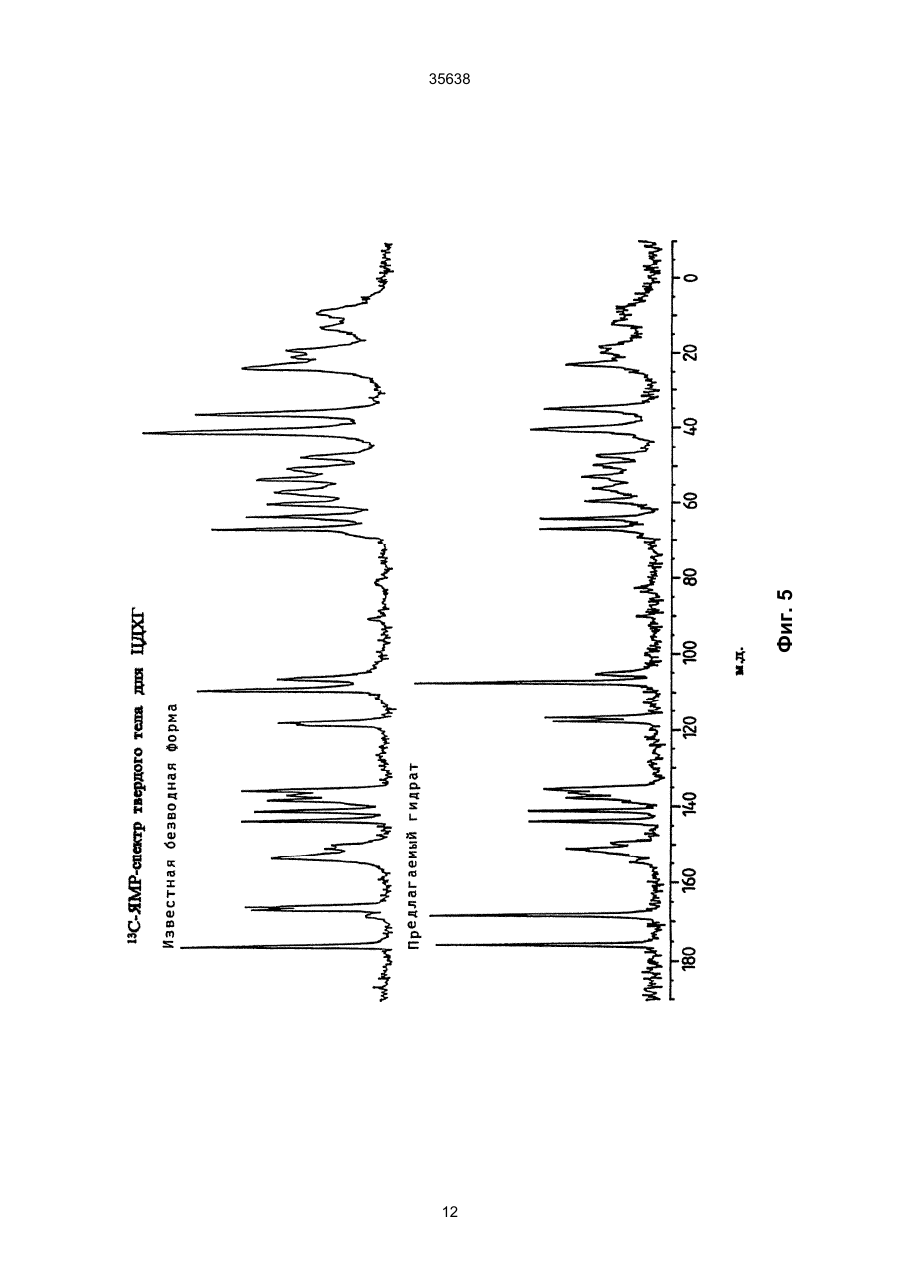
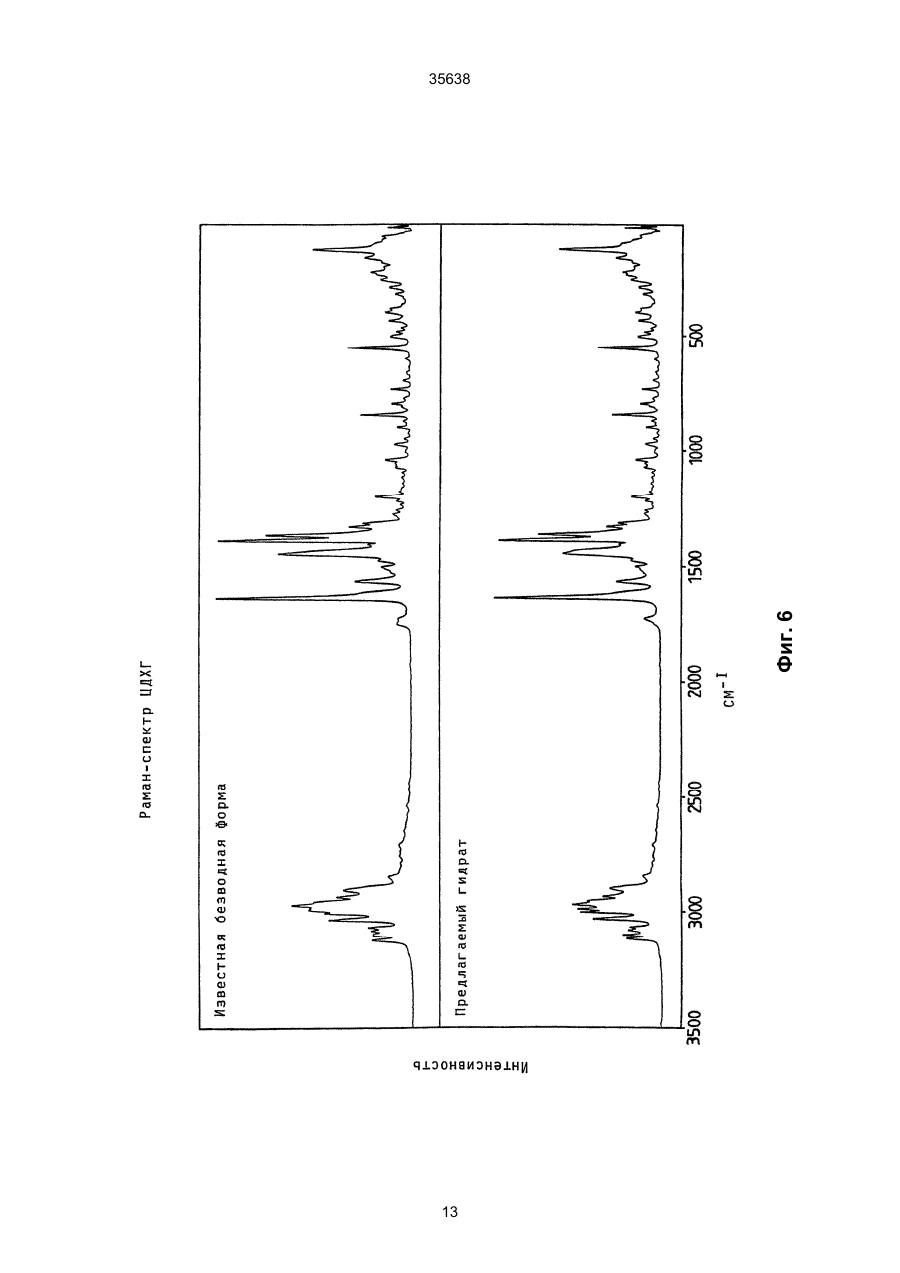
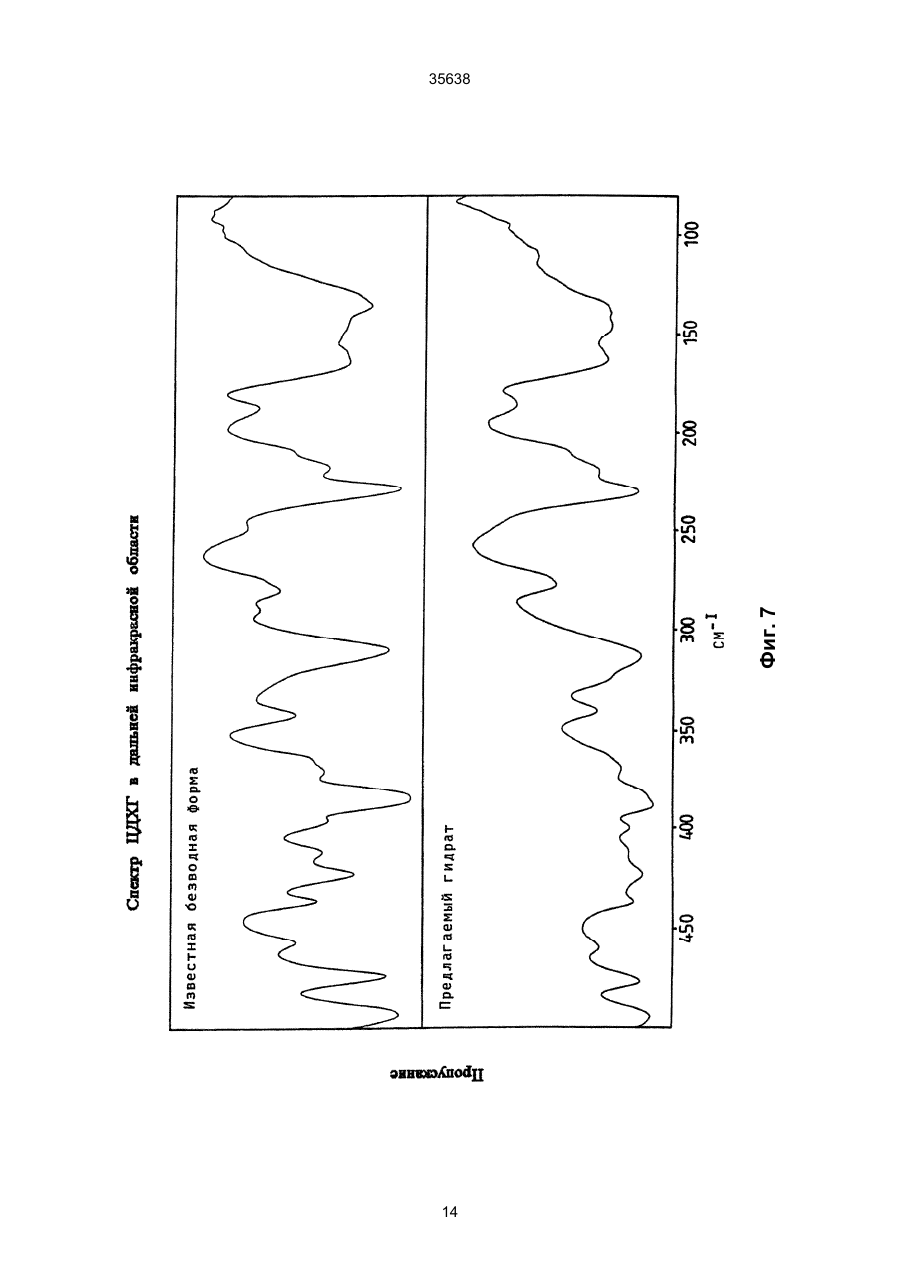
1. Моногидрат гидрохлорида 1-циклопропил7 - ([S,S] -2,8-диазабицикло[4.3.0]нон-8-ил)-6-фтор1,4-дигидро - 8 -метокси-4-оксо-3-хинолинкарбоновой кислоты формулы 35638 coli, их получение в виде внутренней соли четвертичного аммониевого основания описывается в заявке на европейский патент № 550 903 и в Международной заявке № 591 808. Безводная форма ЦДХГ не может, однако, вполне удовлетворить при изготовлении различных лекарственных форм. ЦДХГ гигроскопичен и поглощает влагу при неблагоприятных условиях хранения и при галеновой обработке биологически активных веществ в лекарственные формы. Это нарушает точность дозировки и вредит качеству препаратов. Причиной физической нестабильности ЦДХГ являются дополнительные изменения в кристаллической структуре безводной формы, когда ЦДХГ хранится в водных суспензиях или при влажности окружающей среды. Поэтому имеет большое значение применение, по возможности, стабильной кристаллической формы для получения лекарственной формы ЦДХГ. Было найдено, что ЦДХГ можно превратить в новую, содержащую воду, кристаллическую модификацию, которая отличается от известной безводной формы повышенной стабильностью, в особенности при хранении при высокой влажности, и очень хорошо подходит для приготовления устойчивых фармацевтических препаратов. При получении моногидрата биологически активное вещество кристаллизуется из водных сред в виде сильно переплетенных игл. Неожиданным образом габитус кристалла может быть изменен при определенных условиях кристаллизации. Полученные таким образом призмы представляют предпочтительную форму выполнения настоящего изобретения, так как они не переплетаются и обладают значительно большей текучестью, чем моногидрат в виде игл. Это очень ценно при получении лекарственных форм. При применении негигроскопичного сыпучего биологически активного вещества достигается удовлетворительная точность дозировки при получении лекарственных средств, что повышает безопасность и при этом делает риск для пациентов минимальным. Моногидрат ЦДХГ вышеуказанной формулы, в соответствии с изобретением, получают, когда безводный кристаллический ЦДХГ обрабатывают достаточным для хорошего смешения и образования моногидрата количеством воды при температуре до 80°С до поглощения стехиометрического количества кристаллизационной воды и полного превращения кристаллов, полученные таким образом кристаллы отделяют и для удаления имеющейся поглощенной воды сушат до постоянного веса моногидрата. Чтобы избежать образования безводной формы, влажность при высушивании должна быть не менее 30% относительной влажности. Моногидрат из водных сред с содержанием воды более 10% кристаллизуется в виде игл. Предпочтительная кристаллическая форма моногидрата в виде призм может быть получена при суспендировании безводного кристаллического ЦДХГ в смесях этанол/вода, особенно предпочтительно в этаноле/воде с максимальным содержанием воды 10%, при этом необходимо хорошее перемешивание твердой фазы с добавленным количеством воды для поглощения требуемого количества кристаллизационной воды и полного превращения кристаллов, например, путем перемешивания суспензии или встряхивания, покачивания, вращения реакционного сосуда и т.п. Если содержание воды в смеси этанол/вода составляет максимально 10%, моногидрат кристаллизуется в виде призм. При условии, что количество воды достаточно для образования стехиометрического моногидрата и для достижения хорошего смешивания ЦДХГ с прибавленной к нему водой, можно для образования моногидрата в виде игл использовать любое большое количество воды, так как поглощение кристаллизационной воды заканчивается вместе с происходящим при превращении кристаллов образованием моногидрата, и затем никакой другой гидрат больше не получается. Целесообразно ограничить количество воды таким образом, чтобы при наличии хорошего смешивания не происходило никакого или незначительного понижения растворимости. Получение моногидрата предпочтительно осуществлять при комнатной температуре, можно, однако, проводить реакцию при повышенной температуре, например, от 30°С до 60°С или при более низкой температуре, например, от 5°С до 20°С. Получение моногидрата удается также из безводной формы при относительной влажности более 30%. Этот способ не годится, однако, для получения предпочтительного кристаллического моногидрата в виде призм. Отделение кристаллов моногидрата от избытка растворителей происходит с помощью обычных методов, например, при фильтрации, декантировании, центрифугировании и тому подобных методах. Целесообразно сушить отделенные кристаллы моногидрата при комнатной температуре или при более высокой температуре до 50°С при относительной влажности, по крайней мере, 30%. Моногидрат ЦДХГ, в соответствии с данным изобретением, имеет характерный ИК-спектр (фиг. 1), в котором наблюдаются характеристические полосы поглощения кристаллизационной воды в области валентных колебаний группы ОН (36003100 см-1), которые отсутствуют в случае безводной кристаллической модификации. Спектр отличается также от спектра безводного ЦДХГ и в других областях частот, что может быть связано с совершенно различным расположением молекул в кристаллических решетках обеих модификаций. Определение содержания влаги подтверждает существование стехиометрического моногидрата ЦДХГ. Определенная в некоторых пробах моногидрата термогравиметрическая потеря массы составляет 1 моль воды (3,9%, фиг. 2). Снятая с помощью ДСК (дифференциальной сканирующей калориметрии) при атмосферном давлении термограмма моногидрата (фиг. 3) показывает, в соответствии с термогравиметрическими измерениями, отщепление воды, обнаруживаемое по широкому эндотермическому пику, который указывает на перестройку кристаллической решетки исследуемого моногидрата, диссоциацию ЦДХГ и воды, и энтальпию испарения свободноудаляемой кристаллизационной воды. Рентгеновские дифрактограммы, 13С-ЯМР-спектры, Раман-спектры и спектры в дальней инфракрасной области безводной формы и моногидрата указывают на характерные различия (фиг. 4-7, таблицы 2-5): так, например, в 2 35638 13 С-ЯМР-спектре обнаруживают характеристический пик при 168,1 м.д., а на рентгеновской дифрактограмме обнаруживают линию при угле 2Q=26,7. Термограммы дифференциальной сканирующей калориметрии и термогравиметрического анализа были получены при использовании приборов для термоанализа (DSC 7 и TGA 7) (фирмы Перкин-Эльмер). Рентгеновские дифрактограммы регистрировались с помощью трансмиссионного дифрактометра (Stoe). ИК-спектры, спектры в дальней инфракрасной области и Раман-спектры регистрировались с помощью ИК-спектрометров с Фурье-преобразованием IFS 66 (ИК), IFS 66v (спектры в дальней инфракрасной области) и IFS 88 (Раман-спектры) (фирмы Брукер). 13С-ЯМР-спектры твердого тела регистрировали с помощью прибора Bruker MSL 300. Микроскопические снимки были сделаны с помощью микроскопа Laborlux S (фирмы Ляйтц). Моногидрат ЦДХГ по изобретению проявляет при хранении, по сравнению с безводной кристаллической модификацией, более высокую физическую стабильность и поэтому более пригоден для изготовления различных лекарственных форм. Предпочитаемый кристаллизующийся в виде призм моногидрат придает ЦДХГ, кроме того, превосходную сыпучесть и текучесть, что является большим преимуществом при изготовлении фармацевтических препаратов (фиг. 8). Объектом изобретения является, поэтому, также фармацевтическая композиция с антибактериальной активностью, которая наряду, по крайней мере, с одним носителем содержит моногидрат ЦДХГ в соответствии с изобретением, в эффективном количестве, например, в виде суспензии, эмульсии, таблетки, драже, драже с ядром, суппозиториев, твердых или мягких желатиновых капсул и тому подобных форм. Водные суспензии и таблетки для перорального применения предпочтительно содержат моногидрат в соответствии с изобретением, особенно предпочтительно в кристаллической форме в виде призм. Фармацевтическая композиция может также содержать и другие антибактериальные активные вещества. В качестве носителей фармацевтическая композиция содержит обычные, применяемые принятым способом при изготовлении лекарств, вспомогательные средства и добавки, такие, как связующее вещество для таблеток, наполнители, консерванты, разрыхлитель для таблеток, средство для регулирования текучести, мягчитель, смачиватель, диспергатор, эмульгаторы, растворитель, вкусовые добавки и тому подобные вещества. Получение фармацевтической композиции осуществляется известным способом, например, при смешении, перемешивании, суспендировании, диспергировании, эмульгировании и тому подобных операциях, биологически активных веществ с, например, фармацевтическими вспомогательными веществами, и в переработке в фармацевтически пригодные полезные лекарственные формы для перорального, парентерального или ректального введения. Получение кристаллического ЦДХГ (иглы, призмы). Пример 1 (призмы). 1 г безводного ЦДХГ растворяют в 150 мл абсолютного этанола и раствор фильтруют. Раствор нагревают при 60°С до полного испарения растворителя. Выпавшие кристаллы высушивают при комнатной температуре при влажности окружающей среды. Пример 2 (призмы). 0,1 г безводного ЦДХГ растворяют в 10 мл этанола (10% воды). Раствор нагревают при 60°С до полного испарения растворителя. Выпавшие кристаллы высушивают при комнатной температуре при влажности окружающей среды. Пример 3 (призмы). 4 г безводного ЦДХГ растворяют в 300 мл этанола (96%). Растворитель отгоняют на роторном испарителе при 60°С и 120 мбар остаточного давления. Кристаллы высушивают в вакуум-сушильном шкафу 2 часа при 80 мбар остаточного давления и 105°С до достижения влажности окружающей среды. Пример 4 (иглы). 0,3 г безводного ЦДХГ растворяют в 6 мл смеси вода: этанол (1:1). Раствор нагревают при 70°С до полного испарения растворителя. Выпавшие кристаллы сушат при комнатной температуре в вакууме и после этого оставляют на ночь при комнатной температуре при относительной влажности 85%. Пример 5 (иглы). 0,1 г безводного ЦДХГ растворяют в 5 мл метанола. Раствор выдерживают при комнатной температуре до полного испарения растворителя. Кристаллы сушат при комнатной температуре в вакууме и затем оставляют на ночь при комнатной температуре при относительной влажности 85%. Пример 6 (иглы). 0,1 г безводного ЦДХГ растворяют в 5 мл воды. Раствор выдерживают при комнатной температуре до полного испарения растворителя. Кристаллы сушат в вакууме при комнатной температуре, а затем оставляют стоять на ночь при комнатной температуре при относительной влажности 85%. Пример 7. 25,1 г моногидрата ЦДХГ (призмы), 3,3 г Авицела РН 101 и 1,7 г кукурузного крахмала смешивают в грануляторе-смесителе и затем гранулируют с 13 г воды. После обработки с помощью рашпиля (4 мм) гранулят сушат в мини-сушилке в псевдоожиженном слое (температура приточного воздуха 80°С) и просеивают через сито (0,8 мм). Дополнительно смешивают с 0,19 г Ac-Di-Sol (модифицированная натрий-карбоксиметилцеллюлоза с поперечной сшивкой) и 0,01 г стеарата магния. После этого осуществляют прессование на прессе с эксцентриком (размер таблетки: диаметр - 5,5 мм, радиус кривизны - 9 мм, вес таблетки 68,5 мг). Пример 8. 196,6 г сверхизмельченного (до микрон) моногидрата ЦДХГ (иглы) смешивают с 88 г Авицела в грануляторе-смесителе (порошкообразная смесь); 3,6 г поливинилпирролидона 25 растворяют в 97,2 г воды (жидкость для гранулирования). Порошкообразную смесь гранулируют вместе с жидкостью для гранулирования. После обработки ра 3 35638 шпилем (3 мм) гранулят сушат в экспресс-сушилке (температура приточного воздуха 90°С) и просеивают через сито (1 мм). Дополнительно смешивают с 1,8 г Ac-Di-Sol (модифицированная натрийкарбоксиметилцеллюлоза с поперечной сшивкой) и 0,1 г стеарата магния. После этого производят прессование на ротационном прессе (размер таблетки: диаметр - 5,5 мм, радиус кривизны - 9 мм, вес таблетки - 83,4 мг). Таблица 1 ИК-спектрометрия Безводная форма, [см-1] 722 804 834 938 957 994 1048 1186 1319 1354 1372 1453 1513 1622 1709 2427 2524 2700 2929 3469 3527 Гидрат, [см-1] 722 804 835 875 938 994 1045 1082 1163 1184 1319 1352 1372 1394 1432 1456 1517 1624 1709 2427 2456 2524 2634 2925 2698 2745 2893 2925 3472 3530 Таблица 2 Рентгеновская дифрактометрия Безводная форма, [2Q] 5,8 8,6 10,3 11,6 13,6 14,5 15,0 15,8 17,3 17,5 18,3 18,9 19,3 19,6 20,6 21,5 22,5 Гидрат, [2Q] 5,8 8,5 10,1 11,6 13,4 14,5 14,8 15,6 17,0 17,2 17,4 17,5 17,9 18,6 19,1 19,6 20,4 4 35638 Продолжение таблицы 2 Безводная форма, [2Q] 22,8 23,0 23,8 24,2 24,7 25,0 26,3 27,0 27,4 27,8 28,2 29,4 29,7 30,0 30,3 31,3 31,8 34,5 35,3 37,1 Гидрат, [2Q] 21,1 21,8 22,7 23,0 23,6 24,1 24,5 26,5 26,7 27,0 27,3 27,5 27,8 28,5 28,9 29,2 29,7 31,4 31,9 32,3 32,6 34,2 35,1 35,5 36,8 37,5 Таблица 3 13 С-ЯМР-спектрометрия твердого тела Безводная форма, [м.д.] 8,5 12,3 14,1 18,2 20,0 22,8 35,2 39,7 46,5 49,5 52,3 55,9 59,2 62,6 65,8 105,4 108,1 116,9 117,5 134,7 136,0 137,3 140,1 142,6 150,1 152,6 165,3 166,0 175,5 Гидрат, [м.д.] 7,7 8,3 9,0 10,8 12,1 18,2 19,8 22,9 34,9 40,2 47,0 49,5 50,1 52,6 55,9 56,8 59,4 64,1 66,8 105,0 107,1 116,3 117,4 135,2 136,1 137,4 140,8 143,5 149,3 5 35638 Продолжение таблицы 3 Безводная форма, [м.д.] Гидрат, [м.д.] 150,9 168,1 175,5 Таблица 4 Раман-спектрометрия Безводная форма, [см-1] 110 147 243 278 388 425 496 543 723 833 964 1031 1191 1267 1305 1320 1354 1376 1433 1491 2891 2922 2957 2991 3020 3054 3069 3082 3088 3110 Гидрат, [см-1] 109 148 243 278 309 425 496 543 724 833 962 1031 1191 1305 1321 1352 1376 1433 1490 1554 1619 1711 2835 2888 2923 2942 2958 2977 2990 3019 3056 3069 3089 3106 6 35638 Таблица 5 Спектроскопия в дальней инфракрасной области Безводная форма, [см-1] 137 165 187 219 230 248 279 289 311 342 370 386 396 412 423 436 456 474 494 Гидрат, [см-1] 95 111 139 145 163 185 220 230 277 313 340 369 388 399 412 423 436 459 476 494 7 Фиг. 1 35638 8 35638 Фиг. 2 9 35638 Фиг. 3 10 Фиг. 4 35638 11 Фиг. 5 35638 12 Фиг. 6 35638 13 Фиг. 7 35638 14 35638 Фиг. 8 15 35638 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2001 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 16
ДивитисяДодаткова інформація
Назва патенту англійськоюMonohydrate of 1-cyclopropyl-7-([s,s]-2,8- diazabicyclo[4.3.0]non-8-yl)-6-fluoro-1,4-dihydro-8-methoxy-4-oxo-3-quinolinecarboxylic acid hydrochloride and pharmaceutical composition with antibacterial activity
Автори англійськоюGrunenberg Alfons, Bosche Patrick
Назва патенту російськоюМоногодрат гидрохлорида 1-циклопропил-7-([s,s]-2,8-диазабицикло[4.3.0]нон-8-ил)- 6-фтор-1,4-дигидро-8-метокси-4-оксо-3-хинолинкарбоновой кислоты и фармацевтическая композиция с антибактериальной активностью
Автори російськоюГруненберг Альфонс, Боше Патрик
МПК / Мітки
МПК: C07D 471/04, A61P 31/04, A61K 31/47
Мітки: 6-фтор-1,4-дигідро-8-метокси-4-оксо-3-хінолінкарбонової, фармацевтична, антибактеріальною, композиція, 1-циклопропіл-7-([s,s]-2,8-діазабіцикло[4.3.0]нон-8-іл, гідрохлориду, моногідрат, кислоти, активністю
Код посилання
<a href="https://ua.patents.su/16-35638-monogidrat-gidrokhloridu-1-ciklopropil-7-ss-28-diazabiciklo430non-8-il-6-ftor-14-digidro-8-metoksi-4-okso-3-khinolinkarbonovo-kisloti-ta-farmacevtichna-kompoziciya-z-antibakterialn.html" target="_blank" rel="follow" title="База патентів України">Моногідрат гідрохлориду 1-циклопропіл-7-([s,s]-2,8-діазабіцикло[4.3.0]нон-8-іл)- 6-фтор-1,4-дигідро-8-метокси-4-оксо-3-хінолінкарбонової кислоти та фармацевтична композиція з антибактеріальною активністю</a>
Попередній патент: Замкнутий скручений джгут та спосіб його виготовлення
Наступний патент: Система керування заглибними водо-нафтопідіймальними електронасосами
Випадковий патент: Стояк