Спосіб одержання фторорганічних сполук у спиртових розчинниках
Номер патенту: 83324
Опубліковано: 25.06.2008
Автори: Чі Дае Йун, Ох Сеунг Джун, Ріу Джин-сук, Мун Дае Хюк, Кім Донг Вук
Формула / Реферат
1. Спосіб одержання фторорганічних сполук, який відрізняється тим, що проводять взаємодію фториду з заміщеним алкілгалогенідом або заміщеним алкілсульфонатом у присутності спирту формули 1 як розчинника
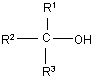 , 1
, 1
у якій R1, R2 і R3 означають атом водню або C1-C18-алкіл.
2. Спосіб за п. 1, який відрізняється тим, що фторид містить фтор-18 або фтор-19.
3. Спосіб за п. 1, який відрізняється тим, що R1 означає метил або етил; R2 означає метил або етил; і R3 означає метил або етил.
4. Спосіб за п. 1, який відрізняється тим, що спирт формули 1 вибраний з групи, що складається з первинних спиртів, таких як метанол, етанол, н-пропанол, н-бутанол, аміловий спирт, н-гексиловий спирт, н-гептанол або н-октанол; вторинних спиртів, таких як ізо-пропанол, ізо-бутанол, ізо-аміловий спирт і 3-пентанол; і третинних спиртів, таких як трет-бутанол, трет-аміловий спирт, 2,3-диметил-2-бутанол, 3-метил-3-пентанол, 3-етил-3-пентанол, 2-метил-2-пентанол, 2,3-диметил-3-пентанол, 2,4-диметил-2-пентанол, 2-метил-2-гексанол, 2-циклопропіл-2-пропанол, 2-циклопропіл-2-бутанол, 2-циклопропіл-3-метил-2-бутанол, 1-метилциклопентанол, 1-етилциклопентанол, 1-пропілциклопентанол, 1-метилциклогексанол, 1-етилциклогексанол і 1-метилциклогептанол.
5. Спосіб за п. 1, який відрізняється тим, що спирт формули 1 вибраний з групи, що складається з трет-бутанолу, трет-амілового спирту, 2,3-диметил-2-бутанолу.
6. Спосіб за пп. 1 або 2, який відрізняється тим, що фторидом є фторид цезію або фторид тетраалкіламонію, і спирт вибраний з групи, що складається з трет-бутанолу, трет-амілового спирту, 2,3-диметил-2-бутанолу.
7. Спосіб за пп. 1 або 2, який відрізняється тим, що фторид переважно вибраний з групи, що складається з фторидів лужних металів, що включають лужні метали, вибрані з групи, що складається з літію, натрію, калію, рубідію і цезію; фторидів лужноземельних металів, що включають лужноземельні метали, вибрані з групи, що складається з магнію, кальцію, стронцію і барію; і похідних фториду амонію.
8. Спосіб за п. 7, який відрізняється тим, що похідні фториду амонію переважно вибрані з групи, що складається з фторидів четвертинного амонію, включаючи фторид тетрабутиламонію і фторид бензилтриметиламонію; фторидів третинного амонію, включаючи фторид триетиламонію і фторид трибутиламонію; фторидів вторинного амонію, включаючи фторид дибутиламонію і фторид дигексиламонію; і фторидів первинного амонію, включаючи фторид бутиламонію і фторид гексиламонію.
9. Спосіб за пп. 1 або 2, який відрізняється тим, що фторидом є фторид цезію або фторид тетраалкіламонію.
10. Спосіб за п. 9, який відрізняється тим, що фторид цезію або фторид тетраалкіламонію адсорбований на підкладках, вибраних з групи, що складається з целіту, молекулярного сита, оксиду алюмінію і силікагелю.
11. Спосіб за пп. 1 або 2, який відрізняється тим, що кількість фториду складає 1,0-10 екв. до заміщеного алкілгалогеніду або заміщеного алкілсульфонату у разі фтору-19, і кількість фториду є слідовою кількістю [18F]фториду до заміщеного алкілгалогеніду або заміщеного алкілсульфонату у разі фтору-18.
12. Спосіб за п. 11, який відрізняється тим, що використовують 1 пкг-100 нг [18F]фториду на 1 мг заміщеного алкілгалогеніду або заміщеного алкілсульфонату солі фториду у разі фтору-18.
13. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фтордезоксиглюкоза формули 2
 2.
2.
14. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фтормізонідазол формули 3
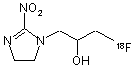 3.
3.
15. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фторестрадіол формули 4
 4.
4.
16. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фторпропілкарбометокситропан формули 5
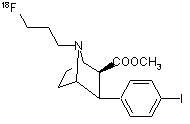 5.
5.
17. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фтоpDDNP формули 6
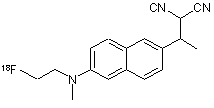 6.
6.
18. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фтортимідин формули 7
 7.
7.
19. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фторхолін формули 8
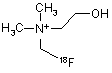 8.
8.
20. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фторетилхолін формули 9
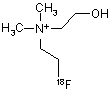 9.
9.
21. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фторпропілхолін формули 10
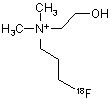 10.
10.
Текст
1. Спосіб одержання фторорганічних сполук, який відрізняється тим, що проводять взаємодію фториду з заміщеним алкілгалогенідом або заміщеним алкілсульфонатом у присутності спирту формули 1 як розчинника R1 2 (19) 1 3 83324 слідовою кількістю [18F]фториду до заміщеного алкілгалогеніду або заміщеного алкілсульфонату у разі фтору-18. 12. Спосіб за п. 11, який відрізняється тим, що використовують 1 пкг-100 нг [18F]фториду на 1 мг заміщеного алкілгалогеніду або заміщеного алкілсульфонату солі фториду у разі фтору-18. 13. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18 F]фтордезоксиглюкоза формули 2 OH O HO 18F H N OH 18 F 3. 15. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фторестрадіол формули 4 OH 18 F HO 4. 16. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18 F]фторпропілкарбометокситропан формули 5 18 F N COOCH 3 CN N 6. 18. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18 F]фтортимідин формули 7 O NH OH 2. 14. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18 F]фтормізонідазол формули 3 NO 2 N CN H 3C HO 18 4 HO N O O 18 F 7. 19. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фторхолін формули 8 CH 3 OH H 3C N + 18 F 8. 20. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фторетилхолін формули 9 CH 3 OH H 3C N + 18 F 9. 21. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18 F]фторпропілхолін формули 10 CH 3 OH H 3C N + I 5. 17. Спосіб за пп. 1 або 2, який відрізняється тим, що фторорганічною сполукою є [18F]фтоpDDNP формули 6 Даний винахід відноситься до способу отримання фторорганічних сполук, що містять фтор-18, радіоактивний ізотоп фтору. Конкретніше, даний винахід відноситься до способу отримання фторорганічних сполук із забезпеченням фторорганічних сполук з високим виходом за допомогою взаємодії фториду, що містить радіоактивний фтор-18, з алкілгалогенідом або алкілсульфонатом у присутності спирту формули 1 у якості розчинника. Формула 1 18 F 10. (у якій R1, R2 та R3 є атомами водню або С 1С18 алкілом). Атом фтор у має високу полярність і гідрофобні властивості, і має майже такий же розмір як атом водню. Такі фторорганічні сполуки, що містять 5 83324 атоми фтору, мають унікальні хімічні та фізіологічні властивості в порівнянні з взагалі органічними сполуками та застосовуються в області медицини, в якості агрохімікатів, барвників, полімерів і тому подібне [Gerstenberger M.R.C., Haas A., Angew. Chem., Int. Ed. Engl. 1981, 20, 647; Filler R., In Organofluorine Compounds in Medicinal Chemistry and Biomedical Applications; Filler R., Ed., Studies in Organic Chemistry 48, Elsevier, New York, NY, 1993, p. 1-23]. Як правило, фторорганічні сполуки отримують по реакції заміщення атома фтору взаємодією алкілгалогеніду або алкілсульфонату з фторидом, як представлено на схемі реакції 1. Схема реакції 1 R - X + MFn ® R - F Розчинник Галогенід в алкілгалогеніді вибраний з групи, що складається з СІ, Вr та І, за винятком F. Сульфонат в алкілсульфонаті є SO 3R12, де R12 є алкілом або арилом. Алкіл переважно представляє С1С12 алкілгалогенід або С 1-С12 алкілсульфонат. Наприклад, алкілсульфонат вибраний з групи, що складається з метансульфоната, етансульфоната, ізопропансульфоната, хлорметансульфоната, трифторметансульфоната та хлоретансульфоната. Арил переважно вибраний з групи, що складається з фенілу, С1-С4 алкіл фенілу, галогенфенілу, С1-С4 алкоксифенілу та нітрофенілу. Переважними прикладами є метилфенілсульфонат, етилфенілсульфонат, хлор фенілсульфонат, бромфенілсульфонат, метоксифенілсульфонат або нітрофенілсульфонат. Фторид (MFn), у якості джерела атомів фтору, вибраний з групи, що складається з фториду лужних металів, що містить лужні метали, такі як літій, натрій, калій, рубідій або цезій; і фториду лужноземельних металів, що містить лужноземельні метали, такі як магній, кальцій, стронцій або барій; і фториду амонію, що містить амоній або його похідні, такі як тетраалкіламоній. Як правило, реакцію нуклеофільного фтор у Як приклад, повідомлялося про використання фториду тетрабутиламонію у якості фториду, для отримання фторорганічних сполук з високим виходом в м'яких умовах реакції [Сох, D.P.; Terpinsky, J.; Lawrynowicz, W. J. Org. Chem. 1984, 49, 3216]. Проте для фториду тетрабутиламонія гідрата властива проблема, що полягає в тому, що утворюється велика кількість спирту, який є побічним продуктом, викликаним присутністю води, і утворюється алкен в якості іншого побічного продукту за рахунок високої основності фториду тетрабутиламонію. Отже, для отримання фторорганічних сполук взаємодією фториду з алкілгалогенідом або алкілсульфонатом потрібний спосіб отримання, який може привести до зниження тривалості реакції за рахунок підвищення реакційної здатності фториду і може зменшити утворення побічних продуктів, таких як алкен або спирт, за допомогою усунення 6 вання проводять в полярному апротонному розчиннику, такому як ацетонітрил (CH3CN), диметилформамід (ДМФА) або диметилсульфоксид (ДМСО), для підвищення розчинності фториду і реакційної здатності фториду. Відомо, що спирт, будучи протонним розчинником, не підходить для проведення реакції нуклеофільного фторування. Також відомо, що спирт утворює водневі зв'язки з фторидом, який є джерелом атомів фтору, і тим самим знижує його реакційну здатність в реакції нуклеофільного фторування [Smith M.D.; March J. Ad vanced Organic Chemistry, 5th ed., Wiley Interscience: New York, N Y, 2001, pp. 389-674]. Повідомлялося, що в способі отримання вищезгаданих фторорганічних сполук алкілфторид отримують взаємодією фториду калія з алкілгалогенідом в розчиннику етилгліколі [Hoffmann, F.W., J. Am. Chem. Soc, 1948, 70, 2596]. Проте даний спосіб отримання має недоліки, що полягають в низькому виході та великій тривалості реакції при високій температурі реакції вище 140°С за рахунок низької реакційної здатності в результаті низької розчинності фториду калію. Повідомлялося, що 18-краун-6-ефір, який утворює сильні зв'язки з іонами металів, використовували у якості каталізатора для отримання фторорганічних сполук для підвищення розчинності фториду та реакційної здатності фториду при відносно низькій температурі в межах 80-90°С і м'яких умов реакції, і при цьому вихід продукту був високим [Liotta, С. L.; Harris H.P., J. Am. Chem. Soc, 1974, 96, 2250]. Проте даний спосіб має недоліки, що полягають в тому, що 18-краун-6-ефір є дорогою сполукою, потрібна велика тривалість реакції, та утворюється велика кількість алкена в якості побічного продукту, оскільки фторид функціонує в якості основи. Відомо, що, коли фторид використовується в отриманні фторорганічних сполук, то має місце побічна реакція, представлена в схемі реакції 2. Схема реакції 2 впливу вологи і зведення до мінімуму основності самого фториду. Заявники спробували вирішити вказані вище проблеми. У способі отримання фторорганічних сполук взаємодією алкілгалогеніду або алкілсульфонату з фторидом заявники встановили, що даний винахід слід розглядати як в наступній реакції, представленій на фігурі 1, але що теоретично не завжди обмежується цим. Заявники виявили, що спиртовий розчинник підвищує реакційну здібність фториду до н уклеофільного заміщення за допомогою ослаблення іонних зв'язків у фториді між катіонами металу і аніонами фтору за рахунок утворення водневих зв'язків з фторидами металу і знижує побічні реакції за рахунок зменшення впливу основності на реакцію фторування шляхом зменшення основності фториду через утворення водневих зв'язків фториду, і так було виконано даний винахід. 7 83324 Розкриття суті винаходу Технічне рішення Метою даного винаходу є забезпечення способу отримання фторорганічних сполук з високим виходом за допомогою взаємодії фториду з алкілгалогенідом або алкілсульфонатом при підвищенні розчинності фториду за рахунок ослаблення іонних зв'язків у фториді між катіонами металу і аніонами фтору і одночасному зменшенні тривалості реакції в результаті підвищеної реакційної здатності фториду. Спосіб отримання може привести до підвищення реакційної здатності фториду до н уклеофільного заміщення і одночасного зменшення утворення побічних продуктів усуненням впливу вологи або зниженням основності самого фториду. Переважні ефекти даного винаходу За даним винаходом фторорганічні сполуки можна вибірково отримати, у якості основних продуктів, з ви ходом, що складає більше 90% за допомогою зменшення утворення побічних продуктів при використанні спирту в якості розчинника реакції. Спиртовий розчинник підвищує реакційну здібність фториду до нуклеофільного заміщення за допомогою ослаблення іонних зв'язків між катіонами металу та аніонами фтору за рахунок утворення водневих зв'язків з фторидами металу, за допомогою чого можна вирішити проблему низької реакційної здатності в результаті сильних іонних зв'язків атома фтору звичайним способом, скоротити час реакції за рахунок підвищення реакційної здатності і швидкості реакції фториду та зменшити утворення побічних продуктів за рахунок зменшення впливу основності за допомогою ослаблення основності фториду через утворення водневих зв'язків фториду. Короткий опис фігур Фігура 1 представляє схемне зображення принципу того, як спирт приводить до ослаблення іонних зв'язків між катіонами металу та аніонами фтор у за допомогою утворення водневих зв'язків з фторидом металу згідно зразковому варіанту здійснення даного винаходу. Фігура 2 представляє схемне зображення одноразової касети згідно зразковому варіанту здійснення даного винаходу. Опис переважного варіанту здійснення даного винаходу Даний винахід відноситься до способу отримання фторорганічних сполук застосуванням спирту формули 1 в якості розчинника, в якому фторорганічні сполуки отримують взаємодією фториду з алкілгалогенідом або алкілсульфонатом. Формула 1 (у якій R1, R2 тa R3 представляють атом водню або С1-С18 алкіл). Фторорганічні сполуки в справжньому винаході представляють фторорганічні сполуки, фтор-18, що містять, та/або фтор-19. У способі отримання фторорганічних сполук за 8 даним винаходом переважно R1 представляє атом водню або С1-С18 алкіл, переважно R2 є атомом водню або С1-C18 алкілом, переважно R3 представляє атом водню або С1-С18 алкіл, переважніше R1 є метилом або етилом, переважніше R2 представляє метил або етил, переважніше R3 є метилом або етилом. У способі отримання фторорганічних сполук за даним винаходом спирт формули 1 переважно вибраний з групи, що складається з первинних спиртів, таких як метанол, етанол, н-пропанол, нбутанол, аміловий спирт, н-гексиловий спирт, нгептанол або н-октанол; вторинних спиртів, таких як ізопропанол, ізобутанол, ізоаміловий спирт, 3пентанол; і третинних спиртів, таких як третбутанол, трет-аміловий спирт, 2,3-диметил-2бутанол, 2-(трифторметил)-2-пропанол, 3-метил-3пентанол, 3-етил-3-пентанол, 2-метил-2-пентанол, 2,3-диметил-3-пентанол, 2,4-диметил-2-пентанол, 2-метил-2-гексанол, 2-циклопропіл-2-пропанол, 2циклопропіл-2-бутанол, 2-циклопропіл-3-метил-2бутанол, 1-метилциклопентанол, 1етилциклопентанол, 1-проплциклопентанол, 1метилциклогексанол, 1-етилциклогексанол і 1метилциклогептанол. Переважніше спирт вибраний з групи, що складається з третинних спиртів, таких як трет-бутанол, трет-аміловий спирт, 2,3диметил-2-бутанол і 2-(трифторметил)-2пропанол. Сіль фториду переважно вибрана з групи, що складається з фторидів лужних металів, що містять лужні метали, вибрані з групи, що складається з літію, натрію, калію, рубідію і цезію; фторидів лужно-земельних металів, що містять лужноземельні метали, вибрані з групи, що складається з магнію, кальцію, стронцію та барію; та фториду амонію. Переважніше в способі отримання фторорганічних сполук за даним винаходом бажаними є фторид цезію та фторид амонію. Вказаний вище фторид амонію переважно вибраний з групи, що складається з фторидів четвертинного амонію, що включають фторид тетрабутиламонію та фторид бензилтриметиламонію; фторидів третинного амонію, що включають фторид триетиламонію та фторид трибутиламонію; фторидів вторинного амонія, що включають фторид дибутиламонію та фторид дигексиламонію; та фторидів первинного амонію, що включають фторид бутиламонію та фторид гексиламонію, переважніше в способі отримання фторорганічних сполук за даним винаходом бажаним є фторид тетрабутиламонію. У способі отримання фторорганічних сполук за даним винаходом фторид тетраалкіламонію або фторид лужного металу, включаючи цезій, переважно адсорбований на підкладках, вибраних з групи, що складається з целіту, молекулярного сита, оксиду алюмінію та силікагелю. У способі отримання фторорганічних сполук за даним винаходом в найбільш переважній комбінації фториду та спирту фторидом є фторид металу або фторид тетраалкіламонію, конкретніше фторид цезію або фторид тетрабутиламонію, та переважним спиртом є третинний спирт, такий як третбутанол і трет-аміловий спирт. 9 У способі отримання фторорганічних сполук за даним винаходом кількість вказаного вище фториду переважно складає 1,0-10 екв до алкілгалогеніду або алкілсульфонату. У способі отримання фторорганічних сполук за даним винаходом фторорганічна сполука, отримана з використанням спирту формули 1 в якості розчинника, представляє [18F]фтордезоксиглюкозу формули 2. Формула 2 У способі отримання фторорганічних сполук за даним винаходом фторорганічна сполука, отримана з використанням спирту формули 1 в якості розчинника, представляє [18F]фтормізонідазол формули 3. Формула З У способі отримання фторорганічних сполук за даним винаходом фторорганічна сполука, отримана з використанням спирту формули 1 в якості розчинника, представляє [18F]фторестрадіол формули 4. Формула 4 У способі отримання фторорганічних сполук за даним винаходом фторорганічна сполука, отримана з використанням спирту формули 1 в якості розчинника, представляє [18 F]фторпропілкарбометокситропан формули 5. Формула 5 У способі отримання фторорганічних сполук за даним винаходом фтоорганічна сполука, отримана з використанням спирту формули 1 в якості розчинника, представляє [18F]фторDDNP формули 6. Формула 6 83324 10 У способі отримання фторорганічних сполук за даним винаходом фтоорганічна сполука, отримана з використанням спирту формули 1 в якості розчинника, представляє [18F]фтортимідін формули 7. Формула 7 У способі отримання фторорганічних сполук за даним винаходом фтоорганічна сполука, отримана з використанням спирту формули 1 в якості розчинника, представляє [18F]фтор холін формули 8. Формула 8 У способі отримання фторорганічних сполук за даним винаходом фтоорганічна сполука, отримана з використанням спирту формули 1 в якості розчинника, представляє [18F]фторетилхолін формули 9. Формула 9 У способі отримання фторорганічних сполук за даним винаходом фтоорганічна сполука, отримана з використанням спирту формули 1 в якості розчинника, представляє [18F]фторпропілхолін формули 10. Формула 10 У способі отримання за даним винаходом Спиртовий розчинник утворює водневі зв'язки з фторидом і тим самим підсилює реакцію нуклеофільного заміщення фториду. Таким чином, можна вирішити проблему низької реакційної здатності 11 83324 фториду за рахунок утворення теіонних зв'язків у фториді між катіонами металу та аніонами фтору, можна зменшити час реакції та можна отримати кінцевий продукт фторорганічної сполуки з високим виходом при одночасному зменшенні побічних реакцій. Опис способу за даним винаходом Нижче будуть детально описані зразкові варіанти здійснення даного винаходу. У способі отримання фторорганічної сполуки за допомогою взаємодії фториду з алкілгалогенідом або алкілсульфонатом, спирт формули 1 використовують в якості розчинника. Переважно реакцію проводять при 0-150°С протягом 0,5-24 години, переважніше реакцію проводять протягом 1-10 години при 20-120°С, ще переважніше реакцію проводять при 40-100°С протягом 1,5-6 години. Точка кипіння, спорідненість до води, хімічна стабільність і реакційна здатність спирту залежать від складу алкільної групи в спирті формули 1. По мірі зростання числа атомів вуглецю в спирті та алкільних заступників точка кипіння та плавлення спирту збільшується. Спирт, що має високу точку кипіння і плавлення, не підходить у якості розчинника або знаходиться в твердому стані. Спирт, що має низьке число атомів вуглецю в алкілі або меншу кількість алкільних замісників, не підходить у якості розчинника, оскільки реакційна здатність самого спирту зростає за рахунок зменшення стеричної перешкоди спирту. З ура хуванням даних ефектів R1 переважно представляє атом водню або C1-C18 алкіл, переважніше С1-С6 алкіл, ще переважніше метил або етил. R2 переважно є атомом водню або С 1-С18 алкілом, переважніше С1-С6 алкілом, ще переважніше метилом або етилом. R3 переважно представляє атом водню або С1-С18 алкіл, переважніше С1-С6 алкіл, ще переважніше метил або етил. В якості прикладів спирту, описаного вище, переважно спирт вибраний з групи, що складається з первинних спиртів, таких як метанол, етанол, н-пропанол, н-бутанол, аміловий спирт, нгексиловий спирт, н-гептанол або н-октанол; і вторинних спиртів, таких як ізопропанол, ізобутанол, ізоаміловий спирт, 3-пентанол; і третинних спиртів, таких як трет-бутанол, трет-аміловий спирт, 2,3диметил-2-бутанол, 2-(трифторметил)-2-пропанол, 3-метил-3-пентанол, 3-етил-3-пентанол, 2-метил2-пентанол, 2,3-диметил-3-пентанол, 2,4-диметил2-пентанол, 2-метил-2-гексанол, 2-циклопропіл-2пропанол, 2-циклопропіл-2-бутанол, 2циклопропіл-3-метил-2-бутанол, 1-метилциклопентанол, 1-етилциклопентанол, 1-пропілциклопентанол, 1-метилциклогексанол, 1-етилциклогексанол і 1-метилциклогептанол. Переважніше спирт вибраний з групи, що складається з третинних спиртів, таких як трет-бутанол, третаміловий спирт, 2,3-диметил-2-бутанол і 2(трифторметил)-2-пропанол. Спиртовий розчинник за даним винаходом підвищує реакційну здібність фториду до нуклеофільного заміщення ослабленням іонних зв'язків у 12 фториді між катіонами металу і аніонами фтору за допомогою утворення водневих зв'язків з фторидом металу і фторидом тетраалкіламонію та також зменшує утворення побічних продуктів за рахунок ослаблення основності фториду. Спосіб за даним винаходом слід розглядати як в наступній схемі реакцій, представленій на фігурі 1, але що теоретично не завжди обмежується цим. Крім того, було встановлено, що реакція з алкілсульфонатом є ефективнішою в порівнянні з алкілгалогенідом, оскільки спиртутворює водневі зв'язки з алкілсульфонатом. У способі отримання фторорганічних сполук за даним винаходом фторид, що є джерелом іонів фтор у, можна вибрати з групи, що складається з фторидів лужних металів, що містять лужні метали, вибрані з групи, що складається з літію, натрію, калію, рубідію та цезію; і фторидів лужноземельних металів, що містять лужно-земельні метали, вибрані з групи, що складається з магнію, кальцію, стронцію та барію; і фториду амонію. Вказаний вище фторид амонію переважно вибраний з групи, що складається з фторидів четвертинного амонію, таких як фторид тетрабутиламоній і фторид бензилтриметиламоній; і фторидів третинного амонію, таких як фторид триетиламонію та фторид трибутиламонію; фторидів вторинного амонію, таких як фторид дибутиламонію та фторид дигексиламонію; та фторидів первинного амонію, таких як фторид бутиламонію та фторид гексиламонію, найпереважніше можна використовувати фторид цезію або фторид тетрабутиламонію. Фторид лужного металу, включаючи цезій, та фторид тетраалкіламонію можна використовувати у формах, адсорбованих на різних підкладках. Наприклад, фторид цезію та фторид тетрабутиламонію адсорбують на підкладках, таких як целіт, молекулярне сито, оксид алюмінію та силікагель. Коли використовують фтор-19, та кількість фториду переважно складає 1,0-10 екв до алкілгалогеніду або алкілсульфонату, переважніше 3,0-6,0 екв. Коли додають меншу кількість фториду, чим вказані межі, то вихід реакції стає менше. Коли додають більшу кількість фториду чим вказані межі, то вихід реакції стає вищим, але має місце перевитрата фториду. З тієї ж причини у разі фтору-18 переважно використовують кількість [18F] сліду фториду як фторид в порівнянні з кількістю алкілгалогеніду або алкіл сульфонату. Переважніше використовують 1пкг - 100нг [18F]фториду на 1 міліграм алкілгалогеніду або алкілсульфонату. З іншого боку можна отримати фторорганічну сполуку, що включає мітку фтор-18, взаємодією алкілгалогеніду або алкілсульфонату з фторидом із радіоактивним ізотопом, що випускає позитрони, фтором-18. В даному випадку фтор у фториді, який є радіоактивним ізотопом, представляє фтор18, конкретніше [18F]фторид. У способі отримання фторорганічні сполуки взаємодією фториду з алкілгалогенідом або алкілсульфонатом фторорганічну сполуку вибірково отримують з високим виходом, що складає більше 90%, у якості основного продукту при зменшенні 13 83324 побічних реакцій і використанні третинного спирту у якості розчинника реакції. В протилежність, згідно до варіанту здійснення даного винаходу, у разі ацетонітрилу або ДМФА, що є полярними апротонними розчинниками, зазвичай вживаними для отримання фторорганічних сполук, вихід є низьким за рахунок низької розчинності фториду. Коли реакцію проводять при використанні 1,4-діоксану або бензолу, які є неполярними розчинниками, то взагалі не отримують фторорганічні сполуки (див. таблицю 1). Насамкінець спиртовий розчинник, що використовується в даному винаході, приводить до підвищення реакційної здатності фториду до нуклеофільного заміщення за допомогою ослаблення іонних зв'язків між катіонами металу і аніонами фтор у за рахунок утворення водневих зв'язків з фторидом лужних металів і фторидом тетраалкіламонію, і таким чином, звичайним способом можна подолати проблему низької реакційної здатності фториду в результаті сильних іонних зв'язків у фториді, скоротити час реакції підвищенням реакційної здатності і швидкості реакції фториду, і отримати фторорганічну сполуку по справжньому винаходу з високим виходом. Крім того, спирт, що є протонним розчинником, може пригнічувати утворення побічних продуктів за рахунок впливу на основність під час реакції фтор ування шляхом зниження основності фториду в результаті утворення водневих зв'язків з фторидом. Отже, може знизитися утворення побічних продуктів, таких як спирти і алкени. За даним винаходом з використанням способу отримання фторорганічних сполук при застосуванні спирту формули 1 у якості розчинника можна отримати фторорганічні сполуки з вищим виходом, при меншій тривалості реакції та у м'якіших умовах в порівнянні із звичайним способом отримання. Було показано, що фторорганічні сполуки можна отримати з високим виходом за допомогою іншого способу отримання, вже розкритого заявниками [Kim, D.W.; Song, C.E.; Chi, D.Y. J. Am. Chem. Soc, 2002, 124, 10278-10279]. Проте, спосіб, описаний у наведеній вище роботі, має економічні недоліки, оскільки необхідна дорога іонна рідина, тоді як у даному винаході використовуються дешеві спирти. Наведений вище звичайний спосіб є дуже придатним для отримання неполярних фторорганічних сполук. Наприклад, можна отримати 18Fвідмічені фторорганічні сполуки з високим виходом [Kim, D.W.; Choe, Y.S.; Chi, D.Y. Nucl. Med. Biol., 2003, 30, 345-350]. У тих випадках, коли дійсно синтезують 18F-відмічені радіоактивні лікарські препарати, то даний спосіб має недолік, що полягає в тому, що дуже скрутне їх відділення від іонної рідини, оскільки більшість 18F-відмічених радіоактивних лікарських препаратів є полярними. Отже, приведений вище спосіб не можна використовувати для отримання 18F-відмічених радіоактивних лікарських препаратів. В цьому відношенні даний винахід має велику практичну придатність в отриманні 18F-відмічених радіоактивних лікарських препаратів. Даний винахід забезпечує різні застосування для отримання F-відмічених радіоактивних лікарських препаратів. 14 Зразкові варіанти здійснення за даним винаходом призначені для застосувань відносно існуючих Fвідмічених радіоактивних лікарських препаратів. Даний винахід буде докладніше описано при зверненні до наступних прикладів. Наступні варіанти здійснення є прикладами даного винаходу, і даний винахід не слід розглядати як такий, що обмежується представленими нижче варіантами здійснення; а більшою мірою дані варіанти здійснення представлені для опису принципу винаходу для фахівців в даній області. Очевидно, фа хівцям в даній області зрозуміло, що можна зробити різні зміни, що стосуються форми і деталей, не відступаючи від суті і об'єм у винаходу, визначених формулою винаходу, що додається. Приклад 1 Отримання фторорганічних сполук 1 280 міліграм (1,0ммоль) 2-(3метансульфонілоксипропокси) нафталіну і 456 міліграм (3,0ммоль) фториду цезію додають до розчинника, 4,0мл трет-бутанолу. Реакційну суміш перемішують протягом 6 годин при 80°С. У реакційну суміш вносять 7мл простого етилового ефіру для видалення солей металів. Після фільтрування фільтрат концентрують при зниженому тиску. 188 міліграм (вихід 92%) 2-(3-фторпропокси) нафталіну отримують колоночною хроматографією (суміш етілацетат:н-гексан=1:20). Приклад 2 Отримання фторорганічних сполук 2-7 Реакції проводять таким самим способом, що описаний у прикладі 1, за винятком того, що спиртові розчинники, температура реакції і час є такими, як представлені в таблиці 1. Фторорганічні сполуки отримують, як представлено в таблиці 1. На схемі реакції 3 показані 2-(3-фторпропокси) нафталіну (А), 2-(3-гідроксипропокси) нафталіну (В), 2-(3-аллилокси) нафталіну (С) і 2-(3алкоксипропокси) нафталіну (D), які є продуктами, що їх отримали при отриманні фторорганічних сполук. Порівняльний приклад 1 Отримання фторорганічних сполук 1 280 міліграм (1,0ммоль) 2-(3метансульфонілоксипропокси) нафталіну і 456 міліграм (3,0ммоль) фториду цезію додають до 4,0мл ацетонітрілу, використовуваному замість спирту. Реакційну суміш перемішують протягом 6 годин при 80°С. Реакція майже не протікає, і таким чином, показана важлива роль спирту для отримання фторорганічних сполук. Порівняльний приклад 2 Отримання фторорганічних сполук 2 280 міліграм (1,0ммоль) 2-(3метансульфонілоксипропокси) нафталіну і 456 міліграм (3,0ммоль) фториду цезію додають до 4,0мл ДМФА, використовуваному замість спирту. Реакційну суміш перемішують протягом 6 годин при 80°С. Після реакції як і раніше залишається 33% реагуючи х речовин. Утворюється велика кількість спирту і алкену у якості побічних продуктів. Показана важлива роль спирту для отримання фторорганічних сполук. 15 83324 Порівняльні приклади 3-4 Отримання фторорганічних сполук 3-4 280 міліграм (1,0ммоль) 2-(3метансульфонілоксипропокси) нафталіну і 456 міліграм (3,0ммоль) фториду цезію додають до 4,0мл бензолу або 1,4-діоксану, що використовуються замість спирту. Реакційну суміш перемішують протягом 6 годин при 80°С. Реакція майже не протікає, і таким чином, показана важлива роль спирту для отримання фторорганічних сполук. Порівняльні приклади 5-6 16 Отримання фторорганічних сполук 5-6 Для підтвердження підвищення реакційної здатності за рахунок утворення водневих зв'язків між фторидом і спиртом реакцію проводять таким же способом, як описаний в прикладі 1, з використанням броміду калію, який не утворює водневі зв'язки із спиртом, замість фториду. Реакція бромування майже не протікає, і таким чином, показано, що утворення водневих зв'язків між спиртом і фторидом є важливим для підвищення реакційної здатності фториду. Таблиця 1 Розчинник Фторид Приклад 1 Приклад 2 Порівняльний клад 1 Порівняльний клад 2 Порівняльний клад 3 Порівняльний клад 4 Температура (С) Час (год) t-BuOH приприпри 80 6 n-BuOH при CsF CsF 80 6 АВихід В 92 64 С D 7 30 CH3CN CsF 80 6 91 7 Кількість сліду ДМФА CsF 80 6 33 48 8 9 1,4діоксан CsF 80 6 94 бензол CsF 80 6 97 CsF 80 6 93 5 CsF 80 2,5 94 4 KBr 80 6 94 Кількість сліду KBr 80 6 67 30 RbF 80 24 13 76 9 KF 80 24 90 Кількість сліду 7 TBAF 80 1 Кількість сліду 4 третаміловий спирт третПриклад 4 аміловий спирт третПорівняльний приаміловий клад 5 спирт Порівняльний приCH3CN клад 6 третПриклад 5 аміловий спирт третПриклад 6 аміловий спирт третПриклад 7 аміловий спирт Приклад 3 SM Кількість сліду 4 Схема реакції 3 Дані, представлені в таблиці 1, показують, що 2-(3-фторпропокси) нафталіну (А) отримують (вихід 92%), коли використовують фторид цезію у якості джерела атомів фтору, і третинні спирти, трет-бутанол або трет-аміловий спирт, використовують у якості розчинника (приклади 1, 3 і 4). 17 83324 У тих випадках, коли у якості джерела атомів фтор у використовують фторид тетрабутиламонія замість фториду цезію, то вихід основного продукту складає більше 90% (приклад 7). Коли використовують фторид рубідія, то реакція фтор ування протікає, але для реакції потрібний більший час (приклад 5). У разі порівняльних прикладів 1 і 2 при використанні полярного апротонного розчинника, який зазвичай застосовують для отримання фторорганічних сполук, і у разі використання неполярного розчинника, реакційну суміш обробляють протягом 6 годин. Реакція зовсім не протікає, або утворюються великі кількості побічних продуктів, і вихід продукту складає тільки 48%. Даний результат свідчить, що використання спирту є важливим для отримання фторорганічних сполук. 2-(3-нбутоксипропокси) нафталіну (D), побічний продукт ефір, утворюється (30%), коли у якості розчинника використовують н-бутанол, первинний спирт. Даний результат показує, що застосування третинного спирту замість первинного або вторинного спиртів пригнічує утворення ефірів у якості побічних продуктів. У порівняльних прикладах 5 і 6 бромід калію, не здатний до утворення водневих зв'язків, використовують замість фториду для підтвердження підвищення реакційної здатності за рахунок утво 18 рення водневих зв'язків між спиртом і фторидом. Встановлено, що реакція бромування майже не протікає, і утворення водневих зв'язків між спиртом і фторидом є важливим для підвищення реакційної здатності фториду при отриманні фторорганічних сполук. Приклад 8 Отримання фторорганічних сполук 8 356 міліграм (1,0ммоль) 2-(3толуолсульфонілоксипропокси) нафталіну і 456 міліграм (3,0ммоль) фториду цезію додають до 4,0мл трет-амілового спирту в реакційній судині. Реакційну суміш перемішують протягом 2 годин при 90°С. Додають 7мл простого етилового ефіру для видалення солі металу. Після фільтрування фільтрат концентрують при зниженому тиску. 190 міліграм (вихід 93%) 2-(3-фторпропокси) нафталіну отримують колоночною хроматографією (суміш етілацетат:н-гексан=1:20). Приклади 9-14 Отримання фторорганічних сполук 9-14 Реакції проводять таким же способом, який описаний в прикладі 8, за винятком того, що використовують 1,0ммоль декілька алкілгалогенідів або алкілсульфонатів, представлених в таблиці 2, замість 2-(3-толуолсульфонілоксипропокси) нафталіну. 19 83324 20 Як представлено в таблиці 2, реакції проводять протягом 1,5-24 годин при 25-110°С залежно від використовуваних алкілгалогенідів або алкілсульфонатів. Встановлено, що фторорганічні сполуки отримують з високим виходом. Приклад 15 Отримання фторорганічних сполук 15 Отримання [18F] фтордезоксиглюкози (FDG) Спосіб отримання [18F]фтордезоксиглюкози представлений на схемі реакції 4. 10 мккюрі [18Р]фториду адсорбують на іонообмінній смолі. Адсорбований [18F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18F]фторид висушують ацетонітрілом (500мкл * 3). До розчину додають 20 міліграм трифлата манози. І потім до реакційної суміші дода ють змішаний розчин з 300мкл трет-бутилового спирту або трет-амілового спирту і 300мкл ацетонітрілу. Реакцію проводять при 100°С протягом 15хв. Розчинник видаляють при 95°С з використанням газоподібного азоту і потім вносять 500мкл 2н(ДМСО) розчину NaOH. Гідроліз проводять протягом 2хв. при кімнатній температурі і потім вносять 3мл води для розбавлення. Реакційну суміш послідовно пропускають через картридж з нейтральним оксидом алюмінію, картридж tC18 і картридж ІС-Н+ з отриманням чистої [18 F]фтордезоксиглюкози. У дослідженні, проведеному у вказаних ви ще умовах, з поправкою на ослаблення радіохімічний вихід складає 95,12,7%, і радіохімічна чистота дорівнює 98,2±1,3%. Схема реакції 4 Приклад 16 Отримання фторорганічних сполук 16 Автоматизоване отримання [18F] фтордезоксиглюкози (FDG) Автоматизоване отримання [18F] фтордезоксиглюкози проводять в умовах реакції, описаних в прикладі 15. Пристрій для автоматизованого отримання є GE TracerLab MX, і робочу програму модифікують для отримання [18 F]фтордезоксиглюкози. Використовують одноразову касету для отримання, і схематичне зображення касети показане на фігурі 2. Після вставки одноразового картріджа для GE TracerLab MX в автоматичне устаткування вносять хімічні реактиви таким чином: 7мл ацетонітрілу у флакон V1 ємкістю 10мл, 20 міліграм трифлата манози (1,2мл трет-бутилового спирту або третамілового спирту і 0,8мл ацетонітрілу) у флакон V2 ємкістю 10мл, 5мл етанолу у флакон V3 ємкістю 10мл, 5мл 1н розчину НСl і буфер у флакон V4 і 2мл 2н розчину NaOH в шприц об'ємом 2мл. 1,000 мккюрі [18F]фториду отримують з міченої киснем-18 води в циклотроні і потім [18F]фторид переносять в автоматичний пристрій GE TracerLab MX під тиском газоподібного гелію. Перенесений [18 F]фторид адсорбують на картриджі з іонообмінною смолою і кисень-18 видаляють в резервуар для міченої киснем-18 води. Адсорбований [18 F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 21 83324 22 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. Елюйований [18F]фторид повністю висушують 1мл ацетонітрілу у флаконі V1. Після додавання трифлата манози у флаконі V2 в реакційній судині, що містить висушений [18F]фторид, проводять реакцію при 100°С протягом 15хв., і потім розчинник повністю видаляють. У реакційну судин у додають 1мл ацетонітрілу у флаконі V1 і потім суміш переносять в шприц 1 на фігурі 2. Проміжний продукт реакції розбавляють додаванням 25мл води і потім адсорбують на картриджі tC18. Після додавання 2н розчину NaOH в 2мл шприці до адсорбованого проміжного продукту для гідролізу, чисті [18 F]фтордезоксиглюкозу отримують після очищення пропусканням через картридж з нейтральним оксидом алюмінію і картридж tC18. Коли автоматизоване отримання проводять у вказаних вище умовах, то з поправкою на ослаблення радіохімічний вихід складає 75,1±7,4%, і радіохімічна чистота дорівнює 98,2±1,2%. Приклад 17 Отримання фторорганічних сполук 17 Отримання [18F]фтормізонідазолу (FMISO) 1 Спосіб отримання [18F]фтормізонідазолу представлений на схемі реакції 5. 10 мккюрі [18 F]фториду адсорбують на іонообмінній смолі. Адсорбований [18F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (2 міліграми в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18F]фторид висушують ацетонітрілом (500мкл * 3). До даного розчину додають 10 міліграм 1-(1,2-епоксипропіл)-2-нітромідазолу. Після додавання змішаного розчину, що містить 500мкл трет-бутилового спирту або трет-амілового спирту і 100мкл ацетонітрілу, до вказаної вище реакційної суміші, реакцію проводять при 100°С протягом 15хв. Розчинник видаляють з використанням газоподібного азоту при 95°С і потім в реакційну судину вносять 200мкл ацетонітрілу і 1000мкл води. Чисті [18F]фтормізонідазол отримують високоефективною рідинною хроматографією (ВЕРХ). Умови проведення ВЕРХ є наступними: використовують колонку Alltech Econosil C18, суміш вода:етанол=95:5 використовують із швидкістю потоку 5мл/хв., і прилад має УФ-ДЕТЕКТОР при 254нм і радіоактивний детектор. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 75,4±3,1%, і радіохімічна чистота дорівнює 98,1±0,7%. Схема реакції 5 Приклад 18 Отримання фторорганічних сполук 18 Отримання [18F]фтормізонідазолу (FMISO) 2 Інший спосіб отримання [18F]фтормізонідазолу представлений на схемі реакції 6. 10 мккюрі [18 F]фториду адсорбують на іонообмінній смолі. Адсорбований [18F] фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18F]фторид висушують ацетонітрілом (500мкл * 3). До даного розчину додають 10 міліграм 1-(2-нітро-1-імідазоіл)-2-Отетрагідропіраніл-3-Отолуолсульфонілоксипропандіола. Після додавання змішаного розчину, що містить 500мкл третбутилового спирту або трет-амілового спирту і 100мкл ацетонітрілу, до вказаної вище реакційної суміші реакцію проводять при 100°С протягом 10хв. Розчинник повністю видаляють з використанням газоподібного азоту при 95°С і потім в реакційну судину вносять 200мкл ацетонітрілу і 500мкл 1н розчину НСl. Гідроліз проводять при 100°С протягом 5хв. Чистий [18F]фтормізонідазол отримують високоефективною рідинною хроматографією ВЕРХ. Умови проведення ВЕРХ є наступними: використовують колонку Alltech Econosil C18, суміш вода:етанол=95:5 використовують із швидкістю потоку 5мл/хв., і прилад має УФДЕТЕКТОР при 254нм і радіоактивний детектор. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 75,4±3,1%, і радіохімічна чистота дорівнює 98,1±0,7%. Схема реакції 6 Приклад 19 Отримання фторорганічних сполук 19 Отримання [18F]фторестрадіолу (FES) Спосіб отримання [18F]фторестрадіолу пред 23 83324 24 ставлений на схемі реакції 7. 10 мккюрі [18 F]фториду адсорбують на іонообмінній смолі. Адсорбований [18F] фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18F]фторид висушують ацетонітрілом (500мкл * 3). До розчину додають 3 міліграми 3-Ометоксиметил-16b,17b-епістріол-Оциклосульфона. Після додавання змішаного розчину, що містить 400мкл трет-бутилового спирту або трет-амілового спирту і 100мкл ацетонітрілу, до вказаної вище реакційної суміші, проводять реакцію при 100°С протягом 15хв. Розчинник повністю видаляють з використанням газоподібного азоту при 95°С і потім в реак ційну судину вносять 200мкл ацетонітрілу і 50мкл 1н розчину НСl, і гідроліз проводять в атмосфері азоту при 100°С протягом 5хв. Вказану вище методику проводять три рази. Чистий [18 F]фторестрадіол отримують ВЕРХ. Умови проведення ВЕРХ є наступними: використовують колонку Nucleosil C18 120-5A C18, суміш вода:етанол=40:60 використовують із швидкістю потоку 4мл/хв., і прилад має УФ-ДЕТЕКТОР при 280нм і радіоактивний детектор. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 72,1±1,1%, і радіохімічна чистота дорівнює 98,4±1,2%. Схема реакції 7 Приклад 20 Отримання фторорганічних сполук 20 Автоматизоване отримання [18 F]фторестрадіолу (FES) Автоматизоване отримання [18 F]фторестрадіолу проводять в умовах реакції, описаних в прикладі 19. Пристрій для автоматизованого отримання є GE TracerLab MX і робочу програму модифікують для отримання [18 F]фторестрадіолу. Використовують одноразову касету для отримання, і схематичне зображення касети показане на фігурі 2. Після вставки одноразового картріджа для GE TracerLab MX в автоматичне устаткування вносять хімічні реактиви таким чином: 7мл ацетонітрілу у флакон V1 ємкістю 10мл, 3 міліграми 3-Ометоксиметил-16,17-епістріол-О-циклосульфона (1,5мл трет-бутилового спирту або трет-амілового спирту і 0,5мл ацетонітрілу) у флакон V2 ємкістю 10мл, 3мл етанолу і змішаний розчин 500мкл 2н розчину NaOH і 1мл води у флакон V3 ємкістю 10мл, 0,63мл 2н розчину НСl і 6мл ацетонітрілу у флакон V4 і флакони поміщають в одноразову касету. 1,0 кюрі [18F]фториду отримують з міченої киснем-18 води в циклотроні і потім отриманий [18 F] фторид переносять в автоматичний пристрій GE TracerLab MX під тиском газоподібного гелію. Перенесений [18F]фторид адсорбують на картриджі з іонообмінною смолою і кисень-18 видаляють в резервуар для міченої киснем-18 води. Адсорбований [18F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. Елюйований [18F]фторид повністю висушують 1мл ацетонітрілу у флаконі V1. Після додавання 3-Oмeтoкcимeтил-16β,17β-eпicтpioл-O-циклocyльфoнa у флаконі V2 в реакційну судину, що містить висушений [18F]фторид, реакцію проводять при 95°С протягом 5хв., і потім розчинник видаляють. Гідро ліз проводять при 90°С додаванням змішаного розчину 2мл НСl і ацетонітрілу у флаконі V4 в реакційну судину. Дану методику повторюють три рази. Розчинники видаляють після гідролізу. Змішаний розчин у флаконі V3 додають в реакційну судину для розчинення реакційної суміші. Чистий [18 F]фторестрадіол отримують ВЕРХ. Умови проведення ВЕРХ є наступними: використовують колонку Nucleosil С18 120-5А С18, суміш вода:етанол=40:60 використовують із швидкістю потоку 4мл/хв., і прилад має УФ-ДЕТЕКТОР при 280нм і радіоактивний детектор. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 42,1±5,1%, і радіохімічна чистота дорівнює 98,0±1,1%. Приклад 21 Отримання фторорганічних сполук 21 Отримання [18 F]фторпропілкарбометокситропана (FP-CIT) 1 Спосіб отримання [18 F]фторпропілкарбометокситропана представлений на схемі реакції 8. 10 мккюрі [18F]фториду адсорбують на іонообмінній смолі. Адсорбований [18 F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18 F]фторид висушують ацетонітрілом (500мкл * 3). До даного розчину додають 10 міліграм 1,3дитозилпропана. Після додавання змішаного розчину, що містить 500мкл трет-бутилового спирту або трет-амілового спирту і 100мкл ацетонітрілу, до вказаної вище реакційної суміші, реакцію проводять при 95°С протягом 15хв. Розчинник видаляють з використанням газоподібного азоту при 95°С і потім вносять 5 міліграм нор-b-CIT у суміші 300мкл ацетонітрілу і 500мкл трет-бутилового спирту. Реакцію проводять при 135°С протягом 40хв. Чистий [18F]фторпропілкарбометокситропан 25 83324 26 отримують ВЕРХ. Умови проведення ВЕРХ є наступними: використовують колонку m-Bondapack С18, суміш - фосфорна кислота:ацетонітріл=40:60 використовують із швидкістю потоку 5мл/хв, і прилад має УФ-ДЕТЕКТОР при 220нм і радіоактивний детектор. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 25,3±2,1%, і радіохімічна чистота дорівнює 97,2±1,3%. Схема реакції 8 Приклад 22 Отримання фторорганічних сполук 22 Отримання [18 F]фторпропілкарбометокситропана (FP-CIT) 2 Спосіб отримання [18 F]фторпропілкарбометокситропана представлений на схемі реакції 9. 10 мккюрі [18F]фториду адсорбують на іонообмінній смолі. Адсорбований [18 F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу). [18F]фторид висушують ацетонітрілом (500мкл * 3). До реакційного розчину додають 5 міліграм (3-метансульфонілоксипропіл)-2bкарбометокси-3b-(4-йодфеніл)тропана або (3толуолсульфонілоксипропіл)-2b-карбометокси-3b(4-йодфеніл)тропана і змішаний розчин, що містить 100мкл ацетонітрілу і 500мкл трет-бутилового спирту або трет-амілового спирту. Реакцію проводять при 95°С протягом 10хв. Розчинник повністю видаляють з використанням газоподібного азоту при 95°С і потім в реакційну судину вносять 300мкл ацетонітрілу і 500мкл води. Чистий [18 F]фторпропілкарбометокситропан отримують ВЕРХ. Умови проведення ВЕРХ є наступними: використовують колонку m-Bondapack С18, суміш фосфорна кислота:ацетонітріл=40:60 використовують із швидкістю потоку 5мл/хв., і прилад має УФ-ДЕТЕКТОР при 220нм і радіоактивний детектор. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 25,3±2,1%, і радіохімічна чистота дорівнює 97,2±1,3%. Схема реакції 9 Приклад 23 Отримання фторорганічних сполук 23 Отримання [18F]фторDDNP (FDDNP) Спосіб отримання [18 F]фторпропілкарбометокситропана представлений на схемі реакції 10. 10 мккюрі [18F]фториду адсорбують на іонообмінній смолі. Адсорбований [18 F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18 F] фторид висушують ацетонітрілом (500мкл * 3). До розчину додають 4 міліграми тозилпопередника, представленого на схемі реакції 9. Після додавання змішаного розчину, що містить 500мкл трет-бутилового спирту або трет-амілового спирту і 100мкл ацетонітрілу, до вказаної вище реакційної суміші, реакцію проводять при 95°С протягом 10хв. Розчинник видаляють з використанням газоподібного азоту при 95°С. Реакційну суміш розчиняють в ацетонітрілі і радіохімічний вихід продукту визначають з використанням радіо 27 83324 28 ізотопної ТСХ. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 42,3±4,1%, і радіохімі чна чистота дорівнює 97,2±1,3%. Схема реакції 10 Приклад 24 Отримання фторорганічних сполук 24 Отримання [18F]фтортимідіна (FLT) Інший спосіб отримання [18F]фтортимідіна представлений на схемі реакції 11. 10 мккюрі [18 F]фториду адсорбують на іонообмінній смолі. Адсорбований [18F] фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18 F] фторид висушують ацетонітрілом (500мкл * 3). До розчину додають 10-40 міліграм 3-N-трет-бутоксикарбоніл-(5'-О-(4,4'диметокситрифенілметил)-2-дезокси-3'-О-(4нітробензолсульфоніл)-b-D-треопентофуранозіл) тиміну або 3-N-трет-бутоксикарбоніл-(5'-О(трифенілметил)-2-дезокси-3'-О-(4нітробензолсульфоніл)-b-D-треопентофуранозіл) тиміну і потім додають суміш 100мкл ацетонітрілу і 500мкл трет-бутилового спирту або трет-амілового спирту. Реакцію проводять при 100-150°С протягом 10хв. Розчинник видаляють з використанням газоподібного азоту при 95°С і потім додають 200мкл ацетонітрілу і 500мкл 1н розчину НСl. Гідроліз проводять при 100°С протягом 5хв. Чистий [18 F]фтортимідін отримують ВЕРХ. Умови проведення ВЕРХ є наступними: використовують колонку Alltech Econosil С18, суміш вода:етанол=90:10 використовують із швидкістю потоку 5мл/хв., і прилад має УФ-ДЕТЕКТОР при 267нм і радіоактивний детектор. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 85,6±3,1%, і радіохімічна чистота дорівнює 98,5±1,2%. Схема реакції 11 Приклад 25 Отримання фторорганічних сполук 25 Отримання [18F]фторхоліну (Fхоліну) Інший спосіб отримання [18F]фторхоліну представлений на схемі реакції 12. 10 мккюрі [18 F]фториду адсорбують на іонообмінній смолі. Адсорбований [18F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18F]фторид висушують ацетонітрілом (500мкл * 3). До розчину додають 10 міліграм 1,1ди-п-толуолсульфонілоксиметану і потім додають змішаний розчин, що містить 500мкл третбутилового спирту або трет-амілового спирту і 100мкл ацетонітрілу. Реакцію проводять при 100150°С протягом 10хв. Після закінчення реакції додають N,N-диметиламіноетанол для алкілування. Чистий [18F]фторхолін отримують ВЕРХ. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 75,7±3,1%, і радіохімічна чистота дорівнює 97,5±1,2%. Схема реакції 12 Приклад 26 Отримання фторорганічних сполук 26 Отримання [18F]фторетилхоліну (FЕхоліну) Інший спосіб отримання [18F]фторетилхоліну представлений на схемі реакції 13. 10 мккюрі [18 F]фториду адсорбують на іонообмінній смолі. Адсорбований [18F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18 F] фторид висушують ацетонітрілом (500мкл * 3). До розчину додають 10 міліграм 1,2-ди-п-толуолсульфонілоксиметану і потім до дають змішаний розчин, що містить 500мкл третбутилового спирту або трет-амілового спирту і 100мкл ацетонітрілу. Реакцію проводять при 100150°С протягом 10хв. Після закінчення реакції додають N,N-диметиламіноетан для алкілування. Чистий [18 F]фторетилхолін отримують ВЕРХ. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 67,7±8,1%, і радіохімічна чистота дорівнює 98,2±2,3%. Схема реакції 13 Приклад 27 Отримання фторорганічних сполук 27 Отримання [18F]фторпропілхоліну (FРхоліну) Спосіб отримання [18F]фторпропілхоліну представлений на схемі реакції 14. 10 мккюрі [18 F]фториду адсорбують на іонообмінній смолі. Адсорбований [18F]фторид елююють в реакційну судину змішаним розчином карбонату цезію (16 міліграм в 300мкл води) і Kryptofix 222 (22 міліграми в 300мкл ацетонітрілу) або розчином тетрабутиламмонію. [18 F] фторид висушують ацетонітрілом (500мкл * 3). До розчину додають 10 міліграм 1,3-ди-п-толуолсульфонілоксипропану і потім додають змішаний розчин, що містить 500мкл третбутилового спирту або трет-амілового спирту і 100мкл ацетонітрілу. Реакцію проводять при 100150°С протягом 10хв. Після закінчення реакції додають N,N-диметиламіноетанол для алкілування. Чистий [18F]фторпропілхолін отримують ВЕРХ. У дослідженні, проведеному у вказаних вище умовах, з поправкою на ослаблення радіохімічний вихід складає 72,4±6,1%, і радіохімічна чистота дорівнює 98,1±1,3%. Схема реакції 14 31 Комп’ютерна в ерстка А. Крулевський 83324 Підписне 32 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparation of organofluoro compounds in alcohol solvents
Автори англійськоюMoon Dae Hyuk, Chi Dae Yoon, Kim Dong Wook, Oh Seung Jun, Ryu Jin-Sook
Назва патенту російськоюСпособ получения фторорганических соединений в спиртовых растворителях
Автори російськоюМун Дае Хюк, Чи Дае Йун, Ким Донг Вук, Ох Сеунг Джун, Риу Джин-сук
МПК / Мітки
МПК: C07C 233/58, C07C 69/76, C07C 17/007
Мітки: фторорганічних, одержання, сполук, спиртових, розчинниках, спосіб
Код посилання
<a href="https://ua.patents.su/16-83324-sposib-oderzhannya-ftororganichnikh-spoluk-u-spirtovikh-rozchinnikakh.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання фторорганічних сполук у спиртових розчинниках</a>
Попередній патент: Морозиво комбіноване
Наступний патент: Спосіб одержання полімерних порожнистих мікросфер
Випадковий патент: Спосіб одержання сульфату нікелю реактивної кваліфікації












