Похідні гідантоїну, що застосовуються як mmp інгібітори
Номер патенту: 93425
Опубліковано: 10.02.2011
Автори: Мунк Аф Розеншольд Маґнус, абос Балі, Чапмен Девід
Формула / Реферат
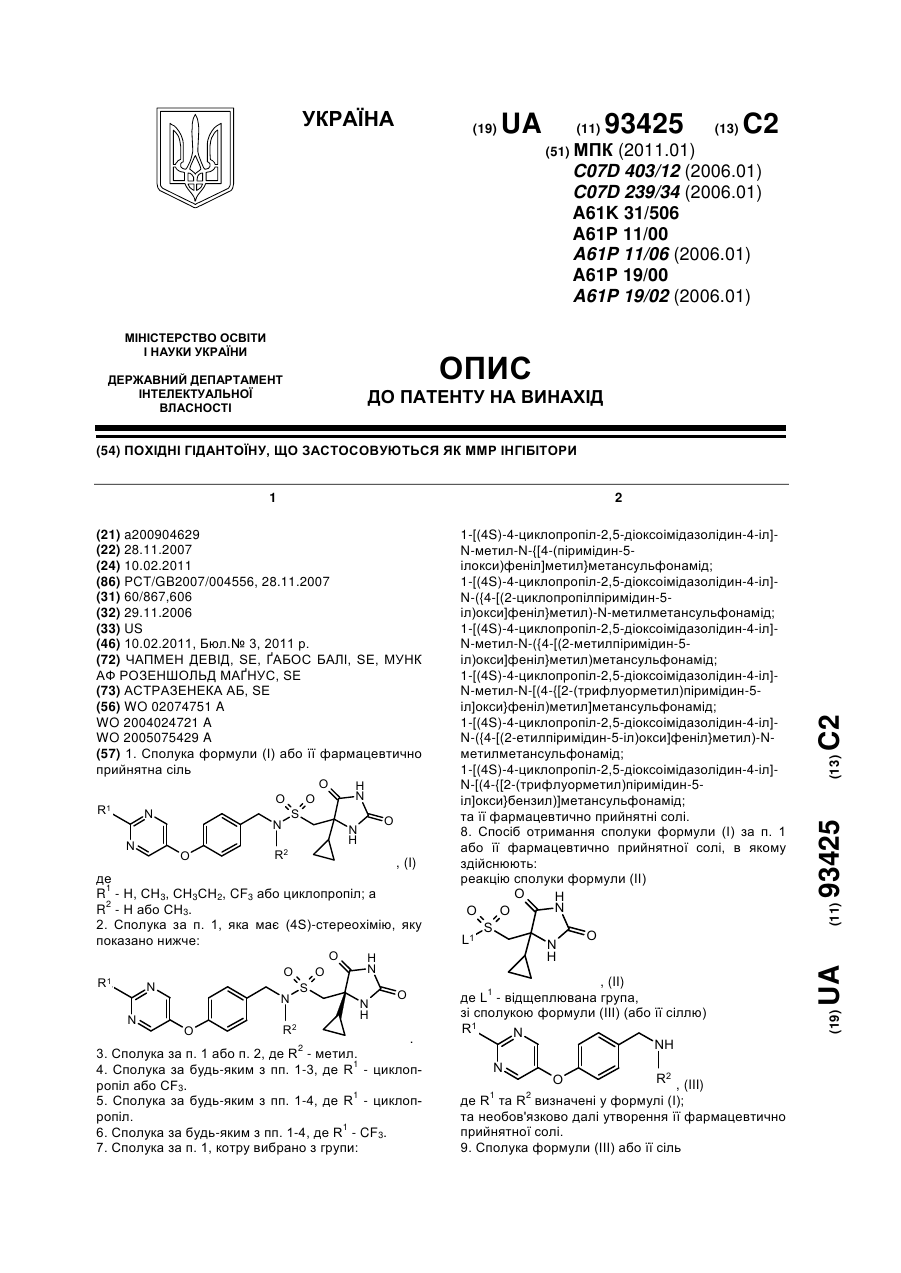
1. Сполука формули (І) або її фармацевтично прийнятна сіль
 , (I)
, (I)
де
R1 - Н, СН3, СН3СН2, CF3 або циклопропіл; а
R2 - Н або СН3.
2. Сполука за п. 1, яка має (4S)-стереохімію, яку показано нижче:
 .
.
3. Сполука за п. 1 або п. 2, де R2 - метил.
4. Сполука за будь-яким з пп. 1-3, де R1 - циклопропіл або CF3.
5. Сполука за будь-яким з пп. 1-4, де R1 - циклопропіл.
6. Сполука за будь-яким з пп. 1-4, де R1 - CF3.
7. Сполука за п. 1, котру вибрано з групи:
1-[(4S)-4-циклопропіл-2,5-діоксоімідазолідин-4-іл]-N-метил-N-{[4-(піримідин-5-ілокси)феніл]метил}метансульфонамід;
1-[(4S)-4-циклопропіл-2,5-діоксоімідазолідин-4-іл]-N-({4-[(2-циклопропілпіримідин-5-іл)окси]феніл}метил)-N-метилметансульфонамід;
1-[(4S)-4-циклопропіл-2,5-діоксоімідазолідин-4-іл]-N-метил-N-({4-[(2-метилпіримідин-5-іл)окси]феніл}метил)метансульфонамід;
1-[(4S)-4-циклопропіл-2,5-діоксоімідазолідин-4-іл]-N-метил-N-[(4-{[2-(трифлуорметил)піримідин-5-іл]окси}феніл)метил]метансульфонамід;
1-[(4S)-4-циклопропіл-2,5-діоксоімідазолідин-4-іл]-N-({4-[(2-етилпіримідин-5-іл)окси]феніл}метил)-N-метилметансульфонамід;
1-[(4S)-4-циклопропіл-2,5-діоксоімідазолідин-4-іл]-N-[(4-{[2-(трифлуорметил)піримідин-5-іл]окси}бензил)]метансульфонамід;
та її фармацевтично прийнятні солі.
8. Спосіб отримання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, в якому здійснюють:
реакцію сполуки формули (II)
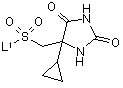 , (II)
, (II)
де L1 - відщеплювана група,
зі сполукою формули (III) (або її сіллю)
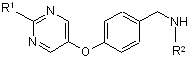 , (III)
, (III)
де R1 та R2 визначені у формулі (І);
та необов'язково далі утворення її фармацевтично прийнятної солі.
9. Сполука формули (III) або її сіль
 , (III)
, (III)
де R1 та R2 вказані у п. 1,
для застосування як інтермедіату при отриманні сполуки формули (І).
10. Фармацевтична композиція, що містить сполуку формули (І) або її фармацевтично прийнятну сіль за будь-яким з пп. 1-7 в асоціації з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
11. Спосіб отримання фармацевтичної композиції за п. 10, котрий полягає у змішуванні сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7 з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
12. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-7 для застосування у терапії.
13. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7 у виробництві медикаменту для застосування у лікуванні обструктивної хвороби дихальних шляхів.
14. Застосування за п. 13, де обструктивною хворобою дихальних шляхів є астма або хронічна обструктивна хвороба легень.
15. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7 у виробництві медикаменту для застосування у лікуванні ревматоїдного артриту, остеоартриту, атеросклерозу, періодонтальної хвороби або розсіяного склерозу.
16. Спосіб лікування хвороби або стану, опосередкованих ММР12, котрий полягає у застосуванні до пацієнта терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7.
17. Спосіб лікування обструктивної хвороби дихальних шляхів, котрий полягає у застосуванні до пацієнта терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7.
18. Фармацевтичний продукт, що містить у комбінації два або більше активних інгредієнтів, у тому числі перший активний інгредієнт, котрим є сполука формули (І) за будь-яким з пп. 1-7, та один або більше інших активних інгредієнтів, котрі вибрані з групи:
інгібітор фосфодіестерази,
агоніст адреноцептора b2,
модулятор функції рецептора хемокіну,
інгібітор функції кінази,
інгібітор протеази,
глюкокортикоїд;
антихолінергічний засіб; та
агоніст нестероїдного глюкокортикоїдного рецептора.
Текст
1. Сполука формули (І) або її фармацевтично прийнятна сіль C2 2 (19) 1 3 R1 N NH N 1 93425 O 2 R2 , (III) де R та R вказані у п. 1, для застосування як інтермедіату при отриманні сполуки формули (І). 10. Фармацевтична композиція, що містить сполуку формули (І) або її фармацевтично прийнятну сіль за будь-яким з пп. 1-7 в асоціації з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. 11. Спосіб отримання фармацевтичної композиції за п. 10, котрий полягає у змішуванні сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7 з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. 12. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-7 для застосування у терапії. 13. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7 у виробництві медикаменту для застосування у лікуванні обструктивної хвороби дихальних шляхів. 14. Застосування за п. 13, де обструктивною хворобою дихальних шляхів є астма або хронічна обструктивна хвороба легень. 15. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7 Заявлений винахід стосується нових гідантоінових похідних, способів їх отримання, фармацевтичних композицій, що їх містять, та їх застосування у терапії. Металопротеїнази є надродиною протеїназ (ферментів), число яких в останні роки дуже збільшилося. На основі структурних та функціональних розглядів ці ферменти класифіковані на родини та підродини, як описано у Ν.Μ. Hooper (1994) FEBS Letters 354 1-6. Приклади металопротеїназ охоплюють матриксні металопротеїнази (ММР) якто колагенази (ММР1, ММР8, ММР13), желатинази (ММР2, ММР9), стромелізини (ММР3, ММР10, ММР11), матрилізин (ММР7), металоеластаза (ММР12), енамелізин (ММР19), МТ-ММР (ММР14, ММР15, ММР16, ММР17), репролізин або адамалізин або родину MDC котра стосується секретаз та шедаз, як-то ферменти перетворення TNF (ADAM10 та ТАСЕ), родину астацинів, що охоплює ферменти, як-то протеїназа процесингу проколагену (РСР), та інших металопротеїназ, як-то агреканаза, родину ферментів перетворення ендотеліну та родин ферментів перетворення анпотензину. Металопротеїнази, можна вважати, є важливими у багатьох фізіологічних процесах хвороб, що охоплюють трансформування тканин, як-то розвиток ембріона, утворення кісток та трансформування матки при менструації. Це є на основі здатності металопротеїназ розщеплювати багато 4 у виробництві медикаменту для застосування у лікуванні ревматоїдного артриту, остеоартриту, атеросклерозу, періодонтальної хвороби або розсіяного склерозу. 16. Спосіб лікування хвороби або стану, опосередкованих ММР12, котрий полягає у застосуванні до пацієнта терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7. 17. Спосіб лікування обструктивної хвороби дихальних шляхів, котрий полягає у застосуванні до пацієнта терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пп. 1-7. 18. Фармацевтичний продукт, що містить у комбінації два або більше активних інгредієнтів, у тому числі перший активний інгредієнт, котрим є сполука формули (І) за будь-яким з пп. 1-7, та один або більше інших активних інгредієнтів, котрі вибрані з групи: інгібітор фосфодіестерази, агоніст адреноцептора 2, модулятор функції рецептора хемокіну, інгібітор функції кінази, інгібітор протеази, глюкокортикоїд, антихолінергічний засіб, та агоніст нестероїдного глюкокортикоїдного рецептора. матриксних субстратів, як-то колаген, протеоглікан та фібронектин. Металопротеїнази, можна також вважати, є важливими у процесингу або секреції біологічно важливих медіаторів клітин, як-то фактор некрозу пухлин (TNF), та процесингу посттрансляційного протеолізу, або позбавленню від біологічно важливих мембранних білків, як-то рецептору CD23 низької афінності ІgЕ (дивись Ν.Μ. Hooper et al., (1997) Biochem J. 321:265-279). Металопротеїнази асоційовані з багатьма хворобами або станами. Інгібування активності одної або більше металопротеїнази може бути корисним при цих хворобах або станах як-то різні запальні та алергічні хвороби, як-то запалення суглобів (особливо ревматоїдний артрит, остеоартрит та подагра), запалення шлунково-кишкового тракту (особливо запальна хвороба кишковику, виразковий коліт та гастрит), запалення шкіри (особливо псоріаз, екзема, дерматит), при метестазах або інвазії пухлин у хворобі, асоційованій з неконтрольованим розкладанням зовнішньоклітинного матриксу, як-то остеоартрит, у резорбтивній хворобі кісток (як-то остеопороз та хвороба Педжета), у хворобах, асоційованих з аберантним ангіогенезом, посилене трансформування колагену, асоційоване з діабетом, перioдонтальна хвороба (як-то гінгівіт) утворення виразок рогівки, утворення виразок шкіри, післяопераційні стани (як-то анастомоз ободової кишки) та загоєння поранень шкіри, 5 демієлінізувальні хвороби центральної та периферійної нервових систем (як-то розсіяний склероз), хвороба Альцгеймера, трансформування зовнішньоклітинного матриксу при серцево-судинних хворобах, як-то рестеноз та атеросклероз, астма, риніт, та хронічні обструктивні хвороби легень (COPD). ММР12, також відома як еластаза макрофагів або металоеластаза, була спочатку клонована у миші Shapiro et al. [1992, Journal of Biological Chemistry 267 4664] та у людині тою ж групою у 1995 ММР12 переважно експресуються в активованих макрофагах, та секретуються з альвеолярних макрофагів курців [Shapiro et al., 1993, Journal of Biological Chemistry, 268: 23824], а також у пінних клітинах у атеросклеротичних ураженнях [Matsumoto et al., 1998, Am. J. Pathol 153 109]. Мишача модель COPD є на основі провокаційної проби мишей сигаретним димом протягом 6 місяців, дві сигарети на добу 6 діб на тиждень У диких мишей після цього розвивалася емфізема легень. Коли нокаутних ММР12 мишей тестували у цій моделі у них не розвивалася емфізема, вказуючи, що ММР12 є ключовим ферментом у патогенезі COPD. Роль ММР, як-то ММР12, у COPD (емфізема та бронхіт) обговорено Anderson та Shinagawa, 1999, Current Opinion in Anti-inflammatory and Immunomodulatory Investigational Drugs 1(1) 29-38. Нещодавно виявлено, що куріння збільшує інфільтрацію макрофагів та експресію похідної від макрофагів ММР-12 у людини тромбоцитах сонної артерії Kangavari [Matetzky S, Fishbein MC et al., Circulation 102 (18), 36-39 Suppl. S, Oct 31, 2000]. Клінічні дослідження з інгібіторами матриксних металопротеїназ часто виявляють шкідливу побічну дію, позначену як скелетно-м'язовий синдром. Таку побічну дію попереджують подальшою розробкою деяких кандидатів у ліки інгібіторів матриксної металопротеїнази. Деякі гіпотези на основі втрати селективності цих кандидатів у ліки серед відмінних матриксних металопротеїназ пояснюють скелетно-м'язовий синдром (дивись, наприклад, J. Thomas Peterson, Cardiovascular Research, 69 (2006) 677-687). Для мінімізації будь-якої можливої шкідливої побічної скелетно-м'язової дії, треба розробляти селективні інгібітори ММР-12 для лікування опосередкованих ММР-12 хвороб людини. Ряд інгібіторів металопротеїназ є відомими (дивись, наприклад, огляди інгібіторів ММР Beckett R.P. та Whittaker Μ., 1998, Εxp. Οpin. Ther. Patents, 8(3): 259-282, та Whittaker Μ. et al., 1999, Chemical Reviews 99(9): 2735-2776). WO 02/074751 розкриває гідантоінові похідні формули 93425 6 що є корисними як інгібітори ММР. Ми зараз розкриваємо наступну групу гідантоінових похідних, що є інгібіторами металопротеїназ та є зокрема інтересними як потужні та селективні інгібітори ММР12. Сполуки заявленого винаходу мають корисну потужність, селективність та/або фармакокінетичні властивості. Згідно з заявленим винаходом запропоновано сполуки формули (І) де R1 - Н, СН3, СН3СН2, CF3 або циклопропіл, та R2 - Η або СН3, та її фармацевтично прийнятні солі В одному втіленні R2 - СН3 В одному втіленні R1 - циклопропіл або CF3 В одному втіленні R1 - циклопропіл, a R2 - СН3 В одному втіленні R1 - CF3, a R2 - СН3 Приклади сполук винаходу охоплюють 1-[(4S)-4-циклопропіл-2,5-дioксоімідазолідин-4iл]-N-метил-N-{[4-(піримідин-5ілокси)феніл]метил}метансульфонамід; 1-[(4S)-4-циклопропіл-2,5-дioксоімідазолідин-4іл]-N-({4-[(2-циклопропілпіримідин-5іл)окси]феніл}метил)-N-метилметансульфонамід; 1-[(4S)-4-циклопропіл-2,5-дioксоімідазолідин-4іл]-N-метил-N-({4-[(2-метилпіримідин-5іл)окси]феніл}метил)метансульфонамід; 1-[(4S)-4-циклопропіл-2,5-діоксоімідазолідин-4іл]-N-метил-N-[(4-{[2-(трифлуорметил)піримідин-5іл]окси}феніл)метил]метансульфонамід; 1-[(4S)-4-циклопропіл-2,5-дioксоімідазолідин-4iл]-N-({4-[(2-етилпіримідин-5-іл)окси]феніл}метил)N-метилметансульфонамід; 1-[(4S)-4-циклопропіл-2,5-дioксоімідазолідин-4іл]-N-[(4-{[2-(трифлуорметил)піримідин-5іл]окси}бензил)]метансульфонамід; та її фармацевтично прийнятні солі. Кожна представлена сполука є конкретним та незалежним аспектом винаходу. Сполуки формули (І) можуть існувати в енантіомерних формах. Зрозуміло, що усі енантіомери, діастереомери, рацемати та їх суміші є охопленими рамками винаходу. Різні оптичні ізомери можна виділяти розділенням рацемічної суміші сполук звичайними способами, як-то фракційна кристалізація або ВЕРХ. Альтернативно оптичні ізомери можна отримувати асиметричним синтезом, або синтезом з оптично активних вихідних матеріалів. Коли у сполуках винаходу існують оптично активні ізомери, ми розкриваємо усі індивідуальні оптично активні форми та їх комбінації як індивідуальні втілення винаходу, а також їх відповідні рацемати. В одному втіленні сполуки формули (І) мають (4S)-стереохімію, яку показано нижче: 7 Для запобігання невизначеності (4S)стереоізомер може бути у суміші з (4R)стереоізомером Наприклад, (4S)-cтepeoізомер може бути у 1:1 суміші з (4R)-стереоізомером. В одному втіленні сполук формули (І) є оптично чистими. У контексті опису, термін оптично чистий визначено у термінах енантіомерного надлишку (e.н.), що розраховують за співвідношенням різниці між кількостями відповідних енантіомерів та суми цих кількостей, виражених у відсотках. Для ілюстрації, препарат, що містить 95% одного енантіомеру та 5% ще одного енантіомеру, має енантіомерний надлишок (e.н.) 90% [тобто (955)/(95+5)×100]. Оптично чиста сполука згідно з заявленим винаходом має e.н. принаймні 90%. У втіленні винаходу оптично чиста сполука має e.н. принаймні 95%. У наступному втіленні винаходу оптично чиста сполука має e.н. принаймні 98%. Коли для сполук винаходу існують таутомери, ми розкриваємо усі їх індивідуальні таутомерні форми та комбінації як індивідуальні втілення винаходу. Заявлений винахід стосується сполуки формули (І) у формі солей. Придатні солі охоплюють солі з органічними або неорганічними кислотами або органічними або неорганічними основами. Такі солі повинні звичайно бути фармацевтично прийнятними, хоча фармацевтично неприйнятні солі можна застосовувати при отриманні та очистці конкретних сполук. Такі солі охоплюють кислотноадитивні солі, як-то гідрохлорид, гідробромід, цитрат, тозилат та малеат, та солі фосфатної кислоти або сульфатної кислоти. У другому аспекті придатними солями є солі основ, як-то сіль лужного металу, як-то натрій або калій, лужноземельного металу, як-то кальцій або магній, або органічного аміну, наприклад, триетиламіну. Солі сполук формули (І) можна створювати реакцією вільної основи або іншої и солі з одним або більше еквівалентами прийнятної кислоти або основи. Сполуки формули (І) є корисними, оскільки вони виявляють фармакологічн активність у тварин, зокрема людей, та є таким чином потенційно корисними як фармацевтичні засоби Зокрема, сполуки винаходу є інгібіторами металопротеїназ та можуть таким чином бути застосовуваними у лікуванні хвороб або станів людини, опосередкованих ММР12, як-то астма, риніт, хронічні обструктивні хвороби легень (COPD), артрит (як-то ревматоїдний артрит та остеоартрит), атеросклероз та рестеноз, рак, інвазія та метастази, хвороби, що охоплюють руйнування тканин, ослаблення замінників суглобів стегна, перioдонтальна хвороба, фіброзна хвороба, інфаркт та хвороба серця, фіброз печінки та нирок, ендометрioз, хвороби, споріднені з ослабленням зовнішньоклітинного матриксу, серцева недостатність, аневризми аорти споріднені з 93425 8 центральною нервовою системою хвороби, як-то хвороба Альцгеймера та розсіяний склероз (MS), та гематологічні розлади. Загалом, сполуки заявленого винаходу є потужними та селективними інгібіторами ММР12 людини (hMMP12). Сполуки заявленого винаходу також виявляють гарну селективність стосовно відносної втрати інгібування різних інших hMMP, як-то hMMP2, hММР8, hММР9, hММР14 та hММР19. Сполуки формули (І) та їх фармацевтично прийнятні солі можуть бути застосовуваними у лікуванні хвороб респіраторного тракту, як-то обструктивні хвороби респіраторного тракту, у тому числі астма, у тому числі бронхіальна, алергічна, спадкова бронхіальна, екзогенна бронхіальна, викликана фізичними вправами, викликана ліками (у тому числі викликана аспірином та NSAID) та викликана пилюкою астма, переміжна чи стійка, будь-якої суворості, та інші випадки гіперчутливості дихальних шляхів, хронічні обструктивна хвороба легень (COPD), бронхіт, у тому числі інфекційний та еозинофільний бронхіт емфізема, бронхоектаз, кістозний фіброз, саркоідоз, легені фермера та споріднені хвороби, гіперчутливий пневмоніт, фіброз легень, у тому числі ендогенний фіброзувальний альвеоліт, ідіопатичні інтерстиціальні пневмонії, ускладнююча фіброз антинеопластична терапія та хронічна інфекція, у тому числі туберкульоз та аспергільоз, та інші грибкові інфекції, ускладнення від трансплантації легень, васкулітичні та тромботичні розлади судинної мережі легень, та гіпертензія легень, протикашльова активність у тому числі лікування хронічного кашлю, асоційованого із запальними та секреторними станами дихальних шляхів, та ятрогенний кашель, гострий та хронічний риніт, у тому числі медикаментозний риніт та вазомоторний риніт, цілорічний та сезонний алергічний риніт у тому числі поліноз (сінна лихоманка), назальний поліпоз, гостра вірусна інфекція у тому числі застуда, та інфекція внаслідок респіраторного синцитіального вірусу, грип, коронавірус (у тому числі SARS) та аденовірус; Сполуки формули (І) та їх фармацевтично прийнятні солі можна також застосовувати у лікуванні хвороб кісток та суглобів, як-то ураження шкіри ревматичного чи подагричного характеру, асоційовані з остеоартритом/остеоартрозом, первинними та вторинними, наприклад, стосовно вибраного з групи уроджена дисплазія стегна, шийний та поперековий с пондиліт, та біль у спині та шиї, ревматоїдний артрит та хвороба Стилла, серонегативні спондилоартропати у тому числі анкілозувальний спондиліт, псоріатичний артрит, реактивний артрит та недиференційована спондартропатія, септичний артрит та інші споріднені з інфекцією артропати та розлади кісток, як-то туберкульоз, у тому числі хвороба Потта та синдром Понсе, гострий та хронічний індукований кристалами синовіт, у тому числі уратна подагра, хвороба відкладання кальцій пірофосфату, та споріднений з кальцій апатитом сухожилля, синовіально-сумкове та синовіальне запалення, хвороба Бекхета, первинний та вторинний синдром Шегрена, системний склероз та обмежена 9 склеродерма, системний червоний вовчак, змішана хвороба сполучних тканин та недиференційована хвороба сполучних тканин, запальні міопатії у тому числі дерматоміозити та поліміозит, ревматична поліміалгія, ювенільний артрит, у тому числі ідіопатичні запальні артритиди та асоційовані синдроми, та ревматична лихоманка та її системні ускладнення, васкулітиди, у тому числі артеріїт велетенських клітин, артеріїт Такаясу, синдром Чарга-Штрауса, нодозний поліартерит, мікроскопічний поліартерит, та васкулітиди, асоційовані з вірусною інфекцією, реакції гіперчутливості, крioглобуліни, та парапротеїни, біль у спині, родинна середньоземноморська лихоманка, синдром Майкла-Велла, та родинна ірландська лихоманка, хвороба Кікучі, індуковані проліками арталгії, тендонітиди та міопатії; Сполуки формули (І) та їх фармацевтично прийнятні солі можна також застосовувати у лікуванні болю та трансформування сполучних тканин м'язоскелетних розладів внаслідок поранення [наприклад, спортивного поранення] або хвороби артритиди (наприклад, ревматоїдний артрит, остеоартрит, подагра або кристалоартропатія), інша хвороб суглобів (як-то міжхребцевих дисків переродження або переродження скронещелепних суглобів), хвороба трансформування кісток (як-то остеопороз, хвороба Педжета або остеонекроз), поліхондрити, склеродерма, змішаний розлад сполучних тканин, спондилоартропати або зубна хвороба (як-то перioдонтит); Сполуки формули (І) та їх фармацевтично прийнятні солі можна також застосовувати у лікуванні хвороб шкіри, як-то псоріаз, атопічний дерматит, контактний дерматит або інші екзематозні дерматози, та реакції гіперчутливості затриманого типу, фіто- та фотодерматит, себорейний дерматит, герпетиформний дерматит, плоский лишай, гангренозна піодермія, саркоїд шкіри, дискоідний червоний вовчак, пемфігус, пемфігоїд, булезний епедермоліз, кропивниця, велетенська кропивниця, васкулітиди, токсичні еритеми, шкірні еозинофіли, гніздова плішивість, чоловіча плішивість, синдром Світа, синдром Вебера-Кристіана, багатоформна еритема, целюліт, інфекційний та неінфекційний, панікуліт, шкірні лімфоми, немеланомний рак шкіри та інші диспластичні ураження, індуковані проліками розлади, у тому числі висип; Сполуки формули (І) та їх фармацевтично прийнятні солі можна також застосовувати у лікуванні хвороб очей, як-то блефарит, кон'юнктивіт, у тому числі цілорічний та весняний алергічний кон'юнктивіт, ірит, ранішній та пізніший увеїт, хороїдит, автоімунні, дегенеративні або запальні розлади, що вражають сітчасту оболонку, офтальміт у тому числі симпатичнийі офтальміт, саркоідоз, інфекції, у тому числі вірусні, грибкові та бактеріальні; Сполуки формули (І) та їх фармацевтично прийнятні солі можна також застосовувати у лікуванні хвороб шлунково-кишкового тракту, як-то глосит, гінгівіт, амфодонтит, езофагіт, у тому числі рефлюкс, еозинофільний гастроентерит мастоцитоз, хвороба Крона, коліт у тому числі виразковий коліт, проктит, свербіж заднього проходу, черевна 93425 10 хвороба, синдром подразненого кишечнику, та споріднені з їжею алергії, котрі можуть мати дію, віддалену від кишковику (наприклад, мігрень, риніт або екзема); Сполуки формули (І) та їх фармацевтично прийнятні солі можна також застосовувати у лікуванні хвороб серцево-судинної систем, як-то атеросклероз, що вражає коронарну та периферійну циркуляцію, перикардит, міокардит, запальні та автоімунні кардіоміопати, у тому числі міокардіальний саркоїд, ішемічні реперфузійні пошкодження, ендокардит, вальвуліт та аортит, у тому числі інфекційний (наприклад, сифілітичний), васкулітиди, розлади проксимальних та периферійних вен, у тому числі флебіт та тромбоз, у тому числі глибокий тромбоз вен та ускладнення від варикозних вен; Сполуки формули (І) та їх фармацевтично прийнятні солі можна також застосовувати в онкологи, як-то у лікуванні звичайних видів раку, у тому числі пухлин простати, грудної залози, легень, яєчнику, підшлункової залози, кишечнику та ободової кишки, шлунку, шкіри та мозку та злоякісності, що вражають кістковий мозок (у тому числі лейкемії) та лімфопроліферативні системи, як-то лімфома Ходжкіна та не-Ходжкіна у тому числі попередження та лікування метастазів, та паранеопластичні синдроми; та метастатичних хвороб та рецидивів пухлин, та паранеопластичих синдромів. В одному аспекті сполуки формули (І) та їх фармацевтично прийнятні солі можна застосовувати у лікуванні респіраторного дистрес-синдрому дорослих (ARDS), кистозного фіброзу, легень емфізем, бронхіту, бpoнxоектазії, хронічних обструктивних хвороби легень (COPD), гіпертензії легень, астми, риніту, ішемічно-реперфузійного пошкодження, ревматоїдного артриту, остеоартриту, раку, атеросклерозу, розсіяного склерозу, перioдонтальної хвороби та пошкодження слизової шлунку. У другому аспекті сполуки формули (І) та їх фармацевтично прийнятні солі можна застосовувати у лікуванні або профілактиці запальних хвороб або станів та хвороб, асоційованих з неконтрольованим розкладанням зовнішньоклітинного матриксу та трансформуванням. У другому аспекті сполуки формули (І) та їх фармацевтично прийнятні солі можна застосовувати у лікуванні або профілактиці запальних респіраторних хвороб або станів. Більш конкретно, сполуки формули (І) та їх фармацевтично прийнятні солі можна застосовувати у лікуванні хронічної обструктивної хвороби легень (COPD), астми та риніту. Ще конкретніше, сполуки формули (І) та їх фармацевтично прийнятні солі можна застосовувати у лікуванні хронічної обструктивної хвороби легень (COPD). Відповідно, заявлений винахід стосується сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, для застосування у терапії. У другому аспекті винахід стосується застосування сполуки формули (І) або її фармацевтично 11 прийнятної солі, як вищезгадано, у виробництві медикаменту для застосування у терапії. У другому аспекті винахід стосується застосування сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, у виробництві медикаменту для застосування у лікуванні хвороб або станів людини, у котрих інгібування ММР12 є корисним. У другому аспекті винахід стосується застосування сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, у виробництві медикаменту для застосування у лікуванні запальної хвороби. У другому аспекті винахід стосується застосування сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, у виробництві медикаменту для застосування у лікуванні обструктивної хвороби дихальних шляхів, як-то астма або COPD. У другому аспекті винахід стосується застосування сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, у виробництві медикаменту для застосування у лікуванні ревматоїдного артриту, остеоартриту, атеросклерозу, перioдонтальної хвороби або розсіяного склерозу. У другому аспекті винахід стосується сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, для лікування хвороб або станів, у котрих інгібування ММР12 є корисним. У другому аспекті винахід стосується сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, для лікування запальної хвороби. У другому аспекті винахід стосується сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, для лікування обструктивної хвороби дихальних шляхів, як-то астма або COPD. У другому аспекті винахід стосується сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, для лікування ревматоїдного артриту, остеоартриту, атеросклерозу, перioдонтальної хвороби або розсіяного склерозу. У контексті опису, термін "терапія" також охоплює "профілактику" якщо не визначено інше Терміни "терапевтичний" та "терапевтично" застосовують відповідно. Профілактика, як очікують, буде особливо доречною для лікування осіб, які раніше постраждали від такої хвороби або стану, або мають збільшений ризик хвороби або стану. Особи при ризику розвитку хвороби або стану загалом охоплюють осіб з родинною історією хвороби або стану, або схильних за генетичним тестуванням до розвитку хвороби або стану. Винахід крім того стосується способу лікування, або зменшення ризику хвороби або стану, у котрих інгібування ММР12 є корисним, котрий полягає у застосуванні до пацієнта терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано. Винахід крім того стосується способу лікування, або зменшення ризику запальної хвороби або стану, котрий полягає у застосуванні до пацієнта терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано. 93425 12 Винахід також стосується способу лікування, або зменшення ризику обструктивної хвороби дихальних шляхів, як-то астма або COPD, котрий полягає у застосуванні до пацієнта терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано. Для вищезгаданого терапевтичного застосування доза повинна, безумовно, варіювати залежно від застосовуваної сполуки, режиму застосування, потрібного лікування та розладу, що лікують. Добова доза сполуки формули (І)/солі (активний інгредієнт) може бути у межах від 0,001мг/кг до 75мг/кг, зокрема від 0,5мг/кг до 30мг/кг. Цю добову дозу можна давати у відокремлених дозах, якщо необхідно. Звичайно форми окремих доз повинні містити приблизно 1мг-500мг сполуки цього винаходу. Сполуки формули (І) та її фармацевтично прийнятні солі можна застосовувати самі по собі але загалом треба застосовувати у формі фармацевтичної композиції, у котрій сполука/сіль формули (І) (активний інгредієнт) є в асоціації з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. Залежно від режиму застосування, фармацевтична композиція повинна переважно містити від 0,05 до 99мас.%, більш переважно від 0,10 до 70мас.%, активного інгредієнту, та від 1 до 99,95мас.%, більш переважно від 30 до 99,90мас.%, фармацевтично прийнятного ад'юванту, розріджувачу або носія, усі відсотки на основі загальної композиції Звичайні способи відбору та отримання придатних фармацевтичних композицій є описаними, наприклад, у "Pharmaceuticals - The Science of Dosage Form Designs", Μ. Ε. Aulton, Churchill Livingstone, 1σ988. Таким чином, заявлений винахід також стосується фармацевтичної композиції, що містить сполуку формули (І) або її фармацевтично прийнятну сіль, як вищезгадано, в асоціації з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. Винахід крім того стосується способу отримання фармацевтичної композиції винаходу, котрий полягає у змішуванні сполуки формули (І) або її фармацевтично прийнятної солі, як вищезгадано, з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. Фармацевтичні композиції цього винаходу можна застосовувати стандартним способом для хвороби або стану, що потрібно лікувати, наприклад, перорально, місцево, парентерально, букально, назально, вагінально або ректально або інгаляцією. Для цього сполуки цього винаходу можна формувати у форму, як-то таблетки, капсули, водні або олійні розчини, суспензії, емульсії, креми, мазі, гелі, назальні спреї супозиторії, мілко подрібнені порошки або аерозолі для інгаляцій, та для парентерального застосування (у тому числі внутрішньовенно, внутрішньом'язово або вливанням) стерильні водні або олійні розчини або суспензії або стерильні емульсії. На додаток до сполуки заявленого винаходу фармацевтична композиція цього винаходу може також містити або бути співзастосовуваною (одночасно або послідовно) з одним або більше фарма 13 кологічними засобами у лікуванні одної або більше хвороб або станів, позначених вище, як-то продукт "Symbicort" (товарний знак). Заявлений винахід крім того стосується способу отримання сполуки формули (І) або її фармацевтично прийнятної солі, як визначено вище, котрий полягає у: реакції сполуки формули (II) де L1 – відщеплювана група зі сполукою формули (III) або її сіллю де R1 та R2 визначені у формулі (І); та необов'язково далі утворення ії фармацевтично прийнятної солі. У вищенаведеному способі придатні відщеплювані групи L1 охоплюють галоген, конкретно хлор, або трифлуорметилсульфонат. Реакцію переважно проводять у придатному розчиннику або суміші розчинників необов'язково у присутності доданої основи протягом придатного часу, звичайно 0,1-16 годин, при 0°С - температурі кипіння під зворотним холодильником. Звичайно застосо Альдегіди формули (IV) зручно отримувати реакцією нуклеофільного ароматичного заміщення між 4-флуор-бензальдегідом та піримідин-5-олом (V). Умови реакції, котрі зрозумілі спеціалістам, можуть охоплювати нагрівання з основою у полярному апротонному розчиннику, як-то тетрагідрофуран, діоксан, ацетонітрил, Ν,Νдиметилформамід, N-метилпіролідин або диметилсульфоксид. Звичайний спосіб полягає у змішуванні 4-флуор-бензальдегіду та піримідин-5-олу (V) з надлишком калій карбонату або калій третбутоксиду у Ν,Ν-диметилформаміді або Nметилпіролідині та нагрівання при 120°С протягом приблизно 16 годин, отримуючи альдегід (IV). 93425 14 вують розчинники, як-то Ν,Ν-диметилформамід, піридин, тетрагідрофуран, ацетонітрил, Nметилпіролідин або дихлорметан. При застосуванні доданою основою може бути органічна основа, як-то триетиламін, Ν,Ν-діїзопропілетиламін (DIPEA), N-метилморфолін або піридин, або неорганічна основа, як-то карбонат лужного металу. Реакцію звичайно проводять при температурі довкілля протягом 0,5-16 годин, або до завершення реакції, як визначають хроматографічними або спектроскопічними способами. Реакції сульфонілгалогенідів з різними первинними та вторинними амінами є добре відомими та варіації умов зрозумілі спеціалістам. Сульфонілхлориди формули (II) де L1 - хлор, є розкритими у WO 2006/065215 та посиланнях звідти. Аміни формули (III) переважно отримують віднов ним алкілуванням первинного аміну або амоніяк, R2-NH2, з 4-(піримідин-5-ілокси)бензальдегідом формули (IV) у стандартних умовах, котрі зрозумілі спеціалістам. Звичайно, альдегід (IV) гріють при температурі кипіння під зворотним холодильником з надлишком аміну R2-NH2 у розчиннику, як-то етанол протягом 1-2 годин. Надлишок аміну тоді випарюють та інтермедіатний імін знов розчиняють в етанолі. Гідрування при атмосферному тиску з паладієм на вугіллі протягом 0,5 до 2 годин при температурі довкілля тоді дає амін (III). Піримідин-5-оли формули (V) можна отримувати різними способами, відомими у рівні техніки. Для повного огляду синтезу піримідинів, дивись S. Von Angerer, Science of Synthesis, (2004), 16, 379572. Два такі шляхи є коротко згаданими тут. Згідно з першим шляхом амідин, R1C(=NH)NH2, конденсують з сіллю N-[3(диметиламіно)-2-гідроксипроп-2-ен-1-іліден]-Nметилметанамінію, по суті, як описано у US 4,558,039. Гідроксил переважно захищають, наприклад, як бензил-етер. Придатною сіллю є тетрафлуорборат. Згідно з другим шляхом до піримідин-5-олів алкіл-естер, кислоту або амідин конденсують із 1,3-діаміно-пропан-2-олом. Утворений інтермедіат 15 93425 16 із закритим кільцем 1,4,5,6-тетрагідро-піримідин-5ол тоді окиснюють, отримуючи піримідин-5-ол (V). Дивись, наприклад, US 5,175,166 або Hull, J. W. J.; Otterson, K.; Rhubnght, D; J. Org. Chem. 1993, 58, 520-522. Звичайно, конденсування проводять у толуєні або ксилені при температурі кипіння під зворотним холодильником протягом 5-24 годин з азеотропним видаленням утвореної води. Тетрагі дро-піримідиновий інтермедіат зрештою виділяють як сіль, як-то гідрохлорид. Окиснення звичайно досягають надлишком нітробензену та основи якто натрій метоксид, калій трет-бутоксид або калій гідроксид, при 120°С протягом 1-5 годин. Співрозчинники, як-то толуєн або ксилен можна застосовувати. Аміни формули (III) де R2 - Η зручно отримувати відновленням нітрилу (VI). Нітрил (VI) можна у свою чергу створювати реакцією нуклеофільного ароматичного заміщення між 4-заміщеним бензонітрилом та піримідин-5-олу способом аналогічним описаному для утворення альдегіду (IV). Наступний альтернативний шлях до амінів (III) полягає у відновленні аміду (VII). Амід (VII) можна у свою чергу створювати відновленням відповідно го нітрилу (VI) або його синтетичних еквівалентів, а потім N-захистом, R2-алкілуванням та зняттям захисту. Спеціалістам зрозуміло, що у способах заявленого винаходу деякі потенційно реактивні функціональні групи, як-то гідроксил або аміногрупи, у вихідних реагентах або проміжних сполуках можуть потребувати захисту придатними захисними групами. Таким чином, отримання сполук винаходу може охоплювати, на різних етапах, додавання та видалення одної або більше захисних груп. Придатні захисні групи та способи їх додавання та видалення є описаними у 'Protective Groups у Organic Chemistry', edited by J.W.F. McOmie, Plenum Press (1973) та 'Protective Groups у Organic Synthesis', 3rd edition, T.W. Greene та Ρ.G.Μ. Wuts, Wiley-Interscience (1999). Конкретні способи отримання сполук формули (І) є розкритими у прикладах цього опису Такі способи утворюють аспект заявленого винаходу. Необхідні вихідні матеріали є комерційно доступними, є відомими у літературі або їх можна отримувати відомими способами. Конкретні способи отримання деяких ключових вихідних матеріа 17 лів є розкритими у прикладах цього опису i такі способи утворюють аспект заявленого винаходу. Деякі нові інтермедіати є розкритими у прикладах цього опису та такі інтермедіати утворюють аспект заявленого винаходу. Таким чином, в одному втіленні нові аміни формули (III) та їх солі, де R1 та R2 визначені вище, є розкритими як інтермедіати, корисні при отриманні сполук формули (I). Сполуки формули (І) можна перетворити в інші сполуки формули (І) стандартними способами. Сполуки винаходу та їх інтермедіати можна виділяти з їх реакційних сумішей та, якщо необхідно, очищати, стандартними способами. Сполуки винаходу можна також застосовувати разом з іншими сполуками, застосовуваними для лікування вищенаведених станів. Таким чином, винахід крім того стосується комбінаційної терапії, де сполуку винаходу, або її фармацевтично прийнятну сіль, або фармацевтичну композицію, що містить сполуку винаходу, застосовують спільно чи послідовно або як комбінований препарат з другим терапевтичним засобом або засобами для лікування одного або більше з перелічених станів. Зокрема, для лікування запальних хвороб, якто (але без обмеження) ревматоїдний артрит, остеоартрит, астма, алергічний риніт, хронічна обструктивна хвороба легень (COPD), псоріаз, та запальна хвороб кишечнику, сполуки винаходу можуть бути комбінованими із засобами, переліченими нижче. Нестероідні антизапальні засоби (далі NSAID), у тому числі неселективні інгібітори циклооксигеназ СОХ-1/СОХ-2, застосовувані місцево або системно (як-то піроксикам, диклофенак, протонові кислоти, як-то напроксен, флубіпрофен, фенопрофен, кетопрофен та ібупрофен, фенамати, як-то мефенамінова кислот, індометацин, суліндак, азапропазон, піразолони, як-то фенілбутазон, саліцилати, як-то аспірин), селективні інгібітори СОХ-2 (як-то мелоксикам, целекоксиб, рофекоксиб, вальдекоксиб, лумаросоксиб, парекоксиб та еторисоксиб), донори інгібування нітроген оксид-цикло-оксигенази (CINOD), глюкокортикостероіди (що застосовують місцево, перорально, внутрішньом'язово, внутрішньовенно, або внутрішньосуглобово), метотрексат, лефлуномід, гідроксихлорхін, d-пеніциламін, ауронафін або інші парентеральні або пероральні препарати золота, аналгетики, діацереїн, внутрішньосуглобові, як-то похідні палуронової кислоти, та харчові добавки, як-то глюкозамін. Заявлений винахід крім того стосується комбінації сполуки винаходу разом з цитокіном або агоністом або антагоністом функції цитокіну (у тому числі засоби, котрі діють на сигнальні провідні шляхи цитокінів, як-то модулятори системи SOCS), у тому числі альфа-, бета-, та гаммаінтерферони, інсуліно-подібний фактор росту типу І (IGF-1), інтерлейкіни (IL), у тому числі IL1-17, та антагоністи або інгібітори інтерлейкінів, як-то анакінра, інгібітори фактору некрозу пухлин альфа (TNF-α), як-то анті-TNF-моноклональні антитіла (наприклад, інфліксимаб, адалімумаб, та CDP-870) 93425 18 та антагоністи рецепторів TNF, у тому числі молекули імуноглобуліну (як-то етанерцепт) та засоби низької молекулярної маси, як-то пентоксифілін. На додаток винахід стосується комбінації сполуки винаходу з В-лімфоцитами націлювання моноклональних антитіл (як-то CD20 (ритуксимаб), MRA-alLI6R та Т-лімфоцитами, CTLA4-lg, HuMax 11-15). Заявлений винахід крім того стосується комбінації сполуки винаходу з модулятором функції рецептору хемокіну, як-то антагоніст CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 та CCR11 (для родини С-С), CXCR1, CXCR2, CXCR3, CXCR4 та CXCR5 (для родини С-Х-С) та CX3CR1 для родини С-Х3-С. Заявлений винахід крім того стосується комбінації сполуки винаходу та інгібітору біосинтезу лейкотриєну, інгібітор 5-ліпоксигенази (5-LO) або антагоніст активувального білку 5-ліпоксигенази (FLAP) як-то, зилейтон, Abbott-761, фенлейтон, тепоксалін, аббот-79175, аббот-85761, N-(5заміщений)-тіофен-2-алкілсульфонамід, 2,6-дітрет-бутилфенолгідразони, метокситетрагідропірани, як-то Zeneca ZD-2138, сполука SB-210661, заміщена піридинілом сполука 2-ціанонафталіну, як-то L-739,010, сполука 2-ціанохіноліну, як-то L746,530, або сполука індолу або хіноліну, як-то МК591, МК-886, та BAY x 1005. Заявлений винахід крім того стосується комбінації сполуки винаходу та антагоністу рецептору лейкотриєнів (LT) B4, LTC4, LTD4, та LTE4, вибраного з групи фенотіазин-3-is, як-то L-651,392, амідиносполуки, як-то CGS-25019C, бензоксаламіни, як-то онтазоласт, бензенкарбоксимідаміди, як-то BIIL 284/260, та сполуки, як-то зафірлукаст, аблукаст, монтелукаст, пранлукаст, верлукаст ( МК679), RG-12525, Ro-245913 іралукаст (CGP 45715А), та BAY x 7195. Заявлений винахід крім того стосується комбінації сполуки винаходу та інгібітору фосфодіестерази (PDE), як-то метилксантанін, у тому числі теофілін та амінофілін, селективний інгібітор ізоферменту PDE, у тому числі інгібітор PDE4 ізоформи PDE4D, або інгібітор PDE5. Заявлений винахід крім того стосується комбінації сполуки винаходу та антагоністу рецептору гістаміну типу 1, як-то цетризин, лоратадин, деслоратадин, фексофенадин, акривастин, терфенадин, астемізол, азеластин, левокабастин, хлорфенірамін, прометазин, циклізин, або мізоластин, застосовувані перорально, місцево або парентерально. Заявлений винахід крім того стосується комбінації сполуки винаходу та інгібітору протонного насосу (як-то омепразол) або гастрозахисного антагоністу рецептору гістаміну типу 2. Заявлений винахід крім того стосується комбінації сполуки винаходу та антагоністу рецептору гістаміну типу 4. Заявлений винахід крім того стосується комбінації сполуки винаходу та агоністу адреноцептору альфа-1/альфа-2 судинозвужувального симпатоміметичого засобу, як-то пропілгекседрин, фенілфрин, фенілпропаноламін, ефедрин, псевдоефедрин, нафазолін гідрохлорид, оксиметазолін 19 гідрохлорид, тетрагідрозолін гідрохлорид, ксилометазолін гідрохлорид, трамазолін гідрохлорид або етилнорепінфрин гідрохлорид. Заявлений винахід крім того стосується комбінації сполуки винаходу або її фармацевтично прийнятної солі, та антихолінергічних засобів, у тому числі антагоністу мускаринових рецепторів (М1, М2, та М3), як-то атропін, гіосцин, глікопіролат, іпратропіум бромід, тіотропіум бромід, окситропіум бромід, пірензепін або телензепін. Заявлений винахід крім того стосується комбінації сполуки винаходу та агоністу бетаадреноцептору (у тому числі підтипів бетарецептору 1-4), як-то ізопреналін, салбутамол, формотерол, салметерол, тербуталін, орципреналін, бітолтерол мезилат, пірбутерол, або індакатерол або його хіральний енантіомер. Заявлений винахід крім того стосується комбінації сполуки винаходу та хромону, як-то натрій кромоглікат або натрій недокроміл. Заявлений винахід крім того стосується комбінації сполуки винаходу із глюкокортикощом, як-то флунізолід, тріамцинолон ацетонід, беклометазон дипропіонат будезонід, флутиказон пропіонат, циклезонід або мометазон фуроат. Заявлений винахід крім того стосується комбінації сполуки винаходу із засобом, що модулює рецептор ядерного гормону, як-то PPAR. Заявлений винахід крім того стосується комбінації сполуки винаходу разом із імуноглобуліном (Ід) або препаратом, антагоністом або антитілом Іg, що модулює функцію Іg, як-то анті-ІgЕ (наприклад, омалізумаб). Заявлений винахід крім того стосується комбінації сполуки винаходу та ще одного системного або місцево-застосовуваного антизапального засобу, як-то талідомід або його похідне, ретиноїд, дитранол або кальципотрioл. Заявлений винахід крім того стосується комбінації сполуки винаходу та комбінації аміносаліцилатів та сульфапіридину, як-то сульфасалазин, месалазин, балсалазид та олсалазин, та імуномодуляторів, як-то тіопурини, та кортикостероїдів, якто будезонід. Заявлений винахід крім того стосується комбінації сполуки винаходу разом із антібактеріальним засобом, як-то похідне пеніциліну, тетрациклін, макролід, бета-лактам, флуорхінолон, метронідазол, інгаляційний аміноглікозид, антівірусний засіб, у тому числі ацикловір, фамцикловір, валацикловір, ганцикловір, цидофовір, амантадин, римантадин, рибавірин, занамавір та озелтамавір, інгібітор протеази, як-то індинавір, нелфінавір, ритонавір, та сахінавір, нуклеозидний інгібітор зворотної транскриптази, як-то диданозин, ламівудин, ставудин, залцитабін або зидовудин, або ненуклеозидний інгібітор зворотної транскриптази, як-то невірапін або ефавіренз. Заявлений винахід крім того стосується комбінації сполуки винаходу та серцево-судинного засобу, як-то блокатор каналу кальцію, блокатор бета-адреноцептору, інгібітор ферменту перетворення анпотензину (АСЕ), антагоніст рецептору анпотензину-2, засіб зниження ліпіду, як-то статин або фібрат, модулятор морфології клітин крові, як 93425 20 то пентоксифілін, тромболітик, або антикоагулянт, як-то інгібітор агрегації тромбоцитів. Заявлений винахід крім того стосується комбінації сполуки винаходу та засобу ЦНС, як-то антидепресант (як-то сертралін), проліки проти паркінсонізму (як-то депреніл, L-допа, ропінірол, праміпексол, інгібітор МАОВ, як-то селегін та разаплін, інгібітор соmР, як-το тасмар, інгібітор А-2, інгібітор перепоглинання допаміну, антагоніст NMDA, агоніст нікотину, агоніст допаміну або інгібітор неврональної нітроген-оксид-синтази), або проліки проти хвороби Альцгеймера, як-то донепезил, ривастигмін, такрин, інгібітор СОХ-2, пропентофілін або метрифонат. Заявлений винахід крім того стосується комбінації сполуки винаходу та засобу для лікування гострого або хронічного болю, як-то центрально або периферійно діючого аналгетику (як-то, опюїд або його похідне), карбамазепін, фенітоїн, натрій валпроат, амітриптилін або інші антидепресанти, парацетамол або нестероїдний антизапальний засіб. Заявлений винахід крім того стосується комбінації сполуки винаходу разом із парентерально або місцево застосовуваним (у тому числі інгаляцією) локальним анестетиком, як-то лігнокаїн або його похідне. Сполуку заявленого винаходу можна також застосовувати у комбінації із анті-остеопорозним засобом, у тому числі гормональним засобом, якто ралоксифен, або біфосфонатом, як-то алендронат. Заявлений винахід крім того стосується комбінації сполуки винаходу разом з вибраним з групи а (і) інгібітор триптази, (іі) антагоніст фактору активування тромбоцитів (PAF), (ііі) інгібітор ферменту перетворення інтерлейкіну (ICE), (iν) інгібітор IMPDH, (ν) інгібітори адгезії молекул, у тому числі антагоніст VLA-4, (νi) катепсин, (νii) інгібітор кінази, як-то інгібітор тирозинюнази (як-то Btk, Itk, Jak3 або МАР, наприклад, Гефітиніб або Іматиніб мезилат), серин/треонін-кінази (як-то інгібітор МАРкінази, як-то р38, JNK, білкової кінази А, В або С, або ІКК), або кінази, задіяної у регулюванні клітинного циклу (як-то залежна від циліну кіназа), (νiii) інгібітор глюкоза-6 фосфат-дегідрогенази, (їх) антагоніст рецептору кініну-В1 - або В2.; (х) засіб проти подагри наприклад, колхіцин, (хi) інгібітор ксантин-оксидази, наприклад, алопуринол, (хіі) урикозуричний засіб, наприклад, пробенецид, сульфінпіразон або бензбромарон, (хііі) стимулятор секреції гормону росту, (хiν) трансформувальний фактор росту (TGFβ), (xv) похідний від тромбоцитів фактор росту (PDGF), (хνi) фактор росту фібробластів, наприклад, основний фактор росту фібробластів (bFGF), (хνii) фактор стимулювання колоній гранулоцит-макрофапв (GM-CSF), (хνiii) крем капсаїцину, (хіх) антагоніст рецептору тахікініну NK1 або NK3, як-то NKP-608C, SB-233412 (талнетант) або D-4418, (хх) інгібітор еластази, якто UT-77 або ZD-0892, (ххі) інгібітор ферменту перетворення TNF-альфа (ТАСЕ), (ххіі) інгібітор індукованої нітроген-оксидом синтази (iNOS), (ххііі) молекула гомологічного рецептору хемоатрактанта, експресована на клітинах ТН2, (як-то антаго 21 ніст CRTH2), (ххiν) інгібітор Р38, (xxv) засіб, що модулює функцію Toll-подібних рецепторів (TLR), (ххνi) засіб, що модулює активність пуринергічних рецепторів, як-то Р2Х7, або (ххνii) інгібітор транскрипційного фактору активування, як-то NFkB, API, або STATS. Сполуку винаходу можна також застосовувати у комбінації із існуючим терапевтичним засобом для лікування раку, наприклад, придатні засоби охоплюють: (і) антіпроліферативні/антінеопластичні проліки або їх комбінацію, як застосовувано в онкології, як-то алкілувальний засіб (наприклад, цис-платин, карбоплатин, циклофосфамід, азотистий іприт, мелфалан, хлорамбуцил, бусульфан або нітрозосечовина), антіметаболіт (наприклад, антіфолат, як-то флуорпіримідин типу 5-флуорурацилу або тегафур, ралітрексед, метотрексат, цитозин арабінозид, гідроксисечовина, гемцитабін або паклітаксел), протипухлинні антибіотики (наприклад, антрациклін, як-то адріаміцин, блеоміцин, доксорубіцин, дауномідин, епірубіцин, ідарубіцин, мітомідин-С, дактиномідин або мітраміцин), антимітотичний засіб (наприклад, алкалоїд вінка, як-то вінкристин, вінбластин, віндезин або вінорелбін, або таксоїд, як-то таксол або таксотер), або інгібітор топоізомераз (наприклад, епаподофілотоксин, як-то етопозид, теніпозид, амсакрин, топотекан або камптотецин); (іі) цитостатичний засіб, як-то антіестрогенний (наприклад, тамоксифен, тореміфен, ралоксифен, дролоксифен або йодоксифен), даун-регулятор рецептору естрогену (наприклад, фулвестрант), антіандрогенний (наприклад, бікалутамід, флутамід, нілутамід або ципротерон ацетат), антагоніст LHRH або агоніст LHRH (наприклад, госерелін, лейпрорелін або бусерелін), прогестоген (наприклад, мегестрол ацетат), інгібітор ароматази (наприклад, як анастрозол, летрозол, воразол або екземкстан) або інгібітор 5а-редуктази, як-то фінастерид, (ііі) засіб, котрий інгібує інвазію ракових клітин (наприклад, інгібітор металопротеїнази типу маримастат або інгібітор функції активатору рецептору плазміногену урокінази); (iν) інгібітор функції фактору росту, наприклад фактору росту антитіл (наприклад, анті-еrbb2антитіло трастузумаб, або анті-erbb1-антитіло цетуксимаб [С225]), інгібітор фарнезил-трансферази, інгібітор тирозинкінази або інгібітор серин/треонінкінази, інгібітор родини епідермального фактору росту (наприклад, інгібітор родини EGFR тирозинкінази, як-то N-(3-хлор-4-флуорфеніл)-7-метокси-6(3-морфолінопропокси)хіназолін-4-амін (гефітиніб, AZD1839), N-(3-етинілфеніл)-6,7-біс(2метоксіетокси)хіназолін-4-амін (ерлотиніб, OSI774) або 6-акриламiдо-N-(3-хлор-4-флуорфеніл)-7(3-морфолінопропокси)хіназолін-4-амін (СІ 1033)), інгібітор родини похідних від тромбоцитів факторів росту, або інгібітор родини факторів росту гепатоцитів; (ν) антіангіогенний засіб, як-то котрий інгібує дію судинного ендотеліального фактор росту (наприклад, антисудинне антитіло до фактору росту ендотеліальних клітин бевацизумаб, сполука, роз 93425 22 крита у WO 97/22596, WO 97/30035, WO 97/32856 або WO 98/13354), або сполука, що працює за ще одним механізмом (наприклад, ліномід, інгібітор функції інтегрину ανβ3 або ангіостатин); (νi) засіб пошкодження судин, як-то комбретастатин А4, або сполука, розкрита у WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 або WO 02/08213; (νii) засіб, застосовуваний у антисенсовій терапії, наприклад, спрямований на одну з цілей, перерахованих вище, як-то ISIS 2503, анті-рас антисенс; (νііi) засіб, застосовуваний у підході генної терапії, наприклад, підходи для заміни аберантних генів, як-то аберантний р53 або аберантний BRCA1 або BRCA2, GDEPT (ген-спрямований фермент терапії проліками) підходи, як-то, застосовуючи цитозин-деаміназу, тимідин-кіназу або бактеріальний фермент нітроредуктазу та підходи для збільшення толерантності пацієнта до хіміотерапії або радіотерапії, як-то резистентності до генної терапії; або (іх) засіб, застосовуваний у імунотерапевтичному підході, наприклад, підходи ех vivo та in vivo для збільшення імуногенності клітин пухлин пацієнта, як-то трансфекція цитокінами, як-то інтерлейкін 2, інтерлейкін 4 або фактор стимулювання колоній гранулоцит-макрофагів, підходи для зменшення анергії Т-клітин, підходи, застосовуючи трансфектовані імунні клітини, як-то цитокінтрансфектовані дендритні клітини, підходи, застосовуючи цитокін-трансфектовані лінії клітин пухлин та підходи, застосовуючи анті-ідіотипові антитіла. У наступному втіленні заявлений винахід стосується фармацевтичного продукту, що містить у комбінації, першу активну складову, котрою є сполука формули (І) яку вище описано та принаймні одну наступну активну складову, вибрану з групи: - інгібітор фосфодіестерази, - агоніст адреноцептору β2 , - модулятор функції рецептору хемокіну, - інгібітор функції кінази, - інгібітор протеази, - глюкокортикоїд, - антихолінергічний засіб, та - агоніст нестероідного глюкокортикоїдного рецептору Прикладами інгібітору фосфодіестерази є інгібітор PDE4, у тому числі інгібітор ізоформи PDE4D, або інгібітор PDE5, приклади селективного агоністу β2-адреноцептору, що можна застосовувати у фармацевтичному продукті згідно з цим втіленням, охоплюють метапротеренол, ізопротеренол, ізопреналін, альбутерол, салбутамол, формотерол, салметерол, тербуталін, орципреналін, бітолтерол (наприклад, як мезилат), пірбутерол або індакатерол, прикладами агоністу мускаринових рецепторів є антагоністи М1, М2 або М3, як-то селективний антагоніст М3, як-то іпратропіум бромід, тіотропіум бромід, окситропіум бромід, пірензепін або телензепін, прикладами модулятору функції рецептору хемокіну є антагоністи рецептору CCR1, прикладами інгібітору кінази є інгібітор функції р38 або ІКК2; прикладами інгібітору протеази є 23 інгібітор нейтрофіл-еластази, приклади глюкокортикоїду охоплюють флунізолід, тріамцинолон ацетонід, беклометазон дипропіонат, будезонід, флутиказон пропіонат, циклезонід або мометазон фуроат. Заявлений винахід далі пояснено з посиланням на приклади. Загальні способи Спектри 1Н ЯМР реєстрували на приладі Vanan Inova 400MHz або Vanan Mercury-VX 300MHz. Центральні піки хлороформу-d (δΗ 7,27млн-1), диметилсульфоксиду-d6 (δΗ 2,50млн-1) або метанолу-d4 (δΗ 3,31млн-1) застосовували, як внутрішні стандарти Застосовані скорочення s, синглет, br s, широкий синглет, d, дублет, dd, подвійний дублет, ddd, подвійний подвійний дублет, t, триплет, dt, подвійний триплет, q, квартет, т, мультиплет. Для мультиплетів хімічний зсув є наданим для центру сигналу або як межі Аналітичну тонко-шарову хроматографію проводили на силікагелевих планшетах 60 (Merck) з флуоресцентним індикатором Колонкову хроматографію проводили на силікагелі (0,040-0,063мм, Merck) під слабким надлишковим тиском (0,2-0,4бар). Для препаративної ВЕРХ застосовували колонку Kromasil KR-100-5-C18 (250×20мм, Akzo Nobel) та суміші ацетонітрилу та води (0,1об.% трифлуороцтової кислоти додавали, де показано) при швидкості потоку 10мл/хвил. Фракції з вмістом потрібної сполуки комбінували, концентрували роторним випарюванням та зрештою сушили сублімацією. Якщо не сказане інше, вихідні матеріали були комерційно доступними. Усі розчинники та реагенти були лабораторного ґатунку. Операції проводили при температурі довкілля, тобто у межах 17 до 25°С та в атмосфері інертного газу, як-то аргон, якщо не сказане інше. Часи реакції можуть бути коротшими або довшими, ніж показано для завершення реакції у прикладах. Органічні фази з екстракцій сушили безводним натрій сульфатом, якщо не сказане інше, та концентрували роторним випарюванням. Вихід не оптимізовано. Наступний спосіб застосовували для РХ-МСаналізу: Прилад Agilent 1100; Колонка Waters Symmetry 2,1×30мм; Мас ХІАТ; Швидкість потоку 0,7мл/хвил; Довжина хвилі 254 або 220нм; Розчинник А вода+0,1% ТФОК; Розчинник В ацетонітрил+0,1% ТФОК; Градієнт 15-95%/В 2,7хвил., 95% В 0,3хвил. Наступний спосіб застосовували для ГХ-МСаналізу: Прилад Hewlett Packard 5890 Series II, Колонка Agilent НР-5 (30м×0,32мм ID), Mac-селективний детектор Hewlett Packard 5971 Series; Тиск 55кПа Не; Програма 100°С (3хвил.) до 300°С, 25°С/хвил. Скорочення DIPEA Ν,Ν-дизопропілетиламін ДМФ Ν,Ν-диметилформамід ДМСО диметилсульфоксид EtOAc етилацетат EtOH етанол ГХ-МС газова хроматографія масспектрометрія ВЕРХ високоефективна рідинна хроматографія 93425 24 РХ-МС рідинна хроматографія - масспектроскопія MeCN ацетонітрил МеОН метанол NMP N-метилпіролідинон Rt час утримування ТГФ тетрагідрофуран ТВМЕ трет-бутилметил-етер ТФОК трифлуороцтова кислота Приклад 1 1-[(4S)-4-циклопропіл-2,5-дioксоімідазолідин-4іл]-N-метил-N-{[4-(піримідин-5ілокси)феніл]метил}метансульфонамід трифлуорацетат N-Mетил-N-{[4-(піримідин-5ілокси)феніл]метил}амін (0,043г, 0,20ммоль) перемішували у NМР (1,0мл). Суміш охолоджували на бані з холодною водою та додавали DIPEA (36мкл, 0,22ммоль), а потім порціями (4S)-(4-циклопропіл2,5-дioксоімідазолідин-4-іл)метансульфонілхлорид (WO 2006/065215; 0,051г, 0,20ммоль) протягом 5 хвилин. Через 10 хвилин додавали воду та продукт екстрагували тричі ЕtOАс. Екстракти промивали розсолом, сушили та концентрували. Продукт очищали препаративною ВЕРХ (0,1% ТФОК в елюенті), отримуючи 0,057г (66%) заголовної сполуки, як трифлуорацетат. ХІАТ-МС m/z 432 (М+1). 1 Н ЯМР (ДМСО-d6) δ 0,12-0,26 (m, 1Н), 0,350,58 (m, 3Н), 1,12-1,22 (m, 1H), 2,67 (s, 3Н), 3,60 (d, 2H), 4,25 (q, 2H), 7,28 (q, 4H), 7,97 (d, 1H), 8,63 (s, 2H), 9,01 (s, 1H), 10,74 (s, 1Н) млн.-1. Вихідні матеріали отримували таким чином: а) 5-(Метилокси)піримідин Отримано, як у Chem. Eur. J. 2003, 9, 49975010 на 31ммоль з виходом 47% після очистки. 1 Н ЯМР (CDCI3) δ 3,93 (s, 3Н), 8,42 (s, 2H), 8,86 (s, 1H) млн-1. b) Піримідин-5-ол Отримано, як у Chem. Eur. J. 2003, 9, 49975010 на 15ммоль з виходом 27% після очистки. 1 Н ЯМР (ДМСО-d6) δ 8,33 (s, 2H), 8,66 (s, 1H), 10,45 (s, 1H) млн-1. c) 4-(Піримідин-5-ілокси)бензальдегід При перемішуванні до розчину піримідин-5-олу (0,384г, 4,0ммоль) у ДМФ (4,0мл) додавали 4флуорбензальдегід (0,429г, 4,0ммоль), натрій метансульфінат (0,118г, 1,0ммоль) та калій карбонат (0,828г, 6,0ммоль). Реакційну суміш гріли при 120°С протягом 3 годин, охолоджували до температури довкілля, обробляли водою та екстрагували тричі ТВМЕ. Екстракти промивали розсолом, сушили та концентрували Колонкова хроматографія дала 0,523г (43%) підзаголовної сполуки. ХІАТ-МС m/z 201 (М+1). 1 Н ЯМР (CDCI3) δ 7,15 (dd, 2H), 7,93 (dt, 2H), 8,58 (s, 2H), 9,13 (s, 1H), 9,98 (s, 1H) млн-1. d) N-Метил-N-{[4-(піримідин-5ілокси)феніл]метил}амін 25 4-(Піримідин-5-ілокси)бензальдегід (0,344г, 1,7ммоль) перемішували з 33% метиламіном у ЕtOН (30мл) при температурі кипіння під зворотним холодильником протягом 3 годин та тоді концентрували Залишок розчиняли у МеОН та обробляли натрій борогідридом (0,195г, 5,2ммоль) протягом 1 години та перемішували ще 1 годину. Воду додавали та продукт екстрагували тричі ЕtOАс. Органічні фази комбінували, промивали розсолом, сушили та концентрували, отримуючи 0,267г (100%) продукту, що застосовували без подальшої очистки. ХІАТ-МС m/z 216 (М+1). 1 Н ЯМР (CDCI3) δ 2,38 (s, 3Н), 3,68 (s, 2H), 6,94 (d, 2H), 7 28 (d, 2H), 8,38 (d, 2H), 8,87 (s, 1Н) млн.-1. Приклад 2 1-[(4S)-4-циклопропіл-2,5-дioксоімідазолідин-4іл]-N-({4-[(2-циклопропілпіримідин-5іл)окси]феніл}метил)-N-метилметансульфонамід Сирий {4-[(2-циклопропілпіримідин-5іл)окси]бензил}метиламін дигідрохлорид (0,115г, 0,35ммоль) розчиняли у NMP (2,0мл), ТГФ (2,0мл) та DIPEA (0,30мл, 1,8ммоль), отримуючи жовтий розчин (4S)-(4-циклопропіл-2,5-дioксоімідазолідин4-іл)метансульфонілхлорид (WO 2006/065215, 0,070г, 0,28ммоль) додавали порціями протягом 5 хвилин та реакційну суміш перемішували протягом 1 години. Розчинник видаляли випарюванням та залишок розбавляли водою та екстрагували двічі ЕtOАс Комбіновані органічні фази промивали водою та концентрували. Сирий продукт очищали за допомогою ВЕРХ, застосовуючи 35 хвилин градієнт від 20% до 90% MeCN у воді, отримуючи 0,081г (61% виходу) заголовної сполуки як безбарвний порошок. ХІАТ-МС m/z 472,1 (М+1), Rt=1 93хвил. 1 Н-ЯМР (ДМСО-d6) δ 0,14-0,24 (m, 1Н), 0,330,57 (m, 3Н), 0,96 (m, 2H), 1,03 (m, 2H), 1,15 (m, 1Н), 2,22 (m, 1Н), 2,65 (s, 3Н), 3,44 (d, 1H), 3,75 (d, 1H), 4,23 (q, 2H), 7,09 (d, 2H), 7,34 (d, 2H), 7,96 (s, 1H), 8,45 (s 2H), 10,74 (s, 1H) млн-1. Вихідні матеріали отримували таким чином: a) 5-(Бензилокси)-2-циклопропілпіримідин Підзаголовну сполуку синтезували, застосовуючи спосіб, описаний у US 4,558,039, починаючи з циклопропілкарбамідин гідрохлориду. РХ-ХІАТ-МС m/z 227,0 (М+1), Rt=2,36хвил. 1 Н-ЯМР (ДMCO-d6) δ 0,86-0,99 (m, 4H), 2,14 (m, 1H), 5,21 (s, 2H), 7,31-7,47 (m, 5H), 8,44 (s, 2Н) млн1 . b) 2-циклопропілпіримідин-5-ол 5-(Бензилокси)-2-циклопропілпіримідин (4,0г, 18ммоль) розчиняли у МеОН (100мл) та додавали 10% паладій на вугіллі (0,170г). Суміш гідрували при температурі довкілля та 1,013бар протягом ночі. Фільтрування та концентрація дали сирий продукт, що фільтрували через коротку колонку з силікагелем, застосовуючи 5% МеОН-ЕtOАс як елюент. Випарювання розчиннику дало 1,3г (54% 93425 26 виходу) підзаголовної сполуки як безбарвний твердий продукт. ГХ-МС m/z 136,0М+ (41% відносна інтенсивність) 135,0 (100% відносна інтенсивність), Rt=7,36хвил. 1 Н-ЯМР (ДMCO-d6) δ 0,80-0,96 (m, 4H) 2,09 (m, 1H), 8,17 (s, 2H), 10,02 (s, 1H) млн-1. c) 4-[(2-циклопропілпіримідин-5іл)окси]бензальдегід 2-циклопропілпіримідин-5-ол (0,272г, 2,0ммоль), 4-флуорбензальдегід (0,22мл, 2,1ммоль) та калій карбонат (0,414г, 3,0ммоль) у сухому ДМФ (2,0мл) гріли до 120°С у герметичній тубі протягом 3 годин. Кашицю розбавляли водою та екстрагували двічі ЕtOАс. Комбіновані органічні фази промивали тричі водою та розсолом, сушили, фільтрували та концентрували, отримуючи жовту олію. Очистка колонковою хроматографією, застосовуючи 20г оксиду силіцію та градієнт від 0% до 50% суміші ЕtOАс-гептани як елюент дала 0,478г (99% виходу) підзаголовної сполуки як безбарвну олію. РХ-ХІАТ-МС m/z 241,1 (М+1), Rt=1,98хвил. 1 Н-ЯМР (CDCI3) δ 1,04-1,17 (m, 4H), 2,30 (m, 1H), 7,07 (d, 2H), 7,88 (d, 2H), 8,40 (s, 2H), 9,94 (s, 1Н) млн.-1. d) {4-[(2-циклопропілпіримідин-5іл)окси]бензил}метиламін дигідрохлорид До розчину 4-[(2-циклопропілпіримідин-5іл)окси]бензальдегіду (0,240г, 1,0ммоль) у MeCN (0,50мл) додавали 2М метиламін у ТГФ (2,0мл, 4,0ммоль), а потім натрій борогідрид (0,120г, 3,2ммоль) та MeCN (0,50мл). Кашицю перемішували протягом 30 хвилин. Розчинники видаляли випарюванням, додавали воду та суміш екстрагували EtOAc. Органічну фазу промивали розсолом та випарювали на силікагелі. Цей гель переносили на колонку з 20г силікагелю. Колонкова хроматографія, застосовуючи градієнт від 10% до 60% ЕtOАс у гептанах елювала забруднення. Елювання 10% МеОН у ЕtOАс (100мл), а потім 5% концентрованим NH3 у МеОН (100мл) дало продукт в основних фракціях. Ці фракції комбінували, концентрували та знов розчиняли у воді рН доводили до 13 до 14, застосовуючи натрій гідроксид та суміш екстрагували кілька разів ЕtOАс. Органічні екстракти промивали розсолом, сушили калій карбонатом, фільтрували та концентрували, отримуючи олійний залишок. Цю олію розчиняли у ЕtOАс та додавали надлишок 1,5М розчину гідроген хлориду у ЕtOАс. Розчинник видаляли випарюванням, отримуючи 0,186г (56% виходу) сирої підзаголовної сполуки. Сіль мала 93,9% чистоти та й застосовували без подальшої очистки. РХ-ХІАТ-МС m/z 256,1 (М+1-2 НСІ), Rt=1,49хвил. 1 Н-ЯМР (CD3OD) δ 1,21-1,44 (m, 4Н), 2,36 (m, 1Н), 2,74 (s, 3Н), 4,22 (s, 2H), 7,26 (d, 2Н), 7,60 (d, 2H), 8,72 (s, 2H) млн-1. Приклад 3 1-[(4S)-4-циклопропiл-2,5-дioксоiмiдазолiдин-4iл]-N-метил-N-({4-[(2-метилпіримідин-5іл)окси]феніл}метил)метансульфонамід 27 Отримано, як у прикладі 1, але починаючи з Nметил-1-{4-[(2-метилпіримідин-5-іл)окси]феніл}метанаміну на рівні 0,50ммоль з виходом 61% після очистки. XIAT-MC m/z 446 (M+1). 1 Н ЯМР (ДMCO-d6) δ 0,13-0,24 (m, 1Н), 0,330,57 (m, 3Н), 1,15 (ddd, 1H), 2,61 (d, 3Н), 2,66 (s, 3Н), 3,60 (dd, 2H), 4,23 (dd, 2H), 7,11 (dd, 2H), 7,35 (dd, 2H), 7,97 (s, 1H), 8,52 (s, 2Н), 10,74 (s, 1Н) млн.-1. Вихідні матеріали отримували таким чином: а) 2-Метил-5-[(фенілметил)окси]піримідин Отримано, як у прикладі 2(а) на рівні 15ммоль з виходом 73% після очистки. XIAT-MC m/z 201 (M+1). 1 H ЯМР (CDCI3) δ 2,67 (s, 3H), 5,13 (s, 2H), -1 7,31-7,50 (m, 5H), 8,37 (s, 2H) млн . b) 2-Метилпіримідин-5-ол Отримано, як у прикладі 2(b) на рівні 11ммоль з виходом 100% та застосовували без подальшої очистки 1 Η ЯМР (ДMCO-d6) δ 8,10 (s, 2Н), 2,50 (s, 3Н) -1 млн c) 4-[(2-Метилпіримідин-5-іл)окси]бензальдегід Отримано, як у прикладі 1(с) на рівні 11ммоль з виходом 22% після очистки. XIAT-MC m/z 214 (M+1). 1 Н ЯМР (CDCI3) δ 2,78 (s, 3Н), 7,11 (dd, 2H), 7,91 (dd, 2H), 8,49 (s, 2H), 9,97 (s, 1H) млн-1. d) N-Метил-1-{4-[(2-метилпіримідин-5іл)окси]феніл}метан амін Отримано, як у прикладі 1(d) на рівні 2,4ммоль з виходом 82% після очистки. XIAT-MC m/z 228 (M+1). 1 Н ЯМР (CDCI3) δ 2,46 (s, 3Н), 2,72 (s, 3Н), 3,74 (s, 2H), 6,98 (d, 2H), 7,33 (d, 2H), 8,38 (s, 2H) млн-1. Приклад 4 1-[(4S)-4-циклопропіл-2,5-дioксоімідазолідин-4іл]-N-метил-N-[(4-{[2-(трифлуорметил)піримідин-5іл]окси}феніл)метил]метансульфонамід Отримано, як у прикладі 1, але починаючи з Nметил-N-[(4-{[2-(трифлуорметил)піримідин-5іл]окси}феніл)метил]амін на рівні 0,60ммоль з виходом 7,5% після очистки. XIAT-MC m/z 500 (M+1). 1 Н ЯМР (ДMCO-d6) δ 0,14-0,25 (m, 1Н), 0,46 (m, 3Н), 1,16 (m, 1Н), 2,68 (s, 3Н), 3,47 (d, 3Н), 3,77 (d, 1Н), 4,28 (m, 2Н), 7,30 (d, 2Н), 7,42 (d, 2Н), 7,98 (br s, 1Н), 8 81 (s, 2Н), 10,75 (brs, 1Н) млн.-1. Вихідні матеріали отримували таким чином: а) 2-(Трифлуорметил)-1,4,5,6тетрагідропіримідин-5-ол гідрохлорид 93425 28 Вільну основу отримували, як описано у US 5,175,166 на рівні 114ммоль. Сирий продукт розчиняли у пропан-2-олі, обробляли 6М гідроген хлоридом у пропан-2-олі та продукт відфільтровували, як білі кристали з виходом 86%. XIAT-MC m/z 169 (M+1). 1 Н ЯМР (ДМСО-d6) δ 3,39 (d, 2H), 3,51 (d, 2H), 4,25 (q, 1H), 6,32 (s, 1H), 12,11 (s, 1Н) млн-1. b) 2-(Трифлуорметил)піримідин-5-ол 2-(Трифлуорметил)-1,4,5,6тетрагідропіримідин-5-ол (4,20г, 25ммоль) перемішували у нітробензені при 90°С. Натрій метоксид (5,4г, 100ммоль) розчиняли у метанолі (75мл) та додавали порціями до реакційної суміші, відганяючи метанол перед наступним додаванням. Реакційну суміш тоді нагрівали до 121°С протягом 1 години, охолоджували, струшували з водою (150мл), органічну фазу відділяли та водну фазу промивали етилацетатом (2×100мл). Водну фазу доводили до рН4,0 6М водною хлоридною кислотою, екстрагували етилацетатом (2×100мл), сушили та випарювали, отримуючи 2,53г (61,7%) оранжевого продукту, що застосовували без подальшої очистки. XIAT-MC m/z 165 (M+1). 1 Н ЯМР (ДМСО-d6) δ 8,54 (s, 2H), 11,48 (s, 1H) млн.-1. c) 4-{[2-(Трифлуорметил)піримідин-5іл]окси}бензальдегід Отримано, як у прикладі 1(с) на рівні 5,0ммоль з виходом 74%. + ГХ-МС m/z=268 (М ) 1 Н ЯМР (ДMCO-d6) δ 7,44 (d, 2H), 7,99 (d, 2H), 8,95 (s, 2H), 9,97 (d, 1H) млн.-1. d) N-Метил-N-[(4-{[2(трифлуорметил)піримідин-5іл]окси}феніл)метил]амін 4-{[2(Трифлуорметил)піримідин-5-іл]окси}бензальдегід перемішували з 33% метиламіном у 95% етанолі (30мл) при температурі кипіння під зворотним холодильником протягом 1 години та тоді концентрували. Залишок знов розчиняли у 95% етанолі, 10% паладій/карбон додавали, та суміш гідрували при кімнатній температурі при атмосферному тиску протягом 30 хвилин. Реакцію проводили на рівні 5,0ммоль з виходом 95%. XIAT-MC m/z 284 (M+1). 1 Н ЯМР (CDCI3) δ 2,49 (s, 3Н), 3,80 (s, 2H), 5,30 (s, 1H), 7,08 (dd, 2H), 7,43 (dd, 2H), 8,53 (s, 2H) млн1 . Приклад 5 1-[(43)-4-циклопропiл-2,5-дioксоiмiдазолiдин-4iл]-N-({4-[(2-етилпiримiдин-5-іл)окси]феніл}метил)N-метилметансульфонамід Отримано, як у прикладі 1, але починаючи з [4(2-етилпіримідин-5-ілокси)бензил]метиламін на рівні 1,6ммоль з виходом 37% після очистки. XIAT-MC m/z 460 (M+1). 29 1 H ЯМР (ДMCO-d6): δ 0,12-0,28 (m, 1H), 0,350,58 (m, 3Н), 1,08 -1,20 (m, 1H), 1,28 (t, 3Н), 2,66 (s, 3Н), 2,90 (q, 2H), 3,44 (d, 1H), 3,75 (d, 1H), 4,23 (dd, 2H), 7,14 (d, 2H), 7,35 (d, 2H), 7,97 (s, 1H), 8,55 (s, -1 2H), 10,74 (s, 1H) млн . Вихідні матеріали отримували таким чином: a) 2-Етилпіримідин-5-ол Отримано, як у прикладі 2(а) та 2(b) на рівні 11ммоль із загальним виходом 69%, та застосовували без подальшої очистки. XIAT-MC m/z 125 (М+1). 1 Н ЯМР (CDCI3): δ 1,25 (t, 3Н), 2,8 (q, 2H), 8,28 (s, 2H), 11,3 (brs, 1H) млн.-1. b) 4-(2-Етилпіримідин-5-ілокси)бензальдегід Отримано, як у прикладі 1(с) на рівні 2,0ммоль з виходом 83% після очистки. ХІАТ-МС m/z 229,1 (М+1). 1 Н ЯМР (ДMCO-d6): δ 1,31 (t, 3Н), 2,94 (q, 2Н), 7,24 (dd, 2Н), 7,96 (d, 2Н), 8,70 (s, 2Н), 9,96 (s, 1Н) млн.-1. c) [4-(2-Етилпіримідин-5-ілокси)бензил]метиламін Отримано, яку прикладі 1(d) на рівні 1,6ммоль з виходом 83% після очистки. ХІАТ-МС m/z: 244,1 (М+1). 1 Н ЯМР (ДMCO-d6): δ 1,25 (t, 3Н), 2,22 (s, 3Н), 2,86 (q, 2H), 3,58 (s, 2H), 7,01 (dd, 2Н), 7,31 (d, 2H), 8,48 (s, 2H) млн-1. Приклад 6 1-[(4S)-4-циклопропіл-2,5-діоксоімідазолідин-4іл]-N-[(4-{[2-(трифлуорметил)піримідин-5іл]окси}бензил)]метан сульфонамід Отримано, як у прикладі 1, але починаючи з (4-{[2-(трифлуорметил)піримідин-5іл]окси}феніл)метил]амін на рівні 0,26ммоль з виходом 75% після очистки. ХІАТ-МС m/z 486,1 (М+1). 1 Н ЯМР (ДMCO-d6): δ 0,14-0,25 (m, 1Н), 0,46 (m, 3Н), 1,16 (m, 1H), 3,25 (d, 1H), 3,62 (d, 1H), 4,28 (m, 2H), 7,30 (d, 2H), 7,42 (d, 2H), 7,76 (t, 1H), 7,85 (s,1H), 8,81 (s, 2H), 10,75 (brs, 1Н) млн.-1. Вихідні матеріали отримували таким чином: а) 4-{[2-(Трифлуорметил)піримідин-5іл]окси}бензонітрил Отримано, як у прикладі 1(с) з 2циклопропілпіримідин-5-олу та 4-флуорбензонітрилу на рівні 6,1ммоль з виходом 55% ГХ-МС m/z=265,1 (М+). b) 4-{[2-(Трифлуорметил)піримідин-5іл]окси}бензиламін гідрохлорид 4-{[2-(Трифлуорметил)піримідин-5іл]окси}бензонітрил гідрували у суміші 1:1 Η2О Ас ЕtOΗ з вмістом 10% Pd/C. Сирий продукт очищали за допомогою ВЕРХ, застосовуючи протягом 25 хвилин градієнт від 10% до 70% MeCN-вод/ТФОК 0,1%, отримуючи підзаголовну сполуку. ХІАТ-МС m/z 270,1 (М+1) 93425 30 1 Н ЯМР (ДМСО-d6) δ 4,8 (q, 2Н), 7,35 (d, 2Н), 7,56 (d, 2Н), 8,18 (b, 3Н), 8,79 (s, 1H) млн-1. Фармакологічний приклад Аналізи виділеного ферменту ММР12 Рекомбінантний каталітичний домен людини ММР12 можна експресувати та очищати, як описано Parkar A.A. et al., (2000), Protein Expression and Purification, 20, 152. Очищений фермент можна застосовувати для моніторингу активностей інгібіторів таким чином ММР12 (50нг/мл кінцева концентрація) інкубують протягом 60 хвилин при кімнатній температурі із синтетичним субстратом Mca-Pro-Cha-Gly-Nva-His-Ala-Dpa-NH2 (10мкМ) у буфері для аналізу (0,1Μ "Tns-HCI" (товарний знак) буфер, рН7,3 з вмістом 0,1М NaCI, 20мМ СаСІ2, 0,020мМ ZnCI та 0,05мас./об.% "Brij 35" (товарний знак) детергент) у присутності (10 концентрацій) або відсутності інгібіторів Активність визначають вимірюванням флуоресценції при λзб 320нм та λем 405нм. Відсоток інгібування розраховують таким чином: % Інгібування дорівнює [Флуоресценція плюс інгіФлуоресценція фон] поділено на [Флубіторорeсцeнція мінус інгібітор- Флуорeсцeнція фон]. ММР8 Очищений про-ММР8 отримано від Calbiochem Фермент (при 10мкг/мл) активують п-аміно-фенілмеркурій ацетатом (АРМА) при 1мМ протягом 2,5 годин, 35°С. Активований фермент можна застосовувати для моніторингу активностей інгібіторів таким чином ММР8 (200нг/мл кінцева концентрація) інкубують протягом 90 хвилин при 35°С (80% Н2О) із синтетичним субстратом Mca-Pro-Cha-GlyNva-His-Ala-Dpa-NH2 (12,5мкМ) у буфері для аналізу (0,1Μ "Tns-HCI" (товарний знак) буфер, рН7,5 з вмістом 0,1Μ NaCI, 30мМ СаСІ2, 0,040мМ ZnCI та 0,05мас./об.% "Brij 35" (товарний знак) детергент) у присутності (10 концентрацій) або відсутності інгібіторів. Активність визначають вимірюванням флуоресценції при λзб 320 нм та λем 405нм. Відсоток інгібування розраховують таким чином: % Інгібування дорівнює [Флуоресценція плюс інгібітор- Флуоресценція фон] поділено на [Флуоресценція мінус інгібітор- Флуоресценція фон]. ММР9 Рекомбінантний каталітичний домен людини ММР9 експресували та тоді очищали Zn-хелатною колонковою хроматографією, а потім колонковою хроматографією з гідроксаматною афінністю. Фермент можна застосовувати для моніторингу активностей інгібіторів таким чином: ММР9 (5нг/мл кінцева концентрація) інкубують протягом 30 хвилин при RT із синтетичним субстратом Mca-ProCha-Gly-Nva-His-Ala-Dpa-NH2 (5мкМ) у буфері для аналізу (0,1Μ "Tris-HCI" (товарний знак) буфер, рН7,3 з вмістом 0,1Μ NaCI, 20мМ СаСІ2, 0,020мМ ZnCI та 0,05мас./об.% "Brij 35" (товарний знак) детергент) у присутності (10 концентрацій) або відсутності інгібіторів. Активність визначають вимірюванням флуоресценції при λзб 320нм та λем 405нм. Відсоток інгібування розраховують таким чином: 31 93425 32 % Інгібування дорівнює [Флуоресценція плюс інгіФлуоресценція фон] поділено на [Флуоресценція мінус інгібітор- Флуоресценція фон]. ММР14 Рекомбінантний каталітичний домен людини ММР14 можна експресувати та очищати, як описано Parkar A.A. et al., (2000), Protein Expression and Purification, 20, 152. Очищений фермент можна застосовувати для моніторингу активностей інгібіторів таким чином: ММР14 (10нг/мл кінцева концентрація) інкубують протягом 60 хвилин при кімнатній температурі із синтетичним субстратом Mca-Pro-Cha-Gly-Nva-His-Ala-Dpa-NH2 (10мкМ) у буфері для аналізу (0,1Μ "Tris-HCI" (товарний знак) буфер, рН7,5 з вмістом 0,1Μ NaCI, 20мМ СаСІ2, 0,020мМ ZnCI та 0,05мас./об.% "Brij 35" (товарний знак) детергент) у присутності (5 концентрацій) або відсутності інгібіторів. Активність визначають вимірюванням флуоресценції при λзб 320нм та λем 405нм. Відсоток інгібування розраховують таким чином: % Інгібування дорівнює [Флуоресценціяплюс інгібітор- Флуоресценція фон] поділено на [Флуоресценціямінус інгібітор- Флуоресценція фон]. Протокол тестування стосовно інших матриксних металопротеїназ, у тому числі ММР9, застосовуючи експресований та очищений про-ММР опи сано, наприклад, С Graham Knight et al., (1992) FEBS Lett., 296(3), 263-266. MMP19 Рекомбінантний каталітичний домен людини ММР19 можна експресувати та очищати, як описано Parkar A.A. et al., (2000), Protein Expression and Purification, 20:152. Очищений фермент можна застосовувати для моніторингу активностей інгібіторів таким чином: ММР19 (40нг/мл кінцева концентрація) інкубують протягом 120 хвилин при 35°С із синтетичним субстратом Mca-Pro-Leu-Ala-NvaDpa-Ala-Arg-NH2 (5мкМ) у буфері для аналізу (0,1Μ "Tris-HCI" (товарний знак) буфер, рН7,3 з вмістом 0,1Μ NaCI, 20мМ СаСІ2, 0,020мМ ZnCI та 0,05мас./об.% "Brij 35" (товарний знак) детергент) у присутності (5 концентрацій) або відсутності інгібіторів. Активність визначають вимірюванням флуоресценції при λзб 320нм та λем 405нм. Відсоток інгібування розраховують таким чином: % Інгібування дорівнює [Флуоресценція плюс інгібітор- Флуоресценція фон] поділено на [Флуоресценція мінус інгібітор- Флуоресценціяфон]. Наступна таблиця показує дані вибору сполук заявленого винаходу у порівнянні зі структурно найближчою сполукою розкритою у WO 02/074751. Селективність для інгібування hММР12 відносно hMMPx визначено, як ІС50 (ММРх), що поділено на ІС50 (ММР12). Як можна чітко бачити з даних таблиці, сполуки заявленого винаходу при порівнянні з 1-[(4S)-4метил-2,5-діоксоімідазолідин-4-iл]-N-[(4фенокси)феніл)метил]-метансульфонамідом з одного боку, набагато більш потужні як інгібітори hММР12; а з іншого боку, значно більш селективні стосовно інгібування інших hMMP, особливо hММР9. бітор Комп’ютерна верстка Т. Чепелева Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюHydantoin derivatives used as mmp inhibitors
Автори англійськоюChapman David, Gabos Balint, Munck Af Rosenschold Magnus
Назва патенту російськоюПроизводные гидантоина, которые применяются kak mmp ингибиторы
Автори російськоюЧапмен Девид, Габос Бали, Мунк Аф Розеншольд Магнус
МПК / Мітки
МПК: C07D 403/12, A61P 11/06, A61P 11/00, A61K 31/506, C07D 239/34, A61P 19/00, A61P 19/02
Мітки: інгібітори, похідні, застосовуються, гідантоїну
Код посилання
<a href="https://ua.patents.su/16-93425-pokhidni-gidantonu-shho-zastosovuyutsya-yak-mmp-ingibitori.html" target="_blank" rel="follow" title="База патентів України">Похідні гідантоїну, що застосовуються як mmp інгібітори</a>
Попередній патент: Спосіб одержання азоксистробіну
Наступний патент: Спосіб одержання гідролізату з молюсків
Випадковий патент: Пастоподібний продукт