Похідні гідантоїну як інгібітори металопротеїназ
Номер патенту: 89801
Опубліковано: 10.03.2010
Автори: абос Балінт, Мунк Аф Розеншельд Маґнус, Лундквіст Мікаель, Шамовскі Іґор, Златоідскі Паволь
Формула / Реферат
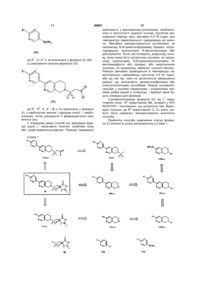
1. Сполука формули (І) або її фармацевтично прийнятна сіль
 , (I)
, (I)
де
R1 представляє Н, галоген, CF3 або CH2CN;
R2 представляє С1-С3алкіл; і
А, А1 і В, кожен незалежно, представляють СН або N;
2. Сполука за пунктом 1, де R1 представляє хлор.
3. Сполука за пунктом 1, де R1 представляє CF3.
4. Сполука за будь-яким з пунктів 1-3, де R2 представляє метил або етил.
5. Сполука за будь-яким з пунктів 1-4, де А і А1, кожен, представляють N.
6. Сполука за пунктом 1, вибрана із групи, що складається з:
(5S)-5-метил-5-({[6-[2-(трифторметил)піримідин-5-іл]-3,4-дигідроізохінолін-2(1Н)-іл]сульфоніл}метил)імідазолідин-2,4-діон;
(5S)-5-({[6-(4-хлорфеніл)-3,4-дигідроізохінолін-2(1Н)-іл]сульфоніл}метил)-5-метилімідазолідин-2,4-діон;
{4-[2-({[(4S)-4-метил-2,5-діоксоімідазолідин-4-іл]метил}сульфоніл)-1,2,3,4-тетрагідроізохінолін-6-іл]феніл}ацетонітрил;
(5S)-5-метил-5-{[(6-піридин-3-іл-3,4-дигідроізохінолін-2(1Н)-іл)сульфоніл]метил}імідазолідин-2,4-діон;
(5S)-5-({[6(4-хлорфеніл)-3,4-дигідро-2,7-нафтиридин-2(1Н)-іл]сульфоніл}метил)-5-метилімідазолідин-2,4-діон;
і її фармацевтично прийнятні солі.
7. Фармацевтична композиція, що містить сполуку формули (І) або її фармацевтично прийнятну сіль за будь-яким з пунктів 1-6 у комбінації з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
8. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пунктів 1-6 у виробництві ліків для використання в лікуванні обструктивного захворювання респіраторного тракту.
9. Застосування за пунктом 8, де обструктивна хвороба респіраторного тракту - астма або хронічна обструктивна легенева хвороба.
10. Спосіб лікування обструктивного захворювання респіраторного тракту, в якому пацієнту вводять терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким з пунктів 1-6.
Текст
1. Сполука формули (І) або її фармацевтично прийнятна сіль R1 A1 C2 2 (19) 1 3 89801 4 10. Спосіб лікування обструктивного захворювання ли (І) або її фармацевтично прийнятної солі за респіраторного тракту, в якому пацієнту вводять будь-яким з пунктів 1-6. терапевтично ефективну кількість сполуки форму Даний винахід відноситься до нових похідних гідантоїну, способів їх одержання, фармацевтичних композицій, що містять їх і використання в терапії. Металопротеїнази - суперсімейство протеїназ (ензимів), чия чисельність в останні роки різко зросла. Базуючись на структурному і функціональному аналізі, ці ензими були класифіковані в сімейства і підсімейства, як описано в N.M. Hooper (1994) FEBS Letters 354:1-6, Приклади металопротеїназ включають матричні металопротеїнази (MMPs) як наприклад, колагенази (ММР1, ММР8, ММР13), желатинази (ММР2, ММР9), стромелізини (ММР3, ММР10, ММР11), матрилізини (ММР7), металоеластази (ММР12), енамелізини (ММР19), MT-MMPs (ММР14, ММР15, ММР16, ММР17); репролізин або адамалізин або сімейство MDC, яке включає секретази і шедази, як наприклад TNF конверуючі ензими, (ADAM10 і ТАСЕ); сімейство астацинів, яке включає ензими, як наприклад, проколаген продукувальні протеїнази (РСР); і інші металопротеїнази, як наприклад, агреканази, сімейство ендотелін-конвертуючих ензимів, і сімейство ангіотензин-конвертуючих ензимів. Металопротеїнази, як вважається, є важливі в багатьох фізіологічних процесах хвороб, що залучені в відновлення тканин, як наприклад ембріональний розвиток, остеогенез і відновлення слизової матки протягом менструації. Це базується на здатності металопротеїнази розщеплювати широкий ряд матричних субстратів, як наприклад колаген, протеоглікан і фібронектин. Металопротеїнази, як також вважається, є важливі в продукуванні, або секреції, біологічно важливих клітинних медіаторів, як наприклад фактор некрозу пухлини (TNF); і посттрансляційній протеолітичній обробці або депонуванні біологічно важливих мембранних протеїнів, як наприклад, низько афінний рецептор IgE CD23 (повніший список див. N. М. Hooper et al., (1997) Biochem. J. 321:265-279). Металопротеїнази пов'язані з багатьма захворюваннями або станами. Інгібування активності однієї або більше металопротеїназ, може бути бажане при цих захворюваннях або станах, наприклад: різні запальні і алергічні захворювання, як наприклад, запалення суглобів (особливо ревматоїдний артрит, остеоартрит і подагра), запалення шлунково-кишкового тракту (особливо запалення товстого кишечника, виразковий коліт і гастрит), запалення шкіри (особливо псоріаз, екзема, дерматит); метастазування пухлини або інвазія; захворювання, пов'язане з нерегульованою деградацією екстрацелюлярної матриці, як наприклад остеоартрит; кістково-резорбційне захворювання (як наприклад, остеопороз і хвороба Педжета); захворювання, пов'язані з аномальним ангіогенезом; посилене колагеном ре моделювання, пов'язане з діабетом, захворювання періодонту (як наприклад гінгівіт), виразка рогівки, виразка шкіри, післяопераційні стани (як наприклад колоноанастомоз) і загоєння ран шкіри; демієлінізуючі захворювання центральної і периферичної нервової системи (як наприклад, розсіяний склероз); хвороба Альцгеймера; екстраклітинне матричне ремоделювання, що спостерігається при серцевосудинних захворюваннях, як наприклад, рестеноз і атеросклероз; астма; риніт; і хронічне обструктивне легеневе захворювання (XOЛЗ(COPD)). ММР12, також відома як макрофагальна еластаза або металоеластаза, спочатку була клонована у миші Shapiro et al [1992, Journal of Biological Chemistry 267: 4664 і людях в такій же групі в 1995]. ММР12 переважно експресується в активованих макрофагах і була виділена із альвеолярних макрофагів [Shapiro et al, 1993, Journal of Biological Chemistry, 268: 23824], також як і в пінистих клітинах в атеросклеротичних ушкодженнях [Matsumoto et al, 1998, Am. J. Pathol. 153: 109]. Мишача модель XOЛЗ(COPD) базується на сенсибілізуванні сигаретним димом протягом шести місяців, дві сигарети на день протягом шести днів на тиждень. У мишей дикого типу виявилася емфізема легенів після цієї обробки. Коли ММР12 тестували в цій моделі, вона не проявляла ніякої значної емфіземи, що вказує, що ММР12 - ключовий ензим в XOЛЗ(COPD) патогенезі. Роль MMPs, як наприклад ММР12 в XOЛЗ(COPD) (емфізема і бронхіт) обговорюється в Anderson and Shinagawa, 1999, Current Opinion in Anti-inflammatory and Immunomodulatory Investigational Drugs 1(1): 29-38, Недавно було виявлено, що, куріння збільшує макрофагальну інфільтрацію і експресію макрофагально похідну ММР-12 в бляшках Kangavari сонної артерії у людей Kangavari [Matetzky S, Fishbein MC et al., Circulation 102:(18). 36-39 Suppl. S, Oct 31, 2000]. MMP9 (Желатиназа В; 92kDa коллагеназа тип IV; 92kDa желатиназа) - продукується протеїном, який спочатку очищували, потім клонували і аналізували послідовність, в 1989 [S.M. Wilhelm і (1989) інші J. Biol. Chem. 264 (29): 17213-17221; опублікований з помилкою в J. Biol. Chem. (1990) 265 (36): 22570]. Недавній огляд ММР9 забезпечує чудове джерело для детальної інформації і посилань щодо цієї протеази: Т.Н. Vu & Ζ. Werb (1998) (In : Matrix Metalloproteinases, 1998, edited by W.C. Parks & R.P. Mecham, pp. 115-148, Academic Press. ISBN 0-12-545090-7). Наступні положення здобуті із того огляду Т.Н. Vu & Ζ. Werb (1998). Експресія ММР9 обмежена декількома типами клітин, зокрема: трофобласти, остеокласти, нейтрофіли і макрофаги. Проте, експресія може індукуватися в тих же самих клітинах і в інших типах клітин декількома медіаторами, зокрема експозицією клітин факторами росту або цитокінами. Останні такі ж медіатори, що часто залучаються у ініціацію запальної відповіді. Як із іншими продукованими 5 89801 6 MMPs, MMP9 вивільняється як неактивний проЗгідно з даним винаходом забезпечені сполуки ензим, який послідовно розщеплюється до утвоформули (І) рення ензиматично активного ензиму. Необхідні протеази для цієї активації in vivo не відомі. Баланс активного ММР9 проти неактивного ензиму, крім того, регулюється in vivo взаємодією з ТІМР-1 (Тканинний Ингібітор Металопротеїнази -1), нативний протеїн. ТІМР-1 зв'язується з С-термінальною областю ММР9, приводячи до інгібування каталітичного домена ММР9. Баланс індукованої експресії про-ММР9, розщеплювання про-до активного ММР9 і наявність ТІМР-1 - складові визначення , кількості каталітично активного ММР9, який присутній в локальному сайті. Протеолітично активна де ММР9 руйнує субстрати, що включають желатин, 1 R представляє Н, галоген, CF3 або CH2CN; еластин, і нативний тип IV і V колагену; не має 2 R представляє C1-C3 алкіл; і ніякої активності проти нативного типу І колагену, А, А1 і В кожен незалежно представляють СН протеогліканів або ламінінів. або N; Було зібрано більшість даних, що демонструі її фармацевтично прийнятні солі. ють ролі ММР9 в різних фізіологічних і патологічСполуки формули (І) можуть існувати в енантіних процесах. Фізіологічні ролі включають інвазію ометричних формах. Зрозуміло, що всі енантіомеембріональними трофобластами через матковий ри, діастереомери, рацемати і їх суміші є включеепітелій в ранніх стадіях ембріональної імплантаними в межі діапазону винаходу. ції; деяку роль в рості і розвитку кісток; і міграцію Сполуки формули (І) можуть також існувати в запальних клітин з судинного русла в тканини. різних таутомерних формах. Всі можливі таутомеВивільнення ММР9, вимірюване використанрні форми і їх суміші є включеними в межі діапазоням імуноензимних тестів, було значно посилене в ну винаходу. рідинах і в AM супернатантах від нелікованих астУ одному втіленні, R1 представляє хлор. матиків, порівняно з іншими популяціями [Am. J. 1 У одному втіленні, R представляє CF3, Resp. Cell & Моl. Biol., Nov 1997, 17 (5):583-591]. У одному втіленні, R2 представляє метил або Також, збільшена експресія ММР9 спостерігалася етил. У одному втіленні, R2 представляє метил. при певних інших патологічних станах, таким чиУ одному втіленні А і А1 кожен представляють ном демонструючи ММР9 в патогенезі захворюN. У іншому втіленні, А представляє N і А1 предвання, як наприклад, XOЛЗ(COPD), артрит, метасставляє СН. У іншому втіленні А і А1 кожен предтази пухлин, хвороба Альцгеймера, розсіяний ставляють СН. склероз, і розрив атеросклеротичної бляшки при У одному втіленні, В представляє N. У іншому атеросклерозі, що приводить до гострих коронарвтіленні, В представляє СН. них станів, як наприклад, інфаркт міокарду. У одному втіленні, R1 представляє CF3; R2 Відомий цілий ряд інгібіторів металопротеїназ 1 представляє метил або етил; А і А кожен пред(див., наприклад, огляди інгібіторів ММР by Beckett ставляють N; і В представляє СН. R.P. and Whittaker Μ., 1998, Exp. Opin. Ther. У одному втіленні, R1 представляє CF3; R2 Patents, 8(3):259-282; and by Whittaker M. et al, представляє метил або етил; А і А1 кожен пред1999, Chemical Reviews 99(9):2735-2776). ставляють N; і В представляє N. WO 02/074767 розкриває похідні гідантоїну 1 2 У одному втіленні, R представляє хлор; R формули представляє метил або етил; А представляє N і А1 представляє СН; і В представляє N. 1 2 У одному втіленні, R представляє хлор; R 1 представляє метил або етил; А , А і В кожен представляють СН. За винятком інакше вказаного, термін "C1-C3 алкіл" означає тут лінійну або розгалужену ланцюгову алкільну групу, що має від 1 до 3 вуглецевих атомів. Приклади таких груп включають метил, , етил, н-пропіл та і-пропіл. За винятком інакше вказаного, термін "галощо є корисні як інгібітори ММР, особливо, як ген" означає тут фтор, хлор, бром і йод. потужні інгібітори ММР12, Приклади сполук винаходу включають: Ми зараз розкриваємо подальшу групу похід(5S)-5-метил-5-({[6-[2-(трифторметил) піриміних гідантоїну, які є інгібіторами металопротеїнази дин-5-іл]-3,4-дигідроізохінолін-2(1Н)і представляють особливий інтерес у інгібуванні іл]сульфоніл}метил)імідазолідин-2,4-діон; MMPs, як наприклад, ММР12 і ММР9. Сполуки (5S)-5-({[б-(4-хлорфеніл)-3,4-дигідроізохінолінданого винаходу мають бажану потенцію, селек2(1Н)-іл]сульфоніл}метил)-5-метилімідазолідинтивність і фармакокінетичні властивості. Сполуки 2,4-діон; даного винаходу знаходяться в межах генеричного діапазону WO 02/074767, але є типом, що не були наведені як конкретні приклади там. 7 89801 8 {4-[2-({[(4S)-4-метил-2,5-діоксоімідазолідин-4Сполуки формули (І) є корисними, тому що воіл]метил}сульфоніл)-1,2,3,4-тетрагідроізохінолін-6ни виявляють фармакологічну активність на тваіл]феніл}ацетонітрил; ринах і, тому є потенційно корисними як фармаце(5S)-5-метил-5-{[(6-піридин-3-іл-3,4втичні препарати. Зокрема, сполуки винаходу є дигідроізохінолін-2(1Н)інгібіторами металопротеїнази і, тому можуть виіл)сульфоніл]метил}імідазолідин-2,4-діон; користовуватися в лікуванні захворювань або ста(5S)-5-({[6-(4-хлорфеніл)-3,4-дигідро-2,7нів, опосередкованих ММР12 та ММР9, як напринафтиридин-2(1Н)-іл]сульфоніл}метил)-5клад астма, риніт, хронічні обструктивні легеневі метилімідазолідин-2,4-діон;і їх фармацевтично захворювання (XOЛЗ(COPD)), артрит (як наприприйнятні солі. клад ревматоїдний артрит і остеоартрит), атероКожна ілюстраційна сполука представляє спесклероз і рестеноз, рак, інвазія і метастази, захвоцифічний і незалежний аспект винаходу. рювання, що включають деструкцію тканини, Сполуки формули (І) можуть існувати в енантідеструкцію заміненого суглоба стегна, захворюометричних формах. Тому, всі енантіомери, діасвання періодонту, фіброзне захворювання, інтереомери, рацемати і їх суміші включені в межах фаркт і захворювання серця, фіброз печінки та діапазону винаходу. Різні оптичні ізомери можуть нирок, ендометріоз, захворювання пов'язані з бути ізольовані розділенням рацемічної суміші ослабленням екстрацелюлярної матриці, серцева сполук, використовуючи загальноприйнятні спосонедостатність, аневризма аорти, захворювання, би, наприклад, фракційну кристалізацію або пов'язані з ЦНС, як наприклад, хвороба АльцгейНРLС(високо-ефективну рідинну хроматографію, мера і розсіяний склероз, гематологічні розлади. ВЕРХ). Альтернативно оптичні ізомери, можуть Взагалі, сполуки даного винаходу - потужні інбути одержані асиметричним синтезом або синтегібітори ММР9 і ММР12. Сполуки даного винаходу зом від оптично активних стартових речовин. також показують хорошу селективність щодо відКоли оптичні ізомери існують серед сполук виносної відсутності інгібування різних інших ММР, находу, ми розкриваємо всі індивідуальні оптично як наприклад ММР14. активні форми і комбінації їх як індивідуальні конкВідповідно, даний винахід забезпечує сполуку ретні втілення винаходу, також як, і їх відповідні формули (І) або її фармацевтично прийнятну сіль, рацемати. як вище визначено, для використання в терапії. Переважно, сполуки формули (І) мають (5S) У іншому аспекті, винахід забезпечує викорисстереохімію, як показано нижче: тання сполуки формули (І) або її фармацевтично прийнятної солі, як вище визначено, у виробництві ліків для використання в терапії. У іншому аспекті, винахід забезпечує використання сполуки формули (І) або її фармацевтично прийнятної солі, як вище визначено, у виробництві ліків для використання в лікуванні захворювань або станів, при яких бажане інгібування ММР12 і ММР9. У іншому аспекті, винахід забезпечує використання сполуки формули (І) або її фармацевтично прийнятної солі, як вище визначено, у виробництві ліків для використання в лікуванні запального заКоли таутомери існують серед сполук винахохворювання. ду, ми розкриваємо всі індивідуальні таутомерні У іншому аспекті, винахід забезпечує викорисформи і комбінації їх, як індивідуальні конкретні тання сполуки формули (І) або її фармацевтично втілення винаходу прийнятної солі, як вище визначено, у виробництві Даний винахід включає сполуки формули (І) у ліків для використання в лікуванні обструктивного формі солей. Прийнятні солі включають ті, що захворювання респіраторного тракту, як наприутворені з органічними або неорганічними кислоклад, астма або XOЛЗ(COPD). тами, або органічними або неорганічними основаУ іншому аспекті, винахід забезпечує викорисми. Такі солі звичайно будуть фармацевтично тання сполуки формули (І), або її фармацевтично прийнятними солями, хоча фармацевтично неприйнятної солі, як вище визначено, у виробництві прийнятні солі, можливо, є корисні в одержанні і ліків для використання в лікуванні ревматоїдного очищенні певних сполук. Такі солі включають кисартриту, остеоартриту, атеросклерозу, раку або лотно-адитивні солі, як наприклад гідрохлорид, розсіяного склерозу. гідробромід, цитрат, тозилат і малеат і солі, що У контексті представленого винаходу, термін утворені з фосфорною або сірчаною кислотою. У "терапія" також включає "профілактику" якщо неіншому аспекті прийнятні солі - основні солі, як має протилежних конкретних показань. Терміни наприклад, сіль лужного металу, наприклад, на"терапевтичний" і "терапевтично" потрібно тлуматрію або калію, сіль лужно-земельного металу, чити відповідно. наприклад, кальцію або магнію, або органічна сіль Профілактика, як очікується, є особливо дореаміну, наприклад, триетиламін. чною для лікування людей, які перенесли попереСолі сполук формули (І), можуть бути утворені дній епізод, або мають підвищений ризик хвороби реагуванням вільної основи або іншої її солі з одабо стану. Люди з ризиком розвитку певного заним або більше еквівалентами відповідної кислоти хворювання або стану, загалом включають тих, що або основи. мають сімейну історію захворювання або стану, 9 89801 10 або тих, хто був ідентифікований генетичним тесназальні спреї, супозиторії, порошки або аерозолі том або скринінгом щодо особливої сприйнятлидля інгаляції, і для парентерального використання вості до розвитку захворювання або стану. (включаючи внутрішньовенний, внутрішньом'язоВинахід далі забезпечує спосіб лікування завий або інфузійний) стерильні водні або масляні хворювання або стану, при яких інгібування розчини, або суспензії, або стерильні емульсії. ММР12 і ММР9 є бажаним, який полягає в признаНа додаток до сполук даного винаходу, фарченні пацієнту терапевтично ефективної кількості мацевтична композиція цього винаходу може тасполуки формули (І) або її фармацевтично прийнкож складатися або сумісно вводитись (одночасно ятної солі, як вище визначено. або послідовно) з одним або більше фармакологіВинахід також забезпечує спосіб лікування обчних агентів в лікуванні одного або більше захвоструктивного захворювання респіраторного тракту, рювань або станів, посилаючись на вищенаведені, наприклад, астми або XOЛЗ(COPD), який полягає як наприклад продукт "Symbicort" (торгова марка). в призначенні пацієнту терапевтично ефективної Даний винахід надалі забезпечує спосіб одеркількості сполуки формули (І) або її фармацевтичжання сполуки формули (І) або її фармацевтично но прийнятної солі, як вище визначено. прийнятної солі, як визначено вище, що включає: Для вищенаведених терапевтичних викориса) реагування сполуки формули (II) тань призначене дозування буде, звичайно, змінюватися в залежності від використовуваної сполуки, шляху введення, бажаності ефекту лікування, і розладу, який підлягає лікуванню. Щоденне дозування сполуки формули (І)/солі (активний інгредієнт) може знаходиться в межах від 0,001мг/кг до 75мг/кг, зокрема від 0,5мг/кг до 30мг/кг. Ця щоденна доза, може даватися в розді, лених дозах в міру необхідності. Звичайно, одиничні дозовані форми міститимуть приблизно 1-500 де R2 є, як визначено у формулі (І) і L1 предміліграм сполуки винаходу. ставляє відхідну групу, з сполукою формули (III) Сполуки формули (І) і її фармацевтично при(або її сіллю) йнятні солі, можуть використовуватися самостійно, але загалом призначатимуться у формі фармацевтичної композиції, в якій сполука/сіль (активний інгредієнт) формули (І) знаходиться в поєднанні з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. Залежно від способу введення, фармацевтична композиція переважно містить від 0,05 до 99%ваг., переважніше від 0,10 до 70%ваг. активного інгредієнта, і, від 1 до 99,95%ваг., переважніше від 30 до 99,90%ваг. фармацевтично прийнятного ад'юванта, розріджувача або носія, всі вагові відсотки(%ваг.) базуються , на загальній композиції. Загальноприйнятні процедури для вибору і одержання відповідних фарде R1, А, А1 і В є, як визначено у формулі (І); мацевтичних композицій описано, наприклад, в або фармацевтичні "Pharmaceuticals - The Science of b) реагування сполуки формули (V) Dosage Form Designs", Μ. Ε. Aulton, Churchill Livingstone, 1988. Тому, даний винахід також забезпечує фармацевтичну композицію, що містить сполуку формули (І) або її фармацевтично прийнятну сіль, як вище визначено, в комбінації з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм. Винахід надалі забезпечує спосіб одержання фармацевтичної композиції винаходу, який складається із змішування сполуки формули (І) або її , фармацевтично прийнятної солі, як вище визначено, з фармацевтично прийнятним ад'ювантом, 2 де R і В є, як визначено у формулі (І) і LG - вірозріджувачем або носієм. дхідна група; з похідною борної кислоти формули Фармацевтичні композиції цього винаходу для (XII) лікування захворювання або стану можуть призначатися стандартним способом, наприклад: пероральний, місцевий, парентеральний, буккальний, назальний, вагінальний або ректальний, або інгаляційний. Для цих цілей сполуки винаходу, можуть бути утворені засобами, відомими в галузі, у форму, наприклад, таблетки, капсули, водні або масляні розчини, суспензії, емульсії, креми, мазі, гелі, 11 89801 12 здійснюють у відповідному розчиннику, необов'язково в присутності доданої основи, протягом відповідного періоду часу, звичайно 0,5-16 годин, при температурі навколишнього середовища до кипіння. Звичайно використовуються розчинники, як наприклад, Ν,Ν-диметилформамід, піридин, тетрагідрофуран, ацетонітрил, N-метилпіролідин або , дихлорметан. Коли застосовують додаткову основу, вона може бути органічною основою, як наприде R1, А і А1 є, як визначено у формулі (І); або клад, триетиламін, N,N-диізопропілетиламін, Nс) реагування сполуки формули (IX) метилморфолін або піридин, або неорганічною основою, як наприклад, карбонат лужного металу. Реакція звичайно проводиться в температурі навколишнього середовища протягом 0,5-16 годин, або до тих пір, поки не досягнеться завершення реакції, що визначають хроматографічними або спектроскопічними способами. Реакції сульфонілгалоїдів з різними первинними і вторинними амінами добре відомі в літературі, і варіації умов будуть очевидні для фахівців. 1 Сульфонілхлориди формули (II), де L пред2 , ставляє хлор і R представляє Me, розкриті у WO 02/074767 і посиланнях, що цитуються там. Відпо1 2 1 де R , R , А, А і В є, як визначено у формулі відні сполуки, де R2 представляє C1-C3 алкіл, мо(І); з карбонатом амонію і ціанідом калію; і, необожуть бути одержані, використовуючи аналогічні в'язково, потім утворюючи її фармацевтично приспособи. йнятну сіль. Прийнятні способи одержання сполук формуУ згаданому вище способі (а), відповідні відхіли (І) описані в шляху ретроминтезу в Схемі 1, 1 дні групи L включають галоген, особливо хлор або трифторметилсульфонат. Реакцію переважно Схема 1 13 У Схемі 1, захисні групи (PG) можуть бути або карбаматами (наприклад трет-бутоксикарбамат), амідами (наприклад трифторацетил), або алкілами (наприклад трет-бутил або бензил). Відхідні групи (LG) можуть бути наступними: хлорид, бромід, йодид, або трифторметилсульфонат. У каталізованих паладієм сполученнях Suzuki можуть використовуватися або борна кислота, або пінаколборонати. Проміжна сполука (IVa-c) може бути одержана стандартним Suzuki контактуванням (Chem. Rev. 1995, 95, 2457) електрофільної сполуки (Vlla-c) і борного реактиву, або інакше, електрофільної сполуки (XI) і борного реактиву (Vllla-c). Останній може бути одержаний від (Vlla-c) використанням стандартних умов Miyaura (J. Org. Chem. 1995, 60, 7508-7510). Зняття захисту (IVa-c) або хлоридом водню в метанолі (PG=третбутоксикарбоніл), або кип'ятінням 1-хлоретил хлорформат/киплячий метанол (PG=трет-бутил або бензил) (Synlett. 1993, 195-196) надає амін (ІІІа-с) як гідрохлоридну сіль. Вільна основа може бути одержана обробкою (ІІІа-с) основою і екстракцією з органічним розчинником, як наприклад етилацетат або толуол. Реагування (ІІІа-с) або як солі, або основи у відповідному розчиннику (наприклад ацетонітрил, тетрагідрофуран, N-метилпіролідин або Ν,Ν-диметилформамід) з сульфоніл хлоридом (II) у присутності третинного аміну (наприклад триетиламін, піридин або Ν,Ν-диізопропілетиламін) протягом 0,5-16 годин надає сполуку формули (І). Альтернативний шлях до сполук формули (І) від проміжної сполуки (ІІІа-с) через метансульфонамід (Ха-с) і кетон (ІХа-с) був попередньо описаний (WO 02/074767). Стисло, обробка (ІІІа-с) метансульфонілхлоридом і третинним аміном (наприклад триетиламін, піридин або Ν,Νдиізопропілетиламін) у відповідному розчиннику (наприклад дихлорметан або тетрагідрофуран) приводить до метансульфонаміду (Ха-с), який в свою чергу може бути трансформований в кетон (ІХа-с), використовуючи стандартні процедури. Нагрівання кетону (ІХа-с) з карбонатом амонію і ціанідом калію в 50% водному етиловому спирті в герметичній пробірці при 80-90°С протягом 1-5 годин надає рацемічний гідантоїн, який може бути розділений хіральною хроматографією (наприклад на OD-OH з 100% етиловим спиртом). 89801 14 У третьому шляху, з проміжної сполуки (Vlla-c) знімають захист, як викладено вище, щоб одержати амін (Vla-c) як гідрохлоридну сіль. Вільна основа може бути ізольована обробкою основою і екстракцією органічним розчинником, наприклад етилацетатом або толуолом. Реагування (Vla-c) або як солі, або як основи у відповідному розчиннику (наприклад ацетонітрил, тетрагідрофуран, Nметилпіролідин або Ν,Ν-диметилформамід) з сульфонілхлоридом (II) у присутності третинного аміну (наприклад триетиламін, піридин або Ν,Νдиізопропілетиламін) протягом 0,5-16 годин надає хіральний сульфонамід (Va-c). Останній може контактувати з борним реактивом, використовуючи стандартні умови Suzuki, щоб одержати сполуки формули (І). Проміжні сполуки (Vlla-b) одержують загальноприйнятними шляхами, використовуючи наступні способи. Проміжна сполука 1,2,3,4-тетрагідроізохінолін (VIla) Способи для синтезу 1,2,3,4тетрагідроізохінолінів добре відомі в літературі. Класичним шляхом є реакція Pomeranz-Fritz бензальдегідів з з діацеталь-захищеним аміноацетальдегідом (Org. React. 1951, 6, 191), що надає ядро ізохіноліну, котре під каталітичним відновленням надає 1,2,3,4-тетрагідро-ізохінолін. Інший шлях - реакція Bischler-Napieralski (Org. React. 1951, 6, 74) карбамату 2-фенілетанаміну з фосфорил хлоридом в киплячому толуолі або ксилені. Відновлення одержаного циклічного бензаміду з гідридом літію-алюмінію в тетрагідрофурані (J. Med. Chem. 1987, 30(12), 2208-2216) або диборану в тетрагідрофурані (J. Med. Chem. 1980, 23(5), 506-511) надає 1,2,3,4-тетрагідроізохінолін. Варіація реакції Bischler-Napieralski - синтез PictetSpengler (Org. React. 1951, 6, 151). У цій реакції аміди, карбамати або сульфонаміди 2фенілетанаміну нагрівають з параформальдегідом і сильними протонними кислотами (наприклад трифтороцтова кислота, сірчана кислота) або кислотами Люіса в розчиннику (наприклад, дихлорметан, толуол, мурашина кислота), щоб одержати 1,2,3,4-тетрагідроізохінолін за одну стадію (Tetrahedron 2002, 58(8), 1471-1478). Схема 2 Переважно, проміжну сполуку (VIla) 1,2,3,4тетрагідроізохінолін - синтезують шляхом А, показаним в Схемі 2. Цей шлях - реакція типу Friedel CraftN-[2-(3-бромфеніл)етил]-2,2,2трифторацетаміду з формальдегідом і сірчаною кислотою в оцтовій кислоті (Tetrahedron Lett. 1996, 15 89801 16 37(31), 5453-5456), що надає суміш 6-бром- і 8лька стадій і розпочинається з кислотно каталізобромізомер в співвідношенні 3 до 1. Заміна триваної конденсації малононітрилу з діетил 1,3фторацетамідної групи на ВОС-групу надає (VIla). ацетондикарбоксилатом (J. Chem. Soc. 1960, 3513Регіоізомери зазвичай не відділяють на цій стадії. 3515; see also J. Heterocycl. Chem. 1970, 7, 419Проміжна сполука 1,2,3,4-тетрагідро-2,7421). Злегка інший шлях до 2,7-нафтиридину нафтиридин (VII) включає окислення 4-форміл-2,7-нафтиридину, У контрасті щодо 1,2,3,4-тетрагідроізохіноліну, щоб одержати 2,7-нафтиридин-4-карбонову кислов літературі є швидше декілька прикладів способів ту, з наступним декарбоксилюванням (Synthesis синтезу 1,2,3,4-тетрагідро-2,7-нафтиридину. Один 1973, 46-47). Зовсім інший спосіб заснований на важливий спосіб, щоб одержати 1,2,3,4-тетрагідровнутрішній реакції Diels-Alder N-(етоксикарбоніл)2,7-нафтиридин - регіоселективне каталітичне відN-(бут-3-ініл)аміно-метилпіразину, що надає суміш новлення 2,7-нафтиридину (Eur. J. Med. Chem. 1,2,3,4-тетрагідро-2,7-нафтиридин і 5,6,7,8Ther. 1996, 31(11), 875-888). Синтез 2,7тетрагідро-1,7-нафтиридин після гідролізу карбанафтиридину і деяких його похідних був описаний матної групи (WO 02/064574). в літературі. Один класичний шлях включає декіСхема 3 Переважно, проміжна сполука 1,2,3,4тетрагідро-2,7-нафтиридин (VIІb) може бути синтезована, як показано в Схемах 3 і 4. У шляху В, комерційно доступний 6-метоксинікотинальдегід послідовно обробляють літієвою сіллю Ν,Ν,Ν'триметилетилендіаміну, потім n-BuLi в гексані і на завершення у йоді, щоб одержати 4-йод-6метоксинікотинальдегід (cf. Tetrahedron Lett. 1993, 34(39), 6173-6176). Йодовану сполуку контактують з триметилсилілацетиленом за звичайних умов Sonagashira-Hagihara (Synthesis 1980, 627-630) і одержаний 6-метокси-4 [(триметилсиліл)етиніл]нікотинальдегід конденсують з гідроксидом амонію в етиловому спирті, щоб одержати 3-метокси-2,7-нафтиридин (Synthesis 1999, 2, 306-311). Каталітичне регіоселективне відновлення (cf. Eur. J. Med. Chem. Ther. 1996, 31(11), 875-888) надає 6-метокси-1,2,3,4тетрагідро-2,7-нафтиридин. Деметилювання і Nзахист з ВОС-ангідридом і заключна обробка одержаного трет-бутил 6-гідрокси-3,4-дигідро-2,7нафтиридин-2(1Н)-карбоксилату з трифтороцтовим ангідридом в двохфазовій системі надає (VIІb). 17 89801 18 Схема 4 У шляху С, комерційно доступний 5-бром-2метокси-4-метилпіридин в безводному тетрагідрофурані металізують з n-BuLi, а потім обробляють з Ν,Ν-диметилформамідом, щоб одержати 6метокси-4-метилнікотинальдегід. Останній перетворюють на трет-бутилімін з трет-бутиламіном в дихлорметані. Металізація з літій 2,2,6,6тетраметилпіперидином (Li-TMP)) (cf. J. Org. Chem. 1993, 58, 2463-2467) і додавання Ν,Νдиметилформаміду надає іміноацетальдегід, який відновлюють з ціаноборогідридом натрію в метанолі, щоб одержати 2-трет-бутил-6-метокси1,2,3,4-тетрагідро-2,7-нафтиридин. Розщеплювання метильної групи нагріванням із 48% бромводневою кислотою і обробка трифтороцтовим ангідридом у присутності основи надає (VIІb) захищену, як трет-бутиламін. Буде оцінено фахівцями, що в способах даного винаходу певні потенційно реактивні функціональні групи, як наприклад, гідроксильні або аміногрупи в стартових реактивах або проміжних сполуках, можуть вимагати захисту відповідними захисними групами. Тому, одержання сполук винаходу може включати на різних стадіях додавання і видалення однієї або більше захисних груп. Відповідні захисні групи і деталі способів додавання і видалення таких груп описані в 'Protective Groups in Organic Chemistry', edited by J.W.F. McOmie, Plenum Press (1973) and 'Protective Groups in Organic Synthesis', 3rd edition, T.W. Greene and P.G.M. Wuts, Wiley-lnterscience (1999). Сполуки винаходу і проміжні сполуки крім того, можуть бути виділені із реакційних сумішей і, якщо необхідно, крім того очищені, використовуючи стандартні способи. Даний винахід буде, крім того, пояснений посиланням на наступні ілюстративні приклади. Загальні Способи 1 Н ЯМР і 13С ЯМР спектри були записані на приладі Varian Inova 400МГц або Varian MercuryVX 300МГц. Центральні піки хлороформу-d ( H 7,27ppm), диметилсульфоксиду-d6 ( H 2,50ppm), ацетонітрилу-d3 ( H 1,95ppm) або метанолу-d4 (год. 3,31ppm) використовувалися як внутрішні еталони. Колонкову хроматографію виконували, використовуючи силікагель (0,040-0,063мм, Merck) з легким надлишком тиску (0,2-0,4бар), застосовуваним до колонки. Колонка Kromasil KR-100-5-C18 (250 20мм, Nobel Akzo) і суміш ацетонітрил/вода з 0,1% ТФК при швидкості потоку 10мл/хв використовувалася для препаративної ВЕРХ (високоефективної рідинної хроматографії, ВЕРХ). За винятком заявленого інакше, стартові речовини були комерційно доступні. Всі розчинники і комерційні реактиви були лабораторної марки і використовувалися як одержано. Органічні фази від екстракцій висушували над безводним сульфатом натрію, якщо не вказано інакше. Органічні фази або розчини були сконцентровані ротаційним випаровуванням. Виходи не були оптимізовані. Наступний спосіб використовувався для аналізу LC-MS: Прилад Agilent 1100; колонка Waters Symmetry 2,1 30мм; Мас АРСІ; Швидкість потоку 0,7мл/хв; Довжина хвилі 254 або 220нм; Розчинник А: вода+0,1% ТФК; Розчинник В: ацетонітрил+0,1% ТФК; Градієнт 15-95% /В 2,7хв., 95% В 0,3хв. Наступний спосіб використовувався для аналізу GC-MS: Прилад Hewlett Packard 5890 Серія II; Колонка Agilent НР-5 (30m 0,32мм ID); Масселективний детектор Hewlett Packard Серія 5971; Тиск 55kPa He; Програма сушильної шафи 100°С (3 хвилини) до 300°С, 25°С/хв. 19 89801 20 Абревіації ВОС-ангідрид n-BuLi DCM DIPEA DMF DMSO EtOAc EtOH GC-MS LDA MeOH LC-MS PdCI2 dppf PT TEA THF TBME TFK Triflic ангідрид ди-трет-бутил бікарбонат n-бутил літію дихлорметан Ν,Ν-диізопропілетиламін Ν,Ν-диметилформамід диметилсульфоксид етилацетат етиловий спирт газова хроматографія- масспектрометрія діізопропіламід літію метанол рідка хроматографія- масспектроскопія 1,1'-біс(дифенілфосфін)ферроцен паладію(ІІ) дихлориду кімнатна температура, звичайно 20-22°С триетиламін тетрагідрофуран метиловий ефір трет-бутилу трифтороцтова кислота трифторметансульфоновий ангідрид (Tf2O) Приклад 1 (5S)-5-метил-5-({[6-[2(трифторметил)піримідин-5-іл]-3,4дигідроізохінолін-2(1Н)іл]сульфонiл}метил)імідазолідин-2,4-діон [(4S)-4-метил-2,5-діоксоімідазолідин-4іл]метансульфоніл хлорид (0,0295г, 0,13ммоль) в збезводненому THF (0,60мл) додавали по краплях до перемішуваного розчину 6-[2(трифторметил)піримідин-5-іл]-1,2,3,4тетрагідроізохіноліну (0,039г, 0,14ммоль), DIPEA (0,034мл, 0,20ммоль) і збезводненого THF (0,60мл) при температурі крижаної ванни. Після завершення додавання, розчин перемішували при кімнатній температурі протягом 2 годин, а поміщали в насичений сольовий розчин і двічі екстрагували EtOAc. Комбіновані органічні фази промивали насиченим сольовим розчином, висушували, фільтрували і концентрували, щоб одержати сирий продукт. Очищення препаративною НРLС(високоефективною рідинною хроматографією, ВЕРХ) надало 0,050г (76%) названої сполуки як білої твердої речовини. LC-MS m/z 470 (M+1); 1 Н ЯМР (CD3CN) 9,19 (с, 2Н), 8,51 (ш с, 1Н), 7,62 (с, 1Н), 7,61 (дд, 1Н), 7,36 (д, 1Н), 6,33 (ш с, 1Н), 4,51 (с, 2Н), 3,57 (т, 2Н), 3,52 (д, 1Н), 3,42 (д, 1Н), 3,04 (т, 2Н) і 1,48 (с, 3H) ppm. Стартові речовини були одержані, як вказано нижче: 6-[2-(Трифторметил)піримідин-5-іл]-1,2,3,4тетрагідроізохінолін трет-Бутил 6-[2-(трифторметил)піримідин-5іл]-3,4-дигідроізохінолін-2(1Н)-карбоксилат (0,051г, 0,13ммоль) перемішували в ТФК (1,0мл) і DCM (1,0мл) при кімнатній температурі (RT) протягом ночі, потім концентрували двічі, другий раз з додаванням толуолу (5мл), щоб одержати трифторацетатну сіль. LC-MS m/z 280 (M+1); 1 Н ЯМР (CD3CN) 9,25 (с, 2Н), 7,73 (м, 2Н), 7,44 (д, 1Н), 4,45 (с, 2Н), 3,56 (т, 2Η) і 3,24 (т, 2Н) ppm. Сирий продукт поміщали в 1М розчину карбонату натрію (10мл) і двічі екстрагували EtOAc. Комбіновані органічні фази промивали насиченим сольовим розчином, висушували, фільтрували і концентрували, щоб одержати 0,039г (100%) названого продукту як білої твердої речовини. 2-(Трифторметил)піримідин-5ілтрифторметансульфонат Трифторметансульфоновий ангідрид (13,9г, 85ммоль) в сухому DCM (70мл) додавали повільно до крижаного розчину 2-(трифторметил)піримідин5-олу (13,9, 85ммоль) (US 4,558,039), DIPEA (16мл, 93ммоль) і збезводненого DCM (260мл) при такій швидкості, що температура утримувалася між 4°С і 6°С. Після завершення додавання розчини перемішували протягом 2,5год. при 4°С, а потім дозволяли стати теплим до кімнатної температури. Додавали воду (50мл) і 1М фосфорної кислоти (4,5мл) і фази промивали і відділяли. Органічну фазу промивали послідовно водою і насиченим бікарбонатом натрію, висушували, фільтрували і ретельно концентрували ротаційним випаровуванням (тиск 300-400мбар). Темно-червоне масло очищували колонковою хроматографією з EtOAcгептани (1:8 через 1:4) як елюент, щоб одержати 22,5г (90%) названого продукту як незабарвлене масло, що кристалізується на холоді. Альтернативно, продукт міг би міг би бути очищений дистиляцією, b.р. 75-77°С/10мбар. 1 НЯМР (CDCI3) 8,90 (с, 2Н) ppm. 21 89801 22 трет-Бутил 6-[2-(трифторметил)піримідин-5(10мл) при 60°С протягом 4год. Додавали більше іл]-3,4-дигідроізохінолін-2(1Н)-карбоксилат 25% гідроксиду амонію (15мл) і безперервно пеСуміш 4:1 (0,10г, 0,28ммоль) трет-бутилу 6ремішували при кімнатній температурі (RT) протя(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-3,4гом ночі. Леткі речовини випаровували, щоб залидигідроізохінолін-2(1Н)-карбоксилат і трет-бутил 8шити сирий амін як білу тверду речовину. (4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-3,4LC-MS m/z 212, 214 (М+1). дигідроізохінолін-2(1Н)-карбоксилату, 2Додавали сухий THF (50мл) і DIPEA (1,3мл, (трифторметил)піримідин-5-іл трифторметансу7,5ммоль), потім ВОС-ангідрид (1,8г, 8,2ммоль). Суміш перемішували при кімнатній температурі льфонату (0,083г, 0,28ммоль), PdCI2 dppf (RT) протягом ночі. Леткі речовини випаровували і (0,0048г), 2М карбонату натрію (1,1мл), толуолу залишок поміщали у воду. рН був скоректований (4,0мл) і EtOH (1,0мл) очищували із сухим аргоном до 2 з 1М фосфорною кислотою і продукт двічі протягом десяти хвилин, потім нагрівали в гермеескстрагували EtOAc. Комбіновані органічні фази тичній пробірці протягом 6год при 81°С. Чорний промивали насиченим сольовим розчином, злегка розчин фільтрували через скловату, поміщали в залуженим насиченим бікарбонатом натрію, висунасичений сольовий розчин і двічі промивали шували, фільтрували і концентрували. Сирий проEtOAc. Комбіновані органічні фази висушували, дукт очищували колонковою хроматографією з фільтрували і концентрували з кремнієм (5г). КоEtOAc-гептани (1:50 через 1:20), щоб одержати лонкова хроматографія з EtOAc-гептани (1:8 через 2,24г (96%) 3:1 суміш названого продукту і трет1:5) надала 0,051г (48%) названого продукту як бутилу 8-бром-3,4-дигідроізохінолін-2(1Н)білої твердої речовини. карбоксилату. LC-MS m/z 380 (M+1); 1 LC-MS m/z 256, 258 (М-56); Н ЯМР (CDCI3) 9, 06 (с, 2Н), 7,44 (дд, 1Н), 1 Н ЯМР (CDCI3) 7,31 (дд, 1Н), 7,30 (ш с, 1Н), 7,38 (ш с, 1Н), 7,30 (д, 1Н), 4,66 (с, 2Н), 3,71 (т, 6,98 (д, 1Н), 4,52 (с, 2Н), 3,63 (т, 2Η), 2,81 (т, 2Н) і 2Н), 2,95 (т, 2Н), і 1,51 (с, 9Н) ррm. 1,50 (с, 9Н) ppm (6-ізомер). трет-бутил 6-(4.4,5,5-тетраметил-1,3,21 Н ЯМР (CDCI3) 7,42 (дд, 1Н), 7,12-7,01 (м, діоксаборолан-2-іл)-3,4-дигідроізохінолін-2(1Н)карбоксилат 2Н), 4,55 (с, 2Н), 3,64 (т, 2Η), 2,84 (т, 2Η) і 1,51 (с, Суміш 3:1 (0,49г, 1,6ммоль) трет-бутил 6-бром9Н) ppm (8-ізомер). 3,4-дигідроізохінолін-2(1Н)-карбоксилату і третПриклад 2 (5S)-5-({[6-(4-Хлорфеніл)-3,4бутил 8-бром-3,4-дигідроізохінолін-2(1Н)дигідроізохінолін-2(1Н)-іл]сульфонiл}метил)-5карбоксилату, біс(пінаколато)диборану (0,45г, метилімідазолідин-2,4-діон 1,8ммоль), PdCI2 dppf (0,039г, 0,048ммоль), ацетат калію (0,48г, 4,8ммоль) і DMF (8,0мл) нагрівали при 81°С протягом ночі. Розчинник випаровували, залишок поміщали в насичений сольовий розчин і двічі промивали EtOAc. Органічну фазу висушували, фільтрували і концентрували. Колонкова хроматографія з EtOAc-гептани (1:10 через 1:4) надала 0,24г 4:1 суміші названого продукту і трет-бутил 8-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)3,4-дигідроізохінолін-2(1Н)-карбоксилату. (5S)-5-{[(6-Бром-3,4-дигідроізохінолін-2(1Н)1 Н ЯМР (CDCI3) 7,62 (д, 1Н), 7,60 (с, 1Н), 7,13 іл)сульфоніл]метил}-5-метил-імідазолідин-2,4-діон (д, 1Н), 4,59 (с, 2Н), 3,64 (т, 2Н), 2,85 (т, 2Н), 1,50 (0,016г, 0,040ммоль), 4-хлорфенілборна кислота (с, 9Н) і 1,35 (с, 12Н) ppm (6-ізомер). (0,0072г, 0,045ммоль), PdCI2 dppf (0,0030г), 2М 1 НЯМР (CDCI3) 7,69 (д, 1Η), 7,24-7,14 (м, 2Н), карбонату натрію (0,15мл), толуолу (0,80мл) і 4,88 (с, 2Н), 3,64 (т, 2Η), 2,85 (т, 2Η), 1,50 (с, 9Н) і EtOH (0,20мл) перемішували в герметичній ампулі 1,35 (с, 12Н) ppm (8-ізомер). при 95°С протягом 17год. Розчинник випаровували трет-бутил 6-бром-3.4-дигідроізохінолін-2(1Н)і залишок поміщали у воду. Розчини підкислювали карбоксилат 10% НОАс до рН 6, а потім двічі екстрагували 6-Бром-2-(трифторацетил)-1,2,3,4EtOAc. Комбіновані органічні фази промивали сотетрагідроізохінолін одержували в дві стадії із [2льовим насиченим розчином бікарбонатом натрію, (3-бромфеніл)етилу]аміну (4,0г, 20ммоль), послівисушували, фільтрували і концентрували, щоб довною процедурою Stokker (Tetrahedron Lett. одержати сирий продукт. 1996, 37(31), 5453-5456). Колонкова хроматограLC-MS m/z 434 (M+1) фія з EtOAc-гептани (1:10 через 1:6) надала 2,3г Очищення препаративною НРLС(високо(7,5ммоль) 3:1 суміш 6-бром-2-(трифторацетил)ефективною рідинною хроматографією, ВЕРХ) 1,2,3,4-тетрагідроізохінолін і 8-бром-2-(трифторнадало 0,0080г (46%) названої сполуки як білої ацетил)-1,2,3,4-тетрагідроізохіноліну. твердої речовини. 1 1 Н ЯМР (CDCI3) 7,62 (д, 1Н), 7,60 (с, 1Н), 7,13 Н ЯМР (CD3CN) 8,53 (ш с, 1Н), 7,62 (м, 2Н), (д, 1Н), 4,59 (с, 2Н), 3,64 (т, 2Н), 2,85 (т, 2Н) і 1,50 7,46 (м, 4Н), 7,23 (д, 1Н), 6,34 (ш с, 1Н), 4,45 (с, (с, 9Н) і 1,35 (с, 12Н) ppm (6-ізомер). 2Н), 3,53 (м, 2Н), 3,49 (д, 1Н), 3,39 (д, 1Н), 2,99 (м, 1 Н ЯМР (CDCI3) 7,69 (д, 1Н), 7,24-7,14 (м, 2Н) і 1,46 (с, 3H) ppm. 2Н), 4,88 (с, 2Н), 3,64 (т, 2Н), 2,85 (т, 2Н) і 1,50 (с, Сполуки Прикладів 3 і 4 були одержані, вико9Н) і 1,35 (с, 12Н) ppm (8-ізомер). ристовуючи загальний спосіб Прикладу 2. Згадану вище речовину перемішували з абсолютним EtOH (100мл) і 25% гідроксидом амонію 23 89801 24 Приклад 3 {4-[2-({[4S)-4-метил-2,5(5S)-5-({[8-Бром-3.4-дигідроізохінолін-2(1Н)діоксоімідазолідин-4-iл]метил}сульфоніл)-1,2,3,4іл]сульфоніл}метил)-5-метилімідазолідин-2,4-діон тетрагідроізохінолін-6-іл]феніл}ацетонітрил (перше елюювання) Вихід: 0,13г білої твердої речовини. LC-MS m/z 402/404 (М+1), 419/421 (М+18); 1 Н ЯМР (СО3СN) 8,48(шс, 1Н), 7,48 (м, 1Н), 7,21 (м, 1Н), 7,14 (м, 1Н), 6,31 (ш с, 1Н), 4,36 (с, 2Н), 3,48 (м, 4Н), 2,95 (м, 2Н) і 1,46 (с, 3H) ppm. (5S)-5-({[6-Бром-3.4-дигідроізохінолін-2(1Н)іл]сульфоніл}метил)-5-метилімідазолідин-2,4-діон (друге елюювання) Вихід: 0,25г білої твердої речовини. LC-MS m/z 402/404 (М+1), 419/421 (М+18); Біла тверда речовина. 1 LC-MS m/z 439 (M+1); Н ЯМР (CD3CN) 8,47 (ш с, 1Н), 7,38 (м, 1Н), 1 7,36 (м, 1Н), 7,08 (м, 1Н), 6,29 (ш с, 1Н), 4,36 (с, Н ЯМР (CD3CN) 8,61 (ш с, 1 Η), 7,65 (м, 2Н), 2Н), 3,48 (м, 2Н), 3,47 (д, 1Н), 3,37 (д, 1Н), 2,92 (м, 7,48 (м, 2Н), 7,43 (м, 2Н), 7,23 (д, 1Н), 6,38 (ш с, 2Н) і 1,45 (с, 3H) ppm. 1Н), 4,46 (с, 2Н), 3,87 (с, 2Н), 3,53 (м, 2Н), 3,50 (д, Приклад 5 (5S)-5-(([6-(4-Хлорфеніл)-3.41Н), 3,40 (д, 1Н), 3,00 (м, 2Н) і 1,46 (с, 3H) ppm. дигідро-2,7-нафтиридин-2(1Н)Приклад 4 (5S)-5-метил-5-{[(6-піридин-3-іл-3,4іл]сульфонiл}метил)-5-метилімідазолідин-2,4-діон дигідроізохінолін-2(1Н)іл)сульфонiл]метил}імідазолідин-2.4-діон Біла тверда речовина. LC-MS m/z 401 (М+1); 1 Н ЯМР (CD3CN) 8,98 (ш с, 1Н), 8,71 (м, 1Н), 8,54 (д, 2Н), 7,89 (м, 1Н), 7,56 (м, 2Н), 7,34 (м, 1Н), 6,34 (ш с, 1Н), 4,49 (с, 2Н), 3,55 (м, 2Н), 3,52 (д, 1Н), 3,41 (д, 1Н), 3,03 (м, 2Н) і 1,47 (с, 3H) ppm. Стартову речовину одержували як вказано нижче: (5S)-5-({[6-Бром-3,4-дигідроізохінолін-2(1Н)іл]сульфоніл}метил)-5-метилімідазолідин-2,4-діон Суміш 3:1 (0,44г, 1,4ммоль) 6-бром-2(трифторацетил)-1,2,3,4-тетрагідроізохіноліну і 8бром-2-(трифторацетил)-1,2,3,4тетрагідроізохіноліну (одержаного згідно Tetrahedron Lett. 1996, 37(31), 5453-5456) перемішували в етиловому спирті (10мл), що містить декілька крапель 25% гідроксиду амонію при кімнатній температурі. Після 2,5год., розчин концентрували, розчиняли в збезводненому THF (1,0мл) під аргоном і охолоджували у крижаній ванні. Додавали DIPEA (0,41мл, 2,4ммоль), потім розчин [(4S)-4-метил-2,5-діоксоімідазолідин-4іл]метансульфоніл хлориду (0,27г, 1,2ммоль) і збезводнений THF (1,0мл). Суміш перемішували при кімнатній температурі (RT) протягом 1Н, а потім концентрували. Сирий продукт поміщали у воду і двічі екстрагували EtOAc. Комбіновані органічні фази промивали насиченим сольовим розчином, висушували, фільтрували і концентрували, щоб одержати 0,55г суміш (5S)-5-({[6-бром-3,4дигідроізохінолін-2(1Н)-іл]сульфоніл}метил)-5метилімідазолідин-2,4-діону і (5S)-5-({[8-бром-3,4дигідроізохінолін-2(1Н)-іл]сульфоніл}метил)-5метилімідазолідин-2,4-діон. Регіоізомери відділяли препаративною НРLС(високо-ефективною рідинною хроматографією, ВЕРХ). [(4S)-4-метил-2,5-діоксоімідазолідин-4іл]метансульфоніл хлорид (0,086г, 0,38ммоль) в безводному ΝΜΡ (0,50мл) додавали по краплях до перемішуваного розчину 6-(4-хлорфеніл)-1,2,3,4тетрагідро-2,7-нафтиридину (0,046г, 0,19ммоль), DIPEA (0,066мл, 0,38ммоль) і безводного ΝΜΡ (1,5мл) при кімнатній температурі. Після завершення додавання, розчин перемішували при кімнатній температурі (RT) 1,5Н, потім розбавляли водою (1мл) ι очищували препаративною НРLС(високо-ефективною рідинною хроматографією, ВЕРХ), до одержання 0,0070г (8%) названої сполуки як білої твердої речовини. LC-MS m/z 435, 436 (М+1), 1 Н ЯМР (DMSO-d6) 10,8 (с, 1Н), 8,49 (с, 1Н), 8,10 (д, 2Н), 8,06 (с, 1Н), 7,84 (с, 1Н), 7,54 (д, 2Н), 4,45 (с, 2Н), 3,61 (д, 1Н), 3,48 (д, 1Н), 3,47 (т, 2Н), 2,98 (т, 2Н) і 1,34 (с, 3H) ppm Стартові речовини були одержані як вказано нижче: 6-(4-Хлорфеніл)-1,2,3,4-тетрагідро-2,7нафтиридин трет-Бутил 6{[(трифторметил)сульфоніл]окси}-3,4-дигідро-2,7нафтиридин-2(1Н)-карбоксилат (0,69г, 1,8ммоль), 4-хлорфенілборна кислота (0,39г, 2,5ммоль), PdCI2 dppf (0,050г), насичений розчин карбонату натрію (2мл), EtOH (4мл) і толуол (4мл) перемішували при 80°С протягом 6год. Розчин охолоджували до кімнатної температури, додавали воду (10мл) і екстрагували з EtOAc (25мл). Комбіновані органічні фази промивали насиченим сольовим розчином, висушували, фільтрували і концентрували. Очищення колонковою хроматографією з EtOAcгептани (1:1), як елюент, надало 0,065г (10%) третбутил 6-(4-хлорфеніл)-3,4-дигідро-2,7нафтиридин-2(1Н)-карбоксилату. 25 89801 26 LC-MS m/z 345 (M+1). ня, безперервно перемішували при -70°С ще 15 Цей матеріал розчиняли в МеОН (2мл) і повіхвилин. Потім додавали по краплях 1,6М n-BuLi в льно додавали ацетилхлорид (0,2мл). Після перегексані (10мл, 16ммоль) і, безперервно перемішумішування при 40°С протягом ночі, розчин конценвали при -45°С протягом 4год. Розчин охолоджутрували, залишок додавали в 1М гідроксиду вали до -70°С, а потім розчин йоду (3,0г, 12ммоль) натрію (10мл) і екстрагували з EtOAc-ефір(1:1) і безводного THF (25мл) додавали по краплях. Після завершення додавання, безперервно пере(4 30мл). Комбіновані органічні фази висушували, мішували при -70°С протягом 30 хвилин, а потім фільтрували і концентрували до одержання 0,046г при кімнатній температурі (RT) на протязі 3год. (100%) сирої названої сполуки. Сирий продукт поміщали в ефір (40мл) і послідовLC-MS m/z 245 (M+1). но промивали насиченим розчином хлористого трет-Бутил 6амонію (2 40мл) і 5% тіосульфатом натрію {[(трифторметил)сульфоніл]окси}-3,4-дигідро-2,7нафтиридин-2(1Н)-карбоксилат (2 20мл). Органічну фазу висушували, фільтруваСирий 3-метокси-2,7-нафтиридин (одержаний ли і концентрували. Очищення колонковою хромаіз 4,4ммоль 6-метокси-4тографією з EtOAc-гептани (1:1), як елюент надало [(триметилсиліл)етиніл]нікотинальдегід) гідрогені0,41г (15% вихід) 4-йод-6-метоксинікотинальдегіду. зували (тиск 30psi) при кімнатній температурі над LC-MS m/z 264 (M+1); 1 РtO2 (приблизно 0,1г) в НОАс (25мл) протягом Н ЯМР (CDCI3) 9,95 (с, 1Н), 8,53 (с, 1Н), 7,32 2,5год. Розчин фільтрували через Celite фільтр і (с, 1Н) і 3,98 (с, 3H) ppm. прозорий фільтрат концентрували сублімаційною 4-Йод-6-метоксинікотинальдегід (0,41г, сушкою, щоб одержати сирий 6-метокси-1,2,3,41,6ммоль), триметилсилілацетилен (0,35мл, тетрагідро-2,7-нафтиридин, як ацетатну сіль. 2,8ммоль), РdСІ2(РРh3)2 (каталітична кількість), Cul LC-MS m/z 165 (M+1). (каталітична кількість), TEA (2мл) і THF (10мл) пеЦей матеріал був повторно кип'ятили в 48% ремішували при 60°С 2год. Леткі речовини випабромводневій кислоті протягом 10год. Леткі речоровували і залишок поміщали у воду і екстрагувавини випаровували і залишок сушили під вакуумом ли з ефіром. Органічну фазу висушували, при 45°С, щоб одержати приблизно 0,70г сирого фільтрували і концентрували. Очищення колонкогідроброміду 5,6,7,8-тетрагідро-2,7-нафтиридин-3вою хроматографією з EtOAc-гептани (1:3), як олу. елюент, надало 0,25г (68% вихід) 6-метокси-4LC-MS m/z 151 (M+1). [(триметилсиліл)етиніл]нікотинальдегіду. Цей матеріал (приблизно 4,8ммоль) розчиняLC-MS m/z 234 (M+1); 1 ли у воді (13мл) і обробляли THF (33мл), Et3N Н ЯМР (CDCI3) 10,4 (с, 1Н), 8,73 (с, 1Н), 6,84 (0,85мл, 6,0ммоль) і ВОС-ангідридом (1,6г, (с, 1Н), 4,03 (с, 3H) і 0,30 (с, 9Н) ppm. 7,3ммоль) при кімнатній температурі. Після пере6-Метокси-4мішування при такій же температурі протягом [(триметилсиліл)етиніл]нікотинальдегід (0,25г, 6год. розчин концентрували до однієї третини його 1,1ммоль) і 7М аміаку в МеОН (5мл) перемішували оригінального об'єму і залишок поміщали у воду і в герметичній ампулі при 80°С протягом ночі. Розекстрагували тричі з EtOAc. Комбіновані органічні чин концентрували, поміщали в насичений розчин фази висушували, фільтрували і концентрували до карбонату натрію і екстрагували з ефіром. Органіодержання 0,80г (67% сирого продукту) трет-бутил чну фазу висушували, фільтрували і концентрува6-гідрокси-3,4-дигідро-2,7-нафтиридин-2(1Н) ли до одержання 0,20г названого продукту. карбоксилату як білої твердої речовини. GC-MS m/z 160 (M); 1 LC-MS m/z 251 (М+1), 195 (М-55). Н ЯМР (CDCI3) 9,41 (с, 1Н), 9.27 (с, 1Н), 8,47 Цей матеріал (приблизно 5,4ммоль) розчиня(д, 1Н), 7,64 (д, 1Н), 7,03 (с, 1Н) I 4,12 (с, 3H) ppm. ли в двохфазній системі толуолу (20мл) і 30% воФармакологічний Приклад дного трикалієвого ортофосфату (20мл) і обробММР12 ляли трифотрметансульфоновим ангідридом Каталітичний домен людської рекомбінантної (1,6мл, 6,8ммоль) при 4°С [Org. Lett. 2002, 4(26), ММР12 може бути експресований і очищений, як 4717-4718]. Крижану ванну вилучали і безперервописано by Parkar A.A. et al, (2000), Protein но перемішували протягом 2год. при кімнатній теExpression and Purification, 20, 152. Очищений енмпературі, після чого дві фази відділяли. Водну зим може використовуватися, щоб контролювати фазу промивали однократно з толуолом. Комбіноінгібітори активності, вказані нижче: ММР12 (завані органічні фази промивали насиченим сольоключна концентрація 50нг/мл) інкубували протягом вим розчином, висушували і концентрували. Очи60 хвилин при кімнатній температурі з синтетичщення колонковою хроматографією з EtOAcним субстратом Mca-Pro-Cha-Gly-Nva-His-Ala-Dpaгептани (2:1), як елюент надало 0,45г (17% Вихід) NH2 (10 Μ) в тестовому буфері (0,1Μ буфер "Trisназваного продукту. HCI" (торгова марка), рН 7,3, що містить 0,1Μ LC-MS m/z 383 (М+1), 283 (М-99). NaCI, 20мМ СаСІ2, 0,020мМ ZnCI і 0,05% (вага/об) 3-Метокси-2,7-нафтиридин "Brij 35" (торгова марка) детергент) у присутності До перемішуваного розчину Ν,Ν,Ν'(10 концентрацій) або відсутності інгібіторів. Актитриметилетилендіаміну (1,9мл, 15ммоль) в безвовність визначали вимірюванням флуоресценції дному THF (65мл) під аргоном при -70°С повільно при ех 320нм і еm 405нм. Відсоток інгібування додавали 1,6М n-BuLi в гексані (9,0мл, 14ммоль). розраховували, як вказано нижче: Після перемішування при -70°С протягом 15 хвилин, 6-метокси-нікотинальдегід (1,3г, 9,8ммоль) додавали по краплях. Після завершення додаван 27 89801 28 % інгібування дорівнює [Флуоресценціяплюс інгібітор60 хвилин при кімнатній температурі з синтетичФлуоресценціяфон] розділена на [Флуоресценціяміним субстратом Mca-Pro-Cha-Gly-Nva-His-Ala-DpaNH2 (10 Μ) в тестовому буфері (0,1Μ буфер "Trisнус інгібітор-Флуоресценціяфон]. HCI" (торгова марка), рН 7,5, що містить 0,1Μ ММР8 NaCI, 20мМ СаСІ2, 0,020мМ ZnCI і 0,05% (вага/об) Очищений про-ММР8, придбаний від "Brij 35" (торгова марка) детергент) у присутності Calbiochem. Ензим (при 10 г/мл) активували п(5 концентрацій) або відсутності інгібіторів. Активаміно-феніл-ртуті ацетатом (АРМА) при 1мМ проність визначали вимірюванням флуоресценції при тягом 2,5год. 35°С. Активований ензим може викоех 320нм і еm 405нм. Відсоток інгібування розристовуватися, щоб контролювати інгібітори актираховували, як вказано нижче: вності, як вказано нижче: ММР8 (200нг/мл) інкубували протягом 90 хвилин при 35°С (80% % інгібування дорівнює [Флуоресценціяплюс інгібіторН2О) з синтетичним субстратом Mca-Pro-Cha-GlyФлуоресценціяфон] розділена на [ФлуоресценціяміNva-His-Ala-Dpa-NH2 (12,5 Μ) в тестовому буфері нус інгібітор-Флуоресценціяфон]. (0,1Μ буфер "Tris-HCI" (торгова марка), рН 7,5, що містить 0,1Μ NaCI, 30мМ СаСІ2, 0,040мМ ZnCI і Для протоколу тестування інших матричних 0,05% (вага/об) "Brij 35" (торгова марка) детергенметалопротеїназ, включно ММР9, використовувата) у присутності (10 концентрацій) або відсутності ли експресований і очищений про-ММР, описаний, інгібіторів. Активність визначали вимірюванням наприклад, С. Graham Knight et al., (1992) FEBS Lett., 296(3), 263-266. флуоресценції при ех 320нм і еm 405нм. ВідсоMMP19 ток інгібування розраховували, як вказано нижче: Каталітичний домен людської рекомбінантної ММР19, може бути експресований і очищений, як % інгібування дорівнює [Флуоресценціяплюс інгібіторописано by Parkar A.A. et al, (2000), Protein Флуоресценціяфон] розділена на [ФлуоресценціяміExpression and Purification, 20, 152. Очищений еннус інгібітор-Флуоресценціяфон]. зим може використовуватися, щоб контролювати інгібітори активності вказані нижче: ММР19 (заMMP9 ключна концентрація 40нг/мл) інкубували протягом Каталітичний домен людської рекомбінантної 120 хвилин при 35°С із синтетичним субстратом ММР9 був експресований, а потім очищений цинкMca-Pro-Cha-Gly-Nva-His-Ala-Dpa-NH2 (5 Μ) в тесхелатною колонковою хроматографією, наступною гідроксамат-афінною колонковою хроматографією. товому буфері (0,1Μ буфер "Tris-HCI" (торгова Ензим може використовуватися, щоб контролювамарка), рН 7,5, що містить 0,1Μ NaCI, 20мМ СаСІ 2, ти інгібітори активності, як вказано нижче: ММР9 0,020мМ ZnCI і 0,05% (вага/об) "Brij 35" (торгова (5нг/мл) інкубували протягом 30 хвилин при кімнамарка) детергент) у присутності (5 концентрацій) тній температурі з синтетичним субстратом Mcaабо відсутності інгібіторів. Активність визначали Pro-Cha-Gly-Nva-His-Ala-Dpa-NH2 (5 Μ) в тестововимірюванням флуоресценції при ех 320нм і еm му буфері (0,1Μ буфер "Tris-HCI" (торгова марка), 405нм. Відсоток інгібування розраховували, як рН 7,3, що містить 0,1Μ NaCI, 20мМ СаСІ2, вказано нижче: 0,020мМ ZnCI і 0,05% (вага/об) "Brij 35" (торгова марка) детергент) у присутності (10 концентрацій) % інгібування дорівнює [Флуоресценціяплюс інгібіторабо відсутності інгібіторів. Активність визначали Флуоресценціяфон] розділена на [Флуоресценціямівимірюванням флуоресценції при ех 320нм і еm нус інгібітор-Флуоресценціяфон]. 405нм. Відсоток інгібування розраховували, як Наступна таблиця показує дані вибору сполук вказано нижче: даного винаходу. % інгібування дорівнює [Флуоресценціяплюс інгібіторТаблиця Флуоресценціяфон] розділена на [Флуоресценціямінус інгібітор-Флуоресценціяфон]. hММР12 hMMP9 hMMP14 Сполука ІС50 (нМ) IC50 (нМ) IC50 (нМ) MMP14 Каталітичний домен людської рекомбінантної Приклад 1 10,4 29,3 >10000 ММР12, може бути експресований і очищений, як Приклад 2 1,4 3,5 415 описано by Parkar A.A. et al, (2000), Protein Приклад 5 7 8,3 1990 Expression and Purification, 20, 152. Очищений ензим може використовуватися, щоб контролювати інгібітори активності вказані нижче: ММР14 (заключна концентрація 10нг/мл) інкубували протягом Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel hydantoin derivatives as metalloproteinase inhibitors
Автори англійськоюGabos Balint, Lundkvist Michael, Munck Af Rosenschoeld Magnus, Shamovsky Igor, Zlatoidsky Pavol
Назва патенту російськоюПроизводные гидантоина как ингибиторы металлопротеиназ
Автори російськоюГабос Балинт, Лундквист Микаэль, Мунк Аф Розеншэльд Магнус, Шамовски Игор, Златоидски Павол
МПК / Мітки
МПК: A61K 31/506, A61P 19/02, A61K 31/4725, A61P 11/06, C07D 401/14, A61P 9/10, A61K 31/4375, A61P 35/00, C07D 471/04, C07D 401/12
Мітки: похідні, інгібітори, металопротеїназ, гідантоїну
Код посилання
<a href="https://ua.patents.su/14-89801-pokhidni-gidantonu-yak-ingibitori-metaloprotenaz.html" target="_blank" rel="follow" title="База патентів України">Похідні гідантоїну як інгібітори металопротеїназ</a>
Попередній патент: Ациловані нонадепсипептиди як похідні лізобактину
Наступний патент: Гіперспектральний структурно-польовий спосіб прогнозування покладів нафти і газу
Випадковий патент: Паросилова установка