Похідні гідантоїну, корисні як інгібітори металопротеїназ
Формула / Реферат
1. Сполука формули (І)
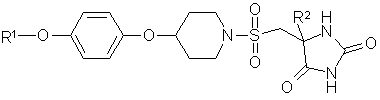 , (І)
, (І)
де
R1 - (2-4С)алкіл, та є заміщеним двома або більше атомами флуору; а
R2 - метил або етил;
або її фармацевтично прийнятна сіль.
2. Сполука формули (І) за п. 1, де R1 - етил, пропіл або бутил, та є заміщеним двома або більше атомами флуору.
3. Сполука формули (І) за п. 1 або за п. 2, де R1 - етил, пропіл або бутил, та є заміщеним 2-6 атомами флуору.
4. Сполука формули (І) за будь-яким з пп. 1-3, де R1 - CF3CH2-, CF2HCF2-, CF3CF2-, CF3CH2CH2-, CF2HCF2CH2- або CF3CF2CH2-.
5. Сполука формули (І) за будь-яким з пп. 1-4, вибрана із групи:
(5S)-5-метил-5-[({4-[4-(2,2,2-трифлуоретокси)фенокси]піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон;
(5S)-5-етил-5-[({4-[4-(2,2,2-трифлуоретокси)фенокси]піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон;
5S-метил-5-[({4-[4-(1,1,2,2-тетрафлуоретокси)фенокси]піперидин-іл}сульфоніл)метил]імідазолідин-2,4-діон;
5S-етил-5-[({4-[4-(1,1,2,2-тетрафлуоретокси)фенокси]піперидин-іл}сульфоніл)метил]імідазолідин-2,4-діон;
(5S)-5-метил-5-[({4-[4-(пентафлуоретокси)фенокси]піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон;
(5S)-5-етил-5-[({4-[4-(пентафлуоретокси)фенокси]піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон;
5S-метил-5-[({4-[3,3,3-трифлуорпропокси)фенокси]піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон;
5S-етил-5-[({4-[3,3,3-трифлуорпропокси)фенокси]піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон;
(5S)-5-метил-5-[({4-[4-(2,2,3,3-тетрафлуорпропокси)фенокси]-піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон;
(5S)-5-етил-5-[({4-[4-(2,2,3,3-тетрафлуорпропокси)фенокси]-піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон;
(5S)-5-метил-5-[({4-[4-(2,2,3,3,3-пентафлуорпропокси)фенокси]-піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон; та
(5S)-5-етил-5-[({4-[4-(2,2,3,3,3-пентафлуорпропокси)фенокси]-піперидин-1-іл}сульфоніл)метил]імідазолідин-2,4-діон.
6. Спосіб отримання сполуки формули (І) за будь-яким із пп. 1-5 або її фармацевтично прийнятної солі, в якому здійснюють реакцію феноксипіперидину формули (II) із сульфонілхлоридом формули (III)
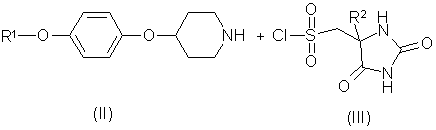 ,
,
де R1 та R2 визначено в п. 1, а будь-яка функціональна група є захищеною, якщо потрібно, та
(і) видалення будь-якої захисної групи; і
(іі) як варіант, утворення фармацевтично прийнятної солі.
7. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль за будь-яким із пп. 1-5 у поєднанні з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
8. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким із пп. 1-5 для застосування у терапії.
9. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким із пп. 1-5 у виробництві медикаменту для застосування в лікуванні хворобливого стану, опосередкованого одним або більше ферментами металопротеїназами.
10. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким із пп. 1-5 у виробництві медикаменту для застосування у лікуванні хворобливого стану, опосередкованого колагеназою 3.
11. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким із пп. 1-5 у виробництві медикаменту для застосування у лікуванні остеоартриту.
12. Спосіб лікування опосередкованого металопротеїназою хворобливого стану, в якому вводять пацієнту терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким із пп. 1-5.
13. Спосіб лікування ревматоїдного артриту або остеоартриту, в якому вводять пацієнту терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі за будь-яким із пп. 1-5.
Текст
1. Сполука формули (І) C2 2 (19) 1 3 89067 4 7. Фармацевтична композиція, яка містить сполуку лікуванні хворобливого стану, опосередкованого формули (І) або її фармацевтично прийнятну сіль колагеназою 3. за будь-яким із пп. 1-5 у поєднанні з фармацевти11. Застосування сполуки формули (І) або її фарчно прийнятним ад'ювантом, розріджувачем або мацевтично прийнятної солі за будь-яким із пп. 1-5 носієм. у виробництві медикаменту для застосування у 8. Сполука формули (І) або її фармацевтично прилікуванні остеоартриту. йнятна сіль за будь-яким із пп. 1-5 для застосу12. Спосіб лікування опосередкованого металопвання у терапії. ротеїназою хворобливого стану, в якому вводять 9. Застосування сполуки формули (І) або її фарпацієнту терапевтично ефективну кількість сполумацевтично прийнятної солі за будь-яким із пп. 1-5 ки формули (І) або її фармацевтично прийнятної у виробництві медикаменту для застосування в солі за будь-яким із пп. 1-5. лікуванні хворобливого стану, опосередкованого 13. Спосіб лікування ревматоїдного артриту або одним або більше ферментами металопротеїнаостеоартриту, в якому вводять пацієнту терапевзами. тично ефективну кількість сполуки формули (І) або 10. Застосування сполуки формули (І) або її фарїї фармацевтично прийнятної солі за будь-яким із мацевтично прийнятної солі за будь-яким із пп. 1-5 пп. 1-5. у виробництві медикаменту для застосування у Заявлений винахід стосується деяких похідних гідантоїну, корисних в інгібуванні металопротеїназ, способів їх отримання, фармацевтичних композицій, що їх містять, та їх застосування у терапії. Сполуки цього винаходу є інгібіторами одного або більше ферментів металопротеїназ. Металопротеїнази є надродиною протеїназ (ферментів), кількість відомостей про які разюче збільшилась в останні роки. Спираючись на структурні та функціональні міркування, ці ферменти класифікували на родини та надродини, як описано Ν. Μ Hooper (1994) FEBS Letters 354:1-6. Приклади металопротеїназ залучають родину матриксних металопротеїназ (ММР), як-то колагенази (ММР1, ММР8, ММР13, ММР18), желатинази (ММР2, ММР9), стромелізини (ММР3, ММР10, ММР11), матрилізини (ММР7, ММР26), металоеластаза (ММР12), енамелізин (ММР19), типів мембран МТ-ММР (ММР14, ММР15, ММР16, ММР17, ММР24, ММР25) та інші (ММР20, ММР21, ММР22, MMP23a/b, MMP28); родину ADAM (дезінтегрин, металопротеїназа, також відомі як репролізин, адамалізин або MDC), яке тепер охоплює 32 відомі ADAM з активністю секретази та шедази, як-то TNF-перетворювальний фермент (ADAM 17), та 18 відомих ADAMTS (дезінтегрин тромбоспондин металопротеїнази), що охоплюють агреканази (ADAMTS4, ADAMTS5); родину астацину, яке залучає ферменти як-то проколаген-оброблювальна протеїназа (РСР); та інші металопротеїнази, як-то родину ендотелін-перетворювальних ферментів та родину ангіотензин-перетворювальних ферментів. Металопротеїнази вважають важливими у великому надлишку фізіологічних процесів хвороби, що залучає перетворення тканин, як-то ембріональний розвиток, остеогенез та маточне перетворення при менструації. Це базовано на здатності металопротеїназ розщеплювати широкий діапазон матриксних субстратів, як-то колаген, протеоглікан та фібронектин. Металопротеїнази також вважають важливими в процесінгу або секреції біологічно важливих медіаторів клітин, як-то фактор некрозу пухлин (TNF); та процесингу посттрансліційного протеолізу або втраті біологічно важливих білків мембран, як-то lgE-рецептор низької спорідненості CD23 (для більш повного переліку дивись N. М. Hooper etal., (1997) Biochem J. 321:265-279). Металопротеїнази асоційовано з багатьма станами хвороб. Інгібування активності одної або більше металопротеїназ може бути корисним у станах хвороб, наприклад з групи: різні запальні та алергічні хвороби, як-то запалення суглобів (головним чином ревматоїдний артрит, остеоартрит та подагра), запалення шлунково-кишкового тракту (головним чином, запальна хвороба кишечнику, виразковий коліт та гастрит), запалення шкіри (головним чином, псоріаз, екзема, дерматит); метастаз або інвазія пухлини; в асоційованих хворобах, де деградація випереджає синтез позаклітинного матриксу, як-то остеоартрит; хвороба резорбції кісток (як-то остеопороз та хвороба Педжета); хвороби, асоційовані з аберантним ангіогенезом; посилене перетворення колагену, асоційоване з діабетом, періодонтальна хвороба (як-то періодонтит), укривання виразками рогівки, укривання виразками шкіри, післяопераційні стани (якто анастомоз товстої кишки) та загоювання ран на шкірі; демієлінізуюча хвороби центральної та периферійної нервових систем (як-то розсіяний склероз); хвороба Альцгеймера; перетворення позаклітинного матриксу, спостережене в серцевосудинних хворобах, як-то рестеноз та атеросклероз; та хронічні обструктивні хвороби легенів, COPD. Відомі численні інгібітори металопротеїназ; різні класи сполук можуть мати різні ступені ефективності та селективності для інгібування різних металопротеїназ. Заявники відкрили новий клас сполук, які є інгібіторами металопротеїназ та представляють особливий інтерес в інгібуванні колагенази 3 (також відомої як ММР-13). Сполуки цього винаходу мають переважну ефективність та/або фармакокінетичні властивості. Колагеназу 3 (ММР13) спочатку клонували з бібліотеки кДНК, похідної з пухлини грудної залози [J. М. P. Freije et al. (1994) Journal of Biological Chemistry 269(24): 16766-16773]. PCR-PHK-аналіз РНК широкого діапазону тканин показав, що експресія колагенази 3 (ММР13) обмежена карциномами молочної залози, бо її не знаходили в фіброаденомах молочної залози, нормальній грудній 5 89067 6 залозі або грудній залозі у стані покою, плаценті, Заявниками виявлено, що арилоксипіперидинпечінці, яєчнику, матці, простаті, привушна залоза сульфонілметил-заміщені сполуки гідантоїну, де або в лінії ракових клітин молочної залози (T47-D, замісником є (2-4С) алкоксил, яку саму заміщено MCF-7 та ZR75-1). У подальшому спостережені двома або більше атомами флуору, є особливо колагеназу З (ММР13) виявили в перетворених сильнодіючими інгібіторами металопротеїнази, епідермальних кератиноцитах [N. Johansson et al., головним чином, колагенази 3 (ММР13), та мають (1997) Cell Growth Differ. 8(2):243-250]. сквамозних бажані профілі активності. клітинних карциномах [Ν. Johansson et al., (1997) Згідно з заявленим винаходом запропоновано Am. J. Pathol. 151 (2)A99-508] та епідермальних сполуку формули (І) пухлинах [К. Airola et al., (1997) J. Invest. Dermatol. 709(2,1:225-231]. Ці результати наводять на думку, що колагеназа 3 (ММР13) секретується перетвореними епітеліальними клітинами та може залучатися у деградацію позаклітинного матриксу та взаємодію клітина-матрикс, асоційовану з де метастазом, головним чином, спостережену в ін1 R - (2-4С)алкіл, та є заміщеним двома або бівазивних ураженнях при раку молочної залози та в льше атомами флуору; злоякісному епітеліальному рості при карциноге2 R - метил або етил; незі шкіри. або її фармацевтично прийнятну сіль. В останніх опублікованих даних мають на уваВ цьому описі, термін (2-4С)алкіл охоплює алзі, що колагеназа З (ММР13) відіграє роль в обміні кіл з лінійним та розгалуженим ланцюгом, як-то речовин інших сполучних тканин. Наприклад, спеетил, пропіл, ізопропіл, бутил, ізобутил та третцифічність сумісного з колагеназою 3 (ММР13) бутил та подібне. Посилання на окремі алкільні субстрату та переважність для деградації колагену групи, як-то етил, пропіл та бутил, стосуються контипу II [P. G Mitchell et al., (1996) J. Clin. Invest. кретної версії для лінійного ланцюгу. 97(3):761-768; V. Knauper et al., (1996) Biochemical Придатна фармацевтично прийнятна сіль споJournal 271:1544-1550], дозволили висловити гіполуки формули (І), наприклад, кислотно-адитивна тезу, що колагеназа 3 (ММР13) відіграє роль просіль сполуки формули І, яка є достатньо основною, тягом первинного окостеніння та скелетного перенаприклад, кислотно-адитивна сіль неорганічної творення [М. Stahle-Backdahl et al., (1997) Lab. або органічної кислоти, як-то хлоридна, бромідна, Invest. 76(5):717-728; N Johansson et al., (1997) сульфатна, фосфатна, трифлуороцтова, лимонна, Dev. Dyn. 208(3):387-397], у деструктивних хворомалеїнова, винна, фумарова, геміфумарова, бурбах суглобів, як-то ревматоїдний артрит та остеоштинова, гемібурштинова, мигдалева, метансульартрит [D. Wernicke et al., (1996) J. Rheumatol. фонова, диметансульфонова, етан-1,223:590-595; P. G. Mitchell et al., (1996) J. Clin. сульфонова, бензолсульфонова, саліцилова або Invest. 97(3):761-768; O. Lindy et al., (1997) Arthritis 4-толуолсульфонова кислота, або наприклад, сіль Rheum 40(8): 1391-13991; та протягом асептичного сполуки формули (І), яка є достатньо кислотною, послаблення при ендопротезуванні тазостегнових наприклад, сіль лужного або лужноземельного суглобів [S. Imai et al., (1998) J. Bone Joint Surg. Br. металу, як-то сіль кальцію або натрію, або сіль 80(4):701-710]. Колагеназу 3 (ММР13) також залуамонію, або сіль з органічною основою як-то метичено в хронічний періодонтит дорослих, який лоламін, диметиламін, триметиламін, піперидин, калізовано на епітелії хронічно запаленої слизової морфолін або трис-(2-гідроксіетил)амін. оболонки тканин ясен людини [V. J. Uitto et al., Там, де сполуки згідно з винаходом містять (1998) Am. J. Pathol 152(6): 1489-1499] та в перетодин або більше асиметрично заміщених атомів воренні колагенового матриксу при хронічних покарбону, винахід охоплює усі стереоізомери, що раненнях [М. Vaalamo et al., (1997) J. Invest. охоплюють енантіомери, діастереомери та їх суDermatol. 109(1 ):96-101]. міші, які охоплюють рацемічні суміші. Також охопСполуки, які інгібують дію металопротеїназ, лено таутомери та їх суміші. особливо колагенази 3 (ММР 13) та ММР12, опи1 2 Подальші значення R та R - наступні. Такі сано в WO 00/12478, WO 00/75108, WO 01/62742 значення можна застосовувати там, де це доречно та WO 02/074767. Охоплені цими повідомленнями з будь-яким з визначень, пунктів формули винахоінгібітори представляють арилоксипіперидинсульду або втілень, визначених вище або нижче. фонілметил-заміщені сполуки гідантоїну, в яких 1 R -(2-4С)алкіл, та є заміщеним двома або бікільце арилу заміщено рядом можливих заміснильше атомами флуору ків, що охоплюють, між іншим, трифлурметоксил. R1 -(2-4С)алкіл, та є заміщеним 2-6 атомами Не розкрито, що замісник трифлурметоксил у тафлуору. ких сполуках може заміщуватися. 1 R -(2-4С)алкіл, та є заміщеним 2-5 атомами Алкокси- або арилоксипіперидинсульфонілмефлуору. тил-заміщені сполуки гідантоїну як інгібітори мат1 R - етил, пропіл або бутил, та є заміщеним риксних металопротеїназ охоплено загальним роздвома або більше атомами флуору. криттям WO 02/074767. Серед перерахованих R1 - етил або пропіл, та є заміщеним двома численних можливих замісників алкоксилу є галоабо більше атомами флуору. ген. Одною з розкритих сполук є (5S)-5-метил-5R1 - етил, пропіл або бутил, та є заміщеним 2 [({4-[4-(трифлурметоксил)фенокси]піперидин-16 атомами флуору. іл}сульфоніл)метил]імідазолідин-2,4-діон (сполука 1 R - етил, пропіл або бутил, та є заміщеним 2 X для порівняння). 7 атомами флуору. 7 89067 8 1 R - етил або пропіл, та є заміщеним 2-6 атоAdvanced Organic Chemistry: 3 rd Edition: author J мами флуору. March, p104-107). Придатна процедура залучає 1 R - етил або пропіл, та є заміщеним 2-5 атоутворення діастереомерних похідних реакцією мами флуору. рацемічної речовини з хіральною допоміжною ре1 R CF3CH2-, CF2HCF2-, CF3CF2-, човиною, а потім - розділення діастереомерів, наCF3CH2CH2-, CF2HCF2CH2- або CF3CF2CH2-. приклад, хроматографією, і тоді - відщеплення R2 - метил або етил. допоміжної речовини. 2 R - метил. Без обмеження вихідними визначеннями вва2 R - етил. жають, що активний енантіомер має SКонкретні нові сполуки винаходу залучають, стереохімію. Це базовано на порівнянні зі споріднаприклад, сполуку формули (І) або її фармацевненими сполуками, для яких підтверджено абсотично прийнятні солі, де: лютну конфігурацію. Таким чином, у формулі, на1 (a) R - (2-4С)алкіл, та є заміщеним двома або даній в прикладах нижче, показано S-структуру. 2 більше атомами флуору; та R -метил. Однак, слід знати, що рацемат будь-якої сполуки 1 (b) R - (2-4С)алкіл, та є заміщеним 2-6 атомазгідно з винаходом можна розділяти на окремі 2 ми флуору; a R - метил або етил. енантіомери описаним вище способом, та більш 1 (c) R - етил, пропіл або бутил, та є заміщеним активний енантіомер можна ідентифікувати придадвома або більше атомами флуору; та R2 - метил тним аналізом без потреби визначати абсолютні або етил. конфігурації. 1 (d) R - етил, пропіл або бутил, та є заміщеним Сполуки формули І або їх фармацевтично 2-6 атомами флуору; та R2 - метил або етил. прийнятні солі, можна отримувати будь-яким відо(e) R1 - етил або пропіл, та є заміщеним 2-5 мим як придатний для отримання хімічно спорід2 атомами флуору; та R - метил або етил. нених сполук способом. Придатні способи ілюст(f) R1 - CF3CH2-, CF2HCF2-, CF3CF2-, ровано, наприклад, в WO 02/074767. У разі CF3CH2CH2-, CF2HCF2CH2- або CF3CF2CH2; та застосування для отримання нової сполуки форR2 - метил або етил. мули І такі способи запропоновано як подальшу Конкретними переважними сполуками винахоознаку винаходу та ілюстровано наступними покаду є, наприклад: зовими варіантами способу, де якщо не встанов(5S)-5-метил-5-[({4-[4-(2,2,2лено інакше, R1 та R2 мають будь-які визначені трифлуоретокси)фенокси]піперидин-1вище значення. Потрібні вихідні матеріали можна іл}сульфоніл)метил]імідазолідин-2,4-діон; отримувати звичайними способами органічної хі(5S)-5-етил-5-[({4-[4-(2,2,2мії. Отримання таких вихідних матеріалів описано трифлуоретокси)фенокси]піперидин-1у зв'язку з наступними варіантами способу та у іл}сульфоніл)метил]імідазолідин-2,4-діон; супроводжуючих прикладах. Альтернативно, пот5S-метил-5-[({4-[4-(1,1,2,2рібні вихідні матеріали є доступними згідно з натетратрифлуоретокси)фенокси]піперидинведеними тут процедурами, які є у межах звичайіл}сульфоніл)метил]імідазолідин-2,4-діон; ної кваліфікації хіміка-органіка. 5S-етил-5-[({4-[4-(1,1,2,2Сполуку формули І або її фармацевтично притетратрифлуоретокси)фенокси]піперидинйнятну сіль можна отримувати реакцією феноксиіл}сульфоніл)метил]імідазолідин-2,4-діон; піперидину формули II з сульфонілхлоридом фор(5S)-5-метил-5-[({4-[4мули III (пентатрифлуоретокси)фенокси]піперидин-1іл}сульфоніл)метил]імідазолідин-2,4-діон; (5S)-5-етил-5-[({4-[4(пентатрифлуоретокси)фенокси]піперидин-1іл}сульфоніл)метил]імідазолідин-2,4-діон; де R1 та R2 визначено вище та, де будь-яка 5S-метил-5-[({4-[3,3,3функціональна група є захищеною, якщо потрібно, трифлуорпропокси)фенокси]піперидин-1та: іл}сульфоніл)метил]імідазолідин-2,4-діон; (і) видаленням будь-яких захисних груп; та 5S-етил-5-[({4-[3,3,3(іі) як варіант, утворенням фармацевтично трифлуорпропокси)фенокси]піперидин-1прийнятної солі. іл}сульфоніл)метил]імідазолідин-2,4-діон; Переважно, реакцію проводять в придатному (5S)-5-метил-5-[({4-[4-(2,2,3,3розчиннику, як варіант, у присутності основи протетрафлуорпропокси)фенокси]-піперидин-1тягом 1 - 24 годин при температурі навколишнього іл}сульфоніл)метил]імідазолідин-2,4-діон; середовища до температури дефлегмації. Пере(5S)-5-етил-5-[({4-[4-(2,2,3,3важно, застосовували розчинники, як-то піридин, тетрафлуорпропокси)фенокси]-піперидин-1диметилформамід, тетрагідрофуран, ацетонітрил іл}сульфоніл)метил]імідазолідин-2,4-діон; або дихлорметан з основами подібними до трие(5S)-5-метил-5-[({4-[4-(2,2,3,3,3тиламіну, N-метилморфоліну, піридину або карбопентафлуорпропокси)фенокси]-піперидин-1натів лужного металу при температурі навколишіл}сульфоніл)метил]імідазолідин-2,4-дюн; та нього середовища протягом часу реакції 2-18 (5S)-5-етил-5-[({4-[4-(2,2,3,3,3годин, або до досягнення кінця реакції, визначенопентафлуорпропокси)фенокси]-піперидин-1го хроматографічними або спектроскопічними споіл}сульфоніл)метил]імідазолідин-2,4-діон. собами. Реакції сульфонілхлоридів формули III з Рацемати можна розділяти на окремі енанті різними первинними та вторинними амінами попеомери, застосовуючи відомі способи (порівн. 9 89067 10 редньо описано в літературі, та зміни умов слід Сполуки формули (І) та їх фармацевтично розуміти спеціалістам у рівні техніки. прийнятні солі можна застосовувати як такі, але, Синтез сульфонілхлоридів формули III описазвичайно, їх застосовують у вигляді фармацевтично в літературі та їх можна отримати, наприклад, із ної композиції у поєднанні з фармацевтично прицистеїну або гомоцистеїну йнятним ад'ювантом, розріджувачем або носієм. (Mosher,J.:J.Org.Chem,23,1257 (1958). СульфонілТому згідно з заявленим винаходом також захлориди формули III також зручно отримувати згіпропоновано фармацевтичну композицію, яка оходно з Griffith, О.: J. Biol. Chem., 1983,258,3, 1591. плює сполуку формули (І) або її фармацевтично Сполуки формули (II) можна отримувати згідно прийнятну сіль у поєднанні з фармацевтично приз Bioorg Med Chem 2003, 11 (3), 367 та Tet Lett йнятним ад'ювантом, розріджувачем або носієм. 2002, 43 (12), 2157, застосовуючи придатний флуФармацевтичні композиції винаходу можна заоралкоксифенол та трет-бутил 4-гідрокси-1стосовувати звичайним способом для хвороблипіперидин карбоксилат. вих станів, які бажано лікувати, наприклад, пероСлід розуміти, що при отриманні сполук форрально, місцево, парентерально, мули (І) на різних етапах можна залучати додавнутрішньосуглобово, букально, назально, вагінавання та видалення одної або більше захисних льно, ректально або інгаляцією. З цією метою спогруп. Захист та зняття захисту функціональних луки цього винаходу можна компонувати способагруп описано в ’’Protective Groups in Organic ми, відомими у рівні техніки, наприклад, у вигляді Chemistry’’, edited by J.W.F. McOmie, Plenum Press таблеток, капсул, водних або олійних розчинів, (1973) та ’’Protective Groups in Organic Synthesis’’, суспензій, емульсій, кремів, мазей, гелів, назаль2nd edition, T.W. Greene та P.G.M. Wuts, Wileyних спреїв, супозиторіїв, мілко подрібнених порошlnterscience (1991). ків або аерозолів для інгаляції, а для парентераСполуки винаходу є інгібіторами металопротельного застосування (охоплюючи їнази, зокрема, вони є інгібіторами колагенази 3 внутрішньовенне, внутрішньом'язове або інфузі(ММР13) і тому вони є показаними в лікуванні хвоєю) стерильні водні або олійні розчини, суспензії роб або станів, опосередкованих ферментами або стерильні емульсії. металопротеїназами, що охоплюють артрит (як-то На додаток до сполук заявленого винаходу остеоартрит), рак, атеросклероз та хронічні обфармацевтична композиція винаходу також може структивні легеневі хвороби (COPD), як розглянуто містити або бути співзастосованою (одночасно або вище. Зокрема, сполуки винаходу є показаними в послідовно) з одним або більше фармакологічнилікуванні хвороб або станів, опосередкованих коми засобами у лікуванні одної або більше вищелагеназою 3 (ММР13). Особливою перевагою інгівказаних хвороб. Звичайно формам одиничного біторів колагенази 3 згідно з винаходом є те, що дозування слід містити приблизно 1 мг - 500 мг вони виявляють поліпшену селективність відносно сполуки згідно з винаходом. інших металопротеїназ. Активність та селективність сполук згідно з виТому згідно з подальшим підходом заявленого находом можна визначати, застосовуючи придатвинаходу запропоновано сполуку формули (І) або ний тест інгібування ферменту, який описано в WO її фармацевтично прийнятну сіль, які визначено 00/12478, WO 00/75108 та WO 01/62742. Активвище, для застосування у лікуванні людини або ність інгібітору колагенази 3 (ММР13) можна оцітварини. нювати, наприклад, застосовуючи процедуру, виЗгідно з винаходом також запропоновано закладену нижче:стосування сполуки формули (І) або її фармацевРекомбінантну proММР13 людини (колагеназа тично прийнятної солі, які визначено вище, у ви3) можна експресувати та очищати, як описано в робництві медикаменту для застосування у Knauper et al. [V. Knauper et al., (1996) Biochemical терапії. Journal 271:1544-1550 (1996)]. Очищений фермент Слід розуміти, що "лікування" також охоплює можна застосовувати для контролю активності "профілактику", якщо не вказано інакше. Терміни інгібіторів наступним чином: очищену рrоММР13 "терапевтичний" та "терапевтично" слід розуміти активували 20 годин при 21°С, застосовуючи 1 мМ відповідно. амінофенілмеркурієву кислоту (АРМА); активоваЗгідно з ще одним підходом заявленого винаний ММР13 (11,25 нг на аналіз) інкубували протяходу запропоновано спосіб лікування опосередкогом 4-5 годин при 35°С в аналітичному буфері (0,1 ваних металопротеїназою хворобливих станів, Μ трис-НСІ, рН 7,5, що містить 0,1 Μ NaCI, 20 мМ який полягає у призначенні теплокровній тварині СаСІ2, 0,02 ммоль ZnCI та 0,05% (маса в об'ємі) терапевтично ефективної кількості сполуки форBrij 35, застосовуючи синтетичний субстрат 7мули (І) або її фармацевтично прийнятної солі. метоксикумарин-4-іл)ацетил.Рrо.Lеu.СІу.Lеu.N-3Слід розуміти, що застосоване дозування змі(2,4-динітрофеніл)-L-2,3нюватиметься залежно від застосованої сполуки, діамінопропіоніл.АІа.Аrg.NН2 у присутності або способу застосування, бажаного лікування та вкавідсутності інгібіторів. Активність визначали вимізаного розладу. Звичайно добова доза 0,1 - 75 рюванням флуоресценції при збудження 328 нм та мг/кг маси тіла (та переважно - 0,1 - 30 мг/кг маси емісії 393 нм. Вимірюванням активності у діапазоні тіла) є загальновизнаною. Цю добову дозу можна концентрацій генеровано криву зв'язування, з якої надавати в розподілених дозах, як потрібно, точна визначали ІК50, це є інгібувальною концентрацією, кількість отриманої сполуки та шлях застосування при якій активність ферменту зменшено на 50%. залежить від маси, віку та статі лікованого пацієнСлід розуміти, що фармакологічні властивості та та конкретної хвороби, яку лікують, згідно з сполук винаходу змінюються залежно від їх струкпринципами, відомими у рівні техніки. тури, але взагалі, сполуки винаходу демонструють 11 89067 12 активність інгібітору колагенази 3 таку, як визнадіацерхеїн, композиції гіалуронової кислоти, як-то чали вищенаведеним аналізом при концентраціях гіалан, румалон, артепарон, хондроїтин сульфат ІК50 у діапазоні 0,01 - 20 нМ. Наступна таблиця та солі глюкозаміну, як-то антрил. показує дані ІК50 для вибраних характерних споСполуку формули І можна застосовувати в лілук згідно з винаходом а також для сполуки X для куванні астми в композиції з антиастматичними порівняння, розкритої у WO 02/074767, що тестозасобами, як-то стероїди, бронходилататори та вано в вищенаведеному аналізі. антагоністи лейкотриєну. Сполуки прикладу ІК50 (нМ) Зокрема, для лікування запальних хвороб, якСполука X для порівняння 59 то ревматоїдний артрит, остеоартрит, псоріаз, 1 8,5 запальна хвороба кишечнику, хронічна обструкти2 8,4 вна легенева хвороба, астма та алергічний риніт, 3 5,0 сполуку заявленого винаходу можна комбінувати з 4 4,9 засобами, як-то інгібітори TNF-α, як-то анти-ТNF5 9,8 моноклональн! антитіла (як-то ремікад, CDP-870 6 13 та D.sub2.E.sub7.) та молекули імуноглобуліну 7 5,4 TNF-рецептору (як-то енбрел.рег), неселективні -1 8 5,5 інгібітори СОХ / СОХ-2 (як-то піроксикам, дикло9 1,1 фенак, пропіонові кислоти, як-то напроксен, флу10 0,7 біпрфен, фенопрофен, кетопрфен та ібупрофен, 11 2,0 фенамати, як-то мефенамінова кислота, індоме12 1,9 тацин, суліндак, апазон, піразолон, як-то фенілбуСполуку формули І можна застосовувати у потазон, саліцилати як-то аспірин), інгібітори СОХ-2 єднанні з іншими ліками та застосовувати в ліку(як-то мелоксикам, целекоксиб, рофекоксиб, валванні хворобливих станів, яким сприяє інгібування декоксиб та еторикоксиб) низькодозовий метотреметалопротеїназ, зокрема, колагенази 3 (ММР13). ксат, лефуномід; циклезонід; гідроксихлорохін, dНаприклад, сполуку формули І можна застосовупеніциламін, ауронофін або парентеральне або вати в композиції з ліками та терапіями, що застопероральне золото. совують у лікуванні хвороб з групи: ревматоїдний Крім того заявлений винахід подалі стосується артрит, астма, рак, запальна хвороба кишечнику, композиції сполуки формули І разом з інгібітором розсіяний склероз, СНІД, септичний шок, застійна біосинтезу лейкотриєну, інгібітором 5серцева недостатність, ішемічна хвороба серця, ліпоксигенази (5-LO) або антагоністом активації псоріаз та інші хворобливі стани, згадані раніше в білку 5-ліпоксигенази (FLAP), як-то зилейтон; АВТцьому описі. 761; фенлейтон; тепоксалін; Abbott-79175; AbbottНаприклад, завдяки її здатності інгібувати ме85761; N-(5-заміщені)-тіофен-2-алкілсульфонаміди талопротеїнази, сполука формули І є корисною в 2,6-ди-трет-бутилфенол гідразони; метокситетралікуванні деяких запальних та незапальних хвогідропірани, як-то зенека ZD-2138; сполука SBроб, які тепер лікують нестероїними протизапаль210661; піридиніл-заміщені сполуки 2ними ліками - інгібіторами циклооксигенази цианонафталіну, як-то L-739,010; сполуки 2(NSAID), як-то індометацин, кеторолак, ацетилсацианохіноліну, як-то L-746,530; сполуки індолу та ліцилова кислота, ібупрофен, суліндак, толметин хіноліну, як-то МК-591, МК-886, та BAY x 1005. та піроксикам. Співзастосування сполуки формули Крім того заявлений винахід подалі стосується І заявленого винаходу з NSAID дає у результаті композиції сполуки формули І разом з антагонісзниження кількості останнього згаданого засобу, том рецептору лейкотриєнів LTB.sub4., LTC.sub4., потрібного для створення терапевтичної дії. Таким LTD.sub4, та LTE.sub4. вибраних з групи фенотіачином, зменшується вірогідність шкідливої побічзин-3-онів, як-то L-651,392; амідиносполукою, як-то ної дії від NSAID, як-то шлунково-кишкової дії. ОтCGS-25019c; бензоксаламінами, як-то онтазоласт; же, згідно з подальшою ознакою винаходу запробензолкарбоксімідамідами, як-то BIIL 284/260; та поновано фармацевтичну композицію, як містить сполуками, як-то зафірлукаст, аблукаст, монтелусполуку формули І або її фармацевтично прийняткаст, пранлукаст, верлукаст (МК-679), RG-12525, ну сіль, у поєднанні або суміші з нестероїдним Ro-245913, іралукаст (CGP 45715А), та BAY x протизапальним засобом - інгібітором циклоокси7195. генази, та фармацевтично прийнятним розріджуКрім того заявлений винахід подалі стосується вачем або носієм. композиції сполуки формули І разом з інгібітором Сполуку формули І також можна застосовуваPDE4, що охоплює інгібітори ізоформи PDE4D. ти з протизапальними засобами, як-то інгібітор Крім того заявлений винахід подалі стосується ферменту 5-ліпоксигенази. композиції сполуки формули І разом з антагонісСполуку формули І також можна застосовуватами антигістамінного рецептору H.sub1., як-то ти в лікуванні станів, як-то ревматоїдний артрит, в цетиризин, лоратадин, деслоратадин, фексофекомпозиції з протиартритними засобами, як-то надин, астемізол, азеластин та хлорфенірамін. золото, метотрексат, стероїди та пеніцилінамін, та Крім того заявлений винахід подалі стосується в станах, як-то остеоартрит, в композиції зі стероїкомпозиції сполуки формули І разом з гастрозахидами. сним антагоністом рецептору H.sub2.. Сполуку формули І також можна застосовуваКрім того заявлений винахід подалі стосується ти при деградативних хворобах, наприклад, остекомпозиції сполуки формули І разом з судинооартриті, з хондрозахисними, протидеградативнизвужуючим адреноміметичним засобом .sub1. ми та/або репаративними засобами, як-то та .sub2.-адреноміметиком, як-то пропілгексед 13 89067 14 рин, фенілеприн, фенілпропаноламін, псевдоефеінгібітори IMPDH; (ν) інгібітори злипання молекул, дрин, нафазолін гідрохлорид, оксиметазолін гідрощо охоплюють антагоністи VLA-4; (vi) інгібітори хлорид, тетрагідрозолін гідрохлорид, ксилометакатепсинів, наприклад, катепсину В, катепсину К, золін гідрохлорид, та етилнорепінефрин катепсину L; (vii) MAP інгібітори кінази; (viii) інгібігідрохлорид. тори глюкоза-6 фосфатдегідрогенази; (іх) антагоКрім того заявлений винахід подалі стосується ністи рецептору кінін-B.sub1. та -B.sub2.; (x) засоби композиції сполуки формули І разом з антихолінепроти подагри, наприклад, колхіцин; (хі) інгібітори ргічними засобами, як-то іпратропіум бромід; тіотксантиноксидази, наприклад, алопуринол; (хіі) уриропіум бромід; окситропіум бромід; пірензепін; та козуричні засоби, наприклад, пробенецид, сульфітелензепін. нпіразон та бензбромарон; (хііі) стимулятори секКрім того заявлений винахід подалі стосується реції гормону росту; (xiv) модулятор перетворення композиції сполуки формули І разом з .sub1. фактору росту (TGF ); (xv) модулятори тромбоцитпохідного фактору росту (PDGF); (xvi) модулятори .sub4.-адреноміметиками, як-то метапротеренол, фактору росту фібробластів, наприклад, основного ізопротеренол, ізопреналін, албутерол, салбутафактору росту фібробластів (bFGF); (xvii) модулямол, формотерол, салметерол, тербуталін, орциптори фактору стимулювання колоній макрофагівреналін, бітолтерол мезилат, та пірбутерол; або гранулоцитів (GM-CSF); (xviii) катепсиновий крем; метилксантаніни, що охоплюють теофілін та амі(хіх) антагоністи рецептору тахікініну NK.sub1. та нофілін; натрій хромоглікат; або антагоніст мускаNK.sub3., вибрані з групи: NKP-608C; SB-233412 ринового рецептору (М1, М2, та М3). (талнетант); та D-4418; (хх) інгібітори еластази, Крім того заявлений винахід подалі стосується вибрані з групи: UT-77 та ZD-0892; (ххі) інгібітори композиції сполуки формули І разом з інсулінопоTNF -перетворювального ферменту (ТАСЕ); (ххіі) дібним міметиком фактору росту типу І (IGF-1). Крім того заявлений винахід подалі стосується індуковані інгібітори нітроген оксид-синтази (iNOS) композиції сполуки формули І разом з дихальним або (ххііі) хемоатрактантна рецептор-гомологічна глюкокортикоїдом зі зниженими системними побічмолекула, експресована на клітинах ТН2, (антагоними діями, як-то преднізон, преднізолон, фунізоністи CRTH2). лід, триамцинолон ацетонід, беклометазон дипроСполуку формули І також можна застосовувапіонат, будезонід, флутіказон пропіонат, та ти в композиції з засобами проти остеопорозу, якмометазон фуроат. то ролоксифен, дролоксифен, лазофоксифен або Крім того заявлений винахід подалі стосується фосомакс та імунодепресантними засобами, як-то композиції сполуки формули І разом з іншими моFK-506, рапаміцин, циклоспорин, азатіоприн та дуляторами функцій рецептору хемокіну, як-то метотрексат. CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, Сполуку формули І також можна застосовуваCCR5, CCR6, CCR7, CCR8, CCR9, CCR10 та ти в композиції з існуючими терапевтичними засоCCR11 (для родини С-С); CXCR1, CXCR3, CXCR4 бами для лікування остеоартриту. Придатні засота CXCR5 (для родини С-Х-С) та CX3CR1 для роби, застосовувані в композиції, залучають звичайні дини С-Х3-С. нестероїдні протизапальні засоби (нижче NSAID), Крім того заявлений винахід подалі стосується як-то піроксикам, диклофенак, пропіонові кислоти, композиції сполуки формули І разом з противірусяк-то напроксен, флубіпрфен, фенопрофен, кетоними засобами, як-то вірацепт, AZT, ацикловір та прфен та ібупрофен, фенамати, як-то мефенаміфамцикловір, та сполуками проти сепсису, як-то нова кислота, індометацин, суліндак, апазон, піравалант. золони, як-то фенілбутазон, саліцилати, як-то Крім того заявлений винахід подалі стосується аспірин, інгібітори СОХ-2, як-то целекоксиб, валкомпозиції сполуки формули І разом з серцеводекоксиб, рофекоксиб та еторикоксиб, анальгетики судинними засобами, як-то блокатори кальцієвого та внутрішньо-суглобові ліки, як-то кортикостероїканалу, засоби зниження ліпідів, як-то статини, ди та гіалуронові кислоти, як-то хіалган та син віск, фібрати, бета-блокатори, нецентральні інгібітори, та антагоністи рецептору Р2Х7. антагоністи рецептору ангіотензину-2 та інгібітори Сполуку формули І також можна застосовуваагрегації тромбоцитів. ти в композиції з існуючими терапевтичними засоКрім того заявлений винахід подалі стосується бами для лікування раку. Придатні засоби, застокомпозиції сполуки формули І разом з ЦНСсовувані в композиції, залучають: засобами, як-то антидепресанти (як-то сертралін), (і) антипрофілеративні/протипухлинні ліки та їх ліки проти паркінсонізму (як-то депреніл, L-допа, композиції, які застосовують в медичній онкології, рекуїр, мірапекс, інгібітори МАОВ, як-то селегін та як-то алкілувальні засоби (наприклад, цис-платин, ресагилін, інгібітори соmР, як-то тасмар, інгібітори карбоплатин, циклофосфамід, азотистий іприт, А-2, інгібітори перепоглинання допаміну, антагонімелфалан, хлорамбуцил, бусульфан та нітрозосести NMDA, агоністи нікотину, агоністи допаміну та човина); антиметаболіти (наприклад, антифолати, інгібітори нейрональної нітроген оксид-синтази), та як-то флуорпіримідин-подібний 5-флуорурацил та ліки проти хвороби Альцгеймера, як-то донепезил, тегафур, ралтітрексед, метотрексат, цитозинаратакрин, інгібітори СОХ-2, пропентофілін або метбінозид, гідроксисечовина, гемцитабін та паклітакрифонат. сел (ТахоІ®); протиракові антибіотики (наприклад, Крім того заявлений винахід подалі стосується подібний антрациклінам адріаміцин, блеоміцин, композиції сполуки формули І разом з речовинами доксорубіцин, дауноміцин, епірубіцин, ідарубіцин, з групи: (і) інгібітори триптази; (іі) антагоністи актимітоміцин-С, лактиноміцин та мітраміцин); антимівації фактору тромбоциту (PAF); (ііі) інгібітори інтотичні засоби (наприклад, подібні алкалоїдам терлейкін-перетворювального ферменту (ICE); (iv) вінка вінкристин, вінбластин, віндестин та віноре 15 89067 16 бін та подібний таксоїдам таксол та таксотер); та WO 00/41669, WO01/92224, WO02/04434 та інгібітори топоізомерази (наприклад, епіподофілоWO02/08213; токсино-подібні етопозид та теніпозид, амсакрин, (vii) антисенсове лікування, наприклад, спрятопотекан та камптотецин); (іі) цитостатичні засомоване до цілей, описаних вище, як-то ISIS 2503, би, як-то антиестрогени (наприклад, тамоксифен, анти-рас антисенс; тореміфен, ралоксифен, дролоксифен та йодок(viii) підходи генної терапії, що охоплюють, насифен), знижувальні регулятори рецептору естроприклад, підходи до заміщення аберантних генів, гену (наприклад, фулвестрант), антиандрогени як-то аберантний р53, аберантний BRCA1 або (наприклад, бікалутамід, флутамід, нілутамід та BRCA2, підходи GDEPT (ген-спрямована ферменципротерон ацетат), антагоністи LHRH або агоністна терапія проліками), як-то застосовуючи цитоти LHRH (наприклад, госерелін, лейпрорелін та зиндеаміназу, тимідинкіназу або бактеріальний бусерелін), прогестогени (наприклад, мегестрол фермент нітроредуктазу, та підходи для підвиацетат), інгібітори аромотази (наприклад, як анащення толерантності пацієнта до хіміотерапії або строзол, летрозол, воразол та ексеместан) та інгірадіотерапії, як-то генна терапія резистентності до багатьох ліків; та бітори 5 -редуктази, як-то фінастерид; (іх) підходи імнотерапії, що охоплюють, напри(ііі) Засоби, які інгібують інвазію ракових клітин клад, підходи ex-vivo та in-vivo для підвищення (наприклад, інгібітори металопротеїназо-подібного імуногенності клітин пухлини пацієнта, як-то транмаримастату та інгібітори функції активатору ресфекція цитокінами, як-то інтерлейкін 2, інтерлейцептору плазміногену урокінази); кін 4, або фактором стимулювання колоній грану(iv) модулятори функції фактору росту, наприлоцитів-макрофагів, підходи до зменшення анергії клад, такі інгібітори залучають антитіла фактору Т-клітин, підходи із застосуванням трансфектоваросту, антитіла рецептору фактору росту (наприних імунних клітин, як-то цитокін-трансфектованих клад, антитіло anti-erbb2 трастузумаб [Herceptin™] дендритних клітин, підходи із застосуванням цитота антитіло anti-erbb1 цетуксимаб [С225]), інгібітокін-трансфектованих ліній клітин пухлин та підходи ри фармезилтрансферази, інгібітори тирозинкінази із застосуванням антиідіотипичних антитіл. та інгібітори серин/треонінкінази, наприклад, інгібіСкомпоновані у вигляді фіксованої дози комтори родини епідермального фактору росту (напозиції продуктів застосовують сполуку формули І приклад, інгібітори EGFR-родини тирозинкінази, у межах описаного тут діапазону дозування та як-то N-(3-хлор-4-флуорфеніл)-7-метокси-6-(3-) інший фармацевтично активний засіб у межах апморфолінопропокси)хіназолін-4-амін (гефітиніб, робованого діапазону його дозування. Послідовне ZD1839), N-(3-етинілфеніл)-6,7-біс(2застосування розглядають, коли комбінована комметоксіетокси)хіназолін-4-амін (ерлотиніб, OSIпозиція є неприйнятною. 774) та 6-акриламідо-N-(3-хлор-4-флуорфеніл)-7Хоч сполука формули І є первинно важливою (3-морфолінопропокси)хіназолін-4-амін (СІ 1033)), як терапевтичний засіб для застосування теплокнаприклад, інгібітори родини тромбоцит-похідного ровним тваринам (охоплюючи людей), вона також фактору росту та наприклад, інгібітори родини є корисною кожного разу, коли є потреба інгібувафактору росту гепатоциту; ти дію металопротеїнази. Отже, вона є корисною (ν) антіангіогенні засоби, як-то інгібітори дій як фармакологічний стандарт для застосування у васкулярного ендотеліального фактору росту, (нарозвитку нових біологічних тестів та в пошуку ноприклад, антиваскулярно-ендотеліальне антитіло вих фармакологічних засобів. фактору росту клітин бевацизумаб [Avastin™], Винахід подалі ілюстровано наступними необсполуки, як-то розкриті в міжнародних заявках на межувальними прикладами. патент WO 97/22596, WO 97/30035, WO 97/32856 Доречні вихідні матеріали є комерційно достута WO 98/13354), та сполуки, що працюють за інпними або їх можна отримати будь-яким придатшими механізмами (наприклад, ліномід, інгібітори ним способом, який описано в літературі, є відофункції інтегрину ανβ3 та ангіостатин); мим спеціалісту-хіміку або описано тут у (vi) засоби васкулярного ураження, як-то комприкладах. На додаток наступна таблиця показує бретастатин А4, та сполуки, розкриті в міжнароддеталі щодо інтермедіатів та їх відповідні номери них заявках на патент WO 99/02166, WO00/40529, регістрації в Chemical Abstracts. Приклад 1 (5S)-5-метил-5-[({4-[4-(2,2,2трифлуоретокси)фенокси]піперидин-1іл}сульфоніл)метил]імідазолідин-2,4-діон До розчину 4-[4-(2,2,2трифлуоретокси)фенокси]піперидин гідрохлориду (0,3 г) та діізопропілетиламіну (0,37 мл) в дихлорметані (100 мл) додавали [(4S)-4-метил-2,5 діохоімідазолідин-4-іл]метансульфонілхлорид (0,261 г). Отриманий розчин перемішували при температурі навколишнього середовища протягом 18 годин. Реакційний розчин заздалегідь адсорбували прямо на оксиді силіцію та очищали хроматографією на колонці з оксидом силіцію та елююванням етилацетатом. Отриманий матеріал розтирали на 17 89067 18 порошок, фільтрували та промивали диетилетеючи 20% етилацетатом/ізогексаном, що дає третром, що дає (5S)-5-метил-5-[({4-[4-(2,2,2бутил 4-[4-(2,2,2трифлуоретокси)фенокси]піперидин-1трифлуоретокси)фенокси]піперидин-1-карбоксилат іл}сульфоніл)метил]імідазолідин-2,4-діон [0,33 г]. (3 г). Спектр ЯМР: (CDCI3) 1,45 (s, 9Н), 1,7 (m, 2Н), Спектр ЯМР: (ДМCOd6) 1,15 (s, 3Н), 1,6 (s, 2H), 1,9 (m, 2Н), 3,3 (m, 2Н), 3,7 (m, 2Н), 4,3 (m, 3Н), 1,8 (m, 2H), 3,1 (m, 2H), 3,2-3,6 (m, 4Н), 4,4 (m, 1Н), 6,85 (m, 4Н). 4,6-4,7 (m, 2Н), 6,9 (m, 4Н), 8,9 (s, 1Н) 10,7 (широДо трет-бутил 4-[4-(2,2,2кий, 1Н), трифлуоретокси)фенокси]піперидин-1Мас-спектр: М-Н 464. карбоксилату (3 г) додавали 4 молярний гідроген Відповідний вихідний матеріал синтезували хлорид в 1,4-діоксані (50 мл), перемішували при наступним чином; температурі навколишнього середовища протягом До розчину 4-бензилоксифенолу (10 г), трет1 години. Розчинник видаляли та отриману тверду бутил 4-гідрокси-1-піперидин карбоксилату (11 г) речовину розтирали на порошок та промивали та трифенілфосфіну (19,7г), в дихлорметані двічі малою кількістю диетилетеру, що дає 4-[4(300мл) краплями додавали розчин діізопропілдіа(2,2,2-трифлуоретокси)фенокси]піперидин гідрохзодікарбоксилату (14,8 мл), в дихлорметані (15 лоридну сіль (2,4 г). Спектр ЯМР: (ДMCOd6) 1,7 (m, мл), протягом 15 хвилин. Реакцію нагрівали з де2H), 2,0 (m, 2H), 3,0 (m, 2H), 3,2 (m, 2H), 4,5 (m, флегматором протягом 4 годин. 1H), 4,6 (m, 2Н), 6,9 (m, 4Н), 8,8 (широкий, 2Н). Розчинник видаляли. Залишок перемішували з Мас-спектр: М-Н- 276. 20% етилацетатом/ізогексаном (250мл) та відфіПриклад 2 льтровували трифенілфосфіноксид. Фільтрат ви(5S)-5-етил-5-[({4-[4-(2,2,2парювали та перерозчиняли в дихлорметані (100 трифлуоретокси)фенокси]піперидин-1мл) та заздалегідь адсорбували на оксиді силіцію. іл}сульфоніл)метил]імідазолідин-2,4-діон Очищення виконували, застосовуючи прокладку [(4S)-4-етил-2,5-діоксоімідазолідин-4оксиду силіцію, застосовуючи градієнт елюювання іл]метансульфонілхлорид (WO 2004/024698) (869 2-20% етилацетат/ізогексан. Відокремлений матемг) додавали до перемішуваного розчину 4-[4ріал розтирали на порошок з 10% диетилете(2,2,2-трифлуоретокси)фенокси]піперидин гідрохром/ізогексаном (100мл), що дає трет-бутил 4-[4лориду (750 мг) та триетиламіну (1,68 мл) в дих(бензилокси)фенокси]піперидин-1-карбоксилат лорметані (50 мл) та реакцію перемішували при (12,2g). Спектр ЯМР: (ДМСОd6) 1,4 (s, 9H), 1,5 (m, температурі навколишнього середовища протягом 2Н), 1,8 (m, 2Н), 3,1 (m, 2Н), 3,6 (m, 2Н), 4,4(m, 1Н), 2 годин. Розчинники видаляли у вакуумі та зали5,0 (s, 2Н), 6,9 (m, 4Н), 7,3-7,5 (m, 5Н). Мас-спектр: шок перемішували у воді протягом 2 годин. ОтриМ-Н- 284. ману тверду речовину відфільтровували, промиДо 10% паладію на карбоні (0,75 г) під потоком вали водою, а тоді - етером та сушили, що дає аргону, додавали розчин трет-бутил 4-[4заголовну сполуку (1,13 г); Спектр ЯМР: (ДMCOd6) (бензилокси)фенокси]піперидин-1-карбоксилату 0,78 (t, 3Н), 1,25 (m, 2H), 1,66 (m, 4H), 1,94 (m, 2H), (7,5 г) в етанолі (250 мл). Посудину очищали три 3,11 (m, 2H), 3,49 (d, 1H), 3,58 (m, 1H), 4,41 (m, 1H), рази аргоном перед уведенням до системи водню 4,64 (q, 2H), 6,97 (m, 4H), 8,5 (s, 1H), 10,71 (s, 1H); з балону. Реакцію енергійно перемішували при Мас-спектр: М-Н- 478. температурі навколишнього середовища протягом Приклад 3 3 годин. Водень видаляли із системи та очищали 5S-метил-5-[({4-[4-(1,1,2,2три рази аргоном перед фільтруванням через протетратрифлуоретокси)фенокси]піперидинкладку целіту. Прокладку ретельно промивали. іл}сульфоніл)метил]імідазолідин-2,4-діон Фільтрат та промивну рідину комбінували та випаДіізопропілетиламін (0,35 мл) та (4S-метилрювали, тверду речовину розтирали на порошок з 2,5-діоксоімідазолідин-4-іл)метансульфонілхлорид 20% диетилетером/ізогексаном, що дає трет(248 мг) додавали до суспензії 4-[4-(1,1,2,2бутил-4-гідрокси-1-піперидинкарбоксилат (5,7 г) тетратрифлуоретокси)фенокси]піперидину (300 Спектр ЯМР: (CDCI3) 1,5 (s, 9H), 1,7 (m, 2H), 1,9 мг) в дихлорметані (50 мл). Суміш перемішували (m, 2H), 3,3 (m, 2H), 3,7 (m, 2H), 4,3 (m, при температурі навколишнього середовища про1H),4,8(s,1H),6,7(m,4H). тягом 18 годин. Тоді суміш заздалегідь адсорбуваДо суспензії трет-бутил-4-гідрокси-1ли на гелі оксиду силіцію при зниженому тиску та піперидинкарбоксилату (4 г) та свіжерозмеленого очищали хроматографією на колонці з оксидом калій карбонату (4,2 г) в ацетоні (200 мл) додавали силіцію, елюючи етилацетатом. Тоді виділений чистий 2,2,2продукт перекристалізовували з етанолу (5 мл) та трифлуоретилнонафлуорбутанульфонат (6,7 г) та фільтрували. Тоді тверду речовину перемішували дозволяли перемішуватися протягом 3 годин при в диетилетері, фільтрували та сушили під вакуунавколишній температурі. Через 4 години додавамом, що дає заголовну сполуку як білу тверду рели нонафлат (3,3 г) та температуру підвищували човину (245 мг); Спектр ЯМР: (ДМСОd6) 1,34 (s, до температури нагрівання з дефлегматором про3Н), 1,66-1,78 (m, 2Н), 1,92-2,04 (m, 2Н), 3,08-3,20 тягом 18 годин. (m, 2Н), 3,31-3,42 (m, 2Н), 3,35 (d, 1H), 3,52 (d, 1H), Відфільтровували калій карбонат, залишок ви4,50-4,60 (m, 1Н), 6,76 (tt, 1H), 7,06 (d, 2H), 7,20 (d, парювали та розчиняли в етилацетаті (200 мл), 2H), 7,98 (s, 1H), 10,72 (s. 1H); Мас-спектр: М-Н промивали водою (100 мл) та насиченим розсолом 482. 4-[4-(1,1,2,2(100 мл), сушили над магній сульфатом та випаТетратрифлуоретокси)фенокси]піперидин отримурювали, що дає сиру білу тверду речовину, яку вали наступним чином: очищали хроматографією на оксиді силіцію, елю 19 89067 20 діізопропілазодікарбоксилат (2,25 мл) додава(0,12 г). Реакцію перемішували при ι температурі ли до розчину 4-(1,1,2,2навколишнього середовища протягом 18 годин. тетратрифлуоретокси)фенолу (2,0 г), трет-бутил 4 Реакційний розчин прямо очищали, застосогідроксипіперидин-1-карбоксилату (2,3 г) та тривуючи хроматографію на колонці, елюючи з градіфенілфосфіну (3,5 г) в дихлорметані (30 мл). Реаєнтом 1 - 5% метанол в дихлорметані. Отриманий кційну суміш перемішували при температурі наматеріал розтирали на порошок з малим об'ємом вколишнього середовища протягом 18 годин, а 50% етанолу/диетилетеру. Отриману тверду речотоді концентрували при зниженому тиску. Цю вину промивали диетилетером, фільтрували та отриману суміш очищали хроматографією на косушили під вакуумом, що дає заголовну сполуку лонці з оксидом силіцію, елюючи з градієнтом 0 (0,18 г); Спектр ЯМР: (ДМСOd6) 1,0 (m, 3Н), 1,35 (s, 15% етилацетат в гексані, що дає трет-бутил 4-[43Н), 1,7 (m, 2Н), 1,9 (m, 2Н), 3,1 (m, 2Н), 3,3-3,5 (m, (1,1,2,2-тетратрифлуоретокси)фенокси]піперидин4Н), 4,5 (m, 1Н), 7,05 (m, 2Н), 7,25 (m, 2Н) 8,0 (s, 1-карбоксилат як ясно-зелену олію (3,3 г); Спектр 1H), 10,7 (s, 1H); Мас-спектр: М-Н 500. ЯМР: (ДMCOd6) 1,39 (s, 9H), 1,43-1,57 (m, 2H), 4-[41,82-1,95 (m, 2H), 3,09-3,24 (m, 2Н), 3,56-3,70 (m, (Пентатрифлуоретокси)фенокси]піперидин гідрох2H), 4,47-4,59 (m, 1H), 6,73 (tt, 1H), 7,03 (d, 2H), лорид, застосований як вихідний матеріал, отри7,16 (d, 2H). мували наступним чином:4М НСІ в діоксані (30мл) додавали до третдо розчину 4-(1,1,2,2,2бутил 4-[4-(1,1,2,2пентатрифлуоретокси)фенолу (6,5г), трет-бутил-4тетратрифлуоретокси)фенокси]піперидин-1гідрокси-1-піперидинкарбоксилату (6,3 г), трифенікарбоксилату (3,3 г). Суміш перемішували при телфосфіну (11,2 г) в дихлорметані (400 мл) краплямпературі навколишнього середовища протягом ми додавали чистий діізопропілдіазодікарбоксилат 30 хвилини. Тоді суміш концентрували при зниже(5,6 мл) протягом 5 хвилин. Тоді реакцію нагрівали ному тиску та розтирали на порошок диетилетедо температури дефлегмації і тримали при дефлером. Отриманий осад відфільтровували, промивагмації протягом 18 годин. ли диетилетером та сушили під вакуумом, що дає Реакційний розчин заздалегідь адсорбували 4-[4-(1,1,2,2на оксиді силіцію та очищали застосовуючи хротетратрифлуоретокси)фенокси]піперидин як гідроматографію на колонці, елюючи 1:4 сумішшю етихлоридну сіль (2,76 г); Спектр ЯМР: (ДMCOd6) лацетату та ізогексану, що дає трет-бутил 4-[41,75-1,91 (m, 2H), 2,02-2,17 (m, 2H), 2,95-3,12 (m, (пентатрифлуоретокси)фенокси]піперидин-12H), 3,13-3,29 (m, 2H), 4,57-4,69 (m, 1H), 6,75 (tt, карбоксилат (3,9 г) Спектр ЯМР: (CDCI3) 1,2 (s, 1H), 7,06 (d, 2H), 7,19 (d, 2H), 8,95 (bs, 2H); Мас9Н), 1,5 (m, 2Н), 1,8 (m, 2H), 3,1 (m, 2H), 3,6 (m, спектр: М+Н+ 294. 2H), 4,6 (m, 1Н), 7,05 (m, 2Н), 7,25 (m, 2Н); МасПриклад 4 спектр: М-tВu- 354. 5S-eтил-5-[({4-[4-(1,1,2,2трет-бутил 4-[4тетратрифлуоретокси)фенокси]піперидин(пентатрифлуоретокси)фенокси]піперидин-1іл}сульфоніл)метил]імідазолідин-2,4-діон карбоксилат (3,8 г) перемішували в 4,0 Μ НСІ в Діізопропілетиламін (0,35 мл) та (4S-етил-2,51,4-діоксані (50 мл) протягом 1 години. Розчинник діоксоімідазолідин-4-іл)метансульфонілхлорид видаляли, отриману тверду речовину розтирали (262 мг) додавали до суспензії 4-[4-(1,1,2,2на порошок з диетилетером (50 мл), фільтрували тетратрифлуоретокси)фенокси]піперидину (300 та промивали диетилетером (2x50 мл), що дає 4мг) в дихлорметані (50 мл). Суміш перемішували [4-(пентатрифлуоретокси)фенокси]піперидин гідпри температурі навколишнього середовища пророхлорид як білу тверду речовину (2,9 г) ; Спектр тягом 18 годин. Тоді суміш заздалегідь адсорбуваЯМР: (СDCl3) 2,1 (m, 2Н), 2,3 (m, 2Н), 3,3 (m, 4Н), ли на гелі оксиду силіцію при зниженому тиску та 4,6.(s, 1Н), 6,9(m, 2Н), 7,2 (m, 2Н), 9,8 (широкий, очищали хроматографією на колонці з оксидом 1Н); Мас-спектр: М-Н 312 силіцію, елюючи етилацетатом. Тоді виділений Приклад 6 продукт перекристалізовували з етанолу (5 мл) та (5S)-5-етил-5-[({4-[4фільтрували. Тоді тверду речовину перемішували (пентатрифлуоретокси)фенокси]піперидин-1в диетилетері, фільтрували та сушили під вакууіл}сульфоніл)метил]імідазолідин-2,4-діон мом, що дає заголовну сполуку як білу тверду реДо розчину 4-[4човину (250 мг); Спектр ЯМР. (ДMCOd6) 0,78 (t, (пентатрифлуоретокси)фенокси]піперидин гідрох3Н), 1,60-1,79 (m, 2Н), 1,65 (q, 2Н), 1,90-2,09 (m, лориду (0,17 г) та діізопропілетиламіну (0,19 мл) в 2H), 3,09-3,20 (m, 2H), 3,31-3,42 (m, 2H), 3,35 (d, дихлорметані (100 мл) додавали [(4S)-4-етил-2,51H), 3,50 (d, 1Н), 4,50-4,60 (m, 1H), 6,76 (tt, 1H), діоксоімідазолідин-4-іл]метансульфонілхлорид 7,06 (d, 2H), 7,20 (d, 2H), 7,95 (s, 1H), 10,74 (s, 1H); (0,13 г). Реакцію перемішували при температурі Мас-спектр: М-Н 496. навколишнього середовища протягом 18 годин. Приклад 5 Реакційний розчин очищали прямо застосову(5S)-5-метил-5-[({4-[4ючи хроматографію на колонці, елюючи з градієн(пентатрифлуоретокси)фенокси]піперидин-1том 1 - 5% метанол у дихлорметані. Отриманий іл}сульфоніл)метил]імідазолідин-2,4-діон матеріал розтирали на порошок з малим об'ємом До розчину 4-[450% етанолу/диетилетеру. Отриману тверду речо(пентатрифлуоретокси)фенокси]піперидин гідрохвину промивали ) диетилетером, фільтрували та лориду (0,15 г) та діізопропілетиламіну (0,19 мл) в сушили під вакуумом, що дає заголовну сполуку дихлорметані (100 мл) додавали [(4S)-4-метил-2,5(0,17 г); Спектр ЯМР: (ДМСОd6) 0,8 (m, 3Н), 1,2 (s, діоксоімідазолідин-4-іл]метансульфонілхлорид 2Н), 1,7 (m, 2Н), 1,8 (m, 2Н), 2,0 (m, 2Н), 3,1 (m, 21 89067 22 2Н), 3,3-3,5 (m, 4Н), 4,6 (m, 1Н), 7,1 (m, 2Н), 7,25 (гідроксифенокси)піперидин-1-карбоксилату (1,2 г), (m, 2Н) 7,9 (s, 1H), 10,7 (s, 1H); Мас-спектр: М-Н 3,3,3-трифлуор-1-пропанолу (0,56 г) та трифеніл514. фосфіну (1,5 г) в дихлорметані (15 мл). Реакційну Приклад 7 суміш перемішували при температурі навколиш5S-метил-5-[({4-[3,3,3нього середовища протягом 18 годин і тоді концетрифлуорпропокси)фенокси]піперидин-1нтрували при зниженому тиску. Цю отриману суіл}сульфоніл)метил]імідазолідин-2,4-діон міш очищали хроматографією на колонці з Діізопропілетиламін (0,37 мл) та (4S-метилоксидом силіцію, елюючи з градієнтом 0 - 15% 2,5-діоксоімідазолідин-4-іл)метансульфонілхлорид етилацетату в гексані, що дає трет-бутил 4-[4(117 мг) додавали до суспензії 4-[4-(3,3,3(3,3,3-трифлуорпропокси)фенокси]піперидин-1трифлуорпропокси)фенокси]піперидин гідрохлокарбоксилат як білу тверду речовину (0,6 г); риду (140 мг) в метиленхлориді (20 мл). Спектр ЯМР: (CDCI3) 1,47 (s, 9H), 1,66-1,77 (m, Суміш перемішували при температурі навко2H), 1,83-1,94 (m, 2H), 2,52-2,66 (m, 2H), 3,24-3,34 лишнього середовища протягом 18 годин. Реакція (m, 2H), 3,65-3,75 (m, 2H), 4,11 (t, 2H), 4,27-4,37 (m, + була незавершеною, тому додавали (4S-метил1H), 6,78-6,89 (m, 4H); Мас-спектр: М+Н 390 та (М+ 2,5-діоксоімідазолідин-4-іл)метансульфонілхлорид 'ВuОСО)+Н 290. (50 мг). Суміш перемішували при температурі на4М НСІ в діоксані (10 мл) додавали до третвколишнього середовища протягом 4 годин. Тоді бутил 4-[4-(3,3,3суміш концентрували при зниженому тиску та трифлуорпропокси)фенокси]піперидин-1очищали хроматографією на колонці з оксидом карбоксилату (550 мг). Суміш перемішували при силіцію, елюючи з градієнтом 0 - 5% метанол у температурі навколишнього середовища протягом дихлорметані. Тоді виділений продукт очищали 10 хвилини. Тоді суміш концентрували при знижехроматографією на колонці з оксидом силіцію, ному тиску та розтирали на порошок з диетилетеелюючи з градієнтом 0 - 100% етилацетат в гексаром та перемішували протягом 10 хвилин. Отрині, що дає заголовну сполуку як білу тверду речоманий осад відфільтровували та сушили під вину (90 мг); Спектр ЯМР: (ДМСОd6) 1,34 (s, 3Н), вакуумом, що дає 4-[4-(3,3,31,63-1,75 (m, 2Н), 1,87-1,98 (m, 2Н), 2,65-2,82 (m, трифлуорпропокси)фенокси]піперидин як гідрох2Н), 3,06-3,19 (m, 2Н), 3,30-3,41 (m, 2Н), 3,34 (d, лоридну сіль (286 мг); Спектр ЯМР: (ДMCOd6) 1H), 3,51 (d, 1Н), 4,15 (t, 2Н), 4,35-4,45 (m, 1Н), 1,76-1,88 (m, 2Н), 2,01-2,12 (m, 2Н), 2,66-2,82 (m, 6,87-6,98 (m, 4Н), 7,98 (s, 1Н), 10,71 (s, 1Н); Мас-з 2Н), 2,97-3,10 (m, 2Н), 3,14-3,27 (m, 2Н), 4,15 (t, спектр: М-Н- 478. 2Н), 4,46-4,56 (m, 1Н), 6,87-6,98 (m, 4Н), 9,03 (bs, Вихідний матеріал 4-[4-(3,3,32H); Мас-спектр: М+Н+ 290. трифлуорпропокси)фенокси]піперидину отримуваПриклад 8 ли наступним чином: 5S-етил-5-[({4-[3,3,3Діізопропілазодікарбоксилат (2,36 мл) додаватрифлуорпропокси)фенокси]піперидин-1ли до розчину 4-(бензилокси)фенолу (2,0 г), третіл}сульфоніл)метил]імідазолідин-2,4-діон бутил-4-гідроксипіперидин-і-карбоксилату (2,41 г) Діізопропілетиламін (0,37 мл, 2,12 ммоль) та та трифенілфосфіну (3,67г) в дихлорметані (30 (4S-етил-2,5-діоксоімідазолідин-4мл). Реакційну суміш перемішували при темпераіл)метансульфонілхлорид (124 мг, 0,52 ммоль) турі навколишнього середовища протягом 18 гододавали до суспензії 4-[4-(3,3,3дин і тоді концентрували при зниженому тиску. Цю трифлуорпропокси)фенокси]піперидин гідрохлоотриману суміш очищали хроматографією на кориду(140 мг) в дихлорметані (20 мл). Суміш перелонці з оксидом силіцію, елюючи з градієнтом 0 мішували при температурі навколишнього середо20% етилацетату в гексані, що дає трет-бутил 4-[4вища протягом 18 годин. Реакція була (бензилокси)фенокси]піперидин-1-карбоксилат як незавершеною, тому додавали (4S-етил-2,5світлу оранжеву олію (3,25 г); Спектр ЯМР: (CDCI 3) діоксоімідазолідин-4-іл)метансульфонілхлорид (50 1,47 (s, 9H), 1,65-1,77 (m, 2Н), 1,83-1,93 (m, 2Н), мг). Суміш перемішували при температурі навко3,24-3,34 (m, 2Н), 3,65-3,76 (m, 2Н), 4,27-4,35 (m, лишнього середовища протягом 4 годин. Тоді су1Н), 5,01 (s, 2Н), 6,80-6,93 (m, 4H), 7,28-7,45 (m, міш концентрували при зниженому тиску та очиt + 5H); Мас-спектр: (M- BuOCO)+H 284. щали хроматографією на колонці з оксидом 10% паладій на карбоні (0,75 г, 50%w/w) додасиліцію, елюючи з градієнтом 0 - 5% метанолу в вали до розчину трет-бутил 4-[4метиленхлориді. Тоді виділений продукт очищали (бензилокси)фенокси]піперидин-1-карбоксилату хроматографією на колонці з оксидом силіцію, (1,5 г) в етанолі (100 мл). Суміш вакуумували та елюючи з градієнтом 0 -100% етилацетату в гексаочищали двічі воднем і тоді перемішували під атні, що дає заголовну сполуку як білу тверду речомосферою водню протягом 2 годин. Суміш фільтвину (90 мг):Спектр ЯМР: (ДMCOd6) 0,78 (t, 3Н), рували через целіт та прокладку фільтру проми1,60-1,65 (m, 2Н), 1,65 (q, 2H), 1,88-1,98 (m, 2H), вали етанолом. Фільтрат концентрували при 2,66-2,81 (m, 2H), 3,06-3,16 (m, 2H), 3,30-3,40 (m, зниженому тиску, що дає трет-бутил 42H), 3,33 (d, 1H), 3,49 (d, 1H), 4,15 (t, 2H), 4,36-4,45 (гідроксифенокси)піперидин-і-карбоксилат як кори(m, 1H), 6,87-6,97 (m, 4H), 7,95 (s, 1H), 10,73 (s, чневу тверду речовину (1,24 г); Спектр ЯМР: 1Н); Мас-спектр: М-Н- 492. (CDCI3) 1,47 (s, 9H), 1,65-1,76 (m, 2H), 1,82-1,93 (m, Приклад 9 2H), 3,23-3,33 (m, 2H), 3,65-3,76 (m, 2H), 4,25-4,34 (5S)-5-Метил-5-[({4-[4-(2,2,3,3(m, 1H), 5,07 (s, 1H), 6,70-6,85 (m, 4H). тетрафлуорпропокси)фенокси]-піперидин-1Діізопропілазодікарбоксилат (0,97 мл) додаваіл}сульфоніл)метил]імідазолідин-2,4-діон ли до розчину трет-бутил 4 23 89067 24 [(4S)-4-Метил-2,5-діоксоімідазолідин-4(5S)-5-етил-5-[({4-[4-(2,2,3,3іл]метансульфонілхлорид (0,453 г) додавали до тетрафлуорпропокси)фенокси]-піперидин-1розчину 4-{4-(2,2,3,3іл}сульфоніл)метил]імідазолідин-2,4-діон тетрафлуорпропокси)фенокси]-піперидин гідрохАналогічну цій процедуру, описану в прикладі лориду (0,69 г) в дихлорметані (25 мл) та триети9, застосовували для отримання заголовної сполуламіні (1,7 мл) при температурі навколишнього ки, застосовуючи [(4S)-4-етил-2,5середовища. Перемішували протягом 16 годин та діоксоімідазолідин-4-іл]метансульфонілхлорид, у випарювали до сухого стану. Залишок очищали тому ж охопленні. Вихід 136 мг. Спектр ЯМР: хроматографією на колонці (застосовуючи довжи(ДМСОd6) δ 10,8(s, 1H), 7,95 (s, 1H), 6,95 (m, 4H), ну хвилі λ 230 нм для виявлення сполуки), елюючи 6,7 (tt, 1H), 4,5 (m, 2H), 4,4 (m, 1H), 3,5 (d, 1H), 3,3 0-10% метанолом та дихлорметаном. Отриманий (m, 3Н), 3,1 (m, 2Н), 1,9(01, 2Н), 1,65 (m, 4Н), 0,8 (t, твердий продукт сушили під вакуумом при 50°С, 3Н). Мас-спектр: М-Н- 510. що дає заголовну сполуку (0,24 г). Спектр ЯМР Приклад 11 (5S)-5-метил-5-[({4-[4-(2,2,3,3,3(ДМСOd6) 10,7 (s, 1Н), 8,0 (s, 1Н), 6,95 (m, 4Н), пентафлуорпропокси)фенокси]-піперидин-16,6 (tt, 1Н), 4,5 (m, 2Н), 4,4 (m, 1Н), 3,5 (d, 1Н), 3,3 іл}сульфоніл)метил]імідазолідин-2,4-діон (m, 3Н), 3,1 (m, 2Н), 1,9 (m, 2Н), 1,7 (m, 2Н), 1,35 (s, [(4S)-4-Метил-2,5-діоксоімідазолідин-43Н). Мас-спектр М-Н- 495,89 іл]метансульфонілхлорид (0,188 г) додавали до 4-{4-(2,2,3,3-Тетрафлуорпропокси)фенокси]розчину 4-{4-(2,2,3,3,3піперидин гідрохлорид, застосований як вихідний пентафлуорпропокси)фенокси]-піперидин гідрохматеріал, отримували наступним чином :лориду (0,30 г) в дихлорметані (10 мл) та триети2,2,3,3-тетрафлуорпропанол (2,64 г) додавали ламіні (0,70 мл) при температурі навколишнього до суспензії натрій гідриду (1,08 г) в сухому етері середовища. Перемішували протягом 16 годин та (50 мл) при 0°С під атмосферою аргону. Перемівипарювали до сухого стану. Залишок очищали шували при 0°С протягом 15 хвилин. Повільно препаративною ВЕРХ (застосовуючи довжину додавали перфлуор-1-бутансульфоніл флуорид хвилі λ 230 нм для виявлення сполуки), елюючи 0(12,08 г). Перемішували під дефлегматором протя95% ацетонітрилом, Н2О,+ 0,2% трифлуороцтовою гом 3 годин, охолоджували та ретельно гасили кислотою. Отримували твердий продукт, який суН2О. Двічі екстрагували етером. Комбіновані екстшили під вакуумом при 50°С, що дає заголовну ракти промивали насиченим розсолом, сушили сполуку (0,076 г). ЯМР: (ДMCOd6) δ 10,7 (s, 1H), 8,0 над MgSO4, фільтрували та випарювали, що дає (s, 1H), 7,0 (m, 4H), 4,75 (t, 2H), 4,45 (m, 1Н), 3,5 (d, 2,2,3,3-тетрафлуорпропіл-1,1,2,2,3,3,4,4,4-) нона1Н), 3,3 (m, 3Н), 3,1 (m, 2H), 1,95 (m, 2H), 1,7 (m, флуорбутан-1-сульфонат як олію. Вихід 5,47 г. 2H), 1,35 (s, 3Н). Мас-спектр: М-Н- 513. Спектр ЯМР: (CDCI3) δ 5,9 (tt, 1H), 4,75 (t, 2H). 4-{4-(2,2,3,3,3-Пентафлуорпропокси)фенокси]2,2,3,3-Тетрафлуорпропіл-1,1,2,2,3,3,4,4,4піперидин гідрохлорид, застосований як вихідний нонафлуорбутан-1-сульфонат (4,84 г) розчиняли в матеріал, отримували наступним чином :ацетоні (50 мл). Додавали трет-бутил 4-(42,2,3,3,3-пентафлуорпропанол (3,0 г) додавагідроксифенокси)піперидин-1-карбоксилат (1,71 г) ли до суспензії натрій гідриду (1,08 г) в сухому та калій карбонат (2,42 г) та перемішували при етері (50 мл) при 0°С під атмосферою аргону. Петемпературі навколишнього середовища протягом ремішували при 0°С протягом 15 хвилин. Повільно 16 годин. Відфільтровували нерозчинний матеріал додавали перфлуор-1-бутансульфоніл флуорид та випарювали фільтрат до сухого стану, що дає (12,08 г). Перемішували під дефлегматором протяолію. Очищали хроматографією на колонці, застогом 3 годин, охолоджували та ретельно гасили совуючи 0-25% етилацетат/йогексан як елюент. Н2О. Двічі екстрагували етером. Комбіновані екстОтримували трет-бутил-4-[4-(2,2,3,3ракти промивали насиченим розсолом, сушили тетрафлуорпропокси)фенокси]піперидин-1над MgSO4, фільтрували та випарювали, що дає карбоксилат, 2,66 г як олію. Спектр ЯМР: (CDCI 3) δ 2,2,3,3,3-пентафлуорпропіл-1,1,2,2,3,3,4,4,46,85 (m, 4Н), 6,0 (tt, 1Н), 4,6 (m, 2Н), 4,26 (m, 1Н), попафлуорбутан-1-сульфонат як олію. Вихід 7,9 г. 3,7 (m, 2Н), 3,3 (m, 2H), 1,85 (m, 2H), 1,7 (m, 2H), ЯМР: (CDCI3) δ 4,9 (m, 2H). 1,45 (s, 9H). 2,2,3,3,3-Пентафлуорпропіл-1,1,2,2,3,3,4,4,4Трет-бутил-4-[4-(2,2,3,3нонафлуорбутан-1-сульфонат (6,7 г) розчиняли в тетрафлуорпропокси)фенокси]піперидин-1ацетоні (75 мл). Додавали трет-бутил 4-(4карбоксилат (2,66 г) розчиняли в 1,4-діоксані (25 гідроксифенокси)піперидин-1-карбоксилат (2,34 г) мл) та додавали 4М НСІ в 1,4-діоксані (9,75 мл). та калій карбонат (3,31 г). Перемішували при темПеремішували при температурі навколишнього пературі навколишнього середовища протягом 16 середовища протягом 16 годин. Реакційну суміш годин. Нерозчинний матеріал відфільтровували та випарювали до сухого стану, що дає білу тверду фільтрат випарювали до сухого стану, що дає речовину. Тверду речовину розтирали на порошок олію. Очищали хроматографією на колонці, застоз етером, виділяли та сушили під вакуумом при совуючи 0-20% етилацетат/ізогексан як елюент. 50°С. Отримували з 4-{4-(2,2,3,3Отримували трет-бутил-4-[4-(2,2,3,3,3тетрафлуорпропокси)фенокси]-піперидин гідрохпентафлуорпропокси)фенокси]піперидин-1лорид як тверду речовину 1,38 г Спектр ЯМР: карбоксилат як олію, 0,81 г. Спектр ЯМР: (CDCI 3) δ (ДMCOd6) δ 9,0 (br, 1H), 7,0 (m, 4H), 6,65 (tt, 1H), 6,35 (m, 4Н), 3,8 (m, 3Н), 3,2 (m, 2H), 2,8 (m, 2H), 4,52 (m, 2H), 4,4 (m, 1Н), 3,2 (m, 2H), 3,05 (m, 2H), 1,3 (m, 2H), 1,2 (m, 2Н), 0,9 (s, 9H). 2,1 (m, 2H), 1,8 (m, 2H). Мас-спектр М+Н 308 Трет-бутил-4-[4-(2,2,3,3,3Приклад 10 пентафлуорпропокси)фенокси]піперидин-1 25 89067 26 карбоксилат (0,81 г) розчиняли в 4М НСІ в 1,4Приклад 12 діоксані (10 мл). Перемішували при температурі (5S)-5-етил-5-[({4-[4-(2,2,3,3,3навколишнього середовища протягом 16 годин. пентафлуорпропокси)фенокси]-піперидин-1Реакційну суміш випарювали до сухого стану, що іл}сульфоніл)метил]імідазолідин-2,4-діон. дає білу тверду речовину. Тверду речовину розтиДля отримання заголовної сполуки застосовурали на порошок з етером, виділяли та сушили під вали процедуру аналогічну описаній в прикладі 11, вакуумом при 50°С. Отримували 4-{4-(2,2,3,3,3застосовуючи [(4S)-4-етил-2,5-діоксоімідазолідинпентафлуорпропокси)фенокси]-піперидин гідрох4-іл]метансульфонілхлорид, у тому ж охопленні. лорид як тверду речовину 0,76 г. Спектр ЯМР Вихід 0,85 г. Спектр ЯМР (ДMCOd6) δ 10,8(s, 1H), (ДМСОd6) δ 9,0 (br, 1H), 7,0 (m, 4H), 4,7 (m, 2H), 4,5 7,95 (s, 1H), 6,95 (m, 4Н), 6,7 (tt, 1Н), 4,5 (m, 2Н), (m, 1H), 3,2 (m, 2H), 3,0 (m, 2H), 2,05 (m, 2H), 1,8 4,4 (m, 1Н), 3,5 (d, 1Н), 3,3 (m, 3Н), 3,1 (m, 2H), 1,9 (m, 2H). Мас-спектр М+Н- 326 (m, 2H), 1,65 (m, 4Н), 0,8 (t, 3Н). Комп’ютерна верстка І. Скворцова Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюHydantoin derivatives useful as metalloproteinase inhibitors
Автори англійськоюWaterson David, Persson David Jonas
Назва патенту російськоюПроизводные гидантоина, полезные как ингибиторы металлопротеиназ
Автори російськоюВотерсон Дейвид, Перссон Давид Йонас
МПК / Мітки
МПК: A61K 31/4166, C07D 401/12, A61K 31/445, A61P 19/02
Мітки: похідні, інгібітори, гідантоїну, корисні, металопротеїназ
Код посилання
<a href="https://ua.patents.su/13-89067-pokhidni-gidantonu-korisni-yak-ingibitori-metaloprotenaz.html" target="_blank" rel="follow" title="База патентів України">Похідні гідантоїну, корисні як інгібітори металопротеїназ</a>
Попередній патент: Рідкий сцинтилятор
Наступний патент: Фасадна порожниста цегла
Випадковий патент: Механічний захоплюючий пристрій












