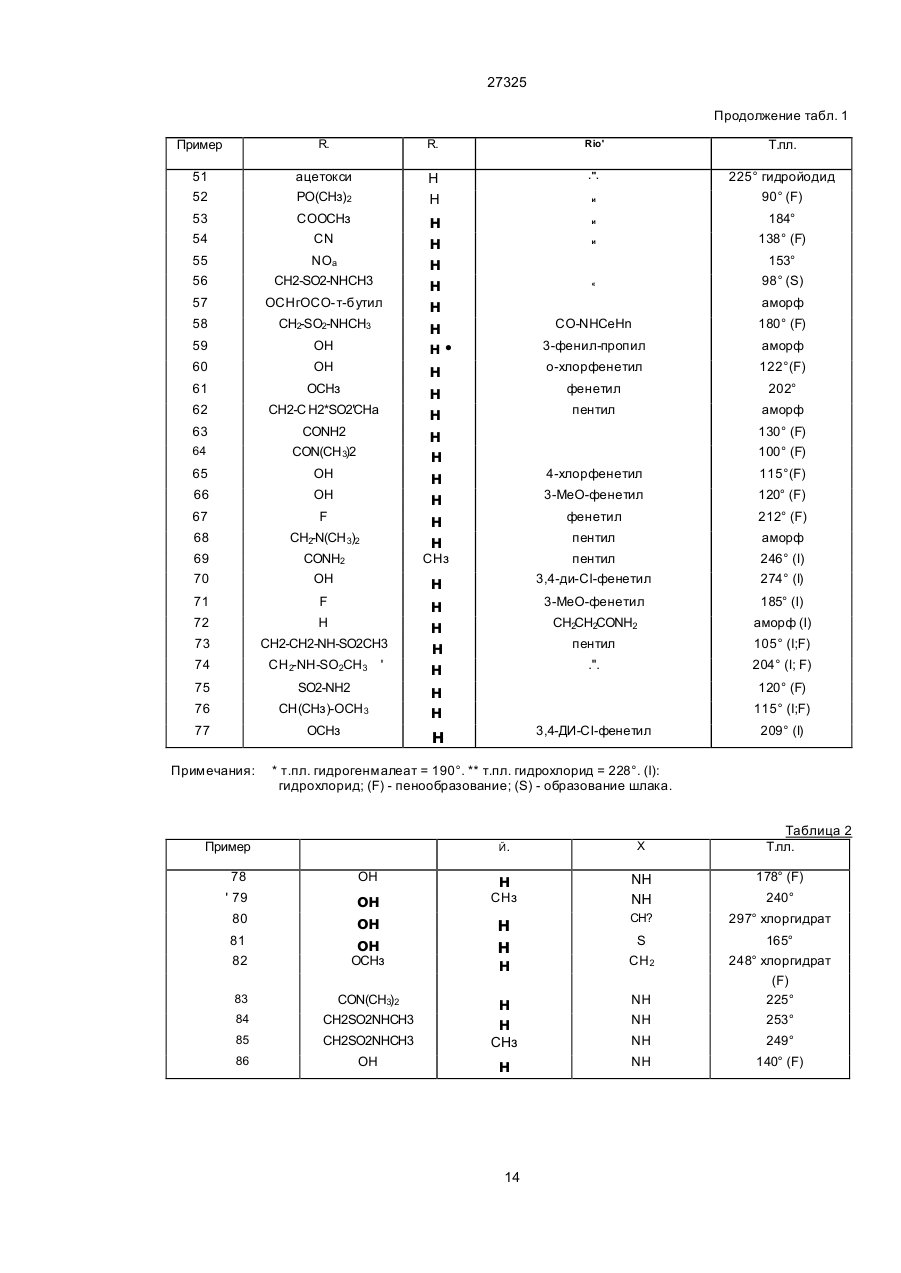
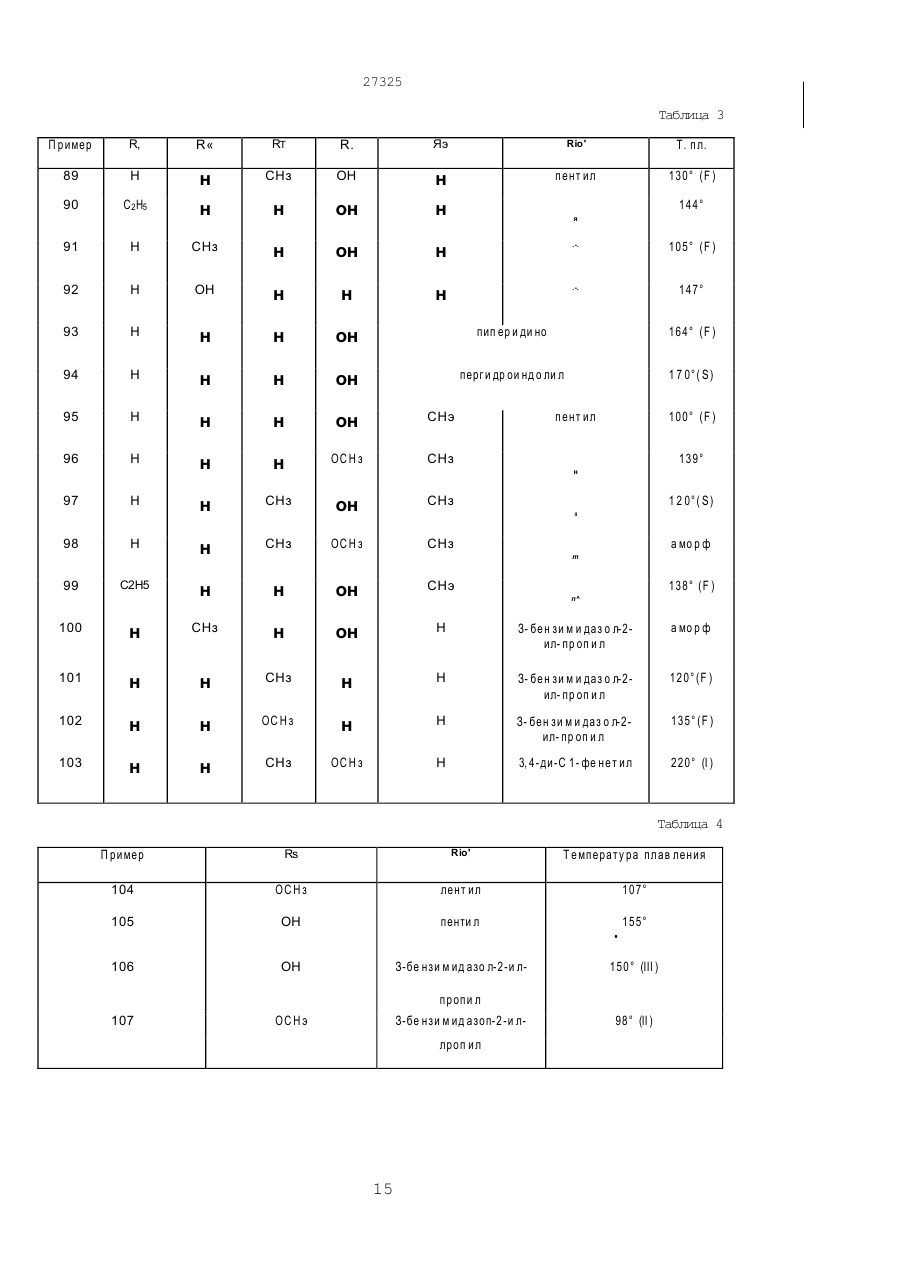
Аміногуанідин, що має стимулюючу дію на гастроінтестинальну рухомість, антисеротонінергічну дію на 5-нт1 рецептори, антагоністичну дію на 5-нт1д рецептори, в вільній формі або в формі солі
Текст
1 Аминогуанидин, обладающий стимулирую щим действием на гастроин тестинальную под вижность, антисеротонинэргическим действием на 5-НТ1 рецепторы антагонистическим действи ем на 5-НТ1д рецепторы, общей формулы I (D где Ri представляет собой водород, Сі-валкил; Rs представляет собой водород, галоген, Сі є алкил, гидрокси, амино, Сі 4алкиламино, Смоалкилкарбониламино, Сг валкоксикарбонильные радикалы, SO2NRaRb, в котором каждый Ra и Rb независимо представляет собой водород или Сі валкил* циано, или триметилсилил, Сі 6алкил, замещенный SO2-C1 в алкил, SO2NRaRb, -CONRaRb, NH-802-Сі-балкил, -N(Ci-6anKnn)-SO2-(Ci валкил), NRaRb1, где Rb' представляет собой водород, или Ci-бЭлкил, С2 еалкоксикарбонил, или -РО(Сі 27325 -tCH s)n' (в ) (с) где Rz? представляет собой водород или Січалкил; Ві представляет собой -СНгСНг-, -СОСН 2- или (СНг)з-, в которых один или два водорода могут быть замещены Сідалкилом или 1,2-фениленом; Е представляет собой -СН2СН2-, -CHzN(Ri7)- или -(СНг)з-, в которых один или два Н могут быть замещены Сібалкилом или 1,2-фениленом; Єї является СО или СНг', Ri7 представляет собой водород или Січалкил; G представляет собой СО, -CHCOORie, -CHCOR19, 5,5диметил-1,3- диоксан-2-илиден или 1,3-диоксолан2-илиден, где Rie является водородом, или Сібалкилом, и Rig является Сі^алкилом, и п' = 0 или 1, и Хг представляет собой -SR20 или -NR3R10', где R20 - Сі валки л, R 3 я вляе тся во доро дом , или Rio ' имеет одно из значений, приведенных выше для Rio, или R3 и Rio' вместе с атомом азота, к которому они присоединены, образуют ге тероциклический радикал как определено выше; при условии, что В представляет собой радикал формулы (Ь), только один из Rio и Rio1 может быть отличным от водорода и Хг может быть -SR20 только, когда Rio является водородом, и их фиэиологически-гидролизуемые и -приемлемые простые и сложные эфиры и когда Rs представляет собой гидроксил, в свободной форме или в форме соли. 2. Соединение формулы I по пункту 1, R. (О где R7, X Ri, Yи В определены в пункте 1, Z представляет собой -CFU =, где R4 является водородом, галогеном, гидроксилом или Сі^алкилом, и Rs представляет собой водород; Сі-еалкил; гид-рокси; Сібалкокси; Сі-валкокси, замещенный гид-рокси, Сібалкокси, (Сі-балкил)карбонилокси, бен Изобретение касается аминогуанидинов, применяемых в фармакологии, способов их получения, включающих их фармацевтических композиций и использования их в качестве фармацевтических препаратов. Более точно, настоящее изобретение относится к новым соединениям формулы (I) зоилокси, фенилСі-далкилкарбонилокси, NRaRb', CONRaRb или CSNRaRb, где каждый из Ra Rb Rb1 независимо представляет собой водород, или Ci-e алкил; Са-балкенилокси; пиридилкарбонилокси; нитро; амино, Сі 4алкиламино; Сыоалкилкарбониламино; Сг-еалкоксикарбонил; SO2NRaRb; циано; или триметилсилил; Сі-валкил, замещенный вОг-Сі-балкилом; -SO2NRaRb, -CONR aRb, -NH-БОгСібалкилом, Ы(СьбВпк\лп)-ЗОг' (Сьеалкил), NRaRb, Сг-бЭлкоксикарбонил, или -РО(Сі-4алкил)г; (Сі^алкил)карбонилокси; бензоилокси; фенилСічалкилкарбонилокси; карбокси; CONRaRb; РО(Сі.далкил)г; или OCONRcRd, где каждый из Rc и Rd независимо является Сі-еалкилом, при условии, что когда В является радикалом формулы (Ь), только один из Rio и Rio' отличен от водорода и Хг может быть SR20, только когда R10 является водородом, в свободной форме или в форме соли. 3. Соединение по пункту 1 или 2, в котором Ri = =Н, R7 = Н и Z = -СН =. 4. Соединение по пункту 1, в котором Ri = Н, R7 = =Н, Z = -N = и R5 = ОН. 5. Соединение по любому из пунктов 1, 2 или 3, в котором Rs является водородом, гидрокси груп пой, Сі-еалкокси, карбокси, Сг-еалкоксикарбонил, CONRaRb, SO2NH(Ci-6anKnn), Сі-валкил, замещен ный БОгСі-балкил, или РО(Сі-балкил)г, Ri = Н, R7 = =Н, Z =-СН= и R6 = Н. 6. Соединение по любому из предыдущи х пунк тов, в котором В является радикалом форм улы (Ь), в которой Хг является NR3R101. 7. Соединение по пункту 1, представляющее со бой 5-метоксииндол-З- карбоксальдегид амино(пентиламино)метиленгидразон в свободной форме или в форме соли. 8. Соединение по пункту 1, представляющее собой: 5-гидроксииндол-3-карбоксальдегидамино(^циклогексилуреидо)- метиленгидразон, 5-гидроксииндогъЗ-кар6оксальдегидамино(3-бензимидазол-2- илпропиламино)-метиленгидразон, 5-гидроксииндол-3-карбоксальдегидамино(пёнтиламино)-метиленгидразон, 5-гидрокси-7-метипиндол-3-карбоксальдегидамино(пентиламино)- метиленгидразон, 1-этил-5-гидроксииндол-3-карбоксальдегидамино(пентиламино)- метиленгидразон, 5-гидрокси-7-метилиндол-3-карбоксальдегидамиHo(N-MeTnn-N- пентиламино)-метиленгидразон и 5-оксо-4-азаиндол-3-карбоксальдегидамино(пентиламино)- метиленгидразон в свободной форме или в форме соли. R 0) 27325 где Ri - водород, Сі-еалкил; Rs - водород, галоген, Сі-еалкил, гидрокси, амино. Сі 4алкиламино, ациламино, Сгєалкоксикарбонил, SCbNRaRb. у которого каждый Ra и Rb независимо - водород или Сі валкил; циано, или триметилсилил, или Сі-балкил, замещенный -ЭОг -Сі-еалкилом, -SC^NRaRb, -CONRaRb, -NH-SOe-Ci-eanкилом, -N(Ci.6anKHn)-SO2-(Ci еалкил), -NRaRb', У которого Rb1 - водород, Сі єалкил, Сг валкоксикарбонил, -РО(Сі-4алкил)2, карбокси; CONR 8Rb, РО(Сі 4алкил)г; OCONRcRd. У которого каждый из Rc и R; -РО(Сі-С* алкил)2; или OCONRcRd. R7 - Н или СНз. X - Y - CR 8=N-. Re - Н или СН3. В - радикал формулы (а), предпочтительно радикал формулы (а), в которой Xi-NH-. В является радикалом формулы (Ь). R i o -H . X - NR3R10'. R3 - водород или С1-С4 алкил. Ri o 1 - во доро д, Сі -С ю а лкил, R "C O, CONHRu, -(CH2)i- 5-NH-CO-Ri6 или d-Ce алкил, замещенный в со арилом, радикалом формулы (d) или бензимидазолилом. Более предпочтительно Rio' - С1-С12 алкил. R3 и Rio' вместе с атомом азота, к которому они присоединены, образуют 5-, 6- или 7-членную, насыщенную или: неароматически ненасыщенную гетероциклическую группу, которая может включать далее ге тероатом, выбранный из N, S и О, и которая может быть далее сконденсирована с бензольным кольцом. Более предпочтительно Яз и Rio' вместе с атомом азота, к которому они присоединены, являются пиперидином или пергидроиндолом. Радикал формулы (d) является Одна группа соединений по изобретению является группой соединений формулы I, в которой X - Y и В такие, как определено выше, Z CR4=, как определено выше, Rs - водород; Ci-e алкил, гидрокси, Ci-e алкокси; Сі-6 алкокси, замещенный гидрокси, С1-С4 алкокси, ацилокси, NRaRb', CONRaRb или CSNRaRb, где каждый из Ra и Rb независимо являются водородом или CvCe алкилом, a Rb1 - водород, Сі С6 алкил, С3-С7 циклоалкил, СзСе алкенил, фенил или фенил-СгСз алкил, где фенольное кольцо возможно замещено; С2^ алкенилокси, пиридил-карбонилокси; нитро; амино; Ci-4 алкиламино; ациламино; С2-б апкоксикарбонил; SO2NRaRb, циано, или триметилсилил; или, Rs также является С 1-е алкилом, замещенным -БОг-Сі-еалкилом, SO2NRaRb, CONR aRb, NH-SO2-Ci є алкилом, -N (Сі-балкил)-8О2- (Ci-e алкил), -NRaRb", С2-є алкоксикарбонилом, или РО(Сі 4алкил)2; ацилокси; карбокси; CONRaRb; РО(Сі-4алкил)2; или OCONRcRd, где каждый из Re и Rd независимо является Сі-еалкилом. Особенно предпочтительными соединениями цЬормулы I являются такие соединения, у которых Z - -СН= или -ССНз=; R7 - Н или СН3; Rs - водород, гидрокси, Сі-Сб элкокси, Сі-Сб алкил, замещенный -БОг-С^алкилом, SO2NRaRb-CONRaRb, -NHSOrCi-e алкилом, N (Сі-еалкил)-8О2- Сі-6 алкилом, или -РО(Сі-С4 алкил)2; ацилокси, карбокси, CONRaRb, -PO(Ci-C 4 алкил)г или OCONR cRd. Также особенно предпочтительными являются соединения форм улы І, у которы х, Z -N=; R7 - Н или СНз; R - -ОН или d-Сб алкокси. Еще более предпочтительными соединениями формулы I являются те из них, у которых Z, Rs имеют одно из значений, данных выше, а В •NHявляется радикалом N формулы (Ь). или радикалом 27325 Соединения формулы I могут существовать в свободном виде, в виде соли , а также в виде сольвата или гидрата Соли могут включать кислотно-аддитивные соли и соли, которые могут быть получены, когда R5 - карбокси Пригодные фармацевтически приемлемые кислотно-аддитивные соли для применения в соответствии с настоящим изобретением, как описано выше, включают, например, хлоргидратные, сульфатные, ацетатные, оксалатные, малеинатные и фумаратные соли Если Rs - карбокси, то подходящими солями являются, например, соли щелочных металлов, таких как натрий или калий, или соли замещенного или незамещенного аммония Следует иметь в виду, что соединения формулы I, в которой X - Y - это -CR8=N- и В радикал формулы (bf) могут существовать как таутомеры NH R (И) где Ri, R7, Z, R2, R5, Re и Re - такие, как определено вы ше с соединением форм улы H I H2NNHB, где В - такой, как определено выше, или b) для получения соединения формулы І, в ко торой X - Y это -CHRe=NH-, гидрогенирование сое динения формулы 1, в которой X - Y это -CRe=N-, c) для получения соединения формулы I, в которой В - радикал формулы (Ь1 ), алкилирование, ацилирование или карбамоилирование сое динения формулы 1а R HN где Ri, R7, Z, R2, R5, Re и X - Y такие, как d) (b) где Ri, R5, R6, Re, R7 Z и Rio1 - такие, как описано выше Соединения формулы І, в которой Z - -N= и Rs - гидрокси, также могут существовать как таутомеры Y—NHB где R,i, R7, R2. В и X - Y такие, как определено выше Следует учиты вать, что когда возникают таутомерные формы, то изобретение охватывает все таутомерные формы и их смеси, то есть хотя соединения формулы I определены для удобства со ссылкой только на одну гуанидиновую и одну оксо-форму, следует понимать, что изобретение никоим образом не ограничивается конкретной номенклатурой и использованным графическим изображением То же касается и исходных материалов, проявляющих гуанидин-таутомеризм, как описано выше Кроме того, настоящее изобретение также относится к способу получения соединений формулы I, предусматривающему а) для получения соединения формулы I, в которой X - Y это -CRe=N-, реакцию соединения формулы II в R где Ri, R7, как Y—N определено выше, для получения соединения формулы I, которой Rs - гидрокси, расщепление по эфирной связи соединения формулы Ib, R .Y—NH —В Z, R2, Re и X - Y и В такие, определено выше, и Rsa расщепляемая эфирная группа, или е) для получения физиологически гидролизуемого и физиологически приемлемого простого или сложного эфира соединения формулы І, в которой Rs - гидрокси, этарифицирование или ацилирование соединения формулы I, где Rs - гидрокси, и выделение соединений формулы I или их физиологически гидролизуемых и физиологически приемлемых эфиров, полученных таким образом в свободном виде или в виде сольвата или гидрата. В способе стадия а) может осуществляться аналогично известным методам, например удобно в присутствии кислоты, например неорганической кислоты, такой как хлорводородная или бромводородная кислота, или органической кислоты, такой как уксусная, р-толуол-сульфоновая или пиридинр-толуолсульфрновая кислота Реакция может быть удобно осуществлена в присутствии протонного растворителя, например метанола, этанола или изопропанола Реакцию преимущественно осуществляют при температуре между комнатной и кипения 27325 Стадия Ь) может быть проведена согласно известным методам гидрогенирования. Если Rs бензилокси, то он может быть одновременно присоединен к гидрокси-группе. Стадия с) может быть проведена путем известных в данной области методов. Алкилирование или ацилирование соединений формулы 1а может быть удобно осуществлено путем реакции с алкилом, циклоалкилом или арил-галогенидом или ацил-гелогенидом или ангидридом соответственно, предпочтительно в присутствии основания, например, триэтиламина или основания Хунига (Hunig). Карбамоилирование может быть удобно проведено путем реакции с изоцианатом, таким как RuNCO, предпочтительно, в присутствии растворителя, например, диметилформамида. Стадия d) способа может быть проведена аналогично известным в данной области методам эфирного расщепления. Если R5a - бензилокси, то она (стадия d) может быть удобно осуществлена посредством гидрогенирования в присутствии катализатора, например палладия на древесном угле. Эта реакция может проводиться в растворителе, например в спирте, при температуре примерно от комнатной до 60°С. Rsa может быть алкокси, замещенный алкокси, алкенилокси или бензилокси. Стадия е) способа может, например, осуществляться путем реакции соединения формулы І, в которой R5- гидрокси, с ацилгалогенидом, предпочтительно с ацилхлоридом. Соединения формулы I, в которой Rs - пиридил-карбонилокси, могут быть приготовлены путем реакции соединения формулы I, в которой Rs - гидрокси, с галогенидом никотиновой кислоты. Эта реакция может быть удобно осуществлена в растворителе, таком как трифторуксусная кислота или трифторметан-сульфоновая кислота. Исходные материалы формул II или III либо уже известны или могут быть получены аналогично методам, известным и применяемым в данной области. Например, соединения формулы II могут быть получены согласно следующей схеме реакции динения формулы V с реагентом Бредерека, например (СНз)гМСН(ОСНз)2, в отсутствие растворителя или в присутствии растворителя, такого как пирролидин, с последующим восстановлением, например, водородом в присутствии палладиевого катализатора или гидразином в присутствии никеля Ренея (Raney). Соединения формулы И, в которой W -NRr, могут бы ть удобно получены п утем подвергания соединения формулы IV модифицированной реакции Вилсмайера, и затем алкилированию или ацилированию. Моди фицированная реакция Вилсмайера может быть осуществлена с использованием диметил-алкиламида в присутствии РОСІз, согласно известным в данной области методам. Алкилирование или ацилирование может быть осуществлено известным образом, например, в присутствии о снования, например, К 2СОз или СгНбМдВг, в растроре, таком как диметилформамид или тетрагидрофуран. Соединения формулы III, в которых В - радикал формулы (Ь), в которой Хг - не - SR20. могут быть удобно получены путем реакции соединения формулы VI R 21 (VI) CH, R в которой Rio - такой, как определено выше, и R21 - либо - NR3R101 или NHNH2, либо с гидразином, если R2i - это - NR3R101. либо с амином формулы NHR3R10', если R21 - это -NHNHg. Реакцию можно преимущественно проводить посредством нагревания при температуре кипения. Ее можно удобно проводить в растворителе, например в спирте, таким как метанол и этанол, вода или диметилформамид, в отсутствии или в присутствии щелочного соединения, например, гидроксида ипи карбоната калия.' Соединения формулы III, в которой В является радикалом формулы (Ь), в которой Хг это -SR20, могут быть удобно приготовлены путем алкилирования соединения формулы VII Н N Н R 1 Модифицированная реакция Вилсмайера R, (VII) N Н R2 Соединения вышеуказанной формулы IV могут быть удобно получены путем реакции сое с помощью Rco-дел соединения, в соответствии с известными методами. Поскольку получение исходных материа-" лов не описывается подробно, то следует использовать известные соединения или соединения, которые могу быть получены аналогично известным и используемым в данной области методом, или как раскрыто в следующих примерах Эти примеры иллюстрируют изобретение, но не ограничивают его, и все температуры, указанных в них, даны в градуса х Цельсия. 10 27325 Использованы сле дующие сокра щения: ТГФ - тетрагидрофуран, ДМФ - диметилформамид, ЕтОН - этиловый спирт, МеОН - метиловый спирт, АсОЕт - этиловый ацетат, (II) - образование пены, (III) - образование шлака. Пример 1. 5-Гидрокси-индол-З-карбоксальдегидамино {3-(2'-пирролидинон-1 '-ил)-пропил амино]метиленгидразон. К раствору 0,9 г 5-гидрокси-индол-З-карбоксальде гида диаминоме тилен ги дразона (4,1 ммоль) в 10 мл ТГФ, содержащего 2 мл ДМФ и 0,9 мл ET3N (6,2 ммоль) при комнатной температуре добавляют 1,3 г 3-(2'-пирролидинон-1-ил)-1бромпропана (6,2 ммоль). Смесь перемешивают до утра при 50°С. Здесь смесь охлаждают до комнатной температуры, и растворитель выпарива ю. Оста ток хрома то гр а фир уют на д 5 іОг (элюент: толуол (ЕтОН) NH3 в соотношении 70:30:2,5) с получением вышеуказанного в названии соединения в кристаллическом виде. Т. пл. = =158°С (II). Масс-спектральный анализ (относительная интенсивность): 343,3 (МН+, 100); 217,2 (20); 168,2 (20); 143,2 (23)... Пример 2. 5-Гидрокси-индол-З-карбоксальдегид амино (N-метил-Ы- гептиламино)метиленгидразона. К раствору 0,48 г 5-бензилокси-индол-Зкарбоксальдегида амино (1М-метил-М-гептиламино)метилен-гидразона (1,1 ммоль) в ЕтОН добавляют 0,25 г 10% Pd/C. С успензию гидрогенируют до утра при 45°С. Затем суспензию фильтруют через силикагель, растворитель выпаривают и о ста ток хрома то гр а фир уют на силикагеле (элюент: толуол (ЕтОН) NH3 в соотно шении .85:15:1) с получением целевого соединения. Чистый материал кристаллизуют из СН 2СІг (гексан в соотношении 2:8). Т. пл.: 110° (III). Масс-спектр: m/z: 329 (М+, 40); 128 (40); 111 (60); 73 (50). Исходные материалы могут быть получены следующим образом: а) К раствор у 3,2 г 5-бензилокси-индол-Зкарбоксальдегида (12,7 ммоль) и 5,0 г 1-(1 М-метил-М-гептил)-3-М'-аминогуанидина,' гидроиодида (16,0 ммоль) в 100 мл МеОН добавляют при 5°, раствор MeOH/HCI до рН 3. Через 2 ч, раствори тель выпаривают и оста ток помещают в АсОЕт. Раствор промывают раствором ЫагСОз(2М). Ор ганический слой сушат над сульфатом натрия, и растворитель выпаривают. Остаток хроматогра фируют (элюент: толуол (ЕтОН) NH3 в соотноше нии 85:15:0,5) с получением целево го соедине ния. Масс-спектр m/z (о тносительная интенси в ность): 420 (МН+, 100); 330 (7); 249 (4); 172 (16). б) 1 -(Й-метил-ІЧ-гептил)-З-М'-аминагуанидина гидроиодид. Раствор, содержащий 4,7 г 3-метил-изотиополукарбазида гидроиодида (20 ммоль) и 3,7 мл М-метил-Ы-гептиламина (22 моль) в 30 мл метанола подвергают рефлюксу в течение 6 ч. Раствор затем охлаждают до комнатной температуры и растворитель выпаривают с получением 1-(N-Meтил-М-гептил^З-Ы'-аминогуанидина гидроиодида. Полученный сырой материал используют для следующего этапа без дополнительной очистки. Пример 3. 5-Гидрокси-индол-З-карбоксальдегид амино (М-циклогексилуреидо)метиленгидразона. К раствору 0,8 г 5-гидрокси-индол-З-карбоксальде гида диаминомети лен гидразона (3,7 ммоль) в 20 мл ДМФ добавляют в течение 5 мин при 0° к раствору 0,5 мл циклогексил-изоцианата (4,0 ммоль) в 5 мл ДМФ. Раствор перемешивают в течение 4 ч. Растворитель затем выпаривают и оста ток хрома тогра фир уют (элюен т: то луол (ЕтОН) ЫНз 85:15:0,5) с получением целевого соединения в виде кристаллов. Т. пл. = 135° (II). Масс-спектр: m/z (относительная интенсивность): 343 (МН+, 100); 244 (50); 218 (85); 159 (33). Пример 4. 5-Гидрокси-6-фтор-индол-3-карбоксальдегид амино(пентиламин)-метилен-гидразона. Целевое соединение получают по примеру 2. Т. пл. = 125° (II). 5-Бензиллокси-6-фтор-индол-3-карбоксальдегид, используемый в качестве исходного материала, может быть получен следующим образом: a) 2-нитро-4-фтор-5-бензилокси-толуол К раствору 85,6 г 2-нитро-4-фтор-5-гидрокси-толуола (0,5 моль) в 1300 мл ацетона добавляют при комнатной температуре 138 г К2СОз (1,0 моль). 72 мл бензил-бромида (0,6 моль) добавляют затем по каплям в течение 1 ч и полученную смесь перемешивают до утра при 60°. Растворитель выпаривают и остаток помещают в АсОЕт. Преципитат удаляют фильтрованием, и раствор промывают водой. Органический слой сушат над сульфа том натрия, растворитель выпаривают, и остаток рекристаллизуют из гексана с получением 2-нитро-4-фтор-5-бензилокси-толуола. Т. пл.: 95°. Масс-спектр- m/z : 261 (М+). b) 2-[1 '-(М,г\1-диметиламино)-этен-2'-ил]-4бензилокси-5-фтор- нитробензол. Раствор 126 г 2-нитро-4-фтор-5-бензилокси-толуола (0,48 моль) в 200 г бис-диметиламино-т-бутокси-метана (1,15 моль) перемешивают до утра при 90°. Затем растворитель выпаривают и остаток кристаллизуют из МеОН с получением Ь) целевого соединения в виде красных кристаллов. Т. пл.: 146°. Масс-спектр: m/z: 316 (М*). c) 5-Бензилокси-6-фтор-индол. Раствор 9,5 г соединения Ь) (30,0 ммоль) в 150 мл толуола и 30 мл ТГФ, содержащего 1 г Raney-никеля, гидрогенизируют при комнатной температуре. Через 4 ч суспензию фильтруют через "Ryflo", и растворитель выпаривают. Остаток хрома то гра фи р уют при сре днем давлении (элюент: толуол) с получением целевого соединения, которое кристаллизуют из гексана. Т. пл.= = 126°. Масс, спектр: m/z: 241 (М*). d) 5-Бензилокси-б-фтор-индол-З-карбок-. сальдегид. 3,3 мл РОСІз (36,0 ммоль) добавляют по каплям при 0° к 14 мл ДМФ (180 ммоль). Через 15 мин по каплям в течение 10 мин добавляют 7,30 г соединения с) (30 ммоль) в 14 мл ДМФ, Смесь перемешивают 1 ч при комнатной температур, затем разбавляют холодной водой, а затем добавляют по каплям 7,2 г NaOH в 50 мл воды. Остаток фильтруют и промывают водой. Полученное твердое вещество хроматографируют на SiOg (элюент: СН2СІ2) и кристаллизуют из эфира с получением целевого d) соединения Т. пл.: 190°. Масс, спектр: m/z (относительная интенсивность): 269 (М+, 72); 178 (20); 150 (15); 91 (100); 65 (38). 27325 Пример 5. 5-Гидрокси-индол-З-карбоксальдегид амино (бутириламид) метиленгидразона. К раствору 0,5 г 5-гидрокси-индол-З-карбоксальде гида диаминометилен гидр азона (2 ,3 ммоль) в 5 мл ДМФ добавляют по каплям раствор 0,4 мл бутан-ангидрида (2,5 ммоль) в 5 мл ДМФ. Через 7 ч при комнатной температуре растворитель выпаривают и остаток хроматографир уют н а Si O 2 (элюен т: то луо л (ЕтОН ) ЫН з 85'15*0,3). Таким образом получают целевое соединение, которое осаждают из гексана. Т. пл. = =90° (II). Масс, спектр: n./z (относительная интенсивность): 287 (М\ 16); 217 (8); 200 (4); 158 (30); 98 (100); 70 (46). Пример 6. 5-Гидрокси-индол-З-карбоксальдегид амино (пентил-амино)-метиленгидразона трифторацетат. Температура плавления = 138°. Пример 7. 5-Гидрокси-индол-З-карбоксальдегид амино (пентиламино)-метиленгидразона трифторацетат. К раствору 1,0 г 5-гидрокси-индол-З-карбоксальдегид-амино (пентиламино) метиленгидразона (3,5 мммоль) в 10 мл CF3C O2H доба вляют 0,72 мл гексаноилхлорида (5,2 ммоль) при 0°. Через 3 ч реакцию гасят 2N раствором ЫагСОз, и смесь перемешивают в те чение 20 мин. Добавляют АсОЕт, и отделяют органический слой, который промывают рассолом и сушат над сульфатом натрия. Растворитель затем выпаривают, и остаток промывают эфиром с получением кристаллического целевого соединения. Т. пл. = 205°. Масс, спектр: m/z : 385 (М, 20); 160 (30); 158 (25); 69(100). Путем описанной выше следующей процедуры могут быть получены соединения формулы IA NHR' в которой R5, Re и Rio' - такие, как определено в табл. 1. Путем описанной выше процедуры, могут быть получены следующие соединения формулы IB, в которой: R5, Re и X - такие как определено в табл. 2 ниже. Пример 87. 5-Гидрокси-3-{(М'-2'-имидазолин-4'-онил)- гидразометил]-индол. Температура плавления = 110° (II); Пример 88.' Н N Т. пл.: = 239°. Следующей процедурой, как раскрыто вы* ше, могут бы ть получены соединения формулы IC, в которой Ri, R3, R4, R5, R7 и Rto' такие, как определено в табл. 3 ниже. R. NH Путем следующей процедуры, раскрытой выше, могут быть получены соединения формулы ID, в которой R5 и Rio' - такие, как в табл. 4 ниже. Путем следующей процедуры, как раскрыто выше, могут быть получены следующие сое динения формулы IE (IE) в которой R? и Rio' такие, как определено в табл. 5 ниже. Пример 113. (7-Азаиндол)-3-карбоксальдегид амино(пентиламино) метилен-гидразина. Т. пл.: 78° (III). Пример 114. 5-Бензилокси-6-фтор-индол3-карбоксальдегид амидингидразона. Т. пл.: 168° (II). 5-(Диметилфосфиноксид)-индол-3-карбоксальдегид, используемый в качестве исхо дного вещества для получения соединения по примеру 52, может быть приго товлен по примеру 4 d) из индол-5-диметилфосфина оксида. Индол-5-диметилфосфина оксид может быть приготовлен таким образом: Пример 115. Индол-5-(диметилфосфина оксид). Раствор т-бутил-лития в гексане (10 ммоль, 1,7 М) добавляют при -78° к раствору 5-бром-ІЧбензил-индолина (5 ммоль) в 30 мл эфира. Через 10 мин к смеси добавляют раствор СІРО(Ме)2 (10 ммоль) в 10 мл ТГФ. Реакционную смесь оставляют нагреться до комнатной температуры в течение 6 ч. Добавляют воду и АсОЕт, органический слой отделяют, и водную фаз у экстрагируютАсОЕт. Органические фазы соединяют и промывают рассолом, сушат, и. растворитель выпарива ют. Оста ток хрома то гра фир уют н а БЮг (элюент : СНгСЬ/МеОН 95:5) с получением целевого а)-соединения. Т. пл.: 180°. b) Индолин-5-(диметилфосфина оксид). Раствор соединения а) (1,5 ммоль) в 20 мл МеОН, содержащем 0,2 г Pd/C гидрогенизируют в течение 2 ч. Раствор фильтруют через Hyflo, и растворитель выпаривают с получением целевого ^-соединения. c) Индол-5-(диметилфосфина оксид). Раствор соедин ения Ь) (1 ,5 ммоль) в 2 5 мл ксилола, содержаще го 100 м г Pd /C подвергают на гревани ю с кипячением в те чение 3 ч. Раствор фи льтр уют через H yflo, и ката лизатор промывают СН 2СІ2. Растворитель выпаривают с 27325 получением целевого соединения с). Т. пл.: =195°. 5-Гидрокси-бензотиофен-З-карбоксальдегид и 5-метоксибензотиофен- 3-карбоксальдегид, используемые в качестве исходных ве ществ для получения соединений по примерам 104-107; могут быть приготовлены следующим образом: Пример 116. 5-Метокси-бензотиофен-Зкарбоксальдегид. a) (4-Метокси-бенэил)ацетонила сульфид. 0,165 моль гидрида на трия добавляют по частям при 0° к раствору 4-метокси-тиофенола (0,15 моль) в 300 мл ТГФ. Через 1 ч добавляют хлорацетон Смесь перемешивают до утра при комнатной температуре. Затем выпаривают растворитель, и смесь растворяют в СН2СІ2 и промывают 2N Na2COa. Органическую фазу сушат, и растворитель выпаривают с получением целевого соединения а), которое используют без дополнительной очистки. b) З-Метил-5-метокси-бензотиофен. 0,15 моль соединения а) добавляют в течение 1 ч при кипячении к раствору полифосфорной кислоты (0,17 моль) в 1 л хлорбензола. Этот раствор перемешивают при кипячении до утра. Смесь фильтруют и фильтрат выпаривают. Сырой продукт хроматографируют на ЭЮг (элюент: гексан с получением целевого Ь) соединения. c) 5-Метокси-З-бромметил-бензотиофен. 0,01 моль NBS и кристалл дибензоилпероксида добавляют к раствор у соединения Ь) (0,01 моль) в 60 мл тетрахлоруглерода. Смесь перемешивают при кипячении в течение 1,5 ч. Суспензию фильтруют и фильтрат выпаривают. Полученное масло кристаллизуется при его охлаждении и далее используется без дополнительной очистки d) 5-Метокси-бензотиофен-З-карбоксальдегид. 0,09 моль тетраамина гексаметилена добавляют к раствор у соединения с) (0,08 моль) в 150 мл хлороформа. Смесь перемешивают при кипячении в течение 6 ч. После охлаждения суспензии к ней добавляют эфир; и твердое вещество отделяют фильтрованием Остаток растворяют в 100 мл 50% СНзСООН и смесь нагревают при кипячении в течение 3 ч. Затем добавляют 130 мл воды и 25 мл конц. HCI и смесь кипятят в течение еще 5 мин. Смесь охлаждают на льду. Кристаллизовавшееся целевое соединение d) отделяют фильтрованием и промывают водой Тч. пл.: 50°. Пример 117, 5-Гидрокси-бензотиофен-Зкарбоксальдегид. Раствор ВВгз (0,07 моль) в 15 мл СН2СІ2 добавляют при 0° к раствору 0,014 моль 5-метокси-бензотиофен-3-карбоксальдегида в 80 мл СНгСІг. После 4 ч стояния добавляют 2N ЫагСОз до рН 7. Органический растворитель выпаривают и суспензию фильтруют. Твердое вещество промывают водой с получением сырого продукта в названии примера, который рекристаллизуют из смеси СНзОН/Н 2О. Т.пл.: 200°. Соединения формулы I и их фармацевтически приемлемые соли (далее упоминаемые как соединения по изобретению) проявляют фармацевтическую активность и являются поэтому полезными в фармакологии. В частности, соединения по изобретению обладают стимулирующим действием на работу желудо чно-кишечно го тракта (перисталь тику), что может быть продемонстрировано на стандартных тестовых моделях, например, так. Однополюсные электроды имплантируют в серозную сторону стенки кишечника (тонкая кишка) собак (Beagle). Из этих электродов сигналы поступают в усилитель и фильтруются с целью регистрации потенциалов низкой и высокой частоты, чтобы отделить медленные сокращения от резких. Количество пиков (резких сокращений) определяют за период в 2 мин Исходя из этого, получают следующие результаты: длительность, фазы НИ, интерва л между блоками двух после довательных фаз III, скорость распространения. Один-два цикла записывают перед введением лекарства, которое осуществляют подкожно через 10-15 мин после фазы И!, прошедшей большинство дистальных электродов. Контрольные опыты осуществляют обычно посредством введения растворителя. У накормленных собак количество резких сокращений за 30 мин определяли дополнительно. В этом эксперименте соединения по изобретению стимулируют миоэлектрическую активность в дозах порядка примерно от 0,001 до 10 мг/кг s. с. (подкожно). Далее, стимуляторный эффект на активность работы желудочно-кишечного тракта соединений по изобретению демонстрируется также, например, их действием на перистальтический рефлекс на отделенную ободочную кишку морс-* кой свинки. Мужских особей морских свинок весом 200-400 г глушили и обескровливали. Участки концевого участка ободочной кишки длиной 4-5 см удаляют и суспендируют, как описано Тренделенбургом в "Arch. Exp Path. Pharmacol" 81, 55129 (1917), в 20 мл бане при начальной загрузке 1 г Ткань выдерживают при 37° в модифицированном растворе Кребса (NaCI 118,6; CaCI2 2,7; KCI 4,7; КН2РО* 1,2; MgSO4 0,1; NaHCO3 25,0; глюкоза 5,6 мМ), и продували 5% СО в кислороде. Перистальтику вызывали на 30 с путем увеличения давления в просвете от нуля до 1-4 см с помощью воды. Измерения проводят на реакцию продольной (гладкой) мускулатуры с помощью датчика смещения - изотонической силы, а также активность кольцевых мышц с помощью датчика давления . Область под кривой (сокра щенно AUC) перистальтических сокращений определяют и кривые реакции в зависимости от концентрации устанавливают с помощью определения AUC, представляющей деятельность продольной и кольцевой мускулатуры. Каждый препарат используют в качестве его собственного контроля, принимая за 100% перистальтическую активность до введения испытываемых соединений. Испытываемые соединения добавляют к серозной стороне и оставляют в контакте с ней в течение 15 мин. В этом эксперименте соединения по изобретению оказывали стимулирующее действие на перистальтическую активность при концентрации порядка примерно от 10~10 до 10~7 М. Соединения по изобретению являются поэтом у полезными для лечения расстрой ств 27325 подвижности желудочно-кишечного тракта, например для нормализации или для улучшения желудочной эвакуации и кишечной проходимости у лиц с расстройством такой активности, например болезнь, характеризующуюся желудочно-пищеводным рефлюксом, пониженной перистальтикой пищевода и/или желудка, и/или тонкого и/или толстого кишечника, или для лечения воспаления пищевода, гастропареза, диспепсии, нежелчной диспепсии псевдонепроходимости (псевдозаворот кишок), непроходимости ободочной кишки, тощей кишки, синдром острого живота, вздутие, боли в области желудка, послеоперационную атонию кишечника, рецидивную тошноту и рвоту, невротическое истощение или дискинезию желчной системы. Далее, соединения по изобретению также показаны для использования при лечении дискинезии мочевого пузыря, регулирования выделения котизола/альдостерона, или для улучшения памяти и запоминания. Для вышеуказанных применений, требуемая дозировка будет, конечно, зависеть в значительной степени от пути введения, конкретного состояния подлежащего лечению и требуемого эффекта. Показанные дневные дозы находятся в пределах примерно от 0,01 до 3 мг, например приблизительно от 0,01 до 1 мг для парентерального применения, или примерно от 0,1 до 3 мг для орального применения, предпочтительно вводимые разовой дозой, в разделенных дозах на 2-4 приема в день, или в формах с замедленным высвобождением лекарства. Соответственно, единицы дозировок дпя орального введения включают примерно 0,0025-1,5 мг активного ингредиента (то есть соединения по изобретению или его фармацевтически приемлемой соли), смешанного с подходящим твердым или жидким, фармацевтически приемлемым разбавителем или носителем. В соответствии со сказанным выше, настоящее изобретение также обеспечивает: I) Способ лечения расстройств деятельности желудочно-кишечного тракта, например, путем стимулирования подвижности желудочно-кишечной системы, дескинезии мочевого пузыря, регулирования выделения кортизол/альдостерона или улучшения памяти и запоминания у лица, нуждающегося в таком лечении, предусматривающий введение указанному лицу эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Далее, было обнаружено, что соединения по изобретению обладают антисеротонинзргическим действием, специфично действующим на рецепторы б-НТд, как было продемонстрировано на стандартных экспериментальных моделях, например, следующим образом: выделенная из организма морской свинки продольная мускулатура ободочной кишки с прилегающим к ней сплетением мышечного слоя является хорошо испытанной моделью, позволяющей проводить исследования механизма действия нейротрансмиттеров (медиаторов). - Методика. Морских свинок (мужских особей весом 200-400 г) забивали ударом по голове и обескровливали. Длина удаляемого тонкого ки шечника составляеет примерно 2 см от илео-цекального клапана. Кусочек ободочной кишки растягивают поверх стеклянной палочки и осторожно удаляют мезентерий. Слой продольной мускулатуры о тде ляют и снимают с нижележащего слоя кольцевой мускулатуры тангенциальными движениями в сторону от мезентериального присоединения (т.е. от брыжейки). Участки продольной мускула туры длиной 4-5 см помещают в 10 мл бани для ор га но в, содержа щей раствор Tyrode при 37° и продувают 5% углекислого газа в кислороде. Раствор Tyrode содержит следующие концентрации веществ, моль/л: NaCI 137,0; CaCI2 1,8; КС І 2,7; MgCI 1,05 ; NaHCO3 11,9; NaHPCu 0,4; глюкоза 5,6; и метизергид 0,1 M. Участки кишки поддерживали под постоянным натяжением усилия 500 мг. Сокращения записывали с помощью изотонического качающегося рычага. После уравно веши вания в течение 30 мин применяли заданные концентрации карбахола через 10-минутные интервалы, пока не достигалась постоянная реакция. Получение кривой зависимости концентрации и реакции. Кривую реакции на некумулятивн ую концентрация для 5-НТ устанавливают путем добавления возрастающих концентраций агониста к бане органа в интервалы по меньшей мере 15 мин. Предыдущие эксперименты показали, что такие интервалы были достаточно длинными, чтобы избежать тахифилаксиса. Каждую концентрацию оставляют контактировать с тканью в течение 1 мин. Каждый участок кишки используется' только однажды для записи двух кривых реакции от концентрации: первая - только для одного 5НТ, и вторая - для 5-НТ в присутствии установленной концентрации антагониста, причем каждый участок служил таким образом своим собственным контролем. Антагонистам позволяют предварительно уравновеситься в течение по меньшей мере 10 мин перед добавлением 5-НТ. Концентрации, выражаемые в процентах от максимальной реакции на 5-НТ, которые были получены от нескольких препаратов, отмечали как средние значения, чтобы получить логарифмические кривые зависимости реакции от концентрации. Константы ингибирования выражают в виде значений рА2, которые определяют графически по традиционным методам (Arunlakshana и др.,159 , McRa y,1978). В этом эксперименте 5-НТ проявляет зависимое от концентрации контрактильное действие. 5-НТ вызывает это основное сократительное действие в мускулатуре продольных мышц участка ободочной кишки морской свинки путем высвобождения субстанции Р из нервных окончаний в этой ткани. Это действие передает двумя различными рецепторами 5-НТ. При низких концентрациях 5-НТ активирует нейронный рецептор, который вызывает высвобождение субстанции Р. Освобожденная субстанция Р активирует нейронные рецепторы субстанции Р, и это вызывает высвобождение ацетилхолина, который затем активирует мускариновые рецепторы, размещенные на клетках гладкой мускулатуры, и вызывает их сокращение. При более высоких концентрациях 5-НТ активир ует второй нейронный рецеп 10 27325 тор, что приводит к высвобождению субстанции Р для активирования рецепторов субстанции Р на клетка х гла дкой м уск ула туры , взы вая при этом сокращение. Соединения по изобретению действуют главным образом на блокирование рецепторов высокой аффинности к б-НТд. ингибир уя при этом вызываемое 5-НТ сокращение, например, при концентрация х примерно от КГ 8 до 10 моль/л. Эти соединения проявляют менее антагонистическую активность к рецепторным сайтам низкой аффинности к 5-НТз. Соединения по изобретению поэтому являются полезными для лечения расстройств подвижности желудочно-кишечного тракта, таких как тахигастрия, затрудненная эвакуация желудка вследствие та хигастрии, синдром острого живота, кишечные спазмы, судороги, запор вследствие повышенного тонуса толстого кишечника, болезнь желудочно-кишечного рефлекса и дискинезия желчной системы. Соединения по изобретению также ингибируют образование эрозий желудка, вызываемых некротизирующими агентами, как было продемонстрировано стандартными экспериментами, например, с использованием крыс с вызванными этанолом повреждениями желудка. Эти эксперименты проводили на мужских особях крыс массой 200-250 г, которых не кормили в ночь, но имевших свободный доступ к воде. Испытываемое вещество вводили подкожно или орально через металлическую желудочную тр убку. Абсолютный спирт задавали орально через 30 мин после введения испытываемого вещества и животных забивали часом позже. Желудок раскрывали разрезом по большой кривизне и прикалывали в плоском виде. Геморрагические эрозии оценивали двояко: по площади и длине эрозий. При подкожном введении соединения по изобретению в качестве испытываемого вещества, при дозе примерно от 0,1 |іг/кг до 10 мг/кг, наблюдается существенное ингибирование желудочных повреждений, вызываемых этанолом, по сравнению с результатами, полученными с контрольной группой, которая получала плацебо вместо испытываемого вещества. Соединения по изобретению, соответственно., показаны для использования при лечении или профилактике желудочно-кишечных расстройств, таких как язва желудка и двенадцатиперстной кишки. Соединения по изобретению далее показаны для лечения диареи, воспалительных заболеваний желудка и кишечника, например гастрита, дуоденита, включая воспалительные заболевания кишечника, тошноту и рвоту. Далее, они также показаны для лечения аритмии, тахикардии, дискинезии мочевого пузыря, например недержания мочи, для снижения частоты приступов или для смягчения стрессовых реакций. Для вышеуказанных применений требуемая дозировка, конечно, будет изменяться в зависимости от пути введения, конкретного состояния подлежащего лечению и требуемого эффекта. Как показано, дневная доза находится в предела х примерно о т 5 цг до 5 мг для паренте рального применения и порядка примерно 0,1100 мг для орального применения, предпочтительно вводимая однажды или в разделенных дозировках 2-4 раза Б день, или в формах замедленного высвобождения лекарства. Единичные дозы для орального введения соответственно включают примерно 0,025-50 мг соединения по изобретению, смешанного с соответствующим твердым или жидким фармацевтически приемлемым разбавителем или носителем активного ингредиента. В соответствии с вышеизложенным настоящее изобретение также обеспечивает: II) Способ лечения любых из выше упомя нутых расстройств или состояний у лица, которое нуждается в таком лечении, предусматривающий введение указанному лицу эффек тивного коли чества соединения по изобретению или его фар мацевтически приемлемой соли Далее, было обнаружено, что соединения по изобретению обладают антагонистическим действием на центральные 5НТ-1С рецепторы. Соединения по изобретению обладают потенциальной связывающей аффинностью к центральным 5НТ-1С рецепторам, как например было измерено согласно методике, раскрытой Хойером и др. (Hoyer, Eur. J. Pharmacol. 118, 13-23 (1985)). Соединения по изобретению являются ан тагонистами пониженной активности (hypolocomotion), что вызывается у крыс введе нием м-хлорфенил-липеразина (мСРР), по мето дике Кеннета и Курзона (Kennet и Curson Br J. Pharmacol., 94, 137-147 (1988)). В этом экспери менте соединения по изобретению противо действовали вызываемому мСРР эффекту после введения их в дозах примерно от 0,1 до 30 мг/кг живого веса. Соединения по изобретению поэтому полезны для профилактического лечения мигрени или для лечения психиатрических заболеваний, например возбуждения, навязчивых идей, приступов страха, депрессии, булимии (обжорства), шизофрении, ситуаций с повышенным внутричерепным давлением и приапизма. Для вышеупомянутых применений требуемая доза будет, конечно, отличаться в зависимости от пути введения, конкретного состояния больного и требуемого эффекта Показанная дневная доза находится в пределах примерно от 0,5 до 300 мг, предпочтительно применяемая одноразово или в разделенных на 2-4 приема в день дозировках, или в форме медленного высвобождения лекарства. В соответствии с вышеизложенным, настоящее изобретение также обеспечивает: III) Способ профилактического лечения мигрени или лечения психиатрических расст ройств у лица, нуждающегося в таком лечении, предусматривающий введение указанному
ДивитисяДодаткова інформація
Назва патенту англійськоюAminoguanidine, having stimulant action on gastro-intestinal mobile, antiserotonergic action on 5-ht1 receptors, antagonistic action on 5-nt1d receptors, in free form or in form of salt
Автори англійськоюGiger Rudolf Karl Andreas, Mattes Henri
Назва патенту російськоюАминогуанидин, имеющий стимулирующее действие на гастроинтестинальную подвижность, антисеротонинергическое действие на 5-нт1 рецепторы, антагонистическое действие на 5-нт1д рецепторы, в свободной форме или в форме соли
Автори російськоюГигер Рудольф Карл Андреас, Матт Анри
МПК / Мітки
МПК: A61K 31/403, A61P 1/04, A61K 31/404, C07D 471/04, A61K 31/40, C07D 209/14, C07D 333/58, C07F 7/08, A61P 1/00, C07D 403/12, C07F 9/572, C07D 417/12, C07D 409/12, A61K 31/435
Мітки: аміногуанідин, вільний, гастроінтестинальну, антагоністичну, рухомість, солі, дію, форми, 5-нт1д, має, 5-нт1, антисеротонінергічну, стимулюючу, рецептори
Код посилання
<a href="https://ua.patents.su/17-27325-aminoguanidin-shho-maeh-stimulyuyuchu-diyu-na-gastrointestinalnu-rukhomist-antiserotoninergichnu-diyu-na-5-nt1-receptori-antagonistichnu-diyu-na-5-nt1d-receptori-v-vilnijj-formi-ab.html" target="_blank" rel="follow" title="База патентів України">Аміногуанідин, що має стимулюючу дію на гастроінтестинальну рухомість, антисеротонінергічну дію на 5-нт1 рецептори, антагоністичну дію на 5-нт1д рецептори, в вільній формі або в формі солі</a>
Попередній патент: Спосіб струминного закріплення слабких гірських порід
Наступний патент: Пігментна композиція, концентрат диспергованого неорганічного пігменту
Випадковий патент: Офтальмологічна композиція з високою концентрацією олопатадину