Аналоги камптотецину, спосіб їх отримання (варіанти) і фармацевтична композиція
Номер патенту: 57757
Опубліковано: 15.07.2003
Автори: АРНЕТТ Джеррі, ЛАНКО Крістоф, РОЛЛАН Ален, ЛІБЕРАТОР Анн-Марі, ЛАВЕРНЬ Олів'є, БІГГ Денніс
Формула / Реферат
1. Аналог камптотецину, який відрізняється тим, що гідроксилактон камптотецину замінений на ![]() -гідроксилактон, захищений легковідщеплюваною групою або відповідною
-гідроксилактон, захищений легковідщеплюваною групою або відповідною ![]() -гідроксикислотою, що утворилася внаслідок розмикання цього лактону.
-гідроксикислотою, що утворилася внаслідок розмикання цього лактону.
2. Сполука, яка відрізняється тим, що вищезгадана сполука є сполукою формули (І) або формули (II)
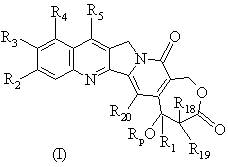
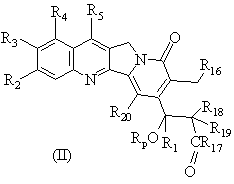
у рацемічній або енантіомерній формі або будь-якій комбінації цих форм, де
R1 - це нижчий алкіл, нижчий алкеніл, нижчий алкініл, нижчий галоалкіл, нижчий алкокси нижчий алкіл або нижчий алкілтіо нижчий алкіл;
R2, R3 і R4 - це, незалежно, Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкеніл, ціано, нижчий ціаноалкіл, нітро, нижчий нітроалкіл, амідо, нижчий амідоалкіл, гідразино, нижчий гідразиноалкіл, азидо, нижчий азидоалкіл, (СН2)mNR6R7, (СН2)mOR6, (СН2)mSR6, (СН2)mСO2R6, (СН2)mNR6C(O)R8, (СН2)mC(O)R8, (СН2)mOC(O)R8, O(СН2)mNR6R7, ОС(O)NR6R7, ОС(O)(СН2)mСO2R6 або (CH2)n[N=X], OC(O)[N=X], (СН2)mOC(O)[N=X] (де [N=X] - це гетероциклічна група від 4 до 7 членів з атомом азоту N, який є членом гетероциклічної групи, і Х це інші члени, які необхідні для утворення гетероциклічної групи, вибрані з групи, що складається з О, S, CH2, СН, N, NR9 і COR10), арил або нижчий арилалкіл заміщений (тобто заміщений 1-4 рази на арильну групу або гетероцикл) або незаміщений, в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл або R3 і R4 утворюють разом ланцюг з 3 або 4 членами, у якому елементи ланцюга вибрані з групи, що складається з СН, CH2, О, S, N або NR9;
R5 - це Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкокси, нижчий алкокси нижчий алкіл, нижчий алкілтіо нижчий алкіл, циклоалкіл, циклоалкіл нижчий алкіл, ціано, ціаноалкіл, нижчий алкіл нижчий сульфонілалкіл, нижчий гідроксіалкіл, нітро, (СН2)mC(O)R8, (СН2)mNR6C(O)R8, (СН2)mNR6R7, (СН2)mN(СН3)(СН2)nNR6R7, (СН2)mOC(O)R8, (СН2)mOC(O)NR6R7, (СН2)mS(O)qR11, (СН2)mP(O)R12R13, (СН2)2P(S)R12R13 або (CH2)n[N=X], OC(О)[N=X], (СН2)mOC(O)[N=X], заміщений або незаміщений арил або нижчий алкіл арил (тобто заміщений 1-4 рази на арил або гетероарильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл;
R6 і R7 - це, незалежно, Н, нижчий алкіл, нижчий гідроксіалкіл, нижчий алкіл нижчий аміноалкіл, нижчий аміноалкіл, циклоалкіл, циклоалкіл нижчий алкіл, нижчий алкеніл, нижчий алкокси нижчий алкіл, нижчий галоалкіл або заміщений, або незаміщений арил або нижчий арилалкіл (тобто, заміщений 1-4 рази на арильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл;
R8 - це Н, нижчий алкіл, нижчий гідроксіалкіл, аміно, нижчий алкіламіно, нижчий алкіл нижчий аміноалкіл, нижчий аміноалкіл, циклоалкіл, циклоалкіл нижчий алкіл, нижчий алкеніл, нижчий алкокси, нижчий алкокси нижчий алкіл, нижчий галоалкіл або заміщений, або незаміщений арил або нижчий арилалкіл (тобто, заміщений 1-4 рази на арильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл;
R9 - це Н, нижчий алкіл, нижчий галоалкіл, арил або арил заміщений однією або кількома групами, вибраними з наступних радикалів: нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл;
R10 - це Н, нижчий алкіл, нижчий галоалкіл, нижчий алкокси, арил або арил заміщений (тобто, такий, що має 1-4 замісники на арильну групу) однією або кількома групами, вибраними з наступних радикалів: нижчий алкіл, нижчий галоалкіл, нижчий гідроксіалкіл або нижчий алкокси нижчий алкіл;
R11 - це нижчий алкіл, арил, (СН2)mOR14, (СН2)mSR14, (CH2)2NR14R15 або (СН2)m[N=X];
R12 та R13 - це, незалежно, нижчий алкіл, арил, нижчий алкокси, арилокси або аміно;
R14 та R15 - це, незалежно, Н, нижчий алкіл або арил;
R16 - це Н або ОR21;
R17 - це OR6 або NR6R7;
R18 і R19 - це, незалежно, Н, гало, нижчий алкіл, нижчий алкокси або гідрокси;
R20 - це Н або гало;
R21 - це Н, нижчий алкіл, СНО або С(O)(СН2)mСН3;
Rp - це Н або легкорозщеплювана група, краще, якщо вибрана з груп, що відповідають формулі -C(O)-A-NR22R23, в якій А це лінійний або розгалужений радикал алкілену, за бажанням заміщений на радикал, вибраний з вільних, естерифікованих або сполучених з атомом металу гідрокси, галогену, вільних, естерифікованих або сполучених з атомом металу карбокси, аміно, моно або діалкіламіно радикалів, в той час як R22 та R23, незалежно, - це Н, нижчий алкіл, нижчий гідроксіалкіл, нижчий алкіл нижчий аміноалкіл, нижчий аміноалкіл, циклоалкіл, циклоалкіл нижчий алкіл, нижчий алкеніл, нижчий алкокси нижчий алкіл, нижчий галоалкіл або заміщений або незаміщений арил або нижчий арилалкіл (тобто, заміщений 1-4 рази на арильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий гідроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, або R22 і R23 разом утворюють кільце з 5, 6, 7 членами, за бажанням заміщеними, за бажанням містять інший гетероатом, який вибраний з О, N, S;
m є цілим числом від 0 до 6;
n є 1 або 2; і
q - це ціле число від 0 до 2; і
[N=X] це гетероциклічна група з 4-7 членами, Х - це ланцюг, необхідний для утворення вищезгаданої гетероциклічної групи і вибраний з групи, що складається з О, S, СН2, СН, N, NR9 і COR10;
є зрозумілим те, що якщо Rp - це атом водню, R3 і R4 разом утворюють ланцюг з 3 або 4 членами;
або її фармацевтично прийнятна сіль.
3. Сполука за п. 2, яка відрізняється тим, що R1 - це етильна група; або її фармацевтично прийнятна сіль.
4. Сполука за п. 2, яка відрізняється тим, що R5 - це Н, нижчий алкіл або (СН2)mNR6R7, або (СН2)n[N=X], незаміщений або заміщений нижчим алкілом; або її фармацевтично прийнятна сіль.
5. Сполука за п. 2, яка відрізняється тим, що R3 і R4 утворюють, за бажанням, заміщене оксазинове кільце;
або її фармацевтично прийнятна сіль.
6. Сполука за п. 2, яка відрізняється тим, що Rp є легковідщеплюваною групою;
або її фармацевтично прийнятна сіль.
7. Сполука за п. 6, яка відрізняється тим, що Rp - це C(O)-(A1)-N-R22-R23-група, у якій A1 - це CH2m або розгалужений нижчий радикал алкілену і m - це ціле числом між 0 і 6;
або її фармацевтично прийнятна сіль.
8. Сполука за п. 5, яка відрізняється тим, що вищезгадана сполука вибрана зі сполук, що відповідають наступним формулам:
1,8-діетил-8,9-дигідро-8-гідрокси-2H,10H,12H-[1,3]оксазин[5,6-f]оксепін [3',4':6,7]індолізин [1,2-b]хінолін-10,13 (15Н)-діон;
8-етил-8,9-дигідро-8-гідрокси-1-метил-2H,10Н,12H-[1,3]оксазин[5,6-f]оксепін[3',4':6,7]індолізин[1,2-b]хінолін-10,13 (15H)-діон;
8-етил-8,9-дигідро-8-гідрокси-1-бензил-2Н,10H,12H-[1,3]оксазин[5,6-f]оксепін[3',4':6,7]індолізин[1,2-b]хінолін-10,13 (15Н)-діон;
8-етил-8,9-дигідро-4-фтор-8-гідрокси-1-бензил-2Н,10Н,12H-[1,3]оксазин[5,6-f]оксепін[3',4':6,7]індолізин[1,2-b]хінолін-10,13 (15Н)-діон;
або її фармацевтично прийнятна сіль.
9. Сполука за п. 6, яка відрізняється тим, що вищезгадана сполука вибрана зі сполук, що відповідають наступним формулам:
5-етил-9,10-дифтор-4,5-дигідро-5-(2-аміно-1-оксоетоксі)1H-оксепін[3',4':6,7]індолізин[1,2-b]хінолін-3,15(4H,13H)-діон;
5-етил-9,10-дифтор-4,5-дигідро-5-(2-аміно-1-оксопропоксі)-1H-оксепін-[3',4':6,7]індолізин[1,2-b]хінолін-3,15 (4Н,13Н)-діон;
або її фармацевтично прийнятна сіль.
10. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятна сіль, яка відрізняється тим, що використовується як ліки.
11. Фармацевтична композиція, яка відрізняється тим, що містить як активний інгредієнт принаймні одну зі сполук за будь-яким з пп. 1-9.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що використовується як протипухлинні ліки.
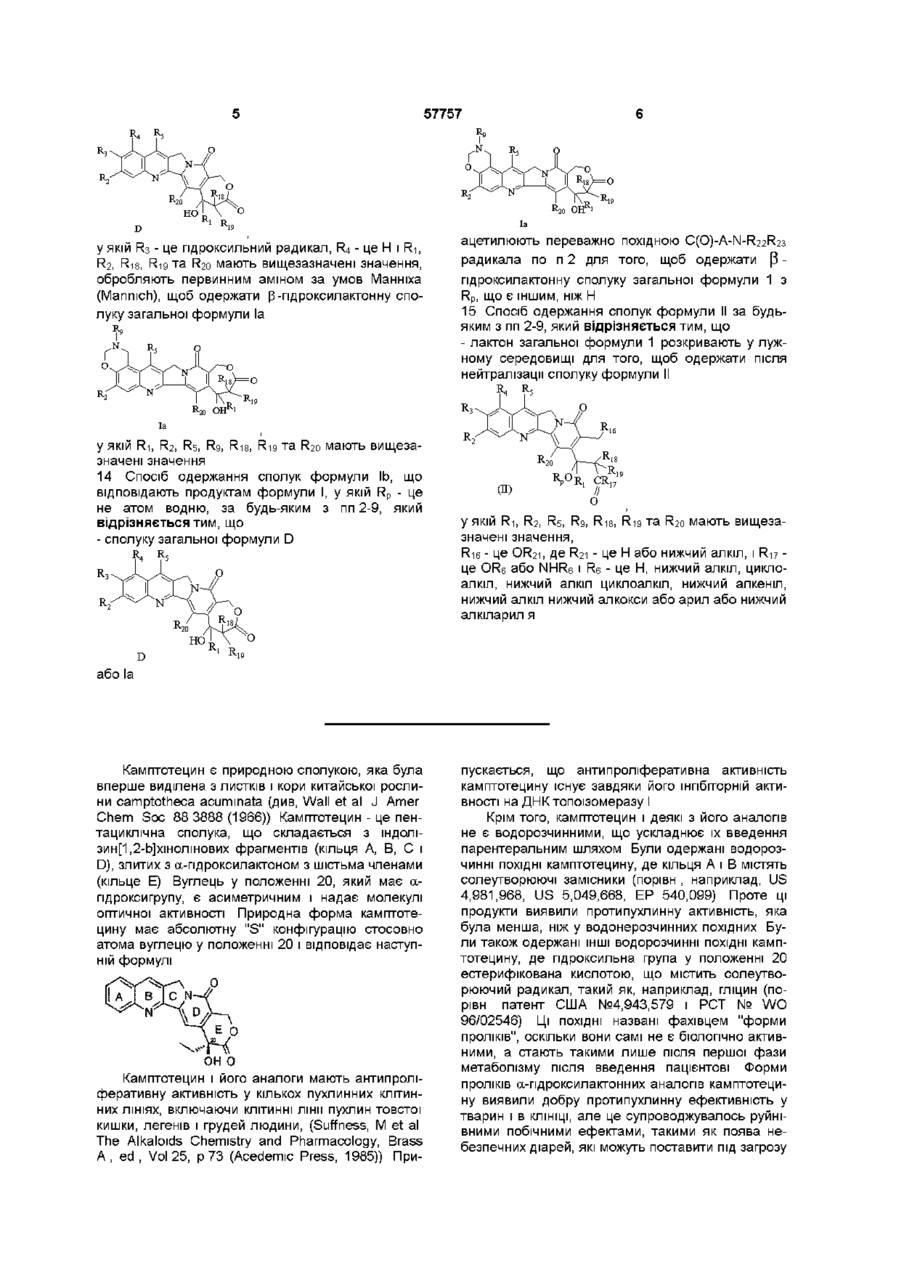
13. Спосіб одержання сполук формули Іа, що відповідають продуктам формули І, у якій R3 і R4 утворюють оксазинове кільце за будь-яким з пп. 2, 5 або 8, який відрізняється тим, що:
- ![]() -гідроксилактонну сполуку загальної формули D
-гідроксилактонну сполуку загальної формули D
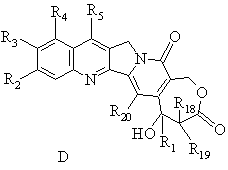 ,
,
у якій R3 - це гідроксильний радикал, R4 - це H і R1, R2, R18, R19 та R20 мають вищезазначені значення, обробляють первинним аміном за умов Манніха (Mannich), щоб одержати ![]() -гідроксилактонну сполуку загальної формули Іа
-гідроксилактонну сполуку загальної формули Іа
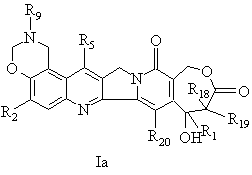 ,
,
у якій R1, R2, R5, R9, R18, R19 та R20 мають вищезазначені значення.
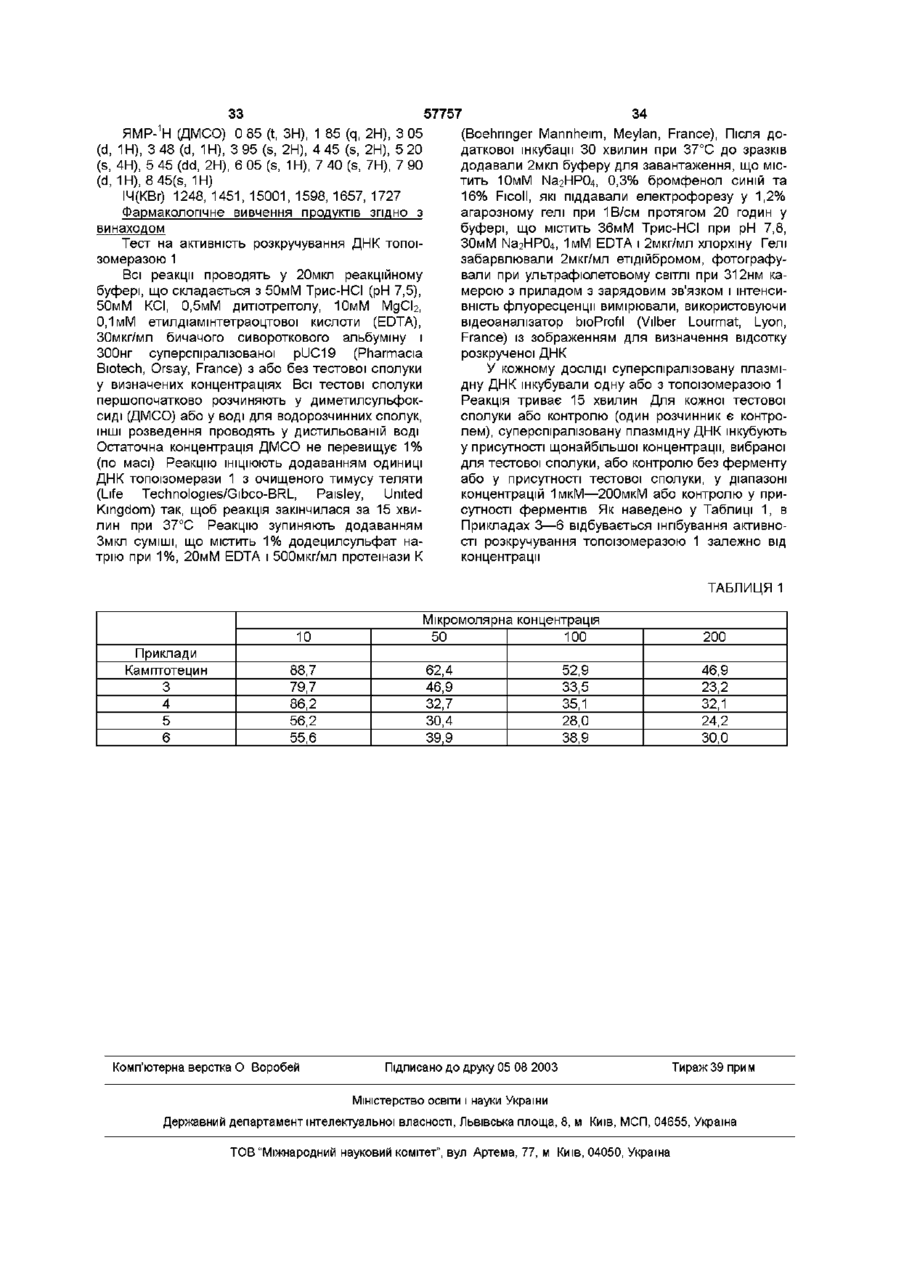
14. Спосіб одержання сполук формули Іb, що відповідають продуктам формули І, у якій Rp - це не атом водню, за будь-яким з пп. 2-9, який відрізняється тим, що:
- сполуку загальної формули D

або Іа

ацетилюють переважно похідною C(O)-A-N-R22R23 радикала по п. 2 для того, щоб одержати ![]() -гідроксилактонну сполуку загальної формули 1 з Rp, що є іншим, ніж Н.
-гідроксилактонну сполуку загальної формули 1 з Rp, що є іншим, ніж Н.
15. Спосіб одержання сполук формули II за будь-яким з пп. 2-9, який відрізняється тим, що:
- лактон загальної формули 1 розкривають у лужному середовищі для того, щоб одержати після нейтралізації сполуку формули II
 ,
,
у якій R1, R2, R5, R9, R18, R19 та R20 мають вищезазначені значення;
R16 - це OR21, де R21 - це Н або нижчий алкіл; і R17 - це OR6 або NHR6 і R6 - це Н, нижчий алкіл, циклоалкіл, нижчий алкіл циклоалкіл, нижчий алкеніл, нижчий алкіл нижчий алкокси або арил або нижчий алкіларил.я
Текст
1 Аналог камптотецину, який відрізняється тим, що пдроксилактон камптотецину замінений на Р-пдроксилактон, захищений легковідщеплюваною групою або ВІДПОВІДНОЮ р пдроксикислотою, що утворилася внаслідок розмикання цього лактону 2 Сполука, яка відрізняється тим, що вищезгадана сполука є сполукою формули (І) або формули (II) R, R, о (її) у рацемічній або енантюмерній формі або будьякій комбінації цих форм, де Ri - це нижчий алкіл, нижчий алкеніл, нижчий алкі ніл, нижчий галоалкіл, нижчий алкокси нижчий алкіл або нижчий алкілтю нижчий алкіл, R2, R3 і R4 - це, незалежно, Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкеніл, ціано, нижчий ціаноалкіл, нітро, нижчий нітроалкіл, амідо, нижчий амідоалкіл, пдразино, нижчий пдразиноалкіл, азидо, нижчий азидоалкіл, (CH2)mNR6R7, (CH2)mOR6, (CH2)mSR6, (CH2)rnCO2R6, (CH2)mNR6C(O)R8, (CH2)mC(O)R8, (CH2)mOC(O)R8, O(CH2)mNR6R7, OC(O)NR6R7, OC(O)(CH2)mCO2R6 або (CH2)n[N=X], OC(O)[N=X], (CH2)mOC(O)[N=X] (де [N=X] - це гетероциклічна група від 4 до 7 членів з атомом азоту N, який є членом гетероциклічної групи, і X це ІНШІ члени, які необхідні для утворення гетероциклічної групи, вибрані з групи, що складається з О, S, СН2, СН, N, NRg і CORio), арил або нижчий арилалкіл заміщений (тобто заміщений 1-4 рази на арильну групу або гетероцикл) або незаміщений, в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламшо, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл або R3 і R4 утворюють разом ланцюг з 3 або 4 членами, у якому елементи ланцюга вибрані з групи, що складається з СН, СН2, О, S, N або NRg, R5 - це Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкокси, нижчий алкокси нижчий алкіл, нижчий алкілтю нижчий алкіл, циклоалкіл, циклоалкіл нижчий алкіл, ціано, ціаноалкіл, нижчий алкіл нижчий сульфонілалкіл, нижчий пдроксіалкіл, нітро, (CH2)mC(O)R8, (CH2)mNR6C(O)R8, (CH2)mNR6R7, (CH2)mN(CH3)(CH2)nNR6R7, (CH2)mOC(O)R8, (CH2)mOC(O)NR6R7, (CH2)mS(O)qRn, (CH2)mP(O)R12R13, (CH2)2P(S)R12R13 або (CH2)n[N=X], OC(O)[N=X], (CH2)mOC(O)[N=X], заміщений або незаміщений арил або нижчий алкіл арил (тобто заміщений 1-4 рази на арил або гетероарильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, R6 і R7 - це, незалежно, Н, нижчий алкіл, нижчий пдроксіалкіл, нижчий алкіл нижчий аміноалкіл, нижчий аміноалкіл, циклоалкіл, циклоалкіл нижчий алкіл, нижчий алкеніл, нижчий алкокси нижчий алкіл, нижчий галоалкіл або заміщений, або незаміщений арил або нижчий арилалкіл (тобто, заміщений 1-4 рази на арильну групу), в якому заміс О і ю ю 57757 ником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламшо, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, Rs - це Н, нижчий алкіл, нижчий пдроксіалкіл, аміно, нижчий алкіламшо, нижчий алкіл нижчий аміноалкіл, нижчий аміноалкіл, циклоалкіл, циклоалкіл нижчий алкіл, нижчий алкеніл, нижчий алкокси, нижчий алкокси нижчий алкіл, нижчий галоалкіл або заміщений, або незаміщений арил або нижчий арилалкіл (тобто, заміщений 1-4 рази на арильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламшо, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, Rg - це Н, нижчий алкіл, нижчий галоалкіл, арил або арил заміщений однією або кількома групами, вибраними з наступних радикалів нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, R-іо - це Н, нижчий алкіл, нижчий галоалкіл, нижчий алкокси, арил або арил заміщений (тобто, такий, що має 1-4 замісники на арильну групу) однією або кількома групами, вибраними з наступних радикалів нижчий алкіл, нижчий галоалкіл, нижчий пдроксіалкіл або нижчий алкокси нижчий алкіл, Rn - це нижчий алкіл, арил, (CH2)mORi4, (CH2)mSR14, (CH 2 ) 2 NR 14 Ri 5 або (CH2)m[N=X], R-I2 та R-із - це, незалежно, нижчий алкіл, арил, нижчий алкокси, арилокси або аміно, RM та R-I5 - це, незалежно, Н, нижчий алкіл або арил, R-іб - це Н або OR 2 i, R17 - це OR6 або NR 6 RT, R-I8 і Rig - це, незалежно, Н, гало, нижчий алкіл, нижчий алкокси або гідрокси, R2o - це Н або гало, R2i - це Н, нижчий алкіл, СНО або С(О)(СН 2 ) т СН 3 , Rp - це Н або легкорозщеплювана група, краще, якщо вибрана з груп, що відповідають формулі C(O)-A-NR22R23, в якій А це ЛІНІЙНИЙ або розгалужений радикал алкілену, за бажанням заміщений на радикал, вибраний з вільних, естерифікованих або сполучених з атомом металу гідрокси, галогену, вільних, естерифікованих або сполучених з атомом металу карбокси, аміно, моно або діалкіламшо радикалів, в той час як R22 та R23, незалежно, - це Н, нижчий алкіл, нижчий пдроксіалкіл, нижчий алкіл нижчий аміноалкіл, нижчий аміноалкіл, циклоалкіл, циклоалкіл нижчий алкіл, нижчий алкеніл, нижчий алкокси нижчий алкіл, нижчий галоалкіл або заміщений або незаміщений арил або нижчий арилалкіл (тобто, заміщений 1-4 рази на арильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, або R22 і R23 разом утворюють кільце з 5, 6, 7 членами, за бажанням заміщеними, за бажанням містять інший гетероатом, який вибраний з О, N, S, m є цілим числом від 0 до 6, п є 1 або 2, і q - це ціле число від 0 до 2, і [N=X] це гетероциклічна група з 4-7 членами, X це ланцюг, необхідний для утворення вищезгада ної гетероциклічної групи і вибраний з групи, що складається з О, S, СН2, СН, N, NR91 CORio, є зрозумілим те, що якщо Rp - це атом водню, R3 і R4 разом утворюють ланцюг з 3 або 4 членами, або и фармацевтично прийнятна сіль 3 Сполука за п 2, яка відрізняється тим, що Ri це етильна група, або її фармацевтично прийнятна сіль 4 Сполука за п 2, яка відрізняється тим, що Rs це Н, нижчий алкіл або (CH2)mNR6R7, або (CH2)n[N=X], незаміщений або заміщений нижчим алкілом, або її фармацевтично прийнятна сіль 5 Сполука за п 2, яка відрізняється тим, що R3 і R4 утворюють, за бажанням, заміщене оксазинове кільце, або и фармацевтично прийнятна сіль 6 Сполука за п 2, яка відрізняється тим, що Rp є легковідщеплюваною групою, або и фармацевтично прийнятна сіль 7 Сполука за п 6, яка відрізняється тим, що Rp це C(O)-(Ai)-N-R22-R23-rpyna, у якій Аі - це С Н 2 т або розгалужений нижчий радикал алкілену і т це ціле числом між 0 і 6, або и фармацевтично прийнятна сіль 8 Сполука за п 5, яка відрізняється тим, що вищезгадана сполука вибрана зі сполук, що відповідають наступним формулам 1,8-діетил-8,9-дипдро-8-пдрокси-2Н,10Н,12Н[1,3]оксазин[5,6-1]оксепш [3і,4' 6,7] ІНДОЛІЗИН [1,2Ь]хшолш-10,13 (15Н)-дюн, 8-етил-8,9-дипдро-8-пдрокси-1-метил-2Н,10Н,12Н[1,3]оксазин[5,6-1]оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2 Ь]хшолш-10,13 (15Н)-дюн, 8-етил-8,9-дипдро-8-пдрокси-1-бензил2Н,10Н,12Н-[1,3]оксазин[5,61]оксепш[3',4' 6,7]шдолізин[1,2-Ь]хшолш-10,13 (15Н)-дюн, 8-етил-8,9-дипдро-4-фтор-8-пдрокси-1-бензил2Н,10Н,12Н-[1,3]оксазин[5,61]оксепш[3',4' 6,7]шдолізин[1,2-Ь]хшолш-10,13 (15Н)-дюн, або и фармацевтично прийнятна сіль 9 Сполука за п 6, яка відрізняється тим, що вищезгадана сполука вибрана зі сполук, що відповідають наступним формулам 5-етил-9,10-дифтор-4,5-дипдро-5-(2-амшо-1оксоетоксі)1 Н-оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2Ь]хшолш-3,15(4Н,13Н)-дюн, 5-етил-9,10-дифтор-4,5-дипдро-5-(2-амшо-1оксопропоксі)-1 Н-оксепш-[3',4' 6,7]шдолізин[1,2Ь]хшолш-3,15 (4Н,13Н)-дюн, або и фармацевтично прийнятна сіль 10 Сполука за будь-яким з попередніх пунктів або и фармацевтично прийнятна сіль, яка відрізняється тим, що використовується як ліки 11 Фармацевтична композиція, яка відрізняється тим, що містить як активний інгредієнт принаймні одну зі сполук за будь-яким з пп 1-9 12 Фармацевтична композиція за п 11, яка відрізняється тим, що використовується як протипухлинні ЛІКИ 13 Спосіб одержання сполук формули Іа, що відповідають продуктам формули І, у якій R3 і R4 утворюють оксазинове кільце за будь-яким з пп 2, 5 або 8, який відрізняється тим, що - р-пдроксилактонну сполуку загальної формули D 57757 у якій F 3 - це гідроксильний радикал, R4 - це Н і Ri, ? R2, R18, R19 та R20 мають вищезазначені значення, обробляють первинним аміном за умов Манніха (Manmch), щоб одержати р-пдроксилактонну сполуку загальної формули Іа у якій R-і, R2, R5, R9, Ri8, R19 та R20 мають вищезазначені значення 14 Спосіб одержання сполук формули ІЬ, що відповідають продуктам формули І, у якій Rp - це не атом водню, за будь-яким з пп 2-9, який відрізняється тим, що - сполуку загальної формули D ,0 ацетилюють переважно похідною C(O)-A-N-R22R23 радикала по п 2 для того, щоб одержати р пдроксилактонну сполуку загальної формули 1 з Rp, що є іншим, ніж Н 15 Спосіб одержання сполук формули II за будьяким з пп 2-9, який відрізняється тим, що - лактон загальної формули 1 розкривають у лужному середовищі для того, щоб одержати після нейтралізації сполуку формули II R. R, (П) та R20 мають вищезау якій R-і, R2, R5, значені значення, R-іб - це OR21, де R21 - це Н або нижчий алкіл, і R^ це 0R6 або NHR6 і R6 - це Н, нижчий алкіл, циклоалкіл, нижчий алкіл циклоалкіл, нижчий алкеніл, нижчий алкіл нижчий алкокси або арил або нижчий алкіларил я або Іа Камптотецин є природною сполукою, яка була вперше виділена з листків і кори китайської рослини camptotheca acummata (див, Wall et al J Amer Chem Soc 88 3888(1966)) Камптотецин - це пентациклічна сполука, що складається з індоліЗИН[1,2-Ь]ХІНОЛІНОВИХ фрагментів (кільця А, В, С і D), злитих з а-пдроксилактоном з шістьма членами (кільце Е) Вуглець у положенні 20, який має апдроксигрупу, є асиметричним і надає молекулі оптичної активності Природна форма камптотецину має абсолютну "S" конфігурацію стосовно атома вуглецю у положенні 20 і відповідає наступній формулі ,0 ЕО ОН О Камптотецин і його аналоги мають антипроліферативну активність у кількох пухлинних клітинних ЛІНІЯХ, включаючи КЛІТИННІ ЛІНІЇ пухлин товстої кишки, легенів і грудей людини, (Suffness, M et al The Alkaloids Chemistry and Pharmacology, Brass A , ed , Vol 25, p 73 (Acedemic Press, 1985)) При пускається, що антипроліферативна активність камптотецину існує завдяки його шпбіторній активності на ДНК топоізомеразу І Крім того, камптотецин і деякі з його аналогів не є водорозчинними, що ускладнює їх введення парентеральним шляхом Були одержані водорозчинні ПОХІДНІ камптотецину, де кільця А і В містять солеутворюючі замісники (порівн , наприклад, US 4,981,968, US 5,049,668, ЕР 540,099) Проте ці продукти виявили протипухлинну активність, яка була менша, ніж у водонерозчинних похідних Були також одержані ІНШІ водорозчинні ПОХІДНІ камптотецину, де гідроксильна група у положенні 20 естерифікована кислотою, що містить солеутворюючий радикал, такий як, наприклад, гліцин (порівн патент США №4,943,579 і РСТ № WO 96/02546) Ці ПОХІДНІ названі фахівцем "форми проліків", оскільки вони самі не є біологічно активними, а стають такими лише після першої фази метаболізму після введення пацієнтові Форми проліків а-пдроксилактонних аналогів камптотецину виявили добру протипухлинну ефективність у тварин і в КЛІНІЦІ, але це супроводжувалось руйнівними побічними ефектами, такими як поява небезпечних діарей, які можуть поставити під загрозу 57757 життя пацієнта Таким чином, необхідно розробляти водорозчинні аналоги камптотецину, які є більш ефективними і такими, що краще переносяться До того ж, було показано, що а-пдроксилактон являється абсолютною умовою активності камптотецинів in vivo та in vitro (Camptothecins New Anticancer Agents, Putmesil, M et al, ed , p 27 (CRC Press, 1995), Wall M et al, Cancer Res 55 753 (1995), Hertzberg et al, J Med Chem 32 715(1982) і Crow et al, J Med Chem 35 4160(1992)) Проте, Заявник виявив, що р-пдроксилактони з 7 членами мають таку ж або більшу біологічну активність, ніж у а-пдроксилактонів (не опублікована РСТ заявка № FR 96/00980) Цей винахід стосується нових похідних цього класу аналогів камптотецину, у якому р-пдроксилактон з 7 членами замінює природний а-пдроксилактон камптотецину рпдроксилактон - це лактон, який містить додатковий атом вуглецю між вуглецем карбоксилу і авуглецем, що містить гідроксил у апдроксилактоні Було вибрано два підходи, щоби вирішити проблеми, пов'язані з підвищенням водорозчинності аналогів камптотецину перший полягає у приєднанні оксазину до А кільця молекули, і другий - у створенні форм проліків ацетилюванням пдроксигрупи р-пдроксилактону Більш докладно, серед цього нового класу аналогів камптотецину сполуки згідно з цим винаходом є або аналогами, модифікованими фіксацією оксазинового кільця на атомах вуглецю 10 і 11, або формами проліків, у яких р-пдроксилактон замінює природний а-пдроксилактон камптотецину Сполуками цього винаходу є, таким чином, рпдроксилактонні аналоги камптотецину, до яких було приєднано оксазинове кільце або водорозчинні проліки, а також ті, що мають сильну біологічну активність, яка є несподіваною у СВІТЛІ ВІДОМО ГО рівня техніки Більш конкретним об'єктом винаходу є сполуки формули (І) і формули (II) І!,, (І) (II) у рацемічній або енантюмерній формі або у будь-яких комбінаціях цих форм, де Ri це нижчий алкіл, нижчий алкеніл, нижчий алкініл, нижчий галоалкіл, нижчий алкокси нижчий алкіл або нижчий алкілтю нижчий алкіл, R2, R3 і R4 це, незалежно, Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкеніл, ціано, нижчий ціаноалкіл, нітро, нижчий нітроалкіл, амідо, нижчий амідоалкіл, пдразино, нижчий пдразиноалкіл, азидо, нижчий азидоалкіл, (CH2)mNR6R7, (CH2)mOR6, (CH2)mSR6, (CH2)rnCO2R6, (CH2)mNR6C(O)R8, (CH2)mC(O)R8, (CH2)mOC(O)R8, O(CH2)mNR6R7, OC(O)NR6R7, OC(O)(CH2)mCO2R6 або (CH2)n[N=X], OC(O)[N=X], (CH2)mOC(O)[N=X] (y якому [N=X], у цьому винаході це гетероциклічна група від 4 до 7 членів з атомом азоту N, який є 8 членом гетероциклічної групи, і X - це ІНШІ члени, які необхідні для утворення гетероциклічної групи, вибраної з групи, що складається з О, S, СН2, СН, N, NRg і COR-io), арил або нижчий арилалкіл заміщений (тобто, заміщений 1-4 рази на арильну групу або гетероцикл) або незаміщений, в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламшо, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, або R2 і R3 або R3 і R4 утворюють разом ланцюг з 3 або 4 членами, у якому елементи ланцюга вибрані з групи, що складається з СН, СН2, О, S, N або NR9, R5 це Н, гало, нижчий галоалкіл, нижчий алкіл, нижчий алкокси, нижчий алкокси нижчий алкіл, нижчий алкілтю нижчий алкіл, циклоалкіл, циклоалкіл нижчий алкіл, ціано, ціаноалкіл, нижчий алкіл нижчий сульфонілалкіл, нижчий пдроксіалкіл, нітро, (CH2)mC(O)R8, (CH2)mNR6C(O)R8, (CH2)mNR6R7, (CH2)mN(CH3)(CH2)nNR6R7, (CH2)mOC(O)R8, (CH2)mOC(O)NR6R7, (CH2)mS(O)qRn, (CH2)mP(O)R12R13, (CH2)2P(S)R12R13 або (CH2)n[N=X], OC(O)[N=X], (CH2)mOC(O)[N=X], заміщений або незаміщений арил або нижчий алкіл арил (тобто, заміщений 1-4 рази на арил або гетероарильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, R6 і R7 це, незалежно, Н, нижчий алкіл, нижчий пдроксіалкіл, нижчий алкіл нижчий аміноалкіл, нижчий аміноалкіл, циклоалкіл, циклоалкіл нижчий алкіл, нижчий алкеніл, нижчий алкокси нижчий алкіл, нижчий галоалкіл, або заміщений, або незаміщений арил або нижчий арилалкіл (тобто, заміщений 1-4 рази на арильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, R8 це Н, нижчий алкіл, нижчий пдроксіалкіл, аміно, нижчий алкіламіно, нижчий алкіл нижчий аміноалкіл, нижчий аміноалкіл, циклоалкіл, циклоалкіл нижчий алкіл, нижчий алкеніл, нижчий алкокси, нижчий алкокси нижчий алкіл, нижчий галоалкіл, або заміщений, або незаміщений арил або нижчий арилалкіл (тобто, заміщений 1-4 рази на арильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, Rg це Н, нижчий алкіл, нижчий галоалкіл, арил, або арил, заміщений однією або кількома групами, вибраними з наступних радикалів нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, R-іо це Н, нижчий алкіл, нижчий галоалкіл, нижчий алкокси, арил або арил заміщений (тобто, такий, що має 1-4 замісників на арильну групу) однією або кількома групами, вибраних з наступних радикалів нижчий алкіл, нижчий галоалкіл, нижчий пдроксіалкіл або нижчий алкокси нижчий алкіл, Rn це нижчий алкіл, арил, (CH2)mORi4, (CH2)mSR14, (CH 2 ) 2 NR 14 Ri 5 або (CH2)m[N=X], R12 та R-із це, незалежно, нижчий алкіл, арил, 57757 нижчий алкокси, арилокси або аміно, RM та R-I5 це, незалежно, Н, нижчий алкіл або арил, R-іб це Н або OR21, R I T це O R 6 або NR6RT, RIS і Rig це, незалежно, Н, гало, нижчий алкіл, нижчий алкокси або гідрокси, R20 це Н або гало, R21 це Н, нижчий алкіл, СНО або C(O)CH2)mCH3, Rp це Н або легко відщеплювана група, краще, якщо вибрана з груп, що відповідають формулі C(O)-A-NR22R23, в якій А - це ЛІНІЙНИЙ або розгалужений радикал алкілену, за бажанням заміщений на радикал, вибраний з вільних, естерифікованих або сполучених з атомом металу гідрокси, галогену, вільних, естерифікованих або сполучених з атомом металу карбокси, аміно, моно або діалкіламіно радикалів, в той час як R22 та R23, незалежно, це Н, нижчий алкіл, нижчий пдроксіалкіл, нижчий алкіл нижчий аміноалкіл, нижчий аміноалкіл, циклоалкіл, циклоалкіл нижчий алкіл, нижчий алкеніл, нижчий алкокси нижчий алкіл, нижчий галоалкіл, або заміщений або незаміщений арил або нижчий арилалкіл (тобто, заміщений 1-4 рази на арильну групу), в якому замісником є нижчий алкіл, гало, нітро, аміно, нижчий алкіламіно, нижчий галоалкіл, нижчий пдроксіалкіл, нижчий алкокси або нижчий алкокси нижчий алкіл, m є цілим числом від 0 до 6, п є 1 або 2, і q це ціле число від 0 до 2, і [N=X] це гетероциклічна група з 4—7 членами, X це ланцюг, необхідний для утворення вищезгаданої гетероциклічної групи і вибраний з групи, що складається з О, S, СН2, СН, N, NR91 CORio, є зрозумілим те, що якщо Rp - це атом водню, то R3 і R4 разом утворюють ланцюг з 3 або 4 членами, або и фармацевтичне прийнятна сіль Як використано тут, термін нижчий стосовно алкілу, алкілтю і алкокси групи означає ЛІНІЙНІ або розгалужені насичені аліфатичні вуглеводневі групи, що містять 1-6 атомів вуглецю, такі як, наприклад, метил, етил, пропіл, ізопропіл, бутил, третбутил, метилтю, етилтю, метокси і етокси Стосовно алкенільних або алкінільних груп, термін нижчий означає групи, що містять 2—6 атомів вуглецю і один або кілька подвійних або потрійних зв'язків, такі як, наприклад, ВІНІЛ, аліл, ізопропеніл, пентеніл, гексаніл, етиніл, пропеніл, пропініл і бутиніл Термін циклоалкіл означає кільце з 3—7 атомів вуглецю, таке, як наприклад, циклопропіл, циклобутил, циклопентил або циклогексил Термін арил значить моно- ди- або трициклічну вуглеводневу сполуку з принаймні одним ароматичним кільцем, кожне кільце, що містить щонайбільше 7 членів, таке як, наприклад, феніл, нафтил, антрацил, біфеніл або інденіл Термін гало означає хлор, бром, йод або фтор Радикали, що відповідають виразам нижчий галоалкіл, нижчий ціаноалкіл, нижчий нітроалкіл, нижчий амідоалкіл, нижчий пдразиноалкіл, нижчий азидоалкіл, нижчий арилалкіл, нижчий пдроксіалкіл, нижчий алкокси нижчий алкіл, нижчий алкілтю нижчий алкіл і нижчий алкіл нижчий сульфонілалкіл, заміщені, ВІДПОВІДНО, 1—З 10 гало, ціано, нітро, амідо, пдразино, азидо, арилом, гідрокси, нижчим алкокси, нижчим алкілтю або нижчими сульфонілалкільними групами Нижчий алкіламіно радикал може містити одну або дві групи нижчого алкілу і являє собою, наприклад, NHCH3, NHCH2CH3, N(CH3)2 або N(CH3)(CH2CH3) Термін вільна, естерифікована, етерифікована або сполучена з металом гідрокси стосується ОН, OCOR26, OR27 груп і алкоголятів Сполуки згідно з цим винаходом мають дві можливі енантюмерні форми, тобто у "R" і "S" конфігураціях Цей винахід включає дві енантюмерні форми і будь-яку комбінацію цих форм, включаючи "RS" рацемічні суміші Заради спрощення, якщо не вказано жодної конфігурації у структурних формулах, треба вважати, що присутні дві енантіомерні форми і їх суміші Стосовно форм проліків винаходу (тих, для яких Rp не є атомом водню), перевагу надають сполукам загальної формули І Приклади заміщених камптотецинів, використаних як початкові продукти, можна знайти у патентах США №4473692, 4604463, 4894956, 5162532, 5395939, 5315007, 5264579, 5258516, 5254690, 5212317 і 5341745, РСТ патентних заявках №US91 /08028, US94/06451, US90/05172, US92/04611, US93/10987, US91/09598, ЕР94/03058 і ЕР95/00393 та Європейських патентних заявках №325247, 495432, 321122 і 540099 Для сполук, що складаються з оксазинового кільця Р-пдроксилактонну сполуку загальної формули D D де R3 - це гідроксильний радикал, R4 - це Н і Ri, R2, R5, Ris, R19 і R20 мають вищезазначене значення, обробляють первинним аміном, за умов Манніха (Manmch) для того, щоб одержати рпдроксилактонну сполуку загальної формули Іа Іа у якій R-і, R2, R5, R9, Ris, R19 і R20 мають вищезазначене значення Цей процес складається з нагрівання початкового продукту у присутності первинного аміну, такого як бензиламін, формальдегід у кислотному розчиннику, такому як оцтова кислота або пропюнова кислота при температурі 30°С-80°С протягом 0,5-5 годин Як альтернатива, суспензію початкового продукту у оцтовій кислоті з три-ІЧ-заміщеним гексапдротриазином, таким як гексапдро-1,3,5-триметилтриазин, 1,3,5триетилгексапдротриазин або 1,3,5трибензилгексапдротриазин, можна нагрівати при температурі 30°С-80°С протягом 0,5-5 годин 11 57757 лактон загальної формули Іа переводять за бажанням у лужне середовище для того, щоб створити після нейтралізації сполуку формули Па На 12 X у якій R2, R3, R4 і Rs мають вищезазначене значення, і X - це атом галогену, для того, щоб одержати сполуку формули О О у якій Ri, R2, R5, R19 і R20 мають вищезазначене значення, R-іб - це OR21, у якому R21 - це Н або нижчий алкіл, і R-I7 - це OR6 або NHR6 і R6 - це Н, нижчий алкіл, циклоалкіл, нижчий алкіл циклоалкіл, нижчий алкеніл, нижчий алкіл нижчий алкокси, або арил або нижчий алкіл арил вищезгадану сполуку загальної формули D або Іа за бажанням ацилюють, краще похідною радикалу C(O)-A-N-R22R23, як зазначено вище, для того, щоб одержати р-пдроксилактонну сполуку загальної формули ІЬ, тобто І з Rp відрізняється від Н (форм проліків винаходу) так само, як з лактоном Іа, лактон ІЬ можна відкрити для того, щоб одержати пдроксикислоту lib У вищезгаданому процесі R2, R3, R4 і Rs групи можна захистити, якщо це необхідно, згідно зі стандартними методами захисту (Greene, T, Protective Groups in Organic Synthesis 10-86 (John Wiley & Sons 1981)) Якщо принаймні одна з R22 або R23 груп є Н або містить принаймні одну групу, яка є ХІМІЧНО несумісною з процесом ацилювання, така як, наприклад, первинний або вторинний амін, тоді необхідно застосувати захисну групу, яка є резистентною до умов ацилювання Захисною групою, що зазвичай використовують для амінів, є трет-бутилоксикарбоніл (ВОС) Потім проводять реакцію ацилювання, як описано вище, потім захисну групу відщеплюють, наприклад, обробкою трифтороцтовою кислотою у випадку з ВОС для того, щоб одержати сполуку загальної формули (І) або (II) Використання захисних груп відомо фахівцям у цій галузі (для інших прикладів див Greene, Т, Protective Groups in Organic Synthesis, John Wiley & Sons, 1981) ном R а но у якій R-і, R3, R4, Rs, Rig, R20 і X мають вищезазначене значення, потім сполуку загальної формули О циклізують для того, щоб одержати сполуку загальної формули D, як зазначено вище У вищезгаданому процесі групи R,, R3 і R4 можна захистити, у разі потреби, стандартними методами захисту (Greene, T, Protective Groups in Organic Synthesis 10-86 (John Wiley & Sons 1981)) Утворення сполуки О, починаючи зі сполук загальної формули М і N, проводять обробкою, відомою фахівцям під назвою реакція Міцунобу (Mitsunobu) (див Mitsunobu, О etal Synthesis, p 1 (1981)) Гідроксильну групу сполуки N заміщують нуклеофілом, таким як сполука М або її депротонована похідна, обробкою фосфіном, наприклад трифенілфосфіном, і азодикарбоксилатною похідною, наприклад діетилазодикарбоксилатом, у апротонному розчиннику, такому як, наприклад, тетрапдрофуран або N.N-диметилформамід Циклізацію сполуки О краще проводять у присутності паладієвого каталізатора (наприклад, діацетату паладію) за лужних умов (створених, наприклад, лужним ацетатом, за бажанням поєднаним з агентом переносу фази, таким як, наприклад, бромід тетрабутиламонію), у апротонному розчиннику, такому як ацетонітрил або N.N-диметилформамід, при температурі 50°С—120°С (R Gngg et al , Tetrahedron 46, page 4003 (1990)) Сполуки загальної формули М можна одержати згідно з процесом карбоніл піридину загальної формули Сполуки формули D одержують наступним чисполуку загальної формули М Н і в якому Ri і R20 мають вищезазначене значення, і R24 - це атом галогену або нижчий алкокси, захищають ацетальною групою для того, щоб одержати сполуку загальної формули F „R24 НО у якій R-і, R-I8 і Rig мають вищезазначене значення, і R20 що є атомом водню або галогену, сполучають з 2-гало-З-хінолш-метанолом загальної формули N 6г 02' у якій Ri R20 і R24 мають вищезазначене значення, і Z і Z' - це групи, які є, незалежно, нижчим алкілом або утворюють разом насичений вуглеводневий ланцюг з 2—4 членами пдроксиметильну групу вводять у сполуку за 13 57757 гальної формули F для того, щоб одержати сполуку загальної формули G у якій Ri, R20, R24, Z і Z' мають вищезазначене значення, потім спиртову групу сполуки загальної формули G захищають для того, щоб одержати сполуку загальної формули Н R20, R24, Z і Z' мають вищезазначене значення, і R25 - це захисна група спиртової групи ацеталь сполуки загальної формули Н позбавляють захисту для того, щоб одержати сполуку загальної формули Г у якій R-і, R20, R24 і R25 мають вищезазначене значення, сполуку формули Г обробляють функцюналізованим алкілуючим агентом для того, щоб одержати р-пдроксіестер загальної формули J у якій R-і, R20, R24 і R25 мають вищезазначене значення, Ri7, R18 і Rig такі, як зазначено у загаль ній формулі II, захисну групу R25 сполуки загальної формули J відщеплюють для того, щоб одержати сполуку загальної формули К, ж л, R17 у якій Ri, Ris, R19, R20 і R24 мають вищезазначене значення, R-I7 - це OR6 або NHR6 і R6 - це Н, нижчий алкіл, циклоалкіл, нижчий алкіл циклоалкіл, нижчий алкеніл, нижчий алкіл нижчий алкокси або арил або нижчий алкіларил, сполуку загальної формули К циклізують у сполуку загальної формули L 14 у якій R-і, Ris Rig, R20 і R24 мають вищезазначене значення, і, нарешті, радикал R24 сполуки L перетворюють на карбоніл для того, щоб одержати сполуку загальної формули М у якій R-і, Ris R19, R20 і R24 мають вищезазначене значення Карбонільну групу 4-ацил-2-галопіридин (одержаний, наприклад, згідно з Lammattina J L J Heterocychc Chem 20, p 553 (1983)) краще захищати ацетальною групою, ще краще циклічною ацетальною, за звичайних умов, відомих фахівцю у цій галузі (Greene T , Protective Groups in Organic Synthesis 10-86 (John Wiley & Sons 1981)) Проміжний продукт, одержаний таким чином, обробляють алкоголятам натрію або калію у апротонному розчиннику (наприклад, ацетонітрилі) або спирті, з якого походить алкоголят, при температурі 0°С— 100°С для того, щоб одержати сполуку загальної формули F Останню можна літіювати у положенні З обробкою арил- або алкіл-літієм (наприклад, мезитил-літій) у ефірному розчиннику, такому як тетрапдрофуран, при температурі від -100°С до 0°С Формілюючий електрофіл, такий як N,Nдиметилформамід додають до таким чином одержаного літійованого проміжного продукту, і альдегід, одержаний таким чином, обробляють після гідролізу відновлюючим агентом, таким як борпдрид натрію для того, щоб одержати сполуку загальної формули G Захист спиртової групи сполуки G проводять за звичайних умов, відомих фахівцям у цій галузі, для того, щоб одержати сполуку загальної формули Н До прикладів захисних груп спиртових груп належать ті, які утворюють естери (тобто, метил, метоксиметил, тетрапдропіраніл, 2метоксиетоксиметил, бензилоксиметил, третбутил і бензил (заміщений або не заміщений)), і естери (тобто, формат, ацетат та ізобутират) Інші приклади захисних груп первинного гідроксилу див у Greene T, Protective Groups in Organic Synthesis 10-86 (John Wiley & Sons 1981) Позбавлення захисту сполук загальної формули Н для того, щоб одержати сполуку загальної формули Г, проводять за селективних умов, підтримуючи ЦІЛІСНІСТЬ радикалу R25, наприклад, обробкою за кислих умов (наприклад, трифтороцтовою кислотою) Селективні умови для захисту і позбавлення захисту функціональних груп ВІДОМІ фахівцям у цій галузі (Greene T, ProtectiveGroups in Organic Synthesis 10-86 (John Wiley & Sons 1981)) Обробку 16 15 57757 сполуки Г функцюналізованим алкілуючим агентом нику (наприклад, метанолі) борпдридом натрію для того, щоб одержати р-пдроксіестер загальної при температурі 0°С і 40°С формули J, можна проводити, використовуючи Сполуки формули N можуть також бути одеренолят ЛІТІЮ або похідну карбоксильного естеру жані згідно з наступним процесом аніліни загальцинку у безводному апротонному розчиннику, наної формули Р, як зазначено вище, ацетилюють приклад, тетрапдрофурані Захисну групу R25 спореакцією з нітрилом (таким як хлорацетонітрил луки загальної формули J відщеплюють для того, або пропюнітрил) у присутності трихлориду бору і щоб одержати сполуку загальної формули К за ще однієї кислоти Льюіса, такої яктрихлорид алюумов позбавлення захисту, відомих фахівцям у цій мінію, тетрахлорид титану або хлорид діетилалюгалузі Наприклад, якщо R25 - це бензильна група, МІНІЮ у апротонному розчиннику або суміші апроспиртовий розчин сполуки загальної формули J з тонних розчинників, після чого проводять гідроліз паладієвим каталізатором, доданим до нього, мо(порівн Sugasawa T et al J Am Chem Soc, 100 же бути підданий дії атмосфери водню під тиском p 4842 (1978)) Таким чином одержаний проміжний 0,5—10 Бар Циклізація таким чином одержаних продукт потім обробляють хлоридом етилмалонілу сполук загальної формули К може бути проведена у апротонному розчиннику, такому як ацетонітрил, в кислотних умовах (наприклад, обробкою триу присутності основи, такої як триетиламш, потім фтороцтовою кислотою або хлорводневим газом, обробляють лужним спиртом, наприклад, метилрозчиненим у безводному розчиннику, такому як атом натрію у метанолі, для того, щоб одержати дихлорметан або діоксан) для того, щоб одержати етил 2-пдрокси-З-хінолінкарбоксилат, заміщений у Р-пдроксилактонне кільце з 7 членами, такими як у положенні 4 Його перетворюють на етил 2-хлор-Зсполуки загальної формули L Сполуки загальної хінолшкарбоксилат обробкою оксихлоридом фосформули L можна перетворити на піридони загафорилу Якщо у положенні 4 ХІНОЛІН має хлормельної формули М, наприклад, обробкою теплою тильну групу, то нуклеофілільне заміщення може соляною кислотою або обробкою триметилсилілбути проведене обробкою вторинним аміном, тайодидом ким як, наприклад, диметиламін, Nметилпіперазин, морфолін або піперидин Етил 22-гало-З-хінолшметаноли загальної формули хлор-3-хінолшкарбоксилат потім відновлюють гідN можуть бути одержані, починаючи з ацетанілідів ридом дизобутилалюмінію у апртонному розчиннизагальної формули Р ку, такому як дихлорметан, для того, щоб одержати 2-хлор-З-хінолшметанол загальної формули N Аналоги проміжних продуктів сполуки (N) були описані у літературі, зокрема у заявці РСТ 95/05427 у яких F?2, R3 і R4 мають значення, зазначене у загальних формулах сполук І і II У процесах, описаних нижче, групи F?2, R3 і R4 можуть бути захищені, у разі потреби, згідно зі стандартними методами захисту (Greene, T, Protective Groups in Organic Synthesis 10-86 (John Wiley & Sons 1981)) Сполуки формули N можуть, таким чином, бути одержані згідно з наступним процесом вищезгадані аніліни формули Р N-ацетилюються обробкою ацетилюючим агентом, таким як, наприклад, оцтовий ангідрид Таким чином одержані ацетаніліди обробляють при температурі 50°С і 100°С, краще 75°С, реактивом, відомим фахівцям у цій галузі під назвою реактив Вілсмейера (Vilsmeyer) (одержаним дією оксихлориду фосфорилу на N,Nдиметилформамід при температурі 0°С і 10°С) для того, щоб одержати ВІДПОВІДНИЙ 2-хлор-Зхінолшкарбальдепд (наприклад, див Meth-Cohn et al J Chem Soc, Perkm Trans I p1520 (1981), Meth-Cohn et al J Chem Soc, Perkm Trans I p2509 (1981), і Nakasimhan etal J Am Chem Soc, 112 p4431 (1990)) Хлор у положенні 2 2-хлор-Зхінолшкарбальдепдів може бути заміщений на йод або бром нагріванням продукту у інертному розчиннику, такому як ацетонітрил, у присутності солі йоду або брому (наприклад, йодиду натрію або броміду тетрабутиламонію) Залишок кислоти, такої як концентрована соляна кислота, може бути необхідним для каталізу цього перетворення 2гало-3-хінолінкарбальдепди легко відновлюються до ВІДПОВІДНИХ 2-гало-З-хінолшметанолів загальної формули N за звичайних умов, відомих фахівцям у цій галузі, таких як обробка у спиртовому розчин Певні сполуки винаходу можуть бути одержані у формі фармацевтичне прийнятних солей згідно зі звичайними методами До прийнятних солей належать, як не обмежуючі приклади, аддитивні солі з неорганічними кислотами, такими як пдрохлорид, сульфат, фосфат, дифосфат, пдробромід і нітрат або з органічними кислотами, такими як ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, р-толуол сульфонат, памоат, саліцилат, оксалат і стеарат Солі, утворені з основами, такими як гідроксид натрію або калію, також являють собою частину заявки цього винаходу, якщо їх можна використати Заради інших прикладів фармацевтичне прийнятних солей можна звернутися до "Pharmaceutical Salts", J Pharm Sci 66 1 (1977) Сполуки цього винаходу мають корисні фармакологічні властивості Таким чином, сполуки цього винаходу мають шпбіторний вплив на топоізомеразу І і/або II і протипухлинну активність Рівень техніки припускає, що сполуки згідно з винаходом мають антипаразитну і/або антивірусну активність Сполуки згідно з цим винаходом можуть також бути використані для різних терапевтичних застосувань Далі буде наведено експериментальну частину після опису фармакологічних властивостей сполук винаходу Сполуки можуть інгібувати топоізомеразу, наприклад, типу І і/або II, у пацієнта, наприклад, ссавця, такого як людина, введенням цьому пацієнтові терапевтичне ефективної КІЛЬКОСТІ сполуки формули (І) або (II) 57757 18 17 Сполуки згідно з винаходом також мають проклад, вода, органічні розчинники, такі як гліцерин типухлинну активність Вони можуть бути викорисабо ГЛІКОЛІ, такі як поліетиленгліколь, а також їх тані для лікування пухлин, наприклад, пухлин, ексводні суміші у різноманітних пропорціях пресуючих топоізомеразу у пацієнта, введенням Предметом винаходу є також використання останньому терапевтично ефективної КІЛЬКОСТІ продуктів формул (І) або (II), як зазначено вище, сполуки формули (І) або (II) До прикладів пухлин для одержання ЛІКІВ, ЩО інгібують топоізомеразу і, або раку належить рак стравоходу, шлунку, кишок, зокрема, топоізомеразу типу І або типу II, ЛІКІВ ДЛЯ прямої кишки, ротової порожнини, глотки, гортані, лікування пухлин, ЛІКІВ ДЛЯ лікування паразитних легенів, товстої кишки, грудей, шийки матки, тіла інфекцій, а також ЛІКІВ ДЛЯ лікування вірусних хвоендометрію, яєчників, простати, яєчок, сечового роб міхура, нирок, печінки, підшлункової залози, кісток, Доза сполуки згідно з цим винаходом признасполучної тканини, шкіри, очей, мозку і центральчена для лікування хвороб або розладів, згаданих ної нервової системи, також рак щитовидної заловище, змінюється залежно від методу введення, зи, лейкемія, хвороба Ходжкіна, ІНШІ лімфоми, віку і ваги тіла пацієнта, а також його стану, і конкВІДМІННІ від тих, що стосуються хвороби Ходжкіна, ретне рішення щодо дози буде прийнято лише багаточисельні мієломи та ІНШІ лікарем-куратором або ветеринаром Така КІЛЬКІСТЬ, визначена лікарем-куратором або ветеринаВони можуть також бути використані для лікуром, має тут назву "ефективна терапевтична КІЛЬвання паразитних інфекцій інгібуванням гемофлаКІСТЬ" гелятів (наприклад, інфекцій трипаносом або лейшманій) або інгібуванням плазмодію (наприклад, Якщо окремо не зазначено, всі технічні і наумалярійного плазмодію), а також для лікування кові терміни, використані тут, мають ті ж значення, вірусних інфекцій і хвороб як і зазвичай зрозумілі звичайному спеціалістові у тій галузі, до якої належить винахід Таким же чиЦі властивості роблять продукти формул (І) ном, усі публікації, патентні заявки, усі патенти й або (II) придатними для фармацевтичного викориусі ІНШІ посилання, згадані тут, включені сюди стання Предметом цієї заявки є також, продукти шляхом посилання формул (І) або (II) в якості ЛІКІВ, ЯК зазначено вище, а також адитивні солі з фармацевтичне приНаступні приклади наведені для опису вищейнятними мінеральними або органічними кислотазгаданих методів і не повинні розглядатися як такі, ми вищезгаданих продуктів формул (І) або (II), а що обмежують об'єм винаходу також фармацевтичні композиції, що містять приЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА наймні одні ліки, як зазначено вище, як активний Композиція 1 5-етил-4,5-дипдро-1 Н-оксепін інгредієнт [3і,4і 6,7]-ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН-3,15(4Н,13Н)-ДІОН Таким чином, винахід стосується фармацевти1а 4-етил-3,4-дипдрокси-1Н-піран чних композиції, що містять сполуки згідно з вина[3'4' 6,7]ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН-14(4Н,12Н)-ОН ходом або адитивну сіль з її фармацевтичне приБорпдрид натрію (14г, 370 ммоль) додають йнятною кислотою, разом з фармацевтично причастинами до суспензії (3)-(+)-камптотецину (14г, йнятною основою згідно з вибраним методом уве40 ммоль, який може бути одержаний з різних кодення (наприклад, орально, внутрішньовенне, внумерційних джерел, таких як Aldnch Chemical Co трішньочеревинно, внутрішньом'язово, крізьшкірно (Milwaukee, Wl)) у метанолі (750мл) і створену суабо підшкірне) Фармацевтична композиція (наміш нагрівають повільно до 55°С для того, щоб приклад, терапевтична) може бути у формі твердої одержати прозорий розчин, який потім перемішуречовини, рідини, ліпосом або ЛІПІДНИХ міцел ють протягом 16 годин при температурі оточуючого середовища Розчинник потім випаровують під Фармацевтична композиція може бути у формі зниженим тиском, залишок переносять у воду твердої речовини, наприклад, порошків, пілюль, (250мл), нейтралізують додаванням оцтової кисгранул, таблеток, ліпосом, желатинових капсул лоти (21 мл) і залишають у стані спокою протягом 2 або супозиторіїв Пілюля, таблетка або желатиногодин при 4°С Створену суспензію фільтрують і ва капсула може бути вкрита речовиною, здатною промивають послідовно холодною водою, ацетозахистити композицію від дії кислоти шлунку або ном і діетиловим етером, що дозволяє одержати ферментів шлунку пацієнта протягом тривалого потрібний продукт після висушування під знижечасу, щоб дозволити цій композиції пройти у непеним тиском у формі білої твердої речовини, ретравленій формі у тонку кишку пацієнта Сполут п 280°С ка може також бути введена місцево, наприклад, у тому ж МІСЦІ, де є пухлина Сполука може також 1б 8-формілоксиметил-7бути введена згідно з процесом тривалого вивільпропюнілшдолізин[1 ,2-Ь]ХІНОЛІН-9(1 1 Н)-он нення (наприклад, композиція тривалого вивільРозчин метаперюдату натрію (14г, 65 ммоль) у нення або за допомогою насоса для інфузії) Приводі (140мл) додають краплинами до суспензії 4датними твердими основами можуть бути, наприетил-3,4-дипдрокси-1 Н-піран [3і,4' 6,7] ІНДОЛІЗИН клад, фосфат кальцію, стеарат магнію, карбонат [1,2-Ь]хінолш-14(4Н,12Н)-ону (13,4г, 38 ммоль) у магнію, тальк, цукри, лактоза, декстран, крохмаль, льодяній оцтовій кислоті (720мл) і створений розжелатин, целюлоза, метилцелюлоза, натрійкарбочин перемішують протягом однієї години за темксиметилцелюлоза, полівшілпіролідин і віск Фарператури оточуючого середовища Реакційну сумацевтичні композиції, що містять сполуки згідно з міш потім додають до суміші льод/вода (650мл) і винаходом можуть також бути представлені у рідстворену суспензію потім перемішують протягом кій формі, такій як, наприклад, розчини, емульсії, півгодини, потім фільтрують і промивають послісуспензії або рецептури тривалого вивільнення довно водою, ізопропіловим спиртом і діетиловим Придатним рідкими основами можуть бути, наприетером, що дозволяє одержати потрібний продукт 19 57757 20 (11,5 г) після висушування під зниженим тиском у 1757 формі блідої жовтої речовини, т п > 200°С (d) Композиція 2 розділення 5-етил-4,5-дипдро-5пдрокси-1Н-оксепш[3',4' 6,7]-ІНДОЛІЗИН[1,21в трет-бутил р-етил-р-пдрокси-р-(8пдроксиметил-9-оксо(11 Н)-ІНДОЛІЗИН-[1 ,2-Ь]ХІНОЛІН Ь]ХІНОЛІН-3,15(4Н, 13Н)-дюну 7-іл)-пропюнат Суспензію цинку (6,5г, 100 ммоль), яку перемішують магнітною мішалкою у безводному діетиловому етері (50мл) у атмосфері аргону, активують, додаючи краплинами хлортриметилсилан (0,75мл, 5,7 ммоль) Перемішування продовжують протягом 15 хвилин за температури оточуючого середовища, потім реакційне середовище нагрівають при дефлегмації Баню для нагрівання потім видаляють і трет-бутил б ром ацетат (15мл, 100 ммоль) додають краплинами зі швидкістю, яка забезпечує проведення дефлегмації Зовнішнє нагрівання поновлюють і продовжують нагрівати протягом однієї години Створений ефірний розчин реактиву Реформатського (Reformatsky) залишають охолоджуватись до температури оточуючого середовища, потім переносять, використовуючи канюлю, у суспензію 8-формілоксиметил-7пропюнілшдолізин[1 ,2-Ь]ХІНОЛІН-9(1 1 Н)-ону (1,6г, 4,7 ммоль) у безводному тетрапдрофурані (40мл) у атмосфері аргону Реакційну суміш перемішують при дефлегмації протягом однієї години, потім залишають охолоджуватись до температури оточуючого середовища і реакцію зупиняють додаванням насиченого хлориду амонію (ЮОмл), екстракцію проводять хлороформом (3 х ЮОмл) Змішані хлороформні екстракти висушують над сульфатом натрію, випаровують і залишок очищують хроматографією на колонці з силікагелем (1-2% МеОН/СНгСЬ), що дозволяє одержати 0,64г потрібного продукту (31%) у формі блідої жовтої речовини, т п 146-149°С Суміш р-етил-р-пдрокси-(8пдроксиметилшдолізин-[1 ,2-Ь]ХІНОЛІН-9-(1 1 Н-он-7іл)-пропюновоі кислоти (19,5г, 51 ммоль) і І_-(-)-аметилбензиламшу (12,12г, 100 ммоль) у абсолютному етанолі (11) нагрівають до кипіння, після чого фільтрують, доки тепла, і залишають у стані спокою протягом 68 годин Осад фільтрують і промивають етанолом і етером для одержання 9,8г білої твердої речовини Аналіз рідинною хроматографією під високим тиском нахіральніи нерухомій фазі ("Chiral HPLC" на Chiral-AGP колонці (Chromtech, Stockholm, Sweden) 100 х 4мм, елюант 2% ацетонітрил у ЮмМфосфатному буфері при рН 6,9, піки, що елюювалися на 4,5 і 7,5хв) виявив два піки, що зайняли ВІДПОВІДНО 24% і 76% загальної площі обох ПІКІВ Твердий осад переносять у 93%й етанол (350мл) і дефлегмують, потім залишають у стані спокою протягом 48 годин Осад відфільтровують, потім промивають етанолом і етером для того, щоб одержати 4,8г білої твердої речовини, яка дає два піки, що займають ВІДПОВІДНО 9% і 91% загальної площі двох ПІКІВ, використовуючи хіральну HPLC Твердий осад переносять у 50%-й етанол (48мл) і дефлегмують, потім залишають у стані спокою протягом 48 годин Осад відфільтровують, потім промивають етанолом і етером для того, щоб одержати 2,7г білої твердої речовини, яка дає два піки, що займають ВІДПОВІДНО 3% і 97% загальної площі двох ПІКІВ, використовуючи хіральну HPLC Твердий осад переносять у 50%-й етанол (22мл) і дефлегмують, потім залишають у стані спокою протягом 48 годин Осад відфільтровують, потім промивають етанолом і етером для того, щоб одержати 1,6г білої твердої речовини, яка дає два піки, що займають ВІДПОВІДНО 1% і 99% загальної площі двох ПІКІВ, використовуючи хіральну HPLC Створену сіль, збагачену діастереоізомерами, додають у дистильовану воду (20мл), обробляють оцтовою кислотою (0,35мл, 6,4 ммоль) протягом 15 хвилин Одержаний осад відфільтровують, промивають водою, ацетоном і етером, потім висушують у вакуумі при 80°С для того, щоб одержати 1,1г білої твердої речовини Останню додають у абсолютний етанол (55мл) з концентрованою соляною кислотою (11,5N, 11мл), яку додають для того, щоб одержати жовтий розчин, який зберігають при перемішуванні при температурі оточуючого середовища протягом 68 годин Таким чином одержаний осад відфільтровують і промивають водою, етанолом і етером, потім висушують у вакуумі при 80°С для того, щоб одержати 770мг 5-етил-4,5-дипдро-5-пдрокси-1Н ЯМР-1Н(СОСІ3) 0 93 (t, 3H), 1 37 (s, 9H), 1 99 (m, 2H), 2 97(dd, 2H), 3 5 (se, 1H), 5 10(s, 2H), 5 24 (s, 2H), 7 40 (s, 1Н), 7 59 (t, 1Н), 7 83 (t, 1Н), 7 90 (d, 1Н), 8 20(d, 1H), 8 34(s, 1H) ЯМР- С (CDCI3) 8 18, 27 90, 34 59, 45 34, 4991, 5855, 77 39, 82 42, 10052, 127 67, 12797, 128 10, 128 64, 129 44, 129 79, 130 42, 130 99, 142 86, 148 69, 152 75, 15516, 162 38, 172 24 ІЧ(КВг) 764, 1016, 1157, 1580, 1651, 1726 1д 5-етил-4,5-дипдро-5-пдрокси-1 Ноксепш[3',4' 6,7]-ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюн трет-бутил р-етил-р-пдрокси-р-(8 пдроксиметил-9-оксо(11 Н)-ІНДОЛІЗИН-[1 ,2-Ь]ХІНОЛІН 7-іл)-пропюнат (1,45г, 3,32 ммоль) розчиняють у безводному дихлорметані (25мл) і обробляють насиченим розчином хлориду водню у дихлорметані (ЮОмл) Створену суміш зберігають при -20°С протягом 16 годин Осад фільтрують, промивають метанолом і висушують під зниженим тиском, що дозволяє одержати 662мг (55%) потрібного продукту у формі жовтої твердої речовини, т п > 300°С ЯМР-1Н (ДМСО) 0 90 (t, 3H), 1 20 (q, 2H), 3 27 (dd, 2H), 5 29 (s, 2H), 5 49 (dd, 2H), 7 42 (s, 1H), 7 73(t, 1HV 7 90(t, 1H), 8 16(t, 2H), 8 71 (s, 1H) ЯМР- С (ДМСО) 8 45, 36 48, 42 54, 50 68, 61 44, 73 34, 99 78, 122 71, 127 83, 128 15, 128 75, 12908, 13007, 13061, 13181, 14466, 14804, 152 80, 155 91, 159 26, 172 08 ІЧ(КВг) 761, 1127, 1204, 1285, 1580, 1653, оксепш[3',4' 6,7]-ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюну, який збагачений на енантюмери Аналіз хіральною HPLC (Chiral-AGP колонка, елюювали 2—5% градієнтом ацетонітрилу у ЮмМ фосфатному буфері при рН 6,9, піки, що елюювалися на 15 і 20 хвилині) виявив 98% надлишок енантюмерів Спосіб, описаний вище, використовують повторно, замінюючи L-(-)-aметилбензиламш О-(+)-а-метилбензиламшом У такий спосіб одержують інший енантюмер 5-етил 22 57757 вою хроматографією (S1O2, ТВМО/НХ 50/50) виІНДОЛІЗИН[1,2-6]ХІНОЛІН-3,15(4Н,13Н)-ДІОН являє повну витрату початкового продукту Реакцію зупиняють насиченим хлоридом амонію і реаКомпозиція 3 5,12-діетил-4,5-дипдро-5кційну суміш екстрагують діетиловим етером пдрокси-1 Н-оксепш[3',4' 6,7]-ІНДОЛІЗИН[1 ,2(200мл, 50мл, 50мл) Змішані екстракти висушують Ь]хінолш-3,15(4Н,13Н)-цюн над сульфатом натрію і випаровують, що дає жовЦю сполуку одержують так само, як у Прикладі ту олію, яку очищують колоночною хроматографі1, за винятком того, що на етапі 1 а , 7єю (SiO2, ТВМО/НХ 0/100-5/95 для того, щоб етилкамптотецин (Sawada et al, Chem Pharm елюювати ПОХІДНІ местилену потім 20/80—50/50 Bull 39 2574 (1991)) використовується замість кадля того, щоб елюювати продукт) для того, щоб мптотецину Потрібну сполуку одержують у формі одержати проміжний продукт — альдегід (7г) Альяскравої жовтої твердої речовини, т п > 270°С 1 дегід розчиняють у метанолі (ЮОмл) і обробляють ЯМР- Н (ДМСО) 0 92 (t, 3H), 1 39 (t, 3H), 1 93 борпдридом натрію (5г, 132 ммоль) і створену су(q, 2H), 3 08 (d, 2H), 3 25 (q, 2H), 3 51 (d, 2H), 5 32 міш перемішують до повного поглинання проміж(s, 2H), 5 52 (dd, 2H), 7 42 (s, 1Н), 7 76 (t, 1Н), 7 89 ного продукту — альдегіду (приблизно 1 година) із (t, 1H), 8 18(d, 1H), 8 32(d, 1H) 13 застосуванням аналітичного контролю тонкошароЯМР- С (ДМСО) 8 46, 14 15, 22 42, 36 50, вою хроматографією Потім розчинник випарову42 54, 49 95, 6145, 73 35, 99 68, 122 61, 124 27, ють, залишок переносять у етер, промивають во126 76, 127 70, 12827, 129 92, 13018, 14517, дою і сольовим розчином, висушують і розчинник 145 82, 148 57, 152 15, 155 89, 159 26, 172 08 випаровують Колоночна хроматографія (S1O2, Композиція 4 5-етил-9,10-дифтор-4,5-дипдроТВМО/НХ 10/90—50/50) залишку дала 7г (загаль5-пдрокси-і Н-оксепін[3',4' 6,7] ІНДОЛІЗИН[1 ,2ний вихід 62%) продукту (G) у формі жовтої олії 21 4,5-дипдро-5-пдрокси-1 Н-оксепін[3',4' 6,7] Ь]ХІНОЛІН-3,15(4Н,13Н)-ДІОН 4 а 2-етил-2-(2-метокси-4-піридил)-1,3дюксолан Воду дистилюють у азеотропний спосіб (вночі) апаратом Dean Stark з суміші 2-хлор-4пропюнілпіридину (10г, 59 ммоль), одержаного по Lamattina, J LJ Heterocychc Chem 20, р 553 (1983), етиленгліколю (20мл) і р-толуолсульфонової кислоти (250мг) у толуолі (150мл) Розчинник потім видаляють у вакуумі, кислоту нейтралізують насиченим водним бікарбонатом натрію (ЮОмл) і продукт екстрагують етером Змішані ефірні екстракти промивають сольовим розчином, висушують над сульфатом натрію і випаровують, що дає 13,3г (96%) сирого продукту, захищеного карбонільною групою, яку нагрівають при дефлегмації з 3 еквівалентами метоксиду натрію у ацетонітрилі, доки реакція не закінчиться (перевіряли тонкошаровою хроматографією S1O2, трет 4 в 2-(3-бензилоксиметил-2-метокси-4піридил)-2-етил-1,3-дюксолан Розчин 2-етил-2-(3-пдроксиметил-2-метокси-4піридил)-1,3-дюксолану (7г, ЗО ммоль) і бензилхлориду (5мл, 45 ммоль) у безводному тетрапдрофурані (50мл) додають краплинами до суспензії гідриду натрію (80% у мінеральній олії, 1,85г, 61 ммоль) у безводному тетрапдрофурані (ЮОмл) і реакційну суміш дефлегмують протягом 16 годин Потім реакційну суміш залишають охолоджуватись до температури оточуючого середовища, реакцію зупиняють водою (50мл) і реакційну суміш концентрують під зниженим тиском Залишок розчиняють у діетиловому етері (150мл), промивають водою і сольовим розчином, висушують і випаровують Очищення колоночною хроматографією (S1O2, ТВМО/НХ 5/95—20/80) дало продукт, захищений бензилом (Н), 9г, (87%) у формі прозорої олії бутилметилоксид/гексан (ТВМО/НХ) 50/50) Розчин ацетонітрилу потім фільтрують і випаровують Залишок переносять у етер, промивають водою і сольовим розчином, висушують над сульфатом натрію і випаровують, що дає коричневу олію, яку переганяють (70-75°С, 0,04мбар), 10,7г (загальний вихід 81%) продукту (F) збирають у формі прозорої олії 4 б 2-етил-2-(3-пдроксиметил-2-метокси-4піридил)-1,3-дюксолан трет-бутиллітій (1,7М у пентані, ЮОмл, 170 ммоль) додають краплинами, використовуючи канюлю, до розчину броммезитилену (1 Змл, 85 ммоль) у безводному тетрапдрофурані (ЗООмл) при -78°С і у атмосфері аргону Створений білий осад перемішують при -78°С протягом однієї години, потім додають 2-етил-2-(2-метокси-4-піридил)1,3-дюксолан (10г, 44,8 ммоль) і реакційну суміш перемішують протягом 15 хвилин при -78°С, протягом однієї години при 0°С і протягом однієї години за температури оточуючого середовища Після повторного охолодження до -78°С, додають безводний N.N-диметилформамід (100 ммоль) і реакційну суміш залишають нагріватися до температури оточуючого середовища, потім перемішують протягом 16 годин, після чого аналіз тонкошаро 4 г 1 -(3-бензилоксиметил-2-метокси-4піридил)-пропан-1-он 2-(3-бензилоксиметил-2-метокси-4-піридил)-2етил-1,3-дюксолан (9г, 27 ммоль) обробляють трифтороцтовою кислотою (Юмл) і водою (5мл) при температурі бані 120°С протягом 3 годин Реакційну суміш концентрують у вакуумі і остаточні залишки кислот нейтралізують додаванням насиченого водного бікарбонату натрію Екстракцію проводять етером, після чого проводять колоночну хроматографію (SiO2, ТВМО/НХ 10/90), що дало 5,5г (70%) продукту (І) 4 д трет-бутил р-етил-р-пдрокси-р-(3бензилоксиметил-2-метокси-4-піридил)-пропюнат трет-бутил б ром ацетат (13мл, 80 ммоль) додають краплинами до суспензії цинку (5,3г, 80 ммоль, активованого 6N НСІ протягом 10 секунд, потім промивають послідовно водою, доки не створиться нейтральний рН, ацетоном і діетиловим етером) у безводному тетрапдрофурані (60мл) при дефлегмації Реакційне середовище дефлегмують протягом ще 10 хвилин по закінченні додавання Потім додають розчин 1-(3бензилоксиметил-2-метокси-4-піридил)-пропан-1ону (5,8г, 20 ммоль) у безводному тетрапдрофурані (20мл) і реакційну суміш перемішують при 23 57757 дефлегмації ще протягом години Реакцію зупиняють при 0°С насиченим водним хлоридом амонію (ЮОмл) і реакційну суміш екстрагують діетиловим етером Змішані екстракти висушують над сульфатом натрію і випаровують, що дає жовту олію, яку очищують колоночною хроматографією (S1O2, ТВМО/НХ 5/95—10/90) для того, щоб одержати трет-бутиловий естер (J) (7г, 95%) у формі прозорої олії 4 є трет-бутил р-етил-р-пдрокси-р-(3пдроксиметил-2-метокси-4-піридил)-пропюнат трет-бутил р-етил-р-пдрокси-р-(3бензилоксиметил-2-метокси-4-піридил)-пропюнат (1г, 2 5 ммоль) піддають пдрогенолізу під атмосферним тиском і за температури оточуючого середовища, використовуючи 5%-й паладій на вугіллі як каталізатор (50мг) і абсолютний етанол як розчинник (Юмл) По закінченні реакції (6 годин), каталізатор ВІДДІЛЯЮТЬ фільтрацією і розчинник випаровують, що дає 0,7г (90%) продукту (К) достатньої чистоти для наступного використання у синтезі 4 ж 5-етил-1,5-дипдро-5-пдрокси-9-метоксиоксепш[3,4-с]піридин-3(4Н)-он трет-бутил р-етил-р-пдрокси-р-(3пдроксиметил-2-метокси-4-піридил)-пропюнат (8,8г, 28 ммоль) обробляють трифтороцтовою кислотою (ЗОмл) протягом 3 годин при температурі оточуючого середовища Леткі компоненти випаровують і залишок очищують колоночною хроматографією (SiO2, CH2CI2/Me0H 100/0—98/2), що дає прозору олію, яка після обробки толуолом дала 5,9г продукту (L) (89%) у формі білих кристалів, т п 97-98°С 4 з 5-етил-1,5-дипдро-5-пдрокси-оксепш[3,4с]піридин-3,9(4Н,8Н)-дюн 5-етил-1,5-дипдро-5-пдрокси-9-метоксиоксепш[3,4-с]піридин-3(4Н)-он (0,5г, 2,1 ммоль) нагрівають при дефлегмації протягом 9 годин у 1N соляній кислоті (20мл) Реакційну суміш концентрують під зниженим тиском і залишок знову висушують додаванням і подвійним випаровуванням толуолу, потім залишають на ніч під зниженим тиском у присутності оксиду фосфору (V) Створену олію розчиняють у безводному ацетонітрилі (5мл) і перемішують у атмосфері аргону протягом 24 годин Осад відфільтровують і висушують, що дає 0,23г (49%) білої твердої речовини (М), т п 118-119°С 4 і 2-хлор-6,7-дифтор-3-хшолш-метанол Використовують метод, описаний Meth-Cohn і співробітниками, J Chem Soc Perkm Trans I, p 1520 (1981), Meth-Cohn, J Chem Soc Perkm Trans I, p 2509 (1981) 3,4-дифторацетанілід (38г, 22 ммоль) додають до реактиву Вілсмейера (Vilsmeyer), одержаний додаванням краплинами фосфорилоксихлориду (ЮЗмл, 1,1 моль) до безводного диметилформаміду (34мл, 44 ммоль), охолоджують у ВОДЯНІЙ/ЛЬОДЯНІЙ бані і перемішують протягом 0,5 години у атмосфері аргону Створену суміш нагрівають при 70°С протягом 16 годин Після охолодження до температури оточуючого середовища реакційну суміш додають до суміші льоду і води (400мл), що зберігають при перемішуванні протягом 2 годин, потім фільтрують і промивають послідовно водою, етанолом і ете 24 ром для того, щоб одержати 9г 2-хлор-6,7дифторхінолін-3-карбальдепду у формі жовтої твердої речовини, т п 222-224°С Цей проміжний продукт обробляють борпдридом натрію (2г, 52 ммоль) у метанолі (400мл) при температурі оточуючого середовища протягом 0,5 години, потім надлишок реактиву знешкоджують додаванням оцтової кислоти (2мл) Розчинник видаляють під зниженим тиском, залишок переносять у розчин етилацетату і промивають послідовно розведеним бікарбонатом натрію, водою і насиченим водним розчином хлориду натрію Органічну фазу висушують над сульфатом натрію, фільтрують і концентрують Створений твердий осад рекристалізують з 1,2-дихлоретаном для того, щоб одержати 8г 2хлор-6,7-дифтор-3-хшолш-метанол у формі бежевої твердої речовини 4 й 5-етил-8-(2-хлор-6,7-дифтор-3хінолінметил)-1,5-дипдро-5-пдрокси-оксепін[3,4с]піридин-3,9(4Н,8Н)-дюн Діетил азодикарбоксилат (570мкл, 3,6 ммоль) додають краплинами протягом 5 хвилин до розчину 5-етил-1,5-дипдро-5-пдрокси-оксепш[3,4с]піридин-3,9,(4Н,8Н)-дюну (400мг, 1,79 ммоль), сполуки, одержаної у попередній стадії 4 і (770мг, 2,23 ммоль), трифенілфосфіну (934мг, 3,58 ммоль) у безводному N.N-диметилформаміді (45мл) і створену суміш перемішують у атмосфері аргону при температурі оточуючого середовища протягом 16 годин Реакційну суміш потім концентрують під зниженим тиском і залишок розчиняють у етері (ЮОмл) Створений розчин промивають сольовим розчином (4 х 50мл), висушують над сульфатом натрію і випаровують Залишок очищують колоночною хроматографією (SiO2, СН2СІ2/Ме0Н 99/1 — 98/2), що дає 650мг (66%) продукту (О) у формі білої твердої речовини, т п 165-167°С 4 к 5-етил-9,10-дифтор-4,5-дипдро-5-пдрокси1 Н-оксепін[3',4' 6,7]-ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюн 5-етил-8-(2-хлор-6,7-дифтор-3-хшолшметил)і.б-дипдро-б-пдрокси-оксепшІЗ^-сІпіридин3,9(4Н,8Н)-дюн (600мг, 1 1 ммоль), бромід тетрабутил-амонію (352мг, 1,1 ммоль), ацетат натрію (359мг, 4,4 ммоль) і ацетат паладію II (98мг, 0,43 ммоль) розчиняють у безводному ацетонітрилі (40мл) і нагрівають при 90°С у атмосфері аргону протягом 16 годин Після охолоджування до температури оточуючого середовища, білий осад виділяють з червонуватого розчину Цей осад відфільтровують і висушують під зниженим тиском Сирий продукт суспендують у воді, фільтрують і висушують під зниженим тиском над оксидом фосфору (V), що дає 250мг потрібної сполуки у формі бежевої твердої речовини, т п > 250°С ЯМР-1Н (ДМСО) 0 91 (t, 3H), 1 87 (m, 2H), 3 08 (d, 1H), 3 51 (d, 1H), 4 45 (s, 4H), 5 19 (s, 2H), 5 47 (dd, 2H), 6 02 (se, 1H), 7 33 (s, 1H), 7 54(s,1H), 7 55(s, 1 НУ 8 43(s, 1H) ЯМР- С (ДМСО) 8 43, 36 47, 42 54, 50 52, 6143, 64 43 (2С), 73 31, 99 07, 112 27, 113 14, 122 00, 124,24, 12818, 129 74, 144 59, 145 01, 145 33, 147 63, 150 88, 155 88, 159 23, 172 07 Композиція 5 5-етил-4,5-дипдро-5,10дипдрокси-1 Н-оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2Ь]хінолін-3,15(4Н, 13Н)-дюн 25 Ю-бензилокси-б-етил-^б-дипдро-б-пдрокси 57757 1 Н-ОКСЄПІН[3',4',6,7]-ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюн (370мг, 0,79 ммоль) обробляють воднем при атмосферному тиску і при температурі оточуючого середовища, використовуючи 10%-й паладій на вугіллі як каталізатор (60мг), і трифтороцтову кислоту як розчинник (15мл) По закінченні реакції (16 годин) дихлорметан (50мл) і метанол (50мл) додають до реакційної суміші, каталізатор відфільтровують і леткі компоненти випаровують під зниженим тиском, що дозволяє одержати сирий потрібний продукт, що містить сліди трифтороцтової кислоти Ці СЛІДИ ВИДІЛЯЮТЬ перегонкою з 1,4-дюксаном Продукт одержують у формі оранжевої твердої речовини, тп150°С (d), достатньо очищений для наступного використання у синтезі 1 ЯМР- Н (ДМСО) 0 89 (t, 3H), 1 85 (q, 2H), 3 02 (d, 1H), 3 45 (d, 1H), 5 19 (s, 2H), 5 37 (d, 1H), 5 50 (d, 1Н), 5 98 (se, 1Н), 7 26 (s 1Н), 7 31 (s, 1Н), 7 40 (d, 1H), 8 00(d, 1H), 8 42(s, 1H), 10 32(s, 1H) ЯМР-13С (ДМСО) 8 47, 36 50, 42 61, 50 57, 61 46, 73 35, 98 84, 109 02, 121 83, 123 18, 129 50, 129 85, 130 12, 130 80, 143 39, 14510, 149 69, 155 97, 156 82, 159 30, 172 11 Композиція 6 5-етил-9-фтор-4,5-дипдро-5пдрокси-10-метокси-ІНоксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 26 1 ЯМР- Н (ДМСО) 0 85 (t, ЗН), 1 85 (q, 2H), 3 07 (d, 1H), 3 47 (d, 1H), 5 25 (s, 2H), 5 39(d, 1H), 5 51 (d, 1H), 6 05 (s, 1H), 7 39 (s, 1H), 8 15 (q, 1H), 8 25(q, 1HV 8 68(s, 1H) Я М Р - С (ДМСО) 8 41, 36 45, 42 48, 50 68, 61 40, 73 25, 99 92, 114 44, 115 42, 115 58, 122 96, 12552, 13056, 13146, 14421, 14525, 14236, 153 41, 155 85, 159 15, 172 00 ІЧ(КВг) 1266, 1512, 1581, 1618, 1751 Композиція 9 7-етил-7,8-дипдро-7-пдрокси9Н,11 Н-[1,3]дюксол[4,5-д]оксепін[3',4' 6,7]ІНДОЛІЗИН [1 ,2-Ь]ХІНОЛІН-9,1 2(14Н)-дюн Цю сполуку одержують з 3,4метилендюксианіліну згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Кремоподібна речовина, т п > 250°С 1 ЯМР- Н (ДМСО) 0 85 (t, ЗН), 1 85 (q, 2H), 3 07 (d, 1Н), 3 45 (d, 1Н), 5 20 (s, 2H), 5 39 (d, 1Н), 5 51 (d, 1Н), 6 00 (s, 1Н), 6 ЗО (s, 2Н), 7 ЗО (s, 1Н), 7 49 (d, 2H), 8 45(s, 1H) ЯМР-13С (ДМСО) 8 43, 36 49, 42 56, 50 58, 61 42, 73 31, 98 87, 102 75, 103 33, 104 92, 121 76, 125 74, 128 59, 130 33, 145 08, 146 69, 148 78, 150 19, 151 49, 155 90, 159 24, 172 08 ІЧ(КВг) 1248, 1459, 1606,1731 Композиція 10 9-хлор-5-етил-4,5-дипдро-5пдрокси-10-метокси-1Н 3,15(4Н,13Н)-дюн Цю сполуку одержують з З-фтор-4метоксианіліну згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Жовта тверда речовина, т п > 250°С ЯМР-1Н (ДМСО) 0 89 (t, 3H), 1 85 (q, 2H), 3 08 (d, 1Н), 3 49 (d, 1Н), 4 00 (s, 3H), 5 25 (s, 2H), 5 39 (d, 1Н), 5 51 (d, 1Н), 6 00 (s, 1Н), 7 32 (s, 1Н), 7 72 (d, 1H), 7 91 (d, 1H), 8 58(s, 1H) ЯМР-13С (ДМСО) 8 43, 36 48, 42 51, 50 68, 5660, 61 42, 73 29, 99 25, 10868, 11352, 12223, 126 33, 129 99, 130 30, 143 79, 144 70, 148 42, 151 18, 153 19, 155 81, 159 20, 172 06 ІЧ (КВг) 1259, 1503, 1602, 1737 Композиція 7 9-хлор-5-етил-4,5-дипдро-5пдрокси-10-метил-1Н 3,15(4Н,13Н)-дюн Цю сполуку одержують з З-хлор-4метоксианіліну згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Біла тверда речовина, т п > 250°С ЯМР-1Н (ДМСО) 0 85 (t, ЗН), 1 85 (q, 2H), 3 07 (d, 1H), 3,45 (d, 1H), 4 01 (s, ЗН), 5 22 (s, 2H), 5 39 (d, 1Н), 5 51 (d, 1Н), 6 02 (s, 1Н), 7 31 (s, 1Н), 7 68 (s, 1H), 8 20(s, 1H), 8 55(s, 1H) ЯМР-13С(ДМСО) 8 22, 36 27, 42 30, 50 48, 56 69, 6123, 73 08, 99 16, 107 44, 122 16, 12712, 128 12, 129 25, 130 02, 130 53, 143 29, 144 37, 151 12, 153 29, 155 71, 158 98, 171 84 ІЧ(КВг) 1056, 1256, 1483, 1592, 1657, 1747 Композиція 11 5-етил-4,5-дипдро-5-пдрокси оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 10-метокси-1Н-оксепін[3',4' 6,7]ІНДОЛІЗИН[1,2 3,15(4Н,13Н)-дюн Цю сполуку одержують з З-хлор-4метоксианіліну згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Жовта тверда речовина, т п >250°С ЯМР-1Н (ДМСО) 0 85 (t, 3H), 1 85 (q, 2H), 2 55 (s, ЗН), 3 07 (d, 1Н), 3 45 (d, 1Н), 5 25 (s, 2H), 5 39 (d, 1H), 5 51 (d, 1H), 6 05 (s, 1H), 7 39 (s, 1H), 8 10 (s, 1Н), 8 20(5, 1Н), 8 60(s, 1H) ЯМР-13С (ДМСО) 8 43, 20 20, 36 47, 42 49, 5067, 61 41, 73 28, 99 87, 122 82, 12698, 12799, 129 60, 130 53, 13108, 135 64, 136 56, 144 39, 147 11, 153 10, 155 85, 159 18, 172 03 ІЧ (КВг) 1208, 1479, 1606, 1656, 1724 Композиція 8 8-етил-2,3,8,9-тетрапдро-8пдрокси-10Н,12Н-[1,4]дюксин[2,3 Ь]ХІНОЛІН-3,15(4Н,13Н)-ДІОН д]оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 10,13(15Н)-дюн Цю сполуку одержують з 3,4етилендюксианіліну згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Жовта тверда речовина, т п > 250°С оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН Цю сполуку одержують з 4-метоксианіліну згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Жовта тверда речовина, т п > 250°С 1 ЯМР- Н (ДМСО) 0 85 (t, ЗН), 1 85 (q, 2H), 3 07 (d, 1Н), 3 45 (d, 1Н), 3 95 (s, ЗН), 5 28 (s, 2H), 5 40 (d, 1Н), 5 51 (d, 1Н), 6 00 (s, 1Н), 7 38 (s, 1Н), 7 51 (d, 2H), 8 07(d, 1H), 8 55 (s, 1H) ЯМР-13С (ДМСО) 8 45, 36 48, 42 51, 50 64, 55 92, 61 42, 73 33, 99 01, 106 49, 122 02, 12319, 129 59, 130 20, 130 43, 14417, 144 94, 150 40, 155 92, 158 31, 159 26, 172 07 ІЧ(КВг) 1251, 1604, 1655, 1735 Композиція 12 9,11-дихлор-5-етил-4,5-дипдро5-пдрокси-і Н-оксепін[3',4' 6,7]ІНДОЛІЗИН[1 ,2Ь]ХІНОЛІН-3,15(4Н,13Н)-ДІОН Цю сполуку одержують з 3,5-дихлоранілшу згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Жовта тверда речовина, т п > 250°С ЯМР-1Н (ДМСО) 0 85 (t, ЗН), 1 85 (q, 2H), 3 07 (d, 1Н), 3 45 (d, 1Н), 5 ЗО (s, 2H), 5 41 (d, 1Н), 5 55 (d, 1Н), 6 08 (з, 1Н), 7 41 (s, 1Н), 8 05 (s, 1Н), 8 21 27 57757 (s, 1H), 8 91 (s, 1H) 13 ЯМР- С (ДМСО) 8 39, 36 45, 42 51, 5103, 61 39, 73 25, 100 62, 123 55, 124 63, 127 60, 128 08, 128 56, 132 06, 13219, 134 53, 143 77, 148 80, 154 88, 155 82, 159 13, 171 98 ІЧ(КВг) 1064, 1275, 1586, 1651, 1743 Композиція 13 5-етил-9-фтор-4,5-дипдро-5пдрокси-10-метил-1Ноксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюн Цю сполуку одержують з З-фтор-4метиланіліну згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Жовта тверда речовина, т п > 250°С 1 ЯМР- Н (ДМСО) 0 89 (t, 3H), 1 85 (q, 2H), 2 49 (s, ЗН), 3 08 (d, 1Н), 3 49 (d, 1Н), 5 21 (s, 2H), 5 39 (d, 1Н), 5 51 (d, 1Н), 6 05 (s, 1Н), 7 39 (s, 1Н), 7 87 (d, 1H), 8 05(d, 1H), 8 61 (s, 1H) ЯМР-13С (ДМСО) 8 40, 15 14, 36 45, 42 52, 5060, 61 41, 73 28, 99 71, 11200, 12266, 12538, 127 66, 129 59, 130 28, 144 49, 147 88, 152 88, 155 85, 159 18, 162 25, 172 02 ІЧ(КВг) 1054, 1580, 1651, 1760 Композиція 14 5-етил-10-фтор-4,5-дипдро-5пдрокси-1Н-оксепш[3',4' 6,7]ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюн Цю сполуку одержують з 4-фторанілшу згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Біла тверда речовина, т п > 250°С ЯМР-1Н (ДМСО) 0 85 (t, ЗН), 1 85 (q, 2H), 3 07 (d, 1Н), 3 45 (d, 1Н), 5 29 (s, 2H), 5 39 (d, 1Н), 5 55 (d, 1Н), 6 ЗО (s, 1Н), 7 39 (s, 1Н), 7 80 (q, 1Н), 7 99 (q, 1H), 8 23(q, 1H),8 68(s, 1H) ЯМР-13С (ДМСО) 8 40, 36 46, 42 48, 50 66, 61 41, 73 31, 99 68, 111 83, 122 75, 128 93, 130 93, 13122, 13193, 144 46, 145 27, 152 60, 155 89, 159 21, 172 04 ІЧ(КВг) 1209, 1589, 1659, 1739 Композиція 15 10-хлор-5-етил-4,5-дипдро-5пдрокси-1 Н-оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюн Цю сполуку одержують з 4-хлоранілшу згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4/Жовта тверда речовина, т п > 250°С ЯМР-1Н (ДМСО) 0 85 (t, ЗН), 1 85 (q, 2H), 3 07 (d, 1Н), 3 47 (d, 1Н), 5 25 (s, 2H), 5 39 (d, 1Н), 5 51 (d, 1H), 6 05 (s, 1H), 7 39 (s, 1H), 7 89 (d, 1H), 8 19 (d, 1H), 8 29(s, 1H), 8 67(s, 1H) 13 ЯМР- С (ДМСО) 8 40, 36 46, 42 47, 50 70, 61 42, 73 31, 100 00, 122 96, 127 31, 127 42, 128 87, 13111, 13212, 14434, 14653, 15338, 15588, 159 20, 172 04 ІЧ(КВг) 1069, 1483, 1606, 1741 Композиція 16 9-хлор-5-етил-10-фтор-4,5дипдро-5-пдрокси-1 Ноксепш[3',4' 6,7]ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН-3,15 (4Н,13Н)-дюн Цю сполуку одержують з 4-хлор-З-фторанілшу згідно з методом, описаним у стадіях 4і, 4й, і 4к Композиції 4 Жовта тверда речовина, т п > 250°С ЯМР-1Н (ДМСО) 0 85 (t, ЗН), 1-85 (q, 2H), 3 07 (d, 1Н), 3 45 (d, 1Н), 5 25 (s, 2H), 5 39 (d, 1Н), 5 51 (d, 1Н), 6 05 (s, 1Н), 7 40 (в, 1Н), 8 20 (d, 1Н), 8 40 (d, 1H), 8 68(s, 1H) ЯМР-13С (ДМСО) 8 38, 36 47, 42 58, 50 71, 61 40, 73 26, 99 99, 113 59, 123 09, 124 28, 127 74, 28 13064, 13131, 14413, 14508, 15357, 15413, 155 84, 156 61, 159 14, 172 00 ІЧ(КВг) 1488, 1583, 1655, 1743 Композиція 17 5,12-дієтил-9-фтор-4,5-дипдро5-пдрокси-і 0-метокси-1 Ноксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюн 17 а 5-фтор-4-метокси-2-пропюніланілш Цей продукт одержують згідно з Sugasawa T, Toyoda Т, Adachi М, Sasakura К, J Am Chem Soc , 100 (1978), p 4842-4852) Краплинами додають трихлорид бору (1М у гептані, 156мл, 156 ммоль), у атмосфері аргону при 0°С до розчину З-фтор-4метокси-аніліну (20г, 142 ммоль) у безводному дихлорметані (200мл) Таким чином одержану рожеву суспензію перемішують протягом 5 хвилин, потім додають краплинами пропюнітрил (ЗЗмл, 420 ммоль), після чого малими частинами трихлорид алюмінію (20,8г, 156 ммоль) Реакційне середовище нагрівають при дефлегмації протягом З годин, охолоджують до 0°С, пдролізують, обережно додаючи 2N соляну кислоту (ЮОмл), потім нагрівають при дефлегмації протягом 45 хвилин Після охолодження до 0°С одержують осад, який відфільтровують, промивають дихлорметаном, потім переносять у воду (ЗООмл) Водну фазу залуговують до лужного рН, екстрагують дихлорметаном, потім етилацетатом Органічну фазу висушують (MgSO4), потім випаровують для одержання сирого продукту, який очищують колоночною хроматографією (SiO2, AcOEt/Hpt 1/99—20/80) Одержують 15,3г жовтої твердої речовини ЯМР-1Н (CDCI 3 ) 1 20 (t, ЗН), 2 92 (q, 2H), 3 83 (s, ЗН), 6 2 (s, 2H), 6 40 (d, 2H), 7 32 (d, 2H) ІЧ(КВг) 857, 1148, 1240, 1561, 1583, 1662 17 6 Етил 4-етил-7-фтор-2-пдрокси-6-метокси3-хінолшкарбоксилат Розчин хлориду етилмалонілу (12,9мл, 100 ммоль) у безводному ацетонітрилі (ЗОмл) додають краплинами, у атмосфері аргону і при 0°С до розчину 5-фтор-4-метокси-2-пропюніланілшу (15,3г, 77,5 ммоль) і триетиламшу (13 9мл, 100 ммоль) у безводному ацетонітрилі (110мл) Реакційне середовище залишають нагріватися до температури оточуючого середовища, розчин етилату натрію (одержаний додаванням 1,8г, 78 ммоль натрію у 80мл етанолу) додають краплинами і у атмосфері аргону, потім реакційне середовище залишають при перемішуванні протягом 12 годин при температурі оточуючого середовища Реакційну суміш додають до льодяної води (ЮОмл) і проводять перемішування протягом двох годин, потім осад відфільтровують і промивають водою, етанолом і етером Одержують 19,4г білої твердої речовини ЯМР-1Н (ДМСО) 125 (m, 6H), 2 78 (q, 2H), З 92 (s, ЗН), 4 ЗО (q, 2H), 7 15(d, 2H), 7 40 (d, 2H), 11 93 (s, 1Н) ІЧ(КВг) 786, 1083, 1410, 1521, 1644, 1725 17 в ЕТИЛ 2-хлор-4-етил-7-фтор-6-метокси-3 хінолшкарбоксилат Суспензію етил 4-етил-7-фтор-2-пдрокси-6метокси-3-хінолшкарбоксилату (19,4г, 0,066 моль) у фосфорилхлориді (243мл) нагрівають при дефлегмації протягом 6 годин Фосфорилхлорид відганяють Реакційну суміш декантують у льодяній воді, потім переносять у дихлорметан для роз 57757 ЗО 29 чинення Органічну фазу промивають водою, потім ЯМР-1Н (ДМСО) 0 87 (t, ЗН), 1 87 (q, 2H), 2 78 насиченим розчином хлориду натрію Органічну (s, ЗН), 2 80 (d, 1H), 3 55 (d, 1H), 5 27(s, 2H), 5 42 фазу висушують над сульфатом магнію і розчин(d, 1Н), 5 52 (d, 1Н), 6 04 (s, 1Н), 7 39 (s, 1Н), 7 75 ник випаровують Залишок суспендують у етері і (t, 1H), 7 88(t, 1H), 8 13(d, 1H), 8 25 (d, 1H) неперетворений початковий продукт (4г) відфільтЯМР-13С (ДМСО) 8 23, 36 26, 42 36, 62 00, ровують Фільтрат випаровують і залишок очищу73 11, 78 65, 79 13, 79 25, 99 52, 122 36, 124 30, ють колоночною хроматографією (S1O2, AcOEt/Hpt 12767, 12954, 12955, 12956, 14011, 14506, 5/95—20/80) 148 07, 152 00, 155 79, 159 09, 171 89 Одержують 10,9г білої твердої речовини ІЧ(КВг) 1649, 1751, 3404 ЯМР-1Н (ДМСО) 1 ЗО (t, ЗН), 1 39 (t, ЗН), 3 08 Композиція 19 10-бензилокси-5-етил-9-фтор(q, 2H), 4 09 (s, ЗН), 4 49 (q, 2H), 7 64 (d, 2H), 7 86 4,5-дипдро-5-пдрокси-1 Н(d, 2H) оксепш[3',4' 6,7]ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН-3,15(4Н, ІЧ(КВг) 865, 1016, 1082, 1190, 1224, 1253, 13Н)-дюн 1272, 1508, 1571, 1732 Спосіб, наведений у стадії 4 і , застосовують до З-фтор-4-метокси-ацетаніліду для того, щоб 17г 2-хлор-4-етил-7-фтор-6-метокси-3одержати 2-хлор-7-фтор-6-метокси-хшолш-3хінолшметанол карбальдепд, який обробляють надлишком триРозчин етил 2-хлор-4-етил-7-фтор-6-метоксиброміду бору у дихлорметані при температурі ото3-хінолшкарбоксилату (10,8г, 35 ммоль) у безводчуючого середовища протягом 24 годин Одержуному дихлорметані (200мл) обробляють краплиють 2-хлор-7-фтор-6-пдрокси-хінолш-3нами при температурі оточуючого середовища у карбальдепд, який є О-бензильованим у диметиінертній атмосфері гідридом дмзобутилалюмінію лформаміді у присутності бензилброміду і карбо(1М у дихлорметані, 65мл, 65 ммоль), потім нагрінату калію для того, щоб одержати 6-бензилоксивають при 40°С протягом 4 годин Після охоло2-хлор-7-фтор-хінолш-3-карбальдепд, який віднодження до 0°С обережно додають 20%-й водний влюють борпдридом натрію у метанолі для того, розчин солі Рошелле (Rocheile) (105мл) і дихпорщоб одержати ВІДПОВІДНИЙ хінолшметанол Останметан (200мл), реакційну суміш перемішують проній сполучають зі сполукою (М), як описано у стадії тягом 1 години, після чого декантують і промива4 й Композиції 4 Створений продукт циклізують ють тричі водою Органічну фазу висушують над згідно зі способом, описаним у стадії 4 к Одержусульфатом магнію і розчинник випаровують Зають жовту тверду речовину, т п > 275°С лишок очищують колоночною хроматографією (SiO2, AcOEt/Hpt 5/95—50/50) Одержують 6г білої ЯМР-1Н (ДМСО) 0 86 (t, ЗН), 1 85 (q, 2H), 3 05 твердої речовини (d, 1Н), 5 25 (s, 2H), 5 37 (s, 2H), 5 45 (dd, 2H), 6 05 ЯМР-1Н (ДМСО) 1 28 (t, ЗН), 3 25 (q, 2H), 4 04 (s, ЗН), 4 77 (d, 2H), 5 27 (t, 1H), 7 55 (d, 2H), 7 73 (d, 2H) ІЧ(КВг) 840, 864, 1023, 1232, 1267, 1317, 1444, 1511, 1569 17 д 5,12-діетил-9-фтор-4,5-дипдро-5пдрокси-10-метокси-1Н оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюн 2-хлор-4-етил-7-фтор-6-метокси-3хінолшметанол з'єднують зі сполукою (М), яка описані у стадії 4 й Композиції 4 Створений продукт циклізують згідно з методом, описаним у стадії 4 к Одержують жовту тверду речовину, т п > 275°С ЯМР-1Н (CF3COOD) 1 07 ( т , ЗН), 1 62 ( т , ЗН), 2 27 (т, 2Н), 3 44 (d, 1Н), 3 54 (т, 2Н), 3 91 (d, 1Н), 4 25 (s, ЗН), 5 60 (d, 1Н), 5 74 (s, 2Н), 5 98 (d, 1Н), 7 85(т, 1HV 8 16(т, 1Н), 8 31 (s, 1H) ЯМР- С (CF3COOD) 9 03, 14 20, 26 68, 38 77, 43 98, 53 79, 58 27, 64 73, 77 93, 106 85, 109 24, 11015, 12899, 12920, 13161, 13732, 141,23, 144 13, 154 79, 158 32, 160 25, 160 81, 179 30 ІЧ(КВг) 1013, 1068, 1265, 1466, 1514, 1601, 1655, 1748 Композиція 18 5-етил-4,5-дипдро-5-пдрокси12-метил-1Н-оксепш[3',4' 6,7]ІНДОЛІЗИН[1,2Ь]ХІНОЛІН-3,15(4Н,13Н)-ДІОН Спосіб, описаний у Прикладах 17 6 , 17 в і 17 г, застосовують до 2-ацетиланілшу для того, щоб одержати 2-хлор-4-метил-3-хшолшметанол Останній з'єднують зі сполукою (М), як описані у стадії 4 й Композиції 4 Створений продукт циклізують згідно зі способом, описаним у стадії 4 к Одержують жовту тверду речовину, т п > 260°С (s, 1H), 7 4-7 6 (m, 5H), 7 88 (d, 1H), 7 95 (d, 1H), 8 56 (s, 1Н) Композиція 20 5-етил-9-фтор-4,5-дипдро-5,10дипдрокси-1 Н-оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2Ь]ХІНОЛІН-3,15(4Н,13Н)-ДІОН Сполуку Композиції 19 (0,79 ммоль), розчинену у трифтороцтовій кислоті (15мл), обробляють воднем, використовуючи 10% паладій на вугіллі (60мг) Одержують жовту тверду речовину, т п > 275°С ЯМР-1Н (ДМСО) 0 86 (t, ЗН), 1 85 (q, 2H), 3 05 (d, 1Н), 5 25 (s, 2H), 5 37 (s, 2H), 5 45 (dd, 2H), 6 05 (s, 1Н), 7 8 (d, 1Н), 7 90 (d, 1Н), 8 56 (s, 1Н) Вищезгадані композиції слугуватимуть, як основа для опису винаходу наступними прикладами ПРИКЛАД 1 5-етил-9,10-дифтор-4,5-дипдро-5-(2-амшо-1оксоетокси)-1 Н-оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2И]ХІНОЛІН-3,15(4Р,13Н)-ДІОН а пдрохлорид 5-етил-9,10-дифтор-4,5-дипдро5-(2-(трет-бутилоксикарбоніл-амшо)-1-оксоетокси)1 Н-оксепін[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюну Суміш 5-етил-9,10-дифтор-4,5-дипдро-5пдрокси-1 Н-оксепш[3',4' 6,7]ІНДОЛІЗИН[1 ,2-6]ХІНОЛІН 3,15(4Н,13Н)-дюну (200мг, 0,526 ммоль, одержаний згідно з Композицією 4), N-Boc-гліцин (185мг, 1,051 ммоль) і каталітичну КІЛЬКІСТЬ 4диметиламшопіридину (20мг) у безводному піридині (Юмл) обробляють при 0°С і у атмосфері аргону дициклогексилкарбодимідом (239мг, 1,16 ммоль), потім перемішують при температурі оточуючого середовища протягом 48 годин Леткі речовини відганяють у вакуумі і залишок хроматог 31 57757 32 рафують (S1O2, 1%-й метанол у хлороформі) для 172 07 того, щоб одержати бажаний проміжний продую" ІЧ(КВг) 1045, 1215, 1502, 1604, 1657, 1722 (40мг, 14%), жовту тверду речовину ПРИКЛАД 4 1 ЯМР- Н (CDCI3) 1 20 (t, ЗН), 1 38 (s, 9H), 1 408-Етил-8,9-дипдро-8-пдрокси-1-метил1 70 (m, 2H), 3 10(d, 1H), 4 00 (d, 2H), 4 30 (d, 1H), 2Н,10Н,12Н-[1,3]оксазин[5,65 00 (t, 1Н), 5 20 (s, 2Н), 5 30-5 90 (dd, 2Н), 7 20 (s, 1]оксепін[3',4' 6,7]ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН-10,13(15Н)1Н), 7 50-8 10 (m, 2Н), 8 ЗО (s, 1H) дюн б 5-етил-9,10-дифтор- 4,5-дипдро-5-(2-амшоСуспензію 5-етил-4,5-дипдро-5,10-дипдрокси1-оксоетокси)-1Н-оксепш[3',4' 6,7]ІНДОЛІЗИН[1,2Ь]ХІНОЛІН-3,15(4Н,13Н)-ДІОН, пдрохлорид Проміжний продую", одержаний вище (40мг, 0,072 ммоль) у розчині дихлорметану (Юмл) зберігають при 0°С і додають краплинами діоксан, насичений хлоридом водню (8мл) Таким чином створену жовту суспензію перемішують протягом 2 годин, потім леткі речовини відганяють у вакуумі Залишок, перенесений у воду (5мл), промивають дихлорметаном (3 х ЗОмл) Водну фазу заморожують і люфілізують для того, щоб одержати передбачувану сіль, гігроскопічну жовту тверду речовину (20мг, 50%) ЯМР-1Н (CDCI3) 1 00 (t, ЗН), 2 15 (m, 1H), 2 30 (m, 1H), 3 60 (d, 1H), 3 90 (d, 1H), 4 15 (s, 2H), 5 10 (s, 2H), 5 40 (d, 1H), 5 70 (d, 2H), 7 40 (s, 1H), 7 80(m, 2H), 8 50(s, 1H) ПРИКЛАД 2 3-етил-9,10-дифтор-4,5-дипдро-5-(2-аміно-1оксопропокси)-1 Н-оксепін[3',4' 6,7]ІНДОЛІЗИН[1 ,2Ь]ХІНОЛІН-3,15(4Н,13Н)-ДІОН До 5-етил-9,10-дифтор-4,5-дипдро-5-пдрокси1 Н-оксепін[3',4' 6,7]ІНДОЛІЗИН[1 ,2-6]ХІНОЛІН 3,15(4Н,13Н)-дюну застосовують спосіб Прикладу 1, використовуючи N-Boc-b-аланш замість N-Bocгліцину, потім Вос протектор таким чином одержаного проміжного продукту відщеплюють обробкою трифтороцтовою кислотою у дихлорметані Леткі речовини випаровують у вакуумі і залишок переносять у дихлорметан Створений розчин промивають розведеним бікарбонатом, висушують і випаровують Одержують жовту тверду речовину Застосовуючи способи Прикладів 1 і 2 до інших сполук, одержують такі самі результати Таким чином, цілий клас аналогів камптотецину доступний у формі "проліків", ПРИКЛАД З 1,8-діетил-8,9-дипдро-8-пдрокси-2Н,10Н,12Н[1,3]оксазин[5,6-1]оксепін[3',4' 6,7]ІНДОЛІЗИН[1 ,2Ь]ХІНОЛІН-10,13(15Н)-ДІОН Суспензію 5-етил-4,5-дипдро-5,10-дипдрокси1 Н-оксепін[3',4' 6,7]ІНДОЛІЗИН[1 ,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюну (84мг, одержану згідно з Композицією 5) у оцтовій кислоті (2,5мл) обробляють 1,3,5-триетилгексапдротриазином (0,5мл) Реакційну суміш перемішують при 70°С протягом ЗО хвилин, потім випаровують у вакуумі Залишок переносять у етанол, фільтрують і промивають етером Одержують тверду речовину, т п > 275°С ЯМР-1Н (ДМСО) 0 87 (t, ЗН), 1 50 (t, ЗН), 1 85 (q, 2H), 2 77 (q, 2H), 3 05 (d, 1Н), 3 47 (d, 1Н), 4 37 (s, 2H), 5 00 (s, 2H), 5 22 (s, 2H), 5 45 (dd, 2H), 6 00 (s, 1Н), 7 34 (s, 1Н), 7 36 (d, 1Н), 7 93 (d, 1Н), 8 53 (s,1H) ЯМР-13С (ДМСО) 8 46, 13 48, 36 46, 42 49, 45 49, 46 44, 50 75, 61 43, 73 33, 82 06, 99 02, 11290, 12200, 12298, 12542, 12704, 12904, 130 20, 144 09, 144 97, 149 87, 152 92, 155 98, 1,Н-оксепін[3',4' 6,7]ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюну (200мг, одержаний згідно з Композицією 5) у оцтовій кислоті (5мл) обробляють гексапдро-1,3,5-триметилтриазином (110мг) Реакційну суміш перемішують при 70°С протягом ЗО хвилин, потім випаровують у вакуумі Залишок переносять у етанол, фільтрують і промивають етером Одержують тверду речовину, т п > 275°С 1 ЯМР- Н (ДМСО) 0 87 (t, ЗН), 1 85 (q, 2H), 3 04 (d, 1Н), 3 48 (d, 1Н), 4 33 (s, 2H), 4 93 (s, 2H), 5 28 (s, 2H), 5 45 (dd, 2H), 6 01 (s, 1Н), 7 35 (s, 1Н), 7 38 (d, 1H), 7 94(d, 1H), 8 49(s, 1H) ЯМР-13С (ДМСО) 8 46, 36 43, 37 85, 42 55, 48 68, 50 79, 6143, 73 35, 83 82, 99 04, 112 49, 122 04, 123 00, 125 46, 12714, 129 07, 130 27, 144 99, 149 95, 152 46, 155 99, 172 09 ІЧ(КВг) 1047, 1058, 1219, 1246, 1295, 1439, 1504, 1604, 1655, 1735 ПРИКЛАД 5 8-етил-8,9-дипдро-8-пдрокси-1-бензил2Н,10Н,12Н-[1,3]оксазин[5,61]оксепін[3',4' 6,7]ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН-10,13(15Н) дюн Суспензію 5-етил-4,5-дипдро-5,10-дипдрокси1,Н-оксепін[3',4' 6,7]ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН 3,15(4Н,13Н)-дюну (200мг, одержану згідно з Композицією 5) у оцтовій кислоті (5мл) обробляють 1,3,5-трибензилгексапдротриазином (285мг) Реакційну суміш перемішують при 70°С протягом ЗО хвилин, потім випаровують у вакуумі Залишок переносять у етанол, фільтрують і промивають етером Одержують тверду речовину, т п > 275°С ЯМР-1Н (ДМСО) 0 85 (t, ЗН), 1 85 (q, 2H), 3 05 (d, 1Н), 3 47 (d, 1Н), 3 96 (s, 2H), 4 33 (s, 2H), 5 04 (s, 2H), 5 17 (s, 2H), 5 44 (dd, 2H), 6 01 (s, 1H), 7 38 (т, 6Н), 7 42 (d, 1Н), 7 97 (d, 1Н), 8 42 (s, 1Н) ЯМР-13С (ДМСО) 8 42, 19 96, 36 45, 42 51, 46 36, 50 78, 55 38, 6139, 73 31, 99 00, 112 55, 12201, 12308, 12538, 12709, 12747, 12870, 129 14, 130 35, 128 40, 13919, 14418, 149 99 152 84, 155 92, 159 24, 172 05 ІЧ(КВг) 1056, 1205, 1225, 1248, 1504, 1535, 1599, 1655, 1726 ПРИКЛАД 6 8-етил-8,9-дипдро-4-фтор-8-пдрокси-1-бензил2Н,10Н,12Н-[1,3]оксазин[5,61]оксепін[3',4' 6,7]ІНДОЛІЗИН[1,2-Ь]ХІНОЛІН-10,13(15Н) дюн Суспензію 5-етил-9-фтор-4,5-дипдро-5,10 дипдрокси-1,Н-оксепін[3',4' 6,7]ІНДОЛІЗИН[1,2 Ь]хінолш-3,15(4Н,13Н)-дюну (200мг, одержану згідно з Композицією 20) у оцтовій кислоті (5мл) обробляють 1,3,5-трибензилгексапдротриазином (285мг) Реакційну суміш перемішують при 70°С протягом ЗО хвилин, потім випаровують у вакуумі Залишок переносять у етанол, фільтрують і промивають етером Одержують тверду речовину, т п > 250°С 33 57757 34 (Boehrmger Mannheim, Meylan, France), Після додаткової інкубації ЗО хвилин при 37°С до зразків додавали 2мкл буферу для завантаження, що містить ЮмМ Na2HP04, 0,3% бромфенол синій та 16% Ficoll, які піддавали електрофорезу у 1,2% агарозному гелі при 1В/см протягом 20 годин у буфері, що містить ЗбмМ Трис-НСІ при рН 7,8, ЗОмМ Na2HP04, 1мМ EDTA і 2мкг/мл хлорхіну Гелі забарвлювали 2мкг/мл етідійбромом, фотографували при ультрафіолетовому СВІТЛІ при 312нм камерою з приладом з зарядовим зв'язком і інтенсивність флуоресценції вимірювали, використовуючи відеоаналізатор bioProfil (Vilber Lourmat, Lyon, France) із зображенням для визначення відсотку розкрученої ДНК ЯМР-1Н (ДМСО) 0 85 (t, ЗН), 1 85 (q, 2H), 3 05 (d, 1H), 3 48 (d, 1Н), 3 95 (s, 2H), 4 45 (s, 2H), 5 20 (s, 4H), 5 45 (dd, 2H), 6 05 (s, 1H), 7 40 (s, 7H), 7 90 (d, 1H), 8 45(s, 1H) ІЧ(КВг) 1248, 1451, 15001, 1598, 1657, 1727 Фармакологічне вивчення продуїшв згідно з винаходом Тест на активність розкручування ДНК топоізомеразою 1 Всі реакції проводять у 20мкл реакційному буфері, що складається з 50мМ Трис-НСІ (рН 7,5), 50мМ КСІ, 0,5мМ дитютреїтолу, ЮмМ МдСІ2, 0,1 мМ етилдіамштетраоцтової кислоти (EDTA), 30мкг/мл бичачого сивороткового альбуміну і ЗООнг суперспіралізованої pUC19 (Pharmacia Biotech, Orsay, France) з або без тестової сполуки у визначених концентраціях Всі тестові сполуки першопочатково розчиняють у диметилсульфоксиді (ДМСО) або у воді для водорозчинних сполук, ІНШІ розведення проводять у дистильованій воді Остаточна концентрація ДМСО не перевищує 1% (по масі) Реакцію ІНІЦІЮЮТЬ додаванням одиниці ДНК топоізомерази 1 з очищеного тимусу теляти (Life Technologies/Gibco-BRL, Paisley, United Kingdom) так, щоб реакція закінчилася за 15 хвилин при 37°С Реакцію зупиняють додаванням Змкл суміші, що містить 1% додецилсульфат натрію при 1%, 20мМ EDTA і 500мкг/мл протеїнази К У кожному ДОСЛІДІ суперспіралізовану плазмідну ДНК шкубували одну або з топоізомеразою 1 Реакція триває 15 хвилин Для кожної тестової сполуки або контролю (один розчинник є контролем), суперспіралізовану плазмідну ДНК інкубують у присутності щонайбільшої концентрації, вибраної для тестової сполуки, або контролю без ферменту або у присутності тестової сполуки, у діапазоні концентрацій 1мкМ—200мкМ або контролю у присутності ферментів Як наведено у Таблиці 1, в Прикладах 3—6 відбувається інгібування активності розкручування топоізомеразою 1 залежно від концентрації ТАБЛИЦЯ 1 10 Приклади Камптотецин 3 4 5 6 88,7 79,7 86,2 56,2 55,6 Комп'ютерна верстка О Воробей Мікромолярна концентрація 50 100 200 62,4 46,9 32,7 30,4 39,9 46,9 23,2 32,1 24,2 30,0 52,9 33,5 35,1 28,0 38,9 Підписано до друку 05 08 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюForms of prodrugs and new analogues of camptothecin, their application as medicines
Назва патенту російськоюФормы пролекарств и новые аналоги камптотецина, их применение в качестве лекарств
МПК / Мітки
МПК: C07D 471/14, A61P 43/00, A61P 35/00, A61K 31/4375, A61K 31/5365, C07D 491/22, C07D 498/22
Мітки: аналоги, фармацевтична, камптотецину, композиція, спосіб, варіанти, отримання
Код посилання
<a href="https://ua.patents.su/17-57757-analogi-kamptotecinu-sposib-kh-otrimannya-varianti-i-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Аналоги камптотецину, спосіб їх отримання (варіанти) і фармацевтична композиція</a>
Попередній патент: Горілка особлива “кримський сувенір”
Наступний патент: Аналоги камптотецину і фармацевтична композиція
Випадковий патент: Консерви "фарш особливий"