Дріжджі, що зброджують ксилозу у етанол (варіанти), плазмідний вектор та спосіб зброджування ксилози у етанол
Формула / Реферат
1. Дріжджі, що зброджують ксилозу у етанол, які містять гени, інтегровані до двох або більше з множини повторюваних сайтів рибосомної ДНК цих дріжджів, причому згадані гени кодують ксилозредуктазу, ксилітолдегідрогеназу та ксилулокіназу, а згадані дріжджі містять також реплікаційну/інтеграційну плазміду, до складу якої входять автономна реплікаційна послідовність і гени, що кодують ксилозредуктазу, ксилітолдегідрогеназу та ксилулокіназу.
2. Дріжджі за п. 1, які також зброджують глюкозу у етанол.
3. Дріжджі за п. 2, які належать до роду Saccharomyces.
4. Дріжджі за п. 3, причому згадані сайти є нетранскрибованими сайтами ДНК.
5. Дріжджі за п. 1, причому згадані гени злиті з промоторами, які не пригнічуються у присутності глюкози, і згадані дріжджі одночасно зброджують глюкозу та ксилозу у етанол.
6. Дріжджі за п. 5, причому згадані промотори не потребують ксилози для індукування.
7. Дріжджі за п. 3, причому згадані гени зливаються з промоторами, які не пригнічуються у присутності глюкози, і згадані дріжджі одночасно зброджують глюкозу та ксилозу у етанол.
8. Дріжджі за п. 4, причому згадані гени злиті з промоторами, які не пригнічуються у присутності глюкози, і згадані дріжджі одночасно зброджують глюкозу та ксилозу у етанол, причому згадані промотори також не потребують ксилози для індукування.
9. Дріжджі за п. 6, причому гени ксилозредуктази та ксилітолдегідрогенази походять від природних дріжджів, що зброджують ксилозу у етанол.
10. Дріжджі за п. 9, причому згаданими природними дріжджами є Candida Shehataе, Pichia stipitis або Pachysolen tannophilus.
11. Дріжджі за п. 9, причому ген ксилулокінази походить від дріжджів або бактерій.
12. Дріжджі за п. 11, причому ген ксилулокінази походить від Candida Shehatae, Pichia stipitis, Pachysolen tannophilus, Saccharomyces cerevisiaе, Schizosaccharomyces pombe або Escherichia coli.
13. Дріжджі за п. 1, причому згадані гени інтегровані до щонайменше приблизно 10 сайтів рибосомної ДНК цих дріжджів.
14. Дріжджі за п. 1, одержані шляхом трансформування клітин дріжджів плазмідою, до складу якої входять гени, що кодують ксилозредуктазу, ксилітолдегідрогеназу та ксилулокіназу, причому ці гени служать як селекційні маркери.
15. Дріжджі, що зброджують ксилозу у етанол, які містять дріжджі, які мають численні копії екзогенної ДНК, інтегровані до хромосомної ДНК даних дріжджів, причому згадана екзогенна ДНК містить гени, які кодують ксилозредуктазу, ксилітолдегідрогеназу та ксилулокіназу, злиті з промоторами, які не пригнічуються у присутності глюкози, причому ці дріжджі одночасно зброджують глюкозу та ксилозу у етанол і підтримують свою здатність до зброджування ксилози у етанол впродовж щонайменше 20 генерацій у разі культивування за неселективних умов.
16. Дріжджі за п. 15, причому згадані промотори не потребують ксилози для індукування.
17. Дріжджі, що зброджують ксилозу у етанол, які містять дріжджі, що мають численні копії впровадженої ДНК, яка містить гени, які кодують ксилозредуктазу, ксилітолдегідрогеназу та ксилулокіназу, причому згадані дріжджі зброджують ксилозу у етанол і підтримують свою здатність до зброджування ксилози у етанол у разі культивування за неселективних умов впродовж як мінімум 20 генерацій.
18. Дріжджі за п. 17, причому згадані промотори не потребують ксилози для індукування.
19. Спосіб зброджування ксилози у етанол, який включає зброджування ксилозовмісного середовища дріжджами за пп. 1, 15, 16, 17 або 18 для одержання етанолу.
20. Плазмідний вектор для інтегрування послідовності екзогенної ДНК до дріжджів для утворення стійких інтегрантів, які зброджують ксилозу у етанол, причому згаданий реплікаційний/інтергаційний плазмідний вектор містить дріжджеву функціональну автономну реплікаційну послідовність та екзогенну ДНК, яка містить гени, які кодують ксилозредуктазу, ксилітолдегідрогеназу та ксилулокіназу, фланковану з кожного кінця фланкувальною послідовністю ДНК, яка є гомологічною повторювальній послідовності ДНК дріжджової клітини-мішені.
Текст
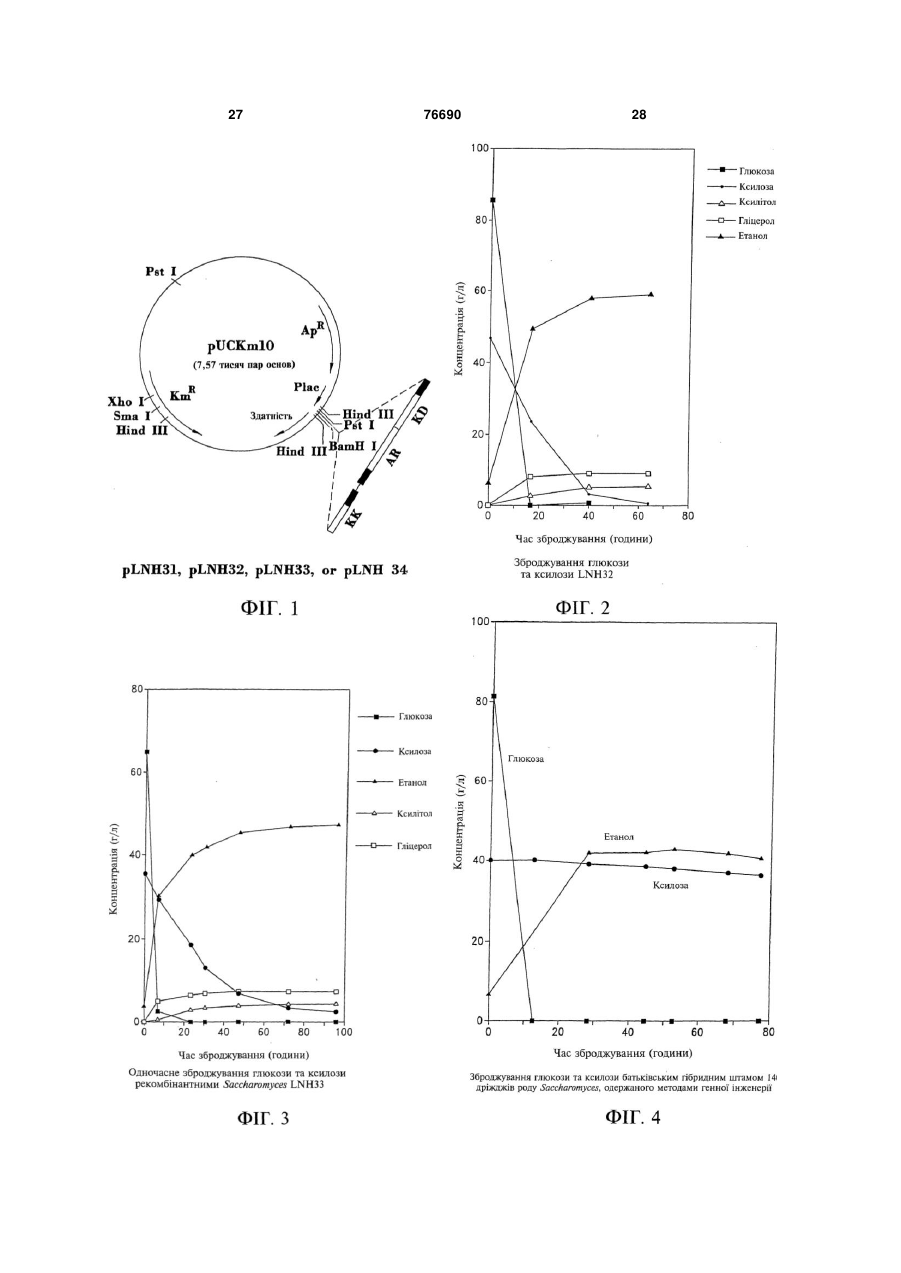
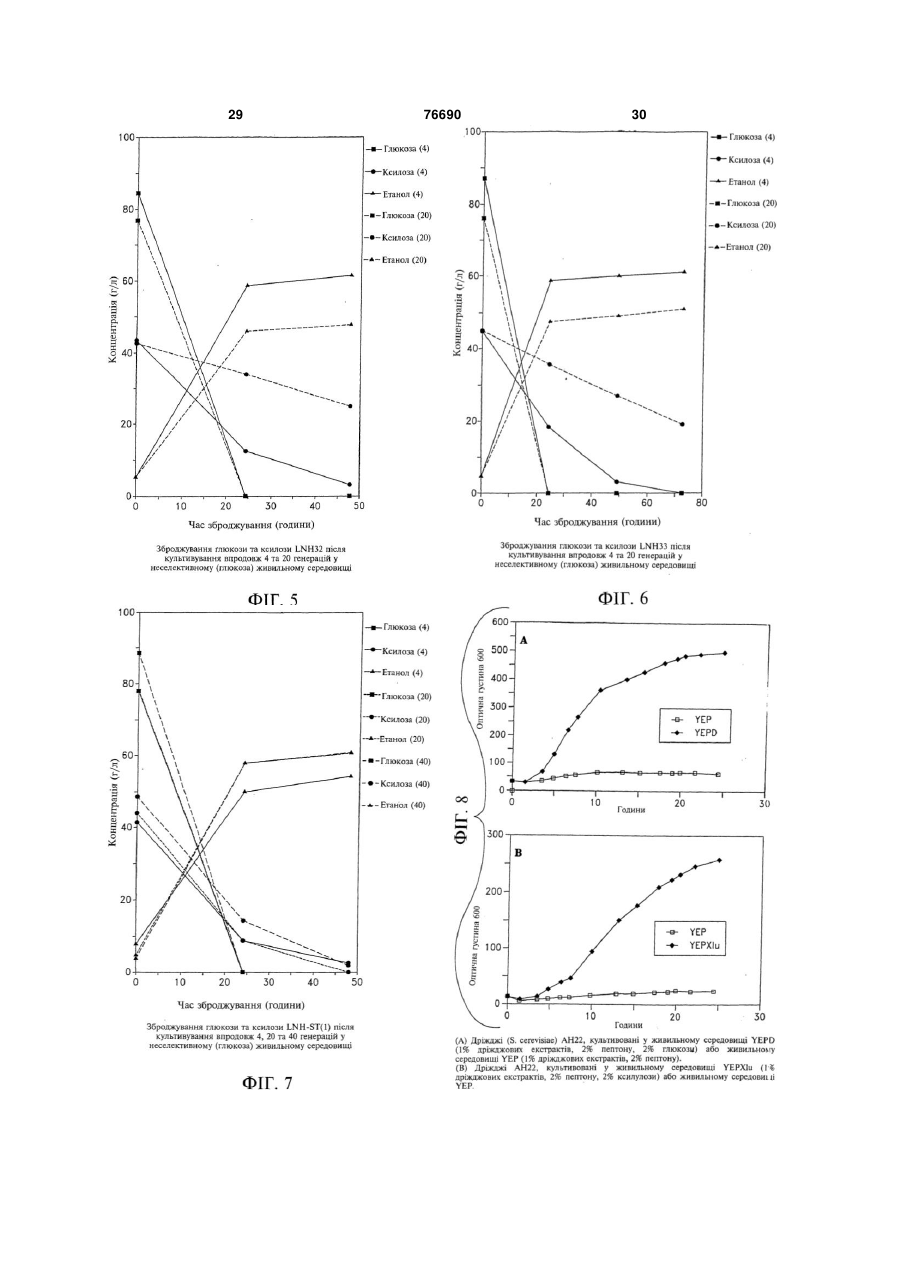
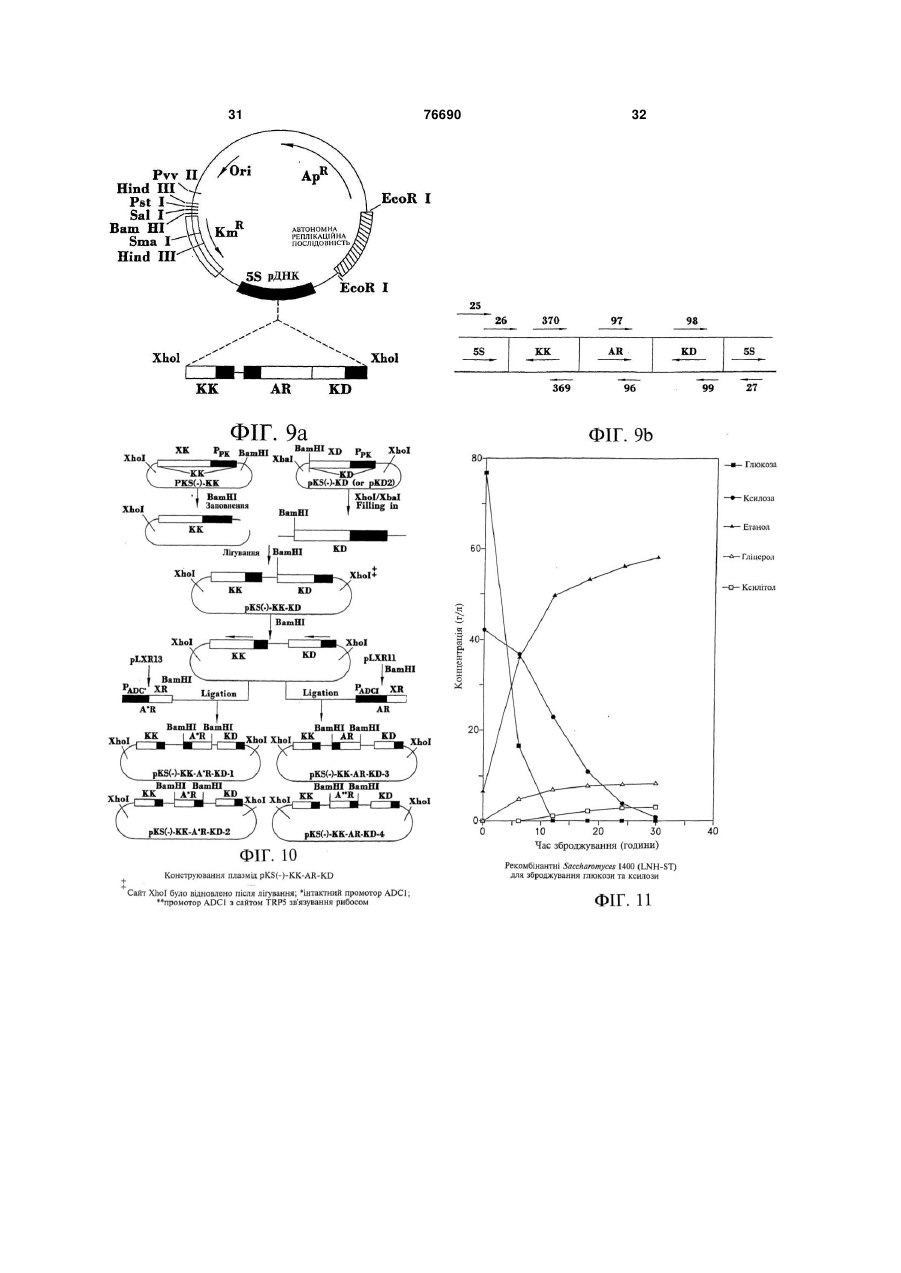
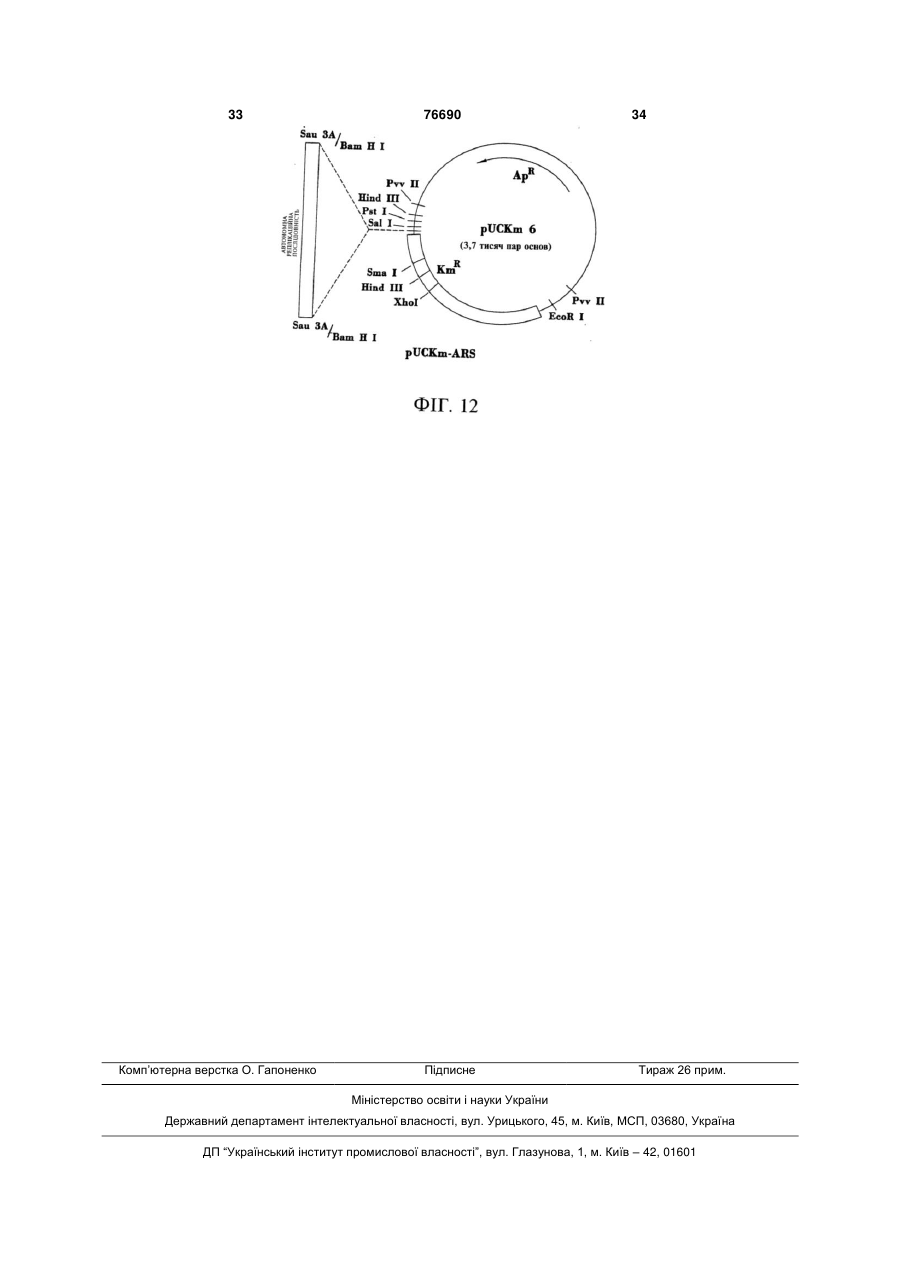
1. Дріжджі, що зброджують ксилозу у етанол, які містять гени, інтегровані до двох або більше з множини повторюваних сайтів рибосомної ДНК цих дріжджів, причому згадані гени кодують ксилозредуктазу, ксилітолдегідрогеназу та ксилулокіназу, а згадані дріжджі містять також реплікаційну/інтеграційну плазміду, до складу якої входять автономна реплікаційна послідовність і гени, що кодують ксилозредуктазу, ксилітолдегідрогеназу та ксилулокіназу. 2. Дріжджі за п. 1, які також зброджують глюкозу у етанол. 3. Дріжджі за п. 2, які належать до роду Saccharomyces. 4. Дріжджі за п. 3, причому згадані сайти є нетранскрибованими сайтами ДНК. 5. Дріжджі за п. 1, причому згадані гени злиті з промоторами, які не пригнічуються у присутності 2 (19) 1 3 76690 4 ксилозу у етанол і підтримують свою здатність до 19. Спосіб зброджування ксилози у етанол, який зброджування ксилози у етанол впродовж щонайвключає зброджування ксилозовмісного середоменше 20 генерацій у разі культивування за несевища дріжджами за пп. 1, 15, 16, 17 або 18 для лективних умов. одержання етанолу. 16. Дріжджі за п. 15, причому згадані промотори не 20. Плазмідний вектор для інтегрування послідовпотребують ксилози для індукування. ності екзогенної ДНК до дріжджів для утворення 17. Дріжджі, що зброджують ксилозу у етанол, які стійких інтегрантів, які зброджують ксилозу у етамістять дріжджі, що мають численні копії впрованол, причому згаданий реплікаційдженої ДНК, яка містить гени, які кодують ксилозний/інтергаційний плазмідний вектор містить дріжредуктазу, ксилітолдегідрогеназу та ксилулокіназу, джеву функціональну автономну реплікаційну причому згадані дріжджі зброджують ксилозу у послідовність та екзогенну ДНК, яка містить гени, етанол і підтримують свою здатність до зброджуякі кодують ксилозредуктазу, ксилітолдегідрогенавання ксилози у етанол у разі культивування за зу та ксилулокіназу, фланковану з кожного кінця неселективних умов впродовж як мінімум 20 генефланкувальною послідовністю ДНК, яка є гомолорацій. гічною повторювальній послідовності ДНК дріж18. Дріжджі за п. 17, причому згадані промотори не джової клітини-мішені. потребують ксилози для індукування. Цей винахід взагалі має відношення до мікроорганізмів, одержаних засобами генної інженерії, і, зокрема, до специфічних способів стійкого включення екзогенної ДНК до клітин, у тому числі, стійкого включення численних копій екзогенної ДНК до повторюваних послідовностей ДНК хазяїна. За своїм переважним аспектом, цей винахід має відношення до дріжджів, здатних до зброджування ксилози (у переважному варіанті, до зброджування ксилози з глюкозою) у етанол. Зокрема, за своїм переважним аспектом цей винахід має відношення до дріжджів, до складу яких входять клоновані гени, які кодують ксилозредуктазу (XR), ксилітолдегідрогеназу (XD) та ксилулокіназу (ХК), причому згадані дріжджі, по суті, зберігають свою ефективність відносно зброджування ксилози у етанол навіть після культивування у неселективному живильному середовищі впродовж значної кількості генерацій. Як додаткова передумова, результати нещодавніх досліджень підтвердили те, що етанол є ідеальним рідким паливом для автомобілів. Він може бути використаним безпосередньо, як чисте паливо (100% етанол), або як суміш з бензином у різних концентраціях. Застосування етанолу, як додатка до або замінника бензину може зменшити залежність багатьох країн від імпортованої закордонної нафти, а також забезпечити відновлювальне паливо для транспорту. На додаток до цього, виявилось, що етанол забезпечує більш чисте паливо, яке виділяє набагато менше забруднювачів до довколишнього середовища, аніж звичайний бензин. Наприклад, було продемонстровано, що використання у бензині матеріалів, насичених киснем, може зменшити викид у повітря моноксиду вуглецю, шкідливого забруднювача. Серед декількох оксигенаторів, які застосовуються сьогодні для підвищення вмісту кисня у бензині, найвищий вміст кисня має етанол. Агентство по захисту довколишнього середовища (США) показало, що бензин, змішаний з 10% етанолу, зменшує викиди моноксиду вуглецю, приблизно, на 25-30%. До сього часу, сировиною, яка використовувалась для одержання технічного спирту шляхом зброджування, були цукри з цукрового очерету або цукрового буряка та крохмаль з кукурудзи або інших продовольчих культур. На цей час, однак, згадані сільськогосподарські культури розглядаються, як надто дорогі для використання як сировина з метою великомасштабного продукування паливного етанолу. Рослинна біомаса є привабливою сировиною для продукування паливного етанолу шляхом зброджування, оскільки вона є відновлювальною та доступною за низькими цінами та у великих кількостях. Згадана концепція використання спирту, виробленого шляхом мікробіологічного зброджування цукрів біомаси сільськогосподарських культур, народилась, як мінімум, два десятиріччя тому. Головними зброджувальними цукрами з целюлозних матеріалів є глюкоза та ксилоза, причому співвідношення між глюкозою та ксилозою складає, приблизно, від 2 або 3 до 1. Найбажанішими способами зброджування целюлозних матеріалів були б, звичайно, такі, які повністю перетворюють глюкозу та ксилозу у етанол. На жаль, навіть зараз немає жодного відомого природного мікроорганізму, здатного до ефективного зброджування глюкози та ксилози. Дріжджі, зокрема, дріжджі роду Saccharomyces, традиційно застосовують для зброджування глюкозовміщувальної сировини у етанол і вони все ще розглядаються, як найкращі мікроорганізми для цієї мети. Встановлено, однак, що ці глюкозозброджувальні дріжджі, у тому числі, дріжджі роду Saccharomyces, є нездатними до зброджування ксилози, а також нездатними до використання згаданого пентозного цукру для росту. Нещодавно Η. Γο (Ν. Но) та інші одержали рекомбінантні дріжджі, зокрема, рекомбінантні дріжджі роду Saccharomyces, здатні до ефективного зброджування ксилози у етанол (Го та Цао (Tsao), 1995). Зокрема, переважні рекомбінантні дріжджі були здатними до комбінованого зброджування двох головних цукрових складових целюлозної біомаси, глюкози та ксилози, у етанол (Го та Цао, 1993). Згадані рекомбінантні дріжджі було створено шляхом трансформування дріжджів мультико 5 76690 6 пійною плазмідою, до складу якої входили три клонування необхідного гену у дріжджовій хромоклоновані гени, XR, XD та ХК, які кодують три клюсомі шляхом інтегрування є, по-перше, клонування чові ферменти для метаболізму ксилози (Фігура 1). необхідного гену у плазміді, до складу якої не вхоНа Фігурі 2 та Фігурі 3 показано двоє попередньо дить сайт ініціювання реплікації або ARS (автоноутворених рекомбінантних дріжджів роду мні реплікаційні послідовності), але до складу якої Saccharomyces, позначених, як 1400 (pLNH32) та входить фрагмент ДНК хазяїна для спрямування 1400 (pLNH33), здатних до комбінованого зброінтеграції до певного сайту (Орр-Вівер, 1981). Траджування 8% глюкози та 4% ксилози, присутніх у нсформація нових дріжджів-хазяїв таким інтактним одному середовищі, майже повністю у етанол інтеграційним вектором приведе до утворення впродовж двох днів. З іншого боку, на Фігурі 4 поінтеграційних трансформантів, до складу яких буказано, що батьківський дріжджовий гібрид 1400 де входити необхідний ген, клонований у сайті (Д'Амор (D'Amore) та інші, 1989 та Д'Амор та інші, поряд з вибраною цільовою послідовністю ДНК 1990) може зброджувати у етанол тільки глюкозу, дріжджів. Однак, частота такої інтеграційної транале не ксилозу. 1400 (pLNH32) (скорочено, LNH32) сформації є надзвичайно низька (від 1 до 10 транта 1400 (pLNH33) (скорочено, LNH33) було ствосформантів на мкг ДНК). У подальшому, було порено шляхом трансформування гібриду казано, що інтеграційні вектори, лінеаризовані у Saccharomyces 1400 (Д'Амор та інші, 1989 та Д'Амежах фрагменту ДНК, гомологічного хромосомній мор та інші, 1990) за допомогою двох мультикопійДНК хазяїна, можуть трансформувати дріжджі з них плазмід, pLNH32 та pLNH33, які представлено набагато вищою частотою (вищою у 100-1000 рана Фігурі 1. На цей час є повідомлення про існузів) (Орр-Вівер, 1981; Орр-Вівер та Шостак вання чотирьох таких мультикопійних плазмід, (Szostak), 1983). Було висунуто припущення, що pLNH31, pLNH32, pLNH33 та pLNH34 (Го та Цао, двониткові розриви, внесені рестриктазним роз1995). Кожна з цих плазмід може трансформувати щепленням, є рекомбіногенними та високоінтеракгібрид 1400 до рекомбінантних дріжджів для комтивними з гомологічною хромосомною ДНК. Це є бінованого зброджування глюкози та ксилози з особливо придатним у разі комплексної плазміди, однаковою ефективністю. до складу якої входить більше одного дріжджового Дріжджі 1400 (pLNH32), 1400 (pLNH33) та спогену, завдяки чому інтеграцію можна спрямувати ріднені рекомбінантні ксилозозброджувальні дріждо певного сайту шляхом утворення рестриктазноджі роду Saccharomyces, з їхніми генами до метаго розрізу на відповідній ділянці плазм іди. болізування ксилози, клонованими на 2мкм У іншому типі інтеграції, який називають також стабільній мультикопійній плазміді, є цілком припереміщенням або розділенням генів, застосовудатними для періодичного зброджувального проють подвійну гомологічну рекомбінацію для заміцесу. Однак, під час безперервного зброджувальщення дріжджової хромосомної ДНК (Ротстейн ного процесу, після тривалого культивування у (Rothstein), 1981). До складу подвійних гомологічживильному середовищі, збагаченому глюкозою них рекомбінаційних векторів входить екзогенна (більше 20 генерацій), 1400 (pLNH32), 1400 ДНК або ген(-и), призначений(і) для клонування, та (pLNH33) та подібні плазмідопосередковані рекоселекційний маркер, фланкований послідовностямбінантні дріжджі втрачають здатність до зброми ДНК дріжджів, гомологічних 5' та 3' ділянкам джування ксилози, як показано на Фігурі 5 та сегменту хромосомної ДНК, призначеним для заФігурі 6. міщення. Перед трансформацією, згаданий вектор Взагалі, екзогенна ДНК або ген(и) можуть бути розщеплюють рестриктазами, які вивільняють пеклонованими у дріжджах двома різними шляхами. ремісний фрагмент, до складу якого входять 5' та Одним з них є клонування екзогенної ДНК або ге3' кінці, гомологічні послідовностям хромосомної ну(-ів) у векторі на основі плазміди, до складу якоДНК на необхідних сайтах інтеграції. Останній згаго входить генетичний маркер, що селектується, даний спосіб став переважним способом інтеграта функціональний сайт ініціювання реплікації ДНК ційної трансформації дріжджів у разі необхідності дріжджів або автономна реплікаційна послідоводержання стійкого монокопійного трансформанту. ність (ARS) (Струл (Struhl) та інші, 1979; Стінчкомб Ряд способів, заснованих на інтеграції до по(Stinchcomb) та інші, 1980; Чен (Chan) та Тай (Туе), вторюваної послідовності ДНК, було використано 1980), що наділяє плазміду здатністю до автономдля одержання стійких мультикопійних інтегрантів. ної реплікації у її новому хазяїні з наступним транНаприклад, дельта-послідовність дріжджового сформуванням бажаних дріжджів-хазяїв згаданою ретротранспозону Ту (Сакаі (Sakаi) та інші, 1990; плазмідою, до складу якої входить клонований Сакаі та інші, 1991), висококонсервативний повтофрагмент ДНК або ген(-и). Утворені дріжджові рюваний сигма-елемент (Кудла (Kudla) та Ніколас трансформанти є здатними до стійкої підтримки (Nicolas), 1992) та нетранскрибовані послідовності клонованого гену у присутності селекційного тиску. рибосомної ДНК (Лопес (Lopes) та інші, 1989; ЛоОднак, такий клонований ген(-и) є нестійким після пес та інші, 1991; Россоліні (Rossolini) та інші, тривалого культивування у неселективному живи1992) було використано, як сайти-мішені для мнольному середовищі (за відсутності селекційного жинної інтеграції екзогенного гену(-ів) до дріжджів тиску). (Ротстейн, 1991; Романос (Romanos) та інші, Іншим способом клонування екзогенної ДНК 1992). або гену(-ів) у дріжджах-хазяях є інтегрування ДНК Під час виконання недавніх досліджень по або гену(-ів) до дріжджової хромосоми. У дріжджів множинній інтеграції екзогенних генів до дріжджоінтеграційне трансформування майже завжди відвої хромосоми, результати яких повідомлялись у бувається шляхом гомологічної рекомбінації (Оррлітературі, було залучено, головним чином, викоВівер (Orr-Weaver), 1981). Найпростішим шляхом ристання або відповідним чином лінеаризованих 7 76690 8 нереплікаційних векторів, або фрагментів ДНК, до метою стимулювання затримки реплікаційної та складу яких входив необхідний ген(-и), призначеінтеграційної плазміди у наступних генераціях кліний для клонування, та генетичний маркер для тин-попередників та утворення клітинселекції, фланкованих послідовностями ДНК, гопопередників, які мають численні інтегровані копії мологічними ділянці хромосомної ДНК дріжджів. екзогенної ДНК. На додатковому етапі, згадані Для здійснення згаданої рекомбінантнзї трансфоклітини з етапу (b) можуть реплікуватись для одермації подеколи використовували лінеаризовані ржання ряду генерацій клітин-попередників за відреплікаційні вектори і майже ніколи інтактні реплісутності відбору клітин, які включають селекційний каційні вектори, наприклад, інтактні вектори на маркер, з метою стимулювання втрати плазміди у основі автономних реплікаційних послідовностей. наступних генераціях клітин-попередників (внасліТаким чином, з часу проведення ранніх дослідок чого залишається збагачена популяція стійких джень відносно започаткування розвитку інтеграінтегрантів). ційної трансформації дріжджів (Шостак та By (Wu) Цей винахід також надає переважний спосіб (1979)) та незважаючи на повідомлення про те, що відбору та підтримки необхідних трансформантів. ДНК, клонована на векторах на основі ARS, може Добре відомо, що усі мікроорганізми для росту інтегруватись до хромосом хазяїна (Крегг (Cregg) потребують присутності у мінімальному живильта інші, 1985; Курц (Kurtz) та інші, 1986), від застоному середовищі джерела вуглецю, наприклад, сування інтактних векторів на основі ARS (Струл глюкози або ксилози. Більшість мікроорганізмів, та інші, 1979; Стінчкомб та інші, 1980; Чен та Тай, однак, не потребує присутності джерела вуглецю 1980) для інтеграційних цілей давно відмовились. для росту у збагаченому живильному середовищі. Це стало особливо помітним з моменту відкриття Незважаючи на це, цим винаходом передбачаєтьтого, що двониткові розриви, здійснені шляхом ся використання джерела вуглецю, як селекційнорестриктазного розщеплення, є рекомбіногенними го тиску для відбору трансформантів навіть у зба(Орр-Вівер, 1981; Орр-Вівер та Шостак, 1983). гаченому живильному середовищі, наприклад, У світлі згаданих передумов, залишається неYEP (1% дріжджового екстракту плюс 2% пептону). обхідність у більш стійких дріжджах, які зброджуРозробку стійких трансформантів, наприклад, 1400 ють ксилозу у етанол, у переважному варіанті, (LNH-ST) (Фігура 7), здатних до ефективного зброодночасно ксилозу та глюкозу у етанол, та у легджування ксилози після культивування у неселекких та ефективних способах одержання мультикотивному живильному середовищі впродовж, по пійних інтегрантів. Цей винахід адресовано задосуті, необмеженої кількості генерацій, було значно воленню згаданих потреб. полегшено відкриттям того, що багато дріжджів, Відповідно, цей винахід надає дріжджі, до зокрема, дріжджі роду Saccharomyces, природно складу яких входять численні копії стійко клоновапотребують присутності джерела вуглецю, наприних XR, XD та ХК генів, які навіть після культивуклад, ксилози або глюкози, для росту навіть у збавання у неселективному живильному середовищі гаченому живильному середовищі, як показано на впродовж численних генерацій (наприклад, більше Фігурі 8. 20) зберігають свою повну здатність до зброджуУ широкому аспекті, цей винахід також надає вання ксилози у етанол. У більш переважному спосіб інтегрування численних копій екзогенної варіанті, XR, XD та ХК гени повністю зливаються з ДНК до повторюваної хромосомної ДНК згаданих промоторами, не пригніченими присутністю глюкоклітин. Згаданий спосіб включає (а) трансформази і які також не потребують присутності ксилози цію згаданих клітин реплікаційною та інтеграційдля своєї експресії. У ще більш переважному варіною плазмідою, яка має екзогенну ДНК, яка вклюанті, дріжджі за цим винаходом можуть комбіновачає селекційний маркер. Згаданий спосіб також но зброджувати дві головні складові целюлозної включає (b) реплікацію згаданих клітин з етапу (а) біомаси, глюкозу та ксилозу, у етанол. для одержання ряду генерацій клітинІнший варіант здійснення цього винаходу має попередників з відбиранням клітин, які включають відношення до використання повторюваних посліселекційний маркер з метою стимулювання затридовностей, наприклад, нетранскрибованих послімки реплікаційної та інтеграційної плазміди у надовностей рДНК, прилеглих до 5S ДНК (Валензуеступних генераціях клітин-попередників та утвола (Valenzuela) та інші, 1977), як гомологічних рення клітин-попередників, які мають численні послідовностей для спрямування мультикопійної інтегровані копії екзогенної ДНК. У специфічному інтеграції фрагменту ДНК, до складу якого входять варіанті застосування, згаданий спосіб включає (і) XR, XD та ХК, до геному дріжджів шляхом гомолотрансформацію дріжджових клітин реплікаційною гічної рекомбінації. Наприклад, реплікаційний плаплазмідою, яка має екзогенну ДНК, яка включає змідний вектор, до складу якого входить фрагмент селекційний маркер, причому згадана екзогенна ДНК, фланкований гомологічними послідовностяДНК фланкується з кожного кінця послідовністю ми, може бути використаний для спрямованої інтеДНК, гомологічною повторюваній послідовності грації фрагменту ДНК. Переважний спосіб за цим ДНК хазяїна; (іі) повторну реплікацію згаданих винаходом включає етапи (а) трансформування трансформованих дріжджових клітин з етапу (і) клітин реплікаційною/інтеграційною плазмідою, яка для одержання ряду генерацій клітинвключає екзогенну ДНК, до складу якої входить попередників з відбиранням клітин, які включають селекційний маркер; та (b) повторної реплікації селекційний маркер, з метою стимулювання зазгаданих клітин з етапу (а) для одержання ряду тримки реплікаційної плазміди у наступних генегенерацій клітин-попередників з відбиранням кліраціях клітин-попередників та одержання клітинтин, які включають селекційний маркер (наприпопередників, які мають численні інтегровані копії клад, реплікацією на селективних планшетах), з екзогенної ДНК; та (ііі) реплікацію клітин 9 76690 10 попередників з етапу (іі) для одержання ряду геневість їх використання за неселективних умов (нарацій клітин-попередників за відсутності відбору приклад, у безперервних процесах зброджування) клітин, які включають селекційний маркер для для комбінованого зброджування ксилоли та глюстимулювання втрати плазмід наступними генеракози у етанол без втрати ними здатності до зброціями клітин-попередників та виділення дріжджоджування ксилози. На додаток до цього, цей винавих клітин, кожна з яких включає численні копії хід надає способи та матеріали для одержання екзогенної ДНК, інтегровані до її хромосомної ДНК. стійких мультикопійних інтегрантів дріжджових та За ще іншим варіантом втілення, цей винахід інших клітин, які є легкими до здійснення і які монадає дріжджі, які зброджують ксилозу у етанол, жуть бути контрольованими для модулювання причому згадані дріжджі мають численні копії екзокількості копій інтегрованої екзогенної ДНК. Додатгенної ДНК, інтегровані до їх хромосомної ДНК. кові варіанти втілення, характерні особливості та Екзогенна ДНК включає гени, які кодують ксилозпереваги цього винаходу будуть очевидними з редуктазу, ксилітолдегідрогеназу та ксилулокіназу, наведеного дачі опису та пунктів формули винахозлиті з промоторами, які не пригнічують глюкозу, ду, яка додається. де згадані дріжджі одночасно зброджують глюкозу На Фігурі 1 показано рестрикційну карту згадата ксилозу у етанол та, по суті, зберігають свою них плазмід pLNH31, -32, -33 та 34, та клонованих здатність до зброджування ксилози у етанол впроу них генів. довж, як мінімум, 20 генерацій, навіть у випадку На Фігурі 2 показано, що дріжджовий трансфокультивування за неселективних умов. рмант 1400 (pLNH32) (скорочено, LNH32) може Інший аспект цього винаходу має відношення ефективно комбіновано зброджувати глюкозу та до способів зброджування ксилози у етанол, які ксилозу. Умови, застосовані для культивування включають зброджування ксилозовміщувальних дріжджів та для зброджування цукрів є подібними середовищ за допомогою дріжджів за цим винаходо умов, опис яких наведено у Прикладі 7. дом. На Фігурі 3 показано, що дріжджовий трансфоІнший варіант втілення цього винаходу надає рмант 1400 (pLNH33) (скорочено, LNH33) може плазмідний вектор для інтегрування послідовності ефективно комбіновано зброджувати глюкозу та екзогенної ДНК, яка включає селекційний маркер, ксилозу. Умови, застосовані для культивування до хромосомної ДНК дріжджової клітини-мішені. дріжджів та для зброджування цукрів є подібними До складу плазмідного вектору за цим винаходом до умов, опис яких наведено у Прикладі 7. входить функціональний сайт ініціювання реплікаНа Фігурі 4 показано, що батьківський дріжції ДНК дріжджів та екзогенна ДНК, яка включає джовий гібридний штам 1400 може зброджувати селекційний маркер, фланкований на кожному глюкозу і не може зброджувати ксилозу. Умови, кінці ДНК-фланкувальною послідовністю, яка є застосовані для культивування дріжджів та для гомологічною повторюваній послідовності рибосозброджування цукрів є подібними до умов, опис мної ДНК дріжджової клітини-мішені. Згадана плаяких наведено у Прикладі 7. зміда додатково включає другий селекційний марФігура 5 демонструє, що дріжджовий транскер у позиції, яка відрізняється від позиції між ДНКформант 1400 (pLNH32) (скорочено, LNH32) з його фланкувальними послідовностями. генами до метаболізування ксилози, клонованими За іншим додатковим варіантом втілення, цей у реплікаційній плазміді pLNH32, є нестійким у невинахід надає плазмідний вектор для інтегрування селективному живильному середовищі. Після купослідовності екзогенної ДНК до дріжджів з метою льтивування впродовж 20 генерацій у неселективутворення стійких інтегрантів, які зброджують ксиному (наприклад, глюкозі) живильному лозу у етанол. Згаданий вектор включає функціосередовищі, 1400 (pLNH32) втрачає свою здатнальний сайт ініціювання реплікації ДНК дріжджів ність до зброджування ксилози. та екзогенну ДНК, яка включає гени, які кодують Фігура 6 демонструє, що дріжджовий трансксилозредуктазу, ксилітолдегідрогеназу та ксилуформант 1400 (pLNH33) (скорочено, LNH33) з його локіназу, фланковані з кожного кінця ДНКгенами до метаболізування ксилози, клонованими фланкувальною послідовністю, гомологічною поу реплікаційній плазміді pLNH33, є нестійким у невторюваній послідовності ДНК дріжджової клітиниселективному живильному середовищі. Після кумішені. льтивування впродовж 20 генерацій у неселективЗа іншим додатковим аспектом, цей винахід ному живильному середовищі, (наприклад, надає спосіб одержання клітин, які мають численні глюкозному живильному середовищі), 1400 інтегровані копії фрагменту екзогенної ДНК. Спосіб (pLNH33) втрачає свою здатність до зброджування за цим винаходом включає реплікацію клітин, які ксилози. мають повторювану геномну ДНК та до складу На Фігурі 7 показано, що дріжджовий трансфояких входить реплікаційна та інтеграційна плазмірмант 1400 (LNH-ST) (скорочено, LNH-ST) може да, яка включає екзогенну ДНК, для одержання стійко підтримувати свою здатність до зброджучисленних генерацій клітин-попередників з відбовання ксилози навіть після культивування у несером клітин, до складу яких входить селекційний лективному живильному середовищі впродовж маркер з метою стимулювання затримки реплікабільше ніж 40 генерацій. ційної та інтеграційної плазміди у наступних генеФігура 8 демонструє, що S. cerevisiae та інші раціях клітин-попередників та одержання клітиндріжджі роду Saccharomyces потребують джерела попередників, які мають численні інтегровані копії вуглецю для росту навіть у тому разі, коли у живиекзогенної ДНК. льному середовищі є присутніми збагачені живиЦей винахід надає дріжджі, до складу яких льні середовища, наприклад, дріжджовий екстракт входять стійкі клоновані гени, які надають можлита пептон. Ці експерименти показали, наприклад, 11 76690 12 що S. cerevisiae неспроможні були рости у живи1400 до 1400 (pLNH32) та 1400 (pLNH33), відповільному середовищі YEP, до складу якого входить дно. Ці рекомбінантні дріжджі роду Saccharomyces 1% дріжджового екстракту та 2% пептону, однак, можуть ефективно комбіновано зброджувати як виявились здатними до росту після того, як до глюкозу, так і ксилозу, що присутні у тому ж саможивильного середовища YEP було додано глюкозу му живильному середовищі, у етанол, яκ показано та ксилулозу. на Фігурах 2 та 3, у той час, як батьківські дріжджі На Фігурі 9А показано рестрикційну карту 1400, які не було піддано обробці методами генеpLNH-ST та клоновані у ньому гени. тичної інженерії, можуть зброджувати лише глюкоНа Фігурі 9В показано генетичну карту (порязу і не здатні до комбінованого зброджування глюдок та орієнтацію) генів (5S рДНК, КК, AR та KD), кози та ксилози (Фігура 4). клонованих у pLNH-ST. Олігонуклеотиди (наприПлазмідопосередковані рекомбінантні дріжджі клад, олігонуклеотид 25, олігонуклеотид 26 і т.п.), можуть підтримувати клоновані гени у присутності які знаходяться вище та нижче генетичної карти, є селекційного тиску і не здатні до цього за його відпраймерами, які було використано для визначення сутності. Як показано на Фігурах 5 та 6, 1400 поряди та орієнтації клонованих генів за допомо(pLNH32) та 1400 (pLNH33), врешті-решт, втрачагою полімеразно-ланцюгової реакції (PCR). ють свої плазміди та здатність до зброджування Фігура 10 є схематичною діаграмою, на якій ксилози після тривалого культивування за відсутзображено конструкцію плазміди pBluescript II KS(ності селекційного тиску. ), до складу якої входять клоновані гени XR, XD, Вкрай бажано, щоб рекомбінантні технічні дріХК: було сконструйовано чотири такі плазміди. жджі, зокрема ті штами, які використовуються для Фрагмент KK-AR-KD, клонований у pKS(-)-KK-ARодержання великих об'ємів технічних продуктів, KD-3 було обрано до клонування у pUCKm-рДНК наприклад, етанолу, були стійкими без запотребу(5S)-ARS для конструювання pUCKm-рДНК (5S) вання присутності селекційного тиску. Розробка (KRD)-ARS, який було позначено також, як рекомбінантних дріжджів, до складу яких входять pLNH-ST. інтегровані XR, XD та ХК гени, як, наприклад, у На Фігурі 11 показано, що дріжджовий трансцьому винаході, забезпечує таку стійкість. На доформант 1400 (LNH-ST) (скорочено, LNH-ST), який даток до цього, для того, щоб одержані рекомбінаперевищує 1400 (pLNH 32) та 1400 (pLNH 33), монтні дріжджі мали здатність до комбінованого же ефективно комбіновано зброджувати глюкозу зброджування глюкози та ксилози з ефективністю, та ксилозу. Умови, застосовані для культивування яка є подібною до або перевершує ефективність дріжджів та для зброджування цукрів є подібними 1400 (pLNH32) та 1400 (pLNH33), до складу згадаумовам, опис яких наведено у Прикладі 7. них рекомбінантних дріжджів повинні входити не На Фігурі 12 показано гени, клоновані у плазтільки інтегровані гени до метаболізування ксиломіді з широким колом хазяїв га рестрикційну карту зи, але і численні копії таких інтегрованих генів. За згаданої плазміди з широким колом хазяїв для переважними аспектами цього винаходу, мультивиділення фрагментів ДНК, до складу яких вхокопійні (hсn) інтегранти дріжджів (тобто дріжджі, які дить ARS, з хромосомної ДНК S. cerevisiae та інмають, як мінімум, приблизно, 10 інтегрованих ших дріжджів. копій екзогенної ДНК) було одержано шляхом виЗ метою поліпшення розуміння принципів цьозначення некодувальної ділянки, наприклад, некого винаходу, у подальшому буде робитись посидувальної ділянки 5S рибосомної ДНК (рДНК), ділання на певні переважні варіанти його втілення лянкою для множинної інтеграції. та для їх опису буде використано специфічну морДНК надає переважне місце для інтегруванву. Незважаючи на це, слід розуміти, що це не ня, оскільки вона є висококонсервативною, а дріжпризначено до будь-якого обмеження обсягу цього джі, взагалі, включають більше 100 копій повторвинаходу, оскільки цим винаходом передбачаютьних послідовностей рДНК. Слід розуміти, однак, ся такі зміни, додаткові модифікації та застосуванщо для одержання дріжджів за цим винаходом, ня принципів цього винаходу, які були б очевидзовсім не обов'язково здійснювати інтегрування ними фахівцю у галузі техніки, дο якої належить необхідних генів у кожному випадку повторної або цей винахід. повторюваної послідовності. У відповідності до Як згадувалось перед тим, за одним з перевашироких аспектів цього винаходу, достатнім вижних аспектів, цей винахід надає рекомбінантні явиться здійснення такої інтеграції на кожній з дріжджі, до складу яких входять стійко клоновані множинних ділянок повторюваної послідовності, XR, XD та ХК гени, які представляють поліпшення тобто на двох або більше ділянках. у порівнянні до попередніх рекомбінантних дріжЗ метою інтегрування hcn XR, XD та ХК до джів. Взагалі, повідомлялось про рекомбінантні дріжджової хромосоми на ділянці 5S рДНК, було дріжджі, які можуть ефективно комбіновано збросконструйовано інтеграційну плазміду pLNH-ST, як джувати глюкозу та ксилозу, що присутні у тому ж показано на Фігурі 9. pLNH-ST є "човниковим" вексамому живильному середовищі (Го та Цао, 1995). тором на основі дріжджів - Е. соІі та похідною плаДріжджі за цим винаходом було одержано шляхом зміди pUCKm 6 (Го та інші, 1984). Послідовність 5S клонування відповідно до модифікованих XR, XD рДНК було вставлено до сайту рестрикції Xhol та ХК генів на мультикопійній плазміді, pUCKm10, pUCKm 6. Послідовність 5S рДНК було скопійоваз наступним використанням утвореної плазміди, но з дріжджової хромосомної ДНК за допомогою pLNH3X (Х=від 1 до 4) (Фігура 1), для трансфорполімеразно-ланцюгової реакції та модифіковано мування придатних природних дріжджів. Напризасобами сайт-специфічного мутагенезу для доклад, плазміди pLNH32 та рLNН33 було викорисдання сайту рестрикції Xhol до її центральної тано для трансформування гібридних дріжджів від (приблизно) послідовності, як показано на Фігурі 9. 13 76690 14 Фрагмент Xhol з pKS(-)-KK-AR-KD (Фігура 10) (Го манти можуть культивуватись у селективному жиva Цао, 1995) було вставлено до сайту Xhol 5S вильному середовищі і трансформантами, які зберДНК, клонованого у pLNH-ST. режуть здатність до ефективного росту у селектиpLNH-ST відрізняється від інших традиційних вному живильному середовищі, виявляться ті з hcn дріжджових інтеграційних векторів на основі них, які будуть включали численні копії необхідних 5S рДНК тим, що до його складу входить також екзогенних генів, інтегрованих до хромосоми дріжфункціональна дріжджова автономна реплікаційна джів або інших клітин-хазяїв. Наприклад, дріжджопослідовність (ARS) (Струл та інші, 1979; Стінчвий гібрид 1400 було трансформовано за допомокомб та інші, 1980; Чен та Тай, 1980), як показано гою pLNH-ST у відповідності до процедур, на Фігурі 9. Таким чином, pLNH-ST є одночасно наведених перед тим, і одержані стійкі рекомбінареплікаційним та інтеграційним вектором. Специнтні дріжджі, 1400 (LNH-ST), можуть комбіновано фічним чином, під час одержання рекомбінантних зброджувати як глюкозу, так і ксилозу краще, аніж дріжджів, до складу яких входить велика кількість 1400 (pLNH32) та 1400 (pLNH33), як показано на копій XR, XD та ХК, pLNH-ST функціонує спочатку, Фігурі 11. Важливо те, що новоутворені стійкі реяк реплікаційний вектор, потім як інтеграційний комбінантні дріжджі, 1400 (LNH-ST), все ще зберівектор. Згаданий фрагмент ARS було вставлено гають здатність до зброджування як глюкози, так і до сайту EcoR1 pUCKm 6. На додаток до цього, до ксилози з рівною ефективністю піа/я культивуванскладу pLNH-ST входить також ген стійкості до ня у неселективному живильному середовищі канаміцину (KmR) та ген стійкості до ампіциліну впродовж 4, 20 тa 40 генерацій, як показано на (ApR). KmR функціонує у дріжджах, як ген стійкості Фігурі 7, у той час, як 1400 (pLNH32) та 1400 до генетицину і передасть стійкість до генетицину (pLNH33) утратять більшу частину активності до дріжджовим трансформантам. Сайт Xhol KmR було зброджування ксилози після культивування у невидалено за допомогою полімеразно-ланцюгової селективному живильному середовищі впродовж реакції без впливу на його активність. Як KmR, так і 20 генерацій (Фігури 5 та 6). На додаток до цього, ApR є складовими вихідної плазміни pUCKm 6. 1400 (LNH-ST) у подальшому культивували у неЯк зазначалось раніше, вектори, опис яких населективному живильному середовищі впродовж ведено перед тим, відрізняються від векторів, які декількох сотень генерацій і він все так же зберігав було використано у способах відомого рівня техніповну активність до комбінованого зброджування ки тим, що до їх складу входить автономна репліяк глюкози, так і ксилози. каційна послідовність (ARS). На додаток до цього, У переважних способах одержання стійких hcn у попередніх способах одержання hcn дріжджових інтегрантів, для відбору та підтримки як плазмідінтегрантів, інтеграція клонованих генів відбуваопосередкованої активності, так і активності, залась миттєво, у той момент, коли згадані дріжджобезпеченої інтегрованими генами, за допомогою ві клітини трансформуються екзогенними генами. того ж самого селективного живильного середоУ протилежність цьому, у відповідності до перевавища, використовують загальний(-і) селекційний(-і) жних способів за цим винаходом, інтеграція кломаркер(-и). У цій роботі загальними селекційними нованих генів продовжує відбуватись поступово, маркерами є три клоновані гени до метаболізації ще довго піст я того, як було завершено трансфоксилози, XR, XD та ХК, у той час, як загальним рмацію. Зокрема, трансформація спочатку відбуселективним живильним середовищем є збагачевається завдяки присутності реплікаційної плазміне або мінімальне живильне середовище (для ди, наприклад, pLNH-ST, у трансформованих дріжджів), до складу якого входить ксилоза. На дріжджових клітинах і інтеграція відбувається лидодаток до цього, згадані клоновані гени виконуше поступово шляхом повторної реплікації трансють роль селекційних маркерів у збагаченому жиформантів на планшетах з селективним живильвильному середовищі для більшості дріжджів роду ним середовищем. Saccharomyces, оскільки заявники показали, що Таким чином, цей винахід має відношення до більшість дріжджів роду Saccharomyces потребує застосування наведених далі процедур для одерприсутності джерела вуглецю, наприклад, ксилози, жання дріжджів або інших клітинних трансформандля росту навіть у збагаченому живильному серетів, до складу яких входить hcn інтегрований клодовищі (Фігура 8). Незважаючи на те, що необхіднований ген(-и). Клітини-хазяї, до складу яких ність у присутності джерела вуглецю у збагаченовходять повторювані послідовності ДНК, наприму живильному середовищі для росту не є клад, дріжджі або еукаріотичні клітини, трансфоркритичною для дріжджів, які було обрано хазяями, муються реплікаційною/інтеграційною плазмідою, все ж, незважаючи на це, набагато зручніше мати наприклад, pLNH-ST, і відбираються трансформаможливість здійснення відбору необхідних інтегнти, до складу яких входять мультикопійні реплірантів на планшетах зі збагаченим живильним каційні/інтеграційні плазміди. Одержані відібрані середовищем з ксилозою, аніж на планшетах з трансформанти повторно реплікуються на планмінімальним живильним середовищем з ксилозою. шетах зі свіжим селективним живильним середоПереважні хазяї для трансформування у цьому вищем і вирощуються до високого рівня густини винаході належать до видів Saccharomyces, оскіклітки впродовж достатньої кількості разів для інльки вони, як правило, є надзвичайно ефективнитегрування необхідної кількості копій екзогенної ми відносно зброджування глюкози. У разі, якщо ДНК з наступним культивуванням трансформантів виявиться, що види дріжджів, необхідні для викоу неселективному живильному середовищі впрористання у ролі хазяїв для інтегрування великої довж достатньої кількості генерацій для видалення кількості копій генів, які метаболізують ксилозу, не реплікаційних/інтеграційних плазмід зі згаданих потребують присутності джерела вуглецю для ротрансформантів. Після цього одержані трансфорсту у збагаченому живильному середовищі, за 15 76690 16 допомогою традиційних способів можна буде видіідентифікування тиx трансформантів, до складу лити придатний мутант цього виду, який буде потяких входять hcn інтегровані клоновані гени, а не ребувати джерела вуглецю у збагаченому жививектори на основі плазмід. льному середовищі. Особливою рисою підходу за цим винаходом Бажано також, щоб до складу реплікаційдля одержання стійких рекомбінантних дріжджів, ної/інтеграційної плазміди, наприклад, pLNH-ST, до складу яких входить hcn інтегрований ген(-и), є призначеної для забезпечення hcn інтеграції, вхоте, що кількість копій гену(-ів), призначених для див другий селекційний засіб для відбору реплікаінтегрування, може бути легко контрольованою. ційних плазмід-опосередкованих трансформантів. Наприклад, до хромосоми дріжджового гібриду У разі pLNH-ST, другий селекційний механізм у 1400 можна вставити більшу кількість копій XR-XDролі селектованого маркеру використовує як KmR, XK генів, якщо до фрагменту 5S рДНК (або цільотак і ApR. Незважаючи на те, що належність другої вої послідовності) вставлено інший селекційний селекційної системи для реплікаційномаркер, наприклад, KmR. На додаток до цього, го/інтеграційного вектору не є критичною, це заспособи одержання hcn дріжджових інтегрантів за безпечить більш переважні вектори, зокрема, якцим винаходом також є легшими до здійснення, у що вектор на основі автономної реплікаційної порівнянні до інших відомих підходів, під час здійпослідовності не є достатньо стійким навіть у приснення яких, перш ніж буде одержано стійкий сутності селекційного тиску, а трансформанти маштам, може виникнути потреба у коректуванні та ють схильність до втрати більшості своїх плазмід контролюванні експериментальних умов та повтодо того, як буде інтегрована достатня кількість рному здійсненні процесу трансформування. копій необхідних генів. У разі застосування вектоТаким чином, заявники поліпшили стійкість рів, до складу яких входить другий селекційний попередніх рекомбінантних ксилозозброджувальмеханізм, згадані трансформанти можуть культиних дріжджів, наприклад, 1400 (pLNH32) та 1400 вуватись у присутності другого селекційного реак(pLNH33) і створили переважно стійкі рекомбінантиву для підвищення кількості копій плазмід або тні дріжджі, наприклад, 1400 (LNH-ST), які не потдля поновного трансформування згаданих трансребують присутності селекційного тиску для підтформантів за допомогою того ж самого вектору, римки клонованих генів і є настільки ж але з застосуванням другого селекційного механіефективними або навіть більш ефективними відзму для поновного відбору згаданих трансформанось комбінованого зброджування глюкози та ксинтів таким чином, щоб процес інтеграції зміг бути лози, аніж 1400 (pLNH32) та 1400 (pLNH33). На продовженим або поновно ініційованим. додаток до цього, згадані заявники також розроЗастосування KmR та ApR у ролі другої селекбили придатній спосіб, який забезпечує легку hcn ційної системи є необхідним для одержання дріжінтеграцію екзогенного гену(-ів) до клітинної хроджів, які, на думку заявників, є переважними. KmR мосоми, де кількість копій гену(-ів), призначена може бути домінантним селекційним маркером для інтегрування, також легко піддається контродля трансформування дріжджів, які є стійкими до люванню. генетицину, однак деякі дріжджі є природно стійПодібно до 1400 (pLNH32) та 1400 (pLNH33), кими до генетицину без прийняття до свого складу переважні стійкі ксилозозброджувальні дріжджі за плазміди, яка включає KmR. Внаслідок цього, KmR цим винаходом, створені методами генної інженесам по собі не є переважним селекційним маркерії, також можуть ефективно комбіновано зброром для відбору дріжджових трансформантів. З джувати глюкозу та ксилозу. Це відбувається заіншого боку, ApR може ефективно експресуватись вдяки тому, що XR, XD та ХК гени, вставлені до більшістю дріжджів, однак він, як правило, не може хромосоми нових дріжджів-хазяїв, виявляються бути використаним у ролі домінантного селекційзлитими з інтактними 5' некодувальними послідовного маркеру для трансформування дріжджів, ностями генів, які можуть бути ефективно експреоскільки більшість дріжджів є природно стійкою до сованими у дріжджах, кодують продукування висоампіциліну. Однак, KmR та ApR разом є надзвичайких рівнів ферментів і, крім того, їх не пригнічує но доброю домінантною селекційною системою присутність глюкози у живильному середовищі. для більшості дріжджів, зокрема, для дріжджів Наприклад, інтактні 5' некодувальні послідовності роду Saccharomyces. Для застосування такої сеДНК, які вміщують усі генетичні елементи для лекційної системи, згадані трансформанти спочатефективного експресування гліколітичних генів та ку відбираються на планшетах з YEPD (1% дріждля продукування високих рівнів гліколітичних феджового екстракту, 2% пептону, 2% глюкози) та рментів, є придатними, як замісники інтактних 5' відповідними концентраціями генетицину (20некодувальних послідовностей XR, XD та ХК для 80мкг/мл, у залежності від виду). Одержані трансзгаданих цілей. форманти перевіряються на експресію ApR за доXR, XD та ХК, клоновані на pLNH-ST, походять помогою пеніциліназної проби (Шевальє від Pichia stipitis (XR та XD) та від Saccharomyces (Chevallier) та Егл (Aigle), 1979) для ідентифікуcerevisiae (ХК). Однак, вони можуть походити від вання справжніх трансформантів. будь-яких мікроорганізмів, доки є здатними до R Наявність Ap у pLNH-ST (Фігура 9) та спорідпродукування високих рівнів відповідних ферменнених реплікаційних/інтеграційних плазмідах, витів після злиття з відповідними 5' некодувальними конує також іншу функцію. Оскільки ApR є присутпослідовностями, до складу яких входять ефектинім тільки у реплікаційній плазміді і його немає на вні промотори, рибосомо-зв'язувальні ділянки і згаданому фрагменті, інтегрованому до дріжджот.ін. Відомо, наприклад, що три згадані гени зувої хромосоми, згадана ампіцилінова проба викострічаються у різноманітних мікроорганізмах; було ристовується також, як традиційний процес для ідентифіковано та ізольовано численні XR, XD та 17 76690 18 ХК гени. Таким чином, конкретне джерело цих гездійснені за допомогою традиційних методів генної нів не є критичним для широких аспектів цього інженерії, добре відомих у цій галузі та літературі. винаходу; придатними, скоріше, виявляться будьСайт ініціювання реплікації ДНК дріжджів, наякі ДНК, які кодують білки (ферменти), які мають приклад, автономна реплікаційна послідовність, до ксилозредуктазну активність (здатність до перетскладу якої входить фрагмент ДНК, може бути ворення D-ксилози на ксилітол з застосуванням одержаним з хромосомної ДНК дріжджів або з NADPH (нікотинамід-аденін-динуклеотидфосфату хромосомної ДНК інших мікроорганізмів, доки фра(відновленої форми)) та/або NADΗ (відновленого гмент ДНК може функціонувати, як активний сайт нікотинамід-аденін-динуклеотиду) у ролі кофактоініціювання реплікації для підтримки автономної ру), ксилітолдегідрогеназну активність (здатність реплікації плазміди у хазяїні, якого було обрано до перетворення ксилітолу на D-ксилулозу з задля hсn інтеграції. Фрагменти ДНК, які функціонустосуванням NAD+ (нікотинамід-аденін-нуклеотиду ють, як автономні реплікаційні послідовності, мо(окисненої форми)) та/або NADP+ (нікотинаміджуть бути легко виділеними шляхом включення аденін-динуклеотидфосфату (окисненої форми)) у довільно розщеплених фрагментів ДНК до плазміролі кофактору) або ксилулокіназну активність ди на основі Е. соІі з наступним трансформуван(здатність до перетворення D-ксилулози на Dням необхідного мікроорганізму-хазяїна, наприксилулозо-5-фосфат). Ці гени можуть бути одерклад, дріжджів роду Saccharomyces, за допомогою жаними, як природні гени або можуть бути модиодержаного банку плазмід, і к повідомлялось у фікованими, наприклад, доданням, заміщенням літературі (Стінчкомб та інші, 1980; Го та інші, або делецією основ природного гену, доти, доки 1984). закодовані білки все ще мають XR, XD або ХК акДля одержання стійких штамів за цим винахотивність. Подібним же чином, згадані гени або їх дом було використано нові способи. Незважаючи частини можуть бути створені методами синтезу на це, існують деякі дані, які свідчать про те, що за відомими способами і, знову таки, доти, доки клоновані гени знаходяться не на реплікаційній одержана ДНК кодує білок, який демонструє необплазміді, а були інтегровані до геному хазяїна. хідну XR, XD або ХК активність. Наприклад, хромосомна ДНК, виділена з 1400 Як приклади, до придатних джерел XR та XD (LNH-ST), може бути використана, як матриця для генів належать дріжджі, я
ДивитисяДодаткова інформація
Назва патенту англійськоюYeast which ferments xylose to ethanol (variants), plasmid vector and method for fermentation of xylose to ethanol
Назва патенту російськоюДрожжи, сбраживающие ксилозу в этанол (варианты), плазмидный вектор и способ сбраживания ксилозы в этанол
МПК / Мітки
МПК: C12N 15/09, C12N 15/90, C12N 9/04, C12N 1/19, C12N 15/81, C12N 9/12, C12P 7/06
Мітки: зброджують, дріжджі, плазмідний, вектор, зброджування, варіанти, ксилози, етанол, ксилозу, спосіб
Код посилання
<a href="https://ua.patents.su/17-76690-drizhdzhi-shho-zbrodzhuyut-ksilozu-u-etanol-varianti-plazmidnijj-vektor-ta-sposib-zbrodzhuvannya-ksilozi-u-etanol.html" target="_blank" rel="follow" title="База патентів України">Дріжджі, що зброджують ксилозу у етанол (варіанти), плазмідний вектор та спосіб зброджування ксилози у етанол</a>
Попередній патент: Спосіб лікування хворих на хронічний панкреатит
Наступний патент: Спосіб керування інтенсивністю електромагнітного потоку та підсилювальні елементи на його основі
Випадковий патент: Застосування способу передпосівної дезінфекції насіння, як способу захисту бульб картоплі від колорадських жуків