Сукцинатна і малонатна солі транс-4-((1r,3s)-6-хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазину та їх застосування як лікарського засобу
Номер патенту: 89617
Опубліковано: 25.02.2010
Автори: Лопес де Дієґо Хейді, Хауелз Марк, Банґ-Андерсен Бенні, Дахл Аллан Карстен, Сван Хенрік, Лінґсьо Ларс Оле, Нільсен Оле, Рінґор Лоне Мунк, Колліер Шеррі Лінн
Формула / Реферат
1. Сукцинатна сіль або малонатна сіль сполуки формули (І)
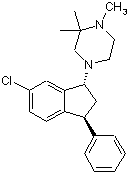 (I)
(I)
[транс-4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазин].
2. Сукцинатна сіль за п. 1, яка являє собою гідросукцинатну сіль сполуки формули (І).
3. Кристалічна гідросукцинатна сіль сполуки формули (І), визначеної в п. 1.
4. Сіль за п. 3, яка являє собою кристалічну альфа-форму.
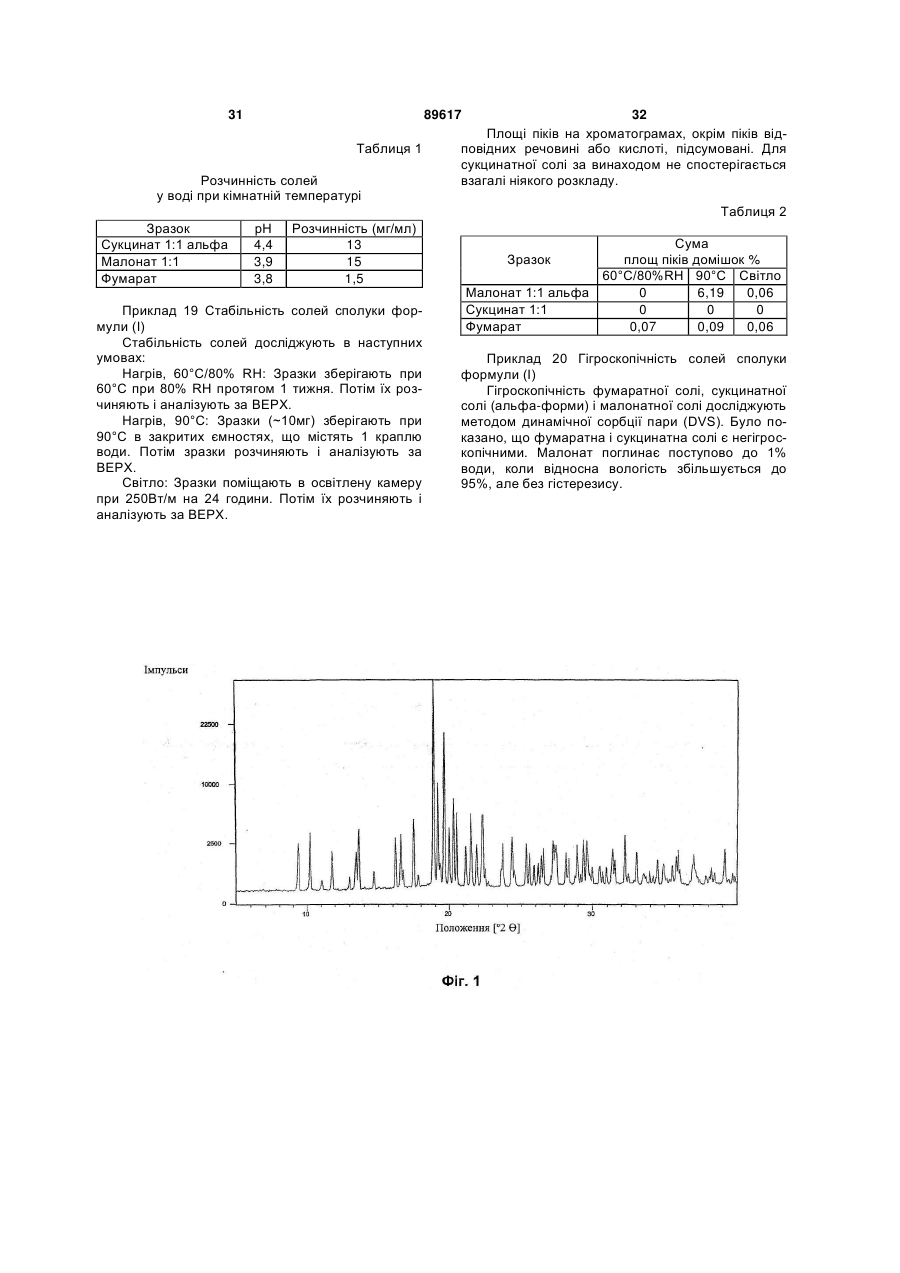
5. Сіль за п. 3 або п. 4, кристалічна форма якої характеризується порошковою рентгенівською дифрактограмою, відповідною дифрактограмі на фіг. 1.
6. Сіль за будь-яким з пп. 3-5, кристалічна форма якої характеризується порошковою рентгенівською дифрактограмою, одержаною з використанням СuКa1 випромінювання (l = 1,5406 ![]() ), на якій є піки при наступних 2
), на якій є піки при наступних 2![]() -кутах: 9,36; 10,23; 11,81; 13,45; 16,21; 16,57; 17,49; 18,89; 19,20; 19,63; 20,01; 20,30; 21,15; 21,53; 21,93; 22,34; 24,37; 25,34; 27,27; 29,65.
-кутах: 9,36; 10,23; 11,81; 13,45; 16,21; 16,57; 17,49; 18,89; 19,20; 19,63; 20,01; 20,30; 21,15; 21,53; 21,93; 22,34; 24,37; 25,34; 27,27; 29,65.
7. Сіль за будь-яким з пп. 3-6, кристалічна форма якої характеризується диференціальною сканувальною калориметрією (DSC), що показує ендотерму з початком близько 139-141 °С.
8. Сіль за п. 3, яка являє собою кристалічну бета-форму.
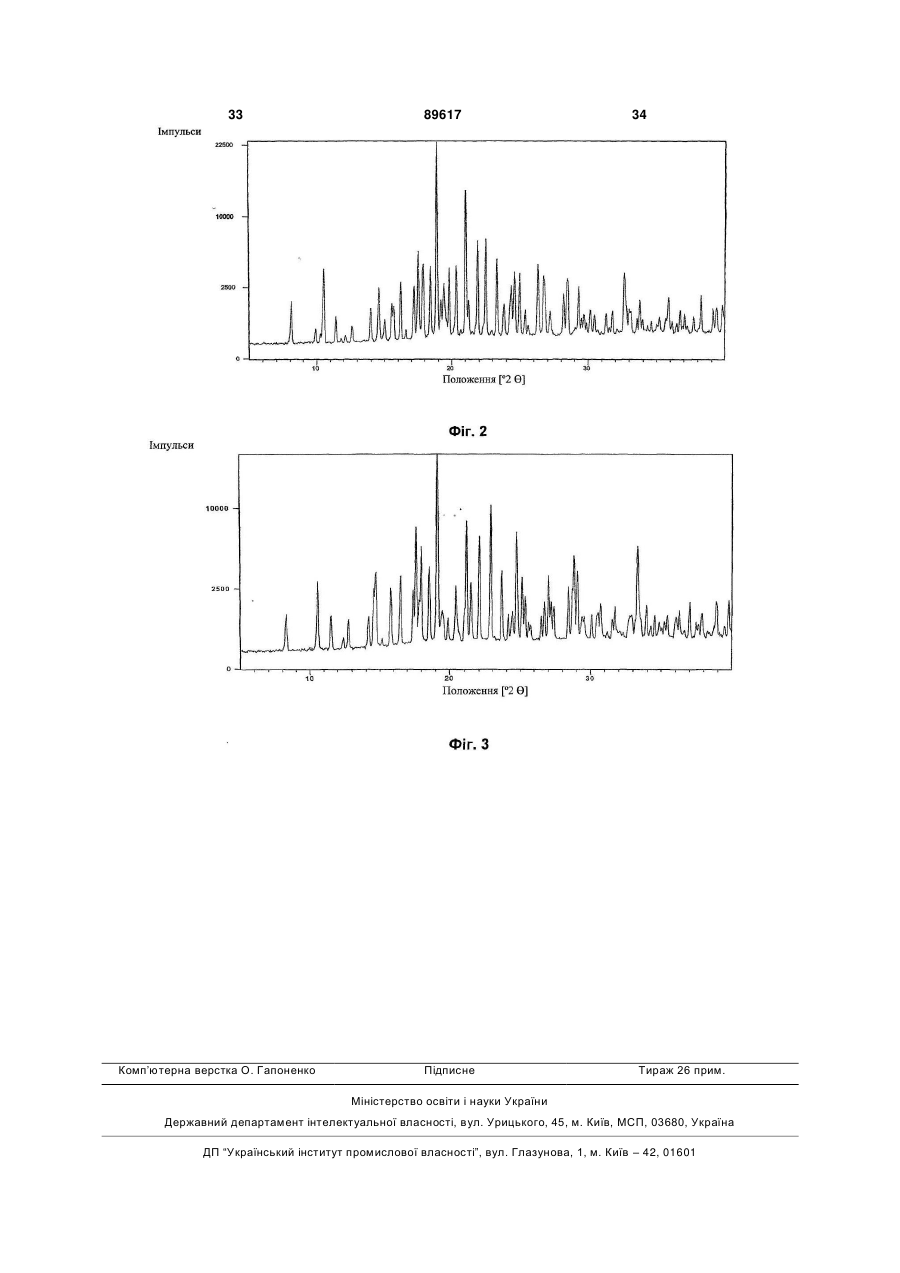
9. Сіль за п. 3 або п. 8, кристалічна форма якої характеризується порошковою рентгенівською дифрактограмою, відповідною дифрактограмі на Фіг. 2.
10. Сіль за будь-яким з пп. 3, 8, 9, кристалічна форма якої характеризується порошковою рентгенівською дифрактограмою, одержаною з використанням СuК![]() 1 випромінювання (l = 1,5406
1 випромінювання (l = 1,5406 ![]() ), на якій є піки при наступних 2
), на якій є піки при наступних 2![]() -кутах: 8,1; 10,5; 11,4; 14,0; 14,6; 15,6; 15,7; 16,2; 17,2; 17,5; 17,9; 18,4; 18,9; 19,2; 20,3; 21,0; 21,9; 22,5; 23,3; 26,3.
-кутах: 8,1; 10,5; 11,4; 14,0; 14,6; 15,6; 15,7; 16,2; 17,2; 17,5; 17,9; 18,4; 18,9; 19,2; 20,3; 21,0; 21,9; 22,5; 23,3; 26,3.
11. Сіль за будь-яким з пп. 3, 8-10, кристалічна форма якої характеризується диференціальною сканувальною калориметрією (DSC), що показує ендотерму з початком близько 135-138 °С.
12. Малонатна сіль за п. 1, яка являє собою гідромалонатну сіль сполуки формули (І).
13. Кристалічна гідромалонатна сіль сполуки формули (І), визначеної в п. 1.
14. Кристалічна сіль за п. 13, кристалічна форма якої характеризується порошковою рентгенівською дифрактограмою, показаною на фіг. 3.
15. Кристалічна сіль за п. 13 або п. 14, кристалічна форма якої характеризується порошковою рентгенівською дифрактограмою, одержаною з використанням СuК![]() 1 випромінювання (l = 1,5406
1 випромінювання (l = 1,5406 ![]() ), на якій є піки при наступних 2
), на якій є піки при наступних 2![]() -кутах: 8,3; 10,6; 11,5; 12,8; 14,2; 14,5; 14,7; 15,8; 16,5; 17,4; 17,6; 18,0; 18,6; 19,2; 21,2; 22,0; 22,9; 23,7; 24,7; 28,8.
-кутах: 8,3; 10,6; 11,5; 12,8; 14,2; 14,5; 14,7; 15,8; 16,5; 17,4; 17,6; 18,0; 18,6; 19,2; 21,2; 22,0; 22,9; 23,7; 24,7; 28,8.
16. Фармацевтична композиція, яка містить сіль, визначену у будь-якому з пп. 1-15, разом з принаймні одним фармацевтично прийнятним носієм, наповнювачем або розріджувачем.
17. Сіль за будь-яким з пп. 1-15 для застосування в медицині.
18. Сіль за п. 17 для застосування в лікуванні психотичних симптомів.
19. Застосування солі за будь-яким з пп. 1-15 для одержання лікарського засобу для лікування захворювання, вибраного з групи, що складається із захворювання, що включає психотичні симптоми, тривожних розладів, афективних розладів, що включають депресію, порушення сну, мігрені, індукованого нейролептиками паркінсонізму або розладів, пов’язаних із зловживаннями, наприклад, кокаїнової залежності, нікотинової залежності або алкоголізму.
20. Застосування солі за будь-яким з пп. 1-15 для одержання лікарського засобу для лікування шизофренії або інших психотичних розладів.
21. Застосування солі за будь-яким з пп. 1-15 для одержання лікарського засобу для лікування захворювання, вибраного з групи, що складається з шизофренії, шизоморфного розладу, шизоафективного розладу, маревного розладу, короткочасного психотичного розладу, сумісного (подільного) психотичного розладу та манії в біполярному розладі.
22. Застосування солі за будь-яким з пп. 1-15 для одержання лікарського засобу для лікування одного або декількох з наступного: позитивних симптомів, негативних симптомів і депресивних симптомів шизофренії.
23. Застосування за будь-яким з пп. 19-22, де добова доза сполуки формули (І) в розрахунку на вільну основу складає від 2 до 55 мг на добу.
24. Застосування за п. 23, де згадана добова доза в розрахунку на вільну основу складає 2 або 3 мг на добу.
25. Фармацевтична композиція за п. 16, яка містить згадану сіль в розрахунку на вільну основу від 2 до 55 мг.
26. Фармацевтична композиція за п. 25, яка містить згадану сіль в розрахунку на вільну основу 2 або 3 мг.
27. Фармацевтична композиція за п. 25 або 26 для застосування в лікуванні шизофренії або інших психотичних розладів.
Текст
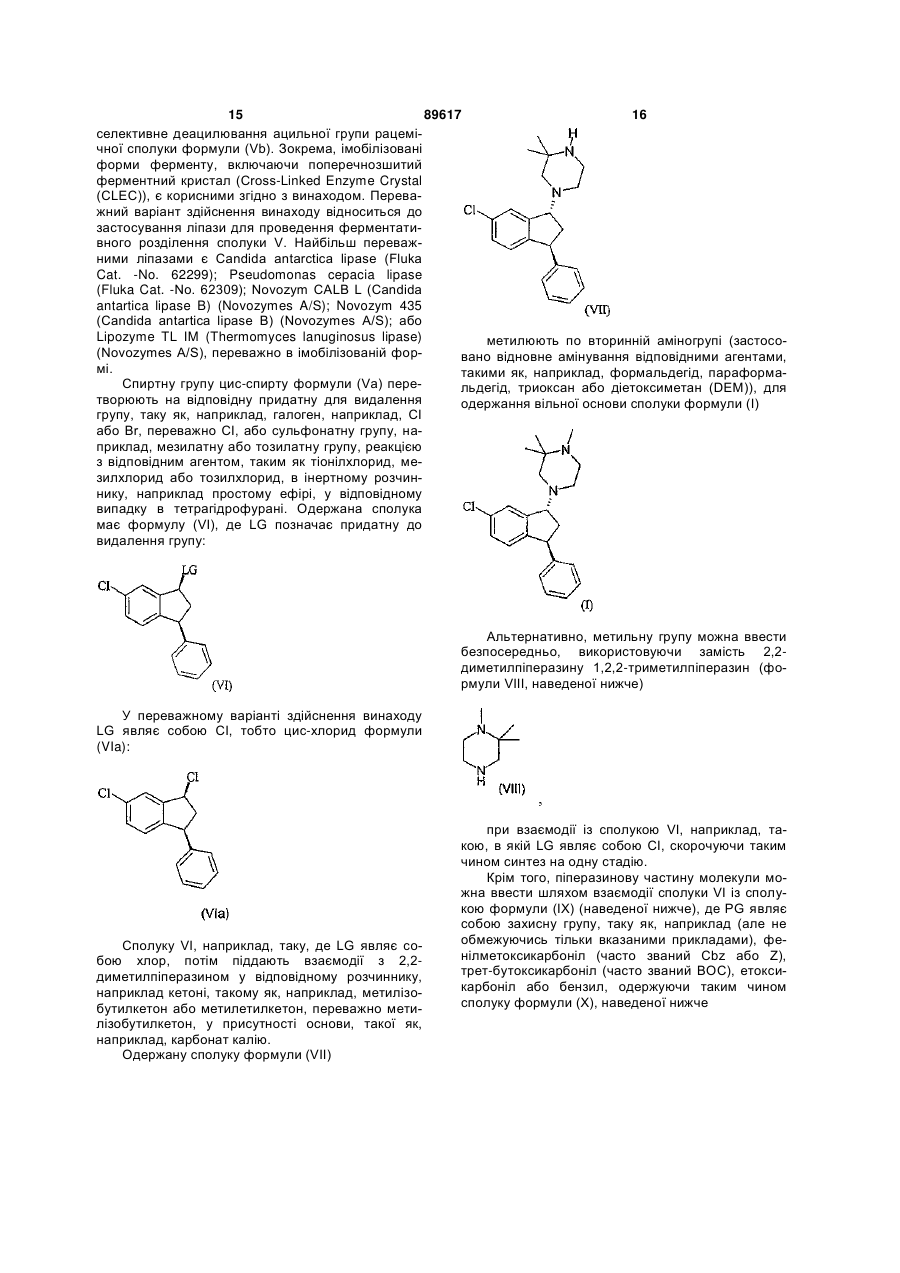
1. Сукцинатна сіль або малонатна сіль сполуки формули (І) C2 2 (19) 1 3 89617 4 11. Сіль за будь-яким з пп. 3, 8-10, кристалічна ладів, пов’язаних із зловживаннями, наприклад, форма якої характеризується диференціальною кокаїнової залежності, нікотинової залежності або сканувальною калориметрією (DSC), що показує алкоголізму. ендотерму з початком близько 135-138 °С. 20. Застосування солі за будь-яким з пп. 1-15 для 12. Малонатна сіль за п. 1, яка являє собою гідроодержання лікарського засобу для лікування шималонатну сіль сполуки формули (І). зофренії або інших психотичних розладів. 13. Кристалічна гідромалонатна сіль сполуки фор21. Застосування солі за будь-яким з пп. 1-15 для мули (І), визначеної в п. 1. одержання лікарського засобу для лікування за14. Кристалічна сіль за п. 13, кристалічна форма хворювання, вибраного з групи, що складається з якої характеризується порошковою рентгенівською шизофренії, шизоморфного розладу, шизоафектидифрактограмою, показаною на фіг. 3. вного розладу, маревного розладу, короткочасного 15. Кристалічна сіль за п. 13 або п. 14, кристалічна психотичного розладу, сумісного (подільного) псиформа якої характеризується порошковою рентгехотичного розладу та манії в біполярному розладі. нівською дифрактограмою, одержаною з викорис22. Застосування солі за будь-яким з пп. 1-15 для одержання лікарського засобу для лікування однотанням СuК 1 випромінювання ( = 1,5406 A ), на го або декількох з наступного: позитивних симптоякій є піки при наступних 2 -кутах: 8,3; 10,6; 11,5; мів, негативних симптомів і депресивних симптомів шизофренії. 12,8; 14,2; 14,5; 14,7; 15,8; 16,5; 17,4; 17,6; 18,0; 23. Застосування за будь-яким з пп. 19-22, де до18,6; 19,2; 21,2; 22,0; 22,9; 23,7; 24,7; 28,8. бова доза сполуки формули (І) в розрахунку на 16. Фармацевтична композиція, яка містить сіль, вільну основу складає від 2 до 55 мг на добу. визначену у будь-якому з пп. 1-15, разом з при24. Застосування за п. 23, де згадана добова доза наймні одним фармацевтично прийнятним носієм, в розрахунку на вільну основу складає 2 або 3 мг наповнювачем або розріджувачем. на добу. 17. Сіль за будь-яким з пп. 1-15 для застосування 25. Фармацевтична композиція за п. 16, яка місв медицині. тить згадану сіль в розрахунку на вільну основу від 18. Сіль за п. 17 для застосування в лікуванні пси2 до 55 мг. хотичних симптомів. 26. Фармацевтична композиція за п. 25, яка міс19. Застосування солі за будь-яким з пп. 1-15 для тить згадану сіль в розрахунку на вільну основу 2 одержання лікарського засобу для лікування заабо 3 мг. хворювання, вибраного з групи, що складається із 27. Фармацевтична композиція за п. 25 або 26 для захворювання, що включає психотичні симптоми, застосування в лікуванні шизофренії або інших тривожних розладів, афективних розладів, що психотичних розладів. включають депресію, порушення сну, мігрені, індукованого нейролептиками паркінсонізму або роз Цей винахід відноситься до 4-((1R,3S)-6-хлор3-феніліндан-1-іл)-1,2,2-триметилпіперазину, зокрема до його солей: гідросукцинату та гідромалонату, способів одержання 4-((1R,3S)-6-хлор-3феніліндан-1-іл)-1,2,2-триметилпіперазину та його солей, фармацевтичних композицій, які містять вказані солі, та до їх застосування в медицині, включаючи лікування шизофренії або інших захворювань з психотичними симптомами. Сполука, яка є об'єктом цього винаходу, - (4((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2триметилпіперазин) - загальної формули (І) описана у загальних рисах в ЕР 638073. Патент ЕР 638073 охоплює групу трансізомерів 3-арил-1-(1-піперазиніл)інданів, заміщених в положенні 2 та/або 3 піперазинового циклу. Сполуки описані як такі, що мають високу афінність до дофамінових D1 і D2 рецепторів і рецептора 5-НТ2 припускають, що вони корисні для лікування деяких захворювань центральної нервової системи, включаючи шизофренію. У ЕР 638073 не розкривається конкретна енантіомерна форма вищезгаданої сполуки формули (І), описані тільки транс-ізомери у вигляді рацематів. Енантіомер формули (І), наведений вище, описаний в статті (Bøgesø et al, J. Med. Chem., 1995, 38, page 4380-4392) у вигляді фумаратної солі (див. таблицю 5) сполуки (-)-38. У вказаній публікації зроблений висновок про те, що (-)енантіомери сполуки є сильними антагоністами рецепторів D1/D2, що виявляють деяку селективність у відношенні D1 in vitro, хоча in vivo як антагоністи D1 і D2 вони рівносильні. Сполуку також описано як сильний антагоніст рецепторів 5-НТ2, що має високу афінність до 1 адренорецепторів. Згадується також, що сполука не викликає каталепсію у щурів. 5 89617 6 Відповідний рацемат, а також фумаратна сіль Фігура 2: Показана порошкова рентгенівська вищезгаданої сполуки формули (І) також описані дифрактограма кристалічної бета-форми гідросук(Klaus P. B Bøgesø в "Drug Hunting, the Medicinal цинатної солі сполуки І (одержана при викорисChemistry of 1-Piperazino-3-phenylindans і Related танні СuK 1 випромінювання ( =1,5406Å)). Compounds", 1998, ISBN 87-88085-10-4 (див., наФігура 3: Показана порошкова рентгенівська приклад, сполуку 69 в таблиці 3, стор. 47 і в табдифрактограма кристалічної альфа-форми гідролиці 9А, стор. 101)). малонатної солі сполуки І (одержана при викорисТаким чином, сполука формули (І) являє сотанні СuK 1 випромінювання ( =1,5406Å)). бою змішаний антагоніст рецепторів D1/D2, антагоСолі за винаходом ніст рецепторів 5-НТ2, а також має спорідненість Тепер показано, що розчинність у воді гідросудо 1 адренорецепторів. Далі стисло викладений кцинатної солі та гідромалонатної солі сполуки можливий зв'язок між різними захворюваннями і формули (І) значно вища, ніж розчинність у воді дофаміновими рецепторами D1 і D2, рецепторами фумаратної солі цієї сполуки. 5-НТ2 і 1 адренорецепторами, відповідно. Термін "гідросукцинатна сіль" сполуки формуЕтіологія шизофренії невідома, але дофаміноли (І) відноситься до солі сполуки формули (І) і ва гіпотеза шизофренії (Carlsson, Am. J. Psychiatry бурштинової кислоти (1:1). 1978, 135, 164-173), яка сформульована на початТермін "гідромалонатна сіль" сполуки формуку 60-х років, створила теоретичну основу для роли (І) відноситься до солі сполуки формули (І) і зуміння біологічних механізмів, що лежать в основі малонової кислоти (1:1). цього захворювання. У простій формі дофамінової Було виявлено, що гідросукцинатна сіль є гіпотези затверджується, що шизофренія пов'язабільш стабільною, ніж фумаратна і гідромалонатна на з гіпердофамінергічним станом; на користь цієї солі, і є негігроскопічною. точки зору говорить той факт, що всі антипсихотиБуло виявлено, що стабільність гідромалонатчні ліки, що є на ринку в даний час, впливають на ної солі сполуки І близька до стабільності фумараантагонізм деяких дофамінових D2 рецепторів тної солі при витримці на світлі та вище за стабі(Seeman Science і Medicine 1995, 2, 28-37). Проте, льність фумаратної солі при 60°С/відносній хоча звичайно прийнято вважати, що антагонізм вологості (RH) 80%, але нижче, ніж стабільність дофамінових D2 рецепторів в лімбічних ділянках фумаратної солі при 90°С. Проте, 90°С - це дуже мозку грає ключову роль в лікуванні позитивних жорсткі умови, і ці дані по стабільності необов'язсимптомів шизофренії, блокада D2 рецепторів в ково відносяться до стабільності в нормальних стриарних ділянках мозку викликає екстрапірамідні умовах. Малонат поступово поглинає до 1% води, симптоми (EPS). Як описано в ЕР 638073, профілі коли відносна вологість збільшується до 95%, але змішаного інгібування дофамінових D1/D2 рецепбез гістерезису. Тому його вважають негігроскопіторів спостерігаються з деякими так званими "атичним, але таким, що має хорошу змочуваність, що повими" антипсихотичними сполуками, зокрема з вказує на хороші характеристики розчинності. клозапіном, що використовуються для лікування Винахід також охоплює кристалічні солі за вихворих шизофренією. находом, які включають, наприклад, ангідрати, гідрати і сольвати солей за винаходом. Терміном Було зроблено припущення, що центральна 1 "ангідрат" позначають солі за винаходом, які не антагоністична дія вносить внесок в поліпшення містять зв'язаної води в кристалах. Терміном "гідантипсихотичних властивостей (Millan et al, JPET, рати" позначають солі за винаходом, які містять 2000, 292, 38-53). зв'язані молекули води в кристалах. Гідрати звиКрім того, селективні антагоністи D1 пов'язані з чайно одержуються при утворенні солі у присутнолікуванням порушень сну і алкогольної залежності сті деякої кількості води. Сольватами називають (D.N. Eder, Current Opinion in Investigational Drugs, солі за винаходом, які містять зв'язані молекули 2002 3(2): 284-288). розчинника в кристалах. Сольвати звичайно одерДофамін може також грати важливу роль в жують при утворенні сукцинатної солі у присутносетіології афективних розладів (P. Willner, Brain ті розчинника. У одному сольваті можуть міститися Res. Rev. 1983, 6, 211-224, 225-236 і 237-246; J. молекули одного, двох або декількох розчинників. Med. Chem., 1985, 28, 1817-1828). Сольват може містити воду як один з двох або У ЕР 638073 описано, як сполуки, що мають декількох органічних розчинників, або він може афінність до рецепторів 5-НТ2, конкретно, антагомістити тільки неводний розчинник. ністи рецепторів 5-НТ2, пропонуються для лікуванОдин з варіантів здійснення винаходу відноня різних захворювань, таких як шизофренія, ситься до солі транс-4-((1R,3S)-6-хлор-3включаючи негативні симптоми у хворих шизоффеніліндан-1-іл)-1,2,2-триметилпіперазину, тобто ренією пацієнтів, депресія, тривожні стани, порудо солі сполуки формули (І) і бурштинової кислоти шення сну, напади мігрені та індукований нейро(1:1), у вигляді кристалічного ангідрату. лептиками паркінсонізм. Припускають, що Автори винаходу відкрили 2 кристалічні форми антагонізм рецепторів 5-НТ2 зменшує поширеність гідросукцинатної солі сполуки І (названі альфа і екстрапірамідних побічних ефектів, викликаних бета). класичними нейролептиками (Balsara et al. Таким чином, один з варіантів здійснення виPsychopharmacology 1979, 62, 67-69). находу відноситься до кристалічної форми гідроФігура 1: Показана порошкова рентгенівська сукцинатної солі сполуки І, яку називають альфадифрактограма кристалічної альфа-форми гідроформою і характеризують одним або декількома з сукцинатної Солі сполуки І (одержана при викоринаступних результатів аналізу: станні СuK 1 випромінювання ( =1,5406Å)). 7 89617 8 (і) порошковою рентгенівською дифрактогравикористанні СuK 1 випромінювання ( =1,5406Å), у мою, як показано на Фіг.1; якому показані основні піки при заданих кутах 2 ; (іі) зразком порошкової рентгенівської дифрак(ііі) даними диференціальної сканувальної катограми, як показано в таблиці І, одержаним при лориметрії, що показує ендотерму з початком при використанні СuK 1 випромінювання ( =1,5406Å), у температурі 135-138°С. якому показані основні піки при заданих кутах 2 ; Подальший варіант здійснення винаходу від(ііі) даними диференціальної сканувальної каноситься до кристалічної гідромалонатної солі лориметрії (DSC), що показують ендотерму з посполуки І, яку характеризують одним або декільчатком при температурі 139-141°С. кома з наступних результатів аналізу: Наступний варіант здійснення винаходу відно(і) порошковою рентгенівською дифрактограситься до кристалічної форми гідросукцинатної мою, як показано на Фіг.3; солі сполуки І, яку називають бета-формою і хара(іі) зразком порошкової рентгенівської дифракктеризують одним або декількома з наступних ретограми, як показано в таблиці І, одержаним при зультатів аналізу: використанні СuK 1 випромінювання ( =1,5406Å), у (і) порошковою рентгенівською дифрактограякому показані основні піки при заданих кутах 2 ; мою, як показано на Фіг.2; (іі) зразком порошкової рентгенівської дифрактограми, як показано в таблиці І, одержаним при Таблиця I Типові порошкові рентгенівські дифрактограми, одержані при використанні СuK 1 випромінювання ( =1,5406Å) кристалічних альфа- і бета-форм гідросукцинатної солі сполуки І, і кристалічної гідромалонатної солі сполуки І. Фіг.; порівняй також Фіг.1, Фіг.2 і Фіг.3, що представляють репрезентативний зразок XRPD поліморфних альфа- і бета-форм гідросукцинатної солі та гідромалонатної солі сполуки І, відповідно Сіль Характеристичні відбиття - основні піки (що виражені в градусах кута дифракції 2Θ) 9,36; 10,23; 11,81; 13,45; 16,21; 16,57; 17,49; 18,89; 19,20; 19,63; 20,01; 20,30; 21,15; Сукцинат-альфа 21,53; 21,93; 22,34; 24,37; 25,34; 27,27; 29,65 8,1; 10,5; 11,4; 14,0; 14,6; 15,6; 15,7; 16,2; 17,2; 17,5; 17,9; 18,4; 18,9; 19,2; 20,3; 21,0; 21,9; Сукцинат-бета 22,5; 23,3; 26,3 8,3; 10,6; 11,5; 12,8; 14,2; 14,5; 14,7; 15,8; 16,5; 17,4; 17,6; 18,0; 18,6; 19,2; 21,2; 22,0; 22,9; Малонат 23,7; 24,7; 28,8 Вирази подібні наступному "кристалічна форма конкретної солі сполуки І, що характеризується порошковою рентгенівською дифрактограмою, показаною на Фіг.1", які використовуються тут, означають кристалічну форму даної солі сполуки І, порошкова рентгенівська дифрактограма якої практично аналогічна Фігурі (1), тобто така, що показує зразок порошкової рентгенівської дифрактограми практично ілюстрований фігурою і одержаний в порівнянних умовах, як описано в даній заявці, або будь-яким порівняним методом. Взагалі, зрозуміло, що всі дані тут є приблизними і схильними до звичайної помилки вимірювань в залежності, наприклад, від використовуваної апаратури та інших параметрів, що впливають на положення та інтенсивність піків. Винахід також відноситься до твердої гідросукцинатної солі сполуки І, яка складається в основному з альфа-форми по відношенню до всієї кількості солі. В одному варіанті здійснення винаходу термін "в основному" означає, що тверда гідросукцинатна сіль сполуки І складається принаймні з 75%, наприклад, принаймні з 80%, принаймні з 90% або принаймні з 95% кристалічної альфаформи, по відношенню до всієї кількості присутньої гідросукцинатної солі сполуки І. Винахід також відноситься до твердої гідросукцинатної солі сполуки І, яка складається в основному з бета-форми по відношенню до всієї кількості солі. У одному варіанті здійснення винаходу термін "в основному" означає, що тверда гідросук цинатна сіль сполуки І складається принаймні з 75%, наприклад, принаймні з 80%, принаймні з 90% або принаймні з 95% кристалічної бетаформи, по відношенню до всієї кількості присутньої гідросукцинатної солі сполуки І. Винахід також відноситься до будь-яких сумішей кристалічних форм гідросукцинатної солі за винаходом, наприклад, суміші альфа- і бетакристалічних форм гідросукцинатної солі сполуки І. Одержання солей за винаходом Сукцинатна сіль за винаходом може бути одержана обробкою вільної основи сполуки формули (І) бурштиновою кислотою в інертному розчиннику з подальшим осадженням солі, її виділенням і необов'язково перекристалізацією. Якщо це потрібно, кристалічну сіль можна потім піддати тонкому подрібненню шляхом вологого або сухого розмелювання або іншим зручним способом або одержанням частинок способом емульгування в розчиннику. Осадження сукцинатної солі за винаходом переважно здійснюють, розчиняючи вільну основу сполуки формули (І) у відповідному розчиннику, такому як ацетон або толуол, і потім змішуючи одержаний розчин з суспензією або розчином бурштинової кислоти у відповідному розчиннику, такому як ацетон, водний ацетон або толуол. У одному варіанті здійснення винаходу розчинник являє собою суміш ацетону і води, наприклад, суміш, що складається практично з ацетону і близько 2-10%, переважно близько 5% води, в розра 9 89617 10 хунку на масу суміші. Одержану суспензію можна (Bøgesø et al. J. Med. Chem., 1995, 38, page 4380нагрівати або додавати розчинник доти, поки не 4392) описано, як можна здійснити розділення розчиниться бурштинова кислота. Сукцинатну сіль рацемату на оптичні ізомери шляхом кристалізації сполуки за винаходом осаджують, переважно при діастереомерних солей і одержати таким чином охолоджуванні розчину. Сукцинатну сіль за винаенантіомер формули (І). ходом можна необов'язково перекристалізувати Автори цього винаходу розробили вдосконаодин або кілька разів, відфільтрувати, промити, лений шлях синтезу, за допомогою якого енантіонаприклад, ацетоном і висушити. мер формули (І) одержують в результаті послідовВинахід також відноситься до способу одерних синтезів, виходячи з енантіомерно чистої жання кристалічної бета-форми гідросукцинатної сполуки V, тобто сполуки Va ((1S,3S)-6-хлор-3солі сполуки І, який включає відстоювання водного феніліндан-1-олу, див. нижче). Таким чином, у вкарозчину гідросукцинатної солі сполуки І для повізаному способі проміжну сполуку формули V розльного випаровування розчинника в умовах наділяють, наприклад, хіральною хроматографією вколишнього середовища. або ферментативним шляхом і одержують енантіМалонатну сіль можна одержати за аналогічомер формули Va. Такий новий шлях синтезу для ними методиками. Відповідно, малонатну сіль за одержання сполуки формули (І) набагато ефективинаходом можна одержати обробкою вільної освніший, ніж вищезазначена кристалізація діастенови сполуки формули І малоновою кислотою в реомерних солей кінцевого продукту І. Конкретно: інертному розчиннику з подальшим осадженням вихід при розділенні вказаним новим методом іссолі, виділенням і необов'язково перекристалізацітотно вищий (45% відносно кількості початкової єю. Якщо буде потрібно, кристалічну сіль можна рацемічної речовини, тобто максимальний теорепотім піддати тонкому подрібненню шляхом волотичний вихід складає 50%) в порівнянні з виходом гого або сухого розмелювання, або іншим зручним при розділенні кінцевого продукту І кристалізацією способом, або одержанням частинок способом діастереомерних солей (22% відносно кількості емульгування в розчиннику. початкової рацемічної речовини, тобто максимаОсадження малонатної солі за винаходом пельний теоретичний вихід складає 50%). Ще однією реважно проводять, розчиняючи вільну основу перевагою даного винаходу є те, що енантіомерна сполуки формули (І) у відповідному розчиннику, чистота сполуки (І) є вищою (вище за 99% ее.) при наприклад, 2-пропанолі, а потім змішують одержаодержанні її синтезом за винаходом в порівнянні з ний розчин з суспензією або розчином малонової синтезом, в якому використовують кристалізацію кислоти у відповідному розчиннику, наприклад, 2діастереомерних солей (95,4% ее.). Крім того, ропропанолі. Суспензію можна нагрівати доти, поки зділення проміжної сполуки, а не кінцевого продуне розчиниться вся малонова кислота. Малонатну кту, забезпечує набагато ефективніший синтез, сіль сполуки за винаходом осаджують, переважно оскільки на подальших стадіях використовують при охолоджуванні розчину. Малонатну сіль за тільки правий енантіомер, що в результаті привовинаходом необов'язково перекристалізовують дить до вищих об'ємних виходів і зменшення виодин або кілька разів, відфільтровують, промиватрати реагентів. ють, наприклад, в 2-пропанолі і сушать. Отже, енантіомер формули (І) може бути одеОдержання сполуки формули (І) ржаний за способом, який включає наступні стадії: Сполуку формули (І) у вигляді рацемату можна одержати, як описано в ЕР 638073, а в статті Здійснюють взаємодію бензилціаніду з 2,5дихлорбензонітрилом у присутності основи (зручно використовувати трет-бутоксид калію (tBuOK)) у відповідному розчиннику, такому як диметиловий простий ефір (DME); подальша реакція з метилхлорацетатом (МСА) приводить до спонтанного замикання циклу і утворення сполуки формули (II) в одному реакторі. Сполуку формули (II) потім піддають кислотному гідролізу з утворенням сполуки формули (III), зручно нагріванням в суміші оцтової кислоти, сірчаної кислоти і води, а потім сполуку (III) декарбоксилюють нагріванням у відповідному розчиннику, такому як толуол з триетиламіном або Nметилпіролідоном, одержуючи сполуку формули (IV). 11 Потім сполуку формули (IV) відновлюють, зручно NaBH4, у розчиннику, такому як спирт, наприклад, етанол або iзо-пропанол, і переважно при температурі від -30° до +30°С, наприклад нижче 30°С, нижче 20°С, нижче 10°С або переважно нижче 5°С, одержуючи сполуку формули (V) з цисконфігурацією. Сполуку формули (V) розділяють для одержання необхідного енантіомера (формули Va), тобто енантіомера також з цис-конфігурацією ((1S,3S)-6-хлор-3-феніліндан-1-олу): Розділення сполуки (V) з виділенням (Va) можна здійснити, наприклад, за допомогою хіральної, переважно рідинної хроматографії, на відповідній хіральній колонці з силікагелем, покритим хіральним полімером, наприклад модифікованою амілозою, переважно на силікагелі, покритому трис-(3,5диметилфенілкарбамат)амілозою. Для хіральної рідинної хроматографії використовують відповідний розчинник, такий як, наприклад, спирт, нітрил, простий ефір або алкан або їх суміші, у відповід Відповідними складними ефірами (Vb) сполуки формули (V) є складні ефіри, такі як ацетат, пропіонат, бутират, валерат, гексаноат, бензоат, 89617 12 ному випадку етанол, метанол, ізопропанол, ацетонітрил або метил-трет-бутиловий простий ефір або їх суміші, переважно метанол або ацетонітрил. Хіральна рідинна хроматографія може бути здійснена в збільшених масштабах за допомогою спеціальних технологій, наприклад, систем з симульованим рухом стаціонарної фази (SMB). У альтернативному варіанті, сполуку формули (V) піддають розділенню з одержанням сполуки Va ферментативним розділенням. Встановлено, що енантіомерно чиста сполука Va або її ациловані похідні можна одержати ферментативним енантіоселективним ацилюванням гідроксильної групи в рацемічній сполуці V, при цьому одержують сполуку Va або її ациловане похідне високої оптичної чистоти. Альтернативно, енантіомерно чисту сполуку Va можна також одержати за способом, який включає перетворення рацемічної сполуки V у відповідний складний ефір по положенню, в якому знаходиться гідроксильна група, з подальшим ферментативним енантіоселективним деацилюванням. Застосування ферментативного енантіоселективного деацилювання описано для інших сполук. Відповідно, розділення сполуки (V) з виділенням (Va) можна здійснити за допомогою селективного ферментативного ацилювання. Селективне ферментативне ацилювання означає, що ферментативне ацилювання є переважно ефективним для перетворення одного з цис-енантюмерів сполуки формули V, причому інший цис-енантіомер сполуки V залишається в реакційній суміші незміненим. Альтернативно, розділення сполуки (V) з виділенням (Va) можна здійснити за допомогою селективного ферментативного деацилювання. Селективне ферментативне деацилювання означає, що ферментативне деацилювання є переважно ефективним для перетворення одного з складних ефірів сполуки формули V, причому інший цисенантіомер з складних ефірів сполуки формули V залишається в реакційній суміші незміненим. лаурат, ізобутират, 2-метилбутират, метилбутират, півалат, 2-метилвалерат, метилвалерат, 4-метилвалерат 33 13 де R позначає, наприклад, ацетат, пропіонат, бутират, валерат, гексаноат, бензоат, лаурат, ізобутират, 2-метилбутират, 3-метилбутират, півалат, 2-метилвалерат, 3-метилвалерат, 4метилвалерат. Таким чином, один з варіантів здійснення винаходу відноситься до способу одержання (S,S)або (R,R)-енантюмера сполуки формули V (тобто з цис-конфігурацією), який включає: a) енантіоселективне ферментативне ацилювання рацемічної сполуки V з використанням ацилювального агента або b) енантіоселективне ферментативне деацилювання рацемічної сполуки Vb з утворенням суміші деацилованої сполуки Va. Енантіоселективне ферментативне ацилювання означає, що ферментативне ацилювання є переважно ефективним для перетворення одного з енантіомерів сполуки формули V, причому інший цис-енантіомер сполуки V залишається в реакційній суміші переважно незміненим. Енантіоселективне ферментативне деацилювання означає, що ферментативне деацилювання є переважно ефективним для перетворення одного з енантіомерів. сполуки формули (Vb), причому інший цисенантіомер з складних ефірів сполуки формули Vb залишається в реакційній суміші переважно незміненим. Суміші, одержані ферментативним розділенням, можуть бути не зовсім чистими, наприклад, вони можуть містити разом з великою кількістю бажаного ізомеру (Va) меншу кількість іншого ізомеру. Склад суміші, одержаної після ацилювання або деацилювання за винаходом, залежить, серед іншого, від конкретної використовуваної гідролази та умов, при яких проводять реакцію. Особливість ферментативного ацилювання/деацилювання за винаходом полягає в тому, що перетворенню піддається набагато більша частина одного енантіомера, ніж іншого. Таким чином, енантіоселективне ацилювання за винаходом в результаті приводить до утворення суміші, що містить переважно сполуку формули (Vb) в (R,R)-формі та сполуку формули (Va) в (S,S)-формі, або може в результаті дати суміш переважно сполуки формули (Vb) в (S,S)формі та сполуки формули (Va) в (R,R)-формі. Таким же чином енантіоселективне ферментативне деацилювання може в результаті привести до утворення суміші, яка містить переважно сполуку формули (Vb) в (S,S)-формі і сполуку формули (V) в (R,R)-формі, або може в результаті дати суміш, яка містить переважно сполуку формули (Va) в (R,R)-формі та сполуку формули (Va) в (S,S)формі. Оптична чистота Va, одержаної за способом оптичного розділення за винаходом, звичайно складає принаймні 90% ее., переважно принаймні 89617 14 95% ее., більш переважно принаймні 97% ее. і найбільш переважно принаймні 98% ее. Проте, допустимі й нижчі значення оптичної чистоти. За винаходом енантіоселективне ферментативне ацилювання проводять в умовах, які практично пригнічують гідроліз. Гідроліз, який є реакцією, зворотною ацилюванню, має місце, якщо в реакційній системі є вода. Отже, енантіоселективне ферментативне ацилювання проводять в органічному розчиннику, який не містить воду або в майже безводному органічному розчиннику (звичайно для того, щоб ферменти були активними, потрібна присутність деякої кількості води). Відповідні розчинники включають вуглеводні, такі як гексан, гептан, бензол і толуол; прості ефіри, такі як діетиловий ефір, діізопропіловий ефір, тетрагідрофуран, 1,4-діоксан, трет-бутилметиловий ефір і диметоксіетан; кетони, такі як ацетон, діетилкетон, бутанон і метилетилкетон; складні ефіри, такі як метилацетат, етилацетат, етилбутират, вінілбутират і етилбензоат; галогеновані вуглеводні, такі як метиленхлорид, хлороформ і 1,1,1-трихлоретан; вторинні і третинні спирти, такі як трет-бутанол; азотовмісні розчинники, такі як диметилформамід, ацетамід, формамід, ацетонітрил і пропіонітрил; і апротонні полярні розчинники, такі як диметилсульфоксид, N-метилпіролідон і гексаметилфосфортриамід. Переважними органічними розчинниками для ферментативного ацилювання є органічні розчинники, такі як толуол, гексан, гептан, діоксан і тетрагідрофуран (ТГФ). Відповідними незворотними донорами ацильноі групи є, наприклад, такі донори ацилу, як вінілові складні ефіри, 2-пропенілові складні ефіри або 2,2,2-тригалогенетилові складні ефіри. Енантіоселективне ферментативне деацилювання переважно проводять у воді або в суміші води та органічного розчинника, доцільно у присутності буфера. Відповідними органічними розчинниками є, наприклад, розчинники, що змішуються з водою, такі як спирти, ацетонітрил, диметилформамід (DMF), диметилсульфоксид (DMSO), 1,4діоксан, DME і диглім. Встановлено, що ферментативне ацилювання за винаходом можна проводити, використовуючи Novozym 435 (Candida Antarctica lipase В, від Novozymes A/S, Fluka Cat. -No. 73940). Взагалі, енантіоселективне ферментативне ацилювання або деацилювання за винаходом проводять переважно, використовуючи ліпазу, естеразу, ацилазу або протеазу. Ферменти, придатні за винаходом, являють собою такі ферменти, які здатні здійснити R-селективне ацилювання або S-селективне ацилювання гідроксильної групи рацемічної сполуки формули (V), або такі ферменти, які здатні здійснити R-селективне деацилювання або S 15 89617 16 селективне деацилювання ацильної групи рацемічної сполуки формули (Vb). Зокрема, імобілізовані форми ферменту,включаючи поперечнозшитий ферментний кристал (Cross-Linked Enzyme Crystal (CLEC)), є корисними згідно з винаходом. Переважний варіант здійснення винаходу відноситься до застосування ліпази для проведення ферментативного розділення сполуки V. Найбільш переважними ліпазами є Candida antarctica lipase (Fluka Cat. -No. 62299); Pseudomonas cepacia lipase (Fluka Cat. -No. 62309); Novozym СALB L (Candida antartica lipase B) (Novozymes A/S); Novozym 435 (Candida antartica lipase B) (Novozymes A/S); або Lipozyme TL IM (Thermomyces lanuginosus lipase) метилюють по вторинній аміногрупі (застосо(Novozymes A/S), переважно в імобілізованій форвано відновне амінування відповідними агентами, мі. такими як, наприклад, формальдегід, параформаСпиртну групу цис-спирту формули (Va) перельдегід, триоксан або діетоксиметан (DEM)), для творюють на відповідну придатну для видалення одержання вільної основи сполуки формули (І) групу, таку як, наприклад, галоген, наприклад, СІ або Br, переважно СІ, або сульфонатну групу, наприклад, мезилатну або тозилатну групу, реакцією з відповідним агентом, таким як тіонілхлорид, мезилхлорид або тозилхлорид, в інертному розчиннику, наприклад простому ефірі, у відповідному випадку в тетрагідрофурані. Одержана сполука має формулу (VI), де LG позначає придатну до видалення групу: Альтернативно, метильну групу можна ввести безпосередньо, використовуючи замість 2,2диметилпіперазину 1,2,2-триметилпіперазин (формули VIII, наведеної нижче) У переважному варіанті здійснення винаходу LG являє собою СІ, тобто цис-хлорид формули (VIa): Сполуку VI, наприклад, таку, де LG являє собою хлор, потім піддають взаємодії з 2,2диметилпіперазином у відповідному розчиннику, наприклад кетоні, такому як, наприклад, метилізобутилкетон або метилетилкетон, переважно метилізобутилкетон, у присутності основи, такої як, наприклад, карбонат калію. Одержану сполуку формули (VII) при взаємодії із сполукою VI, наприклад, такою, в якій LG являє собою СІ, скорочуючи таким чином синтез на одну стадію. Крім того, піперазинову частину молекули можна ввести шляхом взаємодії сполуки VI із сполукою формули (IX) (наведеної нижче), де PG являє собою захисну групу, таку як, наприклад (але не обмежуючись тільки вказаними прикладами), фенілметоксикарбоніл (часто званий Cbz або Z), трет-бутоксикарбоніл (часто званий ВОС), етоксикарбоніл або бензил, одержуючи таким чином сполуку формули (X), наведеної нижче 17 89617 18 сполуки VII. У даному контексті зрозуміло, що коли вказують стереоізомерну форму, тоді стереоізомер є головним складником сполуки. Конкретно, коли вказують енантіомерну форму, тоді сполука має енантіомерний надлишок вказаного енантіомера. Відповідно, один варіант здійснення винаходу відноситься до сполуки формули (Va), яка переважно має енантіомерний надлишок принаймні 60% (енантіомерний надлишок 60% означає, що відношення Va до її енантіомера складає 80:20 у вказаній суміші), принаймні 70%, принаймні 80%, принаймні 85%, принаймні 90%, принаймні 96%, Після зняття захисту одержують продукт (VII), переважно принаймні 98%. Крім того, діастереометилування якого, розглянуте вище, дає кінцевий продукт - сполуку І. Альтернативно, захисну групу, мерний надлишок сполуки складає переважно принаймні 70% (діастереомерний надлишок 70% таку як, наприклад, етоксикарбоніл, можна відразу означає, що відношення сполуки Va до (1R,3S)-6перетворити безпосередньо на метильну групу, хлор-3-феніліндан-1-олу складає 85:15 у вказаній використовуючи відповідний відновлювальний суміші), принаймні 80%, принаймні 85%, принаймні агент, наприклад алюмогідрид літію. 90% або принаймні 95%. Один варіант здійснення В процесі синтезу деяка кількість цисвинаходу відноситься до практично чистої сполуки діастереоізомера сполуки І (тобто 4-((1S,3S)-6Va. хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазин) утворюється як домішка до кінцевого продукту. Ця Наступний варіант здійснення винаходу відноситься до сполуки формули (VI), яка переважно домішка обумовлена, головним чином, утворенням має енантіомерний надлишок принаймні 60%, деякої кількості транс-форми сполуки (VI) (наприпринаймні 70%, принаймні 80%, принаймні 85%, клад (1R,3S)-3,5-дихлор-1-феніліндану, де LG явпринаймні 90%, принаймні 96%, переважно приляє собою СІ) на стадії утворення сполуки VI. Отнаймні 98% же, вміст домішки можна звести до мінімуму кристалізацією бажаної цис-форми сполуки VI з суміші транс- і цис-(VI); у випадку, коли LG являє собою СІ в сполуці VI, це можна зробити шляхом перемішування цієї суміші з відповідним розчинником, наприклад, алканом, таким як гептан, в результаті бажана цис-форма VI випадає в осад, а небажана транс-форма. сполуки VI переходить в розчин. Бажану цис-форму сполуки VI (наприклад, коли LG являє собою СІ) виділяють фільтруванням, промивають вказаним розчинником і сушать. Якщо цис-форма сполуки VI присутня в партії де LG є придатною до видалення групою, пе(VI), використовуваній в синтезі сполуки VII, збільреважно вибраною з групи, що складається з галошуватиметься утворення транс-форма сполуки VII гену, наприклад хлориду, або сульфонату. Один (наприклад, 4-((1S,3S)-6-хлор-3-феніліндан-1-іл)варіант здійснення винаходу відноситься до діас3,3-диметилпіперазину) як домішки в (VII); це дає тереомерної чистоти сполуки VI; тобто сполуки, другу можливість уникнути присутності цис-форми яка має діастереомерний надлишок переважно сполуки І в кінцевому продукті. Було встановлено, принаймні 10% (діастереомерний надлишок 10% що цис-форму сполуки VII можна видалити шляозначає, що відношення сполуки VI до цисхом осадження відповідної солі сполуки формули діастереоізомера (наприклад (1S,3R)-3,5-дихлорVII, наприклад, солі органічної кислоти, такої як 1-феніліндану, коли LG являє собою СІ) у вказаній органічна двоосновна кислота, відповідно, гідросуміші складає 55:45), принаймні 25% або принайфумаратної солі або гідромалеатної солі сполуки мні 50%. Один варіант здійснення винаходу відноформули (VII), необов'язково з подальшою перекситься до практично чистої сполуки VI. ристалізацією один або кілька разів. Відповідно, винахід також відноситься до споКрім того, було знайдено, що домішки в І у вилуки формули (VIa) гляді цис-діастереоізомера (наприклад, 4-((1S,3S)6-хлор-3-феніліндан-1-іл)-1,2,2триметилпіперазину) можна ефективно видаляти шляхом осадження відповідної солі сполуки формули (І), наприклад, солі органічної кислоти, такої як органічна двоосновна кислота, відповідно, фумаратної солі, наприклад, гідрофумаратної солі сполуки формули (І), необов'язково з подальшою перекристалізацією один або кілька разів. Додатковими об'єктами винаходу також є проміжні сполуки, як описано в даній заявці, для синтезу сполуки формули (І), тобто конкретно проміжяка переважно має енантіомерний надлишок ні сполуки (Va), VI, наприклад VIa, і VII або солі принаймні 60%, принаймні 70%, принаймні 80%, 19 89617 20 принаймні 85%, принаймні 90%, принаймні 96%, лонатної солі сполуки формули (І). Винахід також переважно принаймні 98%. Один варіант здійсвідноситься до застосування таких солей і компонення винаходу відноситься до діастереомерної зицій в медицині, наприклад, для лікування захвочистоти сполуки, тобто сполуки, яка має діастерерювань центральної нервової системи, що вклюомерний надлишок переважно принаймні 10% (дічають психоз, зокрема шизофренію або інші астереомерний надлишок 10% означає, що віднозахворювання з психотичними симптомами, такі шення сполуки до цис-діастереоізомера (1S,3R)як, наприклад, шизофренія, шизоморфний розлад, 3,5-дихлор-1-феніліндану у вказаній суміші склашизоафективний розлад, маревний розлад, коротдає 55:45), принаймні 25% або принаймні 50%. кочасний психотичний розлад, сумісний (подільОдин варіант здійснення винаходу відноситься до ний) психотичний розлад, а також інші психотичні практично чистої сполуки VI, де LG являє собою порушення або захворювання з психотичними СІ. симптомами, наприклад, манія в біполярному розВинахід також відноситься до сполуки (VII) ладі. структури: Крім того, антагоністична активність сполуки за винаходом відносно рецепторів 5-НТ2 примушує припустити, що сполука може мати відносно низький ризик щодо екстрапірамідних побічних ефектів. Цей винахід також відноситься до застосування сукцинатної або малонатної солі за винаходом, переважно гідросукцинатної солі (наприклад, її кристалічної альфа-форми) або гідромалонатної солі сполуки формули (І) для лікування захворювання, вибраного з групи, що складається з тривожних розладів, афективних розладів, що включають депресію, порушення сну, мігрені, індукованого нейролептиками паркінсонізму, кокаїнової залежності, нікотинової залежності, алкоголізму та інших розладів, пов'язаних із зловживанщо переважно має енантіомерний надлишок нями. принаймні 60% (енантіомерний надлишок 60% У широкому аспекті цей винахід відноситься означає, що відношення VII до її енантіомера до способу лікування шизоморфного розладу, шискладає 80:20 у вказаній суміші), принаймні 70%, зоафективного розладу, маревного розладу, коропринаймні 80%, принаймні 85%, принаймні 90%, ткочасного психотичного розладу, сумісного (подіпринаймні 96%, переважно принаймні 98%, або до льного) психотичного розладу або манії в її солі, такої як, наприклад, фумаратна сіль, набіполярному розладі, який включає введення теприклад гідрофумарат, або малеатна сіль, наприрапевтично ефективної кількості сполуки транс-4клад гідромалеат. Один варіант здійснення вина(6-хлор-3-феніліндан-1-іл)-1,2,2ходу відноситься до сполуки VII діастереомерної триметилпіперазину або її солі. чистоти, тобто сполуки, яка має діастереомерний Оскільки використовуваний тут термін "транснадлишок переважно принаймні 10% (діастерео4-(6-хлор-3-феніліндан-1-іл)-1,2,2мерний надлишок 10% означає, що відношення триметилпіперазин" не містить будь-якої конкретсполуки VII до цис-(1S,3S) діастереоізомера у вканої вказівки на енантіомерну форму (наприклад, заній суміші складає 55:45), принаймні 25%, привикористовуючи прийняті позначення (+) і (-) або наймні 50%, принаймні 70%, принаймні 80%, приR/S), це означає, що він відноситься до будь-якої наймні 90%, принаймні 95%, принаймні 97%, енантіомерної форми вказаної сполуки, тобто до принаймні 98%. Один варіант здійснення винаходу будь-якого з двох енантіомерів 4-((1R,3S)-6-хлорвідноситься до практично чистої сполуки VII або її 3-)-1,2,2-триметилпіперазину (І) або 4-((1S,3R)-6солі. хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазину Наступний об'єкт винаходу відноситься до або до суміші цих двох, наприклад, рацемічної сполуки І або до її солі, зокрема фумаратної, масуміші. Проте, в даному контексті переважно, коли лонатної або сукцинатної солі, яку можна одержувміст енантіомера, відповідного енантіомеру сповати, зокрема одержана за способом за винахолуки (І), складає принаймні 50%, тобто принаймні дом, як описано в даній заявці. такий, як в рацемічній суміші, але переважним є Наступний об'єкт винаходу відноситься до енантіомерний надлишок сполуки І. сполуки VII або до її солі, наприклад, фумаратної У цьому контексті для фармацевтичного засолі, яку можна одержувати, зокрема одержана за стосування зрозуміло, що коли вказана енантіомеспособом за винаходом, як описано в даній заявці. рна форма сполуки отранс-4-(6-хлор-3-фенілінданФармацевтичне застосування 1-іл)-1,2,2-триметилпіперазину (наприклад, як Фізичні властивості солей сполуки І за винахозроблено у формулі (І)), тоді сполука відносно дом указують на те, що вони особливо корисні як стереохімічно чиста, як описано вище, енантіомефармацевтичний засіб. рний надлишок складає переважно принаймні 80% Відповідно, цей винахід, крім того, відноситься (енантіомерний надлишок 80% означає, що віднодо фармацевтичної композиції сукцинатної солі, шення сполуки І до її енантіомера ркладає 90:10 у зокрема до гідросукцинатної солі, як описано тут вказаній суміші), принаймні 90%, принаймні 96% (наприклад, до альфа-або бета-форми, як описано або переважно принаймні 98%. У переважному тут) або до малонатної солі, зокрема до гідрома 21 89617 22 варіанті здійснення винаходу діастереомерний (І), переважно гідросукцинатної або гідромалонатнадлишок сполуки І складає принаймні 90% (діасної солі сполуки формули (І). тереомерна чистота 90% означає, що відношення Наступний об'єкт винаходу відноситься до сполуки І до цис-4-((1S,3S)-6-хлор-3-феніліндан-1способу лікування індукованого нейролептиками іл)-1,2,2-триметилпіперазину складає 95:5), припаркінсонізму, який включає введення терапевтинаймні 95%, принаймні 97% або принаймні 98%. чно ефективної кількості сполуки транс-4-(6-хлорУ переважному варіанті здійснення винахід ві3-феніліндан-1-іл)-1,2,2-триметилпіперазину або її дноситься до способу лікування шизоморфного солі, переважно сполуки формули (І) або її солі, розладу, шизоафективного розладу, маревного або в переважному варіанті здійснення винаходу розладу, короткочасного психотичного розладу, сукцинатної або малонатної солі сполуки формули сумісного (подільного) психотичного розладу або (І), переважно гідросукцинатної або гідромалонатманії в біполярному розладі, який включає ввеної солі сполуки формули (І). дення терапевтично ефективної кількості сполуки Крім того, винахід відноситься до способу ліформули (І) [тобто 4-((1R,3S)-(6-хлор-3кування наркотичної залежності, наприклад, нікофеніліндан-1-іл)-1,2,2-триметилпіперазину] або її тинової, алкогольної або кокаїнової залежності, солі. який включає введення терапевтично ефективної Один варіант здійснення винаходу відноситься кількості сполуки транс-4-(6-хлор-3-феніліндан-1до способу лікування позитивних симптомів шиіл)-1,2,2-триметилпіперазину або її солі, переважзофренії, негативних симптомів і депресивних но сполуки формули (І) або її солі, або в переважсимптомів шизофренії, який включає введення ному варіанті здійснення винаходу сукцинатної терапевтично ефективної кількості сполуки трансабо малонатної солі сполуки формули (І), перева4-(6-хлор-3-феніліндан-1-іл)-1,2,2жно гідросукцинатної або гідромалонатної солі триметилпіперазину або її солі, переважно сполусполуки формули (І). ки формули (І) або її солі або в переважному варіСіль або композицію за винаходом можна анті здійснення винаходу сукцинатної або малонавводити будь-яким відповідним шляхом, напритної солі сполуки формули (І), переважно клад, перорально, букально, сублінгвально або гідросукцинатної або гідромалонатної солі сполуки парентерально, і сіль може знаходитися в будьформули (І). якій формі, відповідній для такого введення, наНаступний варіант здійснення винаходу відноприклад, у вигляді пігулок, капсул, порошків, сироситься до способу лікування позитивних симптомів пів або розчинів або дисперсій для ін'єкцій. В одшизофренії, який включає введення терапевтично ному з варіантів здійснення винаходу сіль за ефективної кількості сполуки транс-4-(6-хлор-3винаходом вводять у вигляді твердої фармацевфеніліндан-1-іл)-1,2,2-триметилпіперазину або її тичної форми, пігулки або капсули, відповідно. солі, переважно сполуки формули (І) або її солі Способи одержання твердих фармацевтичних або в переважному варіанті здійснення винаходу препаратів добре відомі в даній галузі техніки. Пісукцинатної або малонатної солі сполуки формули гулки можуть бути одержані змішуванням активно(І), переважно гідросукцинатної або гідромалонатго інгредієнта із звичайними ад'ювантами, наповної солі сполуки формули (І). нювачами і розріджувачами і потім пресуванням Ще один варіант здійснення винаходу відносуміші у відповідній таблетувальній машині. Прикситься до способу лікування негативних симптомів лади ад'ювантів, наповнювачів і розчинників вклюшизофренії, який включає введення терапевтично чають кукурудзяний крохмаль, лактозу, тальк, стеефективної кількості сполуки транс-4-(6-хлор-3арат магнію, камедь і їм подібні речовини. Будь-які феніліндан-1-іл)-1,2,2-триметилпіперазину або її інші ад'юванти і добавки, такі як барвники, аромасолі, або переважно сполуки формули (І) або її тизатори, консерванти і т.п. також можна викориссолі, або в переважному варіанті здійснення винатовувати за умови, що вони сумісні з активними ходу сукцинатної або малонатної солі сполуки фоінгредієнтами. рмули (І), переважно гідросукцинатної або гідроРозчини для ін'єкцій можна одержувати розчималонатної солі сполуки формули (І). ненням солі за винаходом і можливих добавок в Наступний варіант здійснення винаходу відночастині розчинника для ін'єкцій, переважно стериситься до способу лікування депресивних симптольній воді, доведенням розчину до потрібного мів шизофренії, який включає введення терапевоб'єму, стерилізацією розчину і заповненням відтично ефективної кількості сполуки транс-4-(6повідних ампул або флаконів. Можна додавати хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазину будь-які відповідні добавки, які звичайно викорисабо її солі, переважно сполуки формули (І) або її товують в даній галузі техніки, такі як агенти ізотосолі, або в переважному варіанті здійснення винанічності, консерванти, антиоксиданти, солюбілізаходу гідросукцинатної або малонатної солі сполуки тори і т.п. формули (І). Денна доза вищезгаданої сполуки формули (І), Наступний об'єкт винаходу відноситься до в розрахунку на вільну основу, складає відповідно способу лікування манії та/або підтримки біполярвід 1,0 до 160мг на день, більш підхожа доза скланого розладу, який включає введення терапевтичдає від 1 до 100мг, наприклад, переважно від 2 до но ефективної кількості сполуки транс-4-(6-хлор-355 або від 3 до 55мг. феніліндан-1-іл)-1,2,2-триметилпіперазину або її Термін "лікування", використовуваний в даній солі, переважно сполуки формули (І) або її солі, заявці у зв'язку із захворюваннями і розладами, або в переважному варіанті здійснення винаходу включає також профілактику залежно від обстасукцинатної або малонатної солі сполуки формули вин. 23 89617 24 Винахід ілюструється наведеними нижче приЯМР в хлороформі, використовуючи інтеграли -1 кладами, які не є обмежувальними. сигналу при 5,3ррm (млн ) для цис-ізомеру і сиг-1 Приклади налу при 5,5ррm (млн ) для транс-ізомеру. Одержання сполук Звичайно методом ЯМР можна визначити Аналіз вміст приблизно 1% небажаного ізомеру. Енантіомерний надлишок сполуки (Vа) в прикПорошкові рентгенівські дифрактограми реладі 1а визначають за допомогою хіральної ВЕРХ єструють на дифрактометрі PANalytical X'Pert PRO на колонці CHIRALCEL OD 0,46см ID (ID - внутріпри використанні СuK 1 випромінювання. Вимірюшній діаметр) x 25см L (L - довжина), 10мкм при вання проводять в режимі відбиття в інтервалі 40°С. Як рухому фазу використовують нкутів відбиття 2 від 5 до 40°. гексан/етанол 95:5 (об'єм/об'єм) при швидкості Температури плавлення визначають, викориспотоку 1,0мл/хв., детектування здійснюють УФтовуючи диференціальну сканувальну калориметдетектором при 220нм. рію (DSC) на приладі TA-Instruments DSC-2920, Аналіз методом ВЕРХ ступеня перетворення, каліброваному при 5°/хвилину і одержують темпевикористовуваний для прикладів 1b: ратуру плавлення як початкове значення. Близько Колонка: колонка A Lichrospher RP-8, 250x4мм 2мг зразка нагрівають із швидкістю 5°/хвилину в (розмір частинок 5мкм) нещільно закритій чашці в струмі азоту. Елюент: забуферений МеОН/вода, приготоваСинтез ключового початкового матеріалу ний таким чином: 1,1мл Et3N додають до 150мл Сполуку V синтезують із сполуки IV відновленводи, 10% Н3РО4 (водн.) додають до рН=7 і водою ням боргідридом натрію (NaBH4), адаптуючи сподоводять загальний об'єм до 200мл. Суміш додасіб, описаний в роботі (Bøgesø J. Med Chem., 1983, ють до 1,8л МеОН. 26, 935), використовують етанол як розчинник і Енантіомерний надлишок сполуки (Vа) в прикпроводять реакцію при температурі приблизно ладі 1b визначають за допомогою хіральної ВЕРХ, 0°С. Обидві сполуки описані в Bøgesø et al., J. Med використовуючи колонку CHIRALPAK AD 0,46см Chem , 1995, 38, 4380-4392. Сполуку IV синтезу(ID) x 25см (L), 10мкм при 21°С. Як рухому фазу ють з II, використовуючи загальні методики, опивикористовують гептан/етанол/діетиламін, сані в статті (Sommer et al., J. Org Chem., 1990, 55, 89,9:10:0,1 (об'єм/об'єм/об'єм) при швидкості пото4822), де також описано сполуку II та її синтез. ку 1,0мл/хв., детектування здійснюють УФПриклад 1а Синтез (1S,3S)-6-хлор-3детектором при 220нм. феніліндан-1-олу (Va) із застосуванням хіральної Енантіомерний надлишок сполуки (І) визначахроматографії ють електрофорезом з використанням кварцової Рацемічний цис-6-хлор-3-феніліндан-1-ол (V) капілярної колонки (СЕ) в наступних умовах: капі(492г) розділяють за допомогою препаративної ляр: 50мкм (ID) x 64,5см L, робочий буфер: 1,25мМ хроматографії на колонці CHIRALPAK AD 10см -циклодекстрину в 25мл розчину дигідрофосфа(ID) x 50см L, 10мкм при 40°С. Як рухому фазу ту, рН 1,5, напруга: 16кВ, температура: 22°С, упвикористовують метанол при витраті потоку рискування: 50мбар протягом 5 секунд, детекту190мл/хвилину, детектування здійснюють УФвання: детектування на колонці за допомогою детектором при 287нм. Рацемічний спирт (V) вводioдної матриці при 192нм, концентрації зразка: дять у вигляді розчину концентрацією 50000ррm 500мкг/мл. У вказаній системі час утримування (млн-1) в метанолі; уприскують 90мл з інтервалами сполуки І складає приблизно 33 хвилини і час 28 хвилин. Всі фракції, що містять вказану в загоутримування іншого енантіомера складає приблиловку сполуку з більш ніж 98% енантіомерним зно 35 хвилин. надлишком, об'єднують і випарюють насухо на 1 H ЯМР спектри реєструють на приладі Bruker роторному випарнику з подальшою сушкою у вакуAvance DRX500 (500,13МГц) або на приладі Bruker умі при 40°С. Вихід складає 220 грамів твердої AC 250 (250,13МГц). Хлороформ (99,8% D) або речовини. Дані елементного аналізу і ЯМР відподиметилсульфоксид (99,8% D) використовують як відають структурі, енантіомерний надлишок вище 20 розчинники, а тетраметилсилан (ТМС) - як внутрі98% згідно з хіральною ВЕРХ [ ]D +44,5° (с=1,0, шній стандарт. метанол). Відношення цис/транс-форм для сполук І і VII Приклад lb Синтез (1S,3S)-6-хлор-3визначають методом 1H ЯМР, як описано (Bøgesø феніліндан-1-олу (Va) із застосуванням ферментаet al., J Med Chem., 1995, 38, 4380-4392 (сторінка тивного розділення 4388, правий стовпчик). Відношення цис-транс1 форм сполуки VI визначають також методом H 25 Сполуку V (5г, 20,4ммоль ) розчиняють в 150мл безводного толуолу. Додають 0,5г Novozym 435 (Candida Antarctica lipase В) (Novozymes A/S, Fluka Cat. -No. 73940), а потім вінілбутират (13мл, 102,2ммоль). Суміш перемішують механічною мішалкою при 21°С. Через 1 день додають додатково 0,5г Novozym 435. Через 4 дні при перетворенні 54% суміш фільтрують і концентрують у вакуумі, одержуючи оливу, яка містить суміш складного ефіру (1R,3R)-цис-6-хлор-3-феніліндан-1-олбутирату і цільової сполуки Va з енантіомерним надлишком 99,2% (99,6% сполуки Va і 0,4% (1R,3R)-цис-6-хлор-3-феніліндан-1-олу). Синтез (І) і видалення домішки у вигляді цисдіастереоізомера осадженням гідрофумаратної солі (І) Приклад 2 Синтез (1S,3S)-3,5-дихлор-1феніліндану (VI, LG=CI) Цис-(1S,3S)-6-хлор-3-феніліндан-1-ол (Va) (204г), одержаний, як описано в прикладі 1а, розчиняють в ТГФ (1500мл) і охолоджують до -5°С. Додають по краплях тіонілхлорид (119г) у вигляді розчину в ТГФ (500мл) протягом 1 години. Суміш перемішують при кімнатній температурі протягом ночі. До реакційної суміші додають лід (100г). Коли лід розплавляється, розділяють водну фазу (А) і органічну фазу (В) і органічну фазу В двічі промивають насиченим розчином бікарбонату натрію (200мл). Фази з бікарбонатом натрію об'єднують з водною фазою А, доводять рН до 9, додаючи гідроксид натрію (28%) і використовують ще для одного промивання органічної фази В. Утворену водну фазу (С) і органічну фазу В розділяють і водну фазу С екстрагують етилацетатом. Етилацетатну фазу об'єднують з органічною фазою В, сушать над сульфатом магнію і випарюють насухо на роторному випарнику, одержуючи вказану в заголовку сполуку у вигляді оливи з виходом 240г, яку відразу ж використовують в прикладі 5. Відношення цис/транс складає 77:23 (за даними ЯМР). Приклад 3 Синтез 3,3-диметилпіперазин-2-ону Карбонат калію (390г) і етилендіамін (1001г) перемішують з толуолом (1,50л). Додають розчин етил-2-бромізобутирату (500г) в толуолі (750мл). Суспензію кип'ятять із зворотним холодильником протягом ночі та фільтрують. Осад на фільтрі промивають толуолом (500мл). Об'єднані фільтрати (об'єм 4,0л) нагрівають на водяній бані та переганяють при тиску в 0,3атм, використовуючи апарат Кляйзена; перші 1200мл дистиляту збирають при 35°С (температура суміші становить 75°С). Додають додаткову кількість толуолу (600мл) і збирають ще 1200мл дистиляту при 76°С (температура суміші становить 80°С). Знову додають толуол (750мл) і збирають 1100мл дистиляту при 66°С (температура суміші становить 71°С). Суміш перемішують на льодяній бані та вносять затравку, в результаті продукт випадає в осад. Продукт виділяють фільтруванням, промивають толуолом і сушать протягом ночі у вакуумній сушильній шафі при 50°С. Вихід 3,3-диметилпіперазин-2-ону складає 171г (52%). Дані ЯМР відповідають структурі. Приклад 4 Синтез 2,2-диметилпіперазину Суміш 3,3-диметилпіперазин-2-ону (8,28кг, 64,6моль) і тетрагідрофурану (ТГФ) (60кг) нагріва 89617 26 ють до 50-60°С, внаслідок чого утворюється мутнуватий розчин. ТГФ (50кг) перемішують в атмосфері азоту і додають LiAIH4 (250г, в розчинній пластиковій упаковці від Chemetall), що приводить до повільного виділення газу. Після припинення виділення газу, додають додаткову кількість LiAIH4 (всього використовують 3,0кг, 79,1моль), і температура підвищується від 22°С до 50°С внаслідок екзотермічної реакції. Поволі додають розчин 3,3диметилпіперазин-2-ону протягом 2 годин при 4159°С. Суспензію перемішують протягом ще однієї години при 59°С (температура "сорочки" становить 60°С). Суміш охолоджують і протягом двох годин додають воду (3л), підтримуючи температуру нижче 25°С (необхідно охолоджувати при температурі в сорочці 0°С). Потім додають гідроксид натрію (15%, 3,50кг) протягом 20 хвилин при 23°С, при обов'язковому охолоджуванні. Протягом півгодини додають додаткову кількість води (9л) (при обов'язковому охолоджуванні) і одержану суміш перемішують протягом ночі в атмосфері азоту. Додають фільтрувальний агент целіт (Celit) (4кг) і суміш фільтрують. Осад на фільтрі промивають ТГФ (40кг). Об'єднані фільтрати концентрують в реакторі доги, поки температура в реакторі не підніметься до 70°С (температура перегонки 66°С) при тиску 800мбар. Залишок (12,8кг) додатково концентрують на роторному випарнику до об'єму приблизно 10л. Нарешті, суміш піддають фракційній перегонці при атмосферному тиску і збирають продукт при температурі 163-4°С. Вихід складає 5,3кг (72%). Дані ЯМР відповідають структурі. Приклад 5 Синтез транс-1-((1R,3S)-6-хлор-3феніліндан-1-іл)-3,3-диметилпіперазину (VII) Цис-(1S,3S)-3,5-дихлор-1-феніліндан (VI LG=CL) (240г) розчиняють в бутан-2-оні (1800мл). Додають карбонат калію (272г) і 2,2диметилпіперазин (одержаний в прикладі 4) (113г) і суміш кип'ятять із зворотним холодильником протягом 40 годин. До реакційної суміші додають діетиловий ефір (2л) і 1М соляну кислоту (6л) Фази розділяють і рН у водній фазі знижують з 8 до 1 дією концентрованої соляної кислоти. Водну фазу використовують для промивання органічної фази ще раз для того, щоб гарантувати, що весь продукт знаходиться у водній фазі До водної фази додають гідроксид натрію (28%) до рН 10 і водну фазу двічі екстрагують діетиловим ефіром (2л). Ефірні екстракти об'єднують, сушать над сульфатом натрію, випарюють насухо на роторному випарнику і одержують вказану в заголовку сполуку (вихід 251г) у вигляді оливи, яку відразу ж використовують в наступному прикладі. Відношення цис/транс складає 82:18 (за даними ЯМP). Приклад 6 Синтез гідрофумарату транс-4((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2триметилпіперазинію (І) Неочищений транс-1-((1R,3S)-6-хлор-3феніліндан-1-іл)-3,3-диметилпіперазин (VII) (250г) змішують з формальдегідом (37% у воді, 300мл) і мурашиною кислотою (366г) і суміш поволі нагрівають до кипіння. Суміш перемішують при кипінні протягом 3,5 годин і після охолоджування до кімнатної температури додають воду (1200мл). Суміш двічі екстрагують ефіром (1200мл) і потім водну 27 89617 28 фазу роблять лужною, додаючи гідроксид натрію ня більш стабільної альфа-форми гідросукцинату (28%, приблизно 500мл). Водну фазу три рази сполуки І. екстрагують ефіром (900мл). Органічні фази об'єУ вищеописаному експерименті ацетон можна днують і промивають насиченим розчином хлоризамінити водним ацетоном (95%), який також приду натрію (650мл) і водою (двічі) (500мл). Органічводить до утворення альфа-форми гідросукцинату ну фазу сушать над сульфатом натрію, сполуки І. фільтрують і випарюють насухо на роторному виДиференціальна сканувальна калориметрія парнику. Одержують 212г вільної основи транс-4(DSC) показує ендотерму з початковою темпера((7R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2турою 140°С і піком при 141°С, що відповідає альтриметилпіперазину (І) у вигляді оливи, що містить фа-формі. XRPD дифрактограма відповідає аль19% цис-діастереоізомера (за даними ЯМР). Спофа-формі. луки розчиняють в 1-пропанолі (3,18л), суміш наПриклад 9 Гідромалонат транс-4-((1R,3S)-6грівають до 50°С і одержують прозорий розчин. хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазинію Додають фумарову кислоту (69,3г), одержуючи (І) прозорий розчин. Суміші дають охолодитися, в Неочищений транс-4-((1R,3S)-6-хлор-3результаті вказана в заголовку сполука випадає в феніліндан-1-іл)-1,2,2-триметилпіперазин (І) (1,0г, осад. Продукт фільтрують, промивають 12,81ммоль), одержаний, як описано вище в прикпропанолом і сушать у вакуумі при 60°С. Одержуладі 7, розчиняють в 2-пропанолі (5мл). Готують ють 182г продукту, що-містить менше 1% цисрозчин малонової кислоти (0,291г, 2,46ммоль) в 2діастереоізомера (заданими ЯМР). Дані елементпропанолі (5мл) і додають розчин транс-4ного аналізу і ЯМР відповідають структурі. Енанті((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2омерний надлишок складає більше 99% (за данитриметилпіперазину (І), в результаті в осад випами хірального капілярного електрофорезу (СЕ). дає гідромалонат транс-4-((1R,3S)-6-хлор-3феніліндан-1-іл)-1,2,2-триметилпіперазинію. Су[ ]D20=-22,8° (с=1,0, метанол). спензію охолоджують до кімнатної температури, Виділення вільного аміну (І) з гідрофумаратної потім відокремлюють осад центрифугуванням. солі та повторне осадження у вигляді гідросукциСупернатант відкидають і осад промивають 2натної і гідромалона гної солей. пропанолом (5мл). Суспензію центрифугують, суПриклад 7 Синтез вільної основи 4-((1R,3S)-6пернатант відкидають і осад сушать "у вакуумі" хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазину при 50°С. Вихід 0,98г (84%). Елементний аналіз (І) відповідає структурі. Рентгенівська дифрактограма Гідрофумарат транс-4-((1R,3S)-6-хлор-3відповідає рентгенодифрактограмі гідромалонату, феніліндан-1-іл)-1,2,2-триметилпіперазинію (І) як показано на Фіг.3. (25,0г) суспендують в толуолі (125мл). Додають Синтез сполуки (І), утворення солі (VII) для то25% водний аміак (75мл). Три фази перемішують го, щоб видалити цис-діастереоізомер (VII) і утводоти, поки всі тверді речовини не зникнуть. Оргарення гідросукцинатної солі з неочищеної (І) нічну фазу відокремлюють, а водну фазу промиПриклад 10 Синтез гідромалеату транс-4вають толуолом (25мл). Об'єднані толуольні фази ((1R,3S)-6-хлор-3-феніліндан-1-iл)-3,3промивають водою (25мл). Водну фазу відкидадиметилпіперазинію (VII) ють, а органічну фазу сушать над сульфатом наПовторюють приклади 2 і 5, одержуючи нетрію (35г), суспензію фільтрують і фільтрат випаочищений транс-1-((1R,3S)-6-хлор-3-феніліндан-1рюють насухо на роторному випарнику, іл)-3,3-диметилпіперазин (VII) (близько 20г) у виодержуючи вказану в заголовку сполуку у вигляді гляді оливи, яку додатково очищають флешоливи. Неочищену вільну основу (15г) використохроматографією на силікагелі (елюент: етилацевують без додаткового очищення. тат/етанол/триетиламін, 90:5:5) і потім випарюють Приклад 8 Синтез гідросукцинату транс-4насухо на роторному випарнику. Одержують 12г ((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2вказаної в заголовку сполуки у вигляді оливи (відтриметилпіперазинію (І) ношення цис/транс складає 90:10 заданими ЯМР). Неочищений транс-4-((1R,3S)-6-хлор-3Оливу розчиняють в етанолі (100мл) і до одержафеніліндан-1-іл)-1,2,2-триметилпіперазину (І) ного розчину додають розчин малонової кислоти в (8,50г оливи), одержаний, як описано вище в прикетанолі до рН 3. Одержану суміш перемішують ладі 7, розчиняють в ацетоні (30мл). Готують супри кімнатній температурі протягом 16 годин і спензію бурштинової кислоти (3,25г) в ацетоні утворений осад збирають фільтруванням. Об'єм (32мл) і додають розчин транс-4-((1R,3S)-6-хлор-3етанолу зменшують і виділяють ще одну партію феніліндан-1-іл)-1,2,2-триметилпіперазину (І), буосаду. Вихід твердої вказаної в заголовку сполуки рштинова кислота розчиняється і незабаром випаскладає 3,5г (наявність цис-ізомеру не визначадає в осад гідросукцинат транс-4-((1R,3S)-6-хлорється за ЯМР). Температура плавлення 1753-феніліндан-1-іл)-1,2,2-триметилпіперазинію (І). 178°С. Суспензію охолоджують до 0°С протягом 90 хвиПриклад 11 транс-1-((1R,3S)-6-хлор-3лин, потім відокремлюють осад центрифугуванфеніліндан-1-іл)-3,3-диметилпіперазинин (VII) ням. Супернатант відкидають і осад промивають Суміш гідромалеату транс-1-((1R,3S)-6-хлор-3ацетоном (20мл). Суспензію центрифугують, супефеніліндан-1-іл)-3,3-диметил-піперазинію (VII) рнатант відкидають і осад сушать "у вакуумі" при (9,9г), концентрованого водного аміаку (100мл), 50°С. Вихід 8,56г. насиченого розчину хлориду натрію (150мл) і етиКоли дану методику здійснюють вперше, виділацетату (250мл) перемішують при кімнатній темлений продукт знаходиться у бета-формі, подальпературі протягом 30 хвилин. Фази розділяють і ші повторення приводять в результаті до утворен 29 89617 30 водну фазу ще раз екстрагують етилацетатом. Розчин алюмогідриду літію в тетрагідрофурані Об'єднані органічні фази промивають насиченим (ТГФ) (1,0М, Aldrich cat. no.21,277-6, 90мл) нагрірозчином хлориду натрію, сушать над сульфатом вають до 50°С на масляній бані. Поволі додають магнію, фільтрують і випарюють насухо у вакуумі. неочищений 3,3,4-триметилпіперазин-2-он (10г), Вихід 7,5г оливи. суспендований в ТГФ, що приводить до виділення Приклад 12 Одержання вільної основи трансгазу. Утворену суміш перемішують при 45-56°С 4-((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2протягом 4 годин до повного перетворення у вкатриметилпіперазину (І) зану в заголовку сполуку (згідно ЯМР) (відсутній -1 транс-1-((1R,3S)-6-Хлор-3-феніліндан-1-іл)сигнал початкової речовини при 1,2ррm (млн )). 3,3-диметилпіперазин (8,9г) (VII) розчиняють в Суміш охолоджують і додають воду (3,3мл), що мурашиній кислоті (10,5мл) і до розчину додають приводить до виділення газу. Потім додають 15% формальдегід (10,5мл). Нагрівають до 60°С і виводний розчин гідроксиду натрію (3,3мл), що підтримують при вказаній температурі протягом 2,5 силює виділення газу і під кінець додають воду годин. Після охолоджування реакційної суміші до(10мл). Суміш фільтрують і осад на фільтрі продають воду (50мл) і гексан (50мл). Водним NaOH мивають ТГФ (100мл). Фільтрати концентрують на (27%, 33мл) доводять рН до >12. Гексанову фазу роторному випарнику (0,3атм. і 60°С на водяній промивають водним NaCl (20мл) і водою (20мл). бані). Залишок розчиняють в ТГФ (200мл) і сушать Гексан обмінюють азеотропним чином з ацесульфатом натрію, потім суміш фільтрують, фільтоном (90мл) і суміш концентрують. Неочищену трат концентрують на роторному випарнику вільну основу в ацетоні (10мл) використовують без (0,2атм. і 60°С на водяній бані) і одержують 6,4г додаткового очищення. вказаної в заголовку сполуки. Дані ЯМР відповідаПриклад 13 Гідросукцинат транс-4-((1R,3S)-6ють структурі, речовина містить невелику кількість хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазинію ТГФ. (І) Приклад 16 Синтез гідрофумарату транс-4Неочищений транс-4-((1R,3S)-6-хлор-3((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2феніліндан-1-іл)-1,2,2-триметилпіперазин (І) у ацетриметилпіперазинію (І) із сполуки VI тоновому розчині (10мл). Готують суспензію буршЦис-(1S,3S)-3,5-дихлор-1-феніліндан (VI з тинової кислоти (3,4г) в ацетоні (20мл), додають LG=Cl) (17,8г) вводять в реакцію поєднання з перозчин транс-4-((1R,3S)-6-хлор-3-феніліндан-1-іл)регнаним 1,2,2-триметилпіперазином (VIII) (8,7г), 1,2,2-триметилпіперазину (І) і суміш нагрівають до використовуючи методику, описану в прикладі 5. кипіння (55°С). Бурштинова кислота розчиняється, Початкову речовину, вільний амін (15,7г), що місі під час охолоджування починає випадати в осад тить 6% цис-ізомеру, використовують для утвогідросукцинат транс-4-((1R,3S)-6-хлор-3рення гідрофумаратної солі за методикою, описафеніліндан-1-іл)-1,2,2-триметилпіперазинію (І). ною в прикладі 6. Вихід вказаної в заголовку Суспензію залишають на ніч для осадження. Гідсполуки 15,7г; дані ЯМР відповідають структурі, росукцинат транс-4-((1R,3S)-6-хлор-3-фенілінданприсутність цис-ізомеру не спостерігають. 1-іл)-1,2,2-триметилпіперазинію виділяють фільтСинтез кристалічної бета-форми гідросукцинаруванням і промивають ацетоном (20мл). Продукт тної солі сполуки І сушать "у вакуумі" при 60°С. Вихід 7,9г. Приклад 17 Синтез гідросукцинату транс-4За допомогою диференціальної сканувальної ((1R,3S)-6-хлор-3-феніліндан-1-іл)-1,2,2калориметрії одержано ендотерму з початковою триметилпіперазинію (І), бета-форми температурою 140°С і піком при 141°С, що відпоГідросукцинат сполуки І (50мг) суспендують у відає альфа-формі. XRPD дифрактограма відповіводі (1мл) і дозволяють урівноважитися протягом 3 днів. Нерозчинену речовину видаляють фільтрудає альфа-формі. [ ]D20=-22,04° (с=1,0, метанол). ванням. Бета-форма гідросукцинату сполуки І Синтез І з використанням 1,2,2утворюється при природному випаровуванні розтриметилпіперазину чинника. Після повного випаровування розчинника Приклад 14 Синтез 3,3,4-триметилпіперазин-2бета-форму аналізують за методами XRPD і DSC. ону Результати аналізу: Диференціальна сканува3,3-Диметилпіперазин-2-он (50г) суспендують льна калориметрія (DSC) показує ендотерму з в 1,2-диметоксіетані (DME) (150мл) і додають карпочатковою температурою 135,6°С і пік при бонат калію (70г). Протягом півгодини додають 137,5°С, що відповідає бета-формі. XRPD відповіметилйодид (66,4г), при цьому суміш злегка оходає бета-формі. лоджують, дозволяючи температурі підніматися до Характеристика солей 50°С. Суміш перемішують протягом 9 годин на Приклад 18 Розчинність солей сполуки формасляній бані при 40-45°С і відбирають зразок для мули (І) ЯМР, який показує, що залишилося 8% початкової -1 Розчинність солей у воді визначали додаванречовини (сигнал при 2,8ррm (млн )). Додають ням надлишку (50мг) солі до 2мл води. Суспензії додаткову кількість метилйодиду (4,6г) і суміш пезалишають при перемішуванні принаймні на 24 ремішують ще 2,5 години при 40°С; ЯМР-аналіз години, потім вимірюють рН і визначають концентнового зразка вказує на повне перетворення. Сурацію методом ВЕРХ. Виділяють твердий осад і міш фільтрують і осад на фільтрі промивають залишають сушитися в лабораторії. Результати DME. Фільтрат випарюють насухо і одержують 41г підсумовані в таблиці 1. вказаної в заголовку сполуки. Дані ЯМР відповідають структурі. Приклад 15 Синтез 1,2,2-триметилпіперазину 31 89617 Таблиця 1 Розчинність солей у воді при кімнатній температурі 32 Площі піків на хроматограмах, окрім піків відповідних речовині або кислоті, підсумовані. Для сукцинатної солі за винаходом не спостерігається взагалі ніякого розкладу. Таблиця 2 Зразок Сукцинат 1:1 альфа Малонат 1:1 Фумарат рН 4,4 3,9 3,8 Розчинність (мг/мл) 13 15 1,5 Приклад 19 Стабільність солей сполуки формули (І) Стабільність солей досліджують в наступних умовах: Нагрів, 60°С/80% RH: Зразки зберігають при 60°С при 80% RH протягом 1 тижня. Потім їх розчиняють і аналізують за ВЕРХ. Нагрів, 90°С: Зразки (~10мг) зберігають при 90°С в закритих ємностях, що містять 1 краплю води. Потім зразки розчиняють і аналізують за ВЕРХ. Світло: Зразки поміщають в освітлену камеру при 250Вт/м на 24 години. Потім їх розчиняють і аналізують за ВЕРХ. Сума площ піків домішок % 60°C/80%RH 90°С Світло Малонат 1:1 альфа 0 6,19 0,06 Сукцинат 1:1 0 0 0 Фумарат 0,07 0,09 0,06 Зразок Приклад 20 Гігроскопічність солей сполуки формули (І) Гігроскопічність фумаратної солі, сукцинатної солі (альфа-форми) і малонатної солі досліджують методом динамічної сорбції пари (DVS). Було показано, що фумаратна і сукцинатна солі є негігроскопічними. Малонат поглинає поступово до 1% води, коли відносна вологість збільшується до 95%, але без гістерезису. 33 Комп’ютерна верстка О. Гапоненко 89617 Підписне 34 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSuccinate and malonate salt of trans 4-(1r,3s)-6-chloro-3-phenylindan-1-yl)-1,2,2-trimethylpiperazine and use thereof as a medicament
Автори англійськоюLopez De Diego Heidi, Nielsen Ole, Ringgard Lone Munch, Svane Henrik, Dahl Allan Carsten, Howells Mark, Bang-Andersen Benny, Lyngso Lars Ole, Collier Sherry Lynn
Назва патенту російськоюСукцинатная и малонатная соли транс-4-((1r,3s)-6-хлор-3-фенилиндан- 1-ил)-1,2,2-триметилпиперазина и их применение как лекарственного средства
Автори російськоюЛопес де Диего Хейди, Нильсен Оле, Рингор Лоне Мунк, Сван Хенрик, Дахл Аллан Карстен, Хауэлз Марк, Банг-Андерсен Бенни, Лингсьо Ларс Оле, Коллиэр Шерри Линн
МПК / Мітки
МПК: A61P 25/18, A61K 31/495, C12P 41/00, C07C 35/00, C07C 25/00, C07D 295/06, C12P 7/02
Мітки: транс-4-((1r,3s)-6-хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазину, сукцинатна, солі, засобу, малонатна, застосування, лікарського
Код посилання
<a href="https://ua.patents.su/17-89617-sukcinatna-i-malonatna-soli-trans-4-1r3s-6-khlor-3-fenilindan-1-il-122-trimetilpiperazinu-ta-kh-zastosuvannya-yak-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Сукцинатна і малонатна солі транс-4-((1r,3s)-6-хлор-3-феніліндан-1-іл)-1,2,2-триметилпіперазину та їх застосування як лікарського засобу</a>
Попередній патент: Гідролізат казеїну, спосіб його одержання та застосування
Наступний патент: 6-заміщені 2-хінолінони та 2-хіноксалінони як інгібітори полі(адф-рибоза)полімерази
Випадковий патент: Проміжна п-подібна опора буксирувальної канатної дороги