Поліненасичені сполуки, спосіб їхнього одержання та композиції, що їх містять
Номер патенту: 97104
Опубліковано: 10.01.2012
Автори: Сорг Олівьє, Брайєр Жан-Луіс, Тарру Роже, Борда Паскаль, Сора Жан-Ілєр, Фрізон Наташа
Формула / Реферат
1. Сполука формули (І):
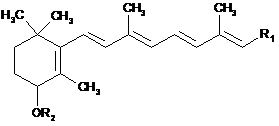 , (І)
, (І)
де
R1 є групою R'1 або -A-R'1, у якій R'1 вибраний з -СООН, -COOR3, -CONH2, -CONHR3, -CONR3R4, -СНО, -СН2ОН, -CH2OR5, і А є лінійною чи розгалуженою С1-С16-алкіленовою групою, лінійною чи розгалуженою С2-С16-алкеніленовою групою або лінійною чи розгалуженою С2-С16-алкініленовою групою;
R2 є:
• фенільною, нафтильную або біфенільною групою, можливо заміщеною одним або більше атомами галогену або розгалуженою або лінійною (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, або
• піридилом, піридазинілом, піразинілом, піримідинілом, тієнілом, фурилом, піролілом, імідазолілом, піразолінілом, індолілом, бензимідазолілом, оксазолілом, тіазолілом або ізотіазолілом, можливо заміщеними одним або більше атомами галогену або розгалуженою або лінійною (С1-С6)алкільною групою, розгалуженою або лінійною (С2-С6)алкенільною групою, лінійною або розгалуженою (С2-С6)алкінільною групою, розгалуженою або лінійною (С1-С16)алкоксигрупою, гідрокси, лінійною або розгалуженою (С3-С18)триалкілсилільною групою, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом, карбамоїлом або оксогрупою, або
• азидним залишком, або
• лінійним або розгалуженим залишком жирної кислоти, який містить 4-30 атомів вуглецю, можливо заміщеним, краще, наприкінці ланцюга одним або більше атомами галогену або лінійною або розгалуженою (С1-С16)алкоксигрупою, гідроксигрупою, можливо етерифікованою, або меркапто, алкілтіо, ціано, захищеною або незахищеною аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом і, зокрема, гідрокси, ацетокси або захищеним чи незахищеним амінорадикалом,
• групою -ОС-(СН2)n-СО-токоферил (альфа-, бета- або гамма-, або дельта-) з 2£n£10,
• групою -R'2-O-R6, де
R'2 є феніленовою, нафтиленовою або біфеніленовою групою, можливо заміщеною одним або більше атомами галогену або розгалуженою або лінійною (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, або
піридиленом, піридазиніленом, піразиніленом, піримідиніленом, тієніленом, фуриленом, піроліленом, імідазоліленом, піразолініленом, індоліленом, бензимідазоліленом, оксазоліленом, тіазоліленом або ізотіазоліленом, можливо заміщеними одним або більше атомами галогену або розгалуженою або лінійною (С1-С6)алкільною групою, розгалуженою або лінійною (С2-С6)алкенільною групою, лінійною або розгалуженою (С2-С6)алкінільною групою, розгалуженою або лінійною (С1-С16)алкоксигрупою, гідрокси, лінійною або розгалуженою (С3-С18)триалкілсилільною групою, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом, карбамоїлом або оксогрупою, та
R6 є атомом водню,
лінійними чи розгалуженими С1-С16-алкільними групами, можливо заміщеними одним або більше атомами галогену або лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом,
лінійною чи розгалуженою С2-С16-алкенільною групою, можливо заміщеною одним або більше атомами галогену, лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, або
лінійною чи розгалуженою С2-С16-алкінільною групою, можливо заміщеною одним або більше атомами галогену, лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, токоферильним радикалом, можливо заміщеним одним або більше атомами галогену, лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом або його аналогом, вибраним з альфа-, бета-, гамма- або дельта-токоферолу,
амінокислотним залишком, вибраним із залишків природних a-амінокислот, таких як Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Туr та Val, або залишків неприродних амінокислот, таких як b-аланін, алілгліцин, або
• азидним залишком;
R3 та R4 незалежно є
• лінійним чи розгалуженим С1-С16-алкільним радикалом, можливо заміщеним одним або більше атомами галогену, лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом,
• лінійним чи розгалуженим С2-С16-алкенілом, або
• лінійним чи розгалуженим С2-С16-алкінілом, можливо заміщеним одним або більше атомами галогену, лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом;
R5 є
• лінійним чи розгалуженим С1-С16-алкільним радикалом, можливо заміщеним одним або більше атомами галогену, лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом,
• лінійною чи розгалуженою С2-С16-алкенільною групою, можливо заміщеною одним або більше атомами галогену, лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом,
• розгалуженою або лінійною С2-С16-алкінільною групою, можливо заміщеною одним або більше атомами галогену, лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, або
• лінійною чи розгалуженою С2-С16-ацильною групою,
її енантіомери та діастереоізомери, а також будь-які солі, що є результатом приєднання кислоти або фізіологічно прийнятної основи.
2. Сполука формули (І) за п. 1, де R1 є групою, вибраною з -СООН, -COOR3, -СНО, -СН2ОН, -CH2OR5, де R3 та R5 є такими, як визначено в п. 1.
3. Сполука формули (І) за п. 1, де А є метиленовою групою.
4. Сполука формули (І) за будь-яким з пп. 1-3, де R2 є групою -R'2-O-R6, у якій R'2 є
феніленовою, нафтиленовою або біфеніленовою групою, можливо заміщеною одним або більше атомами галогену або розгалуженою або лінійною (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, та R6 є лінійною чи розгалуженою (С1-С6)-алкільною групою або азидним залишком.
5. Сполука формули (І) за п. 4, де R'2 є феніленовою групою, і R6 є цукровим залишком, вибраним із глюкози, галактози, фруктози, манози, фукози, рамнози.
6. Сполука формули (І) за п. 1, яка відрізняється тим, що вона вибрана з:
- (2Е,4Е,6Е,8Е)-3,7-диметил-9-{2,6,6-триметил-3-[4-((2S,3R,4S,5S,6R)-3,4,5-тригідрокси-6-гідроксиметилтетрагідропіран-2-ілокси)фенокси]циклогекс-1-еніл}нона-2,4,6,8-тетраєнової кислоти,
- трет-бутилового складного ефіру (2Е,4Е,6Е,8Е)-9-[3-(4-метоксифенокси)-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєнової кислоти,
- (2Е,4Е,6Е,8Е)-9-[3-(4-метоксифенокси)-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєналю,
- трет-бутилового складного ефіру (2Е,4Е,6Е,8Е)-9-[3-(4-гідроксифенокси)-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєнової кислоти,
- (2Е,4Е,6Е,8Е)-9-[3-(4-гідроксифенокси)-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєналю,
- (2Е,4Е,6Е,8Е)-3,7-диметил-9-{2,6,6-триметил-3-диметил-[4-((2S,3R,4S,5S,6R)-3,4,5-тpигiдpoкcи-6-гiдpoкcимeтилтeтpaгiдpoпipaн-2-iлoкcи)фeнoкcи]-циклогекс-1-еніл}нона-2,4,6,8-тетраєналю,
- 9-[(3-транс-деценоат)-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєналю,
- 9-[(3-лінолеат)-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєналю,
- 9-[(3-ліноленат)-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєналю,
- 3-((1E,3E,5E,7E)-3,7-диметил-9-оксонона-1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2-енілового складного ефіру (9Z,12Z,15Z)-октадеца-9,12,15-триєнової кислоти,
- 9-[(3-ліпоат)-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєналю,
- 9-[{3-(8-гідрокси-5-метил-2-октеноат)}-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєналю,
- 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2-енілового складного ефіру (Е)-14-гідрокситетрадец-2-енової кислоти,
- 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2-енілового складного ефіру (Е)-10-гідроксидец-2-енової кислоти,
- 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2-енілового складного ефіру (Е)-10-ацетоксидец-2-енової кислоти,
- 9-[(3-тетраацетилглюкоза)-2,6,6-триметилциклогекс-1-еніл]-3,7-диметилнона-2,4,6,8-тетраєналю,
- 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2-енілового та (R)-2,8-диметил-2-((4R,8R)-4,8,12-триметилтридецил)-1-бензопіран-6-ілового біс-ефіру гептандикислоти,
- 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2-енілового та (R)-2,8-диметил-2-((4R,8R)-4,8,12-триметилтридецил)-1-бензопіран-6-ілового бісефіру нонандикислоти,
- 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2-енілового та (R)-2,8-диметил-2-((4R,8R)-4,8,12-триметилтридецил)-1-бензопіран-6-ілового бісефіру бурштинової кислоти,
- 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2-енілового та (R)-2,8-диметил-2-((4R,8R)-4,8,12-триметилтридецил)-1-бензопіран-6-ілового бісефіру пентандикислоти.
7. Спосіб одержання сполуки формули (І), вказаної в будь-якому з пп. 1-6, який характеризується тим, що сполуку формули (II):
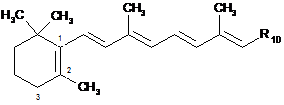 , (II)
, (II)
де R10 має таке ж значення, як і радикал R1 за п. 1, за винятком групи -СН2ОН, піддають реакції алільного окиснення в положенні 3 з одержанням сполуки формули (III):
 , (III)
, (III)
де R10 є таким, як визначено вище,
карбонільну групу якої в положенні 3 потім відновлюють до відповідного спирту формули (IV):
 , (IV)
, (IV)
сполуку (IV) піддають реакції алкілування або реакції сполучення в лужному, кислотному чи нейтральному середовищі, можливо в присутності реагенту сполучення, з використанням реагенту формули R2-X, де X є гідроксигрупою або атомом галогену, причому зрозуміло, що гідроксильна група при необхідності може бути активована у форму відхідної групи, з одержанням сполуки формули (Іа):
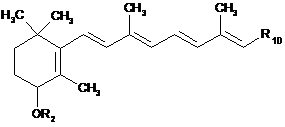 , (Ia)
, (Ia)
окремого випадку сполук формули (І), де R2 є таким, як визначено в п. 1, і R10 має таке ж значення, як визначено вище,
яка, якщо радикал R10 є групою -COOR3, як визначено в п. 1, може бути піддана гідролізу або реакції відновлення з одержанням сполуки формули (Іb):
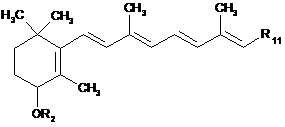 , (Ib)
, (Ib)
окремого випадку сполук формули (І), де R2 є таким, як визначено в п. 1, і R11 є групою -СООН або СН2ОН,
причому зрозуміло, що різні групи, присутні у попередніх сполуках, є придатними для синтезу захищених, а потім з видаленим захистом, груп у будь-який час, залежно від їхньої несумісності з використовуваними реагентами.
8. Косметична або дерматологічна композиція, яка відрізняється тим, що включає щонайменше одну сполуку формули (І) за будь-яким з пп. 1-6 у фізіологічно прийнятному середовищі.
9. Композиція за п. 8, яка відрізняється тим, що кількість сполуки формули (І) становить від 0,01 до 5 % мас. по відношенню до загальної маси композиції.
Текст
1. Сполука формули (І): C2 2 (19) 1 3 формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, або піридиленом, піридазиніленом, піразиніленом, піримідиніленом, тієніленом, фуриленом, піроліленом, імідазоліленом, піразолініленом, індоліленом, бензимідазоліленом, оксазоліленом, тіазоліленом або ізотіазоліленом, можливо заміщеними одним або більше атомами галогену або розгалуженою або лінійною (С1-С6)алкільною групою, розгалуженою або лінійною (С2-С6)алкенільною групою, лінійною або розгалуженою (С2С6)алкінільною групою, розгалуженою або лінійною (С1-С16)алкоксигрупою, гідрокси, лінійною або розгалуженою (С3-С18)триалкілсилільною групою, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом, карбамоїлом або оксогрупою, та R6 є атомом водню, лінійними чи розгалуженими С1-С16-алкільними групами, можливо заміщеними одним або більше атомами галогену або лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, лінійною чи розгалуженою С2-С16-алкенільною групою, можливо заміщеною одним або більше атомами галогену, лінійною або розгалуженою (С1С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, або лінійною чи розгалуженою С2-С16-алкінільною групою, можливо заміщеною одним або більше атомами галогену, лінійною або розгалуженою (С1С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, токоферильним радикалом, можливо заміщеним одним або більше атомами галогену, лінійною або розгалуженою (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом або його аналогом, вибраним з альфа-, бета-, гамма- або дельтатокоферолу, амінокислотним залишком, вибраним із залишків природних -амінокислот, таких як Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Туr та Val, або залишків неприродних амінокислот, таких як -аланін, алілгліцин, або азидним залишком; R3 та R4 незалежно є лінійним чи розгалуженим С1-С16-алкільним радикалом, можливо заміщеним одним або більше атомами галогену, лінійною або розгалуженою (С1С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, лінійним чи розгалуженим С2-С16-алкенілом, або лінійним чи розгалуженим С2-С16-алкінілом, можливо заміщеним одним або більше атомами галогену, лінійною або розгалуженою (С1 97104 4 С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом; R5 є лінійним чи розгалуженим С1-С16-алкільним радикалом, можливо заміщеним одним або більше атомами галогену, лінійною або розгалуженою (С1С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, лінійною чи розгалуженою С2-С16-алкенільною групою, можливо заміщеною одним або більше атомами галогену, лінійною або розгалуженою (С1С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, розгалуженою або лінійною С2-С16-алкінільною групою, можливо заміщеною одним або більше атомами галогену, лінійною або розгалуженою (С1С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, або лінійною чи розгалуженою С2-С16-ацильною групою, її енантіомери та діастереоізомери, а також будьякі солі, що є результатом приєднання кислоти або фізіологічно прийнятної основи. 2. Сполука формули (І) за п. 1, де R1 є групою, вибраною з -СООН, -COOR3, -СНО, -СН2ОН, CH2OR5, де R3 та R5 є такими, як визначено в п. 1. 3. Сполука формули (І) за п. 1, де А є метиленовою групою. 4. Сполука формули (І) за будь-яким з пп. 1-3, де R2 є групою -R'2-O-R6, у якій R'2 є феніленовою, нафтиленовою або біфеніленовою групою, можливо заміщеною одним або більше атомами галогену або розгалуженою або лінійною (С1-С16)алкоксигрупою, гідрокси, меркапто, алкілтіо, ціано, аміногрупою, нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом або карбамоїлом, та R6 є лінійною чи розгалуженою (С1-С6)алкільною групою або азидним залишком. 5. Сполука формули (І) за п. 4, де R'2 є феніленовою групою, і R6 є цукровим залишком, вибраним із глюкози, галактози, фруктози, манози, фукози, рамнози. 6. Сполука формули (І) за п. 1, яка відрізняється тим, що вона вибрана з: - (2Е,4Е,6Е,8Е)-3,7-диметил-9-{2,6,6-триметил-3[4-((2S,3R,4S,5S,6R)-3,4,5-тригідрокси-6гідроксиметилтетрагідропіран-2ілокси)фенокси]циклогекс-1-еніл}нона-2,4,6,8тетраєнової кислоти, - трет-бутилового складного ефіру (2Е,4Е,6Е,8Е)9-[3-(4-метоксифенокси)-2,6,6-триметилциклогекс1-еніл]-3,7-диметилнона-2,4,6,8-тетраєнової кислоти, (2Е,4Е,6Е,8Е)-9-[3-(4-метоксифенокси)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналю, 5 - трет-бутилового складного ефіру (2Е,4Е,6Е,8Е)9-[3-(4-гідроксифенокси)-2,6,6-триметилциклогекс1-еніл]-3,7-диметилнона-2,4,6,8-тетраєнової кислоти, (2Е,4Е,6Е,8Е)-9-[3-(4-гідроксифенокси)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналю, - (2Е,4Е,6Е,8Е)-3,7-диметил-9-{2,6,6-триметил-3диметил-[4-((2S,3R,4S,5S,6R)-3,4,5-тpигiдpoкcи-6гiдpoкcимeтилтeтpaгiдpoпipaн-2-iлoкcи)фeнoкcи]циклогекс-1-еніл}нона-2,4,6,8-тетраєналю, - 9-[(3-транс-деценоат)-2,6,6-триметилциклогекс-1еніл]-3,7-диметилнона-2,4,6,8-тетраєналю, - 9-[(3-лінолеат)-2,6,6-триметилциклогекс-1-еніл]3,7-диметилнона-2,4,6,8-тетраєналю, - 9-[(3-ліноленат)-2,6,6-триметилциклогекс-1-еніл]3,7-диметилнона-2,4,6,8-тетраєналю, - 3-((1E,3E,5E,7E)-3,7-диметил-9-оксонона-1,3,5,7тетраєніл)-2,4,4-триметилциклогекс-2-енілового складного ефіру (9Z,12Z,15Z)-октадеца-9,12,15триєнової кислоти, - 9-[(3-ліпоат)-2,6,6-триметилциклогекс-1-еніл]-3,7диметилнона-2,4,6,8-тетраєналю, 9-[{3-(8-гідрокси-5-метил-2-октеноат)}-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналю, - 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7тетраєніл)-2,4,4-триметилциклогекс-2-енілового складного ефіру (Е)-14-гідрокситетрадец-2-енової кислоти, - 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7тетраєніл)-2,4,4-триметилциклогекс-2-енілового складного ефіру (Е)-10-гідроксидец-2-енової кислоти, - 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7тетраєніл)-2,4,4-триметилциклогекс-2-енілового складного ефіру (Е)-10-ацетоксидец-2-енової кислоти, 9-[(3-тетраацетилглюкоза)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналю, - 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7тетраєніл)-2,4,4-триметилциклогекс-2-енілового та (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-ілового бісефіру гептандикислоти, - 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7тетраєніл)-2,4,4-триметилциклогекс-2-енілового та (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-ілового бісефіру нонандикислоти, - 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7тетраєніл)-2,4,4-триметилциклогекс-2-енілового та (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-ілового бісефіру бурштинової кислоти, - 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона-1,3,5,7тетраєніл)-2,4,4-триметилциклогекс-2-енілового та (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-ілового бісефіру пентандикислоти. 7. Спосіб одержання сполуки формули (І), вказаної в будь-якому з пп. 1-6, який характеризується тим, що сполуку формули (II): 97104 6 H3 C CH3 CH3 CH3 R 10 1 2 CH3 3 , (II) де R10 має таке ж значення, як і радикал R1 за п. 1, за винятком групи -СН2ОН, піддають реакції алільного окиснення в положенні 3 з одержанням сполуки формули (III): H3C CH3 CH3 CH3 R 10 1 2 CH3 3 O , (III) де R10 є таким, як визначено вище, карбонільну групу якої в положенні 3 потім відновлюють до відповідного спирту формули (IV): H3C CH3 CH3 CH3 R 10 CH3 OH , (IV) сполуку (IV) піддають реакції алкілування або реакції сполучення в лужному, кислотному чи нейтральному середовищі, можливо в присутності реагенту сполучення, з використанням реагенту формули R2-X, де X є гідроксигрупою або атомом галогену, причому зрозуміло, що гідроксильна група при необхідності може бути активована у форму відхідної групи, з одержанням сполуки формули (Іа): H3 C CH3 CH3 CH3 R 10 CH3 OR2 , (Ia) окремого випадку сполук формули (І), де R2 є таким, як визначено в п. 1, і R10 має таке ж значення, як визначено вище, яка, якщо радикал R10 є групою -COOR3, як визначено в п. 1, може бути піддана гідролізу або реакції відновлення з одержанням сполуки формули (Іb): H3 C CH3 CH3 CH3 R 11 CH3 OR2 , (Ib) окремого випадку сполук формули (І), де R2 є таким, як визначено в п. 1, і R11 є групою -СООН або СН2ОН, причому зрозуміло, що різні групи, присутні у попередніх сполуках, є придатними для синтезу захищених, а потім з видаленим захистом, груп у будь-який час, залежно від їхньої несумісності з використовуваними реагентами. 7 97104 8 8. Косметична або дерматологічна композиція, яка відрізняється тим, що включає щонайменше одну сполуку формули (І) за будь-яким з пп. 1-6 у фізіологічно прийнятному середовищі. 9. Композиція за п. 8, яка відрізняється тим, що кількість сполуки формули (І) становить від 0,01 до 5 % мас. по відношенню до загальної маси композиції. Винахід стосуєтьсянових поліненасичених похідних ретиноїдів, способів їхнього одержання, композицій, що їх містять, та їхнього застосування в області косметології та/або дерматології. Похідні ретиноєвої кислоти зараз використовують у дерматології при різних показаннях, таких як псоріаз або іхтіоз, і навіть депігментація шкіри (зменшення меланогенезу під дією вітаміну А). Однак застосування похідних ретиноєвої кислоти місцевим шляхом включає ряд труднощів, таких як недолік стабільності цих похідних у часі та під дією світла, подразнення, що є результатом місцевої надлишкової концентрації, а також низька абсорбція цих похідних через роговий шар. Останній недолік є результатом надзвичайно ліпофільної природи речовини, що при нанесенні на шкіру видаляється в основному в результаті десквамації (злущування епітеліальних клітин). Побічні ефекти, які включають почервоніння, подразнення, набряк і надмірну десквамацію, обмежують застосування похідних ретиноєвої кислоти для пацієнтів, які в значній мірі мотивовані, а тому існує інтерес у поліпшенні біодоступності активного інгредієнта та його абсорбції одночасно, щоб уникнути шкідливих ефектів місцевого перевищення концентрації. Заявник вже пропонував спосіб подолання побічних ефектів цих сполук шляхом застосування потрійних глікозильованих комплексів, які забезпечують можливість вивільнення активної речовини під дією двох ферментів (F2791679). Це приводить до повільного вивільнення, що запобігає проблемі накопичення. Однак існує потреба у сполуках, які мають менш проблематичні побічні ефекти або, альтернативно, у сполуках, більша активність яких дозволила б використовувати їх у більш низьких концентраціях для того, щоб небажані ефекти стали менш проблематичними. Заявник виявив, що нові похідні ретиноєвої кислоти виявляють значну депігментуючу дію. Цей винахід стосується сполук формули (І): R2 є: арильною групою, можливо заміщеною, або гетероарильною групою, можливо заміщеною, або озидним залишком, або залишком жирної кислоти, можливо розгалуженим та/або заміщеним, краще, наприкінці ланцюга і, зокрема, гідрокси, ацетокси або захищеним чи незахищеним аміно радикалом, групою -ОС-(СН2)n-СО-токоферил (альфа-, бета- або гамма- або дельта-) з 2≤n≤10, групою -R'2-O-R6, де R'2 є ариленовою групою, можливо заміщеною, або гетероариленовою групою, можливо заміщеною, і R6 є атомом водню, лінійними чи розгалуженими С1-С16-алкільними групами, можливо заміщеними, лінійною чи розгалуженою С2-С16-алкенільною групою, можливо заміщеною, або лінійною чи розгалуженою С2-С16алкінільною групою, можливо заміщеною, токоферильним радикалом, можливо заміщеним, або аналогом, амінокислотним залишком або озидним залишком; R3 та R4 незалежно є лінійним чи розгалуженим С1-С16-алкільним радикалом, можливо заміщеним, лінійним чи розгалуженим С2-С16алкенілом або лінійним чи розгалуженим С2-С16алкінілом, можливо заміщеним; R5 є лінійним чи розгалуженим С1-С16алкільним радикалом, можливо заміщеним. лінійною чи розгалуженою С2-С16-алкенільною групою, можливо заміщеною, розгалуженою чи лінійною С2-С16-алкінільною групою, можливо заміщеною, або лінійною чи розгалуженою С2-С16-ацильною групою, можливо заміщеною; їх енантіомери та діастереоізомери, а також будь-які солі, що є результатом приєднання кислоти або фізіологічно прийнятної основи. Фармацевтично прийнятні кислоти включають, без обмеження, такі кислоти: соляну, бромистоводневу, сірчану, фосфонову, оцтову, трифтороцтову, молочну, піровиноградну, малонову, бурштинову, глутарову, фумарову, малеїнову, матансульфонову, камфорну, щавлеву і т.д. Фармацевтично прийнятні основи включають, без обмеження, гідроксид натрію, гідроксид калію, триетиламін, трет-бутиламін і т.д. Подвійні зв'язки ненасиченої групи, як правило, усі мають Ε-конфігурацію, але даний винахід також стосується застосування сполук формули (І), у яких весь або тільки частина подвійного зв'язку має Z-конфігурацію. Термін "арил" стосується фенільної, нафтильної або біфенільної групи. Термін "гетероарил" стосується моно- або біциклічної групи, яка включає щонайменше одне 511-членне ароматичне кільце, що містить 1-5 гетероатомів, вибраних з азоту, кисню та сірки. Необ (I) де R1 є групою R'1 або -A-R'1, у якій R'1 вибраний з -СООН, -COOR3, -CONH2, -CONHR3, -CONR3R4, СНО, -СН2ОН, -CH2OR5, і А є лінійною чи розгалуженою С1-С16-алкіленовою групою, лінійною чи розгалуженою С2-С16-алкеніленовою групою або лінійною чи розгалуженою С2-С16-алкініленовоюю групою. 9 межуючі приклади гетероарилу включають такі групи: піридил, піридазиніл, піразиніл, піримідиніл, тієніл, фурил, піроліл, імідазоліл, піразолініл, індоліл, бензімідазоліл, оксазоліл, тіазоліл, ізотіазоліл. Закінчення "-eн" означає, що розглянута група є двовалентним радикалом з таким же визначенням, що і базовий радикал, стосовно обох найбільш загальних аспектів винаходу, а також конкретних, переважних та/або кращих аспектів. Термін "можливо заміщений" з посиланням на арильну, гетероарильну та токоферильну групу означає, що ці групи не заміщені або заміщені одним чи більше атомами галогену або розгалуженою чи лінійною (С1-С6)-алкільною групою, розгалуженою чи лінійною (С2-С6)-алкенільною групою, лінійною чи розгалуженою (С2-С6)-алкінільною групою, розгалуженою чи лінійною (С1-С16)алкоксигрупою, гідрокси лінійною чи розгалуженою (С3-С18)-триалкілсилільною групою, меркапто, алкілтіо, ціано, аміногрупою (можливо заміщеною однією чи двома лінійними чи розгалуженими (С1С6)-алкільними групами), нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом (можливо заміщеним однією чи двома лінійними чи розгалуженими (С1-С6)-алкільними групами) і карбамоїльною групою, причому зрозуміло, що гетероарильні групи можуть бути також заміщені оксогрупою. Термін "можливо заміщений" з посиланням на алкільні, алкенільні, алкінільнї групи означає, що ці групи не заміщені або заміщені одним чи більше атомами галогену або лінійною чи розгалуженою (С1-С16)-алкоксигрупою, гідрокси, меркапто. алкілтіо. ціано, аміногрупою (можливо заміщеною однією чи двома (С1-С6)-алкільними групами), нітро, карбокси, формілом, алкоксикарбонілом, амінокарбонілом (можливо заміщеним однією чи двома лінійними чи розгалуженими (С1-С6)-алкільними групами) і карбамоїльними групами. Термін "амінокислотний залишок" означає залишки природних α-амінокислот, таких як Ala, Arg, Asn, Asp, Cys, Gin, Glu, Gly, His, lle, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr і Val, або залишки неприродних амінокислот, таких як β-аланін, алілгліцин і т.д. Термін "озидний залишок" означає радикал, що відповідає похідному цукру (або вуглеводу), такому як глюкоза, галактоза, фруктоза, маноза, фукоза, рамноза, причому зрозуміло, що в цих залишках одна чи більше гідроксигруп можуть бути захищені групою, звичайно використовуваною для цієї мети, такою як бензильна, ацетильна або бензоїльна група. Термін "залишок жирної кислоти" означає радикал, що відповідає лінійній чи розгалуженій жирній кислоті з 4-30 атомами вуглецю. Цей радикал може походити з незамінної жирної кислоти або замінних жирних кислот. Прикладами кислотних залишків є такі: масляна, валеріанова, капронова, каприлова, капринова, лауринова, міристинова, пальмітинова, стеаринова, арахінова, бегенова, олеїнова, лінолева, ліноленова, арахідонова, азелаїнова, ліпоєва кислоти. Ці радикали можуть бути не заміщені або заміщені одним чи більше атомами галогену або 97104 10 лінійною чи розгалуженою (С1-С16)-алкоксигрупою, гідроксигрупою, можливо етерифікованою (краще, ацетильованою), або меркапто, алкілтіо, ціано, захищеною чи незахищеною аміногрупою (можливо заміщеною однією чи двома лінійними чи розгалуженими С1-С6-алкільними групами), нітро, карбокси, формілом. алкоксикарбонілом, амінокарбонілом (можливо заміщеним однією чи двома лінійними чи розгалуженими С1-С6 групами) або карбамоїльною групою. Токоферильний радикал може бути отриманий із всіх типів токоферолів: альфа-, бета-, гаммаабо дельта-. Внаслідок хіральної природи цих залишків, аномерна вуглецева конфігурація може бути α-, βабо сумішшю α-β- у різних пропорціях. У рамках даного винаходу кращою арильною групою є фенільна група. Алкільні радикали в сполуках формули (І) відповідно до винаходу є, краще, лінійними чи розгалуженими (С1-С6)-алкільними радикалами. Зокрема, вони можуть бути метальними, етильними, пропільними, ізопропільними, бутильними, вторбутильними, трет-бутильними, пентильними, ізопентильними, гексильними радикалами. Алкенільні радикали в сполуках формули (І) відповідно до винаходу є, краще, лінійними чи розгалуженими (С2-С6)-алкенільними радикалами, наприклад, алільними або вінільними групами. Алкінільні радикали в сполуках формули (І) відповідно до винаходу є, краще, лінійними чи розгалуженими (С2-С6)-алкінільними радикалами, наприклад, алкиновими, пропіновими, бутиновими радикалами. У сполуках формули (І) група R1, краще, є групою R'1, вибраною з -СООН, -СОСR3, -СНО, СН2ОН, -CH2OR5, де R3 та R5 є такими, як визначено вище. Відповідно до іншої кращої ознаки винаходу, А є метиленовою групою у сполуці загальної формули (І). Сполуки, які добре підходять для втілення даного винаходу, є сполуками формули (І), де R2 є групою -R'2-O-R6, у якій R'2 є ариленовою групою, можливо заміщеною, і R6 є лінійною чи розгалуженою (Сі-С6)-алкільною групою або озидним залишком. Інші сполуки формули (І), які добре підходять для втілення даного винаходу, є сполуками, де R2 є групою -RVO-R6, у якій R'2 є феніленом і R6 є озидним залишком, краще, глюкозою, галактозою, фруктозою, манозою, фукозою, рамнозою. Серед сполук формули (І) особливо кращими будуть такі сполуки: - (2Е,4Е,6Е,8Е)-3,7-диметил-9-{2,6,6-триметил3-[4-((2S,3R,4S,5S,6R)-3,4,5-тригідрокси-6гідроксиметилтетрагідропіран-2ілокси)фенокси]циклогекс-1-еніл}нона-2,4,6,8тетраєнова кислота, 11 - трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)9-[3-(4-метоксифенокси)-2,6,6-триметилциклогекс1-еніл]-3,7-диметилнона-2,4,6,8-тетраєнової кислоти, - (2Е,4Е,6Е,8Е)-9-[3-(4-метоксифенокси)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь, 97104 12 9-[(3-транс-деценоат)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь, - 9-[(3-олеат)-2,6,6-триметилциклогекс-1-еніл]3,7-диметилнона-2,4,6,8-тетраєналь, - трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)9-[3-(4-гідроксифенокси)-2,6,6-триметилциклогекс1-еніл]-3,7-диметилнона-2,4,6,8-тетраєнової кислоти, 9-[(3-лінолеат)-2,6,6-триметилциклогекс-1еніл]-3,7-диметилнона-2,4,6,8-тетраєналь, - (2Е,4Е,6Е,8Е)-9-[3-(4-гідроксифенокси)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь, - 9-[(3-ліноленат)-2,6,6-триметилциклогекс-1еніл]-3,7-диметилнона-2,4,6,8-тетраєналь, - (2Е,4Е,6Е,8Е)-3,7-диметил-9-{2,6,6-триметил3-диметил-[4-((2S,3R,4S,5S,6R)-3,4,5-тригідрокси6-гідроксиметилтетрагідропіран-2-ілокси)фенокси]циклогекс-1-еніл}нона-2,4,6,8-тетраєналь, - 9-[(3-ліпоат)-2,6,6-триметилциклогекс-1-еніл]3,7-диметилнона-2,4,6,8-тетраєналь, 13 - 9-[{3-(8-гідрокси-5-метил-2-октеноат)}-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь, 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий складний ефір (Е)-14-гідрокситетрадец-2енової кислоти, 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий складний ефір (Е)-10-гідроксидец-2енової кислоти, 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий і (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-іловий біс-ефір нонандикислоти, 97104 14 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий складний ефір (Е)-10-ацетоксидец-2енової кислоти, 9-[(3-тетраацетилглюкоза)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь, 3-((1E,3Е,5Е,7Е)-3,7-диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий і (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-іловий біс-ефір гептандикислоти, 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий і (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-іловий біс-ефір бурштинової кислоти, 15 97104 3-((1Е,3Е,5Е,7Е)-3,7-диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий і (R)-2,8-диметил-2-((4R,8R)-4,8,12 Даний винахід також стосується способу одержання сполук формули (1), у якому сполуку формули (II): 16 триметилтридецил)-1-бензопіран-6-іловий біс-ефір пентандикислоти, (Ib) (II) де R10 має таке ж значення, як і радикал R1, визначений вище, за винятком групи -СН2ОН, піддають реакції алільного окиснення в положенні 3 з одержанням сполуки формули (III): (III) де R10 є таким, як визначено вище, карбонільну групу якої в положенні 3 потім відновлюють до відповідного спирту формули (IV): (IV) сполуку (IV) піддають реакції алкілування або реакції сполучення в лужному. кислотному або нейтральному середовищі, можливо в присутності реагенту сполучення, з використанням реагенту формули R2-X, де X є гідроксигрупою або атомом галогену, причому зрозуміло, що гідроксигрупа при необхідності може бути активована у формі стартової групи, з одержанням сполуки формули (Іа): (Ia) окремого випадку сполук формули (І), де R2 є таким, як визначено вище, і R10 має таке ж значення, як визначено вище, яка, якщо радикал R10 є групою -COOR3, може бути піддана гідролізу або реакції відновлення з одержанням сполуки формули (Іb): окремого випадку сполук формули (І), де R2 є таким, як визначено вище, і R11 є групою -СООН або СН2ОН, причому зрозуміло, що різні групи, присутні у попередніх сполуках, є придатними для синтезу захищених, а потім з видаленим захистом, груп у будь-який час. залежно від їхньої несумісності з використовуваними реагентами. Захисні групи, які можуть бути використані в рамках даного винаходу, вибрані зі звичайно використовуваних груп, таких як групи, описані в "Protective Group in Organic Synthesis, Wiley-Interscience, 3rd Edition, 1999". Реакцію окиснення в положенні 3 сполуки формули (II) здійснюють із використанням традиційних окисників для алільних положень, які включають оксид селену, гіпохлорит натрію, оксид рутенію, оксид хрому та оксид марганцю. Краще, використовують оксид марганцю. Реакцію можна здійснювати в різних розчинниках, таких як дихлорметан, дихлор-1,2-етан, тетрагідрофуран, пентан або гексан. Температура реакційного середовища може бути низкою, кімнатною або температурою кипіння, залежно від вибраного розчинника. Відновлення карбонільної групи сполуки формули (III), краще, здійснюють із використанням гідридів, таких як гідриди алюмінію або бору, і більш конкретно, блокований та дезактивований гідрид алюмінію, при низькій температурі. Краще. вибирають гідрид діізобутилалюмінію (DIBAL-H) при температурах, що варіюють від -20 °С до -70 °С, в ефірвмісному розчиннику, такому як тетрагідрофуран або діоксан, а також у толуолі. Реакція алкілування сполуки формули (IV) з одержанням сполук формули (Іа) або (Іb) буде, наприклад, реакцією Міцунобу, де алкілувальний агент є фенолом, активованим комбінацією фосфіну та діаксокарбоксилату, більш конкретно, трифенілфосфіну та діізопропілдіізокарбоксилату (DIAD). Гідроліз або можливе відновлення групи R10, присутньої у сполуках формули (Іа), можуть бути здійснені з використанням традиційних реагентів, 17 97104 таких як фторид тетрабутиламонію для гідролізу та DIBAL-H для відновлення. Винахід також стосується сполук формули (lllа): (IIIa) де група R3а є розгалуженою С3-С16-алкільною групою. Ця сполука згадана вище та використовується як проміжна сполука синтезу для одержання деяких сполук формули (І). Винахід також стосується сполук формули (IVа): (IVa) де група R3а є розгалуженою С3-С16-алкільною групою. Ця сполука згадана вище та використовується в рамках даного винаходу як проміжна сполука синтезу для одержання ряду сполук формули (І). У кращому аспекті, у сполуках формули (lllа) і (IVa) група R3а є трет-бутильною групою. Серед цих сполук (lllа, IVa), зокрема, можуть бути згадані такі: - трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)3,7-диметил-9-(2,6,6-триметил-3-оксоциклогекс-1еніл)нона-2,4,6,8-тетраєнової кислоти, - трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)9-(3-гідрокси-2,6,6-триметилциклогекс-1-еніл)-3,7диметилнона-2,4,6,8-тетраєнової кислоти. Сполуки формули (І), як визначено вище, показали гарну здатність інгібувати продукцію меланіну меланоцитами. тим самим продемонструвавши свої переваги в області косметології та/або дерматології. Таким чином, даний винахід стосується композиції, яка включає щонайменше одну сполуку формули (І), як вона визначена вище, у фізіологічно прийнятному середовищі. Композиція за винаходом, зокрема, призначена для місцевого застосування. Крім того, вона містить фізіологічно прийнятне середовище, інакше кажучи, середовище, сумісне зі шкірою, включаючи шкіру голови, слизові оболонки, волосся голови, волосся тіла та/або очі, і може бути косметичною та дерматологічною композицією. Похідні за винаходом, окремо або в комбінації, а також композиція, що їх містить, можуть бути використані місцево для нанесення на шкіру, волосся тіла та/або волосся голови. 18 Кількість похідних, які можуть бути використані в рамках винаходу, очевидно залежить від бажаного ефекту. Як приклад, ця кількість може варіювати від 0,01% до 5% мас, краще, від 0,05% до 0,5% мас. по відношенню до загальної маси композиції. Сполуки формули (І) мають перевагу в тому, що мають надзвичайно низьку токсичність і показали гарні властивості інгібування продукції меланіну меланоцитами. Більш того, вони мають менше побічних ефектів (сухість шкіри та запалення), ніж стандартні продукти, використовувані зараз, наприклад, ретиноєва кислота або інші синтетичні кислоти такого ж типу. Вони мають також кращу стабільність. Інший аспект винаходу стосується косметичного способу вибілювання та/або освітління шкіри та/або волосся тіла та/або волосся голови, який включає нанесення на шкіру та/або волосся тіла та/або волосся голови косметичної композиції, що містить щонайменше одну сполуку формули (І), як вона визначена вище. Винахід також стосується косметичного способу видалення коричневих пігментних плям та/або вікових плям з людської шкіри, який включає нанесення на шкіру косметичної композиції, що містить щонайменше одну сполуку формули (І), як вона визначена вище. В одному варіанті винахід стосується застосування щонайменше однієї сполуки формули (І) як лікарського засобу. Більш конкретно, винахід стосується застосування щонайменше однієї сполуки формули (І), як вона визначена вище, для виготовлення дерматологічної композиції, призначеної для застосування в депігментації шкіри та/або волосся тіла та/або волосся голови. Винахід також стосується фармацевтичних композицій, що містять щонайменше одну сполуку формули (І), як вона визначена вище, окремо або в комбінації з одним чи більше фармацевтично прийнятними ексципієнтами. Серед фармацевтичних композицій за винаходом автори винаходу можуть згадати, зокрема, композиції, придатні для перорального, парентерального, інтраназального. підшкірного або черезшкірного, ректального, під'язикового, очного введення або введення в дихальні шляхи, і, наприклад, таблетки або пігулки з покриттям, сублінгвальні таблетки, саше, капсули, гелеві капсули, супозиторії та флакони для ін'єкцій або напоїв. Такі приклади ілюструють винахід без обмеження його обсягу. Сполуки, залежно від прикладу, наведені або з їхніми хімічними назвами, або з їхніми CTFA-назвами (відповідно до Міжнародного словника-довідника косметичних інгредієнтів). Одержання А Стадія 1: Перацетильований арбутин: 15 г (55,1 ммоль) арбутину розчиняли в 7 об'ємах піридину, потім додавали 55 мл (0,5 моль) ангідриду оцтової кислоти. Реакційне середовище 19 перемішували протягом 18 год. Після концентрування до половини об'єму середовище повільно вливали в 100 об'ємів дистильованої води при енергійному перемішуванні. Отриману білу тверду речовину фільтрували, промивали у воді та сушили під вакуумом при 30 °С з одержанням 25,9 г (53,7 ммоль) білої твердої речовини. Rf = 0,4 (толуол/етилацетат, 1/1) Стадія 2: Тетраацетильований арбутин: 25,9 г (53,7 ммоль) перацетильованого арбутину розчиняли в 10 об'ємах метанолу та 10 об'ємах тетрагідрофурану в потоці азоту та без прямого освітлення. Додавали карбонат калію на кінчику шпателя, і середовище перемішували протягом 1 год. 30 хв. Тонкошарову хроматографію використовували для зупинки реакції перед тим, як проводити повне деацетилювання. Після гідролізу в 2 об'ємах 1М НСI середовище екстрагували дихлорметаном. Органічні фази промивали насиченим розчином NaCl, сушили над MgSO4, фільтрували та концентрували під вакуумом з одержанням 18 г (40,9 ммоль) білої твердої речовини. Rf = 0,6 (толуол/етилацетат, 1/1) Приклад 1 2-триметилсиланілетиловий складний ефір (2Е,4Е,6Е,8Е)-3,7-диметил-9-{2,6,6-триметил-3-[4((2S,3R,4S,5R,6R)-3,4,5-триацетокси-6ацетоксиметил-тетрагідропіран-2ілокси)фенокси]циклогекс-1-еніл}нона-2,4,6,8тетраєнової кислоти Стадія 1: 2-Триметилсиланілетиловий складний ефір (2Е,4Е,6Е,8Е)-3,7-диметил-9-(2,6,6триметилциклогекс-1-еніл)нона-2,4,6,8тетраєнової кислоти. 40 г (0,13 моль) ретиноєвої кислоти розчиняли в 65 об'ємах етилацетату в потоці азоту та без прямого освітлення. Додавали 27,5 г (0,13 моль) дициклогексилкарбодііміду, 19,3 мл (0,136 моль) триметилсилілетанолу та 6,3 г (0,05 моль) диметиламінопіридину при 0 °С. Реакційне середовище перемішували при кімнатній температурі протягом 18 год Після фільтрації на целіті фільтрат концентрували під вакуумом. 30 г сирового продукту очищали на колонці із силікагелем та елюювали толуолом з одержанням 22 г (0,055 моль) жовтої твердої речовини. Rf = 0,8 (гептан/етилацетат, 8/2) • Стадія 2: 2-Триметилсиланілетиловий складний ефір (2Е,4Е,6Е,8Е)-3,7-диметил-9-(2,6,6-триметил-3оксоциклогекс-1-еніл)нона-2,4,6,8-тетраєнової кислоти. 97104 20 22 г (55,0 ммоль) сполуки, описаної на стадії 1, розчиняли в 40 об'ємах дихлорметану в потоці азоту та без прямого освітлення. Додавали 329 г (3,78 моль) оксиду марганцю, і суміш перемішували протягом 24 год. Середовище фільтрували на целіті та концентрували під вакуумом. 25 г сирового продукту очищали на колонці із силікагелем та елюювали гептан/етилацетатним градієнтом з одержанням 14,3 г (34,5 ммоль) орандевої твердої речовини. Rf = 0,5 (гептан/етилацетат, 7/3) • Стадія 3: 2-Триметилсиланілетиловий складний ефір (2Е,4Е,6Е,8Е)-9-(3-гідрокси-2,6,6триметилциклогекс-1-еніл)-3,7-диметилнона2,4,6,8-тетраєнової кислоти. 14,3 г (34,5 ммоль) сполуки, описаної на стадії 2, розчиняли в 10 об'ємах тетрагідрофурану в потоці азоту та без прямого освітлення. Середовище охолоджували до -78 °С і по краплях додавали 29 мл (35,2 ммоль) 20%-ного розчину Dibal-H у толуолі, при температурі, підтримуваній при -78 °С. Середовище перемішували протягом 5 год. Повільно додавали 20 об'ємів насиченого розчину солей Розена при -78 °С. Середовище екстрагували етилацетатом. Органічні фази промивали насиченим розчином NaCl, сушили над MgSO4 і концентрували під вакуумом. 16 г сирового продукту очищали на колонці із силікагелем та елюювали гептан/етилацетатним градієнтом з одержанням 10 г (24,0 ммоль) жовтої твердої речовини. Rf = 0,4 (гептан/етилацетат, 7/3) • Стадія 4: 2-Триметилсиланілетиловий складний ефір (2Е,4Е,6Е,8Е)-3,7-диметил-9-{2,6,6-триметил-3-[4((2S,3R,4S,5R,6R)-3,4,5-триацетокси-6ацетоксиметил-тетрагідропіран-2ілокси)фенокси]циклогекс-1-еніл}нона-2,4,6,8тетраенової кислоти 11,8 г (26,8 ммоль) тетраацетильованого арбутину (див. одержання А) розчиняли в 10 об'ємах тетрагідрофурану та 3 об'ємах толуолу в потоці азоту. Додавали по краплях свіжоприготовлений розчин 5,2 мл (29,5 ммоль) діізопропілазодикарбо 21 ксилагу з 10,4 г (40,2 ммоль) трифенілфосфіну в 10 об'ємах толуолу при -5 °С. Середовище перемішували при 0 °С протягом 10 хвилин, потім повільно додавали 5 г (12,0 ммоль) сполуки, описаної на стадії 3, в 10 об'ємах толуолу. Суміш перемішували протягом 20 год. Середовище концентрували під вакуумом, і залишок очищали на колонці із силікагелем та елюювали гептан/етилацетатним градієнтом з одержанням 3,0 г (3,6 ммоль) жовтої твердої речовини. Rf = 0,3 (гептан/етилацетат, 7/3) + Мас-спектрометрія: [MNa ] 861 (обчислено [МН+] 839). Приклад 2 2-Триметилсиланілетиловий складний ефір (2Е,4Е,6Е,8Е)-3,7-диметил-9-{2,6,6-триметил-3-[4((2S,3R,4S,5S,6R)-3,4,5-тригідрокси-6гідроксиметил-тетрагідропіран-2ілокси)фенокси]циклогекс-1-еніл}нона-2,4,6,8тетраєнової кислоти 0,5 г (0,6 ммоль) сполуки із прикладу 1 розчиняли, без прямого освітлення, в 4 об'ємах тетрагідрофурану. Потім додавали 3 об'єми метанолу, а також карбонат калію на кінчику шпателя. Суміш перемішували протягом 6 год. Після гідролізу в дистильованій воді середовище концентрували та екстрагували дихлорметаном. Органічні фази промивали насиченим розчином NaCl, сушили над MgSO4 і концентрували під вакуумом з одержанням 30 г (0,04 ммоль) блідо-жовтої твердої речовини. Rf = 0,1 (гептан/етилацетат, 7/3) + Mac-спектрометрія: [MNa ] 693 (обчислено [МН+] 671) Приклад 3 (2Е,4Е,6Е,8Е)-3,7-Диметил-9-{2,6,6-триметил3-[4-((2S,3R,4S,5S,6R)-3,4,5-тригідрокси-6гідроксиметилтетрагідропіран-2ілокси)фенокси]циклогекс-1-еніл}нона-2,4,6,8тетраєнова кислота. 0,5 г (0,6 ммоль) сполуки із прикладу 1 поміщали в суспензію в 10 об'ємах етанолу без прямого освітлення. У реакційне середовище додавали 0,3 мл (0,6 ммоль) 2М розчину соди. Суміш пере 97104 22 мішували протягом 7 год. Знову додавали 1,8 мл 2М соди. Після кислотного гідролізу (6 н. НСI) до рН=5,8 середовище фільтрували, і твердий залишок сушили під вакуумом з одержанням 0,07 г (0,12 ммоль) блідо-жовтої твердої речовини. Rf = 0,1 дихлорметан/метанол 9/1) + Mac-спектрометрія: [MNa ] 593 (обчислено [МН+] 571) Приклад 4 Трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)9-[3-(4-метоксифенокси)-2,6,6-триметилциклогекс1-еніл]-3,7-диметилнона-2,4,6,8-тетраєнової кислоти. • Стадія 1: Трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)3,7-диметил-9-(2,6,6-триметилциклогекс-1еніл)нона-2,4,6,8-тетраєнової кислоти. 9,1 г (30,3 ммоль) ретиноєвої кислоти розчиняли в 10 об'ємах дихлорметану. 14 г (69,6 ммоль) 2-трет-бутил-1,3-діізопропілізосечовини додавали при кімнатній температурі в потоці азоту та без прямого освітлення. Середовище перемішували протягом 18 год. Контроль за допомогою тонкошарової хроматографії показав закінчення реакції (УФ-детекція). Потім фільтрували солі сечовини. Фільтрат концентрували без прямого освітлення та очищали на колонці із силікагелем сумішшю гептан/етилацетат (9/1) як елюентом без прямого освітлення з одержанням 10,4 г (29,2 ммоль) густого масла. Rf = 0,4 (гептан/етилацетат, 8/2) • Стадія 2: Трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)3,7-диметил-9-(2,6,6-триметил-3-оксоциклогекс-1еніл)нона-2,4,6,8-тетраєнової кислоти. 10.4 г (29,2 ммоль) сполуки зі стадії 1 розчиняли в 40 об'ємах дихлорметану в потоці азоту та без прямого освітлення. Додавали 114 г (131 ммоль) оксиду марганцю, і суміш перемішували протягом 72 год. Середовище фільтрували на целіті, концентрували під вакуумом і очищали на колонці із силікагелем з використанням суміші гептан/етилацетат, 9/1. Після кристалізації одержували 10 г (27,0 ммоль) оранжевої твердої речовини. Rf = 0,5 (гептан/етилацетат, 7/3) • Стадія 3: Трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)9-(3-гідрокси-2,6,6-триметилциклогекс-1-еніл)-3,7диметилнона-2,4,6,8-тетраєнової кислоти. 10 г (27,0 ммоль) сполуки зі стадії 2 розчиняли в 10 об'ємах тетрагідрофурану в потоці азоту та без прямого освітлення. Середовище охолоджу 23 вали до -78 °С і по краплях додавали 23 мл (27,5 ммоль) 20%-ного розчину Dibal-H, підтримуючи температуру при -78 °С. Середовище перемішували протягом 3 год. Додавали 20 об'ємів насиченого розчину солей Розена при -60 °С. Середовище екстрагували дихлорметаном. Органічні фази промивали насиченим розчином NaCl, сушили над MgSО4 і концентрували під вакуумом. 50 г сирового продукту очищали на колонці із силікагелем та елюювали гептан/етилацетатним градієнтом з одержанням 6,8 г (18,3 ммоль) жовтого густого масла. Rf = 0,3 (гептан/етилацетат, 7/3) • Стадія 4: Трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)9-[3-(4-метоксифенокси)-2,6,6-триметилциклогекс1-еніл]-3,7-диметилнона-2,4,6,8-тетраєнової кислоти. 0,67 г (5,2 ммоль) 4-метоксифенолу розчиняли в 20 об'ємах толуолу в потопі азоту. Додавали по краплях свіжоприготовлений розчин 0,58 мл (28,6 ммоль) діізопропілазодикарбоксилату з 1,1 г (38,9 ммоль) трифенілфосфіну в 40 об'ємах толуолу при -5 °С. Середовище перемішували при 0 °С протягом 10 хвилин. Повільно додавали 0,97 г (26,0 ммоль) сполуки зі стадії 3 в 20 об'ємах толуолу без прямого освітлення. Суміш перемішували протягом 20 год. Середовище концентрували під вакуумом, і залишок очищали на колонці із силікагелем та елюювали системою гептан/етилацетат, 98/2, з одержанням 0,5 г жовтого масла. Rf = 0,7 (гептан/етилацетат, 8/2) + Mac-спектрометрія: [MNa ] 501 (обчислено [МН+] 479) Приклад 5 (2Е,4Е,6Е,8Е)-9-[3-(4-Метоксифенокси)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь 0,5 г (1,04 ммоль) сполуки із прикладу 4 розчиняли в 10 об'ємах толуолу в потоці азоту та без прямого освітлення. Середовище охолоджували до -78 °С і додавали по краплях 0,89 мл (1,07 ммоль) 20%-ного розчину Dibal-H у толуолі, підтримуючи температуру -78 °С. Середовище перемішували протягом 10 хвилин. Додавали 10 об'ємів насиченого розчину солей Розена при -78 °С. Середовище екстрагували толуолоім. Органічні фази промивали насиченим розчином NaCl, сушили над MgSO4 і концентрували під вакуумом. 0,8 г сирового продукту очищали на колонці із силікагелем та елюювали гептан/етилацетатним градієн 97104 24 том. Одержані жовті кристали промивали в пентані з одержанням 150 мг (0,37 ммоль) жовтої твердої речовини. Rf = 0,2 (гептан/етилацетат, 8/2) + Mac-спектрометрія: [MNa ] 429 (обчислено [МН+] 407) Приклад 6 Трет-бутиловий складний ефір (2Е,4Е,6Е,8Е)9-[3-(4-гідроксифенокси)-2,6,6-триметилциклогекс1-еніл]-3,7-диметилнона-2,4,6,8-тетраєнової кислоти. 1,1г (10,06 ммоль) гідрохінону розчиняли в 40 об'ємах тетрагідрофурану в потоці азоту. Додавали по краплях свіжоприготовлений розчин 0,87 мл (4,42 ммоль) діізопропілазодикарбоксилату з 1,6 г (6,04 ммоль) трифенілфосфіну в 30 об'ємах юлуолу та 30 об'ємах тетрагідрофурану при -5 °С. Середовище перемішували при 0 °С протягом 10 хвилин, потім повільно додавали 1,5 г (4,03 ммоль) сполуки із прикладу 4 в 20 об'ємах толуолу без прямого освітлення. Потім суміш перемішували протягом 20 год. Середовище концентрували під вакуумом, і залишок очищали на колонці із силікагелем та елюювали в системі гептан/етилацетат (8/2) з одержанням 0,6 г жовтої твердої речовини. Rf = 0,6 (гептан/етилацетат, 7/3) + Mac-спектрометрія: [MNa ] 487 (обчислено [МН+] 465) Приклад 7 (2Е,4Е,6Е,8Е)-9-[3-(4-Гідроксифенокси)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь 6,9 г (31,0 ммоль) гідрохінону, монозахищеного трет-бутилдиметилсилільною групою, розчиняли в 10 об'ємах толуолу в потоці азоту. Додавали по краплях свіжоприготовлений розчин 7,9 мл (40,3 ммоль) діізопропілазодикарбоксилату з 12,2 г (46,5 ммоль) трифенілфосфіну в 10 об'ємах толуолу при -5 °С. Середовище перемішували при 0 °С протягом 10 хвилин, потім повільно додавали 6 г (2,68 ммоль) трет-бутилового складного ефіру (2Е,4Е,6Е,8Е)-9-(3-гідрокси-2,6,6триметилциклогекс-1-еніл)-3,7-диметилнона2,4,6,8-тетраєнової кислоти, одержаної на стадії 3 прикладу 4, в 10 об'ємах толуолу без прямого освітлення. Суміш перемішували протягом 20 год. Суміш концентрували під вакуумом, і залишок очищали на колонці із силікагелем та елюювали градієнтом гептан/ізопропіловий ефір. Одержува 25 ли 5,16 г (8,91 ммоль) жовтої твердої речовини (55%). Видалення захисних груп і одержання сполуки з альдегідною функціональною групою: 1,32 г (2,28 ммоль) попередньої сполуки поміщали в розчин в 10 об'ємах толуолу в потоці азоту та без прямого освітлення. Середовище охолоджували до -80 °С і повільно додавали 2,46 мл 20%-ного розчину Dibal-H у толуолі. Середовище перемішували протягом 20 хвилин, потім додавали 20 об'ємів насиченого розчину солей Розена при -78 °С. Після енергійного перемішування середовище екстрагували толуолом. Органічні фази промивали насиченим розчином NaCl, сушили над MgSO4 і концентрували під вакуумом. Сирову суміш очищали на колонці із силікагелем, обробляли та елюювали градієнтом гептан/ізопропіловий ефір. Одержували 0,58 г (1,18 ммоль) жовтої твердої речовини (вихід 51%). 1,87 г (3,69 ммоль) попереднього похідного поміщали в розчин в 10 об'ємах тетрагідрофурану без прямого освітлення. По краплях додавали 5,2 мл (5,17 ммоль) ЇМ розчину фториду тетрабутиламонію при 0 °С. Середовище перемішували протягом 20 хвилин, потім вливали в насичений розчин NH4C1. Після екстракції ізопропіловим ефіром органічні фази промивали насиченим розчином NaCl, сушили над Na2SO4 і концентрували під вакуумом. Сирову суміш очищали на колонці із силікагелем, обробляли гептаном та елюювали гептан/етилацетатним градієнтом. Одержували 1 г (2,55 ммоль) оранжево-червоної твердої речовини (вихід 69%). Приклад 8 9-[(3-транс-Деценоат)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь Стадія 1: 9-(2,6,6-Триметилциклогекс-1-еніл)-3,7диметилнона-2,4,6,8-тетраєналь 2 г (5,37 ммоль) трет-бутилового складного ефіру гідроксиретиноєвої кислоти, одержаного відповідно до стадії 3 прикладу 4, поміщали в розчин в 10 об'ємів толуолу в потоці азоту та без прямого освітлення. Середовище охолоджували до -78 °С, потім по краплях додавали 4,57 мл (5,48 ммоль) 20%-ного розчину Dibal-H у толуолі. Після 3 год перемішування при -78 °С додавали 20 об'ємів насиченого розчину солей Розена. Середовище екстрагували толуолом, органічні фази промивали насиченим розчином NaCl. сушили над MgSO4, фільтрували та концентрували під вакуумом. Одержаний сировий продукт очищали на колонці із силікагелем та елюювали гептан/етилацетатним градієнтом, 9/1. Одержували 180 мг жовтої твердої речовини (20%). Rf = 0,2 (гептан/етилацетат, 7/3) + Mac-спектрометрія: [M+Na ] = 323 (обчислено [МН+] 300) • Стадія 2: 97104 26 9-[(3-транс-Деценоат)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь 0,3 г (1 ммоль) сполуки зі стадії 1 поміщали в розчин в 30 об'ємах дихлорметану при 0 °С. Додавали 0,14 г (1,15 екв.) диметиламінопіридину, а також 1,1 екв. транс-2-деканової кислоти. Додавали 0,24 г дициклогексилкарбодііміду, і реакційну суміш перемішували протягом 24 год. при кімнатній температурі. Середовище фільтрували на целіті для видалення солей сечовини, і фільтрат концентрували. В результаті очищення на колонці із силікагелем одержували очікуваний продукт. Rf = 0,7 (гептан/етилацетат, 7/3) + Mac-спектрометрія: [MNa ] 475 (обчислено [МН+] 452) Приклад 9 9-[(3-Лінолеат)-2,6,6-триметилциклогекс-1еніл]-3,7-диметилнона-2,4,6,8-тетраєналь 0,3 г (1 ммоль) сполуки із прикладу 7, стадія 1, поміщали в розчин в 30 об'ємах дихлоретану. Додавали 0,09 мл (1 екв.) піридину. Потім повільно додавали 1,1 екв. олеїлхлоридного похідного в реакційне середовище. Середовище перемішували протягом 7 год. при кімнатній температурі. Середовище гідролізували та екстрагували дихлоретаном. Органічні фази промивали насиченим розчином NaCl, потім 0,1 Μ розчином НСI і, зрештою, насиченим розчином NaCl. Після сушіння над Na2SC4 і фільтрації органічні фази концентрували під вакуумом. Сировий продукт очищали на колонці із силікагелем з одержанням очікуваного продукту. Rf = 0,7 (гептан/етилацетат, 7/3) + Мас-спектрометрія: [MNa ] 587 (обчислено + [МН ] 564) Приклад 10 9-[(3-Лінолеат)-2,6,6-триметилциклогекс-1еніл]-3,7-диметилнона-2,4,6,8-тетраєналь 27 Очікуваний продукт одержували з використанням способу, ідентичного способу, описаному в прикладі 8, але заміняючи олеїлхлорид лінолеїлхлоридом. Приклад 11 9-[(3-Ліпоат)-2,6,6-триметилциклогекс-1-еніл]3,7-диметилнона-2,4,6,8-тетраєналь Очікуваний продукт одержували з використанням способу, ідентичного способу, описаному в прикладі 8, але заміняючи олеїлхлорид ліпоїлхлоридом. Приклад 12 9-[{3-(8-Гідрокси-5-метил-2-октеноат)}-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь Очікуваний продукт одержували з використанням способу, ідентичного способу, описаному в прикладі 8, але заміняючи олеїлхлорид 8-гідрокси5-метил-2-октеновою кислотою. Приклад 13 9-[(3-Тетраацетилглюкоза)-2,6,6триметилциклогекс-1-еніл]-3,7-диметилнона2,4,6,8-тетраєналь 8 мл (2,5 екв.) 1,0Μ розчину ZnCb в ефірі розчиняли в 2 об'ємах толуолу та 2 об'ємах ацетонітрилу в присутності 0,7 г молекулярного сита 4А. Після перемішування протягом 10 хв, реакційне середовище поміщали на 90 °С баню та додавали 0,21 г (0,70 ммоль, 1 екв.) сполуки із прикладу 7. стадія 1. Після перемішування протягом 10 хв. додавали 0,32 г (0,77 ммоль, 1,1 екв.) де-2,3,4,6тетра-О-ацетил-альфа-D-глюкопіранозилброміду та 0,25 мл (1,75 ммоль, 2,5 екв.) триетиламіну. 97104 28 Реакційне середовище нагрівали протягом ночі при 80 °С. Середовище фільтрували при кімнатній температурі, і фільтрат перемішували в насиченому розчині NaHCO3. Після екстракції та промивання насиченим розчином NaCl органічні фази концентрували під вакуумом. Сировий продукт очищали на колонці із силікагелем з одержанням очікуваної сполуки. Rf = 0,7 (гептан/етилацетат, 7/3) + + Mac-спектрометрія: [M+Na ] = 653 ([М+Н] обчислено 630) Приклад 14 3-((1Е,3Е,5Е,7Е)-3,7-Диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий складний ефір (9Z,12Z,15Z)-октадеца9,12,15-триєнової кислоти У сухій тригорлій колбі в потоці азоту, без прямого освітлення, розчиняли 0,25 г (0,83 ммоль) гідроксиретиналю в 35 об'ємах дихлорметану. У середовище додавали 0,28 г (1,2 екв.) ліноленової кислоти, а також 0,13 г (1 екв.) диметиламінопіридину. Повільно вливали дициклогексилкарбодіімід (0,20 г, 1 екв.) в 5 об'ємах дихлорметану. Реакційне середовище перемішували протягом ночі при кімнатній температурі. Контроль за допомогою ТШХ дозволив регулювати закінчення реакції. Середовище потім фільтрували та концентрували під вакуумом. Залишок очищали на колонці із силікагелем без прямого освітлення, потім елюювали гептан/етилацетатним градієнтом з одержанням жовтої твердої речовини (0,40 г, тобто, вихід приблизно 85%). ТШХ (гептан/етилацетат, 7/3): Rf = 0,8 + Mac-спектрометрія: [M+Na] = 583 (обчислено 560) Приклад 15 3-((1Е,3Е,5Е,7Е)-3,7-Диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий складний ефір (9Z,12Z)-октадеца-9,12дієнової кислоти Такі ж реакційні умови, як у прикладі 13, використовують для гідроксиретиналю та ліноленової кислоти для здійснення етерифікації в масштабі 250 мг з виходом 34%. Приклад 16 3-((1Е,3Е,5Е,7Е)-3,7-Диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий складний ефір (Е)-14-гідрокситетрадец-2енової кислоти 29 Такі ж реакційні умови для захистуетерифікації-видалення захисних груп використовують для гідроксиретиналю та (Е)-14-тетрадец-2енової кислоти (синтезованої заздалегідь) з 500 мг градієнтом із загальним виходом 15%. ТШХ (гептан/етилацетат, 7/3): Rf = 0,2 + Mac-спектрометрія: [M+Na] = 547 (обчислено 524) Приклад 17 3-((1Е,3Е,5Е,7Е)-3,7-Диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий складний ефір (Е)-10-ацетоксидец-2енової кислоти У сухій тригорлій колбі в потоці азоту розчиняли 1 г (5,3 ммоль) (Е)-10-гідроксидец-2-енової кислоти в 10 об'ємах піридину. Вливали 546 мкл (1,1 екв.) ангідрид} оцтової кислоти. Реакційне середовище перемішували при кімнатній температурі протягом ночі. Контроль за допомогою ТШХ дозволив регулювати закінчення реакції. Середовище потім фільтрували та концентрували під вакуумом. Залишок поміщали в розсіл та етилацетатний розчин. Суміш екстрагували етилацетатом, і органічні фази промивали 1М соляною кислотою, потім насиченим розчином NaCl, потім сушили над MgSO4, фільтрували та концентрували під вакуумом з одержанням коричневого масла. Сировий продукт очищали на колонці із силікагелем та елюювали гептан/етилацетатним градієнтом. Одержували 850 мг жовтого масла (вихід 70%). У сухій тригорлій колбі в потоці азоту розчиняли 0,25 г (0,83 ммоль, 1,2 екв.) жовтих кристалів гідроксиретинолу в 40 об'ємах дихлорметану. Захищену гідроксикислоту в ацетатній формі (0,25 г, 1 екв.) розчиняли в 40 об'ємах дихлорметану та вливали в реакційне середовище. Додавали 0,15 г (1 екв.) диметиламінопіридину, потім в реакційне 97104 30 середовище повільно вливали дициклогексилкарбодіімід (0,38 г, 1,2 екв.), розчинений в 20 об'ємах дихлорметану. Суміш перемішували без прямого освітлення протягом ночі. Контроль за допомогою ТШХ дозволив регулювати закінчення реакції. Реакційне середовище потім фільтрували, і фільтрат концентрували. Одержаний залишок очищали на колонці із силікагелем, потім елюювали гептан/етилацетатним градієнтом без прямого освітлення. Одержували 0,28 г жовтого масла (вихід 65%). ТШХ (гептан/етилацетат, 7/3): Rf = 0,4 Приклад 18 3-((1Е,3Е,5Е,7Е)-3,7-Диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий складний ефір (Е)-10-гідроксидец-2енової кислоти Здійснювали таку ж процедуру, як у прикладі 17, потім 0,2 г попереднього масла розчиняли в 40 об'ємах метанолу в колбі. Додавали 467 мкл свіжоприготовленого розчину KНСО3 і K2СО3 (відповідно 70 мг і 50 мг в 1 мл метанолу). Середовище перемішували при кімнатній температурі без прямого освітлення протягом 4 год. 30 хв. Контроль за допомогою ТШХ дозволив регулювати закінчення видалення захисних груп. Середовище гідролізували шляхом додавання води. Потім його екстрагували дихлорметаном. Органічні фази збирали, промивали насиченим розчином NaCl, сушили над MgSO4, фільтрували та концентрували. Залишок очищали на колонці із силікагелем та елюювали гептан/етилацетатним градієнтом без прямого освітлення. Одержували 0.11 г жовтої твердої речовини з виходом 60%. ТШХ (гептан/етилацетат, 7/3): Rf = 0,2 + Mac-спектрометрія: [M+Na] = 491 (обчислено 468) Приклад 19 3-((1Е,3Е,5Е,7Е)-3,7-Диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий і (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-іловий біс-ефір гептандикислоти 31 97104 32 У сухій тригорлій колбі в потоці азоту розчиняли 0,8 г (0,95 екв.) пімелінової кислоти в 20 об'ємах дихлорметану. Додавали 1,1 г (1 екв.) дициклогексилкарбодііміду та 0,63 г (1 екв.) диметиламінопіридину. Після 5 хвилин перемішування при кімнатній температурі повільно вливали 2,1 г (5,2 ммоль) (+)-дельта-токоферолу в 10 об'ємах дихлорметану. Реакційне середовище перемішували протягом 6 год. Контроль за допомогою ТШХ дозволив регулювати закінчення видалення захисних груп. Середовище потім фільтрували та концентрували. Залишок очищали на колонці із силікагелем та елюювали гептан/етилацетатним градієнтом. Одержували 0,35 г масла (вихід 12%). У сухій тригорлій колбі в потоці азоту, без прямого освітлення, розчиняли 0,17 г (0,57 ммоль) гідроксиретинальдегіду в 30 об'ємах дихлорметану при 0 °С. Додавали 0.08 г (1,2 екв.) диметиламінопіридину, а також 0,35 г (1,15 екв.) проміжного похідного токоферол-С7, одержаного раніше. У се редовище вливали 0,17 і (1,4 екв.) дициклогексилкарбодііміду в 20 об'ємах дихлорметану при 0 °С. і суміш перемішували протягом 24 год. при кімнатній температурі. Контроль за допомогою ТШХ дозволив регулювати закінчення видалення захисних груп. Середовище фільтрували на целіті для видалення солей сечовини, і фільтрат концентрували. Сировий продукт очищали на колонці із силікагелем без прямого освітлення з одержанням оранжево-жовтого масла (0,28 г, тобто, вихід 60%). ТШХ (гептан/етилацетат, 7/3): Rf = 0,5 + Mac-спектрометрія: [M+Na] = 849 (обчислено 827) Приклад 20 3-((1Е,3Е,5Е,7Е)-3,7-Диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий і (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-іловий біс-ефір нонандикислоти Такі ж реакційні умови, як і в попередньому прикладі, використовували для (+)-дельтатокоферолу та азелаїнової кислоти. Це похідне потім піддавали реакції сполучення з гідроксиретиналем шляхом етерифікації в масштабі 250 мг із загальним виходом 11%. ТШХ (гептан/етилацетат, 7/3): Rf = 0,6 + Mac-спектрометрія: [M+Na] = 877 (обчислено 854) Приклад 21 3-(1Е,3Е,5Е,7Е)-3,7-Диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий і (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-іловий біс-ефір бурштинової кислоти тиналем шляхом етерифікації в масштабі 200 мг із загальним виходом 3%. ТШХ (гептан/етилацетат, 7/3): Rf = 0,5 Приклад 22 3-((1Е,3Е,5Е,7Е)-3,7-Диметил-9-оксонона1,3,5,7-тетраєніл)-2,4,4-триметилциклогекс-2еніловий і (R)-2,8-диметил-2-((4R,8R)-4,8,12триметилтридецил)-1-бензопіран-6-іловий біс-ефір пентандикислоти Такі ж реакційні умови, як і в попередньому прикладі, використовували для (+)-дельтатокоферолу та бурштинової кислоти. Це похідне потім піддавали реакції сполучення з гідроксиреВибілювальна композиція Композиція (емульсія масло у воді) Сполуки із прикладу 3 Вазелін Гліцерин 99,5% Гльщерилстеарат GS Такі ж реакційні умови, як і в попередньому прикладі, використовували для (+)-дельтатокоферолу та глутарової кислоти. Це похідне потім піддавали реакції сполучення з гідроксиретиналем шляхом етерифікації в масштабі 250 мг із загальним виходом 21%. ТШХ (гептан/етилацетат, 7/3): Rf = 0,6 Приклад 23 Кількість (г) 0,1 8 15 5 33 97104 Стеаринова кислота Рідкий парафін 352 Циклопентазилоксан Макрогол 600 Етаноламін (три) Парабен Очищена вода 34 3 4 3 5 0,5 0,4 Скільки потрібно до 100 Вибілювальний лосьон Композиція Сполуки із прикладу 3 Бетаїнкокамідопропіл В4F Макрогол 600 Фенілетиловий спирт Етаноламін (три) Очищена вода Комп’ютерна верстка Т. Чепелева Кількість (г) 0,1 2 4 0,5 0,04 Скільки потрібно до 100 Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPolyunsaturated compounds, method for preparing same and compositions containing same
Автори англійськоюBordat Pascal, Tarroux Roger, Saurat Jean-Hilaire, Sorg Olivier, Brayer Jean-Louis, Frison Natacha
Назва патенту російськоюПолиненасыщеные соединения, способ их получения и композиции, которые их содержат
Автори російськоюБорда Паскаль, Тарру Мальва, Сора Жан-Илер, Сорг Оливье, Брайер Жан-Луис, Фризон Наташа
МПК / Мітки
МПК: C07C 403/20, C07D 339/00, C07H 15/203, A61Q 19/02, C07H 15/207, C07C 403/14, A61K 8/67, C07D 311/72
Мітки: спосіб, одержання, поліненасичені, містять, сполуки, їхнього, композиції
Код посилання
<a href="https://ua.patents.su/17-97104-polinenasicheni-spoluki-sposib-khnogo-oderzhannya-ta-kompozici-shho-kh-mistyat.html" target="_blank" rel="follow" title="База патентів України">Поліненасичені сполуки, спосіб їхнього одержання та композиції, що їх містять</a>
Попередній патент: Спосіб визначення осі жорсткості крила літального апарата та пристрій для його здійснення
Наступний патент: Спосіб і пристрій подачі хімікатів у потік обробки
Випадковий патент: Пристрій для захисту двигуна внутрішнього згорання від аварій і токсичних режимів роботи












