8-бета-заміщені естратриєни як селективно активні естрогени
Номер патенту: 99918
Опубліковано: 25.10.2012
Автори: Фрітцемайєр Карл-Хайнріх, Петерс Олаф, Бройєр Ніко, Прелле Катя, Мун Ханс-Петер, Тіме Іна
Формула / Реферат
1. Похідні 8β-заміщеного естра-1,3,5(10)-триєну загальної формули І
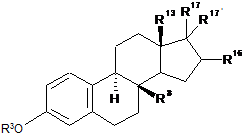 , (І)
, (І)
в якій радикали R3, R8, R13, R16, а також R17 і R17', незалежно один від одного, мають наступні значення:
R3 означає атом водню або групу R18, в якій
R18 означає насичений або ненасичений С1-С6-алкільний радикал з розгалуженим або нерозгалуженим ланцюгом, трифторметильну групу, арильний, гетероарильний або аралкільний радикал, необов'язково заміщений принаймні одним радикалом, незалежно вибраним з метилу, етилу, трифторметилу, пентафторетилу, трифторметилтіо, метокси, етокси, нітро, ціано, гало-, гідрокси, аміно, моно(С1-С8-алкіл)- або ді(С1-С8-алкіл)аміно, де обидві алкільні групи є ідентичними або різними, ді(аралкіл)аміно, де обидві аралкільні групи є ідентичними або різними, карбоксилу, карбоксіалкокси, С1-С20-ацилу або С1-С20-ацилокси, як замісників;
ацильний радикал C(=O)R19, в якому R19 являє собою С1-С10-алкільний радикал з розгалуженим або нерозгалуженим ланцюгом, що є насиченим або ненасиченим в аж до трьох положеннях і є частково або повністю галогенованим, або
R18 означає групу R20SO2, в якій
R20 являє собою групу R21R22N, де R21 і R22, незалежно один від одного, означають атом водню, С1-C5-алкільний радикал, групу -C(=O)R23, в якій R23 означає незаміщений або заміщений С1-С10-алкільний радикал з розгалуженим або нерозгалуженим ланцюгом, який є насиченим або ненасиченим в аж до трьох положеннях і є частково або повністю галогенованим, циклопропільну, циклобутильну, циклопентильну, циклогексильну або циклогептильну групу, С4-С15-циклоалкілалкільний радикал, що містить від 3 до 7 атомів вуглецю в циклоалкільній частині, і з алкільною частиною, що містить аж до 8 атомів вуглецю, або арильний, гетероарильний або аралкільний радикал, необов'язково заміщений принаймні одним радикалом, незалежно вибраним з метилу, етилу, трифторметилу, пентафторетилу, трифторметилтіо, метокси, етокси, нітро, ціано, гало-, гідрокси, аміно, моно(С1-С8-алкіл)- або ді(С1-C8-алкіл)аміно, де обидві алкільні групи є ідентичними або різними, ді(аралкіл)аміно, де обидві аралкільні групи є ідентичними або різними, карбоксилу, карбоксіалкокси, С1-С20-ацилу або С1-С20-ацилокси, як замісників; або
разом з N-атомом, поліетиленімінорадикал з 4-6 атомами вуглецю або морфолінорадикал,
R8 являє собою алкенільний або алкінільний радикал з розгалуженим або нерозгалуженим ланцюгом, що містить 2-6 атомів вуглецю, що може бути частково або повністю фторованим,
R13 являє собою метильну групу або етильну групу,
R16 являє собою атом фтору в a-положенні;
R17 і R17' у кожному випадку незалежно один від одного являють собою атом водню та гідроксигрупу; або
атом водню та групу R18O-, R20SO2- або OC(O)R23, де R18, R20 і R23 у кожному випадку мають значення, які вказані для R3,
де термін "арильний" означає фенільний, 1- або 2-нафтильний радикал, та де "аралкільний" радикал означає радикал, що містить в кільці аж до 14 атомів вуглецю і в алкільному ланцюзі 1-8 атомів вуглецю.
2. Сполука загальної формули І за пунктом 1, в якій R3 являє собою атом водню.
3. Сполука загальної формули І за пунктом 1 або 2, в якій R8 являє собою вінільну, етинільну або проп-1-інільну групу.
4. Сполука загальної формули І за будь-яким з пунктів 1-3, в якій R17 і R17' являють собою атом водню та атом гідроксигрупи.
5. Сполука загальної формули І за будь-яким з пунктів 1-4, в якій R8 являє собою вінільну, етинільну або проп-1-інільну групу, R16 являє собою атом фтору, R17 і R17' являють собою атом водню та атом гідроксигрупи.
6. Сполука загальної формули І за будь-яким з пунктів 1-5, в якій R17 і R17' являють собою атом водню та групу R18-О- або R19SO2-O-, де R18 і R19 у кожному випадку мають значення, які вказані для R3.
7. Естратриєни загальної формули І за пунктом 1 або 2, зокрема
8b-вініл-16a-фторестра-1,3,5(10)-триєн-3,17a-діол,
8b-вініл-16a-фторестра-1,3,5(10)-триєн-3,17b-діол.
8. Фармацевтична композиція, яка містить принаймні одну сполуку за будь-яким з пунктів 1-7, а також фармацевтично сумісний носій.
9. Сполука загальної формули І, як визначено в будь-якому з пунктів 1-7, для використання як лікарського засобу.
10. Застосування сполуки загальної формули І, як визначено в будь-якому з пунктів 1-7, для одержання фармацевтичного агента.
11. Сполука за пунктом 9 для лікування захворювань і станів, індукованих недостатністю естрогену, у жінок і у чоловіків.
12. Сполука за пунктом 9 для лікування пери- і постменопаузальних симптомів.
13. Сполука за пунктом 9 для in vitro лікування безплідності у жінок.
14. Сполука за пунктом 9 для in vivo лікування безплідності у жінок.
15. Сполука за пунктом 9 для терапії симптомів, індукованих недостатністю гормонів, при дисфункції яєчників, що викликана хірургічним втручанням, прийомом лікарських засобів і т. п.
16. Сполука за пунктом 9 для гормонозамісної терапії (ГЗТ).
17. Сполука за пунктом 11 у комбінації із селективними модуляторами естрогенного рецептора (SERM), наприклад ралоксифеном.
18. Сполука за пунктом 9 для профілактики та терапії ревматоїдного артриту, розсіяного склерозу та вовчака.
19. Сполука за пунктом 9 для профілактики та терапії запальних захворювань кишечнику та, зокрема, хвороби Крона.
20. Сполука за пунктом 9 для профілактики та терапії запальних захворювань шкіри та, зокрема, псоріазу.
21. Сполука за пунктом 9 для профілактики та терапії серцево-судинних захворювань.
22. Сполука за пунктом 9 для профілактики та терапії артеріосклерозу, високого кров'яного тиску та гіпертензивної кардіопатії.
23. Сполука за пунктом 9 для запобігання та лікування гіперплазії передміхурової залози.
24. Сполука за пунктом 9 у комбінації з антиестрогенами та/або селективними модуляторами естрогенних рецепторів (SERM) для профілактики та терапії гіперплазії передміхурової залози.
25. Сполука за пунктом 9 для лікування захворювань імунної системи.
26. Сполука за пунктом 9 для лікування ендометріозу.
27. Сполука за пунктом 9 для лікування раку товстої та тонкої кишки.
28. Застосування сполук за пунктом 10 для нетерапевтичної стимуляції росту волосся.
Текст
УКРАЇНА (19) UA (11) 99918 (13) C2 (51) МПК (2012.01) C07J 1/00 A61K 31/565 (2006.01) A61P 5/30 (2006.01) ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (21) Номер заявки: a 2010 01369 (22) Дата подання заявки: 11.07.2008 (24) Дата, з якої є чинними 25.10.2012 права на винахід: (31) Номер попередньої 07075600.2 (32) Дата подання 12.07.2007 заявки відповідно до Паризької конвенції: попередньої заявки відповідно до Паризької конвенції: (33) Код держави-учасниці EP Паризької конвенції, до якої подано попередню заявку: (41) Публікація відомостей 10.03.2010, Бюл.№ 5 про заявку: (46) Публікація відомостей 25.10.2012, Бюл.№ 20 про видачу патенту: (86) Номер та дата подання міжнародної заявки, поданої відповідно до Договору PCT PCT/EP2008/059115, 11.07.2008 (72) Винахідник(и): Петерс Олаф (DE), Бройєр Ніко (DE), Тіме Іна (DE), Прелле Катя (DE), Мун Ханс-Петер (DE), Фрітцемайєр Карл-Хайнріх (DE) (73) Власник(и): БАЙЄР ФАРМА АКЦІЄНГЕЗЕЛЛЬШАФТ, Mullerstrasse 178, D-13353 Berlin, Germany (DE) (74) Представник: Петров Андрій Володимирович, реєстр. №139 (56) Перелік документів, взятих до уваги експертизою: WO0177139 A 18.10.2001 YOO JEONGSOO ET AL: "Synthesis of an estrogen receptor beta-selective radioligand: 5-[F-18]Fluoro-(2R*,3S*)-2,3-bis(4-hydroxy phenyl)pentanenitrile and comparison of in vivo distribution with 16 alpha-[F-18]Fluoro-17 beta-estradiol" JOURNAL OF MEDICINAL CHEMISTRY, vol. 48, no. 20, October 2005 (2005-10), pages 6366-6378, XP002458224 ISSN: 0022-2623 VANBROCKLIN HENRY F ET AL: "Fluorine18 16-beta-( intg luoro)estrogens: Systematic investigation of a new series of fluorine-18labeled estrogens as potential imaging agents for estrogen-receptor-positive breast tumors" JOURNAL OF MEDICINAL CHEMISTRY, vol. 36, no. 11, 1993, pages 1619-1629, XP002458225 ISSN: 0022-2623 (54) 8-БЕТА-ЗАМІЩЕНІ ЕСТРАТРИЄНИ ЯК СЕЛЕКТИВНО АКТИВНІ ЕСТРОГЕНИ (57) Реферат: Винахід стосується похідних 8-заміщеного естра-1,3,5(10)-триєну загальної формули І UA 99918 C2 (12) UA 99918 C2 R 13 R 17 R 17 ' R H R3 O R 16 8 , (І) їх застосування як фармацевтично активних інгредієнтів, які мають in vitro більш високу афінність стосовно препаратів естрогенного рецептора з передміхурової залози щурів, ніж препаратів естрогенного рецептора з матки щурів, а також кращу дію in vivo у яєчнику в порівнянні з маткою, їх одержання, їх терапевтичного застосування та фармацевтичних дозованих форм, які містять такі нові сполуки. UA 99918 C2 Галузь техніки, до якої належить винахід Даний винахід стосується нових похідних 8β-заміщеного естра-1,3,5(10)-триєну загальної формули 5 3 10 15 20 25 30 35 40 45 50 8 13 16 17 17' в якій радикали R , R , R , R , а також R і R , незалежно один від одного, мають наступні значення: 3 18 R означає атом водню або групу R , в якій 18 R означає радикал C1-C6-алкілу з розгалуженим або нерозгалуженим ланцюгом, насичений або ненасичений, групу трифторметилу, радикал арилу, гетероарилу або аралкілу, необов'язково заміщений принаймні одним радикалом, незалежно вибраним з метилу, етилу, трифторметилу, пентафторетилу, трифторметилтіо, метокси, етокси, нітро, ціано, гало-, гідрокси, аміно, моно(C1-C8-алкіл) або ди(C1-C8-алкіл)аміно, де обидві алкільні групи є ідентичними або різними, ди(аралкіл)аміно, де обидві aралкільні групи є ідентичними або різними, карбоксилу, карбоксіалкокси, C 1-C20–ацилу або C1-C20–ацилокси, як замісників; 19 19 ацильний радикал –C(=O)R , в якому R являє собою розгалужений або нерозгалужений ланцюг C1-C10 –алкільного радикалу, що є насиченим або ненасиченим аж до трьох положень і є частково або повністю галогенованим, або 18 20 R означає групу R SO2, в якій 20 21 22 21 22 R являє собою R R N групу, де R і R , незалежно один від одного, означають атом 23 23 водню, C1-C5 –алкільний радикал, групу -C(=O)R , в якій R означає незаміщений або заміщений C1-C10 –алкільний радикал з розгалуженим або нерозгалуженим ланцюгом, де такий є насиченим або ненасиченим аж до трьох положень і є частково або повністю галогенованим, групу циклопропілу, циклобутилу, циклопентилу, циклогексилу або циклогептилу, C 4-C15циклоалкілалкільний радикал, що містить від 3 дo 7 атомів вуглецю в циклоалкільній частині, і з алкільною частиною, що містить аж до 8 атомів вуглецю або арильний, гетероарильний або aралкільний радикал, необов'язково заміщений принаймні одним радикалом, незалежно вибраним з метилу, етилу, трифторметилу, пентафторетилу, трифторметилтіо, метокси, етокси, нітро, ціано, гало-, гідрокси, аміно, моно(C1-C8-алкіл) або ди(C1-C8-алкіл) аміно, де обидві алкільні групи є ідентичними або різними, ди(аралкіл)аміно, де обидві аралкільні групи є ідентичними або різними, карбоксилу, карбоксіалкокси, C1-C20–ацилу або C1-C20–ацилокси, як замісників; або разом з атомом N радикал поліетиленіміно з 4 - 6 атомами вуглецю або радикал морфоліно, 8 R являє собою радикал алкенілу або алкінілу з розгалуженим або нерозгалуженим ланцюгом, що містить 2 - 6 атомів вуглецю, що може бути частково або повністю фторованою, 13 R являє собою групу метилу або групу етилу, 16 R являє собою атом фтору, 17 17' R і R , у кожному випадку, незалежно один від одного являють собою атом водню та групу гідрокси; або 18 20 23 18 20 23 атом водню та групу R O-, R SO2- або OC(O)R , де R , R і R у кожному випадку мають 3 значення, які вказані для R . Даний винахід додатково стосується застосування нового 8β-заміщеного естра-1,3,5(10)триєну як фармацевтично активних інгредієнтів, які in vitro володіють більш високою афінністю стосовно препаратів естрогенного рецептора з передміхурової залози щурів, ніж до препаратів естрогенного рецептора з матки щурів, а також кращою дією in vivo у яєчнику в порівнянні з маткою, їх одержання, їх терапевтичного застосування та до фармацевтичних дозованих форм, які містять такі нові сполуки. Похідні 8β-заміщеного естра-1,3,5(10)-триєну відповідно до даного винаходу являють собою 1 UA 99918 C2 5 10 15 20 25 30 35 40 45 50 55 60 новий стероїдний естратриєн, селективний стосовно підтипу рецептора естрогену, що володіє поліпшеною ефективністю та метаболічною стабільністю. Передумови створення винаходу Ефективність естрогенів у лікуванні симптомів, індукованих недостатністю гормонів, таких, як припливи жару, атрофія органів-мішеней естрогену та нетримання сечі, а також успішне застосування терапій на основі естрогену для запобігання втрати кісткової маси в жінок у пери- і постменопаузальний період, є переконливо підтвердженим документальними доказами та загальновизнаним (Grady і ін. 1992, Ann Intern Med 117: 1016-1037). Також підтвердженим є той факт, що естрогензамісна терапія в жінок у періоді постменопаузи або у жінок з дисфункцією яєчника, викликаною іншими причинами, знижує ризик серцево-судинних захворювань у порівнянні з жінками, яких не піддавали лікуванню з використанням естрогену (Grady та ін., цит. вище). При традиційній естроген- або гормонозамісній терапії (= ГЗТ) природні естрогени, такі, як естрадіол, і кон„юговані естрогени, які складаються з кінської сечі, застосовуються або самі по собі або в комбінації з гестагеном. Замість природних естрогенів також можуть використовуватися похідні, які одержують шляхом естерифікації, такі, як, наприклад, 17βестрадіол-валерат. Через стимулюючий вплив використовуваних естрогенів на ендометрій, що приводить до підвищення ризику ендометріальної карциноми (Harlap, S. 1992, Am J Obstet Gynecol 166: 19861992), у гормонозамісній терапії переважно застосовуються препарати комбінацій естроген/гестаген. Гестагенний компонент у комбінації естроген/гестаген дозволяє уникнути гіпертрофії ендометрію, проте виникнення небажаних менструальних кровотеч у середині циклу також є пов'язаним з комбінацією, що містить гестаген. Селективні естрогени представляють більш сучасну альтернативу комбінаційним препаратам естроген/гестаген. Дотепер селективні естрогени визначалися як такі сполуки, що володіють естрогеноподібним впливом на мозок, кістки та судинну систему завдяки своєму антиутеротропному (тобто антиестрогенному) частковому впливу, але не справляють проліферативного ефекту на ендометрій. Клас речовин, які частково відповідають бажаному профілю селективного естрогену являє собою так звані "Селективні модулятори естрогенного рецептора" (SERM) (R. F. Kauffman, H. U. Bryant 1995, DNAP 8 (9): 531-539). У цьому випадку вони є частковими агоністами рецептора естрогену підтипу "ERα." Однак цей тип речовини є неефективним відносно терапії гострих постменопаузальних симптомів, таких, як припливи жару. Як приклад SERM можна згадати ралоксифен, що недавно був введений для призначення при лікуванні остеопорозу. Для лікування розладів фертильності в жінок, причиною яких часто є порушення функції яєчника, викликані хірургічним втручанням, прийомом лікарських препаратів і т.п., із застосуванням нових селективних естрогенів відкриваються нові можливі способи терапії. Invitro лікування фертильності являє собою процес, що був розроблений більше 20 років тому. Є відомими численні способи лікування безплідності, індукованої яєчниками, за допомогою екзогенних гонадотропінів. Шляхом введення гонадотропінів, таких, як FSH (FSH = фолікулостимулювальний гормон), досягається стимуляція яєчників, що забезпечує можливість здорового дозрівання фолікулів. Фолікул являє собою функціональну одиницю яєчника та має дві мети: він містить ооцити та забезпечує можливість їх росту та дозрівання. Утворення фолікулів включає розвиток фолікула яєчника, починаючи із зародкової стадії, і до безперервного росту антрального фолікула, що являє собою останню стадію перед овуляцією. Тільки оптимально розвинутий антральний фолікул може вивільняти зрілий ооцит при овуляції. Пацієнти з безплідністю, індукованою яєчниками (PCOS = синдром полікістозного яєчника), страждають від порушення дозрівання фолікулів, що асоціюється як з гормональними, так і овуляторними порушеннями, а також з неадекватно дозрілими ооцитами. Кількість первинних і вторинних фолікулів у цьому випадку є приблизно у два рази вищою за таку у нормальному яєчнику (Hughesden і ін., Obstet. Gynecol. Survey 37, 1982, стор. 59-77). Є вказівки на те, що ранні стадії фолікулогенезу (які відносяться до розвитку примордіальних фолікулів до антральних фолікулів) є незалежними від гонадотропіну. Не існує точного пояснення того, на скільки великий вплив паракринних і аутокринних факторів на ранніх стадіях фолікулогенезу (Elvin і ін., Mol. Cell Endocrinol. 13, 1999, стор. 1035-1048; McNatty і ін., J. Reprod. Fertil. Suppl. 54, 1999, стор. 3-16). Гонадотропіни, такі, як FSH, є в основному залученими в останні стадії розвитку фолікулогенезу при дозріванні фолікулів, тобто в розвиток ранніх антральних фолікулів до зрілого фолікула, що може піддаватися овуляції. 2 UA 99918 C2 5 10 15 20 25 30 35 40 45 50 55 60 Безплідність in-vivo таі in-vitro переважно піддається лікуванню за допомогою гонадотропінів (FSH і aнтиестрогенів) (White і ін., J. Clin. Endocrinol. Metab. 81, 1996, стор. 3821-3824). При invitro лікуванні безплідності ооцити видаляються з передовуляторних антральних фолікулів, які є здатними до дозрівання in vitro до ооцитів, які можуть піддаватися заплідненню. Після запліднення та раннього ембріонального розвитку від одного до трьох ембріонів піддають імплантації у матку жінки. У багатьох аспектах лікування за допомогою екзогенних гонадотропінів супроводжується численними ризиками та побічними ефектами. Найбільший ризик полягає в надлишковій стимуляції яєчників, що у важких випадках може становити серйозну небезпеку для життя (OHSS = синдром гіперстимуляції яєчників). Інші побічні ефекти являють собою високі витрати на in-vitro лікування безплідності, які оплачуються подружжям. Негативні побічні ефекти, такі, як збільшення ваги, здуття живота, нудота, блювота та навіть ще невідомий ризик розвитку раку приписуються лікуванню за допомогою гонадотропіну. Один зі способів уникнення згаданих вище побічних ефектів і ризиків полягає в забезпеченні дозрівання та стимуляції in vivo росту фолікулів у випадку індукованої яєчниками безплідності за допомогою прийнятного активного інгредієнта перед початком лікування при використанні екзогенних гонадотропінів. Бета рецептор естрогену (ERβ) Кілька років тому був відкритий естрогенний рецептор β (ERβ) як другий підтип естрогенного рецептора (Kuiper та ін. (1996), Proc. Natl. Acad. Sci. 93: 5925-5930; Mosselman, Dijkema (1996) Febs Letters 392: 49-53; Tremblay і ін. (1997), Molecular Endocrinology 11: 353-365). Модель експресії ERβ відрізняється від такої для ERα (Kuiper і ін. (1996), Endocrinology 138: 863-870). ERβ, таким чином, переважає над ERα у передміхуровій залозі щурів, у той час, як ERα переважає над ERβ у матці щурів. Найвищі концентрації ERβ і мРНК були виявлені в яєчниках (Couse і ін. Endocrinology 138, 1997, стор. 4612-4613). Інші системи органів з порівняно більш високою експресією ERβ включають кістки (Onoe, Y. і ін., 1997, Endocrinology 138: 4509-4512), судинну систему (Register, T. C., Adams, M. R. 1998, J. Steroid Molec Biol 64: 187-191), сечостатевий тракт (Kuiper, G. J. M. і ін. 1997, Endocrinology 138: 863-870), шлунково-кишковий тракт (Campbell-Thopson 1997, BBRC 240: 478-483), а також яєчки (Mosselmann, S. і ін. 1996 FEBS Lett. 392, 49-53), включаючи сперматиди (Shugrue і ін. 1998, Steroids 63: 498-504). Такий тканинний розподіл припускає, що естрогеннна регуляція функцій органів за допомогою ERβ є високому ступені релевантною. Той факт, що ERβ є функціональним у цьому зв'язку також випливає з досліджень на ERα- (ERKO) або ERβ(βERKO)-нокаутних мишах: oваріоектомія викликає втрату кісткової маси в ERKO-мишей, що може бути усунута шляхом заміщення естрогену (Kimbro і ін. 1998, Abstract OR7-4, Endocrine Society Meeting, New Orleans). Естрадіол у судинах крові самок ERKO мишей також інгібує васкулярне середовище та проліферацію клітин гладеньої мускулатури (Iafrati, M. D. і ін. 1997, Nature Medicine 3: 545-548). Такі захисні впливи естрадіолу здійснювалися в ERKO миші головним чином за допомогою ERβ. Той факт, що ER і ER мають функціонально різний вплив, був підтверджений після успішного одержання ERKO і ERKO мишей. Таким чином, ER відіграє важливу роль у матці дорослих тварин, у тканині молочних залоз, у негативній регуляції активності гонадотропіну, у той час, як ER в основному пов'язаний із процесами фізіології яєчників, зокрема, з такими, як фолікулогенез та овуляція (Couse і ін., Endocrine Reviews 20, 1999, стор. 358-417). Спостереження за βERKO мишами забезпечують вказівку на функцію ERβ у передміхуровій залозі та сечовому міхурі: у випадку більш старих самців мишей виникають симптоми гіперплазії передміхурової залози та сечового міхура (Krege, J. H. і ін. 1998, Proc Natl Acad Sci 95: 1567715682). Крім того, самки ERKO мишей (Lubahn, D. B. і ін. 1993, Proc Natl Acad Sci 90: 1116211166) і самці ERKO мишей (Hess, R. A. і ін. 1997, Nature 390: 509-512), а також самки βERKO мишей (Krege, J. H., 1998, Proc Natl Acad Sci 95: 15677-15682) мають порушення фертильності. Таким чином, підтверджена основна функція естрогенів відносно підтримки функції яєчок і яєчників, а також відносно фертильності. Є можливим досягти селективного естрогенного впливу на специфічні цільові органи за допомогою лігандів, специфічних для підтипу, на основі різного розподілу в тканинах і органах двох підтипів ER. Речовини з перевагою для ERβ у порівнянні з ERα в in-vitro аналізі зв'язування рецептора, були описані Kuiper і ін. (Kuiper і ін. (1996), Endocrinology 138: 863-870). Селективний вплив лігандів, специфічних для підтипу естрогенних рецепторів, на чутливі до естрогену параметри in vivo не був раніше продемонстрований. 8 Патентна заявка WO 01/77139 A1 описує 8β-заміщені естратриєни, в яких R означає алкільний або алкенільний радикал з розгалуженої або нерозгалуженим ланцюгом, 3 UA 99918 C2 5 10 15 20 25 необов'язково частково або повністю галогенований, що містить аж до 5 атомів вуглецю, етинільний- або проп-1-інильний радикал, як фармацевтично активні інгредієнти, які володіють іn vitro більш високою афінністю стосовно препаратів естрогенного рецептора передміхурової залози щурів, ніж препарати естрогенного рецептора матки щурів, їх одержання, їх терапевтичне застосування та форми фармацевтичного застосування, які містять зазначені сполуки. Сполука 3-метокси-8-вініл-естра-1,3,5(10)-триєн-17-oну (Приклад 6) також є описаною в WO01/77139. Існує гостра потреба в даній галузі техніки в сполуках з потужною естрогенною активністю та більш високою афінністю стосовно препаратів рецептора передміхурової залози щурів, ніж до препаратів естрогенного рецептора матки щурів, для одержання лікарського засобу. Задачі винаходу Задача даного винаходу полягає, таким чином, в одержанні сполук, які мають високу роздвоєність in vitro відносно зв'язування препаратів естрогенного рецептора з передміхурової залози щурів та матки щурів. Сполуки є такими, які демонструють більш високу афінність in vitro стосовно препаратів естрогеного рецептора з передміхурової залози щурів, ніж до препаратів естрогенного рецептора з матки щурів. Сполуки відповідно до даного винаходу володіють високою естрогенною активністю та ефективністю, зокрема, високою сполучною афінністю з естрогенним рецептором і більш високою роздвоєністю відносно зв'язування з естрогенним рецептором передміхурової залози щурів у порівнянні з маткою щурів стосовно відомих сполук. Сполуки відповідно до винаходу є такими, які забезпечують підвищену фертильність у яєчнику, у той самий час, як вони в незначній мірі впливають на матку у випадку асоційованої з яєчниками безплідності. Переважний профіль сполук відповідно до винаходу досягався за допомогою специфічної 8 13 16 17 17‟ комбінації замісників R , R , R , R і R . Відповідно до винаходу вказана вище задача вирішується шляхом забезпечення похідних 8β-заміщеного естра-1,3,5(10)-триєну загальної формули I 30 3 35 40 45 50 8 13 16 17 17' в якій радикали R , R , R , R , а також R і R , незалежно один від одного, мають наступні значення: 3 18 R означає атом водню або групу R , в якій 18 R означає радикал C1-C6-алкілу з розгалуженим або нерозгалуженим ланцюгом, насичений або ненасичений, групу трифторметилу, радикал арилу, гетероарилу або аралкілу, необов'язково заміщений принаймні одним радикалом, незалежно вибраним з метилу, етилу, трифторметилу, пентафторетилу, трифторметилтіо, метокси, етокси, нітро, ціано, гало-, гідрокси, аміно, моно(C1-C8-алкіл) або ди(C1-C8-алкіл)аміно, де обидві алкільні групи є ідентичними або різними, ди(аралкіл)аміно, де обидві aралкільні групи є ідентичними або різними, карбоксилу, карбоксіалкокси, C 1-C20–ацилу або C1-C20–ацилокси, як замісників; 19 19 ацильний радикал –C(=O)R , в якому R являє собою розгалужений або нерозгалужений ланцюг C1-C10 –алкільного радикал, що є насиченим або ненасиченим аж до трьох положень і є частково або повністю галогенованим, або 18 20 R означає групу R SO2, в якій 20 21 22 21 22 R являє собою R R N групу, де R і R , незалежно один від одного, означають атом 23 23 водню, C1-C5 –алкільний радикал, групу -C(=O)R , в якій R означає незаміщений або заміщений C1-C10 –алкільний радикал з розгалуженим або нерозгалуженим ланцюгом, де такий є насиченим або ненасиченим аж до трьох положень, і є частково або повністю галогенованим, групу циклопропілу, циклобутилу, циклопентилу, циклогексилу або циклогептилу, C 4-C15 4 UA 99918 C2 5 10 15 20 25 30 35 40 45 50 55 60 циклоалкілалкільнийрадикал, що містить від 3 дo 7 атомів вуглецю в циклоалкільній частині, і з алкільною частиною, що містить аж до 8 атомів вуглецю або арильний, гетероарильний або aралкільний радикал, необов„язково заміщений принаймні одним радикалом, незалежно вибраним з метилу, етилу, трифторметилу, пентафторетилу, трифторметилтіо, метокси, етокси, нітро, ціано, гало-, гідрокси, аміно, моно(C1-C8-алкіл) або ди(C1-C8-алкіл) аміно, де обидві алкільні групи є ідентичними або різними, ди(аралкіл)аміно, де обидві аралкільні групи є ідентичними або різними, карбоксилу, карбоксіалкокси, C1-C20–ацилу або C1-C20–ацилокси, як замісників; або разом з атомом N радикал поліетиленіміно з 4 - 6 атомами вуглецю або радикал морфоліно, 8 R являє собою радикал алкенілу або алкінілу з розгалуженим або нерозгалуженим ланцюгом, що містить 2 - 6 атомів вуглецю, що може бути частково або повністю фторованим, 13 R являє собою групу метилу або групу етилу, 16 R являє собою атом фтору, 17 17' R і R , у кожному випадку незалежно один від одного являють собою атом водню та групу гідрокси; або 18 20 23 18 20 23 атом водню та групу R O-, R SO2- або OC(O)R , де R , R і R у кожному випадку мають 3 значення, які вказані для R . Особливе втілення відповідно до даного винаходу являє собою сполуки загальної формули 3 I, в якій R являє собою атом водню. Відповідно до додаткового втілення даного винаходу сполуки загальної формули I 8 включають R , що являє собою групу вінілу, етинілу або проп-1-інілу. Інші можливі форми втілення відповідно до даного винаходу є визначеними в залежних пунктах формули винаходу. 17 17' Сполуки загальної формули I, в якій R і R являють собою атом водню та атом групи гідрокси також є переважними. 16 Сполуки загальної формули I, в якій R перебуває в -положенні, або сполуки загальної 16 формули I, у якій R перебуває в -положенні, також являють собою переважні форми втілення даного винаходу. Крім того, деякі втілення відповідно до даного винаходу являють собою сполуки загальної 8 16 формули I, в якій R являє собою групу вінілу, етинілу або проп-1-інілу, R являє собою атом 17 17' фтору, R і R незалежно один від одного являють собою атом водню та атом групи гідрокси. 17 17' 18 Сполуки загальної формули I, в якій R і/або R являють собою атом водню та групу R -O19 18 19 3 або R SO2-O-, де R і R у кожному випадку мають значення, зазначені для R , є додатковою окремою формою відповідно до даного винаходу. 17 18 Інший варіант винаходу, зокрема, зазначений для сполук, в яких R означає групу R O- або 20 18 20 3 R SO2-O-, де R і R у кожному випадку мають значення, зазначені для R . Сполуки відповідно до даного винаходу являють собою: 8β-вініл-16α-фторестра-1,3,5(10)-триєн-3,17α-діол 8β-вініл-16α-фторестра-1,3,5(10)-триєн-3,17β-діол 8β-вініл-16β-фторестра-1,3,5(10)-триєн-3,17β-діол Під гало- або галогеном відповідно до даного винаходу маються на увазі атом фтору, хлору, брому або йоду. Під алкільним радикалом у загальному випадку мають на увазі (C 1-C6)алкільний радикал, якщо спеціально не вказується інше, зазначений алкільний радикал являє собою такий з нерозгалуженим або нерозгалуженим ланцюгом, насичений або ненасичений. Характерні групи для алкільного радикала відповідно до даного винаходу являють собою метил, етил, н-пропіл, 1-метилетил (ізо-пропіл), н-бутил, н-пентил, 1,1-диметилетил (т-бутил) і н-гексил. C1-C6алкільний радикал може бути частково або повністю заміщеним атомами галогену, групами гідрокси або C1-C6-алкоксигрупами. 18 Відповідно до даного визначення R являє собою, наприклад, радикал метилу, етилу, пропілу, ізопропілу, бутилу, ізобутилу, трет.-бутилу, пентилу, ізопентилу, нeoпентилу або гексилу. 18 Алкокси групи OR у сполуках загальної формули I у кожному випадку можуть містити алкільний радикал відповідно до визначення, наведеного вище, де метокси, етокси, пропокси, ізопропокси та т-бутилокси групи переважно являють собою радикал алкокси. 21 22 Характерні представники C1-C5-алкільних радикалів R і R являють собою метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, пентил, ізопентил і неопентил. 23 Можуть бути згадані характерні представники C1-C10 –алкільних радикалів R з нерозгалуженим або розгалуженим ланцюгом, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, пентил, ізопентил, неопентил, гептил, гекси, і децил; при цьому метил, 5 UA 99918 C2 5 10 15 20 25 30 35 40 45 50 55 60 етил, пропіл та ізопропіл є переважними. Як C3-C7-циклоалкільна група можуть бути згадані групи циклопропілу, циклобутилу, циклопентилу, циклогексилу або циклогептилу. C4-C15-циклоалкілалкільний радикал містить від 3 дo 7 атомів вуглецю в циклоалкільній частині; типовими представниками є циклоалкільні групи, які згадані безпосередньо вище. Алкільна частина містить аж до 8 атомів вуглецю. Як приклади С4-C15-циклоалкілалкільних радикалів можуть бути згадані групи циклопропілметилу, циклопропілетилу, циклопентилметилу, циклопентилпропілу. У контексті даного винаходу арильний радикал являє собою радикал фенілу, 1- або 2нафтилу; при цьому радикал фенілу є переважним. Приклади гетероарильного радикала відповідно до даного винаходу являють собою радикал 2-, 3- або 4-піридинілу, 2- або 3-фурилу, 2- або 3-тієнілу, 2- або 3-піроліолу, 2-, 4- або 5імідазолілу, піразинілу, 2-, 4- або 5-піримідинілу або 3- або 4-піридазинілу. Як замісники, які можуть бути присутні на арильному або гетероарильном радикалі, можуть бути згадані, наприклад, групи метилу-, етилу-, трифторметилу, пентафторетилу-, трифторметилтіо-, метокси-, етокси-,нітро-, ціано-, галогену- (фтор, хлор, бром, йод), гідрокси-, аміно-, моно(C1-C8-алкіл) або ди(C1-C8-алкіл)аміно, де обидві алкільні групи є ідентичними або різними, ди(аралкіл)аміно, де обидві аралкільні групи є ідентичними або різними, карбоксилу, карбоксіалкокси, C1–C20–ацилу або C1–C20–ацилокси. Aралкільний радикал являє собою радикал, що містить кільце, що має аж до 14, переважно від 6 дo 10 C атомів, та алкільний ланцюг , що містить від 1 дo 8, переважно від 1 дo 4, C атомів. Tаким чином, як аралкільні радикаліи є прийнятними, наприклад, бензил, фенілетил, нафтилметил, нафтилетил, фурилметил, тієнілетил і піридилпропіл. Алкільні групи та радикали можуть бути частково або повністю заміщеними 1-5 атомами галогену, групами гідрокси або C1-C4-алкоксигрупами. Радикал вінілу або алілу головним чином визначається як C2-C6-алкенільний радикал. C2-C6-алкінільний радикал переважно визначається як етинільний радикал або проп-1інільний радикал.C1-10–ацильні радикали означають, наприклад, ацетил, пропіоніл, бутирил, валероїл, ізовалероїл, півалоїл, гексаноїл, октил, ноніл, або деканоїл. Одна або дві гідроксильні групи при C атомах 3 і 16 можуть бути естерифікованими за допомогою аліфатичної, розгалуженої або нерозгалуженої, насиченої або ненасиченої C 1-C14моно- або полікарбонової кислоти або ароматичної карбонової кислоти. Такими прийнятними карбоновими кислотами для естерифікації є, наприклад: - Монокарбонові кислоти: мурашина кислота, оцтова кислота, пропіонова кислота, масляна кислота, ізомасляна кислота, валеріанова кислота, ізовалеріанова кислота, триметилоцтова кислота, лауринова кислота, міристимова кислота, акрилова кислота, пропіонова кислота, метакрилова кислота, кротонова кислота, ізокротонова кислота, олеїнова кислота та елаїдинова кислота. Естерифікація за допомогою оцтової кислоти, валеріанової кислоти або триметилоцтової кислоти є переважною. - Дикарбонові кислоти: щавлева кислота, малонова кислота, янтарна кислота, глутарова кислота, адипінова кислота, пімелінова кислота, суберинова кислота, азелаїнова кислота, себацинова кислота, малеїнова кислота, фумарова кислота, муконова кислота, цитраконова кислота та мезаконова кислота. - Aроматичні карбонові кислоти: бензойна кислота, фталева кислота, ізофталева кислота, терефталева кислота, нафтойна кислота, o-, м- і п-толуїлова кислота, гідратропова кислота, атропова кислота, фенілакрилова кислота, нікотинова кислота та ізонікотинова кислота. Естерифікація за допомогою бензойної кислоти є бажаною. Як пролікарські форми естери 8β-заміщених естратриєнів відповідно до винаходу мають перевагу в порівнянні з неестерифікованими активними інгредієнтами відносно способу їх введення, їх типу дії, сили та тривалості дії. Зокрема, 8-заміщені естратриєни відповідно до винаходу мають фармакокінетичні та фармакодинамічні переваги. Подібні ефекти вже були описані в інших стероїд-сульфаматів (J. Steroid Biochem. Molec. Biol, 55, 395-403 (1995); Exp. Opinion Invest. Drugs 7, 575-589 (1998)). У даній заявці стероїди на основі скелету 8β-заміщеного естра-1,3,5(10)-триєну описуються для лікування розладів і станів, опосередкованих естрогенним β-рецептором, як селективні естрогени, які володіють in-vitro роздвоєністю відносно їх зв'язування із препаратами естрогенного рецептора з передміхурової залози щурів і матки щурів і які володіють in vivo кращою роздвоєністю відносно дії на яєчники у порівнянні з дією на матку. ERβ-специфічні сполуки відповідно до даного винаходу є такими, які опосередковують in 6 UA 99918 C2 5 10 15 20 25 30 35 40 45 50 55 60 vivo проліферативну дію на яєчники. У той же час сполуки демонструють роздвоєність відносно впливу на яєчники в порівнянні з дією на матку. Було виявлено, що 8β-заміщені естра-1,3,5(10)-триєни відповідно до загальної формули I є прийнятними як селективні естрогени для лікування різних станів і розладів, які характеризуються більш високим вмістом естрогенних рецепторів β, ніж естрогенних рецепторів α у відповідній цільовій тканині або цільовому органі. Зазначені сполуки мають поліпшену ефективність і метаболічною стабільність Винахід також стосується фармацевтичних препаратів, які містять принаймні одну сполуку загальної формули I (або їх фізіологічно сумісні адитивні солі з органічними або неорганічними кислотами), застосування сполук загальної формули I для одержання фармацевтичних агентів, зокрема, для показань, згаданих нижче. Нові селективні естрогени, які описані в даній заявці, можуть використовуватися як індивідуальні компоненти у фармацевтичних препаратах або в комбінації, зокрема, з гестагенами. Частина даного винаходу являє собою комбінацію селективних естрогенів з ERαселективними aнтиестрогенами, які є периферично активними, тобто такими, які не проходять через гематоенцефалічні бар'єри, а також із селективними модуляторами естрогенного рецептора (SERM). ERβ-селективні сполуки відповідно до винаходу можуть використовуватися, зокрема, для одержання фармацевтичних агентів для лікування розладів фертильності, для запобігання та терапії гіперплазії передміхурової залози, для запобігання та лікування коливань настрою, індукованих недостатністю гормонів у жінок і чоловіків і для застосування в гормонозамісній терапії (ГЗТ) у чоловіків і жінок. Крім того, сполуки відповідно до винаходу володіють антипроліферативними ефектами в моделях гіперплазії товстого та тонкого кишечнику та можуть, таким чином, вводитися для запобігання та лікування захворювань, асоційованих із проліферацією епітелію товстого та тонкого кишечнику, наприклад, для лікування та запобігання раку. ERβ-специфічні сполуки відповідно до даного винаходу можуть переважно використовуватися для селективної стимуляції росту волосся. Терапевтичний продукт, що містить естроген і чистий антиестроген для одночасного, послідовного або роздільного застосування у селективній естрогенній терапії перименопаузальних і постменопаузальних станів, вже був описаний в EP-A 0 346 014. Через їх роздвоєність впливу в яєчнику в порівнянні з дією в матці, речовини та фармацевтичні агенти, які їх містять, є особливо прийнятними для лікування у випадку дисфункції яєчників, що викликана хірургічним втручанням, прийомом лікарських засобів, і т.п., такої, як жіноча безплідність, для стимуляції фолікулогенезу для самостійного лікування як такого з метою підвищення фертильності, для підтримки in-vitro лікування фертильності (IVF) у зв'язку з in-vivo лікуванням і для лікування розладів, індукованих яєчниками, у літньому віці (“пізня фертильність”), а також лікування симптомів, індукованих недостатністю гормонів. Сполуки відповідно до даного винаходу є також прийнятними для терапії захворювань яєчників, таких, як синдром полікістозного яєчника, POF (передчасне згасання функції яєчників) синдромі та розладах овуляції. На завершення, сполуки загальної формули I можуть використовуватися у поєднанні з селективними модуляторами естрогенного рецептора (SERM) або ралоксифеном, зокрема, для застосування у гормонозамісній терапії (ГЗТ) і для лікування гінекологічних розладів. 8β-заміщені естратриєни відповідно до винаходу є також прийнятними як індивідуальні компоненти для лікування перименопаузальних і постменопаузальних симптомів, зокрема, припливів жару, порушення сну, дратівливості, перепадів настрою, нетримання сечі, вагінальної атрофії та психічних розладів, індукованих недостатністю гормонів. Згадані вище 8β-заміщені естратриєни є також прийнятними для заміщення гормонів і для терапії симптомів, індукованих недостатністю гормонів при порушенні функції яєчників, що викликано хірургічним втручанням, прийомом лікарських засобів і т.п. Крім того, 8β-заміщені естратриєни відповідно до винаходу можуть також використовуватися для запобігання серцево-судинних захворювань, зокрема, судинних захворювань, таких, як aртеріосклероз, високий кров'яний тиск, гіпертензивної кардіоміопатії та для запобігання нейродегенеративних захворювань, індукованих недостатністю гормонів, таких, як хвороба Альцгеймера, а також порушення пам'яті та здатності до навчання, індукованих недостатністю гормонів. Крім того, сполуки відповідно до даного винаходу можуть використовуватися як активні інгредієнти в препаратах для лікування запальних захворювань і захворювань імунної системи, зокрема, аутоімунних захворювань, таких, як, наприклад, ревматоїдний артрит, розсіяний 7 UA 99918 C2 5 10 15 20 25 30 35 40 45 50 55 60 склероз, вовчак, хвороба Крона та інші запальні захворювання кишечнику, запальних захворювань шкіри, таких, як, псоріаз, а також для лікування ендометріозу. Ґрунтуючись на фактах, отриманих із доклінічних моделей запальних захворювань людини, ER-специфічні сполуки можуть, таким чином, використовуватися для запобігання та лікування захворювань, згаданих вище (Heather, H.A.; Mol Endocrinol. 2007 Jan;21(1):1-13. Epub 2006 Mar 23. Review). На доповнення до зазначеного вище, ці сполуки є ефективними при запальних захворювань респіраторного тракту, легенів і бронхіол, таких, як, наприклад, астма. Лікарська терапія є прийнятною для терапії та профілактики захворювань, індукованих недостатністю естрогену як у чоловіків, так і в жінок. Дані сполуки є також прийнятними для запобігання та терапії гіперплазії передміхурової залози. Ці сполуки можуть додатково використовуватися для профілактики та терапії порушень функції або захворювань людини, пов'язаних із віком. Зокрема, вони можуть використовуватися для запобігання або лікування пов'язаного з віком зниження рівня андрогенів, таких, як тестостерон і DHEA, а також гормону росту. Кількість сполуки загальної формули I, що вводиться, коливається в межах широкого інтервалу та може охоплювати будь-яку ефективну кількість. Ґрунтуючись на стані, що піддається лікуванню та способі введення, кількість сполуки, що вводиться, може становити 0,01 мкг/кг - 100 мг/кг ваги тіла, переважно 0,04 мкг/кг - 1 мг/кг ваги тіла, на добу. У людей це відповідає дозі від 0,8 мкг до 8 г, переважно від 3,2 мкг дo 80 мг щоденно. Відповідно до винаходу одинична доза містить від 1,6 мкг дo 2000 мг однієї або більше сполук загальної формули I. Сполуки відповідно до винаходу і їх солі приєднання кислоти є прийнятними для одержання фармацевтичних композицій та препаратів. Фармацевтичні композиції або фармацевтичні агенти містять як активні інгредієнти одну або більше сполук відповідно до винаходу або їх солі приєднання кислоти, необов'язково змішані з іншими фармакологічно або фармацевтично активними речовинами. Одержання фармацевтично активних агентів здійснюють відомим способом, при якому застосовують відомі та широко використовувані фармацевтичні ад„юванти, а також можуть застосовуватися інші традиційно використовувані носії або розріджувачі. Як такі носії та ад„юванти є прийнятними, наприклад, ті, які рекомендовані або зазначені в наступних бібліографічних посиланнях як ад„юванти для фармацевтичних агентів, косметичних засобів, а також в інших галузях: Ullmans Encyklopadie der technischen Chemie [Ullman's Enсуcloоpedia of Technical Chemistry], том 4 (1953), сторінки з 1 пo 39; Journal of Pharmaceutical Sciences, том 52 (1963), стор. 918 ff., з Czetsch-Lindenwald, Hilfsstoffe fur Pharmazie und angrenzende Gebiete [Adjuvants for Pharmaceutics and Related Fields]; Pharm. Ind., Issue 2, 1961, p. 72 і ff.: Dr. H. P. Fiedler, Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete [Dictionary of Adjuvants for Pharmaceutics, Cosmetics і Related Fields], Cantor KG, Aulendorf in Wurttemberg 1971. Ці сполуки можуть вводиться перорально або парентерально, наприклад, інтраперитонеально, внутрішньом„язово, підшкірно або через шкіру Зазначені сполуки можуть також бути імплантовані в тканину. Для перорального введення є прийнятними капсули, пігулки, таблетки, таблетки з покриттям і т.п. На доповнення до активного інгредієнта одиничні дози можуть містити фармацевтично сумісний носій, такий, як, наприклад, крохмаль, цукор, сорбіт, желатин, речовину, що сприяє ковзанню, кремнієву кислоту, тальк і т.п. Для парентерального введення активні інгредієнти можуть бути розчинені або суспендовані у фізіологічно сумісному розріджувачі. Як розріджувачі дуже часто застосовуються масла з додаванням солюбілізатора, поверхнево-активної речовини, суспендувального агента або емульгувального агента. Приклади масел, які використаються, являють собою оливкову олію, горіхову олію, олію насіння бавовнику, соєву олію, рицинову олію та сезамову олію. Ці сполуки можуть також використовуватися у формі ін'єкцій речовин повільного всмоктування або у вигляді препаратів імплантату, які можуть бути рецептовані таким чином, щоб зробити можливим відстрочене вивільнення активного інгредієнта. Як інертні матеріали імплантати можуть містити, наприклад, полімери,які здатні до біорозкладання, або синтетичні силікони, такі, як, наприклад, силіконовий каучук. Крім того, для введення через шкіру активні інгредієнти можуть додаватися, наприклад, до пластиру. Для одержання інтравагінальних систем (наприклад, вагінальних кілець) або (R) внутрішньоматкових систем (наприклад, вагінальних супозиторіїв, спіралей, IUD, Mirena ), які містять активні сполуки загальної формули I для місцевого введення, є прийнятними різні полімери, такі, як, наприклад, кремнійорганічні полімери, етилeнвінілацетат, поліетилен або поліпропілен. 8 UA 99918 C2 5 10 15 20 Для досягнення кращої біодоступності активного інгредієнта сполуки також можуть бути рецептовані у вигляді клатратів циклодекстрину. Із цією метою сполуки піддають реакції з α-, β-, або -циклодекстрином або похідним останнього (PCT/EP95/02656). Відповідно до винаходу сполуки загальної формули I можуть також піддаватися інкапсуляції з використанням ліпосом. Способи Дослідження зв'язування естрогенного рецептора: Сполучну афінність нових селективних естрогенів піддавали аналізу в конкурентних 3 аналізах при використанні H-естрадіолу як ліганда для препаратів естрогенного рецептора з передміхурової залози щурів і матки щурів. Одержання цитозолю передміхурової залози та аналіз рецепторів естрогену з використанням цитозолю передміхурової залози здійснювали відповідно до Testas і ін. (1981) (Testas, J. і ін., 1981, Endocrinology 109: 1287-1289). Одержання цитозолю матки щурів, а також аналіз рецепторів з використанням ERутримуючого цитозолю в основному здійснювали так, як описано Stack і Gorski, (1985) (Stack, Gorski 1985, Endocrinology 117, 2024-2032), з деякими модифікаціями, як описано в Fuhrmann і ін. (1995) (Fuhrmann, U. і ін. 1995, Contraception 51: 45-52). Речовини, описані в даній заявці, мали більш високу сполучну афінність із естрогенними рецепторами передміхурової залози щурів, ніж з естрогенними рецепторами матки щурів. У цьому випадку передбачається, що ERβ превалює у передміхуровій залозі щурів над ERα, а ERα превалює в матці щурів над ERβ. Таблиця 1 показує, що співвідношення зв'язування з рецепторами передміхурової залози та матки якісно збігається з показником відносної сполучної афінності (RBA) для людського ERβ і ERα щурів (відповідно до Kuiper і ін. (1996), Endocrinology 138: 863-870) (Таблиця 1). Таблиця 1 Естроген hERα * RBA Структура Естрадіол ERβ/ hERβ * ERα RBA Матка щурів ER(RBA) Передміхур. ER залоза передміх. щурів зал./ ER ER(RBA) матки 100 100 1 100 100 1 60 37 0,6 3 2 0,8 58 11 0,2 2,4 1,3 0,5 14 21 1,5 4 20 5 6 17 3 0,1 5 50 5 36 7 0,1 10 100 O Chiral Естрон HO OH Chiral 17α-Естрадіол HO OH Chiral OH Естріол HO OHChiral 5-Андростендіол HO OH O Геністеїн HO OH O 9 UA 99918 C2 Куместрол 94 185 2 1,3 24 18 * Цитується з: Kuiper і ін. (1996), Endocrinology 138: 863-870. Таблиця 2 показує результати для однієї з похідних 8-вініл-естра-1,3,5(10) -триєн-3,17діолу (сполука 1) відповідно до винаходу. Сполука 2 (8-вініл-естра-1,3,5(10) -триєн-3,17-діолу представлена як стандарт. 5 Таблиця 2 Сполука ER(RBA) ER(RBA) передміхурової матки щурів залози щурів 1,7 15 20 25 30 35 40 167 98 0,7 8-Вініл-естра-1,3,5(10) -16-фтор-3,17-діол (1) 8-Вініл-естра-1,3,5(10) -3,17-діол (2) 10 ER передміхурової залози / ER матки 63 90 Сполука 1 відповідно до винаходу, а також сполука 2 демонструють більш високу сполучну афінність із естрогенними рецепторами передміхурової залози щурів, ніж з естрогенними рецепторами матки щурів. Сполука 1 перевершує сполуку 2 за своєю більш високою сполучною активністю з естрогенними рецепторами передміхурової залози щурів і за поліпшеною роздвоєністю відносно передміхурової залози щурів у порівнянні з естрогенними рецепторами матки щурів. На доповнення до цього, можливість прогнозування тестової системи ER передміхурової залози проти ER матки підтверджується стосовно селективного відносно тканин впливу в in-vivo дослідженнях. Речовини, бажані для ER передміхурової залози, роздвоюються in vivo переважно відносно впливу в яєчниках і матці, а також впливу у гіпофізі на користь впливу на яєчники. Дослідження роздвоєності впливу на матку та гіпофіз Дослідження відносно впливу на ріст матки та овуляцію (опосередкований ефект шляхом впливу на секрецію гормонів гіпофіза) здійснювали на дорослих самках щурів (вага тіла 220-250 г). Речовини вводили підшкірно чотири рази протягом чотирьох послідовних днів. Перше введення здійснювали у період після тічки. Через один день після останнього введення проводили аутопсію. Визначали кількість ооцитів у Фаллопієвій трубі (вплив на овуляцію), а також вагу матки. У той час, як естрадіол викликає залежне від дози інгібування овуляції та збільшення ваги матки зі значенням ED50 0,004 мг/кг ваги тіла, речовина відповідно до винаходу не викликає ніякого впливу на гіпофіз і вагу матки. Дослідження яєчників: Сполуки піддавали аналізу in vivo з використанням молодих особин щурів з вилученим гіпофізом. У модифікації цього оперативного способу тваринам вводили GnRH aнтагоніст (Cetrorelix). Досліджували, чи стимулює речовина фолікулярну проліферацію (дозрівання) у яєчнику. Вага яєчника являла собою вимірюваний параметр. У кожному випадку п'ять тварин (вага тіла 40-50 г) випадковим чином розподіляли на групи обробки. Тварин одержували їжу " ad libitum" при використанні стандартного корму (алтронім) у клітках Макролона в кімнатах з кондиціонованим повітрям при використанні певної програми освітлення (12 годин темряви, 12 годин освітлення) і забезпечували підкисленою водою для питва. Для підшкірного введення досліджувану речовину, а також контрольну речовину (естрадіол E2) розчиняли в суміші бензилбензоат/рицинова олія (1+4 об./об.). Молодих самок щурів або піддавали видаленню гіпофіза в день 0 і підшкірно вводили (введення 1 x щодня) від дня 1 до дня 4 естрадіол, сполуку відповідно до винаходу, або підшкірно вводили (введення 1 x щодня) носій (касторове масло/бензил бензоат). У модифікованій версії цього способу вводили 0,5 мг/тварина/добу Цетрорелікса тваринам одночасно зі сполукою відповідно до винаходу або носієм і контрольною речовиною естрадіолом протягом чотирьох днів лікування. В обох випадках тварин забивали через 24 10 UA 99918 C2 5 10 15 20 25 30 35 40 45 50 55 60 години після останнього введення та визначали вагу яєчника, і також стадії фолікула. Сполуки відповідно до винаходу, таким чином, продемонстрували чітке роздвоєння впливу на яєчник у порівнянні із впливом на матку та впливом на гіпофіз, і є більш прийнятними для лікування безплідності в жінок завдяки своєму фолікулостимуювальному впливу. Одержання сполук відповідно до винаходу Сполуки загальної формули I відповідно до винаходу одержують так, як описано в прикладах. Додаткові сполуки загальної формули I можуть бути отримані за допомогою аналогічної процедури при використанні реагентів, які є гомологічними реагентам, описаним у прикладах. Етерифікацію та/або естерифікацію гідроксигруп здійснюють у відповідності зі способами, відомими фахівцеві в даній галузі техніки. Сполуки відповідно до винаходу можуть бути представлені у вуглецевих атомах 16 і 17 як α, β-стереoізомери. При одержанні сполук відповідно до описаних процесів сполуки в більшості випадків акумулюються як суміші відповідних α, β -ізомерів. Суміші можуть бути розділені, наприклад, за допомогою хроматографічних процесів. Відповідно до загальної формули I можливі замісники можуть бути присутні вже в заключній формі або у формі попередника навіть у вихідному продукті, заміщеному естроні, що вже відповідає бажаному кінцевому продукту. 17-замісники також вводять відповідно до відомих процесів за допомогою нуклеофільного приєднання бажаного замісника або його реактивного попередника та необов'язково додатково нарощують. Эстери 8β-заміщеної естратриєнкарбонової кислоти відповідно до винаходу одержують із відповідних гідроксистероїдів, аналогічно до процесів, які також є відомими (дивися, наприклад., Pharmazeutische Wirkstoffe, Synthesen, Patente, Anwendungen [Pharmaceutical Active Ingredients, Syntheses, Patents, Applications]; A. Kleemann, J. Engel', Georg Thieme Verlag Stuttgart 1978, Arzneimittel, Fortschritte [Pharmaceutical Agents, Improvements] 1972 - 1985; A. Kleemann, E. Lindner, J. Engel (Editors), VCH 1987, стор. 773-814). Естратриєнсульфамати відповідно до винаходу є доступними при використанні способу, відомого в галузі техніки, з відповідних гідроксистероїдів шляхом естерифікації за допомогою сульфамоїлхлоридів у присутності основи (Z. Chem. 15, 270-272 (1975); Steroids 61, 710-717 (1996)). Подальше ацилування сульфамідної групи приводить до утворення (N-ацил)сульфаматів відповідно до винаходу, для яких уже визначені фармакокінетичні переваги у випадку відсутності 8-замісника (див. DE 195 40 233 A1). Регіоселективну естерифікацію полігідроксильованих стероїдів за допомогою N-заміщених і N-незаміщених сульфамоїлхлоридів здійснювали відповідно до часткового захисту тих гідроксильних груп, які залишаються неестерифікованими. Силілові етери відключали як захисні групи з використанням селективної реактивності, що є прийнятним для цієї мети, оскільки такі силілові етери є стабільними за умов утворення сульфамату, і сульфаматна група залишається інактною тоді, коли силілові етери знову відщеплюють для регенерації залишкової(их) гідроксильної(их) групи(груп), які усе ще містяться в молекулі (Steroids 61, 710-717 (1996)). Одержання сульфаматів відповідно до винаходу з однієї або більше додатковими гідроксильними групами в молекулі також є можливим, та як вихідний матеріал являє собою прийнятні гідроксистероїдні кетони. Спочатку, залежно від поставленої мети, одну або більше гідроксильних груп, які є присутніми, піддають сульфамоїлуванню. Потім сульфаматні групи необов'язково можуть бути перетворені з використанням бажаного ацилхлориду у присутності основи на (N-ацил)сульфамати, які представляють інтерес. Отримані oксосульфамати або oксo(N-ацил)сульфамати перетворюють шляхом відновлення у відповідні гідроксисульфамати або гідрокси(N-ацил)сульфамати (Steroids 61, 710-717 (1996)). Борогідрид натрію та борандиметилсульфідний комплекс є прийнятними як підходящі агенти для відновлення. Введення різних замісників у кільця D естратриєнового скелету, зокрема, атома галогену (наприклад, атома фтору) при C-aтомі 16, може в основному здійснюватися відповідно до хімічних методик, які є відомими фахівцеві в даній галузі техніки, за допомогою яких одержують відповідні похідні естратриєну, які не є заміщеними в 8-положенні (дивися, серед інших: Steroide [Steroids], L. F. Fieser, M. Fieser, Verlag Chemie, Weinheim/Bergstr., 1961; Organic Reactions in Steroid Chemistry, J. Fried, J. A. Edwards, Van Nostrand Reinhold Company, New York, Cincinnati, Toronto, London, Melbourne, 1972; Medicinal Chemistry of Steroids, F. J. Zeelen, Elsevier, Amsterdam, Oxford, New York, Tokyo, 1990). Замісники відповідно до загальної формули I можуть бути також введені на етапі естратриєнів, які вже є заміщеними в 8-положенні, відповідно до відомих в галузі техніки 11 UA 99918 C2 5 10 15 20 25 30 35 40 45 50 55 60 способів. Це може бути корисним або необхідним, зокрема, у випадку численних заміщень бажаної заключної сполуки. Типові, але не такі, що обмежують даний винахід, процеси синтезу, які є корисними для забезпечення моделей заміщення в скелету естрону, також у комбінації з деякими замісниками, можуть бути знайдені, наприклад, в: C(1) J. Chem. Soc. (C) 1968, 2915; C(7) Steroids 54, 1989, 71; C(8) Tetrahedron Letters 1991, 743; C(8β) Tetrahedron Letters 1964, 1763; J. Org. Chem. 1970, 35, 468; C(11) J. Steroid Biochem. 31, 1988, 549; Tetrahedron 33, 1977, 609 і J. Org. Chem. 60, 1995, 5316; C(9) DE-OS 2035879; J. Chem. Soc. Perk. 1 1973, 2095; C(15) J. Chem. Soc. Perk. 1 1996, 1269.); C(13?) Mendeleev Commun. 1994, 187; C(14β) Z. Chem. 23, 1983, 410. Приклади, наведені нижче, використовуються для більш докладного пояснення винаходу. Аналогічно до деградації груп 8-вінілу, що утворилися, інші сполуки загальної формули I можуть бути отримані за допомогою реагентів, які є гомологічними реагентам, які описуються в прикладах. Етерифікацію та/або естерифікацію вільних гідроксильних груп здійснюють відповідно до способів, які є відомими фахівцеві в даній галузі техніки. Приклад 1 8β-Вініл-16α-фтор-естра-1,3,5(10)-триєн-3,17-діол 3-метокси-16α-фтор-8-вініл-естра-1,3,5(10)-триєн-17-он 7,3 г (23,5 ммоля) 3-метокси-8-вініл-естра-1,3,5(10) -триєн-17-ону в 65 мл ТГФ по краплях додавали в атмосфері аргону до 30 мл 2M розчину діізопропіламіду літію (60,0 ммолів) у суміші ТГФ / гептан / етилбензол, охолодженої при -78°C, і потом додавали 16 мл (115,4 ммоля) триетиламіну та 7,6 мл (59,9 ммоля) хлортриметилсилану один за одним. Реакційну суміш послідовно нагрівали аж до кімнатної температури протягом 1,5 години, промивали за допомогою розчину бікарбонату натрію і екстрагували за допомогою н-гексану. Зібрані органічні фази промивали за допомогою води, висушували над сульфатом натрію та концентрували шляхом випарювання у вакуумі. Отриманий сировий продукт (3-метокси-8-вініл-естра-1,3,5(10),16-триєн-17-ілокси)триметилсилану (12 г жовтуватого рідкого залишку) використовували без якого-небудь додаткового очищення на наступному етапі. Rf = 0,54 (Циклогексан / етилацетат = 8/2). 6,8 г сирового продукту (3-метокси-8-вініл-естра-1,3,5(10),16-тетраєн-17-ілокси)триметилсилану розчиняли в 50 мл метиленхлориду, поєднували з 5 г (15,9 ммоля) Nфтордибензолсульфоніміду та перемішували протягом 16 годин при кімнатній температурі та декілька разів екстрагували при використанні метилхлориду. Зібрані органічні фази промивали за допомогою розчину бікарбонату натрію, води та насиченого розчину хлориду натрію один за одним, висушували над сульфатом магнію та концентрували у вакуумі. Отриманий сировий продукт (8,43 жовтувато-коричневого масла) очищали за допомогою хроматографії на силікагелі (19/1 циклогексан/етилацетат). У такий спосіб одержували 1,65 г (38%, безбарвна піна) 3метокси-16α-фтор-8-вініл-естра-1,3,5(10)-триєн-17-ону та 2,08 г (51%, безбарвна піна) 3метокси-8-вініл-естра-1,3,5(10)-триєн-17-ону. 3-метокси-16α-фтор-8-вініл-естра-1,3,5(10) -триєн-17-он 1H-ЯМР (CDCl3): δ = 0,96 (s, 3H; 18CH3), 3,76 (s, 3H; OMe), 5,01 (d, 1H; CH=CH2), 5,05/5,18 (d, 1H; 16-H), 5,13 (d, 1H; CH=CH2), 5,54 (dd, 1H; CH=CH2), 6,59 (d, 1H; 4-H), 6,69 (dd, 1H; 1-H, 2-H), 7,15 (d, 1H; 1-H, 1-H). 3-метокси-16α-фтор-8-вініл-естра-1,3,5(10)-триєн-17α-ол і 3-метокси-16α-фтор-8-вініл-естра1,3,5(10)-триєн-17β-ол 1,65 г (5,0 ммоля) 3-метокси-16α-фтор-8-вініл-естра-1,3,5(10) -триєн-17-ону розчиняли в суміші 150 мл ТГФ і 150 мл метанолу, охолоджували при 5°C і поєднували з 1,9 г (50,2 ммоля) борогідриду натрію. Під час нагрівання до кімнатної температури протягом 1,5 години реакційну суміш перемішували. Потім додавали 10 мл оцтової кислоти та на завершення розчин висушували у вакуумі. Залишок повторно розчиняли у воді та кілька разів екстрагували за допомогоюетилацетату. Збирали органічні фази, висушували при використанні сульфату магнію та концентрували у вакуумі. Отриманий сировий продукт відокремлювали за допомогою хроматографії на силікагелі (циклогексан / метил трет-бутиловий етер = 13/1). Відповідно до цієї процедури одержували 0,67 г (40%) 3-метокси-16α-фтор-8-вініл-естра-1,3,5(10)-триєн-17α-олу та 1,00 г (60%) 3-метокси16α-фтор-8-вініл-естра-1,3,5(10)-триєн-17β-олу у вигляді безбарвної піни. 3-метокси-16α-фтор-8-вініл-естра-1,3,5(10)-триєн-17α-ол 1H-ЯМР (CDCl3): δ = 0,72 (s, 3H; 18-CH3), 3,72 (d, 1H, 17-H), 3,75 (s, 3H; OMe), 4,90 (d, 1H; CH=CH2), 5,04 (d, 1H; CH=CH2), 5,14/5,28 (dd, 1H; 16-H), 5,51 (dd, 1H; CH=CH2), 6,57 (d, 1H; 4-H), 6,67 (dd, 1H; 1-H, 2-H), 7,16 (d, 1H; 1-H, 1-H). 12 UA 99918 C2 5 10 15 20 25 30 35 3-метокси-16α-фтор-8-вініл-естра-1,3,5(10)-триєн-17β-ол 1H-ЯМР (CDCl3): δ = 0,79 (s, 3H; 18-CH3), 3,75 (s, 3H; OMe), 3,81 (d, 1H, 17-H), 4,82/4,95 (dd, 1H; 16-H), 4,89 (d, 1H; CH=CH2), 5,06 (d, 1H; CH=CH2), 5,51 (dd, 1H; CH=CH2), 6,57 (d, 1H; 4-H), 6,68 (dd, 1H; 1-H, 2-H), 7,15 (d, 1H; 1H, 1-H). 16α-Фтор-8-вініл-естра-1,3,5(10)-триєн-3,17β-діол 690 мг (1,87 ммоля) йодиду тетрабутиламонію додавали до розчину 70 мг (0,21 ммоля) 3метокси-16α-фтор-8-вініл-естра-1,3,5(10) -триєн-17β-олу в 9 мл метиленхлориду в атмосфері аргону. Реакційну суміш охолоджували при -78°C і потом поєднували з 1,9 мл (1,9 ммоля) 1M розчину боротрихлориду в метиленхлориді. Суміш перемішували протягом 0,5 годин при -78°C, а потім нагрівали при кімнатній температурі та гасили при використанні води. Відокремлювали органічну фазу, водну фазу кілька разів екстрагували за допомогою метиленхлориду та збирали органічні фази, промивали за допомогою насиченого розчину хлориду натрію, висушували при використанні сульфату магнію та концентрували у вакуумі. Отриманий сировий продукт відокремлювали за допомогою хроматографії на силікагелі (циклогексан / етилацетат = 9/1). 26 мг (39%) 16α-фтор-8-вініл-естра-1,3,5(10)-триєн-3,17β-діолу одержували відповідно до цієї процедури. 16α-Фтор-8-вініл-естра-1,3,5(10)-триєн-3,17β-діол 1H-ЯМР (ДМСО[D6]): δ = 0,64 (s, 3H; 18CH3), 3,49/3,57 (t, 1H, 17-H), 4,70/4,84 (dd, 1H; 16-H), 4,85 (d, 1H; CH=CH2), 4,98 (d, 1H; CH=CH2), 5,19 (d, 1H, 17-OH), 5,46 (dd, 1H; CH=CH2), 6,37 (d, 1H; 4-H), 6,48 (dd, 1H; 1-H, 2-H), 6,99 (d, 1H; 1-H, 1-H), 8,93 (s, 1H, 3-OH). Приклад 2 16α-Фтор-8-вініл-естра-1,3,5(10)-триєн-3,17α-діол 295 мг (0,80 ммоля) йодиду тетрабутилaмонію додавали до розчину 30 мг (0,09 ммоля) 3метокси-16α-фтор-8-вініл-естра-1,3,5(10) -триєн-17α-олу в 4 мл метиленхлориду в атмосфері аргону. Реакційну суміш охолоджували при -78°C і потом поєднували з 0,8 мл (0,8 ммоля) 1M розчину боротрихлориду в метиленхлориді. Суміш перемішували протягом 0,5 години при 78°C, а після цього нагрівали при кімнатній температурі та гасили за допомогою води. Відокремлювали органічну фазу, водну фазу кілька разів екстрагували за допомогою метиленхлориду, і збирали органічні фази, промивали за допомогою насиченого розчину хлориду натрію, висушували при використанні сульфату магнію та концентрували у вакуумі. Отриманий сировий продукт відокремлювали за допомогою хроматографії на силікагелі (циклогексан / етилацетат = 7/3). Відповідно до цієї процедури одержували 27 мг (94%) 16αфтор-8-вініл-естра-1,3,5(10)-триєн-3,17α-діолу. 16α-Фтор-8-вініл-естра-1,3,5(10)-триєн-3,17α-діол 1H-ЯМР (ДМСО[D6]): δ = 0,63 (s, 3H; 18CH3), 3,51 (t, 1H, 17-H), 4,82 (d, 1H, 17-OH), 4,85 (d, 1H; CH=CH2), 4,97 (d, 1H; CH=CH2), 5,05/5,18 (dd, 1H; 16-H), 5,47 (dd, 1H; CH=CH2), 6,37 (d, 1H; 4-H), 6,48 (dd, 1H; 1-H, 2-H), 6,99 (d, 1H; 1-H, 1-H), 8,97 (s, 1H, 3-OH). ФОРМУЛА ВИНАХОДУ 40 1. Похідні 8β-заміщеного естра-1,3,5(10)-триєну загальної формули І R 13 R 17 R 17 ' R H R 16 8 R3 O 45 50 , (І) 3 8 13 16 17 17' в якій радикали R , R , R , R , а також R і R , незалежно один від одного, мають наступні значення: 3 18 R означає атом водню або групу R , в якій 18 R означає насичений або ненасичений С1-С6-алкільний радикал з розгалуженим або нерозгалуженим ланцюгом, трифторметильну групу, арильний, гетероарильний або аралкільний радикал, необов'язково заміщений принаймні одним радикалом, незалежно вибраним з метилу, етилу, трифторметилу, пентафторетилу, трифторметилтіо, метокси, етокси, нітро, ціано, гало-, гідрокси, аміно, моно(С1-С8-алкіл)- або ді(С1-С8-алкіл)аміно, де обидві алкільні групи є ідентичними або різними, ді(аралкіл)аміно, де обидві аралкільні групи є 13 UA 99918 C2 5 10 15 20 25 30 35 40 45 50 55 ідентичними або різними, карбоксилу, карбоксіалкокси, С 1-С20-ацилу або С1-С20-ацилокси, як замісників; 19 19 ацильний радикал C(=O)R , в якому R являє собою С1-С10-алкільний радикал з розгалуженим або нерозгалуженим ланцюгом, що є насиченим або ненасиченим в аж до трьох положеннях і є частково або повністю галогенованим, або 18 20 R означає групу R SO2, в якій 20 21 22 21 22 R являє собою групу R R N, де R і R , незалежно один від одного, означають атом водню, 23 23 С1-C5-алкільний радикал, групу -C(=O)R , в якій R означає незаміщений або заміщений С1С10-алкільний радикал з розгалуженим або нерозгалуженим ланцюгом, який є насиченим або ненасиченим в аж до трьох положеннях і є частково або повністю галогенованим, циклопропільну, циклобутильну, циклопентильну, циклогексильну або циклогептильну групу, С4С15-циклоалкілалкільний радикал, що містить від 3 до 7 атомів вуглецю в циклоалкільній частині, і з алкільною частиною, що містить аж до 8 атомів вуглецю, або арильний, гетероарильний або аралкільний радикал, необов'язково заміщений принаймні одним радикалом, незалежно вибраним з метилу, етилу, трифторметилу, пентафторетилу, трифторметилтіо, метокси, етокси, нітро, ціано, гало-, гідрокси, аміно, моно(С1-С8-алкіл)- або ді(С1-C8-алкіл)аміно, де обидві алкільні групи є ідентичними або різними, ді(аралкіл)аміно, де обидві аралкільні групи є ідентичними або різними, карбоксилу, карбоксіалкокси, С 1-С20-ацилу або С1-С20-ацилокси, як замісників; або разом з N-атомом, поліетиленімінорадикал з 4-6 атомами вуглецю або морфолінорадикал, 8 R являє собою алкенільний або алкінільний радикал з розгалуженим або нерозгалуженим ланцюгом, що містить 2-6 атомів вуглецю, що може бути частково або повністю фторованим, 13 R являє собою метильну групу або етильну групу, 16 R являє собою атом фтору в -положенні; 17 17' R і R у кожному випадку незалежно один від одного являють собою атом водню та гідроксигрупу; або 18 20 23 18 20 23 атом водню та групу R O-, R SO2- або OC(O)R , де R , R і R у кожному випадку мають 3 значення, які вказані для R , де термін "арильний" означає фенільний, 1- або 2-нафтильний радикал, та де "аралкільний" радикал означає радикал, що містить в кільці аж до 14 атомів вуглецю і в алкільному ланцюзі 18 атомів вуглецю. 3 2. Сполука загальної формули І за пунктом 1, в якій R являє собою атом водню. 8 3. Сполука загальної формули І за пунктом 1 або 2, в якій R являє собою вінільну, етинільну або проп-1-інільну групу. 17 17' 4. Сполука загальної формули І за будь-яким з пунктів 1-3, в якій R і R являють собою атом водню та атом гідроксигрупи. 8 5. Сполука загальної формули І за будь-яким з пунктів 1-4, в якій R являє собою вінільну, 16 17 17' етинільну або проп-1-інільну групу, R являє собою атом фтору, R і R являють собою атом водню та атом гідроксигрупи. 17 17' 6. Сполука загальної формули І за будь-яким з пунктів 1-5, в якій R і R являють собою атом 18 19 18 19 водню та групу R -О- або R SO2-O-, де R і R у кожному випадку мають значення, які вказані 3 для R . 7. Естратриєни загальної формули І за пунктом 1 або 2, зокрема 8-вініл-16-фторестра-1,3,5(10)-триєн-3,17-діол, 8-вініл-16-фторестра-1,3,5(10)-триєн-3,17-діол. 8. Фармацевтична композиція, яка містить принаймні одну сполуку за будь-яким з пунктів 1-7, а також фармацевтично сумісний носій. 9. Сполука загальної формули І, як визначено в будь-якому з пунктів 1-7, для використання як лікарського засобу. 10. Застосування сполуки загальної формули І, як визначено в будь-якому з пунктів 1-7, для одержання фармацевтичного агента. 11. Сполука за пунктом 9 для лікування захворювань і станів, індукованих недостатністю естрогену, у жінок і у чоловіків. 12. Сполука за пунктом 9 для лікування пери- і постменопаузальних симптомів. 13. Сполука за пунктом 9 для in vitro лікування безплідності у жінок. 14. Сполука за пунктом 9 для in vivo лікування безплідності у жінок. 15. Сполука за пунктом 9 для терапії симптомів, індукованих недостатністю гормонів, при дисфункції яєчників, що викликана хірургічним втручанням, прийомом лікарських засобів і т. п. 16. Сполука за пунктом 9 для гормонозамісної терапії (ГЗТ). 14 UA 99918 C2 5 10 15 17. Сполука за пунктом 11 у комбінації із селективними модуляторами естрогенного рецептора (SERM), наприклад ралоксифеном. 18. Сполука за пунктом 9 для профілактики та терапії ревматоїдного артриту, розсіяного склерозу та вовчака. 19. Сполука за пунктом 9 для профілактики та терапії запальних захворювань кишечнику та, зокрема, хвороби Крона. 20. Сполука за пунктом 9 для профілактики та терапії запальних захворювань шкіри та, зокрема, псоріазу. 21. Сполука за пунктом 9 для профілактики та терапії серцево-судинних захворювань. 22. Сполука за пунктом 9 для профілактики та терапії артеріосклерозу, високого кров'яного тиску та гіпертензивної кардіопатії. 23. Сполука за пунктом 9 для запобігання та лікування гіперплазії передміхурової залози. 24. Сполука за пунктом 9 у комбінації з антиестрогенами та/або селективними модуляторами естрогенних рецепторів (SERM) для профілактики та терапії гіперплазії передміхурової залози. 25. Сполука за пунктом 9 для лікування захворювань імунної системи. 26. Сполука за пунктом 9 для лікування ендометріозу. 27. Сполука за пунктом 9 для лікування раку товстої та тонкої кишки. 28. Застосування сполук за пунктом 10 для нетерапевтичної стимуляції росту волосся. Комп‟ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 15
ДивитисяДодаткова інформація
Назва патенту англійською8-b-substituted estratrienes as selectively active estrogens
Автори англійськоюPeters, Olaf, Braeuer, Nico, Thieme, Ina, Prelle Katja, Muhn Hans-Peter, Fritzemeier Karl-Heinrich
Назва патенту російською8-бета-замещенные эстратриены как селективно активные эстрогены
Автори російськоюПетерс Олаф, Бройер Нико, Тиме Ина, Прелле Катя, Мун Ханс-Петер, Фритцемайер Карл-Хайнрих
МПК / Мітки
МПК: A61P 5/30, A61K 31/565, C07J 1/00
Мітки: 8-бета-заміщені, естрогени, селективної, естратриєни, активні
Код посилання
<a href="https://ua.patents.su/17-99918-8-beta-zamishheni-estratriehni-yak-selektivno-aktivni-estrogeni.html" target="_blank" rel="follow" title="База патентів України">8-бета-заміщені естратриєни як селективно активні естрогени</a>












