Похідні дипіридодіазепіну та їх гідрати, що мають біологічну активність, зокрема гальмівну дію на зворотну транскриптазу вірусу hiv-1
Номер патенту: 34420
Опубліковано: 15.03.2001
Автори: Енгель Вольфхард, Еберлайн Вольфганг, Харгрейв Карл, Труммлітц Гюнтер, Шмідт Гюнтер
Текст
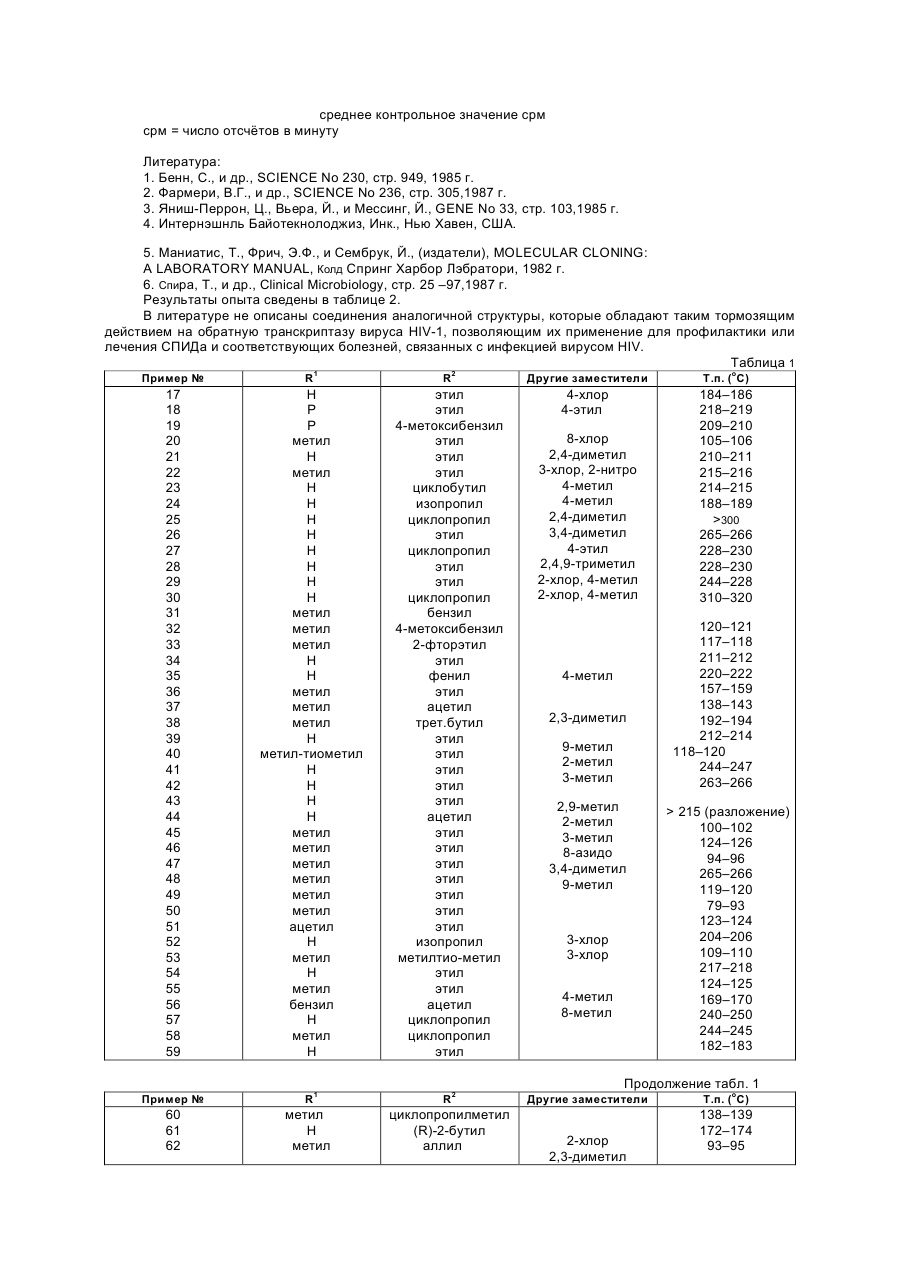
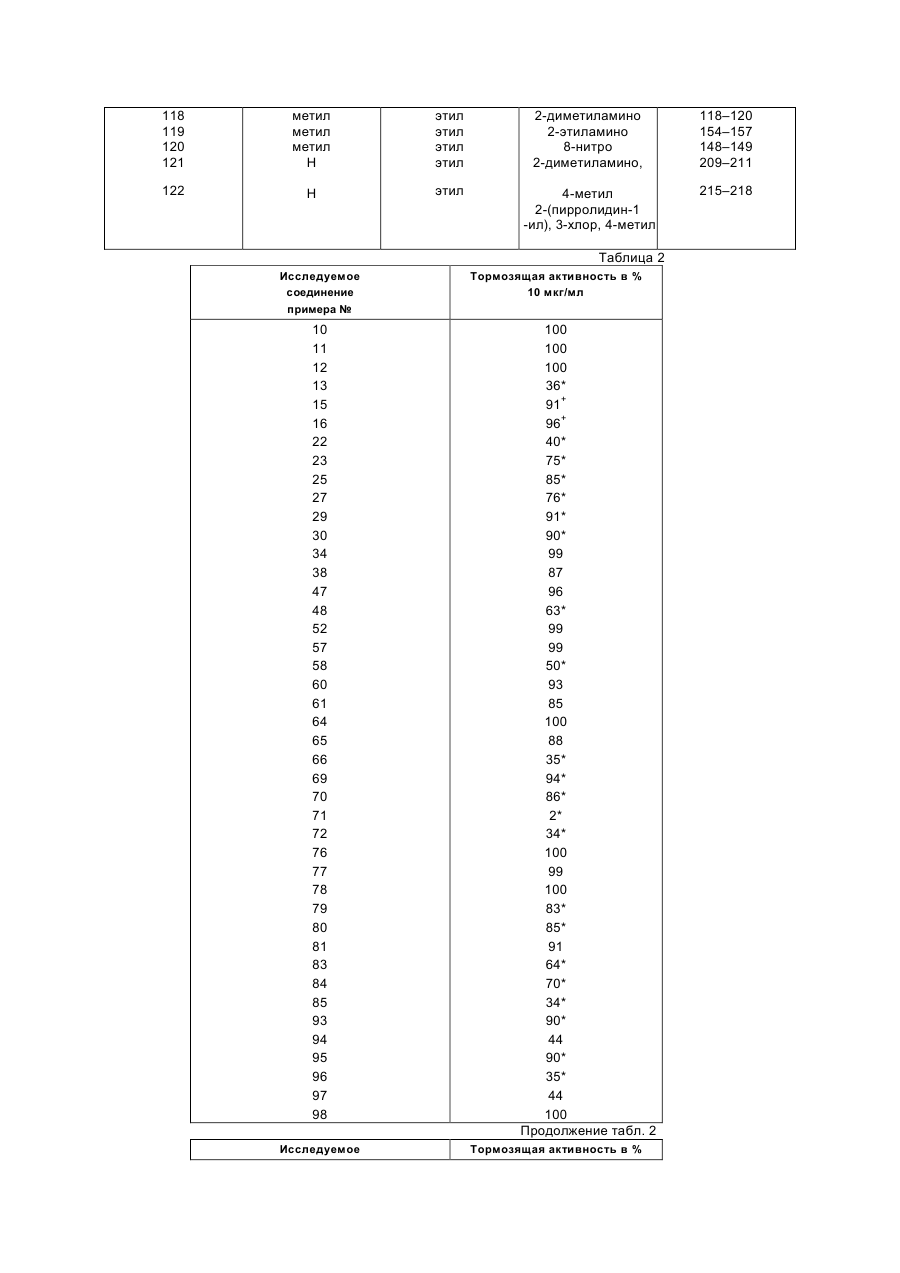
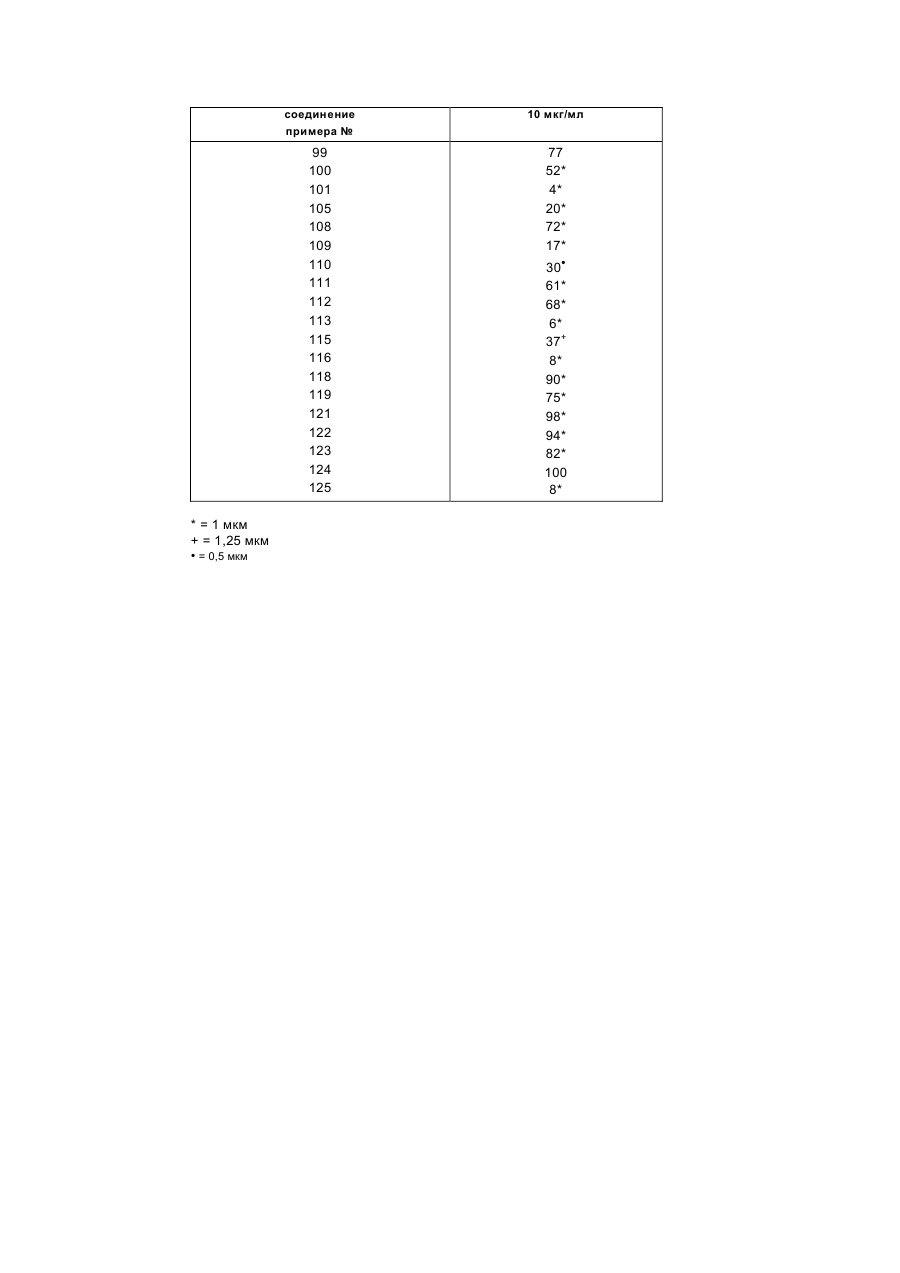
Изобретение относится к новым производным диазепина, в частности к производным дипиридо-диазепина и их гидратам, обладающим биологической активностью, в частности тормозящим действием на обратную транскриптазу вируса HIV-1. Известны производные конденсированного диазепинона, которые обладают биологической активностью, в частности представляют собой вагальный электростимулятор для лечения брадикардий и брадиаритмий (см. патент ЕР № 344 543, кл. С 07 D 471/04, С 07 D 471/14, 06.12.1989). Кроме того, известны производные конденсированного диазепинона, которые обладают биологической активностью, в частности, проявляющие ингибирующие язвы и секрецию желудочного сока свойства (см. патент ЕР № 312 895, кл. С 07 D 471/04, С 07 D 471/14, 26.04.1989). Задачей изобретения является расширение арсенала производных диазепина, обладающих биологической активностью. Поставленная задача решается предлагаемыми производными дипиридо-диазепина общей формулы (I) где Z - кислород, сера, группы NCN и =NOR9, где R9 означает низший алкил, при этом, если Z означает кислород, то R1 - водород, гидроксил, низший алкил, низший алкенил, низший алкенилоксикарбонил, низший алкоксил, низший алканоил, низший диалкиламиноэтил, низший алкоксиалкил, низший алкилтиоалкил, бензил, R2 - водород, низший алкил, низший фторалкил, низший циклоалкил, низший циклоалкилалкил, низший алкенил, низший алкинил, низший алкоксиалкил, низший алкилтиоалкил, низший алканоил, цианогруппа, фенил, бензил, низший алкоксибензил, метилсульфонил, R3 - водород, гидроксил, галоид, нитро, низший алкил, низший алкокси, амино, низший моно- или диалкиламино, низший алкениламино, пирролидин-1-ил, пирролин-1-ил, метоксибензилметиламино, метоксибензиламино, R4- водород, галоид, низший алкил, нитро, амино, R5 - водород, гидроксил, галоид, низший алкил, низший алкокси, тригалоидметил, низший оксиалкил, циано, R6- водород, гидроксил, низший алкил, R7 - водород, галоид, азидо, нитро, амино, низший алкил, R8 - водород, низший алкил, если Z означает серу, то R1 - водород или низший алкил, R2 - водород, низший алкил или низший циклоалкил, R3 - водород или низший алкил, R4- водород, R5 - водород или низший алкил, R6 - R8 - водород, каждый, или если Z означает группы NCN или =NOR9, то R1 - водород, R2 - водород или низший алкил, R3 - водород или низший алкил, R4- водород, R5 - водород или низший алкил, R6 - R8 - водород, каждый, и их гидратами. Производные дипиридо-диазепина соглaсно изобретению предназначены в частности, в качестве ингибитора обратной транскриптазы вируса HIV-1. Поэтому их можно использовать для профилактики или лечения СПИДа. Соединения общей формулы (I) можно получать способами-аналогами, например, по нижеследующим реакциям А - Ж. Реакция А. Циклизация соединения общей формулы (II) где R1 и R3 - R8 имеют вышеуказанные значения, R10 - означает атом галогена и R11 означает группу NHR12, в которой R12 имеет те же значения, что и R2, за исключением водорода, или R10 означает группу NHR12 и R11 означает атом водорода, или его соли щелочного металла, получаемой, в случае необходимости, in situ. Циклизацию можно осуществлять при температуре от 0°С до точки кипения реакционной смеси. Обычно реакцию проводят в среде инертного растворителя, напр., тетрагидрофурана, 1,4—диоксана, простого гликодиметилового эфира, простого диэтиленгликолдиметилового эфира, простого триэтиленгликолдиметилового эфира, диметилформамида, бензола или анизола. Циклизацию можно также осуществлять путём нагревания соединения общей формулы (II) в среде диполярного апротонного растворителя, предпочтительно сульфолана или диметилсульфона. Целесообразно добавить каталитическое количество сильной кислоты, напр., серной кислоты, хлористоводородной кислоты, бромистоводородной кислоты, фосфорной кислоты, полифосфорной кислоты, метансульфокислоты или р-толуолсульфокислоты. Обычно реакцию осуществляют при температуре 110 - 220°С. Соединение формулы (II) может содержать одну или несколько защитных групп, удаляемых после осуществления реакции. Реакция Б. Гидролиз соединения общей формулы (ІІІ) где R1 и R3 — R8 имеют вышеуказанные значения, а Аг означает незамещённый или замещённый арил. Гидролиз осуществляют с применением слабых до сильных кислот или Льюисовых кислот при температуре от –20°С до +150°С. Используют, напр., серную кислоту, метансульфокислоту, трифторуксусную кислоту, трифторметансульфокислоту, фосфорную кислоту или полифосфорную кислоту. При использовании фосфорной или полифосфорной кислоты целесообразно добавлять растворитель, напр., бензол, толуол, фенол, анизол или вератрол. В случае использования для удаления арилметила Льюисовой кислоты, например, хлорида или бромида алюминия, целесообразно добавлять растворитель, например, ароматические углеводороды как, например, бензол, толуол, анизол или их смесь с дихлорметаном. Соединение формулы (III) может содержать одну или несколько защитных групп, удаляемых после осуществления реакции. В случае необходимости получаемое путём гидролиза соединение можно подвергать алкилированию или ацилированию. Реакция В. Соединение общей формулы (IV) (IV), где R2 - R8 имеют вышеуказанные значения, или его соответствующее, получаемые, в случае необходимости, in situ 5-производное щелочного или щелочноземельного металла, подвергают взаимодействию с соединением общей формулы (V) R13X где R13 имеет те же самые значения что и R1, за исключением водорода, и (V), Х - радикал реакционноспособного сложного эфира, атом галогена, группа OSO2OR13, причём R13 имеет вышеуказанное значение, метансульфонилоксигруппа или этансульфонилоксигруппа или ароматическая сульфонилоксигруппа. В том случае, если соединение общей формулы (IV) используют как таковое, реакцию проводят в присутствии аминов, напр., триэтиламина, диазабициклоундецена или 4-(диметиламино)пиридина, или карбонатов или бикарбонатов щелочного металла, напр., карбоната натрия или калия или бикарбоната натрия. Перевод соединения общей формулы (IV) в соответствующую соль щелочного или щелочноземельного металла можно осуществлять путём взаимодействия соединения формулы (IV) с гидроокисью щелочного металла или щелочноземельного металла, напр., гидроокисью лития, гидроокисью бария, гидроокисью натрия или гидроокисью калия, с алкоголятом щелочного металла, напр., метанолатом натрия или трет.-бутанолатом калия, с амидом щелочного металла, напр., амидом натрия или калия, или с гидридом щелочного металла, напр., гидридом натрия или калия. Предпочтительно реакцию осуществляют при повышенной температуре и в среде пригодного органического растворителя. В том случае, если в качестве металлизирующего агента используют гидрид щелочного металла, то предпочтительно используют инертные органические растворители, напр., тетрагидрофуран или простой гликодиметиловый эфир, а если используют гидроокись щелочного или щелочноземельного металла, то можно также использовать водную смесь с органическим растворителем, напр., метанолом или тетрагидрофураном. Раствор или суспензию щелочного или щелочноземельного производного соединения общей формулы (IV) можно непосредственно, т.е., не выделив его, подвергать взаимодействию с соединением формулы (V), причём взаимодействие осуществляют при температуре -20°С или при повышенной температуре, до более низкой из точек кипения растворителя и реакционной среды. Замещение имеет место почти исключительно на атоме азота в положении 5-дигидродипиридодиазепинона, даже в том случае, если в исходном соединении формулы (IV) R2 означает водород, при том условии, что используют один эквивалент основания и один эквивалент соединения формулы (V). Реакция Г. Соединение общей формулы (VI) или (VII) или получаемое, в случае необходимости, in situ, где R1 и R3– R8 имеют вышеуказанные значения, и М означает щелочной металл или группу MgHal, причём Hal означает атом хлора, брома или йода, подвергают взаимодействию с соединением общей формулы (VIII) R2X (VIII), где R и X имеют вышеуказанные значения. Соединения формул (VI) и (VII) можно получать путём взаимодействия соединения формулы (I), в которой R2 означает водород, с алкилом лития, напр., н-бутилом лития или трет.-бутилом лития, в случае необходимости, в присутствии тетраметилэтилендиамина, диалкиламида лития (напр., диизопропиламида лития, дициклогексиламида лития или изопропилциклогексиламида лития), арила лития (напр., фенила лития), гидроокиси щелочного металла (напр., гидроокиси лития, натрия или калия), гидрида щелочного металла (напр., гидрида натрия или калия), амида щелочного металла (напр., амида натрия или калия) или реагента Гриньяра (напр., йодида метилмагния, бромида этилмагния или бромида фенилмагния). Требуется один эквивалент основания для получения соединения формулы (VI), в то время как требуются два эквивалента основания для получения соединения формулы (VII). Целесообразно металлизацию осуществляют в среде инертного органического растворителя, при температуре от –78°С до точки кипения соответствующей реакционной смеси. В том случае, если для металлизации используют алкил лития, арил лития, диалкиламид лития или реагент Гриньяра, то в качестве растворителя предпочтительно используют простой эфир, напр., тетрагидрофуран, простой диэтиловый эфир или диоксан, в случае необходимости в смеси с алифатическими или ароматическими углеводородами, напр., гексаном или бензолом, и реакцию можно осуществлять при температуре от –20°С до +80°С. В том случае, если металлизацию осуществляют с помощью гидрида или амида щелочного металла, то, кроме вышеназванных растворителей, можно использовать ксилен, толуол, ацетонитрил, диметилформамид или диметилсульфоксид, в то время как в том случае, если используют гидроокись щелочноземельного металла, также возможно использовать спирты, напр., этанол, метанол или алифатические кетоны, напр., ацетон, а также смесь упомянутых растворителей с водой. Раствор или суспензию щелочного соединения формулы (VI) или (VII) можно непосредственно, т.е., не выделив получаемое соединение, подвергать взаимодействию с соединением формулы (VIII), причём взаимодействие осуществляют при температуре от –20°С до точки кипения реакционной смеси, предпочтительно при комнатной температуре. Соединение формулы (VI) или (VII) может содержать одну или несколько защитных групп, удаляемых после осуществления реакции. Используемые для осуществления реакций А – Г исходные соединения известны из литературы, или их можно приобрести или получить путём известных из литературы реакций. Реакция Д. Соединение общей формулы (I), в которой Z означает кислород, подвергают взаимодействию с сульфирующим агентом, напр., 2,4-бис-(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом, бис(трициклогексилолово)сульфидом, бис(три-п-бутилолово)сульфидом, бис(трифенилолово)сульфидом, бис(триметилсилил)сульфидом или фосфорным пентасульфидом. Реакцию осуществляют в среде инертного органического растворителя, напр., дисульфида углерода, бензола или толуола, при комнатной температуре или при более высокой температуре, предпочтительно при повышенной температуре до точки кипения реакционной смеси, и предпочтительно в безводной среде. В том случае, если используют вышеуказанные сульфиды олова или силила, то предпочтительно осернение осуществляют в присутствии Льюисовой кислоты, напр., трихлорида бора. Само собой разумеется, что при наличии другой карбонильной группы в соединении формулы (I), напр., соединения, в которой Z означает кислород, требуется защита кетонкарбонила подходящей группой до проведения сульфирования, причём путём удаления защитной группы после проведения реакции получают желаемое соединение. Аналогичным образом, в том случае, если R2 означает, напр., низший алканоил, необходимо, чтобы сульфирование было осуществлено до ацилирования азота, находящегося в позиции 11. Реакция Е. Соединение формулы (IX) в которой R2–R8 имеют вышеуказанные значения, подвергают взаимодействию с цианамидом. Реакцию осуществляют в присутствии основания, напр., карбоната калия, карбоната натрия, триэтиламина или диизопропилэтиламина, в среде инертного растворителя, напр., метиленхлорида, 1,4–диоксана, тетрагидрофурана, простого диэтилового эфира, хлороформа или диметилформамида, при температуре от 0°С до точки кипения реакционной смеси. Реакция Ж. Соединение вышеуказанной формулы (IX), в которой R2 до R8 имеют вышеуказанные значения, подвергают взаимодействию с пригодным алкоксиламином (0-алкил-гидроксиламином) или его солью (напр., хлоргидратом метоксиламина). Реакцию осуществляют в аналогичных реакции Е условиях. Соединения формулы (I) можно известным образом переводить в их нетоксичные, фармакологически переносимые кислотно-аддитивные соли, напр., путём растворения соединения формулы (I) в пригодном растворителе и окисления раствора одним или больше мольных эквивалентов желаемой кислоты. В качестве неорганических и органических кислот, с помощью которых соединение формулы (I) можно переводить в нетоксичные фармакологически переносимые кислотно-аддитивные соли, можно назвать следующие: хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту, метансульфокислоту и т.д. Соединения формулы (I) обычно образуют кислотно-аддитивные соли с одним мольным эквивалентом кислоты. Получение производных дипиридо-диазепина общей формулы (I) поясняется следующими примерами. Пример 1. 5,11-дигидро-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он а)2-хлор-N-(2-хлор-3-пиридинил)-3-пириди-нкарбоксамид В трёхгорлую круглодонную колбу с обратным холодильником, механической мешалкой и капельной воронкой подают 215 г (1,672 моль) 3амино-2-хлорпиридина, растворённого в смеси 400 мл диоксана, 500 мл циклогексана и 130 мл пиридина. Добавляют раствор 299,2 г (1,7 моль) свежеполученного хлорангидрида 2-хлор-3-пиридинкарбоновой кис лоты в 200 мл диоксана со скоростью, позволяющей контролировать интенсивную реакцию. Затем реакционной смеси дают охлаждаться до комнатной температуры, и кристаллический осадок фильтруют и промывают сперва циклогексаном и затем простым эфиром. Тёмно-коричневое соединение растворяют в 5 л 3 %-ного водного раствора гидроокиси натрия. Полученный раствор обрабатывают животным углем, фильтруют отсасыванием, и фильтрат подкисляют добавлением 50 %-ной водной уксусной кислоты. Осадок собирают фильтрацией и тщательно промывают водой. После сушки в потоке азота при комнатной температуре в течение ночи получают почти бесцветное соединение с точкой плавления 156 – 159°С, достаточно чистое для использования на следующей стадии. Выход: 376,0 г (84 % теории). б) N-(2-хлор-3-пиридинил)-2-[[(4-метоксифе-нил)метил]амино]-3-пиридинкарбоксамид 13,4 г (0,05 моль) полученного на стадии а) соединения растворяют в 20 мл ксилена, и к полученному раствору добавляют 13,8 г (0,1 моль) р-метоксибензиламина. Затем полученную смесь нагревают с обратным холодильником в течение 2 ч. Реакционную смесь упаривают в вакууме, остаток очищают путём хроматографии на наполненной силикагелем (величина зёрен 0,2 – 0,5 мм) колонке с использованием в качестве элюента смеси дихлорметана и этилацетата в объёмном соотношении 10 : 1. После сгущения и перекристаллизации из ацетонитрила получают 17,2 г (93 % теории) бесцветных кристаллов с точкой плавления 122 — 124°С. в) 5,11-дигидро-11-[(4-метоксифенил)метил]-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он 16,7 г (0,0453 моль) полученного на предыдущей стадии соединения растворяют в 150 мл абсолютного диоксана, и к полученному раствору добавляют 6,7 г (0,14 моль) 50 %-ной дисперсии гидрида натрия в минеральном масле. Затем смесь в потоке азота нагревают с обратным холодильником до того, пока тонкослойной хроматографией больше не обнаруживают исходного соединения. Избыточный гидрид натрия разлагают осторожным добавлением 10 мл смеси метанола и тетрагидрофурана в объёмном соотношении 50 : 50. Реакционную смесь нейтрализуют добавлением уксусной кислоты, затем упаривают в вакууме. Остаток очищают путём хроматографии на наполненной силикагелем (величина зёрен 0,2 – 0,5 мм) колонке, используя в качестве элюента сперва смесь дихлорметана и этилацетата в объёмном соотношении 10 : 1 и затем смесь дихлорметана и этилацетата в объёмном соотношении 1:1. Соответствующие фракции упаривают, в результате чего получают кристаллическое соединение, которое перекристаллизовывают из ацетонитрила и 2-пропанола. Получают 10,3 г (68 % теории) 5,11-дигидро-11-[(4-метоксифенил)ме-тил]-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она с точкой плавления 213 – 215°С. г) 5, 11-ди гидp о-6Н -ди п ири д о[ 3, 2-b: 2'3' - е][1,4]диазепин-6-он 10,0 г (0,3 моль) полученного на стадии в) соединения растворяют в 50 мл трифторуксусной кислоты, причём смесь слегка нагревается. Затем реакционную смесь перемешивают при температуре 60°С в течение часа. После этого с помощью тонкослойной хроматографии больше не обнаруживают исходного соединения. Смесь упаривают в вакууме, и к остатку добавляют 0,5 %-ный водный аммиак, тщательно перемешивают, и фильтруют путём отсасывания. Сырое соединение перекристаллизовывают из 150 мл диметилсульфоксида, и получают 4,8 г (75 % теории) 5,11-дигидро-6Н-дипиридо[3,2-b:2',3'-e][1,4]диазепин-6oна в виде бесцветных кристаллов с точкой плавления выше 340°С. Пример 2. 5,11-дигидро-11-пропил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он а) N-(2-хлор-3-пиридинил)-2-(пропиламино)-3-пиридинкарбоксамид 26,8 г (0,1 моль) 2-хлор-N-(2-хлор-3-пиридинил)-3-пиридинкарбоксамида растворяют в 200 мл диоксана. К полученному раствору добавляют 21,4 г (0, 362 моль) пропиламида. Затем смесь при температуре 150°С в течение 6 часов размешивают в автоклаве из нержавеющей стали. Реакционную смесь упаривают в вакууме, остаток очищают путём хроматографии на наполненной силикагелем колонке, с использованием в качестве элюента сперва смеси дихлорметана и этилацетата в объёмном соотношении 10 : 1, а затем смеси дихлорметана, циклогексана и этилацетата в объёмном соотношении 1:2:1. Путём упаривания получают высоковязкую смолу, пригодную для использования на следующей стадии. б) 5,11-дигидро-11-пропил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он Согласно описанному в примере 1в) методу из полученного на предыдущей стадии продукта и гидрида натрия в результате перекристаллизации из ацетонитрила получают 5,11-дигидро-11-пропил-6Н-дипиридо[3,2b:2',3'-е][1,4]диазепин-6-он с точкой плавления 184 — 186°С. Выход: 74 % теории. Пример 3. 5,11-дигидро-5-метил-11-пропил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он а) 2-хлоp-N-(2-хлор-3-пиридинил)-N-метил-3-пиридинкарбоксамид В четырёхгорлую круглодонную колбу с обратным холодильником, механической мешалкой, термометром и капельной воронкой подают 268,1 г (1,0 моль) 2-хлор-N-(2-хлор-3-пиридинил)-3-пиридинкарбоксамида, 260 мл 50 %-ного водного раствора гидроокиси натрия, 1500 мл толуола и 8,0 г (0,0352 моль) хлорида бензилтриэтиламмония. При перемешивании в течение примерно 3 ч каплями добавляют раствор 134 мл (178,5 г, 1,415 моль) диметилсульфата в 1 л толуола, причём температура повышается до 50 — 60 о С. По окончании добавления диметилсульфата продолжают перемешивать при температуре 60 оС в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры, и добавляют 1 л воды. Слои разделяют, водную фазу трижды экстрагируют 300 мл толуолом. Органические слои объединяют и промывают сперва 300 мл водой, затем 300 мл 1 %-ной водной уксусной кислотой и в конце 300 мл водой. Объединённые органические экстракты сушат над сульфатом натрия, и растворитель удаляют путём перегонки при повышенном давлении. Остаток очищают путём хроматографии на наполненной силикагелем (величина зёрен 0,2 - 0,5 мм) колонке, с использованием в качестве элюента сперва толуола и затем смеси этила цетата, циклогексана и тетрагидрофурана в объёмном соотношении 1: 9 : 10. Полученный путём упаривания соответствующих фракций продукт перекристаллизовывают из смеси ацетонитрила и простого метил-трет.бутилового эфира в объёмном соотношении 1:1. Получают 232,5 г (82,5 % теории) 2хлор-N-(2-хлор-3-пиридинил)-N-метил-3-пиридинкарбоксамида с точкой плавления 98 – 101°С, хорошо растворимого в дихлорметане. б) N-(2-xлop-3-пиридинил)-N-метил-2-(пропиламинo)-3-пиридинкарбоксамид Согласно аналогичному примеру 2а) методу из полученного на предыдущей стадии продукта и пропиламина получают N-(2-хлор-3-пиридинил)-N-метил-2-(пропиламино)-3-пиридинкарбоксамид. Выход: 91 % теории. в) 5,11-дигидро-5-метил-11-пропил-6Н-дипиридо[3,2-b:2'3'-е][1,4]диазепин-6-он Согласно аналогичному примеру 1в) методу, однако, используя в качестве растворителя тетрагидрофуран вместо диоксан и лишь эквимолекулярные количества гидрида натрия, из полученного на предыдущей стадии продукта получают 5,11-дигидро-5-метил-11-пропил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6он в виде высоковязкого масла. Выход: 75 % теории. Пример 4. 5,11-диэтил-5,11-дигидро-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он 6,4 г (0,03 моль) 5,11-дигидро-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она растворяют в 100 мл абсолютного диметилформамида. К полученному раствору добавляют 3,4 г (0,071 моль) 50 %-ной дисперсии гидрида натрия в минеральном масле. В атмосфере азота смесь размешивают при температуре 50 — 70°С в течение часа. По окончании выделения водорода смесь охлаждают до 30°С, и в течение 15 минут каплями добавляют 10,9 г (0,07 моль) йодистого этила. Затем для завершения экзотермической реакции реакционную смесь нагревают при температуре 80 — 90°С в течение часа. Растворитель удаляют путём перегонки при пониженном давлении. К остатку добавляют воду, и полученную суспензию исчерпывающе экстрагируют дихлорметаном. Полученное в результате обычной обработки соединение перекристаллизовывают из 150 мл изооктана. Получают 5,7 г (71 % теории) 5,11-диэтил-5,11-дигидро-6Н-дипиридо[3,2b:2',3'-е][1,4]диазе-пин-6-она с точкой плавления 102 — 103°С. Пример 5. 5,11-дигидро-5-этил-6Н-дипиридо [3,2-b:2',3'-е][1,4]диазепин-6-он а) N-(2-хлор-3-пиридинил)-2-[(фенилметил) амино]-3-пиридинкарбоксамид Аналогично примеру 1б), однако, используя в качестве растворителя простой диэтиленгликолдиметиловый эфир вместо ксилена, путем перекристаллизации из простого диэтиленгликолдиметилового эфира из 2-хлор-N-(2-хлор-3-пириди-нил)-3-пиридинкарбоксамида и бензиламина получают N-(2-хлор-3-пиридинил)-2-[(фенилметил)амино]-3-пиридинкарбоксамид с точкой плавления 95 - 97°С. Выход: 72 % теории. б) 5,11-дигидро-11-(фенилметил)-6Н-дипи-ридо[3,2-b:2',3'-е][1,4]диазепин-6-он Аналогично примеру 1в), однако, используя в качестве растворителя простой диэтиленгликолдиметиловый эфир вместо диоксана, путём перекристаллизации из 1-пропанола из полученного на предыдущей стадии а) соединения и гидрида натрия получают 5,11-дигидро-11-(фенилметил)-6Н-дипиридо[3,2-b:2'3'е][1,4]диазепин-6-он с точкой плавления 212 — 213°С. Выход: 61 % теории. в) 5,11-дигидро-5-этил-11-(фенилметил)-6Н-дипиридо[3,2-b:2', 3'-e][1,4]диазепин-6-он Аналогично примеру За) после перекристаллизации из смеси толуола и ацетонитрила в объёмном соотношении 1 : 1 и смеси дихлорметана и метанола в объёмном соотношении 99 : 1 из полученного на предыдущей стадии б) соединения и диэтилсульфата получают 5,11-дигидpo-5-этил-11-(фенилмeтил)-6Hдипиpидo[3,2-b:2',3'-е][1,4]диазепин-6-он с точкой плавления 209 — 211°С. Выход: 82 % теории. г) 5,11-дигидро-5-этил-6Н-дипиридо[3,2b:2',3'-е][1,4]диазепин-6-он Аналогично примеру 1г), однако, используя автоклав вместо открытый реактор и нагревая реакционную смесь при температуре 120°С в течение 10 ч, путём перекристаллизации из смеси изооктана и этилацетата в объёмном соотношении 1 : 1 из полученного на предыдущей стадии в) соединения получают 5,11дигидро-5-этил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он с точкой плавления 161 — 163°С. Выход: 57 % теории. Пример 6. 5,11-дигидрo-5-метил-6Н-дипиридо[3,2-b:2', 3'-е][1,4]диазепин-6-он a) N-(2-хлор-3-пиридинил)-N-метил-2-[(фенилметил)амино]-3-пиридинкарбоксамид Аналогично примеру 1б) после перекристаллизации из простого метил-трет.бутилового эфира и смеси дихлорметана и этилацетата в объёмном соотношении 3 : 1 из 2-xлop-N-(2-хлор-3-пиридинил)-N-метил-3-пиридинкарбоксамида и бензиламина получают N-(2-хлор-3-пиридинил)-N-метил-2-[(фенилметил)амино]-3-пиридинкарбоксамид с точкой плавления 114 — 116°С. Выход: 87 % теории. б) 5,11-дигидро-5-метил-11-(фенилметил)-6Н-дипиридо[3,2-b:2', 3'-е][1,4]диазепин-6-он Аналогично примеру 3б) после перекристаллизации из ацетонитрила из полученного на предыдущей стадии а) соединения получают 5,11-дигидро-5-метил-11-(фенилметил)-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он с точкой плавления 198 -199°С. Выход: 80 % теории. в) 5,11-дигидро-5-метил-6Н-дипиридо[3,2-b:2',3'-e][1,4] диазепин-6-он Смесь 75,5 г (0,239 моль) полученного на предыдущей стадии б) соединения, 2,5 кг полифосфорной кислоты и 425 мл анизола перемешивают при температуре 140 —160°С в течение 2 ч. Горячую смесь при размешивании подают на измельченный лёд. Затем реакционную смесь слегка подщелачивают добавлением водного аммиа ка, и исчерпывающе экстрагируют дихлорметаном. Объединённые органические слои сушат над сульфатом натрия и упаривают в вакууме. Остаток подвергают хроматографии на силикагеле с использованием в качестве элюента смеси дихлорметана и этилацетата в объёмном соотношении 1 : 1. Полученный упариванием соответствующих фракций продукт перекристаллизовывают из ацетонитрила, и получают 21,6 г (40 % теории) бесцветных кристаллов с точкой плавления 236 — 237°С. Пример 7. 5,11-дигидро-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он 3,8 г (0,0126 моль) полученного согласно примеру 5б) продукта растворяют в 20 мл трифторуксусной кислоты, причём смесь немного нагревается. Затем реакционную смесь нагревают с обратным холодильником в течение 8 ч. После этого путём тонкослойной хроматографии больше не обнаруживают исходного соединения. Смесь упаривают в вакууме, полученный остаток тщательно перемешивают с 0,5 %-ным водным аммиаком, а затем фильтруют отсасыванием. Сырой продукт суспендируют в 20 мл ацетонитрила, нагревают с обратным холодильником в течение 15 минут, и затем в горячем состоянии фильтруют отсасыванием. Фильтровальный осадок перекристаллизовывают из горячего диметилсульфоксида, и получают 1,2 г (45 % теории) бесцветных кристаллов с точкой плавления выше 340°С, идентичных с целевым продуктом примера 1г). Пример 8. 5,11-дигидро-11-этил-5-мeтил-6H-дипиpидo [3,2-b:2',3'-е][1,4]диазепин-6-он а) 2-хлор-N-(2-хлор-3-пиридинил)-3-пириди-нкарбоксамид Аналогично примеру 1а) получают 2-хлор-N-(2-хлор-3-пиридинил)-N-метил-3-пиридинкарбоксамид. Очищенный продукт получают путём охлаждения реакционной смеси до комнатной температуры и декантирования надосадочной жидкости от осадка. Твёрдое вещество растворяют в метиленхлориде, раствор промывают водой, сушат над безводным сульфатом натрия, и растворитель удаляют в вакууме. Твёрдое вещество затем промывают этилацетатом и сушат, в результате чего получают 7,24 г (84 % теории) соединения, пригодного для использования на следующей стадии. б) N-(2-хлор-3-пиридинил)-2-[[(4-метоксифе-нил)метил]амино]-3-пиридинкарбоксамид Аналогично примеру 1б) получают N-(2хлор-3-пиридинил)-2-[[(4-метоксифенил)метил]амино]-3-пиридинкарбоксамид. Очищенный продукт получают путём удаления растворителя в вакууме, добавления воды к остатку, и экстракции метиленхлоридом. Полученный раствор сушат над безводным сульфатом натрия, растворитель удаляют, в результате чего получают коричневое масло, которое обрабатывают 10 мл простого эфира. Полученное в виде кристаллов соединение фильтруют и промывают сперва простым эфиром и затем гексаном. Получают 78,0 г (91 % теории) целевого продукта в виде беловатого порошка с точкой плавления 121 – 122°С. в) 5,11-дигидро-11-[(4-метоксифенил)метил]-6Н-дипиридо[3,2-b:2', 3'-е][1,4]диазепин-6-он К раствору 3,69 г (0,010 моль) N-(2-хлор-3-пиридинил)-2-[[(4-метоксифенил)метил]амино]-3-пиридинкарбоксамида в 100 мл диметилформамида добавляют 1,44 г 50 %-ной дисперсии гидрида натрия в минеральном масле. По окончании выделения водорода смесь нагревают при температуре 110°С в течение 16 ч, затем нагревают с обратным холодильником в течение 8 ч. После охлаждения смеси избыточный гидрид натрия разлагают медленным добавлением льда. Затем смесь разбавляют водой, экстрагируют простым эфиром и сгущают. Кристаллизовавшийся остаток фильтруют и промывают простым эфиром, и получают 1,60 г (50 % теории) 5,11-дигидро-11-[(4-метоксифенил)метил]-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она в виде беловатого порошка с точкой плавления 209 – 210°С. г) 5,11-дигидро-11-[(4-метоксифенил)метил]-5-метил-6Н-дипиридо[3,2-b:2',3'-е] [1,4]диазепин-6-он 10,0 г (0,030 моль) 5,11-дигидро-11-[(4-метоксифенил)метил]-6Н-дипиридо[3,2-b:-2',3'-е][1,4]диазепин-6-она подают в колбу, содержащую 2,16 г 50 %-ной дисперсии гидрида натрия в минеральном масле и 100 мл диметилформамида. Полученную смесь размешивают при комнатной температуре в течение 30 минут, затем в течение 30 минут нагревают при температуре 50°С. После охлаждения каплями добавляют 8,51 г (0,060 моль) йодистого метила в 10 мл диметилформамида, и реакционную смесь перемешивают при комнатной температуре в течение ночи. Избыточный гидрид натрия разлагают осторожным добавлением льда. Затем добавляют воду, экстрагируют простым эфиром, сушат над безводным сульфатом натрия и сгущают. Получают 10,3 г (99 % теории) 5,11-дигидро-11-[(4-метоксифенил)метил]-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она в виде желтоватого масла, пригодного для использования на следующей стадии. д) 5,11-дигидро-5-метил-6Н-дипиридо[3,2-b:2'3'][1,4]диазепин-6-он К 10,3 г (0,030 моль) 5,11-дигидро-11-[(4-метоксифенил)метил]-5-метил-6Н-дипиридо[3,2-b:2',3'е][1,4]диазепин-6-она добавляют 50 мл трифторуксусной кислоты, и полученную смесь размешивают при комнатной температуре в течение часа. Кислоту удаляют в вакууме, и остаток в течение часа перемешивают с 0,5 % аммония. Твёрдое вещество фильтруют и сушат, и получают 6,70 г (98 % теории) чистого 5,11-дигидро-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она с точкой плавления 230 – 232°С. е) 5,11-дигидро-11-этил-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1.4]диазепин-6-он К раствору 5,75 г (0,025 моль) 5,11-дигидро-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она в 100 мл диметилформамида добавляют 2,00 г 50 %-ной дисперсии гидрида натрия в минеральном масле. По окончании выделения водорода смесь нагревают при температуре 50°С в течение 30 минут, затем охлаждают до комнатной температуры. После этого в течение 15 минут каплями добавляют 7,80 г чистого йодистого этила, и полученную смесь перемешивают при комнатной температуре в течение ночи. Избыточный гидрид натрия разлагают осторожным добавлением льда и затем воды. Экстрагируют простым эфиром, сушат над безводным сульфатом натрия и упаривают. Получают 4,5 г (70 % теории) 5,11-дигидро-11-этил-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она с точкой плавления 130 – 132°С. Пример 9. 5,11-дигидро-11-этил-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-тион Смесь 2,66 г (0,01 моль) 5,11-дигидро-11этил-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазе-пин-6-она и 2,1 г (0,005 моль) реагента Лавессона (2,4 бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфида) в 50 мл толуoла нагревают с обратным холодильником в течение 2,5 ч. Затем растворитель упаривают в вакууме, и к остатку добавляют воду. Экстрагируют этилацетатом, сушат над безводным сульфатом натрия и сгущают в вакууме. Очищают путём хроматографии на наполненной силикагелем колонке с использованием в качестве элюента сперва метиленхлорида, затем смеси этилацетата и гексана в соотношении 1 : 4. Путём удаления растворителя в вакууме получают 2,20 г (74 % теории) 5,11-дигидро-11-этил-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-тиона в виде жёлтого порошка, который перекристаллизовывают из 10 %-ной смеси гексана и этилацетата. Получают 1,1 г целевого продукта в виде жёлтых иголoк с точкой плавления 157 – 158°С. Пример 10. 5,11-дигидро-11-этил-2-метил-4-трифторметил-6Н-дипиридо[3,2-b:2',3'-е][1,4]-диазепин-6-он а) 3-циано-2-гидрокси-6-метил-4-(трифторметил)пиридин Раствор 14,0 г цианоацетамида в 80 мл этанола нагревают до 50°С, затем добавляют 14 г пиперидина и 25 г трифторацетилацетона. Полученную смесь перемешивают при температуре 70°С в течение 30 минут, затем размешивают при комнатной температуре в течение ночи. Смесь сгущают в вакууме и разбавляют 100 мл воды. При перемешивании осторожно добавляют 15 мл концентрированной хлористоводородной кислоты, и по истечении 15 минут осадок фильтруют и сушат в вакууме в течение ночи. Получают 27,8 г желаемого цианопиридина. б) 3-аминокарбонил-2-хлор-6-метил-4-(три-фторметил)пиридин Смесь 35 мл фосфористого оксихлорида и 9,8 г полученного на предыдущей стадии цианопиридина нагревают с обратным холодильником в течение 5 ч. К охлаждённой смеси осторожно добавляют 400 мл ледяной воды. Экстрагируют метиленхлоридом, промывают насыщенным бикарбонатом натрия и сушат над безводным сульфатом магния. Фильтруют и сгущают в вакууме, затем сырое хлорсоединение растворяют в 50 мл концентрированной серной кислоты, и нагревают при температуре 140°С в течение 20 минут. Охлаждённую смесь осторожно выливают на 600 мл льда, осадок фильтруют, промывают ледяной водой и сушат, в результате чего получают 7,6 г желаемого амида. Фильтрат экстрагируют 200 мл этилацетата, сушат над сульфатом магния, фильтруют и сгущают, в результате чего получают ещё 1,7 г желаемого продукта. в) 3-амино-2-хлор-6-метил-4-(трифторметил)пиридин К раствору 6,6 г гидроокиси натрия в 60 мл воды при температуре 5°С добавляют 9,3 г брома. При получении прозрачного раствора быстро добавляют 9,2 г 3-аминокарбонил-2-хлор-6-метил-4-(трифторметил)пиридина, причём температуру держат ниже 5°С. Полученную смесь размешивают до растворения 3(аминокарбонил)пиридина (менее 30 минут). Затем смесь нагревают при температуре 75°С в течение 30 минут. После охлаждения до комнатной температуры 3-аминопиридинсоединение экстрагируют этилацетатом, сушат над сульфатом магния, фильтруют и упаривают. Получают 4,9 г желаемого соединения. г) 2-хлор-N-(2-хлор-6-метил-4-трифторметил-3-пиридинил)-3-пиридин-карбоксамид К охлаждённому при температуре -78°С раствору 2,1 г 3-амино-2-хлор-6-метил-4-(трифторметил)пиридина в 10 мл тетрагидрофурана в течение 3 минут каплями добавляют 7 мл 1,5 молярного раствора диизопропиламина лития в циклогексане. Смесь размешивают в течение 5 минут, затем в течение 1 минуты добавляют 0,9 г 2-хлорникотионилхлорида в 3 мл тетрагидрофурана. По истечении 5 минут ещё раз добавляют 3 мл раствора диизопропиламина лития и 0,5 г кислого хлорида в 1 мл тетрагидрофурана. Полученную смесь размешивают в течение 10 минут, затем добавляют 100 мл воды. Разделяют 30 мл этилацетатом, затем органическую фазу экстрагируют водой, и объединённые водные фазы экстрагируют метиленхлоридом, сушат над сульфатом магния, фильтруют и упаривают, в результате чего получают сырое соединение, которое промывают небольшим количеством этилацетата и сушат, и получают 1,3 г желаемого соединения. д) N-( 2-хлор-6-метил-4-трифторметил-3-пиридинил)-2-этиламино-3-пиридинкарбоксамид К суспензии 1,3 г 2-хлор-N-(2-хлор-6-метил-4-трифторметил-3-пиридинил)-3-пиридинкарбоксамида в 5 мл ксилола добавляют 0,4 г этиламина. Полученную смесь нагревают в камере под давлением при температуре 160°С в течение 30 минут. Охлаждённую смесь разбавляют этилацетатом, промывают, сушат и сгущают. В результате хроматографии на наполненной силикагелем колонке с использованием в качестве элюента смеси этилацетата и гексана в соотношении 1:1 получают 0,5 г желаемого соединения. е) 5,11-дигидро-11-этил-2-метил-4-трифторметил-6Н-дипиридо[3,2-b:2',3'-е][1,4]- диазепин-6-он Раствор 0,5 г N-(2-xлop-6-мeтил-4-тpиф-тopмeтил-3-пиpидинил)-2-этилaминo-3-пиридинкарбоксамида в 3 мл пиридина добавляют к 0,2 г 50 %-ной дисперсии гидрида натрия в масле. Смесь нагревают до температуры 150°С, затем охлаждают и сгущают в вакууме. Затем к остатку добавляют воду, экстрагируют этилацетатом, сушат над сульфатом магния, фильтруют и сгущают. Полученное соединение очищают путём хроматографии на наполненной силикагелем колонке с использованием в качестве элюента сперва метиленхлорида и затем смеси метиленхлорида и метанола. После сгущения в вакууме остаток перекристаллизовывают из гексанола, и получают 0,09 г целевого соединения с точкой плавления 150 – 151°С. Пример 11. 5,11-дигидро-11-этил-4-метил-6Н-дипиридо[3,2-b:2',3'-е] [1,4]-диазепин-6-он а) 2-хлор-4-метил-3-нитропиридин Смесь 25 г 2-гидрокси-4-метил-3-нитропиридина, 12,5 г пентахлорида фосфора и 62 мл хлорокиси фосфора нагревают с обратным холодильником в течение 2 ч. После охлаждения смесь выливают на измельченный лёд до образования осадка. Экстрагируют метиленхлоридом, сушат над сульфатом натрия и сгущают, в результате чего получают коричневое масло, которое промывают горячим гексаном. Путём сгущения в вакууме получают 16,2 г желаемого соединения с точкой плавления 45 - 47°С. б) 3-амино-2-хлор-4-метилпиридин 16,2 г 2-хлор-4-метил-3-нитропиридина добавляют к 470 мл уксусной кислоты, и полученную смесь размешивают при комнатной температуре в течение 15 минут. Добавляют раствор 160 г дигидрата хлорида олова в 200 мл концентрированной хлористоводородной кислоты, и полученную смесь перемешивают при комнатной температуре в течение ночи. Смесь затем разбавляют водой до 1 л, и при охлаждении медленно добавляют10N гидроокиси натрия до растворения гидрохлорида олова, имеющегося в виде белого осадка. Экстрагируют метиленхлоридом, сушат над сульфатом натрия и сгущают, в результате чего получают 12,8 г почти чистого 3-амино-2-хлор-4-метилпиридина в виде жёлтого масла, которое твердеет, когда оставляют стоять, и которое можно использовать на следующей стадии. в) 2-хлop-N-(2-хлор-4-метил-3-пиридинил)-3-пиридинкарбоксамид Аналогично примеру 1a) карбоксамид получают из 12,8 г 3-амино-2-хлор-4-метилпиридина, 15,8 г 2-хлорникотионилхлорида, 7,1 г пиридина, 30 мл циклогексана и 60 мл диоксана. После удаления растворителя продукт растворяют в метиленхлориде, промывают водой и сушат над сульфатом натрия. Опять удаляют растворитель, остаток промывают этилацетатом, и получают 1,2 г желаемого соединения с точкой плавления 193 — 194°С. г) N-( 2-хлор-4-метил-3-пиридинил)-2-этиламино-3-пиридинкарбоксамид К суспензии 21,0 г 2-хлор-N-(2-хлор-4-метил-3-пиридинил)-3-пиридинкарбоксамида в 150 мл ксилола в стальном автоклаве добавляют 12,7 г этиламина. Смесь в масляной ванне нагревают при температуре 165°С в течение 6 ч, затем размешивают при комнатной температуре в течение ночи. Растворитель удаляют в вакууме, и к остатку добавляют воду. Экстрагируют простым эфиром, сушат над сульфатом натрия и сгущают, и полученное в результате этого масло растворяют в этилацетате и затем в гексане, причём образуется осадок. Твёрдое вещество фильтруют и сушат, и получают 16,5 г желаемого соединения с точкой плавления 122 — 124°С. д) 5,11-дигидpo-11-этил-4-мeтил-6H-дипиpи-дo[3,2-b:2',3'-e][1,4]-диазепин-6-он К раствору 16,0 г полученного на предыдущей стадии N-(2-хлор-4-метил-3-пиридинил)-2этиламино-3-пиридинкарбоксамида в 200 мл диметилформамида добавляют 7,9 г 50 %-ной суспензии гидрида натрия, и перемешивают в течение 30 минут. Затем смесь нагревают с обратным холодильником в течение 2 ч, охлаждают и осторожно обрабатывают измельченным льдом. Растворитель удаляют в вакууме, и к остатку добавляют воду. Экстрагируют простым эфиром, сушат над сульфатом натрия и сгущают. Остаток кипятят со смесью этилацетата и циклогексана в соотношении 1:1 и фильтруют, в результате чего получают 4,1 г почти чистого соединения. 2,0 г данного соединения дальше очищают путём перекристаллизации из дихлорэтана, и получают 1,0 г чистого 5,11-дигидро-11-этил-4-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она с точкой плавления 212 — 214°С. Пример 12. 11-циклопропил-5,11-дигидро-4-метил-6Н -дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он Аналогично примеру 11, однако, используя циклопропиламин вместо этиламина, получают целевое соединение, имеющее точку плавления 247 — 249°С. Пример В. 11-циклопропил-5,11-дигидро-5-гидрокси-4-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-он К смеси 0,5 г 11-циклопропил-5,11-дигидро-4-метил-6Н-дипиридо[3,2-b:2',3'-e][1,-4]диазепин-6-она (пример 12) в 25 мл тетрагидрофурана добавляют 0,12 г 50 %-ной дисперсии гидрида натрия в минеральном масле. Реакционную смесь размешивают при комнатной температуре в течение часа, затем охлаждают до 0°С, и добавляют 0,9 г оксодипероксимолибден(п иридин)гексаметилфосфорамида. Реакционную смесь затем оставляют стоять до достижения комнатной температуры, и перемешивают в течение ночи. К смеси добавляют воду, и растворители удаляют в вакууме. Экстрагируют тёплым этилацетатом, сгущают в вакууме и очищают путём хроматографии на наполненной силикагелем колонке, используя в качестве элюента этилацетат. Получают 0,05 г чистого 11-циклопропил-5,11-дигидро-5-гидрокси-4-метил-6Н-дипиридо[3,2b:2',3'-е][1,4]диазепин-6-она с точкой плавления 239 – 241°С. Выход: 9,5 % теории. Пример 14. 5,11-дигидро-11-этил-2-метокси-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4] диазепин-6-он а) 3-амино-2-бpом-6-метоксипиридин К раствору 2,5 г 5-амино-2-метоксипиридина в 15 мл уксусной кислоты добавляют 1,6 г ацетата натрия. К получаемому раствору каплями добавляют 3,0 г брома. Смесь перемешивают в течение 20 минут, затем её добавляют к раствору 10 г гидроокиси натрия в 100 мл воды. Экстрагируют 50 мл этилацетата, сушат над безводным сульфатом магния и сгущают в вакууме. Полученный продукт очищают путём хроматографии на наполненной силикагелем колонке, используя в качестве элюента смесь этилацетата и гексана в соотношении 1 : 4. Получают 2,7 г желаемого соединения, пригодного для использования на следующей стадии. б) N-(2-6poм-6-метокси-3-пиридинил)-2xлop-3-пиридинкapбoкcaмид К раствору 2,7 г 3-амино-2-бром-6-метоксипиридина в 20 мл метиленхлорида и 1 мл пиридина добавляют 2,2 г 2-хлорникотионилхлорида, и полученную смесь размешивают в течение 20 минут. Затем смесь разбавляют 100 мл метиленхлорида, промывают 100 мл воды, сушат над безводным сульфатом магния, и сгущают. Полутвёрдый остаток насыщают гексаном, фильтруют, и сушат, в результате чего получают 4,1 г целевого продукта, пригодного для использования на следующей стадии. в)N-(2-бром-6-метокси-3-пиридинил)-2-хлор-N-метил-3-пиридинкарбоксамид К 10 мл диметилсульфоксида добавляют 0,3 г 50 %-ной дисперсии гидрида натрия в минеральном масле, и нагревают до 50°С. После охлаждения до комнатной температуры добавляют 2,0 г N-(2-бром-6-метокси-3-пиридинил)-2-хлор-3-пиридинкарбоксамида, и полученный раствор перемешивают в течение 10 минут. Добавляют 0,4 мл йодистого метила, и размешивают в течение 30 минут. К реакционной смеси добавляют 10 мл воды и затем 100 мл этилацетата. Органическую фазу четыре раза промывают 100 мл воды, сушат над безводным сульфатом магния, сгущают и очищают путём хроматографии на наполненной силикагелем колонке, используя в качестве элюента сперва метиленхлорид и затем смесь метиленхлорида и этанола в соотношении 98 : 2. Получают 1,9 г желаемого соединения, пригодного для использования на следующей стадии. г) N-(2-бром-6-метокси-3-пиридинил)-2-эти-ламино-N-метил-3-пиридинкарбоксамид К раствору 1,9 г N-(2-бpoм-6-метокси-3-пиридинил)-2-xлop-N-мeтил-3-пиpидинкарбоксами-да в 5 мл ксилола добавляют 0,7 г этиламина. Смесь подают в автоклав, закрывают и нагревают при температуре 150°С в течение 4 ч. Затем раствор разбавляют этилацетатом, промывают водой, сушат над безводным сульфатом магния, сгущают и очищают путём хроматографии на наполненной силикагелем колонке (элюент : смесь этилацетата и гексана в соотношении 1:4). Получают 1,5 г желаемого соединения, пригодного для использования на следующей стадии. д) 5,11-дигидро-11-этил-2-метокси-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4] диазепин-6-он К раствору 1,4 г N-(2-бром-6-метокси-3-пиридинил)-2-этиламино-N-метил-3-пиридинкарбоксамида в 20 мл ксилола добавляют 0,9 г 50 %-ной дисперсии гидрида натрия в минеральном масле, и полученную смесь нагревают с обратным холодильником в течение 2 ч. После охлаждения к смеси добавляют метанол, разбавляют этилацетатом и промывают водой. Органическую фазу сушат над безводным сульфатом магния, сгущают и очищают путём хроматографии на наполненной силикагелем колонке, используя в качестве элюента смесь этилацетата и гексана в соотношении 1: 4. Получают довольно чистое соединение, которое дважды перекристаллизовывают из смеси этилацетата и гексана, и получают 0,52 г чистого 5,11-дигидро11-этил-2-метокси-5-метил-6Н-дипиридо[3,2-b:2',3'-e] [1,4]диазепин-6-она с точкой плавления 116 – 118°С. Пример 15. 5,11-дигидро-11-этил-5метил-2-(N-пирролидинo)-6H-дипиридо[3,2-b:2',3'-e][1,4]диазепин-6-он а) 5,11-дигидро-11-этил-2-окси-5-метил-6Н-дипиридо[3,2-b:2',3'-е] [1,4]диазепин-6-он К раствору 0,3 г 5,11-дигидро-11-этил-2-метокси-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6она в 2 мл уксусной кислоты добавляют 2 мл 48 %-ной бромистоводородной кислоты, и полученную смесь быстро нагревают, и кипятят с обратным холодильником в течение 5 минут. К реакциoнной смеси добавляют 10 мл 10 %-ной гидроокиси натрия, и продукт экстрагируют этилацетатом, сушат над безводным сульфатом магния и сгущают. Получают твёрдое вещество, которое перекристаллизовывают из этилацетата, в результате чего получают 0,08 г желаемого соединения с точкой плавления 215 – 218°С. б) 5,11-дигидро-11-этил-5-метил-2-трифторметансульфонилгидрокси-6Н-дипиридо[3,2-b:2',3'е][1,4]диазепин-6-он К раствору 0,2 г 5,11-дигидро-11-этил-2-гидрокси-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она в 4 мл метиленхлорида в атмосфере азота добавляют 0,2 мл диизопропилэтиламина, и затем 0,2 мл ангидрида трифторметансульфоно-вой кислоты. Полученную смесь перемешивают в течение часа, затем разбавляют 20 мл метиленхлорида и промывают водой. Органическую фазу сушат над безводным сульфатом магния и сгущают. В результате хроматографии на наполненной силикагелем колонке с использованием в качестве элюента смеси этилацетата и гексана в соотношении 1: 3 получают довольно чистое соединение, пригодное для использования на следующей стадии. в) 5,11-дигидро-11-этил-5-метил-2-(N-пирролидино)-6Н-дипиридо-[3,2-b:2',3'-е][1,4]диазе-пин-6-он 0,25 г 5,11-дигидро-11-этил-5-метил-2-трифторметансульфонилгидрокси-6Н -д и п и р и д о[ 3 , 2 -b:2',3'-е][1,4]диазепин-6-она растворяют в 1 мл пиридина и нагревают с обратным холодильником в течение 30 минут. Охлаждённый раствор разбавляют этилацетатом, промывают водой, и органическую фазу сушат над безводным сульфатом магния и сгущают. Полученный маслянистый остаток выкристаллизовывают из смеси этилацетата и гексана, и получают 0,11 г 5,11-дигидро-11-этил-5-метил-2-N-(пирролидино)-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазе-пин-6-oна с точкой плавления 185 - 188°С. Пример 16. 5,11-дигидро-11-этил-2-метокси-4-метил-6Н-дипиридо[3,2-b:2',3'-е] [1,4]диазепин-6-он а) 2-метокси-4-метил-5-нитропиридин К раствору 19,0 г 2-хлор-4-метил-5-нитропиридина в 100 мл метанола добавляют 26,1 г метилата натрия, и полученную смесь нагревают с обратным холодильником в течение 12 ч. После охлаждения смесь выливают в 1 л воды, и экстрагируют этилацетатом и промывают водой. Органическую фазу сушат над безводным сульфатом магния и сгущают, и полученный остаток растворяют в горячем простом эфире и фильтруют. Путём перекристаллизации из простого эфира получают 10,2 г желаемого соединения, пригодного для использования на следующей стадии. б) 5-амино-2-метокси-4метилпиридин К раствору 5,1 г 2-метокси-4-метил-5-нитропиридина в 40 мл уксусной кислоты медленно добавляют смесь 41 г дигидрата хлорида олова и 40 мл концентрированной хлористоводородной кислоты, держа температуру ниже 35°С. Полученную смесь перемешивают при комнатной температуре в течение 2 ч, затем оставляют стоять в холодильнике в течение ночи. Твёрдое вещество собирают, твёрдое вещество и надосадочную жидкость отдельно подщелачивают добавлением 20 %-ного раствора гидроокиси натрия. Экстрагируют хлороформом, объединяют, сушат над безводным сульфатом магния и сгущают. В результате получают 3,9 г желаемого соединения в виде твёрдого вещества, пригодного для использования на следующей стадии. в) 3-амино-2-бром-6-метокси-4-метилпири-дин К смеси 3,9 г 5-амино-2-метокси-4-метилпиридина в 25 мл уксусной кислоты и 4,0 г ацетата натрия добавляют 4,8 г брома. Полученную смесь перемешивают в течение 20 минут, затем её добавляют к раствору 15 г гидрокси натрия в 200 мл воды. Экстрагируют хлороформом, сушат над безводным сульфатом магния, сгущают и очищают путём хроматографии на наполненной силикагелем колонке, используя в качестве элюента смесь метиленхлорида и этилацетата в соотношении от 19 : 1 до 4 : 1, в результате чего получают 4,5 г соединения, пригодного для использования на следующей стадии. г) N-(2-бром-6-метокси-4-метил-3-пиридинил)-2-хлор-3-пиридинкарбоксамид К раствору 4,5 г 3-амино-2-бром-6-метокси-4-метилпиридина в метиленхлориде добавляют 3,5г 2-хлорникотионилхлорида. Полученную смесь перемешивают при комнатной температуре в течение ночи и растирают с простым диизопропиловым эфиром. Твёрдый осадок фильтруют, получают 6,0 г желаемого соединения, пригодного для использования на следующей стадии. д) N-(2-бром-6-метокси-4-метил-3-пиридинил)-2-этиламино-3-пиридинкарбоксамид Смесь 2,1 г N-(2-бром-6-метокси-4-метил-3-пиридинил)-2-хлор-3-пиридинкарбоксамида, 10 мл диоксана и 0,5 г этиламина нагревают в автоклаве при температуре 140°С в течение 5 ч. Охлаждённую смесь разбавляют этилацетатом, промывают водой, и органическую фазу сушат над безводным сульфатом магния и сгущают. Полученное соединение очищают путём хроматографии на наполненной силикагелем колонке с использованием в качестве элюента смеси метиленхлорида и этилацетата в соотношении 99 : 1 и выкристаллизовывают из простого диизопропилового эфира. Получают 0,95 г желаемого соединения. е) 5,11-дигидро-11-этил-2-метокси-4-метил-6Н-дипиpидо[3,2-b:2',3'-е][1,4]диазепин-6-он К раствору 0,54 г N-(2-бром-6-метокси-4-метил-3-пиридинил)-2-этиламино-3-пиридинкарбоксамида в 4 мл пиридина добавляют 0,14 г 50 %-ной дисперсии гидрида натрия в минеральном масле. Полученную смесь нагревают с обратным холодильником в течение 1,5 ч. Охлаждённую смесь разбавляют этилацетатом, промывают водой, и органическую фазу сушат над безводным сульфатом магния и сгущают. Остаток промывают простым диизопропиловым эфиром и горячим этилацетатом, и затем выкристаллизовывают из этанола, в результате чего получают 0,2 г 5,11-дигидро-11-этил-2-метокси-4-метил6Н-дипиридо [3,2-b:2',3'-е] [1,4]диазепин-6-она с точкой плавления 249 – 251°С. Аналогично описанным выше методам получают приведённые в таблице 1 соединения примеров 17– 122. Приведённые в данной таблице соединения имеют следующую формулу в которой R1 – R8 имеют нижеуказанные значения, a Z означает атом кислорода, если не указано, что Z является атомом серы. Соединения являются незамещёнными в положениях 2, 3, 4, 7, 8 и 9, если в колонке "другие заместители" ничего не указано Пример 123. Гемигидрат 8-aминo-5,11-дигидpo-11-этил-5-метил-6H-дипиpидo[3,2-b:2',3'-e] [1,4]диазепин-6-она а) 2-этиламино-3-нитропиридин Размешанную смесь 8,60 г (0,054 моль) 2—хлор-3-нитропиридина, 5,37 г (0,12 моль) этиламина и 10 мл ксилола нагревают в автоклаве при температуре 100°С в течение 3 ч. После охлаждения растворитель удаляют в вакууме, и к остатку добавляют воду. Экстрагируют метиленхлоридом, сушат над сульфатом натрия и сгущают в вакууме. Получают 10,0 г желаемого соединения в виде жёлтого масла, пригодного для использования на следующей стадии. б) 3-амино-2-этиламинопиридин Аналогично примеру 11б) из 9,1 г 2-этиламино-3-нитропиридина получают 6,5 г вышеуказанного соединения. в) 2-xлop-N-(2-этиламино-3-пиридинил)-5-нитро-3-пиридинкарбоксамид Раствор 2,21 г 2-хлор-5-нитроникотионилхлорида (полученного тем, что нитруют 2-оксиникотиновую кислоту с последующим переводом в 2хлор-5-нитроникотиновую кислоту, которую затем обрабатывают тионилхлоридом) в 10 мл тетрагидрофурана в течение 15 минут медленно добавляют к охлаждаемой и размешиваемой смеси 1,34 г 3-амино-2-этиламинопиридина, 1,29 г диизопропилэтиламина и 40 мл тетрагидрофурана. Полученную смесь перемешивают при комнатной температуре в течение ночи, затем сгущают в вакууме. Путём обработки метиленхлоридом получают 2,30 г желаемого соединения в виде осадка, пригодного для использования на следующей стадии. Т.пл.: 185 — 186°С. г) 5,11-дигидро-11-этил-8-нитро-6Н-дипиридо[3.2-b:2',3'-е][1,4]диазепин-6-он Раствор 1,80 г 2-хлор-N-(2-этиламино-3-пиридинил)-5-нитро-3-пиридинкарбоксамида в 25 мл ксилола нагревают с обратным холодильником в течение 4 ч. После сгущения в вакууме остаток очищают путём хроматографии на наполненной силикагелем колонке, используя в качестве элюента 50 %-ную смесь этилацетата и гексана. Получают 0,93 г желаемого соединения. д) 5,11-дигидро-11-этил-5-метил-8-нитро-6Н-дипиридо[3,2-b:2',3'-е] [1,4]диазепин-6-он 0,72 г вышеуказанного соединения, имеющего точку плавления 148 – 149°С, получают аналогично примеру 8г) из 0,93 г 5,11-дигидро-11-этил-8-нитро-6Н-дипиридо[3,2-b:2',3'-е] [1,4]диазепин-6-она. е) Гемигидрат 8-амино-5,11-дигидро-11-этил-5-метил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепин-6-она Аналогично примеру 11б) из 0,23 г 5,11-дигидро-11-этил-5-метил-8-нитро-6Н-дипиридо[3,2-b:2',3'е][1,4]диазепин-6-она после перекристаллизации из смеси 1,2-дихлорэтана и гексана получают 0,060 г целевого соединения в виде жёлто-коричневого порошка, имеющего точку плавления 193 – 194°С. Пример 124. 6-цианоимино-5,11-дигидро-11-этил-2,5-диметил-6Н-дипиридо[3,2-b:2',3'-е] [1,4]диазепин Смесь 0,25 г (0,63 ммоль) 5,11-дигидро-11-этил-6-метансульфонилгидрокси-2,4-диметил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепина, 0,034 г (0,8 ммоль) цианамида, 5 мл 1,4-диоксана и 0,11 г (0,8 ммоль) карбоната калия нагревают при комнатной температуре в течение 10 дней. Затем смесь сгущают в вакууме, остаток разделяют между этилацетатом и водой. Органическую фазу сушат, фильтруют и сгущают в вакууме. Остаток подвергают хроматографии на силикагеле с использованием в качестве элюента 10 %-ной смеси этилацетата и метиленхлорида. Получают 0,025 г целевого соединения с точкой плавления 230 – 233°С. Пример 125. 5,11-дигидро-11-этил-6-метоксиимино-2,4-диметил-6Н-дипиридо[3,2-b:2',3'-е] [1,4]диазепин а) 5,11-дигидро-11-этил-6-метансульфонилгидрокси-2,4-диметил-6Н-дипиридо-[3,2-b:2',3'е][1,4]диазепин К раствору 0,314 г (1,2 ммоль) 5,11-дигидро-11-этил-2,4-диметил-6Н-дипиридо[3,2-b:2',3'е][1,4]диазепин-6-она в 15 мл метиленхлорида, содержащему 0,25 мл (14 ммоль) диизопропилэтиламина, добавляют 0,24 мл (14 ммоль) ангидрида трифторметансульфоновой кислоты. Полученную смесь в атмосфере аргона нагревают с обратным холодильником в течение 3 ч. Затем добавляют этилацетат (примерно 200 мл), и раствор трижды промывают водой и четыре раза соляным раствором. Сушат над сульфатом магния, затем раствор сгущают в вакууме, и остаток сушат в высоком вакууме в течение 2 ч. Остаток растворяют в 20 мл метиленхлорида, добавляют 0,23 г (14 моль) цианида тетраэтиламмония. Полученный раствор перемешивают при комнатной температуре в течение ночи, затем реакционную смесь сгущают в вакууме. Остаток растворяют в 100 мл этилацетата, и раствор промывают водой и соляным раствором. Раствор затем сушат над сульфатом магния и сгущают в вакууме. Остаток подвергают хроматографии на силикагеле с использованием в качестве элюента 5 %-ной смеси этилацетата и гексана. Полученное твёрдое вещество выкристаллизовывают из гептана, и получают 0,033 г желаемого соединения в виде красных кристаллов с точкой плавления 154 – 155°С. б) 5,11-дигидро-11-этил-6-метоксиимино-2,4-диметил-6Н-дипиридо-[3,2-b:2',3'-е][1,4]диазепин Раствор 0,3 г (0,75 ммоль) 5,11-дигидро-11этил-6-метансульфонилгидрокси-2,4-диметил-6Н-дипиридо[3,2-b:2',3'-е][1,4]диазепина, 0,15 г (1,8 ммоль) гидрохлорида метоксиламина и 0,3 г (2 ммоль) диизопропилэтиламина в метиленхлориде размешивают при комнатной температуре в течение 4 дней. Органическую фазу промывают водой, сушат и фильтруют. Затем раствор сгущают в вакууме, и остаток подвергают хроматографии на силикагеле с использованием в качестве элюента 20 %-ной смеси этилацетата и гексана. Получают 0,07 г целевого продукта с точкой плавления 164 - 166°С. Пример 126. 5,11- диг ид р о- 6 Н - 11 -ц ик лоп р оп и л -4-метил-дипиридо[3,2-b:2',3'-е] [1,4]диазепин-6-тион Смесь 5,0 г (18,77 ммоль) 5,11-дигидро-6Н-11-циклопропил-4-метил-дипиридо[3,2-b:2',3'е][1,4]диазепин-6-она и 3,8 г (9,40 ммоль) димерного р-метоксифенилтиенофосфинсульфида (агент Лавессона) в 100 мл толуола нагревают с обратным холодильником в течение 2,5 ч. Раствор охлаждают до комнатной температуры и оставляют стоять в течение ночи. Толуол удаляют путём перегонки, и остаток подвергают хроматографии на наполненной силикагелем колонке (элюент: смесь метиленхлорида и этилацетата в соотношении 6 : 1), в результате чего получают жёлтое масло, которое твердеет, когда его оставляют стоять. После перекристаллизации из смеси простого этилового эфира и простого петролейного эфира получают ярко-жёлтое твёрдое вещество, которое сушат в высоком вакууме при температуре 80°С в течение 12 ч. Выход: 1,7 г (32,0 % теории), т.пл.: 189 – 194°С. Как уже указывалось, соединения формулы (I) обладают тормозящим действием в отношении обратной транскриптазы вируса HIV-1. Из опытов, проведённых нижеописанным образом с данными соединениями, известно, что они тормозят активность обратной транскриптгазы HIV зависящей от РНК ДНК-полимеразы. С помощью нижеописанного опыта с применением обратной транскриптазы испытывали способность соединения формулы (I) и соединений, приведённых в таблице 1, к торможению активности обратной транскриптазы HIV зависящей от РНК ДНК-полимеразы. Опыт с применением обратной транскриптазы. Теория опыта: Среди энзимов, корирующих вирус иммунодефицита человека HIV-1, находится и обратная транскриптаза (1), названная так, потому что она транскрибирует копию ДНК с матрицы РНК. Эту активность можно определять количественно в рамках известного опыта (2) с применением энзима без клеток, основанного на наблюдении того, что обратная транскриптаза в состоянии использовать синтетическую матрицу [по ли г(С), снабжённый олиго d(G)] для транскрипции радиомаркированной, поддающейся осаждению кислотой однонитьевой ДНК, причём 3H-dGTP используется в качестве субстрата. Материалы: а) Выделение энзима Обратная транскриптаза из штамма LAV вируса иммунодефицита человека HIV-1 (1) выделяют из штамма бактерии JM109 (3), экспримирующей клон pBRTprtl+ ДНК, контролируемый промотором 1ac в экспрессионном векторе рIВ121 (4). Культивированную в среде 2XYT (при 37°С и 225 об/мин) (5) в течение ночи культуру, в которую в целях положительной селекции подают 100 мкг/мл ампициллина (5), инокулируют при разбавлении 1 : 40 в среде М9, содержащей 10 мкг/мл тиамина, 0,5 % каз- аминокислот и 50 мкг/мл ампициллина. Культуру инкубируют при температуре 37°С при 225 об/мин до достижения оптической плотности 0,3 - 0,4 при 540. В этот момент добавляют репрессорный ингибитор изопропил-b-D-тиогалактопираносид в количестве 0,5 ммоль и продолжают инкубировать в течение 2 ч, после чего сгущают и остаток повторно суспендируют в 50 ммоль трис-буфера, содержащего 0,6 ммоль этилендиаминотетрауксусной кислоты и 0,375 моль хлорида натрия и добавлением лизозима в количестве 1 мг на мл переваривают в течение 30 минут на льду. Клетки растворяют подачей в 0,2 % поверхностно-активного вещества NP-40, а затем подают в 1 М хлорида натрия. После удаления нерастворимых нежелаемых компонентов путём центрифугирования осаждают белок путём добавления 3 объёмов насыщенного водного сульфата аммония, после чего сгущают и остаток повторно суспендируют в буфере обратной транскриптазы (50 ммоль трис, рН 7,5, 1 ммоль этилендиаминотетрауксусной кислоты, 5 моль ДТТ (1,4-димеркапто-2,3-бутандиола), 0,1 % поверхностно-активного вещества NP-40, 0,1 моль хлорида натрия и 50 % глицерина), и хранят при температуре —70°С до использования. б) Состав исходной реакционной Компоненты Содержание компонентов 1 М Трис (рН 7,4) ммоль 1 М ДТТ 40 ммоль 1 М хлорида натрия ммоль 1 %-ное поверхностно-активное вещество NP-40 100 120 0,1% 1 М хлорида магния ммоль [поли г(С)/олиго d(G)](5 : 1) 3 H-dGTP (81 мкМ) моль 4 2 мкг/мл 0,6 мк Осуществление опыта: Аликвоты реакционной смеси хранят при температуре –20°С. Смесь является стабильной, и каждый раз для использования её размораживают. Данный известный опыт (6) с применением энзима составлен для осуществления с использованием системы микротитрующих плит с 96 углублениями. 50 ммоль трис (рН 7,4), носитель (растворитель для разбавления исследуемых соединений), или исследуемые соединения в носителе подают в микротитрующие плиты с 96 углублениями (10 мкл на углубление, 3 углубления на исследуемое соединение). Размораживают обратную транскриптазу HIV, разбавляют её в 50 ммоль трис (рН 7,4), так что 15 мкл разбавленного энзима содержат 0,001 единицу (1 единица - то количество энзима, которое трансформирует 1 мкмоль субстрата в минуту при температуре 25°С), и подают 15 мкл в каждое углубление. Добавляют 20 мкл 0,12 - 0,5 М этилендиаминотетрауксусной кислоты к первым трём углублениям микротитрующей плиты. Этилендиаминотетрауксусная кислота образует хелатный комплекс с магниевыми ионами и предотвращает обратную транскрипцию. 25 мкл вышеуказанной реакционной смеси добавляют во все углубления, и дают инкубироваться при комнатной температуре в течение часа. Опыт заканчивают путём осаждения ДНК в каждом углублении в результате 50 мкл 10 %-ной трихлоруксусной кислотой с 1 % пирофосфатом натрия. Микротитрующую плиту инкубируют при температуре 4°С в течение 15 минут, и осадок фиксируют на стекловолокнистой бумаги # 30 (фирмы Schleicher & Schuell) с помощью полуавтоматического аппарата Skatron. Затем фильтры промывают ещё 5 %-ной трихлоруксусной кислотой с 1 % пирофосфатом натрия, промывают 70 %-ным водным этанолом, сушат, и подают в трубки для сцинтилляции (6). В каждую трубку подают 2 мл сцинтиллирующего средства; подсчёт осуществляют в счётчике бета-частиц Весkmаn. Процент торможения вычисляли по следующему уравнению: % торможения = среднее значение опыта срм - среднее контрольное значение срм х 100 среднее контрольное значение срм срм = число отсчётов в минуту Литература: 1. Бенн, С., и др., SCIENCE No 230, стр. 949, 1985 г. 2. Фармери, В.Г., и др., SCIENCE No 236, стр. 305,1987 г. 3. Яниш-Перрон, Ц., Вьера, Й., и Мессинг, Й., GENE No 33, стр. 103,1985 г. 4. Интернэшнль Байотекнолоджиз, Инк., Нью Хавен, США. 5. Маниатис, Т., Фрич, Э.Ф., и Сембрук, Й., (издатели), MOLECULAR CLONING: A LABORATORY MANUAL, Колд Спринг Харбор Лэбратори, 1982 г. 6. Спира, Т., и др., Clinical Microbiology, стр. 25 –97,1987 г. Результаты опыта сведены в таблице 2. В литературе не описаны соединения аналогичной структуры, которые обладают таким тормозящим действием на обратную транскриптазу вируса HIV-1, позволяющим их применение для профилактики или лечения СПИДа и соответствующих болезней, связанных с инфекцией вирусом HIV. Таблица 1 1 Пример № R 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 Н Р Р метил Н метил Н Н Н Н Н Н Н Н метил метил метил Н Н метил метил метил Н метил-тиометил Н Н Н Н метил метил метил метил метил метил ацетил Н метил Н метил бензил Н метил Н Пример № R 60 61 62 метил Н метил 1 R 2 этил этил 4-метоксибензил этил этил этил циклобутил изопропил циклопропил этил циклопропил этил этил циклопропил бензил 4-метоксибензил 2-фторэтил этил фенил этил ацетил трет.бутил этил этил этил этил этил ацетил этил этил этил этил этил этил этил изопропил метилтио-метил этил этил ацетил циклопропил циклопропил этил R 2 циклопропилметил (R)-2-бутил аллил о Другие заместители Т.п. ( С) 4-хлор 4-этил 184–186 218–219 209–210 105–106 210–211 215–216 214–215 188–189 >300 265–266 228–230 228–230 244–228 310–320 8-хлор 2,4-диметил 3-хлор, 2-нитро 4-метил 4-метил 2,4-диметил 3,4-диметил 4-этил 2,4,9-триметил 2-хлор, 4-метил 2-хлор, 4-метил 4-метил 2,3-диметил 9-метил 2-метил 3-метил 2,9-метил 2-метил 3-метил 8-азидо 3,4-диметил 9-метил 3-хлор 3-хлор 4-метил 8-метил 120–121 117–118 211–212 220–222 157–159 138–143 192–194 212–214 118–120 244–247 263–266 > 215 (разложение) 100–102 124–126 94–96 265–266 119–120 79–93 123–124 204–206 109–110 217–218 124–125 169–170 240–250 244–245 182–183 Продолжение табл. 1 Другие заместители 2-хлор 2,3-диметил о Т.п. ( С) 138–139 172–174 93–95 63 64 65 66 67 68 69 Н метил Н Н метил метил метил этил этил (R)-2-бутил циклопентил пропаргил этил этил 70 71 72 73 74 75 76 метил Н метил метокси-метил Н Н Н этил этил циклопентил метокси-метил этил этил этил 77 78 79 80 Н метил Н метил циклобутил циклобутил циклопропил этил 81 82 83 Н Н метил 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 метил Н Н метил метил метил метил Н метил Н метил метил Н Н метил метил метил аллил метил Н Н метил метил Н винилгидроксикарбонил метокси ацетил метил 109 110 111 112 113 114 115 116 метил метил метил Н диметиламиноэтил Пример № R 117 метил 1 циклопропил этил этил 2-хлор 2-(пирролидин-1-ил), 4-метил 2-(3-пирролин-1-ил) 7,9-диметил 4-метил 7-метил 8,9-диметил 2-хлор, 4-трифторметил 2 этил 153–156 245–247 135–137 193–194 204–206 158–160 4-хлор 2-(тетрагидропиридин-1-ил) 4-метокси 4-метокси 2-(p-метоксибензилметиламино) 2-аллиламино 4-гидроксиметил 8-бром 3-нитро 3,8-динитро 3-амино 2,8-динитро, 3-хлор 4-метил, 7-гидроксил 2,4-диметил (Z=сера) этил циклопропил этил этил этил этил этил циклопропил этил циклопропил-метил циано 7,9-диметил, 8-хлор циклогексил циклогексил 2-амино, 3-хлор этил 4-метил циклопропил 7-метил метисульфонил 4-метил (Z=сера) этил 4-гидрокси циклопропил 3,8-диамино этил 2-гидрокси этил 2,4-диметил (Z=сера) этил этил 4-метил этил 4-метил этил 4-метил циклопропил 2-(p-метоксибензиламино) циклопропил 2-(морфолин-1-ил) циклопропил 2-(пиперидин-1-ил) этил 2-амино 4-циано этил этил этил циклопропил циклопропил R 252–254 143–145 173–175 225–228 169–170 125–126 244–246 241–243 144–146 138–140 185–187 156–157 83–85 167–170 243–246 233–235 154–156 167–169 235–240 215–216 225–227 151–153 189–194 274–277 145–146 199–201 160–162 163–166 239–241 160–162 146–149 122–124 158–159 295–296 240–250 215–218 199–201 140–143 169–171 176–179 133–135 158–160 164–166 197–199 243–245 88–89 Продолжение табл. 1 о Другие заместители Т.п. ( С) 2-метиламино 186–189 118 119 120 121 метил метил метил Н этил этил этил этил 2-диметиламино 2-этиламино 8-нитро 2-диметиламино, 118–120 154–157 148–149 209–211 122 Н этил 4-метил 2-(пирролидин-1 -ил), 3-хлор, 4-метил 215–218 Таблица 2 Исследуемое соединение примера № 10 11 12 13 15 16 22 23 25 27 29 30 34 38 47 48 52 57 58 60 61 64 65 66 69 70 71 72 76 77 78 79 80 81 83 84 85 93 94 95 96 97 98 Исследуемое Тормозящая активность в % 10 мкг/мл 100 100 100 36* 91+ 96+ 40* 75* 85* 76* 91* 90* 99 87 96 63* 99 99 50* 93 85 100 88 35* 94* 86* 2* 34* 100 99 100 83* 85* 91 64* 70* 34* 90* 44 90* 35* 44 100 Продолжение табл. 2 Тормозящая активность в % соединение примера № 99 100 101 105 108 109 110 111 112 113 115 116 118 119 121 122 123 124 125 * = 1 мкм + = 1,25 мкм • = 0,5 мкм 10 мкг/мл 77 52* 4* 20* 72* 17* 30· 61* 68* 6* 37+ 8* 90* 75* 98* 94* 82* 100 8* Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03
ДивитисяДодаткова інформація
Назва патенту англійськоюDipyridodiazepin derivatives and hydrates thereof having biological activity, in particular inhibitory action against reverse transcriptase of hiv-1
Автори англійськоюSchmidt Gunther, Engel Wolfhard, Trummlitz Gunter, Eberlein Wolfgang, Hargrave Karl
Назва патенту російськоюПроизводные дипиридодиазепина и их гидраты, имеющие биологическую активность, в частности тормозящее действие на обратную транскриптазу вируса hiv-1
Автори російськоюШмидт Гюнтер, Энгель Вольфхард, Труммлитц Гюнтер, Эберлайн Вольфганг, Харгрейв Карл
МПК / Мітки
МПК: C07D 471/14
Мітки: hiv-1, дію, вірусу, похідні, активність, зокрема, гідрати, мають, біологічну, транскриптазу, дипіридодіазепіну, гальмівну, зворотну
Код посилання
<a href="https://ua.patents.su/18-34420-pokhidni-dipiridodiazepinu-ta-kh-gidrati-shho-mayut-biologichnu-aktivnist-zokrema-galmivnu-diyu-na-zvorotnu-transkriptazu-virusu-hiv-1.html" target="_blank" rel="follow" title="База патентів України">Похідні дипіридодіазепіну та їх гідрати, що мають біологічну активність, зокрема гальмівну дію на зворотну транскриптазу вірусу hiv-1</a>
Попередній патент: Спосіб одержання заміщених в п’ятому положенні піроло[2,3-d]піримідинів
Наступний патент: Радіотелефон та генератор для формування сигналу із заданою частотою (варіанти)
Випадковий патент: Кліткове обладнання для утримання батьківського поголів`я курей-несучок