Спосіб одержання гідрокортизону та проміжні сполуки в синтезі гідрокортизону
Номер патенту: 35556
Опубліковано: 16.04.2001
Автори: БРІОН Франсіс, Діолез Крістіан, Віват Мішель, Бюандіа Жан
Формула / Реферат
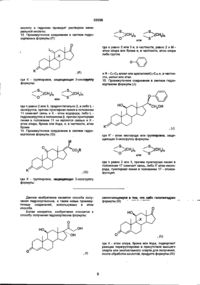
1. Способ получения гидрокортизона формулы (I):
 , (І)
, (І)
отличающийся тем, что либо
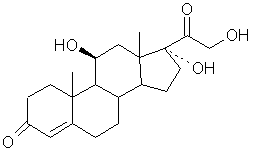
а) галогенгидрин общей формулы (II):
 , (ІІ)
, (ІІ)
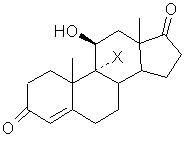
где Х - атом хлора, брома или йода, подвергают реакции перегруппировки в присутствии высшего спирта или многоатомного спирта, с получением после обработки кислотой, продукта формулы (III):
 , (ІІІ)
, (ІІІ)
3-оксогруппу которого селективно защищают действием тиола или дитиола формулы:
HO-(CH2)n-SH или HS-(CH2)n-SH,
где n равно 2 или 3, с получением соединения общей формулы (IV):
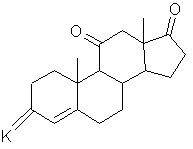 , (ІV)
, (ІV)
где К - группировка, защищающая 3-оксогруппу, формулы:
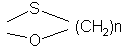 или
или 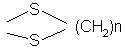 ,
,
где n имеет определенное выше значение, или
б) вышеуказанное соединение формулы (II) обрабатывают агентом для защиты 3-оксогруппы, соответствующим для значения К реагентом, с получением соединения формулы (V):
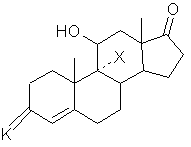 , (V)
, (V)
где Х и К имеют вышеуказанные значения, которое далее подвергают реакции перегруппировки в присутствии высшего спирта или многоатомного спирта с получением, после обработки кислотой, соединения формулы (IV),
а затем, полученное по любой из выше перечисленных методик, соединение формулы (IV) обрабатывают тригалоидацетатом формулы:
Hal3C-CO2R,
где Hal - атом хлора или брома и R – С1-С6 алкил, арилалкил-С7-С15 в присутствии цинка и кислоты Льюиса, с получением соединения общей формулы (VI):
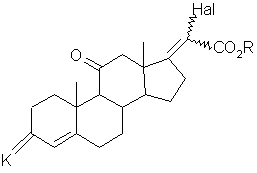 , (VI)
, (VI)
где К, Hal и R имеют вышеуказанные значения, которое в щелочной среде обрабатывают фенолом с получением соединения общей формулы (VII):
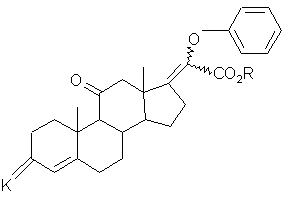 , (VII)
, (VII)
где К и R имеют вышеуказанные значения, которое затем подвергают действию восстановителя с получением соединения формулы (VIII):
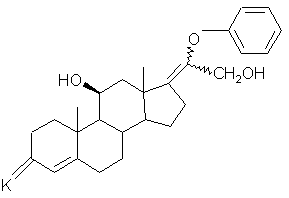 , (VIII)
, (VIII)
где К имеет вышеуказанное значение, 3-оксогруппу которого освобождают от блокировки с получением соединения формулы (IX):
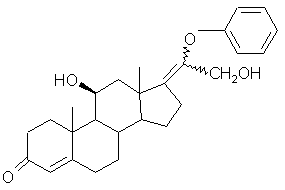 , (IX)
, (IX)
которое обрабатывают эпоксидирующим агентом с получением соединения формулы (X):
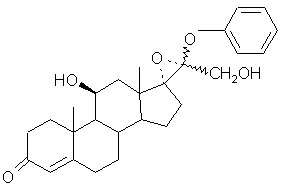 (X)
(X)
и которое подвергают гидролизу в кислой среде.
2. Способ по п.1, отличающийся тем, что в соединении формулы (II) Х - атом брома.
3. Способ по п.2, отличающийся тем, что перегруппировку галогенгидрина ведут в присутствии этиленгликоля, употребляемого в избытке.
4. Способ по любому из пп.1-3, отличающийся тем, что перегруппировку производят в присутствии сорастворителя с точкой кипения ниже 100°С, при кипячении с обратньм холодильником.
5. Способ по п.4, отличающийся тем, что в качестве сорастворителя используют этиловый эфир уксусной кислоты.
6. Способ по п.1, отличающийся тем, что 3-оксогруппу селективно защищают действием этандитиола в присутствии каталитического количества концентрированной соляной кислоты или концентрированной бромисто-водородной кислоты, или эфирата трифтористого бора.
7. Способ по п.1, отличающийся тем, что ведут защиту 3-оксогруппы, а затем перегруппировку галогенгидрина без выделения промежуточного продукта формулы(V).
8. Способ по п.1, отличающийся тем, что тригалоидацетатом является метиловый эфир трихлоруксусной кислоты.
9. Способ по п.1, отличающийся тем, что кислотой Льюиса является тетрахлорид титана.
10. Способ по п.1, отличающийся тем, что в качестве восстановителя используют гидрид алюминия или щелочной борогидрид.
11. Способ по п.1 или 6, отличающийся тем, что снятие защиты 3-оксогруппы ведут действием йода в присутствии основания, либо действием каталитического количества йода в присутствии окислителя.
12. Способ по п.1, отличающийся тем, что в качестве эпоксидирующего агента используют надкислоту и гидролиз проводят раствором минеральной кислоты.
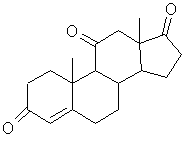
13. Промежуточное соединение в синтезе гидрокортизона формулы (F):
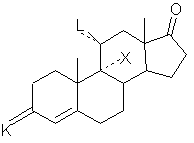 , (F)
, (F)
где К - группировка, защищающая 3-оксогруппу формулы:
 или
или  ,
,
где n равно 2 или 3, предпочтительно 2, и либо L - оксогруппа, причем пунктирная линия в положении 11 означает связь и Х - атом водорода, либо L - гидроксигруппа в положении β, причем пунктирная линия в положении 11 не является связью и Х - атом хлора, брома или йода, и в частности атом брома.
14. Промежуточное соединение в синтезе гидрокортизона формулы (G):
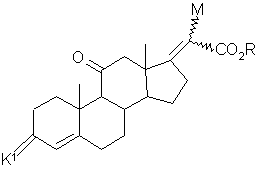 ,(G)
,(G)
где К - группировка, защищающая 3-оксогруппу формулы:
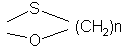 или
или 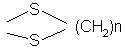 ,
,
где n равно 2 или 3 и в частности равно 2, и М - атом хлора или брома, и в частности атом хлора, либо группа
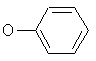
и R – С1-С6 алкил или арилалкилС7-С15, и в частности, метил или этил.
15. Промежуточное соединение в синтезе гидрокортизона формулы (J):
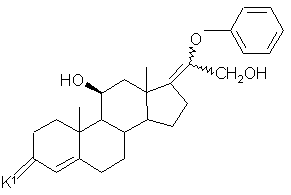 , (J)
, (J)
где К1 - атом кислорода или группировка, защищающая 3-оксогруппу формулы:
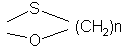 или
или 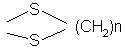 ,
,
где n равно 2 или 3, причем пунктирная линия в положении 17 - означает связь, либо К1 атом кислорода, пунктирная линия в положении 17 - эпоксифункция.
Текст
1. Способ получения гидрокортизона формулы (I): НО О (III) 3-оксогруппу которого селективно защищают действием тиола или дитиола формулы: HO-(CH2)n-SH или HS-(CH2)n-SH, где п равно 2 или 3, с получением соединения общей формулы (IV): О СМ .О) .(IV) отличающийся тем, что либо а) галогенгидрин общей формулы (II): где К - группировка, защищающая 3-оксогруппу, формулы: НО или (II) где X - атом хлора, брома или йода, подвергают реакции перегруппировки в присутствии высшего спирта или многоатомного спирта, с получением после обработки кислотой, продукта формулы (III): где п имеет определенное выше значение, или б) вышеуказанное соединение формулы (II) обрабатывают агентом для защиты 3-оксогруппы, соответствующим для значения К реагентом, с получением соединения формулы (V): НО О ш ю ю ю со CH 2 ) n или где п равно 2 или 3, предпочтительно 2, и либо L оксогруппа, причем пунктирная линия в положении 11 означает связь и X - атом водорода, либо L гидроксигруппа в положении (3, причем пунктирная линия в положении 11 не является связью и X атом хлора, брома или йода, и, в частности, атом брома 14. Промежуточное соединение в синтезе гидрокортизона формулы (G): О НО где К' - атом кислорода или группировка, защищающая 3-оксогруппу формулы: >Н2)П или (G) где п равно 2 или 3, причем пунктирная линия в положении 17 означает связь, либо К1 атом кислорода, пунктирная линия в положении 17 - эпоксифункция. где К - группировка, защищающая 3-оксогруппу формулы: Данное изобретение касается способа получения гидрокортизонов, а также новых промежуточных соединений, используемых в этом способе. Более конкретно, изобретение относится к способу получения гидрокортизона формулы: заключающемуся в том, что либо галогенгидрин формулы (II): НО но (И) (О где X - атом хлора, брома или йода, подвергают реакции перегруппировки в присутствии высшего спирта или многоатомного спирта для получения, после обработки кислотой, продукта формулы (III): 35556 О , (НО 3-оксогруппу которого селективно защищают действием тиола или дитиола формулы: HO-(CH2)nSH или HS-CH2)n-SH, где п равно 2 или 3, для получения соединения общей формулы (IV): .(VI) где К, Hal и R имеют вышеуказанные значения, которое в щелочной среде обрабатывают фенолом для получения соединения общей формулы (VII): О .(IV) где К - группировка, защищающая 3-оксогруппу, формулы: , (VII) где К и R имеют вышеуказанные значения, которое затем подвергают действию восстановителя для получения соединения формулы (VIII): или где п имеет определенное выше значение либо вышеуказанное соединение формулы (II) обрабатывают агентом для защиты 3-оксогруппы, соответствующим для значения К реагентом, для получения соединения формулы (V): НО СН 2 ОН НО , (VIII) где К имеет вышеуказанное значение, 3-оксогруппу которого освобождают от блокировки для получения соединения формулы (IX): где X и К имеют вышеуказанные значения, которое далее подвергают реакции перегруппировки в присутствии высшего спирта или многоатомного спирта для получения, после обработки кислотой, соединения формулы (IV), а затем полученное по любой из выше перечисленных методик соединение формулы (IV), обрабатывают тригалоидацетатом формулы Hal3C-CO2R где Hal - атом хлора -или брома, и R - Сі-Сб алкил, арилалкил-С7-С-і5 в присутствии цинка и кислоты Льюиса, для получения соединения общей формулы (VI): НО, сн2он .(IX) которое обрабатывает эпоксидирующим агентом для получения соединения формулы (X): 35556 НО СН 2 ОН .(X) и которое подвергают гидролизу в кислой среде. Если R - радикал алкил, то предпочтительно это метил, этил, пропил, изопропил, бутил, вторичный бутил, третбутил, пентил или гексил. Если R - радикал аралкил, то предпочтительно это бензил или фенетил. В частности, изобретение относится к способу, описанному выше, при котором используют соединение формулы (II), где X - атом брома. Реакция перегруппировки галогенгидрина предпочтительно ведется в присутствии, например, глицерина или диола, в частности, пропиленгликоля или, предпочтительно, этиленгликоля, используемого в избытке при нагревании при температуре ниже 100°С Предпочитают работать в присутствии растворителя, предпочтительно, с точкой кипения ниже 100°С, кипячении с обратным холодильником. Сорастворителем является инертный растворитель в условиях реакции, например, этиловый эфир уксусной кислоты. Обработка кислотой ведется водной кислотой, например, соляной кислотой, серной кислотой или бромисто-водородной кислотой. Защита функции 3-оксо ведется действием дитиола в кислой среде, в частности, этанолдитиолом, в присутствии концентрированной соляной кислоты или бромисто-водородной кислоты в каталитическом количестве, или она в присутствии кислоты Льюиса, такой как хлористый цинк, тетрахлорид титана и трифторид брома, предпочтительно, в виде эфирной вытяжки. В частности способ, описанный выше, включает защиту 3-оксогруппы, а затем перегруппировку галогенгидрина, осуществляемые без выделения промежуточного продукта формулы (V). Перегруппировка галогенгидрина облегчается промежуточной защитой оксогруппы в положении 3 или 3 и 17, что обеспечивает протекание реакции в очень мягких условиях. Можно отметить, что следствием защиты может быть появление неустойчивости связи углерод-галоген в положении 9, что облегчает перегруппировку. Используемой кислотой Льюиса в реакции взаимодействия соединения формулы (IV) с тригалоидацетатом является, например, хлористый цинк, хлористый алюминий, хлористый диэтилалюминий или, предпочтительно, тетрахлорид титана. В частности, используют тригалоидацетат алкила и особенно трихлорацетат метила и этила. Работают предпочтительно в среде циклического эфира, такого как тетрагидрофуран или диоксан Взаимодействие фенола с соединением формулы (VI) осуществляется в присутствии гидроокиси или щелочного или щелочноземельного карбоната, в частности, натрия, калия, бария или кальция, гидрида, алкоголята или амида щелочного металла, в частности, натрия, калия или лития или же алкиллития, в частности, бутиллития. Работают в среде органического растворителя, например, кетона, такого как ацетон или метилэтилкетон, и при необходимости в смеси с галогенированным растворителем, таким как хлористый метилен, или с эфиром, таким как диоксан или тетрагидрофуран. Восстановителем может быть, в частности, гидрид, предпочтительно алюминия, например, алюмогидрид лития, гидрид диэтил натрия алюминия, гидрид диизобутил алюминия или дигидробис 12метоксиэтокси/ алюмината натрия. Действуют, например, в толуоле или тетрагидрофуране. В частности, восстановителем может быть щелочной борогидрид, например, борогидрид натрия, при необходимости катализированный солью лития, или борогидрид лития. Снятие защиты с 3-оксогруппы ведется действием йода в присутствии основания, например, щелочного бикарбоната, или действием йода в каталитическом количестве в присутствии окислителя, в частности, перекиси водорода, действием метилиодида, глиоксиловой кислоты, или солями металлов, такими как соли ртути или кадмия. Обычно можно действовать в растворителе, таком как низший алканол, например, метанол или этанол, в смеси с галогенированным растворителем, например, с хлористым метиленом в присутствии воды. Эпоксидирующим агентом может быть перкислота, такая как метахлорпербензойная кислота, надфталевая кислота, первольфрамовая кислота или перекись водорода, одна или в присутствии гексахлор- или гексафторацетона. Эпоксидирующим агентом может быть гидроперекись, такая как гидроперекись третбутила, используемая в присутствии ацетилацетоната ванадия или других металлов, таких как молибден, в каталитическом количестве. Можно действовать в среде органического растворителя, такого как хлористый метилен, тетрахлорметан, хлороформ, метанол, тетрагидрофуран, диоксан, толуол или этиловый эфир уксусной кислоты, при необходимости в присутствии воды. Можно также действовать в буферной среде, например, в среде вторичного фосфата натрия или смеси третичного фосфата натрия - фосфорной кислоты. Гидролиз эпоксидированного в положении 17, 20 соединения производится действием водной кислоты, причем кислотой является минеральная кислота, такая как соляная кислота, серная кислота или азотная кислота. Можно также действовать в буферной среде, такой, как она описана выше. Синтез гидрокортизона согласно изобретению имеет ряд преимуществ, перечисленных ниже: - перегруппировка соединения 11-ОН в соединение 11-кето через промежуточное соединение галогенгидрина производится в более мягких условиях, чем те, которые описаны в европейском патенте 30368, что одновременно создает преиму 35556 щество в части выхода реакции, так как образование побочных продуктов или деградации ограничены, и также в части производительности способа, так как синтез протекает более экономично, - защита группы в положении 3 очень селективна, по сравнению с известными блокирующими агентами, как эфиры енолей и кетали, которые приводят к смесям продуктов, блокированных в положениях 3 и 3, 17, - защита в положении 3 согласно изобретению, кроме того, очень устойчива в реакционных условиях, которые могут быть кислыми или щелочными, и ее снятие во время синтеза, в частности, действием йода в щелочной среде или йода в каталитическом количестве, в мягкой окислительной среде очень легко, - получение гидрокортизона возможно без стадии гидроксилирования в положении 11, что невозможно, в частности, при известных синтезах, в которых используют андростендион в качестве исходного соединения Эта возможность увеличивает общий выход способа Изобретение относится также к промежуточным соединениям, необходимым для осуществления описанного выше способа Так, объектом изобретения являются промежуточные соединения формулы (F): или где п равно 2 или 3 и, в частности, равно 2 и М атом хлора или брома и, в частности, атом хлора либо группа и R-C-i-Сбалкил или арилалкилС7-Сі5 и, в частности, метил иди этил Объектом изобретения являются промежуточные соединения формулы (J): но СН 2 ОН где К' - атом кислорода или группировка, защищающая 3-оксогруппу формулы' где К - группировка, защищающая 3-оксогруппу формулы ИЛИ где п равно 2 или 3, предпочтительно 2, и либо Lоксогруппа, причем пунктирная линия в положении 11 означает связь и X - атом водорода, либо L гидроксигруппа в положении р, причем пунктирная линия в положении 11 не является связью и X атом хлора, брома или йода и, в частности, атом брома Объектом изобретения являются промежуточные соединения формулы (G). () где К - группировка, защищающая 3-оксогруппу формулы или где п равно 2 или 3, причем пунктирная линия в положении 17 - означает связь, либо К1 - атом кислорода, пунктирная линия в положении 17 эпоксифункция. Соединения формулы (II), в частности, описаны в патенте США 3 072.684 Следующий пример иллюстрирует изобретение, но не ограничивает его. Пример1 Гидрокортизон Стадия А Циклический 3-[(1,2-этандиил) меркаптол]-андрост-4-ен-3,11,17-триона а) Андрост-4-ен-3,11,17-трион В атмосфере инертного газа и при комнатной температуре смешивали 1,05 г 9альфа-бром11бета-гидрокси-андрост-4-ен-3,17-диона, 7,5 см 3 этилового эфира уксусной кислоты и 2,5 см 3 этиленгликоля, кипятят с обратным холодильником при перемешивании 10 часов, охлаждают, а затем прибавляют 10 см 3 2н соляной кислоты и 10 см 3 воды, перемешивают 20 часов, а затем удаляют этиловый эфир уксусной кислоты под уменьшенным давлением После обработки хлористым натрием охлаждают до температуры около 0°С, отсасывают кристаллы, промывают их водой и сушат Поглощают их метиленхлоридом, прибавляют этиловый эфир уксусной кислоты, отгоняют метиленхлорид, охлаждают раствор в ледяной бане и отсасывают кристаллы, а затем сушат их 35556 Получают 0,52 г целевого продукта Т пл =221 °С Экстрагируют водный слой метиленхлоридом и хроматографируют на двуокиси кремния сырой продукт, элюируя смесью метиленхлоридэтиловый эфир уксусной кислоты (95-5), и после кристаллизации в этиловом эфире уксусной кислоты получают 0,097 г целевого продукта Т пл=220°С б) Циклический 3-[(1,2-этандиил)меркаптол]анд рост-4-ен-З 11,17-триона В инертном газе при комнатной температуре перемешивают 100 см метанола, 5 г продукта, полученного на предыдущей стадии, 1,8 см этаніьідущей диола и 2,5 см 3 эфирной вытяжки трифторида бора Перемешивают 1 час 30 мин и отгоняют метанол, поглощают метиленхлоридом, промывают насыщенным водным раствором бикарбоната натрия, водой и сушат, а затем доводят досуха Полученный продукт кристаллизуют в гексане и получают 5,99 г целевого продукта Т пл =+160°С ЯМР спектр (СОСІз 90 Мгц чнм) 18-СНз 0,85, 19-СНз 1,27, тиокеталь 3,17 до 3,47, Н 4 5,6 ИК спектр (СНСІз) Отсутствие дельта4 3-она, поглощение при 1645 с м 1 (С=С), 1709 с м 1 (С=0 в 11), 1740 с м 1 (С=0в 17) Стадия А' Циклический 3-[(1,2-этандиил) меркаптол]-анд рост-4-ен-З, 11,17-триона В инертном газе смешивают 4 г 9альфа-бром11бета-гидрокси андрост-4-ен-3,20-диона, 40 см 3 этилового эфира уксусной кислоты, а затем при комнатной температуре прибавляют 0,9 см 3 этан диола Потом медленно прибавляют 0,09 см 3 соляной кислоты в 22°Бе, затем выдерживают при перемешивании 6 часов Прибавляют 9,3 см 3 этиленгликоля, кипятят с обратным холодильником 20 часов, а затем охлаждают до 20°С и реакционную смесь выливают в смесь 40 см 3 2 н соляной кислоты и 40 см 3 воды Перемешивают 16 часов, а затем удаляют этиловый эфир уксусной кислоты под уменьшенным давлением (20 мм/Hg) при температуре максимум 35°С Затем охлаждают суспензию до 0+5°С, перемешивают 1 час и отсасывают кристаллы Промывают их водой а затем сушат и хроматографируют на двуокиси кремния, элюируя смесью гексан-диоксан (9-1) Получают 3,2 г целевого продукта ЯМР спектр (CDCI3 300 Мгц чнм) 18-СНз 0,84 (S), 19-СНз 1,26 (S), тиокеталь 3,15 до 3,4 Н4 5,57, скелетная формула 1,1 до 2,61 (м) ИК спектр (СНСІз) Погпощения при 1741-1709 с м 1 (кетоны), 1641 с м 1 (С=С) Стадия Б Метиловый эфир 20-хлор-3,3-[1,2этандиил-бис-(тио)]-11-оксо-прегна-4,17 (20) диен21-оновой кислоты В инертной атмосфере смешивают 100 см 3 тетрагидрофурана и 12,55 г порошка цинка Медленно прибавляют при -10/-15°С 7,9 см 3 тетрахлорида титана, а затем смесь 100 см 3 тетрагидрофурана, 8,6 см 3 метиловый эфир трихлоруксусной кислоты и 18 г продукта, полученного, как это описано в стадии А или А1 Дают температуре подняться, а затем перемешивают при комнатной температуре 1 час 30 мин Прибавляют при +Ю/+15°С, 100 см 3 смеси вода-пиридин (4-1), перемешивают смесь 1 час, давая температуре подняться, а затем прибавляют 100 см 3 смеси водаконцентрированная соляная кислота (6-4) Перемешивают 15 минут, экстрагируют метиленхлоридом, промывают водой органический слой, сушат его и отгоняют растворитель Кристаллы растворяют в метиленхлориде, прибавляют изопропиловый эфир, отгоняют метиленхлорид, охлаждают и отсасывают кристаллы Маточные растворы хроматографируют на двуокиси кремния, элюируя смесью циклогексан-этиловый эфир уксусной кислоты (8-2) Получают 21,8 г целевого продукта Т пл*175°С ИК спектр (СНСІз) Поглощения при 1715 с м 1 и 1730 с м 1 (С=0) макс 1705 с м 1 1643 с м 1 (С=С дельта4) и 1610см 1 (С=С) ЯМР спектр (CDCI3 90 Мгц чнм) Смесь изомеров 20 CI 18-СНз 1,02-0,98, 19-СНз 1,25, тиокеталь 3,33, СНз-сложный эфир 3,83-3,82, Н4 5,58 Стадия В Метиловый эфир 20-фенокси-3,3[1,2-этанд иил-бис-(тио)]-11 -оксо-прегна-4,17(20) диен-21-оновой кислоты В инертной атмосфере нагревают с обратным холодильником смесь 18 г фенола, 150 см 3 бутанона, 30 г продукта, полученного по способу, описанному на стадии Б, и 17,7 г карбоната калия После 16 часов смесь выливают в смесь 100 см 3 воды, 90 г льда и 10 см 3 Ю н раствора едкого натра Экстрагируют метиленхлоридом, промывают водой органический слой и концентрируют его Поглощают остаток метанолом, оставляют для медленного остывания и отсасывают кристаллы, а затем сушат их В два приема получают 27,4 г целевого продукта Т пл «208-210°С ИК спектр (СНСІз) Поглощение при 1592-1491 с м 1 (ароматическое соединение типа CgHs-O-), 1714-1705 с м 1 (С=0), 1646см 1 (С=С) ЯМР спектр (CDCIs 90 Мгц чнм) 18-СНз 0,9, 19-СНз 1,21, тиокеталь 3,33, СН 3 сложный эфир 3,63, Н4 5,58, C6Hs 6,81 до 7,39 Смесь изомеров 20-0-CeHs Стадия Г Циклический (11 бета)-3,3-[(1,2этандиил)меркаптол]20-фенокси-11,21-дигидрокси-прегна-4,17(20)-д иен-3-он В инертном газе смешивают 20 г полученного на стадии В продукта и 200 см 3 толуола, охлаждают до -25°С и медленно вводят 110-см 20%-го раствора алюмогидрида диизобутила в толуоле Дают температуре подняться до +10°С, перемешивают 1 час а затем заново охлаждают до -15°С Медленно прибавляют 10 см 3 метанола, дают температуре подняться до 0°С и медленно прибавляют 200 см 3 2 н раствора соляной кислоты Декантируют, промывают водой органический слой, сушат и отгоняют растворитель Остаток хроматографируют на двуокиси кремния, элюируя смесью толуол-этиловый эфир уксусной кислоты (9-1) Получают 17,4 г целевого продукта ИК спектр (СНСІз) Поглощение при 1490-1596 с м 1 (CeHs-O-C), 1644 с м 1 (С=С дельта) и 1682 с м 1 (С=С), 3612 с м 1 (ОН свободный) ЯМР спектр (CDCI3 - C5D5N/ /90 Мгц чнм) 35556 18-СНз: 1,17; 19-СН3: 1,29; тиокеталь: 3,33; СН2ОН: 4,15; Нц: 4,32; Н4: 5,45 Стадия Д. (11бета)-11,21-дигидрокси-20-фенокси-прегна-4,17 (20)диен-3-он. 5 г полученного выше продукта растворяют в 10 см 3 хлористого метилена и 30 см 3 метанола, прибавляют 2,5 см 3 опресненной воды, а затем 0,3 г йода. Получают рН=1,5 и в 15 минут вводят 1,4 см 3 50%-ой перекиси водорода. Среду окисления нейтрализуют прибавкой 2 г тиосульфата натрия. Затем прибавляют 5 г кларцеля, фильтруют и концентрируют досуха под уменьшенным давлением. Сухой экстракт растворяют в метиленхлориде, промывают его раствором 1 г тиосульфата натрия в 25 см 3 воды, декантируют, сушат и концентрируют досуха под уменьшенным давлением и получают 4,8 г сырого целевого продукта. 1,8 г этого продукта очищают хроматографией на двуокиси кремния (элюант. метиленхлоридизопропанол-97,5-2,5) и получают 1,7 г целевого продукта. Т пл.«188°С. ИК спектр (СНСІз). Поглощения при 3613 см"1 (ОН), 1662, 1617 и 868 см' 1 (дельта4-3оксо); 1597-1491 см'1 (-О-С6Н5). ЯМР спектр (CDCI 3 - C5D5N - 90 Мгц чнм) 18-СН3: 1,17; 19-СН3: 1,42; Нц: 4,27, Н 4 5,67; СН2ОН: 4,11, С 6 Н 5 : 6,87 до 7,37 Стадия Е: (11 бета) 11,21-дигидрокси-17,20эпокси-20-фенокси-прегна-4-ен-3-он В инертном газе смешивают 1,0 г полученного в стадии Д продукта, 10 см 3 этилового эфира уксусной кислоты и 5 см 3 воды. Прибавляют 0,5 г вторичного фосфата натрия, 0,65 г надфталевой кислоты и 0,75 см 3 50%-ной перекиси водорода, перемешивают 3 часа 15 минут, прибавляют 0,15 г вторичного фосфата натрия и 0,20 г надфталевой кислоты и перемешивают 1 час 15 мин. Затем прибавляют 20 см этилового эфира уксусной кислоты и 9 см 3 1 н. раствора едкого натра, перемешивают 5 минут, декантируют, промывают органический слой водой и водой, содержащей бисульфит натрия и 1 н. раствор серной кислоты, сушат и упаривают досуха. Получают 1,05 г сырого целевого продукта (который неустойчив), используемый в данном виде на следующей стадии. Rf: 0,28 /двуокись- кремния -СНгСЬ/ диоксан 90/10/. ИК спектр (СНСІз). Поглощение при 3613 см"1 (ОН); 1662 и 1616 см'1 (дельта-4-Зон); 1600, 1590 и 1494 см' 1 (ароматическое соединение). ЯМР спектр (CDCI3 300 Мгц чнм). 18-СНз: 1,29 (S); 19-СН3: 1,43 (S); -С-СНг-О-; 3,49 (dd) и 4,20 (dd); Нц eq: 4,32; Н4: 5,68; Н от О-СЄНБ: пара 7,06 (т), орто 7,13 (d) и мета 7,29 (т). Стадия Ж: Гидрокортизон. В инертном газе смешивают 5 см 3 метанола, 3 см 3 воды и 0,08 см 3 1 н. раствора серной кислоты (рН 2). При комнатной температуре прибавляют 0,525 г полученного на стадии Е продукта и перемешивают 16 часов. Нейтрализуют прибавлением бикарбоната натрия и экстрагируют метиленхлоридом. Органический слой сушат и упаривают досуха. Остаток поглощают метиленхлоридом, содержащим 5% метанола, в горячем виде, а затем концентрируют до начала кристаллизации. Дают остынуть, отсасывают кристаллы и сушат их. Концентрируют маточные растворы и остаток хроматографируют на двуокиси кремния, элюируя смесью метиленхлорид-метанол (95-5). Получают в целом 0,318 г целевого гидрокортизона. Т. пл.=224°С. Апьфа о 20 =+164 о +2,5 о (К=1% этанол). ИК спектр (вазелиновое масло). Поглощение при 3430 см' 1 (ОН), 1710 см' 1 (С=0), 1642, 1630 и 1610 см"1 (дельта4 3-он). ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 Підписанодо друку {5JCI 2001 p. Формат 60x84 J/8 V ОбсягU.StL обл.-вид. арк. Тираж 50 прим. Зам._ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of hydrocortisone and intermediate compounds in the synthesis of hydrocortisone
Автори англійськоюBrion Francis, Buendia Jean, Diolez Christian, Vivat Michel
Назва патенту російськоюСпособ получения гидрокортизона и промежуточные соединения в синтезе гидрокортизона
Автори російськоюБрион Франсис, Бюандиа Жан, Диолез Кристиан, Виват Мишель
МПК / Мітки
МПК: C07J 13/00, C07J 33/00, C07J 21/00, C07J 5/00
Мітки: гідрокортизону, спосіб, синтезі, одержання, сполуки, проміжні
Код посилання
<a href="https://ua.patents.su/8-35556-sposib-oderzhannya-gidrokortizonu-ta-promizhni-spoluki-v-sintezi-gidrokortizonu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання гідрокортизону та проміжні сполуки в синтезі гідрокортизону</a>
Попередній патент: Спосіб отримання ароматичних сполук
Наступний патент: Похідні 1,2,4-оксадіазолілфеноксіалкілізоксазолу, що мають противірусну активність та фармацевтична композиція на їх основі
Випадковий патент: Спосіб гартування скла