Інгібітори калієвого каналу
Формула / Реферат
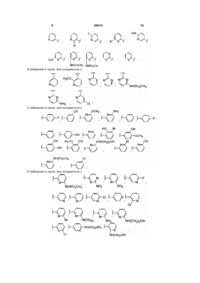
1. Сполука, вибрана з групи, яка складається з
(R)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3-ілетил]бензонітрилу і
(S)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3-ілетил]бензонітрилу;
а також їх фармацевтично прийнятних солей.
2. Спосіб лікування стану у ссавця, лікування якого здійснюють або полегшують інгібуванням KV1.5, який включає введення ефективної для інгібування KV1.5 кількості сполуки, вибраної з групи, яка складається з
(R)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3-ілетил]бензонітрилу і
(S)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3-ілетил]бензонітрилу;
а також їх фармацевтично прийнятних солей.
3. Спосіб за п. 2, де стан являє собою серцеву аритмію.
4. Спосіб за п. 3, де серцева аритмія являє собою фібриляцію передсердь.
5. Фармацевтичний препарат для інгібування калієвого каналу, який містить фармацевтично прийнятний носій і сполуку, вибрану з групи, яка складається з
(R)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3-ілетил]бензонітрилу і
(S)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3-ілетил]бензонітрилу;
або її фармацевтично прийнятну кристалічну форму, або її гідрат.
6. Фармацевтична композиція, яка містить сполуку, вибрану з групи, яка складається з
(R)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(S)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин-3-ілетил]піридин-2-іл}метансульфонаміду,
(R)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3-ілетил]бензонітрилу і
(S)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3-ілетил]бензонітрилу,
а також їх фармацевтично прийнятних солей; і фармацевтично прийнятний носій.
Текст
1. Сполука, вибрана з групи, яка складається з (R)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (R)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (R)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин3-ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин3-ілетил]піридин-2-іл}метансульфонаміду, (R)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3ілетил]бензонітрилу і (S)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3ілетил]бензонітрилу; а також їх фармацевтично прийнятних солей. 2. Спосіб лікування стану у ссавця, лікування якого здійснюють або полегшують інгібуванням KV1.5, який включає введення ефективної для інгібування KV1.5 кількості сполуки, вибраної з групи, яка складається з (R)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (R)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (R)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин3-ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин3-ілетил]піридин-2-іл}метансульфонаміду, (R)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3ілетил]бензонітрилу і (S)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3ілетил]бензонітрилу; а також їх фармацевтично прийнятних солей. 3. Спосіб за п.2, де стан являє собою серцеву аритмію. 4. Спосіб за п.3, де серцева аритмія являє собою фібриляцію передсердь. 5. Фармацевтичний препарат для інгібування калієвого каналу, який містить фармацевтично прийнятний носій і сполуку, вибрану з групи, яка складається з (R)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (R)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (R)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин3-ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин3-ілетил]піридин-2-іл}метансульфонаміду, (R)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3ілетил]бензонітрилу і (S)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3ілетил]бензонітрилу; або її фармацевтично прийнятну кристалічну форму, або її гідрат. 6. Фармацевтична композиція, яка містить сполуку, вибрану з групи, яка складається з (R)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (R)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (R)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин3-ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин3-ілетил]піридин-2-іл}метансульфонаміду, (R)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3ілетил]бензонітрилу і (S)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3ілетил]бензонітрилу, а також їх фармацевтично прийнятних солей; і фармацевтично прийнятний носій. Даний опис стосується, у широкому значенні, сполук, які використовують як інгібітори калієвого каналу. Сполуки цього класу можуть бути використані як антагоністи Kv1.5 для лікування і попередження серцевих аритмій і т.ін. Передсердна фібриляція (AF) являє собою найбільш поширену стабільну (стійку) серцеву аритмію в клінічній практиці і, ймовірно, рівень поширення цього захворювання зростає разом зі старінням населення. Хоча AF рідко має летальний кінець, це захворювання може ослабити кар 5 діальну функцію і призвести до ускладнень, таких як розвиток застійної серцевої недостатності, тромбоемболія або фібриляція шлуночків. Доступні в цей час антиаритмічні засоби були розроблені для лікування шлуночкової екстрасистолії і передсердної/суправентрикулярної аритмії. Злоякісна шлуночкова екстрасистолія безпосередньо загрожує життю пацієнта і потребує невідкладної медичної допомоги. Фармакотерапія для шлуночкової екстрасистолії включає антиаритмічні засоби класу Іа (наприклад, прокаїнамід, хінідин), класу Іс (наприклад, флекаїнід, пропафенон) і класу III (аміодарон), прийом яких призводить до достовірних ризиків виникнення проаритмії. Ці лікарські засоби класів І і III, як було показано, конвертують AF у синусовий ритм і запобігають рецидиву AF (Mounsey, JP, DiMarco, JP. Circulation, 102:2665-2670), однак вони є провокуючим фактором розвитку шлуночкової проаритмії з потенційно можливим летальним кінцем і тим самим можуть сприяти зростанню смертності (Pratt, CM, Moye, LA, Am J. Cardiol, 65:20B-29B, 1990; Waldo et al, Lancet, 348:7-12, 1996; Torp-Pedersen et al, Expert Opin. Invest. Drugs, 9:2695-2704, 2000). Ці результати спостережень виразно демонструють незадоволену потребу в розробці безпечніших і ефективніших лікарських засобів для лікування передсердних аритмій. Антиаритмічні засоби класу III спричиняють селективне пролонгування APD без істотного пригнічення провідної системи серця або скорочувальної функції міокарда. Єдиним селективним лікарським засобом класу III, дозволеним для клінічного використання в лікуванні передсердної фібриляції, є дофетилід, який опосередковує свої антиаритмічні дії шляхом блокування ІKr, швидко активуючого компонента ІK, виявленого як у передсерді, так і в шлуночку (серця) у людей (Mounsey, JP, DiMarco, JP, Circulation, 102:2665-2670,) Оскільки блокатори ІKr збільшують APD і резистентність, як у передсердях, так і шлуночку, не впливаючи на провідність per se, то теоретично вони являють собою потенційно корисні засоби для лікування аритмій, які подібні до AF (Torp-Pedersen, et al, Expert Opin. Invest. Drags, 9:2695-2704, 2000). Однак, ці засоби, в основному, є відповідальними за підвищення ризику розвитку проаритмії при зменшенні частоти серцевих скорочень. Надшвидкий запізнілий випрямлений K+ струм, ІKur, був виявлений, специфічно, у передсерді людини і не виявлений у шлуночку. Молекулярним корелятом ІKur. У передсерді людини є калієвий канал, що позначається Kv1.5. Вважають, що ІKur вносить істотний внесок у реполяризацію в людському передсерді. Отже, специфічний блокатор ІKur, тобто, сполука, яка блокує Kv1.5, ймовірно, міг би подолати нестачу інших сполук шляхом пролонгування реполяризації через сповільнення реполяризації в передсерді людини, не спричиняючи сповільнення шлуночкової реполяризації, яка лежить в основі аритмогенних слідових деполяризацій і синдрому набутого подовження інтервалу QT, що спостерігаються під час лікування сучасними лікарськими засобами класу III. Блокатори Kv1.5, що мають ці властивості, були описані в (Peukert et al, 88018 6 J. Med. Chem., 46:486-498, 2003; Knobloch et al, Naunyn-Schmedieberg"s Arch. Pharmacol. 366: 482287, 2002; Merck & Co., Inc. WO0224655, 2002). Сполуки, описані в даному винаході, являють собою новий структурний клас антагоніста Kv1.5. Даний винахід стосується сполук формули І, які виявляють антагонізм стосовно калієвого каналу Kv1.5: Сполуки за даним винаходом застосовують для лікування і попередження аритмій серця і т. ін. У межах обсягу даного винаходу також знаходяться фармацевтичні препарати (склади), що містять сполуки формули І і фармацевтичний носій. Даний винахід стосується сполук формули І, які є антагоністами калієвого каналу Kv1.5: де: А, В і С незалежно вибрані з групи, яка складається з: 1) арильного кільця, і 2) гетероарильного кільця, де точкою приєднання до гетероарильного кільця є атом вуглецю і гетероарильне кільце вибране з групи, яка складається з: a) 5-членної ненасиченої моноциклічної структури з 1, 2, 3 або 4 гетероатомами в циклі, вибраними з групи, яка складається з Ν, Ο або S, b) 6-членної ненасиченої моноциклічної структури з 1, 2, 3 або 4 гетероатомами в циклі, вибраними з групи, яка складається з N. О або S, і c) 8-, 9- або 10-членної ненасиченої біциклічної структури з 1, 2, 3 або 4 гетероатомними циклічними атомами, вибраними з групи, яка складається з Ν, Ο або S, зазначене арильне і гетероарильне кільце є незаміщеним. монозаміщеним R4, дизаміщеним групами, незалежно вибраними з R4, тризаміщеним групами, незалежно вибраними з R4, або тетразаміщеним групами, вибраними з R4, і де будьякий стабільний атом S або N гетероарильного або гетероциклічного кільця є незаміщеним або заміщеним оксо. причому заміщення R4 зазначеного гетероарильного кільця знаходяться на одному або декількох атомах вуглецю гетероарильного кільця; за умови, що принаймні один із (замісників) А, В і С являє собою гетероарильне кільце; D вибраний із групи, яка складається з: 1) арильного кільця, 2) гетероарильного кільця, де точкою приєднання до гетероарильного кільця є атом вуглецю і гетероарильне кільце вибране з групи, яка складається з: 7 a) 5-членної ненасиченої моноциклічної структури з 1, 2, 3 або 4 гетероатомами в циклі, вибраними з групи, яка складається з Ν, Ο або S, b) 6-членної ненасиченої моноциклічної структури з 1, 2, 3 або 4 гетероатомами в циклі, вибраними з групи, яка складається з Ν, Ο або S, і c) 8-, 9- або 10-членноі ненасиченої біциклічної структури з 1, 2, 3 або 4 гетероатомними циклічними атомами, вибраними з групи, яка складається з Ν, Ο або S, і 3) (4-6)-членного насиченого гетероциклічного кільця з 1, 2 або 3 гетероатомами в кільці, вибраними з групи, яка складається з Ν, Ο і S, де точкою приєднання до гетероциклічного кільця є атом вуглецю, зазначене арильне. гетероарильне, насичене гетероциклічне кільце є незаміщеним, монозаміщеним R4, дизаміщеним групами, незалежно вибраними з R4, тризаміщеним групами, незалежно вибраними з R4, або тетразаміщеним групами, незалежно вибраними з R4, і де будь-який стабільний атом S або N гетероарильного або гетероциклічного кільця є незаміщеним або заміщеним оксо, причому заміщення R4 зазначеного гетероарильного кільця знаходяться на одному або декількох атомах вуглецю гетероарильного кільця; X і Υ незалежно вибрані з групи, яка складається з Η і OR5; Ra, у кожному випадку, в якому він з'являється, незалежно вибраний із групи, яка складається з водню, С1-С6алкілу і галогену; R4, у кожному випадку, в якому він з’являється, незалежно вибраний із групи, яка складається з водню, галогену, CN, CR4=C(R5)2, (CRa2)nOR5, (CRa2)nN(R5)2, (CRa2)nC(O)R5, N(R5)C(O)R5, 5 5 5 C(O)OR і N(R )S(O)m R ; R5, у кожному випадку, в якому він з'являється, незалежно вибраний із групи, яка складається з водню, незаміщеного або заміщеного С1-С6алкілу, незаміщеного або заміщеного С3-С10циклоалкілу, незаміщеного або заміщеного арилу і незаміщеного або заміщеного гетероциклілу; m дорівнює, незалежно, 0, 1 або 2; і n дорівнює, незалежно, 0, 1, 2, 3, 4, 5 або 6. Вислів "за умови, що принаймні один із (замісників) А, В і С являє собою гетероарильне кільце" означає, що винахід не включає сполуки, в яких А, В і С являють собою одночасно арил. Сполуки за даним винаходом включають сполуки, в яких будьякий один з А, В і С являє собою гетероарильне кільце, сполуки, в яких два з А, В і С являють собою гетероарильні кільця, і сполуки, в яких всі три з А, В і С являють собою гетероарильні кільця. Варіантом (здійснення) винаходу є сполука, де А являє собою гетероарильне кільце, де точкою приєднання до гетероарильного кільця є атом вуглецю, де гетероарильне кільце являє собою 6членну ненасичену моноциклічну структуру з 1 або 2 атомами N у циклі, зазначене гетероарильне кільце є незаміщеним, монозаміщеним R4, диза 88018 8 міщеним групами, незалежно вибраними з R4, тризаміщеним групами, незалежно вибраними з R4, або тетразаміщеним групами, вибраними з R4, і де будь-який стабільний атом N гетероарильного кільця є незаміщеним або заміщеним оксо, причому заміщення R4 зазначеного гетероарильного кільця знаходяться на одному або декількох атомах вуглецю гетероарильного кільця; В являє собою гетероарильне кільце, де точкою приєднання до гетероарильного кільця є атом вуглецю, і гетероарильне кільце являє собою 6членну ненасичен> моноциклічну структуру з 1 або 2 атомами Ν, зазначене гетероарильне кільце є незаміщеним, монозаміщеним R4, дизаміщеним групами, незалежно вибраними з R4, тризаміщеним групами, незалежно вибраними з R4, або тетразаміщеним групами, вибраними з R4, і де будьякий стабільний атом N гетероарильного кільця є незаміщеним або заміщеним оксо, причому заміщення R4 зазначеного гетероарильного кільця знаходяться на одному або декількох атомах вуглецю гетероарильного кільця; С вибраний із групи, що складається з 1) арильного кільця, і 2) гетероарильного кільця, де точкою приєднання до гетероарильного кільця є атом вуглецю, де гетероарильне кільце являє собою 6членну ненасичену моно циклічну структуру з 1 атомом Ν, зазначене арильне і гетероарильне кільце є незаміщеним, монозаміщеним R4, дизаміщеним групами, незалежно вибраними з R4, тризаміщеним групами, незалежно вибраними з R4, або тетразаміщеним групами, вибраними з R4, і де будь-який стабільний атом N гетероарильного або гетероциклічного кільця є незаміщеним або заміщеним оксо, причому заміщення R4 зазначеного гетероарильного кільця знаходяться на одному або декількох атомах вуглецю гетероарильного кільця; і D являє собою гетероарильне кільце, де точкою приєднання до гетероарильного кільця є атом вуглецю, і гетероарильне кільце являє собою 6членну ненасичену моноциклічну структуру з 1 або 2 атомами N у циклі, і зазначене гетероарильне кільце є незаміщеним, монозаміщеним R4, дизаміщеним групами, незалежно вибраними з R4, тризаміщеним групами, незалежно вибраними з R4, або тетразаміщеним групами, вибраними з R4, і де будь-який стабільний атом N гетероарильного кільця є незаміщеним або заміщеним оксо, причому заміщення R4 зазначеного гетероарильного кільця знаходяться на одному або декількох атомах вуглецю гетероарильного кільця; Переважним варіантом даного винаходу є сполука, де X вибраний із групи, яка складається з водню і -ОН; Υ вибраний із групи, яка складається з водню і -ОН; А вибраний із групи, яка складається з 9 В вибраний із групи, яка складається з С вибраний із групи, яка складається з D вибраний із групи, яка складається з 88018 10 11 Прикладом сполуки за даним винаходом є сполука, вибрана з групи, яка складається з (R)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонаміду, (S)-N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансул ьфонамі ду, (R)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансул ьфонаміду, (S)-N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансул ьфонаміду, (R)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2дипіридин-3-ілетил]піридин-2іл}метансульфонаміду, (S)-N-{6-[1-(6-метоксипіридин-2-іл)-2,2дипіридин-3-ілетил]піридин-2іл}метансульфонаміду, (R)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин3-ілетил]бензонітрилу і (S)-3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин3-ілетил]бензонітрилу. Вищеперелічені сполуки є активними в одному або декількох аналізах на Kv1.5, які описані нижче. Інший варіант здійснення винаходу являє собою спосіб лікування або попередження стану у ссавця, лікування або попередження якого здійснюють або полегшують інгібуванням Kv1.5, який включає введення ефективної при інгібуванні Kv1.5 кількості сполук формули І. Переважним варіантом є спосіб лікування або попередження серцевих аритмій, наприклад, передсердної фібриляції, тріпотіння передсердь, аритмії передсердь і суправентрикулярної тахікардії, у ссавця, який включає введення терапевтично ефективної кількості сполуки формули І. Іншим переважним варіантом є спосіб попередження тромбоемболічних ускладнень (подій), таких як інсульт. 88018 12 Іншим переважним варіантом є спосіб попередження застійної серцевої недостатності. Іншим переважним варіантом є спосіб лікування або попередження імунодепресії або розладу, пов'язаного з імунодепресією, такого як СНІД, рак, стареча деменція, травма (включаючи загоєння рани, травматичну операцію, травматичний шок), хронічна бактеріальна інфекція, деякі порушення центральної нервової системи, і стани, що включають резистентність до трансплантації органів або тканини, гомологічні [вторинні] хвороби (реакції "трансплантат проти хазяїна"), викликані трансплантацією кісткового мозку. У межах цього варіанта пропонується також спосіб лікування або попередження імунодепресії шляхом введення сполуки за даним винаходом разом з імунодепресивною сполукою (засобом). Іншим переважним варіантом є спосіб лікування або попередження гліом, включаючи гліоми з невеликим і підвищеним ступенем злоякісності, переважно гліоми з підвищеним ступенем злоякісності. Інший переважний варіант являє собою спосіб індукування у пацієнта, страждаючого на передсердну фібриляцію, стану з нормальним синусовим ритмом, в якому індукований ритм відповідає ритму, який звичайно вважається нормальним для індивідуума, що має схожі з пацієнтом габаритні та вікові характеристики, який включає лікування пацієнта сполукою за даним винаходом. Іншим переважним варіантом є спосіб лікування тахікардії (тобто, збільшення частоти серцевих скорочень, наприклад, 100 ударів за хвилину) у пацієнта, який включає лікування пацієнта пристроєм, що відновлює ритм серця (наприклад, дефібрилятор або пейсмекер (серцевий водій ритму), у комбінації зі сполукою за п.1. 13 88018 Даний винахід також охоплює фармацевтичний препарат (склад), що містить фармацевтично прийнятний носій і сполуку формули І або її фармацевтично прийнятну кристалічну форму або її гідрат. Переважним варіантом є фармацевтична композиція сполуки формули І, що містить, крім того, другий засіб. Сполуки за даним винаходом можуть мати хіральні центри, наприклад, один хіральний центр (забезпечуючи наявність двох стереоізомерів, (R) і (S)), або два хіральні центри (забезпечуючи наявність аж до чотирьох стереоізомерів, (R,R). (S,S), (R,S) і (S,R)). Даний винахід включає всі зазначені ізомери та їхні суміші. Кожного разу, коли не зазначений ізомерний склад, передбачається включення всіх можливих ізомерів. Таутомери сполук, визначених у формулі І. також входять до обсягу даного винаходу. Наприклад, сполуки, що містять карбонільні -СН2С(О)групи (кетогрупи), можуть зазнавати таутомеризму, утворюючи гідроксильні -СНС(ОН )- групи = (енольні форми). До обсягу даного винаходу включені як кето-, так і енольні форми. Крім того, сполуки з вуглець-вуглецевими подвійними зв'язками, можуть існувати в Z- і Εформах, і ці всі ізомерні форми сполук також входять до даного винаходу. Перелік скорочень: AAS AIDS AF АСЕ APD Аr Вос Вос2О СНО dba DEA DMF DMSO EDTA EGTA атомно-абсорбційна спектроскопія синдром набутого іменного дефіциту фібриляція (мерехтіння) передсердь ангіотензинконвертуючий фермент тривалість потенціалу дії аргон бутоксикарбоніл ди-трет-бутилдикарбонат яєчник китайського хом'ячка дибензилідинацетон діетиламін диметилформамід диметилсульфоксид етилендіамінтетраоцтова кислота етиленбіс(оксіетиленнітрило)тетраоцтова кислота ESI електророзпилювальна іонізація Et3N триетиламін EtOAc етилацетат Et2O діетиловий ефір Et3OBF4 тетрафторборат триетилоксонію EtOH етанол FAAS полуменева атомно-абсорбційна спектроскопія FBS фетальна бичача сироватка HBSS збалансований сольовий розчин Хенкса HEPES N-2-гідроксіетилпіперазин-N'-2етансульфонова кислота HPLC високоефективна рідинна хроматографія HRMS мас-спектр високого розрізнення iPrMgCl ізопропілмагнійхлорид i-PrOH ізопропанол INH інгібування LDA літій діізопропіламід LiHMDS літій гексаметилдисилазид 14 LRMS LYS MeOH MS n-BuLi NMR NSAID PBS SUP TAFI TFA THF TsOH мас-спектр низького розрізнення лізат метанол мас-спектр н-бутиллітій ядерно-магнітний резонанс (ЯМР) нестероїдний протизапальний лікарський засіб забуферений фосфатом фізіологічний розчин супернатант тромбін-активований інгібітор фібринолізу трифтороцтова кислота тетрагідрофуран п-толуолсульфокислота Використовуваний тут термін "алкіл", якщо не обумовлено особливо, як мається на увазі, включає насичені аліфатичні вуглеводневі групи як з розгалуженим, так і з прямим ланцюгом, включаючи всі (можливі) ізомери, що містять визначену кількість вуглецевих атомів. Протягом всього опису для алкільних груп використовуються звичайно застосовувані абревіатури, наприклад, метил може бути позначений "Me" або СН3, етил може бути позначений "Et" або СН2СН3, пропіл може бути позначений "Рr" або СН2СН2СН3, бутил може бути позначений "Вu" або СН2СН2СН2СН3 і т. д. "С16алкіл" (або "С1-С6алкіл"), наприклад, означає алкільні групи з прямим або розгалуженим ланцюгом, включаючи всі (можливі) ізомери, що містять визначену кількість вуглецевих атомів. С1-6алкіл включає всі гексилалкільні і пентилалкільні ізомери, а також н-, ізо-, втор- і трет-бутил, н- та ізопропіл, етил і метил. " С1-4алкіл" означає н-, ізо-, вторі трет-бутил, н- і ізопропіл, етил і метил. Термін "алкокси" являє пряму або розгалужену алкільну групу із зазначеною кількістю атомів вуглецю, приєднану через кисневий місток. Термін "алкеніл" включає ненасичені вуглеводневі групи з прямим або розгалуженим ланцюгом, що містять принаймні два вуглецевих атоми, сполучені подвійним зв'язком. Алкен, етилен позначають, наприклад, як "СН2СН2" або альтернативно, як "Η2Ο=CΗ2", "С2-5алкеніл" (або "С2С5алкеніл"), наприклад, означає алкенільні групи з прямим або розгалуженим ланцюгом, що містять від 2 до 5 атомів вуглецю, і включає всі пентенільні ізомери, а також 1-бутеніл, 2-бутеніл, 3-бутеніл, 1пропеніл, 2-пропеніл і етеніл (або етиленіл). Подібні терміни, такі як "С2-3алкеніл", мають аналогічне значення. Термін "алкініл" включає ненасичені вуглеводневі групи з прямим або розгалуженим ланцюгом, що містять принаймні два вуглецевих атоми, сполучені потрійним зв'язком. Алкін, ацетилен позначають, наприклад, як "СНСН" або альтернативно, як "НСºСН". " С2-5алкініл" (або "С2-С5алкініл"), наприклад, означає алкінільні групи з прямим або розгалуженим ланцюгом, що містять від 2 до 5 атомів вуглецю, і включає всі пентинільні ізомери, а також 1-бутиніл, 2-бутиніл, 3-бутиніл, 1-пропініл, 2-пропініл і етиніл (або ацетиленіл). Подібні терміни, такі як "С2-3алкініл", мають аналогічне значення. 15 88018 Якщо конкретно не обумовлено інакше як тільки "незаміщений" або тільки "'заміщений", то алкільні, алкенільні та алкінільні групи є незаміщеними або заміщені 1-3 замісниками на кожному вуглецевому атомі, вибраними з галогену, С1-С20алкілу, CF3, NH2, N(С1-С6алкіл)2, NO2, оксо, CN, N3, -ОН, О(С1-С6алкілу), С3-С10циклоалкілу, С2-С6алкенілу, С2-С6алкінілу, (С0-С6алкіл)S(O)0-2-, (С0С6алкіл)S(O)0-2(С0-С6алкіл)-, (С0-С6алкіл)С(O)NH, H2N-C(NH)-, -О(С1-С6алкіл)СF3, (С0-С6алкіл)С(О)-, (С0-С6алкіл)ОС(О)-, (С0-С6алкіл)О(С1-С6алкіл)-, (С0-С6алкіл)С(О)1-2(С0-С6алкіл)-, (С0С6алкіл)ОС(О)NH-, -NH(С1-С6алкіл)NHС(О)NH(С1С6алкіл), -NH(С1-С6алкіл)NHSО2(С1-С6алкіл), -(С1С6алкіл)NHSО2(С1-С6алкіл), арилу. аралкілу, гетероциклу, гетероциклілалкілу, галогенарилу, галогенаралкілу, галогенгетероциклу, галогенгетероциклілалкілу, ціаноарилу, ціаноаралкілу, ціаногетероциклу і ціаногетероциклілалкілу. Термін "C0", що використовується у висловах, таких як "С0-6алкіл". означає прямий ковалентний зв'язок. Аналогічно, у тих випадках, коли ціле число, що визначає наявність визначеного числа атомів у групі, дорівнює нулю, це означає, що атоми, які знаходилися поруч, зв’язані безпосередньо зв'язком. Наприклад, у структурі де s є цілим числом, що дорівнює нулю, 1 або 2, вищезгадана структура являє собою , коли s дорівнює нулю. Термін "С3-8циклоалкіл" (або "С3С8циклоалкіл") означає циклічну структуру алкану, що містить, сумарно, від трьох до восьми атомів вуглецю (тобто, циклопропіл, циклобутил. циклопентил. циклогексил, циклогептил або циклооктил). Терміни "С3-7циклоалкіл", "С3-6циклоалкіл", "С5-7циклоалкіл" і т.ін. мають аналогічні значення. Термін "галоген" (або "гало") стосується фтору, хлору, брому або йоду (що альтернативно позначаються F, СІ, Вr і І). Термін "С1-6галогеналкіл'* (який альтернативно може бути названий як "С1-С6галогеналкіл'" або "галогенований С1-С6алкіл'") означає (С1-С6) пряму або розгалужену алкільну групу, визначену вище, з одним або декількома замісниками-галогенами. Термін "С1-4галогеналкіл" має аналогічне значення. Термін "С1-6фторалкіл" має аналогічне значення, за винятком того, що замісники-галогени обмежені фтором. Придатні фторалкіли включають ряд (CH2)0-4CF3 (тобто, трифторметил, 2,2,2трифторетил, 3,3,3-трифтор-н-пропіл і т.д.). Використовуваний тут термін "карбоцикл (вуглецевий цикл)" (і його варіації, такі як '"карбоциклік" або "карбоцикліл"), якщо не обумовлено інакше, стосується (і) (С3-C8) моноциклічної насиченої або ненасиченої циклічної структури або (іі) (С7-С12) біциклічної насиченої або ненасиченої циклічної структури. Кожний цикл у (іі) є або незалежним, або конденсованим з іншим циклом, і кожний цикл є насиченим або ненасиченим. Карбоцикл може бути приєднаний до залишку моле 16 кули при будь-якому вуглецевому атомі, за умови утворення при цьому стабільної сполуки. Конденсовані біциклічні карбоциклічні структури являють собою підмножину карбоциклічних структур; тобто, термін "конденсований біциклічний карбоцикл"', як правило, стосується (С7-С10)біциклічної структури, в якій кожний цикл (кільце) є насиченим або ненасиченим і в якій два сусідніх вуглецевих атоми належать (одночасно) коленому з циклів у зазначеній циклічній структурі. Конденсований біциклічний карбоцикл, в якому один цикл (кільце) є насиченим і інший цикл (кільце) - насиченим, являє собою насичену біциклічну структуру. Конденсований біциклічний карбоцикл, в якому одне кільце являє собою бензол, а інше кільце є насиченим, являє собою ненасичену біциклічну структуру. Конденсований біциклічний карбоцикл, в якому одне кільце являє собою бензол і інше кільце є ненасиченим, являє собою ненасичену циклічну структуру. Насичені карбоциклічні структури також називають циклоалкілами, наприклад, циклопропіл. циклобутил, і т. д. Якщо не обумовлено інакше, карбоцикл є незаміщеним або заміщений С16алкілом, С1-6алкенілом, С1-6алкінілом, арилом, галогеном, NH2 або ОН. Підмножина конденсованих біциклічних ненасичених карбоциклів являє собою біциклічні карбоцикли, в яких одне кільце являє собою бензол і інше кільце є насиченим або ненасиченим, із приєднанням через будь-який атом вуглецю, з утворенням стабільної сполуки. Типові приклади цієї підмножини включають нижченаведене: Термін "арил"' стосується ароматичних моно- і полікарбоциклічних структур, в яких індивідуальні карбоцикли в поліциклічних структурах конденсовані або зв'язані один з одним за допомогою простого (ординарного) зв'язку. Придатні арильні групи включають феніл, нафтил і біфеніленіл. Термін "гетероцикл" (і його варіації, такі як "гетероциклік" або "гетероцикліл"), у широкому значенні, стосується (і) стабільної (4-8)-членної, насиченої або ненасиченої моноциклічної структури, або (іі) стабільної (7-12)-членної біциклічної структури, де кожний цикл у (іі) є незалежним від, або конденсований з іншим циклом або циклами і кожний цикл є насиченим або ненасиченим, і моноциклічна структура або біциклічна структура містить один або декілька гетероатомів (наприклад, від 1 до 6 гетероатомів, або від 1 до 4 гетероатомів), вибраних із N, О і S, і баланс вуглецевих атомів (моноциклічна структура звичайно містить принаймні один атом вуглецю і циклічні структури звичайно містять принаймні два атоми вуглецю); і де будь-який один або декілька з гетероатомів азоту і сірки необов’язково знаходиться в окисленій формі, і будь-який один або декілька з гетероатомів азоту необов'язково кватернізовані. Якщо не обу 17 мовлено особливо, гетероциклічна структура може бути приєднана при будь-якому гетероатомі або атомі вуглецю, за умови, що приєднання приводить до створення стабільної структури. Якщо не обумовлено інакше, то очевидно, що в тих випадках, коли гетероциклічна структура має замісники, ці замісники можуть бути приєднані до будь-якого атома в циклі, будеце гетероатом або атом вуглецю, за умови, що при цьому буде одержана стабільна хімічна структура. Якщо спеціально не обумовлено інакше як тільки "незаміщений" або тільки "заміщений", то циклоалкільні, арильні і гетероциклічні групи є незаміщеними або заміщеними. Використовувані тут терміни "заміщений С3-С10циклоалкіл", "заміщений арил" і "заміщений гетероцикл", як мається на увазі, включають циклічну групу, що містить від 1 до 3 замісників крім точки приєднання до затишку сполуки. Переважно, замісники вибирають із групи, яка включає, але ними не обмежується, галоген, С1-С20алкіл, CF3, NH2, N(C1-C6алкіл)2, NO2, оксо, CN, N3, -ОН, -О(C1-C6алкіл), С3-С10циклоалкіл, С2С6алкеніл, С2-С6алкініл, (С0-С6алкіл)С(О)0-2-, арилС(О)0-2-, (С0-С6алкіл)S(O)0-2(С0-С6алкіл)-, (С0С6алкіл)С(О)NН-, H2N-C(NH)-, -О(С0-С6алкіл)СF3, (С0-С6алкіл)С(О)-, (С0-С6алкіл)ОС(О)-, (С0С6алкіл)О(C1-C6алкіл)-, (С0-С6алкіл)С(O)1-2(С0С6алкіл)-, (С0-С6алкіл)ОС(О)NHі-, арил, аралкіл, гетероарил, гетероциклілалкіл, галогенарил, галогенаралкіл, галогенгетероцикл, галогенгетероциклілалкіл, ціаноарил, ціаноаралкіл, ціаногетероцикл і ціаногетероциклілалкіл. Насичені гетероцикли утворюють підмножину гетероциклів; тобто, термін "насичений гетероцикл" звичайно стосується гетероциклу, визначеного вище, в якому циклічна структура, загалом, (моно- або поліциклічна) є насиченою. Термін "насичена гетероциклічна структура" стосується (4-8)членної насиченої моноциклічної структури або стабільної (7-12)-членної біциклічної структури, яка складається з вуглецевих атомів і одного або декількох гетероатомів, вибраних із Ν, Ο i S. Типові приклади включають піперидиніл, піперазиніл, азепаніл, піролідиніл, піразолідиніл, імідазолідиніл, оксазолідиніл, ізоксазолідиніл, морфолініл, тіоморфолініл, тіазолідиніл, ізотіазолідиніл і тетрагідрофурил (або тетрагідрофураніл). Гетероароматичні цикли утворюють іншу підмножину гетероциклів; тобто, термін "гетероароматичний цикл" (альтернативно "гетероарил") звичайно стосується гетероциклу, визначеного вище, в якому циклічна структура, загалом, (моно- або поліциклічна) являє собою ароматичну циклічну структуру. Термін "гетероароматична циклічна структура" стосується 5- або 6-членної моноциклічної ароматичної структури або (7-12)-членної біциклічної структури, яка складається з атомів вуглецю і одного або декількох гетероатомів, вибраних із N, О і S. У випадку заміщених гетероарилів, що містять принаймні один атом азоту (наприклад, піридин), такі заміщення можуть бути заміщеннями, що приводять до утворення Nоксиду. Типові приклади гетероароматичних циклів включають піридил, піроліл, піразиніл, піримідиніл, піридазиніл, тієніл, (або тіофеніл), тіазоліл, 88018 18 фураніл, імідазоліл, піразоліл. триазоліл, тетразоліл, оксазоліл, ізооксазоліл, оксадіазоліл, тіазоліл, ізотіазоліл і тіадіазоліл. Типові приклади біциклічних гетероциклів включають бензотриазоліл, індоліл, ізоіндоліл, індазоліл, індолініл, ізоіндолініл, хіноксалініл, хіназолініл, цинолініл, хроманіл, ізохроманіл, тетрагідрохінолініл, хінолініл, тетрагідроізохінолініл, ізохінолініл, 2,3-дигідробензофураніл, 2,3дигідробензо-1,4-діоксиніл (тобто зо(2,1-b) (1,3)тіазол (тобто, діоксоліл (тобто, тут, ) і, іміда) і бензо-1,3 ). У деяких контекстах альтернативно називають фенілом, що має замісник, метилендіокси, приєднаний до двох сусідніх атомів вуглецю. Якщо спеціально не обумовлено зворотне, то '"ненасичений" цикл являє собою частково або повністю ненасичене кільце. Наприклад, "ненасичений моноциклічний С6карбоцикл"' стосується циклогексену, циклогексадієну і бензолу. Якщо спеціально не обумовлено зворотне, то всі діапазони, цитовані тут, носять охоплюючий характер. Наприклад, гетероцикл, описаний як такий, що містить від "1 до 4 гетероатомів"', означає, що гетероцикл може містити 1, 2, 3 або 4 гетероатоми. Якщо яка-небудь змінна зустрічається більше ніж один раз в якому-небудь замісникові або в якій-небудь формулі, що зображає або описує сполуки за даним винаходом, то її визначення в кожному випадку не залежить від її визначення в кожному іншому випадку. Крім того, комбінації замісників і/або змінних допустимі тільки в тих випадках, якщо такі комбінації приводять до утворення стабільних сполук. Термін "заміщений" (наприклад, як у вислові "арил, який необов'язково заміщений одним або декількома замісниками... ") включає моно- і полізаміщені названим замісником у ступені, в якому таке разове і кратне заміщення (включаючи кратне заміщення в одному і тому ж місці) хімічно допустиме. У сполуках за даним винаходом, які мають піридил-N-оксидні частини, піридил-N-оксидну частину структурно зображають, використовуючи звичайні представлення, такі як , які мають еквівалентні значення. Для визначень змінних, що містять терміни, які мають повторювані елементи, наприклад, (CRiRj)r, де r являє ціле число, що дорівнює 2, Ri являє собою визначену змінну і Rj являє собою визначену змінну, значення Ri може відрізнятися (із визначення) у кожному випадку, в якому Ri зустрічається, і Rj може відрізнятися у кожному випадку, в якому Rj має місце. Наприклад, якщо Ri і Rj незалежно вибрані з групи, яка складається з метилу, 19 етилу, пропілу і бутилу, то (CRiRj)2 може являти собою Фармацевтично прийнятні солі включають як солі металів (неорганічні солі), так і органічні солі; перелік яких наводиться в Remington's Pharmaceutical Sciences, 17th Edition, pg. 1418 (1985). Фахівцеві в даній галузі відомо, що придатну сольову форму вибирають, виходячи з фізичної і хімічної стабільності, текучості (сипкості порошкоподібних речовин), гігроскопічності та розчинності. Як очевидно фахівцям у даній галузі, фармацевтично прийнятні солі включають, але не обмежуються ними, солі неорганічних кислот, такі як гідрохлорид, сульфат, фосфат, дифосфат, гідробромід і нітрат, або солі органічних кислот, такі як малат, малеат, фумарат, тартрат, сукцинат, Змінні А, В, С і D на схемі мають значення, визначені у "формулі І". Приклад 1-1 (R і S) N-{6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонамід До суміші 6-бром-2-піридинкарбоксальдегіду (6,12г, 32,90ммоль) у безводному THF (150мл) при (@) -78°С в атмосфері N2 додають по краплях 4фторфенілмагнійбромід (2М у діетиловому ефірі, 17,27мл). Реакційну суміш нагрівають до 0°С і перемішують протягом 1.5 годин. Реакцію гасять насиченим водним NH4CI. Об'єднані органічні шари сушать (безводний Na2SO4), фільтрують і кон 88018 20 цитрат, ацетат, лактат, метансульфонат, птолуолсульфонат або пальмоат, саліцилат і стеарат. Аналогічно, фармацевтично прийнятні катіони включають, але ними не обмежуються, натрій, калій, кальцій, алюміній, літій і амоній (особливо, солі амонію з вторинними амінами). Переважні солі за даним винаходом, за визначеними вище причинами, включають солі калію, натрію, кальцію і амонію. В обсяг даного винаходу включені також кристалічні форми, гідрати і сольвати сполук Формули І. Способи одержання сполук за даним винаходом проілюстровані на схемах, наведених нижче. Протоколи інших синтезів зазначених сполук очевидні фахівцям у даній галузі техніки. Приклади ілюструють одержання сполук Формули І і ці приклади не треба розглядати як обмеження даного винаходу, викладеного в нижченаведеній формулі винаходу. центрують, одержуючи (6-бромпіридин-2-іл)(4фторфеніл)метанол. 1 H ЯМР (500МГц, CDCI3) δ 7,50 (т, 1Н, J=7,7), 7,40 (д 1H, J=7,8), 7,38-7,32 (м, 2H), 7,10 (д, 1Н, J=7,6), 7,03 (т, 2H, J=8,7), 5,73 (д, 1Н, J=4,2), 4,43 (д, 1Н, J=4,4). LRMS m/z (M+H) обчислено: 282,0, знайдено: 282,0. Стадія В До суміші (6-бромпіридин-2-іл)(4фторфеніл)метанолу в СН2СI2 (120мл) при 0°С додають SOCI2 (5,870г, 49,34ммоль). Суміші дають можливість повільно нагрітися до кімнатної температури і перемішують протягом 16 годин. Суміш знову охолоджують до 0°С і гасять насиченим водним NaHCO3. Одержану суміш екстрагують (3´СН2СІ2. Об'єднані органічні екстракти сушать (безводний Na2SO4), фільтрують і концентрують. Одержаний залишок очищають хроматографією на силікагелі (20-30% СН2СІ2 у гексанах), одержуючи 2-бром-6-[хлор(4-фторфеніл)метил]піридин. 21 1 Н ЯМР (500МГц, CDCI3) δ 7.58 (т, 1Н, J=7,7). 7,51 (д 1Н, J=7,6). 7,47-7,39 (м, 3Н), 7,04 (т, 2Н, J=8,7), 6,08 (с, 1H). LRMS m/z (М+Н) обчислено: 300,0, знайдено: 300,0. Стадія С До розчину 3-(піридин-3-ілметил)піридину (2,5г, 14,69ммоль) у безводному THF (75мл) в атмосфері N2. Суміш охолоджують до -78°С і по краплях додають LDA (12.24мл, 1,8М). Суміш перемішують при -78°С протягом 1 години і додають 2бром-6-[хлор(4-фторфеніл)метил]піридин (4,64г, 15,42ммоль). Суміш нагрівають до 0°С і перемішують протягом 2 годин. Реакційну суміш гасять насиченим водним NH4CI та екстрагують Зх EtOAc. Об'єднані органічні екстракти сушать (безводний Na2SO4), фільтрують і концентрують. Одержаний залишок очищають хроматографією на силікагелі (1-3% МеОН у СН2СІ2), одержуючи 2бром-6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин. 1 H ЯМР (500МГц, CDCI3) δ 8,55 (д. 1Н, J=2,0), 8,45 (д, 1H, J=2,0), 8,35-8,29 (м, 2H), 7,60 (дт, 1Н, J=7,9, 1,9), 7,49 (дт, 1Н, J=7,9, 1,9), 7,35-7,24 (м, 3Н), 7,17 (д, 1Н, J=7,8), 7,14-7,07 (м. 2Н), 7,05 (д, 1Н, J=7,6), 6,86 (т, 2Н, J=8,7), 5.13 (д, 1Н, J=12.2), 4,78 (д, 1Н, J=12,0) LRMS m/z (M+H) обчислено: 434,0, знайдено: 434,0. Рацемічну суміш розділяють за допомогою ChiralPak AD (30% іРгОН у гексані+DEA 1мл/л). Перший пік являє собою енантіомер А 2-бром-6-[1(4-фторфеніл)-2,2-дипіридин-3-ілетил] піридин; HRMS m/z (M+H) обчислено 434,0663, знайдено: 434,0648. І другий пік являє собою енантіомер В 2бром-6-[1-(4-фторфеніл)-2,2-дипіридин-3ілетил]піридин; HRMS m/z (M+H) обчислено 434,0633, знайдено: 434,0646. Стадія DСуміш 2-бром-6-[1-(4-фторфеніл)-2,2дипіридин-3-ілетил]піридину (енантіомер А) (0.550г, 1,266ммоль), метансульфонаміду (0,144г, 1,518ммоль). Cs2CO3 (0,578г, 1,774ммоль), Pd2(dba)3 (23 мг, 0,025ммоль) і ксантфосу (44мг, 0,076ммоль) перемішують у безводному діоксані (5мл). Суміш дегазують (3´насос/N2) і нагрівають до 100°С протягом 16 годин в атмосфері N2. Суміш охолоджують до кімнатної температури, розводять СНСl3 і фільтрують через подушку целіту. Целіт промивають СНСl3 і EtOAc. Фільтрат концентрують і очищають хроматографією на силікагелі (1-5% МеОН у СН2Сl2), одержуючи енантіомер А N-{6-[1(4-фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2іл}метансульфонаміду. 1 H ЯМР (500МГц, d6 ДМСО) δ 10,51 (с, 1Н), 8,64 (д, 1H, J=2,0), 8,59 (д, 1Н, J=2,0), 8,23 (дд, 2Н, J=4,6, 1,5), 7,90 (дт, 1Н, J=8,0, 1,9), 7,87 (д, 1Н, J=7,8), 7,60-7,2 (m, 2H), 7,47 (т, 1H, J=7,8), 7,247,15 (м, 2Н), 7,01 (д, 1Н, J=7,3), 6,96 (т, 2Η, J=8,9), 6,54 (д, 1Н, J=8,0), 5,37 (д, 1H, J=12,2), 5,13 (д, 1Н, J=12,5), 3,43 (с, 3Н). HRMS m/z (M+H) обчислено: 449,1442, знайдено: 449,1450. Енантіомер В N-{6-[1-(4фторфеніл)-2,2-дипіридин-3-ілетил]піридин-2іл}метансульфонаміду (HRMS m/z (M+H) обчисле 88018 22 но: 449,1442. знайдено: 449,1459) синтезують, використовуючи спосіб, описаний вище, за винятком того, що як вихідну речовину (на цій стадії) використовують енантіомер В 2-бром-6-[1-(4фторфеніл)-2,2-дипіридин-3-ілетил]піридин. Приклад 1-2 (R і S) N-{6-[1-(3-ціанофеніл)-2,2-дипіридин-3ілетил]піридин-2-іл}метансульфонамід До суміші 2,6-дибромпіридину (6г, 25,33ммоль) у безводному THF (150мл) в атмосфері N2 при 78°С додають по краплях H-BuLi (10,13мл, 2,5М). Суміш перемішують при -78°С протягом 15 хвилин і додають 3-ціанобензальдегід (3,32г, 25,33ммоль) у безводному THF (10мл, промитий 5мл). Суміш перемішують протягом 20 хвилин при -78°С, потім нагрівають до 0°С і перемішують протягом 1 години. Суміш гасять насиченим водним NH4CI, і одержану суміш екстрагують (3´ЕtOАс. Об'єднані органічні екстракти сушать (безводний Na2SO4), фільтрують і концентрують. Залишок очищають хроматографією на силікагелі (15-30% ЕtOАс у гексанах), одержуючи 3-[(6-бромфеніл-2іл)(гідрокси)метил]бензнітрил. LRMS m/z (М+Н) обчислено: 289,0, знайдено 289,1. Стадія В До суміші 3-[(6-бромпіридин-2іл)(гідрокси)метил]бензнітрилу (4,88г, 16,88ммоль) у СН2Сl2 (60мл) при 0°С в атмосфері N2 додають SOCI2 (2,01мл, 16,88ммоль). Суміш нагрівають до кімнатної температури, і перемішують протягом 48 годин. Суміш охолоджують до 0°С і гасять насиченим водним бікарбонатом натрію та екстрагують 3х СН2Сl2. Об'єднані органічні екстракти сушать (безводний Na2SO4), фільтрують і концентрують. Залишок очищають хроматографією на силікагелі (25-50% СН2Сl2 у гексанах), одержуючи 3-[(6бромпіридин-2-іл)(хлор)метил]бензонітрил. LRMS m/z (М+Н) обчислено: 307,0, знайдено: 307,0. Стадія С До суміші 3-(піридин-3-ілметил)піридину (0,700г, 4,11ммоль) у безводному THF (20мл) при 78°С в атмосфері N2 додають по краплях LDA (3,43мл, 1,8Μ). Суміш перемішують протягом 1 години при -78°С і додають 3-[(6-бромпіридин-2іл)(хлор)метил]бензонітрил. Реакційну суміш нагрівають до 0°С і перемішують протягом 2 годин. Одержану суміш гасять насиченим водним NH4CI і екстрагують (3´ЕtOАс. Об'єднані органічні екстракти сушать (безводний Na2SO4), фільтрують і концентрують. Залишок очищають хроматографією на силікагелі (1-4% МеОН у СН2Сl2), одержуючи рацемічний 3-[1-(6-бромпіридин-2-іл)-2,2-дипіридин3-ілетил]бензонітрил LRMS m/z (M+H) обчислено: 441,0, знайдено 441,0. Рацемічну суміш розділяють за допомогою ChiralPak AD (градієнтне елюю 23 вання сумішшю 40% іРrОН у гексанах+імл/л DEA до 80% іРrOН у гексанах+1мл/л DEA протягом 45 хвилин). Перший пік являє собою енантіомер А 3[1-(6-бромпіридин-2-іл)-2,2-дипіридин-3ілетил]бензонітрилу, і другий пік являє собою енантіомер В 3-[1-(6-бромпіридин-2-іл)-2,2-дипіридин3-ілетил]бензонітрилу. Стадія D Суміш енантіомера А 3-[1-(6-бромпіридин-2іл)-2,2-дипіридин-3-ілетил]бензонітрилу (0,318г, 0,721ммоль), метансульфонаміду (0,082г, 0,865ммоль), Cs2CO3 (0,329г, 1,01ммоль), Pd2(dba)3 (13мг, 0,014ммоль) і ксантфосу (25мг, 0,043ммоль) перемішують у безводному діоксані (5мл). Суміш дегазують (3´ насоc/N2) і нагрівають до 100°С протягом 16 годин в атмосфері N2. Реакційну суміш охолоджують до кімнатної температури, розводять СНСІ3, і фільтрують через подушку целіту. Целіт промивають СНСІ3 і ЕtOАс, щоб позбутися домішок. Потім целіт промивають МеОН. Фільтрат концентрують і очищають хроматографією на силікагелі (1-5% МеОН у СН2Сl2), одержуючи енантіомер А N-{6-[1-(3-ціанофеніл-2,2дипіридин-3-ілетил]піридин-2іл}метансульфонаміду. 1 H ЯМР (500МГц, d6 ДМСО) δ 10,57 (с, 1H), 8,63 (дд, 2Н, J=5,6, 2,0), 8,29-8,20 (м, 2Н), 8,04 (с, 1H), 7,90 (д, 2Н, J=8,1), 7.84 (д, 1Н, J=7,8), 7,557,45 (м, 2Н), 7,35 (т, 1Н, J=7,8), 7,20 (дд, 2Н, J=7,9, 4,8), 7,03 (д, 1Н, J=7,3), 6,57 (д, 1Н, J=8,0), 5,47 (д, 1Н, J=12,5), 5,15 (д, 1Н, J=12,2), 3,46 (с, 3Н). HRMS m/z (M+H) обчислено: 456,1489, знайдено: 456,1460. Енантіомер В N-{6-[1-(3ціанофеніл)-2,2-дипіридин-3-ілетил]піридин-2іл}метансульфонаміду (HRMS m/z (M+H) обчислено: 456,1489, знайдено: 456,1469) синтезують, використовуючи спосіб, описаний вище, за винятком того, що як вихідну речовину (на цій стадії) використовують енантіомер В 3-[1-(6-бромпіридин2-іл)-2,2-дипіридин-3-ілетил]бензонітрилу. Приклад 1-3 (R і S) N-{6-[1-(6-метоксипіридин-2-іл)-2,2дипіридин-3-ілетил]піридин-2іл}метансульфонамід До суміші 2-бром-6-метоксипіридину (5,00г, 26,59ммоль) у безводному THF (100мл) при -78°С в атмосфері N2 додають по краплях H-BuLi (11,701мл, 2,5М). Суміш перемішують протягом 20 хвилин і додають 6-бром-2піридинкарбоксальдегід (4,95г, 26,93ммоль). Суміш нагрівають до 0°С і перемішують протягом 1 години. Одержану суміш гасять насиченим водним NH4CI і екстрагують 3´ЕtOАс. Об'єднані органічні екстракти сушать (безводний Na2SO4), фільтрують і концентрують. Залишок очищають хроматографі 88018 24 єю на силікагелі (15% ЕtOАс у гексанах), одержуючи (6-бромпіридин-2-іл)(6-метоксипіридин-2іл)метанол. 1 H ЯМР (500МГц, CDCI3) δ 7,60-7,49 (м, 3Н), 7,37 (дд, 1Н, J=7,1, 1,5), 7,12 (д, 1Н, J=7,3), 6,64 (д, 1Н, J=8,3), 5,78 (д, 1Н, J=5,4), 5,27 (д, 1Н, J=5,4), 3,97 (с, 3Н). LRMS m/z, (M+H) обчислено: 295,0, знайдено 295,1. Стадія В До суміші (6-бромпіридин-2-іл)(6метоксипіридин-2-іл)метанолу (5,11г, 17,31ммоль) у СН2Сl2 (56мл) при 0°С в атмосфері N2 додають SOCI2 (3,09г, 25,97ммоль). Потім суміші надають можливість нагрітися до кімнатної температури протягом 3 годин. Потім суміш знову охолоджують до 0°С і гасять насиченим водним бікарбонатом натрію. Одержану суміш екстрагують 3´СН2Сl2. Об'єднані органічні екстракти сушать (Na2SO4), фільтрують і концентрують. Одержаний залишок очищають хроматографією на силікагелі (25-35% СН2Сl2 у гексанах), одержуючи 2-бром-6-[хлор(6метоксипіридин-2-іл)метил]піридин. 1 H ЯМР (500МГц, CDCI3) δ 7,76 (д, 1Н, J=7,8), 7,61-7,54 (м, 2Н), 7,41 (д, 1Н, J=7,8), 7,12 (д. 1Н, J=7,1), 6,66 (д, 1Н, J=8,3), 6,02 (с, 1Н), 3,86 (с, 3Н). LRMS m/z (M+H) обчислено: 313,0, знайдено: 312,9 Стадія С До суміші 3-(піридин-3-ілметил)піридину (2г, 11,75ммоль) у безводному THF (40мл) при -78°С в атмосфері N2 додають по краплях LDA (9,79мл, 1,8М). Суміш перемішують при -78С протягом 1 години і додають 2-бром-6-[хлор(6метоксипіридин-2-іл)метил]піридин. Суміш нагрівають до 0°С і перемішують протягом 2 годин. Реакційну суміш гасять насиченим водним NH4CI і екстрагують 3´ЕtOАс. Об'єднані органічні екстракти сушать (безводний Na2SO4), фільтрують і концентрують. Залишок очищають хроматографією на силікагелі (1-5% МеОН у СН2Сl2), одержуючи 2бром-6-[1-(6-метоксипіридин-2-іл)-2,2-дипіридин-3іл етил] піридин. 1 H ЯМР (500МГц, CDCI3) δ 8,51 (т, 2Η, J=2,7), 8,36-8,28 (м, 2H), 7,69 (дт, 1Н, J=8,1, 2,0), 7,58 (дт, 1Н, J=8,0, 1,9) 7,50 (д, 1Н, J=7,6), 7,38-7,30 (м, 2Н), 7,18 (д, 1Н, J=7,8), 7,13 (дд, 1Н, J=7,9, 4,8), 7,09 (дд, 1Н, J=7,8, 4,9), 6,86 (д, 1Н, J=7,3), 6,45 (д, 1Н, J=8,1), 5,27 (д, 1Н, J=12,2), 5,06 (д, 1Н, J=12,5), 3,95 (с, 3Н). LRMS m/z (M+H) обчислено: 447,1, знайдено: 447.1. Рацемічну суміш розділяють за допомогою ChiralPak AD (40% EtOH у гексанах+DEA 1мл/л). Перший пік являє собою енантіомер А 2-бром-6-[1(6-метоксипіридин-2-іл)-2,2-дипіридин-3ілетил]піридину і другий пік являє собою енантіомер В 2-бром-6-[1-(6-метоксипіридин-2-іл)-2,2дипіридин-3-ілетил]піридину. Стадія D Суміш енантіомера А 2-бром-6-[1-(6метоксипіридин-2-іл)-2,2-дипіридин-3ілетил]піридину (1,00г, 2,235ммоль), метансульфонаміду (0,255г, 2,683ммоль), Cs2CO3 (1,02г, 3,13ммоль), Pd2(dba)3 (41мг, 0.045ммоль) і ксанфосу (78мг, 0,134ммоль) у безводному діоксані 25 (10мл) в атмосфері N2 дегазують (3´нacoc/N2) і нагрівають до 100°С протягом 16 годин. Суміш охолоджують до кімнатної температури і розводять СНСl3. Суміш фільтрують через подушку целіту і промивають СНСl3 і ЕtOАс. Фільтрат концентрують і очищають хроматографією на силікагелі (1-5% МеОН у СН2Сl2). Потім суміш очищають ВЕРХ із кислотною оберненою фазою (градієнт 95% Н2О:5% CH3CN до 100% CH3CN+0,1% TFA). Фракції концентрують, потім гасять насиченим водним бікарбонатом натрію та екстрагують 3´ЕtOАс. Об'єднані органічні екстракти сушать (безводний Na2SO4), фільтрують і концентрують, одержуючи N-{6-[1-(6-метоксипіридин-2-іл)-2,2дипіридин-3-ілетил]піридин-2іл}метансульфонамід. 1 H ЯМР (500МГц, d6 ДМСО) δ 10,43 (с, 1H), 8,64 (д, 2Н, J=8,3), 8,22 (т, 2Η, J=5,2), 7,91 (тд, 2Н, J=6,2, 1,8), 7,55-7,40 (м, 2Н), 7,25-7,10 (м, 3Н) 7,06 (д, 1Н, J=7,3), 6.55 (д, 1Н, J=7,6), 6,44 (д, 1Н, J=8.1), 5,43 (д, 1Н, J=12,2), 5,39 (д, 1Н, J=12,2). 3.82 (с, 3Н), 3,45 (с, 3Н). LRMS m/z (M+H) обчислено: 462,1595, знайдено 462,1597. Енантіомер В N-{6-[1-(6-метоксипіридин-2-іл)2,2-дипіридин-3-ілетил]піридин-2-іл) метансульфонаміду (LRMS m/z (M+H) обчислено: 462,1595. знайдено 462,1597) синтезують, використовуючи спосіб, описаний вище, за винятком того, що як вихідну речовину (на цій стадії) використовують енантіомер В 2-бром-6-[1-(6-метоксипіридин-2-іл)2,2-дипіридин-3-ілетил]піридину Приклад 1-4 (R і S)-3-[1-(2-амінопіридин-4-іл)-2,2дипіридин-3-ілетил]бензонітрил До розчину 4-йод-2-(метилтіо)піримідину (2,52г, 10ммоль) у THF (50мл) при 0°С додають iPrMgCl (5мл, 2,0 Μ, 10ммоль) і перемішують протягом 1 години. Додають 3-ціанобензальдегід (1,31г, 10ммоль). Суміш перемішують при 0°С протягом 2 годин. Реакційну суміш гасять насиченим водним розчином NH4CI і екстрагують СН2СІ2. Об’єднаний органічний шар сушать, фільтрують і концентрують. Залишок очищають хроматографією на силікагелі (20-50% ЕtOАс у гексані), одержуючи 3-{гідрокси[2-(метилтіо)піримідин-4іл]метил}бензонітрил. 1 H ЯМР (500МГц, CDCI3) δ 8,46 (д, 1Н, J=5,1), 7,72 (с, 1Н), 7,65 (д, 1Н, J=7,9), 7,61 (д, 1Н, J=7,8), 7,48 (т, 1H, J=7,6), 6,84 (д, 1Н, J=5,1), 5,69 (д, 1Н, J=3,7), 4,58 (д, 1Н, J=4,1), 2,60 (с, 3Н). LRMS m/z (M+H) обчислено: 258,3, знайдено: 258,1 Стадія В 88018 26 До розчину 3-{гідрокси[2-(метилтіо)піримідин4-іл]метил}бензонітрилу (1,65г, 6,41ммоль) у ССl4 (10мл) і СН2СІ2 (10мл) додають трифенілфосфін (2,36г, 8,98ммоль) і перемішують протягом 4 годин. Суміш концентрують і залишок очищають хроматографією на силікагелі (20% ЕtOАс у гексані), одержуючи 3-{хлор[2-(метилтіо)піримідин-4іл]метил}бензонітрил 1 H ЯМР (500МГц, CDCI3) δ 8,58 (д, 1Н. J=5,1), 7,79 (с, 1H), 7,70 (д, 1Н, J=8,1), 7,62 (д, 1H, J=7,8), 7,49 (т, 1Η, J=7,8), 7,25 (д, 1Н, J=4,9), 5,92 (с, 1Н), 2,51 (с, 3Н) LRMS m/z (M+H) обчислено: 276,8, знайдено: 276,0. Стадія С До розчину 3-(піридин-3-ілметил)піридину (1,24г, 7,26ммоль) у THF (32мл) при -78°С додають LDA (4,4мл, 1,8М) і перемішують протягом 1 години. Додають 3-{хлор[2-(метилтіо)піримідин-4іл]метил}бензонітрил (20г, 7,25ммоль) у THF (5мл). Суміш перемішують при 0°С протягом 2 годин. Реакційну суміш гасять льодом і екстрагують СН2Сl2. Об'єднаний органічний шар сушать, фільтрують і концентрують, одержуючи тверду речовину. Тверду речовину очищають хроматографією на силікагелі (3% МеОН у СН2Сl2), одержуючи (±)-3{1-[2-(метилтіо)піримідин-4-іл]-2,2-дипіридин-3ілетил}бензонітрил. LRMS m/z (M+H) обчислено: 410,5, знайдено: 410,1. Стадія D До розчину 3-{1-[2-(метилтіо)піримідин-4-іл]2,2-дипіридин-3-ілетил}бензонітрилу (1,2г, 2,93ммоль) у СНСl3 (15мл) при 0°С додають мхлорпероксибензойну (м-хлорнадбензойну) кислоту (0,657г, 77%, 2,93ммоль) і перемішують протягом 1 години. Реакційну суміш концентрують і очищають хроматографією на силікагелі (6% МеОН у СН2Сl2), одержуючи діастереомерну суміш (±)-3-{1-[2-(метилсульфініл)піримідин-4-іл]-2,2дипіридин-3-ілетил}бензонітрилу. LRMS m/z (M+H) обчислено: 426,6, знайдено: 426,1. Стадія Ε Розчин діастереомерної суміші (±)-3-{1-[2(метилсульфініл)піримідин-4-іл]-2,2-дипіридин-3ілетил}бензонітрилу (0,11г, 0,25ммоль) у DMSO (2мл), насиченому ΝΗ3, нагрівають до 100°С у мікрохвильовій печі протягом 2 годин. Суміш концентрують і залишок очищають хроматографією на силікагелі (5% МеОН у СН2Сl2), одержуючи (±)3-[1-(2-амінопіримідин-4-іл)-2,2-дипіридин-3ілетил]бензонітрил. 1 H ЯМР (500МГц, d6 ДМСО) δ 8,68 (д. 1Н, J=1,5), 8,60 (д, 1H. J=1,5), 8.29 (д, 1H, J=4,6), 8,23 (д, 1Н, J=4,6). 8,00 (д, 1H, J=4,8), 7,95 (с, 1Н), 7,90 (т, 2Η, J=9,4), 7,80 (д, 1Н, J=8,0), 7,55 (д, 1Н, J=7.6), 7,40 (т, 1Η, J=7,8), 7,25 (дд, 1Н, J=7,8, 4,6), 7,19 (дд, 1H, J=8,0, 4,6), 6,67 (д, 1H, J=5,1), 6.54 (c, 2H), 5,25 (д, 1Н, J=12,5), 5,20 (д, 1H, J=12,4). LRMS m/z (M+H) обчислено: 379,4, знайдено: 379,2. Рацемічну суміш розділяють за допомогою Chiralcel OD (50% і-РrОН у гексані). Перший пік являє собою (-)-3-[1-(2-аміногаримідин-4-іл)-2,2дипіридин-3-ілетил]бензонітрил. Другий пік являє собою (+)-3-[1-(2-амІнопіримідин-4-іл)-2,2дипіридин-3-ілетил]бензонітрил. 27 Змінні С і А в схемі такі, як визначені для "формули І". Приклад II-1 (±)-трет-бутил 2-(2-гідрокси-1-феніл-2,2дипіридин-3-ілетил)піролідин-1-карбоксилат (діастереомер А) До розчину N-бензилпіролідинону (2.18г, 12,4ммоль) у 25мл простого ефіру додають при 0°С тетрафторборат триегилоксонію (2,15г, 11,3ммоль). Реакційній суміші дають можливість нагрітися до температури навколишнього середовища і перемішуватися протягом 30 хвилин, і під час цього періоду часу з реакційної суміші осаджується твердий продукт. Ефір декантують і залишок, що залишився, промивають три рази ефіром. Залишковий розчинник видаляють у вакуумі, одержуючи 1-бензил-5-етокси-3,4-дигідро-2Н-піролій тетрафторборат. Стадія В Розчин гексаметилдисилазиду літію (8,39мл 1Μ у тетрагідрофурані. 8,39ммоль) додають до сухого THF і охолоджують до -78°С. Додають по краплях метилфенілацетат (1,15мл, 7,99ммоль), і реакційну суміш перемішують протягом 15 хвилин. По краплях додають розчин 1-бензил-5-етокси-3,4дигідро-2Н-піролій тетрафторборату в 5мл тетрагідрофурану і після закінчення одного часу реакційній суміші дають можливість нагрітися до кімнатної температури. Суміш гасять насиченим розчином NаНСО3, нагрівають до температури навколишнього середовища і виливають у воду. Водний шар екстрагують ЕtOАс і органічний екстракт промивають насиченим розчином солі, сушать (Na2SO4), фільтрують і концентрують у вакуумі Залишок очищають хроматографією на силікагелі (суміш 25-30% ЕtOАс/гексан), одержую 88018 28 чи метил 2-(1-бензилпіролідин-2іліден)(феніл)ацетат. ESI+MS: 308,3 [М+Н]+ Стадія С До розчину метил 2-(1-бензилпіролідин-2іліден)(феніл)ацетату (0,505г, 1,64ммоль) у 5мл метанолу додають гідроксид паладію (II) (231мг, 1,64ммоль) і реакційну суміш перемішують в атмосфері газу-водню. Через 3 дні. суміш фільтрують через целіт, подушку целіту промивають сумішшю СН2Сl2/МеОН і фільтрат концентрують у вакуумі, одержуючи метил феніл(піролідин-2-іл)ацетату у вигляді суміші двох діастереомерів. ESI+MS: 220,2 [М+Н]+. Стадія D До розчину метил феніл(піролідин-2іл)ацетату (0,360г, 1,64ммоль) у 5мл тетрагідрофурану додають ди-трет-бутилдикарбонат (717мг, 3,28ммоль) і реакційну суміш перемішують протягом ночі. Суміш концентрують у вакуумі, потім очищають хроматографією на силікагелі (суміш 20% ЕtOАс/гексан), одержуючи трет-бутил 2-(2метоксі-2-оксо-1-фенілетил)піролідин-1карбоксилат. ESI+MS: 264,2 [М+Н - ізобутилен]+. Стадія Ε 3-бромпіридин (0,790мл, 8,20ммоль) розчиняють у 30мл сухого Еt2О і охолоджують до -78°С. нБутиллітій (3,28мл, 2,5Μ розчин у гексанах, 8,20ммоль) додають по краплях за допомогою шприца протягом 10 хвилин. Після перемішування протягом 15 хвилин, по краплях додають розчин трет-бутил 2-(2-метоксі-2-оксо-1фенілетил)піролідин-1-карбоксилату (0,524г, 1,64ммоль) у 5мл ефіру. Реакційну суміш перемішують протягом 45 хвилин при -78°С, гасять насиченим водним розчином NaHCO3 і виливають у насичений водний розчин NаНСО3 і EtOAc. Органічний шар екстрагують насиченим розчином солі, сушать Na2SO4, фільтрують і концентрують у вакуумі. Залишок очищають препаративною ВЕРХ з оберненою фазою, і об'єднані чисті фракції розподіляють між (незмішуваними) СН2СІ2 і насиченим водним розчином NаНСО3. Концентрування органічної фракції дає один діастереомер зазначеної в заголовку сполуки. 1 Н ЯМР (500МГц, CDCI3): δ 9,03 (ушир, с, 1H), 8,56 (ушир, с, 1Н), 8,52 (д, J=4,4Гц, 1H), 8,18 (д, 29 J=8,3Гц, 1Н), 8,15 (д, J=4,4Гц, 1H), 7,75 (д, J=7,8Гц, 1H), 7,43 (ушир, с, 1H), 7,36 (дд, J=7,8 і 4,8Гц, 1H), 7,06-7,12 (м, 4Н), 7,02 (дд, J=7,8 і 4,8Гц, 1Н), 5,1 (ушир, с, 1Н), 4,28 (д, J=6,6Гц, 1H), 3,93 (с, 1Н), 3,22 (м, 1H), 2.25 (м, 1Н), 2,17 (м, 1Н), 1,96 (м, 1H), 1,50 (м, 9Н). 1,30 (м, 1Н). HRMS [М+Н] С27Н32Н3О3 обчислено 446,2438, знайдено 446,2424. Використовуючи методології, описані нижче, була зроблена оцінка типових сполук за даним винаходом і було встановлено, що вони виявляють активність у Kvl.5 аналізах, тим самим демонструючи і підтверджуючи корисність сполук за даним винаходом як інгібіторів Kvl.5 і як антиаритмічних засобів. Сполуки цього типу можуть виявляти пряму швидкість-залежність, блокуючи вихідні K+ струми у більшій мірі або переважно при більш швидких швидкостях деполяризації або частотах серцевих скорочень. Така сполука може бути ідентифікована в електрофізіологічних дослідженнях, як описано нижче. Наприклад, під час послідовності деполяризацій, що проводяться при частотах 1Гц і 3Гц, блокада є "швидкістьзалежною", якщо величина блокади, що спостерігається під час 10-секундної послідовності при 3Гц, більша, ніж величина блокади при 1Гц. Блокатор Kvl.5 може також демонструвати застосування-залежність, під час якої блокада вихідних K+ струмів підсилюється із застосуванням або під час повторюваної деполяризації кардіальної (серцевої) клітини. Застосування-залежність блокади виявляється все в більшій мірі з кожною подальшою деполяризацією в ланцюгу або послідовності імпульсів або деполяризацій при заданій швидкості або частоті. Наприклад, під час послідовності з 10 деполяризацій при частоті 1Гц, блокада є "застосування-залежною", якщо величина блокади більше для 10-го імпульсу, ніж для 1-го імпульсу послідовності. Блокатор Kvl.5 може виявляти як застосування-залежність, так і швидкістьзалежність. Блокатор Kvl.5 може бути також ідентифікований за допомогою електрофізіологічних досліджень нативного ІKur, використовуючи серцеві міоцити (м'язові клітини) або іншу тканину (провідної системи серця) від різних біологічних видів, включаючи, але не обмежуючись ними, людину, щура, мишу, собаку, мавпу, тхора, кролика, морську свинку або козу. У нативних тканинах Kvl.5 може існувати у вигляді гомоолігомеру або у вигляді гетероолігомеру з іншими представниками сімейства Kv, або може існувати в комплексі з β-субодиницею. Сполуки за даним винаходом можуть блокувати гомо- або гетероолігомери Kvl.5 або Kvl.5 у комплексах з β-субодиницями. Аналізи Kvl.5 Високорозрізнювальний аналіз Kvl.5 методом планарної фіксації потенціалу являє собою систематичний первинний скринінг Він підтверджує активність і забезпечує функціональний ступінь активності засобів, які, специфічно, впливають на калієві Kvl.5. Kiss et al. (Assaнy and Drug Dev. Tech., 1(1-2): 127-135, 2003) and Schroeder et al. (J. of Biomol. Screen., 8(1); 50-64, 2003) описують ви 88018 30 користання цього інструмента для Kvl.5, а також інших керованих напругою іонних каналів. Клітини яєчника китайського хом'ячка (СНО), що стабільно експресують альфа-субодиницю людського калієвого каналу Kvl.5, клоновану від людського серця, культивують до 90-100% злиття в середовищі Ham F12, доповненому 10% FBS, 100Од/мл пеніциліну, 100нг/мл стрептоміцину, 1000мг/мл сульфату G-418. Клітини субкультивують обробкою Versene. потім суспендують у забуференому фосфатом фізіологічному розчині (PBS) і центрифугують. Дебріс ресуспендують у PBS і одержану суспензію вміщують у клітинний резервуар (вимірювального) приладу Ion Works™ HT. Електрофізіологічні реєстрації здійснюють із внутрішньоклітинним розчином, що містить (мМ): K-глюконат 100, KСl 140, MgCl2 3,2, EGTA 3, N-2гідроксилетилпіперазин-N'-2-етансульфонову кислоту (HEPES) 5; доведеним до рН7,3. Амфотеріцин (Sigma) одержують у вигляді 30мг/мл вихідного розчину і розводять до кінцевої робочої концентрації 0,1мг/мл у внутрішньому буферномy розчині. Зовнішній розчин являє собою PBS за Дульбекко (Invitrogen) і містить (мМ): СаСl2 0,90, KСl 2,67, K3РО4 1,47, MgCl2 0,50, NaCl 138, Na3PO4 8,10 і має рН7,4. Всі сполуки одержують у вигляді 10мМ вихідних розчинів у DMSO. Сполуки розводять у зовнішньому буфері, потім переносять із планшета з лікарським засобом у петч-планшет на час експерименту (кінцева концентрація DMSO -0,2Па попередньо зчитувана пікова метрика 20% інгібування при концентрації 33мкМ або менше в аналізі Kvl.5 методом планарної фіксації потенціалу (петч-кламп), описаним вище Протокол атомно-абсорбційної спектроскопії Цей аналіз ідентифікує засоби, які, зокрема, блокують людський K+ канал Kvl.5, гетерогенно експресований у СНО клітинах, що вимірюється по відтоку Rb+, використовуючи метод полуменевої атомно-абсорбційної спектроскопії (FAAS). Це застосування FAAS для вимірювання активності іонного каналу адаптоване, виходячи з Terstappen et al, Anal. Biochem., 272: 149-155, 1999. CHO клітини, що експресують людський Kvl.5, культивують, як описано вище, потім збирають за допомогою суміші трипсин-EDTA і промивають середовищем. 1. 40000 клітин на ямку висівають у 96ямковий культуральний планшет (аналітичний 88018 32 планшет) і клітинам надають можливість рости протягом 48 годин при 37°С. 2. Середовище видаляють і додають 200мкл Rb Load Буфера (Aurora Biomed, Vancouver, BP) і витримують протягом 3 годин при 37°С в атмосфері 5% СО2. 3. Клітини промивають 5 разів 200мкл збалансованого сольового розчину Хенкса (HBSS) із подальшим додаванням 100мкл HBSS, що містить випробувану сполукy або 0,5% DMSO. 4. Через 10 хвилин додають 100мкл забуференого HEPES фізіологічного розчин), що містить 140мМ KСl і планшет інкубукль при КТ протягом 5 хвилин при обережному струшуванні. 5. Відразу після цього, 150мкл супернатанту переносять у свіжий 96-ямковий планшет і супернатант, що залишився, аспірують (відсмоктують). 6. 120мкл буфера для лізису клітин (Aurora Biomed, Vancouver, BP) додають в аналітичний планшет і струшують протягом 10 хвилин до аналізу. 7. Вміст Rb вимірюють у пробах супернатанту (SUP) і лізату (LYS), використовуючи автоматизований (вимірювальний) прилад для AAS моделі ICR-8000 (Aurora Biomed, Vancouver, BP). %FLUX=100%*(SUP/(LYS+SUP)). %INH=100%*(l-(A-B)/(C-B)). де А являє собою %FLUX у присутності випробуваної сполуки, В являє собою %FLUX у присутності 10мМ хлориду (6метокси-2-метил-1-оксо-4-феніл-1,2дигідроізохінолін-3-iл)-N,N-диметилметанамінію, С являє собою %FLUX у присутності 0,25% DMSO; FLUX - (іонний Rb+) потік. Вищеперелічені сполуки забезпечують ³25% інгібування при концентрації 25мкМ або менше в AAS аналізі, описаному вище. Сполуки за даним винаходом можуть вводитися для лікування або попередження недуг, хвороб і розладів відповідно до даного винаходу будьяким способом, який здійснює контакт активної сполуки-компонента з місцем дії в тілі теплокровної тварини. Наприклад, введення може бути пероральним, місцевим, включаючи трансдермальне, (внутрішньо)очне, букальне, інтраназальне, шляхом інгаляції, інтравагінальне, ректальне, інтрацистернальне і парентеральне. Використовуваний тут термін "парентеральний" стосується способів введення, які включають підшкірну, внутрішньовенну, внутрішньом'язову, внутрішньосуглобову ін'єкцію або інфузію, надчеревну та інтраперитонеальну. Сполуки можуть бути введені будь-яким звичайним способом, придатним для використання у зв'язку з фармацевтичними препаратами, або у вигляді індивідуальних терапевтичних засобів, або в комбінації терапевтичних засобів. Вони можуть вводитися, як такі, однак, звичайно їх вводять разом із фармацевтичним носієм, вибраним з урахуванням вибраного шляху введення і звичайної фармацевтичної практики. Для даного розкриття, теплокровна тварина є представником великої групи тварин, стійкість організму яких забезпечується гомеостатичними процесами, і включає ссавців і птахів. 33 Доза, що вводиться, звичайно залежить від віку, стану здоров'я і маси тіла реципієнта, тяжкості захворювання, виду супутнього (паралельного) лікування, якщо воно взагалі є, частоти лікування і характеру бажаної дії. Як правило, добова доза активної сполуки складає близько 1-500 міліграмів на день. Звичайно, для одержання бажаних результатів ефективна добова доза від 10 до 100 міліграмів на день, що приймається один або декілька разів на день. Ці дози є ефективними кількостями для лікування і попередження недуг, хвороб і розладів, описаних вище, наприклад, серцевих аритмій, таких як фібриляція передсердь (миготлива аритмія), тріпотіння передсердь, передсердна аритмія і суправентрикулярна тахікардія, тромбоемболічні ускладнення, такі як інсульт і застійна серцева недостатність, і імунодепресія. Активний компонент може бути введений перорально у вигляді твердих лікарських форм, таких як капсули, таблетки, пастилки, драже, гранули і порошки, або у вигляді рідких лікарських форм, таких як еліксири, сиропи, емульсії, дисперсії і суспензії. Активний компонент може бути також введений парентерально, у вигляді стерильних рідких лікарських форм, таких як дисперсії, суспензії або розчини. Інші лікарські форми, які також можуть бути використані для введення активного компонента, включають для місцевого введення - мазь, крем, краплі, трансдермальний пластир або порошок; для (внутрішньо)очного введення - офтальмічний розчин або суспензія, тобто, очні краплі; для інгаляції або інтраназального введення - аерозольний спрей або порошковий склад; для ректального або вагінального введення - крем, мазь, спрей або супозиторій. Желатинові капсули містять активний компонент і порошкоподібні носії, такі як лактоза, крохмаль, похідні целюлози, стеарат магнію, стеаринову кислоту і т.ін. Аналогічні розріджувачі можуть бути використані для одержання спресованих таблеток. Як таблетки, так і капсули можуть бути виготовлені у вигляді продуктів із пролонгованою дією, які забезпечують безперервне вивільнення лікарського засобу протягом (декількох) годин. Спресовані таблетки можуть мати цукрове покриття або плівкове покриття для маскування якогонебудь неприємного смаку і захисту таблетки від (впливу) атмосфери, або ентеросолюбільне покриття для селективної дезінтеграції (розпаду) у шлунково-кишковому тракті. Рідкі лікарські форми для перорального введення можуть містити барвник і ароматизатор для підвищення сприйняття у пацієнта. Загалом, придатними носіями для парентеральних розчинів є вода, придатна олія, фізіологічний розчин, водна декстроза (глюкоза), і розчини споріднених цукрів і гліколі, такі як пропіленгліколь або поліетиленгліколі. Розчини для парентерального введення переважно містять розчинну у воді сіль активного компонента, придатні стабілізувальні засоби, і, якщо потрібно, буферні речовини. Антиоксиданти, такі як бісульфіт натрію, сульфіт натрію або аскорбінова кислота, або окремо, або у поєднанні, є придатними стабілізувальними засобами. Також використовують лимонну кислоту та її 88018 34 солі і натрій EDTA. Крім того, парентеральні розчини можуть містити консерванти, такі як хлорид бензалконію. метил- або пропілпарабен і хлорбутанол. Придатні фармацевтичні носії описані в Remington's Pharmaceutical Sciences, A. Osol, книга стандартних довідкових даних у цій галузі техніки. Для введення інгаляцією, сполуки за даним винаходом можуть зручно доставлятися у формі аерозольного спрею з упаковок під (надмірним) тиском або розпилювачів. Сполуки можуть бути також доставлені у вигляді порошків, які можуть бути складені, і порошкова композиція може бути введена інгаляцією (вдуванням) за допомогою інсуфлятора (апарату-інгалятора для введення порошкоподібних речовин вдуванням). Переважною системою доставки для інгаляції є аерозоль із контрольованою за витратою дозою для інгаляції (MDI), який одержують у вигляді суспензії або розчину сполуки формули І у придатних пропелентах, таких як фторвуглеці або вуглеводні. Для (внутрішньо)очного введення, може бути приготований офтальмопрепарат (очний препарат) у вигляді розчину або суспензії сполук формули І придатної концентрації (% мас.) у придатному офтальмонаповнювачі (очному наповнювачі), так щоб сполука утримувалася в контакті з поверхнею ока протягом періоду часу, достатнього для того, щоб допустити проникнення сполуки в корнеальну (рогівкову) і внутрішню ділянки ока. Використовувані фармацевтичні лікарські форми для введення сполук за даним винаходом включають, але ними не обмежуються, тверді і м'які желатинові капсули, таблетки, суспензії, що вводяться парентерально шляхом ін’єкції, і пероральні суспензії. Велику кількість одиничних капсул одержують наповненням стандартних твердих желатинових капсул, що складаються із двох частин, кожну 100 міліграмами порошкоподібного активного компонента, 150 міліграмами лактози, 50 міліграмами целюлози і 6 міліграмами стеарату магнію. Одержують суміш активного компонента в олії, що легко засвоюється, такій як соєва олія, бавовняна олія або оливкова олія, і упорскують за допомогою об'ємного (поршневого) насоса в желатин, одержуючи м'які желатинові капсули, що містять 100 міліграмів активного компонента. Капсули промивають і сушать. Велику кількість таблеток одержують звичайними способами, так що стандартна доза включає в себе 100 міліграмів активного компонента, 0,2 міліграма колоїдного діоксиду кремнію, 5 міліграмів стеарату магнію, 275 міліграмів мікрокристалічної целюлози, 11 міліграмів крохмалю і 98,8 міліграма лактози. Для підвищення смакової привабливості або сповільнення абсорбції можуть бути застосовані відповідні покриття. Парентеральну композицію, придатну для введення шляхом ін'єкції, одержують перемішуванням 1,5% мас. активного компонента в 10%, за об'ємом, пропіленгліколю. Розчин доводять до об'єму водою для ін'єкції і стерилізують. Водну суспензію для перорального введення одержують так, що кожні 5 мілілітрів містять 100 35 88018 міліграмів тонкодиспергованого активного компонента, 100 міліграмів натрійкарбоксиметилцелюлози, 5 міліграмів бензоату натрію, 1,0 грам розчину сорбіту, U.S.P., і 0,025 мілілітра ваніліну. Ідентичні лікарські форми можуть бути також використані в тих випадках, коли сполуку за даним винаходом вводять ступінчасто або в поєднанні з іншим терапевтичним засобом. Якщо лікарські засоби вводять у фізичній комбінації, то лікарську форму і шлях (спосіб) введення потрібно вибирати з урахуванням сумісності лікарських засобів, що комбінуються. Таким чином, очевидно, що термін сумісне введення включає введення двох засобів супровідним чином або послідовно, або альтернативно, у вигляді комбінації двох активних компонентів із постійною (заздалегідь визначеною) дозою. Сполуку за даним винаходом можна вводити у вигляді єдиного активного компонента або в комбінації з другим активним компонентом, включаючи інші антиаритмічні засоби, що мають блокуючу активність відносно Kvl.5, такі як хінідин, пропафенон, амбасилід, аміодарон, флекаїнід, соталол, бретилій, дофетилід, альмокалант, бепридил, клофілій, інші сполуки, що мають блокуючу активність відносно Kvl.5. такі як клотримазол, кетоконазол, бупівакаїн, еритроміцин, верапаміл, ніфе Комп’ютерна верстка Т. Чепелева 36 дипін, затебрадин, бісиндолілмалеімід, або інші серцево-судинні засоби, такі як, але не обмежуючись ними, інгібітори АСЕ, як наприклад, беназеприл, каптоприл, еналаприл, фосиноприл, лізиноприл, моексиприл, периндоприл, ербумін, хінаприл, раміприл і трандолаприл, антагоністи ангіотензину II, такі як кандесартан, епросартан, ірбесартан, лосартан. олмесартан, телмісартан і валсартан, серцеві глікозиди, такі як дигоксин, блокатори кальцієвого каналу L-типу, блокатори кальцієвого каналу Т-типу, селективні і неселективні бетаблокатори, імунодепресивна сполука, антагоністи ендотеліну. інгібітори тромбіну, аспірин, неселективні NSAID, інші ніж аспірин, такі як напроксен, варфарин, інгібітори фактора Ха, низькомолекулярний гепарин, нефракціонований гепарин, клопідогрел, тиклопідин, антагоністи рецептора Ilb/IIIa, такі як тирофібан, антагоністи рецептора 5НТ, антагоністи рецептора інтегрину, антагоністи рецептора тромбоксану, інгібітори TAFI і антагоністи рецептора Р2Т. Сполуки за даним винаходом можна також вводити у вигляді єдиного активного компонента або в комбінації з електронним стимулятором серця або дефібрилятором (пристроєм, який відновлює ритм серця). Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPotassium channel inhibitors
Автори англійськоюBilodeau Mark T., Wu Zhicai, Hartnett John
Назва патенту російськоюИнгибиторы калиевого канала
Автори російськоюБилодо Марк Т., У Чжицай, Хартнетт Джон
МПК / Мітки
МПК: C07D 401/14, A61K 31/444, A61P 9/06
Мітки: каналу, інгібітори, калієвого
Код посилання
<a href="https://ua.patents.su/18-88018-ingibitori-kaliehvogo-kanalu.html" target="_blank" rel="follow" title="База патентів України">Інгібітори калієвого каналу</a>
Попередній патент: Спосіб і пристрій для призначення векторів руху
Наступний патент: Пристрій для відключення каналізаційного трубопроводу квартирного підключення, з’єднаного з вертикальним каналізаційним трубопроводом
Випадковий патент: Стрижневий пристрій для остеосинтезу пошкоджень переднього відділу тазового кільця