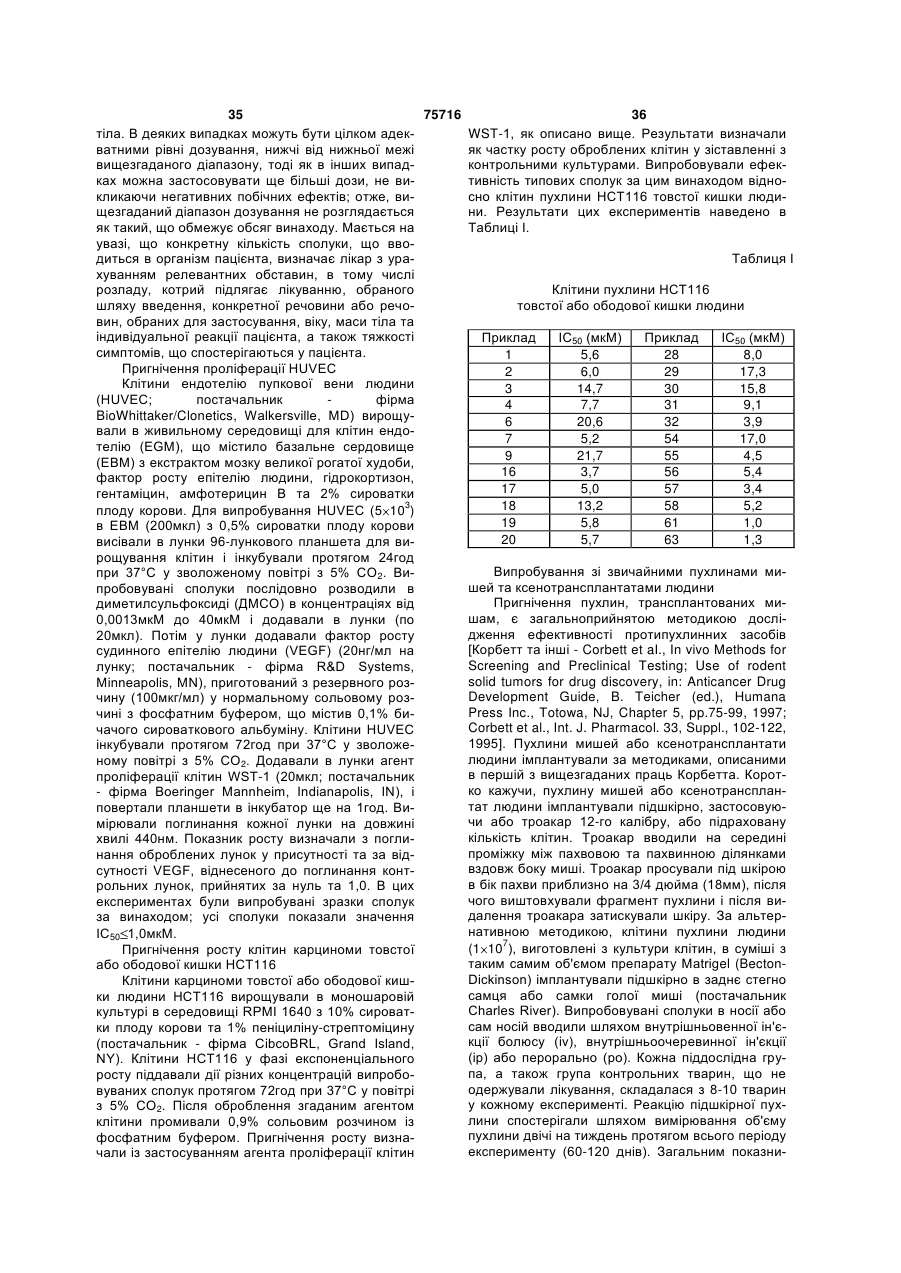
Тіофенсульфаміди та тіазолсульфаміди як протипухлинні засоби, фармацевтична композиція на їх основі
Номер патенту: 75716
Опубліковано: 15.05.2006
Автори: Лін Хо-Шен, Лопес де Уральде Гармендіа Беатріс, Мадер Мері Маргарет, Гроссман Кора Сью, де Діос Альфонсо, Лопес Хосе Едуардо, Річетт Майкл Енріко, Лобб Карен Лінн, Хіпскінд Філіп Артур, Ші Чан
Формула / Реферат
1. Сполука Формули I
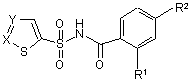 , І
, І
де
-X=Y- є група 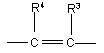 або
або 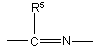 ;
;
R1 вибраний з групи, до якої входять галоїд, С1-С6-алкіл та CF3;
R2 вибраний з групи, до якої входять галоїд, -NO2, С1-С6-алкіл та CF3;
R3 є H, С1-С6-алкіл, С1-С4-алкоксигрупа, С1-С6-алкілтіогрупа або галоїд;
R4 вибраний з групи, до якої входять H, галоїд, С1-С4-алкоксигрупа, С1-С6-алкіл, -СOO(С1-С6-алкіл), С1-С6-алкіл, факультативно заміщений С1-С4-алкоксигрупою, ціан, С1-С6-алкілтіогрупа, CF3, S-феніл та піридиніл;
R5 є галоїд, С1-С6-алкіл або С1-С4-алкоксигрупа; або
фармацевтично прийнятна сіль такої сполуки з основою.
2. Сполука за п. 1, де R1 та R2 незалежно один від одного є галоїд або С1-С6-алкіл.
3. Сполука за п. 1 або п. 2, де обидва R1 та R2 є хлор або бром, або R1 є метил і R2 є хлор.
4. Сполука за будь-яким із пп. 1-3, де -X=Y- є група  .
.
5. Сполука за п. 4, де R3 вибраний з групи, до якої входять H, хлор, бром, метил, метоксигрупа або метилтіогрупа.
6. Сполука за будь-яким із пп. 4 або 5, де R4 вибраний з групи, до якої входять H, хлор, бром, метил, етил, пропіл, метилтіогрупа, CH2OCH3, метоксигрупа, ціан, S-феніл або піридиніл.
7. Сполука за п. 1, яка являє собою N-[2,4-дихлорбензоїл]-5-бромтіофен-2-сульфамід або його фармацевтично прийнятну сіль з основою.
8. Сполука за п. 1, яка являє собою N-[4-хлор-2-метилбензоїл]-5-хлортіофен-2-сульфамід або його фармацевтично прийнятну сіль з основою.
9. Сполука за будь-яким із пп. 1-8, де згаданою фармацевтично прийнятною сіллю з основою є натрієва сіль.
10. Сполука за п. 1, яка являє собою натрієву сіль N-[2,4-дихлорбензоїл]-5-бромтіофен-2-сульфаміду.
11. Фармацевтична композиція, яка містить сполуку Формули I
 , І
, І
де
-X=Y- є група  або
або  ;
;
R1 вибраний з групи, до якої входять галоїд, С1-С6-алкіл та CF3;
R2 вибраний з групи, до якої входять галоїд, -NO2, С1-С6-алкіл та CF3;
R3 є водень, С1-С6-алкіл, С1-С4-алкоксигрупа, С1-С6-алкілтіогрупа або галоїд;
R4 вибраний з групи, до якої входять водень, галоїд, С1-С4-алкоксигрупа, С1-С6-алкіл, -СOO(С1-С6-алкіл), С1-С6-алкіл, факультативно заміщений С1-С4-алкоксигрупою, ціан, С1-С6-алкілтіогрупа, CF3, S-феніл та піридиніл;
R5 є галоїд, С1-С6-алкіл або С1-С4-алкоксигрупа; або
фармацевтично прийнятну сіль такої сполуки з основою в суміші з фармацевтично прийнятним носієм або наповнювачем.
12. Фармацевтична композиція за п. 11, яка містить N-[2,4-дихлорбензоїл]-5-бромтіофен-2-сульфамід або його фармацевтично прийнятну сіль з основою.
13. Фармацевтична композиція за п. 12, яка містить натрієву сіль N-[2,4-дихлорбензоїл]-5-бромтіофен-2-сульфаміду.
14. Застосування сполуки за будь-яким із пп. 1-10 як фармацевтичної речовини.
15. Застосування сполуки за будь-яким із пп. 1-10 для виготовлення лікарського засобу для лікування чутливих новоутворень.
16. Застосування за п. 15, де чутливим новоутворенням є пухлина товстої, ободової або прямої кишки.
Текст
1. Сполука Формули I 3 75716 R4 є -X=Y група R3 C C або R5 C N ; R вибраний з групи, до якої входять галоїд, С1С6-алкіл та CF3; R2 вибраний з групи, до якої входять галоїд, -NO2, С1-С6-алкіл та CF3; R3 є водень, С1-С6-алкіл, С1-С4-алкоксигрупа, С1С6-алкілтіогрупа або галоїд; R4 вибраний з групи, до якої входять водень, галоїд, С1-С4-алкоксигрупа, С1-С6-алкіл, -СOO(С1С6-алкіл), С1-С6-алкіл, факультативно заміщений С1-С4-алкоксигрупою, ціан, С1-С6-алкілтіогрупа, CF3, S-феніл та піридиніл; 1 За останні роки досягнуто принципового прогресу в розвитку хімічних агентів та терапевтичних схем для боротьби з пухлинними захворюваннями. Незважаючи на цей безперервний прогрес, ракові пухлини продовжують завдавати нестерпні болі та страждання ураженим ними людям. Потреба в нових та кращих способах лікування злоякісних новоутворень та лейкемій продовжує стимулювати зусилля по створенню нових класів лікарських речовин, зокрема, в галузі неоперабельних або метастатичних солідних пухлин. Остання лавина інформації, що стосується основних біологічних процесів у новоутвореннях, забезпечує більш глибоке розуміння гетерогенності пухлин. Саме з причин цієї надзвичайної гетерогенності популяцій клітин новоутворень від нових хіміотерапевтичних агентів вимагається широкий спектр дії та прийнятний терапевтичний індекс. Крім того, такі агенти мають бути хімічно стійкими та сумісними з іншими агентами. Важливо також, щоб будь-який режим хіміотерапії був по можливості зручним та безболісним для пацієнта. При лікуванні раку часто застосовують хіміотерапію та радіаційну терапію, проте, хоч ці способи часто викликають певну позитивну реакцію при злоякісних захворюваннях, вони рідко забезпечують вилікування. Маса більшості солідних пухлин збільшується внаслідок проліферації злоякісних клітин та клітин строми, в тому числі клітин ендотелію. Для розростання пухлини до розміру більше ніж 2-3мм у діаметрі в ній має сформуватися судинна система; цей процес відомий під назвою ангіогенезу. Сповіщається, що наслідком пригнічення індукованого пухлиною ангіогенезу ангіостатином та ендостатином є протипухлинна дія [О-Рейлі та інші - O'Reilly, et al., Cell, 88, 277285, 1997]. Оскільки ангіогенез є вирішальною складовою розвитку збільшення маси більшості солідних пухлин, розроблення нових агентів для пригнічення цього процесу є перспективним підходом до протипухлинної терапії. Такий принцип 4 R5 є галоїд, С1-С6-алкіл або С1-С4-алкоксигрупа; або фармацевтично прийнятну сіль такої сполуки з основою в суміші з фармацевтично прийнятним носієм або наповнювачем. 12. Фармацевтична композиція за п. 11, яка містить N-[2,4-дихлорбензоїл]-5-бромтіофен-2сульфамід або його фармацевтично прийнятну сіль з основою. 13. Фармацевтична композиція за п. 12, яка містить натрієву сіль N-[2,4-дихлорбензоїл]-5бромтіофен-2-сульфаміду. 14. Застосування сполуки за будь-яким із пп. 1-10 як фармацевтичної речовини. 15. Застосування сполуки за будь-яким із пп. 1-10 для виготовлення лікарського засобу для лікування чутливих новоутворень. 16. Застосування за п. 15, де чутливим новоутворенням є пухлина товстої, ободової або прямої кишки. протипухлинної терапії може забезпечити уникнення токсичних побічних ефектів або розвитку резистентності до лікарських засобів, яке має місце при звичайній хіміотерапії [J. Folkman, Endogenous Inhibitors of Angiogenesis, The Harvey Lectures, Series 92, pp.65-82, Wiley-Liss Inc., 1998]. Цей винахід пропонує нові похідні Ν-[бензоїл]гетероарилсульфамідів, корисні при лікуванні чутливих до них новоутворень. Цей винахід пропонує сполуки Формули І де -Φ=Υ- є група або ; R1 вибраний з групи, до якої входять галоїд, С1-С6-алкіл та CF3; R2 вибраний з групи, до якої входять галоїд, NO2, С1-С6-алкіл та CF3; R3 є водень, С1-С6-алкіл, С1-С4-алкоксигрупа, С1-С6-алкілтіогрупа або галоїд; R4 вибраний з групи, до якої входять водень, галоїд, С1-С4-алкоксигрупа, С1-С6-алкіл, -СОО(С1С6-алкіл), С1-С6-алкіл, факультативно заміщений С1-С4-алкоксигрупою, ціан, С1-С6-алкілтіогрупа, CF3, S-феніл та піридиніл; R5 є галоїд, С1-С6-алкіл або С1-С4алкоксигрупа; або фармацевтично прийнятні солі таких сполук з основами. Цей винахід пропонує також спосіб лікування чутливих новоутворень у ссавців, який включає введення в організм ссавця, котрий потребує тако 5 75716 6 го лікування, онколітично ефективної кількості сполуки Формули І або фармацевтично прийнятної солі такої сполуки з основою. q) -X=Y- є група ; Цей винахід пропонує, крім того, спосіб пригнік) R3 є Η, галоїд, С1-С6-алкіл, С1-С4чення ангіогенезу пухлин у ссавців, який включає алкоксигрупа або С1-С6-алкілтіогрупа; введення в організм ссавця, котрий потребує такоs) R3 є Н, хлор, бром, метил, метоксигрупа або го лікування, сполуки Формули І або фармацевтиметиллтіогрупа; чно прийнятної солі такої сполуки з основою в кіt) R3 є Η або галоїд; лькості, яка пригнічує ангіогенез. u) R3 є Н; Цей винахід пропонує також фармацевтичну v) R3 є бром; композицію, яка містить сполуку Формули І або w) R3 є хлор; фармацевтично прийнятну сіль такої сполуки з х) R3 є С1-С6-алкіл основою та один або кілька фармацевтично приу) R3 є метил; йнятних наповнювачів. z) R3 є С1-С4-алкоксигрупа; Цей винахід пропонує також застосування аа) R3 є метоксигрупа; сполуки Формули І для виготовлення лікарського bb) R3 є С1-С6-алкілтіогрупа; засобу для лікування чутливих новоутворень. Крім сс) R3 є метилтіогрупа; того, цей винахід пропонує фармацевтичну компоdd) R4 є Н, галоїд, С1-С6-алкіл, С1-С6зицію для лікування чутливих новоутворень, яка алюлтіогрупа, С1-С6-алкіл, факультативно заміщемістить сполуку Формули І в комбінації з фарманий С1-С4-алкоксигрупою, С1-С4-алкоксигрупа, ціцевтично прийнятним носієм або наповнювачем. ан, S-феніл або піридиніл; Далі, цей винахід охоплює спосіб лікування чутлиее) R4 є Н, хлор, бром, метил, етил, пропіл, вих новоутворень, який включає введення в оргаметилтіогрупа, СН2ОСН3, метоксигрупа, ціан, Sнізм пацієнта ефективної кількості сполуки Формуфеніл або піридиніл; ли І. ff) R4 є С1-С6-алкіл; Загальні хімічні терміни, вжиті у вищенаведеgg) R4 є метил; них формулах, мають звичайні значення. Наприhh) R4 є етил; клад, термін "С1-С6-алкіл" охоплює метил, етил, іі) R4 є пропіл; пропіл, ізопропіл, бутил, ізобутил, втор-бутил, jj) R4 є галоїд; трет-бутил, пентил та гексил. Термін "С1-С4-алкіл" kk) R4 є хлор; охоплюється терміном "С1-С6-алкіл" і означає меll) R4 є бром; тил, етил, пропіл, ізопропіл, бутил, ізобутил, вторmm) R4 є водень; 4 бутил та трет-бугил. Термін "С1-С4-алкоксигрупа" nn) R є С1-С4-алкоксигрупа; означає С1-С4-алкіл, приєднаний до основної часоо) R4 є метоксигрупа; тини молекули через атом кисню, і охоплює метокрр) R4 є -СОО(С1-С6-алкіл); сигрупу, етоксигрупу, ізопропоксигрупу тощо. Терqq) R4 є С1-С6-алкіл, факультативно заміщений мін "галоїд" означає хлор, бром, фтор або йод. С1-С4-алкоксигрупою; Термін "ссавець" означає будь-який вид тепrr) R4 є група -СН2ОСН3; локровних хребетних тварин класу ссавців ss) R4 є ціан; (Mammalia), у варіанті, якому віддається найбільtt) R4 є С1-С6-алкілтіогрупа; ша перевага, людину, який характеризується приuu) R4 є S-феніл; сутністю волосяного покрову на шкірі і наявністю у vv) R4 є піридиніл; самок молочних залоз для вигодовування дитинww) R5 є галоїд; чат. хх) R5 є хлор; Хоч усі сполуки Формули І є корисними протиуу) R5 є С1-С4-алкоксигрупа; бластомними засобами, певним класам сполук zz) R5 є метоксигрупа; віддається перевага. Нижче перелічені такі класи, ааа) R5 є С1-С6-алкіл; яким віддається перевага. bbb) R5 є метил; 1 a) R є галоїд, С1-С6-алкіл або CF3; ссc) R1 та R2 незалежно один від одного є гаb) R1 є хлор, бром, фтор, метил або CF3; лоїд або С1-С6-алкіл; c) R1 є галоїд або С1-С6-алкіл; ddd) R1 та R2 є хлор, бром або R1 є метил і R2 1 d) R є хлор; є хлор; e) R1 є бром; еее) R1 та R2 є хлор; 1 f) R є метил; fff) R1 є метил і R2 є хлор. g) R1 є CF3; Мається на увазі, що перелічені вище класи h) R2 є галоїд, нітрогрупа, С1-С6-алкіл або CF3; можна комбінувати з утворенням додаткових кла2 і) R є хлор, бром, нітрогрупа, метил або CF3; сів сполук, яким віддається перевага. j) R2 є галоїд або С1-С6-алкіл; Сполуки Формули І є протибластомними засо2 k) R є хлор; бами. Таким чином, цей винахід пропонує також 2 І) R є бром; спосіб лікування чутливих новоутворень у ссавців, m) R2 є метил; який включає введення в організм ссавця, котрий 2 n) R є -NO2; потребує такого лікування, онколітично ефективної о) R2 є CF3; кількості сполуки Формули І. Вважається, що сполуки за цим винаходом є корисними при лікуванні чутливих новоутворень, в тому числі пухлин та р) -Φ=Υ- є група ; карцином, наприклад, новоутворень центральної 7 75716 8 нервової системи, до яких належать: поліморфна фармацевтично прийнятні солі основ віддається гліобластома, астроцитома, олігодендрогліальні перевага з точки зору простоти застосування у пухлини, пухлини епендими та хоріоїдних сплевипадках, коли необхідно застосовувати водні ротінь, пухлини шишкоподібного тіла, нейронні пухзчини відповідних сполук. Сполуки Формули І молини, медулобластома, шванома, менінгіома, межуть реагувати з матеріалами основного характенінгіомна саркома; новоутворення ока: ру, наприклад, із гідроксидами, карбонатами та базальноклітинна карцинома, плосколітинна карбікарбонатами лужних або лужноземельних метацинома, меланома, рабдоміосаркома, ретиноблалів, в тому числі (але не тільки) з гідроксидом настома; новоутворення ендокринних залоз: новотрію, карбонатом натрію, гідроксидом калію, гідроутворення гіпофізу, новоутворення щитовидної ксидом кальцію та гідроксидом літію, утворюючи залози, новоутворення кори надниркових залоз, фармацевтично прийнятні солі, наприклад, відпоновоутворення нейроендокринної системи, нововідні натрієві, калієві, літієві або кальцієві солі. утворення шлунково-кишкової та панкреатичної Особлива перевага віддається натрієвим та калієендокринної системи, новоутворення статевих вим солям. залоз; новоутворення голови та шиї: рак голови та Прикладами амінів, придатних для утворення шиї, рак ротової порожнини, рак горла, рак гортані, солей, є; первинні, вторинні та третинні аліфатичні одонтогенні пухлини; новоутворення грудної клітта ароматичні аміни, наприклад, метиламін, етики: великоклітинна карцинома легенів, дрібнокліламін, пропіламін, ізопропіламін, чотири ізомерні тинна карцинома легенів, недрібноклітинна карцибутиламіни, диметиламін, діетиламін, діетаноланома легенів, злоякісна мезотеліома, тимоми, мін, дипропіламін, діізопропіламін, ди-н-бутиламін, первинні пухлини зародкових клітин грудної клітки; піролідин, піперидин, морфолін, триметиламін, новоутворення травного тракту: новоутворення триетиламін, трипропіламін, хінуклідин, піридин, стравоходу, новоутворення шлунка, новоутворенхінолін та ізохінолін, зокрема, етил-, пропіл-, діеня печінки, новоутворення жовчного міхура, новотил- або триетиламін, особливо ізопропіламін та утворення екзокринної підшлункової залози, новодіетаноламін. утворення тонкого кишечнику, апендикса та Прикладами четвертинних амонієвих основ є очеревини, аденокарцинома товстої, ободової та катіони гідроксіамонієвих солей, наприклад, катіопрямої кишок, новоутворення ануса; новоутворенни тетраметиламонію, триметилбензиламонію, ня сечостатевого тракту: гіпернефроїдний рак, триетилбензиламонію, тетраетиламонію, триметил новоутворення ниркових мисок та сечоводів, новоетил амонію, а також катіон амонію. утворення сечового міхура, новоутворення уретри, Для фахівця ясно, що введення певних замісновоутворення простати, новоутворення пеніса, ників спричиняє асиметрію в сполуках Формули І. новоутворення яєчок; новоутворення жіночих поЦей винахід має на увазі всі енантіомери та суміші лових органів: новоутворення вульви та вапни, енантіомерів, в тому числі рацемічні суміші. Переновоутворення шийки матки, аденокарцинома тіла вага віддається хоральним сполукам за винахоматки, рак яєчників, гінекологічні саркоми; новодом, які являють собою індивідуальні енантіомери. утворення грудних залоз; новоутворення шкіри: Цей винахід охоплює, окрім того, всі діастереомебазально-клітинна карцинома, плоскоклітинна кари. рцинома, дерматофібросаркома, пухлина клітин Сполуки за цим винаходом можуть бути одерМеркеля; злоякісна меланома; новоутворення кісжані різноманітними способами; деякі з цих спосоток та м'яких тканин: остеобластосаркома, злоякібів ілюстровані поданими нижче схемами. Для сна фіброзна гістіоцитома, хондросаркома, саркофахівця зрозуміло, що для одержання сполук Фома Евінга, примітивна нейроектодермальна рмули І окремі стадії в наведених нижче схемах пухлина, ангіосаркома; новоутворення кровотворможна варіювати. Деякі з таких варіацій розгляданої системи: мієлодиспластичні синдроми, гострий ються в цьому описі. мієлолейкоз, хронічний мієлолейкоз, гострий лімКонкретна послідовність стадій, необхідних фоцитарний лейкоз, лейкоз/лімфома HTLV-1 та Тдля одержання сполук Формули І, залежить від клітин, хронічний лімфоцитарний лейкоз, лейкоз конкретної сполуки, котра має бути синтезована, ворсистих клітин, хвороба Ходжкіна (лімфогранувихідної сполуки та відносної рухомості заміщених ломатоз), нелімфогрануломатозні лімфоми, масфрагментів. тоцитозний лейкоз; та дитячі новоутворення: гостСполуки за цим винаходом можна одержати рий лімфобластичний лейкоз, гострі способами, добре відомими фахівцям. Як правимієлоцитарний лейкоз, нейробластома, пухлини . ло, сполуки Формули І можна одержати шляхом кісток, рабдоміосаркома, лімфоми, пухлини нирок. сполучення відповідних заміщених тієнілсульфаСполуки за цим винаходом вважаються особливо мідів або тіазолілсульфамідів із придатною заміпридатними для лікуваня солідних пухлин, зокрещеною бензойною кислотою, як показано на подама, пухлин товстої, ободової та прямої кишок. Сених нижче схемах. Змінні групи R1, R2, X та Υ ред ссавців, що підлягають лікуванню шляхом відповідають поданим вище визначенням. введення в організм сполук Формули І, перевага віддається людині. Сполуки за цим винаходом мають кислотну природу і, відповідно, можуть реагувати з численними неорганічними та органічними основами, наприклад, з амінами та четвертинними амонієвими основами, утворюючи фармацевтично прийнятні солі основ. Перетворенню сполук Формули І у Факультативно заміщену бензойну кислоту 9 75716 10 сполучають із придатним сульфамідом в стандарнілхлорид формули (6). За альтернативним варіатних умовах пептидного сполучення, добре відонтом сполуку формули (4) можна обробити хлоримих пересічному фахівцю. Конкретно, тієніл- або стим сульфурилом (стадія (e)), і одержати безпотіазолілсульфаміди сполучають із бензойною киссередньо сульфонілхлорид формули (6) [Хоуберт лотою в присутності реагентів пептидного сполута інші (J.J. Houbert, F. Mohammadi, M.M. Spees), чення, факультативно в присутності каталізатора. Європейський патент 0467613 Α1]. Для фахівця До придатних для цього реагентів пептидного споясно також, що сульфонілхлорид формули (6) молучення належать Ν,Ν'-карбонілдіімідазол (CDI), жна одержати шляхом проведення реакції сполуки Ν,Ν'-дициклогексил-карбодіімід (DCC), гідрохлорид формули (3) із хлорсульфоновою кислотою (стадія 1-(3-диметиламінопропіл)-3-етилкарбодііміду (g)). Сульфонілхлорид формули (6) можна ввести (EDC) та 1-(3-(1-піролідиніл)пропіл)-3в реакцію з гідроксидом амонію (стадія (d)) і одеретилкарбодіімід (РЕРС). Описані прищеплені до жати сульфамід формули (1) [Кремлин та інші (R.J. полімерів форми EDC [Tetrahedron Letters. 34(48), Cremlyn, J.P. Bassin, S. Farouk, et al., Phosphorus, 7685, 1993] та РЕРС [патент США №5,792,763], Sulfur Silicon Relat. Elem., 1992, 73(1-4), 107-120); дуже корисні для одержання сполук за цим винаБестерман та інші (J.M. Besterman, D. Delorme, J. ходом. До каталізаторів, придатних для проведенRahil, WO 0102411, 2001)]. За альтернативним ня згаданої реакції сполучення, належить Ν,Νваріантом, сполуку формули (5) можна обробити [диметил]-4-амінопіридин (DMAP). Усі реагенти гідроксиламін-О-сульфокислотою (стадія (f)) і одезмішують у придатному розчиннику, наприклад, в ржати сульфамід формули (1) [Могамаді, Спіс (F. дихлорметані, хлороформі, тетрагідрофурані, діоMohamadi, M.M. Spees), патент США №5,169,860]. ксані або діетиловому ефірі, і перемішують протяУмови синтезів за Схемою II добре відомі та гом періоду від 1год до 72год при температурі від поширені в практиці [див. Грехем та інші (S.L. температури навколишнього середовища до темGraham et al., J. Med. Chem., 1989, 32, 2548-2554); ператури кипіння розчинника. Якщо в реакційній Барніш та інші (I.T. Barnish et al., J. Med. Chem., суміші залишається надлишок сульфаміду або 1981, 24, 959); Цимерман-Крег та інші (J. бензойної кислоти, що не вступили в реакцію, то Cymerman-Craig et al., J. Chem. Soc, 1956, 4115)]. його можна видалити шляхом змішування з відповідною кислотною або основною іонообмінною смолою з подальшим фільтруванням. За альтернативним варіантом, ці реагенти можна видалити способами екстракції. Необхідний продукт можна виділити стандартними способами екстракції та кристалізації і, в разі необхідності або за бажанням, очистити хроматографією або кристалізацією. В разі застосування реагентів, прищеплених до Необхідні бензойні кислоти (2) можна одержаполімерів, їх зручно видаляти з реакційної суміші ти шляхом перетворень функціональних груп, дофільтруванням. бре відомих фахівцям, як показано на Схемі синНеобхідні бензойні кислоти та сульфаміди є тезу III. Наприклад, якщо Ζ є ціан, то перетворення комерційно доступними або можуть бути одержані в карбонову кислоту можна виконувати в кислотспособами, добре відомими пересічному фахівцю, них умовах [Ларок - R.C. Larock, Comprehensive наприклад, згідно з поданими нижче схемами. nd Organic Transformations, 2 Ed., 1999, John Wiley Змінні групи R1, R2, X та Υ відповідають поданим & Sons, с.1986-1987]. Якщо Ζ є галоїд, то можна вище визначенням, a Z є ціан або галоїд. виконати каталізоване металом карбонілування із застосуванням ацетату паладію та моноксиду вуглецю в метанолі, і одержати метилбензоат [там само, с.1685-1687] з подальшим гідролізом для одержання бензойної кислоти формули (2) [там само, с.1559-1968]. Для фахівця є зрозумілими подальші операції із замісниками R вихідних сполук формул (3) та (8), які виконуються відомими способами синтетичних взаємоперетворень, наприклад, амінопохідної в відповідну галоїдну похідну [там само, с.677-679], заміни гадоїду із застоСхема синтезу II ілюструє сульфонілування тісуванням алкілату металу [там само, с.893-894] офенів та тіазолів формули (3) з утворенням суабо нуклеофільного приєднання придатних сіркольфамідів формули (1). Умови синтезу при сульвмісних або азотвмісних нуклеофілів [там само, фонілуванні залежать від функціональних груп, с.779-780]. присутніх у вихідній похідній тіофену. Наприклад, Пересічному фахівцю також зрозуміло, що не на стадії (а) застосовують основну сполуку літію, всі замісники в сполуках Формули І є стійкими в наприклад, н-бутиллітій, для утворення in situ катіпевних умовах проведення реакцій, що застосоону (4) в діапазоні температур від -78°С до кімнатвуються у синтезах цих сполук. Ці групи можна ної температури. Цей аніон гасять сульфонілуваввести на зручній для цього стадії синтезу або льним агентом, наприклад, діоксидом сірки (стадія захистити їх з подальшим відщепленням групи (b)), і одержують сполуку формули (5). Сполуку захисту в разі необхідності або за бажанням. Крім формули (5) потім вводять в реакцію з Nтого, для пересічного фахівця ясно, що в багатьох хлорсукцинімідом (стадія (с)), одержуючи сульфо 11 75716 12 випадках послідовність введення замісників не гексану з етилацетатом (2:1). 1H ЯМР (300МГц), має суттєвого значення. CDCІ3) : 7,52 (d, 1Н), 6,94 (d, 1H), 5,10 (br s, 2H), Наведені нижче методики підготовчих синтезів 2,58 (s, 3H). та приклади додатково ілюструють одержання Підготовчий синтез 2 сполук за цим винаходом і не можуть розглядатися як такі, що обмежують обсяг винаходу. Для фахівців ясно, що можливі численні модифікації, які не виходять за межі обсягу та суті винаходу. Всі публікації, згадані в цьому описі, лежать у межах компетенції фахівців, яких стосується цей винахід. За відсутності спеціальних означень, терміни та абревіатури, вживані в поданих нижче методиРозчин 2-етилтіофену (1,78ммоль) в хлорофоках підготовчих синтезів та прикладах, мають зармі (1мл/ммоль) додають до охолодженого (0°С) гальновідомі значення. Наприклад, позначення розчину хлорсульфонової кислоти (0,35мл, "°С", "N (н.)", "mmol (ммоль)", "g (г)", "mL (мл)", "М", 5,35ммоль) у хлороформі (1,3мл/ммоль). Суміш "HPLC (PXBE)", "IR (ІЧ)", "MS(FD)", "MS(IS)", перемішують при кімнатній температурі протягом "MS(FIA)", "MS(FAB)", "MS(EI)", "MS(ES)", "UV 3год у колбі з приєднаною осушувальною трубкою. (УФ)", "TLC (ТШХ)" та "1H NMR (1H ЯМР)" означаПотім суміш виливають в охолоджену суміш ють відповідно градуси за Цельсієм, нормальність, хлороформу з водою і перемішують протягом мілімоль або мілімолі, грам або грами, мілілітр або 10хв. Органічний шар промивають водою, сушать мілілітри, молярність, рідинну хроматографію винад сульфатом натрію і концентрують у вакуумі. сокої ефективності, інфрачервону спектрометрію, Додають до одержаного неочищеного масла 2мл мас-спектрометрію з польовою десорбцією, масводного розчину гідроксиду амонію і перемішують спектроскопію з іонізацією іонним струменем, массуміш протягом 30хв. Видаляють розчинник у васпектрометрію з аналізом інжектованого потоку, куумі. Залишок використовують без подальшого мас-спектрометрію з іонізацією бомбардуванням очищення. 1H ЯМР (200МГц, CDCІ3) : 7,48 (d, 1Н, швидкими атомами, мас-спетрометрію з іонізацією J=3,6Гц), 6,74 (dd, 1Н, J=3,7Гц, 0,8Гц), 5,2 (br s, електронним ударом, мас-спектрометрію з іоніза2H), 2,9 (q, 2H, J=7,5Гц), 1,32 (t, 3H, J=7,5Гц). цією іонним струменем, ультрафіолетову спектроПідготовчий синтез 3 метрію, хроматографію в тонкому шарі та спектрометрію протонного магнітного резонансу. Крім того, в описах ІЧ спектрів перелічені тільки абсорбційні максимуми, які становлять інтерес в даному випадку, а не всі максимуми, котрі спостерігаються. Підготовчий синтез 1 1,3Μ розчин н-бутиллітію в тетрагідрофурані (10мл, 12,5ммоль; продукт фірми Aldrich) додають до охолодженого (-78°С) розчину 2(метилтіо)тіофену (10,0ммоль; продукт фірми Aldrich) в безводному тетрагідрофурані (5,0мл/ммоль). Залишають суміш для проведення реакції протягом 90хв в атмосфері азоту. Барботують через розчин діоксид сірки при -78°С протягом 30хв. Нагрівають суміш до кімнатної температури і концентрують у роторному випарнику. До залишку додають розчин ацетату нагрію (8екв.) і гідроксиламін-О-сульфокислоти (2,5екв.) у воді (4мл/ммоль) і перемішують при 25°С протягом 1год. Підлужують реакційну суміш додаванням 1,0н. гідроксиду натрію до рН 10 і екстрагують діетиловим ефіром (2 50мл). Водну фазу підкислюють до рН 2 концентрованою хлористоводневою кислотою і екстрагують хлористим метиленом (2 50мл). Об'єднані органічні фази промивають насиченим розчином бікарбонату натрію (3 25мл) і розсолом (50мл), сушать (сульфат натрію), фільтрують і концентрують у роторному випарнику. Неочищений твердий продукт очищають хроматографією на колонці, застосовуючи як елюент суміш Продукт одержують за методикою, аналогічною описаній в Препаративному синтезі 2, з тим винятком, що застосовують 2-н-пропілтіофен. 1H ЯМР (200МГц, CDCІ3) : 7,46 (d, 1H, J=3,8Гц), 6,72 (dd, 1H, J=3,8Гц, 0,8Гц), 5,30 (bs, 2H), 2,79 (t, 2H, J=7,4Гц), 1,69 (q, 2H, J=7,4Гц), 0,97 (t, 3H, J=7,4Гц). Підготовчий синтез 4 1,6Μ розчин н-бутиллітію (1мл, 1,75ммоль) додають до охолодженого (-78°С) розчину 2(метокси)тіофену (1,75ммоль) в безводному тетрагідрофурані (2,6мл/ммоль). Залишають суміш для проведення реакції протягом 45хв в атмосфері азоту. Потім нагрівають суміш до 0°С, і барботують через розчин діоксид сірки протягом 15хв, після чого продувають суміш азотом. Видаляють розчинник у вакуумі, розчиняють неочищене масло в хлористому метилені (1мл/ммоль), і додають Nхлорсукцинімід (1,75ммоль). Перемішують суміш протягом 2год при кімнатній температурі в атмосфері азоту. Фільтрують і концентрують у вакуумі. 13 75716 14 Неочищене масло розчиняють в ацетоні 6,92 (d, 1Н, J=3,7Гц), 5,23 (br s, 2H), 4,60 (s, 2H), (3мл/ммоль), і додають 2мл водного розчину гідро3,41 (s, 3H). ксиду амонію. Перемішують суміш протягом ночі. Підготовчий синтез 7 Видаляють розчинник у вакуумі. Залишок розчиняють в етилацетаті, промивають водою і розсолом, сушать над сульфатом натрію і концентрують у вакуумі. Залишок очищають хроматографією на колонці, застосовуючи як елюент суміш гексану з етилацетатом (7:3). 1H ЯМР (200МГц, CDCІ3) : 7,37 (d, 1H, J=4,3Гц), 6,17 (d, 1H, J=4,3Гц), 4,9 (br s, 2H), 3,94 (s, 3H). До хлорсульфонової кислоти (0,14г, 1,2ммоль) Підготовчий синтез 5 додають частинами при перемішуванні п'ятихлористий фосфор (0,16г, 0,8ммоль), і охолоджують одержаний розчин до 0°С в атмосфері азоту. Додають при перемішуванні 2,3-дибромтіофен (0,24г, 0,8ммоль), і нагрівають одержану суміш при 50°С протягом 1год. Додають до реакційної суміші льодяну воду, після чого екстрагують її етилацетатом (20мл). Органічний шар концентрують і розчиняПродукт одержують за методикою, аналогічють в ацетоні (5мл). Додають гідроксид амонію ною описаній в Препаративному синтезі 2, з тим (5мл, концентрований), і перемішують одержану винятком, що застосовують 2-(метил)тіофен. 1H суміш при кімнатній температурі протягом 30хв. Додають розсол (10мл) та етилацетат (20мл), відЯМР (200МГц, CDCІ3) : 7,44 (d, 1H, J=3,7Гц), 6,71 діляють органічний шар, і екстрагують водний шар (br d, 1H, J=3,7Гц), 4,92 (br s, 2H), 2,51 (d, 3H, ще раз етилацетатом (10мл). Об'єднані органічні J=0,9Гц). шари сушать над сульфатом натрію, концентрують Підготовчий синтез 6 у вакуумі, після чого хроматографують залишок на силікагелі (елюент 0,5% метилового спирту в хлористому метилені), і одержують вказану в заголовку сполуку (вихід 58%) у вигляді твердої речовини коричневого кольору. Мас-спектр ES(-)MS m/z 318 (M-Η)-, відповідає двом атомам брому. Підготовчий синтез 8 2-(гідроксиметил)тіофен (4,4ммоль; Aldrich), оксид срібла (І) (6,6ммоль, 1,5екв.; Aldrich) та метилйодид (2,2ммоль, 5екв.; Aldrich) розчиняють в хлористому метилені (2мл/ммоль) і перемішують при кімнатній температурі протягом 48год. Фільтрують суміш через целіт, і випаровують розчинник у вакуумі. Залишок очищають хроматографією на колонці, застосовуючи як елюент суміш гексану з етилацетатом (75:25). 1,6Μ розчин н-бутиллітію в тетрагідрофурані (0,6мл, 0,9ммоль; Aldrich) додають до охолодженого (-78°С) розчину одержаного вище продукту, 2(метоксиметил)тіофену (0,87ммоль), в безводному тетрагідрофурані (1,3мл/ммоль). Залишають суміш для проведення реакції протягом 30хв в атмосфері азоту і переносять за допомогою канюлі в розчин хлористого сульфурилу (0,1мл, 1,7ммоль; Aldrich) в гексані (2,5мл/ммоль). Перемішують суміш протягом 2год в атмосфері азоту і нагрівають до кімнатної температури. Розбавляють суміш етилацетатом, промивають водою і розсолом, сушать над сульфатом натрію і концентрують у вакуумі. Залишок розчиняють в ацетоні (3мл/ммоль), додають 2мл водного розчину гідроксиду амонію, і перемішують розчин протягом ночі. Видаляють розчинник у вакуумі. Залишок розчиняють в етилацетаті, промивають водою і розсолом, сушать над сульфатом натрію і концентрують у вакуумі. Залишок очищають хроматографією на колонці, застосовуючи як елюент суміш гексану з етилацетатом (7:3). 1 H ЯМР (200МГц, CDCІ3) : 7,52 (d, 1Н, J=3,7Гц), Суміш 5-бромтіофен-2-сульфаміду (0,50г, 2,1ммоль), ціаніду цинку (0,25г, 2,1ммоль), тетракіс(трифенілфосфін)паладію(0) (0,072г, 0,06ммоль) в диметилформаміді (5мл, безводний) піддають дії мікрохвильового випромінення (в атмосфері азоту, при 160°С) протягом 15хв. Хроматографія в тонкому шарі (елюент 5% метилового спирту в хлористому метилені) посвідчує неповноту реакції. Додають до реакційної суміші додатково тетракіс(трифенілфосфін)паладій(0) (0,24г, 0,2ммоль) та диметилформамід (10мл), і піддають суміш дії мікрохвильового випромінення (в атмосфері азоту, при 160°С) протягом 37хв. Додають до суміші 10мл води та 20мл етилацетату. Відділяють органічний шар, і екстрагують водний шар 20мл етилацетату. Об'єднані органічні фази сушать над сульфатом натрію, концентрують у вакуумі, після чого хроматографують залишок на силікагелі (елюент 0-5% метилового спирту в хлористому метилені), і одержують вказану в заголовку сполуку у вигляді білої твердої речовини (0,22г, вихід 57%). ES(-)MS m/z 187, (М-Н)-. Підготовчий синтез 9 15 Суміш 5-бромтіофен-2-сульфаміду (0,50г, 2,1ммоль), триетиламіну (1мл), метанолу (1мл), ацетату паладію (0,046г, 2,1ммоль) та 1,3біс(дифенілфосфін)пропану (0,085г, 2,1ммоль) (додають у вказаній послідовності) в диметилформаміді (5мл, безводний) насичують газоподібним монооксидом вуглецю при кімнатній температурі. Цю реакційну суміш нагрівають при 100°С і перемішують протягом ночі в атмосфері монооксиду вуглецю. Додають до реакційної суміші 10мл розсолу та 10мл етилацетату. Відділяють органічний шар, і екстрагують водний шар 10мл етилацетату. Об'єднані органічні фази сушать над сульфатом натрію, концентрують у вакуумі, після чого хроматографують залишок на силікагелі (елюент 0-1% метилового спирту в хлористому метилені), і одержують вказану в заголовку сполуку у вигляді твердої речовини жовтого кольору (0,15г, вихід 34%). ES(-)MS m/z 220, (М-Н)-. Підготовчий синтез 10 Сполуку одержують за методикою, аналогічною описаній в Підготовчому синтезі 4 з тим винятком, що застосовують 2-хлортіазол. Підготовчий синтез 11 Сполуку одержують за методикою, аналогічною описаній в Підготовчому синтезі 1 з тим винятком, що застосовують 2-метокситіазол. Підготовчий синтез 12 Розчин 1,4-дитіан-2,5-діолу (20г, 131ммоль) суспендують в Et2O (80мл) в круглодонній колбі, обладнаній конденсатором та трубкою для подачі газу. Додають ізобутиральдегід (40мл) та Na2SO4 (12г), після чого барботують через реакційну суміш аміак протягом 20хв при кімнатній температурі і 10хв при нагріванні зі зворотним холодильником. Потім охолоджують суміш до кімнатної температури, видаляють Na2SO4 фільтруванням, і випаровують розчинник під атмосферним тиском. Залишок дистилюють на колонці Вігро при 130°С під тиском 7дюймів рт. ст. (180мм рт. ст.), і одержують вказану в заголовку сполуку (13,4г, 40%). 75716 16 ES(+)MS m/z 130, (М+Н)+. Підготовчий синтез 13 Розчин 2-ізопропіл-2,5-дигідротіазолу (12,4г, 95,9ммоль) в бензолі (125мл) додають до розчину n-хлоранілу (23,6г, 95,6мл). Реакційну суміш нагрівають зі зворотним холодильником протягом 2год і охолоджують до кімнатної температури. Додають до реакційної суміші 2Μ розчин NaOH (200мл), перемішують протягом 5хв, і переносять суміш у ділильну лійку. Відділяють органічний шар і промивають 2Μ розчином NaOH (200мл) і водою (2 100мл). Водні шари екстрагують бензолом, і об'єднують органічні шари. Бензол відганяють під атмосферним тиском, і одержують маслянистий залишок, який дистилюють на колонці Вігро при 110°С під тиском 8дюймів рт. ст. (200мм рт. ст.), і одержують вказану в заголовку сполуку (6,13г, 48%) у вигляді безбарвного масла. ES(+)MS m/z 128, (М+Н)+. Підготовчий синтез 14 До розчину 2-ізопропілтіазолу (2г, 15,7ммоль) в Et2O (75мл) при -78°С додають крапля за краплею н-бутиллітій (12,8мл, 1,6Μ в гексані, 20,4ммоль) (випадає осад рожевого кольору). Через 40хв реакційну суміш нагрівають до 0°С протягом 10хв, а потім знов охолоджують до -78°С. Над поверхнею реакційної суміші пропускають діоксид сірки протягом 5хв. Нагрівають реакційну суміш до кімнатної температури і перемішують ще протягом 2,5год. Охолоджують суміш до 0°С, додають Nхлорсукцинімід (4,20г, 32,4ммоль), і перемішують реакційну суміш протягом 1,5год. Потім суміш фільтрують, і промивають осад Et2O. Концентрують фільтрат у вакуумі, і одержують неочищений сульфонілхлорид, який розчиняють в ацетоні (20мл) і додають при перемішуванні до розчину концентрованого NH4OH (20мл) в ацетоні (50мл) при 0°С. Перемішують реакційну суміш протягом 5хв і розподіляють між EtOAc та Н2О. Водний шар відділяють і екстрагують EtOAc (двічі). Органічні шари об'єднують, сушать (MgSO4), фільтрують і випаровують під зниженим тиском. Продукт перекристалізують із СН2Сl2/ацетону/гексану, і одержують вказану в заголовку сполуку (1,89г, 58%). ES(+)MS m/z 207, (М+Н)+. Підготовчий синтез 15 До розчину 2-бромтіазолу (5,0г, 30,5ммоль) в 17 75716 18 Et2O (60мл) при -78°С додають крапля за краплею вакуумі, одержуючи вказану в заголовку сполуку в атмосфері азоту н-бутиллітій (14,6мл, 1,6Μ в (5,4г, 65%). 1H ЯМР (300МГц, CD3OD) 6,94 (d, гексані, 36,6ммоль). Перемішують реакційну суміш J=5,8Гц, 1Н), 7,50 (d, J=5,8Гц, 1Н). протягом 40хв, після чого додають крапля за крапПідготовчий синтез 18 лею диметилсульфат (4,75мл, 50,3ммоль), нагрівають реакційну суміш до -10°С (вміщують у холодильник) і залишають на ніч. Нагрівають реакційну суміш до 0°С і обережно гасять 2Μ НСІ (40мл). Відділяють органічний шар і екстрагують його 2Μ НСІ (двічі). Кислотні екстракти об'єднують, доводять їх реакцію до сильно основної додаванням 2Μ NaOH і екстрагують EtOAc (чотири рази). Об'єДо п'ятихлористого фосфору (4,6г, 22,2ммоль) днані органічні екстракти сушать над КОН, і видадодають в атмосфері азоту хлорсульфонову кисляють розчинник під атмосферним тиском, після лоту (2,2мл, 33,3ммоль). Охолоджують розчин до чого дистилюють вказану в заголовку сполуку при 0°С, і додають 2-бром-3-хлортіофен (1,0г, 128-130°С (1,5г, 49%). + 5,0ммоль). Нагрівають суміш при 50°С протягом ES(+)MS m/z 100, (М+Н) . 1год. Охолоджують реакційну суміш, потім гасять її Підготовчий синтез 16 сумішшю води з льодом, екстрагують розчин СН2Сl2 (200мл), і видаляють СН2Сl2 під зниженим тиском. Залишок розчиняють в ацетоні (30мл) і додають до розчину 29% NH4OH (40мл) в ацетоні (100мл) при 0°С. Перемішують реакційну суміш протягом 30хв, після чого видаляють ацетон під зниженим тиском. Залишок екстрагують EtOAc (200мл). Органічний шар промивають розсолом, До розчину н-бутиллітію (12,1мл, 1,6Μ в гексасушать (Na2SO4), фільтрують і концентрують у ні, 19,4ммоль) в Еt2О (70мл) при -78°С в атмосфевакуумі, одержуючи вказану в заголовку сполуку рі азоту додають крапля за краплею розчин 2(8,1г, вихід більше 100%), яку використовують без метилтіазолу (1,48г, 14,9ммоль) в Et2O (70мл). подальшого очищення. Перемішують реакційну суміш при -78°С протягом ES(-)MS m/z 274, [М-Н]-, відповідає одному 40хв, після чого нагрівають до -20°С. Над поверхатому брому та одному атому хлору. нею реакційної суміші пропускають діоксид сірки Підготовчий синтез 19 протягом 5хв, після чого дають суміші нагрітися до кімнатної температури протягом ночі. Додають Nхлорсукцинімід (3,99г, 29,9ммоль), і перемішують реакційну суміш протягом 1год. Суміш фільтрують, і фільтрат концентрують у вакуумі, одержуючи неочищений продукт. Цей продукт розчиняють в ацетоні (30мл), додають концентрований NH4OH (20мл), і перемішують суміш протягом 15хв. Розподіляють реакційну суміш між EtOAc та Н2О. ВодДо розчину 5-бром-4-хлортіофен-2-сульфаміду ний шар екстрагують EtOAc (двічі), органічні шари (2,4г, 8,7ммоль) в АсОН (20мл) додають цинковий об'єднують, сушать (MgSO4), фільтрують і конценпил (1,7г, 26,0ммоль). Нагрівають реакційну суміш трують у вакуумі. Після флеш-хроматографїї на при 120°С протягом 6год. Через 6год суміш фільтсилікагелі з градієнтним елююванням (від гексану рують і нейтралізують 1Μ NaOH. Водний шар ексдо гексану з етилацетатом (1:1)) одержують вказатрагують EtOAc (2 100мл). Об'єднані органічні ну в заголовку сполуку (282мг, 11%) у вигляді твеекстракти сушать (Na2SO4), фільтрують і концентрдої речовини жовтувато-коричневого кольору. рують у вакуумі. Неочищений продукт хроматогES(-)MS m/z 177, [М-Н] . рафують на силікагелі з елююванням СН2Сl2, і Підготовчий синтез 17 одержують вказану в заголовку сполуку (0,88г, 52%). 1 H ЯМР (300МГц, CD3OD) 7,48 (s, 1H), 7,58 (s, 1H). Підготовчий синтез 20 До розчину 3-хлортіофену (5,0г, 42ммоль) в суміші CDCІ3 (50мл) та АсОН (50мл) додають Nбромсукцинімід (8,3г, 46ммоль). Нагрівають розчин при 50°С. Через 1,5год охолоджують реакційну суміш до кімнатної температури. Додають до суміші розеол (100мл) та Et2O (200мл), і екстрагують водний шар Et2O (100мл). Об'єднані органічні екстракти промивають насиченим розчином NaHCO3, сушать (Na2SO4), фільтрують і концентрують у 3-метилтіофен (5,0г, 50,9ммоль) розчиняють в суміші СНСІ3 (50мл) та АсОН (50мл). До розчину додають N-бромсукцинімід (9,5г, 53,5ммоль), і нагрівають суміш при 50°С. Через 1,5год охолоджують реакційну суміш до кімнатної температури. 19 75716 20 Додають до суміші розеол (100мл) та Et2O (200мл). Органічний шар відділяють і промивають Розчин н-бутиллітію (19,7мл, 1,6Μ в гексані, 1Μ NaOH і розсолом, після чого сушать (Na2SO4), 31,5ммоль) додають крапля за краплею до розчифільтрують і концентрують у вакуумі, одержуючи ну 3-метокситіофену (3,0г, 26,3ммоль) в безводвказану в заголовку сполуку (6,4г, 71%) у вигляді ному Et2O (20мл) в атмосфері азоту при -70°С. прозорого масла. Суміш перемішують при -70°С протягом 2год. По1 вільно додають до розчину хлортриметилсилан H ЯМР 300МГц (CD3OD) 2,14 (s, 3Н), 6,81 (d, (4,5мл, 35,4ммоль). Нагрівають суміш до кімнатної J=5,6Гц, 1Н), 7,28 (d, J=5,6Гц, 1Н). температури і перемішують протягом 3год. Гасять Підготовчий синтез 21 реакційну суміш водою (50мл) та гексаном (100мл). Водний шар екстрагують гексаном (50мл). Об'єднані органічні екстракти сушать (Na2SO4), фільтрують і концентрують. Неочищений продукт хроматографують на силікагелі з елююванням гексаном, і одержують вказану в заголовку сполуку (4,0г, 82%) у вигляді безбарвної рідини. 1 H ЯМР 300МГц (CD3OD) 0,29 (s, 9H), 3,81 (s, До п'ятихлористого фосфору (6,5г, 31ммоль) 3Н), 6,92 (d, J=4,9Гц, 1H), 7,40 (d, J=4,9Гц, 1Н). додають хлорсульфонову кислоту (3,1мл, Підготовчий синтез 24 46,4ммоль). Охолоджують суміш до 0°С, і додають 2-бром-3-метилтіофен (5,4г, 31ммоль). Нагрівають суміш при 50°С протягом 1год. Охолоджують реакційну суміш, гасять її сумішшю води з льодом, і екстрагують розчин СН2Сl2 (200мл). Органічний шар промивають розсолом, сушать (Na2SO4), фільтрують і концентрують у вакуумі. Залишок розчиняють в ацетоні (20мл) і додають до розчину 29% NH4OH (54мл) в ацетоні (250мл). Перемішують реакційну суміш протягом 0,5год, після чого видаляють ацетон під зниженим тиском. Залишок екстрагують EtOAc (2 100мл). Об'єднані органічні екстракти промивають розсолом, сушать (Na2SO4), фільтрують і концентрують у вакуумі. Неочищений продукт хроматографують на силікагелі з елююванням СН2Сl2, і одержують вказану в заголовку сполуку (5,3г, 58%). 1 H ЯМР (300МГц, CD3OD) 2,20 (s, 3Н), 7,32 (s, 1Н). Підготовчий синтез 22 До розчину 5-бром-4-метилтіофен-2сульфаміду (3,1г, 12,1ммоль) в АсОН (30мл) додають цинковий пил (2,4г, 36,2ммоль). Нагрівають реакційну суміш зі зворотним холодильником протягом 8год. Через 8год суміш охолоджують і фільтрують. Фільтрат нейтралізують 1Μ NaOH. Водний шар екстрагують EtOAc (300мл). Органічний екстракт сушать (Na2SO4), фільтрують і концентрують у вакуумі. Неочищений продукт хроматографують на силікагелі з елююванням СН2Сl2, і одержують вказану в заголовку сполуку (0,90г, 43%). 1 H ЯМР (300МГц, CD3OD) 2,26 (s, 3Н), 7,27 (s, 1H), 7,41 (s, 1H). Підготовчий синтез 23 Розчин н-бутиллітію (11,8мл, 2,5Μ в гексані, 29,4ммоль) додають крапля за краплею до розчину 2-триметилсиліл-3-метокситіофену (2,19г, 11,8ммоль) в безводному ТГФ (40мл) в атмосфері азоту при -70°С. Суміш перемішують при -70°С протягом 4год, після чого барботують через розчин діоксид сірки протягом 5хв. Після перемішування протягом 2,5год до суспензії додають Nхлорсукцинімід (3,15г, 23,6ммоль). Нагрівають суміш до кімнатної температури і перемішують протягом 1год, після чого фільтрують і промивають тверду речовину СН2Сl2. Фільтрат концентрують, і залишок розчиняють в СН2Сl2 (200мл). Органічний шар промивають розсолом, сушать (Na2SO4), фільтрують і концентрують. Залишок розчиняють в ацетоні (20мл) і додають до розчину 29% NH4OH (20мл) в ацетоні (30мл) при 0°С. Суміш перемішують при 0°С протягом 30хв, після чого видаляють ацетон під зниженим тиском, а залишок екстрагують EtOAc (2 100мл). Органічні екстракти промивають розсолом, сушать (Na2SO4), фільтрують і концентрують. Неочищений продукт хроматографують на силікагелі з елююванням сумішшю гексану з етилацетатом (3:1), і одержують вказану в заголовку сполуку (0,77г, 25%). 1 Н ЯМР 300МГц (CD3OD) 0,29 (s, 9H), 3,31 (s, 3Н), 7,49 (s, 1H). Підготовчий синтез 25 До розчину 5-триметилсиліл-4-метокситіофен2-сульфаміду (770мг, 2,90ммоль) в ТГФ (10мл) додають розчин тетрабутиламоній-фториду 21 75716 22 (17,4мл, 1M в ТГФ, 17,4ммоль). Реакційну суміш Розчин н-бутиллітію (7,4мл, 2,5Μ в гексані, перемішують при кімнатній температурі протягом 18,4ммоль) додають крапля за краплею до розчи2год. Видаляють ТГФ під зниженим тиском. Залину 2-триметилсиліл-3-метилтсульфаніліофену шок розчиняють в EtOAc (200мл). Органічний шар (1,5г, 7,4ммоль) в безводному ТГФ (25мл) в атмопромивають розсолом, сушать (Na2SO4), фільтрусфері азоту при -70°С. Суміш перемішують при ють і концентрують у вакуумі. Неочищений продукт 70°С протягом 4год. Барботують через розчин хроматографують на силікагелі з елююванням діоксид сірки при -70°С протягом 5хв. Через 2,5год сумішшю гексану з етилацетатом (3:1), і одержудо суспензії додають N-хлорсукцинімід (1,98г, ють вказану в заголовку сполуку (480мг, 86%). 1H 14,8ммоль). Суміш перемішують при кімнатній температурі протягом 1год. Суміш фільтрують, і ЯМР (300МГц, CD3OD) 3,81 (s, ЗН), 6,73 (s, 1H), тверду речовину промивають СН2Сl2. Фільтрат 7,22 (s, 1H). концентрують, і залишок розчиняють в СН2Сl2 Підготовчий синтез 26 (200мл). Органічний шар промивають розсолом, сушать (Na2SO4), фільтрують і концентрують. Залишок розчиняють в ацетоні (20мл) і додають до розчину 29% NH4OH (13мл) в ацетоні (30мл) при 0°С. Суміш перемішують при 0°С протягом 30хв. Видаляють ацетон під зниженим тиском, а залишок екстрагують EtOAc (2 100мл). Органічні екстракти промивають розсолом, сушать (Na2SO4), До розчину 4-метокситіофен-2-сульфаміду фільтрують і концентрують. Неочищений продукт (240мг, 1,24ммоль) в СН2Сl2 (40мл) додають Nхроматографують на силікагелі з елююванням бромсукцинімід (287мг, 1,61ммоль). Реакційну сусумішшю гексану з етилацетатом (3:1), і одержуміш перемішують при 0°С протягом 7год. Через ють вказану в заголовку сполуку (0,65г, 34%). 7год реакційну суміш розбавляють СН2Сl2 (150мл). 1 H ЯМР (300МГц, CD3OD) 0,39 (s, 9H), 2,45 Органічний шар промивають розсолом, сушать (s, 3Н), 7,65 (s, 1Н). (Na2SO4), фільтрують і концентрують у вакуумі. Підготовчий синтез 29 Неочищений продукт хроматографують на силікагелі з елююванням сумішшю гексану з етилацетатом (2:1), і одержують вказану в заголовку сполуку (277мг, 82%). 1 H ЯМР (300МГц, CD3OD) 3,30 (s, 3Н), 7,40 (s, 1Н). Підготовчий синтез 27 Розчин н-бутиллітію (5,3мл, 1,6Μ в гексані, 8,5ммоль) додають крапля за краплею до розчину 3-метилсульфанілтіофену (1,0г, 7,7ммоль) в безводному Et2O (8мл) в атмосфері азоту при -70°С. Суміш перемішують при -70°С протягом 2год. Повільно додають до реакційної суміші хлортриметилсилан (1,5мл). Нагрівають суміш до кімнатної температури і перемішують протягом 3год. Гасять реакційну суміш водою (50мл) та Et2O (50мл). Водний шар екстрагують Et2O (50мл). Об'єднані органічні екстракти сушать (Na2SO4), фільтрують і концентрують. Неочищений продукт хроматографують на силікагелі з елююванням гексаном, і одержують вказану в заголовку сполуку (0,75г, 48%) у вигляді безбарвної рідини. 1 H ЯМР 300МГц (CD3OD) 0,38 (s, 9H), 2,42 (s, 3Н), 7,17 (d, J=3,7Гц, 1H), 7,51 (d, J=3,7Гц, 1Н). Підготовчий синтез 28 До розчину 5-триметилсиліл-4метилсульфанілтіофен-2-сульфаміду (660мг, 2,34ммоль) в ТГФ (10мл) додають розчин тетрабутиламоній-фториду (14,0мл, 1M в ТГФ, 14,0ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 3год. Видаляють ТГФ під зниженим тиском, і залишок розчиняють в EtOAc (200мл). Органічний шар промивають розсолом, сушать (Na2SO4), фільтрують і концентрують у вакуумі. Неочищений продукт хроматографують на силікагелі з елююванням сумішшю гексану з етилацетатом (2:1), і одержують вказану в заголовку сполуку (400мг, 82%). 1H ЯМР (300МГц, CD3OD) 2,49 (s, 3Н), 7,35 (s, 1H), 7,47 (s, 1H). Підготовчий синтез 30 До розчину 4-метилсульфанілтіофен-2сульфаміду (210мг, 1,00ммоль) в СНСІ3 (10мл) та АсОН (10мл) додають N-бромсукцинімід (231мг, 1,30ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 7год. Через 7год суміш нейтралізують 1Μ NaOH і екстрагують EtOAc (200мл). Органічний шар промивають розсолом, потім сушать (Na2SO4), фільтрують і конце 23 75716 24 нтрують у вакуумі. Неочищений продукт хроматогції сумішшю етилацетату з гексаном (3:1; 2 400мл) рафують на силікагелі з елююванням сумішшю об'єднані огранічні шари промивають розсолом гексану з етилацетатом (3:1) і одержують вказану (200мл), сушать, концентрують і хроматографують в заголовку сполуку (200мг, 70%). на діоксиді кремнію (елюент 1% метилового спир1 H ЯМР (300МГц, CD3OD) 2,49 (s, 3Н), 7,45 ту і 0,5% оцтової кислоти в хлороформі) одержую(s, 1Н). чи вказану в заголовку сполуку (4,04г, вихід 59%). Підготовчий синтез 31 Т.пл. 154-155°С; ES(-)MS m/z 233, (M-Η)- відпові2,4-дибромбензонітрил дає одному атому брому та одному атому хлору. До безводного диметилсульфоксиду (50мл) Підготовчий синтез 34 при 60°С додають при перемішуванні ціанід міді (2,32г, 25,9ммоль) до одержання прозорого розчину, а потім додають однією порцією третбутилнітрил (7,1мл, 59,7ммоль). До одержаної суміші додають крапля за краплею через канюлю розчин 2,4-диброманіліну (5,0г, 19,9ммоль) у безводному диметилсульфоксиді (30мл). Після закінчення додавання перемішують суміш протягом До 4-бром-3-хлортолуолу (4,97г, 24,2ммоль) в 1год. Після охолодження до 45°С до суміші повідиметилформаміді (25мл) додають ацетат палально додають 5-н. хлористоводневу кислоту дію (0,54г, 2,42ммоль), 1,3(50мл). Через 5хв реакційну суміш охолоджують біс(дифенілфосфін)пропан (0,998г, 2,42ммоль), до температури навколишнього середовища, після триетиламін (12,5мл) та метанол (12,5мл). З реакчого екстрагують сумішшю етилацетату з гексаном ційної посудини видаляють повітря (вакуумують) і (1:1, 2 300мл). Об'єднані органічні шари промиватричі продувають газоподібним монооксидом вугють водою (100мл) і розсолом (100мл), сушать, лецю. За допомогою еластичної камери, заповнеконцентрують у вакуумі, після чого хроматографуної газоподібним монооксидом вуглецю, підтримують на діоксиді кремнію (елюент 0-5% етилацетату ють у реакторі атмосферу монооксиду вуглецю. в гексані), і одержують вказану в заголовку сполуНагрівають реакційну суміш при 80°С протягом ку (1,61г, вихід 31%). 8год. Промивають суміш водою і екстрагують гекFD(+)MS m/z 259, (М+) відповідає двом атомам саном (2 50мл). Об'єднані органічні шари сушать брому. над сульфатом натрію, фільтрують, концентрують Підготовчий синтез 32 і хроматографують з елююванням 0-3% етилаце2,4-дибромбензойна кислота тату в гексані. Одержують 1,24г (28%) метил-2Суспензію 2,4-дибромбензонітрилу (1,57г, хлор-4-метилбензоату у вигляді безбарвного мас6,0ммоль) в сірчаній кислоті (6М, 150мл) нагрівала. ють зі зворотним холодильником протягом 3 діб. ES(+)MS m/z 184, (М+Н)+ відповідає одному Охолоджують реакційну суміш до температури атому хлору. навколишнього середовища, після чого екстрагуДо метил-2-хлор-4-метилбензоату (1,00г, ють етилацетатом (2 75мл). Об'єднані органічні 5,42ммоль) в суміші тетрагідрофурану (10мл), мешари промивають водою (100мл) і розсолом тилового спирту (5мл) та води (2,5мл) додають 2(50мл), сушать і концентрують, після чого хроматон. розчин гідроксиду літію (8,12мл, 16,2ммоль). графують на діоксиді кремнію (елюент оцтова кисНагрівають реакційну суміш при 50°С протягом лота/метиловий спирт/хлороформ, 0,1:0,5:99,4), і 2,5год, охолоджують до кімнатної температури, одержують вказану в заголовку сполуку (0,81г, після чого гасять 5-н. хлористоводневою кислотою вихід 48%). Т.пл. 171-172°С; ES(-)MS m/z 277, (М(3,24мл). Концентрують суміш, видаляючи тетрагіН)- відповідає двом атомам брому. дрофуран та метиловий спирт. Утворюється білий Підготовчий синтез 33 осад, який відділяють фільтруванням. Після висушування одержують 0,922г (100%) 2-хлор-4метилбензойної кислоти. ES(-)MS m/z 169, (М-Н)- відповідає одному атому хлору. Підготовчий синтез 35 Етиловий складний ефір 4,4,4-трифтор-3метокси-бут-2-енової кислоти До розчину 4,4,4-трифторацетоацетату (12мл, 82ммоль) в ДМФ (80мл) додають карбонат цезію До охолодженої льодом суміші 2-аміно-4(26,4г, 82ммоль). Нагрівають реакційну суміш до хлорбензойної кислоти (5,00г, 29,1ммоль) та 48% 70°С. Потім додають крапля за краплею протягом бромистоводневої кислоти (150мл) з водою 30хв розчин метил-n-толуолсульфонату (13,5мл, (150мл) додають крапля за краплею при перемі90ммоль) в ДМФ (30мл), і перемішують реакційну шуванні розчин нітрату натрію (2,21г) у воді суміш ще протягом 1год. Після охолодження до (15мл). Одержану суміш перемішують при 0°С кімнатної температури розбавляють реакційну протягом 2год. Потім додають крапля за краплею суміш водою (150мл) і екстрагують Et2O (2 150мл). розчин броміду міді (7,81г) у воді (20мл). Після Органічні екстракти об'єднують, промивають возавершення додавання реакційній суміші дають дою і розсолом, сушать (Na2SO4), фільтрують і нагрітися до температури навколишнього середоконцентрують, одержуючи вказану в заголовку вища і перемішують протягом ночі. Після екстраксполуку (9,0г, вихід 56%) у вигляді масла, яке ви 25 75716 26 користовують без подальшого очищення. містить 5-хлор-1-феніл-1Н-тетразол (2,1г, 1 11,9ммоль) та К2СО3 (3,3г, 23,8ммоль) нагрівають H ЯМР (300МГц, CDCІ3) 1,28 (t, J=7,1Гц, 3Н), зі зворотним холодильником протягом ночі, рете4,01 (s, 3Н), 4,19 (q, J=7,1Гц, 2Н), 5,75 (s, 1Н). льно запобігаючи попаданню вологи в реакційну Підготовчий синтез 36 посудину. Видаляють ацетон під зниженим тиском, Метиловий складний ефір 3-гідрокси-5а залишок розподіляють між СН2Сl2 (500мл) і вотрифторметилтіофен-2-карбонової кислоти дою (50мл). Органічні екстракти промивають розРозчин етилового складного ефіру 4,4,4солом, потім сушать (Na2SO4), фільтрують і концетрифтор-3-метокси-бут-2-єнової кислоти (9,6г, нтрують. Неочищений продукт хроматографують 48,5ммоль) та метилтіогліколяту (4,3мл, на силікагелі з елююванням сумішшю етилацетату 48,5ммоль) в МеОН (75мл) охолоджують до 5°С. з гексаном (1:80), одержуючи вказану в заголовку Потім протягом 30хв додають розчин КОН (3,3г, сполуку (2,5г, 68%) у вигляді білої твердої речови58,2ммоль) в МеОН (75мл). Перемішують реакційни. ну суміш протягом ночі при кімнатній температурі. 1 Потім виливають суміш із перемішуванням в суміш H ЯМР (300МГц, CDCІ3) 7,52-7,61 (m, 4H), льоду (75г), води (75г) та концентрованої H2SO4 7,73 (d, J=7,7Гц, 2Н), 7,79 (s, 1H). Підготовчі синтези 40 та 41 (4,5мл). Екстрагують суміш EtOAc (2 250мл). 3-(1-феніл-1Н-тетразол-5-ілокси)-5Об'єднані екстракти промивають насиченим розтрифторметилтіофен-2-сульфамід та 3-[1-(4чином NaHCO3. Промивний розчин піддають звосульфамоїлфеніл)-1Н-тетразол-5-ілокси]-5ротній екстракції EtOAc. Об'єднані огранічні шари трифторметилтіофен-2-сульфамід промивають розсолом, потім сушать (Na2SO4), Завантажують у склянку розчин хлорсульфофільтрують і концентрують, одержуючи вказану в нової кислоти (2мл, 30ммоль), і додають в атмосзаголовку сполуку (10г, вихід 91%) у вигляді масла фері азоту 1-феніл-5-(5-трифторметилтіофен-3коричневого кольору, яке використовують без доілокси)-1Н-тетразол (100мг, 0,30ммоль). Нагрівадаткового очищення. 1 ють розчин при 100°С протягом 2год. ОхолоджуH ЯМР (300МГц, CDCІ3) 3,92 (s, 3Н), 7,06 (s, ють розчин до 70°С, і додають тіонілхлорид 1Н), 9,48 (br s, 1H). (0,1мл, 0,33ммоль), потім знов нагрівають реакційПідготовчий синтез 37 ну суміш до 100°С і перемішують ще протягом 3-гідрокси-5-трифторметилтіофен-2-карбонова 2год. Реакційну суміш крапля за краплею виливакислота ють на лід, і екстрагують одержаний розчин СН2Сl2 До розчину NaOH (8,0г, 200ммоль) у воді (100мл). Органічний шар промивають розсолом, (25мл) додають при перемішуванні розчин метисушать (Na2SO4), фільтрують і концентрують. Залового складного ефіру 3-гідрокси-5лишок розчиняють в ацетоні (5мл) і додають до трифторметилтіофен-2-карбонової кислоти (11,4г, розчину 29% NH4OH (5мл) в ацетоні (10мл) при 50ммоль) в МеОН (25мл). Реакційну суміш нагрі0°С. Суміш перемішують при 0°С протягом 30хв. вають зі зворотним холодильником протягом 3год, Видаляють ацетон під зниженим тиском, азалипісля чого охолоджують до кімнатної температури. шок екстрагують EtOAc (2 50мл). Органічні екстКонцентрують суміш приблизно до половини об'єракти промивають розсолом, сушать (Na2SO4), му і охолоджують до 5°С. Після підкисленя концефільтрують і концентрують. Неочищений продукт нтрованою НСI (17мл) до рН 1 утворюється сухроматографують на силікагелі з елююванням спензія. Після перемішування цієї суспензії сумішшю етилацетату з гексаном (1:3), і одержупротягом 30хв при 5°С тверду фазу відділяють ють суміш вказаних в заголовку сполук (91мг, 65%) фільтруванням, промивають водою і сушать у вау вигляді білої твердої речовини. В іншій реакції куумі, одержуючи вказану в заголовку сполуку згадані компоненти розділяють хроматографією на (8,5г, 79%) у вигляді жовтуватої твердої речовини, силікагелі з елююванням сумішшю етилацетату з яку використовують без додаткового очищення. 1 гексаном (1:5), і характеризують кожну речовину H ЯМР (300МГц, CDCІ3) 7,30 (s, 1H), 11,7 (br окремо. s, 2H). 1 H ЯМР (300МГц, CD3OD) 7,57-7,67 (m, 4H), Підготовчий синтез 38 7,89 (d, J=5,9Гц, 2Н). 5-трифторметилтіофен-3-ол 1 3-гідрокси-5-трифторметилтіофен-2-карбонову H ЯМР (300МГц, CD3OD) 7,96 (d, J=4,2Гц, кислоту (8,0г, 37,8ммоль) вміщують у колбу і нагрі1Н), 8,15 (s, 4H). вають при 105°С в атмосфері аргону. Для заверПідготовчий синтез 42 шення декарбоксилювання необхідне нагрівання 5-трифторметилтіофен-2-сульфамід протягом 2год. Після охолодження одержують вкаДо розчину 3-[1-(4-сульфамоїлфеніл)-1Нзану в заголовку сполуку (6,8г, вихід 85%) у виглятетразол-5-ілокси]-5-трифторметилтіофен-2ді масла коричневого кольору, яке використовують сульфаміду (210мг, 0,47ммоль) в бензолі (50мл) без подальшого очищення. додають воду (2мл), EtOH (3мл), мурашину кисло1 ту (2мл) та 10% паладій на вугіллі (350мг). Суміш H ЯМР (300МГц, CDCІ3) енол (головний) нагрівають при 80°С протягом ночі. Охолоджують 5,01 (br s, 1Н), 6,52 (d, J=1,7Гц), 7,06 (m, 1H). 1 реакційну суміш до кімнатної температури і розбаH ЯМР (300МГц, CDCІ3) кетогрупа (другорядвляють бензолом (50мл). Фільтрують суміш. Бенна) 3,86 (s, 2H), 6,59 (br s, 1H). зольний шар сушать (Na2SO4), фільтрують і конПідготовчий синтез 39 центрують. Неочищений продукт 1-феніл-5-(5-трифторметилтіофен-3-ілокси)хроматографують на силікагелі з елююванням 1Н-тетразол сумішшю етилацетату з гексаном (1:10), і одержуРозчин 5-трифторметилтіофен-3-олу (2,0г, ють вказану в заголовку сполуку (18мг, 17%) у ви11,9ммоль) у безводному ацетоні (480мл), який 27 75716 28 гляді твердої білої речовини. лишок розподіляють між етилацетатом та водою. Застосовуючи ту саму методику до аміду 3-(1Органічний шар промивають 1-н. хлористоводнефеніл-1Н-тетразол-5-ілокси)-5вою кислотою (4 рази, 20мл/ммоль), а потім об'єдтрифторметилтіофен-2-сульфокислоти, одержунані водні фази екстрагують етилацетатом (двічі, ють ту саму сполуку, вказану в заголовку. 20мл/ммоль). Нарешті, об'єднані органічні шари 1 промивають водою і насиченим водним розчином H ЯМР (300MГц,CD3OD) 7,56 (d, J=4,0Гц, хлориду натрію, сушать над сульфатом натрію і 1Н), 7,60 (d, J=4,0Гц, 1H). ES(-)MS m/z 230, (M-H)-. концентрують під зниженим тиском. В разі необЗагальна методика сполучення хідності або за бажанням, залишок можна очистиДо розчину бензойної кислоти (1,25екв.) в безти хроматографією на силікагелі, хроматографією водному дихлорметані (10мл/ммоль) додають одз оберненою фазою або кристалізацією. нією порцією при перемішуванні сульфамід Сполуки за Прикладами 1-53 одержують за за(1,0екв.), а потім EDC (1,25-1,5екв.) і, нарешті, N,Nгальною методикою сполучення. |диметил]-4-амінопіридин (1,2екв.). Суміш інтенсивно перемішують в атмосфері азоту протягом 16год, концентрують під зниженим тиском, а заПриклад № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 Продукт Дані мас-спектру (m/z) N-[4-бром-2-хлорбензоїл]-5-хлортіофен2-сульфамід N-[4-хлор-2-метилбензоїл]-5бромтіофен-2-сульфамід N-[4-бром-2-хлорбензоїл]-4-бром-5хлортіофен-2-сульфамід N-[2,4-біс(трифторметил)-бензоїл]-5хлортіофен-2-сульфамід N-[2,4-біс(трифторметил)-бензоїл]-5бромтіофен-2-сульфамід N-[2,4-диметилбензоїл]-5-хлортіофен-2сульфамід N-[2-хлор-4-метилбензоїл]-5бромтіофен-2-сульфамід N-[2-хлор-4-метилбензоїл]-5хлортіофен-2-сульфамід Ν-[4-хлор-2-фторбензоїл]-5бромтіофен-2-сульфамід Ν-[2-бром-4-метилбензоїл]-5бромтіофен-2-сульфамід Ν-[2-бром-4-метилбензоїл]-5хлортіофен-2-сульфамід N-[4-метил-2-трифторметил-бензоїл]-5хлортіофен-2-сульфамід N-[2,4-дихлорбензоїл]-5(метилтіо)тіофен-2-сульфамід N-[4-хлор-2-метилбензоїл]-5(метилтіо)тіофен-2-сульфамід N-[4-метил-2-бромбензоїл]-5(метилтіо)тіофен-2-сульфамід N-[2,4-дихлорбензоїл]-5-(метил)тіофен2-сульфамід N-[2,4-дихлорбензоїл]-5-(етил)тіофен-2сульфамід N-[2,4-дихлорбензоїл]-5-(пропіл)тіофен2-сульфамід N-[2,4-дихлорбензоїл]-5-метокситіофен2-сульфамід N-[2,4-дихлорбензоїл]-5метоксиметилтіофен-2-сульфамід N-[2-метил-4-бромбензоїл]-4бромтіофен-2-сульфамід N-[2-метил-4-хлорбензоїл]-2хлортіазол-5-сульфамід N-[2,4-дихлорбензоїл]-2-хлортіазол-5сульфамід ES(-)MS m/z 412, (M-Η)- відповідає одному атому брому та двом атомам хлору ES(-)MS m/z 392, (M-Η)- відповідає одному атому брому та одному атому хлору ES(-)MS m/z 490, (M-Η)- відповідає двом атомам брому та двом атомам хлору ES(-)MS m/z 436, (M-Η)- відповідає одному атому хлору ES(-)MS m/z 480, (M-Η)- відповідає одному атому брому ES(-)MS m/z 328 (M-Η)- відповідає одному атому хлору ES(+)MS m/z 394 (М+Н)+ відповідає одному атому брому та одному атому хлору ES(+)MS m/z 350, (М+Н)+ відповідає двом атомам хлору ES(-)MS m/z 396, (M-Η)- відповідає одному атому брому та одному атому хлору ES(-)MS m/z 438, (М+Н)+ відповідає двом атомам брому ES(+)MS m/z 394, (М+Н)+ відповідає одному атому брому та одному атому хлору ES(-)MS m/z 382, (M-Η)- відповідає одному атому хлору ES(-)MS m/z 380, (M-Η)- відповідає двом атомам хлору ES(-)MS m/z 360, (M-Η)- відповідає одному атому хлору ES(-)MS m/z 404, (M-Η)- відповідає одному атому брому ES(-)MS m/z 348, (М-Н)- відповідає двом атомам хлору ES(-)MS m/z 362, (M-Η)- відповідає двом атомам хлору ES(-)MS m/z 376, (M-Η)- відповідає двом атомам хлору ES(-)MS m/z 364, (M-Η)- відповідає двом атомам хлору ES(-)MS m/z 378 (M-Η)- відповідає двом атомам хлору ES(-)MS m/z 436, (M-Η)- відповідає двом атомам брому ES(-)MS m/z 349, (М-Н)- відповідає двом атомам хлору ES(-)MS m/z 369, (М-Н)- відповідає трьом атомам хлору 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 29 N-[2,4-дихлорбензоїл]-2-метокситіазол5-сульфамід N-[2-метил-4-хлорбензоїл]-2метокситіазол-5-сульфамід N-[2,4-дихлорбензоїл]-4,5дибромтіофен-2-сульфамід N-[4-бром-2-метилбензоїл]-4,5дибромтіофен-2-сульфамід N-[4-хлор-2-метилбензоїл]-5ціантіофен-2-сульфамід N-[4-бром-2-метилбензоїл]-5ціантіофен-2-сульфамід N-[4-хлор-2-метилбензоїл]-5хлортіофен-2-сульфамід N-[2-бром-4-метилбензоїл]-5хлортіофен-2-сульфамід N-[2,4-дибромбензоїл]-5-бромтіофен-2сульфамід N-[2-бром-4-хлорбензоїл]-5бромтіофен-2-сульфамід N-[2-метил-4-бромбензоїл]-4хлортіофен-2-сульфамід N-[2,4-дихлорбензоїл]-4-хлортіофен-2сульфамід Ν-[2,4-дихлорбензоїл]-4-хлор-5бромтіофен-2-сульфамід Ν-[2,4-дихлорбензоїл]-4-метил-5бромтіофен-2-сульфамід Ν-[2,4-дихлорбензоїл]-4-метилтіофен-2сульфамід Ν-[2-метил-4-бромбензоїл]-4метокситіофен-2-сульфамід N-[2,4-бістрифторметилбензоїл]-4метилтіофен-2-сульфамід Ν-[2,4-дихлорбензоїл]-4-метокситіофен2-сульфамід Ν-[2-метил-4-бромбензоїл]-4-метилтіотіофен-2-сульфамід N-[2,4-дихлорбензоїл]-4-метилтіотіофен-2-сульфамід N-[2,4-бістрифторметилбензоїл]-4метокситіофен-2-сульфамід N-[2,4-біс(трифторметил)бензоїл]-4метилтіо-тіофен-2-сульфамід Ν-[2,4-дихлорбензоїл]-4-метилтіо-5бромтіофен-2-сульфамід N-[2,4-дихлорбензоїл]-4-метокси-5бромтіофен-2-сульфамід N-[2-метил-4-бромбензоїл]-4-метокси-5бромтіофен-2-сульфамід N-[2-метил-4-бромбензоїл]-4-метилтіо5-бромтіофен-2-сульфамід N-[2,4-дихлорбензоїл]-2ізопропілтіазол-5-сульфамід N-[2-метил-4-бромбензоїл]-2ізопропілтіазол-5-сульфамід N-[2-метил-4-бромбензоїл]-2метилтіазол-5-сульфамід N-[2,4-дихлор-бензоїл]-5трифторметилтіофен-2-сульфамід Приклад 54 75716 30 ES(-)MS m/z 365, (М-Н)- відповідає двом атомам хлору ES(-)MS m/z 345, (М-Н)- відповідає одному атому хлору ES(-)MS m/z 490, (М-Н)- відповідає одному атому брому та двом атомам хлору ES(-)MS m/z 514, (М-Н)- відповідає трьом атомам брому ES(-)MS m/z 341, (М+Н)+ відповідає одному атому хлору ES(+)MS m/z 385, (М+Н)+ відповідає одному атому брому ES(+)MS m/z 350, (М+Н)+ відповідає двом атомам хлору ES(-)MS m/z 392, (М-Н)- відповідає одному атому брому та одному атому хлору ES(-)MS m/z 500, (М-Н)- відповідає трьом атомам брому ES(-)MS m/z 456, (М-Н)- відповідає двом атомам брому та одному атому хлору ES(-)MS m/z 392, (М-Н)- відповідає одному атому брому та одному атому хлору ES(-)MS m/z 368, (М-Н) відповідає трьом атомам хлору ES(-)MS m/z 446, (M-Η)- відповідає одному атому брому та трьом атомам хлору ES(-)MS m/z 426, (M-Η)- відповідає одному атому брому та двом атомам хлору ES(-)MS m/z 348, (M-Η)- відповідає двом атомам хлору ES(-)MS m/z 388, (M-Η)- відповідає одному атому брому ES(-)MS m/z 416, (M-Η)ES(-)MS m/z 364, (M-Η)- відповідає двом атомам хлору ES(-)MS m/z 404, (M-Η)- відповідає одному атому брому ES(-)MS m/z 380, (M-Η)- відповідає двом атомам хлору ES(-)MS m/z 432, (М-Н)ES(-)MS m/z 448, (M-Η)ES(-)MS m/z 458, (M-Η)- відповідає одному атому брому та двом атомам хлору ES(-)MS m/z 442, (М-Н)- відповідає одному атому брому та двом атомам хлору ES(-)MS m/z 466, (М-Н)- відповідає двом атомам брому ES(-)MS m/z 482, (М-Н)- відповідає двом атомам брому ES(-)MS m/z 377, (М-Н)- відповідає двом атомам хлору ES(-)MS m/z 401, (М-Н)- відповідає одному атому брому ES(-)MS m/z 373, (М-Н)- відповідає одному атому брому ES(-)MS m/z 402, (М-Н)- відповідає двом атомам хлору 31 75716 У реакційну склянку місткістю 8мл завантажують 4-бром-2-хлорбензойну кислоту (0,39ммоль, 1,5екв.) та 2,0мл дихлорметану. Додають резервний розчин (4,0мл), який містить 5бромтіофен-2-сульфамід (0,26ммоль, 1екв.) та N,N-[диметил]-4-амінопіридин (48мг, 0,39ммоль, 1,5екв.) в дихлорметані, а потім 0,261г карбодіімід-полістирольної смоли (2,0ммоль/г, 0,52ммоль, 2,0екв., продукт фірми Novabiochem), Приклад № 55 56 57 58 59 60 61 62 32 склянку закривають і струшують. Через 72год додають 0,77г сульфонованої полістирольної смоли (MP-TsOH; 1,53ммоль/г, 1,17ммоль, продукт фірми Argonaut). Приблизно через 18год реакційну суміш фільтрують і концентрують під зниженим тиском. Залишок хроматографують, фракції, котрі містять продукт, об'єднують і концентрують під зниженим тиском, одержуючи вказану в заголовку сполуку. ES(-)MS m/z 456, (М-H)- відповідає двом атомам брому та одному атому хлору. Сполуки за Прикладами 55-62 одержують за методикою, описаною в Прикладі 54. Продукт Дані мас-спектру (m/z) N-[2,4-дихлорбензоїл]-тіофен-2сульфамід N-[2,4-дихлорбензоїл]-5-(2-піридил)тіофен-2-сульфамід N-[4-бром-2-метилбензоїл]-5бромтіофен-2-сульфамід N-[2-хлор-4-нітробензоїл]-5-бромтіофен2-сульфамід N-[2,4-диметилбензоїл]-5-бромтіофен-2сульфамід N-[4-хлор-2-метилбензоїл]-5хлортіофен-2-сульфамід N-[2,4-дихлорбензоїл]-5-хлортіофен-2сульфамід N-[2,4-дихлорбензоїл]-5(фенілтіо)тіофен-2-сульфамід ES(-)MS m/z 334, (M-Η)- відповідає двом атомам хлору Приклад 63 До реакційної суміші дихлорбензойної кислоти (28,4г, 148,7ммоль), 5-бромтіофен-2сульфаміду (30,0г, 123,9ммоль) та EtOAc (200,0мл) додають при кімнатній температурі нагрітий розчин CDI (24,1г, 148,7ммоль) в ТГФ (100,0мл) протягом 13,0хв. Залишковий CDI змивають додатковою кількістю ТГФ (50,0мл), і виливають змив у реакційну колбу. Під час додавання розчину та суспензії CDI спостерігається вивільнення газу. Швидкість цього вивільнення можна регулювати, змінюючи швидкість додавання. Після завершення додавання CDI одержаний розчин світло-жовтого кольору перемішують протягом 10хв, а потім нагрівають зі зворотним холодильником протягом 90хв або до припинення вивільнення газу (хід реакції контролюють газовою хроматографією; реакція вважається завершеною, коли аналіз посвідчує відсутність піка кислоти). Потім дають температурі реакційної маси знизитися до рівноважного значення 40°С, після чого додають однією порцією нерозчинений DBU (при завершенні додавання досягається максимальна ES(-)MS m/z 411, (M-H)- відповідає двом атомам хлору ES(-)MS m/z 436, (M-H)- відповідає двом атомам брому ES(-)MS m/z 423, (M-Η)- відповідає одному атому брому та одному атому хлору ES(-)MS m/z 372, (M-Η)- відповідає одному атому брому ES(-)MS m/z 348, (M-Η)- відповідає двом атомам хлору ES(-)MS m/z 368, (М-Н)- відповідає трьом атомам хлору ES(-)MS m/z 442, (M-Η)- відповідає двом атомам хлору температура 45°С), і перемішують суміш протягом ночі, при цьому температура знижується до кімнатної. Реакція вважається завершеною, коли аналіз РХВЕ посвідчує відсутність вихідного сульфаміду. Додають до суміші деіонізовану воду (250,0мл), і відділяють верхній органічний шар. Водний шар піддають зворотній екстракції EtOAc (50мл). Об'єднані органічні шари ретельно промивають 1-н. розчином НСI (500,0мл), сушать безводним MgSO4, фільтрують, і промивають осад на фільтрі EtOAc (20,0мл). Фільтрат концентрують під зниженим тиском (температура водяної бані приблизно 50°С), одержуючи 70,4г густого розчину. До цього розчину додають гептан (200,0мл) при інтенсивному перемішуванні до утворення (приблизно через 1год) жовтуватого осаду. Цей осад відділяють фільтруванням і промивають на фільтрі гептаном (25,0мл). Сушать осад у вакуумній шафі при 55°С протягом 18год, і одержують вказану в заголовку сполуку (45,4г, вихід 88,2% (мас.)). ES(-)MS m/z 412, (М-Н)- відповідає одному атому брому та двом атомам хлору. Приклад 64 33 75716 34 До розчину сполуки, одержаної за Прикладом забезпечує відповідне дозування. Композиції та 63 (25,0г, 60,2ммоль) в метил-трет-бутиловому препарати за цим винаходом, яким слід віддавапростому ефірі (208,0мл) додають однією порціти перевагу, можна визначити методами, добре єю при кімнатній температурі метилат натрію відомими фахівцям. (3,3г, 60,2ммоль). Потім перемішують реакційну Таблетки, пілюлі, капсули, пастилки тощо масу протягом 24год, після чого додають гептан можуть містити також одну або кілька таких до(426,0мл) і інтенсивно перемішують протягом поміжних речовин: в'яжучі, наприклад, полівініл60хв. Утворюється білий осад, який фільтрують піролідон, гідроксипропілцелюлозу, мікрокристапід позитивним тиском азоту і промивають на лічну целюлозу або желатин; наповнювачі або фільтрі гептаном (150,0мл). Відсмоктують осад розріджувачі, наприклад, крохмаль, лактозу, мікдо напівсухого стану, після чого сушать у вакумрокристалічну целюлозу або дикальційфосфат; ній шафі при 100°С протягом 18год (маса продукдезінтегратори, наприклад, кроскармелозу, кросту 22,1г, вихід 84%). повідон, натрієвий крохмаль-гліколят, кукурудзя1 ний крохмаль тощо; змащувальні агенти, наприH ЯМР (DMSO d6) 7,13-7,14 (d, J=3,9Гц, клад, стеарат магнію, стеаринову кислоту, тальк 1Н), 7,30-7,35 (m, 2H), 7,47-7,52 (m, 2H). або гідрогенізовану рослинну олію; ковзні агенти, Усі сполуки за винаходом придатні для перонаприклад, колоїдний діоксид кремнію; змочуварального вживання і, як правило, застосовуються льні агенти, наприклад, лаурилсульфат натрію та перорально, таким чином, пероральному застополісорбат 80; можуть бути додані також підсосуванню віддається перевага. Пероральний сполоджувачі, наприклад, сахароза, аспартам або сіб, однак, не є ні єдиним способом застосування, сахарин, або смакоароматичні домішки, наприні навіть єдиним способом, якому віддається пеклад, м'ята, метилсаліцилат або цитрусовий ароревага. Наприклад, для пацієнтів, схильних забуматизатор. Якщо дозованою лікарською формою вати або незгодних застосовувати лікарські засоє капсула, то вона може містити, окрім матеріалів би пероральним способом, дуже бажаним є вищезгаданих типів, рідкий носій, наприклад, почерезшкірне введення лікарського засобу в оргаліетиленгліколь або жирну олію. Інші дозовані нізм, а внутрішньовенному введенню може відлікарські форми можуть містити різноманітні інші даватися перевага з міркувань зручності або з матеріали, які змінюють фізичну форму лікарсьметою уникнення можливих ускладнень, пов'язакого препарату, наприклад, у вигляді оболонок. них із пероральним введенням. За певних обстаТак, таблетки або пілюлі можуть мати оболонку з вин сполуки Формули І можна вводити в організм цукру, гідроксипропілметилцелюлози, поліметактакож підшкірним, внутрішньом'язовим, назальрилатів або інших покривних матеріалів. Сироп, ним або ректальним способами. Різноманітні моокрім сполук за винаходом, може містити сахарожливості варіювання способів введення обмежузу як підсолоджувач та певні консерванти, барвються фізичними властивостями лікарських ники та ароматизатори. Матеріали, що застосоречовин, міркуваннями зручності для пацієнта та вуються при виготовленні цих різноманітних лікаря та іншими релевантними обставинами композицій, мають бути фармацевтично чистими [див. Remington's Pharmaceutical Sciences. 18th та нетоксичними у використовуваних кількостях. Ed., Mack Publ. Co., 1990]. До ін'єкційних лікарських форм для парентеФармацевтичні композиції виготовляють спорального застосування належать стерильні воді собами, добре відомими в фармацевтичній пракабо неводні розчини, суспензії та емульсії. Водні тиці. Носієм або наповнювачем може бути тверрозчини та суспензії можуть містити дистильовадий, напівтвердий або рідкий матеріал, який ну воду для ін'єкцій або фізіологічний сольовий може відігравати роль носія або середовища для розчин. Неводні розчини та суспензії можуть місактивного інгредієнта. Придатні носії або наповтити пропіленгліколь, поліетиленгліколь, рослинні нювачі добре відомі в практиці. Фармацевтична олії, наприклад, оливкову олію, спирти, наприкомпозиція може бути пристосована для перораклад, етанол, або POLYSORBATE 80 (зареєстрольного, інгаляційного, парентерального або місвана торгова марка). Ін'єкційні препарати можуть цевого застосування, і може бути введена в ормістити, окрім інертних розріджувачів, додаткові ганізм пацієнта у формі таблеток, капсул, інгредієнти, наприклад, консерванти, змочувальні аерозолів, інгаляційних препаратів, супозиторіїв, агенти, емульгатори, диспергатори, стабілізатори розчинів, суспензій тощо. (наприклад, лактозу), допоміжні речовини, наприСполуки за цим винаходом можуть бути ввеклад, агенти, що сприяють розчиненню (напридені в організм перорально, наприклад, з інертклад, глутамінову кислоту або аспарагінову кисним розріджувачем або в капсулах, або у формі лоту). Вони можуть бути стерилізовані, пресованих таблеток. Для цілей перорального наприклад, шляхом фільтрування через бактерізастосування з терапевтичною метою згадані альні фільтри, введення стерилізувальних агенсполуки можуть бути комбіновані з наповнювачатів до їх складу або опромінення. Вони можуть ми і застосовуватися у формі таблеток, пастилок, бути виготовлені також у формі стерильних тверкапсул, еліксирів, суспензій, сиропів, облаток, дих композицій, які можна розчиняти в стерильній жувальних гумок тощо. Ці препарати у варіанті, воді або деяких інших стерильних розчинниках якому віддається перевага, містять щонайменше для ін'єкцій безпосередньо перед застосуванням. 4% сполуки за цим винаходом як активного інгреСполуки Формули І, як правило, ефективні в дієнта, однак вміст згаданої сполуки може варіюширокому діапазоні дозування. Наприклад, добовати залежно від конкретної лікарської форми і ві дози звичайно лежать у межах від приблизно становити від 4% до приблизно 70% маси дозо10мг/кг маси тіла до приблизно 300мг/кг маси ваної одиниці. Кількість сполуки в композиціях 35 75716 36 тіла. В деяких випадках можуть бути цілком адекWST-1, як описано вище. Результати визначали ватними рівні дозування, нижчі від нижньої межі як частку росту оброблених клітин у зіставленні з вищезгаданого діапазону, тоді як в інших випадконтрольними культурами. Випробовували ефекках можна застосовувати ще більші дози, не витивність типових сполук за цим винаходом віднокликаючи негативних побічних ефектів; отже, висно клітин пухлини НСТ116 товстої кишки людищезгаданий діапазон дозування не розглядається ни. Результати цих експериментів наведено в як такий, що обмежує обсяг винаходу. Мається на Таблиці І. увазі, що конкретну кількість сполуки, що вводиться в організм пацієнта, визначає лікар з ураТаблиця І хуванням релевантних обставин, в тому числі розладу, котрий підлягає лікуванню, обраного Клітини пухлини НСТ116 шляху введення, конкретної речовини або речотовстої або ободової кишки людини вин, обраних для застосування, віку, маси тіла та індивідуальної реакції пацієнта, а також тяжкості Приклад ІС50 (мкМ) Приклад ІС50 (мкМ) симптомів, що спостерігаються у пацієнта. 1 5,6 28 8,0 Пригнічення проліферації HUVEC 2 6,0 29 17,3 Клітини ендотелію пупкової вени людини 3 14,7 30 15,8 (HUVEC; постачальник фірма 4 7,7 31 9,1 BioWhittaker/Clonetics, Walkersville, MD) вирощу6 20,6 32 3,9 вали в живильному середовищі для клітин ендо7 5,2 54 17,0 телію (EGM), що містило базальне сердовище 9 21,7 55 4,5 (ЕВМ) з екстрактом мозку великої рогатої худоби, 16 3,7 56 5,4 фактор росту епітелію людини, гідрокортизон, 17 5,0 57 3,4 гентаміцин, амфотерицин В та 2% сироватки 3 18 13,2 58 5,2 плоду корови. Для випробування HUVEC (5 10 ) 19 5,8 61 1,0 в ЕВМ (200мкл) з 0,5% сироватки плоду корови 20 5,7 63 1,3 висівали в лунки 96-лункового планшета для вирощування клітин і інкубували протягом 24год Випробування зі звичайними пухлинами мипри 37°С у зволоженому повітрі з 5% СО2. Вишей та ксенотрансплантатами людини пробовувані сполуки послідовно розводили в Пригнічення пухлин, трансплантованих мидиметилсульфоксиді (ДМСО) в концентраціях від шам, є загальноприйнятою методикою дослі0,0013мкМ до 40мкМ і додавали в лунки (по дження ефективності протипухлинних засобів 20мкл). Потім у лунки додавали фактор росту [Корбетт та інші - Corbett et aI., In vivo Methods for судинного епітелію людини (VEGF) (20нг/мл на Screening and Preclinical Testing; Use of rodent лунку; постачальник - фірма R&D Systems, solid tumors for drug discovery, in: Anticancer Drug Minneapolis, MN), приготований з резервного розDevelopment Guide, B. Teicher (ed.), Humana чину (100мкг/мл) у нормальному сольовому розPress Inc., Totowa, NJ, Chapter 5, pp.75-99, 1997; чині з фосфатним буфером, що містив 0,1% биCorbett et al., Int. J. Pharmacol. 33, Suppl., 102-122, чачого сироваткового альбуміну. Клітини HUVEC 1995]. Пухлини мишей або ксенотрансплантати інкубували протягом 72год при 37°С у зволожелюдини імплантували за методиками, описаними ному повітрі з 5% СO2. Додавали в лунки агент в першій з вищезгаданих праць Корбетта. Коротпроліферації клітин WST-1 (20мкл; постачальник ко кажучи, пухлину мишей або ксенотрансплан- фірма Boeringer Mannheim, Indianapolis, IN), і тат людини імплантували підшкірно, застосовуюповертали планшети в інкубатор ще на 1год. Вичи або троакар 12-го калібру, або підраховану мірювали поглинання кожної лунки на довжині кількість клітин. Троакар вводили на середині хвилі 440нм. Показник росту визначали з поглипроміжку між пахвовою та пахвинною ділянками нання оброблених лунок у присутності та за відвздовж боку миші. Троакар просували під шкірою сутності VEGF, віднесеного до поглинання контв бік пахви приблизно на 3/4 дюйма (18мм), після рольних лунок, прийнятих за нуль та 1,0. В цих чого виштовхували фрагмент пухлини і після виекспериментах були випробувані зразки сполук далення троакара затискували шкіру. За альтерза винаходом; усі сполуки показали значення нативною методикою, клітини пухлини людини ІС50 1,0мкМ. (1 107), виготовлені з культури клітин, в суміші з Пригнічення росту клітин карциноми товстої таким самим об'ємом препарату Matrigel (Bectonабо ободової кишки НСТ116 Dickinson) імплантували підшкірно в заднє стегно Клітини карциноми товстої або ободової кишсамця або самки голої миші (постачальник ки людини НСТ116 вирощували в моношаровій Charles River). Випробовувані сполуки в носії або культурі в середовищі RPMI 1640 з 10% сироватсам носій вводили шляхом внутрішньовенної ін'єки плоду корови та 1% пеніциліну-стрептоміцину кції болюсу (iv), внутрішньоочеревинної ін'єкції (постачальник - фірма CibcoBRL, Grand Island, (ір) або перорально (ро). Кожна піддослідна груNY). Клітини НСТ116 у фазі експоненціального па, а також група контрольних тварин, що не росту піддавали дії різних концентрацій випробоодержували лікування, складалася з 8-10 тварин вуваних сполук протягом 72год при 37°С у повітрі у кожному експерименті. Реакцію підшкірної пухз 5% СО2. Після оброблення згаданим агентом лини спостерігали шляхом вимірювання об'єму клітини промивали 0,9% сольовим розчином із пухлини двічі на тиждень протягом всього періоду фосфатним буфером. Пригнічення росту визнаексперименту (60-120 днів). Загальним показничали із застосуванням агента проліферації клітин 37 75716 38 ком токсичності була маса тіла тварин. ХарактеТаблиця II ристики підшкірних пухлин аналізували шляхом визначення середньої маси пухлини в кожній підКарцинома товстої або дослідній групі на протязі експерименту і обчисободової кишки людини НТ-29 лення затримки росту пухлини як різниці в кількості днів, необхідної для досягнення об'єму Затримка росту Приклад 64 Доза (мг/кг) пухлини 500мм3 або 1000мм3, для оброблюваних пухлини (дні) та контрольних тварин. Експеримент А Сполуку за Прикладом 64 випробовували, як 30 0+/-2 описано вище, в двох різних лабораторіях на 60 2+/-2 різномантіних пухлинах мишей та людей. Резуль80 2+/-2 тати цих випробувань наведено в Таблиці II. ПаЕксперимент В раметри, вимірювані в кожному експерименті, 30 9+/-4 охарактеризовані нижче. 60 3+/-4 2 Маса пухлини (мг)=(а b) /2. де а - довжина 80 8+/-3,6 пухлини (мм), b - ширина пухлини (мм). Затримка росту пухлини=Т-С. де Τ - середній Після зростання пухлин до стану, при якому час (дні), необхідний для досягнення заданого пухлину можна виявити шляхом пальпації, лікарпопередньо розміру пухлини при обробленні, С ську речовину вводили внутрішньовенно протясередній час (дні), необхідний для досягнення гом 5 послідовних днів, потім тваринам давали такого самого розміру пухлини в контрольній грувідпочити 2 дні і знов вводили лікарську речовину пі. внутрішньовенно протягом 5 послідовних днів. Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюThiopene- and thiazolesulfonamides as antineoplastic agents, pharmaceutical composition based thereon
Автори англійськоюDe Dios Alfonso, Hipskind, Philip, Arthur, Mader Mary Margaret, Shih Chuan
Назва патенту російськоюТиофенсульфамиды и тиазолсульфамиды как противоопухолевые средства, фармацевтическая композиция на их основе
Автори російськоюде Диос Альфонсо, Хипскинд Филип Артур, Лопес Хосе Эдуардо, Мадер Мери Маргарет, Ши Чан
МПК / Мітки
МПК: A61P 35/00, C07D 333/34, C07D 277/36, A61K 31/38, A61K 31/425
Мітки: тіофенсульфаміди, композиція, засоби, тіазолсульфаміди, основі, фармацевтична, протипухлинні
Код посилання
<a href="https://ua.patents.su/19-75716-tiofensulfamidi-ta-tiazolsulfamidi-yak-protipukhlinni-zasobi-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Тіофенсульфаміди та тіазолсульфаміди як протипухлинні засоби, фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб виробництва хонсуриду
Наступний патент: Інспекційний риштак шахтного скребкового конвеєра
Випадковий патент: Спосіб поліхемотерапії раку яєчників