Арилхіназоліни
Номер патенту: 116020
Опубліковано: 25.01.2018
Автори: Емде Ульріх, Медерскі Вернер, Фуксс Томас, Бухшталлер Ханс-Петер
Формула / Реферат
1. Сполука формули (I)
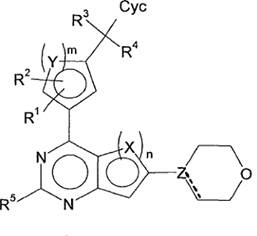 , (I)
, (I)
у якій
X являє собою CH, CF, S або N,
Y являє собою CH, S або N,
Z являє собою C або N,
---- утворює, якщо Z=C, подвійний зв'язок разом із простим зв'язком, відсутній, якщо Z=N,
n дорівнює 1 або 2,
де, якщо n=1, X=S і якщо n=2, обидва X=CH, або X, зв'язаний з піримідиновим кільцем, являє собою CF і X, не зв'язаний з піримідиновим кільцем, являє собою CH, або один X являє собою CH, а інший X являє собою N;
m дорівнює 1 або 2,
де, якщо m=1, Y=S і якщо m=2, обидва Y=CH, або один Y являє собою CH, а інший Y являє собою N;
R1, R2, R3, R4, незалежно один від одного, являють собою H, Hal, CN, OH, CONH2, CONH(LA) або LA;
R5 являє собою H, Hal, CN або C≡CH;
Cyc являє собою феніл, який може бути незаміщений або моно- або дизаміщений, незалежно один від одного, за допомогою R6, або являє собою Het1;
Het1 являє собою моно- або біциклічний 5-10-членний гетероцикл, який має 1-3 атоми N, O та/або S або 1-4 атоми N, який може бути незаміщений або моно-, ди- або тризаміщений, незалежно один від одного, за допомогою R6 або може бути монозаміщений за допомогою Het2;
R6 являє собою Hal, LA, оксо, CN, або NH2;
LA являє собою нерозгалужений або розгалужений алкіл, який має 1-5 атомів C, який може бути насиченим або частково ненасиченим, у якому 1-3 атоми H можуть бути замінені Hal, та/або один атом H може бути замінений CN або Het2, та/або одна або дві CH2-групи можуть бути замінені O, NH, NH2, N(CH3) або CO;
Het2 являє собою 3-5-членний аліфатичний гомо- або гетероцикл, що має 0, 1, 2 або 3 атоми N, O та/або S, який незаміщений;
Hal являє собою F, Cl, Br або I;
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях.
2. Сполука відповідно до пункту 1, яка відповідає формулі (Ib)
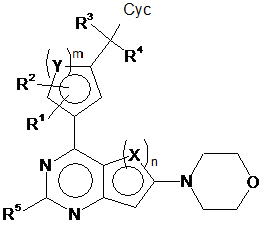 , (Ib)
, (Ib)
у якій усі замісники мають значення, вказані для формули (I),
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
3. Сполука відповідно до пункту 1 або 2, яка відповідає формулі (IІ)
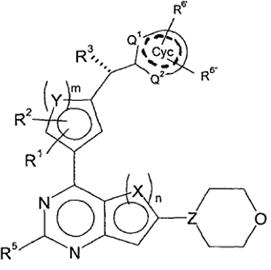 , (II)
, (II)
у якій
R3 являє собою Hal, CN, OH, CONH2, CONH(LA) або LA;
R6', R6'', незалежно один від одного, являють собою H, Hal, LA, оксо, CN, NH2 або Het2;
Q1,Q2, незалежно один від одного, являють собою CH, N або NH і в кожному випадку є незаміщеними;
---- означає присутність або відсутність подвійних зв'язків в Cyc;
і інші замісники мають значення, вказані для формули (I),
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
4. Сполука відповідно до пункту 1 або 2, яка відповідає формулі (IІІ)
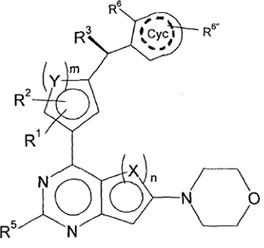 , (III)
, (III)
у якій
R3 являє собою Hal, CN, OH, CONH2, CONH(LA) або LA;
R6 являє собою Hal, LA, оксо, CN, NH2 або Het2;
R6'' являє собою H, Hal, LA, оксо, CN, NH2 або Het2;
---- означає присутність або відсутність подвійних зв'язків в Cyc;
і інші замісники мають значення, вказані для формули (I),
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
5. Сполука відповідно до пункту 3, яка відповідає формулі (IІa)
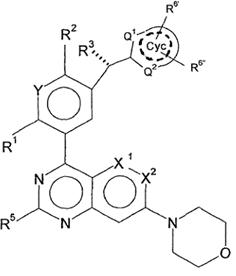 , (IIa)
, (IIa)
у якій
R2, R3, незалежно один від одного, являють собою Hal, CN, OH, CONH2, CON(LA) або LA;
R6',R6'', незалежно один від одного, являють собою H, Hal, LA, оксо, CN, NH2 або Het2;
Q1,Q2, незалежно один від одного, являють собою CH, N або NH і в кожному випадку є незаміщеними;
X1 являє собою CH, CF або N;
X2 являє собою CH або N, де X1, X2 одночасно не являють собою N;
Y являє собою CH або N;
---- означає присутність або відсутність подвійних зв'язків в Cyc;
і інші замісники мають значення, вказані для формули (I),
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
6. Сполука відповідно до пункту 3, яка відповідає формулі (IІb)
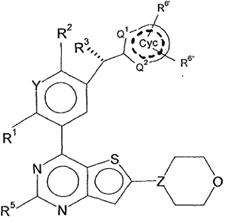 , (IIb)
, (IIb)
у якій
R2, R3, незалежно один від одного, являють собою Hal, CN, OH, CONH2, CON(LA) або LA;
R6', R6'', незалежно один від одного, являють собою H, Hal, LA, оксо, CN, NH2 або Het2;
Q1,Q2, незалежно один від одного, являють собою CH, N або NH і в кожному випадку є незаміщеними;
Y являє собою CH або N,
---- означає присутність або відсутність подвійних зв'язків в Cyc;
і всі інші замісники мають значення, вказані для формули (I),
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
7. Сполука відповідно до пункту 4, яка відповідає формулі (IІІa)
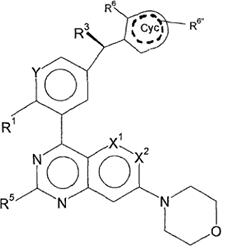 , (IIIa)
, (IIIa)
у якій
R3 являє собою Hal, CN, OH, CONH2, CON(LA) або LA;
R6 являє собою Hal, LA, оксо, CN, NH2 або Het2;
R6'' являє собою H, Hal, LA, оксо, CN, NH2 або Het2;
X1 являє собою CH, CF або N;
X2 являє собою CH або N, де X1, X2 одночасно не являють собою N;
Y являє собою CH або N;
---- означає присутність або відсутність подвійних зв'язків в Cyc;
і інші замісники мають значення, вказані для формули (I),
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
8. Сполука відповідно до пункту 4, яка відповідає формулі (IІІb)
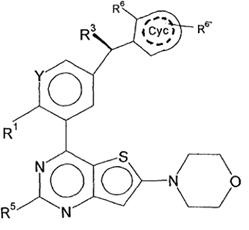 , (IIIb)
, (IIIb)
у якій
R3 являє собою Hal, CN, OH, CONH2, CON(LA) або LA;
R6 являє собою Hal, LA, оксо, CN, NH2 або Het2;
R6'' являє собою H, Hal, LA, оксо, CN, NH2 або Het2;
Y являє собою CH або N,
---- означає присутність або відсутність подвійних зв'язків в Cyc;
і всі інші замісники мають значення, вказані для формули (I),
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
9. Сполука відповідно до пункту 5, у якій радикали, не позначені більш докладно, мають значення, вказані для формули (IІa), але в яких
у випадку підформули (IІa-А)
X1 являє собою CH,
R1 являє собою F або Cl,
R2 являє собою F або Cl,
у випадку підформули (IІa-B)
R1 являє собою F,
R2 являє собою F або Cl,
у випадку підформули (IІa-C)
X1, X2 являє собою CH,
у випадку підформули (IІa-D)
X1 являє собою CH,
R5 являє собою H,
у випадку підформули (IІa-E)
R3 являє собою H, OH,
у випадку підформули (IІa-F)
X1 являє собою CH,
R3 являє собою OH,
у випадку підформули (IІa-G)
X1 являє собою CH,
Y являє собою CH,
у випадку підформули (IІa-H)
X1 являє собою CH,
Cyc являє собою піридин, піразин або піридазин, або піразоло[1,5-a]піримідиніл, або імідазо[1,2-b]піридазиніл,
у випадку підформули (IІa-J)
Cyc являє собою піридин, піразин, піридазин, піразоло[1,5-a]піримідиніл, імідазо[1,2-b]піридазиніл, фуро[2,3-c]піридиніл, фуро[2,3-d]піридазиніл, тієно[2,3-d]піридазиніл, тієно[2,3-d]піримідиніл або імідазо[4,5-c]піридиніл, кожний з яких може бути незаміщений або може бути моно- або дизаміщений за допомогою метокси, метилу, оксо, Cl або CHF2O,
у випадку підформули (IІa-K)
R1 являє собою F або Cl,
R2 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
X1, X2 являє собою CH,
у випадку підформули (IІa-L)
R1 являє собою F,
R2 являє собою F або Cl,
R3 являє собою H або OH,
R5 являє собою H,
у випадку підформули (IІa-M)
R1 являє собою F або Cl,
R2 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
X1, X2 являє собою CH,
Cyc являє собою піридин, піразин або піридазин, або піразоло[1,5-a]піримідиніл, або імідазо[1,2-b]піридазиніл,
у випадку підформули (IІa-N)
R1 являє собою F,
R2 являє собою F або Cl,
R3 являє собою H або OH,
R5 являє собою H,
Cyc являє собою піридин, піразин, піридазин, піразоло[1,5-a]піримідиніл, імідазо[1,2-b]піридазиніл, фуро[2,3-c]піридиніл, фуро[2,3-d]піридазиніл, тієно[2,3-d]піридазиніл, тієно[2,3-d]піримідиніл або імідазо[4,5-c]піридиніл, кожний з яких може бути незаміщений або може бути моно- або дизаміщений за допомогою метокси, метилу, оксо, Cl або CHF2O,
у випадку підформули (IІa-O)
R1 являє собою F,
R2 являє собою F або Cl,
R3 являє собою H або OH,
R5 являє собою H,
Cyc являє собою 5-метоксипіридазин-3-іл, імідазо[1,2-b]піридазин-6-іл, 3-хлор-6-метоксипіразин-2-іл, 3-хлорпіразин-2-іл, піридазин-4-іл, 3-метоксипіразин-2-іл, 6-метоксипіридазин-3-іл, 3-дифторметоксипіридин-2-іл, 3-метилпіразин-2-іл, тієно[2,3-d]піримідин-4-іл, 1-метил-1H-піридин-2-он-6-іл, 1H-піридазин-6-он-3-іл, фуро[2,3-d]піридазин-7-іл, тієно[2,3-d]піридазин-7-іл, 3,5-диметилпіразин-2-іл, фуро[2,3-d]піримідин-4-іл, 3-метил-3H-імідазо[4,5-c]піридин-4-іл,
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
10. Сполука відповідно до пункту 7, у якій радикали, не позначені більш докладно, мають значення, вказані для формули (IІІa), але в яких
у випадку підформули (IІІa-B)
R1 являє собою F,
у випадку підформули (IІІa-C)
X1, X2 являє собою CH,
у випадку підформули (IІІa-D)
X1 являє собою CH,
R5 являє собою H,
у випадку підформули (IIIa-E)
R3 являє собою H, OH,
у випадку підформули (IІІa-F)
X1 являє собою CH,
R3 являє собою OH,
у випадку підформули (IІІa-G)
X1 являє собою CH,
Y являє собою CH,
у випадку підформули (IІІa-H)
X1 являє собою CH,
Cyc являє собою піридин, піразин або піридазин, або піразоло[1,5-a]піримідиніл, або імідазо[1,2-b]піридазиніл,
у випадку підформули (IІІa-J)
Cyc являє собою піридин, піразин, піридазин, піразоло[1,5-a]піримідиніл, імідазо[1,2-b]піридазиніл, фуро[2,3-c]піридиніл, фуро[2,3-d]піридазиніл, тієно[2,3-d]піридазиніл, тієно[2,3-d]піримідиніл або імідазо[4,5-c]піридиніл, кожний з яких може бути незаміщений або може бути моно- або дизаміщений за допомогою метокси, метилу, оксо, Cl або CHF2O,
у випадку підформули (IІІa-K)
R1 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
X1, X2 являє собою CH,
у випадку підформули (IІІa-L)
R1 являє собою F,
R3 являє собою H або OH,
R5 являє собою H,
у випадку підформули (IІІa-M)
R1 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
X1, X2 являє собою CH,
Cyc являє собою піридин, піразин або піридазин, або піразоло[1,5-a]піримідиніл, або імідазо[1,2-b]піридазиніл,
у випадку підформули (IІІa-N)
R1 являє собою F,
R3 являє собою H або OH,
R5 являє собою H,
Cyc являє собою піридин, піразин, піридазин, піразоло[1,5-a]піримідиніл, імідазо[1,2-b]піридазиніл, фуро[2,3-c]піридиніл, фуро[2,3-d]піридазиніл, тієно[2,3-d]піридазиніл, тієно[2,3-d]піримідиніл або імідазо[4,5-c]піридиніл, кожний з яких може бути незаміщений або може бути моно- або дизаміщений за допомогою метокси, метилу, оксо, Cl або CHF2O,
у випадку підформули (IІІa-O)
R1 являє собою F,
R3 являє собою H або OH,
R5 являє собою H,
Cyc являє собою 5-метоксипіридазин-3-іл, імідазо[1,2-b]піридазин-6-іл, 3-хлор-6-метоксипіразин-2-іл, 3-хлорпіразин-2-іл, піридазин-4-іл, 3-метоксипіразин-2-іл, 6-метоксипіридазин-3-іл, 3-дифторметоксипіридин-2-іл, 3-метилпіразин-2-іл, тієно[2,3-d]піримідин-4-іл, 1-метил-1H-піридин-2-он-6-іл, 1H-піридазин-6-он-3-іл, фуро[2,3-d]піридазин-7-іл, тієно[2,3-d]піридазин-7-іл, 3,5-диметилпіразин-2-іл, фуро[2,3-d]піримідин-4-іл, 3-метил-3H-імідазо[4,5-c]піридин-4-іл,
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
11. Сполука відповідно до пункту 6, у якій радикали, не позначені більш докладно, мають значення, вказані для формул (IІb), але в яких
у випадку підформули (IІb-Q)
R1 являє собою F або Cl,
R2 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
Y являє собою CH,
у випадку підформули (IІb-R)
R1 являє собою F,
R2 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
Y являє собою CH,
у випадку підформули (IІb-S)
Cyc являє собою піридин, піразин або піридазин,
у випадку підформули (IІb-T)
R1 являє собою F або Cl,
R2 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
Cyc являє собою піридин, піразин або піридазин,
у випадку підформули (IІb-U)
R1 являє собою F,
R2 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
Cyc являє собою піридин, піразин, піридазин або 3-метилпіразин-2-іл,
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
12. Сполука відповідно до пункту 8, у якій радикали, не позначені більш докладно, мають значення, вказані для формул (IІІb), але в яких
у випадку підформули (IІІb-Q)
R1 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
Y являє собою CH,
у випадку підформули (IІІb-R)
R1 являє собою F,
R3 являє собою OH,
R5 являє собою H,
Y являє собою CH,
у випадку підформули (IІІb-S)
Cyc являє собою піридин, піразин або піридазин,
у випадку підформули (IІІb-T)
R1 являє собою F або Cl,
R3 являє собою OH,
R5 являє собою H,
Cyc являє собою піридин, піразин або піридазин,
у випадку підформули (IІІb-U)
R1 являє собою F,
R3 являє собою OH,
R5 являє собою H,
Cyc являє собою піридин, піразин, піридазин або 3-метилпіразин-2-іл,
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери,
включаючи їх суміші у всіх співвідношеннях.
13. Сполука відповідно до одного з пунктів 1-12, вибрана із групи:
[2-хлор-4-фтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]-(5-метоксипіридазин-3-іл)метанол,
[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]-(5-метоксипіридазин-3-іл)метанол,
[2,4-дифтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]імідазо[1,2-b]піридазин-6-ілметанол,
(3-хлор-6-метоксипіразин-2-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]метанол,
(R)-(3-хлорпіразин-2-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]метанол,
[2-хлор-4-фтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]піридазин-4-ілметанол,
[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метоксипіразин-2-іл)метанол,
[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]-(6-метоксипіридазин-3-іл)метанол,
(3-дифторметоксипіридин-2-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]метанол,
(R)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метилпіразин-2-іл)метанол,
[2,4-дифтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метилпіразин-2-іл)метанол,
[2,4-дифтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]тієно[2,3-d]піримідин-4-ілметанол,
6-{[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]гідроксиметил}-1-метил-1H-піридин-2-он,
3-[[2-хлор-4-фтор-5-(7-морфолінoхіназолін-4-іл)феніл]гідроксиметил]-1H-піридазин-6-он,
(S)-[2-хлор-4-фтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]-(6-метоксипіридазин-3-іл)метанол,
(R)-[4-фтор-3-(7-морфолін-4-ілпіридо[3,2-d]піримідин-4-іл)феніл]-(3-метилпіразин-2-іл)метанол,
4-(4-хлор-2-фтор-5-імідазо[1,2-b]піридазин-6-ілметилфеніл)-7-морфолін-4-ілхіназолін,
[4-фтор-3-(6-морфолін-4-ілтієно[3,2-d]піримідин-4-іл)феніл]-(3-метилпіразин-2-іл)метанол,
(R)-[4-фтор-3-(5-фтор-7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метилпіразин-2-іл)метанол,
[2-хлор-4-фтор-5-(5-фтор-7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метоксипіразин-2-іл)метанол,
[4-фтор-3-(5-фтор-7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метоксипіразин-2-іл)метанол,
[4-фтор-3-(5-фтор-7-морфолін-4-ілхіназолін-4-іл)феніл]-(6-метоксипіридазин-3-іл)метанол,
[4-фтор-3-[7-(2,2,3,3,5,5,6,6-октадейтеріоморфолін-4-іл)хіназолін-4-іл]феніл]-(3-метилпіразин-2-іл)метанол,
[4-фтор-3-(5-фтор-7-морфолін-4-ілхіназолін-4-іл)феніл]-(6-метоксипіридазин-3-іл)метанол,
[2-хлор-4-фтор-5-[7-(2,2,3,3,5,5,6,6-октадейтеріоморфолін-4-іл)хіназолін-4-іл]феніл]-(6-метоксипіридазин-3-іл)метанол,
[2-хлор-4-фтор-5-(6-морфолін-4-ілтієно[3,2-d]піримідин-4-іл)феніл]-(3-метилпіразин-2-іл)метанол,
[4-фтор-3-(6-морфолін-4-ілтієно[3,2-d]піримідин-4-іл)феніл]-(3-метилпіразин-2-іл)метанол,
[2-хлор-4-фтор-5-(5-фтор-7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метоксипіразин-2-іл)метанол,
[4-хлор-3-(5-фтор-7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метоксипіразин-2-іл)метанол,
[4-хлор-3-(5-фтор-7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метилпіразин-2-іл)метанол,
[2-хлор-4-фтор-5-(5-фтор-7-морфолін-4-ілхіназолін-4-іл)феніл]-(6-метоксипіридазин-3-іл)метанол,
[4-хлор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]фуро[2,3-d]піридазин-7-ілметанол,
[2,4-дифтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]фуро[2,3-d]піридазин-7-ілметанол,
[2,4-дифтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]тієно[2,3-d]піридазин-7-ілметанол,
(3,5-диметилпіразин-2-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]метанол,
6-{[2-хлор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]гідроксиметил}-1-метил-1H-піридин-2-он,
6-{[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]гідроксиметил}-2H-піридазин-3-он,
6-{[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]гідроксиметил}-1-метил-1H-піридин-2-он,
6-{[2-хлор-4-фтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]гідроксиметил}-1-метил-1H-піридин-2-он,
[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]фуро[2,3-d]піримідин-4-ілметанол,
[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]фуро[3,2-d]піримідин-4-ілметанол,
[2,4-дифтор-5-(7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метоксипіразин-2-іл)метанол,
[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]-(3-метил-3H-імідазо[4,5-c]піридин-4-іл)метанол,
[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]фуро[3,2-d]піримідин-4-ілметанол,
та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях.
14. Спосіб одержання сполуки формули (I) відповідно до пункту 1 та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, що включає наступні стадії:
(a) взаємодію сполуки формули (V)
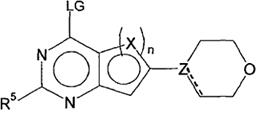 , (V)
, (V)
у якій LG являє собою загальноприйняту відхідну групу, таку як Hal,
зі сполукою формули (IV)
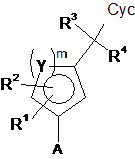 , (IV)
, (IV)
у якій A являє собою боронову кислоту або складний ефір боронової кислоти,
одержуючи сполуки формули (I), і необов'язково
(б) перетворення основи або кислоти сполуки формули (I) в одну з її солей.
15. Застосування принаймні однієї сполуки відповідно до одного з пунктів 1-13 та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, для приготування лікарського засобу для сенсибілізації злоякісних клітин до протиракових засобів та/або іонізуючого випромінювання.
16. Застосування принаймні однієї сполуки відповідно до одного з пунктів 1-13 та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, для приготування лікарського засобу для профілактики та/або терапії злоякісного новоутворення, пухлин або метастазів у комбінації із променевою терапією та/або із принаймні одним протираковим засобом.
17. Лікарський засіб, що містить принаймні одну сполуку відповідно до одного з пунктів 1-13 та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях.
18. Фармацевтична композиція, що містить, як активну сполуку, ефективну кількість принаймні однієї сполуки відповідно до одного з пунктів 1-13 та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, разом з фармацевтично припустимими ад'ювантами.
19. Фармацевтична композиція, що містить, як активну сполуку, ефективну кількість принаймні однієї сполуки відповідно до одного з пунктів 1-13 та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, разом з фармацевтично припустимими ад'ювантами в комбінації з ефективною кількістю принаймні одного протиракового засобу.
20. Набір, що містить окремі упакування (a) ефективної кількості принаймні однієї сполуки відповідно до одного з пунктів 1-13 та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, і (б) ефективної кількості принаймні одного протиракового засобу.
Текст
Реферат: Винахід стосується нових сполук формули (I) (72) Винахідник(и): Фуксс Томас (DE), Емде Ульріх (DE), Бухшталлер Ханс-Петер (DE), Медерскі Вернер (DE) (73) Власник(и): МЕРК ПАТЕНТ ГМБХ, Frankfurter Strasse 250, 64293 Darmstadt, Germany (DE) (74) Представник: Петров Андрій Володимирович, реєстр. №139 (56) Перелік документів, взятих до уваги експертизою: WO 2011/113512 A1, 22.09.2011 UA 116020 C2 МІНІСТЕРСТВО ЕКОНОМІЧНОГО РОЗВИТКУ І ТОРГІВЛІ УКРАЇНИ UA 116020 C2 , (I) які можна застосовувати для інгібування серин-треонін протеїнкіназ і для сенсибілізації злоякісних клітин до протиракових засобів та/або іонізуючого випромінювання. UA 116020 C2 Винахід стосується сполук формули (I) 5 10 15 20 25 30 35 40 45 у якій X представляє собою CH, CF, S або N, Y представляє собою CH, S або N, Z представляє собою C або N, ---- утворює, якщо Z=C, подвійний зв'язок разом із простим зв'язком, відсутній, якщо Z=N, n дорівнює 1 або 2, де якщо n=1, X=S, і якщо n=2, обидва X=CH, або X, зв'язаний з піримідиновим кільцем, представляє собою CF і X, незв'язаний з піримідиновим кільцем, представляє собою CH, або один X представляє собою CH, а інший X представляє собою N; m дорівнює 1 або 2, де якщо m=1, Y=S, і якщо m=2, обидва Y=CH, або один Y представляє собою CH, а інший Y представляє собою N; 1 2 3 4 R , R , R , R , незалежно один від одного, представляють собою H, Hal, CN, OH, CONH 2, CONH(LA) або LA; 5 R представляє собою H, Hal, CN або C≡CH; Cyc представляє собою феніл, який може бути незаміщений або моно- або дизаміщений, 6 1 незалежно один від одного, за допомогою R , або представляє собою Het ; 1 Het представляє собою моно- або біциклічний, 5-10-членний гетероцикл, який має 1-3 атоми N, O та/або S, або 1-4 атоми N, який може бути незаміщений або моно-, ди- або 6 тризаміщений, незалежно один від одного, за допомогою R , або може бути монозаміщений за 2 допомогою Het ; 6 R представляє собою Hal, LA, оксо, CN, або NH2; LA представляє собою нерозгалужений або розгалужений алкіл, який має 1-5 атомів C, який може бути насиченим або частково ненасиченим, у якому 1-3 атоми H можуть бути замінені Hal, 2 та/або один атом H може бути замінений CN або Het , та/або одна або дві CH2 групи можуть бути замінені O, NH, NH2, N(CH3) або CO; 2 Het представляє собою 3-5-членний аліфатичний гомо- або гетероцикл, що має 0, 1, 2 або 3 атоми N, O та/або S, який незаміщений; Hal представляє собою F, Cl, Br або I; та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. Сполуки формули (I) можна використовувати для інгібування серин/треонін протеїнкіназ і для сенсибілізації злоякісних клітин до протиракових засобів та/або іонізуючого випромінювання. Винахід також стосується застосування сполук формули (I) для профілактики, терапії або контролю прогресування злоякісного новоутворення, пухлин або метастаз, у комбінації із променевою терапією та/або протираковим засобом. Крім того, винахід стосується способу одержання сполук формули (I) шляхом взаємодії сполук формул (IV) і (V) і необов'язково перетворення основи або кислоти сполук формули (I) у її сіль. ДНК-залежна протеїнкіназа (ДНК-ПК) представляє собою серин/треонін протеїнкіназу, яка активується в комплексі із ДНК. Біохімічні й генетичні дані свідчать про те, що ДНК-ПК складається з (a) каталітичної субодиниці, яка називається ДНК-ПКкс, і (б) двох регуляторних 1 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 компонентів (Ku70 і Ku80). За функціональними показниками, ДНК-ПК є надзвичайно важливою складовою, з одного боку, репарації дволанцюгових розривів ДНК (ДЛР), а з іншого сторони, соматичної або V(D)J рекомбінації. Додатково, ДНК-ПК і її компоненти зв'язані з різноманітними іншими фізіологічними процесами, включаючи модуляцію структури хроматину й підтримку теломер (Smith & Jackson (1999) Genes і Dev 13: 916; Goytisolo і ін. (2001) Mol. Cell. Biol. 21: 3642; Williams і ін. (2009) Cancer Res. 69: 2100). Генетичний матеріал людини у формі ДНК постійно піддається атакам активних форм кисню (АФК), які утворюються головним чином як побічні продукти окисного метаболізму. АФК здатні викликати ушкодження ДНК у формі одноланцюгових розривів. Дволанцюгові розриви можуть виникати, якщо попередні одноланцюгові розриви відбуваються в безпосередній близькості. Додатково, одно- і дволанцюгові розриви можуть виникати, якщо ДНК реплікативна виделка натрапляє на ушкоджені структури основ. Крім того, екзогенні впливи, такі як іонізуюче випромінювання (наприклад, гама або корпускулярне випромінювання), і певні протиракові лікарські засоби (наприклад, блеоміцин) здатні викликати дволанцюгові розриви ДНК. ДЛР, крім того, можуть зустрічатися як проміжні продукти соматичної рекомбінації, процесу, який є важливим для утворення функціональної імунної системи всіх хребетних. Якщо дволанцюгові розриви ДНК не репаровані або репаровані неправильно, то можуть зустрічатися мутації та/або хромосомні аберації, які в результаті можуть привести до клітинної загибелі. Для протидії важким ушкодженням, що виникають внаслідок дволанцюгових розривів ДНК, еукаріотичні клітини розробили різні механізми для їх репарації. Вищі еукаріоти використовують головним чином так зване негомологічне з'єднання кінців, у якому ключову роль виконує ДНК-залежна протеїнкіназа. У біохімічних дослідженнях було показано, що ДНК-ПК найбільш ефективно активується за допомогою випадків ДНК-ДЛР. Клітинні лінії, у яких ДНК-ПК компоненти були мутовані і є нефункціональними, виявляються чутливими до дії радіації (Smith і Jackson, 1999). Завдяки її каталітичному домену, який знаходиться на C-кінцевій каталітичній субодиниці (ДНК-ПКкс), яка складається із приблизно 500 амінокислот, ДНК-ПК належить сімейства фосфатидилінозитол-3-кіназа-споріднених кіназ (PIKK), де ДНК-ПК представляє собою неліпідну кіназу (Hartley і ін. (1995) Cell 82: 849; Smith & Jackson (1999) Genes і Dev 13: 916; Lempiäinen & Halazonetis (2009) EMBO J. 28: 3067). Izzard і ін. ((1999) Cancer Res. 59: 2581) було показано, що інгібітор PI3 кінази LY294002 інгібує функцію ДНК-ПК в експериментах in-vitro. IC50 значення (концентрація, при якій активність ферменту інгібується на 50 %) становить при відносній неефективності 1,25 мкM (5,0 мM АТФ). Незважаючи на наявність даних, що свідчать про те, що інгібітор LY294002 надає можливість клітинам ссавців ставати чутливими до випромінювання, тобто цитотоксичність іонізуючого випромінювання підвищується, у принципі для передбачуваного застосування при променевій терапії, наприклад, сόлідних ракових пухлин, було показано тільки слабке підвищення чутливості до іонізуючого випромінювання для LY294002 на клітинах (Rosenzweig і ін. (1999) Clin. Cancer Res. 3: 1149). Kudos Pharmaceuticals Ltd. оптимізовані лідерну структуру LY294002 і представили різні ДНК-ПК інгібітори. Інтродукція дибензотіофенільної групи привела до інгібітору NU-7441, АФТ-конкуруючої сполуки, що має IC50 значення 20,0 нM (Hardcastle і ін. (2005) J. Med. Chem. 48: 7829). KU-0060648 комбінує інгібуючі властивості по відношенню до ДНК-ПК із поліпшеним профілем розчинності у водному середовищі, але кінази сімейства ізоферменту PI3K, більше того, потенційно інгібуються за допомогою KU-0060648. Отже, потреба в ефективному й селективному ДНК-ПК інгібіторі, що існує протягом тривалого часу, не задоволена дотепер. Винахід ґрунтується на задачі подолання недоліків, вказаних у відомому рівні техніки, і розробки ефективних інгібіторів ДНК-ПК, які є селективними по відношенню до родинних кіназ сімейства PIKK і мають низьку молекулярну вагу й, особливо, надають можливість ефективного застосування для лікування злоякісного новоутворення як радіо- і хемосенсибілізатори – з метою поліпшення терапевтичної ефективності з одночасним зменшенням побічних дій. Задача винаходу вирішується відповідно до незалежних пунктів формули винаходу. Залежні пункти містять переважні варіанти здійснення. Відповідно до винаходу, забезпечуються сполуки формули (I). Несподівано, було виявлено, що сполуки відповідно до винаходу забезпечуються з інгібуючими властивостями для серин/треонін протеїнкіназ. Сполуки формули (I) створювалися таким чином, щоб відбувалося ефективне й селективне інгібування ДНК-ПК. Таким чином, сполуки відповідно до винаходу відкривають зовсім нові можливості по відношенню до антиканцерогенної дії протиракових засобів. Сполуки формули (I) виконують терапевтичну роль у даному винаході як радіо- і хемосенсибілізатори за допомогою специфічного інгібування репарації дволанцюгових розривів ДНК (негомологічне з'єднання кінців) для лікування 2 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 злоякісного новоутворення. Дотепер, з WO 1992/07844 було відомо, що похідні 2,4-діамінохіназоліну є підсилювачами хіміотерапевтичних засобів для лікування злоякісного новоутворення. Похідні націлені на множинну стійкість пухлинних клітин внаслідок понадекспресії гена mdr1, генний продукт якого ефлюксної P глікопротеїнової помпи підтримує внутрішньоклітинну концентрацію активної сполуки низькою. Не були відомі ні фізико-хімічні або фармакологічні описані дані, ні препарат, що поставляється на ринок. Інші похідні хіназоліну як ДНК-ПК інгібітори описані в WO 2011/113512. Даний винахід забезпечує нову генерацію ДНК-ПК інгібіторів, які не тільки здатні специфічно інгібувати, що проявляється, особливо, у випадку клітинних аналізів. Додатково, вони також відрізняються відсутністю небажаного інгібування іонних каналів серця, що часто спостерігається, особливо Kv1.11 hERG, блокада яких може приводити до небезпечних для життя аритмій. Отже, сполуки відповідно до винаходу і їх солі мають цінні фармакологічні властивості, при цьому добре переносяться. Для цілей даного винаходу, сполуки формули (I) визначаються таким чином, що під ними також розуміють фармацевтично прийнятні похідні, солі, сольвати, сольвати солей, попередники сполук, таутомери й оптично активні форми (такі як, наприклад, стереоізомери, діастереомери, енантіомери, рацемати). Під сольватами сполук розуміють аддукцію молекул інертного розчинника на сполуках, які утворюються завдяки їх взаємним силам притягання. Сольвати представляють собою, наприклад, моно- або дигідрати або алкоголяти. Під фармацевтично прийнятними похідними розуміють, наприклад, солі сполук відповідно до винаходу й так звані попередники сполук. Під попередниками розуміють, наприклад, сполуки формули (I), модифіковані за допомогою алкільних або ацильних груп, цукрів або олігопептидів, які швидко розщеплюються в організмі з утворенням ефективних сполук відповідно до винаходу. Вони також включають похідні біорозкладних полімерів сполук відповідно до винаходу, як описано, наприклад, в Int. J. Pharm. 115, 61-67 (1995). Будь-яка сполука, яка може бути перетворена in vivo у біоактивний засіб, тобто сполуки формули (I), представляє собою попередник у контексті даного винаходу. Будь-яка біологічно активна сполука, яка виникає при метаболізації in-vivo сполуки відповідно до винаходу, представляє собою метаболіт у контексті даного винаходу. Сполуки формули (I) можуть мати один або декілька хіральних центрів, і, отже, зустрічатися в різних стереоізомерних формах. Формула (I) охоплює всі ці форми. Винахід також стосується застосування сумішей сполук формули (I), наприклад, сумішей двох діастереомерів, наприклад, у співвідношенні 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 або 1:1000. Особливо переважними в даній заявці є суміші стереоізомерних сполук. 1 2 3 4 5 6 1 2 Вище й нижче, радикали X, Y, R , R , R , R , R , R , LA, Cyc, Het , Het і Hal, а також m і n, мають значення, вказані для формули (I), якщо спеціально не вказано інакше. Якщо індивідуальні радикали зустрічаються декілька раз у сполуці або радикалі, то радикали приймають, незалежно один від одного, вказані значення, якщо спеціально не вказано інакше. Терміни, використовувані в даній заявці для визначення сполук, у цілому ґрунтуються на правилах організації ІЮПАК для хімічних сполук, зокрема, органічних сполук. Терміни для пояснення вищевказаних сполук згідно з винаходом, завжди мають вищевказані значення, якщо спеціально не вказано інакше в описі або пунктах формули. "LA" у контексті винаходу означає насичений або частково ненасичений вуглеводневий радикал, який є нерозгалуженим (лінійним) або розгалуженим і має 1, 2, 3, 4 або 5 атомів C. Прикладами LA є метил, етил, пропіл, ізопропіл, 1,1-, 1,2- або 2,2-диметилпропіл, 1-етилпропіл, бутил, ізобутил, втор-бутил, трет-бутил. Проте, вуглеводневий радикал також може бути заміщений таким чином, що 1-3 атоми H можуть бути замінені Hal, та/або один атом H може 2 бути замінений CN або Het , та/або одна або дві CH2 групи можуть бути замінені O, NH, N(CH3) або CO. Їх прикладами є метокси, метилсульфаніл, етокси, ціанометокси, 2-пропіонітрилокси, оксетан-3-ілокси, N-метиламінокарбоніл, карбоксамідо, 2-метоксіетокси, 2,2,2-трифторетокси, або 2-гідроксіетокси. 1" "Het у контексті винаходу означає моно- або біциклічний аліфатичний або ароматичний вуглеводневий гетероцикл, що має 3, 4, 5, 6, 7, 8, 9 або 10 атомів C і 0, 1, 2 або 3 атоми N, O та/або S, які можуть бути заміщені. Прикладами підходящих "Cyc" є феніл, піридин, піразин, піридазин, піразоло[1,5-a]піримідиніл, або імідазо[1,2-b]піридазиніл. 2 "Het " у контексті винаходу означає 3-5-членний аліфатичний гомо- або гетероцикл, що має 2 0, 1, 2 або 3 атомів N, O або S. Прикладами Het є оксетан, піролідин або циклопропіл. У переважному варіанті здійснення даного винаходу, забезпечуються похідні арилхіназоліну формули (Ia) 3 UA 116020 C2 5 10 15 20 25 30 у якій X, Y, незалежно один від одного, представляють собою CH, S або N, Z представляє собою C або N, ---- утворює, якщо Z=C, подвійний зв'язок разом із простим зв'язком, відсутній, якщо Z=N, n дорівнює 1 або 2, де якщо n=1, X=S, і якщо n=2, обидва X=CH, або X, зв'язаний з піримідиновим кільцем, представляє собою CH і X, незв'язаний з піримідиновим кільцем, представляє собою N; m дорівнює 1 або 2, де якщо m=1, Y=S, і якщо m=2, обидва Y=CH, або один Y представляє собою CH, а інший Y представляє собою N; 1 2 3 4 R , R , R , R , незалежно один від одного, представляють собою H, Hal, CN, OH, CONH 2 або LA; 5 R представляє собою H, Hal, CN або C≡CH; Cyc представляє собою феніл, який може бути незаміщений або моно- або дизаміщений, 6 1 незалежно один від одного, за допомогою R , або Het ; 1 Het представляє собою моно- або біциклічний, 5-10-членний гетероцикл, який має 1-3 атоми N, O та/або S, який може бути незаміщений або моно- або дизаміщений, незалежно один 6 від одного, за допомогою R ; 6 2 R представляє собою Hal, LA, оксо, CN, NH2 або Het ; LA представляє собою нерозгалужений або розгалужений алкіл, який має 1-5 атомів C, який може бути насиченим або частково ненасиченим, у якому 1-3 атоми H можуть бути замінені Hal, 2 та/або один атом H може бути замінений CN або Het , та/або одна або дві CH2 групи можуть бути замінені O, NH, NH2, N(CH3) або CO; 2 Het представляє собою 3-5-членний аліфатичний гомо- або гетероцикл, що має 0, 1, 2 або 3 атоми N, O та/або S, який незаміщений; Hal представляє собою F, Cl, Br або I; Крім того, переважні похідні арилхіназоліну відповідають формулі (Ib) 3 Cyc R m Y 2 4 R R 1 R X N n N 5 R O N 4 UA 116020 C2 5 10 15 20 25 (Ib) у якій усі замісники мають значення, вказані для формул (I) або (Ia), та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. В подальшому переважному варіанті здійснення даного винаходу, забезпечуються похідні арилхіназоліну формули (IІ) у якій 3 R представляє собою Hal, CN, OH, CONH2, CONH(LA) або LA; 6" 6‘‘ 2 R ,R , незалежно один від одного, представляють собою H, Hal, LA, оксо, CN, NH 2 або Het ; 1 2 Q ,Q , незалежно один від одного, представляють собою CH, N або NH і в кожному випадку є незаміщеними; ---- означає присутність або відсутність подвійних зв'язків в Cyc; і інші замісники мають значення, вказані для формули (I), та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. А саме, було виявлено, що активність сполук відповідно до винаходу є особливо високою, 3 якщо R має конфігурацію, зображену у формулі (IІ), і Q не несе замісників. В подальшому переважному варіанті здійснення даного винаходу, забезпечуються похідні арилхіназоліну формули (IІІ) у якій 3 R представляє собою Hal, CN, OH, CONH2, CONH(LA) або LA; 6 2 R представляє собою Hal, LA, оксо, CN, NH2 або Het ; 6‘‘ 2 R представляє собою H, Hal, LA, оксо, CN, NH2 або Het ; ---- означає присутність або відсутність подвійних зв'язків в Cyc; 5 UA 116020 C2 5 і інші замісники мають значення, вказані для формули (I), та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. А саме, було виявлено, що активність сполук відповідно до винаходу є особливо високої, 3 якщо R має конфігурацію, зображену у формулі (IІІ) і Cyc заміщений в орто-положенні за 6 допомогою R . Надзвичайно переважними є підформули (IІa), (IІb), (IІІa) і (IІІb) формул (IІ) і (IІІ): у якій 2 3 R , R , незалежно один від одного, представляють собою Hal, CN, OH, CONH2, CON(LA) або 10 LA; 15 20 6" 6‘‘ 2 R ,R , незалежно один від одного, представляють собою H, Hal, LA, оксо, CN, NH 2 або Het ; 1 2 Q ,Q , незалежно один від одного, представляють собою CH, N або NH і в кожному випадку є незаміщеними; 1 X представляє собою CH, CF або N; 2 1 2 X представляє собою CH або N, де X , X одночасно не представляють собою N; Y представляє собою CH або N; ---- означає присутність або відсутність подвійних зв'язків в Cyc; і інші замісники мають значення, вказані для формули (I), та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях; (IІb) у якій 2 3 R , R , незалежно один від одного, представляють собою Hal, CN, OH, CONH 2, CON(LA) або 25 LA; 6 UA 116020 C2 6" 5 10 15 20 25 6‘‘ 2 R ,R , незалежно один від одного, представляють собою H, Hal, LA, оксо, CN, NH2 або Het ; 1 2 Q ,Q , незалежно один від одного, представляють собою CH, N або NH і в кожному випадку є незаміщеними; Y представляє собою CH або N, ---- означає присутність або відсутність подвійних зв'язків в Cyc; і всі інші замісники мають значення, вказані для формули (I), та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях; у якій 3 R представляє собою Hal, CN, OH, CONH2, CON(LA) або LA; 6 2 R представляє собою Hal, LA, оксо, CN, NH2 або Het ; 6‘‘ 2 R представляє собою H, Hal, LA, оксо, CN, NH2 або Het ; 1 X представляє собою CH, CF або N; 2 1 2 X представляє собою CH або N, де X , X одночасно не представляють собою N; Y представляє собою CH або N; ---- означає присутність або відсутність подвійних зв'язків в Cyc; і інші замісники мають значення, вказані для формули (I), та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях; у якій 3 R представляє собою Hal, CN, OH, CONH2, CON(LA) або LA; 6 2 R представляє собою Hal, LA, оксо, CN, NH2 або Het ; 6‘‘ 2 R представляє собою H, Hal, LA, оксо, CN, NH2 або Het ; Y представляє собою CH або N, 7 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 ---- означає присутність або відсутність подвійних зв'язків в Cyc; і всі інші замісники мають значення, вказані для формули (I), та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. Крім того, переважні підгрупи сполук формули (IІa) можуть бути виражені наступними підформулами (IІa-А) - (IІa-O), які відповідають формулі (IІa), але в яких у випадку підформули (IІa-А) 1 X представляє собою CH, 1 R представляє собою F або Cl, 2 R представляє собою F або Cl, у випадку підформули (IІa-B) 1 R представляє собою F, 2 R представляє собою F або Cl, у випадку підформули (IІa-C) 1 2 X , X представляє собою CH, у випадку підформули (IІa-D) 1 X представляє собою CH, 5 R представляє собою H, у випадку підформули (IІa-E) 3 R представляє собою H, OH, у випадку підформули (IІa-F) 1 X представляє собою CH, 3 R представляє собою OH, у випадку підформули (IІa-G) 1 X представляє собою CH, Y представляє собою CH, у випадку підформули (IІa-H) 1 X представляє собою CH, Cyc представляє собою піридин, піразин або піридазин, або піразоло[1,5-a]піримідиніл або імідазо[1,2-b]піридазиніл, у випадку підформули (IІa-J) Cyc представляє собою піридин, піразин, піридазин, піразоло[1,5-a]піримідиніл, імідазо[1,2b]піридазиніл, фуро[2,3-c]піридиніл, фуро[2,3-d}піридазиніл, тієно[2,3-d}піридазиніл, тієно[2,3d}піримідиніл або імідазо[4,5-c]піридиніл, кожний з яких може бути незаміщений, або може бути моно- або дизаміщений за допомогою метокси, метилу, оксо, Cl або CHF 2O, у випадку підформули (IІa-K) 1 R представляє собою F або Cl, 2 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, 1 2 X , X представляє собою CH, у випадку підформули (IІa-L) 1 R представляє собою F, 2 R представляє собою F або Cl, 3 R представляє собою H або OH, 5 R представляє собою H, у випадку підформули (IІa-M) 1 R представляє собою F або Cl, 2 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, 1 2 X , X представляє собою CH, Cyc представляє собою піридин, піразин або піридазин, або піразоло[1,5-a]піримідиніл або імідазо[1,2-b]піридазиніл, у випадку підформули (IІa-N) 1 R представляє собою F, 2 R представляє собою F або Cl, 3 R представляє собою H або OH, 5 R представляє собою H, Cyc представляє собою піридин, піразин, піридазин, піразоло[1,5-a]піримідиніл, імідазо[1,2 8 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 b]піридазиніл, фуро[2,3-c]піридиніл, фуро[2,3-d}піридазиніл, тієно[2,3-d}піридазиніл, тієно[2,3d}піримідиніл або імідазо[4,5-c]піридиніл, кожний з яких може бути незаміщений, або може бути моно- або дизаміщений за допомогою метокси, метилу, оксо, Cl або CHF 2O, у випадку підформули (IІa-O) 1 R представляє собою F, 2 R представляє собою F або Cl, 3 R представляє собою H або OH, 5 R представляє собою H, Cyc представляє собою 5-метоксипіридазин-3-іл, імідазо[1,2-b]піридазин-6-іл, 3-хлор-6метоксипіразин-2-іл, 3-хлорпіразин-2-іл, піридазин-4-іл, 3-метоксипіразин-2-іл, 6метоксипіридазин-3-іл, 3-дифторметоксипіридин-2-іл, 3-метилпіразин-2-іл, тієно[2,3-d}піримідин4-іл, 1-метил-1H-піридин-2-он-6-іл, 1H-піридазин-6-он-3-іл, фуро[2,3-d}піридазин-7-іл, тієно[2,3d}піридазин-7-іл, 3,5-диметилпіразин-2-іл, фуро[2,3-d}піримідин-4-іл, 3-метил-3H-імідазо[4,5c]піридин-4-іл, та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. Крім того переважні підгрупи сполук формули (IІІa) можуть бути виражені наступними підформулами (IІІa-B) - (IІІa-O), які відповідають формулі (IІІa), але в яких у випадку підформули (IІІa-B) 1 R представляє собою F, у випадку підформули (IІІa-C) 1 2 X , X представляє собою CH, у випадку підформули (IІІa-D) 1 X представляє собою CH, 5 R представляє собою H, у випадку підформули IIIa- (E) 3 R представляє собою H, OH, у випадку підформули (IІІa-F) 1 X представляє собою CH, 3 R представляє собою OH, у випадку підформули (IІІa-G) 1 X представляє собою CH, Y представляє собою CH, у випадку підформули (IІІa-H) 1 X представляє собою CH, Cyc представляє собою піридин, піразин або піридазин, або піразоло[1,5-a]піримідиніл або імідазо[1,2-b]піридазиніл, у випадку підформули (IІІa-J) Cyc представляє собою піридин, піразин, піридазин, піразоло[1,5-a]піримідиніл, імідазо[1,2b]піридазиніл, фуро[2,3-c]піридиніл, фуро[2,3-d}піридазиніл, тієно[2,3-d}піридазиніл, тієно[2,3d}піримідиніл або імідазо[4,5-c]піридиніл, кожний з яких може бути незаміщений, або може бути моно- або дизаміщений за допомогою метокси, метилу, оксо, Cl або CHF 2O, у випадку підформули (IІІa-K) 1 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, 1 2 X , X представляє собою CH, у випадку підформули (IІІa-L) 1 R представляє собою F, 3 R представляє собою H або OH, 5 R представляє собою H, у випадку підформули (IІІa-M) 1 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, 1 2 X , X представляє собою CH, Cyc представляє собою піридин, піразин або піридазин, або піразоло[1,5-a]піримідиніл або імідазо[1,2-b]піридазиніл, у випадку підформули (IІІa-N) 1 R представляє собою F, 9 UA 116020 C2 3 5 10 15 20 25 30 35 40 45 50 55 60 R представляє собою H або OH, 5 R представляє собою H, Cyc представляє собою піридин, піразин, піридазин, піразоло[1,5-a]піримідиніл, імідазо[1,2b]піридазиніл, фуро[2,3-c]піридиніл, фуро[2,3-d}піридазиніл, тієно[2,3-d}піридазиніл, тієно[2,3d}піримідиніл або імідазо[4,5-c]піридиніл, кожний з яких може бути незаміщений, або може бути моно- або дизаміщений за допомогою метокси, метилу, оксо, Cl або CHF 2O, у випадку підформули (IІІa-O) 1 R представляє собою F, 3 R представляє собою H або OH, 5 R представляє собою H, Cyc представляє собою 5-метоксипіридазин-3-іл, імідазо[1,2-b]піридазин-6-іл, 3-хлор-6метоксипіразин-2-іл, 3-хлорпіразин-2-іл, піридазин-4-іл, 3-метоксипіразин-2-іл, 6метоксипіридазин-3-іл, 3-дифторметоксипіридин-2-іл, 3-метилпіразин-2-іл, тієно[2,3-d}піримідин4-іл, 1-метил-1H-піридин-2-он-6-іл, 1H-піридазин-6-он-3-іл, фуро[2,3-d}піридазин-7-іл, тієно[2,3d}піридазин-7-іл, 3,5-диметилпіразин-2-іл, фуро[2,3-d}піримідин-4-іл, 3-метил-3H-імідазо[4,5c]піридин-4-іл, та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. Крім того переважні підгрупи сполук формули (IІb) можуть бути виражені наступними підформулами (IІb-Q) - (IІb-U), які відповідають формулі (IІb), але в яких у випадку підформули (IІb-Q) 1 R представляє собою F або Cl, 2 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, Y представляє собою CH, у випадку підформули (IІb-R) 1 R представляє собою F, 2 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, Y представляє собою CH, у випадку підформули (IІb-S) Cyc представляє собою піридин, піразин або піридазин, у випадку підформули (IІb-T) 1 R представляє собою F або Cl, 2 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, Cyc представляє собою піридин, піразин або піридазин, у випадку підформули (IІb-U) 1 R представляє собою F, 2 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, Cyc представляє собою піридин, піразин, піридазин або 3-метилпіразин-2-іл, та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. Крім того переважні підгрупи сполук формули (IІІb) можуть бути виражені наступними підформулами (IІІb-Q) - (IІІb-U), які відповідають формулі (IІІb), але в яких у випадку підформули (IІІb-Q) 1 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, Y представляє собою CH, у випадку підформули (IІІb-R) 1 R представляє собою F, 3 R представляє собою OH, 5 R представляє собою H, Y представляє собою CH, 10 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 у випадку підформули (IІІb-S) Cyc представляє собою піридин, піразин або піридазин, у випадку підформули (IІІb-T) 1 R представляє собою F або Cl, 3 R представляє собою OH, 5 R представляє собою H, Cyc представляє собою піридин, піразин або піридазин, у випадку підформули (IІІb-U) 1 R представляє собою F, 3 R представляє собою OH, 5 R представляє собою H, Cyc представляє собою піридин, піразин, піридазин або 3-метилпіразин-2-іл, та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. Надзвичайно переважними є ті сполуки формули (I) і їх підформули, та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях, які зібрано в таблицях 1-8. Сполуки формули (I), а також вихідні речовини для їх одержання, готують за допомогою методів, відомих per se, які описані в літературі (наприклад, у стандартних роботах, таких як Houben-weyl, Methoden der organischen Chemie [Методи органічної хімії], Georg-thieme-verlag, Stuttgart) та/або відомі фахівцеві в даній галузі техніки, і в реакційних умовах, які відомі й придатні для вказаних реакцій. Також тут можна здійснювати варіанти, відомі per se, але які тут докладно не описані. Залежно від використовуваних умов, час реакції становить від декількох хвилин до 14 днів, температура реакції знаходиться в діапазоні від -70 °C до 150 °C, звичайно в діапазоні від 50 °C до 100 °C, особливо переважно в діапазоні від -10 °C до 70 °C. Реакцію здійснюють в інертному розчиннику й, як правило, у присутності речовини, що зв'язує кислоту, переважно органічної основи, такої як DIPEA, триетиламін, диметиланілін, піридин, хінолін, піперидин або діетаноламін. Додавання гідроксиду, карбонату або бікарбонату лужного або лужно-земельного металу або іншої солі слабкої кислоти лужних або лужноземельних металів, переважно калію, натрію, кальцію або цезію, також може бути сприятливим. Підходящими основами є оксиди металів, такі як, наприклад, оксид алюмінію, гідроксиди лужних металів (включаючи гідроксид калію, гідроксид натрію й гідроксид літію), гідроксиди лужноземельних металів (наприклад, гідроксид барію й гідроксид кальцію) і алкоголяти лужних металів (наприклад, етоксид калію й пропоксид натрію). Підходящими інертними розчинниками є, зокрема, вуглеводні, такі як циклогексан, толуол або ксилол; хлоровані вуглеводні, такі як трихлоретилен, 1,2-дихлоретан, чотирихлористий вуглець, хлороформ або дихлорметан; спирти, такі як метанол, етанол, ізопропанол, нпропанол, н-бутанол або трет-бутанол; прості ефіри, такі як простий діетиловий ефір, простий діізопропіловий ефір, трет-бутил метиловий ефір, тетрагідрофуран (ТГФ) або діоксан; прості гліколеві ефіри, такі як етиленгліколь монометиловий або моноетиловий ефір, етиленгліколь диметиловий ефір (диглім); кетони, такі як ацетон або бутанон; аміди, такі як ацетамід, диметилацетамід або диметилформамід (ДМФА); нітрили, такі як ацетонітрил; сульфоксиди, такі як диметил сульфоксид (ДМСО); сірковуглець; карбонові кислоти, такі як мурашина кислота або оцтова кислота; нітросполуки, такі як нітрометан або нітробензол; складні ефіри, такі як етилацетат, або суміші вказаних розчинників. Особливо переважними є ДМФА, метанол, дихлорметан, ТГФ, оцтова кислота й ацетонітрил. Одержання й наступна звичайна обробка реакційної суміші може по суті здійснюватися у вигляді періодичної реакції або в безперервній реакційній процедурі. Безперервна реакційна процедура включає, наприклад, реакцію в котловому реакторі, що безперервно перемішується, перемішується котловому каскаді, петлевому або поперечноточному реакторі, трубці Вентурі або в мікрореакторі. Реакційні суміші необов'язково піддають звичайній обробці, при необхідності, шляхом фільтрації через тверді фази, хроматографі, розділення між фазами, що не змішуються (наприклад, екстракція), адсорбції на твердій основі, видалення розчинників та/або азеотропування сумішей шляхом перегонки, селективної перегонки, сублімації, кристалізації, спільної кристалізації або шляхом нанофільтрації на мембранах. Сполуки формули (I) переважно можна одержувати шляхом взаємодії сполук формули (V) і (VI). Отже, даний винахід також стосується способу одержання сполук формули (I), їх підформул та/або їх фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, 11 UA 116020 C2 включаючи їх суміші у всіх співвідношеннях, що включає наступні стадії: (a) взаємодію сполуки формули (V) 5 у якій LG представляє собою загальноприйняту групу, що вилучається, таку як Hal, зі сполукою формули (IV) 3 Cyc R m Y 2 4 R R 1 R A 10 15 20 25 30 35 40 (IV) у якій A представляє собою боронову кислоту або складний ефір боронової кислоти, одержуючи сполуки формули (I) і необов'язково (б) перетворення основи або кислоти сполук формули (I) в одну з їх солей. Вихідні сполуки, як правило, відомі. Якщо вони є новими, то вони можуть бути отримані за допомогою методів, відомих per se. Сполуки формули (I), (Ia), (Ib), (IІ), (IІa), (IІb), (IІІ), (IІІa), (IІІb), (IV) і (V) можуть бути приготовлені за допомогою відомих методів. Якщо це є бажаним, то вихідні речовини можуть утворюватися in situ, таким чином, що вони не виділяються з реакційної суміші, але замість цього вони негайно надалі перетворюються в сполуки відповідно до винаходу. Також можливо здійснювати реакцію постадійно. Вказані сполуки відповідно до винаходу можуть використовуватися в їх кінцевій несольовій формі. В іншої сторони, даний винахід також охоплює застосування цих сполук у формі їх фармацевтично прийнятних солей, які можуть мати походження з різних органічних і неорганічних кислот і основ за допомогою процедур, відомих у даній галузі техніки. Фармацевтично прийнятні сольові форми сполук формули (I) і її підформул головним чином готують за допомогою загальноприйнятих методів. Якщо сполуки містять карбоксильну групу, то одна з їх прийнятних солей може бути утворена шляхом взаємодії сполуки з підходящою основою для одержання відповідної солі приєднання основи. Такими основами є, наприклад, гідроксиди лужних металів (наприклад, гідроксид калію, гідроксид натрію й гідроксид літію), гідроксиди лужно-земельних металів (наприклад, гідроксид барію й гідроксид кальцію), алкоголяти лужних металів (наприклад, етоксид калію й пропоксид натрію) і різні органічні основи, такі як піперидин, діетаноламін і N-метилглутамін. Основа формули (I) і її підформул може бути перетворена в асоційовану сіль приєднання кислоти, використовуючи кислоти, наприклад, шляхом реакції еквівалентних кількість основи й кислоти в інертному розчиннику, такому як, наприклад, етанол, з наступним упарюванням. Підходящі кислоти для цієї реакції представляють собою, зокрема, ті, які утворюють фізіологічно прийнятні солі, такі як, наприклад, галогеноводні (наприклад, хлористий водень, бромистий водень або йодистий водень), інші мінеральні кислоти і їх відповідні солі (наприклад, сульфат, нітрат або фосфат і інші), алкіл- і моноарилсульфонати (наприклад, етансульфонат, толуолсульфонат і бензолсульфонат) і інші органічні кислоти і їх відповідні солі (наприклад, ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, саліцилат, аскорбат і інші. Солі з фізіологічно неприйнятними кислотами, наприклад, пікрати, можна використовувати для виділення та/або очищення сполук формули (I). Беручи до уваги вказане вище, зрозуміло, що вираз "фармацевтично прийнятна сіль" у контексті даній заявці означає активну сполуку, яка містить сполуку формули (I) у формі однієї з її солей, особливо, якщо ця сольова форма надає поліпшені фармакокінетичні властивості активній сполуці в порівнянні з вільною формою активної сполуки. Фармацевтично прийнятна 12 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 сольова форма активної сполуки також може забезпечувати цю активна сполука вперше з бажаною фармакокінетичною властивістю й може навіть впливати на фармакодинаміку цієї активної сполуки по відношенню до її терапевтичної ефективності в організмі. Сполуки відповідно до винаходу можуть бути хіральними завдяки їх молекулярній структурі й можуть, отже, зустрічатися в різних енантіомерних формах. Таким чином, вони можуть бути представлені в рацемічній або оптично активній формі. Оскільки фармацевтична ефективність рацематів або стереоізомерів сполук формули (I) може відрізнятися, то може бути бажаним використовувати енантіомери. У цих випадках, кінцевий продукт, або навіть проміжний продукт, може бути розділений на енантіомерні сполуки за допомогою хімічних або фізичних засобів, відомих фахівцеві в даній галузі техніки або вже застосовуватися, як такий, у синтезі. У цілому відомо, що атоми можуть мати їх атомні маси або масові числа, які відрізняються від атомних мас або масових чисел, що звичайно зустрічаються в природі. Прикладами ізотопів, які є комерційно доступними і які можуть бути інкорпоровані в сполуку відповідно до винаходу за допомогою відомих методів, є ізотопи водню, вуглецю, азоту, кисню, фосфору, фтору й хлору, 2 3 13 14 15 18 17 31 32 35 18 36 наприклад, H, H, C, C, N, O, O, P, P, S, F і CI. Інкорпорація більш важких 2 ізотопів, зокрема дейтерію ( H), у сполуку відповідно до винаходу, має терапевтичні переваги завдяки більш високій метаболічній стабільності цієї міченої ізотопом сполуки. Більша метаболічна стабільність приводить безпосередньо до підвищеного періоду напіврозпаду in vivo, який надає можливість більш низького дозування. Визначення атомів H, C, N, і т.д., як використовується в сполуках відповідно до винаходу, звичайно також стосується більш важких ізотопів цих атомів. 2 Особливо переважним відповідно до винаходу є застосування D (дейтерій, H) замість 1 водню ( H). Було виявлено, що сполуки відповідно до винаходу викликають специфічне інгібування серин/треонін протеїнкіназ. Отже, винахід також стосується застосування сполук формули (I) або її підформул та/або їх фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, для інгібування серин/треонін протеїнкіназ, переважно PIKK, особливо переважно ДНК-ПК. Особливо переважним є інгібування вищевказаних серин/треонін протеїнкіназ ex vivo або in vitro. Термін "інгібування" стосується будь-якого зменшення активності, яке засновано на дії специфічної сполуки відповідно до винаходу в тому розумінні, що остання здатна взаємодіяти із цільовою молекулою таким чином, що є можливим розпізнавання, зв'язування й блокування. Сполуки відрізняються високою афінністю принаймні до однієї серин/треонін протеїнкінази, забезпечуючи надійне зв'язування й переважно повністю блокуючи активність кінази. Сполуки особливо переважно є моноспецифічними для гарантування ексклюзивного й прямого розпізнавання вибраної кінази. Термін "розпізнавання" стосується в даній заявці будь-якого типу взаємодії між сполукою й вказаними цільовими молекулами, зокрема, ковалентні або нековалентні зв'язки, такі як, наприклад, ковалентний зв'язок, гідрофобні/гідрофільні взаємодії, ван-дер-ваальсовські сили, іонні притягання, водневі зв'язки, ліганд/рецепторні взаємодії, спарювання основнуклеотидів або взаємодії між епітопом і зв'язувальним сайтом антитіла. Сполуки відповідно до винаходу представляють сприятливу біологічну активність, яка може бути продемонстрована в тестах, описаних у даний заявці, такі як, наприклад, ферментативні аналізи. Вимірювання активності кінази представляє собою технологію, добре відому кваліфікованому фахівцеві в даній галузі техніки. Звичайні тест-системи для визначення активності кінази, використовуючи субстрати, наприклад, гістон (Alessi і ін. (1996) FEBS Lett. 399(3): 333) або основний мієліновий білок, описані в літературі (Campos-gonzález & Glenney (1992) JBC 267: 14535). Доступні різні системи для аналізів для ідентифікації інгібіторів кіназ. У сцинтиляційному аналізі зближення (Sorg і ін. (2002) J Biomolecular Screening 7:11) і аналізі флеш-планшета, вимірюють радіоактивне фосфорилування білка або пептиду як субстрату, використовуючи АТФ. У присутності інгібуючої сполуки, виявляють зниження радіоактивного сигналу, або сигнал відсутній. Крім того, метод резонансного переносу енергії гомогенної флуоресценції з розділенням у часі (HTR-FRET) і технології флуоресцентної поляризації (FP) придатні як методи визначення (Sills і ін. (2002) J Biomolecular Screening 191). В інших нерадіоактивних методах ELISA використовуються специфічні фосфо-антитіла (фосфо-ат). Фосфо-aт зв'язують тільки фосфорилований субстрат. Це зв'язування можна виявити за допомогою хемілюмінесценції, використовуючи вторинне кон'юговане з пероксидазою антиовече антитіло. Вищевказане застосування сполук можна здійснювати на моделях in-vitro або in-vivo. Чутливість конкретної клітини до лікування із застосуванням сполуки відповідно до винаходу можна визначати шляхом тестування in vitro. Типово, культуру клітин інкубують зі сполукою 13 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідно до винаходу при різних концентраціях протягом періоду часу, якого достатньо для того, щоб активні агенти індукували клітинну загибель або інгібували клітинну проліферацію, життєздатність клітин або міграцію, звичайно в інтервалі від приблизно однієї години до аж до 9 днів. Для тестування in vitro, можна використовувати культивовані клітини зі зразка біопсії. Після цього визначають кількість клітин, що залишилися, після лікування. Застосування in vitro здійснюють, особливо, на зразках з видів ссавців, які страждають від злоякісного новоутворення, пухлин або метастаз. Хазяїн або пацієнт може належати до ссавців будь-яких видів, наприклад, види приматів, особливо люди, але також і гризуни (включаючи мишей, щурів і хом'яків), кролики, коні, корови, собаки, кішки й ін. Тваринні моделі становлять інтерес для експериментальних досліджень, забезпечуючи модель лікування захворювання людину. Тестування безлічі специфічних сполук надає можливість вибору активної сполуки, яка проявляє найбільшу придатність для лікування пацієнта. Дозу in-vivo вибраної сполуки сприятливо підганяють до чутливості кінази та/або тяжкості захворювання пацієнта, враховуючи дані in-vitro, у результаті чого помітно підвищується терапевтична ефективність. Доза змінюється залежно від специфічної використовуваної сполуки, специфічного захворювання, стану пацієнта й ін. Терапевтичної дози типово достатньо в значній мірі для зменшення популяції небажаних клітин у цільовій тканині, при цьому підтримується життєздатність пацієнта. Наступне розкриття винаходу й варіантів його здійснення, що стосуються застосування сполук формули (I) для приготування лікарського засобу для профілактики, терапії та/або контролю прогресування, є дійсним і може застосовуватися без обмежень до застосування сполук для інгібування активності кінази, якщо це є підходящим. Лікування звичайне триває доти, поки не відбудеться значне зменшення, наприклад, зменшення принаймні на приблизно 50 % клітинного навантаження, і може тривати доти, поки по суті не буде більше виявлятися небажаних клітин в організмі. У тестах цього типу, сполуки відповідно до винаходу представляють і викликають інгібуючий ефект, який звичайно підтверджується значеннями IC50 у підходящому діапазоні, переважно в мікромолярному діапазоні й більш переважно в наномолярному до пікомолярного діапазону. Кіназа інгібується, особливо, до рівня 50 %, якщо концентрація сполук становить менше, ніж 1 мкM, переважно дорівнює або менше, ніж 0,5 мкM, особливо переважно, менше, ніж 0,1 мкM. Цю концентрацію називають IC50 значення. Винахід також стосується лікарського засобу, що містить принаймні одну сполуку формули (I) або її підформул та/або її фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях. Винахід також стосується фармацевтичної композиції, що містить, як активну сполуку, ефективну кількість принаймні однієї сполуки формули (I) або її підформул та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, разом з фармацевтично припустимими допоміжними речовинами. "Медикамент", " лікарський засіб" і "фармацевтична композиція" або "фармацевтичний препарат" у даній заявці представляє собою будь-яку композицію, яка може застосовуватися для профілактики, терапії, контролю прогресування або наступного лікування пацієнтів, у яких, принаймні тимчасово, проявляється патогенна модифікація загального стану або стану окремих компонентів організму пацієнта, переважно внаслідок злоякісного новоутворення, пухлин, або метастаз. Для підвищення захисної або терапевтичної дії сполук відповідно до винаходу, можна додавати фармацевтично припустимі ад'юванти. Для цілей винаходу, будь-яка речовина, яка сприяє, підсилює або модифікує ефект зі сполуками відповідно до винаходу, представляє собою "ад'ювант". Відомими ад'ювантами є, наприклад, сполуки алюмінію, такі як, наприклад, гідроксид алюмінію або фосфат алюмінію, сапоніни, такі як, наприклад, QS 21, мураміл дипептид або мураміл трипептид, білки, такі як, наприклад, гамма-інтерферон або TNF, MF 59, фосфатидилхолін, сквален або багатоатомні спирти. Спільне застосування яєчного альбуміну в повному ад'юванті Фрейнда може, імовірно, підвищувати опосередкований клітинами імунітет і, отже, підтримувати дію з нейтралізації антитіл, що утворюються. Крім того, ДНК, яка має імуностимулюючі властивості, або яка кодує білок з ефектом ад'юванта, такий як, наприклад, цитокін, може застосовуватися паралельно або в конструкції. Введення фармацевтичної композиції в клітину або організм може здійснюватися відповідно до винаходу будь-яким способом, який надає можливість кіназам здійснювати контакт зі сполуками, що присутні в композиції, внаслідок чого індукується відповідь. Фармацевтичну композицію згідно із даним винаходом можна вводити перорально, трансдермально, трансмукозально, трансуретрально, вагінально, ректально, легенево, ентерально та/або парентерально. Вибраний тип введення залежить від показань, дози, що вводиться, 14 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 параметрів, специфічних для індивідуума, і т.д. Зокрема, різні типи введення полегшують сайтспецифічну терапію, яка мінімізує побічні дії й зменшує дозу активної сполуки. Надзвичайно переважні ін'єкції представляють собою внутрішньошкірні, підшкірні, внутрішнньом'язові або внутрішньовенні ін'єкції. Введення можна здійснювати, наприклад, за допомогою так званих пістолетів для вакцинації або за допомогою шприців. Також представляється можливим готувати речовину у вигляді аерозолю, який інгалюється в організм, переважно організм людини. Форми для введення фармацевтичної композиції готують відповідно до бажаного типу введення в підходящому дозуванні й за допомогою способу, відомого per se, використовуючи загальноприйняті тверді або рідкі носії та/або розріджувачі й допоміжні речовини, які звичайно застосовуються. Отже, фармацевтично прийнятні наповнювачі, відомі кваліфікованому фахівцеві в даній галузі техніки, можуть у більшості становити частину фармацевтичної композиції відповідно до винаходу, де кількість речовини-наповнювача, яку об'єднують із активною сполукою для приготування однократної дози, змінюється залежно від індивідуума, що піддається лікуванню, і типу введення. Ці фармацевтично припустимі допоміжні речовини включають солі, буфери, заповнювачі, стабілізатори, комплексоутворюючі засоби, антиоксиданти, розчинники, сполучні, змащувальні речовини, речовини для нанесення оболонок на таблетки, ароматизатори, барвники, консерванти, коректуючі речовини й інші. Прикладами наповнювачів цього типу є вода, рослинні олії, бензилові спирти, алкіленгліколь, поліетиленгліколь, Kolliphor, гліцерол триацетат, желатин, гідроксипропілметилцелюлоза (HPMC), вуглеводи, такі як, наприклад, лактоза або крохмаль, стеарат магнію, тальк і вазелін. Фармацевтичний препарат може бути представлений у формі таблетки, таблетки із плівковою оболонкою, драже, пастилки, капсули, пігулки, порошку, гранул, сиропу, соку, краплею, розчину, дисперсії, суспензії, супозиторію, емульсії, екструдату, імпланту, крему, гелю, мазі, пасти, лосьйону, сироватки, масла, спрею, аерозолю, адгезиву, пластиру або бандажа. Форми для перорального введення, які готують, переважно представляють собою таблетки, таблетки із плівковим покриттям, драже, пастилки, капсули, пігулки, порошки, гранули, сиропи, соки, краплі, розчини, дисперсії або суспензії – включаючи у вигляді депо-форми. Крім того, слід розглядати форми парентерального медикаменту, такі як, наприклад, супозиторії, суспензії, емульсії, імпланти або розчини, переважно масляні або водні розчини. Для місцевого застосування, активну сполуку лікарського засобу готують загальноприйнятим способом принаймні з одним фармацевтично прийнятним носієм, таким як, наприклад, мікрокристалічна целюлоза, і необов'язково додатковими допоміжними речовинами, такими як, наприклад, зволожувачі, для одержання твердих препаратів, які можна наносити на шкіру, такі як, наприклад, креми, гелі, мазі, пасти, порошки або емульсії, або для одержання рідких препаратів, які можна наносити на шкіру, такі як, наприклад, розчини, суспензії, лосьйони, сироватки, масла, спреї або аерозолі. Фармацевтична композиція переважно представлена у формі ін'єкційного розчину. Для приготування ін'єкційного розчину, можна використовувати водні середовища, такі як, наприклад, дистильована вода або фізіологічні сольові розчини, де останні включають солі приєднання кислот і основ. Фармацевтична композиція також може бути представлена у формі твердої композиції, наприклад, у ліофілізованому стані, і потім може бути приготовлена перед використанням шляхом додавання розчинника, такого як, наприклад, дистильована вода. Для кваліфікованого фахівця в даній галузі техніки відомі основні принципи приготування ліофілізатів. Концентрація активної сполуки в препараті може становити від 0,1 до 100 відсотків за вагою. Є ключовим, що фармацевтична композиція містить, як активну сполуку, ефективну кількість сполуки разом з фармацевтично припустимими допоміжними речовинами. Терміни "ефективна кількість" або "ефективна доза" використовуються в даній заявці взаємозамінно й означають кількість фармацевтично активної сполуки, яка має профілактично або терапевтично релевантну дію на захворювання або патологічну зміну в клітині, тканині, органі або ссавці. "Профілактична дія" запобігає початку захворювання або навіть інфікування патогеном після потрапляння в організм індивідуальних типових представників таким чином, що його наступне поширення істотне зменшується або вони навіть повністю деактивуються. "Профілактична дія" також включає підвищення нормальної фізіологічної функції. Профілактика доцільна, зокрема, якщо індивідуум має схильності до початку вищевказаних захворювань, такі як, наприклад, сімейний анамнез, дефект гена або недавно перенесене захворювання. "Терапевтично релевантна дія" звільняє частково або повністю від одного, більше або всіх симптомів захворювання або приводить до часткової або повної реверсії одного, декількох або всіх фізіологічних або біохімічних параметрів, які асоційовані з або причинно залучені в захворювання або патологічну зміну нормального стану. Контроль прогресування також є типом 15 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 терапевтичного лікування, якщо сполуки вводять у певні часові проміжки, наприклад, для повної елімінації симптомів захворювання. Відповідна доза або дозований діапазон для введення сполук відповідно до винаходу є досить великим для досягнення бажаного профілактичного або терапевтичного ефекту індукції біологічної або відповідної реакції. У цілому, доза буде змінюватися залежно від віку, конституції й статі пацієнта, і тяжкість захворювання також слід ураховувати. Зовсім очевидно, що специфічна доза, частота й тривалість введення, додатково, залежать від багатьох факторів, таких як, наприклад, націлювання і зв'язувальна здатність сполук, харчові звички індивідуума, що підлягає лікуванню, тип введення, швидкість екскреції й комбінації з іншими лікарськими засобами. Індивідуальна доза може коректуватися як по відношенню до первинного захворювання, так і по відношенню до появи будь-яких ускладнень. Точна доза може бути встановлена кваліфікованим фахівцем у даній галузі техніки, використовуючи відомі засоби й методи. Це розкриття винаходу є дійсним і може застосовуватися без обмежень до фармацевтичної композиції, що містить сполуки формули (I), якщо це є підходящим. У варіанті здійснення винаходу, сполуки вводяться в дозі від 0,01 мг до 1 г на дозовану одиницю, переважно в діапазоні від 1 до 700 мг, особливо переважно від 5 до 200 мг. Добова доза, зокрема, знаходиться в діапазоні від 0,02 до 100 мг/кг ваги тіла. Для підтримки медичного ефекту, фармацевтична композиція також може містити, у варіанті здійснення винаходу, одну або декілька додаткових активних сполук, де можливо одночасне або послідовне введення. Терапевтичний ефект фармацевтичної композиції відповідно до винаходу може полягати, наприклад, для певних протиракових засобів, що мають переважну дію шляхом інгібування ДНК-ПК як бажаний побічний ефект або в декількох побічних діях цих лікарських засобів, які зменшуються шляхом зменшення дози. У переважному варіанті здійснення винаходу, фармацевтична композиція відповідно до винаходу комбінується із протираковим засобом. Як використовується в даний заявці, термін "протираковий засіб" стосується будь-якого засобу, який вводиться пацієнтові зі злоякісним новоутворенням, пухлинами або метастазами для цілей лікування злоякісного новоутворення. Протиракові засоби, які є переважними відповідно до винаходу, представляють собою ті засоби, які ушкоджують ДНК пухлинних клітин і, отже, залучені в реплікацію ДНК, транскрипцію ДНК або експресію генів. Наступні особливо є підходящими для цієї мети: - алкілуючі засоби, такі як алтретамін, бендамустин, бусульфан, кармустин, хлорамбуцил, хлорметин, циклофосфамід, дакарбазин, іфосфамід, імпросульфан тозилат, ломустин, мельфалан, мітобронітол, мітолактол, німустин, ранімустин, темозоломід, тіотепа, треосульфан, мехлоретамін, карбоквон, апазиквон, фотемустин, глуфосфамід, паліфосфамід, піпоброман, трофосфамід, урамустин; - сполуки платини, такі як карбоплатин, цисплатин, ептаплатин, міриплатин гідрат, оксаліплатин, лобаплатин, недаплатин, пікоплатин, страплатин; - інгібітори топоізомерази, такі як етопозид, іринотекан, разоксан, собузоксан, - ДНК-модифікуючі засоби, такі як амрубіцин, бісантрен, децитабін, мітоксантрон, прокарбазин, трабектедин, клофарабін, амсакрин, бросталіцин, піксантрон, ларомустин; - протиракові антибіотики, такі як блеоміцин, дактиноміцин, доксорубіцин, епірубіцин, ідарубіцин, левамізол, мілтефозин, мітоміцин C, ромідепсин, стрептозоцин, валрубіцин, зиностатин, зорубіцин, даунорубіцин, плікаміцин, акларубіцин, пепломіцин, пірарубіцин; 223 - речовини, що випромінюють альфа-частинки, такі як альфарадин ( Ra дихлорид, Xofgio), 211 213 225 227 At, Bi, Ac, Th; особливо переважними є блеоміцин і альфарадин. Винахід також може практично реалізовуватися у вигляді набору, який містить сполуки відповідно до винаходу. Набір складається з окремих упакувань (a) ефективної кількості сполуки формули (I) та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, і (б) ефективної кількості протиракового засобу. Набір містить підходящі контейнери, такі як, наприклад, коробки або картонні коробки, індивідуальні флакони, пакети або ампули. Набір може містити, наприклад, окремі ампули, кожна з яких містить ефективну кількість сполуки формули (I) та/або її фармацевтично прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, і ефективну кількість протиракового засобу в розчиненій або ліофілізованій формі. Набір згідно з винаходом також може містити виріб, який містить письмові інструкції або вказує користувачеві на письмові інструкції, які пояснюють використання сполук згідно з винаходом. Відповідно до винаходу, сполуки формули (I) або її підформул та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях, 16 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 придатні для профілактики, терапії та/або контролю прогресування захворювань, які викликаються, підтримуються та/або поширюються за допомогою активності серин/ треонін протеїнкіназ. Отже, даний винахід також стосується застосування сполук формули (I) або її підформул та/або їх фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, для приготування лікарського засобу для профілактики, терапії та/або контролю прогресування захворювань, які викликаються, підтримуються та/або поширюються за допомогою активності серин/треонін протеїнкіназ. Відповідно до винаходу, сполуки формули (I) або її підформул та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях, придатні для застосування для профілактики, терапії та/або контролю прогресування захворювань, які викликаються, підтримуються та/або поширюються за допомогою активності серин/протеїнкіназ. Для ідентифікації відповідного шляху передачі сигналів і для визначення взаємодій між різними шляхами передачі сигналів, були розроблені підходящі моделі або модельні системи, наприклад, моделі на основі культури клітин (Khwaja і ін. (1997) EMBO 16: 2783) і моделі трансгенних тварин (White і ін. (2001) Oncogene 20: 7064). Для визначення певних стадій у каскаді передачі сигналів, взаємодіючі сполуки можна використовувати для модуляції сигналу (Stephens і ін. (2000) Biochemical J 351: 95). Додатково, сполуки відповідно до винаходу також можна використовувати як реагенти для тестування залежних від кіназ шляхів передачі сигналів на тваринних моделях та/або моделях культур клітин або на клінічних захворювань, вказаних у даній заявці. Як обговорюється в даній заявці, ці шляхи передачі сигналів є релевантними для різних захворювань. Таким чином, сполуки відповідно до винаходу придатні для профілактики, терапії та/або контролю прогресування захворювань, які залежать від шляху передачі сигналів за участю серин/треонін протеїнкіназ. Відповідно до винаходу, сполуки формули (I) або її підформул та/або їх фізіологічно прийнятні солі, таутомери та/або стереоізомери, включаючи їх суміші у всіх співвідношеннях, придатні для застосування для профілактики, терапії та/або контролю прогресування злоякісного новоутворення, пухлин та/або метастаз. Пухлину вибирають, зокрема, із групи злоякісних захворювань сечового міхура, шлунку, нирок, голови, шиї, стравоходу, шийки матки, щитовидної залози, кишечнику, печінки, головного мозку, передміхурової залози, сечостатевого тракту, лімфатичної системи, гортані, легень, шкіри, крові, кісток і імунної системи, та/або злоякісне новоутворення вибирають із групи моноцитарного лейкозу, не-дрібноклітинного раку легені, дрібноклітинного раку легені, раку підшлункової залози, гліобластоми, колоректальної карциноми, карциноми молочної залози, гострого мієлолейкозу, хронічного мієлолейкозу, гострого лімфолейкозу, хронічного лімфолейкозу, ходжкінської лімфоми й не-ходжкінської лімфоми. Подальший варіант здійснення даного винаходу стосується сполук відповідно до винаходу в комбінації із променевою терапією та/або із принаймні однією додатковою активною сполукою, переважно в комбінації із променевою терапією та/або протираковим засобом. Промислові способи опромінення, які використовуються клінічно, переважно включають фотонне опромінення (класичне, електромагнітне рентгенівське /гама випромінювання), протонне опромінення, опромінення пучком важких іонів (іонізований вуглець) і нейронне опромінення, не обмежуючись тільки ними. Додатково, близькофокусна променева терапія використовується клінічно як підходяще джерело випромінювання (наприклад, випромінювачі альфа-частинок) у формі поверхневого застосування й внутрішнньопорожнинного й інтерстиціального введення. Ці радіотерапії й інші підходящі опромінюючі терапії в контексті винаходу відомі фахівцеві в даній галузі техніки, такі як, наприклад, з Herrmann і ін. (2006) Klinische Strahlenbiologie [Клінічна променева біологія], Elsevier Munich, 4-е вид., 67-68; Bhide & Nutting (2010) BMC Medicine 8:25; Choi & Hung (2010) Current Urology Reports 11(3): 172. Як найбільш часте застосування, фотонне опромінення коректується технічно за допомогою методу IMRT (радіотерапія з модулюванням пучка) і за допомогою методів візуалізації (тривимірна конформаційна променева терапія) у запланованому опроміненні й здійснення для найбільш точного можливого фокусування. Сполуки відповідно до винаходу забезпечують синергетичні ефекти з існуючими в цей час хіміотерапіями й опроміненнями при злоякісних новоутвореннях та/або відновлюють ефективність існуючих у цей час хіміотерапій і опромінень при злоякісних новоутвореннях. Ще подальший варіант здійснення винаходу стосується застосування принаймні однієї сполуки формули (I) та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, для сенсибілізації злоякісних клітин до протиракового засобу та/або іонізуючого випромінювання, за умови, що не відбувається сенсибілізації in vivo в організмі людини або тварини. Сенсибілізація переважно відбувається ex vivo або in vitro шляхом введення сполук у клітини, культури клітин, тканини або органі, які 17 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 містять серин/треонін протеїнкінази. Застосування ex-vivo використовується, зокрема, у випадку тваринних клітин, що мають походження з організму тварини, який уражений захворюванням, вибраним із групи злоякісного новоутворення, пухлин або метастаз. Клітини, оброблені ex vivo, можуть або продовжувати підтримуватися в культурі для наступних досліджень або переноситися у тварину, яка може являти собою тварину-хазяїн або інші тварини. ex-vivo сенсибілізація відповідно до винаходу є особливо сприятливою для тестування специфічної дії сполук, таким чином, що in-vivo доза може попередньо коректуватися відповідно до оцінки цих даних ex-vivo. У результаті цього, суттєво підвищується терапевтичний ефект. Альтернативно, винахід також призначений для застосування в in vivo і стосується принаймні однієї сполуки формули (I) та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, для застосування для сенсибілізації злоякісних клітин до протиракового засобу та/або іонізуючого випромінювання. Винахід також стосується способу профілактики, терапії та/або контролю прогресування злоякісного новоутворення, пухлин або метастаз, у якому ефективну кількість принаймні однієї сполуки відповідно до винаходу та/або її фізіологічно прийнятних солей, таутомерів та/або стереоізомерів, включаючи їх суміші у всіх співвідношеннях, вводять суб'єктові, що піддається лікуванню. Переважними суб'єктами в контексті винаходу є люди або тварини, особливо переважно люди. Для кваліфікованого фахівця в даній галузі техніки відомо в цьому випадку, як він може вводити сполуки відповідно до винаходу, яку також, безсумнівно, може використовувати у вигляді фармацевтичної композиції відповідно до винаходу, у різних дозах в організм, особливо в організм людини. Ефективна кількість і тип введення може бути визначений фахівцем у даній галузі техніки за допомогою традиційних експериментів. Розкритий вище опис винаходу й варіанти його здійснення є дійсними й можуть застосовуватися без обмежень до способу лікування, якщо це є підходящим. Усі вказані й додаткові складові або компоненти відомі кваліфікованому фахівцеві в даній галузі техніки й можуть бути випробувані в специфічному варіанті здійснення для ідей відповідно до винаходу в загальноприйнятих експериментах. Усі документи, процитовані в описі, у такий спосіб повністю включені в розкриття даного винаходу як посилання. Як частина винаходу, представленого в даній заявці, вперше забезпечуються нові сполуки арилхіназоліну формули (I). Сполуки відповідно до винаходу контролюють серин/протеїнкінази, особливо ДНК-ПК, афінно та/або селективно. Сполуки згідно з формулою (I) і їх похідні відрізняються високою специфічністю й стабільністю, низькою вартістю одержання й простою обробкою. Ці властивості становлять основу для відтвореного способу дії, і надійної й безпечної взаємодії з відповідними цільовими структурами. Винахід також включає застосування даних похідних арилхіназоліну для інгібування, регуляції та/або модуляції сигнального каскаду серин/треонін протеїнкіназ, особливо ДНК-ПК, і, отже, надають нові набори для дослідження та/або діагностики. Лікарські засоби й фармацевтичні композиції, які містять вказані сполуки, і застосування вказаних сполук для лікування порушень, промотованих кіназами, становлять, додатково, надзвичайно перспективний підхід для широкого спектру терапій, надаючи можливість прямого й безпосереднього полегшення симптомів у людей і тварин. Це є особливо сприятливим для ефективної боротьби з важкими захворюваннями, такими як злоякісне новоутворення, або у вигляді монотерапії або в комбінації з іншими протипухлинними терапіями. Ключова участь ДНК-ПК у процесах репарації ДНК і дані про те, що ДНК-ПК інгібітори надають можливість клітинам ссавців ставати більш чутливими до випромінювання, забезпечують можливість використання ДНК-пк-специфічних інгібіторів як частини лікування, наприклад, сόлідних злоякісних пухлин шляхом променевої терапії та/або хіміотерапії, спрямованих на ДНК-ДЛР. Сполуки формули (I), їх солі, ізомери, таутомери, енантіомери, діастереомери, рацемати, похідні, проліки та/або метаболіти є ефективними не тільки у випадку вказаних клінічних картин захворювань, але, імовірно, при діагностиці й терапії всіх захворювань, зв'язаних із сигнальним каскадом ДНК-ПК, особливо, по відношенню до інгібування клітинної проліферації й міграції. Додатково, інгібітори відповідно до винаходу можна використовувати для лікування ретровірусних захворювань шляхом супресії інтеграції ретровірусів (R. Daniel (1999) Science 284: 644). На завершення, інгібітори відповідно до винаходу можуть застосовуватися в як імуномодулятори і модулятори підтримки теломер. Низькомолекулярні інгібітори використовуються індивідуально та/або в комбінації з іншими терапевтичними засобами, такими як, наприклад, хірургічні втручання, імунотерапія, променева терапія та/або хіміотерапія. Остання стосується націлюючої терапії з будь-яким бажаним NME (тобто NCE та/або NBE) як монотерапії та/або цільової /нецільової комбінованої терапії. Завдяки них несподівано сильному та/або селективному інгібуванню ферментів, які 18 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 регулюють клітинні процеси за допомогою репарації длДНК, сполуки згідно з винаходом можна вводити в сприятливій низькій дозі, у той час як вони забезпечують подібну або навіть переважаючу біологічну ефективність у порівнянні з менш ефективними або менш селективними інгібіторами, відомими з рівня техніки. Зменшена доза також супроводжується зменшеними або відсутністю медичних побічних дій. Додатково, надзвичайно висока селективність інгібування сполуками відповідно до винаходу також супроводжується зменшенням небажаних побічних дій, які не залежать від дози. Особливо, сполуки відповідно до винаходу не мають фізіологічно релевантних інгібувань або блокад Kv 11.1 hERG калієвого іонного каналу. Також є зрозумілим, що даний винахід не обмежується специфічними сполуками, фармацевтичними композиціями, застосуваннями й способами, як описано в даний заявці, оскільки такі аспекти можуть змінюватися. Крім того, є очевидним, що термінологія, використовувана в даний заявці, служить винятково для цілей опису переважних варіантів здійснення винаходу й не призначена для обмеження обсягу захисту винаходу. Як використовується в даній заявці в описі, включаючи додані пункти формули, словоформи в однині включають еквіваленти в множині. Наприклад, посилання на "сполуку" включає одиничну сполуку або багато сполук, які можуть бути, у свою чергу, ідентичними або різними, або посилання на "спосіб" включає еквівалентні стадії й способи, які відомі фахівцеві в даній галузі техніки. Винахід більш докладно пояснюється нижче з посиланням на необмежуючі приклади специфічних варіантів здійснення винаходу. Приклади повинні, зокрема, інтерпретуватися як необмежуючі комбінації характерних ознак, проілюстрованих специфічно, але замість цього проілюстровані характерні ознаки можуть, у свою чергу, вільно комбінуватися доти, поки досягається мета винаходу. Приклади Огляд демонстраційних прикладів представлено в Таблицях 1-7. Наступні діапазони застосовуються до біологічних даних, відтворених у даній заявці: ДНК-ПК (ферментативний): A: IC50 < 3 нM B: 3 нM ≤ IC50 < 7 нM C: 7 нM ≤ IC50 < 30 нM D: 30 нM ≤ IC50 пднк-пк (клітинний): A: IC50 < 0,5 мкM B: 0,5 мкM ≤ IC50 < 5 мкM C: 5 мкM ≤ IC50 < 10 мкM D: 10 мкM ≤ IC50 25 мкM B: 25 мкM ≥ Ki > 15 мкM C: 15 мкM ≥ Ki > 10 мкM D: 10 мкM ≥ Ki Аналіз 1 ЯМР ( H) здійснювали при наступних параметрах. Прилади: Bruker Avance DRX 500, Bruker Avance 400, Bruker DPX 300 Еталон: TMS TD (часовий інтервал = кількість вимірювальних точок або вага молодшого розряду): 65536 Розчинник Дмсо-d6 NS (число сканувань = частота сканувань): 32 SF (частота спектрометра = частота передачі): 400 або 500 Мгц TE (температура): 303 K, 363 K або 393 K Константи зв'язку (J) вказані в Герцах (Гц) ВЕРХ: високоефективна рідинна хроматографія з УФ детектором РХ-МС: високоефективна рідинна хроматографія з УФ і МС детектором SFC: понадкритична рідинна хроматографія з УФ детектором Ідентифікація проміжних сполук при синтезі й кінцевих продуктів синтезу за допомогою РХМС: РХ-МС метод A: Колонка: Chromolith Speedrod RP-18e 50-4,6 мм, швидкість потоку: 2,4 мл/хвилин, довжина хвилі: 220 нм, елюент A: вода + 0,05 об. % мурашиної кислоти, елюент B: ацетонітрил + 0,4 19 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 об. % мурашиної кислоти, градієнт: 4 об. % -100 об. % елюенту B протягом 2,8 хвилин, потім 100 % елюенту B протягом періоду часу 0,5 хвилини. РХ-МС метод B: Колонка: Chromolith Speedrod RP-18e 50-4,6 мм, швидкість потоку: 2,4 мл/хвилин, довжина хвилі: 220 нм, елюент A: вода + 0,1 об. % трифтороцтової кислоти, елюент B: ацетонітрил + 0,1 об. % трифтороцтової кислоти, градієнт: 4 об. % -100 об. % елюенту B протягом 2,8 хвилин, потім 100 об. % елюенту B плин періоду часу 0,5 хвилини. Розділення стереоізомерних сумішей за допомогою ВЕРХ і SFC: ВЕРХ: спочатку, здійснювали скринінг колонок для кожної стереоізомерної суміші, з наступними колонками: Chiralpak AD-H, Chiralpak AS-H, Chiralpak IA, Chiralpak IB, Chiralpak IC, Chiralcel OD-H, Chiralcel OJ-H, Lux Целюлоза-2, Lux-Амілоза-2, усі колонки: 250-4,6 мм. Найбільш підходящу колонку використовували для подальших вимірювань (наприклад, визначення енантіомерного співвідношення). Швидкість потоку: 0,8 мл/хвилин, довжина хвилі: змінна, адаптували відповідно до максимуму екстинкції й використовуваним елюентами. Елюент: наступні розчинники або суміші розчинників використовували для елюентів: н-гептан, нгексан, етанол, метанол, 2-пропанол, ацетонітрил, етилацетат, дихлорметан; наступні можна використовувати як додатковий елюент: 0,01-0,5 об. % мурашиної кислоти, 0,01-0,5 об. % діетиламіну; використовували градієнти або умови ізократичних вимірювань, відповідно до вказівок. SFC: спочатку, здійснювали скринінг колонок для кожної стереоізомерної суміші, з наступними колонками: Chiralpak AD-H, Chiralpak AS-H, Chiralpak IA, Chiralpak IB, Chiralpak IC, Chiralcel OD-H, Chiralcel OJ-H, Lux Целюлоза-2, Lux-Амілоза-2, усі колонки: 250-4,6 мм. Найбільш підходящу колонку використовували для подальших вимірювань (наприклад, визначення енантіомерного співвідношення). Швидкість потоку: 5 мл/хвилин, довжина хвилі: змінна, адаптували відповідно до максимуму екстинкції й використовуваним елюентами. Елюент: діоксид вуглецю в рідкому стані (>70 бар), спів-елюент: наступні розчинники або суміші розчинників використовували для спів-елюентів: етанол, метанол, ізопропанол, ацетонітрил, етилацетат, дихлорметан. Наступні можна використовувати як додатковий елюент: 0,01-0,5 об. % мурашиної кислоти, 0,01-0,5 об. % діетиламіну. Використовували градієнти або умови ізократичних вимірювань, відповідно до вказівок. Біологічне тестування A) ДНК-ПК АНАЛІЗ (БІОХІМІЧНИЙ) Кіназний аналіз здійснювали в покритих стрептавідином мікротитровальних флешпланшетах на 348-лунки. Для цього, 1,5 мкг комплексу ДНК-ПК/білок і 100 нг біотинілованого субстрату, такого як, наприклад, PESQEAFADLWKK-біотин-NH2 ("біотин-ДНК-ПК пептид"), інкубували протягом 90 хвилин при кімнатній температурі в загальному об'ємі 36,5 мкл (34,25 мM HEPES/KOH; 7,85 мM Трис HСl; 68,5 мM Kcl; 5 мкM АТФ; 6,85 мM MgСl2; 0,5 мM EDTA; 0,14 мM EGTA; 0,69 мM DTT; ph 7,4) з 500 нг ДНК із тимусу теляти, 0,1 мкКі 33P-АТФ і 1,8 % ДМСО на лунку з і без тестованої сполуки. Реакцію зупиняли, використовуючи 50 мкл/лунку 200 мM EDTA. Після інкубування додатково протягом 30 хвилин при кімнатній температурі, рідину видаляли. Кожну лунку промивали три рази за допомогою 100 мкл 0,9 % сольового розчину. Неспецифічну реакцію (холосте значення) визначали, використовуючи 10 мкM природного інгібітору кінази. Вимірювання радіоактивності здійснювали, використовуючи Topcount. IC50 значення розраховували в RS1. Джерела інформації:: Kashishian і ін. (2003) Molecular Cancer Therapeutics 1257. Б) ДНК-ПК ФОСФОРИЛуВАНня НА СЕРИНі 2056 (КЛІТИННИЙ) HCT116 клітини культивували при 37 °C і 10 % CO2 в MEM альфа-середовищі з 10 % фетальної бичачої сироватки й 2 мM глутаміну. Клітини від'єднували від основи культуральних посудин за допомогою трипсину /EDTA, центрифугували в центрифужних пробірках, ресуспендували у свіжому середовищі, і визначали щільність клітин. 100000 клітин висівали в 1 мл культурального середовища на лунку планшета для культивування клітин на 24 лунки й культивували протягом ночі. Наступного дня, до клітин додавали 10 мкM блеоміцину (ДНК інтеркалятор і індуктор дволанцюгових розривів ДНК) і тестовані речовини у свіжому культуральному середовищі, і їх культивували додатково протягом шести годин. Після цього здійснювали лізис клітин, і клітинні лізати додавали до блокувального ELISA планшету на 96 лунок, покритому ДНК-ПК-специфічними антитілами (Sigma-aldrich WH0005591M2: загальна ДНК-ПК; Abcam ab18192 або Epitomics EM09912: фосфо-серин 2056 ДНК-ПК) і інкубували при 4 °C протягом ночі. Після цього планшети ELISA на 96 лунок обробляли детекторним антитілом (Abcam ab79444: загальна ДНК-ПК) і кон'югатом стрептавідин-hrp. Розвиток ферментативної реакції здійснювали за допомогою хемілюмінесцентного реагенту, хемілюмінесценцію 20 UA 116020 C2 5 10 15 20 25 30 35 40 45 50 55 60 вимірювали за допомогою Mithras LB940. Сигнали з фосфо-днк-пк-специфічним антитілом стандартизували із сигналом з антитілом до загального білка ДНК-пкc. Визначення IC50 значень або процентних значень здійснювали шляхом порівняння з еталоном з рівнем сигналу обробленої блеоміцином контрольної групи з носієм (100 % контролю). ДМСО контроль використовували як холостий. В) Активність іонного каналу Kv11.1 (hERG) (аналіз фіксації потенціалу) Метод для виявлення й характеристики тестованих речовин, які інтерферують з Kv11.1 (hERG) каналом: Kv11.1 (hERG, ген специфічних калієвих каналів серця людини) представляє собою калієвий канал, які відіграє центральну роль для реполяризації клітин у шлуночкових кардіоміоцитах. Вимірювання фіксації потенціалу здійснювали при кімнатній температурі в конфігурації цілої клітини на ембріональних ниркових клітинах людини (HEK293), у які трансфектували підходящим способом ген hERG. Конфігурації цілої клітини здійснювали, використовуючи автоматизоване обладнання фіксації потенціалу (Patchlinertm, Nanion Technologies, Munich). Воно являло собою систему на основі скляного чіпу, для якого можливо одночасне вимірювання цілих клітин на аж до 8 клітинах. Скляний чіп представляє собою отвір певного розміру, до якого клітину переносять на Gigaseal шляхом застосування зниженого тиску й переводять у конфігурацію цілої клітини. Буфер, клітинну суспензію й тестовані речовини додають через мікроканали чіпу, використовуючи піпетку, покриту тефлоном. Клітини фіксували до вихідного потенціалу -80 мВ. Для вимірювання опосередкованого речовиною інгібування Kv11.1 каналу застосовували наступний протокол напруги з інтервалами 10 секунд: 51 мс / -80 мВ, 500 мс / +40 мВ, 500 мс / -40 мВ, 200 мс / -80 мВ. Струм витоку віднімали за допомогою P4 методу. Клітини ресупендували в екстраклітинному буфері (EC) і застосовували на чіпі. Після збору клітин, ущільнення поліпшували шляхом додавання буфера, що поліпшує ущільнення. Як тільки досягали конфігурації цілої клітини, буфер, що поліпшує ущільнення, відмивали й заміняли на екстраклітинний буфер. Вимірювання починали на EC протягом 1,5 хвилини. Потім застосовували ДМСО (контрольний наповнювач, 0,1 % ДМСО), і записували контрольний струм протягом 3 хвилин. Після цього додавали тестовану речовину двічі в одній і тій же концентрації, і калієвий струм записували протягом 3,5 хвилин у кожному випадку. Якщо виміряний результат для тестованої речовини при початковій концентрації 10 мкМ був менше, ніж (-)50 % ефекту (граничне значення) (наприклад, (-)60 % ефекту), то тестовану речовину, для визначення взаємозв'язку доза/дія, додавали кумулятивно в зростаючій концентрації, де кожну концентрацію вимірювали протягом 5 хвилин. Використовуваною еталонною речовиною був блокатор іонного каналу Kv11.1 (hERG) хінідин. Ефекти тестованих речовин і хінідину стандартизували з асоційованим контрольним носієм. Ефект на активність каналу Kv11.1 (hERG) оцінювали на основі калієвого струму при -40 мВ. Для розрахунків, струм оцінювали для відповідного кінцевого запису. Інгібування каналу Kv11.1(hERG), індуковане тестованою речовиною, стандартизували з контрольним носієм (0,1 % ДМСО). Під час вимірювання, відбирали аліквоту тестованої речовини для визначення концентрації. Пробу відразу вимірювали за допомогою ВЕРХ, і кінцеву концентрацію визначали згідно з каліброваною кривою. Якщо виміряний результат для тестованої речовини при початковій концентрації 10 мкM більше, ніж або дорівнює (-)50 % ефекту (граничне значення) (наприклад, (-)30 % ефекту, тобто 30 % інгібування при 10 мкM), то Ki розраховували відповідно до наступної формули: Ki=1,0E-5 x (100+% ефекту)/(-% ефекту), [M]. Виміряний результат (-)30 % ефекту при концентрації тестованої речовини 10 мкM забезпечує Ki 23 мкM. Г) Аналіз зв'язування іонного каналу Kv11.1 Kv11.1 (hERG= ген специфічних калієвих каналів серця людини) представляє собою + серцевий K канал, які повинен, якщо це можливо, не взаємодіяти з тестованими речовинами. Цю взаємодію кількісно визначають за допомогою Predictortm hERG Fluorescence Polarizations (FP) Assays від Life Technologies. Згідно із принципом цього аналізу, мембрани клітин кардіоміоцитів, що мають певну пропорцію Kv11.1 каналів, виділяли. Мічений барвником Kv11.1 зв'язувальний партнер забезпечує високий сигнал флуоресцентної поляризації шляхом взаємодії з Kv11.1. У випадку витиснення барвника, відбувається зменшення сигналу флуоресцентної поляризації. Цей аналіз здійснювали автоматично в такий спосіб: 15 нл тестованих речовин (найвища 21 UA 116020 C2 5 10 15 20 25 30 35 40 концентрація: 10 мM, 10 концентрації: фактори розведення 1:3,16, ДМСО) переносили в порожні мікротитрувальні планшети, що мають 384 лунок, за допомогою акустичної піпетки. Після цього додавали 3 мкл виділених мембран. Мембрани й тестовані речовини інкубували при 22 °C протягом 15 хвилин (+/-5 хвилин). На наступній стадії, додавали мічений барвником зв'язувальний партнер, потім інкубували при 22 °C. Після інкубування протягом двох годин, здійснювали вимірювання флуоресцентної поляризації на Envision multimode Reader. Виміряні необроблені дані стандартизували за допомогою Genedata Assay Analyzer. Значення IC50 і % ефекту розраховували на Genedata Condoseo. Хімічний синтез Вище й нижче, усі температури вказані в°C. Розподіл стереохімічної конфігурації енантіомерних прикладів 27, 72, 82, 83, 135, 136, 185, 234, 251, 455 і 456 підтверджували за допомогою рентгеноструктурних аналізів. Для прикладів 234 і 251, ідентифікацію здійснювали шляхом кристалізації й рентгеноструктурного аналізу попередника. Інші сполуки, позначені як хіральні в таблицях (зірочка на асиметричному атомі C) одержували за допомогою хроматографії на хіральній твердій фазі. Енантіомер, який елююється першим у відповідних умовах, називали "Ена1", енантіомер, який елююється другим, називали "Ена2". Приклади 1 і 2: (3,5-дифторпіридин-4-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]метанол (1) (4-хлор-5-фторпіридин-3-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]метанол (2) (3-Бром-4-фторфеніл)ацетонітрил (4,00 г, 18,32 ммоль), біс(пінаколато)дибор (5,22 г, 20,15 ммоль), ацетат калію (55,86 ммоль) і біс(трифенілфосфін)паладій (IІ) хлорид (15,2 % Pd) (393,53 мг, 0,55 ммоль) розчиняли в безкисневому 1,4-діоксані (40 мл, макс. 0,005 % води) в атмосфері аргону. Після цього реакційну суміш нагрівали при температурі 130 °C протягом 90 хвилин. Після завершення реакційного перетворення, суміш фільтрували через діатомову землю. Фільтрат розводили дихлорметаном (200 мл) і водою (50 мл) і екстрагували. Органічну фазу висушували над сульфатом натрію, після цього фільтрували й упарювали насухо у вакуумі, одержуючи [4-фтор-3-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)феніл]ацетонітрил у вигляді + масла (7,59 г, чистота 81 %, МС: 262,2 [M+H ]), який піддавали подальшій реакції без додаткової обробки. 4-Фтор-3-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)феніл]ацетонітрил (7,60 г, 23,53 ммоль), 1,4-діоксан (85,6 мл, макс. 0,005 % води), 4-хлор-7-морфолін-4-ілхіназолін (5,00 г, 20,02 ммоль), біс(трициклогексилфосфін)паладій (IІ) дихлорид (597,24 мг, 0,80 ммоль) і розчин карбонату натрію (2,0 M, 30 мл, 60,07 ммоль) спочатку вносили в тригорлу колбу. Отриману суспензію нагрівали при температурі 140 °C в атмосфері азоту при перемішуванні протягом 2,5 год. Після завершення реакції, суміш охолоджували до кімнатної температури й фільтрували через діатомову землю. Фільтрат розводили етилацетатом (250 мл) і водою (100 мл) і екстрагували. Водну фазу промивали двічі етилацетатом (75 мл у кожному випадку). Об'єднані органічні фази висушували над сульфатом натрію, після цього фільтрували й упарювали насухо 22 UA 116020 C2 5 10 15 20 у вакуумі. Для подальшої обробки, залишок суспендували в трет-бутил метиловому ефірі, відфільтровували й промивали двічі з додатковою кількістю трет-бутил метилового ефіру (30 мл у кожному випадку). Осад після фільтрації висушували протягом ночі у вакуумі, одержуючи [4+ фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]ацетонітрил (4,91 г, 13,49 ммоль, МС: 349,1 [M+H ], 67 % вихід) у вигляді жовтої твердої речовини. [4-Фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]ацетонітрил (400 мг, 1,12 ммоль), 4-хлор-3,5дифторпіридин (189,9 мг, 1,23 ммоль) розчиняли в безкисневому, дегазованому тетрагідрофурані (8 мл, макс. 0,0075 % води) в атмосфері безводного аргону. Після цього до реакційної суміші додавали трет-бутилат калію (263,9 мг, 2,35 ммоль), при цьому утворювався темно-червоний розчин, який перемішували при кімнатній температурі додатково протягом 30 хвилин. Після завершення реакції, суміш розводили насиченим розчином хлориду амонію (20 мл) і водою (50 мл). Після цього водну фазу двічі екстрагували за допомогою дихлорметану (60 мл у кожному випадку). Органічну фазу висушували над сульфатом натрію, відфільтровували й упарювали насухо у вакуумі на роторному випарнику. Залишок очищали за допомогою колонкової флеш-хроматографії (градієнт: дихлорметан / 0-4 об. % етанолу), одержуючи суміш (420 мг, приблизно 5:3) масел (3,5-дифторпіридин-4-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4+ іл)феніл]ацетонітрил (263 мг, 0,57 ммоль, МС: 462,1 [M+H ], 50 % вихід) і (4-хлор-5фторпіридин-3-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]ацетонітрил (157 мг, 0,33 + ммоль, МС: 478,1/480,1 [M+H ], 29 % вихід). N N F Cl F O Cl F N F F F N + N N O 25 30 35 N H2O2, KOtBu N F F + CH3CN N N O F N N N O F N O N N N N O Суміш (420 мг, приблизно 5:3) (3,5-дифторпіридин-4-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін4-іл)феніл]ацетонітрилу й (4-хлор-5-фторпіридин-3-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4іл)феніл]ацетонітрилу розчиняли в ацетонітрилі (12,7 мл). Трет-бутилат калію (80,90 мг, 0,72 ммоль) додавали до реакційного розчину при перемішуванні, при цьому утворювався темночервоний розчин. Після перемішування протягом 15 хвилин, суміш охолоджували до 0 °C, і потім по краплях додавали 30 % розчин перекису водню (276 мкл, 2,70 ммоль). Охолодну баню видаляли після перемішування протягом 5 хвилин при 0°. Реакційний розчин перемішували при кімнатній температурі додатково протягом 1 год. Після завершення реакційного перетворення, додавали 10 % розчин тіосульфату натрію (5 мл), і суміш розводили водою (25 мл). Водний розчин двічі екстрагували за допомогою дихлорметану (50 мл у кожному випадку). Об'єднані органічні фази висушували над сульфатом натрію, відфільтровували й упарювали насухо у вакуумі. Залишок очищали за допомогою колонкової флеш-хроматографії (градієнт: дихлорметан / 0-4 об. % етанолу), одержуючи суміш (310 мг, приблизно 3:1) масел (3,5дифторпіридин-4-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]метанон (233 мг, 0,50 + ммоль, МС: 451,1 [M+H ]) і (4-хлор-5-фторпіридин-3-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4+ іл)феніл]метанон (77 мг, 0,16 ммоль, МС: 467,1/469,1 [M+H ]). 23 UA 116020 C2 5 10 15 20 25 30 35 Суміш (310 мг, приблизно 3:1) (3,5-дифторпіридин-4-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін4-іл)феніл]метанону й (4-хлор-5-фторпіридин-3-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4іл)феніл]метанону розчиняли в метанолі (15 мл). Після цього додавали борогідрид натрію (30,4 мг, 0,80 ммоль) (виділення газу). Реакційний розчин перемішували при кімнатній температурі протягом 45 хвилин. Після завершення реакції, суміш розводили насиченим розчином хлориду амонію (5 мл) і водою (15 мл). Після цього водну фазу екстрагували три рази за допомогою дихлорметану (20 мл у кожному випадку). Об'єднані органічні фази висушували над сульфатом натрію, відфільтровували й упарювали насухо у вакуумі на роторному випарнику. Залишок розчиняли в диметилсульфоксиді (4,8 мл) і очищали за допомогою хроматографії шляхом препаративної ВЕРХ (градієнт: вода/1-50 об. % ацетонітрилу протягом 21 хвилин, швидкість потоку 50 мл/хвилин). Фракції, що містять продукт, об'єднували, розводили насиченим розчином гідрокарбонату натрію (5 мл у кожному випадку) і двічі екстрагували за допомогою дихлорметану (40 мл у кожному випадку). Органічні фази упарювали у вакуумі, після цього залишки ресуспендували в 1,4-діоксані (5 мл) і воді (30 мл) і ліофілізували, одержуючи чистий (3,5-дифторпіридин-4-іл)-[4-фтор-3-(7-морфолін-4-ілхіназолін-4-іл)феніл]метанол (ПРИКЛАД 1, + 42,50 мг, 0,09 ммоль, МС: 453,1 [M+H ]) і (4-хлор-5-фторпіридин-3-іл)-[4-фтор-3-(7-морфолін-4+ ілхіназолін-4-іл)феніл]метанол (ПРИКЛАД 2, 28,40 мг, 0,06 ммоль, МС: 469,1/471,1 [M+H ]) у вигляді твердих речовин. ПРИКЛАД 37 (3-хлорпіразин-2-іл)-[4-фтор-3-(6-морфолін-4-ілтієно[3,2-d}піримідин-4-іл)феніл]метанол (37) Гідрид натрію (60 % суспензія в парафіновому маслі, 1,41 г, 35,0 ммоль) суспендували в безводному тетрагідрофурані (25 мл) в атмосфері аргону в скляній посудині. Потім повільно додавали по краплях 4-метоксифенілметанол (4,21 г, 30,0 ммоль), розчинений у безводному тетрагідрофурані (5 мл), при перемішуванні, і суміш перемішували при кімнатній температурі протягом 1 год. Після цього повільно додавали суспензію 4-хлортієно[3,2-d}піримідину (4,00 г, 23,4 ммоль) у безводному тетрагідрофурані (20 мл), і суміш перемішували додатково протягом години. Після завершення реакційного перетворення, обережно додавали метанол (15 мл), після цього суміш упарювали у вакуумі й розводили сумішшю води (100 мл) і етилацетату (150 мл). Водну фазу екстрагували три рази етилацетатом (100 мл у кожному випадку), висушували над сульфатом натрію, відфільтровували з відсмоктуванням, і фільтрат упарювали у вакуумі. Залишок, що не містить розчинника, ресуспендували в етаноле (40 мл) і обережно перемішували приблизно при 5 °C протягом 16 годин. Кристали, які осаджувалися протягом ночі, відфільтровували з відсмоктуванням, промивали невеликою кількістю холодного етанолу й висушували при кімнатній температурі, одержуючи 4-(4-метоксибензилокси)тієно[3,2+ d}піримідин (4,15 г, 15,24 ммоль, МС: 273,0 [M+H ]), 65 % вихід) у вигляді кристалічної твердої речовини. 24 UA 116020 C2 5 10 15 20 25 30 35 40 4-(4-Метоксибензилокси)тієно[3,2-d}піримідин (2,60 г, 9,55 ммоль) розчиняли в безводному тетрагідрофурані (35 мл) і охолоджували до (-)55 °C. Свіжоприготовлений розчин діізопропіламіду літію (21 ммоль, приготовлений з діізопропіламіну [2,13 г, 21 ммоль] і н-BuLi [15 % розчин з н-гексану, 13,13 мл, 21 ммоль у безводному тетрагідрофурані [35 мл] при []10 °C) додавали по краплях при (-)55 °C протягом 10 хвилин. Отриману суспензію перемішували додатково. Після цього додавали 1,2-диброметан (10,76 г, 6,0 ммоль). Через додаткові 10 хвилин, суміш нагрівали до (-)20 °C і перемішували протягом 1 год. Після завершення реакції, реакційний розчин додавали до 50 % водного розчину гідрокарбонату натрію/ тіосульфату натрію (об'ємне співвідношення 1:1, 120 мл). Водну фазу екстрагували три рази за допомогою етилацетату. Об'єднані органічні фази промивали насиченим розчином хлориду натрію, після цього висушували над сульфатом натрію, фільтрували й упарювали насухо на роторному випарнику. Залишок очищали за допомогою колонкової флешхроматографії (градієнт циклогексан / 0-18 об. % етилацетату, Combiflash Rf 200, колонка 80 г діоксиду кремнію, швидкість потоку = 50 мл/хвилин, λ = 220 нм), одержуючи 6-бром-4-(4+ метоксибензилокси)тієно[3,2-d}піримідин (1,39 г, 3,95 ммоль, МС: 351,0/353,0 [M+H ]), 41 % вихід) у вигляді твердої речовини. 6-Бром-4-(4-метоксибензилокси)тієно[3,2-d}піримідин (1,38 г, 3,93 ммоль), морфолін (1,03 г, 11,79 ммоль), трет-бутилат натрію (1,13 г, 11,79 ммоль), (S)-(-)-2,2‘-біс(дифенілфосфіно)-1,1‘бінафтил (S-BINAP, 122,3 мг, 0,196 ммоль) і трис(дибензиліденацетон)дипаладій (179,9 мг, 0,196 ммоль) розчиняли в толуолі (20 мл) в атмосфері азоту в мікрохвильовій посудині. Реакційний розчин нагрівали при 95 °C протягом 4 год. Після цього суміш розводили водою (60 мл) і дихлорметаном (60 мл). Водну фазу екстрагували три рази за допомогою дихлорметану. Об'єднані органічні фази висушували над сульфатом натрію й упарювали на роторному випарнику. Залишок очищали за допомогою флеш-хроматографії (градієнт дихлорметан / 5-25 об. % [дихлорметан/етанол 9:1], Combiflash Rf 200, колонка 80 г діоксиду кремнію, λ = 220 нм). Підходящі фракції продукту об'єднували, і розчинники видаляли на роторному випарнику, одержуючи 4-(4-метоксибензилокси)-6-морфолін-4-ілтієно[3,2-d}піримідин (756,0 мг, 2,12 ммоль, + МС: 358,2 [M+H ]) 54 % вихід) у вигляді твердої речовини. 4-(4-Метоксибензилокси)-6-морфолін-4-ілтієно[3,2-d}піримідин (923 мг, 2,58 ммоль) розчиняли в тетрагідрофурані (5 мл) і метанолі (5 мл). Додавали порціями Pd/C (5 %, 1,9 г) (на початку реакції, через додаткові 7 год. і 24 год.), і суміш гідрували при максимальному тиску водню 5 бар (H2, чистота 3,0, 57,9 г) протягом 36 год. Отриманий розчин фільтрували через діатомову землю й упарювали на роторному випарнику. Залишок очищали за допомогою колонкової флеш-хроматографії (градієнт: дихлорметан/10-20 об. % [метанол/аміак 10:1], Combiflash Rf 200, колонка 24 г діоксиду кремнію, λ = 220 нм). Підходящі фракції продукту об'єднували, і розчинники видаляли на роторному випарнику, одержуючи 6-морфолін-4-іл-3H+ тієно[3,2-d}піримідин-4-он (361,0 мг, 1,521 ммоль, МС: 238,0 [M+H ], 59 % вихід) у вигляді твердої речовини. 25 UA 116020 C2 O S O N Cl NH (57%) 5 10 S PCl3, DIPEA O N N N N 6-Морфолін-4-іл-3H-тієно[3,2-d}піримідин-4-он (206 мг, 0,87 ммоль) суспендували у фосфорилхлориді (1,67 г, 10,89 ммоль). Після цього до суспензії додавали Nетилдіізопропіламін (56,1 мг, 0,43 ммоль). Реакційну суміш перемішували протягом ночі при кімнатній температурі. Для здійснення звичайної обробки, додавали суміш насиченого розчину гідрокарбонату натрію (30 мл) і дихлорметану (20 мл). Отриманий розчин екстрагували три рази за допомогою дихлорметану. Об'єднані органічні фази висушували над сульфатом натрію, фільтрували й упарювали насухо у вакуумі, одержуючи 4-хлор-6-морфолін-4-ілтієно[3,2+ d}піримідин (127 мг, 0,497 ммоль, МС: 256,0/258,0 [M+H ], 57 % вихід) у вигляді твердої речовини. Використовуючи як вихідні сполуки 4-хлор-6-морфолін-4-ілтієно[3,2-d}піримідин, (3хлорпіразин-2-іл)-[4-фтор-3-(6-морфолін-4-ілтієно[3,2-d}піримідин-4-іл)феніл]метанол (ПРИКЛАД 37) одержували аналогічно до послідовності синтезу, описаної для Прикладів 1 і 2. 15 26 UA 116020 C2 Сполуки, які отримані відповідно до Прикладів 1,2 і 37, можна знайти в таблиці 1 нижче. Таблиця 1 Сполуки формули (I) Прик Структурна формула лад IC50 пДНК -ПК Ki [Kv1. 11 hERG ] B B B OH F N (3,5-Дифтор-піридин-4-іл)-[4фтор-3-(7-морфолін-4ілхіназолін-4-іл)феніл]метанол F F N 1 Назва IC50 ДНКПК N N O 1H ЯМР (500 МГц, ДМСО-d6) част. на млн = 9,10 (s, 1H), 8,50 (s, 2H), 7,65-7,60 (m, 2H), 7,55-7,48 (m, 2H), 7,45-7,40 (m, 1H), 7,20 (d, J=2,1, 1H), 6,62 (d, J=4,6, 1H), 6,23 (d, J=4,6, 1H), 3,80-3,75 (m, 4H), 3,47-3,42 (m, 4H) + МС: 453,1 (M+H ) OH Cl F (4-Хлор-5-фтор-піридин-3-іл)-[4фтор-3-(7-морфолін-4ілхіназолін-4-іл)феніл]метанол F N N A C N N 2 B O + МС: 469,1/471,1 (M+H ) (Cl ізотопія, співвідношення інтенсивностей відн. піків [%] 100:37) OH O N Cl N [2-Хлор-4-фтор-5-(7-морфолін4-ілхіназолін-4-іл)феніл]-(4метокси-піридазин-3-іл)метанол F N 3 1H ЯМР (500 МГц, ДМСО-d6) част. на млн = 9,10 (s, 1H), 8,70 (s, 1H), 8,66 (s, 1H), 7,64-7,59 (m, 2H), 7,55-7,48 (m, 2H), 7,44-7,39 (m, 1H), 7,20 (d, J=2,2, 1H), 6,56 (d, J=4,4, 1H), 6,12 (d, J=4,5, 1H), 3,81-3,74 (m, 4H), 3,47-3,40 (m, 4H) B B A N N O + МС: 504,1/506,1 (M+Na ) (Cl ізотопія, співвідношення інтенсивностей відн. піків [%] 100:35) O OH 1H ЯМР (500 МГц, ДМСО-d6) част. на млн = 9,13 (s, 1H), 8,96 (d, J=6,0, 1H), 8,04-8,01 (m, 1H), 7,65-7,60 (m, 2H), 7,56 (dd, J=9,4, 2,5, 1H), 7,32 (d, J=6,0, 1H), 7,22 (d, J=2,5, 1H), 6,46 (d, J=6,2, 1H), 6,39 (d, J=6,3, 1H), 3,96 (s, 3H), 3,81-3,75 (m, 4H), 3,50-3,43 (m, 4H) Cl N N [2-Хлор-4-фтор-5-(7-морфолін4-ілхіназолін-4-іл)феніл]-(5метокси-піридазин-3-іл)метанол F N 4 N A A A N O + МС: 482,1/484,1 (M+H ) (Cl ізотопія, співвідношення інтенсивностей відн. піків [%] 100:34) 1H ЯМР (500 МГц, ДМСО-d6) част. на млн = 9,07 (s, 1H), 8,88 (d, J=4,7, 1H), 7,71 (d, J=9,5, 1H), 7,59 (dd, J=4,7, 0,9, 1H), 7,54 (d, J=7,6, 1H), 7,52-7,50 (m, 2H), 7,21-7,17 (m, 1H), 6,46 (d, J=5,1, 1H), 6,15 (d, J=5,2, 1H), 4,01 (s, 3H), 3,81-3,74 (m, 4H), 3,48-3,41 (m, 4H) 27 UA 116020 C2 OH O HN N 3-{[4-Фтор-3-(7-морфолін-4ілхіназолін-4іл)феніл]гідроксиметил}-1Hпіразин-2-он F N 5 N N D D B O 1H ЯМР (500 МГц, ДМСО-d6) част. на млн = 9,09 (s, 1H), 7,69-7,59 (m, 2H), 7,56-7,50 (m, 2H), 7,39-7,28 (m, 3H), 7,20 (d, J=2,1, 1H), 6,00 (s, 1H), 5,87-5,75 (m, 1H), 3,813,74 (m, 4H), 3,44 (t, J=5,0, 4H) + МС: 434,2 (M+H ) Cl OH O N N Cl 6 [2-Хлор-4-фтор-5-(7-морфолін4-ілхіназолін-4-іл)феніл]-(6хлор-5-метокси-піридазин-3іл)метанол F N A A C N N O МС: 516,1/518,1/520,1 + (M+H ) (Cl2 ізотопія, співвідношення інтенсивностей відн. піків [%] 100:71:14) 1H ЯМР (500 МГц, ДМСО-d6) част. на млн = 9,07 (s, 1H), 7,75 (d, J=1,0, 1H), 7,72 (d, J=9,5, 1H), 7,56 (d, J=7,6, 1H), 7,51 (dd, J=9,5, 2,5, 1H), 7,47 (dd, J=9,4, 2,9, 1H), 7,19 (d, J=2,4, 1H), 6,59 (d, J=5,0, 1H), 6,13-6,10 (m, 1H), 3,98 (s, 3H), 3,80-3,74 (m, 4H), 3,48-3,41 (m, 4H) OH O N N (3-Хлор-6-метокси-піридазин-4іл)-[4-фтор-3-(7-морфолін-4ілхіназолін-4-іл)феніл]метанол F Cl N 7 B A B N N O + МС: 482,1/484,1 (M+H ) (Cl ізотопія, співвідношення інтенсивностей відн. піків [%] 100:39) OH O N Cl Cl N [2-Хлор-4-фтор-5-(7-морфолін4-ілхіназолін-4-іл)феніл]-(6хлор-4-метокси-піридазин-3іл)метанол F N 8 1H ЯМР (500 МГц, ДМСО-d6) част. на млн = 9,09 (s, 1H), 7,62-7,57 (m, 2H), 7,55-7,47 (m, 3H), 7,43-7,39 (m, 1H), 7,20 (d, J=2,4, 1H), 6,58 (d, J=4,5, 1H), 5,88 (d, J=4,4, 1H), 4,04 (s, 3H), 3,80-3,75 (m, 4H), 3,46-3,42 (m, 4H) C B C N N O МС: 516,1/518,1/520,1 + (M+H ) (Cl2 ізотопія, співвідношення інтенсивностей відн. піків [%] 100:72:16) O 1H ЯМР (500 МГц, ДМСО-d6) част. на млн = 9,13 (s, 1H), 8,01-7,99 (m, 1H), 7,65-7,59 (m, 3H), 7,56 (dd, J=9,5, 2,5, 1H), 7,22 (d, J=2,5, 1H), 6,52 (d, J=6,2, 1H), 6,39 (d, J=6,2, 1H), 4,02 (s, 3H), 3,80-3,76 (m, 4H), 3,48-3,44 (m, 4H) OH N N F 9 Cl N N (6-Хлор-5-метокси-піридазин-3іл)-[4-фтор-3-(7-морфолін-4ілхіназолін-4-іл)феніл]метанол N O 28 B A D
ДивитисяДодаткова інформація
Назва патенту англійськоюArylquinazolines
Автори англійськоюFuchss, Thomas, Emde, Ulrich, Buchstaller, Hans-Peter, Mederski, Werner
Автори російськоюФуксс Томас, Эмдэ Ульрих, Бухшталлер Ханс-Пэтэр, Мэдэрски Вернэр
МПК / Мітки
МПК: C07D 403/10, A61K 31/506, C07D 405/14, C07D 491/048, C07D 487/04, C07D 495/04, C07D 401/10, C07D 417/14, C07D 498/08, A61K 31/519, C07D 405/04, C07D 417/10, C07D 513/04, C07D 471/04
Мітки: арилхіназоліни
Код посилання
<a href="https://ua.patents.su/191-116020-arilkhinazolini.html" target="_blank" rel="follow" title="База патентів України">Арилхіназоліни</a>
Попередній патент: Контейнер
Наступний патент: Заміщені n-(тетразол-5-іл)- й n-(триазол-5-іл)арилкарбоксамідні сполуки та їх застосування як гербіцидів
Випадковий патент: Спосіб отримання плавленого сиру