Похідні й аналоги n-етилхінолонів і n-етилазахінолонів
Номер патенту: 99440
Опубліковано: 27.08.2012
Автори: Кастро Пічель Хуліа, Ремуйнан Бланко Модесто Х., Гоффман Джеймс Б., Пендрак Ісрайль, Пірсон Нейл Девід, Деббс Стівен, Джордано Іларіа, Россі Джейсон Ентоні, Девіс Девід Томас, Дейнс Роберт А., Джонс Грехем Елджін, Баррос Девід, Геннессі Алан Джозеф, Майлз Тімоті Джеймс, Фіандор Роман Хосе Маріа, Брукс Джеральд, Баллєлль Льюїс
Формула / Реферат
1. Сполука формули (І) або її фармацевтично прийнятні сіль, сольват або N-оксид:
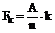 , (I)
, (I)
де:
два з Z1, Z2, Z3 і Z4 незалежно означають CR1c або N, а решта незалежно означають CR1c; або Z3 і Z4 разом означають S, та один з Z1 і Z2 означає CR1c або N, а інший незалежно означає CR1c;
R1a, R1b і R1c незалежно вибрані з групи, що містить водень; галоген; ціано; (С1-6)алкіл; (С1-6)алкілтіо; трифторметил; трифторметокси; карбокси; гідрокси, необов'язково заміщений (С1-6)алкілом, або (С1-6)алкоксизаміщений(С1-6)алкіл; (С1-6)алкоксизаміщений(С1-6)алкіл; гідроксі(С1-6)алкіл; аміногрупу, необов'язково N-заміщену однією або двома (С1-6)алкільними, формільними, (С1-6)алкілкарбонільними або (С1-6)алкілсульфонільними групами; або амінокарбоніл, аміногрупа якого необов'язково заміщена (С1-4)алкілом; або два з R1a, R1b і R1c на сусідніх атомах вуглецю можуть разом утворювати етилендіоксильну групу;
R2 означає водень або (С1-4)алкіл, або разом з R6 утворює Y, визначений нижче;
А означає групу (і):
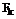 , (іа)
, (іа) 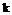 , (ib)
, (ib)
у якій: R3 має таке саме значення, що й R1a, R1b і R1c, або означає оксо або амінометил, а n дорівнює 1 або 2;
або А означає групу (іі)
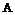 , (іі)
, (іі)
W1, W2 і W3 означають CR4R8,
або W2 і W3 означають CR4R8, a W1 означає зв'язок між W3 і N,
X означає О, CR4R8 або NR6;
один R4 має таке саме значення, що й R1a, R1b і R1c, а решта й R8 означають водень, або один R4 і R8 разом означають оксо, а решта означають водень;
R6 означає водень або (С1-6)алкіл; або разом з R2 утворює Y;
R7 означає водень; галоген; гідрокси, необов'язково заміщений (С1-6)алкілом; або (С1-6)алкіл;
Y означає CR4R8CH2; CH2CR4R8; (C=O); CR4R8; CR4R8(C=O) або (C=O)CR4R8;
або, якщо X означає CR4R8, R8 і R7 разом означають зв'язок;
U вибраний з СО і СН2, і
R5 означає необов'язково заміщену біциклічну карбоциклічну або гетероциклічну кільцеву систему (В):
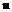 , (В)
, (В)
що містить до чотирьох гетероатомів у кожному циклі, де
гетероциклічне кільце (В) має ароматичний цикл (а), який являє собою за необхідності заміщений піримідино, де
X1 означає С;
X2 означає N;
X3 і X5 означають С; та
Y1 означає лінкерну групу, що містить 2 атоми -N-CR14-,
та неароматичний цикл (b), та Y2 означає лінкерну групу, що містить 3-4 атоми, причому кожен атом Y2 незалежно вибраний з N, NR13, О, S(O)x, CO, CR14 або CR14R15, включаючи принаймні один гетероатом, причому О, S, СН2 або NR13 зв'язані з X5, де R13 відмінний від водню, та або NHCO зв'язаний через N із X3, або О, S, СН2 або NH зв'язаний з X3;
кожен з R14 і R15 незалежно вибраний з: Н; (С1-4)алкілтіо; галогену; карбоксі(С1-4)алкілу; (С1-4)алкілу; (С1-4)алкоксикарбонілу; (С1-4)алкілкарбонілу; (С1-4)алкоксі(С1-4)алкілу; гідрокси; гідроксі(С1-4)алкілу; (С1-4)алкокси; нітро; ціано; карбокси; аміно або амінокарбонілу, необов'язково моно- або дизаміщеного (С1-4)алкілом; або
R14 і R15 можуть разом означати оксо;
кожен R13 незалежно означає Н; трифторметил; (С1-4)алкіл, необов'язково заміщений гідрокси, (С1-6)алкокси, (С1-6)алкілтіо, галогеном або трифторметилом; (С2-4)алкеніл; (С1-4)алкоксикарбоніл; (С1-4)алкілкарбоніл; (С1-6)алкілсульфоніл; амінокарбоніл, де аміногрупа необов'язково є моно- або дизаміщеною (С1-4)алкілом;
кожен х незалежно означає 0, 1 або 2.
2. Сполука за п. 1, де кожен R1a, R1b і R1c незалежно означає водень, метокси, метил, етил, ціано або галоген.
3. Сполука за п. 2, де R1a означає метокси, ціано, фтор, хлор або бром, a R1b і R1c означають водень.
4. Сполука за будь-яким з попередніх пунктів, де R2 означає водень.
5. Сполука за будь-яким з попередніх пунктів, де U означає СН2.
6. Сполука за будь-яким з пп. 1-5, де R5 за необхідністю заміщений:
6,7-дигідро-[1,4]діоксино[2,3-d]піримідин-2-іл,
2-заміщений 1Н-піримідо[5,4-b][1,4]оксазин-7(6Н)-он,
2-заміщений 5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он або
2-заміщений 6,7-дигідро-5Н-пірано[2,3-d]піримідин:
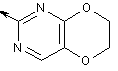 ,
, 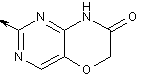 ,
, 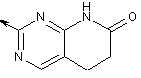 ,
, 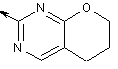 .
.
7. Сполука за п. 6, де R5 означає:
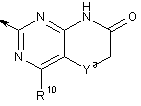 , (С)
, (С)
де:
Y3 означає СН2 або О; та
R10 незалежно вибраний з водню, галогену, (С1-6)алкілу та (С1-6)алкокси.
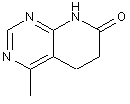
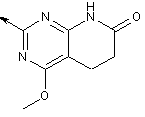
8. Сполука за п. 7, де R5 означає:
2-заміщений 1Н-піримідо[5,4-b][1,4]оксазин-7(6Н)-он,
2-заміщений 4-хлор-1Н-піримідо[5,4-b][1,4]оксазин-7(6Н)-он,
2-заміщений 5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он,
2-заміщений 4-хлор-5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он,
2-заміщений 4-метил-5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он або
2-заміщений 4-метилокси-5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он:
 ,
, 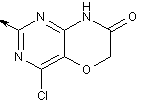 ,
,  ,
, 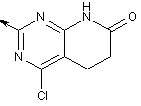 ,
,
 ,
,  .
.
9. Сполука за будь-яким з попередніх пунктів, де:
кожен з Z1, Z2, Z3 і Z4 незалежно означає CR1c;
Z1 означає N, а кожен з Z2, Z3 і Z4 незалежно означає CR1c;
Z2 означає N, а кожен з Z1, Z3 і Z4 незалежно означає CR1c;
Z3 означає N, а кожен з Z1, Z2 і Z4 незалежно означає CR1c;
Z1 і Z3 означають N, a Z2 і Z4 незалежно означають CR1c;
Z2 і Z3 означають N, a Z1 і Z4 незалежно означають CR1c;
Z3 і Z4 означають N, a Z1 і Z2 незалежно означають CR1c;
Z3 і Z4 разом означають S, a Z1 і Z2 незалежно означають CR1c;
Z3 і Z4 разом означають S, Z1 означає CR1c, a Z2 означає N;
Z1 і Z2 означають N, a Z3 і Z4 незалежно означають CR1c.
10. Сполука за п. 9, коли він залежний від будь-якого з пп. 1 або 4-8, де Z1 означає СR1c, а R1a та R1c разом утворюють етилендіоксигрупу.
11. Сполука за будь-яким з попередніх пунктів, де А означає групу (іа), в якій n дорівнює 1, a R3 означає водень або гідрокси, або А означає 3-гідроксипіролідин-4-ілметил або 4-гідроксипіперидин-3-ілметил.
12. Сполука за п. 10, де А означає 4-гідроксипіперидин-3-ілметил.
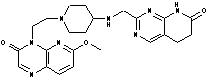
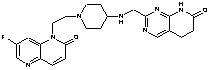
13. Сполука за п. 1, вибрана з групи, яка містить:
2-[({1-[2-(7-фтор-2-оксо-1(2Н)-хінолініл)етил]-4-піперидиніл}аміно)метил]-1Н-піримідо[5,4-b][1,4]оксазин-7(6Н)-он,
4-хлор-2-[({1-[2-(7-фтор-2-оксо-1(2Н)-хінолініл)етил]4-піперидиніл}аміно)метил]-1Н-піримідо[5,4-b][1,4]оксазин-7(6Н)-он,
2-{[(1-{2-[6-(метилоксі)-3-оксопіридо[2,3-b]піразин-4(3Н)-іл]етил}-4-піперидиніл)аміно]метил}-5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он,
4-хлор-2-{[(1-{2-[6-(метилоксі)-3-оксопіридо[2,3-b]піразин-4(3Н)-іл]етил}-4-піперидиніл)аміно]метил}-5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он,
4-метил-2-{[(1-{2-[6-(метилоксі)-3-оксопіридо[2,3-b]піразин-4(3Н)-іл]етил}-4-піперидиніл)аміно]метил}-5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он,
4-(метилокси)-2-{[(1-{2-[6-(метилоксі)-3-оксопіридо[2,3-b]піразин-4(3Н)-іл]етил}-4-піперидиніл)аміно]метил}-5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он,
2-({[((3S)-1-{2-[6-(метилоксі)-3-оксопіридо[2,3-b]піразин-4(3Н)-іл]етил}-3-піперидиніл)метил]аміно}метил)-5,6-дигідропіридо[2,3-d]піримідин-7(1Н)-он,
або вільна основа сполуки, вибрана з Таблиці:
Таблиця
Приклад №
Структура
142
143
144
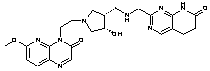
145
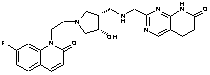
146
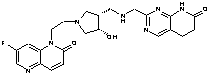
147
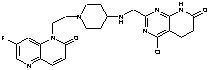
148
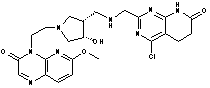
149
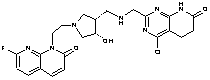
150
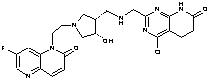
151
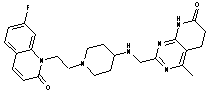
152
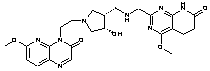
153
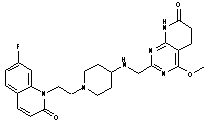
154
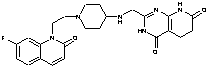
262
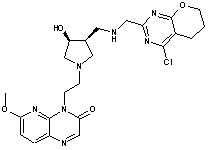
267
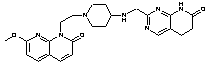
275
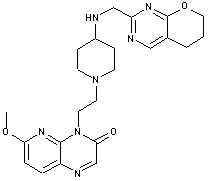
277
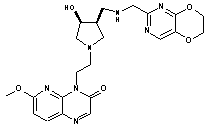
278
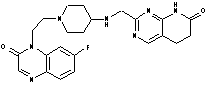
279
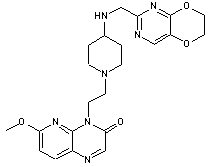
280
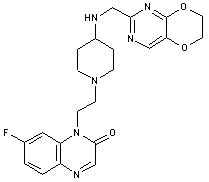
281
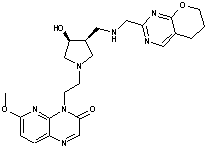
309
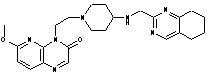
310
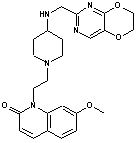
311
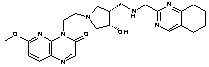
312
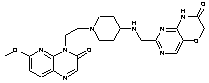
313
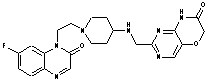
314
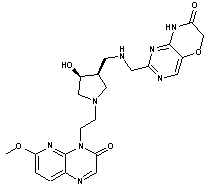
315
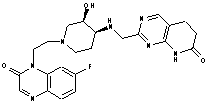
або фармацевтично прийнятна сіль будь-якої із вищезазначених сполук.
14. Сполука за будь-яким з попередніх пунктів для застосування у лікуванні бактерійних інфекцій у ссавців.
15. Фармацевтична композиція, що містить сполуку за будь-яким з попередніх пунктів та фармацевтично прийнятний носій.
Текст
Реферат: Винахід стосується біциклічних азотовмісних сполук та їх застосування як протибактерійних засобів. UA 99440 C2 5 10 Даний винахід стосується нових сполук, композицій, що містять такі сполуки, та їх застосування як протибактерійних засобів, що включає лікування туберкульозу. WO02/08224, WO02/50061, WO02/56882, WO02/96907, WO2003087098, WO2003010138, WO2003064421, WO2003064431, WO2004002992, WO2004002490, WO2004014361, WO2004041210, WO2004096982, WO2002050036, WO2004058144, WO2004087145, WO06002047, WO06014580, WO06010040, WO06017326, WO06012396, WO06017468, WO06020561, WO01/25227, WO02/40474, WO02/07572, WO2004035569, WO2004089947, WO04024712, WO04024713, WO04087647, WO2005016916, WO2005097781, WO06010831, WO04035569, WO04089947, WO06021448, WO06032466, WO06038172, WO06046552, WO06134378 і WO06137485 розкривають похідні хіноліну, нафтиридину, морфоліну, циклогексану, піперидину й піперазину, що мають протибактерійну активність. Даний винахід пропонує сполуку формули (I) або її фармацевтично прийнятні сіль, сольват або N-оксид: 15 20 25 де: 1 2 3 4 1с 1с два з Z , Z , Z і Z незалежно означають CR або N, а решта незалежно означають CR ; 3 4 1 2 1с або Z і Z разом означають S, один з Z і Z означає CR або N, а інший незалежно означає 1с CR ; 1a 1b 1c R , R і R незалежно вибрані з групи, що включає водень; галоген; ціано; (C 1-6)алкіл; (C16)-алкілтіо; трифторметил; трифторметокси; карбокси; гідрокси, необов'язково заміщений (C 1або (C1-6)алкокси-заміщений(C1-6)алкіл; (C1-6)алкокси-заміщений(C1-6)алкіл; 6)алкілом, гідрокси(C1-6)алкіл; аміногрупу, необов'язково N-заміщену однією або двома (C1-6)алкільними, формільними, (C1-6)алкіл-карбонільними або (C1-6)алкілсульфонільними групами; або 1a 1b 1c амінокарбоніл, аміногрупа якого необов'язково заміщена (C1-4) алкілом; або два з R , R і R на сусідніх атомах вуглецю можуть разом утворювати етилендіоксильну групу; 2 6 R означає водень або (C1-4) алкіл, або разом з R утворює Y, визначений нижче; A означає групу (i): 30 3 35 1a у якій: R має таке саме визначення, як і R , R дорівнює 1 або 2: або A означає групу (ii) 1 1b 1c і R , або означає оксо або амінометил, а n UA 99440 C2 1 5 10 2 3 4 8 2 3 4 8 1 3 W , W і W означають CR R , або W і W означають CR R , а W означає зв'язок між W і N. 4 8 6 X означає O, CR R або NR ; 4 1a 1b 1c 8 один R має таке саме визначення, як і R , R і R , а решта й R означають водень, або 4 8 один R і R разом означають оксо, а решта означають водень; 6 2 R означає водень або (C1-6)алкіл; або разом з R утворює Y; 7 R означає водень; галоген; гідрокси, необов'язково заміщений (C 1-6)алкілом; або (C1-6)алкіл; 4 8 4 8 4 8 4 8 4 8 Y означає CR R CH2; CH2CR R ; (C=O); CR R ; CR R (C=O); або (C=O)CR R ; або, якщо Х 4 8 8 7 означає CR R , R і R разом означають зв'язок; U вибраний з CO і CH2, і 5 R означає необов'язково заміщену біциклічну карбоциклічну або гетероциклічну систему (B): 15 20 25 30 35 40 45 що містить до чотирьох гетероатомів у кожному циклі, де щонайменше один з циклів (a) і (b) є ароматичним; 1 14 X означає C або N, якщо він є частиною ароматичного циклу, або CR , якщо він є частиною неароматичного циклу; 2 13 14 X означає N, NR , О, S(O)X, CO або CR , якщо він є частиною ароматичного або 14 15 неароматичного циклу, або він також може означати CR R , якщо є частиною неароматичного циклу; 3 5 X і X незалежно означають N або C; 1 Y означає лінкерну групу, що містить від 0 до 4 атомів, кожен з яких незалежно вибраний з 13 14 N, NR , O, S(O)X, CO і CR , якщо він є частиною ароматичного або неароматичного циклу, або 14 15 також може означати CR R , якщо він є частиною неароматичного циклу; 2 2 Y означає лінкерну групу, що містить від 2 до 6 атомів, причому кожен атом Y незалежно 13 14 вибраний з N, NR , O, S(O)X, CO, CR , якщо він є частиною ароматичного або неароматичного 14 15 циклу, або також може означати CR R , якщо він є частиною неароматичного циклу; 14 15 кожен з R і R незалежно вибраний з: H; (C1-4)алкілтіо; галогену; карбокси(C1-4)алкілу; (C1)-алкілу; (C1-4)алкоксикарбонілу; (C1-4)алкілкарбонілу; (C1-4)алкокси(C1-4)алкілу; гідрокси; 4 гідрокси(C1-4)-алкілу; (C1-4)алкокси; нітро; ціано; карбокси; аміно або амінокарбонілу, необов'язково моно- або дизаміщеного (C1-4) алкілом; або 14 15 R і R можуть разом означати оксо; 13 кожен R незалежно означає H; трифторметил; (C1-4)алкіл, необов'язково заміщений гідрокси, (C1-6)алкокси, (C1-6)алкілтіо, галогеном або трифторметилом; (C2-4)алкеніл; (C14)алкоксикарбоніл; (C1-4)-алкілкарбоніл; (C1-6)алкілсульфоніл; амінокарбоніл, де аміногрупа необов'язково є моно- або дизаміщеною (C1-4) алкілом; кожен Х незалежно означає 0, 1 або 2. Далі даний винахід пропонує сполуку формули (I), що відрізняється від сполуки, де: 3 4 1 2 1с Z і Z разом означають S, а один з Z і Z означає CR або N, а інший незалежно означає 1с CR ; і/або 3 R означає амінометил; або її фармацевтично прийнятні сіль, сольват або N-оксид. Даний винахід також пропонує спосіб лікування бактерійних інфекцій, у тому числі туберкульозу, у ссавців, особливо в людини, яка включає введення ссавцеві, що потребує такого лікування, ефективної кількості сполуки формули (I), або її фармацевтично прийнятних солі, сольвату або N-оксиду. 2 UA 99440 C2 5 Даний винахід також пропонує застосування сполуки формули (I), або її фармацевтично прийнятних солі, сольвату або N-оксиду, у виробництві лікарського засобу для лікування бактерійних інфекцій, у тому числі, туберкульозу, у ссавців. Даний винахід також пропонує фармацевтичну композицію, що містить сполуку формули (I), або її фармацевтично прийнятні сіль, сольват або N-оксид, і фармацевтично прийнятний носій. Далі даний винахід пропонує сполуку формули (IA), або її фармацевтично прийнятні сіль, сольват або N-оксид: 10 15 де: 1 2 3 1с 1с два з Z , Z і Z незалежно означають CR або N, а решта незалежно означають CR ; 4 Z означає CH; 1a R означає водень, галоген, ціано або гідрокси, заміщений (C1-6)алкілом; 1b R означає водень; 3 1c 1c Якщо Z означає CR , то R означає водень; 1 2 1c 1c Якщо Z або Z означає CR , то R означає водень; 2 R означає водень; A означає групу (ia): 20 3 у якій: R означає водень або гідрокси, а n дорівнює 1; або A означає групу (ii) 25 1 30 35 2 3 W , W і W означають CH2; 2 3 1 3 або W і W означають CH2, а W означає зв'язок між W і N. 4 8 X означає O, або CR R ; 4 R означає водень або гідрокси; 8 R означає водень; 7 R означає водень; U вибраний з CO і CH2, і 5 R означає необов'язково заміщену біциклічну гетероциклічну систему (B): 3 UA 99440 C2 5 10 15 20 що містить до чотирьох гетероатомів у кожному циклі, де цикл (a) є ароматичним, а цикл (b) може бути ароматичним або неароматичним; 1 X означає C; 2 14 X означає N, O, S або CR ; 3 5 X і X обидва означають C; 1 Y означає лінкерну групу, що містить 1 або 2 атоми, кожен з яких незалежно вибраний з N і 14 CR ; 2 2 Y означає лінкерну групу, що містить 3 або 4 атоми, причому кожен атом Y незалежно 13 14 14 15 вибраний з NR , O, S, CO, або i) CR , якщо він є частиною ароматичного циклу, або ii) CR R , якщо він є частиною неароматичного циклу; 14 15 кожен з R і R незалежно вибраний з: H або галогену; і 13 R означає H; або (C1-4) алкіл. 1 2 3 У окремому аспекті, що стосується формули (IA), один або два з Z , Z і Z означають N. 1a У окремому аспекті, що стосується формули (IA), R означає водень, галоген або гідрокси, 1a заміщений (C1-6)алкілом. У іншому аспекті, що стосується формули (IA), R означає водень, 1a фтор або метокси. В наступному аспекті, що стосується формули (IA), R означає метокси. У окремому аспекті, що стосується формули (IA), A означає групу (ia): 3 25 30 35 40 45 у якій: R означає водень або гідрокси, а n дорівнює 1. 5 У окремому аспекті, що стосується R у формулі (IA): 2 14 14 X означає N або CR , де R вибраний з водню або галогену, наприклад хлору; й 1 14 Y означає лінкерну групу, що містить 2 атоми, кожен з яких незалежно вибраний з N і CR , 1 за умови, що обидва атоми Y не означають N. 5 2 У окремому аспекті, що стосується R у формулі (IA), Y означає лінкерну групу, що містить 4 атоми, яка є -NR-C(O)-CH2-Q-, де Q вибраний з O, S і CH2. 5 2 У окремому аспекті, що стосується R у формулі (IA), Y відрізняється від -O-CH2-CH2-O-. У окремих аспектах: 1 2 3 4 1c (1) кожен з Z , Z , Z і Z незалежно означає CR ; 1 2 3 4 1c (2) Z означає N, а кожен з Z , Z і Z незалежно означає CR ; 2 1 3 4 1c (3) Z означає N, а кожен з Z , Z і Z незалежно означає CR ; 3 1 2 4 1c (4) Z означає N, а кожен з Z , Z і Z незалежно означає CR ; 1 3 2 4 1c (5) Z і Z означають N, а Z і Z незалежно означають CR ; 2 3 1 4 1c (6) Z і Z означають N, а Z і Z незалежно означають CR ; 3 4 1 2 1c (7) Z і Z означають N, а Z і Z незалежно означають CR ; 3 4 1 4 1c (8) Z і Z разом означають S, а Z і Z незалежно означають CR ; 3 4 1 1c 4 (9) Z і Z разом означають S, Z означає CR , а Z означає N; 1 2 3 4 1c (10) Z і Z означають N, а Z і Z незалежно означають CR . 1a 1b 1c У окремому аспекті кожен R , R і R незалежно означає водень, (C1-4) алкокси, (C1-4) алкілтіо, (C1-4)алкіл, ціано, карбокси, гідроксиметил або галоген; переважніше, водень, метокси, метил, етил, ціано або галоген. 1a 1b 1c У деяких втіленнях лише одна група з R , R або R відрізняється від водню. В окремому 1a 1b 1c втіленні R означає метокси, ціано або галоген, такий як фтор, хлор або бром, а R або R 1b означають водень. У альтернативному втіленні R означає групу, відмінну від водню, наприклад фтор. 4 UA 99440 C2 1a 5 10 15 20 25 30 35 1b 1c 1a У інших втіленнях дві групи R , R або R відрізняються від водню. Переважно, R означає 1b 1c фтор, а R або R означає групу, відмінну від водню, наприклад фтор, етил або метокси. 1 1c 1a 1c У наступних втіленнях Z означає R , а R і R разом утворюють етилендіоксильну групу. 2 У окремому аспекті R означає водень. 3 Конкретні приклади R включають водень; необов'язково заміщений гідрокси; необов'язково заміщений аміно; галоген; (C1-4)алкіл; 1-гідрокси-(C1-4)алкіл; необов'язково заміщений 3 амінокарбоніл. Переважніше, групи R включають водень; CONH2; 1-гідроксіалкіл, наприклад CH2OH; необов'язково заміщений гідрокси, наприклад метокси; необов'язково заміщений аміно; 3 й галоген, особливо фтор. Найпереважніше R означає водень або гідрокси. 3 У окремому аспекті, якщо A означає (ia), n дорівнює 1. У наступному аспекті R знаходиться в 3 або 4 положенні, переважніше, в 3 положенні. В переважнішому аспекті A означає (ia), n 3 дорівнює 1, а R знаходиться в 3 положенні, переважніше, в цис-положенні по відношенню до групи NR2. 3 У окремих втіленнях A означає групу (ia), в якій n рівний 1, а R означає водень або гідрокси. Переважніше, якщо A означає 3-гідроксипіперидин-4-іламіно, має місце конфігурація (3R, 4S). 4 8 8 4 У окремому аспекті, якщо A означає (ii), Х означає CR R , R означає H, а R означає H або 4 ОН. Переважніше, якщо R означає ОН, він знаходиться в трансі-положенні по відношенню до 7 1 7 R . У наступному аспекті W означає зв'язок. У іншому аспекті R означає H. У додатковому 1 2 3 7 аспекті W означає зв'язок, W і W обидва означають CH2, а R означає H. Якщо A означає 3гідроксипіролідин-4-ілметил, в окремому аспекті конфігурація є (3S,4S). 4 8 8 4 1 2 У окремому аспекті, якщо A означає (ii) означає CR R , R означає H, R означає ОН, W , W 3 7 4 і W всі означають CH2, а R означає H, A є 4-гідроксипіперидин-3-ілметил. Переважніше, R 7 означає ОН і знаходиться в трансі-положенні по відношенню до R , який означає H. 7 1 2 3 У окремому аспекті, якщо A означає (ii), Х означає O, R означає H, а кожен з W , W і W означає CH2. У деяких втіленнях U означає CH2. 5 У деяких втіленнях R означає ароматичну гетероциклічну систему (B), що містить 8-11 13 циклічних атомів, у тому числі, 2-4 гетероатоми, з яких, щонайменше, один є N або NR , і де в 2 окремих втіленнях Y містить 2-3 гетероатоми, один з яких є S, а 1-2 є N, причому один N 3 пов'язаний з X . У альтернативних втіленнях гетероциклічна система (B) містить ароматичний цикл (a), вибраний з необов'язково заміщених бензо, піридo, піридазинo й піримідинo, і неароматичний 2 цикл (b), а Y містить 3-4 атоми, в тому числі, щонайменше, один гетероатом, причому O, S, CH 2 13 5 13 3 або NR пов'язані з X , де R відрізняється від водню, і або NHCO зв'язаний через N з Х , або 3 O, S, CH2 або NH пов'язані з Х . У окремому аспекті цикл (a) містить ароматичний атом азоту, переважніше, циклом (a) є піридин, піразин або піримідин. 5 У деяких втіленнях R означає: 40 45 50 55 де: означає точку приєднання; 3 Y означає CH2 або O; і 10 10 R незалежно вибраний з водню, галогену, (C1-6)алкілу і (C1-6)алкокси. Переважніше, R вибраний з водню, хлору, метилу й метокси. Приклади циклів (B) включають необов'язково заміщені: (a) і (b) ароматичні 1H-піроло[2,3-b]піридин-2-іл, 1H-піроло[3,2-b]піридин-2-іл, 3H-імідазо[4,5-b]пірид-2-ил, 3Hхіназолін-4-он-2-іл, бензимідазол-2-іл, бензо[1,2,3]тіадіазол-5-іл, бензо[1,2,5]оксадіазол-5-іл, бензофур-2-ил, бензотіазол-2-іл, бензо[b]тіофен-2-іл, бензоксазол-2-іл, хромен-4-он-3-іл, імідазо[1,2-а]піридин-2-іл, імідазо-[1,2-а]-піримідин-2-іл, індол-2-іл, індол-6-іл, ізохінолін-3-іл [1,8]-нафтиридин-3-іл, оксазоло[4,5-b]піридин-2-іл, хінолін-2-іл, хінолін-3-іл, хіноксалін-2-іл, нафталін-2-іл, 1,3-діоксоізоіндол-2-іл, бензимідазол-2-іл, 1H-бензотріазол-5-іл, 1H-індол-5-іл, 3H-бензооксазол-2-он-6-іл, 3H-бензооксазол-2-тіон-6-іл, 3H-бензотіазол-2-он-5-іл, 3H-хіназолін4-он-6-іл, бензо[1,2,3]тіадіазол-6-іл, бензо[1,2,5]тіадіазол-5-іл, бензо[1,4]оксазин-2-он-3-іл, 5 UA 99440 C2 5 бензотіазол-5-іл, бензотіазол-6-іл, цинолін-3-іл, імідазо[1,2-а]піридазин-2-іл, піразоло[1,5а]піразин-2-іл, піразоло[1,5-а]піридин-2-іл, піразоло[1,5-а]піримідин-6-іл, піразоло[5,1с][1,2,4]триазин-3-іл, піридo[1,2-а]піримідин-4-он-2-іл, піридo[1,2-а]піримідин-4-он-3-іл, хіназолін2-іл, хіноксалін-6-іл, тіазолo[3,2-а]піримідин-5-он-7-іл, тіазолo[5,4-b]піридин-2-іл, тієно[3,2b]піридин-6-іл, тіазолo[5,4-b]піридин-6-іл, тіазолo[4,5-b]піридин-5-іл, [1,2,3]тіадіазолo[5,4b]піридин-6-іл, 2H-ізохінолін-1-он-3-іл 10 15 означає точку приєднання; (a) неароматичний (2S)-2,3-дигідро-1H-індол-2-іл, (2S)-2,3-дигідробензо[1,4]діоксин-2-іл, 3-(R,S)-3,4-дигідро-2Hбензо[1,4]тіазин-3-іл, 3-(R)-2,3-дигідро[1,4]діоксино[2,3-b]піридин-3-іл, 3-(S)-2,3дигідро[1,4]діоксино[2,3-b]піридин-3-іл, 2,3-дигідробензо[1,4]діоксан-2-іл, 3-заміщений 3Hхіназолін-4-он-2-іл 6 UA 99440 C2 5 10 15 20 25 означає точку приєднання; (b) неароматичний 6 1,1,3-триоксо-1,2,3,4-тетрагідро-1/ -бензо[1,4]тіазин-6-іл, бензо[1,3]діоксол-5-іл, 2,3дигідробензо[1,4]діоксин-6-іл, 3-заміщений 3H-бензооксазол-2-он-6-іл, 3-заміщений 3Hбензооксазол-2-тіон-6-іл, 3-заміщений 3H-бензотіазол-2-он-6-іл, 4H-бензо[1,4]оксазин-3-он-6-іл (3-оксо-3,4-дигідро-2H-бензо[1,4]оксазин-6-іл), 4H-бензо[1,4]тіазин-3-он-6-іл (3-оксо-3,4-дигідро2H-бензо[1,4]тіазин-6-іл), 4H-бензо[1,4]оксазин-3-он-7-іл, 4-оксо-2,3,4,5-тетрагідробензо[b][1,4]тіазепін-7-іл, 5-оксо-2,3-дигідро-5H-тіазолo[3,2-а]піримідин-6-іл, 1H-піридo[2,3b][1,4]тіазин-2-он-7-іл, (2-оксо-2,3-дигідро-1H-піридo[2,3-b][1,4]тіазин-7-іл), 2,3-дигідро-1Hпіридo[2,3-b][1,4]тіазин-7-іл, 2-оксо-2,3-дигідро-1H-піридo[3,4-b]тіазин-7-іл, 2,3дигідро[1,4]діоксино[2,3-b]піридин-6-іл, 2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-іл, 2,3дигідро[1,4]діоксино[2,3-b]піридин-7-іл, 3,4-дигідро-2H-бензо[1,4]оксазин-6-іл, 3,4-дигідро-2Hбензо[1,4]тіазин-6-іл, 3-оксо-3,4-дигідро-2H-піридo[3,2-b][1,4]оксазин-6-іл, 3,4-дигідро-2Hпіридo[3,2-b][1,4]тіазин-6-іл, 3-оксо-3,4-дигідро-2H-піридo[3,2-b][1,4]тіазин-6-іл, 3,4-дигідро-1Hхінолін-2-он-7-іл, 3,4-дигідро-1H-хіноксалін-2-он-7-іл, 6,7-дигідро-4H-піразоло[1,5-а]піримідин-5он-2-іл, 1,2,3,4-тетрагідро-[1,8]нафтиридин-7-іл, 2-оксо-3,4-дигідро-1H-[1,8]нафтиридин-6-іл, 6оксо-6,7-дигідро-5Н-8-тіа-1,2,5-триазанафталін-3-іл, 2-оксо-2,3-дигідро-1Н-піридo[3,4b][1,4]оксазин-7-іл, 2-оксо-2,3-дигідро-1H-піридo[2,3-b][1,4]оксазин-7-іл, 6,7дигідро[1,4]діоксино[2,3-d]піримідин-2-іл, [1,3]оксатіоло[5,4-с]піридин-6-іл, 3,4-дигідро-2Hпірано[2,3-с]піридин-6-іл, 2,3-дигідро[1,4]оксатиїно[2,3-с]піридин-7-іл, 6,7дигідро[1,4]діоксино[2,3-с]піридазин-3-іл, 6,7-дигідро[1,4]оксатиїно[2,3-с]піридазин-3-іл, 6,7дигідро-5Н-пірано[2,3-с]піридазин-3-іл, 5,6-дигідрофуро[2,3-с]піридазин-3-іл, 2,3дигідрофуро[2,3-с]піридин-5-іл, 2-заміщений 1H-піримідо[5,4-b][1,4]оксазин-7(6H)-он, 2заміщений 5,6-дигідропіридo[2,3-d]піримідин-7(1H)-он, 7-заміщений 2Н-хромен-2-он, 7заміщений 2H-пірано[2,3-b]піридин-2-он, 2-заміщений 6,7-дигідро-5H-пірано[2,3-d]піримідин, 8заміщений 2H-піридo[1,2-а]піримідин-2-он, 2,3-дигідро-1-бензофуран-5-іл. 30 7 UA 99440 C2 5 10 15 означає точку приєднання; 13 У деяких втіленнях R означає Н, якщо він знаходиться в циклі (a), або також (C 1-4)алкіл, 13 такий як метил або ізопропіл, якщо він знаходиться в циклі (b). Переважніше, в циклі (b) R 13 3 13 5 означає Н, якщо NR пов'язаний з X , і (C1-4) алкіл, якщо NR пов'язаний з X . 14 15 У інших втіленнях R і R незалежно вибрані з водню, галогену, гідрокси, (C1-4) алкілу, (C115 означає водень. 4)-алкокси, нітро й ціано. Переважніше R 14 Переважніше, кожен R вибраний з водню, хлору, фтору, гідрокси, метилу, метокси, нітро й 14 ціано. Ще переважніше, R вибраний з водню, фтору або нітро. 14 15 Найпереважніше, кожен з R і R означає H. 5 Конкретні групи R включають: [1,2,3]тіадіазолo[5,4-b]піридин-6-іл 1H-піроло[2,3-b]піридин-2-іл 2,3-дигідро[1,4]діоксино[2,3-b]піридин-6-іл 2,3-дигідро[1,4]діоксино[2,3-b]піридин-7-іл 2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-іл 2,3-дигідробензо[1,4]діоксин-6-іл 8 UA 99440 C2 5 10 15 20 25 30 35 40 45 50 2-оксо-2,3-дигідро-1H-піридo[2,3-b][1,4]оксазин-7-іл 2-оксо-2,3-дигідро-1H-піридo[2,3-b][1,4]тіазин-7-іл 3,4-дигідро-2H-бензо[1,4]оксазин-6-іл 3-метил-2-оксо-2,3-дигідробензооксазол-6-іл 3-оксо-3,4-дигідро-2H-бензо[1,4]оксазин-6-іл 3-оксо-3,4-дигідро-2H-піридo[3,2-b][1,4]оксазин-6-іл (6-заміщений 2H-піридo[3,2b][1,4]оксазин-3(4H)-он) 3-оксо-3,4-дигідро-2Н-бензо[1,4]тіазин-6-іл (4Н-бензо[1,4]тіазин-3-он-6-іл) 4-оксо-4H-піридo[1,2-а]піримідин-2-іл 6-нітробензо[1,3]діоксол-5-іл 7-фтор-3-оксо-3,4-дигідро-2H-бензо[1,4]оксазин-6-іл 8-гідрокси-1-оксо-1,2-дигідроізохінолін-3-іл 8-гідроксихінолін-2-іл бензо[1,2,3]тіадіазол-5-іл бензо[1,2,5]тіадіазол-5-іл бензотіазол-5-іл тіазолo-[5,4-b]піридин-6-іл 3-оксо-3,4-дигідро-2H-піридo[3,2-b][1,4]тіазин-6-іл (6-заміщений 2H-піридo[3,2-b][1,4]тіазин3(4H)-он) 7-хлор-3-оксо-3,4-дигідро-2H-піридo[3,2-b][1,4]тіазин-6-іл 7-хлор-3-оксо-3,4-дигідро-2H-піридo[3,2-6][1,4]оксазин-6-іл (6-заміщений 7-хлор-2Hпіридo[3,2-b][1,4]оксазин-3(4H)-он) 7-фтор-3-оксо-3,4-дигідро-2H-піридo[3,2-b][1,4]тіазин-6-іл 2-оксо-2,3-дигідро-1H-піридo[3,4-b][1,4]тіазин-7-іл [1,3]оксатіоло[5,4-с]піридин-6-іл 3,4-дигідро-2H-пірано[2,3-с]піридин-6-іл 2,3-дигідро-5-карбонітро-1,4-бензодіоксин-7-іл (7-заміщений 2,3-дигідро-1,4-бензодіоксин-5карбонітрил) 2,3-дигідро[1,4]оксатиїно[2,3-с]піридин-7-іл 2,3-дигідро-1-бензофуран-5-іл 6,7-дигідро[1,4]діоксино[2,3-с]піридазин-3-іл 6,7-дигідро[1,4]оксатиїно[2,3-с]піридазин-3-іл 6,7-дигідро-5Н-пірано[2,3-с]піридазин-3-іл 5,6-дигідрофуро[2,3-с]піридазин-3-іл 2-заміщений 1H-піримідо[5,4-b][1,4]оксазин-7(6H)-он 2-заміщений 4-хлор-1H-піримідо[5,4-b][1,4]оксазин-7(6H)-он 2-заміщений 5,6-дигідропіридo[2,3-d]піримідин-7(1H)-он 2-заміщений 4-хлор-5,6-дигідропіридo[2,3-d]піримідин-7(1H)-он 2-заміщений 4-метил-5,6-дигідропіридo[2,3-d]піримідин-7(1H)-он 2-заміщений 4-метилокси-5,6-дигідропіридo[2,3-d]піримідин-7(1H)-он 7-заміщений 2H-хромен-2-он 7-заміщений 2H-пірано[2,3-b]піридин-2-он 4-хлор-6,7-дигідро-5H-пірано[2,3-d]піримідин-2-іл 8-заміщений 2H-піридo[1,2-а]піримідин-2-он 6,7-дигідро-5H-пірано[2,3-d]піримідин-2-іл 5-хлор-1-бензотіофен-2-іл 6-хлор-1-бензотіофен-2-іл 1-бензотіофен-5-іл 1-метил-1H-1,2,3-бензотриазол-6-іл імідазо[2,1-b][1,3]тіазол-6-іл 4-метил-3,4-дигідро-2H-1,4-бензоксазин-7-іл 1-метил-1H-індол-2-іл 9 UA 99440 C2 5 10 означає точку приєднання; особливо 6-заміщений 2H-піридo[3,2-b][1,4]оксазин-3(4H)-он 2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-іл [1,3]оксатіоло[5,4-с]піридин-6-іл 3,4-дигідро-2H-пірано[2,3-с]піридин-6-іл 6-заміщений 2H-піридo[3,2-6][1,4]тіазин-3(4H)-он 6-заміщений 7-хлор-2H-піридo[3,2-b][1,4]оксазин-3(4H)-он 6,7-дигідро[1,4]діоксино[2,3-с]піридазин-3-іл 6,7-дигідро[1,4]оксатиїно[2,3-с]піридазин-3-іл 2-заміщений 1H-піримідо[5,4-b][1,4]оксазин-7(6H)-он 2-заміщений 5,6-дигідропіридo[2,3-d]піримідин-7(1H)-он 10 UA 99440 C2 5 10 15 20 25 30 35 40 45 50 означає точку приєднання. У даному описі термін "алкіл" включає групи з лінійними або розгалуженими ланцюгами, наприклад метил, етил, н-пропіл, ізо-пропіл, н-бутил, ізо-бутил, втор-бутил, т-бутил, пентил і гексил. Термін "алкеніл" слід інтерпретувати аналогічним чином. Термін галоген включає фтор, хлор, бром і йод. Галогеналкільні фрагменти містять 1-3 атоми галогенів. Сполуки даного винаходу містять гетероциклільну групу й можуть існувати у вигляді двох або більш таутомерних форм, залежно від природи гетероциклільної групи; всі вказані таутомерні форми входять в обсяг даного винаходу. Деякі сполуки даного винаходу можна одержати шляхом кристалізації або перекристалізації з розчинників, таких як водні й органічні розчинники. В таких випадках можуть утворюватися сольвати. В обсяг даного винаходу входять стехіометричні сольвати, в тому числі гідрати, а також сполуки, що містять різні кількості води, які можуть утворюватися в результаті обробки, як-от ліофілізація. Крім того, слід розуміти, що такі фрази, як "сполука формули (I), або її фармацевтично прийнятні сіль, сольват або N-оксид" охоплюють сполуку формули (I), N-оксид сполуки формули (I), фармацевтично прийнятну сіль сполуки формули (I), сольват формули (I), або їх будь-яке фармацевтично прийнятне поєднання. Так, як необмежуючий приклад, використовуваний у даному документі з метою ілюстрації, "сполука формули (I), або її фармацевтично прийнятна сіль або сольват" може включати фармацевтично прийнятну сіль сполуки формули (I), яка також може існувати у вигляді сольвату. Оскільки сполуки формули (I) призначаються для вживання у фармацевтичних композиціях, очевидно, що в окремих втіленнях вони надаються в практично чистому вигляді, й мають чистоту, яка складає, наприклад, щонайменше 60%, переважно, щонайменше 75%, переважніше, щонайменше 85%, і найпереважніше, щонайменше 98% (% наводяться в масових співвідношеннях). Неочищені препарати сполук можна використовувати для одержання чистіших форм, використовуваних у фармацевтичних композиціях; вказані менш чисті препарати сполук можуть містити, щонайменше 1%, переважно, щонайменше 5%, і, переважніше, від 10 до 59% сполуки формули (I), або її фармацевтично прийнятних солі, сольвату або N-оксиду Конкретні сполуки даного винаходу включають сполуки, згадані в прикладах, а також їхні фармацевтично прийнятні N-оксиди, солі й сольвати. Фармацевтично прийнятні солі вищезазначених сполук формули (I) включають кислотноадитивні солі або солі четвертинного амонію, наприклад, солі сполук і мінеральних кислот, таких як хлористоводнева, бромистоводнева, сірчана, азотна або фосфорна, або органічних кислот, таких як оцтова, фумарова, бурштинова, малеїнова, лимонна, бензойна, птолуолсульфонова, метансульфонова, нафталінсульфонова або винна. Сполуки формули (I) також можуть бути одержані у вигляді N-оксидів. Даний винахід охоплює всі вказані похідні. Деякі сполуки формули (I) можуть існувати у вигляді оптичних ізомерів, наприклад діастереомерів, а також сумішей ізомерів у будь-яких співвідношеннях, наприклад рацемічних сумішей. Даний винахід включає всі вказані форми, особливо чисті ізомерні форми. Різні ізомерні форми можна розділити або відокремити одну від іншої за допомогою традиційних методів, або який-небудь конкретний ізомер можна отримати за допомогою традиційних способів синтезу, або за допомогою стереоспецифічного або асиметричного синтезу. Крім того, деякі сполуки формули (I) можуть існувати у вигляді поліморфних форм, які також входять у обсяг даного винаходу. У наступному аспекті даний винахід пропонує спосіб одержання сполук формули (I), а також їхніх фармацевтично прийнятних солей, сольватів або N-оксидів, указаний спосіб включає взаємодію сполуки формули (II) зі сполукою формули (III): 11 UA 99440 C2 5 10 15 20 25 30 35 40 45 де: 20 5 5 2' 2 R означає UR , або групу, здатну перетворюватися на UR , а R означає R , або групу, 2 1 2 3 4 1a 1b 2 5 здатну перетворюватися на R , де Z , Z , Z , Z , A, R , R , R , U і R мають значення, вказані у 20 2' 5 2 формулі (I), і потім необов'язково, або за необхідністю, перетворення R і R в UR і R , взаємоперетворення деяких варіабельних груп і одержання фармацевтично прийнятних солі, сольвату або N-оксиду. Взаємодією є відновне алкілування (опис способів його здійснення можна знайти, наприклад, у Smith, M.B.; March, J.M. Advanced Organic Chemistry, Wiley-Interscience 2001), його проводять з використанням відповідного відновного реагенту, такого як ціаноборгідрид натрію (в суміші метанол/хлороформ/оцтова кислота), триацетоксиборгідрид або (полістирилметил)триметиламонію ціаноборгідрид. Якщо амін знаходиться у вигляді солі хлористоводневої кислоти, краще забуферювати реакційну суміш надлишком ацетату натрію. Для полегшення утворення проміжного іміну також можна використовувати молекулярні сита 3A. Сполука формули (II) може бути одержана у вигляді напівацеталю. 20 2' Один з R і R може бути N-захисною групою, як-от т-бутоксикарбоніл, бензилоксикарбоніл, 9-флуоренілметилоксикарбоніл або трифторацетил. Таку групу можна видалити декількома способами, добре відомими фахівцям у даній галузі (приклади даних способів можна знайти в "Protective Groups in Organic Synthesis, T.W. Greene and P.G.M. Wuts, Wiley-Interscience, 1999), наприклад, шляхом традиційного кислого гідролізу (наприклад, з використанням сумішей трифтороцтова кислота/дихлорметан, хлористоводнева кислота/дихлорметан/метанол), або в 2 5 суміші карбонат калію/метанол, після чого вільний амін перетворюють на NR UR за допомогою традиційних способів, таких як утворення аміду або сульфонаміду, з використанням ацильної 5 похідної R COW, у разі сполук, де U означає CO, або в яких U означає CH 2, шляхом алкілування 5 алкілгалогенідом R CH2-галогенід у присутності основи, ацилування/відновлення з 5 використанням ацильної похідної R COW, або шляхом відновного алкілування альдегідом 5 R CHO в традиційних умовах (див., наприклад, Smith, M.B.; March, J.M. Advanced Organic Chemistry, Wiley-Interscience 2001). Відповідні умови включають застосування ціаноборгідриду (в суміші метанол/хлороформ/оцтова кислота). Якщо амін (III) знаходиться у вигляді солі хлористоводневої кислоти, для забуферювання реакційної суміші можна використовувати ацетат натрію. Альтернативним відновним засобом є триацетоксиборгідрид натрію. Альтернативно, сполуку формули (III) можна замінити на сполуку H-A-ОН. Після стадії взаємодії зі сполукою (II) гідроксильну групу можна окислювати до циклічного кетону за допомогою відповідного окислюючого засобу, такого як периїодинан Десса-Мартіна (1,1,1трис(ацетилокси)-1,1-дигідро-1,2-бензиодоксол-3-(1H)-он. Кетон піддають взаємодії з аміном 20 2' HN(R )R шляхом традиційного відновного алкілування. 5 Відповідні реагенти, що містять потрібну групу R , включають відомі сполуки, або сполуки, які можна одержати за допомогою відомих способів, див., наприклад, WO02/08224, WO02/50061, WO02/56882, WO02/96907, WO2003087098, WO2003010138, WO2003064421, WO2003064431, WO2004002992, WO2004002490, WO2004014361, WO2004041210, WO2004096982, WO2002050036, WO2004058144, WO2004087145, WO2006014580, WO2004/035569, WO2004/089947, WO2003082835, WO2002026723, WO06002047, WO06010040, WO06017326, WO06012396, WO06017468, WO06020561, WO06132739, WO06134378, WO06137485 і EP0559285. Сполуку формули (II) можна отримати за допомогою нижченаведеної схеми 1 12 UA 99440 C2 5 Сполуку формули (IV) можна отримати шляхом алілування сполук типу (V) в традиційних умовах (див., наприклад, Smith, M.B.; March, J.M. Advanced Organic Chemistry, Wiley-Interscience 2001). Перетворення (IV) на (II) можна здійснити шляхом обробки озоном або тетраоксидом осмію й періодатом натрію в традиційних умовах (див., наприклад, Smith, M.B.; March, J.M. Advanced Organic Chemistry, Wiley-Interscience 2001). Сполуку формули (IV) також можна отримати за допомогою нижченаведеної схеми 2: 10 15 Перетворення сполуки формули (VII) на четвертинну сіль (VI) можна здійснити шляхом обробки алілйодидом у традиційних умовах (див., наприклад, Smith, M.B.; March, J.M. Advanced Organic Chemistry, Wiley-Interscience 2001). Потім можна отримати сполуку (IV) шляхом окислення сполуки (VI) з використанням K3[Fe(CN)6] (див., наприклад, Baxter, P.N.W.; Khoury, R.G.; Lehn, J.M.; Baum, G.; Fenske, D. Chemistry- A European Journal (2000), 6(22), 4140). 1 Сполуки формули (V), в яких Z означає CH, можна отримати за допомогою нижченаведеної схеми 3: 20 25 Бромовмісну похідну (IX) можна гідрувати з використанням Pd/C з одержанням сполуки (VIII). Після деметилування за допомогою HBr отримують сполуку (V). У альтернативному аспекті даний винахід пропонує спосіб одержання сполук формули (I), а також їхніх фармацевтично прийнятних солей, сольватів і N-оксидів, вказаний спосіб включає взаємодію сполуки формули (IIA) зі сполукою формули (IIIA) або (IIIB): 13 UA 99440 C2 5 10 15 20 25 30 де: 2' 2 2 R означає R , або групу, здатну перетворюватися на R , а Y означає H або відхідну групу, 1 2 3 4 1a 1b 2 5 де Z , Z , Z , Z , A, R , R , R , U і R мають значення, вказані у формулі (I), і потім 2' 2 необов'язково, або за необхідністю, перетворення R на R , взаємоперетворення деяких варіабельних груп і одержання фармацевтично прийнятних солі, сольвату або N-оксиду Взаємодією є відновне алкілування, алкілування або ацилування, як описано вище. Сполуку 20 формули (IIA) можна одержати шляхом взаємодії описаних вище сполук формул (II) і (III), де R 1 3 означає водень. Альтернативно сполуку формули (IIA), де Z і Z обидва означають атоми азоту, можна отримати за допомогою нижченаведеної схеми 4: Перетворення сполуки формули (XII) на (XI) здійснюють у традиційних умовах (див., наприклад, Smith, M.B.; March, J.M. Advanced Organic Chemistry, Wiley-Interscience 2001). Потім можна отримати сполуку (X) зі сполуки (XI) шляхом каталітичного гідрування в традиційних умовах (див., наприклад, Smith, M.B.; March, J.M. Advanced Organic Chemistry, Wiley-Interscience 2001). Сполуку (X) можна перетворити на сполуку (IIA) шляхом селективного алкілування етилбромацетатом, термічної циклізації з подальшим окисленням діоксидом магнію або киснем у традиційних умовах (див., наприклад, Smith, M.B.; March, J.M. Advanced Organic Chemistry, Wiley-Interscience 2001). 1 3 Сполуки формули (II), у яких Z і Z обидва означають атоми азоту, можна отримати за допомогою модифікованої схеми 4, в якій сполука формули (XII) взаємодіє з диметилацеталем аміноацетальдегіду. Після каталітичного гідрування, селективного алкілування етилбромацетатом і термічної циклізації отримують диметилацеталь формули (II), який можна перетворити на альдегід (II) шляхом обробки трифтороцтовою кислотою. 1a' 1a 1a 1b 1с 2 5 Перетворення R на R і взаємоперетворення R , R , R , R , A і R здійснюють у 1a' традиційних умовах. Наприклад алкоксикарбоніл R шляхом гідролізу можна перетворити на 1a 1a карбокси R , який, у свою чергу, можна перетворити на амінокарбоніл і ціано R за допомогою 14 UA 99440 C2 1a 5 10 15 20 25 30 35 традиційних способів. Галоген R можна вводити за допомогою традиційних реакцій 1b галогенування, наприклад, хлоровмісну групу можна ввести в R шляхом хлорування хлорсукцинімідом в оцтовій кислоті. Відповідні традиційні захисні групи, які можна видалити зі сполук, що містять необов'язково захищену гідроксильну групу, не викликаючи порушень в останній частині молекули, включають ацильні й алкілсилільні групи. N-захисні групи видаляють традиційними методами. 1a 1b 1с 1a 1b 1с Наприклад метокси R , R або R перетворюють на гідрокси R , R або R шляхом обробки літієм і дифенілфосфіном (загальний спосіб, описаний Ireland et al, J. Amer. Chem. Soc, 1973, 7829) або HBr. Алкілування гідроксильної групи відповідною алкільною похідною, що несе 1a 1b 1с 1a відхідну групу, як-от галогенід, дає заміщений галогеновмісний алкокси R , R або R . R , що 1a перетворюють на інший R традиційними способами, наприклад, на гідрокси, алкілтіол (через тіол) і аміно його перетворюють за допомогою реакцій поєднання, що каталізують металами, наприклад, з використанням міді, як описано в Synlett (2003), 15, 2428-2439 and Angewandte Chemie, International Edition, 2003, 42(44), 5400-5449. 20 2' Сполуки формул HA-N(R )R , (V), (VII) і (IX) є відомими сполуками, або сполуками, які можна отримати за допомогою відомих способів, наприклад хіназолінон і хіназоліни можна отримати стандартними способами, як описано T. A. Williamson in Heterocyclic Compounds, 6, 324 (1957) Ed. R.C.Elderfield. Піридазини можна отримати за допомогою способів, аналогічних описаним у Comprehensive Heterocyclic Chemistry, Volume 3, Ed A.J. Boulton and A. McKillop, а нафтиридини можна отримати за допомогою способів, аналогічних описаним у Comprehensive Heterocyclic Chemistry, Volume 2, Ed A.J.Boulton and A. McKillop. 4-Галогенові похідні, такі як сполука (IX), є комерційно доступними, або їх можна отримати за допомогою відомих у даній галузі способів. Сполуку, що містить бром у 4 положенні, можна одержати з хінолін- або нафтиридин-4-ону шляхом взаємодії з трибромідом фосфору (PBr 3) у ДМФ. 4-Хлорхіназолін отримують з відповідного хіназолін-4-ону шляхом взаємодії з оксихлоридом фосфору (POCl3) або пентахлоридом фосфору, PCl5. 20 2' Сполуки формули HA-N(R )R , (V), (VII) і (IX) описані, наприклад, у WO2004/035569, WO2004/089947, WO02/08224, WO02/50061, WO02/56882, WO02/96907, WO2003087098, WO2003010138, WO2003064421, WO2003064431, WO2004002992, WO2004002490, WO2004014361, WO2004041210, WO2004096982, WO2002050036, WO2004058144, WO2004087145, WO2003082835, WO2002026723, WO06002047, WO06014580, WO06134378 і WO06137485. Як показано на схемі 5, гідроксіамінометилпіролідини формули (III) (A означає (ii), Х означає 4 8 1 2 3 4 7 8 CR R , W означає зв'язок, W і W обидва означають CH2, R і R означають H, а R означає ОН) можна отримати з двічі захищеної хіральної проміжної сполуки (XV), розділеної методом препаративної ВЕРХ. Бензилоксикарбонільну захисну групу видаляють шляхом гідрування з одержанням сполуки (XIV) і функціональну аміногрупу перетворюють на трифторацетамід (XIII). т-Бутоксикарбонільну (Boc) захисну групу видаляють за допомогою HCl, отримуючи гідрохлорид піролідину (III). 40 15 UA 99440 C2 Проміжну сполуку (XV) можна одержати за допомогою загального способу, показаного на схемі 6: 5 10 Реагенти й умови: (a) Гідрохлорид N-гідроксибензиламіну, параформальдегід, толуол, EtOH, 80°C; (b) Pd(ОН)2, H2 (50 фунт/кв. дюйм), MеOH, кімнатна температура; (c) бензилоксикарбонілсукцинімід, Et3N, дихлорметан, кімнатна температура. 4 8 Відповідно до схеми 7 амінометилпіролідин формули (III) (A означає (ii), Х означає CR R , 1 2 3 4 7 8 W означає зв'язок, W і W обидва означають CH2, всі R , R і R означають H) можна отримати з комерційно доступного Boc-захищеного амінометилпіролідину й перетворити його на трифторацетамід. 15 16 UA 99440 C2 5 Амінометилморфолін, проміжна сполука формули (III) (A означає (ii), Х означає O, кожен з 1 2 3 W , W і W означає CH2), можна одержати з хіральної дихлорбензильної проміжної сполуки (XX) (WO2003082835) (схема 8) шляхом захисту функціональної аміногрупи захисною групою Boc (XIX), з подальшим видаленням дихлорбензильної групи гідруванням з одержанням (III), захистом N-атому морфоліну бензилоксикарбонільною групою (щоб забезпечити можливість очищення хроматографічними методами) (XVIII) і гідруванням з одержанням цільової морфолінової похідної (III). 10 5 3 Спосіб одержання піримідинілоксазинонового елементу R (C), де Y = O, R на схемі 9. 15 17 10 = H) поданий UA 99440 C2 5 10 15 20 Відповідним чином захищені етилгліколят (у даному прикладі THP-захищену сполуку 1) формілують, використовуючи етилформіат і основу, як-от NаH, у ТГФ або діетиловому ефірі. Потім проміжну сполуку форміленолят 2 відразу піддають взаємодії з амідином, у даному випадку (2E)-3-феніл-2-пропенімідамідом 3, отримуючи піримідинон 4. Піримідинон 4 перетворюють на трифторметансульфоновий ефір (5), який, у свою чергу, піддають взаємодії з аміаком у відповідному розчиннику, такому як 1,4-діоксан, з одержанням аміну 6. Потім зі сполуки 6 видаляють THP-захисну групу за допомогою розчину кислоти в метанолі й одержують аміноспирт 7. Після обробки сполуки 7 основою й ефіром галогеноцтової кислоти в спиртному розчиннику, такому як абсолютний етанол, безпосередньо отримують біциклічну проміжну сполуку 8. Таке перетворення можна здійснювати з використанням основи, як-от трет-бутоксид калію, й алкілуючого реагенту етилбромацетату. Як основу, замість описаного тут алкоксиду можна використовувати амін, такий як триетиламін (приклади подібних синтезів описані у N.V. Sazonov and T.S. Safonova, Khimiya Geterotsiklicheskikh Soedinenii, 1971, 1285-1288). Потім отримують цільовий проміжний альдегід 9 шляхом окислювального розщеплювання бічного ланцюга фенілетенілу. Таке розщеплювання можна здійснити, наприклад, шляхом взаємодії сполуки 8 з NaIO4 в суміші 1,4-діоксан-вода, в присутності каталітичної кількості OsO 4. Цільове перетворення також можна здійснити іншими методами, такими як озоноліз. 5 3 10 Піридиндигідропіридоновий альдегід (R (C), де Y = CH2, а R = Cl) можна отримати за способом, поданим на схемі 10. 18 UA 99440 C2 5 10 15 20 У результаті взаємодії диметилмалонату (10) з етилакрилатом (11) отримують складний триефір 12. Конденсація сполуки 12 з (2E)-3-феніл-2-пропенімідамідом (3) у присутності основи дає дигідроксипіримідин 13. Для проведення даного перетворення можна використовувати триетиламін у EtOH, проте переважні умови включають вживання NaOMe в MеOH. Слід зазначити, що в останньому випадку утворюється метиловий складний ефір сполуки 13 (R = Me), тоді як у першому випадку зберігається етиловий складний ефір. Для проведення останніх стадій синтезу можна використовувати будь-який складний ефір, як метиловий, так і етиловий. Після обробки сполуки 13 POCl3 отримують дихлорпіримідин 14. Нагрівання сполуки 14 в герметично закритій пробірці в присутності NH4OH, як правило, дає суміш компонентів 15, 16 і 17 з переважанням сполук 15 і 16. Потім проміжну сполуку 15 можна перетворити на сполуку 16 шляхом обробки K2CO3 у MеOH. Крім того, сполуку 17 можна перетворити на сполуку 15 (R = Et) шляхом обробки етанольним розчином HCl. Одержання альдегіду 18 здійснюють шляхом окислювального розщеплювання олефінового бічного ланцюга сполуки 16 з використанням або OsO4, або NaIO4, або дорогою озонолізу. На схемі 11 показаний відповідний спосіб видалення замісника хлору, присутнього у сполуці 5 3 10 18, з одержанням дез-хлоральдегіду 20 (R (C), де Y = CH2, а R = Н). Щоб здійснити таке видалення, спочатку захищають альдегідну групу сполуки 18 шляхом утворення диметилацеталю з використанням п-толуолсульфонової кислоти (p-TsOH) і MеOH, і отримують сполуку 19. Потім хлор видаляють гідруванням, використовуючи каталізатор PD-C в атмосфері H2. Шляхом обробки водним розчином кислоти, наприклад розчином ТФО у воді, видаляють захист з альдегідної групи, одержуючи сполуку 20. 25 19 UA 99440 C2 5 10 Схема 12 ілюструє спосіб одержання аналогів, що містять альтернативні замісники в 4 5 3 10 положенні піримідинового циклу, наприклад, R (C), де Y = CH2, а R = OMe або Me. Дані аналоги можна отримати з раніше описаної проміжної сполуки 16 за допомогою низки добре відомих способів. На схемі 13 змальований спосіб одержання 4-метоксильних і 4-метильних похідних, проте подібні або інші способи можна використовувати для введення широкого ряду замісників. Як показано нижче, сполуку 16 можна обробити NaOMe в метанолі при нагріванні з оберненим холодильником з одержанням метоксивмісної проміжної сполуки 21A. Сполуку 21B, що містить метильну групу, можна одержати зі сполуки 16 шляхом взаємодії каталізуючого Pd з метилбороновою кислотою. Вільну альдегідну функціональну групу отримують шляхом окислювального розщеплювання олефінового бічного ланцюга за допомогою таких методів, як озоноліз, або шляхом взаємодії з OsO4 і NaIO4, з одержанням сполук 22A і 22B. 15 20 25 30 35 На схемі 13 показано одержання піримідинової оксазинонової альдегідної сполуки, 5 3 10 необхідної для одержання сполук, що містять R (C), де Y =O, а R =Cl, з використанням як вихідної сполуки диметилдіазомалонату (23), за способом Peace, Carman, Wulfman, Synthesis, 658-661 (1971). Взаємодія сполуки 23 з етилгліколятом, що каталізує родієм, дає заміщений малонат 24. Сполуку 25, що містить піримідинову циклічну систему, одержують шляхом взаємодії сполуки 24 з (2E)-3-феніл-2-пропенімідамідом (3) і метоксидом натрію. Проміжну сполуку 25 виділяють у вигляді карбонової кислоти, оскільки метиловий ефір гідролізується за умов взаємодії з метоксидом натрію. Обробка сполуки 25 POCl3 з подальшим додаванням MеOH дає дихлорид-метиловий ефір 26. Заміну одного з атомів хлору на аміак здійснюють шляхом обробки сполуки 26 NH4OH, при цьому також отримують первинний амід, який потім перетворюють на етиловий ефір 27 з використанням HCl і EtOH. Одержання оксазинонового циклу виконують шляхом обробки сполуки 27 основою, як-от K2CO3, в полярному розчиннику, такому як ДМФ. Як правило, для повного перетворення на біциклічну систему 28 потрібне нагрівання. Перетворення на альдегід можна здійснити шляхом окислювального розщеплювання 2-фенілетенільного бічного ланцюга, в даному конкретному прикладі бічного ланцюга сполуки 28, у результаті взаємодії з OsO 4 і NaIO4, з одержанням альдегіду 29. Детальніший опис способів одержання сполук формули (I) можна знайти у прикладах. Протибактеріальні/протитуберкульозні сполуки даного винаходу, що придатні для введення 20 UA 99440 C2 5 10 15 20 25 30 35 40 45 50 55 будь-яким зручним способом і застосовуються в медицині або ветеринарії, можна отримати по аналогії з іншими протибактеріальними/протитуберкульозними сполуками. Фармацевтичні композиції даного винаходу включають композиції, адаптовані для перорального, місцевого або парентерального вживання, які можна використовувати для лікування бактерійної інфекції, в тому числі туберкульозу, у ссавців, включаючи людей. Можна отримати композиції, відповідні для будь-якого способу введення. Композиції можуть знаходитися у вигляді пігулок, капсул, порошків, гранул, пастил, свічок, кремів або рідких препаратів, таких як пероральні або стерильні парентеральні розчини або суспензії. Місцеві композиції даного винаходу можуть бути отримані, наприклад, у вигляді мазей, кремів або лосьйонів, очних мазей і очних або вушних крапель, просочених перев'язувальних засобів і аерозолів, і можуть містити відповідні традиційні добавки, як-от консерванти, розчинники, що полегшують проникнення лікарського засобу, а також пом'якшувальні засоби, що застосовуються для одержання мазей і кремів. Композиції також можуть містити сумісні традиційні носії, такі як основи для кремів або мазей, і етиловий або олеїловий спирт у випадку лосьйонів. Такі носії можуть складати приблизно від 1% до 98% композиції. Частіше вони складають приблизно до 80% композиції. Пігулки й капсули для перорального введення можуть бути уніфікованими лікарськими формами, й можуть містити традиційні носії, такі як сполучні засоби, наприклад патока, гуміарабік, желатин, сорбіт, трагакант або полівінілпіролідон; наповнювачі, наприклад лактоза, цукор, кукурудзяний крохмаль, фосфат кальцію, сорбіт або гліцин; змащувальні засоби для таблетування, наприклад стеарат магнію, тальк, поліетиленгліколь або оксид кремнію; дезінтегруючі засоби, наприклад картопляний крохмаль; або прийнятні зволожуючі засоби, такі як лаурилсульфат натрію. На пігулки можна нанести покриття за допомогою способів, добре відомих у галузі нормальної фармацевтичної практики. Пероральні рідкі препарати можуть знаходитися у вигляді, наприклад, водних або масляних суспензій, розчинів, емульсій, сиропів або еліксирів, або вони можуть бути надані у вигляді сухого продукту, призначеного для розбавлення водою або іншим відповідним середовищем перед вживанням. Такі рідкі препарати можуть містити традиційні добавки, такі як суспендуючі засоби, наприклад сорбіт, метилцелюлоза, сироп глюкози, желатин, гідроксіетилцелюлоза, карбоксиметилцелюлоза, гель стеарату алюмінію або харчові жири, гідруючі, емульгуючі засоби, наприклад лецитин, моноолеат сорбітану або гуміарабік; неводні середовища (які можуть включати харчові олії), наприклад мигдалеву олію, жирні складні ефіри, наприклад гліцерину, пропіленгліколю або етилового спирту; консерванти, наприклад метил або пропіл-п-гідроксибензоат або сорбінова кислота, і, на бажання, традиційні ароматизуючі або забарвлюючі засоби. Свічки можуть містити традиційні основи для свічок, наприклад кокосова олія або інший гліцерид. Рідкі стандартні лікарські форми для парентерального введення отримують з використанням сполуки і стерильного середовища, причому переважним середовищем є вода. Сполуку можна або суспендувати, або розчинити в середовищі, залежно від вигляду використовуваного середовища й концентрації. При одержанні розчинів сполуки можна розчинити у воді для ін'єкцій і стерилізувати фільтруванням, після чого отриманий розчин вносять до відповідного флакона або ампули й герметично закривають. Переважно, щоб у середовищі були розчинені такі засоби, як локальний анестетик, консервант і забуферювальні засоби. Для підвищення стабільності композицію можна заморозити після внесення до флакона й видалити воду під вакуумом. Потім сухий ліофілізований порошок герметично закривають у флаконі й постачають його разом із флаконом, що містить воду для ін'єкцій, щоб відновити рідкий препарат перед вживанням. Парентеральні суспензії отримують практично таким самим способом, за винятком того, що сполуку не розчиняють, а суспендують у середовищі, й тому неможливо виконувати стерилізацію фільтруванням. Сполуку можна стерилізувати шляхом обробки етиленоксидом з подальшим суспендуванням у стерильному середовищі. Щоб забезпечити однорідний розподіл сполуки до складу композиції можна ввести поверхнево-активну речовину або зволожуючий засіб. Композиції можуть містити від 0,1% мас., переважно 10-60% мас., активної речовини, залежно від способу введення. Якщо композиції представлені у вигляді стандартних лікарських форм, кожна форма переважно містить 50-1000 мг активного інгредієнта. Доза, використовувана для лікування дорослих людей, переважно варіює від 100 до 3000 мг на день, наприклад, 1500 мг на день, залежно від способу й частоти введення. Така доза відповідає 1,550 мг/кг на день. Переважно, доза складає від 5 до 30 мг/кг на день. 21 UA 99440 C2 5 10 15 20 25 30 35 40 45 50 55 Сполука формули (I) може входити до складу композицій, як єдиний терапевтичний засіб, або в поєднанні з іншими протибактерійними засобами, що включають протитуберкульозні сполуки. Якщо інший протибактерійний засіб є -лактамом, можна також використовувати інгібітор -лактамази. Сполуку формули (I) можна використовувати для лікування бактерійних інфекцій, що викликаються широкою низкою організмів, що включають як грам-негативні, так і грам-позитивні організми, як-от інфекції верхніх і нижніх дихальних шляхів, інфекції шкіри та м'яких тканин та інфекції сечових шляхів. Сполуки формули (I) також можна використовувати для лікування туберкульозу, що викликається Mycobacterium tuberculosis. Деякі сполуки формули (I) можуть мати активність проти декількох організмів. Таку активність можна визначити за допомогою способів, описаних у даному документі. Нижченаведені приклади ілюструють способи одержання деяких сполук формули (I), а також активність конкретних сполук формули (I) проти різних бактерійних організмів, у тому числі Mycobacterium tuberculosis. ПРИКЛАДИ Й ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Загальні відомості Використовувані в прикладах скорочення: Фунт/кв. дюйм = фунти на квадратний дюйм (1 фунт/кв. дюйм = 0,069 бар) Кт/к.т. = кімнатна температура ES = Мас-спектрометрія з електророзпилюванням РХМС = Рідинна хроматомас-спектрометрія ВЕРХ = Високоефективна рідинна хроматографія (Час утр. стосується часу утримування). Деякі реагенти також мають скорочені назви. ДХМ - дихлорметан, ДМФ - диметилформамід, ДМСО - диметилсульфоксид, MeOH - метанол, ТФО - трифтороцтова кислота, ТГФ тетрагідрофуран, Pd/C – каталізатор паладій на вугіллі. Boc - трет-бутоксикарбоніл. EtOH етанол. dppf 1,1'-біс(дифенілфосфіно)фероцен. EDC гідрохлорид N-[3(диметиламіно)пропіл]етилкарбодиіміду. HOBt - 1-гідроксибензотриазол. 1 Спектри протонного ядерного магнітного резонансу ( H ЯМР) реєструють при 400 або 250 мГц, значення хімічних зрушень наводять у мільйонних долях () по відношенню до внутрішнього стандарту тетраметилсилану (ТМС). У спектрах ЯМР використовують наступні скорочення: с = синглет, д = дублет, т = триплет, кв = квартет, м = мультиплет, дд = подвійний дублет, дт = подвійний триплет, явн = явний, шир = широкий. J означає константу взаємодії ЯМР, вимірювану в Герцах. CDCl3 означає дейтеріохлороформ, ДМСО-d6 означає гексадейтеріодиметилсульфоксид, а CD3OD означає тетрадейтеріометанол. Мас-спектри отримують, використовуючи метод іонізації електророзпилюванням (ES). Усі значення температури вказані в градусах Цельсія. Celite® є допоміжною фільтрувальною речовиною, що складається з обробленого кислотою діатомового кремнезему, і є торговельним знаком Manville Corp., Denver, Colorado. MDAP або Mass directed autoprep = мас-контрольована препаративна ВЕРХ (з використанням мас-спектрометру ZQ (Waters)). Отримання комплексу триетенілбороксин·піридин описане в Kerins, Fergal; O'Shea, Donal F.; J. Org. Chem. (2002) 67(14) 4968. MP-карбонат є макропористим триетиламонію метилполістиролкарбонатом (Argonaut Technologies). Amberlyst® A21 є слабоосновною, макропористою смолою, що містить алкіламінові функціональні групи, ® зареєстрований торговельний знак Rohm & Haas Co. SCX є іонообмінною колонкою, що містить сильну катіонообмінну смолу (бензолсульфонова кислота), що поставляється Varian, USA. Chiralpak IA, Chiralpak AS-H and Chiralcel OD є хіральними колонками для ВЕРХ на основі полісахаридів (Chiral Technologies Inc.). Колонка Chiralpak AS-H містить амілозу трис[(S)-альфа-метилбензилкарбамат), нанесену на частки оксиду кремнію розміром 5 мкм. Колонка Chiralpak IA містить оксид кремнію для препаративних колонок (розмір часток 5 мкм, вн. д. 21 мм×довжина 250 мм), на якому імобілізована амілоза трис(3,5диметилфенілкарбамат). Колонки Chiralpak AD і AD-H містять оксид кремнію для препаративних колонок (розмір часток AD-H 5 мкм і розмір часток AD 10 мкм, вн. д. 21 мм×довжина 250мм; розмір часток AD 20 мкм, вн. д. 101 мм×довжина 250 мм), покритий амілозою трис(3,5диметилфенілкарбамат) (Chiral Technologies USA). Вимірювані значення часу утримування залежать від конкретних умов, що застосовуються в хроматографічних процедурах. Якщо дані значення наводяться нижче в прикладах, вони вказують на порядок елюювання. Реакції, в яких беруть участь гідриди металів, що включають гідрид літію, гідрид літію алюмінію, гідрид діізобутилалюмінію, гідрид натрію, боргідрид натрію, триацетоксиборгідрид натрію, ціаноборгідрид (полістиролметил) триметиламонію, виконують у атмосфері аргону або іншого інертного газу. 22 UA 99440 C2 5 10 15 20 25 30 35 40 45 50 Досвідченим хімікам слід розуміти, що посилання на способи одержання, що наводиться відповідно до загального способу інших способів одержання, може охоплювати варіації стандартних параметрів, таких як час, температура, умови обробки, незначні зміни кількостей реагентів та ін. Приклад 1 1-(2-{4-[(2,3-Дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)аміно]-1піперидиніл}етил)-7-(метилокси)-2(1Н)-хінолінону гідрохлорид (a) 7-(Метилокси) хіноліну Суспензію NаH (3,3 г; 137,93 ммоль) у безводному ДМФ (160 мл) охолоджують до 0°C, перемішуючи в атмосфері аргону. Додають 7-хінолінол (8 г; 55,17 ммоль), розчинений у безводному ДМФ, (320 мл) і суміш перемішують при 0°C в атмосфері аргону протягом 1 год. Потім суміш залишають нагріватися до к.т., додають MеI (7,8 мл; 55,17 ммоль) і реакційну суміш перемішують протягом 1 год. Обережно додають воду з льодом і отриману суміш екстрагують EtOAc (3×500 мл). Органічний шар, отриманий після екстракції, промивають водою (400 мл) і насиченим соляним розчином (400 мл). Отриманий органічний шар сушать MgSO 4 і видаляють розчинники, отримуючи цільову сполуку (8,76 г; 99%) + МС (ES+) m/z 160 (MH ). (b) 7-(Метилокси)-1-(2-пропен-1-іл)хінолінію йодид 7-(Метилокси)хінолін (8,76 г; 55,09 ммоль) і алілйодид (19,72 мл; 110,18 ммоль) нагрівають з оберненим холодильником у толуолі (120 мл) при 95°C протягом 1 год, потім додають ще порцію алілйодиду (9,86 мл; 55,09 ммоль) і температуру реакційної суміші підвищують до 110°C. Ще через 1 год. температуру реакційної суміші підвищують до 120°C і реакцію залишають протікати протягом 0,5 год. Розчинник видаляють у вакуумі, після чого отриману коричневу тверду речовину промивають толуолом і діетиловим ефіром. Отриману тверду речовину сушать у вакуумній печі протягом ночі й отримують цільовий продукт (14,81 г; 82%) + МС (ES+) m/z 201 (MH ). (c) 7-(Метилокси)-1-(2-пропен-1-іл)-2(1H)-хінолінон 7-(Метилокси)-1-(2-пропен-1-іл)хінолінію йодид (14,81 г; 45,43 ммоль), KOH (11,20 г; 199,89ммоль) і K3[Fe(CN)6] (32,78 г; 99,95 ммоль) перемішують у суміші 1:1 вода:1,4-діоксан (400 мл) при к.т. у атмосфері аргону протягом 1 год. До реакційної суміші додають ще KOH (1,1 г; 19,9 ммоль) і K3[Fe(CN)6] (3,28 г; 10,0 ммоль) і перемішують у тих самих умовах протягом ще 0,5 год. Потім додають EtOAc (500 мл) і воду (500 мл). Шари розділяють, після чого об'єднані органічні шари промивають водою й концентрують. Неочищений залишок очищають колонковою хроматографією на силікагелі, використовуючи градієнт 0-5% MеOH/ДХМ, і отримують цільовий продукт (4,90 г; 51%). + МС (ES+) m/z 216 (MH ). (d) [7-(Метилокси)-2-оксо-1(2H)-хінолініл]ацетальдегід 7-(Метилокси)-1-(2-пропен-1-іл)-2(1H)-хінолінон (2 г; 9,3 ммоль) розчиняють у ДХМ (100 мл) і через реакційну суміш при -78°C протягом 30 хвилин барботують O3. Потім протягом 10 хвилин барботують аргон, щоб видалити надлишок O 3, і реакційну суміш гасять диметилсульфідом (2,3 мл, 37,2ммоль). Реакційну суміш залишають нагріватися до к.т. і перемішують ще 20 хвилин. Потім усі розчинники видаляють і отримують цільову сполуку (2,31 г). Альтернативний синтез даного альдегіду описаний у прикладі 52(a)-(e). + МС (ES+) m/z 218 (MH ). (e) 1,1-Диметилетил (2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)(1-{2-[7-(метилокси)-2оксо-1(2H)-хінолініл]етил}-4-піперидиніл)карбамат Розчин [7-(метилокси)-2-оксо-1(2H)-хінолініл]ацетальдегіду (65 мг, 0,3 ммоль) і 1,1диметилетил (2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)4-піперидинілкарбамату (синтез описаний у WO2004/058144, приклад 99(h)) (105 мг, 0,3 ммоль) у хлороформі (3 мл) і MеOH (3 23 UA 99440 C2 5 10 15 20 25 мл) перемішують при к.т. протягом 1 год. Потім суміш обробляють NаBH(OAc) 3 (190,8 мг, 0,9 ммоль) і перемішують при к.т. протягом 0,5 год. Додають 1,1-диметилетил (2,3дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)-4-піперидинілкарбамат (52 мг, 0,15 ммоль) і NаBH(OAc)3 (127 мг, 0,6 ммоль), після чого реакційну суміш перемішують при к.т. протягом 1 години. Потім розчинники видаляють, залишок піддають колонковій хроматографії на силікагелі, елююючи сумішшю 0-10% метанол-ДХМ, і отримують цільову сполуку (92мг, 56%). + МС (ES+) m/z 551 (MH ). (f) Вказана в заголовку сполука До розчину 1,1-диметилетил (2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)(1-{2-[7(метилокси)-2-оксо-1(2H)-хінолініл]етил}-4-піперидиніл)карбамату (92 мг) у хлороформі (1,5 мл) додають 4н HCl у 1,4-діоксані (1,5 мл) і реакційну суміш перемішують при к.т. протягом 1 год. Додають ще порцію 4н HCl у 1,4-діоксані (0,5 мл) і реакційну суміш перемішують при к.т. протягом 0,5 год, після чого розчинники видаляють. Залишок розчиняють у MеOH (25 мл) і обробляють основною смолою Amberlyst A21 до одержання рН 6. Залишок фільтрують і розчинник видаляють; залишок піддають колонковій хроматографії на силікагелі, елююючи сумішшю 0-20% метанол-ДХМ, і отримують вказану в заголовку сполуку у вигляді вільної основи (67 мг, 89%). 1 H ЯМР (250 МГц) δ (CDCl3) 1,72 (м, 2H), 2,06 (м, 2H), 2,38 (т, 2H), 2,76 (т, 2H), 3,15 (м, 2H), 3,80 (шир.с, 1H), 3,90 (с, 2H), 3,95 (с, 3H), 4,28-4,35(м, 4H), 4,50 (т, 2H), 6,51 (д, 1H), 6,82 (дд, 1H), 6,90(с, 1H), 7,01 (д, 1H), 7,45 (д, 1H), 7,59 (д, 1H), 8,09 (с, 1H). + МС (ES+) m/z 451(MH ). Дану речовину перетворюють на гідрохлорид шляхом розчинення в суміші ДХМ/метанол і додавання 1 еквіваленту 4M HCl у 1,4-діоксані з подальшим упарюванням насухо й одержанням жовтої твердої речовини. Приклад 2 1-(2-{4-[(2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)аміно]-1піперидиніл}етил)-7-фтор-2(1Н)-хінолінону гідрохлорид і Приклад 3 1-(2-{4-[(2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)аміно]-1піперидиніл}етил)-5-фтор-2(1H)-хінолінону гідро хлорид 30 35 40 45 50 (a) N-(3-фторфеніл)-3,3-біс(метилокси)пропанамід 3-Фторанілін (50 г, 450 ммоль) розчиняють у толуолі (500 мл) і додають 25% NaOMe в MеOH (120 мл) і метил (2E)-3-(метилокси)-2-пропеноат (57,4 мл, 495 ммоль). Потім суміш нагрівають до 70°C і перемішують при даній температурі протягом 2,5 годин. Розчинник видаляють приблизно до чверті вихідного об'єму, після чого реакційну суміш обробляють NH 4Cl до одержання pH 7 (використовують приблизно 500 мл). До реакційної суміші додають EtOAc, шари розділяють, водний шар екстрагують тричі EtOAc і об'єднані органічні шари сушать MgSO4. Розчинники видаляють і неочищені залишки очищають колонковою хроматографією на силікагелі, використовуючи градієнт 30-50% EtOAc/40-60 петролейний ефір. Фракції, що містять продукт, концентрують і отримують цільову сполуку (40,68 г, 40%) і менш чисту партію (6,17 г, 6%) + + МС (ES ) m/z 228 (MH ). (b) 7-фтор-2(1H)-хінолінон 70% Розчин H2SO4 отримують шляхом додавання охолодженої H2SO4 (35 мл) до охолодженої води (15 мл), підтримуючи температуру в інтервалі 10-20°C. Потім до отриманого розчину обережно додають тонко подрібнений N-(3-фторфеніл)-3,3-біс(метилокси)пропанамід (6,17 г, 27,2 ммоль), тримаючи судину на льоду. Суміш перемішують протягом 1 години і додають воду з льодом (70 мл). Потім додають ще воду (230 мл). Суміш перемішують протягом 24 UA 99440 C2 5 10 15 20 25 30 35 40 45 50 55 ще 30 хвилин. Осад фільтрують, сушать у вакуумній печі протягом ночі й отримують цільовий продукт (3,67 г, 83%). Дана речовина містить приблизно 10% ізомерного 5-фтор-2(1H)хінолінону. + МС (ES+) m/z 164 (MH ). (c) 7-фтор-1-(2-пропен-1-іл)-2(1H)-хінолінон До суспензії 7-фтор-2(1Н)-хінолінону (1,53 г, 9,39 ммоль) у ДМФ при 0°C додають гідрид натрію (0,83 г 60% мас.:мас. дисперсії в олії, 20,65 ммоль), потім реакційну суміш залишають нагріватися до к.т. протягом 0,5 год. і додають алілйодид (1,91 мл, 20,65 ммоль). Реакційну суміш перемішують при к.т. ще 0,25 год, після чого додають воду (100 мл). Водну фазу екстрагують 10% MеOH у ДХМ (3200 мл), об'єднані органічні фази сушать і упарюють, залишок піддають колонковій хроматографії на силікагелі, використовуючи градієнт 10% MеOH у ДХМ, і одержують цільову сполуку (0,91 г, 48%). Дана речовина містить приблизно 10% ізомерного 5фтор-1-(2-пропен-1-іл)-2(1H)-хінолінону. + МС (ES+) m/z 204 (MH ). (d) (7-Фтор-2-оксо-1(2H)-хінолініл)ацетальдегід Розчин 7-фтор-1-(2-пропен-1-іл)-2(1H)-хінолінону (0,909 г, 4,48 ммоль) в 1,4-діоксані (50 мл) і воді (30 мл) при 0°C обробляють періодатом натрію (2,20 г, 10,30 ммоль) і OsO 4 (4% у воді, 5 мл). Реакційну суміш нагрівають до к.т. і перемішують при к.т. протягом 1 год, після чого додають ще 30 мл води, через 1 год. додають іншу порцію періодату натрію (2,20 г, 10,30 ммоль) і через 2 год. наступну порцію періодату натрію (4,20 г, 19,70 ммоль). Потім реакційну суміш перемішують при к.т. протягом 0,5 год, після чого упарюють, обробляють водою й екстрагують ДХМ (×3). Об'єднані органічні шари сушать, упарюють і отримують цільовий продукт (0,50 г, 88%). Дана речовина містить приблизно 10% ізомерного (5-фтор-2-оксо-1(2H)хінолініл)ацетальдегіду. + МС (ES+) m/z 206 (MH ). (e) 1,1-Диметилетил (2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил){1-[2-(7-фтор-2-оксо1(2H)-хінолініл)етил]-4-піперидиніл}карбамат Суміш (7-фтор-2-оксо-1(2H)-хінолініл)ацетальдегіду (123 мг, 0,602 ммоль) і 1,1-диметилетил (2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)4-піперидинілкарбамату (синтез описаний у WO2004/058144, приклад 99(h)) (210 мг, 0,602 ммоль) у хлороформі (5 мл) і MеOH (0,5 мл) перемішують протягом 2 год, після чого додають NаBH(OAc)3 (383 мг, 1,806 ммоль). Реакційну суміш перемішують протягом 0,5 год. і потім додають насичений водний розчин NaHCO 3 (10 мл). Потім реакційну суміш екстрагують 10% MеOH у ДХМ (3×200 мл). Об'єднані органічні фази сушать, упарюють, неочищений залишок очищають хроматографією на силікагелі, використовуючи градієнт 0-10% MеOH/ДХМ, і отримують цільову сполуку (240 мг, 74%). Дана речовина містить приблизно 10% ізомерного 1,1-диметилетил (2,3-дигідро[1,4]діоксино[2,3с]піридин-7-ілметил){1-[2-(5-фтор-2-оксо-1(2H)-хінолініл)етил]-4-піперидиніл}карбамату. + МС (ES+) m/z 539 (MH ). (f) Вказані в заголовку сполуки До розчину 1,1-диметилетил (2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил){1-[2-(7-фтор2-оксо-1(2H)-хінолініл)етил]-4-піперидиніл}карбамату (240 мг, 0,446 ммоль) у хлороформі (5 мл) і MеOH (5мл) додають 4M HCl у 1,4-діоксані (5 мл), після чого реакційну суміш перемішують при к.т. протягом 0,5 год, упарюють і обробляють насиченим водним розчином NaHCO 3 (10 мл). Потім реакційну суміш екстрагують 10% MеOH у ДХМ (3×200 мл). Об'єднані органічні фази сушать, упарюють, неочищений залишок очищають хроматографією на силікагелі, використовуючи градієнт 0-20% MеOH/ДХМ, і отримують 1-(2-{4-[(2,3-дигідро[1,4]діоксино[2,3с]піридин-7-ілметил)аміно]-1-піперидиніл}етил)-7-фтор-2(1H)-хінолінон (178 мг, 91%). Дана речовина містить приблизно 10% ізомерного 1-(2-{4-[(2,3-дигідро[1,4]діоксино[2,3-с]піридин-7ілметил)аміно]-1-піперидиніл}етил)-5-фтор-2(1H)-хінолінону. Дану речовину розділяють методом препаративної ВЕРХ за допомогою декількох введень на колонку luna C18(2) (3 мікрони), елююючи H2O(0,1% ТФО) і CH3CN (0,1% ТФО) зі швидкістю потоку 1,0мл/хвил. з УФ-детекцією при 254 нм, і отримують вказані в заголовку сполуки у вигляді вільних основ 1-(2-{4-[(2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)аміно]-1піперидиніл}етил)-7-фтор-2(1H)-хінолінон (46 мг, чистота 98%) і 1-(2-{4-[(2,3дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)аміно]-1-піперидиніл}етил)-5-фтор-2(1H)-хінолінон (4,6 мг, чистота 98%). Дані для основного ізомеру (1-(2-{4-[(2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)аміно]1-піперидиніл}етил)-7-фтор-2(1H)-хінолінон): + МС (ES+) m/z 439 (MH ). 25 UA 99440 C2 1 5 10 H ЯМР (400 МГц) δ (CDCl3) 1,48-1,55 (2H, м), 1,58-2,00 (2H, м), 2,15-2,28 (2H, м), 2,51-2,71 (3H, м), 2,95-3,08 (2H, м), 3,70 (2H, с), 4,25-4,44 (м, 6H), 6,58-6,62 (1H, м), 6,82 (1H, с), 6,80-6,95 (1H, м), 7,70 (1H, д, J 11 Гц), 7,45-7,55 (1H, м), 7,62 (1H, д, J 10 Гц), 8,09 (с, 1H). Дані для мінорного ізомеру 1-(2-{4-[(2,3-дигідро[1,4]діоксино[2,3-с]піридин-7-ілметил)аміно]1-піперидиніл}етил)-5-фтор-2(1H)-хінолінону + МС (ES+) m/z 439 (MH ). 1 H ЯМР (500 МГц) δ (MEOD) 1,31-1,44 (2H, м), 1,80-1,88 (2H, м), 2,01-2,11 (2H, м), 2,39-2,58 (3H, м), 2,95-3,01 (2H, м), 3,68 (2H, с), 4,15-4,41 (м, 6H), 6,61 (1H, д, J 10 Гц), 6,88 (1H, с), 6,95 (1H, т, J 9 Гц), 7,34 (1H, д, 9 Гц), 7,55 (1H, м), 7,90 (1H, с), 8,00 (1H, д, J 10 Гц). Потім отримані сполуки перетворюють на солі HCl шляхом розчинення в суміші ДХМ/метанол і додавання 1 еквіваленту 4M HCl в 1,4-діоксані з подальшим упарюванням насухо. Приклад 4 7-фтор-1-(2-{4-[([1,3]оксатіоло[5,4-с]піридин-6-ілметил)аміно]-1-піперидиніл}етил)2(1Н)-хінолінону дигідрохлорид 15 20 25 30 35 40 45 50 (a) 1,1-Диметилетил {1-[2-(7-фтор-2-оксо-1(2H)-хінолініл)етил]-4-піперидиніл}карбамат Суміш (7-фтор-2-оксо-1(2Н)-хінолініл)ацетальдегіду (594 мг; 2,89 ммоль) і 1,1-диметилетил 4-піперидинілкарбамату (578 мг; 2,89 ммоль) у суміші хлороформу й метанолу 1:1 (20 мл:20 мл) перемішують при к.т. у атмосфері аргону протягом 1 год. Потім суміш обробляють NаBH(OAc) 3 (1,83 г; 8,67 ммоль) і перемішують при к.т. протягом 1 год. Додають ще 1,1-диметилетил 4піперидинілкарбамат (297 мг; 1,45 ммоль) і реакційну суміш перемішують у тих самих умовах протягом 0,5 год. Потім суміш знову обробляють NаBH(OAc) 3 (915 мг; 4,34 ммоль) і перемішують при к.т. ще 0,75 год. Додають наступну порцію 1,1-диметилетил 4піперидинілкарбамату (118 мг; 0,578 ммоль), після чого реакційну суміш перемішують при к.т. 10 хвилин, додають NаBH(OAc)3 (366 мг; 1,73 ммоль) і перемішують ще 25 хвилин. Розчинники видаляють, неочищений залишок очищають хроматографією на силікагелі, використовуючи градієнт 0-10% MеOH/ДХМ, і отримують неочищену цільову сполуку (1,32 г, 117%) + МС (ES+) m/z 390 (MH ). (b) 1-[2-(4-Аміно-1-піперидиніл)етил]-7-фтор-2(1H)-хінолінон 1,1-диметилетил {1-[2-(7-фтор-2-оксо-1(2H)-хінолініл)етил]-4-піперидиніл}карбамат (1,32 г; 3,39ммоль) розчиняють у суміші хлороформу (10 мл) і HCl (12 мл) і перемішують при к.т. у атмосфері аргону протягом 1 год. Потім солі розчиняють у MеOH і видаляють усі розчинники. Залишки перерозчиняють у MеOH і перемішують з іоннообменною смолою amberlyst до досягнення нейтрального рН. Після фільтрації розчинник видаляють. Неочищений залишок піддають хроматографії на силікагелі, використовуючи градієнт 0-20% 2M NН3:MeОН/ДХМ, і отримують цільову сполуку (632 мг; 64%) + МС (ES+) m/z 290 (MH ). (c) Вказана в заголовку сполука Суміш 1-[2-(4-аміно-1-піперидиніл)етил]-7-фтор-2(1H)-хінолінону (100 мг; 0,364 ммоль) і [1,3]оксатіоло[5,4-с]піридин-6-карбальдегіду (синтез описаний у WO2004058144, Приклад 61) (57 мг; 0,364 ммоль) розчиняють у суміші хлороформу й метанолу 5:1 (5 мл:1 мл) і перемішують при к.т. у атмосфері аргону протягом 1 год. Потім суміш обробляють NаBH(OAc) 3 (231 мг; 1,092 ммоль) і перемішують ще 1 год. Потім розчинники видаляють, неочищені залишки очищають хроматографією на силікагелі, використовуючи градієнт 0-15% MеOH/ДХМ, і отримують вказану в заголовку сполуку у вигляді вільної основи (140 мг; 92%) + МС (ES+) m/z 441 (MH ). δH CDCl3, (400 МГц) 1,68 (м, 2H), 2,01 (с, 2H), 2,04 (с, 3H), 2,34 (т, 2H), 2,74(т, 3H), 3,15 (м, 2H), 3,92 (с, 2H), 4,43 (т, 2H), 5,48 (шир.с, 2H), 5,75 (с, 2H), 6,62 (д, 1H), 6,96 (м, 1H), 7,24 (м, 2H), 7,52 (м, 1H), 7,64 (д, 1H), 8,00 (с, 1H). 26 UA 99440 C2 Отриману сполуку перетворюють на подвійну сіль HCl шляхом розчинення отриманої вільної основи в MеOH і додаваннях 4M HCl в 1,4-діоксані. Потім суміш упарюють насухо. Приклад 5 6-[({1-[2-(7-фтор-2-оксо-1(2Н)-хінолініл)етил]-4-піперидиніл}аміно)метил]-2Нпіридo-[3,2-6][1,4]оксазин-3(4H)-ону дигідрохлорид 5 10 15 20 Вказану в заголовку сполуку отримують за допомогою загального способу, описаного у прикладі 4(d), використовуючи 1-[2-(4-аміно-1-піперидиніл)етил]-7-фтор-2(1H)-хінолінон (100 мг; 0,346 ммоль) і 3-оксо-3,4-дигідро-2H-піридo[3,2-b][1,4]оксазин-6-карбоксальдегід (синтез описаний у WO2003087098, приклад 31(e)) (66 мг; 0,346 ммоль), потім очищають хроматографією на силікагелі, використовуючи градієнт 0-20% MеOH/ДХМ, і отримують вказану в заголовку сполуку у вигляді вільної основи (100 мг; 64%). + МС (ES+) m/z 453 (MH ). δH CDCl3, (400 МГц) 1,76 (дд, 2H), 2,05 (м, 6H), 2,31 (т, 2H), 2,75 (м, 2H), 2,82 (шир.с, 1H), 3,19 (м, 2H), 3,95 (с, 2H), 4,43 (т, 2H), 4,62 (с, 2H), 6,62 (д, 1H), 6,95 (д, 2H), 7,21 (д, 2H), 7,53 (м, 1H), 7,63 (д, 1H). Дану речовину перетворюють на дигідрохлорид шляхом розчинення вільної основи в суміші ДХМ/метанол з додаванням 4M HCl в 1,4-діоксані, потім упарюють насухо й отримують жовту тверду речовину. Приклад 6 1-(2-{4-[(6,7-дигідро[1,4]діоксино[2,3-с]піридазин-3-ілметил)аміно]-1-піперидиніл}етил)-7-фтор-2(1Н)-хінолінону дигідрохлорид 25 30 35 40 (a) 3,4,6-Трихлорпіридазин Дану речовину отримують за допомогою злегка модифікованого способу Kasnar et al, Nucleosides & Nucleotides (1994), 13(1-3), 459-79. Сульфат гідразину (51 г) суспендують у воді (250 мл), нагрівають з оберненим холодильником і додають по краплях броммалеїновий ангідрид (90,38 г). Суміш нагрівають з оберненим холодильником протягом 4 годин і потім охолоджують до кімнатної температури. Реакцію повторюють з використанням 29 г гідразин сульфату, 53 г броммалеїнового ангідриду і 130 мл води. Осідання збирають фільтрацією, промивають водою й ацетоном, об'єднані партії сушать у вакуумі й отримують 4-бром-1,2-дигідро-3,6-піридазиндіон у вигляді білої твердої речовини (113 г). Тверду речовину від двох партій обробляють оксихлоридом фосфору (2200 мл) і нагрівають з оберненим холодильником протягом 3,5 годин. Суміш охолоджують, упарюють і піддають азеотропній перегонці з толуолом. Залишок розподіляють між дихлорметаном і насиченим водним розчином бікарбонату натрію, після чого двічі екстрагують ДХМ. Органічні екстракти сушать і упарюють. Отриманий залишок перерозчиняють у дихлорметані, 27 UA 99440 C2 5 10 15 20 25 30 35 40 45 50 55 60 хроматографують на силікагелі (300 г) (як елюент використовують ДХМ) і отримують білу тверду речовину (101,5 г, 87%). (Аналіз РХ/МС показує, що наявний приблизно 20-30% домішок, ізомерів бромдихлорпіридазину). + МС (+ve іонізація електророзпилюванням) m/z 184/185/186 (MH ), трихлорпіридазин. + МС (+ve іонізація електророзпилюванням) m/z228/229/231 (MH ), бром-дихлорпіридазин. (b) 2-[(3,6-Дихлор-4-піридазиніл)оксі]етанолу Розчин етилгліколю (55 мл) у тетрагідрофурані (200 мл) обробляють приблизно при 0°C (охолоджування на бані з льодом) гідридом натрію (60% дисперсія в олії, 5,9 г) протягом 40 хвилин. Після завершення додавання порціями додають 3,4,6-трихлорпіридазин (27 г), що містить ізомери бромдихлорпіридазину як домішки, і промивають сухим ТГФ (50 мл), потім суміш перемішують при 0°C протягом 1 години і при кімнатній температурі протягом ночі. Суміш концентрують (до 1/3 об'єму), розбавляють водним розчином бікарбонату натрію й екстрагують хлороформом (5) і етилацетатом (3). Об'єднані органічні екстракти промивають водою, сушать над сульфатом натрію й упарюють, після чого тверді речовини фільтрують, промивають CHCl3 (3) і сушать у вакуумній печі протягом ночі при 40°C, отримуючи білу тверду речовину (25,5 г, 83%), що містить певну кількість похідної для брому (10-15%). + МС (+ve іонізація електророзпилюванням) m/z 209/211 (MH ). МС (+ve іонізація + електророзпилюванням) m/z 255/7 (MH ), бромумісна похідна. (c) 3-Хлор-6,7-дигідро[1,4]діоксино[2,3-с]піридазин Розчин 2-[(3,6-дихлор-4-піридазиніл)оксі]етанолу, що містить певну кількість похідної для брому, (15,46 г; 0,0703 моль) у сухому 1,4-діоксані (1,2 л) обробляють порціями гідриду літію (2,3 г; 0,28моль) і перемішують при кімнатній температурі протягом 1 години в атмосфері аргону, після чого нагрівають при 110°C протягом ночі. Реакційну суміш гасять вологим 1,4діоксаном і потім водою з льодом. Розчин упарюють до половини об'єму, pH доводять до 8 за допомогою 5М хлористоводневої кислоти й упарюють насухо. Додають воду й залишок екстрагують 5 хлороформом, сушать (сульфатом натрію) й упарюють, отримуючи білу тверду речовину (12,4 г, приблизно 77%) (що містить приблизно 15% бромпохідних). + + МС (+ve іонізація електророзпилюванням) m/z 173/5 (Cl MH ); 217/9 (Br MH ) (d) 3-Етеніл-6,7-дигідро[1,4]діоксино[2,3-с]піридазин Розчин 3-хлор-6,7-дигідро[1,4]діоксино[2,3-с]піридазину (13,6 г, 0,079 моль), що містить приблизно 15% бромпохідних, у диметоксіетані (400 мл) дегазують в атмосфері аргону протягом 10 хв, після чого додають тетракис(трифенілфосфін)паладій(0) (2 г), карбонат калію (10,33 г), піридиновий комплекс 2,4,6-тривінілциклотрибороксану (11,32 г) і воду (55 мл). Суміш нагрівають при 95°C протягом 48 годин, охолоджують і упарюють насухо. Суміш обробляють водним розчином бікарбонату натрію й екстрагують (5) ДХМ. Екстракти сушать (сульфатом натрію), упарюють, залишок хроматографують на силікагелі (500 г), елююючи 0-100% етилацетат - гексан, і отримують продукт (6,43 г, 50%); [у тому числі певні фракції з домішками (1,8 г)]. + МС (+ve іонізація електророзпилюванням) m/z 165 (MH ). (e) 6,7-Дигідро[1,4]діоксино[2,3-с]піридазин-3-карбальдегід Розчин 3-етеніл-6,7-дигідро[1,4]діоксино[2,3-с]піридазину (11,58 г) в суміші 1,4-діоксан/вода (600мл/180 мл) охолоджують на льоду, обробляють водним розчином тетраоксиду осмію (4% вага/об'єм, 25 мл) і періодатом натрію (43 г). Отриману суміш залишають нагріватися до кімнатної температури й після перемішування протягом 7 годин суміш упарюють насухо й піддають азеотропній перегонці з 1,4-діоксаном. Додають силікагель, 1,4-діоксан і хлороформ, після чого суміш упарюють насухо протягом ночі, потім додають на колонку з оксидом кремнію (400 г) і хроматографують, елююючи хлороформом, потім 0-100% розчином етилацетату в гексані, і отримують білу тверду речовину (7,55 г, 64%). + МС (+ve іонізація електророзпилюванням) m/z 167 (MH ). (f) Вказана в заголовку сполука Вказану в заголовку сполуку отримують за допомогою загального способу, описаного в прикладі 4(d), використовуючи 1-[2-(4-аміно-1-піперидиніл)етил]-7-фтор-2(1H)-хінолінон (100 мг, 0,346 ммоль) і 6,7-дигідро[1,4]діоксино[2,3-с]піридазин-3-карбальдегід (57 мг, 0,346 ммоль), потім очищають колонковою хроматографією на силікагелі, використовуючи градієнт 0-12% MеOH/ДХМ, і отримують вказану в заголовку сполуку у вигляді вільної основи (86 мг, 66%). δH CDCl3, (400 МГц) 1,65 (м, 2H), 2,03 (с, 1H), 2,06 (с, 4H), 2,40 (т, 2H), 2,75 (м, 3H), 3,17 (д, 2H), 3,93 (шир.с, 2H), 4,05 (с, 2H), 4,38 (м, 2H), 4,47 (м, 2H), 4,53 (м, 2H), 6,62 (д, 1H), 6,97 (м, 1H), 7,08 (с, 1H), 7,31 (д, 1H), 7,53 (м, 1H), 7,65 (д, 1H). + МС (ES+) m/z 440 (MH ). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives and analogs of n-ethylquinolones and n-ethylazaquinolones
Автори англійськоюBallell, Lluis, Barros, David, Brooks, Gerald, Castro Pichel, Julia, Dabbs, Steven, Daines, Robert, A, Davies, David, Thomas, Fiandor Roman, Jose Maria, Giordano, Ilaria, Hennessy, Alan, Joseph, Hoffman, James, B, Jones, Graham, Elgin, Miles, Timothy, James, Pearson, Neil, David, Pendrak, Israil, Remuinan Blanco, Modesto, J, Rossi, Jason, Anthony
Назва патенту російськоюПроизводные и аналоги n-этилхинолонов и n-этилазахинолонов
Автори російськоюБаллелль Льюис, Баррос Дэвид, Брукс Джеральд, Кастро Пичель Хулиа, Деббс Стивен, Дейнс Роберт А., Девис Девид Томас, Фиандор Роман Хосе Мариа, Джордано Илариа, Геннесси Алан Джозеф, Гоффман Джеймс Б., Джонс Грехем Элджин, Майлз Тимоти Джеймс, Пирсон Нейл Дэвид, Пендрак Исраиль, Ремуйнан Бланко Модесто Х., Росси Джейсон Энтони
МПК / Мітки
МПК: A61P 31/04, C07D 471/04, C07D 513/04, C07D 491/04, A61P 31/06, C07D 487/04, C07D 498/04, C07D 497/00
Мітки: похідні, аналоги, n-етилхінолонів, n-етилазахінолонів
Код посилання
<a href="https://ua.patents.su/193-99440-pokhidni-jj-analogi-n-etilkhinoloniv-i-n-etilazakhinoloniv.html" target="_blank" rel="follow" title="База патентів України">Похідні й аналоги n-етилхінолонів і n-етилазахінолонів</a>
Попередній патент: Синтетичний промотор, який індукується патогенами
Наступний патент: Покривна панель зі скошеними краями, які мають змінний поперечний переріз, і пристрій та спосіб її виготовлення
Випадковий патент: Спосіб підготовки лунки для садіння плодових дерев












