Селективні модулятори рецепторів, що активуються проліфераторами пероксисом
Номер патенту: 83265
Опубліковано: 25.06.2008
Автори: Феррітто-Креспо Рафаель, Мартін-Ортега Фінхер Марія Делорес
Формула / Реферат
1. Сполука, що має структурну формулу І
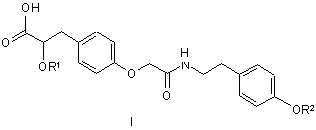 ,
,
або фармацевтично прийнятна сіль, сольват, гідрат або стереоізомер такої сполуки, де:
кожний з R1 та R2 незалежно від іншого - метил або етил.
2. Сполука за п. 1, яка має структурну формулу II
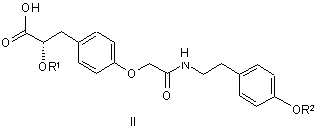 ,
,
або її фармацевтично прийнятна сіль, сольват або гідрат, де:
кожний з R1 та R2 незалежно від іншого - метил або етил.
3. Сполука за п. 2, яка являє собою (2S)-3-(4-{[2-(4-метоксифеніл)-етилкарбамоїл]-метокси}-феніл)-2-метоксипропіонову кислоту, що має структурну формулу III
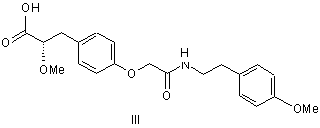 ,
,
або її фармацевтично прийнятна сіль, сольват або гідрат.
4. Сполука за п. 1, яка являє собою 3-(4-{[2-(4-етоксифеніл)-етилкарбамоїл]-метокси}-феніл)-2-метоксипропіонову кислоту, що має структурну формулу IV
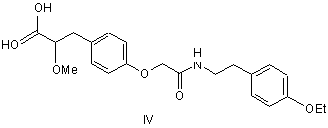 ,
,
або її фармацевтично прийнятна сіль, сольват або гідрат.
5. Сполука за п. 4, яка являє собою (5)-3-(4-{[2-(4-етоксифеніл)-етилкарбамоїл]-метокси}-феніл)-2-метоксипропіонову кислоту, що має структурну формулу V
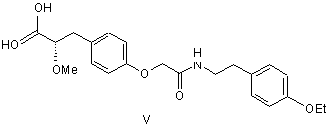 ,
,
або її фармацевтично прийнятна сіль, сольват або гідрат.
6. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та сполуку за пп. 1-5 або її фармацевтично прийнятну сіль, сольват або гідрат.
7. Фармацевтична композиція, яка містить:
(1) сполуку за пп. 1-5 або її фармацевтично прийнятну сіль, сольват, гідрат або стереоізомер;
(2) другий лікарський засіб, вибраний з групи, яку складають: сенсибілізатори до інсуліну, сульфонілсечовини, бігуаніди, меглітиніди, тіазолідиндіони, інгібітори α-глюкозидази, підсилювачі секреції інсуліну, інсулін, антигіперліпідемічні засоби, засоби, що підвищують рівень HDL у плазмі, інгібітори HMG-CoA-редуктази, статини, інгібітори акрил-СоА:холестерин-ацилтрансферази, засоби проти ожиріння, засоби проти гіперхолестеринемії, фібрати, вітаміни та аспірин; та
(3) факультативно фармацевтично прийнятний носій.
8. Спосіб модулювання рецептора, який активується проліфератором пероксисом (PPAR), який включає стадію введення згаданого рецептора в контакт зі сполукою за пп. 1-5 або її фармацевтично прийнятною сіллю, сольватом або гідратом.
9. Спосіб за п. 8, який відрізняється тим, що згаданим PPAR є альфа (α)-рецептор.
10. Спосіб за п. 8, який відрізняється тим, що згаданим PPAR є гамма (γ)-рецептор.
11. Спосіб за п. 8, який відрізняється тим, що згаданим PPAR є альфа/гамма (α/γ)-рецептор.
12. Спосіб лікування опосередкованого PPAR-γ захворювання або патологічного стану у ссавця, який включає стадію введення в організм ефективної кількості сполуки за пп. 1-5.
13. Спосіб лікування опосередкованого PPAR-α захворювання або патологічного стану у ссавця, який включає стадію введення в організм ефективної кількості сполуки за пп. 1-5.
14. Спосіб лікування опосередкованого PPAR-α/γ захворювання або патологічного стану у ссавця, який включає стадію введення в організм ефективної кількості сполуки за пп. 1-5.
15. Спосіб лікування опосередкованого частковим агоністом PPAR-γ захворювання або патологічного стану у ссавця, який включає стадію введення в організм ефективної кількості сполуки за пп. 1-5.
16. Спосіб зниження рівня глюкози у крові ссавця, який включає стадію введення в організм ефективної кількості сполуки за пп. 1-5.
17. Спосіб лікування захворювання або патологічного стану у ссавця, вибраного з групи, яку складають гіперглікемія, дисліпідемія, діабет типу II, діабет типу І, гіпертригліцеридемія, синдром X, резистентність до інсуліну, серцева недостатність, діабетична дисліпідемія, гіперліпідемія, гіперхолестеринемія, гіпертензія, ожиріння, булімія, нервова анорексія, серцево-судинні захворювання та інші захворювання, складовою частиною котрих є резистентність до інсуліну, який включає стадію введення в організм ефективної кількості сполуки за пп. 1-5.
18. Спосіб лікування цукрового діабету у ссавця, який включає стадію введення в організм ссавця терапевтично ефективної кількості сполуки за пп. 1-5.
19. Спосіб лікування серцево-судинного захворювання у ссавця, який включає стадію введення в організм ссавця терапевтично ефективної кількості сполуки за пп. 1-5 або її фармацевтично прийнятної солі, сольвату або гідрату.
20. Спосіб лікування синдрому X, який включає стадію введення в організм ссавця терапевтично ефективної кількості сполуки за пп. 1-5 або її фармацевтично прийнятної солі, сольвату або гідрату.
21. Спосіб лікування захворювання або патологічного стану у ссавця, вибраного з групи, яку складають гіперглікемія, дисліпідемія, діабет типу II, діабет типу І, гіпертригліцеридемія, синдром X, резистентність до інсуліну, серцева недостатність, діабетична дисліпідемія, гіперліпідемія, гіперхолестеринемія, гіпертензія, ожиріння, булімія, нервова анорексія, серцево-судинні захворювання та інші захворювання, складовою частиною котрих є резистентність до інсуліну, який включає стадію введення в організм ефективної кількості сполуки за пп. 1-5 та ефективної кількості другого лікарського засобу, вибраного з групи, яку складають: сенсибілізатори до інсуліну, сульфонілсечовини, бігуаніди, меглітиніди, тіазолідиндіони, інгібітори α-глюкозидази, підсилювачі секреції інсуліну, інсулін, антигіперліпідемічні засоби, засоби, що підвищують рівень HDL у плазмі, інгібітори HMG-CoA-редуктази, статини, інгібітори акрил-СоА:холестерин-ацилтрансферази, засоби проти ожиріння, засоби проти гіперхолестеринемії, фібрати, вітаміни та аспірин.
22. Застосування сполуки за пп. 1-5 або її фармацевтично прийнятної солі, сольвату або гідрату для виготовлення лікарського засобу для лікування патологічного стану, модульованого PPAR.
23. Застосування сполуки за пп. 1-5 або її фармацевтично прийнятної солі, сольвату або гідрату для виготовлення лікарського засобу для лікування діабету.
Текст
1. Сполука, що має структурну формулу І H N O HO OMe O II O OR 2 , або її фармацевтично прийнятна сіль, сольват або гідрат, де: кожний з R1 та R2 незалежно від іншого - метил або етил. 3. Сполука за п. 2, яка являє собою (2S)-3-(4-{[2-(4метоксифеніл)-етилкарбамоїл]-метокси}-феніл)-2 H N O V OEt , або її фармацевтично прийнятна сіль, сольват або гідрат. 6. Фармацевтична композиція, яка містить фармацевтично прийнятний носій та сполуку за пп. 1-5 або її фармацевтично прийнятну сіль, сольват або гідрат. (19) OR1 UA OH O 3 83265 4 7. Фармацевтична композиція, яка містить: стеринемія, гіпертензія, ожиріння, булімія, нервова (1) сполуку за пп. 1-5 або її фармацевтично прийнанорексія, серцево-судинні захворювання та інші ятну сіль, сольват, гідрат або стереоізомер; захворювання, складовою частиною котрих є ре(2) другий лікарський засіб, вибраний з групи, яку зистентність до інсуліну, який включає стадію ввескладають: сенсибілізатори до інсуліну, сульфонідення в організм ефективної кількості сполуки за лсечовини, бігуаніди, меглітиніди, тіазолідиндіони, пп. 1-5. 18. Спосіб лікування цукрового діабету у ссавця, інгібітори a-глюкозидази, підсилювачі секреції інсуліну, інсулін, антигіперліпідемічні засоби, засоби, який включає стадію введення в організм ссавця терапевтично ефективної кількості сполуки за пп. що підвищують рівень HDL у плазмі, інгібітори 1-5. HMG-CoA-редуктази, статини, інгібітори акрил19. Спосіб лікування серцево-судинного захворюСоА:холестерин-ацилтрансферази, засоби проти вання у ссавця, який включає стадію введення в ожиріння, засоби проти гіперхолестеринемії, фібрати, вітаміни та аспірин; та організм ссавця терапевтично ефективної кількості сполуки за пп. 1-5 або її фармацевтично прийнят(3) факультативно фармацевтично прийнятний ної солі, сольвату або гідрату. носій. 20. Спосіб лікування синдрому X, який включає 8. Спосіб модулювання рецептора, який активустадію введення в організм ссавця терапевтично ється проліфератором пероксисом (PPAR), який включає стадію введення згаданого рецептора в ефективної кількості сполуки за пп. 1-5 або її фармацевтично прийнятної солі, сольвату або гідрату. контакт зі сполукою за пп. 1-5 або її фармацевтич21. Спосіб лікування захворювання або патологічно прийнятною сіллю, сольватом або гідратом. ного стану у ссавця, вибраного з групи, яку скла9. Спосіб за п. 8, який відрізняється тим, що згадають гіперглікемія, дисліпідемія, діабет типу II, даним PPAR є альфа (a)-рецептор. діабет типу І, гіпертригліцеридемія, синдром X, 10. Спосіб за п. 8, який відрізняється тим, що резистентність до інсуліну, серцева недостатність, згаданим PPAR є гамма (g)-рецептор. діабетична дисліпідемія, гіперліпідемія, гіперхоле11. Спосіб за п. 8, який відрізняється тим, що стеринемія, гіпертензія, ожиріння, булімія, нервова згаданим PPAR є альфа/гамма (a/g)-рецептор. анорексія, серцево-судинні захворювання та інші 12. Спосіб лікування опосередкованого PPAR-γ захворювання, складовою частиною котрих є резахворювання або патологічного стану у ссавця, зистентність до інсуліну, який включає стадію ввеякий включає стадію введення в організм ефектидення в організм ефективної кількості сполуки за вної кількості сполуки за пп. 1-5. пп. 1-5 та ефективної кількості другого лікарського 13. Спосіб лікування опосередкованого PPAR-α засобу, вибраного з групи, яку складають: сенсибізахворювання або патологічного стану у ссавця, лізатори до інсуліну, суль фонілсечовини, бігуаніякий включає стадію введення в організм ефектиди, меглітиніди, тіазолідиндіони, інгібітори aвної кількості сполуки за пп. 1-5. глюкозидази, підсилювачі секреції інсуліну, інсулін, 14. Спосіб лікування опосередкованого PPAR-a/g антигіперліпідемічні засоби, засоби, що підвищузахворювання або патологічного стану у ссавця, ють рівень HDL у плазмі, інгібітори HMG-CoAякий включає стадію введення в організм ефектиредуктази, статини, інгібітори акрилвної кількості сполуки за пп. 1-5. СоА:холестерин-ацилтрансферази, засоби проти 15. Спосіб лікування опосередкованого частковим ожиріння, засоби проти гіперхолестеринемії, фібагоністом PPAR-g захворювання або патологічного рати, вітаміни та аспірин. стану у ссавця, який включає стадію введення в 22. Застосування сполуки за пп. 1-5 або її фармаорганізм ефективної кількості сполуки за пп. 1-5. цевтично прийнятної солі, сольвату або гідрату 16. Спосіб зниження рівня глюкози у крові ссавця, для виготовлення лікарського засобу для лікуванякий включає стадію введення в організм ефектиня патологічного стану, модульованого PPAR. вної кількості сполуки за пп. 1-5. 23. Застосування сполуки за пп. 1-5 або її фарма17. Спосіб лікування захворювання або патологічцевтично прийнятної солі, сольвату або гідрату ного стану у ссавця, вибраного з групи, яку складля виготовлення лікарського засобу для лікувандають гіперглікемія, дисліпідемія, діабет типу II, ня діабету. діабет типу І, гіпертригліцеридемія, синдром X, резистентність до інсуліну, серцева недостатність, діабетична дисліпідемія, гіперліпідемія, гіперхоле Цей винахід стосується сполуки, яка є селективним модулятором рецепторів, що активуються проліфераторами пероксисом (SPPARM), більш конкретно, частковим агоністом PPARg, та є корисною для лікування та/або профілактики розладів, що модулюються PPAR. Рецептори, що активуються проліфераторами пероксисом (PPARs), належать до генного сімейства нуклеарних рецепторів, які активуються жирними кислотами та метаболітами жирних кислот. PPARs належать до підгрупи нуклеарних рецепто рів, що взаємодіють як гетеродимери з рецепторами 9-цис-ретиноєвої кислоти (RXR). У різноманітних видах організмів, від Xtnopus до людини, знайдено три підтипи PPAR, які позначаються PPARa, PPARg та PPAR d. PPARa є головним підтипом у печінці, і його дослідження сприяли аналізу механізму, за яким проліфератори пероксисом спричиняють свої плейотропні ефекти. PPARa активується багатьма жирними кислотами з ланцюгами помірної та великої довжини і бере участь у b-окисненні жирних 5 83265 6 резистентність щодо реакції на інсулін призводить кислот. PPARa пов'язаний також із дією фібратів до недостатнього активування під впливом інсуліта жирних кислот в організмах гризунів та людини. Похідні фібринової кислоти, наприклад, клофібрат ну засвоєння, окиснення та зберігання у м'язовій тканині глюкози, а також до неадекватного пригні(clofibrate), фенофібрат (fenofibrate), безафібрат чення під впливом інсуліну ліполізу у жировій тка(bezafibrate), ципрофібрат (ciprofibrate), беклофібнині та продукування та секреції глюкози у печінці. рат (beclofibrate) та етофібрат (etofibrate), a також Коли чутливість цих клітин до інсуліну знижується, гемфіброзил (gemfibrozil), спричиняють значне зниження рівня тригліцеридів у плазмі поряд із організм намагається компенсувати це явище шляхом продукування аномально високих конценпомірним зниженням рівня холестерину ліпопротетрацій інсуліну, наслідком чого є гіперінсулінемія. їнів низької густини (LDL), і їх застосовують, зокГіперінсулінемія пов'язана з гіпертензією та збільрема, для лікування гіпертригліцеридемії. шенням маси тіла. Оскільки інсулін бере участь у PPARg є головним підтипом у жировій тканині стимуляції поглинання глюкози, амінокислот та та бере участь в активації програми диференціютригліцеридів із крові чутливими до інсуліну клітивання ліпоцитів. PPARg не бере участі у стимуляції нами, то нечутливість до інсуліну може призвести проліферації пероксисом у печінці. Існують два до підвищення рівнів тригліцеридів та LDLізомери PPARg: PPARg1 та PPARg2; єдиною відхолестерину (відомого під назвою "поганого" холемінністю між ними є те, що PPARg2 містить з боку стерину), які є факторами ризику стосовно до серкінцевої аміногрупи додаткову послідовність з 28 цево-судинних захворювань. Сукупність симптоамінокислот. Послідовності ДНК для рецепторів мів, яка включає гіперінсулінемію в комбінації з PPARg описані в [роботі Ельбрехта та ін. (Eibrecht, гіпертензією, збільшеною масою тіла, підвищениet al., BBRC 224;431-437 (1996)]. Хоча проліферами рівнями тригліцеридів та підвищеним рівнем тори пероксисом, у тому числі фібрати та жирні LDL, відома під назвою синдрому X. кислоти, активують транскрипційну дію різновидів Гіперліпідемія - це стан, що характеризується PPAR, як природні ліганди PPARg ідентифіковано аномальним підвищенням вмісту ліпідів у плазмі, лише похідні простагландину J2, який також зв'язунаприклад, холестерину, тригліцеридів та фосфоється при високому ступені спорідненості з антиділіпідів. Ці ліпіди не циркулюють вільно у формі абетичними агентами - тіазолідиндіонами. Фізіолорозчину у плазмі, а зв'язуються з протеїнами та гічні функції PPARa та PPARg у процесах переносяться у формі макромолекулярних комметаболізму ліпідів та вуглеводів було розкрито плексів, що звуться ліпопротеїнами. Однією з лише після того, як було з'ясовано, що вони є реформ гіперліпідемії є гіперхолестеринемія, яка цепторами відповідно фібратних та глітазонових характеризується підвищеними рівнями LDLлікарських засобів. холестерину. На початковому етапі лікування гіРецептори PPARa та PPARg беруть участь у перхолестеринемії часто застосовують дієту з нирозвитку цукрового діабету, серцево-судинних зьким вмістом жирів та холестерину в комбінації з захворювань, ожиріння та захворювань шлункововідповідними фізичними навантаженнями. Застокишкового тракту, наприклад, запальних захворюсування лікарських засобів починають у разі, якщо вань кишок та інших захворювань, пов'язаних із мета зниження LDL не досягається тільки дієтою запаленням. Необмежувальними прикладами тата фізичними навантаженнями. Бажаним є зниких захворювань, пов'язаних із запаленням, є хвоження підвищених рівнів LDL-холестерину та підроба Альцгеймера, хвороба Крона, ревматоїдний вищення рівнів холестерину, що входить до склаартрит, псоріаз та ішемічні порушення при реперду ліпропротеїнів високої густини (HDLфузії. Навпаки, PPARd (що позначається також як холестерину). З'ясовано, що, як правило, підвищеPPARb та NUC1), за опублікованою інформацією, ні рівні HDL пов'язані зі зниженим ризиком виникне є рецептором для будь-якого відомого класу нення ішемічної хвороби серця (CHD). [Див. Гормолекул лікарських засобів, і його роль у фізіології дон та ін. (Gordon, et al., Am. J. Med., 62, 707-714 людини залишається невизначеною. Ген людсько(1977)); Штампфер та ін. (Stampfer, et al., N. го нуклеарного рецептора PPARd (hPPARd) клоноEngland J. Med., 325, 373-381 (1991)); та Каннель вано з бібліотеки кДНК остеосаркоми людини і та ін. (Kannel, et al., Ann. Internal Med., 90, 85-91 повністю описано в [роботі Шмідта та ін. (A. (1979)]. Прикладом засобу, що підвищує рівень Schmidt et al., Molecular Endocrinology, 6:1634-1641 HDL, є нікотинова кислота, але її застосування в (1992)]. кількостях, необхідних для досягнення підвищення Діабет - це захворювання, при якому здатність HDL, пов'язане з небажаними побічними ефектаорганізму ссавця регулювати рівень глюкози у ми, наприклад, із припливами крові. крові порушується внаслідок обмеженої здатності На сьогодні існує кілька способів лікування цуорганізму перетворювати глюкозу у глікоген для крового діабету, але ці способи лікування залинагромадження у м'язових та печінкових клітинах. шаються ще незадовільними та не вільні від обПри діабеті типу І ця знижена здатність до зберімежень. Хоча фізичні навантаження та зниження гання глюкози спричинена послабленим продукукалорійності харчування полегшують стан діабетиванням інсуліну. "Діабет типу II", або "інсуліноків, хворі можуть недостатньо додержуватися танезалежний цукровий діабет" (NIDDM) - це форма кого режиму внаслідок малорухливого способу діабету, викликана високою резистентністю до життя та надмірного споживання їжі, зокрема, простимулювального або регулювального впливу індуктів із високим вмістом жирів. Тому в процесі суліну на метаболізм глюкози та ліпідів, яку вияврозвитку захворювання часто стає необхідним ляють основні чутливі до інсуліну тканини - м'язолікування гіпоглікемічними засобами, наприклад, ва, печінкова та жирова тканини. Ця сульфонілсечовинами (наприклад, хлорпропамі 7 83265 8 дом, толбутамідом, толазамідом та ацетогексамілікування серцево-судинних захворювань та подом) та бігуанідами (наприклад, фенформіном та в'язаних із ними патологічних станів. Брукс та ін. метформіном). Сульфонілсечовини стимулюють [Brooks et al. (WO 02/100813)] описали модулятори PPAR, корисні для лікування діабету типу II та інпідвищення секреції інсуліну b-клітинами підшлунших захворювань та патологічних станів, опосерекової залози при розвитку захворювання. Проте дковуваних PPAR. Феррітто-Креспо та ін. [Ferritto реакція b-клітин у кінцевому підсумку послаблюCrespo et al. (WO 2004/000789)] розкривають моється, і настає необхідність лікування ін'єкціями дулятори PPAR з амідними місточковими групами. інсуліну. Крім того, як лікування сульфонілсечовиЗ ура хуванням вищезазначеного, метою цього нами, так і ін'єкції інсуліну можуть спричинити завинаходу є запропонувати нові фармацевтичні грозливий для життя побічний ефект у ви гляді гіпозасоби, які модулюють рецептори PPAR для проглікемічної коми, отже, хворі, які застосовують ці філактики, лікування або полегшення згаданих способи, повинні ретельно контролювати дозуванзахворювань та патологічних станів при одночасня лікарських засобів. ному послабленні одного або кількох небажаних Надійно з'ясовано, що покращення глікемічепобічних ефектів, пов'язаних із відомими способаної регуляції у хвори х на діабет (типу І та типу II) ми лікування. супроводжується зменшенням кількості ускладОдним із варіантів здійснення цього винаходу нень, пов'язаних зі станом мікрокровоносних судин є сполука, що є селективним модулятором рецеп(DCCT та UKPDS). У зв'язку з трудністю тривалого торів, що активуються проліфераторами пероксидодержання адекватного глікемічного регулювання сом (SPPARM), або сполука, яка діє як частковий у пацієнтів, що страждають на діабет типу II, поагоніст PPARg, що має стр уктурн у формулу І ширюється застосування при лікуванні діабету типу II сенсибілізаторів до інсуліну. Також постійно нагромаджуються свідоцтва того, що агоніст PPARg, сенсибілізатор до інсуліну, може, окрім ефектів покращення глікемічного регулювання, мати ще й інші переваги. За останнє десятиріччя віднайдено клас сполук, відомих під назвою тіазолідиндіонів (TZD) (дивись, наприклад, [патенти США №5,089,514; №4,342,771; №4,367,234; №4,340,605; та або фармацевтично прийнятна сіль, сольват, №5,306,726], які виявилися ефективними протидігідрат або стереоізомер цієї сполуки, де кожний з абетичними засобами; показано, що ці сполуки R1 та R2 незалежно від іншого - метил або етил. підвищують чутливість до інсулін у інсуліноСполуки за цим винаходом є корисними при чутливи х тканин, наприклад, скелетних м'язів, пелікуванні та/або профілактиці захворювань або чінки та жирової тканини. Підвищення чутливості патологічних станів, пов'язаних із гіперглікемією, до інсуліну, а не кількості інсуліну у крові, знижує дисліпідемією, діабетом типу II, діабетом типу І, ймовірність гіпоглікемічної коми. Хоча показано, гіпертригліцеридемією, синдромом X, резистентніщо тіазолідиндіони підвищують чутли вість до інсустю до інсуліну, серцевою недостатністю, діабетиліну шля хом зв'язування з рецепторами PPARg, чною гіперхолестеринемією, гіпертензією, ожирінтаке лікування також спричиняє небажані побічні ням, булімією, нервовою анорексією, серцевоефекти, наприклад, збільшення маси тіла та насудинними захворюваннями та іншими захворюбряк, а у випадку троглітазону (troglitazone) - токваннями, складовою частиною котрих є резистенсичну дію на печінку. тність до інсуліну. Дія часткових агоністів PPARg може забезпеЗа одним із варіантів здійснення цей винахід чити істотні переваги, оскільки численні дослістосується також фармацевтичної композиції, яка дження показали, що часткові агоністи PPARg, в містить сполуку за цим винаходом або її фарматому числі селективні модулятори PPAR цевтично прийнятну сіль, сольват або гідрат та (SPPAR Ms), забезпечують більш сприятливий пефармацевтично прийнятний носій. Обсяг цього ребіг побічних ефектів у порівнянні до повних аговинаходу о хоплює також фармацевтичну композиністів, особливо стосовно збільшення маси тіла та цію, яка містить додатковий лікарський засіб, а набряку. [Дивись Роккі та ін. (Rocchi S. et al., також сполуку за цим винаходом або її фармацевMolecular Cell, 8:737-747 (2001)); Бергер та ін. тично прийнятну сіль, сольват або гідрат та факу(Berger J.P., et al. Mol Endocrinol. 17:662-676 льтативно фармацевтично прийнятний носій. (2003)); Сімая та ін. (Shimaya A., et al., Metabolism За іншим варіантом здійснення, цей винахід 49:411-417 (2000)); Чакрабарті та ін. (Chakrabarti стосується способу модулювання PPAR шляхом R., et al., Diabetes 52 (Suppl. 1) p.601 (Abstract) введення рецептора в контакт зі сполукою за цим (2003)); Каваї та ін. (Kawai Т., et al., Metabolism, винаходом або її фармацевтично прийнятною сіл48:1102-1107 (1999)); та Вульф та ін. (Wulff E., et лю, сольватом або гідратом. al., Diabetes 52 (Suppl. 1) ρ 594 (abstract) (2003)]. Предметом цього винаходу є сполуки, які є Є відомості, що модуляторами PPAR є також агоністами рецепторів, що активуються проліфесполуки, що не належать до TZD. Адамс та ін. раторами пероксисом (PPAR). Більш конкретно, [Adams et al. (WO 97/28115, WO 97/28135 та пацей винахід стосується сполуки, що є селективним тент США №5,895,051)] описали ацетилфеноли, модулятором рецепторів, що активуються пролікорисні як засоби проти ожиріння та діабету. Лейфераторами пероксисом (SPPARM), або сполуки, бовіц та ін. [Leibowitz et al. (WO 97/28149)] описали яка діє як частковий агоніст PPARg і є корисною сполуки, що є а гоністами PPARd та корисні для 9 83265 10 для лікування та/або профілактики розладів, модульованих PPAR, наприклад, діабету типу II, гіперглікемії, дисліпідемії, діабету тип у І, гіпертригліцеридемії, синдрому X, резистентності до інсуліну, серцевої недостатності, діабетичної гіперхолестеринемії, гіпертензії, ожиріння, булімії, нервової анорексії, серцево-судинних захворювань та інших захворювань цієї групи. Одним із варіантів здійснення цього винаходу або її фармацевтично прийнятна сіль, сольват є сполука, що є селективним модулятором рецепабо гідрат. торів, що активуються проліфераторами пероксиВаріантом здійснення винаходу, якому віддасом (SPPARM), або сполука, яка діє як частковий ється ще більша перевага, є сполука (S)-3-(4-{[2агоніст PPARg, що має стр уктурн у формулу І (4-етоксифеніл)-етилкарбамоїл]-метокси}-феніл)2-метоксипропіонова кислота, що має структурну формулу V або її фармацевтично прийнятна сіль, сольват, гідрат або стереоізомер, де: кожний з R1 та R2 незалежно від іншого - метил або етил. Одним із варіантів здійснення винаходу, якому віддається перевага, є сполука, що має структурну формулу II або її фармацевтично прийнятна сіль, сольват або гідрат, де: кожний з R1 та R2 незалежно від іншого - метил або етил. Іншим варіантом здійснення винаходу, якому віддається перевага, є сполука (2S)-3-(4-{[2-(4метоксифеніл)-етилкарбамоїл]-метокси}-феніл)-2метоксипропіонова кислота, що має структурну формулу III або її фармацевтично прийнятна сіль, сольват або гідрат. Варіантом здійснення винаходу, якому віддається більша перевага, є сполука 3-(4-{[2-(4етоксифеніл)-етилкарбамоїл]-метокси}-феніл)-2метоксипропіонова кислота, що має структурну формулу IV або її фармацевтично прийнятна сіль, сольват або гідрат. Обсяг цього винаходу о хоплює також фармацевтичну композицію, яка включає фармацевтично прийнятний носій та сполуку за цим винаходом або її фармацевтично прийнятну сіль, сольват або гідрат. Обсяг цього винаходу о хоплює також фармацевтичну композицію, яка включає: (1) сполуку за цим винаходом або її фармацевтично прийнятну сіль, сольват, гідрат або стереоізомер; (2) другий лікарський засіб, вибраний з групи, яку складають: сенсибілізатори до інсуліну, сульфонілсечовини, бігуаніди, меглітиніди, тіазолідиндіони, інгібітори a-глюкозидази, підсилювачі секреції інсуліну, інсулін, антигіперліпідемічні засоби, засоби, що підвищують рівень HDL у плазмі, інгібітори HMG-CoA-редуктази, статини, інгібітори акрил-СоА:холестерин-ацилтрансферази, засоби проти ожиріння, засоби проти гіперхолестеринемії, фібрати, вітаміни та аспірин; та (3) факультативно фармацевтично прийнятний носій. Обсяг цього винаходу охоплює також спосіб модулювання рецептора, який активується проліфератором пероксисом (PPAR), який включає стадію введення згаданого рецептора в контакт зі сполукою за цим винаходом або її фармацевтично прийнятною сіллю, сольватом або гідратом. Обсяг цього винаходу охоплює також вищезазначений спосіб, де згаданим PPAR є альфа-(a)рецептор. Обсяг цього винаходу охоплює також вищезазначений спосіб, де згаданим PPAR є гамма-(g)рецептор. Обсяг цього винаходу охоплює також вищезазначений спосіб, де згаданим PPAR є альфа/гамма-(a/g)-рецептор. Обсяг цього винаходу охоплює також спосіб лікування та/або профілактики опосередкованого 11 83265 12 другого лікарського засобу, вибраного з групи, яку PPAR-g захворювання або патологічного стану у складають: сенсибілізатори до інсуліну, сульфоніл ссавця, який включає стадію введення в організм ефективної кількості сполуки за цим винаходом. сечовини, бігуаніди, меглітиніди, тіазолідиндіони, Обсяг цього винаходу охоплює також спосіб інгібітори a-глюкозидази, підсилювачі секреції інлікування та/або профілактики опосередкованого суліну, інсулін, антигіперліпідемічні засоби, засоби, що підвищують рівень HDL у плазмі, інгібітори PPAR-a захворювання або патологічного стану у HMG-CoA-редуктази, статини, інгібітори акрилссавця, який включає стадію введення в організм СоА:холестерин-ацилтрансферази, засоби проти ефективної кількості сполуки за цим винаходом. ожиріння, засоби проти гіперхолестеринемії, фібОбсяг цього винаходу охоплює також спосіб рати, вітаміни та аспірин. лікування та/або профілактики опосередкованого Обсяг цього винаходу о хоплює також застосуPPAR-a/g захворювання або патологічного стану у вання сполуки за цим винаходом або її фармацевссавця, який включає стадію введення в організм тично прийнятної солі, сольвату або гідрату для ефективної кількості сполуки за цим винаходом. виготовлення лікарського засобу для лікування Обсяг цього винаходу охоплює також спосіб патологічного стану, модульованого PPAR. лікування та/або профілактики опосередкованого Обсяг цього винаходу о хоплює також застосучастковим агоністом PPAR-g захворювання або вання сполуки за цим винаходом або її фармацевпатологічного стану у ссавця, який включає стадію тично прийнятної солі, сольвату або гідрату для введення в організм ефективної кількості сполуки виготовлення лікарського засобу для лікування за цим винаходом. діабету. Обсяг цього винаходу охоплює також спосіб Терміни, вживані для опису цього винаходу, зниження рівня глюкози у крові ссавця, який вклюмають вказані нижче значення, якщо не обумовчає стадію введення в організм ефективної кільколено інше. сті сполуки за цим винаходом. Термін "галоген" означає F, СІ, Вr або І. Обсяг цього винаходу охоплює також спосіб Термін "активний інгредієнт" означає сполуки, лікування та/або профілактики захворювання або що відповідають загальній Формулі І, а також солі, патологічного стану у ссавця, вибраного з групи, сольвати та проліки таких сполук. яку складають гіперглікемія, дисліпідемія, діабет Термін "фармацевтично прийнятний" означає, типу II, діабет типу І, гіпертригліцеридемія, синдщо носії, розріджувачі, наповнювачі та солі мають ром X, резистентність до інсуліну, серцева недобути сумісними з іншими інгредієнтами композиції статність, діабетична дисліпідемія, гіперліпідемія, та нешкідливими для організму, у який вони ввогіперхолестеринемія, гіпертензія, ожиріння, булідяться. Фармацевтичні композиції за цим винахомія, нервова анорексія, серцево-судинні захворюдом виготовляються за відомими в галузі спосовання та інші захворювання, складовою частиною бами із застосуванням відомих та легкодоступних котрих є резистентність до інсуліну, який включає інгредієнтів. стадію введення в організм ефективної кількості Термін "профілактика" означає зниження ймосполуки за цим винаходом. вірності виникнення або розвитку у суб'єкта будьОбсяг цього винаходу охоплює також спосіб якого з патологічних станів, описаних у цьому долікування та/або профілактики цукрового діабету у кументі. ссавця, який включає стадію введення в організм Термін "лікування" означає опосередкований ссавця ефективної кількості сполуки за цим винавплив на захворювання або патологічний стан та ходом. запобігання його подальшому розвитку або послаОбсяг цього винаходу охоплює також спосіб блення такого розвитку, або полегшення симптолікування та/або профілактики серцево-судинного мів, пов'язаних із таким захворюванням або патозахворювання у ссавця, який включає стадію ввелогічним станом. дення в організм ссавця ефективної кількості споТермін "фармацевтично ефективна кількість" луки за цим винаходом або її фармацевтично приозначає кількість сполуки за цим винаходом, її йнятної солі, сольвату або гідрату. солі, сольвату, гідрату або проліків, яка викликає Обсяг цього винаходу охоплює також спосіб біологічну або медичну реакцію тканини, системи лікування та/або профілактики синдрому X у ссавабо організму ссавця. Таку кількість можна вводиця, який включає стадію введення в організм ссати з профілактичною метою в організм пацієнта, вця ефективної кількості сполуки за цим винахоякий вважається сприйнятливим для розвитку задом або її фармацевтично прийнятної солі, хворювання або патологічного стану. Така кільсольвату або гідрату. кість, будучи введеною в організм пацієнта профіОбсяг цього винаходу охоплює також спосіб лактично, може бути також ефективною з точки лікування та/або профілактики захворювання або зору профілактики або полегшення тяжкості опопатологічного стану у ссавця, вибраного з групи, середковуваного стану. Мається на увазі, що така яку складають гіперглікемія, дисліпідемія, діабет кількість включає кількість, достатню для модулютипу II, діабет типу І, гіпертригліцеридемія, синдвання рецептора PPAR, наприклад, рецептора ром X, резистентність до інсуліну, серцева недоPPARa, PPARg або PPARa/g, який опосередковує статність, діабетична дисліпідемія, гіперліпідемія, захворювання або патологічний стан. До станів, гіперхолестеринемія, гіпертензія, ожиріння, буліщо опосередковуються рецепторами PPAR, налемія, нервова анорексія, серцево-судинні захворюжать, наприклад, цукровий діабет, серцево-судинні вання та інші захворювання, складовою частиною захворювання, синдром X, ожиріння та захворюкотрих є резистентність до інсуліну, який включає вання шлунково-кишкового тракту. До інши х стастадію введення в організм ефективної кількості нів, пов'язаних із модулюванням рецептора PPAR, сполуки за цим винаходом та ефетивної кількості 13 83265 14 належать стани, пов’язані із запаленням, в тому Якщо сполука за цим винаходом містить більчислі, наприклад, IBD (запальне захворювання ше одного хірального центра, то вона може існукишок), ревматоїдний артрит, псоріаз, хвороба вати у діастереомерних формах. Пари діастереоАльцгеймера, хвороба Крона та ішемічні реперфумерів можна розділяти способами, відомими зійні пошкодження (інсульти та інфаркти міокарда). фа хівцям у галузі, наприклад, хроматографією або Термін "ссавець" означає індивідуальну живу кристалізацією, а індивідуальні енантіомери кожістоту, яка є членом таксономічного класу ссавців ної пари можна розділяти, як описано вище. Цей (Mammalia). До класу ссавців належать люди, мавинахід охоплює кожний діастереомер сполук фовпи, шимпанзе, горили, велика рогата худоба, рмули І та їх суміші. свині, коні, вівці, собаки, коти, миші, пацюки тощо. Деякі сполуки за цим винаходом можуть існуНайбільша перевага віддається застосуванню вати у різних стійких конформаційних формах, які до людей. Людина, в організм якої вводяться споможуть піддаватися розділенню. Розділення різних луки та композиції за цим винаходом, страждає на конформерів може уможливлюватися поворотною захворювання або патологічний стан, при якому асиметрією внаслідок обмеження повороту віднорівні глюкози у крові не регулюються адекватно сно асиметричного одинарного зв'язку, наприклад, без медичного втручання, але у крові людини привнаслідок стеричного утруднення або деформації сутній ендогенний інсулін. Інсуліно-незалежний циклу. Цей винахід охоплює кожний з конформацукровий діабет (NIDDM) є хронічне захворювання ційних ізомерів сполук формули І та їх суміші. або патологічний стан, що характеризується приДеякі сполуки за цим винаходом можуть існусутністю інсуліну у крові навіть на рівні вище норвати у цвітеріонній формі, і цей винахід охоплює мального, але резистентністю або відсутністю чуткожну із цвітеріонних форм сполук формули І та їх ливості тканин до дії інсуліну. суміші. Для фахівця зрозуміло, що у сполуках за цим Деякі сполуки за цим винаходом та їхні солі винаходом присутні хіральні центри. Відповідно, можуть існувати у кількох кристалічних формах. цей винахід охоплює всі можливі стереоізомери Поліморфні модифікації сполук формули І є склазаявлених сполук, в тому числі рацемічні сполуки довою частиною цього винаходу і можуть бути та оптично активні ізомери. одержані шляхом кристалізації сполуки формули І Сполуки за цим винаходом містять один або у різних умовах, наприклад, із застосуванням для кілька хіральних центрів та існують у різних оптичперекристалізації різних розчинників або різних но активних формах. Якщо сполуки за цим винасумішей розчинників; кристалізацією при різних ходом містять один хіральний центр, то вони існутемпературах; та із застосуванням при кристалізають у дво х енантіомерних формах, і винахід ції різних режимів охолодження в межах від дуже охоплює як енантіомери, так і суміші енантіомерів, швидкого до дуже повільного охолодження у пронаприклад, рацемічні суміші. Розділення кінцевого цесі кристалізації. Поліморфні модифікації можна продукту, проміжного продукту або вихідного маодержати також шляхом нагрівання або плавлення теріалу можна здійснювати будь-яким придатним сполуки формули І із подальшим поступовим або способом, відомим у галузі, наприклад, шляхом швидким охолодженням. Присутність поліморфних утворення діастереомерних солей, які можна розмодифікацій можна визначити за допомогою ЯМРділити кристалізацією; утворення діастереомерних спектроскопії, ІЧ-спектроскопії твердої проби, дипохідних або комплексів, які можна розділити криференціальної сканувальної калориметрії, порошсталізацією та газорідинною або рідинною хромакової рентгенодифрактографії або інших існуючих тографією; шляхом проведення селективної реакметодів. ції одного з енантіомерів з енантіомерноДеякі сполуки за цим винаходом та їхні солі специфічним реагентом, наприклад, ферментатиможуть існувати у кількох кристалічних формах, і вної естерифікації; та газорідинною або рідинною цей винахід охоплює кожну з цих кристалічних хроматографією у хіральному середовищі, наприформ та їх суміші. клад, на хіральному сорбенті, наприклад, на діокДеякі сполуки за цим винаходом та їхні солі сиді кремнію з прищепленим хіральним лігандом можуть існувати також у формі сольватів, наприабо у присутності хірального розчинника. Дивись клад, гідратів, і, отже, цей винахід охоплює кожний також монографії Елієля "Стереохімія сполук вугз цих сольватів та їх суміші. лецю" [Sterochemistry of Carbon Compounds by E.L. Термін "фармацевтично прийнятна сіль" стоEliel, McGraw-Hill, 1962] та Уайлена "Таблиці розсується солей сполук формули І, практично нетокділювальних агентів" [Tables of Resolving Agents by сичних для ссавців. До типових фармацевтично S.H. Wilen]. Слід мати на увазі, що у випадках, прийнятних солей належать солі, одержані шляколи бажаний енантіомер перетворюють в інший хом проведення реакції сполук за цим винаходом хімічний об'єкт шляхом однієї або кількох вищеіз неорганічними або органічними кислотами та з згаданих процедур розділення, то необхідною є органічними або неорганічними основами. Такі додаткова стадія вивільнення бажаної енантіомесолі відомі під назвами відповідно солей кислот рної форми. За альтернативним варіантом, індиві(солей з кислотами) та солей основ (солей з оснодуальні енантіомери можна синтезувати способавами). Слід мати на увазі, що конкретний протиіон, ми асиметричного синтезу із застосуванням який є складовою частиною будь-якої солі за цим оптично активних реагентів, субстратів, каталізавинаходом, не має вирішального значення, за торів або розчинників, або шляхом перетворення умови, що сіль в цілому є фармацевтично прийняодного енантіомеру в інший шля хом асиметричнотною та що протиіон не надає солі як цілому него перетворення. бажаних властивостей. 15 83265 16 В разі присутності кислотного фрагмента спотю або харчуванням із високим вмістом жирів, є лука за цим винаходом утворює солі з фармацевфактором ризику стосовно до розвитку серцевих тично прийнятними основами. Необмежувальними захворювань, інсультів та розладів та захворюприкладами солей з основами є солі металів, навань системи кровообігу. Пересічному медику віприклад, алюмінію; солі лужних металів, напридомі способи ідентифікації людей, для яких може клад, літію, натрію або калію; та солі лужноземебути сприятливим вживання сполук та композицій льних металів, наприклад, кальцію або магнію; за цим винаходом. солі амонію або заміщеного амонію. Прикладами Крім того, цей винахід пропонує спосіб лікусолей заміщеного амонію є, наприклад, солі з нивання та/або профілактики гіперглікемії у людей жчими алкіламінами, наприклад, із триметиламіабо інших ссавців, який включає введення в органом та триетиламіном; солі з гідроксіалкіламінами, нізм людини або іншого ссавця, який страждає на наприклад, із 2-гідроксіетиламіном, біс-(2гіперглікемію та потребує такого втручання, ефекгідроксіетил)-аміном або три-(2-гідроксіетил)тивної нетоксично! кількості сполуки формули І аміном; із циклоалкіламінами, наприклад, із біцикабо її таутомерної форми та/або її фармацевтично логексиламіном або дибензилпіперидином, Nприйнятної солі, та/або її фармацевтично прийнятного сольвату. бензил-b-фенетиламіном, дегідроабіетиламіном, Сполуки за цим винаходом є корисними як ліN,N'-біс-(дегідроабіетил)аміном, глюкаміном, Nпіперазин-метилглюкаміном; солі з основами пірикарські речовини при профілактиці або лікуванні синдрому X, цукрового діабету та пов'язаних із динового типу, наприклад, із піридином, колідиними ендокринних та серцево-судинних розладів ном, хініном або хіноліном; та солі з основними та захворювань у людей та інши х ссавців. амінокислотами, наприклад, із лізином та аргініЦей винахід стосується також застосування ном. Необмежувальними прикладами неорганічних описаної вище сполуки формули І для виготовлення лікарського засобу для лікування патологічоснов є гідроксид натрію, гідроксид калію, карбоного стану або захворювання, опосередкованого нат калію, карбонат натрію, бікарбонат натрію, гідроксид кальцію, карбонат кальцію тощо. PPARa, PPARg, частковим агоністом PPARg або Сполуки за цим винаходом, які містять замісподвійним агоністом PPARa/g у ссавців. ники основного характеру, можуть існувати у форТерапевтично ефективну кількість сполуки за мі солей з фармацевтично прийнятними кислотацим винаходом можна застосовувати для виготовми. Цей винахід охоплює такі солі. Прикладами лення лікарського засобу, корисного для лікування таких солей є гідрохлориди, гідроброміди, сульфасиндрому X, діабету, для лікування ожиріння, знити, метансульфонати, нітрати, малеати, цитрати, ження рівня тригліцеридів, підвищення рівня ліпофумарати, тартрати [наприклад, (+)-тартрати, (-)протеїнів високої густини у плазмі, для лікування, тартрати або їх суміші, в тому числі рацемічні супрофілактики або зниження ризику розвитку артеміші], сукцинати, бензоати та солі з амінокислотаріосклерозу, та для профілактики або зниження ми, наприклад, із глутаміновою кислотою. Ці солі ризику першого та наступних нападів атеросклеможна одержати способами, відомими фахівцям у ротичної хвороби у сса вців, зокрема, у людей. галузі. Крім того, для виготовлення лікарського засоДеякі сполуки за цим винаходом та їхні солі бу, корисного для вищезгаданого лікування, можна можуть існувати також у формі сольватів, напризастосовувати е фективну кількість сполуки за цим клад, гідратів, і, отже, цей винахід охоплює кожний винаходом у комбінації з терапевтично ефективз цих сольватів та їх суміші. ною кількістю одного або кількох активних агентів, Сполуки за цим винаходом, які зв'язуються з вибраних з групи, яку складають антигіперліпідерецепторами PPAR та активують їх, знижують рімічні агенти, агенти, що підвищують рівень HDL у вень глюкози, інсуліну, тригліцеридів, жирних кисплазмі, антигіперхолестеричні агенти, фібрати, лот або холестерину, або кількох із цих речовин, і вітаміни, аспірин, стимулятори секреції інсуліну тому є корисними для лікування та/або профілактощо. тики гіперглікемії, дисліпідемії і, зокрема, діабету Доцільно виготовляти композиції, що містять типу II, а також інших захворювань, в тому числі сполуки за цим винаходом або їх солі, у формі синдрому X, діабету типу І, гіпертригліцеридемії, дозованих одиниць. Відповідно до варіанта, якому резистентності до інсуліну, діабетичної дисліпідевіддається перевага, кожна дозована одиниця мії, гіперліпідемії, гіперхолестеринемії, серцевої містить від приблизно 1мг до приблизно 500мг недостатності, коагулопатії, гіпертензії та серцевозгаданої сполуки. Мається на увазі, що застосовусудинних захворювань, особливо артеріосклерозу. вана кількість сполуки за цим винаходом визначаКрім того, з'ясовано, що ці сполуки є корисними ється лікарем з урахуванням усіх релевантних для регулювання апетиту та споживання їжі у суобставин. б'єктів, які страждають на такі розлади, як ожирінТермін "Синдром X" о хоплює переддіабетичня, булімія та нервова анорексія. ний синдром резистентності до інсуліну та ускладСполуки та композиції за цим винаходом є конення, що є його наслідками, резистентність до рисними також для лікування гострих або тимчаінсуліну, інсуліно-незалежний діабет, дисліпідемію, сових розладів чутливості до інсулін у, які іноді вигіперглікемію, ожиріння, коагулопатію, гіпертензію никають після хірургічного втр учання, травм, та інші ускладнення, пов'язані з діабетом. Способи інфаркту міокарда тощо. Сполуки та композиції за та схеми лікування, згадані в цьому описі, охопцим винаходом є корисними також для зниження люють вищезазначене та включають лікування рівнів тригліцеридів у плазмі. Підвищений рівень та/або профілактику будь-якого з перелічених нитригліцеридів, спричинений генетичною схильнісжче розладів або будь-якої їх комбінації: переддіа 17 83265 18 бетичного синдрому резистентності до інсуліну, та льні похідні зшитого декстрану, нікотиніловий ускладнень, що є його наслідками, резистентності спирт, нікотинова кислота, сіль нікотинової кислодо інсуліну, діабету типу II, або інсуліноти, агоністи PPARa, похідні фенофібринової киснезалежного діабету, дисліпідемії, гіперглікемії, лоти, гемфіброзил, клофібрат, фенофібрат, беножиріння та пов'язаних із діабетом ускладнень, в зафібрат, інгібітори поглинання холестерину, bтому числі серцево-судинних захворювань, особситостерол, інгібітори акрил-СоА:холестеринливо артеріосклерозу. ацилтрансферази, мелінамід, пробукол, агоністи Сполуки за цим винаходом можна ефективно PPAR d, сполуки, що протидіють ожирінню, фенфзастосовувати окремо або у комбінації з одним лурамін, дексфенфлурамін, фентирамін, сульбітабо кількома додатковими активними агентами, рамін, орлістат, інгібітори нейропептиду Y5, агонісзалежно від бажаної мети терапії. Комплексна ти b3-адренергічного рецептора та інгібітори терапія включає застосування комбінованої дозотранспортера жовчної кислоти клубової кишки. ваної фармацевтичної композиції, яка містить споСполуки за цим винаходом та їх фармацевтилуку за цим винаходом та один або кілька додатчно прийнятні солі, сольвати та гідрати мають цінні кових активних агентів, а також застосування фармакологічні властивості і можуть бути застососполуки за цим винаходом та кожного з активних вані у фармацевтичних композиціях, що містять агентів у формі окремих дозованих фармацевтичтерапевтично ефективну кількість сполуки за цим них композицій. Наприклад, сполуку за цим винавинаходом або її фармацевтично прийнятних соходом або її сіль та стимулятори секреції інсуліну, лей, складних ефірів або проліків у комбінації з наприклад, бігуаніди, меглітиніди, тіазолідиндіони, одним або фармацевтично прийнятними наповнюсульфонілсечовини, інсулін або інгібітори aвачами. Наповнювачами є інертні речовини, необглюкозидази можна вводити в організм пацієнта межувальними прикладами яких є носії, розріджуспільно у складі комбінованої пероральної дозовавачі, наповнювачі, ароматизатори, підсолоджувачі, ної композиції, наприклад, таблетки або капсули, змочувачі, в'яжучі, дезінтегратори, матеріали для або ж кожний з агентів можна вводити в окремих капсулювання та інші звичайні допоміжні речовипероральних дозованих формах. При застосуванні ни. Оптимальний наповнювач залежить від обраокремих дозованих форм сполуку за цим винахоного шляху введення в організм. У типових випаддом та один або кілька додаткових активних агенках фармацевтичні композиції містять від тів можна вводити в організм пацієнта практично приблизно 1% (мас.) до приблизно 99% (мас.) акодночасно, тобто паралельно, або в окремі рознетивного інгредієнта, котрий є сполукою за цим висені в часі моменти, тобто послідовно; мається на находом. увазі, що термін "комплексна терапія" охоплює усі Відповідно до варіанта, якому віддається петакі режими. ревага, фармацевтична композиція має форму Приклад комплексної терапії або профілактики дозованих одиниць. Термін "дозована одиниця" артеріосклерозу може включати застосування означає фізично дискретну одиницю, яка містить сполуки за цим винаходом або її солей у комбінаодиничну дозу, придатну для введення в організм ції з одним або кількома іншими активними тералюдини або інших ссавців. Наприклад, дозованою певтичними агентами: антигіперліпідемічними агеодиницею може бути капсула або таблетка, або нтами; агентами, що підвищують рівень HDL у кілька капсул або таблеток. плазмі; антигіперхолестеринемічними агентами, Термін "одинична доза" означає заздалегідь фібратами, вітамінами, аспірином тощо. Як вказавизначену кількість активної сполуки за цим винано вище, сполуки за цим винаходом можна застоходом, розраховану на досягнення бажаного терасовува ти у комбінації з кількома додатковими акпевтичного ефекту, у поєднанні з одним або кільтивними агентами. кома фармацевтично прийнятними Як інший приклад комплексної терапії можна наповнювачами. Кількість активного інгредієнта в розглядати лікування діабету та пов'язаних із ним одиничній дозі можна варіювати або встановлювазахворювань, при якому сполуки за цим винахоти в межах від приблизно 0,1мг до приблизно дом або їх солі можна ефективно застосовувати у 1000мг або більше, залежно від конкретної схеми комбінації з іншими активними терапевтичними застосування. агентами, наприклад, сульфонілсечовинами, бігуРежим дозування із застосуванням сполук за анідами, меглітинідами, тіазолідиндіонами, інгібіцим винаходом добирається пересічним фахівцем торами a-глюкозидази, іншими стимуляторами із медицини або ветеринарії з урахуванням різносекреції інсуліну, інсуліном, а також з активними манітних чинників, необмежувальними прикладаагентами, згаданими вище у зв'язку з лікуванням ми яких є вид, вік, маса тіла, стать, стан здоров'я артеріосклерозу. пацієнта, тяжкість патологічного стану, який поПрикладами згаданих інших терапевтичних требує лікування, спосіб застосування, рівень меагентів є сенсибілізатори до інсуліну, агоністи таболічних та екскреційних функцій пацієнта, заPPARg, глі тазони, троглітазон, піоглітазон, енглітастосовувана форма дозування, конкретна зон, МСС-555, BRL 49653, бігуаніди, метформін, застосовувана сполука або сіль тощо. фенформін, інсулін, інсуліноміметики, сульфонілВідповідно до варіанта, якому віддається перевага, сполуки за цим винаходом вводять в оргасечовини, толбутамід, гліпізид, інгібітори aнізм у формі одиничної добової дози, або ж загаглюкозидази, акарбоза, агенти зниження рівня льна добова доза може бути застосована у формі холестерину, інгібітори HMG-CoA-редуктази, ловачасткових доз, які вводять в організм два, три або статин, симвастатин, правастатин, флуваста тин, більше разів на добу. При застосуванні черезшкіратровастатин, ривастатин, інші статини, секвестним шляхом введення є безперервним. рати, холестирамін, колестипол, діалкіламіноалкі 19 83265 20 До шляхів введення, придатних для застосуУ порошках носієм є тонкоподрібнена тверда вання фармацевтичних композицій за цим винахоречовина, змішана з тонкоподрібненим активним дом належать, наприклад, пероральний, очний (у інгредієнтом. У таблетках активний інгредієнт зміформі крапель), ректальний, через слизові оболошаний у відповідному співвідношенні з носієм, нки, місцевий або введення через травильний котрий має необхідні в'яжучі властивості, і шляхом тракт; парентеральне постачання (у вигляді болюпресування сформований у таблетки бажаної фосів або інфузійним способом), в тому числі внутрірми та розмірів. шньом'язові, підшкірні ін'єкції та введення у спинУ композиціях можуть бути присутні різноманіний або кістковий мозок, а також тні інші матеріали у формі покриттів або модифівнутрішньооболонкові, прямі внутрішньошлуночкаторів фізичної форми дозованої одиниці. кові, внутрішньовенні, внутрішньоочеревинні, наНаприклад, таблетки можуть мати покриття з зальні або внутрішньоочні впорскування. Сполуки шелаку, цукру абообох цих речовин. Сироп або за цим винаходом можна застосовувати також у еліксир може містити, окрім активного інгредієнта, формі цілеспрямованих систем постачання лікарсахарозу як підсолоджувач, метил- та пропілпараських засобів, наприклад, у формі ліпосом, що бени як консерванти, барвник та ароматизатор, мають покриття з антитіла, специфічного до клітин наприклад, вишневий або апельсиновий ароматиендотелію. затор. Для перорального застосування сполуки за До стерильних рідин належать суспензії, емуцим винаходом можна без утруднень пристосувальсії, сиропи та еліксири. Активний інгредієнт моти шляхом поєднання активних сполук із фармаже бути розчинений або суспендований у фармацевтично прийнятними носіями, добре відомими у цевтично прийнятному носії, наприклад, у галузі. Такі носії уможливлюють виготовлення стерильній воді, стерильному органічному розчинкомпозицій сполук за цим винаходом у формі табнику або у суміші стерильної води зі стерильним леток, пілюль, порошків, пастилок, гранул, драже, органічним розчинником. капсул, рідин, еліксирів, настоїв, гелів, емульсій, Активний інгредієнт може бути також розчинесиропів, суспензій тощо, для перорального вжиний у придатному органічному розчиннику, напривання пацієнтом, який потребує лікування. Фармаклад, у водному розчині пропіленгліколю. Інші цевтичні композиції для перорального застосуванкомпозиції можна виготовляти шляхом диспергуня можна одержувати шляхом змішування вання тонкоподрібреного активного інгредієнта у активної сполуки з твердим наповнювачем, факуводному розчині крохмалю чи натрієвої каробксильтативного подрібнення одержаної суміші та пеметилцелюлози або у придатній олії. рероблення суміші гранул після додання (в разі На осердя драже наносять відповідні покритбажання) придатних допоміжних речовин для витя. Для цієї мети можна застосовувати концентроготовлення таблеток або осердь драже. вані розчини цукру, які можуть факультативно місДля перорального застосування у формі табтити аравійську камедь, тальк, полівінілпіролідон, леток або капсул активний інгредієнт можна поєдкарбополь-гель, поліетиленгліколь та/або діоксид нати з придатним для пероральних препаратів титану, розчини лаків та прийнятні органічні рознетоксичним фармацевтично прийнятним носієм. чинники або суміші розчинників. У покриття таблеНеобмежувальними прикладами носіїв є лактоза, ток або драже можна вводити барвники або пігмекрохмаль, сахароза, глюкоза, метилцелюлоза, нти з метою ідентифікації або для позначення карбонат кальцію, фосфат кальцію, сульфат кальрізних комбінацій доз активних сполук. цію, карбонат натрію, маніт, сорбіт тощо; факульДо фармацевтичних препаратів, які можна затативно композиції можуть містити дезінтегратори, стосовувати перорально, належать рознімні капнеобмежувальними прикладами яких є зшитий сули, виго товлені із желатину, а також м'які гермеполівінілпіролідон, кукурудзяний крохмаль, метилтизовані капсули, виготовлені із желатину та целюлоза, агар, бентоніт, ксантанова камедь, альпластифікатора, наприклад, гліцерину або сорбіту. гінова кислота або її сіль, наприклад, альгінат наРознімні капсули можуть містити активні інгредієнтрію тощо; в'яжучі агенти, необмежувальними ти в суміші з наповнювачем, наприклад, із лактоприкладами яких є желатин, акацієва камедь, призою, в'яжучими, наприклад, із крохмалем, та/або зі родні цукри, бета-лактоза, кукурудзяні підсолозмащувальними агентами, наприклад, із тальком джувачі, природні та синтетичні камеді, трагант, або стеаратом магнію, та факультативно зі стабіальгінат натрію, карбоксиметилцелюлоза, полілізаторами. У м'яких капсулах активні сполуки моетиленгліколь, воски тощо; змащувальні агенти, жуть бути розчинені або суспендовані у придатних необмежувальними прикладами яких є стеарат рідинах, наприклад, у жирних оліях, вазеліновому магнію, стеарат натрію, стеаринова кислота; олеат маслі або рідких поліетиленгліколях. Крім того, натрію, бензоат натрію, ацетат натрію, хлорид композиція може містити стабілізатори. натрію, тальк тощо. Якщо дозованою одиницею є Усі композиції для перорального застосування капсула, то вона може містити, окрім матеріалів мають містити дози, придатні для такого застосувищезгаданих типів, рідкий носій, наприклад, жирвання. Композиціями, особливо придатними для ну олію. перорального застосування, є дозовані одиниці, До твердих форм належать порошки, таблетки наприклад, таблетки та капсули. та капсули. Твердий носій може являти собою одДля парентерального застосування сполуки за ну або кілька речовин, які можуть діяти також як цим винаходом або їх солі можна поєднувати зі ароматизатори, змащувальні агенти, солюбілізастерильними водними або органічними середовитори, суспензатори, в'яжучі, дезінтегратори для щами для виготовлення розчинів або суспензій таблеток та капсулювальний матеріал. для ін'єкцій. Композиції для ін'єкцій можуть мати 21 83265 22 форму дозованих одиниць, наприклад, міститися в При виготовленні композицій за цим винахоампулах або у багатодозових контейнерах, із додом активний інгредієнт, як правило, змішують із мішкою консерванта. Ці композиції можуть мати носієм або розбавляють носієм, або вміщують у вигляд суспензій, розчинів або емульсій у масляносій, котрий може мати форму капсули, саше, них або водних носіях та можуть містити допоміжні паперового пакета або іншого контейнера. Якщо речовини, наприклад, суспензатори, стабілізатори носій виконує функцію розріджувача, то він може та/або диспергатори. До фармацевтичних форм, бути твердим матеріалом, ліофілізованим твердим придатних для застосування шляхом ін'єкцій, наматеріалом або пастою, напівтвердим або рідким лежать стерильні водні розчини або дисперсії та матеріалом, що діє як носій, або ж мати форму стерильні порошки для негайного приготування таблеток, пілюль, порошків, пастилок, еліксирів, стерильних розчинів або дисперсій для ін'єкцій. У суспензій, емульсій, сиропів, аерозолів (у твердовсіх випадках лікарська форма має бути стерильму вигляді або у рідкому середовищі), або мазей, ною та досить плинною для уможливлювання впоякі містять, наприклад, до 10% (мас.) активної рскування. Вона має бути стабільною в умовах сполуки. Відповідно до варіанта, якому віддається виготовлення та зберігання та захищеною від перевага, сполуки за цим винаходом перед застобудь-якого забруднення. Носієм може бути розсуванням вводять до складу лікарських форм. чинник або дисперсійне середовище, яке містить, Біологічні випробування наприклад, воду, відповідно до варіанта, якому Випробування на зв'язування з конкурентним віддається перевага, з домішкою фізіологічно сувитісненням місного буфера, наприклад, розчин Хенка, розчин Випробування на зв'язування виконують за Рінгера або фізіологічний буферний сольовий розметодом сцинтиляційного визначення спорідненочин, етанол, поліол (наприклад, гліцерин, пропілесті (SPA) із застосуванням рецепторів PPAR та нгліколь та рідкий поліетилен-гліколь), прийнятні відповідних радіомічених лігандів. Кожний з рецепсуміші згаданих розчинників та рослинні олії. В торів PPARa та PPARg разом з їхнім гетеродимерразі зберігання та застосування у звичайних умоним партнером - a-рецептором кретиноїду Х вах ці препарати містять консерванти для запобіодержують із застосуванням бакуловірусної сисгання розвитку мікроорганізмів. теми експресії. Для сполучення відповідних димеРозчини для ін'єкцій, виготовлені, як описано рів рецепторів із гранулами силікату ітрію для SPA вище, можна вводити внутрішньовенним, внутрішзі стрептавідиновим покриттям застосовують біоньоочеревинним, підшкірним або внутрішньом'я тинільовані олігонуклеотиди, які містять елементи зовим шляхами; при лікуванні людей перевага реакції на PPAR (PPREs). Ліганди, специфічні відвіддається внутрішньом'язовому введенню. носно PPARg та PPARa, мітять тритієм і застосоДля введення через слизові оболонки у складі вують у відповідних випробуваннях. Значення ІС50 композиції застосовують пенетранти, придатні для (концентрацій сполуки, які забезпечують 50% інгіподолання бар'єру, через який має проходити лібування) для кожної конкурентної сполуки обчискарський засіб. Такі пенетранти, як правило, відомі люють після виключення неспецифічного зв'язув галузі. Активні сполуки можна застосовувати вання (яке вимірюють у присутності 10мМ також назальним способом, наприклад, у вигляді неміченого ліганду). Сполуки оцінюють на основі рідких крапель або спреїв. кривої доза-реакція, побудованої за 11 точками, Для введення защічним шляхом композиції що відповідають концентраціям від 0,169нМ до можуть мати форму таблеток або пастилок, виго10мМ. Подані результати є середніми значеннями товлених відомими способами. для 1-7 експериментів. Для введення шляхом інгаляції сполуки, що Випробування котрансфекції (CTF) застосовуються за цим винаходом, зручно постаРецептори PPARg або PPARa конститутивно чати у формі сухи х порошків, вміщених у відповідні експресують, застосовуючи плазміди, що містять інгалятори, або аерозольних спреїв, які вводять із промотор цитомегаловірусу. Репортерні плазміди контейнерів під тиском або з розпилювачів із викодля випробування CTF PPARg містять PPRE з таристанням придатного пропелента, наприклад, ких генів: ацил-СоА-оксидази (АОХ); аполіпопротедихлордифторметану, трихлорфторметану, дихїну A1 (Apo A1); ліпопротеїн-ліпази (LPL); або енолор-тетрафторетану, діоксиду вуглецю або іншого їл-СоА-гідратази/3-гідроксіацил-СоА-дегідрогенази придатного газу. У випадку застосування аерозо(HD) плюс промотор тимідинкінази (ТК), розташолю під тиском дозовану одиницю можна визначати ваний вище у кДНК репортера люциферази. Зашляхом обладнання контейнера клапаном для стосовують також хімеричну систему PPARg бакпостачання відміряної кількості. Можуть бути виготеріальної галактозидази (GAL4). Стандартною товлені желатинові капсули або картриджі для системою для випробування CTF PPARa є хімеризастосування в інгаляторах або інсуфляторах, які чна система GAL4. Усі випробування виконують із містять порошкоподібну суміш активної сполуки з застосуванням клітин CV-1. Сполуки випробовупридатною порошковою основою, наприклад, лакють у повному діапазоні логарифмічних розведень тозою або крохмалем. від 0,1нМ до 10мМ із виконанням двох паралельФармацевтичні композиції за цим винаходом них дослідів. Визначають ефективність (у відсотможна виготовляти способами, які є самі по собі ках) відносно речовин порівняння; значення ефеквідомими, наприклад, шляхом звичайного змішутивності відображає максимальну активність вання, розчинення, гранулювання, дражування, агоніста, досягнуту для кожної сполуки при випровідмулювання, емульгування, капсулювання, влобуванні CTF. Значення медіанної ефективної конвлювання або ліофізізації. центрації (ЕС50) визначають шляхом комп'ютерної апроксимації кривих доза-реакція. Значення ЕС50 23 83265 24 не обчислюють, якщо ефективність для сполуки 10.00год та 12.00год (освітлення кліток починають менше 20%. Подані результати є середніми зназ 06.00год), і розподіляють тварин по дослідних ченнями для 2-9 окремих експериментів. групах (n=5 або n=6) на основі вихідних рівнів глюВипробування поповнення кофактора кози. Оброблення сполуками або носієм виконуВипробувальну двогібридну систему ссавців у ють щоденно шляхом перорального згодовування форматі CTF створюють у клітинах CV-1. Застосоприблизно о 07,30год. Визначають масу тіла на вують такі плазміди: вектор експресії ссавців, який початку (день 0) та наприкінці досліду (день 7 або кодує конденсацію домену зв'язування ДНК GAL4 14). Відбирають кров із хвостів некормлених тварин у гепаринізовані пробірки через 2-3год після з доменом зв'язування ліганду PPARg; вектор ексвведення останньої дози. Визначають гематокрит, пресії ссавців, який кодує конденсацію домену рівні глюкози та тригліцеридів. Подані значення транс-активації VP16 із доменом взаємодії нуклерівнів глюкози та тригліцеридів характеризують арного рецептора відповідних коактиваторів: протеїну зв'язування CREB (СВР), гаммаступінь нормалізації (%) у порівнянні з контрольними тваринами, для яких ці рівні взято за 100%, коактиватора-1 рецептора, що активується проліабо ступінь нормалізації глюкози відносно нормафераторами пероксисом (PGC-1), коінтегратора-2 льного рівня глюкози 250мг/дл. Статистичн у знаактивувального сигналу (ASC-2), протеїнового чущість зіставлення експериментальних груп оцікомплексу, що активується рецептором тироїдного гормону (TRAP220) та пептиду С33; та репортерну нюють із застосуванням двостороннього t-критерію Ст’юдента. У поданих нижче таблицях наведено плазміду (мультимеризовані місця зв'язування одержані in vitro результати для сполуки за цим САL4/мінімальний промотор ТК, що керує кДНК винаходом - (2S)-3-(4-{[2-(4-метоксифеніл)-етиллюциферази). Клітини трансфікують у періодичкарбамоїл]-метокси}-феніл)-2-метокси-пропіонової ному форматі та обробляють сполуками (у повному діапазоні логарифмічних розведень від 0,1нМ кислоти, яка має структурну формулу III до 10мМ) або носієм протягом 24год. Потім клітини лізують, і вимірють активність люциферази. Активність люциферази є показником кінцевої точки взаємодії між коактиватором та рецептором. Одержані результати виражають у відсотках ефективності відносно повного агоніста PPARg. Подані результати є середніми значеннями для 4-6 окремих експериментів. Визначення рівнів глюкози, тригліцеридів та гематокриту та збільшення маси тіла у діабетичТаблиця 1 них мишей Самців діабетичних (db/db) мишей у віці 5 тиВипробування зв’язування та CTF жнів (одержаних від фірми Harlan Laboratories, Indianapolis, IN) вміщують у пластмасові клітки (по 6 тварин у клітці; розмір кліток приблизно 10´20´8 IC50 ІС50 Ефект, Ефект, (a) (g) (a) ЕС50 (a) (g) ЕС50 (g) дюймів (25´50´20см), підстилка з осикових стружок) із вільним доступом до води (чашкова систе113 52 43 1305 60 1893 ма, водопровідна вода) та корму (Purina 5008). Після двотижневої акліматизації у тварин (у віці 7 тижнів) беруть проби крові у день 0 в період між Таблиця 2 Випробування поповнення коф актора СВР Ефект. 15 СВР EC50 1917 PGC1 Ефект 24 PGC1 EC50 20657 TRAP220 Ефект. 7 Таблиця 3 Випробування на елементи реакції Gla4 Ефект. 30 Gla4 EC50 1977 HD Ефект. 54 HD EC50 1136 LPL Ефект. 86 LPL EC50 1419 ІС50 та ЕС50 у нМ; CTF (Ефект.) у % ефективності. TRAP220 EC50 Eff>20 ASC2 Ефект 15 ASC2 EC50 1378 C33 Ефект. 13 С33 EC50 3013 Як видно з поданих вище таблиць, сполука формули ІІІ несподівано виявляється частковим агоністом PPARg з високою спорідненістю, а також виявляє активність щодо PPARa. Як видно з Таблиці 1, ця сполука зв'язує PPARg з високою спорідненістю (ІС50=52нМ) та PPARa з відносно нижчою спорідненістю (ІС50=113нМ). Сполука формули III виявляє активність як частковий агоніст PPARg, про що свідчать результати випробувань котрансфекції та поповнення кофактора. Як видно з Таблиці 1 та Таблиці 3, ефективність щодо PPARg (відсоток ефективності відносно повного агоніста PPARg, що прийнята за 100%), досягнена при за 25 83265 26 стосуванні цієї сполуки, лежить у межах від 30% сполуки формули III. Оскільки загальною особлидо 86%. Крім того, здатність цієї сполуки поповнювістю повних агоністів PPARg є протидіабетична дія у комбінації з тенденцією до збільшення об'єму вати специфічні кофактори PPARg лежить у межах від 7% до 24% у зіставленні з повним агоністом плазми [дивись Армстронг та Кінг (Armstrong and King, 2004), Мудальяр та ін. (Mudaliar, et al., 2003), PPARg (де поповнення прийняте за 100%: Таблиця Несто та ін. (Nesto et al., 2004)], одержані нами 2); таким чином, сполука формули III є частковим дані дозволяють припустити, що сполука формули агоністом PPARg. Вищезазначена сполука виявляє III може бути вдосконаленим засобом для лікувантакож активність як агоніст PPARa, як видно з табня діабету типу II у порівнянні з наявними нині на лиці 1 (ефективність 43%, ЕС50=1305нМ). ринку агоністами PPARg. З метою з'ясування протидіабетичної ефектиУ поданих нижче таблицях наведено одержані вності та профілю побічних ефектів сполуки форin vitro результати для сполуки за цим винаходом мули III, діабетичним (db/db) мишам щоденно вво(S)-3-(4-{[2-(4-етоксифеніл)-етилкарбамоїл]дили перорально сполуку формули III у добових метокси}-феніл)-2-метокси-пропіонової кислоти, дозах 1мг/кг, 3мг/кг, 10мг/кг та 30мг/кг протягом 14 яка має структурну формулу V днів шляхом згодовування. Перед початком дослідження (день 0) та наприкінці його (день 14) визначали рівень глюкози у плазмі та рівень гематокриту. Сполука формули ІІІ виявляє високу протидіабетичну ефективність, знижуючи рівень глюкози у плазмі у всі х випробуваних дозах (ступінь нормалізації 42,7%, 68,3%, 96,1% та 109,3%). Несподівано виявлено відсутність залежного від дози зниження рівня гематокриту, який є показником збільшення об'єму плазми, після введення Таблиця 1 Випробування зв'язування та CTF ІС50(a) 360 ІС50(g) 30 Ефект, (a) 39 ЕС50 (a) 1814 Ефект, (g) 60 ЕС50(g) 1012 Таблиця 2 Випробування поповнення коф актора СВР СВР ЕС50 Ефект. 18 2638 PGC1 Ефект 24 PGC1 ЕС50 2597 TRAP220 Ефект. 16 TRAP22 ЕС50 3063 ASC2 Ефект 33 ASC2 ЕС50 2868 C33 С33 ЕС50 Ефект. 43 2893 Таблиця 3 Випробування на елементи реакції Gla4 Ефект. Gla4 ЕС50 HD Ефект. HD ЕС50 39 1907 58 1041 LPL Ефект. 80 LPL ЕС50 466 ApoA1 Ефект. 39 ApoA1 ЕС 50 335 IC50 та ЕС50 у н М; CTF (Ефект.) у % е фективності. Як видно з поданих вище таблиць, сполука формули V несподівано виявляється частковим агоністом PPARg з високою спорідненістю, а також виявляє активність щодо PPARa. Як видно з Таблиці 1, ця сполука зв'язує PPARg з високою спорідненістю (ІС50=30нМ) та PPARa з відносно нижчою спорідненістю (ІС50=360нМ). Сполука формули V виявляє активність як частковий агоніст PPARg, про що свідчать результати випробувань котрансфекції та поповнення кофактора. Як видно з Таблиці 1 та Таблиці 3, ефективність щодо PPARg (відсоток ефективності відносно повного агоніста PPARg, що прийнята за 100%), досягнена при застосуванні цієї сполуки, лежить у межах від 39% до 80%. Крім того, здатність цієї сполуки поповнювати специфічні кофактори PPARg лежить у межах від 16% до 43% у зіставленні з повним агоністом PPARg (де поповнення прийняте за 100%: Таблиця 2); таким чином, сполука формули V є частковим агоністом PPARg. Вищезазначена сполука виявляє також активність як агоніст PPARa, як видно з таблиці 1 (ефективність 39%, ЕС50=1814нМ). З метою з'ясування протидіабетичної ефективності та профілю побічних ефектів сполуки формули III, діабетичним (db/db) мишам та їхнім контрольним аналогам (db?/+) щоденно вводили перорально сполуку формули V у добових дозах 1мг/кг, 3мг/кг, 10мг/кг та 30мг/кг протягом 7 днів 27 83265 28 шляхом згодовування. Перед початком дослітидіабетична ефективність повних агоністів PPARg дження (день 0) та наприкінці його (день 7) визнасупроводжується значним збільшенням маси тіла чали рівень глюкози у плазмі та рівень гематокрита збільшення об'єму плазми, то подані в цьому ту, а також масу тіла. Сполука формули V виявляє описі дані свідчать, що сполука формули V може високу протидіабетичну ефективність, знижуючи забезпечити вдосконалене лікування діабету типу рівень глюкози та тригліцеридів у плазмі у всіх II у порівнянні з наявними нині на ринку агоністами випробуваних дозах (глюкоза: ступінь нормалізації PPARg. 61,2%, 87,5%, 105,6%, 110,3%; тригліцериди: стуПодана нижче схема синтезу ілюстр ує загальпінь нормалізації 108,1%, 108,1%, 121,1%, ний спосіб синтезу сполук за цим винаходом. Схе130,6%). Несподівано виявлено, що застосування ма детально ілюстрована поданими нижче присполуки формули V у будь-яких дозах не викликає кладами. статистично значущи х змін збільшення маси тіла Загальна схема синтезу або рівнів гематокриту. Оскільки відомо, що про Приклад 1 (2S)-3-(4-{[2-(4-метоксифеніл)-етилкарбамоїл]-метокси}-феніл)-2-метоксипропіонова кислота 29 83265 Стадія 1: Синтез сполуки (b) Сполуку (а) розчиняють в ацетонітрилі (0,1М), і обробляють 2екв. трет/-бутилового складного ефіру 2-бром-2-метил-пропіонової кислоти та 2,5екв. карбонату цезію. Реакційну суміш перемішують при 80°С протягом приблизно 24год, фільтрують і концентрують. Неочищений продукт очищають хроматографією на колонці із силікагелем (елюент 10% етилацетату в гексані). Стадія 2: Синтез сполуки (с) Сполуку (b), одержану на Стадії 1, розчиняють у три фтороцтовій кислоті (TFA) та СН 2СІ2 (1:1; 0,5М). Реакційну суміш перемішують протягом приблизно 2год і концентрують. Неочищений продукт використовують на наступній стадії. Стадія 3: Синтез сполуки (d) Сполуку (с), одержану на Стадії 2, розчиняють у ди хлорметані (DCM) і обробляють 2екв. карбодііміду, прищепленого до полістиролу (PSкарбодііміду), та 1екв. HOBT, а потім 1,1екв. 2-(4етоксифеніл)-етиламіну. Реакційну суміш перемішують протягом приблизно 10год при кімнатній температурі, застосовуючи орбітальне перемішування. Прищеплений до субстрату реагент відділяють фільтруванням, і двічі промивають DCM. 30 Неочищений продукт розчиняють у DCM, і додають PS-трисамін (2екв.) та PS-ізоціанат (1екв.). Реакційну суміш перемішують протягом 2год при кімнатній температурі, застосовуючи орбітальне перемішування. Прищеплені до субстрату поглиначі відділяють фільтруванням, і двічі промивають DCM. Розчинник видаляють, і одержаний неочищений продукт використовують на стадії гідролізу. Стадія 4: Синтез сполуки (e) Сполуку (d), одержану на Стадії 3, розчиняють у МеОН і обробляють 10екв. 1Μ водного розчину NaOH. Реакційну суміш перемішують при кімнатній температурі до завершення гідролізу за даними аналізу РХВЕ. Додають 1Μ НСl (1Μ у воді) (до рН=3), і розчинник видаляють у вакуумі. Залишок розчиняють у суміші СН 2СІ2/Н2О, і фільтрують через картридж ChemElute. Елюент концентрують і очищають РХВЕ з мас-спектроскопічним детектуванням, одержуючи вказану в заголовку сполуку у вигляді білої твердої речовини. MS (ES) для C21H25NO 6 [M-H]+: 386; т.пл. 97-98°С. Приклад 2 (R)та (S)-3-(4-гідроксифеніл)-2-метоксипропіонова кислота, натрієва сіль 31 83265 Стадії 1. 2 та 3: Синтез сполуки (d) Метиловий складний ефір (+/-)-3-(4гідроксифеніл)-2-метокси-пропіонової кислоти Трет-бутилат калію (1,6Μ розчин у тетрагідрофурані, 1163мл, 1,86моль) охолоджують у бані із сухим льодом та ацетоном в атмосфері азоту до -40°С. Протягом 30-60хв додають суміш 4бензилоксибензальдегіду (358,9г, 1,69моль) та метилметоксіацетату (184,3мл, 1,86моль) у тетрагідрофурані (1076мл). Реакційну суміш перемішують при -40°С протягом приблизно 1-2год, і одержують проміжний продукт (b). До проміжного продукту (b) повільно додають протягом 25хв розчин трифтороцтового ангідриду (710,3г, 3,38моль) у тетрагідрофурані (1600мл), і реакційній суміші дають нагрітися до температури не вище 15°С. Перемішують реакційну суміш протягом ночі, і одержують сполуку (с). Суспендують паладій на вугіллі (5%, 125,4г) у тетрагідрофурані (500мл). Додають реакційну суміш, яка містить сполуку (с) (приблизно 4500мл), і ополіскують посудину, в якій вона містилася, тетрагідрофураном (1000мл). Вміщують реакційну суміш в апарат Парра для струшування в атмосфері водню під тиском 25 фунті в на кв.дюйм (172,5кПа) при кімнатній температурі. Гідрують реакційну суміш протягом 26год при температурі приблизно 19-32°С. Фільтрують суміш через матеріал Hyflo Supercel®, і ополіскують апарат Парра тетрагідрофураном (2000мл). Органічний розчин концентрують у вакуумі до мінімально можливого 32 об'єму. Додають до залишку толуол (2500мл), і розчин ретельно промивають 10% розчином NаНСО3 (280г у 2800мл води). Розділяють шари, і промивають органічну фазу водою (2800мл). Органічну фазу концентрують у вакуумі, і одержують приблизно 271,8г (76%) сполуки (d), метилового складного ефіру (+/-)-3-(4-гідроксифеніл)-2метокси-пропіонової кислоти, у вигляді масла. Стадія 4: Синтез сполуки (f) Натрієва сіль (S)-3-(4-гідроксифеніл)-2метокси-пропіонової кислоти Розчин 0,75Μ ΚΗ2ΡΟ4 доводять до рН=7,4-7,8 за допомогою 5Μ NaOH. Додають фермент Chiro CLEC CR при помірному перемішуванні, а потім розчин сполуки (d) (10,0г, 47,6ммоль) у толуолі (100мл). Проводять ферментативний гідроліз при кімнатній температурі, і в разі необхідності додають 1Μ NaOH для підтримання pH вище 6,5. Гідроліз припиняють, коли ступінь перетворення у водному шарі досягає, за даними аналізу (дивись вказані нижче умови РХВЕ), 35-42%, як правило, за час від приблизно 4год до 36год, залежно від активності ферменту. Фермент відфільтровують від розчину і промивають буферним розчином КН2РО4 (1-2мл). Розділяють водний та органічний шари. Доводять водний шар до рН=1,9-2,1 за допомогою 4Μ НСI, підтримуючи температуру 2025°С. Екстрагують водний шар ізопропілацетатом. Розділяють шари. Вимірюють об'єм ізопропілацетатного розчину і обчислюють концентрацію сполуки (e). Ізопропілацетатну фазу концентрують у 33 83265 34 вакуумі до концентрації 70-80мг/мл. Вимірюють 8,3 об'єму), доведеного до pH 7,5 за допомогою 5об'єм і обчислюють кількість молей сполуки (e) н. NaOH, та хімотрипсину (25,6г, 1,8% мас). Потім перед кристалізацією. При кімнатній температурі реакційну суміш перемішують при 20-25°С протята при помірному перемішуванні додають до ізогом 49год при інтенсивному перемішуванні, не пропілацетатного розчину сполуки (e) розчин ацедопускаючи, однак, контакту між лопатками мішалтату натрію у метанолі (масово-об'ємне відношенки та стінкою колби з метою зведення до мінімуму ня 11%) до досягнення молярного відношення деструкції ферменту. Розчин продукту фільтр ують ацетату натрію до сполуки (e) 1,3. Через 5-10хв через Hyflo Supercel®, і шар фільтрувального маспостерігається помутніння та кристалізація. У разі теріалу на фільтрі промивають буферним розчивідсутності кристалізації у розчин вносять затравку ном 0,75Μ ΚΗ2ΡΟ4 (1280мл, 0,9 об'єму), доведеносполуки (f). Коли помутніння та кристалізація стаго до pH 7,5 за допомогою 5-н. NaOH. До розчину ють очевидними, швидкість перемішування зменпродукту додають додаткову кількість метил-третшують, і продовжують перемішування при кімнатбутилового простого ефір у (1280мл, 0,9 об'єму) ній температурі протягом 12год. Кристали для більш чіткого розділення органічної та водної відділяють фільтруванням, промивають ізопропіфаз. Відділяють водну фазу від органічної фази і лацетатом кімнатної температури (15мл) і сушать знижують її pH до 2,0 за допомогою 4-н. НСІ у вакуумі при 45°С, одержуючи сполуку (f) (3,1(3000мл, 2,1 об'єму). Водну фазу фільтрують че3,6г), натрієву сіль (S)-3-(4-гідроксифеніл)-2рез Hyflo Supercel® для відділення твердої речометокси-пропіонової кислоти. Якщо випробування вини від ферменту, і шар фільтрувального матеріхірального енантіомерного надлишку (ее) показує алу на фільтрі промивають буферним розчином ее
ДивитисяДодаткова інформація
Назва патенту англійськоюSelective peroxisome proliferator activated receptor modulators
Автори англійськоюFerritto-Crespo Rafael, Martin-Ortega Finger Maria Delores
Назва патенту російськоюСелективные модуляторы рецепторов, которые активируются пролифераторами пероксисом
Автори російськоюФерритто-Креспо Рафаэль, Мартин-Ортега Финхер Мария Делорес
МПК / Мітки
МПК: C07C 235/20, A61K 31/192, A61P 3/10
Мітки: проліфераторами, пероксисом, активуються, модулятори, селективні, рецепторів
Код посилання
<a href="https://ua.patents.su/20-83265-selektivni-modulyatori-receptoriv-shho-aktivuyutsya-proliferatorami-peroksisom.html" target="_blank" rel="follow" title="База патентів України">Селективні модулятори рецепторів, що активуються проліфераторами пероксисом</a>
Попередній патент: Щогла освітлювальна
Наступний патент: Оксазольні похідні тетрациклінів
Випадковий патент: Секційний трубчастий теплообмінний апарат












