Фармацевтична композиція для місцевого лікування неоваскулярних розладів очей
Номер патенту: 94427
Опубліковано: 10.05.2011
Автори: Міллер Вілл'ям Генрі, Левік Марк, Бріґанді Річард Ентоні
Формула / Реферат
1. Фармацевтична композиція для місцевого застосування, яка містить сполуку формули (І):
 (І)
(І)
або її сіль чи сольват для застосування при лікуванні неоваскулярних розладів очей шляхом безпосереднього нанесення на око.
2. Композиція за п. 1, де згаданою сполукою є сполука формули(І'):
 НСl (І').
НСl (І').
3. Композиція за п. 1 або 2, де згаданою сполукою є сполука формули(I''):

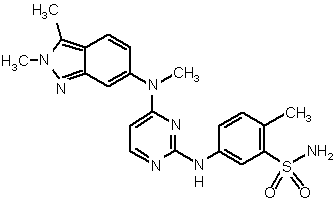
![]() (I'')
(I'')
і де згадана комплексна сполука вводиться місцево на око.
4. Композиція для місцевого застосування за будь-яким з пп. 1-3 у формі очних крапель, де сполука формули І, І' або І'' є розчиненою або суспендованою в придатному носії.
5. Композиція для місцевого застосування за будь-яким з пп. 1-4 для введення в комбінації з одним або кількома додатковими терапевтичними агентами для лікування неоваскулярних розладів.
6. Композиція для місцевого застосування за п. 5, де одним або кількома додатковими терапевтичними агентами є пегаптаніб та/або ранібізумаб.
7. Композиція для місцевого застосування за будь-яким з пп. 5-6, де один або кілька додаткових терапевтичних агентів вводяться окремо.
8. Композиція для місцевого застосування за п. 7, де один або кілька додаткових терапевтичних агентів вводяться різними способами.
9. Композиція для місцевого застосування за будь-яким з пп. 1-8, де неоваскулярним розладом очей є неоваскулярний розлад сітківки.
10. Композиція для місцевого застосування за п. 9, де неоваскулярним розладом очей є пов'язана з віком ексудативна дистрофія жовтої плями (ДЖП), ангіоїдні смуги, патологічна короткозорість, синдром очного гістоплазмозу, розломи у мембрані Бруша, набряк жовтої плями (охоплюючи діабетичний набряк жовтої плями), саркоїдоз, увеїт, атрофічна ДЖП, кератоконус, синдром Шегрена, короткозорість, пухлини очей, відторгнення трансплантата рогівки, пошкодження рогівки, неоваскулярна глаукома, вкривання рогівки виразками, рубцювання рогівки, проліферативна вітреоретинопатія, ретинопатія від дочасних пологів, дегенерація сітківки, хронічна глаукома, відшарування сітківки та ретинопатія серпастих клітин.
11. Композиція для місцевого застосування за п. 10, де неоваскулярним розладом є пов'язана з віком ексудативна дистрофія жовтої плями (ДЖП).
12. Композиція для місцевого застосування за будь-яким з пп. 1-11 для запобігання неоваскулярним розладам очей.
13. Композиція для місцевого застосування за будь-яким з пп. 1-11 для лікування неоваскулярних розладів очей.
14. Композиція для місцевого застосування за будь-яким з пп. 1-11 для зменшення швидкості розвитку розладу.
15. Застосування сполуки формули (І):
 (І)
(І)
або її солі, або сольвату у виробництві лікарського засобу для лікування неоваскулярних розладів очей шляхом безпосереднього нанесення на око.
16. Застосування за п. 15, де згаданою сполукою є сполука формули (І'):
 НСl (І').
НСl (І').
17. Застосування за будь-яким з пп. 15-16, де згаданою сполукою є сполука формули (І''):

![]() (I'').
(I'').
18. Застосування за будь-яким з пп. 15-17, де лікарський засіб є у формі очних крапель, в яких сполука формули І, І' або І'' розчинена або суспендована в придатному носії.
19. Застосування за будь-яким з пп. 15-18, де лікарський засіб вводять в комбінації з одним або кількома додатковими терапевтичними агентами для лікування неоваскулярних розладів.
20. Застосування за п. 19, де одним або кількома додатковими терапевтичними агентами є пегаптаніб та/або ранібізумаб.
21. Застосування за будь-яким з пп. 19-20, де один або кілька додаткових терапевтичних агентів вводяться окремо.
22. Застосування за п. 21, де один або кілька додаткових терапевтичних агентів вводяться різними способами.
23. Застосування за будь-яким з пп. 15-22, де неоваскулярним розладом очей є неоваскулярний розлад сітківки.
24. Застосування за п. 23, де неоваскулярним розладом очей є пов'язана з віком ексудативна дистрофія жовтої плями (ДЖП), ангіоїдні смуги, патологічна короткозорість, синдром очного гістоплазмозу, розломи у мембрані Бруша, набряк жовтої плями (охоплюючи діабетичний набряк жовтої плями), саркоїдоз, увеїт, атрофічна ДЖП, кератоконус, синдром Шегрена, короткозорість, пухлини очей, відторгнення трансплантата рогівки, пошкодження рогівки, неоваскулярна глаукома, вкривання рогівки виразками, рубцювання рогівки, проліферативна вітреоретинопатія, ретинопатія від дочасних пологів, дегенерація сітківки, хронічна глаукома, відшарування сітківки та ретинопатія серпастих клітин.
25. Застосування за п. 24, де неоваскулярним розладом очей є пов'язана з віком ексудативна дистрофія жовтої плями (ДЖП).
26. Застосування за будь-яким з пп. 15-25, для запобігання неоваскулярним розладам очей.
27. Застосування за будь-яким з пп. 15-25, для лікування неоваскулярних розладів очей.
28. Застосування за будь-яким з пп. 15-25, для сповільнення розвитку розладу.
Текст
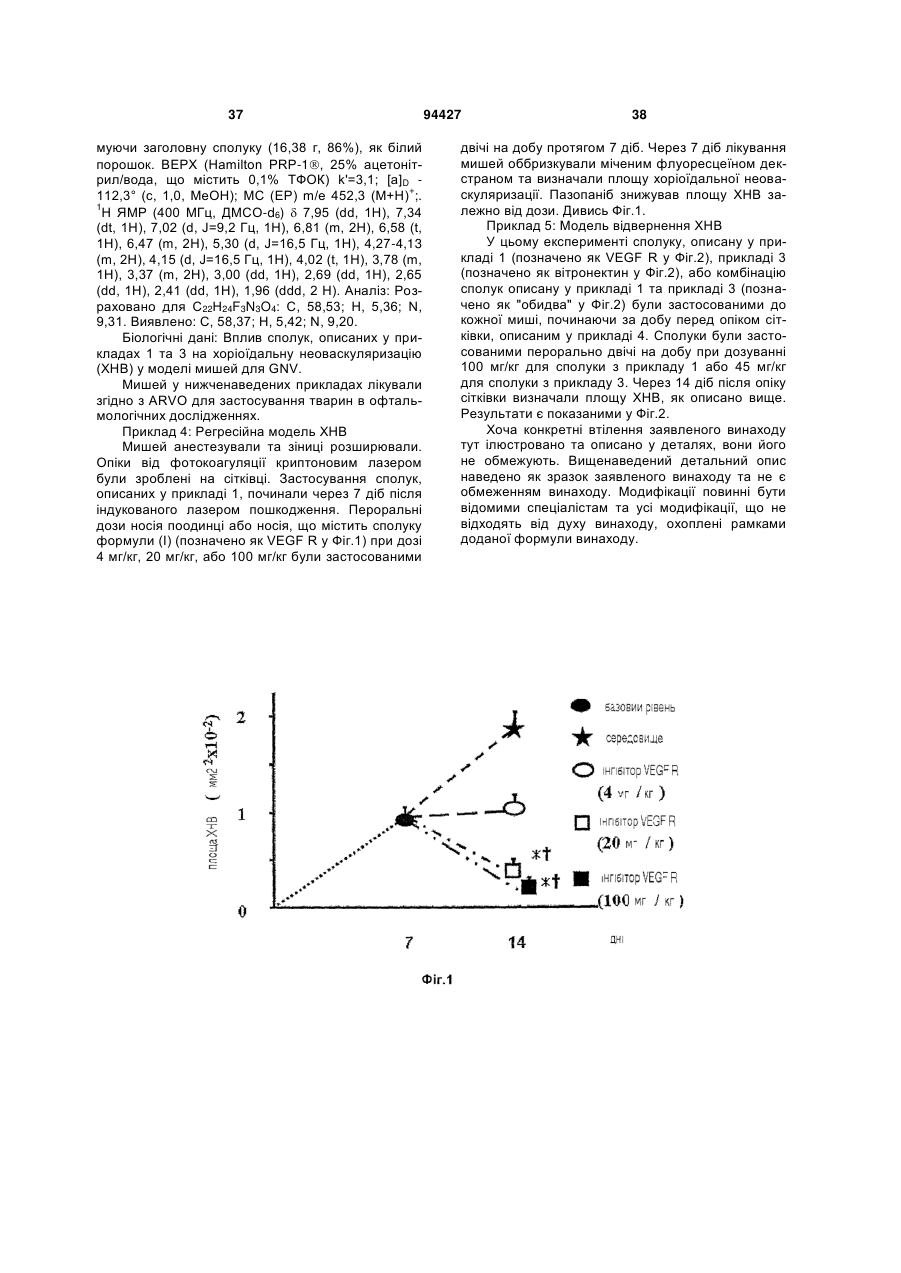
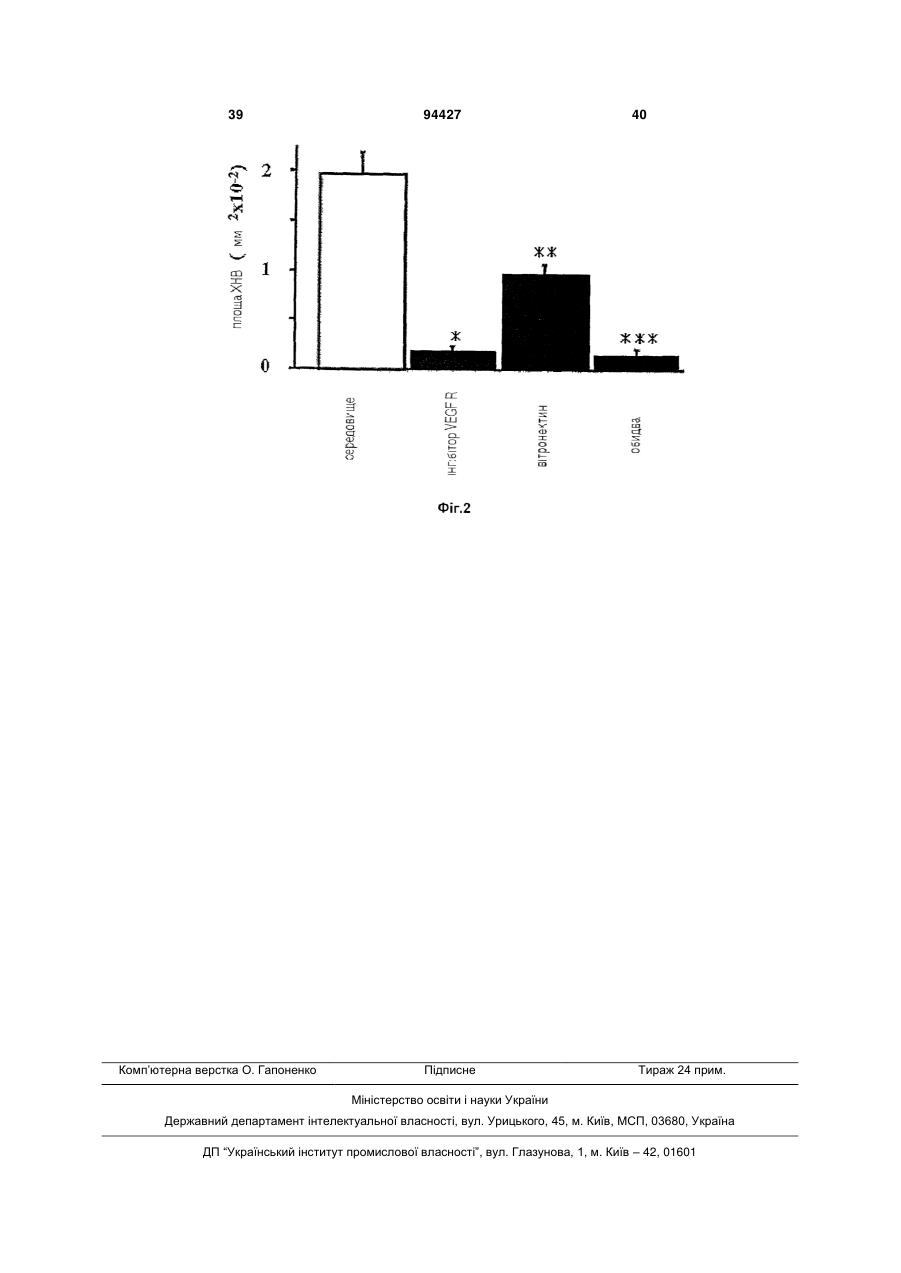
1. Фармацевтична композиція для місцевого застосування, яка містить сполуку формули (І): H3C CH3 S O NH2 O (І) або її сіль чи сольват для застосування при лікуванні неоваскулярних розладів очей шляхом безпосереднього нанесення на око. 2. Композиція за п. 1, де згаданою сполукою є сполука формули(І'): H3C H3C N N N CH3 CH3 N N N H S NH2 O O НСl (І'). 3. Композиція за п. 1 або 2, де згаданою сполукою є сполука формули(I''): (13) N H N C2 CH3 N 94427 N (11) N UA H3C N (19) (21) a200805311 (22) 29.11.2006 (24) 10.05.2011 (86) PCT/US2006/045776, 29.11.2006 (31) 60/740,478 (32) 29.11.2005 (33) US (46) 10.05.2011, Бюл.№ 9, 2011 р. (72) БРІҐАНДІ РІЧАРД ЕНТОНІ, US, ЛЕВІК МАРК, AU, МІЛЛЕР ВІЛЛ'ЯМ ГЕНРІ, US (73) СМІТКЛЯЙН БІЧАМ КОРПОРЕЙШН, US (56) WO 02/059110 A, 01.08.2002 US 2004/082559 A1, 29.04.2004 WO 03/106416 A, 24.12.2003 WO 2006/117666 A, 09.11.2006 US 6 825 188 B2, 30.11.2004 WO 98/14192 A, 09.04.1998 HOYNG C B ET AL: "AG-013958 (VEGFR inhibitor) achieves effective choroidal concentrations withminimal systemic effects in cynomolgus monkeys and humans with age-related macular disease" INVESTIGATIVE OPHTHALMOLOGY & VISUAL SCIENCE, ASSOCIATION FOR RESEARCH IN VISION AND, US, vol. 46, no. Suppl S, May 2005 (2005-05), page 2365 KHALIL D ET AL: "Nonclinical ADME studies of AG013958 demonstrate sustained ocular exposure and low systemic exposure" INVESTIGATIVE OPHTHALMOLOGY & VISUAL SCIENCE, ASSOCIATION FOR RESEARCH IN VISION AND, US, vol. 46, no. Suppl S, May 2005 (2005-05), page 5378 GALE D C ET AL: "Ocular pharmacokinetics in single compound and cassette dose studies following subTenon administration in Dutch-belted rabbits" INVESTIGATIVE OPHTHALMOLOGY & VISUAL SCIENCE, ASSOCIATION FOR RESEARCH IN VISION AND, US, vol. 46, no. Suppl S, 5 May 2005 (2005-05-05), page 5381 SORBERA L A ET AL: "PAZOPANIB HYDROCHLORIDE. ONCOLYTIC, ANGIOGENESIS INHIBITOR, VEGFR-2 TYROSINE KINASE INHIBITOR" DRUGS OF THE FUTURE, BARCELONA, ES, vol. 31, no. 7, July 2006 (200607), pages 585-589 2 3 94427 H3C H3C H3C N N 4 N H3C N CH3 N CH3 N N CH3 N N H S O NH2 O CH3 N N H N HCl . H2O (I'') і де згадана комплексна сполука вводиться місцево на око. 4. Композиція для місцевого застосування за будьяким з пп. 1-3 у формі очних крапель, де сполука формули І, І' або І'' є розчиненою або суспендованою в придатному носії. 5. Композиція для місцевого застосування за будьяким з пп. 1-4 для введення в комбінації з одним або кількома додатковими терапевтичними агентами для лікування неоваскулярних розладів. 6. Композиція для місцевого застосування за п. 5, де одним або кількома додатковими терапевтичними агентами є пегаптаніб та/або ранібізумаб. 7. Композиція для місцевого застосування за будьяким з пп. 5-6, де один або кілька додаткових терапевтичних агентів вводяться окремо. 8. Композиція для місцевого застосування за п. 7, де один або кілька додаткових терапевтичних агентів вводяться різними способами. 9. Композиція для місцевого застосування за будьяким з пп. 1-8, де неоваскулярним розладом очей є неоваскулярний розлад сітківки. 10. Композиція для місцевого застосування за п. 9, де неоваскулярним розладом очей є пов'язана з віком ексудативна дистрофія жовтої плями (ДЖП), ангіоїдні смуги, патологічна короткозорість, синдром очного гістоплазмозу, розломи у мембрані Бруша, набряк жовтої плями (охоплюючи діабетичний набряк жовтої плями), саркоїдоз, увеїт, атрофічна ДЖП, кератоконус, синдром Шегрена, короткозорість, пухлини очей, відторгнення трансплантата рогівки, пошкодження рогівки, неоваскулярна глаукома, вкривання рогівки виразками, рубцювання рогівки, проліферативна вітреоретинопатія, ретинопатія від дочасних пологів, дегенерація сітківки, хронічна глаукома, відшарування сітківки та ретинопатія серпастих клітин. 11. Композиція для місцевого застосування за п. 10, де неоваскулярним розладом є пов'язана з віком ексудативна дистрофія жовтої плями (ДЖП). 12. Композиція для місцевого застосування за будь-яким з пп. 1-11 для запобігання неоваскулярним розладам очей. 13. Композиція для місцевого застосування за будь-яким з пп. 1-11 для лікування неоваскулярних розладів очей. 14. Композиція для місцевого застосування за будь-яким з пп. 1-11 для зменшення швидкості розвитку розладу. 15. Застосування сполуки формули (І): S NH2 O O (І) або її солі, або сольвату у виробництві лікарського засобу для лікування неоваскулярних розладів очей шляхом безпосереднього нанесення на око. 16. Застосування за п. 15, де згаданою сполукою є сполука формули (І'): H3C H3C N N CH3 N CH3 N N H N S NH2 O O НСl (І'). 17. Застосування за будь-яким з пп. 15-16, де згаданою сполукою є сполука формули (І''): H3C H3C N N N CH3 CH3 N N N H S O NH2 O HCl . H2O (I''). 18. Застосування за будь-яким з пп. 15-17, де лікарський засіб є у формі очних крапель, в яких сполука формули І, І' або І'' розчинена або суспендована в придатному носії. 19. Застосування за будь-яким з пп. 15-18, де лікарський засіб вводять в комбінації з одним або кількома додатковими терапевтичними агентами для лікування неоваскулярних розладів. 20. Застосування за п. 19, де одним або кількома додатковими терапевтичними агентами є пегаптаніб та/або ранібізумаб. 21. Застосування за будь-яким з пп. 19-20, де один або кілька додаткових терапевтичних агентів вводяться окремо. 22. Застосування за п. 21, де один або кілька додаткових терапевтичних агентів вводяться різними способами. 23. Застосування за будь-яким з пп. 15-22, де неоваскулярним розладом очей є неоваскулярний розлад сітківки. 24. Застосування за п. 23, де неоваскулярним розладом очей є пов'язана з віком ексудативна дистрофія жовтої плями (ДЖП), ангіоїдні смуги, патологічна короткозорість, синдром очного гістоплазмозу, розломи у мембрані Бруша, набряк 5 94427 6 жовтої плями (охоплюючи діабетичний набряк жовтої плями), саркоїдоз, увеїт, атрофічна ДЖП, кератоконус, синдром Шегрена, короткозорість, пухлини очей, відторгнення трансплантата рогівки, пошкодження рогівки, неоваскулярна глаукома, вкривання рогівки виразками, рубцювання рогівки, проліферативна вітреоретинопатія, ретинопатія від дочасних пологів, дегенерація сітківки, хронічна глаукома, відшарування сітківки та ретинопатія серпастих клітин. 25. Застосування за п. 24, де неоваскулярним розладом очей є пов'язана з віком ексудативна дистрофія жовтої плями (ДЖП). 26. Застосування за будь-яким з пп. 15-25 для запобігання неоваскулярним розладам очей. 27. Застосування за будь-яким з пп. 15-25 для лікування неоваскулярних розладів очей. 28. Застосування за будь-яким з пп. 15-25 для сповільнення розвитку розладу. Заявлений винахід стосується способів лікування очних неоваскулярних розладів у ссавців. Способи полягають у застосуванні піримідинових похідних, бензодіазеринілових похідних та фармацевтичних композицій, що їх містять. Неоваскуляризація, також називана ангіогенезом, є процесом утворення нових кров'яних судин. Неоваскуляризація відбувається протягом нормального розвитку, а також грає важливу роль у загоєнні поранення після пошкодження тканини. Однак, неоваскуляризація також приймає участь як важливий чинник у ряді патологічних станів, як-то, у тому числі, рак, ревматоїдний артрит, атеросклероз, псоріаз та хвороби очей. Очні хвороби, асоційовані із пропусканням судин та/або неоваскуляризацією, є відповідальними за величезну більшість захворюваності очей та сліпоти у розвинених країнах (Campochiaro (2004) Expert Opin. Biol. Ther. 4:1395-402). Одним з прикладів такого розладу є діабетична ретинопатія, загальне ускладнення у осіб з цукровим діабетом та п'ятий чинник нової сліпоти. Найважливішими діючими факторами розвитку діабетичної ретинопатії є гіперглікемія та гіпоксемія, що призводять до збільшеної проникності судин, проліферації ендотеліальних клітин та патологічної неоваскуляризації (Chorostowska-Wynimko et al. J. Physiol. Pharmacol. (2005) 56 Suppl 4:65-70). Ці судинні аномалії призводять до витоку рідини у жовтій плямі, що може призводять до поступової втрати зору. Ще одним розладом очей, у котрому неоваскуляризація грає роль, є пов'язана з віком дистрофія жовтої плями (ДЖП), котра є головним чинником суворої втрати зору у людей в літах. Втрата зору у ДЖП є результатом хоріоїдальної неоваскуляризації (ХНВ). Неоваскуляризація починається з хоріоїдальних кров'яних судин та зростає через мембрану Бруша, звичайно на багатьох ділянках, у пігментованому епітеліальному проміжку підсітківки та/або сітківки (дивись, наприклад, Campochiaro et al. (1999) Моl. Vis. 5:34). Витік та кровотеча з цих нових кров'яних судин спричинює втрату зору. Розлади очей, асоційовані з неоваскуляризацією очей, є головним чинником втрати зору та сліпоти. Відповідно, залишається необхідність у нових способах лікування очних неоваскулярних розладів. Заявлений винахід стосується нових способів лікування очних неоваскулярних розладів. Способи полягають у призначенні піримідинових похідних, бензодіазепінілових похідних та фармацевтичних композицій, що їх містять. Згідно з одним аспектом винахід стосується способу лікування неоваскулярного розладу очей у ссавців що полягає у призначенні ссавцю сполуки формули (І): або її солі чи сольвату. Згідно з ще одним аспектом винахід стосується способу лікування неоваскулярного розладу очей у ссавців, що полягає у призначенні ссавцю сполуки формули (II): або її солі чи сольвату. Згідно з ще одним аспектом винахід стосується способу лікування неоваскулярного розладу очей у ссавців що полягає у призначенні ссавцю сполуки формули (II!): 7 або її солі чи сольвату. Винахід також стосується застосування сполуки формули (І), формули (II), формули (III), або її солі чи сольвату для отримання медикаменту, корисного у лікуванні неоваскулярних розладів очей. Також запропоновано застосування сполуки формули (І), формули (II), формули (III), або її солі чи сольвату у лікуванні неоваскулярних розладів очей. Фіг.1 показує вплив інгібітору рецептору VEGF, описаного у прикладі 1 у регресійній моделі для хоріоїдальної неоваскуляризації (ХНВ) у мишей. У цій регресійній моделі ХНВ було індуковано у мишей лазерними опіками на задньому полюсі сітківки. Через 7 діб після індукованого лазером пошкодження, мишей уводили у режим, у котрому їм було надано тільки носій поодинці або 5-[[4-[(2,3Диметил-2Н-індазол-6-іл)метиламіно]-2піримідиніл]аміно]-2-метилбензолсульфонамід у визначених дозах. Через 7 діб після уведення цього режиму було визначено розмір уражень ХНВ. Результати графічно представлені у Фіг.1. Дивись Приклади для додаткової інформації. Фіг.2 показує вплив попереднього лікування інгібітором рецептору VEGF, описаним у прикладі 1, антагоністом рецептору вітронектину, описаним у прикладі 3, або їх комбінацією на індуковане пошкодженням ХНВ у мишей у моделі відвернення ХНВ. Результати графічно представлені у Фіг.1. Дивись Приклади для додаткової інформації. Заявлений винахід стосується нових способів лікування очних неоваскулярних розладів у ссавців. Способи полягають у застосуванні піримідинових похідних, бензодіазепінілових по хідних та фармацевтичних композиці й, що містять їх, ссав цю. Згідно з одним аспектом сполукою для застосування є пазопаніб ((5-({4-[(2,3-диметил-2Н-індазол6-іл)(метил)аміно]піримідин-2-іл}аміно)-2метилбензолсульфонамїд) або його солі або сольвати. Згідно з ще одним аспектом, сполук для застосування є (S)-3-оксо-8-[3-(піридин-2-іламіно)1-пропілокси]-2-(2,2,2-трифлуоретил)-2,3,4,5тетрагідро-1Н-2-бензазепін-4-оцтової кислоти або її солі чи сольвати. Винахідники продемонстрували, що миші, яких лікують пазопанібом після індукованого лазером пошкодження сітківки, показують зниження розміру утворених хоріоїдальних неоваскулярних уражень у порівнянні з нелікованими мишами. На додаток, винахідники показали, що миші, ліковані пазопанібом, (S)-3-оксо-8-[3(піридин-2-іламіно)-1-пропілокси]-2-(2,2,2 94427 8 трифлуоретил)-2,3,4,5-тетрагідро-1Н-2-бензазепін4-оцтовоою кислотою або комбінацією цих сполук перед індукованим лазером пошкодженням сітківки, показують зниження розміру утворених хоріоїдальних неоваскулярних уражень. Відповідно, винахідники продемонстрували, що пазопаніб, (S)-3оксо-8-[3-(піридин-2-іламіно)-1-пропілокси]-2(2,2,2-трифлуоретил)-2,3,4,5-тетрагідро-1Н-2бензазепін-4-оцтова кислота та їх похідні, солі та сольвати є корисними, як терапевтичні засоби для лікування розладів, асоційованих з неоваскуляризацією в очах. Згідно з одним аспектом винахід стосується способу лікування неоваскулярного розладу очей у ссавців, що полягає у призначенні ссавцю сполуки формули (І): або її солі чи сольвату. В особливому втіленні винахід стосується способу лікування неоваскулярного розладу очей у ссавців, що полягає у призначенні ссавцю сполуки формули (І'): У ще одному втіленні винахід стосується способу лікування неоваскулярного розладу очей у ссавців, що полягає у призначенні ссавцю сполуки формули (І"): Згідно з ще одним аспектом винахід стосується способу лікування неоваскулярного розладу очей у ссавців, що полягає у призначенні ссавцю сполуки формули (II): 9 або її солі чи сольвату. Винахід також стосується комбінаційної терапії. Відповідно, у деяких втіленнях способи лікування полягають у призначенні сполуки формули (III): або її солі чи сольвату ссавцю разом із застосуванням сполуки формули (І), формули (II), або її солі чи сольвату. Згідно з ще одним аспектом винахід стосується способу лікування неоваскулярного розладу очей у ссавців, що полягає у призначенні ссавцю сполуки формули (III) або її солі чи сольвату. Згідно з ще одним аспектом винахід стосується застосування сполуки формули (І), формули (II), формули (III), або її солі чи сольвату для отримання медикаменту, корисного у лікуванні неоваскулярних розладів очей. Також запропоновано застосування сполуки формули (І), формули (II), формули (III), або її солі чи сольвату у лікуванні неоваскулярних розладів очей. У деяких втіленнях винаходу, неоваскулярним розладом очей є хоріоїдальний неоваскулярний розлад або неоваскулярний розлад сітківки. В особливих втіленнях неоваскулярний розлад очей вибрано з групи: пов'язана з віком ексудативна 94427 10 дистрофія жовтої плями, ангіодні смуги, увеїт та набряк жовтої плями. Термін "неоваскулярний розлад очей", застосований тут, означає розлад, у котрому нові кров'яні судини створюються в очах патогенним чином. Неоваскулярні розлади очей, що можна лікувати способами винаходу, охоплюють охарактеризовані судинним витоком. Неоваскулярні розлади очей можуть призводити до часткової або повної втрати зору. Неоваскулярні розлади для лікування способами винаходу можуть мати місце у будь-якій частині ока, як-то, наприклад, рогівка, райдужна оболонка, сітківка, склоподібне тіло та хоріоїд. Термін "хоріоїдальний неоваскулярний розлад", застосований тут, означає розлад, охарактеризований інвазією нових кров'яних судин через мембрану Бруша, найглибший шар хоріоїду. Термін "неоваскулярний розлад сітківки", який застосовуваний тут, стосується розладу, асоційованого із зростанням нових кров'яних судин що починається з вен сітківки та подовжується вздовж вітреальної поверхні сітківки. Необмежувальні приклади судинних розладів очей, що можна лікувати способами винаходу охоплюють пов'язану з віком ексудативну дистрофію жовтої плями (ДЖП), ангioдні смуги, патологічну короткозорість, синдром очного гістоплазмозу, розломи у мембрані Бруша, набряк жовтої плями (охоплюючи діабетичний набряк жовтої плями), саркоідоз та увеїт. Додаткові приклади розладів, що можна лікувати розкритими способами, охоплюють атрофічний ДЖП, кератоконус, синдром Шегрена, короткозорість, пухлини очей, відторгнення трансплантату рогівки, пошкодження рогівки, неоваскулярну глаукому, вкривання рогівки виразками, рубцювання рогівки, проліферативну вітреоретинопатію, ретинопатію від дочасних пологів, дистрофію сітківки, хронічну глаукому, відшарування сітківки та ретинопатію серпастих клітин. Винахід стосується способів лікування неоваскулярних розладів очей. Як застосовувано тут, "лікування" означає будь-як спосіб дії, у котрому один або більше симптомів, асоційованих з розладом, є благотворно зміненими. Відповідно, термін охоплює загоєння, відвернення, або полегшення симптому або побічної дії розладу або зниження швидкості розвитку розладу. Способами винаходу лікування судинних розладів очей може бути досягнутим застосуванням ефективної кількості одного або більше терапевтичних засобів до особи для лікування. Як застосовувано тут, термін "ефективна кількість" означає кількість терапевтичного засобу, що є достатньою для лікування, відвернення та/або полегшення одного або більше симптомів розладу. Як застосовувано тут, термін "сольват" стосується комплексу змінної стехіометрії утвореного розчиненням сполуки формули (І), (II), (III), або її солі та розчиннику Такі розчинники для мети винаходу не можуть взаємодіяти із біологічною активністю розчиненої речовини. Приклади придатних розчинників охоплюють, але без обмеження, воду, метанол, етанол та оцтову кислоту. Переважно 11 94427 12 застосовуваним розчинником є фармацевтично прийнятний розчинник. Приклади придатних фармацевтично прийнятних розчинників охоплюють, без обмеження, воду, етанол та оцтову кислоту. В особливих втіленнях застосовуваним розчинником є вода. В одному втіленні способи відвернення або лікування очних неоваскулярних розладів, розкритих тут, і полягає у призначенні сполуки формули (І): або її солі чи сольвату. У певному втіленні сіль сполуки формули (І) є гідрохлоридом. В особливому втіленні сіль сполуки формули (І) є моногідрохлоридом, як ілюстровано формулою (І'). Моногідрохлорид сполуки формули (І) має хімічну назву 5-[[4-[(2,3-Диметил-2Ніндазол-6-іл)метиламіно]-2-піримідиніл]аміно]-2метилбензолсульфонамід моногідрохлорид. У ще одному втіленні сіль сполуки формули (I) є моногідрохлоридним моногідратним сольватом сполуки формули (І). Моногідрохлоридний моногідратний сольват сполуки формули (І) має хімічну назву 5-({4-[(2,3-диметил-2Н-індазол-6іл)метиламіно]-2-піримідиніл}аміно)-2метилбензолсульфонамід моногідрохлорид моногідрат, як ілюстровано у формулі (І"). Винахід також стосується способів відвернення або лікування очних неоваскулярних розладів, розкритих тут, і полягає у призначенні сполуки формули (II): або її солі чи сольвату. Ця сполука має хімічну 4 4 назву N -(2,3-диметил-2Н-індазол-6-іл)-N -метил2 N -{4-[(метилсульфоні]метил]феніл}-2,4піримідиндіамін. Вільну основу, солі та сольвати сполуки формули (І) або (II) можна отримувати, наприклад, способами міжнародної патентної заявки № PCT/US01/49367, зареєстровано December 19, 2001 та опубліковано, як WO 02/059110 на August 1, 2002 та Міжнародної патентної заявки № PCT/US03/19211, зареєстровано June 17, 2003 та опубліковано, як WO 03/106416 у December 24, 2003, або способами, запропонованими тут. Сполуки формули (III) та їх похідні можна отримувати способами патенту США № 6,825,188 або способами, описаними тут. Звичайно, солями заявленого винаходу є фармацевтично прийнятні солі. Солі охоплені терміном "фармацевтично прийнятні солі", стосуються нетоксичних солей сполук цього винаходу. Солі сполук заявленого винаходу можуть містити кислотно-адитивні солі похідні від нітрогену на заміснику у сполуці заявленого винаходу. Показові солі охоплюють такі солі: ацетат, бензолсульфонат, бензоат, гідрокарбонат, гідросульфат, гідротартрат, борат, бромід, кальцій едетат, камзилат, карбонат, хлорид, клавуланат, цитрат, дигідрохлорид, едетат, едизилат, естолат, eзилат, фумарат, глюцептат, глюконат, глютамат, гліколіларсанілат, гексилрезорцинат, гідрабамін, гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізетіонат, лактат, лактобіонат, лаурат, малат, малеат, манделат, мезилат, метилбромід, метилнітрат, метилсульфат, монокалій малеат, мукат, напзилат, нітрат, Nметилглюкамін, оксалат, памоат (ембонат), пальмитат, пантотенат, фосфат/дифосфат, полігалактуронат, калій, саліцилат, натрій, стеарат, субацетат, сукцинат, танат, тартрат, теоклат, тозилат, триетіодид, триметиламоній та валерат. Інші солі, котрі не є фармацевтично прийнятними, можуть бути корисними при отриманні сполук цього винаходу, та це утворює наступний аспект винаходу. Сполуки можуть бути застосовуваними способами винаходу поодинці, або вони можуть бути застосовуваними у фармацевтичній композиції. Відповідно, винахід також стосується застосування фармацевтичних композицій у способах лікування заявленого винаходу. Фармацевтичні композиції містять сполуку формули (І), (II), (III) та її солі або сольвати та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів. Носії, розріджувачі або наповнювачі повинні бути 13 прийнятними з точки зору сумісності з іншими інгредієнтами композиції та нешкідливими для їх реципієнта. Фармацевтичні композиції можуть бути у формах окремих доз, що містять попередньо визначену кількість активного інгредієнту на окрему дозу. Така окрема доза може містити, наприклад, 1 мкг 1г, як-то 5 мкг - 500 мкг, 10 мкг - 250 мкг, 0,5 мг 700 мг, 2 мг - 350 мг, або 5 мг - 100 мг сполуки формули (І), (II), (III), або її солі чи сольвату залежно від стану, що лікують, шляху застосування та віку, маси та стану пацієнта, або фармацевтичні композиції можуть бути у формах окремих доз, що містять попередньо визначену кількість активного інгредієнту на окрему дозу. У деяких втіленнях композиції окремих доз є тими, що містять добову дозу або субдозу чи прийнятну їх частину, активного інгредієнту. Крім того, такі фармацевтичні композиції можна отримувати будь-якими способами, добре відомими у фармакології. Сполука формули (І), (II), (III), або її солі чи сольвати можуть бути застосовуваними будь-яким прийнятним шляхом. Придатні шляхи охоплюють пероральний, ректальний, назальний, місцевий (охоплюючи букальний, сублінгвальний та очний), вагінальний та парентеральний (охоплюючи підшкірний, внутрішньом'язовий, внутрішньовенний, інтрадермальний, екстраокулярний, інтраокулярний (охоплюючи, наприклад, інтравітріальний, підсітківковий, субсклеральний, інтрахоріоїдальний та субкон'юнктивальний), інтратекальний та епідуральний)). Треба розуміти, що кращий шлях можна варіювати, наприклад, згідно зі станом реципієнта. Способи заявленого винаходу можна також застосовувати у комбінації з іншими способами лікування неоваскулярних розладів очей. У деяких втіленнях способи винаходу охоплюють комбінаційну терапію, у котрій сполуку формули (І), (II), (III), або її солі чи сольвати призначають разом з одним або більше додатковими терапевтичними засобами для лікування неоваскулярних розладів. Необмежувальні приклади додаткових терапевтичних засобів, що можуть бути застосовуваними у комбінаційній терапії, охоплюють пегаптаніб, ранібізумаб, РКС412, непафенак та антагоністи рецептору інтегрину (охоплюючи агоністи рецептору вітронектину). Дивись, наприклад, Takahashi et al. (2003) Invest Ophthalmol. Vis. Sci. 44: 409-15, Campochiaro et al. (2004) Invest Ophthalmol. Vis. Sci. 45:922-31, van Wijngaarden et al. (2005) JAMA 293:1509-13, патент США № 6,825,188, Callahan et al. та патент США № 6,881,736, Manley et al., кожний з котрих уведено тут як посилання стосовно цих сполук. В особливих втіленнях сполуки формули (І) або формули (II) або їх солі або сольвати призначають разом зі сполукою формули (ill) або її солями або сольватами, Коли є застосованою комбінаційна терапія, терапевтичні засоби можуть бути застосовуваними разом або окремо. Це означає, що застосовувати можна більше, ніж один терапевтичний засіб комбінаційної терапії; альтернативно, можуть бути застосовуваними відмінні терапевтичні засоби комбінаційної терапії. Коли терапевтичні засоби призначають окремо, вони можуть бути 94427 14 застосовуваними одночасно або послідовно у будь-якому порядку, близько та віддалено у часі. Кількості сполуки формули (І), (II), (III), та/або іншого фармацевтично активного засобу або засобів та відносні проміжки часу застосування повинні бути вибраними для досягнення потрібного комбінованого терапевтичного впливу. Фармацевтичні композиції, адаптовані для перорального застосування, можуть бути дискретними, як-то капсули або таблетки; порошками або гранулами; розчинами або суспензіями у водних або неводних рідинах; їстівні пінки або збиті маси; або рідкі емульсії олива-у-воді чи вода-в-оливі. Наприклад, для перорального застосування у формі таблетки або капсули, активні ліки можуть бути комбінованими з пероральним нетоксичним фармацевтично прийнятним інертним носієм, якто етанол, гліцерин, вода тощо. Порошки можна отримувати подрібненням сполуки до придатного розміру та змішуванням із подібним чином подрібненим фармацевтичним носієм, як-то їстівний вуглевод, як, наприклад, крохмаль або манітол. Ароматизатор, консервант, диспергувальний засіб та барвник можуть також бути уведеними. Капсули можуть бути зробленими отриманням порошкової суміші, як описано вище, та заповненням утворених желатинових оболонок. Ковзні засоби та лубриканти, як-то силікагель, тальк, магній стеарат, кальцій стеарат або твердий поліетиленгліколь можна додавати до порошкової суміші перед заповненням. Дезинтегратор або солюбілізатор, як-то агар-агар, кальцій карбонат або натрій карбонат можна також додавати для поліпшення корисності медикаменту, коли капсулу ковтають. Більш того, коли потрібно або необхідно, придатні зв'язуючі, лубриканти, дезинтегратори та барвники можуть також бути уведеними у суміш. Придатні зв'язуючі охоплюють крохмаль, желатин, природний цукор, як-то глюкоза або бета-лактоза, кукурудзяні замінники цукру, природні та синтетичні камеді, як-то гуміарабік, трагакантова камедь або натрій альгінат, карбоксиметилцелюлоза, поліетиленгліколь, воски тощо. Лубриканти, застосовувані у цих формах доз, охоплюють натрій олеат, натрій стеарат, магній стеарат, натрій бензоат, натрій ацетат натрій хлорид тощо. Дезинтегратори охоплюють, без обмеження, крохмаль, метилцелюлозу, агар, бентоніт, ксантанову камедь тощо. Таблетки можна виготовляти, наприклад, отриманням порошкової суміші, гранулюванням або кришінням, додаванням лубриканту та дезинтегратору та пресуванням у таблетки. Порошкову суміш отримують змішуванням відповідно подрібненої сполуки з розріджувачем або основою, як описано вище та необов'язково, зі зв'язуючим, якто карбоксиметилцелюлоза, альгінат, желатин або полівінілпіролідон уповільнювач розчинення, як-то парафін, прискорювач ресорбції, як-то четвертинна сіль, та/або засіб поглинання, як-то бентоніт, каолін або дикальцій фосфат. Порошкову суміш можна гранулювати зволоженням зв'язуючим, якто сироп, крохмальна паста рослинний клей або розчини целюлози або полімерних матеріалів та пропусканням через сито. Як альтернативу гранулюванню, порошкову суміш можна пропускати че 15 рез пристрій для таблеток та утворені порції розбивають на гранули. Гранули можна змащувати для відвернення прилипання до таблеток пуансону додаванням стеаринової кислоти, стеарату, тальку або мінеральної оливи. Змащену суміш тоді пресують у таблетки. Сполуки заявленого винаходу можна також комбінувати з вільно сипучим інертним носієм та пресувати у таблетки безпосередньо без гранулювання або кришіння. Прозорі або непрозорі захисні покриття, що складаються з ізоляційного покриття з шелаку, покриття з цукру або полімерного матеріалу та глянцевого покриття воском можна запропонувати. Барвники можна додавати до цих покриттів для визначення відмінних окремих доз. Пероральні рідини, як-то розчини, сиропи та еліксири можна отримувати у формі окремих доз, що містять попередньо визначену кількість сполуки. Сиропи можна отримувати розчиненням сполук у відповідно ароматизованому водному розчин, у той час, як еліксири можна отримувати застосуванням нетоксичного спиртового носія. Суспензії можна виготовляти диспергуванням сполук у нетоксичному носії. Солюбілізатори та емульгатори можна додавати також, як-то етоксиловані ізостеарилові спирти та полюксиетилен-сорбітол-етери, консерванти, ароматизатор, як-то м'ятна олія, або природні замінники цукру або сахарин чи інші штучні замінники цукру, тощо. Коли це прийнятно, композиції окремих доз для перорального застосування можуть бути мікроінкапсульованими. Композицію можна також отримувати для подовженого вивільнення, як наприклад покриттям або уведенням частинок матеріалу уполімери, віск тощо. Засоби згідно з заявленим винаходом можна також застосовувати у формі ліпосомних систем доставки, як-то невеликі одношарові везикули, великі одношарові везикули та багатошарові везикули. Ліпосоми можуть бути утвореними з різних фосфоліпідів, як-то холестерин, стеариламін або фосфатидилхоліни. Засоби для застосування згідно з заявленим винаходом можна також доставляти застосуванням моноклональних антитіл як індивідуальних носив, з котрими сполучаються молекули сполук. Сполуки можна також сполучати з розчинними полімерами, як цільовими носіями ліків. Такі полімери можуть охоплювати полівінілпіролідон, піран-кополімер, полігідроксипропілметакриламід-фенол, полігідроксіетиласпартамідфенол, або поліетиленоксид-полілізин, заміщений пальмитоільними залишками. Крім того, сполуки можна сполучати з класом здатних до біорозкладання полімерів, корисних у досягненні контрольованого вивільнення ліків, як-то, полімолочна кислота, поліепсилон-капролактон, полігідроксимасляна кислота, поліортоестери, поліацеталі, полідигідропірани, поліціаноакрилати та перехресно-зв'язані або амфіпатичні блоккополімери гідрогелів. Фармацевтичні композиції, адаптовані для трансдермального застосування можуть бути дискретними пов'язками для тісного контакту із епідермісом реципієнта протягом подовженого часу. Наприклад, активний інгредієнт можна доставляти 94427 16 з пов'язки іонофорезом, як загалом описано у Pharmaceutical Research, 3(6), 318(1986). Фармацевтичні композиції, адаптовані для місцевого застосування, можна виготовляти, як мазі, креми, суспензії, лосьйони, порошки, розчини, пасти, гелі, спреї, аерозолі або рідкі мастила. Для лікування очей або інших зовнішніх тканин, наприклад рота та шкіри, композиції можна наносити, як місцеві мазі або креми. При виготовленні як мазі активний інгредієнт можна застосовувати з парафіновою або змішуваною з водою основою мазі. Альтернативно, активний інгредієнт можна виготовляти як крем з основою олія-у-воді крем або вода-в-оливі. Фармацевтичні композиції, адаптовані для місцевого застосування до очей, охоплюють очні краплі, де активний інгредієнт є розчиненим або суспендованим у придатному носії, особливо водному розчиннику. Композиції для застосування до очей повинні мати офтальмічно сумісний рН та осмотичий тиск. Один або більше офтальмічно прийнятних засобів доведення рН та/або засобів буферування можуть бути уведеними у композицію винаходу, у тому числі кислоти, як-то оцтова, борна, лимонна, молочна, фосфатна та хлоридна кислоти; основи, як-то натрій гідроксид, натрій фосфат, натрій борат, натрій цитрат, натрій ацетат та натрій лактат; та буфери, як-то цитрат/декстроза, натрій гідрокарбонат та амоній хлорид. Такі кислоти, основи та буфери можуть бути уведеними у кількості, потрібній для утримування рН композиції у офтальмічно прийнятних межах. Одна або більше офтальмічно прийнятних солей можуть бути уведеними у композицію у кількості, достатній для доведення осмотичого тиску композиції до офтальмічно прийнятних меж. Так солі охоплюють ті, що мають катіони натрій, калій або амоній катіони та аніони хлорид, цитрат, аскорбат, борат, фосфат, гідрокарбонат, сульфат, тіосульфат або гідросульфіт. Фармацевтичні композиції, адаптовані для місцевого застосування у роті, охоплюють пастилки та полоскання для рота. Фармацевтичні композиції, адаптовані для назального застосування, де носій є твердим, охоплюють великозернистий порошок, що має розмір частинок наприклад, у межах 20-500 мікрон, котрі призначають швидкою інгаляцією через назальний прохід з контейнеру з порошком у ніс. Придатні композиції, де носій є рідким, для застосування як назального спрею або як назальних крапель охоплюють водні або олійні розчини активного інгредієнту. Фармацевтичні композиції, адаптовані для застосування інгаляцією, охоплюють пилоподібний порошок, що може бути створеним засобами різних типів аерозолі під тиском, розпилювачі або інсуфлятори з виміряною дозою. Фармацевтичні композиції, адаптовані для парентерального застосування охоплюють водні та неводні стерильні розчини для ін'єкцій, котрі можуть містити антюксиданти, буфери, бактерюстати та розчинені речовини, котрі роблять композицію ізотонічною з кров'ю реципієнта, та водні і неводні стерильні суспензії, котрі можуть містити суспен 17 дувальні засоби та загусники. Композиції можуть бути в окремих дозах або багатодозових упаковках, наприклад, герметичних ампулах та склянках та можна зберігати висушеними сублімацією (люфілізованими), що потребує тільки додавання стерильного рідкого носія, наприклад, води для ін'єкцій, безпосередньо перед застосуванням. Виготовлені для негайного прийому розчини та суспензії для ін'єкцій можна отримувати зі стерильних порошків, гранул та таблеток. У деяких втіленнях заявленого винаходу, фармацевтичні композиції є адаптованими для інтраокулярного застосування інтраокулярними ін'єкціями або іншими пристроями для очної доставки. Приклади пристроїв для очей, що можуть бути застосовуваними способами винаходу, охоплюють перioкулярні або інтравітріальні пристрої, контактні лінзи та ліпосоми. Дивись, наприклад, патенти США №№ 3,416,530, 3,828,777, 4,014,335,4,300,557, 4,327,725, 4,853,224, 4,946,450, 4,997,652, 5,147,647, 5,164,188, 5,178,635, 5,300,114, 5,322,691, 5,403,901, 5,443,505, 5,466,466, 5,476,511, 5,516,522, 5,632,984, 5,679,666, 5,710,165, 5,725,493, 5,743,274, 5,766,242, 5,766,619, 5,770,592, 5,773,019, 5,824,072, 5,824,073, 5,830,173, 5,836,935, 5,869,079, 5,902,598, 5,904,144, 5,916,584, 6,001,386, 6,074,661, 6,110,485, 6,126,687, 6,146,366, 6,251,090, 6,299,895, 6,331,313, 6,416,777, 6,649,184, 6,719,750, 6,660,960, та публікації патентів США №№ 2003/0064088 2004/0247645, та, 2005/0113806, кожну з котрих тут уведено як посилання на оптичні пристрої Пристрій для очної доставки може бути призначеним для контрольованого вивільнення одного або більше терапевтичних засобів із багатократно визначеними швидкостями вивільнення та подовженими кінетиками та проникністю дози. Контрольоване вивільнення можна отримати за допомогою полімерної матриці з відмінних здатних до біорозкладання полімерів (наприклад, поліетиленвініл-ацетату (EVA), супергідролізованого PVA), гідроксіалкілцелюлози (НРС), метилцелюлози (МС), гідроксипропілметилцелюлози (НРМС), полікапролактону, полі(гліколєвоі) кислоти, полі(молочноі) кислоти, поліанпдридиду, з молекулярними масами полімерів, кристалічністю полімерів, співвідношенням кополімерів, умовами обробки, обробкою поверхні, геометрією, додаванням наповнювачу та полімерними покриттями, що повинні посилювати дифузію, ерозію, розчинення ліків та осмос. Композиції для доставки ліків, застосовуючи пристрої для очей, можуть комбінувати один або більше активних засобів та ад'ювантів, прийнятних для позначеного шляху застосування Наприклад, активні засоби можуть бути змішаними із будьяким фармацевтично прийнятним наповнювачем, вибраним з групи лактоза, сахароза, крохмальний порошок, естери целюлози алканових кислот, стеаринова кислота, тальк, магній стеарат, магній оксид, солі натрію та кальцію фосфатної та сульфатної кислот, гуміарабік, желатин, натрій альгінат, полівінілпіролідин, та/або полівініловий спирт, 94427 18 таблетованими або інкапсульованими для звичайного застосування. Альтернативно, сполуки можуть бути розчиненими у поліетиленгліколі, пропіленгліколі, колоїдних розчинах карбоксиметилцелюлози, етанолі, кукурудзяній олії, арахісовій олії, бавовняній олії, кунжутній олії, трагакантовій камеді та/або різних буферах. Сполуки можуть також бути змішаними з композиціями здатних до біорозкладання та нездатних до біорозкладання полімерів та носія або розріджувачу, що має властивість затримки в часі. Показові приклади здатних до біорозкладання композицій можуть містити альбумін, желатин, крохмаль, целюлозу, декстрани, полісахариди, полі-(D,L-лактид), полі-(D,L-лактид-співгліколiд), полі-(гліколід), полі-(гідроксибутират), полі(алкілкарбонат) та полі-(ортоестери) та їх суміші. Показові приклади нездатних до біорозкладання полімерів можуть містити кополімери EVA, силіконову гуму та полі-(метилакрилат) та їх суміші. Фармацевтичні композиції для очної доставки також охоплюють здатні до желатинування in situ водні композиції. Такі композиції містять желатинувальний засіб у концентрації, ефективній для сприяння желатинуванню при контакті з очною рідиною або сльозами. Придатні желатинувальні засоби охоплюють, але без обмеження термореактивні полімери. Термін "здатні до желатинування in situ", який застосовувано тут, охоплює тільки рідини низької в'язкості, що утворюють гелі при контакті з очною рідиною або сльозами, але також охоплює більш в'язкі рідини, як-то напіврідини та тиксотропні гелі, що виявляють по суті збільшену в'язкість після застосування до очей. Дивись, наприклад, Ludwig (2005) Adv. Drug Deliv. Rev 3;57:1595-639, що тут уведено як посилання на полімери для застосування при очній доставці ліків. Спеціалістам відомо, що на додаток до інгредієнтів згаданих вище, композиції можуть містити інші звичайні засоби що стосуються типу розглянутої композиції. Наприклад, композиції, придатні для перорального застосування можуть містити ароматизатори. Згідно зі способами винаходу конкретні сполук формули (І), (II), або (III) призначають ссавцю. Звичайно, кількість одного із застосованих засобів заявленого винаходу повинна залежати від ряду факторів, у тому числі, наприклад, віку та маси ссавця, стану, що потребує лікування, суворості стану, природи композиції та шляху застосування. Зрештою, кількість повинна бути знайдена рішенням лікаря або ветеринара. Звичайно, сполука формули (І), (II), (III), або її солі чи сольвату повинна бути призначеною у межах 0,1-100 мг/кг маси тіла реципієнта (ссавця) на добу та більш звичайно у межах 1-10 мг/кг маси тіла на добу. В особливих втіленнях сполуку призначають локально (наприклад, до очей) та загальна кількість застосованої сполуки може бути 1 мкг 10 мг, як-то 5 мкг - 500 мкг, чи 10 мкг -250 мкг. Наступні приклади тільки ілюструють та не обмежують рамок винаходу будь-яким шляхом. Приклади 19 Стандартні одинично-літерні або три-літерні скорочення загалом застосовувано для позначення амінокислотних залишків, котрі є у Lконфігурації, якщо не встановлено інше. Якщо не встановлено інше, усі вихідні матеріали були отриманими від комерційних постачальників та застосовуваними без подальшої очистки. Конкретно, наступні скорочення можуть бути застосовуваними у прикладах та описі: ТШХ (тонко-шарова хроматографія); Тr (час утримування); ЗФ (зворотно-фазова); ДХМ (дихлорметан); ДХЕ (дихлоретан); ДМФ (Ν,Ν-диметилформамід); НОАс (оцтова кислота); ТМСЕ (2-(триметилсиліл)етил); ТМС (триметилсиліл); ТІРС (триізопропілсиліл); ТВС (т-бутилдиметилсиліл); ВЕРХ (високоефективна рідинна хроматографія); ТГФ (тетрагідрофуран); ДМСО (диметилсульфоксид); EtOAc (етилацетат); ДМЕ (1,2-диметоксіетан); ЕДТА етилендіамінтетраоцтова кислота; СКЗ сироватка коров'ячого зародка; IMDM Модифіковане Ісковом середовище Дульбекко; БФФЗ буферований фосфатом фізіологічний розчин. RIPA-буфер) 150 мМ NaCI, 50 мМ Трис-НСІ, рН 7,5, 0,25% (за масою/об'ємом) - дезоксихолат, 1% NP-40, 5 мМ натрій ортованадат, 2 мМ натрій флуорид та суміш інгібіторів протеаз. Якщо не встановлено інше, усі температури виражені у °С. Усі реакції проводили під інертною атмосферою при кімнатній температурі якщо не встановлено інше. Наступні приклади описують синтези інтермедіатів, особливо корисних у синтезі сполук формули (І) та (II). Приклад інтермедіату 1 Отримання 2,3-диметил-6-нітро-2Н-індазолу Процедура 1: При перемішуванні до розчину 18,5 г (0,11 моль) 3-метил-6-нітро-7Н-індазолу у 350 мл ацетону, при кімнатній температурі, було додано 20 г (0,14 моль) триметилоксоній тетрафлуорборату. Після перемішування розчину під струмом аргону протягом 3 годин, розчинник було видалено при зменшеному тиску. До утвореного твердого продукту було додано насичений водний натрій гідрокарбонат (600 мл) та 4:1 суміш хлороформізопропанол (200 мл), суміш перемішували та шари були розділеними. Водну фазу було промито додатково сумішшю хлороформ ізопропанол 94427 20 (4x200 мл) та комбіновану органічну фазу було висушено натрій сульфатом. Фільтрування та видалення розчиннику дали жовто-коричневий твердий продукт. Твердий продукт було промито етером (200 мл), отримуючи 2,3-диметил-6-нітро-2Ніндазол як жовтий твердий продукт (15,85 г, 73%). 1 Н ЯМР (300 МГц, ДМСО-d6) 8,51 (s, 1Н), 7,94 (d, J=9,1 Гц,1Н), 7 73 (d, J=8,9 Гц, 1H), 4,14 (s, 3H) 2,67 (s, 3H) МС (ЕР+, m/z) 192 (М+Н). Процедура 2: Триметилортоформіат (11 ммоль, 1,17 г) було додано протягом 2 хвилин до розчину бор трифлуорид етерату (12,5 ммоль, 1,77 г у метиленхлориді (2,0 мл), котрий охолодили до -30°С Суміш було нагріто до 0°С протягом 15 хвилин та було тоді охолоджено до -70°С. Нітроіндазол (10 ммоль, 1,77 г) було суспендовано у метиленхлориді (30мл) та було додано одною порцією до охолодженої суміші. Суміш перемішували при -70°С протягом 15 хвилин та при температурі довкілля протягом 17 годин. Після 17 годин суміш стала червоною та гетерогенною. Реакційну суміш було погашено насиченим розчином натрій гідрокарбонату (20 мл) та органічний шар відділяли. Водний шар було екстраговано метиленхлоридом (30 мл). Метиленхлоридні шари були комбінованими та екстрагованими водою (30 мл). Метиленхлоридний шар переганяли під зменшеним тиском до приблизно 10 мл. Пропанол (10 мл) було додано та залишок метиленхлориду видалено при зменшеному тиску, даючи жовту кашку. Продукт було виділено фільтруванням, отримуючи 2,3-диметил6-нітро-2Н-індазол (65%, Τ ммоль, 1,25 г) як світ1 ло-жовтий порошок. Н ЯМР (300 МГц, ДМСО-d6) 8,51 (s, 1H), 7,94 (d, J=9,1 Гц, 1Н), 7,73 (d, J=8,9 Гц, 1H), 4,14 (s, 3H), 2,67 (s, 3H). МС (ЕР+, m/z) 192 (М+Н). Процедура 3: У круглодонній колбі на 25 мл було розчинено у ДМСО з перемішуванням 3-метил-6-нітроіндазол (7,27 ммоль, 1,28 г) (4,0 мл) та оброблено концентрованою сульфатною кислотою (7,27 ммоль, 0,73 г), даючи густу кашку. Кашку було оброблено диметилсульфатом (21,1 ммоль, 2,66 г). Суміш було нагріто під струмом азоту при 50°С протягом 72 годин. Після 72 годин було отримано густу жовту кашку. Кашку було охолоджено та повільно оброблено насиченим розчином натрій гідрокарбонату (10 мл). Суміш було екстраговано метиленхлоридом (2x20 мл). Метиленхлоридні шари були комбінованими та екстрагованими водою (20 мл). Метиленхлоридний шар було оброблено пропанолом (10 мл) та метиленхлорид було видалено перегонкою при зменшеному тиску. Твердий продукт було виділено фільтруванням та жовтий твердий продукт промито гептаном (5 мл) та висушено на повітрі. 2,3-диметил-6-нітро-2Н-індазол (70%, 0,97 г) було отримано як світло-жовтий твердий продукт. 1 Н ЯМР (300 МГц, ДМСО-d6) 8,51 (s, 1Н), 7,94 (d, J=9,1 Гц, 1H), 7,73 (d, J=8,9 Гц, 1H), 4,14 (s, 3H), 2,67 (s, 3H). МС(ЕР+, m/z) 192 (М+Н). Процедура 4: У круглодонну тригорлу колбу на 250 мл було уведено сіль 3-метил-6-нітро-1Н-індазолсульфату (5,0 г, 18,2 ммоль) та метиленхлорид (25 мл). Су 21 міш перемішували при 25°С та обробляли ДМСО (5 мл). Диметилсульфат (6,7 г, 5,0 мл, 53,0 ммоль) було додано через шприц та реакційну суміш було нагріто при кипінні під зворотним холодильником у бані при 70°С. Після 7 годин ВЕРХ-аналіз показав 9% вихідного матеріалу. На цей момент нагрівання було зупинено та почато обробку. Насичений розчин натрій гідрокарбонату (35 мл) було додано до реакційної суміші при кімнатній температурі. Шарам давали розділитися та водний шар було екстраговано метиленхлоридом (25 мл). Метиленхлоридні шари були комбінованими та промитими водою (2x25 мл). Метиленхлоридний шар переганяли під зменшеним тиском, доки не було видалено половину об'єму. Пропанол (25 мл) було додано та перегонку під зменшеним тиском було продовжено, доки не було видалено увесь метиленхлорид. Це дало жовту кашку, котру перемішували при 25°С протягом 1 години. Продукт було виділено фільтруванням та утворений жовтий твердий продукт було промито гептаном (10 мл). Це дало 2,3-диметил-6-нітро-2Н-індазол (70%, 2,43 г), 1 як жовтий твердий продукт. Н ЯМР (300 МГц, ДМСО-d6) 8,51 (s, 1H), 7,94 (d, J=9,1 Гц, 1H), 7,73 (d, J=8,9 Гц, 1H), 4,14 (s, 3H), 2,67 (s, 3H). MC(EP+, m/z) 192 (M+H). Приклад інтермедіату 2 Отримання 2,3-диметил-6-аміно-2Н-індазолу: Процедура 1: При перемішуванні до розчину 2,3-диметил-6нітро-2Н-індазолу (1,13 г) у 2-метоксіетил-етері (12 мл), при 0°С, було додано краплями розчин 4,48 г станум(ІІ) хлориду у 8 ,9 мл концентрованої НСІ протягом 5 хвилин. Після повного додавання льодяну баню було видалено та розчин перемішували протягом ще 30 хвилин. Приблизно 40 мл діетилетеру було додано до реакційної суміші, даючи утворення осаду. Утворений осад було виділено фільтруванням та промито діетил-етером, отримуючи жовтий твердий продукт (1,1 г, 95 %), сіль 1 НСІ 2,3-диметил-2Н-індазол-6-аміну. Н ЯМР (300 МГц, ДМСО-d6) 7,77 (d, J=8,9 Гц, 1H), 7,18 (s, 1H), 7,88 (m, 1H), 4,04 (s, 3H), 2,61 (s, 3H). MC (ЕР+, m/z) 162 (М+Н). Процедура 2: Круглодонну тригорлу колбу на 2 л було оснащено впускною та випускною трубкою для азоту та механічною мішалкою. Помірний потік азоту давали та реактор завантажували 10% Pd/C (50% води, 6,0 г). Перемішування включали та реактор завантажували метанолом (750 мл) та продуктом інтермедіату Прикладу 1 (50 г). Амоній форміат (82,54 г) було розчинено у воді (120 мл). Водний розчин амоній форміату було додано до реакційного розчину при швидкості додавання, котра тримала температуру реакції між 25 та 30°С. Реакцію продовжували при 25°С. Через 6 годин реакційну суміш аналізували стосовно закінчення 94427 22 на основі ВЕРХ-аналіз. Суміш було профільтровано та каталізатор промито метанол (50 мл), Метанольні шари були комбінованими та розчинник видалено при зменшеному тиску. Залишок було розчинено у воді (200 мл) та було екстраговано метиленхлоридом (3x250 мл). Метиленхлоридні шари були комбінованими та розчинник видалено під вакуумом для видалення приблизно половини розчиннику. Гептан (400 мл) було додано та вакуумну перегонку продовжено, доки не залишилось приблизно 300 мл кашки продукту реакції. Продукт було виділено фільтруванням та висушено під вакуумом при 50°С протягом 4 годин., даючи густу кашку 2,3-диметил-6-аміно-2Н-індазолу, як вільну 1 основу. (40,76 г, 96,7 %). Н ЯМР (300 МГц, ДМСОd6) 7,31 (d, J=8,9 Гц, 1Н), 6,45 (d, J=8,9 Гц, 1Н), 6,38 (s, 1H), 4,95 (s, br, 2H), 3,85 (s, 3H), 2,44 (s, 3H) MC (EP+, m/z) 162 (M+H). Приклад інтермедіату 3 Отримання N-(2-хлорпіримідин-4-іл)-2,3диметил-2Н-індазол-6-аміну Процедура 1 При перемішуванні до розчину продукту інтермедіату з прикладу 2 (2,97 г,,015 моль) та натрій гідрокарбонату (5,05 г, 0,06 моль) у ТГФ (15 мл) та етанолі (60 мл) було додано 2,4-дихлорпіримідин (6,70 г, 0,45 моль) при кімнатній температурі. Після перемішування реакційної суміші протягом 4 годин при 85°С, суспензію було охолоджено до кімнатної температури, профільтровано та старанно промито етилацетатом. Фільтрат було концентровано при зменшеному тиску та утворений твердий продукт було розтерто у порошок з етилацетатом, отримуючи густу кашку N-(2-хлорпіримідин-4-іл)1 2,3-диметил-2Н-індазол-6-аміну (89 %, 3,84 г). Н ЯМР (400 МГц, ДМСО-d6) 7,28 (d, J=9,0 Гц, 1Н), 6,42 (d, J=8,8 Гц, 1Н), 6,37 (s, 1Η), 5,18 (brs, 1H), 3,84 (s, 3H), 2,43 (s, 3H). МС (ЕР+, m/z) 274 (М+Н). Процедура 2 У тригорлу колбу на 1 л з механічною мішалкою, термометром та впускною/випускною трубкою для азоту було завантажено розчин продукту інтермедіату з прикладу 2 (32,89 г, 0,204 моль, 1,0 еквів.) у 425 мл (13 об'ємів) суміші EtOH/ТГФ (4/1), натрій гідрокарбонат (51,42 г, 0,612 моль, 3,0 еквів.) та тоді 2,4-дихлорпіримідин (45,59 г, 0,306 моль, 1,5 еквів.). Вміст колби було нагріто до 75°С та витримано при 74-76°С протягом 6-7 годин. Перебіг реакції перевіряли за допомогою ВЕРХ (продукт інтермедіату з прикладу 2
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition for the topical treatment of ocular neovascular disorders
Автори англійськоюBrigandi Richard Anthony, Levick Mark, Miller William Henry
Назва патенту російськоюФармацевтическая композиция для местного лечения неоваскулярных расстройств глаз
Автори російськоюБриганди Ричард Энтони, Левик Марк, Миллер Вилльям Генри
МПК / Мітки
МПК: A61P 27/02, A61K 31/506, A61K 31/55
Мітки: місцевого, фармацевтична, композиція, неоваскулярних, розладів, очей, лікування
Код посилання
<a href="https://ua.patents.su/20-94427-farmacevtichna-kompoziciya-dlya-miscevogo-likuvannya-neovaskulyarnikh-rozladiv-ochejj.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція для місцевого лікування неоваскулярних розладів очей</a>
Попередній патент: Спосіб виготовлення плоскої панелі (варіанти) і панель для підлогових покриттів, облицювання стін та стель (варіанти)
Наступний патент: Поліморфна форма та аморфна форма 5-хлор-n-({(5s)-2-оксо-3-[4-(3-оксо-4-морфолініл)феніл]-1,3-оксазолідин-5-іл}метил)-2-тіофенкарбоксаміду
Випадковий патент: Вітровий двигун