Похідні 6-аміно-2,4-заміщених-5-гетарилпіримідинів, спосіб отримання та застосування їх як засобів антибактеріальної, антивірусної та протиракової дії
Номер патенту: 104630
Опубліковано: 25.02.2014
Автори: Хиля Ольга Володимирівна, Мілохов Демид Сергійович, Воловенко Юліан Михайлович, Вовк Андрій Іванович, Кононець Людмила Анатоліївна
Формула / Реферат
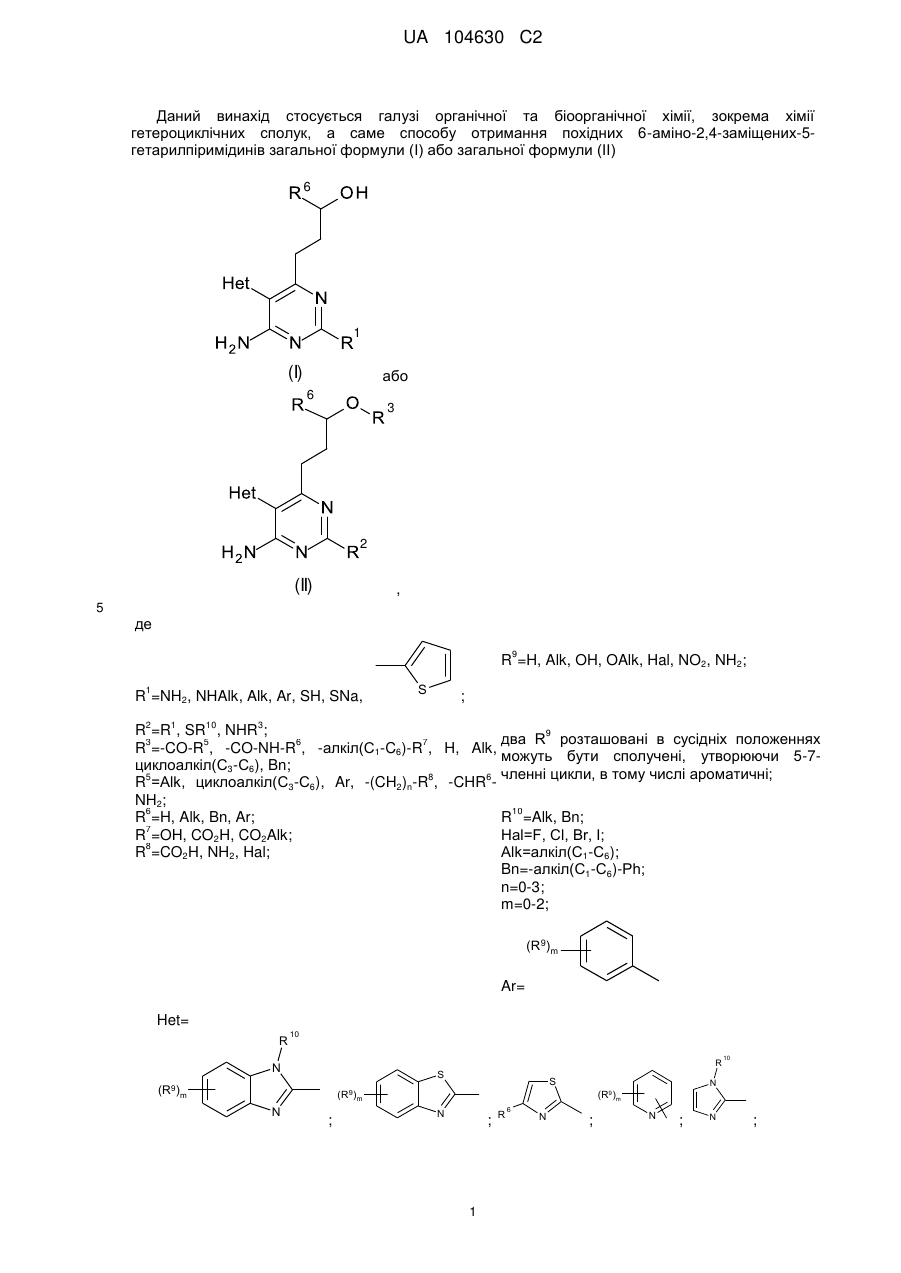
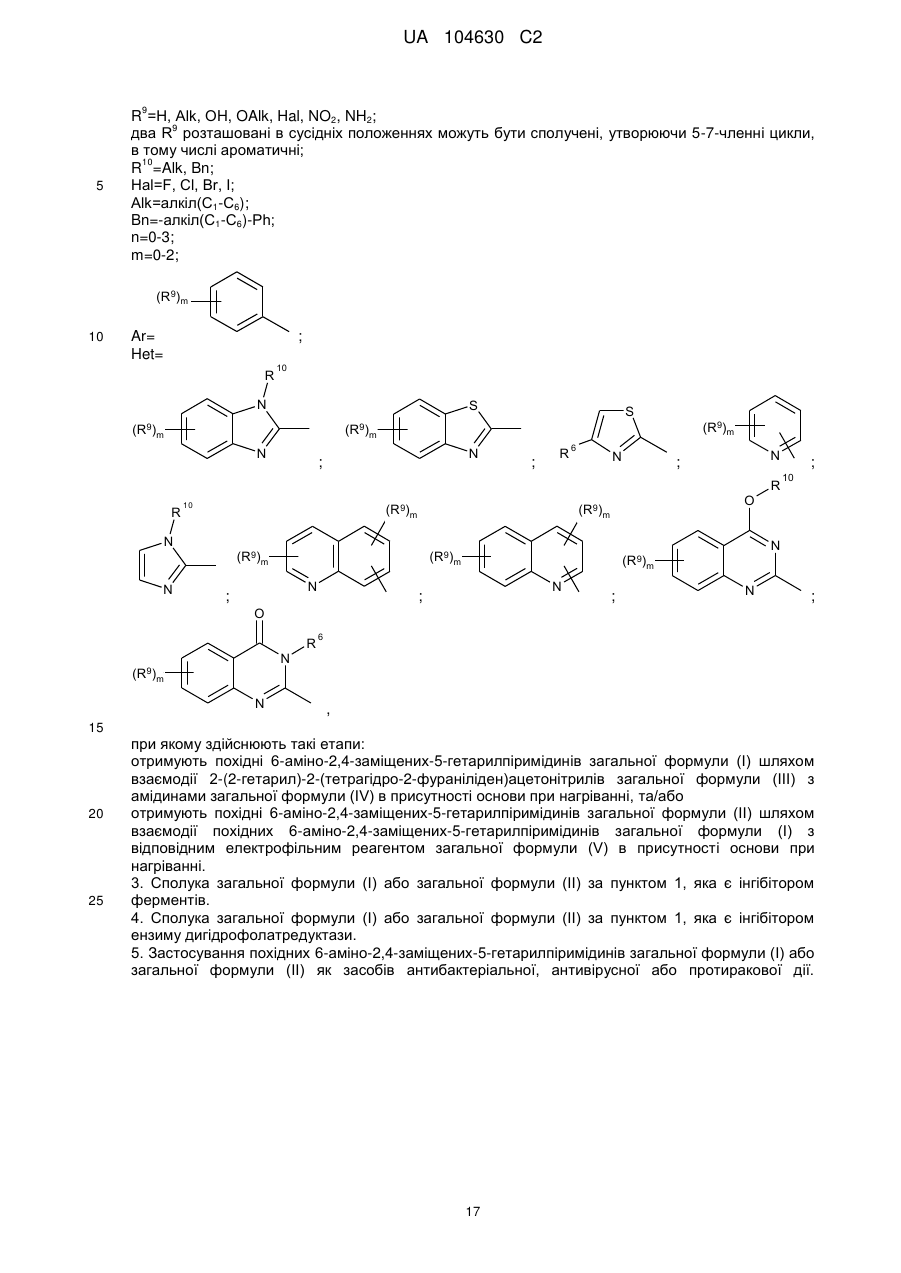
1. Похідні 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) або загальної формули (II)
 або
або ,
,
де
R1=NH2, NHAlk, Alk, Ar, SH, SNa, 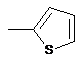 ;
;
R2=R1, SR10, NHR3;
R3=-CO-R5, -CO-NH-R6, -алкіл(С1-C6)-R7, H, Alk, циклоалкіл(С3-С6), Bn;
R5=Alk, циклоалкіл(С3-С6), Ar, -(CH2)n-R8, -CHR6-NH2;
R6=H, Alk, Bn, Ar;
R7=OH, CO2H, CO2Alk;
R8=CO2H, NH2, Hal;
R9=H, Alk, OH, OAlk, Hal, NO2, NH2;
два R9 розташовані в сусідніх положеннях можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні;
R10=Alk, Bn;
Hal=F, Сl, Вr, І;
Alk=алкіл(С1-С6);
Bn=-алкіл(С1-С6)-Рh;
n=0-3;
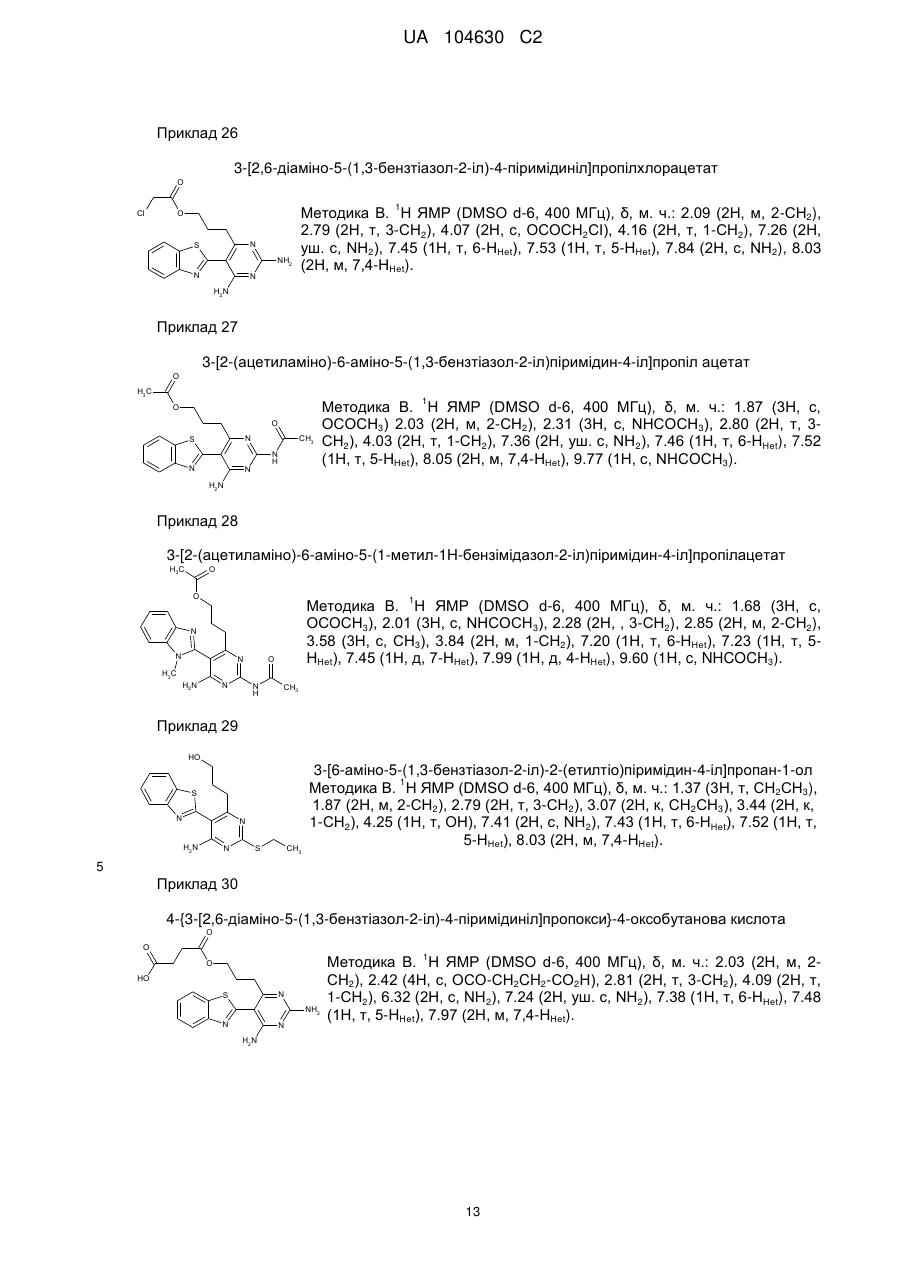
m=0-2;
Ar=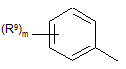 ;
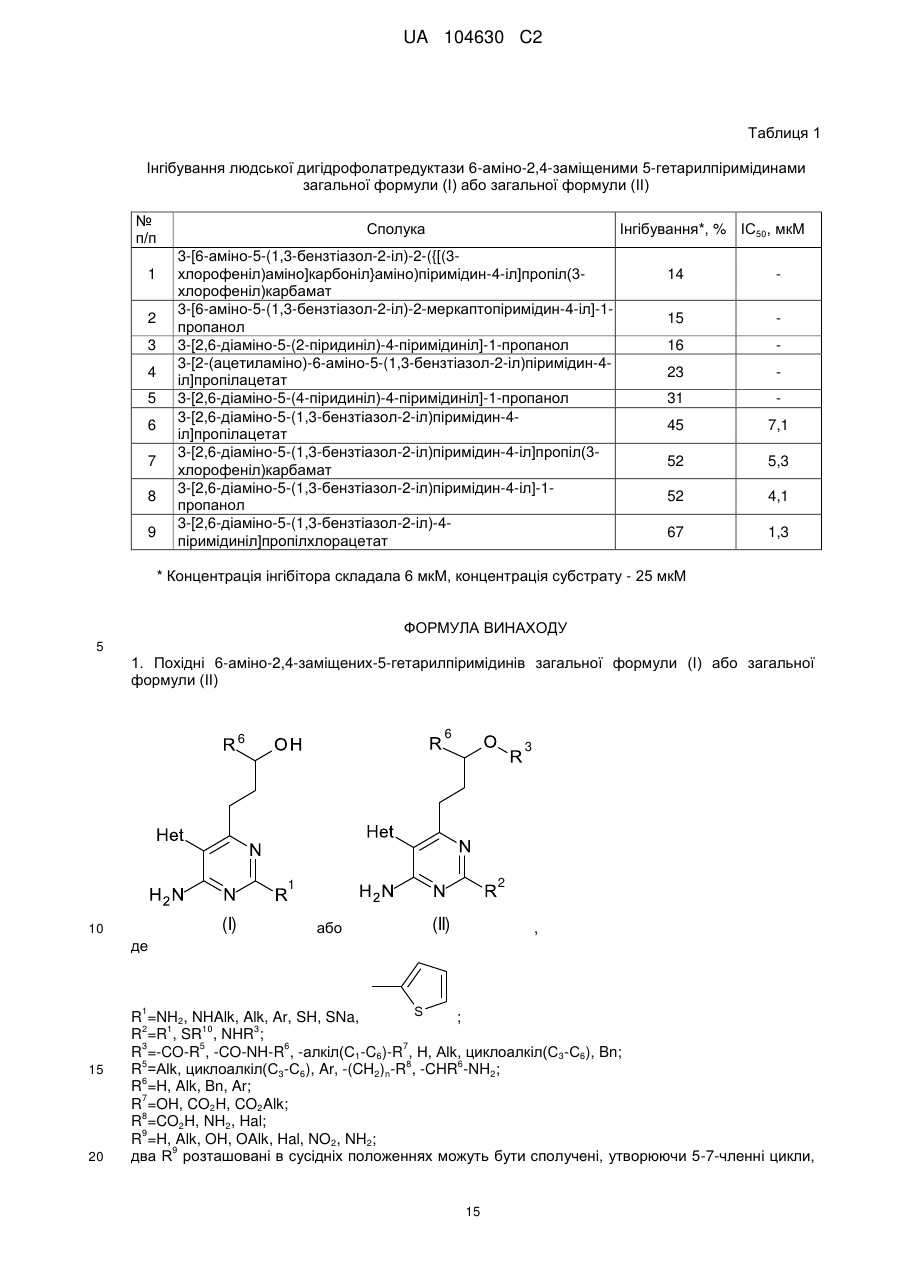
;
Het=
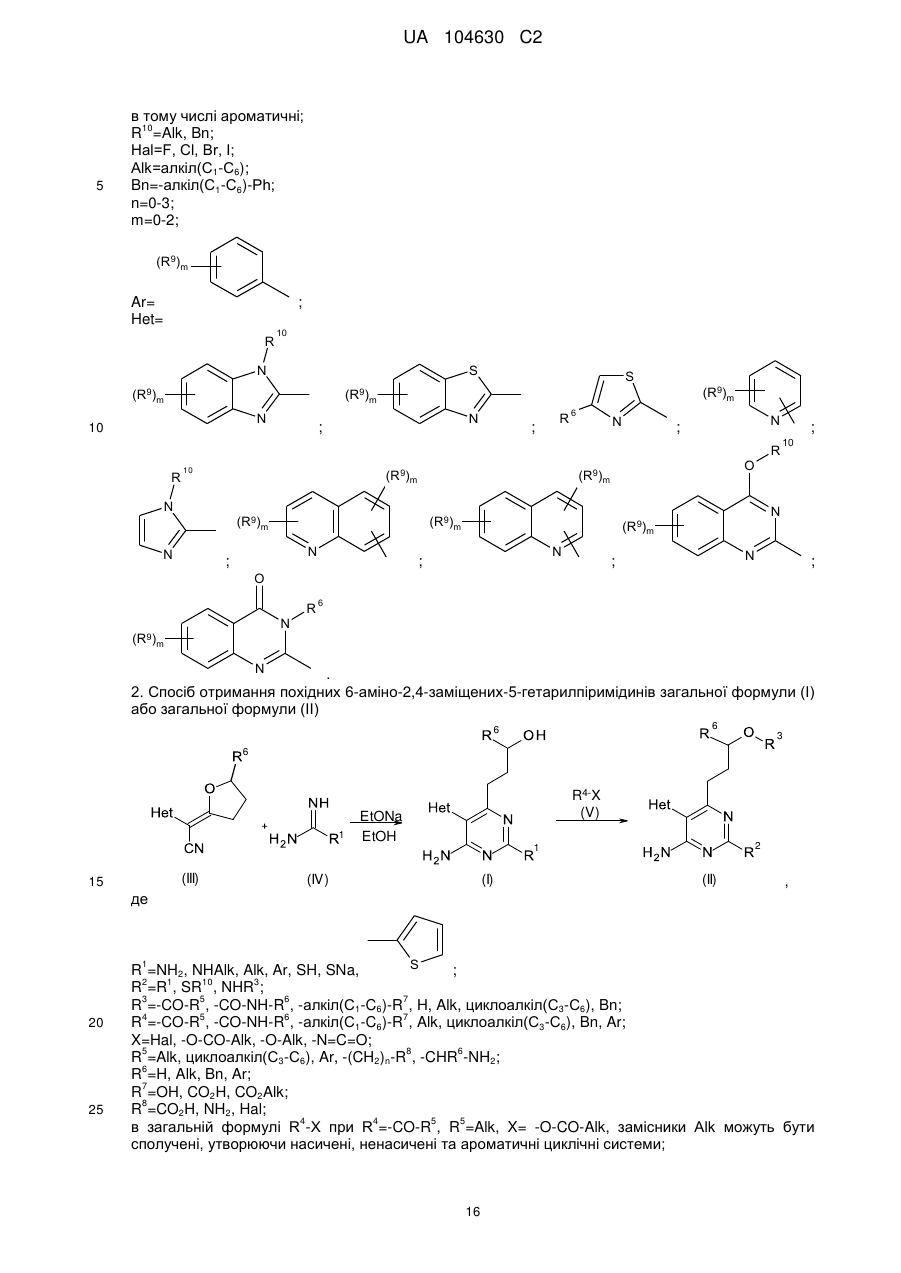
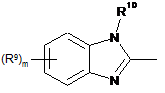 ;
; 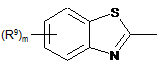 ;
; 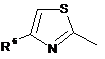 ;
; 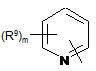 ;
; 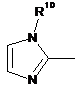 ;
; 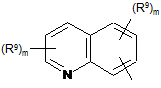 ;
; 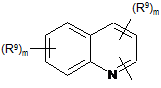 ;
;  ;
;  .
.
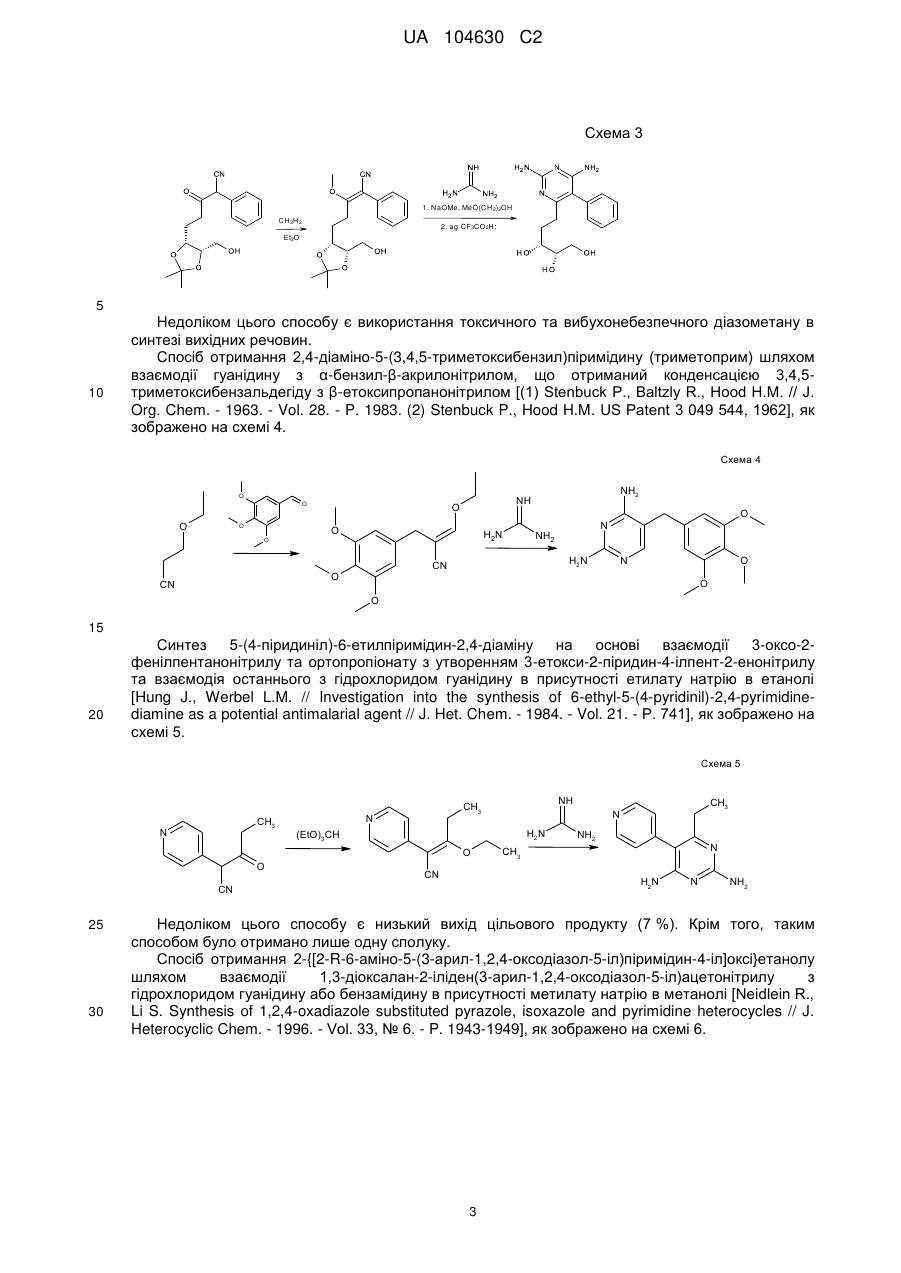
2. Спосіб отримання похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) або загальної формули (ІІ)
 ,
,
де
R1=NH2, NHAlk, Alk, Ar, SH, SNa,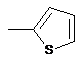 ;
;
R2=R1, SR10, NHR3;
R3=-CO-R5, -CO-NH-R6, -алкіл(С1-C6)-R7, H, Alk, циклоалкіл(С3-С6), Bn;
R4=-CO-R5, -CO-NH-R6, -алкіл(С1-C6)-R7, Alk, циклоалкіл(С3-С6), Bn, Ar;
X=Hal, -O-CO-Alk, -O-Alk, -N=C=O;
R5=Alk, циклоалкіл(С3-С6), Ar, -(CH2)n-R8, -CHR6-NH2;
R6=H, Alk, Bn, Ar;
R7=OH, CO2H, CO2Alk;
R8=CO2H, NH2, Hal;
в загальній формулі R4-X при R4=-CO-R5, R5=Alk, X= -O-CO-Alk, замісники Alk можуть бути сполучені, утворюючи насичені, ненасичені та ароматичні циклічні системи
R9=Н, Alk, OH, OAlk, Hal, NO2, NH2;
два R9 розташовані в сусідніх положеннях можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні;
R10=Alk, Bn;
Hal=F, Сl, Вr, І;
Alk=алкіл(С1-С6);
Bn=-алкіл(С1-С6)-Рh;
n=0-3;
m=0-2;
Ar=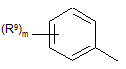 ;
;
Het=
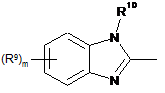 ;
; 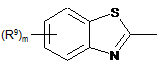 ;
; 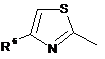 ;
; 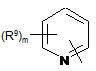 ;
; 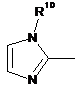 ;
; 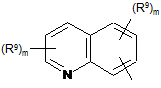 ;
; 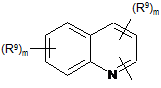 ;
;  ;
;  ,
,
при якому здійснюють такі етапи:
отримують похідні 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) шляхом взаємодії 2-(2-гетарил)-2-(тетрагідро-2-фураніліден)ацетонітрилів загальної формули (III) з амідинами загальної формули (IV) в присутності основи при нагріванні, та/або
отримують похідні 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (II) шляхом взаємодії похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) з відповідним електрофільним реагентом загальної формули (V) в присутності основи при нагріванні.
3. Сполука загальної формули (І) або загальної формули (II) за пунктом 1, яка є інгібітором ферментів.
4. Сполука загальної формули (І) або загальної формули (II) за пунктом 1, яка є інгібітором ензиму дигідрофолатредуктази.
5. Застосування похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) або загальної формули (II) як засобів антибактеріальної, антивірусної або протиракової дії.
Текст
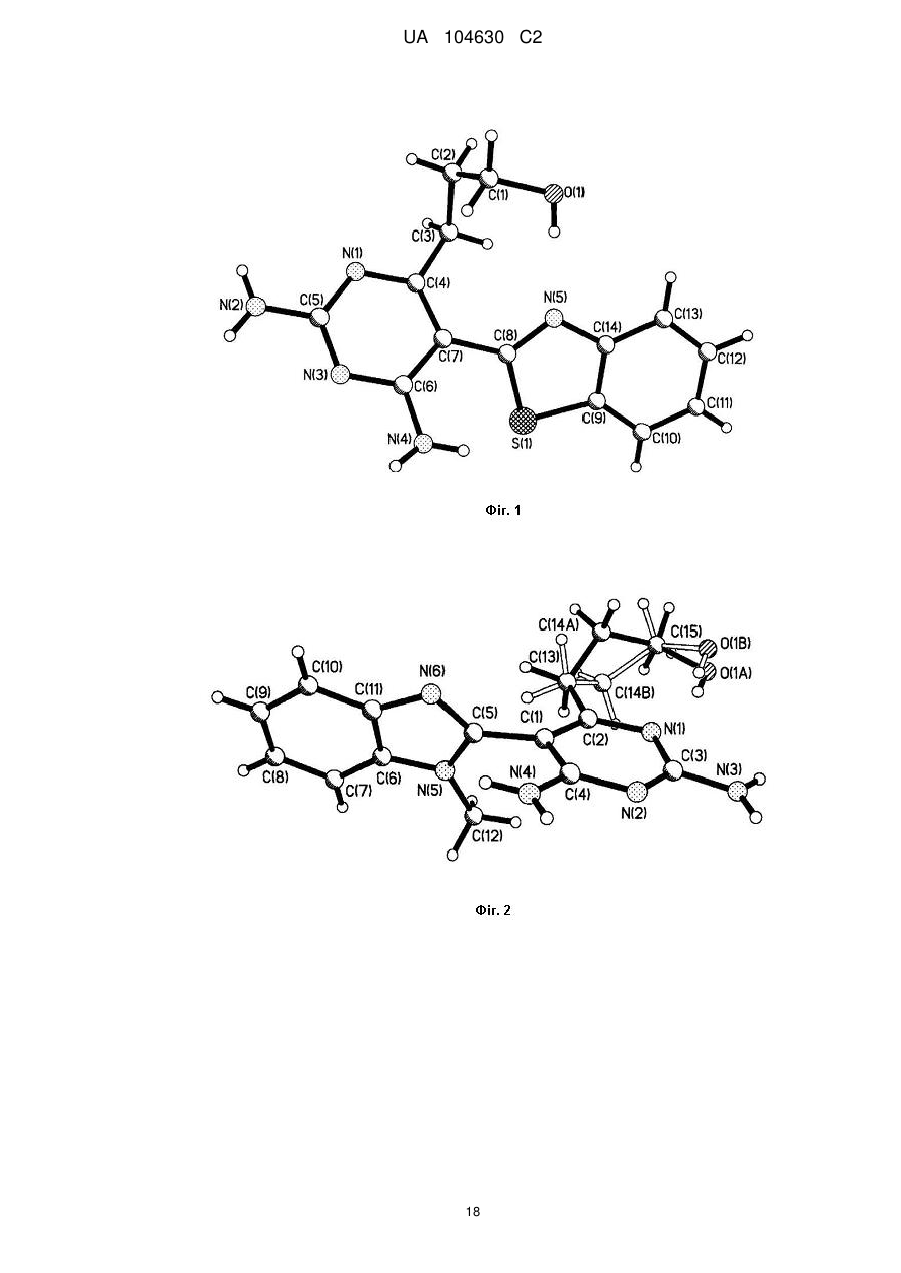
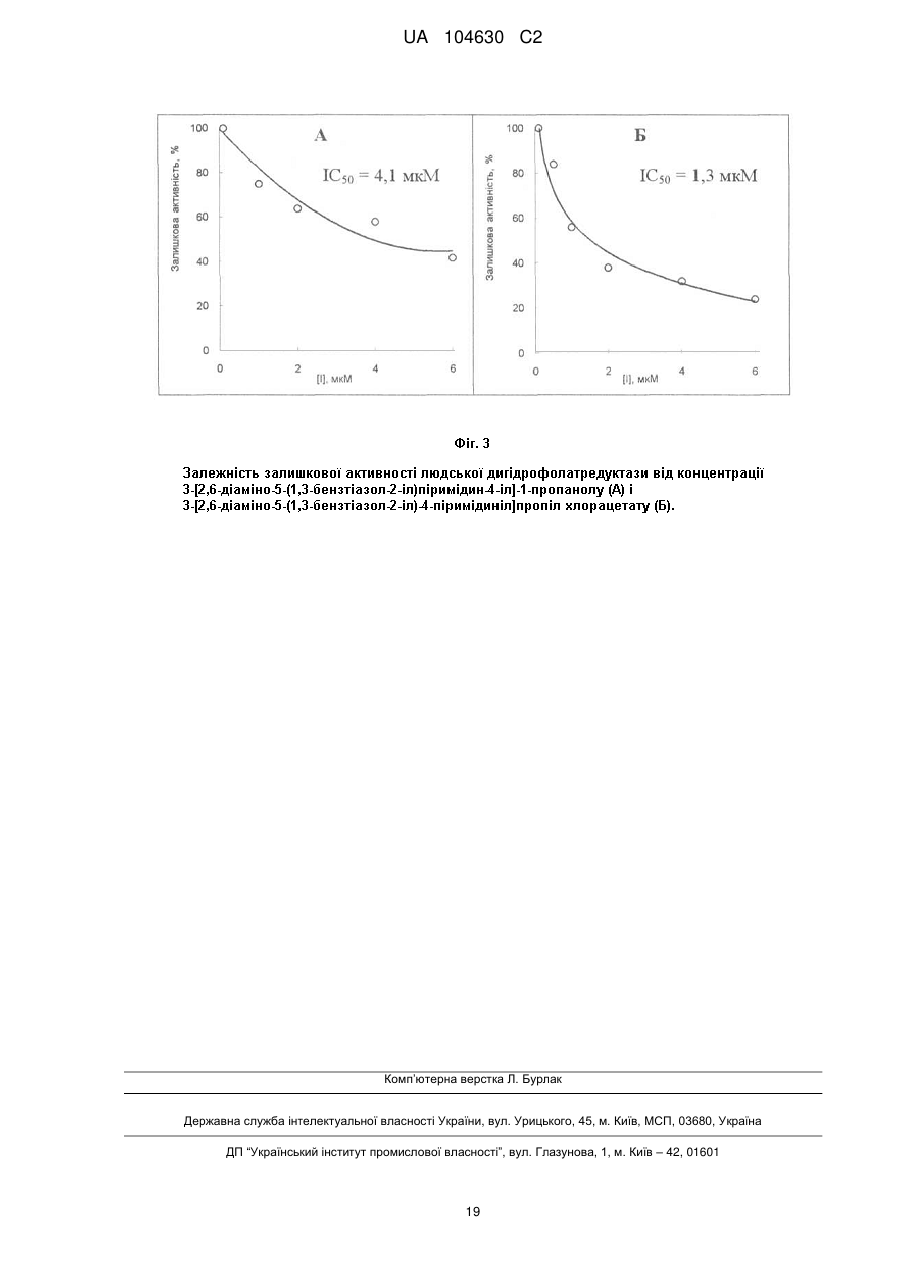
Реферат: Даний винахід стосується галузі органічної та біоорганічної хімії, зокрема хімії гетероциклічних сполук, а саме похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) або загальної формули (II): UA 104630 C2 (12) UA 104630 C2 6 6 1 (I) 3 2 (II) або , які можуть бути використані як проміжні продукти для синтезу нових речовин, а також як біологічно активні речовини, зокрема як інгібітори ферментів, і на основі цього як препарати антибактеріальної, антивірусної і протиракової дії. UA 104630 C2 Даний винахід стосується галузі органічної та біоорганічної хімії, зокрема хімії гетероциклічних сполук, а саме способу отримання похідних 6-аміно-2,4-заміщених-5гетарилпіримідинів загальної формули (І) або загальної формули (II) 6 1 (I) або 6 3 2 (II) , 5 де 9 R =H, Alk, OH, OAlk, Hal, NO2, NH2; 1 R =NH2, NHAlk, Alk, Ar, SH, SNa, 2 1 10 S ; 3 R =R , SR , NHR ; 9 два R розташовані в сусідніх положеннях 3 5 6 7 R =-CO-R , -CO-NH-R , -алкіл(С1-C6)-R , H, Alk, можуть бути сполучені, утворюючи 5-7циклоалкіл(С3-С6), Bn; 5 8 6 членні цикли, в тому числі ароматичні; R =Alk, циклоалкіл(С3-С6), Ar, -(CH2)n-R , -CHR NH2; 6 10 R =H, Alk, Bn, Ar; R =Alk, Bn; 7 R =OH, CO2H, CO2Alk; Hal=F, Сl, Вr, І; 8 R =CO2H, NH2, Hal; Alk=алкіл(С1-С6); Bn=-алкіл(С1-С6)-Рh; n=0-3; m=0-2; (R9)m Ar= Het= R 10 R N S (R9)m S N (R9)m N ; 10 (R9)m N ; 1 R 6 N ; N ; N ; UA 104630 C2 (R9)m (R9)m (R9)m (R9)m 10 10 O N N (R9)m R 6 (R9)m N N N ; ; ; , які можуть бути використані як проміжні продукти для синтезу нових речовин, а також як біологічно активні речовини, зокрема як інгібітори ферментів і на основі цього як препарати антибактеріальної, антивірусної і протиракової дії. Сполуки, що заявляються, їх властивості та спосіб отримання в літературі не описані. Відомо ряд похідних амінопіримідинів (які можуть бути використані або вже використовуються в медицині як лікарські препарати) та їх способи отримання. Спосіб отримання 5-(4-хлорфеніл)-6-етилпіримідин-2,4-діаміну (піритамін) шляхом взаємодії 2-(4-хлорфеніл)-3-метоксипент-2-енонітрилу з гідрохлоридом гуанідину в присутності етилату натрію в етанолі [Russell P.В., Hitchings G.H. // Diaminopyrimidines as Antimalarials. III. 5-Aryl Derivatives // J. Am. Chem. Soc. - 1951. - Vol. 73. - P. 3763], як зображено на схемі 1. N 5 R O Схема 1 NH2 HN Cl Cl O CH3 O 20 N NH2 N CH3 H3C CN CN 15 NH2 CH2N2 H2N Cl Недоліком цього способу є використання токсичного та вибухонебезпечного діазометану в синтезі вихідних речовин. Спосіб отримання 5-(4-хлорфеніл)-6-метилпіримідин-2,4-діаміну (піриметамін) шляхом взаємодії (Е)-1-n-хлорфеніл-1-ціано-2-метилтіо-3-фенілсульфонілпропен з гуанідином та наступною обробкою амальгамою натрію [Yokoyama М., Tsuji К., Imamoto Т. Synthesis of important heteroaromatics from methyl phenyl sulfone // Bull. Chem. Soc, Jap. - 1984. - Vol. 57, № 10. - P. 2954-2956], як зображено на схемі 2. Схема 2 SO2Ph Ar S CN 25 30 SO2Ph NH H2N NH2 Ar H2N CH3 Na / Hg N N Cl NH2 N H2N N NH2 Недоліком цього способу є використання токсичних речовин. Спосіб отримання 5-феніл-6-(3,4,5-тригідроксипентил)піримідин-2,4-діаміну шляхом взаємодії 5-[5-(гідроксиметил)-2,2-диметил-1,3-діоксолан-4-іл]-3-метокси-2-фенілпент-2енонітрилу з гідрохлоридом гуанідину в присутності етилату натрію в глімі (монометиловий етер гліцерину) [El-Hamamsy Mervat H. R. L, Smith A.W., Thompson A.S., Threadgill M.D. Structurebased design, synthesis and preliminary evaluation of selective inhibitors of dihydrofolate reductase from Mycobacterium tuberculosis // Bioorg. Med. Chem. - 2007. - Vol. 15, № 13. - P. 4552-4576], як зображено на схемі 3. 2 UA 104630 C2 Схема 3 1. NaOMe, MeO(CH 2)2OH CH2H2 2. ag CF3CO2H; Et2O 5 10 Недоліком цього способу є використання токсичного та вибухонебезпечного діазометану в синтезі вихідних речовин. Спосіб отримання 2,4-діаміно-5-(3,4,5-триметоксибензил)піримідину (триметоприм) шляхом взаємодії гуанідину з α-бензил-β-акрилонітрилом, що отриманий конденсацією 3,4,5триметоксибензальдегіду з β-етоксипропанонітрилом [(1) Stenbuck P., Baltzly R., Hood H.M. // J. Org. Chem. - 1963. - Vol. 28. - P. 1983. (2) Stenbuck P., Hood H.M. US Patent 3 049 544, 1962], як зображено на схемі 4. Схема 4 O O O O O O O H2N N NH2 H2N CN O CN NH2 NH O N O O O 15 20 Синтез 5-(4-піридиніл)-6-етилпіримідин-2,4-діаміну на основі взаємодії 3-оксо-2фенілпентанонітрилу та ортопропіонату з утворенням 3-етокси-2-піридин-4-ілпент-2-енонітрилу та взаємодія останнього з гідрохлоридом гуанідину в присутності етилату натрію в етанолі [Hung J., Werbel L.M. // Investigation into the synthesis of 6-ethyl-5-(4-pyridinil)-2,4-pyrimidinediamine as a potential antimalarial agent // J. Het. Chem. - 1984. - Vol. 21. - P. 741], як зображено на схемі 5. Схема 5 CH3 N H2 N CN 30 NH2 N CH3 H2N CN 25 CH3 N (EtO)3CH O O NH CH3 N N NH2 Недоліком цього способу є низький вихід цільового продукту (7 %). Крім того, таким способом було отримано лише одну сполуку. Спосіб отримання 2-{[2-R-6-аміно-5-(3-арил-1,2,4-оксодіазол-5-іл)піримідин-4-іл]оксі}етанолу шляхом взаємодії 1,3-діоксалан-2-іліден(3-арил-1,2,4-оксодіазол-5-іл)ацетонітрилу з гідрохлоридом гуанідину або бензамідину в присутності метилату натрію в метанолі [Neidlein R., Li S. Synthesis of 1,2,4-oxadiazole substituted pyrazole, isoxazole and pyrimidine heterocycles // J. Heterocyclic Chem. - 1996. - Vol. 33, № 6. - P. 1943-1949], як зображено на схемі 6. 3 UA 104630 C2 Схема 6 NH*HCl MeONa / MeOH Ar=H-C6H4, 4-OMe-C6H4, 4-ClC6H4, 3-NO2-C6H4; R=Ph, NH2 5 10 15 20 25 30 35 40 45 Недоліком цього способу є низький вихід цільового продукту (15-20 %). 4-Амінопіримідини і 2,4-діамінопіримідини формують загальний структурний мотив багатьох природних і синтетичних біологічно активних сполук. Вони можуть також бути молекулярною платформою для конструювання нових сполук з широким спектром біологічної активності, в тому числі антибактеріальної, противірусної, протипаразитарної та протиракової. Терапевтично важливими білковими мішенями для похідних піримідинів є дигідрофолатредуктаза, тимідилатсинтаза, дигідроптероатсинтаза та інші ферменти. Одними з найбільш вивчених мішеней для антифолатів є дигідрофолатредуктази з різних джерел - ключові ферменти біосинтезу пуринів і тимідилату, нестача яких приводить до блокування росту і проліферації клітин. Відомі інгібітори дигідрофолатредуктаз, що застосовуються в медицині як лікарські препарати антибактеріальної, антималярійної та протиракової дії, наприклад метотрексат, триметоприм і піриметамін [Kompis I. M., Islam Khalid, Then R. L. // Chem. Rev. - 2005. - Vol. 105. P. 593]. Ці препарати мають необхідні лікувальні властивості, проте можуть викликати алергічні реакції та виявляють резистентність. Близьким за структурою до сполук загальної формули (І) або загальної формули (II) є 3-(2,6діаміно-5-феніл-4-піримідиніл)-1-пропанол [Kamchonwongpaisan S., Quarrell R., Charoensetakul N., Ponsinet R., Vilaivan Т., Vanichtanankul J., Tarnchompoo В., Sirawaraporn W., Lowe G., Yuthavong Y. Inhibitors of multiple mutants of Plasmodium falciparum dihydrofolate reductase and their antimalarial activities // J. Med. Chem. - 2004. -Vol. 47, № 3. - P. 673]. Ця сполука та її структурні аналоги виявляють активність як інгібітори дигідрофолатредуктази з Plasmodium falciparum з константами інгібування в наномолярному діапазоні значень. Ряд похідних 2,6-діаміно-5-бензилпіримідину з різними замісниками фенільного фрагменту демонстрували ефективність інгібування дигідрофолатредуктази з L. major і Т. cruzi, діючи селективно у порівнянні з людським ферментом. Константи інгібування людської дигідрофолатредуктази складали при цьому 1,6-25,4 мкМ [Pez D., Leal I., Zuccotto F., Boussard С, Brun, R. Croft S. L., Yardley V., Ruiz Perez L. M., Gonzalez Pacanowska D., Gilbert I.H… 2,4Diaminopyrimidines as Inhibitors of Leishmanial and Trypanosomal Dihydrofolate Reductase. // Bioorg. Med. Chem. - 2003. - Vol. 11. P. 4693-4711]. Нові похідні 2,4-діамінопіримідинів з арилпропаргільним замісником у положенні 5 були запропоновані як некласичні інгібітори людської дигідрофолатредуктази і охарактеризовані значеннями IС50 в мікромолярному і низькомікромолярному діапазоні [Algul О., Paulsen J. L., Anderson A. C. 2,4-Diamino-5-(2-arylpropargyl)pyrimidine derivatives as new nonclassical antifolates for human dihydrofolate reductase inhibition // J. Моl. Graph. Modelling. - 2011. - Vol. 29. - P. 608613]. Перевагами некласичних інгібіторів дигідрофолатредуктази є пасивний спосіб трансмембранного транспорту. В основу винаходу поставлено задачу створити нові похідні 6-аміно-2,4-заміщених-5гетарилпіримідинів загальної формули (І) або загальної формули (II), а саме розробити способи отримання цих сполук як потенційних інгібіторів ферментів і препаратів антибактеріальної, антивірусної і протиракової дії. Поставлена задача вирішується використанням способу отримання похідних 6-аміно-2,4заміщених-5-гетарилпіримідинів загальної формули (І) шляхом взаємодії 2-(2-гетарил)-2(тетрагідро-2-фураніліден)ацетонітрилів загальної формули (III) з амідинами загальної формули (IV) в присутності основи при нагріванні як зображено на схемі 7. Або здійснення способу отримання похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (II) шляхом взаємодії похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) з 4 UA 104630 C2 відповідним електрофільним реагентом загальної формули (V) в присутності основи при нагріванні як зображено на схемі 7 Схема 7 Ошибка! Объект не может быть создан из кодов полей редактирования. 5 9 R =Н, Alk, OH, OAlk, Hal, NO2, NH2; S R =NH2, NHAlk, Alk, Ar, SH, SNa ; 1 10 3 9 R =R , SR , NHR ; два R розташовані в сусідніх положеннях 3 5 6 7 R =-CO-R , -CO-NH-R , -алкіл(С1-C6)-R , H, Alk, можуть бути сполучені, утворюючи 5-7циклоалкіл(С3-С6), Bn; членні цикли, в тому числі ароматичні; 4 5 6 7 R =-CO-R , -CO-NH-R , -алкіл(С1-C6)-R , Alk, циклоалкіл(С3-С6), Bn, Ar; 10 X=Hal, -O-CO-Alk, -O-Alk, -N=C=O; R =Alk, Bn; 5 8 6 R =Alk, Ar, -(CH2)n-R , -CHR -NH2; Hal=F, Сl, Вr, І; 6 R =H, Alk, Bn, Ar; Alk=алкіл(С1-С6); 7 R =OH, CO2H, CO2Alk; Bn=-алкіл(С1-С6)-Рh; 8 R =CO2H, NH2, Hal; n=0-3; m=0-2; 1 2 4 4 5 5 в загальній формулі R -X при R =-CO-R , R =Alk, X= -O-CO-Alk, замісники Alk можуть бути (R9)m сполучені, утворюючи насичені, ненасичені та ароматичні циклічні системи Ar= Het= R 10 S N S (R9)m (R9)m N R N ; 10 ; R 6 N (R9)m N O (R9)m (R9)m N ; ; (R9)m (R9)m N N ; ; 10 N (R9)m N ; R N ; O N R 6 (R9)m 10 15 20 25 N Структура синтезованих сполук доведена методами ЯМР-спектроскопії, ІЧ-спектроскопії, елементного аналізу, рентгено-структурного аналізу. Результати тестувань in vitro свідчать про те, що похідні 6-аміно-2,4-заміщених-5гетарилпіримідинів можуть виявляти біологічну активність як інгібітори дигідрофолатредуктаз. Показано, що значення ІС50 при інгібуванні людської рекомбінантної дигідрофолатредуктази знаходяться в мікромолярному діапазоні. Наприклад, ІС50 для 3-[2,6-діаміно-5-(1,3-бензтіазол-2іл)-4-піримідиніл]пропіл хлорацетату складає 1,3 мкМ (концентрація дигідрофолієвої кислоти 25 мкМ). Отже, сполуки в ряду нових похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів можуть представляти інтерес як інгібітори ферментів, в тому числі як некласичні інгібітори дигідрофолатредуктаз з різних джерел, і на основі цього як потенційні препарати антибактеріальної, антивірусної і протиракової дії. Винахід підтверджується нижченаведеними прикладами. 1. Синтези похідних 6-аміно-2,4-заміщених-5-гетарилпірімідинів загальної формули (І) або загальної формули (II). Методика А. Синтез похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І). 5 UA 104630 C2 5 10 15 Розчиняють 1 ммоль 2-(2-гетарил)-2-(тетрагідро-2-фураніліден)ацетонітрилу загальної формули (ІІІ), 2 ммоль солі амідину загальної формули (IV) та 2 ммоль етилату натрію в 5 мл абсолютного етанолу. Час проходження реакції становить 0,5-8 год., Т=20-80 °C. Після закінчення реакції осад відфільтровують, промивають етанолом та невеликою кількістю льодяної води. Додаткову кількість цільового продукту можна виділити при додаванні до маточного розчину рівного об'єму води, нейтралізації оцтовою кислотою та упарюванні у вакуумі. Залишок перекристалізовують з водно-етанольного розчину. Методика В. Синтез похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (II) на основі похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) як проміжних продуктів. В абсолютному діоксані розчиняють 1 ммоль 6-аміно-2,4-заміщених-5-гетарилпіримідину загальної формули (І) в присутності 1-3 ммоль основи (наприклад: піридин, триетиламін, діізопропілетиламін, гідрид натрію, карбонати лужних металів), потім додають 1-3 ммоль відповідного електрофільного реагенту загальної формули (V). Час проходження реакції становить 1-3 год., Т=20-100 °C. Після закінчення реакції відфільтровують осад, що утворився, промивають невеликою кількістю діоксану та льодяної води. При необхідності, до маточного розчину додають п'ятикратний об'єм води та проводять екстракцію етилацетатом або хлороформом, упарюють екстракти у вакуумі. Залишок перекристалізовують з відповідного розчинника. 20 Приклад 1 3-[2,6-діаміно-5-(4-метил-1,3-тіазол-2-іл)піримідин-4-іл]-1-пропанол HO Методика А. Білі мікрокристали, вихід 56 %. Тпл. 195 °C. 1 H ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.82 (2Н, м, 2-СН2), 2.43 (3Н, с, Me), 2.68 (2Н, т, J=7.6 Гц, 3-СН2), 3.44 (2Н, т, J=6.3 Гц, 1-СН2), 4.43 (1H, уш. с, ОН), 5.93 (2Н, с, 2-NH2), 6.93 (2Н, уш. с, 6-NH2), 7.09 (1H, с, НHet). S H3 C N N H2 N N NH2 -1 ІЧ (KBr): 3428, 3305, 3109, 1667, 1569, 1446 см . Аналіт. (%). Обчислено для C11H15N5OS: С - 49.79; Н - 5.70; N-26.39; S-12.09. Знайдено: С - 49.88; Н - 5.33; N-26.79; S-12.98. Приклад 2 3-[6-аміно-2-(метиламіно)-5-(4-метил-1,3-тіазол-2-іл)піримідин-4-іл]-1-пропанол HO S H3 C N N H2 N N N H CH3 Методика А. Білі мікрокристали, вихід 61 %. Тпл. 208 °C. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м.ч.: 1.70 (2Н, м, 2-СН2), 2.26 (2Н, м, 3СН2), 2.43 (3Н, с, Me), 3.35 (5Н, м, NHMe і 1-СН2), 4.38 (1Н, с, ОН), 6.63 13 (1Н, уш. с, NH), 6.92 (2Н, с, NH2), 7.16 (1Н, с, HHet). С ЯМР (DMSO d-6, 100 МГц), δ, м.ч.: 17.28, 30.65, 31.76, 32.26, 60.92, 103.45, 115.67, 152.14, 154.99, 157.64, 161.60, 162.34. -1 ІЧ (KBr): 3428, 3249, 3103, 1681, 1591, 1384 см . Аналіт. (%). Обчислено для C12H17N5OS: С - 51.59; Н - 6.13; N-25.07; S-11.48. Знайдено: С - 51.42; Н - 6.29; N-25.85; S-11.35. Приклад 3 3-[6-аміно-5-(4-метил-1,3-тіазол-2-іл)]-1-)-2-фенілпіримідин-4-іл]-1-пропанол HO S H3C N N H2N N Ph Методика А. Білі мікрокристали, вихід 75 %. Тпл. 128 °C. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.98 (2Н, м, 2-СН2), 2.48 (3Н, с, Me), 2.90 (2Н, т, J=7.5 Гц, 3-СН2), 3.52 (2Н, т, J=6 Гц, 1-СН2), 4.32 (1Н, т, J=6 Гц, ОН), 7.33 (1Н, с, ННеt), 7.43 (5Н, м, NH2 і 3,4,5-HPh), 8.37 (2Н, м, 2,6-Hph). 13 С ЯМР (DMSO d-6, 100 МГц), δ, м. ч.: 17.50, 31.80, 33.15, 61.37, 107.30, 115.53, 128.58, 128.43,130.54, 138.38, 152.13, 161.86,161.92, 165.97, 166.74. -1 ІЧ (КВr): 3400, 3204, 2952,1597, 1535, 1434 см . Аналіт. (%). Обчислено для C17H18N4OS: С - 62.55; Н - 5.56; N-17.16; S-9.82. Знайдено: С - 62.52; Н - 5.32; N-16.35; S-9.37. 6 UA 104630 C2 Приклад 4 3-[6-аміно2-метил-5-(4-метил-1,3-тіазол-2-іл)піримідин-4-іл]-1-пропанол HO S H3 C N N H2 N N CH3 Методика А. Білі мікрокристали, вихід 85 %. Тпл. 149 °C. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, мл.: 1.81 (2Н, м, 2-СН2), 2.37 (3Н, с, Me), 2.49 (3Н, с, Me), 2.73 (2Н, т, J=7.5 Гц, 3-СН2), 3.44 (2Н, т, 7=6 Гц, 1-СН2), 4.36 (1H, с, ОН), 7.18 (2Н, с, NH2), 7.27 (1H, с, ННеt). 13 С ЯМР (DMSO d-6, 100 МГц), δ, м.ч.: 17.20, 25.70, 31.85, 32.49, 61.03,106.08, 115.54, 151.99, 161.45, 161.52, 165.83, 166.29. -1 ІЧ (КВr): 3411, 3277, 3092, 2946, 1639, 1538 см . Аналіт. (%). Обчислено для C12H16N4OS: С - 54.52; Н - 6.10; N-21.19; S-12.13. Знайдено: С - 54.67; Н - 6.09; N-21.50; S-12.14. Приклад 5 3-[6-аміно-2-меркапто-5-(4-метил-1,3-тіазол-2-іл)піримідин-4-іл]-1-пропанол HO Методика А. Білі мікрокристали, вихід 52 %. Тпл. 212 °C. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.76 (2Н, м, 2-СН2), 2.47 (3Н, с, Me), 2.72 (2Н, 3 т, J=7.8 Гц, -СН2), 3.44 (2Н, т, J=6.1 Гц, 1-СН2), 4.42 (1Н, уш. с, ОН), 7.30 (1Н, с, НHet), 7.96 (1H, с, NH), 8.24 (1H, с, NH), 12.25 (1H, с, SH). S H3 C N N H2N N SH 13 С ЯМР (DMSO d-6, 100 МГц), δ, м. ч.: 17.6, 27.73, 32.07, 60.54, 101.16, 115.85, 152.20, 156.86, 159.06, 160.14, 179.16. -1 ІЧ (КВr): 3243, 2941,1613, 1555, 1471, 1191 см . Аналіт. (%). Обчислено для C11H16N4OS2: С - 46.79; Н - 5.00; N-19.84; S-22.71. Знайдено: С - 46.66; Н - 4.88; N-18.64; S-22.68. Приклад 6 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-меркаптопіримідин-4-іл]-1-пропанол HO S N N H2 N N SH Методика А. Білі мікрокристали, вихід 95 %. Тпл. 218 °C. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.81 (2Н, м, 2-СН2), 2.74 (2Н, т, J=7.6 Гц, 3-СН2), 3.43 (2Н, кв, J=5.5 Гц, 1-СН2), 4.40 (1Н, т, J=5.5 Гц, ОН), 7.45 (1Н, т, J=8.1 Гц, HHet), 7.53 (1Н, т, J=8.1 Гц, НHet), 7.84 (1H, с, NH), 8.06 (2Н, д, J=8.1 Гц, HHet), 8.18 (1H, с, NH), 12.36 (1H, с, SH). 13 С ЯМР (DMSO d-6, 100 МГц), δ, м. ч.: 28.00, 32.55, 60.84, 101.55, 122.74, 123.76, 126.28, 127.04, 136.21, 153.28, 158.25, 160.59, 180.24. -1 ІЧ (КВr): 3422, 3310, 3249, 1608, 1555, 1191 см . Аналіт. (%). Обчислено для C14H14N4OS2: С - 52.81; Н - 4.43; N-17.60; S-20.14. Знайдено: С - 52.68; Н - 4.41; N-17.46; S-19.94. Приклад 7 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-метилпіримідин-4-іл]-1-пропанол HO S N N H2 N N CH3 Методика А, Білі мікрокристали, вихід 86 %. Тпл. 155 °C. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.80 (2Н, м, 2-СН2), 2.40 (3Н, с, Me), 2.70 (2Н, т, J=7.6 Гц, 3-СН2), 3.39 (2Н, кв, J=6.0 Гц, 3-СН2), 4.30 (1H, т, J=6.0 Гц, ОН), 7.14 (2Н, с, NH2), 7.42 (1Н, т, J=7.9 Гц, НHet), 7.50 (1H, т, J=7.9 Гц, HHet), 8.03 (2Н, д, J=7.9 Гц, HHet). 13 С ЯМР (DMSO d-6, 100 МГц), δ, м. ч.: 26.04, 32.20, 32.77, 61.30, 106.35, 122.13, 123.34, 125.75, 126.59, 135.79, 153.03, 161.81, 163.58, 167.04, 167.42. -1 ІЧ (КВr): 3478, 3294, 3134, 1619, 1536, 1059 см . Аналіт. (%). Обчислено для C15H16N4OS: С - 59.98; Н - 5.37; N-18.65; S-10.68. Знайдено: С - 59.62; Н - 5.39; N-18.95; S-10.93. 5 7 UA 104630 C2 Приклад 8 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-ізопропілпіримідин-4-іл]-1-пропанол HO S N N H2 N CH3 N Методика А. Білі мікрокристали, вихід 70 %. Тпл. 123 С. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.26 (6Н, д, J=7.0 Гц, s-Рr), 1.83 (2Н, м, 2-СН2), 2.75 (2Н, т, J=7.6 Гц, 3-СН2), 2.87 (1Н, м, і-Рr), 3.43 (2Н, кв, J=4.0 Гц, 1-СН2), 4.32 (1Н, т, J=4.0 Гц, ОН), 7.14 (2Н, с, NH 2), 7.42 (1H, т, J=7.6 Гц, HHet), 7.50 (1H, т, J=7.6 Гц, ННet), 8.03 (2Н, д, J=7.6Гц, HHet). CH3 13 С ЯМР (DMSO d-6, 100 МГц), δ, м. ч.: 22.02, 32.02, 32.88, 37.42, 61.32, 106.53, 122.11, 123.35, 125.73, 126.59, 135.76, 153.01, 161.96, 163.75, 167.38, 174.15. -1 ІЧ (КВr): 3540, 3317, 3142, 2959, 1618, 1534 см . Аналіт. (%). Обчислено для C17H20N4OS: С - 62.17; Н - 6.14; N-17.06; S-9.76. Знайдено: С - 62.32; Н - 6.09; N-17.15; S-9.86. Приклад 9 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)піримідин-4-іл]-1-пропанол HO S N N H2N N NH2 Методика А. Білі мікрокристали, вихід 95 %. Тпл. 231 С. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.84 (2Н, м, 2-СН2), 2.78 (2Н, т, J=7.8 Гц, 3-СН2), 3.46 (2Н, т, J=6.4 Гц, 1-СН2), 4.34 (1H, с, ОН), 6.27 (2Н, с, 2-NH2), 7.22 (2Н, уш. с, 6-NH2), 7.36 (1H, т, J=7.8 Гц, HHet), 7.46 (1Н, т, J=7.8 Гц, HHet), 7.96 (2Н, д, J=7.8 Гц, ННet). 13 С ЯМР (DMSO d-6, 100 МГц), δ, м.ч.: 32.24, 33.18, 61.39, 100.18, 121.71, 122.59, 125.05, 126.41, 134.98, 152.67, 162.43, 162.78, 165.14, 169.22. -1 ІЧ (КВr): 3344, 3137, 1655, 1555, 1434, 1076 см . Аналіт. (%). Обчислено для C14H15N5OS: С - 55.80; Н - 5.02; N-23.24; S-10.64. Знайдено: С - 55.38; Н - 5.05; N-23.76; S-10.25. 5 10 15 Будову 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)піримідин-4-іл]-1-пропанолу доведено за даними рентгеноструктурних досліджень (Фіг. 1). Амінопіримідиновий фрагмент С(4)…С(7) повернутий відносно бензотіазольного фрагменту C(8)-S(1)-C(9)…N(14)-N(5) (торсійний кут C(6)-C(7)-C(8)S(1) складає 46.2(2)°). Така конформація молекули стабілізована внутрішньомолекулярним водневим зв'язком O(1)-H(1C)…N(5) (відстань H…N дорівнює 1.98 Å, кут O-H…N складає 177°) та взаємодіями S(1)…N(4) (3.06 Å) і S(1)…H(4B) (2.66 Å) (суми вандерваальсових радіусів 3.32 Å та 3.00 Å, відповідно [Зефиров Ю.В., Зоркий П.М. Усп. хим. 1989, 58, 713]). Кристали моноклінні, C14H15N5OS, при 293 К а=16.6709(9) Å, b=9.1898(3) Å, с=22.1852(11) Å, 3 3 β=119.32(1)°, V=2963.4(2)Å , Мr=301.37, Z=8, просторова група С2/с, dвир=1.351 г/см , -1 μ(МоКα)=0,225 мм , F(000)=1264. Параметри елементарної ґратки та інтенсивності 18073 рефлексів (4309 незалежних, Rint=0.047) виміряні на дифрактометрі "Xcalibur-3" (МоКα випромінювання, CCD-детектор, графітовий монохроматор, ω-сканування, 2θмакс=60°). Структура розшифрована прямим методом за комплексом програм SHELXTL [Sheldrick, G. Acta Crystallographica, Section A 2008, 64, 112.]. Положення атомів гідрогену виявлені з різницевого синтезу електронної густини і уточнені ізотропно. Уточнення повноматричним МНК в анізотропному наближенні для неводневих атомів проведено до wR 2=0,108 за 4288 рефлексами (R1=0,061 за 3255 рефлексами с F>4σ(F), S=1,02). 20 8 UA 104630 C2 Приклад 10 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-(метиламіно)піримідин-4-іл]-1-пропанол HO S N N H2N N N H CH3 Методика А. Білі мікрокристали, вихід 95 %. Тпл. 231 °C 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.75 (м, 2Н, 2-СН2), 2.41 (м, 2 Н, 3СН2), 3.38 (м, 5Н, NHMe і 1-СН2), 4.31 (с, 1 Н, ОН), 7.01 (с, 1Н, NH), 7.11 (с, 2Н, NH2), 7.38 (т, J=7.8 Гц, 1 Н, НHet), 7.47 (т, J=7.8 Гц, 1 Н, НHеt, ), 7.97 (д, J=7.8 Гц, 2Н, ННet). 13 С ЯМР (DMSO d-6, 100 МГц), δ, м. ч.: 30.57, 32.21, 32.91, 61.35, 103.93, 122.42, 123.03, 125.58, 126.70, 135.73, 153.23, 155.71, 157.16, 162.62, 164.95. -1 ІЧ (КВr): 3338, 3120, 2980, 1672, 1602, 1560 см . Аналіт. (%). Обчислено для C15H17N5OS: С - 57.12; Н - 5.43; N-22.21; S-10.17. Знайдено: С - 56.14; Н - 5.41; N-22.44; S-10.08. Приклад 11 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-фенілпіримідин-4-іл]-1-пропанол HO S N H2N N Методика А. Білі мікрокристали, вихід 97 %. Тпл. 165 °C. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.97 (2Н, м, 2-СН2), 2.89 (2Н, т,J=7.6 Гц, 3-СН2), 3.51 (2Н, кв, J=5.5 Гц, 1-СН2), 4.32 (1Н, т, J=5.5 Гц, ОН), 7.40 N (2Н, с, NH2), 7.46 (4Н, м, 3,5-HHet і НHеt), 7.54 (1Н, т, J=7.8 Гц, HHet), 8.06 (1H, д, Ph J=7.8 Гц, ННet), 8.07 (1Н, д, J=7.8 Гц, ННеt), 8.40 (2Н, м, 2,6-Нрh). 13 С ЯМР (DMSO d-6, 100 МГц), δ, м. ч.: 31.99, 32.96, 61.28, 107.27, 122.13, 123.38, 125.81, 126.66, 128.51, 128.67, 130.79, 135.74, 138.18, 152.97, 162.12, 162.74, 163.53, 167.77. -1 ІЧ (КВr): 3396, 3260. 2930, 1528, 1429, 946 см . Аналіт. (%). Обчислено для C20H18N4OS: С - 66.28; Н - 5.01; N-15.46; S-8.85. Знайдено: С - 66.25; Н - 5.31; N-15.21; S-8.58. Приклад 12 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-(4-ізопропілфеніл)піримідин-4-іл]-1-пропанол Методика А. Білі мікрокристали, вихід 89 %. Тпл. 167 °C. HO 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.29 (6Н, д, J=7.0 Гц, i-Pr), 1.95 (2Н, м, 2-СН2), 2.89 (2Н, т, J=7.6 Гц, 3-СН2), 2.97 (1Н, м, і-Pr), S 3.49 (2Н, кв, J=6.1 Гц, 1-СН2), 4.33 (1Н, т, J=6.1 Гц, ОН), 7.29 (2Н, д, N N J=7.3 Гц, 3,5-HPh), 7.38 (2Н, с, NH2), 7.45 (1Н, т, J=7.6 Гц, НHеt), 7.53 (1H, т, J=7.6 Гц, HHet), 8.07 (2H, д, J=7.6 Гц, HHet), 8.30 (2H, д, J=7.3 HN N Гц, 2,6-HPh). CH 13 C ЯМР (DMSO d-6, 100 МГц), δ, м.ч.: 24.38, 31.95, 33.02, 34.22, 61.29, 107.04, 122.09, 123.32,125.76, 126.49, 126.63, 128.79, 135.68, CH 135.96, 151.35, 152.93, 162.06, 162.83, 163.70, 167.66. -1 ІЧ (КВr): 3411, 3348, 2948, 1605,1534, 1402 см . Аналіт. (%). Обчислено для C23H24N4OS: С - 68.29; Н - 5.98; N-13.85; S-7.93. Знайдено: С - 68.08; Н - 6.18; N-14.15; S-7.51. 2 3 3 5 9 UA 104630 C2 Приклад 13 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-(2-тієніл)піримідин-4-іл]-1-пропанол HO S N N H2N N S Методика А. Білі мікрокристали, вихід 80 %. Тпл. 164 °C. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.95 (2Н, м, 2-СН2), 2.86 (2Н, т, J=7.6 Гц, 3-СН2), 3.49 (2Н, кв, J=6.0 Гц, 1-СН2), 4.31 (1H, т, J=6.0 Гц, ОН), 7.29 (1H, дд, J=3.7, 4.9 Гц, 4-Hthienyl), 7.46 (3Н, м, NH2 і НHеt), 7.52 (1H, т, J=7.6 Гц, НHet), 7.56 (1H, дд, J=4.9, 0.9 Гц, 3-Hthienyl), 7.90 (1Н, дд, J=3.7, 0.9 Гц, 5-Hthienyl), 8.06 (1Н, д, J=7.6 Гц, НHеt), 8.07(1H, д, J=7.6 Гц, ННеt). 13 C ЯМР (DMSO d-6, 100 МГц), δ, м. ч.: 31.88, 32.84, 61.24, 106.87, 122.08, 123.33, 125.78, 126.64, 128.30, 129.14, 130.28, 135.66, 144.34, 152.90, 159.79, 161.90, 163.45, 167.75. -1 ІЧ (КВr): 3393, 3258, 1610, 1527, 1428, 946 см . Аналіт. (%). Обчислено для C18H16N4OS2: С - 58.67; Н - 4.38; N-15.20; S-17.40. Знайдено: С - 58.32; Н - 4.43; N-15.16; S-17.20. Приклад 14 3-[2,6-діаміно-5-(1-метил-1H-бензімідазол-2-іл)піримідин-4-іл]-1-пропанол OH Методика А. Білі мікрокристали, вихід 91 %. Тпл. 252 °C. 1 1 2 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.68 (1Н, м, 2 -СН2), 1.74 (1H, м, 2 CH 1 2 N СН2), 2.22 (1H, м, 3 -СН2), 2.25 (1H, м, 3 -СН2), 3.30 (2Н, т, J=6 Гц, 1-СН2), 3.65 (3Н, с, NMe), 4.80 (1H, уш. с, ОН), 6.04 (2Н, с, 2-NH3), 6.10 (2Н, уш. с, 6N N NH2), 7.19 (1Н, т, J=7.8 Гц, HHet), 7.23 (1Н, т, J=7.8 Гц, НHеt), 7.48 (1H, д, J=7.8 HN N NH Гц, HHet), 7.62 (1Н, д, J=7.8 Гц, ННet). 13 С ЯМР (100 МГц, DMSO-d6): δ =30.76, 31.69, 31.79, 60.60, 110.77, 119.30, 121.93, 122.36, 136.44, 143.37, 150.75, 163.26, 163.57, 169.58. -1 ІЧ (КВr): 3411, 3333, 3215, 1641, 1580, 1555 см . Аналіт. (%). Обчислено для C15H18N6O: С - 60.39; Н - 6.08; N-28.17. Знайдено: С - 60.61; Н - 6.13; N-28.20. 3 2 5 10 15 20 3 Будову 3-[2,6-діаміно-5-(1-метил-1H-бензімідазол-2-іл)піримідин-4-іл]-1-пропанолу доведено за даними рентгено-структурних досліджень (Фіг. 2). Замісник при атомі С(2) розупорядкований за двома рівнозаселеними положеннями. Амінопіримідиновий фрагмент С(1)…С(4) сильно розвернений відносно бензімідазольного фрагменту (торсійний кут C(4)-C(1)-C(5)-N(6) складає 73.0(2)°). Подібна конформація молекули викликана утворенням внутрішньомолекулярного водневого зв'язку O(1A)/O(1B)-H(1A)…N(1) (відстані H…N складають 1.93 Å (А) та 1.94 Å (В), кути O-H…N складають 164 (А) та 161° (В), відповідно). Кристали моноклінні, C15H18N6O, при 293 К а = 24.5474(7) Å, b=8.4589(3) Å, с=14.6135(4) Å, 3 3 р=91.792(3)°, V=3032.9(2) Å , Мr=298.35, Z=8, просторова група С2/с, dобчисл=1.307 г/см , -1 μ(МоКα)=0,088 мм , F(000)=1264. Параметри елементарної ґратки та інтенсивності 17191 рефлексів (3666 незалежних, Rint=0,024) виміряні на дифрактометрі "Xcalibur-3" (MoKα о випромінювання, CCD-детектор, графітовий монохроматор, ω-сканування, 2θмакс=60 ). Структура розшифрована прямим методом за комплексом програм SHELXTL [Sheldrick, G. Acta Crystallographica, Section A 2008, 64, 112.]. Положення атомів гідрогену виявлені з різницевого синтезу електронної густини і уточнені в рамках моделі "вершника" з U ізo=1.2Ueкв неводневого атома, зв'язаного з цим гідрогеном. Уточнення повноматричним МНК в анізотропному наближенні для неводневих атомів проведено до wR 2=0.136 за 3635 рефлексами (R1=0.047 за 2839 рефлексами с F>4σ(F), S=1.05). 10 UA 104630 C2 Приклад 15 3-[6-аміно-2-(метиламіно)-5-(1-метил-1H-бензімідазол-2-іл)піримідин-4-іл]-1-пропанол OH Методика А. Білі мікрокристали, вихід 73 %. Tпл. 235 °C 1 1 2 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.63 (1Н, м, 2 -СН2), 1.73 (1Н, м, 2 CH 1 2 N СН2), 2.02 (1Н, м, 3 -СН2), 2.10 (1Н, м, 3 -СН2), 3.32 (2Н, т, J=6 Гц, 1-СН2), 3.40 (3Н, с, NHMe), 3.62 (3Н, с, NMe), 4.77 (1Н, с, ОН), 5.63 (1H, уш. с, N N NH), 7.02 (2Н, с, NH2), 7.19 (1Н, т, J=7.6 Гц, НHеt), 7.24 (1Н, т, J=7.6 Гц, CH HN N N НHеt), 7.48 (1H, д, J=7.6 Гц, НHеt), 7.62 (1H, д, J=7.6 Гц, НHеt). H 13 С ЯМР: δ =29.98, 30.40, 31.04, 31.65, 60.33, 100.39, 110.56, 119.12, 121.83, 122.36, 135.80, 142.95, 150.40, 155.89, 158.02, 161.77. -1 ІЧ (КВr): 3366, 3098, 1681, 1605, 1538, 1037 см . Аналіт. (%). Обчислено для C16H20N6О: С - 61.52; H-6.45; N-26.90. Знайдено: С - 61.78; Н - 6.05; N-26.53. 3 3 2 Приклад 16 3-[6-аміно-5-(1-метил-1Н-бензімідазол-2-іл)-2-фенілпіримідин-4-іл]-1-пропанол OH Методика А. Білі мікрокристали, вихід 62 %. Тпл. 205 °C. 1 Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.84 (2Н, м, 2-СН2), 2.45 (2Н, м, 3CH N СН2), 3.37 (2Н, т, J=6 Гц, 1-СН2), 3.67 (3Н, с, NMe), 4.66 (1Н, с, ОН), 6.60 (2Н, с, NH2), 7.25 (1Н, т, J=7.6 Гц, НHеt), 7.29 (1Н, т, J=7.6 Гц, HHet), 7.45 (3Н, м, N N 3,4,5-HPh), 7.54 (1Н, д, J=7.6 Гц, НHеt), 7.69 (1H, д, J=7.6 Гц, НHеt), 8.42 (2Н, м, HN N Ph 2,6-HPh). -1 ІЧ (КВr): 3405, 3294, 3148, 1627, 1535, 1201 см . Аналіт. (%). Обчислено для C21H21N5O: С - 70.17; Н - 5.89; N-19.48. Знайдено: С - 69.74; Н - 5.72; N-19.17. 3 2 Приклад 17 3-[2,6-діаміно-5-(4-піридиніл)-4-піримідиніл]-1-пропанол OH 1 Методика А. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.65 (2Н, м, 2-СН2), 2.20 (2Н, т, 3-СН2), 3.31 (2Н, т, 1-СН2), 4.28 (1H, уш. с, ОН), 5.55 (2Н, уш. с, 6-NH2), 5.78 (2Н, с, 2-NH2), 7.19 (2Н, д, 3,5-НHеt), 8.56 (2Н, д, 2,6-НHеt). N N H2N N NH2 Приклад 18 3-[2,6-діаміно-5-(2-піридиніл)-4-піримідиніл]-1-пропанол OH 1 N Методика А. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.70 (2Н, м, 2-СН2), 2.34 (2Н, т, 3-СН2), 3.31 (2Н, т, 1-СН2), 4.42 (1H, уш. с, ОН), 5.79 (2Н, с, 2-NH2), 5.95 (2Н, с, 6-NH2), 7.23 (1Н, т, 5-НHеt), 7.30 (1Н, д, 3-НHеt), 7.77 (1Н, т, 4-НHеt), 8.58 (1H, д, 6НHеt). N H2N N NH2 5 Приклад 19 3-[2,6-діаміно-5-(1-бензил-1H-імідазол-2-іл)-4-піримідиніл]-1-пропанол OH N N N H2N N 1 2 Методика А. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.55 (1Н, м, 2 -СН2), 1.71 (1H, 1 м, 2 -СН2), 2.04 (2Н, м, 3-СН2), 3.29 (2Н, т, 1-СН2), 4.05 (1Н, уш. с, ОН), 4.83 (1H, д, CH2-Ph), 4.96 (1H, д, СН2-Рh), 5.93 (2Н, уш. с, 2-NH2), 6.00 (2Н, с, 6-NH2), 7.00 (1H, д, 5-НHеt), 7.05 (2Н, д, 2,6-HPh), 7.11 (1Н, д, 4-НHеt),7.24 (3Н, м, 3,4,5-НРh). NH2 11 UA 104630 C2 Приклад 20 3-{2,6-діаміно-5-[4-(4-бромофеніл)-1,3-тіазол-2-іл]-4-піримідиніл}-1-пропанол OH 1 Методика А. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.83 (2Н, м, 2СН2), 2.71 (2Н, т, 3-СН2), 3.46 (2Н, т, 1-СН2), 4.34 (1Н, уш. с, ОН), 6.12 (2Н, с, 2-NH2), 7.00 (2Н, уш. с, 6-NH2), 7.57 (2Н, д, НАr), 7.90 (2Н, д, НАr), 8.02 (1Н, с, НHеt). S Br N N H2N N NH2 Приклад 21 3-{2,6-діаміно-5-[4-(4-нітрофеніл)-1,3-тіазол-2-іл]-4-піримідиніл}-1-пропанол OH 1 S N O N N H2N O N NH2 Методика А. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.83 (2Н, м, 2-СН2), 2.69 (2Н, т, 3-СН2), 3.45 (2Н, т, 1-СН2), 4.33 (1Н, уш. с, ОН), 6.15 (2Н, уш. с, 2-NH2), 6.96 (2Н, уш. с, 6-NH2), 7.71 (1H, д, 6-НАг), 8.16 (1Н, т, 5НАr), 8.33 (1H, с, НHеt), 8.40 (1H, д, 4-НАr), 8.76 (1H, с, 2-НАr). Приклад 22 3-[2,6-діаміно-5-(4-(етокси-2-хіназолініл)-4-піримідиніл]-1-пропанол OH O 1 Методика А. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.51 (3Н, т, ОСН2СН3), 1.86 (2Н, м, 2-СН2), 2.88 (2Н, т, 3-СН2), 3.42 (2Н, т, 1-СН2), 4.37 (1H, т, ОН), 4.62 (2Н, к, ОСН2СН3), 6.04 (2Н, с, 2-NH2), 6.84 (2Н, с, 6-NH2), 7.52 (1Н, т, 6НHеt), 7.82 (2Н, м, 7,8-НHеt), 8.11 (1Н, д, 5-НHеt). N N N H2N N NH2 Приклад 23 3-[2,4-діаміно-6-(3-гідроксипропіл)-5-піримідиніл]-4(3Н)-хіназолінон OH O 1 Методика В. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.78 (2Н, м, 2-СН2), 2.46 (2Н, т, 3-СН2), 3.38 (2Н, т, 1-СН2), 4.71 (1Н, уш.с, ОН), 6.03 (2Н, с, 2-NH2), 6.36 (2Н, с, 6-NH2), 7.43 (1H, т, 6-НHеt), 7.59 (1Н, д, 8-НHеt), 7.73 (1H, т, 7НHеt), 8.11 (1Н, д, 5-НHеt), 12.10 (1Н, уш. с, NHHet). NH N N H2N N NH2 Приклад 24 4-аміно-5-(1,3-бензтіазол-2-іл)-6-(3-гідроксипропіл)піримідин-2-тіолат натрію HO 1 Методика А. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.77 (2Н, м, 2-СН2), 2.74 (2Н, т, 3-СН2), 3.39 (2Н, м, 1-СН2), 4.26 (1Н, . с, ОН), 7.43 (1Н, т, 6-НHеt), 7.50 (1Н, т, 5-НHеt), 7.58 (2Н, с, NH2), 8.04 (2Н, м, 7,4-НHеt). S N N H2N N SNa 5 Приклад 25 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)піримідин-4-іл]пропілацетат O H3C 1 O S N N N NH2 Методика В. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.88 (3Н, с, ОСОСН3), 2.01 (2Н, м, 2-СН2), 2.78 (2Н, т, 3-СН2), 4.03 (2Н, т, 1-СН2), 6.10 (2Н, уш. с, NH2), 7.38 (1H, т, 6-НHеt), 7.50 (1Н, т, 5-НHеt), 7.70 (2Н, с, NH2), 7.98 (2Н, м, 7,4-НHеt). H2N 12 UA 104630 C2 Приклад 26 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)-4-піримідиніл]пропілхлорацетат O Cl 1 O S N N N NH2 Методика В. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 2.09 (2Н, м, 2-СН2), 2.79 (2Н, т, 3-СН2), 4.07 (2Н, с, ОСОСН2СІ), 4.16 (2Н, т, 1-СН2), 7.26 (2Н, уш. с, NH2), 7.45 (1Н, т, 6-НHеt), 7.53 (1Н, т, 5-НHеt), 7.84 (2Н, с, NH2), 8.03 (2Н, м, 7,4-НHеt). H2N Приклад 27 3-[2-(ацетиламіно)-6-аміно-5-(1,3-бензтіазол-2-іл)піримідин-4-іл]пропіл ацетат O H3C 1 O O CH3 N S N N H N Методика В. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.87 (3Н, с, ОСОСН3) 2.03 (2Н, м, 2-СН2), 2.31 (3Н, с, NНСОСН3), 2.80 (2Н, т, 3СН2), 4.03 (2Н, т, 1-СН2), 7.36 (2Н, уш. с, NH2), 7.46 (1Н, т, 6-HHet), 7.52 (1Н, т, 5-НHеt), 8.05 (2Н, м, 7,4-НHеt), 9.77 (1H, с, NHCOCH3). H2N Приклад 28 3-[2-(ацетиламіно)-6-аміно-5-(1-метил-1H-бензімідазол-2-іл)піримідин-4-іл]пропілацетат H3C O O 1 Методика В. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.68 (3Н, с, ОСОСН3), 2.01 (3Н, с, NHСОСH3), 2.28 (2Н, , 3-СН2), 2.85 (2Н, м, 2-СН2), 3.58 (3Н, с, СН3), 3.84 (2Н, м, 1-СН2), 7.20 (1Н, т, 6-НHеt), 7.23 (1H, т, 5НHеt), 7.45 (1H, д, 7-НHеt), 7.99 (1Н, д, 4-НHеt), 9.60 (1H, c, NHCOCH3). N N N O H3C H2N N N H CH3 Приклад 29 HO S N N H2N N CH3 S 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-(етилтіо)піримідин-4-іл]пропан-1-ол 1 Методика В. H ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 1.37 (3Н, т, СН2СН3), 1.87 (2Н, м, 2-СН2), 2.79 (2Н, т, 3-СН2), 3.07 (2Н, к, СH2СН3), 3.44 (2Н, к, 1-СН2), 4.25 (1H, т, ОН), 7.41 (2Н, с, NH2), 7.43 (1H, т, 6-НHеt), 7.52 (1Н, т, 5-НHеt), 8.03 (2Н, м, 7,4-НHеt). 5 Приклад 30 4-{3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)-4-піримідиніл]пропокси}-4-оксобутанова кислота O O 1 O HO S N N N NH2 Методика В. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 2.03 (2Н, м, 2СН2), 2.42 (4Н, с, ОСО-СН2CH2-СО2Н), 2.81 (2Н, т, 3-СН2), 4.09 (2Н, т, 1-СН2), 6.32 (2Н, с, NH2), 7.24 (2Н, уш. с, NH2), 7.38 (1Н, т, 6-НHеt), 7.48 (1Н, т, 5-НHеt), 7.97 (2Н, м, 7,4-НHеt). H2N 13 UA 104630 C2 Приклад 31 3-[2,6-діаміно-5-(1,3-бензтіазол-2-iл)піримідин-4-іл]пропіл(3-хлорофеніл)карбамат 1 Методика В. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 2.10 (2Н, м, 2СН2), 2.87 (2Н, т, 3-СН2), 4.17 (2Н, т, 1-СН2), 6.26 (2Н, уш. с, 2-NH2), 6.91 (1Н, д, 6-НАr1), 7.19 (1Н, т, 5-НАr1), 7.26 (2Н, уш. с, 6-NH2), 7.33 (2Н, м, 6-НHеt і 4-HАr1), 7.44 (1H, т, 5-НHеt), 7.56 (1Н, с, 2-НАr1), 7.87 (1H, д, 7-НHеt), 7.93 (1Н, д, 4-НHеt), 9.68 (1Н, с, NHAr1). Приклад 32 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-({[(3-хлорофеніл)аміно]карбоніл}аміно)піримідин-4-іл]пропіл(3хлорофеніл)карбамат 1 Методика В. Н ЯМР (DMSO d-6, 400 МГц), δ, м. ч.: 2.13 (2Н, м, 2-СН2), 2.87 (2Н, т, 3-СН2), 4.17 (2Н, т, 1-СН2), 6.91 (1Н, д, 6-НАr1), 6.97 (1Н, д, 6-НAr2), 7.18 (1Н, т, 5-НАr1), 7.25 (1Н, т, 5НАr2), 7.33 (1Н, д, 4- НАr1), 7.42 (Н, т, 6-HHet), 7.50 (1Н, т, 5НHеt), 7.54 (1H, с, 2-НАr1), 7.56 (1Н, д, 4-НАr2), 7.75 (2Н, уш. с, NH2), 7.93 (1Н, с, 2-HAr2), 7.96 (1H, д, 7-НHеt), 8.04 (1H, д, 4HHet), 9.51 (1H, c, NHHet), 9.65 (1H, c, NHAr1), 11.75(1H, c, NHAr2). 5 10 15 20 2. Дослідження біологічної активності похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) або загальної формули (II). В роботі використовували людську рекомбінантну дигідрофолатредуктазу, експресовану в Е. соlі з активністю 4,16 од. на 1 мг білка, дигідрофолієву кислоту, β-NADPH та інші реактиви фірми "Sigma". Реакційна суміш вміщувала 50 мМ Трис-НСl-буфер (рН 7,2), 25 мкМ дигідрофолієвої кислоти, 50 мкМ β-NADPH. Інгібітор розчиняли в диметилсульфоксиді, концентрація якого дорівнювала 0,03 об. % (загальний об'єм складав 2 мл). Суміш попередньо термостатували 5 хв. при 30 °C, а реакцію розпочинали додаванням ферменту, кінцева концентрація якого складала 8 нМ. Активність ферменту контролювали за швидкістю витрачання NADPH, вимірюючи оптичну густину розчину при 340 нм. Результати в табл. 1 подані як процент інгібування активності ферменту в присутності 6 мкМ інгібiтора в реакційній суміші, яка була розрахована за формулою: % інгібування = (1-ΔА'/ΔА)∙100, де ΔА' і ΔА - зміна оптичної густини розчину за хвилину за наявності інгібітора і в його відсутності, відповідно. З результатів двох дослідів обраховували середнє значення % інгібування. Величина ІС50 відповідала концентрації інгібітора, яка спричиняла зниження активності ферменту на 50 %. Фігура 3 демонструє залежність інгібуючої дії сполук 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)піримідин-4-іл]-1-пропанол (А) і 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)-4-піримідиніл]пропіл хлорацетат (Б) від їх концентрації в реакційній суміші. Розраховані для окремих сполук значення ІС 50 знижуються в ряду від № 6 до № 9 (Таблиця 1). 14 UA 104630 C2 Таблиця 1 Інгібування людської дигідрофолатредуктази 6-аміно-2,4-заміщеними 5-гетарилпіримідинами загальної формули (І) або загальної формули (II) № п/п 1 2 3 4 5 6 7 8 9 Сполука Інгібування*, % ІС50, мкМ 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-({[(3хлорофеніл)аміно]карбоніл}аміно)піримідин-4-іл]пропіл(3хлорофеніл)карбамат 3-[6-аміно-5-(1,3-бензтіазол-2-іл)-2-меркаптопіримідин-4-іл]-1пропанол 3-[2,6-діаміно-5-(2-піридиніл)-4-піримідиніл]-1-пропанол 3-[2-(ацетиламіно)-6-аміно-5-(1,3-бензтіазол-2-іл)піримідин-4іл]пропілацетат 3-[2,6-діаміно-5-(4-піридиніл)-4-піримідиніл]-1-пропанол 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)піримідин-4іл]пропілацетат 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)піримідин-4-іл]пропіл(3хлорофеніл)карбамат 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)піримідин-4-іл]-1пропанол 3-[2,6-діаміно-5-(1,3-бензтіазол-2-іл)-4піримідиніл]пропілхлорацетат 14 15 16 23 31 45 7,1 52 5,3 52 4,1 67 1,3 * Концентрація інгібітора складала 6 мкМ, концентрація субстрату - 25 мкМ ФОРМУЛА ВИНАХОДУ 5 1. Похідні 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) або загальної формули (II) 6 6 3 2 1 (I) 10 або (II) , де S R =NH2, NHAlk, Alk, Ar, SH, SNa, ; 2 1 10 3 R =R , SR , NHR ; 3 5 6 7 R =-CO-R , -CO-NH-R , -алкіл(С1-C6)-R , H, Alk, циклоалкіл(С3-С6), Bn; 5 8 6 R =Alk, циклоалкіл(С3-С6), Ar, -(CH2)n-R , -CHR -NH2; 6 R =H, Alk, Bn, Ar; 7 R =OH, CO2H, CO2Alk; 8 R =CO2H, NH2, Hal; 9 R =H, Alk, OH, OAlk, Hal, NO2, NH2; 9 два R розташовані в сусідніх положеннях можуть бути сполучені, утворюючи 5-7-членні цикли, 1 15 20 15 UA 104630 C2 5 в тому числі ароматичні; 10 R =Alk, Bn; Hal=F, Сl, Вr, І; Alk=алкіл(С1-С6); Bn=-алкіл(С1-С6)-Рh; n=0-3; m=0-2; (R9)m Ar= Het= ; R 10 N (R9) S S (R9)m (R9)m m N 10 R N ; 10 ; R (R9)m 6 N N ; R O (R9)m N (R9)m N (R9)m N ; N (R9)m N ; ; 10 N ; ; O N R 6 (R9)m N . 2. Спосіб отримання похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) або загальної формули (ІІ) 6 6 3 6 1 (III) 15 R4-X (V) EtONa EtOH 2 1 (IV) (I) (II) , де S R =NH2, NHAlk, Alk, Ar, SH, SNa, ; 2 1 10 3 R =R , SR , NHR ; 3 5 6 7 R =-CO-R , -CO-NH-R , -алкіл(С1-C6)-R , H, Alk, циклоалкіл(С3-С6), Bn; 4 5 6 7 R =-CO-R , -CO-NH-R , -алкіл(С1-C6)-R , Alk, циклоалкіл(С3-С6), Bn, Ar; X=Hal, -O-CO-Alk, -O-Alk, -N=C=O; 5 8 6 R =Alk, циклоалкіл(С3-С6), Ar, -(CH2)n-R , -CHR -NH2; 6 R =H, Alk, Bn, Ar; 7 R =OH, CO2H, CO2Alk; 8 R =CO2H, NH2, Hal; 4 4 5 5 в загальній формулі R -X при R =-CO-R , R =Alk, X= -O-CO-Alk, замісники Alk можуть бути сполучені, утворюючи насичені, ненасичені та ароматичні циклічні системи; 1 20 25 16 UA 104630 C2 9 5 R =Н, Alk, OH, OAlk, Hal, NO2, NH2; 9 два R розташовані в сусідніх положеннях можуть бути сполучені, утворюючи 5-7-членні цикли, в тому числі ароматичні; 10 R =Alk, Bn; Hal=F, Сl, Вr, І; Alk=алкіл(С1-С6); Bn=-алкіл(С1-С6)-Рh; n=0-3; m=0-2; (R9)m 10 Ar= Het= ; R 10 N S (R9)m S (R9)m (R9)m N R N ; 10 ; R (R9)m 6 N N ; O (R9)m N (R9)m N (R9)m N ; N (R9)m N ; ; R ; 10 N ; O N R 6 (R9)m N , 15 20 25 при якому здійснюють такі етапи: отримують похідні 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) шляхом взаємодії 2-(2-гетарил)-2-(тетрагідро-2-фураніліден)ацетонітрилів загальної формули (III) з амідинами загальної формули (IV) в присутності основи при нагріванні, та/або отримують похідні 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (II) шляхом взаємодії похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) з відповідним електрофільним реагентом загальної формули (V) в присутності основи при нагріванні. 3. Сполука загальної формули (І) або загальної формули (II) за пунктом 1, яка є інгібітором ферментів. 4. Сполука загальної формули (І) або загальної формули (II) за пунктом 1, яка є інгібітором ензиму дигідрофолатредуктази. 5. Застосування похідних 6-аміно-2,4-заміщених-5-гетарилпіримідинів загальної формули (І) або загальної формули (II) як засобів антибактеріальної, антивірусної або протиракової дії. 17 UA 104630 C2 18 UA 104630 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 19
ДивитисяДодаткова інформація
Автори англійськоюVolovenko Yulian Mykhailovych, Vovk Andrii Ivanovych, Kononets Liudmyla Anatoliivna
Автори російськоюВоловенко Юлиан Михайлович, Вовк Андрей Иванович, Кононец Людмила Анатолиевна
МПК / Мітки
МПК: C07D 239/47, C07D 239/42, A61K 31/506, C07D 239/48
Мітки: похідні, протиракової, антибактеріальної, засобів, дії, отримання, застосування, спосіб, антивірусної, 6-аміно-2,4-заміщених-5-гетарилпіримідинів
Код посилання
<a href="https://ua.patents.su/21-104630-pokhidni-6-amino-24-zamishhenikh-5-getarilpirimidiniv-sposib-otrimannya-ta-zastosuvannya-kh-yak-zasobiv-antibakterialno-antivirusno-ta-protirakovo-di.html" target="_blank" rel="follow" title="База патентів України">Похідні 6-аміно-2,4-заміщених-5-гетарилпіримідинів, спосіб отримання та застосування їх як засобів антибактеріальної, антивірусної та протиракової дії</a>
Попередній патент: Кондитерський виріб
Наступний патент: Пристрій для розподілу шихтового матеріалу у шахтній печі
Випадковий патент: Спосіб вилучення газу із підземних гірничих виробок