Проліки аналогів фосфонатнуклеотиду, спосіб їх селекції та одержання
Номер патенту: 75889
Опубліковано: 15.06.2006
Автори: Кернан Майкл Р., Бекер Марк У., Хе Гонг-Ксін, Прісбі Ернест Дж., Спарасіно Марк Л., Ейзенберг Юджін Дж., Чапмен Харлан Х., Лі Уільям А., Ціхлар Томас, Рохлофф Джон К.
Формула / Реферат
1. Спосіб скринінгу з метою ідентифікації проліків на основі метоксифосфонатнуклеотидного аналога, що виявляють підвищену активність у цільовій тканині, який включає:
(a) забазпечення щонайменше одного з вказаних проліків,
(b) вибір принаймні однієї терапевтично цільової тканини та принаймні однієї нецільової тканини,
(c) введення проліків до цільової тканини та до вказаної принаймні однієї нецільової тканини; та
(d) визначення відносної активності, що виявляється проліками у тканинах на стадії (с).
2. Спосіб за п. 1, який відрізняється тим, що активність являє собою противірусну активність чи протипухлинну активність.
3. Спосіб за п. 2, який відрізняється тим, що активність являє собою противірусну активність.
4. Спосіб за п. 3, який відрізняється тим, що активність являє собою проти-ВІЛ чи проти-HBV (вірус гепатиту В) активність.
5. Спосіб за п. 1, який відрізняється тим, що проліки являють собою проліки РМРА або РМЕА.
6. Спосіб за п. 5, який відрізняється тим, що проліки являють собою фосфоноамідат, фосфоноестер або змішаний фосфоноамідат/ фосфоностер.
7. Спосіб за п. 6, який відрізняється тим, що амідат являє собою амідат амінокислоти.
8. Спосіб за п. 6, який відрізняється тим, що естер являє собою ариловий естер.
9. Спосіб за п. 1, який відрізняється тим, що додатково проводять вибір проліків, відносна активність яких у цільовій тканині більше ніж у 10 разів перевищує активність у нецільовій тканині.
10. Спосіб за п. 1, який відрізняється тим, що цільова та нецільова тканини знаходяться у тварині, проліки вводять тварині, а відносну активність визначають шляхом аналізу тканин тварини після введення проліків.
11. Спосіб за п. 1, який відрізняється тим, що активність у цільовій та нецільовій тканинах визначають шляхом визначення кількості принаймні одного метаболіту проліків у тканинах.
12. Спосіб за п. 11, який відрізняється тим, що метаболіт являє собою вихідний лікарський засіб.
13. Спосіб за п. 12, який відрізняється тим, що метаболіт являє собою дифосфат вихідного лікарського засобу.
14. Спосіб за п. 1, який відрізняється тим, щоцільова тканина являє собою вірусно інфіковану тканину, а нецільова тканина являє собою таку саму тканину, яка не інфікована вірусом.
15. Спосіб за п. 1, який відрізняється тим, що цільова тканина є лімфоїдною тканиною, і активність являє собою проти-ВІЛ активність.
16. Спосіб за п. 1, який відрізняється тим, що цільова тканина є печінковою, і активність являє собою проти-HBV (вірус гепатиту В) активність.
17. Спосіб за п. 1, який відрізняється тим, що цільова тканина є гематологічною, і активність являє собою протипухлинну активність.
18. Спосіб за п.1, який відрізняється тим, що цільова тканина є злоякісною, і нецільова тканина являє собою таку саму тканину, але не злоякісну.
19. Сполука структурної формули (1)
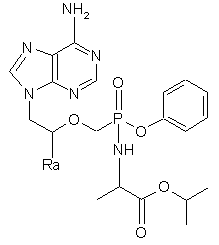
, (1)
у якій Ra означає Н чи метил,
та її хірально збагачені композиції, солі, їхня вільна основа та її сольвати.
20. Сполука структурної формули (2)
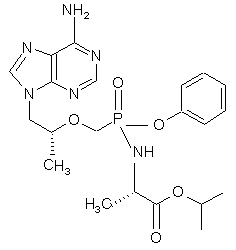
(2)
та її збагачені діастереомери, солі, вільна основа та сольвати.
21. Діастереомерно збагачена сполука структурної формули (3)
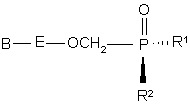
, (3)
яка по суті не містить діастереомеру (4)
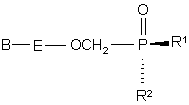
, (4)
де
R1 являє собою оксіестер, що гідролізується in vivo, або гідроксил,
В являє собою гетероциклічну основу,
R2 являє собою гідроксил чи залишок амінокислоти, зв'язаної з атомом Р через аміногрупу амінокислоти, причому кожен карбоксильний замісник амінокислоти є необов'язково етерифікованим, але R1 та R2 не можуть бути обидва гідроксилами, Е означає -(СН2)2-, -СН(СН3)СН2-, -CH(CH2F)CH2-, -СН(СН2ОН)СН2-, -СН(СН=СН2)СН2-, -СН(С![]() СН)СН2-, -СН(СН2N3)СН2-,
СН)СН2-, -СН(СН2N3)СН2-,
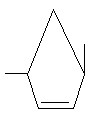
,
,
,
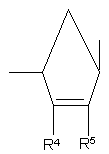
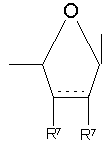
-CH(R6)OCH(R6')-, -CH(R9)CH2O- або -CH(R8)O-, у якому правий зв'язок приєднаний з гетероциклічною основою,
пунктирна лінія означає необов'язково подвійний зв'язок,
R4 та R5 незалежно означають гідроген, гідроксильну групу, галоїд, аміногрупу чи замісник, що має 1-5 атомів карбону, вибраний з ацилоксигрупи, алкілоксигрупи, алкілтіогрупи, алкіламіногрупи та діалкіламіногрупи,
R6 та R6' незалежно являють собою Н, С1-С6-алкіл, С1-С6-гідроксіалкіл чи С2-С7-алканоїл,
R7 являє собою незалежно Н, С1-С6-алкіл або разом утворюють -О- чи -CH2-,
R8 являє собою Н, С1-С6 алкіл, С1-С6 гідроксіалкіл чи С1-С6 галоїдалкіл, і
R9 являє собою Н, гідроксиметил чи ацилоксиметил;
та її солі, вільна основа і сольвати.
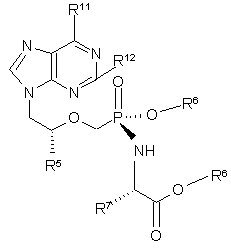
22. Діастереомерно збагачена сполука структурої формули (5а)
, (5а)
яка по суті не містить діастереомеру (5b)
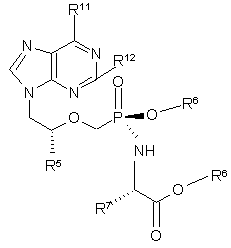
, (5b)
де
R5 являє собою метил чи гідроген,
R6 незалежно являє собою Н, алкіл, алкеніл, алкініл, арил чи арилалкіл, або R6 незалежно означає алкіл, алкеніл, алкініл, арил чи арилалкіл, заміщений 1-3 замісниками, вибраними з алкіламіногрупи, алкіламіноалкілу, діалкіламіноалкілу, діалкіламіногрупи, гідроксилу, оксогрупи, галоїду, аміногрупи, алкілтіогрупи, алкоксигрупи, алкоксіалкілу, арилоксигрупи, арилоксіалкілу, арилалкоксигрупи, арилалкоксіалкілу, галоїдалкілу, нітрогрупи, нітроалкілу, азидогрупи, азидоалкілу, алкілацилу, алкілацилалкілу, карбоксилу чи алкілациламіногрупи,
R7 являє собою бічний ланцюг будь-якої природної чи фармацевтично прийнятної амінокислоти, причому, якщо бічний ланцюг включає карбоксил, карбоксильна група є необов'язково етерифікованою алкільною чи арильною групою,
R11 являє собою аміногрупу, алкіламіногрупу, оксогрупу чи діалкіламіногрупу, і
R12 являє собою аміногрупу чи Н,
та її солі, таутомери, вільна основа та сольвати.
23. Сполука структурної формули (6)
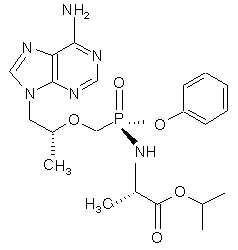
(6)
та її солі і сольвати.
24. Діастереомерно збагачена сполука, структурної формули (6а)
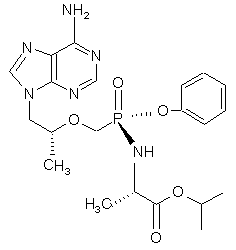
, (6а)
яка по суті не містить діастереомеру (6b)
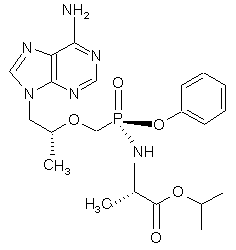
. (6b)
та її солі і сольвати.
25. Сполука структурної формули (7)
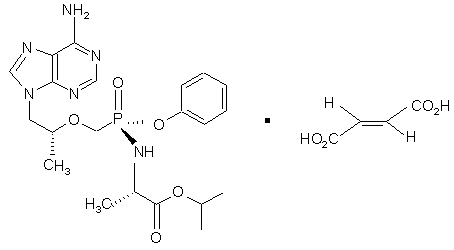
. (7)
26. Діастереомерно збагачена сполука, структурної формули (7а)
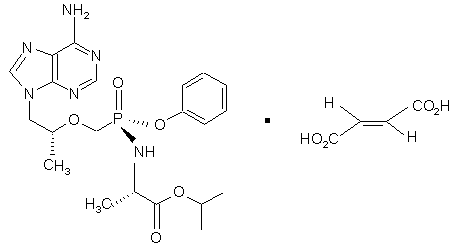
, (7a)
яка по суті не містить діастереомеру (7b)
, (7b)
та її солі і сольвати.
27. Композиція, яка містить сполуку за будь-яким з пп. 19-26 і фармацевтично ефективний наповнювач.
28. Композиція за п. 27, яка відрізняється тим, що наповнювач являє собою гель.
29. Композиція за п. 27, яка відрізняється тим, що є придатною для місцевого застосування.
30. Спосіб противірусної терапії або профілактики, в якому вводять сполуку, визначену в будь-якому з пп. 19-26, у терапевтично або профілактично ефективній кількості суб'єкту, що потребує такої терапії або профілактики.
31. Спосіб застосування алкоксиду магнію, в якому проводять реакцію 9-(2-гідроксипропіл)аденіну (НРА) чи 9-(2-гідроксіетил)аденіну (НЕА), алкоксиду магнію та захищеного п-толуолсульфонілоксиметилфосфонату.
32. Спосіб за п. 31, який відрізняється тим, що додатково виділяють РМРА чи РМЕА, відповідно.
33. Спосіб за п. 31, який відрізняється тим, що фосфонат п-толуолсульфонілоксиметилфосфонату є захищеним етиловим естером.
34. Спосіб за п. 31 який відрізняється тим, що алкоксид являє собою С1-С6-алкоксид.
35. Спосіб за п. 34, який відрізняється тим, що алкоксид являє собою трет-бутил- або ізопропілоксид.
Текст
1. Спосіб скринінгу з метою ідентифікації проліків на основі метоксифосфонатнуклеотидного аналога, що виявляють підвищену активність у цільовій тканині, який включає: (a) забазпечення щонайменше одного з вказаних проліків, (b) вибір принаймні однієї терапевтично цільової тканини та принаймні однієї нецільової тканини, (c) введення проліків до цільової тканини та до вказаної принаймні однієї нецільової тканини; та (d) визначення відносної активності, що виявляється проліками у тканинах на стадії (с). 2. Спосіб за п. 1, який відрізняється тим, що активність являє собою противірусну активність чи протипухлинну активність. 3. Спосіб за п. 2, який відрізняється тим, що активність являє собою противірусну активність. 4. Спосіб за п. 3, який відрізняється тим, що активність являє собою проти-ВІЛ чи проти-HBV (вірус гепатиту В) активність. 5. Спосіб за п. 1, який відрізняється тим, що проліки являють собою проліки РМРА або РМЕА. 6. Спосіб за п. 5, який відрізняється тим, що проліки являють собою фосфоноамідат, фосфоноестер або змішаний фосфоноамідат/ фосфоностер. 2 (19) 1 3 75889 4 R8 являє собою Н, С1-С6 алкіл, С1-С6 гідроксіалкіл чи С1-С6 галоїдалкіл, і R9 являє собою Н, гідроксиметил чи ацилоксиметил; (1) та її солі, вільна основа і сольвати. 22. Діастереомерно збагачена сполука структурої формули (5а) N H2 N N N O N P O O NH Ra O O R11 у якій Ra означає Н чи метил, та її хірально збагачені композиції, солі, їхня вільна основа та її сольвати. 20. Сполука структурної формули (2) N N R7 O O P O (2) O яка по суті не містить діастереомеру (5b) R11 NH CH3 N O H3C N N O O E OCH2 R1 P (3) R2 яка по суті не містить діастереомеру (4) O B E OCH2 R1 P (4) R2 де R1 являє собою оксіестер, що гідролізується in vivo, або гідроксил, В являє собою гетероциклічну основу, R2 являє собою гідроксил чи залишок амінокислоти, зв'язаної з атомом Р через аміногрупу амінокислоти, причому кожен карбоксильний замісник амінокислоти є необов'язково етерифікованим, але R1 та R2 не можуть бути обидва гідроксилами, Е означає -(СН2)2-, -СН(СН3)СН2-, -CH(CH2F)CH2-, -СН(СН2ОН)СН2-, -СН(СН=СН2)СН2-, -СН(С СН)СН2-, -СН(СН2N3)СН2-, O N R12 O P O та її збагачені діастереомери, солі, вільна основа та сольвати. 21. Діастереомерно збагачена сполука структурної формули (3) B R6 O N (5а) NH R5 N N R6 O P O N H2 N N R12 O N R6 O (5b) NH R5 O R6 R7 O де R5 являє собою метил чи гідроген, R6 незалежно являє собою Н, алкіл, алкеніл, алкініл, арил чи арилалкіл, або R6 незалежно означає алкіл, алкеніл, алкініл, арил чи арилалкіл, заміщений 1-3 замісниками, вибраними з алкіламіногрупи, алкіламіноалкілу, діалкіламіноалкілу, діалкіламіногрупи, гідроксилу, оксогрупи, галоїду, аміногрупи, алкілтіогрупи, алкоксигрупи, алкоксіалкілу, арилоксигрупи, арилоксіалкілу, арилалкоксигрупи, арилалкоксіалкілу, галоїдалкілу, нітрогрупи, нітроалкілу, азидогрупи, азидоалкілу, алкілацилу, алкілацилалкілу, карбоксилу чи алкілациламіногрупи, R7 являє собою бічний ланцюг будь-якої природної чи фармацевтично прийнятної амінокислоти, причому, якщо бічний ланцюг включає карбоксил, карбоксильна група є необов'язково етерифікованою алкільною чи арильною групою, R11 являє собою аміногрупу, алкіламіногрупу, оксогрупу чи діалкіламіногрупу, і R12 являє собою аміногрупу чи Н, та її солі, таутомери, вільна основа та сольвати. 23. Сполука структурної формули (6) N H2 R R , , -CH(R )OCH(R )-, -CH(R )CH2O- або -CH(R8)O-, у якому правий зв'язок приєднаний з гетероциклічною основою, пунктирна лінія означає необов'язково подвійний зв'язок, R4 та R5 незалежно означають гідроген, гідроксильну групу, галоїд, аміногрупу чи замісник, що має 1-5 атомів карбону, вибраний з ацилоксигрупи, алкілоксигрупи, алкілтіогрупи, алкіламіногрупи та діалкіламіногрупи, R6 та R6' незалежно являють собою Н, С1-С6-алкіл, С1-С6-гідроксіалкіл чи С2-С7-алканоїл, R7 являє собою незалежно Н, С1-С6-алкіл або разом утворюють -О- чи -CH2-, 6 , 6' R4 R5 9 7 N N 7 N O N P O (6) O NH CH3 O H3C O та її солі і сольвати. 24. Діастереомерно збагачена сполука, структурної формули (6а) 5 75889 6 N H2 N H2 N N N N O N N O P O (6а) NH CH3 O N H2 N O P O (6b) O NH CH3 O H3C O 25. Сполука структурної формули (7) N H2 N N N O N P O . O H CO2H H HO2C NH CH3 (7) O H3C O 26. Діастереомерно збагачена сполука, структурної формули (7а) N H2 N N N O N P O . O NH CH3 H HO2C CO2H H (7a) O H3C . O NH H HO2C CO2H H (7b) O O яка по суті не містить діастереомеру (6b) N P H3C O N O O CH3 H3C N N N O та її солі і сольвати. 27. Композиція, яка містить сполуку за будь-яким з пп. 19-26 і фармацевтично ефективний наповнювач. 28. Композиція за п. 27, яка відрізняється тим, що наповнювач являє собою гель. 29. Композиція за п. 27, яка відрізняється тим, що є придатною для місцевого застосування. 30. Спосіб противірусної терапії або профілактики, вякому вводять сполуку, визначену в будь-якому з пп. 19-26, у терапевтично або профілактично ефективній кількості суб'єкту, що потребує такої терапії або профілактики. 31. Спосіб застосування алкоксиду магнію, в якому проводять реакцію 9-(2-гідроксипропіл)аденіну (НРА) чи 9-(2-гідроксіетил)аденіну (НЕА), алкоксиду магнію та захищеного птолуолсульфонілоксиметилфосфонату. 32. Спосіб за п. 31, який відрізняється тим, що додатково виділяють РМРА чи РМЕА, відповідно. 33. Спосіб за п. 31, який відрізняється тим, що фосфонат п-толуолсульфонілоксиметилфосфонату є захищеним етиловим естером. 34. Спосіб за п. 31 який відрізняється тим, що алкоксид являє собою С1-С6-алкоксид. 35. Спосіб за п. 34, який відрізняється тим, що алкоксид являє собою трет-бутил- або ізопропілоксид. яка по суті не містить діастереомеру (7b) Ця заявка стосується проліків метоксифосфонатнуклеотидних аналогів. Зокрема, він стосується удосконалених способів одержання та ідентифікації таких проліків. Відомо багато метоксифосфонатнуклеотидних аналогів. Загалом, такі сполуки мають структуру AOCH2P(O)(OR)2, де А позначає залишок нуклеозидного аналога, a R незалежно позначає гідроген або захисні групи чи функціональності проліків. Див., наприклад, [патенти США №№ 5663159, 5977061 та 5798340, ОІіуаі etal., Pharmaceutical Research, 16(11): 1687-1693(1999); Stella et al., J. Med. Chem., 23(12): 1275-1282 (1980); Aarons, L, Boddy, A. and Petrak, K. (1989) Novel Drug Delivery and Its Therapeutical Application (Prescott, L.F. and Nimmo, W.S., eds.), pp.121-126; Bundgaard, H. (1985) Design of Prodrugs (Bundgaard, H., ed.), pp.70-74 та 79-82; Banerjee, P.K. and Amidon, G.L. (1985) Design of Prodrugs (Bundgaard, H., ed.), pp.118-121; Notari, R.E. (1985) Design of Prodrugs (Bundgaard, H., ed.), pp.135-156; Stella, V.J. and Himmelstein, K.J. (1985) Design of Prodrugs (Bundgaard, H., ed.), pp.177-198; Jones, G. (1985) Design of Prodrugs (Bundgaard, H., ed.), pp. 199241; Connors, T.A. (1985) Design of Prodrugs (Bundgaard, H., ed.), pp.291-316]. Уся згадана література та патентні посилання незаперечно включені сюди за посиланнями. Сутність винаходу Проліки метоксифосфонатнуклеотидних аналогів, призначені для антивірусної чи протипухлинної терапії, з того часу, коли вони стали відомими, традиційно відбиралися за їхнім системним ефектом. Наприклад, такі проліки відбиралися за їхньою підвищеною біодоступністю, тобто здатністю до всмоктування зі шлунково-кишкового тракту та швидкого перетворення на вихідну лікарську речовину для забезпечення присутності вихідної лікарської речовини в усіх тканинах. Однак, заявники знайшли, що можливо відбирати проліки, які накопичуються у терапевтичних ділянках, як ілюструють описані тут дослідження, у яких аналоги накопичувалися у локалізованих вогнищах ВІЛінфекції. Метою цього винаходу є, крім інших переваг, забезпечення меншої токсичності для навколишніх тканин та більшої активності вихідної лікарської речовини у тканинах, які є мішенями терапії вихідним метоксифосфонатнуклеотидним аналогом. Отже, у відповідності до цих спостережень, 7 75889 8 пропонується спосіб скринінгу для ідентифікації де R1 означає оксіефір, здатний гідролізуватипроліків метоксифосфонатнуклеотидного аналога, ся in vivo, або гідроксил, які забезпечують підвищену активність у цільовій В означає гетероциклічну основу, тканині, що включає: R2 означає гідроксил або амінокислотний за(a) одержання щонайменше одного з таких лишок, зв'язаний з атомом Ρ через проліків, аміногрупу амінокислоти, причому кожен кар(b) вибір щонайменше однієї терапевтично цібоксильний замісник амінокислоти є льової тканини та щонайменше однієї нецільової необов'язково етерифікованим, але R1 та R2 тканини, не можуть бути обидва гідроксилами, (c) введення проліків до вказаної цільової ткаΕ означає -(СН2)2-, -СН(СН3)СН2-, нини та вказаної щонайменше однієї нецільової CH(CH2F)CH2-, -CH(CH2OH)CH2-, тканини, і СН(СН=СН2)СН2-, -СН(С=СН)СН2-, (d) визначення відносної антивірусної активноCH(CH2N3)CH2-, сті, яку виявляють проліки у тканинах за стадією (с). В кращих варіантах втілення цільовою тканиною є ділянки, у яких відбувається активна реплікація ВІЛ та/або такі, що є джерелом ВІЛ, а нецільовою тканиною є неуражена тварина. -CH(R6)OCH(R6')-, -CH(R9)CH2O- або -CH(R8)O-, Несподівано автори знайшли, що вибір лімфоїдної Де тканини як цільової тканини у практиці цього спозв'язок, зображений праворуч, зв'язаний з гесобу для ВІЛ приводить до ідентифікації проліків, тероциклічною основою, які посилюють доставку активного лікарського запунктирна лінія означає необов'язково подвійсобу до таких тканин. ний зв'язок, Кращою сполукою за цим винаходом, що була R4 та R5 позначають незалежно гідроген, гідідентифікована у такий спосіб, є така, що має роксильну групу, галоген, аміногрупу чи замісник, структуру (1) що має 1-5 атомів карбону, обраний з ацилоксигрупи, алкілоксигрупи, алкілтіогрупи, алкіламіногрупи та діалкіламіногрупи, R6 та R6' позначають незалежно Н, Сі-С6-алкіл, С-і-Сб-гідроксіалкіл або С2-С7-алканоїл, (1) R7 позначають незалежно Н, СгС6-алкіл або разом утворюють -О- чи -СН2-, R8 означає Н, Сі-С6-алкіл, СгС6-гідроксіалкіл або Сі-Сб-галоїдалкіл, і R9 означає Н, гідроксиметил чи ацилоксимеде Ra означає Η чи метил, тил, та їхні солі, вільну основу та сольвати. та композиції, хірально збагачені нею, її солі, Діастереомери структурної формули (3) позїхня вільна основа та її сольвати. Кращою сполуначені як (З)-ізомери відносно хірального центра кою за цим винаходом є така, що має структуру (2) на атомі фосфору. Кращими варіантами втілення даного винаходу є діастереомерно збагачені сполуки структурної формули (5а) (2) та її збагачені діастереомери, солі, вільна основа та сольвати. Крім того, несподівано було знайдено, що хіральність замісників атомів фосфору та/або амідатний замісник впливають на збагачення, що спостерігається у практиці цього винаходу. Таким чином, в іншому варіанті втілення цього винаходу пропонуються діастереомерно збагачені сполуки за цим винаходом, що мають структуру (3) які по суті не містять діастереомеру (4) які по суті не містять діастереомеру (5Ь) Де R5 означає метил чи гідроген, R6 незалежно позначають Н, алкіл, алкеніл, алкініл, арил чи аралкіл, або R6 незалежно позначають алкіл, алкеніл, алкініл, арил чи аралкіл, за 9 75889 10 міщені 1-3 замісниками, обраними з алкіламіногрувикористання у цьому методі скринінгу є сполукапи, алкіламіноалкілу, діалкіламіноалкілу, діалкілами, що мають структуру А-ОСН2Р(О)(ОН)2) де А міногрупи, гідроксилу, оксогрупи, галогену, аміногозначає залишок нуклеозидного аналога. Ці спорупи, алкілтіогрупи, алкоксигрупи, алкоксиалкілу, луки є відомими як такі і не входять до цього винаарилоксигрупи, арилоксіалкілу, арилалкоксигрупи, ходу. Конкретніше, вихідні сполуки включають геарилалкоксіалкілу, галоїдалкілу, нітрогрупи, нітротероциклічну основу В та аглікон Е, маючи алкілу, азидогрупи, азидоалкілу, алкілацилу, алкізагалом структурну формулу лацилалкілу, карбоксилу чи алкілациламіногрупи, R7 означає бічний ланцюг будь-якої природної и фармацевтично прийнятної амінокислоти, причому, якщо бічний ланцюг включає карбоксил, то карбоксильна група є необов'язково етерифіковаде група В визначена нижче, а група Ε визнаною алкільною чи арильною групою, чена вище. Приклади описані у [патентах США R11 означає аміногрупу, алкіламіногрупу, оксо№№ 4659825, 4808716, 4724233, 5142051, групу чи діалкіламіногрупу, і 5130427, 5650510, 5663159, 5302585, 5476938, 12 R означає аміногрупу чи Н, та їхні солі, тау5696263, 5744600, 5688778, 5386030, 5733896, томери, вільні основи і сольвати. 5352786 та 5798340, та ЕР 821690 та 654037]. Кращим варіантом втілення даного винаходу є Проліки, придатні для застосування у способі сполука структурної формули (6): 9-[(R)-2-[[(S)скринінгу за даним винаходом, є ковалентно мо[[(S)-1дифікованими аналогами вихідних метоксифос(iзoπpoπoкcикapбoнiл)eтил]aмiнo]фeнoкcифocфiнi фонат-нуклеотидних аналогів, описаних у поперел]-метокси]пропіл]аденін, яка також позначається дньому абзаці. Загалом, атом фосфору вихідного тут як GS-7340 лікарського засобу є кращим місцем для модифікації проліків, але можливі інші місця, що знаходяться у гетероциклічній основі В чи агліконі Е. Багато таких проліків є вже відомими. У першу чергу, вони є складними ефірами чи амідатами атома фосфору, але включають також заміщення на основі та агліконі. Жодна з цих модифікацій як така не входить до цього винаходу і жодна з них не повинна вважатися такою, що обмежує обсяг Іншим кращим варіантом втілення даного вивинаходу. находу є фумаратна сіль сполуки структурної фоАтом фосфору метоксифосфонатнуклеотидрмули (5) (структурна формула (7)) - 9-[(R)-2-[[(S)них аналогів має дві валентності, придатні для [[(S)-1ковалентної модифікації, такої як амідування чи (ізопропоксикарбоетерифікація (за винятком випадку, коли фосфоніл)етил]аміно]феноксифосфініл]метокси]пропіл]а рильний гідроксил є етерифікованим гідроксилденінфумарат (1:1), яка також позначається тут як вмісним замісником аглікону Е, внаслідок чого лиGS-7340-2 ше одна валентність фосфору залишається вільною для заміщення). Складні ефіри типово є арилоксизаміщеними. Амідати є звичайно природними моноамінокислотами, що мають вільну карбоксильну групу (групи), етерифікованими алкільною чи арильною групою, звичайно фенільною, циклоалкільною або t-, n- чи s-алкільними групами. Проліки, придатні для використання у способі скринінгу Сполуки структурних формул (1)-(7) необов'язза даним винаходом, розкриті, наприклад, у патенково вводяться до складу композицій, які містять ті США № 5798340. Однак будь-які проліки, що фармацевтично прийнятні ексципієнти. Такі комвважаються потенційно здатними до перетворення позиції використовуються у ефективних дозах в in vivo у клітинах цільової тканини на вільний вихітерапії чи профілактиці вірусних інфекцій (особлидний лікарський засіб на основі метоксифосфонаво ВІЛ чи гепаднавірусних). тнуклеотидного аналога, наприклад, шляхом гідЗа іншим варіантом втілення, пропонується ролізу, оксидації чи іншого ковалентного зручний спосіб виробництва 9-[2перетворення, спричиненого дією біологічних тка(фосфонометокси)пропіл]аденіну (тут та надалі нин, є придатними для використання у способі за "РМРА") чи 9-[2-(фосфонометоксі)етил]аденіну даним винаходом. Такі проліки можуть бути неві(тут та надалі "РМЕА") з використанням алкоксиду домими зараз, але будуть ідентифіковані у майбумагнію, який включає проведення реакції зв'язутньому і, таким чином, стануть придатними кандивання 9-(2-гідроксипропіл)аденіну чи 9-(2датами, доступними для тестування у способі за гідроксіетил)аденіну, захищеного пданим винаходом. Оскільки проліки є лише кандитолуолсульфонілоксиметилфосфонату та алкокдатами для скринінгу у цих способах, їхні структусиду магнію, і виділення РМРА чи РМЕА, відпори не пов'язані із здійсненням чи забезпеченням відно. можливості здійснення способу скринінга, хоч, Детальний опис винаходу звичайно, їхні структури у кінцевому підсумку виВихідні лікарські засоби на основі метоксифозначають, чи буде виявлено при проведенні аналісфонатнуклеотидних аналогів, призначені для зу селективність цих проліків. 11 75889 12 Προ-фрагменти, зв'язані з лікарським засобом, ступінь та швидкість перетворення проліків на анможуть бути однаковими чи різними. Однак, кожен тивірусно активний вихідний дифосфат будуть лікарський засіб, що використовується у скринінгу, однаковими в усіх тканинах, що тестуються. Інакмає структурно відрізнятися від інших проліків, що ше, можна проводити тест на дифосфат. випробовуються. Відмінні, тобто структурно різні При проведенні скринінгу проліків, придатних проліки, загалом обирають на основі або їхньої для лікування ВІЛ-інфекції, кращою цільовою ткастереохімії, або ковалентної структури, або ці ниною буде лімфоїдна тканина. Лімфоїдна тканиознаки змінюються у комбінаціях. Однак бажано, на відома фахівцям і включає клітини CD4, лімфощоб кожні випробовані проліки були по суті струкцити, лімфатичні вузли, макрофаги та турно та стереохімічно чистими, бо інакше резульмакрофагоподібні клітини, включаючи моноцити, тати скринінгу будуть менш корисними. Звичайно, такі як моноцитні клітини периферичної крові до обсягу даного винаходу входить проведення (РВМС) та гліальні клітини. Лімфоїдна тканина випробувань окремих проліків в індивідуальному також включає нелімфоїдні тканини, що мають варіанті втілення способу за даним винаходом, підвищений вміст лімфоїдної тканини чи клітин, хоч типово у такому випадку ці результати будуть наприклад, легені, шкіру та селезінку. Іншими міпорівнюватись з результатами попередніх дослішенями для інших антивірусних лікарських засобів джень з іншими проліками. будуть, звичайно, основні ділянки реплікації чи Авторами знайдено, що стереохімія проліків латентності для конкретного вірусу, наприклад, здатна впливати на їхнє накопичення у цільових печінка для гепатиту та периферичні нерви для тканинах. Хіральні центри знаходяться на атомі вірусу простого герпесу (HSV). Аналогічно, цільофосфору, а також у його замісниках. Наприклад, вими тканинами будуть по суті самі пухлини. Ці амінокислота, що використовується для одержантканини є добре відомими фахівцям і для їхнього ня амідатів, може знаходитись у D-формі чи Lвибору не потрібне неналежне експериментуванформі, а фосфонатні складні ефіри чи амінокислоня. При скринінгу антивірусних сполук цільова ткатні складні ефіри можуть також містити хіральні нина може бути інфікована вірусом. центри. Хіральні центри також знаходяться у часСкладовою цього способу є скринінг нецільотині нуклеозидного аналога молекул, але вони вих тканин чи клітин. В цьому відношенні може звичайно вже визначені стереохімією вихідного бути використана будь-яка кількість будь-яких талікарського засобу і не змінюються як частина ких тканин чи клітин. Загалом, як нецільові тканини процесу скринінгу. Наприклад, R-ізомер РМРА є звичайно будуть використовуватись тканини, для кращим, оскільки він має вищу активність, ніж відяких очікується, що вихідний лікарський засіб буде повідний S-ізомер.Типово ці діастереомери чи токсичним. Вибір нецільової тканини цілком залеенантіомери хірально збагачуються для кожного жить від природи проліків та активності вихідного центра, якщо вони не є чистими, щоб результати засобу. Наприклад, для проліків проти гепатиту скринінгу були більш значущими. Як відзначалося, мають бути обрані непечінкові тканини, а для відмінність стереоізомерів забезпечується збагаскринінгу протипухлинно-селективних проліків бученням чи очищенням стереоізомера (типово для дуть придатними нетрансформовані клітини такої більшості метоксифосфонатнуклеотидних аналогів самої тканини, як і пухлина. це буде діастереомер, а не енантіомер), щоб він Слід відзначити, що спосіб за цим винаходом не містив інших стереоізомерів для певного хіравідрізняється від досліджень, що звичайно провольного центра, так щоб кожна тестована сполука дяться для визначення біодоступності при перобула по суті гомогенною. Під по суті гомогенним чи ральному введенні проліків. В дослідженнях біохірально збагаченим ми розуміємо, що бажаний доступності при пероральному введенні, метою є стереоізомер складає більш ніж приблизно 60 % визначення проліків, що надходять до системного мас. сполуки, звичайно, більш ніж приблизно 80%, кровообігу по суті перетвореними на вихідний ліі краще, більш ніж приблизно 95%. карський засіб. Метою даного винаходу є визнаНовий спосіб скринінгу чення проліків, що не метаболізуються у шлункоПісля того, як буде відібраний принаймні один во-кишковому тракті чи кровообігу. Таким чином, кандидат проліків, решта стадій способу скринінгу цільові сполуки, які піддають аналізу у способі за за даним винаходом використовуються для іденцим винаходом, звичайно не включають тонку китифікації проліків, що мають потрібну селектившку або, якщо кишечник включений до аналізу, то ність до цільової тканини. Найзручніше, проліки тканини також включають інші тканини, крім тонкої мітять групою, придатною для детектування, накишки. приклад, радіоактивною міткою, для полегшення Цільові та нецільові тканини, що використовунаступного детектування у тканинах чи клітинах. ються у способі скринінгу за даним винаходом, Однак, мітка не є необхідною, оскільки можуть типово є тканинами неураженої живої тварини. бути також застосовані інші придатні методи анаПроліки, що містять складні ефіри, краще випролізу проліків чи їхніх метаболітів (включаючи вихібовувати на собаках, мавпах чи інших тваринах, дний лікарський засіб). Ці методи аналізу можуть крім гризунів; плазма мишей та пацюків має високі включати, наприклад, мас-спектрометрію, ВЕРХ, рівні естераз у кровообігу, що може призвести до біоаналізи чи імуноаналізи. Метод аналізу може помилкового результату, якщо бажаним суб'єктом виявляти проліки та будь-який один чи кілька його лікування є людина чи вищий ссавець. метаболітів, але краще метод аналізу спрямоваЗдійснення цього способу на цільних тваринах ний лише на детектування утворення вихідного не є необхідним. До обсягу даного винаходу вхолікарського засобу. Основою цього є припущення дить також використання органів з перфузійним (яке може не виконуватися в усіх випадках), що живленням, культур органів in vitro (наприклад, 13 75889 14 шкірних трансплантатів) чи клітинних ліній, які рівень селективності. З іншого боку, токсичні споутримуються у різних формах клітинної культури, луки можуть потребувати детальнішого скринінгу наприклад, у роллер-флаконах чи системах судля ідентифікації селективних проліків. Відносні спензій з нульовим тяжінням. Наприклад, клітини витрати на спосіб за даним винаходом можна змеМТ-2 можуть бути використані як цільова тканина ншити завдяки проведенню скринінгу лише у цідля відбору проліків для ВІЛ. Таким чином, термін льовій тканині та тканинах, про які відомо, що по "тканина" на слід тлумачити як такий, що потребує відношенню до них вихідна сполука є відносно організованих клітинних структур або тканинних токсичною, наприклад, для РМЕА, що є нефротокструктур у тому вигляді, який вони мають у приросичним у вищих дозах, увагу слід звернути у перді, хоч вони і є кращими. Замість цього, термін шу чергу на нирки та лімфоїдні тканини. "тканина" слід тлумачити як синонім до клітин певСтадія визначення відносної антивірусної акного джерела, походження чи стадії диференціації. тивності проліків у обраних тканинах звичайно Цільова та нецільова тканина може бути по здійснюється шляхом проведення аналізу цільової суті однією й тою самою тканиною, але тканини та нецільової тканин на відносну присутність чи повинні мати різний біологічний статус. Наприактивність метаболіту проліків, про який відомо, клад, даний спосіб може бути використаний для що цей метаболіт виявляє антивірусну чи противідбору проліків, які виявляють активність у віруспухлинну активність, або перетворюється на мено-інфікованій .тканині (цільовій тканині), але затаболіт, що їх має. Так, типово визначають віднослишаються по суті неактивними у неінфікованих ну кількість вихідного лікарського засобу у вірусом клітинах (відповідно, нецільова тканина), тканинах протягом по суті одного й того самого така саме стратегія буде використовуватися для періоду часу з метою ідентифікації проліків, що відбору профілактичних проліків, тобто, проліків, переважно метаболізуються у цільовій тканині на що метаболізуються до антивірусно активних антивірусно чи протипухлинно активний метаболіт форм у випадку вірусної інфекції, але залишаютьчи їхній прекурсор, який у цільовій тканині зрешся по суті неметаболізованими у неінфікованих тою утворює активний метаболіт. У випадку антиклітинах. Аналогічно, проліки можуть бути піддані вірусних сполук активний метаболіт є дифосфатом скринінгу у трансформованих клітинах та нетранфосфонатних вихідних сполук. Саме цей метабосформованій порівняльній тканині. Це буде особліт включається до вірусної нуклеїнової кислоти, ливо корисним у порівняльному тестуванні з метим самим перериваючи подовження нитки нуклетою відбору проліків для лікування гематологічних їнової кислоти та припиняючи вірусну реплікацію. злоякісних новоутворень, наприклад, лейкемій. Метаболіти проліків можуть бути анаболічними Без обмеження будь-якою конкретною теорією метаболітами, катаболічними метаболітами або механізму дії, у порівнянні з іншими тканинами чи спільним продуктом анаболізму та катаболізму. клітинами, вважається, що тканино-селективні Спосіб одержання метаболіту не є важливим у проліки селективно поглинаються цільовими кліпрактиці способу за цим винаходом. тинами та/або селективно метаболізуються усереСпосіб за даним винаходом не обмежений дині клітини. Унікальною перевагою метоксифосаналізом метаболіту, який сам по собі виявляє фонатних проліків за даним винаходом є те, що антивірусну чи протипухлинну активність. Замість їхній метаболізм до діаніону при фізіологічних знацього можна проводити аналіз неактивних прекурченнях рН забезпечує їхню нездатність до зворотсорів активних метаболітів. Прекурсори антивірусної дифузії з клітини. Таким чином, вони залишано активного дифосфатного метаболіту включаються ефективними протягом тривалих періодів ють монофосфат вихідного лікарського засобу, часу і підтримують підвищену внутрішньоклітинну монофосфати інших метаболітів вихідного лікарконцентрацію, виявляючи завдяки цьому підвищеського засобу (наприклад, проміжна модифікація ну активність. Вважається, що механізми підвищезамісника на гетероциклічній основі), сам вихідний ної активності у цільовій тканині включають підвилікарський засіб та метаболіти, що генеруються щене поглинання цільовими клітинами, підвищене клітиною при перетворенні проліків на вихідну внутрішньоклітинне утримання або обидва механісполуку перед фосфорилюванням. Структури презми працюють разом. Однак, спосіб виявлення курсорів можуть значно відрізнятися, оскільки вони селективності чи посилення доставки до цільової є результатом клітинного метаболізму. Однак, ця тканини не є важливим. Неважливо також, чи усе інформація є вже відомою або може бути легко метаболічне перетворення проліків на вихідну одержана фахівцем в цій області. сполуку відбувається усередині цільової тканини. Якщо проліки, що аналізуються, не виявляють У цільовій тканині має відбуватися лише кінцева протипухлинної чи антивірусної активності самі по стадія перетворення, що забезпечує виявлення собі, то може бути потрібна корекція первинних активності; метаболізм у інших тканинах може результатів аналізу. Наприклад, якщо внутрішньоприводити до утворення проміжних сполук, які клітинне перетворення неактивного метаболіту на зрештою перетворюються на антивірусні форми у активний метаболіт відбувається з різними швидцільовій тканині. костями у різних тканинах, що тестуються, то неоБажаний ступінь селективності чи підвищення броблені результати тобто, проліків, що метаболідоставки буде змінюватись у залежності від вихідзуються до антивірусно активних форм у випадку ної сполуки та від способу вимірювання (розподіл вірусної інфекції, але залишаються по суті немедози у % або концентрація вихідного лікарського таболізованими у неінфікованих клітинах. Аналогізасобу). Загалом, якщо вихідний лікарський засіб чно, проліки можуть бути піддані скринінгу у транвже має широке терапевтичне вікно, то для бажасформованих клітинах та нетрансформованій них проліків може виявитись достатнім низький порівняльній тканині. Це буде особливо корисним 15 75889 16 у порівняльному тестуванні з метою відбору пролітим самим перериваючи подовження нитки нуклеків для лікування гематологічних злоякісних новоїнової кислоти та припиняючи вірусну реплікацію. утворень, наприклад, лейкемій. Метаболіти проліків можуть бути анаболічними Без обмеження будь-якою конкретною теорією метаболітами, катаболічними метаболітами або механізму дії, у порівнянні з іншими тканинами чи спільним продуктом анаболізму та катаболізму. клітинами, вважається, що тканино-селективні Спосіб одержання метаболіту не є важливим у проліки селективно поглинаються цільовими кліпрактиці способу за цим винаходом. тинами та/або селективно метаболізуються усереСпосіб за даним винаходом не обмежений дині клітини. Унікальною перевагою метоксифосаналізом метаболіту, який сам по собі виявляє фонатних проліків за даним винаходом є те, що антивірусну чи протипухлинну активність. Замість їхній метаболізм до діаніону при фізіологічних знацього можна проводити аналіз неактивних прекурченнях рН забезпечує їхню нездатність до зворотсорів активних метаболітів. Прекурсори антивірусної дифузії з клітини. Таким чином, вони залишано активного дифосфатного метаболіту включаються ефективними протягом тривалих періодів ють монофосфат вихідного лікарського засобу, часу і підтримують підвищену внутрішньоклітинну монофосфати інших метаболітів вихідного лікарконцентрацію, виявляючи завдяки цьому підвищеського засобу (наприклад, проміжна модифікація ну активність. Вважається, що механізми підвищезамісника на гетероциклічній основі), сам вихідний ної активності у цільовій тканині включають підвилікарський засіб та метаболіти, що генеруються щене поглинання цільовими клітинами, підвищене клітиною при перетворенні проліків на вихідну внутрішньоклітинне утримання або обидва механісполуку перед фосфорилюванням. Структури презми працюють разом. Однак, спосіб виявлення курсорів можуть значно відрізнятися, оскільки вони селективності чи посилення доставки до цільової є результатом клітинного метаболізму. Однак, ця тканини не є важливим. Неважливо також, чи усе інформація є вже відомою або може бути легко метаболічне перетворення проліків на вихідну одержана фахівцем в цій області. сполуку відбувається усередині цільової тканини. Якщо проліки, що аналізуються, не виявляють У цільовій тканині має відбуватися лише кінцева протипухлинної чи антивірусної активності самі по стадія перетворення, що забезпечує виявлення собі, то може бути потрібна корекція первинних активності; метаболізм у інших тканинах може результатів аналізу, Наприклад, якщо внутрішньоприводити до утворення проміжних сполук, які клітинне перетворення неактивного метаболіту на зрештою перетворюються на антивірусні форми у активний метаболіт відбувається з різними швидцільовій тканині. костями у різних тканинах, що тестуються, то неоБажаний ступінь селективності чи підвищення броблені результати аналізів неактивного метабодоставки буде змінюватись у залежності від вихідліту мають бути відкориговані для того, щоб ної сполуки та від способу вимірювання (розподіл врахувати розбіжності між різними типами клітин, дози у % або концентрація вихідного лікарського тому що релевантним параметром є генерування засобу). Загалом, якщо вихідний лікарський засіб активності у цільовій тканині, а не накопичення вже має широке терапевтичне вікно, то для бажанеактивних метаболітів. Однак, визначення потріних проліків може виявитись достатнім низький бної корекції є доступним пересічному фахівцю. рівень селективності. З іншого боку, токсичні споТаким чином, якщо стадія (d) даного способу потлуки можуть потребувати детальнішого скринінгу ребує визначення активності, то активність може для ідентифікації селективних проліків. Відносні бути або визначена безпосередньо, або екстраповитрати на спосіб за даним винаходом можна змельована. Це не означає, що даний спосіб обмеженшити завдяки проведенню скринінгу лише у ціний лише проведенням аналізу проміжних сполук, льовій тканині та тканинах, про які відомо, що по що є активними самі по собі. Наприклад, можна відношенню до них вихідна сполука є відносно також аналізувати відсутність чи зниження рівня токсичною, наприклад, для РМЕА, що є нефротокпроліків у тестованих тканинах. Стадія (d) потресичним у вищих дозах, увагу слід звернути у пербує лише оцінки активності, створюваної пролікашу чергу на нирки та лімфоїдні тканини. ми при їхній взаємодії з певною тканиною, і вона Стадія визначення відносної антивірусної акможе бути основана на екстраполяції чи іншому тивності проліків у обраних тканинах звичайно непрямому вимірі. здійснюється шляхом проведення аналізу цільової Стадія (d) способу за даним винаходом потрета нецільової тканин на відносну присутність чи бує визначення "відносної" активності проліків. активність метаболіту проліків, про який відомо, Слід розуміти, що для цього не потрібно, щоб кощо цей метаболіт виявляє антивірусну чи протижен аналіз чи серія аналізів обов'язково включав пухлинну активність, або перетворюється на медосліди з обраною нецільовою тканиною. Навпаки, таболіт, що їх має. Так, типово визначають відносдо обсягу даного винаходу входить використання ну кількість вихідного лікарського засобу у історичного контролю нецільової тканини чи ткатканинах протягом по суті одного й того самого нин, або алгоритмів, що представляють результаперіоду часу з метою ідентифікації проліків, що ти, очікувані для таких нецільових тканин, для випереважно метаболізуються у цільовій тканині на значення контрольного значення нецільової антивірусно чи протипухлинно активний метаболіт активності. чи їхній прекурсор, який у цільовій тканині зрешРезультати, одержані на стадії (d), потім викотою утворює активний метаболіт. У випадку антиристовуються для оптимального вибору чи іденвірусних сполук активний метаболіт є дифосфатом тифікації проліків, які продукують більшу антивіруфосфонатних вихідних сполук. Саме цей метабосну активність у цільовій тканині порівняно з літ включається до вірусної нуклеїнової кислоти, нецільовою тканиною. Саме ці проліки обирають 17 75889 18 для подальшої розробки. ною і може бути будь-яким розгалуженим чи норСлід розуміти, що певна попередня оцінка мальним С1-С6-алкілом, але краще т-бутилом (для проліків-кандидатів може бути проведена до пракРМРА) чи ізопропілом (для РМЕА). Реакційні умотичного здійснення способу за даним винаходом. ви також є некритичними, але переважно включаНаприклад, проліки мають бути в значній мірі неють нагрівання реакційної суміші до приблизно 70метаболізованими для проходження крізь шлунко75°С при помішуванні чи помірному збовтуванні. во-кишковий тракт, вони мають бути по суті стабіЯкщо немає потреби у збереженні фосфонатльними у крові, і вони до певної міри мають них замісників, то з продукту видаляють захисні проникати у клітини. У більшості випадків, вони групи (звичайно за допомогою бромтриметилсиповинні також завершати перше коло печінкової лану, якщо захисною групою у тозилаті є алкіл), а циркуляції без істотного метаболізму. Такі поперепотім продукт виділяють кристалізацією чи іншим дні дослідження є необов'язковими і добре відомі зручним способом, відомим фахівцям. фахівцям в цій області. Гетероциклічна основа Ті ж самі висновки, що наведені вище для анУ сполуках за даним винаходом, зображених тивірусної активності, є також застосовними до структурними формулами (3) та (4), гетероциклічпротипухлинних проліків метоксифосфонатнуклену основу В обирають зі структурних фрагментів отидних аналогів. Вони включають, наприклад, проліки PMEG, який є гуанільним аналогом РМЕА. У цьому випадку цитотоксичні фосфонати, такі як PMEG, є придатними кандидатами для проведення досліджень, оскільки їхня цитотоксичність по суті забезпечує їхню протипухлинну активність. у яких Сполука, ідентифікована цим новим способом R15 означає Н, ОН, F, СІ, Br, I, OR16, SH, SR16, 17 скринінгу, може бути потім піддана традиційній NH2 чи NHR , 16 програмі преклінічних чи клінічних випробувань з R означає С1-С6-алкіл чи С2-С6-алкеніл, метою підтвердження того, що було досягнуто включаючи СН3, СН2СН3, СН2ССН, бажаної мети. Типово, проліки вважаються селекСН2СНСН2 та С3Н7, тивними, якщо активність чи концентрація вихідноR17 означає С1-С6-алкіл чи С2-С6-алкеніл, го лікарського засобу у цільовій тканині (розподіл включаючи СН3, СН2СН3, СН2ССН, дози у %) становить більш ніж 2х, краще більш ніж СН2СНСН2 та С3Н7, 5х, порівняно з показником для вихідної сполуки у R18 означає N, CF, ССІ, СВг, СІ, CR19, CSR19 чи нецільовій тканині. За іншим варіантом, кандидата COR19, 19 у проліки можнапорівнювати з еталонними проліR означає Н, С1-С9-алкіл, С2-С9-алкеніл, С2ками. У цьому випадку селективність буде відносС9-алкініл, С1-С9-алкіл- С1-С96-алкоксигрупу або ною, а не абсолютною. Селективними проліками С7-С9-арилалкіл, незаміщений чи заміщений ОН, будуть такі, що забезпечують більш ніж приблизно F, СІ, Вг чи І, і таким чином R19 включає -СН3, 10х концентрацію чи активність у цільовій тканині СН2СН3, -СНСН2, -СНСНВг, -СН2СН2СІ, -CH2CH2F, порівняно з прототипом, хоч ступінь селективності -СН2ССН, -СН2СНСН2, -С3Н7, -СН2ОН, є предметом обговорення. СН2ОСН3, -СН2ОС2Н5, -СН2ОССН, Новий спосіб одержання вихідних матеріалів СН2ОСН2СНСН2, -СН2С3Н7, -СН2СН2ОН, чи проміжних сполук СН2СН2ОСН3, -СН2СН2ОС2Н5, Ця заявка включає також удосконалений споСН2СН2ОССН, -СН2СН2ОСН2СНСН2 та сіб виробництва кращих вихідних матеріалів (вихіСН2СН20С3Н7, дних лікарських засобів) за даним винаходом R20 означає N чи СН, РМЕА та (R)-PMPA. Типово, цей спосіб включає R21 означає N, СН, CCN, CCF3, СС=СН чи проведення реакції 9-(2-гідроксипропіл)аденіну CC(O)NH2> (ΗΡΑ) чи 9-(2-гідроксіетил)аденіну (НЕА) з алкокR22 означає Н, ОН, NH2, SH, SCH3, SCH2CH3, сидом магнію з наступним доданням до реакційної SCH2CCH, SCH2CHCH2, SC3H7, суміші захищеного агліконсинтон-пNH(CH3), N(CH3)2, NH(CH2CH3), N(CH2CH3)2, толуолсульфонілоксиметилфосфонату (тозилату) і NH(CH2CCH), NH(CH2CHCH2), виділення РМРА чи РМЕА, відповідно. NH(C3H7), галоген (F, Cl, Br чи І) або X, де Х Краще, якщо R-енантіомером, який збагачують означає -(CH2)m(O)n(CH2)mN(R10)2, де чи виділяють, є ΗΡΑ. Якщо використовується хіракожен m дорівнює незалежно 0-2, η дорівнює льна суміш ΗΡΑ, то R-PMPA може бути ізольова0-1, і ним з хіральної суміші РМРА після завершення R10 незалежно означає синтезу. Η, Типово тозилат є захищеним нижчими алкільС1-С156-алкіл, С2-С15-алкеніл, С6-С15ними групами, але фахівцям відомі інші придатні арилалкеніл, С6-С15-арилалкініл, С2-С15-алкініл, С1групи. Може бути зручним використання тозилату, С6-алкіламіно-С1-С6-алкіл, С5-С15-аралкіл, С6-С15попередньо заміщеного замісниками фосфонатних гетероаралкіл, С5-С6-арил, С2-С6проліків, які здатні діяти як захисні групи у реакції гетероциклоалкіл, С2-С15-алкіл, С3-С15-алкеніл, С6тозилювання, тим самим дозволяючи пропустити С15-арилалкеніл, С3-С15-алкініл, С7-С15стадію видалення захисних груп і одержувати безарилалкініл, С1-С6-алкіламіно- С1-С6-алкіл, С5-С15посередньо проліки чи проміжні сполуки для їхньоаралкіл, С6-С15-гетероалкіл чи С3-С6го синтезу. гетероциклоалкіл, у якому метилен в алкільному Алкільна група алкоксиду магнію є некритичфрагменті, не сусідній з Ν6, є заміщеним на -О-, 19 75889 20 причому необов'язково обидва R10 з'єднані ратину, 7-деазапохідні 2-амінопурину, 2,6зом з N з утворенням насиченого чи ненасиченого діамінопурину, 2-аміно-6-хлорпурину, гіпоксантину, С2-С5-гетероциклу, який містить один чи два гетеінозину та ксантину, 3-деазапохідні 2-амінопурину, роатоми N та необов'язково додатковий гетероа2,6-діамінопурину, 2-аміно-6-хлорпурину, гіпоксантом О чи S, тину, інозину та ксантину, 6-азацитозин, 510 або одну з вищевказаних груп R , заміщену 1фторцитозин, 5-хлорцитозин, 5-йодцитозин, 53 галоїдами, CN чи Ν3, але необов'язково принайбромцитозин, 5-метилцитозин, 5-бромвінілурацил, мні одна група R10 відрізняється від Н, 5-фторурацил, 5-хлорурацил, 5-йодурацил, 5R23 означає Н, ОН, F, СІ, Br, I, SCH3, SCH2CH3) бромурацил, 5-трифторметилурацил, 5SCH2CCH, SCH2CHCH2, SC3H7, OR16, NH2, NHR17 метоксиметилурацил, 5-етинілурацил та 5чи R22, і пропінілурацил. R24 означає О, S чи Se. Краще, В означає 9-пуринільний залишок, обВ також включає як захищені, так і незахищені раний з гуанілу, 3-деазагуанілу, 1-деазагуанілу, 8гетероциклічні основи, зокрема, пуринові та піриазагуанілу, 7-деазагуанілу, аденілу, 3мідинові основи. Захисні групи для екзоциклічних деазааденілу, 1-деазааденілу, 8-азааденілу, 7амінів та інших лабільних груп відомі (Greene et al., деазааденілу, 2,6-діамінопуринілу, 2"Protective Groups in Organic Synthesis") і включаамінопуринілу, 6-хлор-2-амінопуринілу та 6-тіо-2ють N-бензоїл, ізобутирил, 4/4'-диметокситритил амінопуринілу, або В' означає 1-піримідинільний (DMT) і т.п. Вибір захисної групи є зрозумілим для залишок, обраний з цитозинілу, 5-галоїдцитозинілу пересічного фахівця і залежить від природи лабіта 5-(С1-С3-алкіл)цитозинілу. льної групи та хімічних умов, у яких ця захисна Кращі групи В мають формулу група повинна знаходитись, наприклад, кислотних, основних, окисних, відновних чи інших умов. Прикладами захищених фрагментів є N 4бензоїлцитозин, N6-бензоїладенін, N2ізобутирилгуанін і т.п. Захищені основи мають формули Ха.1, Xla.1, у якій Xlb.1, ХІІа.1 чи ХІІІа.1 R22 незалежно позначають галоїд, оксиген, NH2, X чи Н, але необов'язково принаймні один R22 означає X, X означає -(CH2)m(O)n(CH2)mN(R10)2, де m дорівнює 0-2, n дорівнює 0-1, і R10 незалежно позначають Н, де R18, R20, R21, R24 мають значення, вказані С1-С15-алкіл, С2-С15-алкеніл, С6-С15вище, R22A означає R39 чи R22, за умови, що R22 не арилалкеніл, С6-С15-арилалкініл, С2-С15-алкініл, С1є NH2, R23A означає R39 чи R23, за умови, що R23 не С6-алкіламіно-С1-С6-алкіл, С5-С15-аралкіл, С6-С15є NH2, R39 означає NHR40, NHC(O)R36 чи гетероаралкіл, С5-С6-арил, С2-С6CR41N(R38)2, де R36 означає С1-С19-алкіл, С1-С19гетероциклоалкіл, алкеніл, С3-С10-арил, адамантоїл, алкіланіл чи С3С2-С15-алкіл, С3-С15-алкеніл, С6-С15С10-арил, заміщений 1 чи 2 атомами чи групами, арилалкеніл, С3-С15-алкініл, С7-С15-арилалкініл, С1обраними з галогену, метилу, етилу, метоксигрупи, С6-алкіламіно- С1-С6-алкіл, С5-С15-аралкіл, С6-С15етоксигрупи, гідроксильної групи та ціаногрупи, R38 гетероалкіл чи С3-С6-гетероциклоалкіл, де метиозначає С1-С106-алкіл, або обидва R38 разом утволен у алкільному фрагменті, не сусідній з Ν6, був рюють 1-морфоліно, 1-піперидин чи 1-піролідин, заміщений на -О-, R40 означає С1-С1a-алкіл, включаючи метил, етил, причому необов'язково обидва R10 з'єднуються пропіл, ізопропіл, бутил, ізобутил, т-бутил, пентил, разом з N з утворенням насиченого чи ненасичегексил, октил та деканіл, і R41 означає гідроген чи ного С2-С5-гетероциклу, що містить один чи два СН3. гетероатоми N і необов'язково додатковий гетероДля основ структурних формул ХІа.1 та ХІЬ.1, атом О чи S, якщо R є присутнім у R22A чи R23A, то обидві групи або одна з вищевказаних груп R10 є заміще39 R у одній основі звичайно будуть однаковими. ною 1-3 галоїдами, CN чи N3, але необов'язково Прикладами R36 є феніл, феніл, заміщений одним принаймні одна група R10 означає не Н, і 36 з вищевказаних арильних замісників R , -С10Н15 Ζ означає N чи СН, за умови, що гетероциклі(де С10Н15 означає 2-адамантоїл), -СН2-С6Н5, чне ядро відрізняється від пурину не більш ніж C6H5, -СН(СН3)2, -СН2СН3, метил, бутил, т-бутил, одним Ζ. гептаніл, нонаніл, ундеканіл чи ундеценіл. Групи Ε представляють аглікони, що викорисКонкретні основи включають гіпоксантин, гуатовуються у метоксифосфонатнуклеотидних ананін, аденін, цитозин, інозин, тимін, урацил, ксанлогах. Краще, група Ε означає -СН(СН3)СН2-чи тин, 8-азапохідні 2-амінопурину, 2,6-діамінопурину, СН2СН2-. Також краще, щоб бічні групи у хіральних 2-аміно-6-хлорпурину, гіпоксантину, інозину та центрів аглікону знаходились по суті виключно у ксантину, 7-деаза-8-азапохідні аденіну, гуаніну, 2(R)-конфігурації (за винятком гідроксиметилу, який амінопурину, 2,6-діамінопурину, 2-аміно-6означає збагачений (S)-енантіомер). хлорпурину, гіпоксантину, інозину та ксантину, 1R1 означає складний оксіефір, що гідролізудеазапохідні 2-амінопурину, 2,6-діамінопурину, 2ється in vivo, який має структурну формулу -OR35 аміно-6-хлорпурину, гіпоксантину, інозину та ксанчи -OR6, де R35 визначений у колонці 64, рядок 49 21 75889 22 патента США №5798340, який включено сюди за амінокислотами. Придатні конкретні прикладі напосиланням, a R6 визначений вище. Краще, якщо ведені у патенті США № 5798340, наприклад, у R1 означає арилоксигрупу, звичайно, незаміщену Таблиці 4 та колонках 8-10. чи пара-заміщену (як визначено у R6) феноАлкіл у тому значенні, що використовується ксигрупу. тут, якщо не вказано інше, означає нормальний, 2 R означає амінокислотний залишок, необов'явторинний, третинний чи циклічний вуглеводень. зково, за умови, що будь-яка карбоксильна група, Якщо не вказано інше, алкіл означає С1-С12. Прикзв'язана з амідатним N менш ніж приблизно 5 атоладами є -СН3, -СН2СН3, -CH2CH2CH3, -СН(СН3)2, мами, є етерифікованою. R2 типово має структурСН2СН2СН2СНз, -СН2СН(СН3)2, -СН(СНз)СН2СН3, ну формулу -С(СН3)3, -СН2СН2СН2СН2СН3, СН(СН3)СН2СН2СН3, -СН(СН2СН3)2, С(СН3)2СН2СНз, -СН(СНз)СН(СН3)2, -СН2СН2СН(СНз)2, -СН2СН(СН3)СН2СН3, СН2СН2СН2СН2СН2СН3, -СН(СНз)СН2СН2СН2СНз, СН(СН2СН3)(СН2СН2СН3), -С(СН3)2СН2СН2СН3, у якій -СН(СН3)СН(СН3)СН2СН3, -СН(СН3)СН2СН(СН3)2, n дорівнює 1 чи 2, С(СН3)(СН2СН3)2, 11 6 6 R означає R чи Н, краще R =С3-С9-алкіл, С3-СН(СН2СНз)СН(СН3)2, -С(СНз)2СН(СНз)2, і С9-алкіл, заміщений незалежно ОН, галогеном, О СН(СН3)С(СН3)3. чи Ν, С3-С6-арил, С3-С6-арил, незалежно заміщеАлкеніл та алкініл визначені так само, але місний ОН, галогеном, О чи Ν, або С3-С9-арилалкіл, тять щонайменше один подвійний чи потрійний незалежно заміщений ОН, галогеном, О зв'язок, відповідно. чи Ν, У тих випадках, коли розкриті енольні чи кето12 R незалежно означає Η чи С1-С9-алкіл, який групи, відповідні таутомери вважаються також є незаміщеним чи заміщеним замісниками, незаописаними. лежно обраними групи, що складається з ОН, О, Сполуки проліків за даним винаходом пропо11 N, COOR та галогену, С3-С6-арил, який є незамінуються у формі вільної основи чи різних солей, щеним чи заміщеним замісниками, незалежно обперелічених у [патенті США №5798340], і змішураними з групи, що складається з ОН, О, N, ються з фармацевтично прийнятними ексципієн11 COOR та галогену, або С3-С9-арилалкіл, який є тами чи сольватуючими розріджувачами для виконезаміщеним чи заміщеним замісниками, незалеристання як фармацевтичні продукти, також як жно обраними з групи, що складається з ОН, О, N, описано у [патенті США №5798340]. Ці проліки 11 COOR та галогену, мають антивірусні та інші властивості, вже визна13 11 R незалежно означає C(O)-OR , аміногрупу, чені для вихідних лікарських засобів [див патент амід, гуанідиніл, імідазоліл, індоліл, сульфоксид, США №5798340 та інші посилання, що стосуються фосфорил, С1-С3-алкіламіногрупу, С1-С3метоксифосфонатнуклеотидних аналогів]. Слід алкілдіаміногрупу, С1-С6-алкеніламіногрупу, гідророзуміти, що діастереомер структурної формули ксильну групу, тіол, С1-С3-алкоксигрупу, С1-С3(4) є принаймні корисним як проміжна речовина у 11 алктіол, (CH2)nCOOR , С1-С6-алкіл, який є незахімічному одержанні вихідного лікарського засобу міщеним чи заміщеним ОН, галогеном, SH, NH2, шляхом гідролізу in vitro, незалежно від його відфенілом, гідроксифенілом чи С7-С10носно неселективного характеру, як це було виалкоксифенілом, С2-С6-алкеніл, який є незаміщезначено дослідженнями. ним чи заміщеним ОН, галогеном, SH, NН2, феніВинахід буде краще пояснений з посиланням лом, гідроксифенілом чи С7-С10-алкоксифенілом, на такі приклади: та С6-С12-арил, який є незаміщеним чи заміщеним Приклад 1а ОН, галогеном, SH, NH2, фенілом, гідроксифенілом чи С7-С10-алкоксифенілом, і R14 означає Η чи С1-С9-алкіл або С1-С9-алкіл, незалежно заміщений ОН, галогеном, COOR11, О чи N, С3-С6-арил, Сз-С6-арил, який незалежно заміщеним ОН, галогеном, COOR11, О чи Ν, або С3Перетворення аденіну на РМЕА з використанС6-арилалкіл, який є незалежно заміщеним ОН, ням ізопропоксиду магнію. До суспензії аденіну галогеном, COOR11, О чи N. (16,8г, 0,124моль) у ДМФ (41,9мл) додають етилеКраще, R11 означає С1-С6-алкіл, найкраще, нкарбонат (12,1г, 0,137моль) та гідроксид натрію ізопропіл, R13 означає бічний ланцюг природної (0,100г, 0,0025моль). Суміш нагрівають при 130°С амінокислоти, n=1, R12 означає Η і R14 означає Н. У протягом ночі. Реакцію охолоджують до темперасполуці структурної формули (2), винахід включає тури нижче 50°С і додають толуол (62,1мл). Суметаболіти, у яких складні фенокси та ізопропілові спензію далі охолоджують до 5°С на 2 години, фіефіри були гідролізовані до -ОН. Аналогічно, до льтрують та промивають толуолом (2 ). Вологу обсягу винаходу включені деетерифіковані збагатверду речовину висушують під вакуумом при чені фосфоноамідатні метаболіти сполук 5(а), 5(d) 65°С, одержуючи 20,0г (90%) 9-(2та (6). гідроксіетил)аденін у вигляді білуватої твердої Арил та "О" чи "N''-заміщення визначені у коречовини. Т.пл. 238-240°С. лонці 16, рядки 42-58, патента США №5798340. Типово, амінокислоти є природними чи / 23 75889 24 (66,0г, 0,205моль) протягом двох годин, підтримуючи температуру 78°С. Суміш перемішують при 75°С протягом 4 годин. Після охолодження до температури нижче 50°С додають бромтриметилси9-(2-Пдроксіетил)аденін (НЕА) (20,0г, лан (73,9г, 0,478моль) і суміш нагрівають до 77°С 0,112моль) суспендують у ДМФ (125мл) та нагріпротягом 3 годин. Після завершення реакцію навають до 80 °С. До суміші додають ізопропоксид грівають до 80°С і леткі речовини видаляють шлямагнію (11,2г, 0,0784моль), чи за іншим варіантом хом атмосферної дистиляції. Залишок розчиняють т-бутоксид магнію, а потім діетил-пу воді (120мл) при 50°С, а потім екстрагують етитолуолсульфонілоксиметилфосфонат (66,0г, лацетатом (101мл). рН водної фази доводять до 0,162моль) протягом однієї години. Суміш перемірН 1,1 за допомогою гідроксиду натрію, вводять шують при 80°С протягом 7 годин. 30мл летких затравку з аутентичним (R)-PMPA, і рН водного речовин видаляють вакуумною перегонкою і до шару знов доводять до рН 2,1 за допомогою гідрореакції додають 30мл свіжого ДМФ. Після охолоксиду натрію. Одержану суспензію перемішують дження до кімнатної температури додають бромтпри кімнатній температурі протягом ночі. Суспенриметилсилан (69,6г, 0,450моль) і суміш нагрівазію охолоджують до 4°С на три години. Тверду ють до 80°С протягом 6 годин, реакцію речовину відокремлюють фільтрацією, промиваконцентрують, одержуючи в'язку смолисту речоють водою (60мл) та висушують у вакуумі при вину. Смолисту речовину розчиняють у 360мл во50°С, одержуючи 18,9г (63,5%) сирового (К)-9-[2ди, екстрагують 120мл дихлорметану, доводять до (фосфонометокси)пропіл]аденіну (РМРА) у вигляді рН 3,2 гідроксидом натрію і одержану суспензію білуватої твердої речовини. перемішують при кімнатній температурі протягом Сировий (Р)-9-[2ночі. Суспензію охолоджують до 4°С на одну годи(фосфонометокси)пропіл]аденін нагрівають до ну. Тверді речовини видаляють фільтрацією, прокипіння зі зворотним холодильником у воді (255 мивають водою (2 ) та висушують у вакуумі при мл) до повного розчинення твердих речовин. Роз56°С, одержуючи 20г (65,4%) 9-[2чин охолоджують до кімнатної температури протя(фосфонометоксі)етил]аденін (РМЕА) у вигляді гом 4 годин. Одержану суспензію охолоджують білої твердої речовини. Т.пл. >200°С (розкл.) 1Н при 4°С протягом трьох годин. Тверду речовину ЯМР (D2O) δ 3,49 (τ, 2Н), 3,94 (τ, 2Н), 4,39 (τ, 2Н), відокремлюють фільтрацією, промивають водою 8,13 (с, 1Н), 8,22 (с, 1Н). (56мл) та ацетоном (56мл) і висушують у вакуумі Приклад 1b при 50°С, одержуючи 15,0г (50,4%) (R)-9-[2(фосфонометокси)пропіл]аденіну (РМРА) у вигляді білої твердої речовини. Т.пл.: 278-280°С. Приклад 2 Одержання GS-7171 (III) Схема 1 Перетворення аденіну на РМРА з використанням т-бутоксиду магнію. До суспензії аденіну (40г, 0,296моль) у ДМФ (41,9мл) додають (R)-пропіленкарбонат (34,5г, 0,338моль) та гідроксид натрію (0,480г, 0,012моль). Суміш нагрівають при 130°С протягом ночі. Реакцію охолоджують до 100°С і додають толуол (138мл), а потім метансульфонову кислоту (4,7г, 0,049моль), підтримуючи температуру реакції у межах 100-110°С. Додають ще толуол (114мл) для одержання гомогенного розчину. Розчин охолоджують до З °С протягом 7 годин, а потім витримують при 3°С протягом однієї години. Одержану тверду речовину відокремлюють фільтрацією та промивають ацетоном (2 ). Вологу тверду речовину висушують у вакуумі при 80°С, одержуючи 42,6г (75%) (R)-9-[2-(гідрокси)пропіл]аденін (ΗΡΑ) у вигляді білуватої твердої речовини. Т.пл. 188190°С. (Р)-9-[2-(гідрокси)пропіл]аденін (ΗΡΑ) (20,0г, 0,104моль) суспендують у ДМФ (44,5мл) та нагрівають до 65°С, додають до суміші т-бутоксид магнію (14,2г, 0,083моль), чи за іншим варіантом ізопропоксид магнію, протягом однієї години, а потім діетил-п-толуолсульфонілоксиметилфосфонат Емальований реактор завантажують безводним РМРА, (І) (14,6кг, 50,8моль), фенолом (9,6кг, 102моль) та 1-метил-2-піролідиноном (39кг). Суміш нагрівають до 85°С та додають триетиламін (6,3 кг, 62,3 моль). Потім додають розчин 1,3дициклогексилкарбодііміду (17,1кг, 82,9моль) у 1метил-2-піролідиноні (1,6кг) протягом 6 годин при 100°С. Продовжують нагрівати протягом 16 годин. Реакцію охолоджують до 45°С, додають воду 25 75889 26 (29кг) та охолоджують до 25°С. Тверді речовини Альтернативний спосіб одержання GSвидаляють з реакції фільтрацією та промивають 7171 (III) водою (15,3кг). Об'єднані фільтрат та промивну рідину концентрують до жовто-коричневої суспенСхема 2 зії при зниженому тиску, додають воду (24,6кг) та доводять до рН=11 за . допомогою NaOH (25% у воді). Високодисперсні тверді речовини видаляють фільтрацією крізь діатомову землю видаляють (2кг) з наступною промивкою водою (4,4кг). Об'єднані фільтрат та промивну рідину екстрагують етилацетатом (28кг). Водний розчин доводять до рН=3,1 за допомогою НСІ (37% у воді) (4кг). Сирову речовину II виділяють фільтрацією та промивають метанолом (12,7кг). Вологий осад сирової речовини II суспендують у метанолі (58кг). Тверді речовини відокремлюють фільтрацією, промивають метанолом (8,5кг) та висушують при зниженому тиску, одержуючи 9,33кг II у вигляді білого поМонофеніл-РМРА (II). Круглодонну колбу зі рошку: 1Н ЯМР (D2O) δ 1,2 (д, 3Н), 3,45 (кв, 2Н), 3,7 зворотним холодильником та вхідним отвором для (кв, 2Н), 4 (м, 2Н), 4,2 (кв, 2Н), 4,35 (дц, 2Н), 6,6 (д, азоту поміщають на масляну баню при 70°С. Кол2Н), 7 (т, 1Н), 7,15 (т, 2Н), 8,15 (с, 1Н), 8,2 (с, 1Н), бу завантажують безводним РМРА (І) (19,2г, 31 Р ЯМР (D2O) δ 15,0 (розщеплений). 67ммоль), Ν,Ν-диметилформамідом (0,29г, GS-7171 (III). (Схема 1) Емальований реактор 3,3ммоль) та тетраметиленсульфоном (40мл). завантажують монофеніл-РМРА, (II), (9,12кг, Тіонілхлорид (14,2г, 119ммоль) додають протягом 25,1моль) та ацетонітрилом (30,7кг). Додають тіо4 годин. Температуру нагрівання підвищують до нілхлорид (6,57кг, 56,7моль) при температурі ниж100°С протягом такого ж часу. Одержують гомоче 50°С. Суміш нагрівають при 75°С до розчиненгенний розчин. До розчину протягом 5 хвилин доня твердих речовин. Температуру реакції дають фенокситриметилсилан (11,7г, 7 ммоль). підвищують до 80°С і збирають леткі речовини Продовжують нагрівання на масляній бані при (11,4кг) атмосферною перегонкою під азотом. За100°С протягом ще двох годин. Реакцію виливалишок від перегонки охолоджують до 25°С, додають у ацетон (400мл) при швидкому перемішуванні ють дихлорметан (41кг) та охолоджують до -29°С. та охолодженні до 0°С. Тверді речовини відокремДодають протягом 60 хвилин при температурі люють фільтрацією, висушують при зниженому 18°С розчин (L)-аланінізопропілового складного тиску та розчиняють у метанолі (75мл). рН розчину ефіру (7,1кг, 54,4моль) у дихлорметані (36кг), а доводять до 3,0 за допомогою розчину гідроксиду потім триетиламін (7,66кг, 75,7моль) протягом 30 калію (45% водн.) при охолодженні на суміші хвилин при температурі від –18°С. Реакційну сульод/вода. Тверді речовини, що утворюються, віміш підігрівають до кімнатної температури та продокремлюють фільтрацією, промивають метаномивають п'ять разів розчином дигідрогенфосфату лом та висушують при зниженому тиску, одержуюнатрію (10% у воді, кожна промивка 15,7кг). Оргачи 20,4г II (Схема 2) у вигляді білого порошку. нічний розчин висушують безводним сульфатом GS-7171 (III). Монофеніл-РМРА (II) (3г, натрію (182кг), фільтрують, промивають дихлор8,3ммоль), тетраметиленсульфон (5мл) та Ν,Νметаном (28кг) та концентрують до маслянистої диметилформамід (1 краплина) змішують у кругрідини при зниженому тиску. До маслянистої рідилодонній колбі на масляній бані при 40°С. Додани додають ацетон (20кг) та суміш концентрують ють тіонілхлорид (1,96г, 16,5ммоль). Через 20 хвипри зниженому тиску. До одержаної маслянистої лин прозорий розчин забирають з бані, розводять рідини додають ацетон (18,8кг). Половину розчину дихлорметаном (10мл) і додають до розчину (L)продукту очищають хроматографією на шарі аланінізопропілового складного ефіру (5г, 38 38см з 22кг силікагелю 60, 37-74 мкм (23033ммоль) та діізопропілетиламіну (5,33г, 41ммоль) 400меш). Колонку елююють 480кг ацетону. Процеу дихлорметані (20мл) при -10°С. Реакційну суміш дуру очистки повторюють для другої половини підігрівають до кімнатної температури та промимаслянистої рідини, використовуючи свіжі силікавають три рази розчином дигідрофосфату натрію гель та ацетон. Фракції, що містять чистий про(10% водн., кожна промивка 10мл). Органічний дукт, концентрують при зниженому тиску до масрозчин висушують над безводним сульфатом налянистої рідини. До маслянистої рідини додають трію та концентрують при зниженому тиску до маацетонітрил (19,6кг) і суміш концентрують при слянистої рідини Маслянисту рідину змішують з зниженому тиску. Додають ацетонітрил (66,4кг) і фумаровою кислотою (0,77г, 6,6ммоль) та ацетонірозчин охолоджують до температури у межах від 0 трилом (40мл) і нагрівають до кипіння зі зворотним до -5°С протягом 16 годин. Тверді речовини видахолодильником, одержуючи гомогенний розчин. ляють фільтрацією і фільтрат концентрують при Розчин охолоджують на льодяній бані і тверді резниженому тиску до 5,6кг III у вигляді маслянистої човини відокремлюють фільтрацією. Тверду фурідини темного кольору: маратну сіль GS-7171 висушують при зниженому 1 Н ЯМР (CDCI3) δ 1,1 (м, 12Н), 3,7 (м, 1Н), 4,0 тиску, одержуючи 3,7 г речовини. Сіль (3,16г, (м, 5Н), 4,2 (м, 1Н), 5,0 (м, 1Н), 6,2 (с, 2Н), 7,05 (м, 5,3ммоль) суспендують у дихлорметані (30мл) та 31 5Н), 8,0 (с, 1Н), 8,25 (д, 1Н), Р ЯМР (CDCI3) δ перемішують з розчином карбонату калію (5мл, 21,0, 22,5 (розщеплений). 27 75889 28 2,5М у воді) до розчинення твердої речовини. Орпокриття на силікагелі) (1,2кг). Колонки елююють ганічний шар відокремлюють, а потім промивають 30% метанолу у ацетонітрилі. Фракції, що містять водою (5мл), висушують над безводним сульфапродукт, концентрують до розчину IV у ацетоніттом натрію та концентрують при зниженому тиску, рилі (2,48кг). Розчин з часом перетворюється на одержуючи 2,4г III у вигляді жовтувато-коричневої кристалічну масу, просочену ацетонітрилом. Криспіни. талічну масу висушують при зниженому тиску, Приклад 3 одержуючи кристалічний порошок жовтуватоА. Розділення діастереомерів методом періокоричневого кольору, 1,301кг IV, діастереомерна дичної елюентної хроматографії чистота 98,7%, т.пл. 117-120 °С, 1Н ЯМР (CDCI3) δ Діастереомери GS-7171 (III) розділяють мето1,15 (м, 12Н), 3,7 (τ, 1Н), 4,0 (м, 5Н), 4,2 (дд, 1Н), дом періодичної елюентної хроматографії з вико5,0 (м, 1Н), 6,05 (с, 2Н), 7,1 (м, 5Н), 8,0 (с, 1Н), 8,2 ристанням комерційно доступної колонки Chiralpak (с, 1Н), 31Р ЯМР (CDCI3) δ 21,0 (розщеплений). C. Розділення діастереомерів методом С18 AS, 20мкм, 21 250мм для напівпрепаративної ОФ-ВЕРХ ВЕРХ із запобіжною колонкою Chiralpak AS, 20мкм, GS-7171 (III) піддають хроматографії методом 21 50мм. Chiralpak® AS є фірмовим матеріалом обернено-фазової ВЕРХ для розділення діастеренаповнювача, що виробляється фірмою Diacel та омерів за таким спрощеним протоколом продається у Північній Америці фірмою Chiral ХроматоPhenomenex Luna™ C18(2), Technologies, Inc. [патенти США №№5202433, RE графічна 5мкм, розмір пір 100 35919, 5434298, 5434299 та 5498752]. Chiralpak AS колонка (Phenomenex, Torrance, CA), чи є хіральною нерухомою фазою (CSP), яка складаеквівалентна ється з амілозатрис[(5)-а-метилбензилкарбамату], Запобіжна Pellicular C18 (Alltech, Deerfield, нанесеного на основу з силікагелю колонка IL), чи еквівалентна Діастереомерну суміш GS-7171 розчиняють у Рухома А - 0,02% (85%) Н3РО4 у суміші рухомій фазі і подають помпою у хроматографічну фаза вода : ацетонітрил (95:5) систему аліквоти приблизно 1г GS-7171. НебажаВ - 0,02% (85%) Н3РО4 у суміші ний діастереомер, позначений як GS-7339, утвовода : ацетонітрил (50:50) рював перший великий широкий (тривалістю блиГрадієнт рухомої фази: зько 15 хв.) пік при елююванні з колонки. Після Час % Рухома фаза А % Рухома фаза В закінчення елюювання піка GS-7339 рухому фазу 0 100 0 негайно заміняли на 100% метиловий спирт, який спричинював елюювання бажаного діастереомеру, 5 100 0 позначеного як GS-7340 (IV), з колонки у вигляді 7 70 30 вузького піка з фронтом розчинника метилового 32 70 300 спирту. Метиловий спирт використовують для 40 0 100 зменшення загальної тривалості циклу. Після пе50 0 100 рших двох впорскувань обидва діастереомери збирають у вигляді окремих великих фракцій, які Час прогону 50 хвилин містять один з очищених діастереомерів (>99,0% Затримка для врі10хв. при 100% рухомої окремого діастереомеру). Розчинники рухомої фавноважування фази А зи видаляють у вакуумі, одержуючи очищений діаШвидкість подачі 1,2мл/хв стереомер у вигляді рихлої піни. Температура Навколишнього середоБлизько 95% вихідної маси GS-7171 виділяють вища у двох діастереомерних фракціях. Фракція GSДетектування УФ на 260нм 7340 включає близько 50% від загальної маси виРозчин зразка 20мМ натрій-фосфатний діленої речовини. буфер, рН 6 Хроматографічні умови були такими: Час утримання GS-7339, близько 25 хвиРухома фаза GS-7171лин (початкова) ацетонітрил:ізопропіловий GS-7340, близько 27 хвиспирт (90:10) лин (кінцева) 100% метиловий спирт D. Розділення діастереомерів кристалізацією Витрата 10мл/хвилину GS-7340 (IV). Розчин GS-7171 (III) у ацетонітЧас прогону близько 45 хвилин рилі концентрують до піни бурштинового кольору Детектування УФ на 275нм (14,9г) при зниженому тиску. Піну розчиняють у Температура Навколишнього середовища ацетонітрилі (20 мл) та вносять затравку кристалу Профіль GS-7339 (діастереомер В) IV. Суміш перемішують протягом ночі, охолоджуелюювання GS-7340 (діастереомер А, (IV)) ють до 5 °С і тверді речовини відокремлюють фіB. Виділення діастереомеру GS-7171 методом льтрацією. Тверді речовини висушують до 2,3 г IV SMB-хроматографії Загальний опис методу хроу вигляді білих кристалів, діастереомерна чистота матографії з імітованим рухомим шаром (SMB), 98% (31Ρ ЯМР): 1 [див. у Strube et al., "Organic Process Research and Н ЯМР (CDCI3) δ 1,15 (м, 12Н), 3,7 (т, 1Н), Development" 2:305-319 (1998)]. 3,95 (м, 2Н), 4,05 (м, 2Н), 4,2 (м, 2Н), 5,0 (м, 1Н), GS-7340 (IV). GS-7171 (III), 2,8кг, очищають 6,4 (с, 2Н), 7,1 (м, 5Н), 8,0 (с, 1Н), 8,2 (с, 1Н), 31Р методом хроматографії з імітованим рухомим шаЯМР (CDCI3) δ 19,5 (розщеплений). ром на шарах наповнювача розміром 10см на 5 cm Рентгеноструктурний аналіз окремого криста(Chiral Technologies Inc., 20 мікрон Chiralpak AS лу, обраного з цього продукту, дав такі результати: 29 Колір кристалу, габітус безбарвний, колончастий Розмір кристалу 0,25 0,12 0,08мм Кристалографічна сингонія орторомбічна Тип решітки примітивний Параметри решітки а=8,352(1) b=15,574(2) c=18,253(2) V=2374,2(5)3 Просторова група Ρ212121 (№19) Значення Ζ 4 Dpозp 1,333г/см3 F000 1008,00 μ(ΜοΚα) 1,60 см-1 Приклад 4 Одержання фумаратної солі GS-7340 GS-7340-02 (V). (Схема 1) Емальований реактор завантажують GS-7340 (IV), (1,294кг, 2,71моль), фумаровою кислотою (284г, 2,44моль) та ацетонітрилом (24,6кг). Суміш нагрівають до кипіння зі зворотним холодильником для розчинення твердих речовин, фільтрують у гарячому стані та охолоджують до 5°С на 16 годин. Продукт відокремлюють фільтрацією, промивають ацетонітрилом (9,2кг) та висушують, одержуючи 1329г (V) у вигляді білого порошку: т.пл. 119,7-121,1°С, [a]D20-41,7° (с 1,0, оцтова кислота). Приклад 5 Одержання GS-7120 (VI) Схема 3 Круглодонну колбу на 5л завантажують монофеніл-РМРА, (II), (200г, 0,55моль) та ацетонітрилом (0,629кг). Додають тіонілхлорид (0,144 кг, 1,21моль) при температурі нижче 27°С. Суміш нагрівають при 70°С до розчинення твердих речовин. Леткі речовини (0,45л) видаляють атмосферною дистиляцією під азотом. Залишок від перегонки охолоджують до 25°С, додають дихлорметан (1,6кг) і суміш охолоджують до -20°С. Додають розчин етилового складного ефіру (L)- аміномасляної кислоти (0,144кг, 1,1моль) у дихлорметані (1,33 кг) протягом 18 хвилин при температурі від -20 до -10°С, а потім триетиламін (0,17кг, 1,65моль) протягом 15 хвилин при температурі від -8 до -15°С. Реакційну суміш підігрівають до кімнатної температури та промивають чотири рази розчином дигідрофосфату натрію (10% водн., 0,3 л кожна промивка). Органічний розчин висушують безводним сульфатом натрію (0,5кг) та фільтрують. Тверді речовини промивають дихлорметаном (0,6кг) і об'єднані фільтрат та промивні рідини концентрують до маслянистої рідини при зниженому тиску. Маслянисту рідину очищають хроматографією на шарі 15 13см з 1,2кг силікагелю 60, 7437мкм (230-400меш). Колонку елююють градієнтом дихлорметану та метанолу. Фракції, що містять продукт, концентрують при зниженому тиску, одержуючи 211г VI (Схема 3) у вигляді піни жовтувато 75889 30 коричневого кольору. Приклад 5а Розділення діастереомерів GS-7120 методом періодичної елюентної хроматографії Діастереомерну суміш очищають з використанням умов, описаних для GS-7171 у Прикладі 3А, за винятком таких: Рухома фаза (Поча- GS-7120 - ацетонітрил ізопткова) ропіловий спирт (98:2) (Кінцева) 100% метиловий спирт Профіль елюювання GS-7341 (діастереомер В) GS-7342 (діастереомер А) Приклад 6 Розділення діастереомерів GS-7120 кристалізацією Круглодонну колбу на 1л завантажують монофеніл-РМРА, (II), (50г, 0,137моль) та ацетонітрилом (0,2л). Додають тіонілхлорид (0,036кг, 0,303моль) з екзотермічним ефектом в 10°С. Суміш нагрівають до кипіння зі зворотним холодильником до розчинення твердих речовин. Леткі речовини (0,1л) видаляють атмосферною дистиляцією під азотом. Залишок від перегонки охолоджують до 25°С, додають дихлорметан (0,2кг) і суміш охолоджують до -20°С. Додають розчин етилового складного ефіру (L)- -аміномасляної кислоти (0,036кг, 0,275моль) у дихлорметані (0,67кг) протягом 30 хвилин при температурі від -20 до -8°С, а потім триетиламін (0,042кг, 0,41моль) протягом 10 хвилин при температурі до -6°С. Реакційну суміш підігрівають до кімнатної температури та промивають чотири рази розчином дигідрофосфату натрію (10% водн., 0,075л кожна промивка). Органічний розчин висушують безводним сульфатом натрію (0,1кг) та фільтрують. Тверді речовини промивають етилацетатом (0,25 ) і об'єднані фільтрат та промивну рідину концентрують до маслянистої рідини при зниженому тиску. Маслянисту рідину розводять етилацетатом (0,25л), вносять затравку кристалізації, перемішують протягом ночі та охолоджують до -15°С. Тверді речовини відокремлюють фільтрацією та висушують при зниженому тиску, одержуючи 17,7г GS-7342 (Таблиця 5) у вигляді порошку жовтувато-коричневого кольору: 1 Н ЯМР (CDCI3) δ 0,95 (τ, ЗН), 1,3 (м, 6Н), 1,7, (м, 2Н), 3,7 (м, 2Н), 4,1 (м, 6Н), 4,4 (дд, 1Н), 5,8 (с, 2Н), 7,1 (м, 5Н), 8,0 (с, 1Н), 8,4 (с, 1Н), 31Р ЯМР (CDCI3) δ 21 (розщеплений). Приклад 7 Розділення діастереомерів GS-7097 Діастереомерну суміш очищають з використанням умов, описаних для GS-7171 (Приклад ЗА), за винятком таких: Рухома фаза (почат- GS-7120кова) ацетонітрил:ізопропіловий спирт (95:5) (кінцева) 100% метиловий спирт Профіль елюювання GS-7115 (діастереомер В) GS-7114 (діастереомер А) Приклад 8 Альтернативна методика одержання GS-7097 GS-7097: Феніл-РМРА, етил-Ьаланіламідат. Феніл-РМРА (15,0г, 41,3ммоль), хлористоводневу сіль етилового складного ефіру L-аланіну (12,6г, 83ммоль) та триетиламін (11,5мл, 83ммоль) пере 31 75889 32 мішують у 500мл піридину під сухим Ν2. Цю сусульфатом натрію та концентрування з одержанспензію змішують з розчином трифенілфосфіну ням 11,1г чистого GS-7097 у вигляді білої твердої (37,9г, 145ммоль), Aldrithiol 2 (2,2речовини, вихід 58%. Цей процес був також викодипіридилдисульфіду) (31,8г, 145ммоль) та 120мл ристаний для синтезу діастереомерної суміші GSпіридину. Суміш нагрівають при внутрішній темпе7003a та GS-7003b (фенілаланіламідат) та суміші ратурі 57°С протягом 15 годин. Після завершення GS-7119 та GS-7335 (гліциламідат). Ці діастереореакцію концентрують під вакуумом до жовтої пасмери розділяють з використанням процедури перітоподібної речовини, 100г. Пастоподібну речовину одичного елюювання, такої як описана у Приклаочищають хроматографією на колонці на шарі дах 3А, 6 та 7. Приклад 9 25 11см з 1,1кг силікагелю 60, 74-37мкм (230In vitro дослідження діастереомерних проліків 400меш). Колонку елююють 8 літрами 2% метаноАнти-ВІЛ-1 активність та цитотоксичність у клілу у дихлорметані, а потім лінійним градієнтом на тинах МТ-2 in vitro і стабільність у плазмі людини протязі 26 літрів елюента до кінцевої концентрації та екстрактах клітин МТ-2 для GS-7340 (вільна 13% метанолу. Фракції, що містять чистий продукт, основа) та тенофовірдизопроксилфумарату (TDF) концентрують, одержуючи 12,4г сирової речовини наведені у Таблиці 1. GS-7340 виявляє 10-кратне (5), 65% від теоретичного виходу. Цей матеріал збільшення антивірусної активності порівняно з був забруднений приблизно 15% (вагових) триетиTDF та 200-кратне збільшення стабільності у плаламіну гідрохлориду за даними 1Н ЯМР. Забрудзмі. Очікується, що така підвищена стабільність у нення видаляють шляхом розчинення продукту у плазмі приведе до вищих рівнів GS-7340 у цирку350 мл етилацетату, екстрагування 20мл води, ляції, ніж у TDF, після перорального введення. висушування органічного розчину над безводним Таблиця 1 Активність та стабільність in vitro GS 7340 TDF Тенофовір ВІЛ-1 активність ІС50мкМ 0,005 0,05 5 Цитотоксичність СС50мкМ >40 70 6000 Для оцінки відносного рівня внутрішньоклітинного РМРА, що утворюється внаслідок внутрішньоклітинного метаболізму TDF у порівнянні з показниками для GS-7340, обидва проліки та РМРА мітили радіоактивними ізотопами та вводили до цільної крові людини у еквімолярних концентраціях. Через 1 годину ізолювали плазму, червоні кров'яні клітини (RBCs) та мононуклеарні клітини периферичної крові (PBMCs) і піддавали аналізу методом ВЕРХ з радіометричним детектуванням. Результати наведені у Таблиці 2. Через 1 годину GS-7340 спричинював 10 та Плазма людини 90,0 0,41 Стабільність Т1/2 (хв.) Екстракт клітин МТ-2 28,3 70,7 (Р/МТ-2) L 3,2 0,006 30 зростання загальної внутрішньоклітинної концентрації РМРА-споріднених сполук у РВМС порівняно з TDF та РМРА, відповідно. У плазмі через 1 годину 84% радіоактивності пов'язано з незмінним GS-7340, у той час як TDF через 1 годину не визначається. Оскільки у плазмі не було виявлено незмінного TDF, 10х-кратна різниця між TDF та GS-7340 через 1 годину означає мінімальну різницю, очікувану in vivo. Хроматограма ВЕРХ для усіх трьох сполук наведена на Фігурі 1. Таблиця 2 Метаболіти РМРА у плазмі, РВМС та RBC після 1год. інкубування РМРА-проліків чи РМРА у крові людини Сполука Матриця GS-7340 (60мкг-екв) Плазма/FΡ РВМС RBC/FP Загальний виділений С-14,мкг-екв 43,0 1,25 12,6 GS-4331 (TDF) (60мкгекв) Плазма/F Ρ РВМС RBC/FP 48,1 0,133 10,5 РМРА (60мкг-екв) Плазма/F Ρ РВМС RBC/FP 55,7 0,033 3,72 Метаболіти (% від загальної площи піка) РМРА,% РМРАр,% РМРАрр,% Met.X,% Met.Y,% GS 7340,% 1 45 8 РМРА 11 50 93 РМРА 100 86 74 16 РМРАр 25 7,0 РМРАр 14 10 21 РМРАрр 18 РМРАрр 16 2 18 24 Моно-РОС 89 7 13 11 GS-4331 84 57 Фіг.1. ВЕРХ/С-14 - слідові кількості екстрактів РВМС з крові людини, що інкубувалася протягом 1год. при 37°С з TDF, GS-7340 чи РМРА. 33 75889 34 тенофовіру, TDF, GS-7340, кількох нуклеозидів та інгібітора протеази нелфінавіру (nelfinivir). Як видно, активність нелфінавіру (nelfinavir) та GS-7340 є на 2-3 порядки величини вище, ніж усіх інших нуклеотидів чи нуклеозидів. Таблиця Анти-ВІЛ-1 активність in vitro антиретровірусних сполук Met.X та Met.Y (метаболіти X та Y) наведені у Таблиці 5. Маленькі літери "р" позначають фосфорилювання. Ці результати були одержані через 1 годину у крові людини. Очікується, що із зростанням часу розбіжності in vitro зростатимуть, тому що 84% GS-7340 залишається у плазмі незмінним після однієї години. Оскільки незмінний GS-7340 присутній у плазмі після перорального введення, відносна клінічна ефективність повинна співвідноситися із значеннями ІС5о, що спостерігаються in vitro. У Таблиці 3 нижче, наведені значення ІС50 для Сполука Адефовір (РМЕА) Тенофовір (РМРА) AZT ЗТС d4T Нелфінавір TDF GS 7340 ІС50(мкМ) 13,4±4,21 6,3±3,31 0,17±0,081 1,8±0,251 8±2,51 0,006±0,0021 0,05 0,005 1. A.S.Mulato and J.M.Cherrington, Antiviral Research 36, 91 (1997) Були проведені додаткові дослідження in vitro анти-ВІЛ-1 активності клітинних культур та СС50 розділених діастереомерів за даним винаходом, і результати наведені у таблиці нижче. Таблиця 4 Ефект діастереомеру Сполука РМРА АІа-метиловий складний ефір GS-6957a GS-6957b Phe-метиловий складний ефір GS-7003a GS-7003b Gly-етиловий складний ефір GS-7119 GS-7335 АІа-ізопропіл GS-7340 GS-7339 АВА-етил GS-7342 GS-7341 АІа-етил GS-7114 GS-7115 Діастереомер Суміш 1:1 ІС50 (мкМ) 5 0,025 Кратність зміни 1 200 А/В активність 20 х СС50 (мкМ) 6000 80 А Суміш 1:1 0,0075 0,15 0,03 670 33 170 10 60 А В Суміш 1:1 0,01 0,1 0,5 500 50 10 20 А В Суміш 1:1 А В Суміш 1:1 А В Суміш 1:1 А В 0,05 1.0 0,01 0,005 0,06 0,008 0,004 0,03 0,02 0,005 0,05 100 5 500 1000 83 625 1250 170 250 1000 100 Посилання на джерело з описом аналізу: Arimilli, Μ.Ν., et al., (1997) Synthesis, in vitro biological evaluation та oralbioavailability of 9-[2(phosphonometoxy)propyl]adenine (PMPA) prodrugs. Antiviral Chemistry and Chemotherapy 8(6):557-564. "Phe-метиловий складний ефір" означає метилфенілаланініл моноамідат, складний феніловий моноефір тенофовіру, "gly-метиловий складний ефір" означає метилгліцилмоноамідат, складний феніловий моноефір тенофовіру. У кожному з описаних вище випадків вважається, що ізомер А має таку саме абсолютну стереохімію, як GS-7340 (S), а ізомер В - таку саме абсолютну стереохімію, як GS-7339. Метаболізм in vitro та стабільність розділених >100 12 7,5 40 >100 >100 10 60 діастереомерів визначали на PLCE, екстракті МТ-2 та плазмі людини. Вказаний нижче біологічний зразок, 80мкл, поміщали до центрифугальної пробірки із закручуваною пробкою та інкубують при 37°С протягом 5хв. До біологічного зразка додають розчин, що містить 0,2мг/мл тестової сполуки у придатному буфері, 20мкл, та перемішують. З реакційної суміші, 20мкл, негайно відбирають пробу та змішують з 60мкл метанолу, що містить 0,015мг/мл 2-гідроксиметилнафталіну як внутрішній стандарт для аналізу методом ВЕРХ. Цей зразок використовують як зразок у нульовий момент часу. Потім у визначені моменти часу з реакційної суміші об'ємом 20мкл відбирають зразки і змішують з 60мкл метанолу, що відповідає технічним 35 75889 36 вимогам. Одержану таким чином суміш центрифуДля досліджень на плазмі людини тестову сполуку розчиняють у TBS. TBS (трис-сольовий гують на 15000 g протягом 5хв. і надосадну рідину буфер, Sigma) містить 0,05М трис, 0,0027М хлорианалізують методом ВЕРХ за описаних нижче ду калію та 0,138М хлориду натрію. рН 7,5 при умов. 37°С. Для аналізів використовували такі біологічні Аналіз методом ВЕРХ проводять за таких зразки. умов. Колонка: Zorbax Rx-C8, 4,6 250мм, 5мкм (1) PLCE (карбоксіестераза свинячої печінки від фірми Sigma, 160од./мг протеїну, 21мг протеїну/мл) з 20-кратним розведенням PBS (фосфатноКолонка Zorbax Rx-C8, 4,6 250мм, сольовим буфером). 5мкм (2) Клітинний екстракт МТ-2 був виготовлений (MAC-MOD Analytical, Inc. з клітин МТ-2 у відповідності до опублікованої меChadds Ford, PA) тодики [A. Pompon, I. Lefebvre, J.-L Imbach, S. Детектування УФ на 260нм Kahn, and D. Farquhar, "Antiviral Chemistry & Швидкість подачі 1,0мл/хв. Chemotherapy", 5:91-98 (1994)], за винятком викоЧас прогону 30хв. ристання як середовища буфера HEPES. Об'єм вприскування 20мкл (3) Плазма людини (об'єднана нормальна плаТемпература колонки Температура навколишнього зма людини від фірми George King Biomedical середовища Systems, Inc.) Рухома фаза А 50мМ фосфат калію (рН Для досліджень були використані такі буферні 6,0)/CH3CN=95/5(об./об.) системи. Рухома фаза В 50 мМ фосфат калію (рН Для досліджень на PLCE тестову сполуку роз6,0)/CH3CN = 50/50 (об./об.) чиняють у PBS. PBS (фосфатно-сольовий буфер, Градієнт прогону: 0хв. 100% Рухома фаза А Sigma) містить 0,01Μ фосфату, 0.0027М хлориду 25хв. 100% Рухома фаза В калію та 0,137М хлориду натрію. рН 7,4 при 37°С. 30хв. 100% Рухома фаза В У дослідженнях на клітинних екстрактах МТ-2 тестову сполуку розчиняють у буфері HEPES. БуРезультати наведені нижче у Таблиці 5 (вклюфер HEPES містить 0,01 ОМ HEPES, 0,05M хлочено також обрані дані ІС5о з Таблиці 4). риду калію, 0,005М хлориду магнію та 0,005М d/дитіотреїту. рН 7,4 при 37°С. Таблиця 5 Метаболізм in vitro ізомерів а та b РМРА-моноамідату при 37°С Приклад 10 Рівні у плазмі та РВМС після перорального введення діастереомерних проліків гончим собакам Фармакокінетику GS 7340 досліджували на собаках після перорального введення дози 10мгGSI GS-7340-2 GS-7339 GS7114 GS7115 GS7119 GS7342 GS7341 Амідат амінокислоти Аланін Аланін Аланін Аланін Гліцин α-Аміномасляна кислота α-Аміномасляна кислота екв/кг. Композиції. Композиції проліків виготовляли у формі розчинів у 50 мМ лимонній кислоті за 0,5 години до введення дози. Усі використані у дослідженнях сполуки були синтезовані фірмою Gilead Sciences. Були використані такі партії: Складний ефір амінокислоти і-Пропіловий і-Пропіловий Етиловий Етиловий Етиловий Етиловий Етиловий Діастереомер Ізомер А Ізомер В Ізомер А Ізомер В Ізомер А Ізомер А Ізомер В № партії 1504-187-19 1509-185-31 1509-181-26 1509-181-22 1428-163-28 1509-191-12 1509-191-7 37 Введення дози та відбирання зразків. Стадія досліджень на живих організмах проводилась відповідно до рекомендацій "Порадника з питань догляду та використання лабораторних тварин" ("Guide for the Care та Use of Laboratory Animals", National Institutes of Health, publication 86-23) і була затверджена Комітетом інституту з питань догляду за тваринами та їхнім використанням. Для досліджень використовували негодованих самців гончих собак (10±2кг). Кожен лікарський засіб вводили у вигляді разової дози орально за допомогою шлункового зонда (1,5-2мл/кг). Доза складала 10мг-еквівалентів РМРА/кг. Для аналізів РВМС зразки крові відбирали у моменти часу 0 (перед введенням дози), 2, 8 та 24год. після введення дози. Для аналізів плазми, зразки крові відбирали в моменти часу 0 (перед введенням дози), 5, 15 та 30хв. і 1, 2, 3, 4, 6, 8, 12 та 24год. після введення дози. Кров (1,0мл) негайно переробляли на плазму шляхом центрифугування при 2000 об/хв. протягом 10хв. Зразки плазми заморожували та зберігали при -70°С до проведення аналізів. Підготовка мононуклеарних клітин периферичної крові (РВМС). Цільну кров (8мл), узяту у визначені моменти часу, змішують з однаковою кількістю фосфатно-сольового буфера (PBS), наносять окремим шаром на 15мл розчину FicollPaque (Pharmacia Biotech.) та центрифугують при 400 g протягом 40хв. Шар РВМС видаляють і промивають один раз PBS. Осад РМВС, що утворився, розводять у 0,5мл PBS, клітини ресуспендують, підраховують за допомогою гемоцитометра та зберігають при -70°С до проведення аналізу. Кількість клітин, помножену на середній об'єм окремої клітини, використовують для обчислення внутрішньоклітинної концентрації. Як об'єм покою РВМС використовують наведене у літературі значення, що дорівнює 200 фемтолітрів/клітину (B.L. Robins, R.V. Srinivas, C. Kim, N. Bischofberger and A. Fridland, Antimicrob. Agents Chemother., 42, 612(1998). Визначення РМРА та проліків у плазмі та РВМС. Концентрацію РМРА у зразках плазми собаки визначали шляхом дериватизації РМРА хлорацетальдегідом з одержанням сильно флуоресцентного N1,N6-етеноаденінового похідного (L. Naesens, J. Balzarini and E. De Clercq, Clin. Chem., 38, 480 (1992). Стисло, плазму (100мкл) змішують з 200мкл ацетонітрилу для осадження протеїну. Зразки потім упарюють до сухого стану при зниженому тиску при кімнатній температурі. Висушені зразки відновлюють у 200мкл коктейлю для дериватизації (0,34% хлорацетальдегіду у 100мМ ацетаті натрію, рН 4,5), перемішують вихровою мішалкою та центрифугують. Після цього надосадну рідину переносять до чистої пробірки із закручуваною пробкою та інкубують при 95°С протягом 40хв. Дериватизовані зразки потім упарюють до сухого залишку та відновлюють у 100мкл води для проведення аналізу методом ВЕРХ. Перед проведенням визначення внутрішньоклітинного РМРА методом ВЕРХ треба видалити 75889 38 велику кількість аденін-споріднених рибонуклеотидів, присутніх у екстрактах РВМС, шляхом селективного окислення. Ми використовували модифіковану методику Tanaka et al. [K.Tanaka, A.Yoshioka, S.Tanaka and Y.Wataya, Anal. Biochem., 139, 35 (1984)]. Стисло, зразки РВМС змішують у співвідношенні 1:2 з метанолом та упарюють до сухого залишку при зниженому тиску. Висушені зразки дериватизують, як описано для аналізу плазми. Дериватизовані зразки змішують з 20мкл 1М рамнози і 30мкл 0,1Μ періодату натрію та інкубують при 37°С протягом 5хв. Після інкубування додають 40мкл 4М метиламіну та 20мкл 0,5М інозину. Після інкубування при 37°С протягом 30хв. зразки упарюють до сухого залишку при зниженому тиску та відновлюють у воді для проведення аналізу методом ВЕРХ. У жодному із зразків не було виявлено проліків у незмінному стані. Для зразків плазми, що потенційно містять незмінні проліки, були проведені експерименти для того, щоб впевнитися, що під час дериватизації не відбувалося додаткового перетворення на РМРА. Для цього стандарти проліків додають до плазми, що не містить лікарських засобів та дериватизують, як описано вище. У жодному із зразків плазми не було виявлено визначуваних рівнів РМРА, і прогнозований % перетворення становить менш ніж 1%. Система ВЕРХ складалася з системи подачі розчинника Р4000 з автоінжектором AS3000 та детектором флуоресценції F2000 (Thermo Separation, San Jose, CA). Використовували колонку Inertsil ODS-2 (4,6 150мм). Використовували такі рухомі фази: А - 5% ацетонітрилу у 25мМ фосфатнокалієвому буфері з 5мМ тетрабутиламонійброміду (ТВАВг), рН 6,0, В - 60% ацетонітрилу у 25мМ фосфатнокалієвому буфері з 5мМ ТВАВг, рН 6,0. Швидкість подачі становила 2мл/хв., а температуру колонки підтримували при 35°С за допомогою печі для колонки. Профіль градієнта становив 90% А/10% В протягом 10хв. для РМРА та 65% А/35% В протягом 10хв. для проліків. Детектування здійснювали флуоресцентним методом зі збудженням на 236нм та емісією на 420нм, а об'єм вприскування складав 10мкл. Дані реєстрували та зберігали за допомогою лабораторної системи збирання даних (PeakPro, Beckman, Allendale, NJ). Фармакокінетичні розрахунки. Концентрацію РМРА та проліків розраховували як площу під кривими концентрації у плазмі чи РВМС на протязі періоду від нуля до 24 годин (AUC). Значення AUC обчислювали з використанням формули трапецій. Концентрації у плазмі та РВМС. Результати цих досліджень наведені на Фігурах 2 та 3. Фігура 2 зображує зведені дані з перебігу у часі метаболізму GS-7340-2 у плазмі та РВМС після перорального введення чистих діастереомерів проліків РМРА. Фігура 2. Концентрації РМРА та проліків у плазмі та РВМС після перорального введення GS 7340-2 собакам в дозі 10мг-екв/кг. 39 75889 40 плазмі після введення собакам у дозі 10мг-екв/кг AUC (0-24год.) для РМРА у РВМС та плазмі після оральної дози 10мг-екв/кг проліків РМРА у собак. Стовпчаста діаграма на Фігурі 3 показує AUC (0-24год.) для тенофовіру у РВМС та плазмі собак після введення РМРА підшкірно, TDF та амідатного складного ефіру проліків. Усі амідатні проліки спричинювали збільшення концентрації у РВМС. Наприклад, GS-7340 призводив до 21-кратного підвищення концентрації у РВМС порівняно з РМРА підшкірно та TDF, та до 6,25-кратного 1,29кратного зниження концентрації у плазмі, відповідно. Фігура 3. Концентрації тенофовіру у РВМС та Ці дані дозволяють встановити in vivo, що GS 7340 може доставлятися перорально, зводить до мінімуму системну дію РМРА та значно підвищує внутрішньоклітинну концентрацію РМРА у клітинах, які переважно відповідають за реплікацію ВІЛ. Таблиця 6 Концентрації РМРА у РВМС та плазмі у собак після перорального введення проліків РМРА GS# GS-7114 GS-7115 GS-7340-2 GS-7339 GS-7119 GS-7342 GS-7341 Фрагмент Моно-Ala-Et-A Моно-Ala-Et-B Моно-Ala-iPr-A Моно-АІа-іРг-А Моно-Gly-Et-A Моно-ABA-Et-A Моно-ABA-Et-B AUC для РМРА у плазмі Середнє 5,8 6,6 5,0 6,4 6,11 4,6 5,8 Ст.відх. 0,9 1,5 1,1 1,3 1,86 1,2 1,4 N 2 2 5 2 2 2 2 Приклад 11 Біорозподіл GS-7340 Шляхом часткового передклінічного аналізу GS-7340 було визначено його біорозподіл у собак. Розподіл у тканинах GS-7340 (ізопропілаланінілмоноамідат, складний феніловий моноефір тенофовіру) аналізувалипісля перорального введення гончим собакам. Двом тваринам-самцям вводили 14 перорально дозу C=GS-7340 (8,85мг-екв. РМРА/кг, 33,2мкКі/кг; мітили карбон-8 аденіну) у водному розчині (50мМ лимонна кислота, рН 2,2). Зразки плазми та мононуклеарних клітин периферичної крові (РВМС) відбирали протягом 24 год. Сечу та фекалії збирали у клітках протягом 24год. Через 24год. після введення дози тварин умертвляли і тканини видаляли для аналізів. Загальну радіоактивність тканин визначали шляхом окислення та підрахунку за допомогою рідинного сцин AUC для РМРА у РВМС Середнє 706 284 805 200 530 1060 199 Ст.відх. 331 94 222 57 304 511 86 N 5 5 5 5 5 5 5 Проліки у плазмі Співвідношення концентрацій у РВМС/плазмі ТАК ТАК ТАК ТАК ТАК ТАК ТАК 122 43 161 31 87 230 34 тиляційного лічильника. Біорозподіл РМРА через 24 години після разової оральної дози радіоміченого GS-7340 наведений у Таблиці 4 разом з даними попередніх досліджень для TDF (GS-7341). У випадку TDF, концентрація проліків у плазмі нижче рівня детектування методу, і основною формою сполуки, що спостерігається у плазмі, є вихідний лікарський засіб. Рівні РМРА у лімфатичних тканинах, кістковому мозку та скелетних м'язах підвищуються 10кратно після введення GS-7340. Накопичення у лімфатичних тканинах узгоджується з даними, одержаними для аналізів РВМС, оскільки ці тканини складаються переважно з лімфоцитів. Аналогічно, накопичення у кістковому мозку є, можливо, спричиненим високою відносною часткою лімфоцитів (70%) у цій тканині. 41 75889 42 Таблиця 7 Виведення та розподіл у тканинах радіоміченого GS-7340 у собак (середнє, N=2) після орального введення дози 10мг-екв. РМРА/кг. Тканина/Рідина Печінка Нирка Легені Клубові лімфатичні вузли Пахвові лімфатичні вузли Пахові лімфатичні вузли Брижові лімфатичні вузли Щитовидна Залоза Гіпофіз Слинна залоза(Л+П) Надниркова залоза Селезінка Підшлункова залоза Простата Яєчка (Л+П) Скелетні м'язи Серце Стегнова кістка Кістковий мозок Шкіра Брюшний жир Око (Л+П) Мозок Спинномозкова рідина Спинний мозок Шлунок Порожня кишка Дванадцятипала кишка Клубова кишка Товста кишка Жовчний міхур Жовч Фекалії Загалом вміст шлунково-кишкового тракту Сеча Плазма через 24 год. Плазма через 0,25 год. РВМС* Цільна кров Загалом виявлено GS-4331 % дози Конц. (мкг-екв/г) 12,40 4,58 0,03 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,02 0,00 0,03 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,11 1,34 0,49 0,01 1,63 0,00 0,00 40,96 5,61 23,72 0,00 н.з. 0,00 0,00 81,10 38,30 87,90 0,53 0,51 0,37 0,28 1,20 0,30 0,23 0,45 1,90 0,63 0,57 0,23 1,95 0,11 0,46 0,08 0,20 0,13 0,16 0,06
ДивитисяДодаткова інформація
Назва патенту англійськоюPhosphonatnucleotide analogs prodrugs, a method for selection and preparation thereof
Автори англійськоюLee William A., Rohloff John C.
Назва патенту російськоюПролекарства аналогов фосфонатнуклеотида, способ их селекции и получения
Автори російськоюЛи Уильям А., Рохлофф Джон К.
МПК / Мітки
МПК: A61K 31/675, C07H 19/20, C07F 9/6561, A61P 31/12, A61P 35/00
Мітки: аналогів, спосіб, селекції, проліки, фосфонатнуклеотиду, одержання
Код посилання
<a href="https://ua.patents.su/21-75889-proliki-analogiv-fosfonatnukleotidu-sposib-kh-selekci-ta-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Проліки аналогів фосфонатнуклеотиду, спосіб їх селекції та одержання</a>
Попередній патент: Спосіб одержання 4,6-диметокси-2-(метилсульфоніл)-1,3-піримідину
Наступний патент: Шлікер для одержання глазурних покриттів чорного кольору
Випадковий патент: Спосіб лікування гепатиту с з використанням інтерферону та інтерлейкіну-1