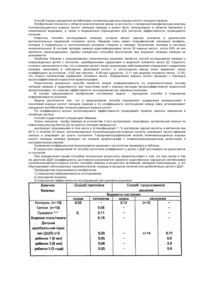
Дельта-5-десатураза і її застосування в продукуванні поліненасичених жирних кислот
Формула / Реферат
1. Виділений полінуклеотид, що містить:
a) нуклеотидну послідовність, яка кодує поліпептид, що має активність дельта-5-десатурази, де поліпептид має принаймні 80 % амінокислотну ідентичність, визначену способом вирівнювання Clustal W, при порівнянні з амінокислотною послідовністю, як вказано в SEQ ID NO:2;
b) нуклеотидну послідовність, яка кодує поліпептид, що має активність дельта-5-десатурази, де поліпептид має принаймні 80 % амінокислотну ідентичність, визначену способом вирівнювання BLASTN, при порівнянні з нуклеотидною послідовністю, як вказано в SEQ ID NO:1 або SEQ ID NO:3;
c) нуклеотидну послідовність, яка кодує поліпептид, що має активність дельта-5-десатурази, де нуклеотидна послідовність гібридизує в жорстких умовах до нуклеотидної послідовності, як вказано в SEQ ID NO:1 або SEQ ID NO:3;
d) комплемент нуклеотидної послідовності (а), (b), або (с), де комплемент і нуклеотидна послідовність складаються з однакової кількості нуклеотидів і є 100 % комплементарними.
2. Полінуклеотид за п. 1, де нуклеотидна послідовність містить SEQ ID NO:1 або SEQ ID NO:3.
3. Полінуклеотид за п. 1, де амінокислотна послідовність поліпептиду містить
a) SEQ ID NO:2;
b) амінокислотну послідовність, що відрізняється від амінокислотної послідовності в (а) на принаймні одне консервативне амінокислотне заміщення.
4. Рекомбінантний конструкт ДНК, що містить полінуклеотид за будь-яким з пп. 1, 2 або 3, функціонально зв'язаний з принаймні однією регуляторною послідовністю.
5. Клітина, що містить в своєму геномі рекомбінантний конструкт ДНК за п.4.
6. Клітина за п. 5, де вказана клітина вибрана з групи, що містить рослини і дріжджі.
7. Спосіб трансформування клітини, що включає трансформування клітини з рекомбінантним конструктом за п. 4 і відбір тих клітин, що трансформувались з рекомбінантним конструктом за п. 4.
8. Спосіб продукування трансформованих рослин, що включає трансформування рослинної клітини з полінуклеотидом за п. 1 або 2, або 3, регенерування рослини з трансформованої рослинної клітини.
9. Спосіб за п. 8, де рослиною є соя.
10. Трансгенне насіння, що містить в своєму геномі рекомбінантний конструкт за п. 4.
11. Трансгенне насіння, одержане з рослини, одержаної за допомогою способу за п. 8 або 9.
12. Спосіб одержання довголанцюгових поліненасичених жирних кислот в рослинній клітині, що включає:
a) трансформування клітини з рекомбінантним конструктом за п. 4;
b) відбір тих трансформованих клітин, що продукують довголанцюгові поліненасичені жирні кислоти.
13. Олія, одержана з насіння за п. 10.
14. Олія, одержана з насіння за п. 11.
15. Спосіб продукування принаймні однієї поліненасиченої жирної кислоти в клітині насіння олійної рослини включає:
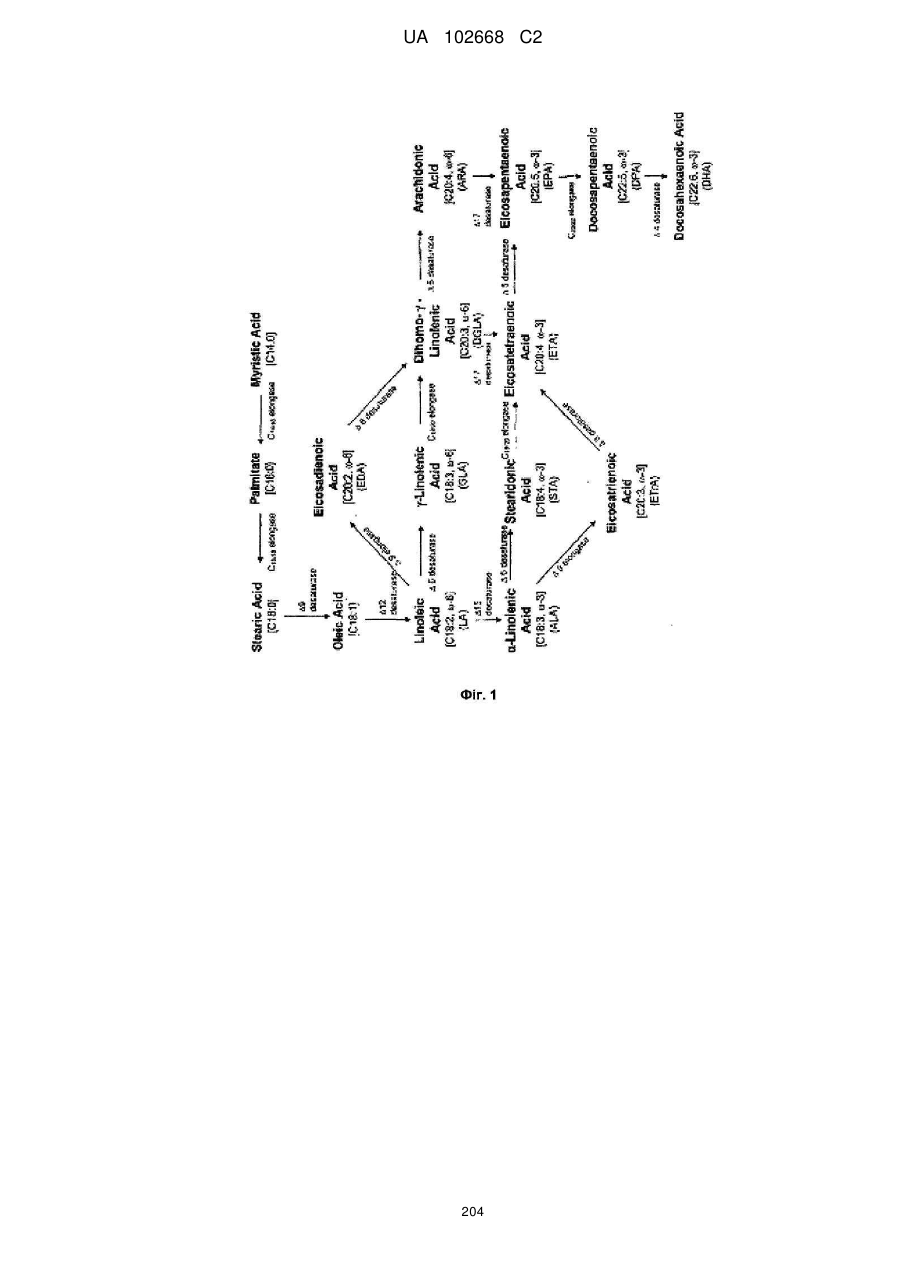
a) трансформування клітини насіння олійної рослини з рекомбінантним конструктом за п. 4 і принаймні одним додатковим рекомбінантним конструктом ДНК, що містить виділений полінуклеотид, функціонально зв'язаний з принаймні однією регуляторною послідовністю, який кодує поліпептид, вибраний з групи, що складається з дельта-4-десатурази, дельта-5-десатурази, дельта-6-десатурази, дельта-8-десатурази, дельта-9-десатурази, дельта-9-елонгази, дельта-12-десатурази, дельта-15-десатурази, дельта-17-десатурази, С14/16елонгази, С16/18елонгази, С18/20елонгази та С20/22елонгази;
b) регенерування олійної рослини з трансформованої в кроці (а) клітини та
c) відбір такого насіння, одержаного з рослин в кроці (b), що має змінений рівень поліненасичених жирних кислот у порівнянні з рівнем в насінні, одержаному з нетрансформованої олійної рослини.
16. Спосіб за п. 15, де олійну рослину вибирають з групи, що складається з сої, Brassica species, соняшника, маїсу, бавовни, льону і сафлору.
17. Олійна рослина, що містить в своєму геномі рекомбінантний конструкт за п. 4.
18. Олійна рослина, що містить:
a) перший рекомбінантний конструкт ДНК, що містить рекомбінантний конструкт за п. 4, та
b) принаймні один додатковий рекомбінантний конструкт ДНК, що містить виділений полінуклеотид, функціонально зв'язаний з принаймні однією регуляторною послідовністю, який кодує поліпептид, вибраний з групи, що складається з дельта-4-десатурази, дельта-5-десатурази, дельта-6-десатурази, дельта-8-десатурази, дельта-9-десатурази, дельта-9-елонгази, дельта-12-десатурази, дельта-15-десатурази, дельта-17-десатурази, С14/16елонгази, С16/18елонгази, С18/20елонгази та С20/22елонгази.
19. Олійна рослина за п. 17 або 18, де олійна рослина є вибраною з групи, що складається з сої, Brassica species, соняшника, маїсу, бавовни, льону і сафлору.
20. Трансгенне насіння, одержане з олійної рослини за п. 17.
21. Трансгенне насіння, одержане з олійної рослини за п. 18.
22. Олія, одержана з насіння за п. 20.
23. Олія, одержана з насіння за п. 21.
24. Олія, одержана згідно зі способом за п. 12 або 15.
25. Харчовий продукт, в якому міститься олія за п. 22.
26. Харчовий продукт, в якому міститься олія за п. 23.
27. Харчовий продукт, в якому міститься олія за п. 24.
28. Харчовий продукт, що містить насіння за п. 20.
29. Харчовий продукт, що містить насіння за п. 21.
30.Харчовий продукт, що містить інгредієнти, одержані з насіння за п. 20.
31. Харчовий продукт, що містить інгредієнти, одержані з насіння за п. 21.
32. Потомство рослин, одержаних з рослин, одержаних за допомогою способу за п. 8 або 9.
33. Потомство рослин, одержаних з олійних рослин за п. 17 або 18.
34. Виділена молекула нуклеїнової кислоти, яка кодує дельта-5-десатуразу, як вказано в SEQ ID NO:3, де принаймні один кодон є кодон-оптимізованим для експресії в Yarrowia sp.
35. Побічні продукти, одержані з насіння за п. 10.
36. Побічні продукти, одержані з насіння за п. 11.
37. Побічні продукти, одержані з насіння за п. 20.
38. Побічні продукти, одержані з насіння за п. 21.
39. Кормовий продукт, в якому міститься олія за п. 22.
40. Кормовий продукт, в якому міститься олія за п. 23.
41. Кормовий продукт, в якому міститься олія за п. 24.
42. Кормовий продукт, що містить насіння за п. 20.
43. Кормовий продукт, що містить насіння за п. 21.
44. Кормовий продукт, що містить інгредієнти, одержані з насіння за п. 20.
45. Кормовий продукт, що містить інгредієнти, одержані з насіння за п. 21.
Текст
Реферат: Винахід належить до біотехнології, зокрема до виділених з Euglena gracilis нуклеїновокислотних фрагментів, які кодують дельта-5-десатуразу, і рекомбінантних конструктів, що містять вказані UA 102668 C2 (12) UA 102668 C2 фрагменти. Винахід також належить до способу продукування довголанцюгових ненасичених жирних кислот (PUFA) з застосуванням вказаних дельта-5-десатураз в рослинах. UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ВИНАХОДУ Даний винахід належить до біотехнології. Більш конкретно, даний винахід стосується ідентифікації фрагментів нуклеїнових кислот, що кодують фермент жирних кислот десатуразу дельта-5, і застосування цієї десатурази в приготуванні довголанцюгових поліненасичених жирних кислот (PUFA). ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ Важливість PUFA беззастережна. Наприклад, деякі PUFA є важливими біологічними компонентами здорових клітин і визнані як "незамінні" жирні кислоти, які не можуть бути синтезовані de novo в ссавцях, і замість цього мають бути отримані або з дієтою, або шляхом десатурації і подовження лінолевої кислоти (LA; 18:2 омега-6) або α-ліноленової кислоти (ALA; 18:3 омега-3); компонентами цитоплазматичних мембран клітин, де вони, можливо, знаходяться в таких формах як фосфоліпіди або триацилгліцероли; необхідні для правильного розвитку (особливо в дитячому мозку, що розвивається) і для утворення і відновлення тканин; і прекурсорами для деякої кількості біологічно активних ейкозаноїдів, важливих для ссавців (наприклад, простацикліни, ейкозаноїди, лейкотрієни, простагландини). Додатково, високий рівень вживання довголанцюгових омега-3 PUFA справляє серцево-судинні захисні ефекти (Dyerberg, J. et al., Amer. J. CHn. Nutr., 28:958-966 (1975); Dyerberg, J. et al., Lancet, 2(8081 ):117119 (July 15, 1978); Shimokawa, H., World Rev. Nutr. Diet,88:100-108 (2001); von Schacky, C. та Dyerberg, J., World Rev. Nutr. Diet, 88:90- 99 (2001)). Також, інші численні дослідження документально підтверджують широку корисність для здоров’я, що надається вживанням омега3 та/або омега-6 PUFA проти різноманітних симптомів та хвороб (наприклад, астма, псоріаз, екзема, діабет, рак). Досліджується ряд різноманітних хазяїв, включаючи рослини, водорості, гриби та дріжджі, як засобів для комерційного виробництва PUFA. Генна інженерія продемонструвала, що природні можливості деяких хазяїв (навіть таких, в яких вроджено обмежений синтез LA та ALA жирних кислот) можуть бути істотно змінені для одержання високих рівнів продукування різних довголанцюгових омега-3/омега-6 PUFA. Чи то є результат природних можливостей, чи рекомбінантної технології, але продукування арахідонової кислоти (ARA; 20:4 омега-6), ейкозапентаєнової кислоти (EPA; 20:5 омега-3) та докозапентаєнової кислоти (DHA; 22:6 омега-3), можливо всіх, вимагає експресії дельта-5-десатурази. Більшість дельта-5-десатуразових ферментів, ідентифікованих на сьогодні, мають первинну здатність перетворювати дигомо-γ-ліноленову кислоту (DGLA; 20:3 омега-6) в ARA, з вторинною активністю до перетворення ейкозатетраєнової кислоти (ETA; 20:4 омега-3) в EPA (де DHA пізніше синтезується з EPA під час реакції з додатковою C20/22 елонгазою і дельта-4 десатуразою). Дельта-5-десатураза приймає участь як в дельта-6 десатураза/дельта-6 елонгаза метаболічному шляху (який в основному зустрічається у морських водоростях, мохах, грибах, нематодах і людях, і який характеризується виробництвом γ-лінолевої кислоти (GLA; 18:3 омега-6) та/або стеаридонової кислоти (STA; 18:4 омега-3)), так і в дельта-9 елонгаза/дельта-8 десатураза метаболічному шляху (який функціонує в деяких організмах, як наприклад, євгленові види і який характеризується виробництвом ейкозадієнової кислоти (EDA; 20:2 омега-6) та/або ейкозатрієнової кислоти (ETrA; 20:3 омега-3)) (Фігура 1). Базуючись на ролі, яку відіграють дельта-5-десатуразові ферменти в синтезі, наприклад, ARA, EPA та DHA, потрібні значні зусилля для ідентифікації та охарактеризування даних ферментів з різних джерел. Як такі, числені дельта-5-десатурази були розкриті як в доступній літературі (наприклад, GenBank Accession № AF199596, № AF226273, № AF320509, № AB072976, № AF489588, № AJ510244, № AF419297, № AF07879, № AF067654 та № AB022097), так і в патентній літературі (наприклад, патент США № 5 972 664 та 6 075 183). Також, попередня заявка № 60/801119 (зареєстрована 17 траня 2006), що знаходиться на розгляді і є спільною власністю, розкриває амінокислотні та нуклеїнокислотні послідовності для фермента дельта-5-десатурази з Peridium sp. CCMP626, що є спільною власністю, попередня заявка № 60/915733 (BB1614) (зареєстрована 3 траня 2007), що знаходиться на розгляді і є спільною власністю, розкриває амінокислотні та нуклеїнокислотні послідовності для фермента дельта-5десатурази з Euglena anabaena. Дана заявка стосується ідентифікації та виділення додаткових генів, що кодують дельта-5десатурази з Euglena gracilis, які були б придатними для геторологічної експресії в різноманітних організмах-хазяїнах для застосування у продукуванні омега-3/омега-6жирних кислот. СТИСЛИЙ ОПИС СУТІ ВИНАХОДУ Даний винахід стосується ізольованого полінуклеотиду, що містить: (a) нуклеотидну послідовність, яка кодує поліпептид, що має активність дельта-5десатурази, причому поліпептид має принаймні 70 %, 75 %, 80 %, 85 %, 90 %, 95 % або 100 % 1 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 ідентичність амінокислот, базуючись на способі вирівнювання Clustal W, у порівнянні з амінокислотною послідовністю, як показано в SEQ ID №:2; (b) нуклеотидну послідовність, яка кодує поліпептид, що має активність дельта-5десатурази, причому нуклеотид має принаймні 70 %, 75 %, 80 %, 85 %, 90 %, 95 % або 100 % ідентичність послідовності, базуючись на способі вирівнювання BLASTN, у порівнянні з нуклеотидною послідовністю, як показано в SEQ ID №:1 або SEQ ID №:3; (c) нуклеотидну послідовність, яка кодує поліпептид, що має активність дельта-5десатурази, причому нуклеотидна послідовність гібридизує в жорстких умовах до нуклеотидної послідовності, як показано в SEQ ID №:1 або SEQ ID №:3; або (d) комплемент нуклеотидної послідовності (a), (b) або (c), причому комплемент та нуклеотидна послідовність складаються з такої ж самої кількості нуклеотидів та є на 100 % комплементарними. В другому втіленні винахід стосується рекомбінантнго конструкту ДНК, що містить будь-який ізольований полінуклеотид згідно з даним винаходом, функціонально зв’язаний з принаймні однією регуляторною послідовністю. В третьому втіленні винахід стосується клітини, що містить в своєму геномі рекомбінантний конструкт ДНК згідно з даним винаходом. Такі клітини можуть бути клітинами рослин або клітинами дріжджів. В четвертому втіленні винахід стосується способу трансформування клітини, що включає трансформування клітини з рекомбінантним конструктом згідно з даним винаходом або ізольованим полінуклеотидом згідно з даним винаходом та відбір тих клітин, що трансформувались з рекомбінантним конструктом або ізольованим полінуклеотидом. В п’ятому втіленні винахід стосується трансгенного насіння, що містить в своєму геномі рекомбінантний конструкт згідно з даним винаходом, або трансгенне насіння, отримане з рослини, одержаної за допомогою способу згідно з даним винаходом. Також становить інтерес олія або побічні продукти, отримані з такого трансгенного насіння. В шостому втіленні винахід стосується способу продукування довголанцюгових поліненасичених жирних кислот в рослинній клітині, що включає: (a) трансформування клітини з рекомбінантним конструктом згідно з даним винаходом; та (b) відбір таких трансформованих клітин, що продукують довголанцюгові поліненасичені жирні кислоти. В сьомому втіленні винахід стосується способу продукування принаймні однієї поліненасиченої жирної кислоти в клітині насіння олійних рослин, що включає: (a) трансформування клітини олійної рослини з першим рекомбінантним конструктом ДНК, який містить ізольований полінуклеотид, що кодує принаймні один полінуклеотид дельта-5десатурази, функціонально зв’язаний з принаймні однією регуляторною послідовністю, та з принаймні одним додатковим рекомбінантним конструктом ДНК, який містить ізольований полінуклеотид, функціонально зв’язаний з принаймні однією регуляторною послідовністю, що кодує поліпептид, вибраний з групи, яка складається з дельта-4 десатурази, дельта-5десатурази, дельта-6 десатурази, дельта-8 десатурази, дельта-12 десатурази, дельта-15 десатурази, дельта-17 десатурази, дельта-9 десатурази, a дельта-9 елонгази, a C14/16 елонгази, C16/18 елонгази, a C18/20 елонгази та a C20/22 елонгази; (b) регенерування олійної рослини з трансформованої клітини в кроці (a); та (c) відбір насіння, що одержане з рослини згідно з кроком (b), яке має змінений рівень поліненасичених жирних кислот у порівнянні з їх рівнем в насінні, одержаному з трансформованої олійної рослини. У восьмому втіленні винахід стосується олійної рослини, що містить в своєму геномі рекомбінантний конструкт згідно з даним винаходом. Придатні олійні рослини включають сою, види Brassica, соняшник, кукурудзу, бавовник, льон та сафлору, але не обмежуються ними. У дев’ятому втіленні винахід стосується оліної рослини, що містить: (a) перший рекомбінантний конструкт ДНК, що містить ізольований полінуклеотид, який кодує принаймні один поліпептид дельта-5-десатурази, функціонально зв’язаний з принаймні однією регуляторною послідовністю; та (b) принаймні один додатковий рекомбінантний конструкт ДНК, що містить ізольований полінуклеотид, функціонально зв’язаний з принаймні однією регуляторною послідовністю, що кодує поліпептид, вибраний з групи, яка складається з дельта-4 десатурази, дельта-5десатурази, дельта-6 десатурази, дельта-8 десатурази, дельта-12 десатурази, дельта-15 десатурази, дельта-17 десатурази, дельта-9 десатурази, дельта-9 елонгази, C14/16 елонгази, C16/18 елонгази, C18 елонгази та C20/22 елонгази. 2 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 Також становить інтерес транс генне насіння, одержане з такийх олійних рослин, так само як і олія або побічні продукти, одержані з цього транс генного насіння. Переважним побічним продуктом є лецитин. В десятому втіленні винахід стосується харчових або кормових продуктів, що містять олію або насіння згідно з даним винаходом, або харчових чи кормових продуктів, що містять інгредієнти, отримані внаслідок обробки насіння. В десятому втіленні винахід стосується потомства рослин, одержаних з рослини, отриманої за допомогою способу згідно з даним винаходом, або з олійної рослини згідно з даним винаходом. КОРОТКИЙ ОПИС ФІГУР ТА ПЕРЕЛІКУ ПОСЛІДОВНОСТЕЙ Фігура 1 ілюструє шлях біосинтезу омега-3/омега-6 жирних кислот. Фігура 2 демонструє хроматограму ліпідного профілю клітинного екстракту Euglena gracilis, як описано в Прикладі 1. Фігура 3 демонструє частину вирівнювання між та серед дельта-5-десатуразних протеїнів та дельта-8 десатуразних протеїнів, використовуючи аналіз Clustal W (MegAlign(TM) program of DNASTAR software). Фігура 4 графічно репрезентує спорідненість між SEQ ID №№:1, 2, 4, 5, 6, 8 та 10, кожна з них стосується дельта-5-десатурази Euglena gracilis. Фігура 5A ілюструє стратегію клонування, використовувану для збільшення гену (EgD5) дельта-5-десатурази Euglena gracilis. Фігура 5B являє собою pZUF17плазмідну карту, в той час як Фігура 5C є pDMW367 плазмідною картою. Фігура 6 забезпечує плазмідну карту для таких об’єктів: (A) pKUNF12T6E; (B) pEgD5S; (C) pDMW369. Фігура 7 демонструє порівняння ДНК-послідовності гена дельта-5-десатурази Euglena gracilis (позначеної як "EgD5"; SEQ ID №:1) та синтетичного гену (позначеного як EgD5S"; SEQ ID №:3), кодон-оптимізованого для експресування в Yarrowia lipolytics. Фігура 8A та 8B демонструє Clustal V вирівнювання (з типовими параметрами) дельта-8 десатурази (SEQ ID №:18) Pavlova lutheri, дельта-8 десатурази (SEQ ID №:64) Pavlova salina, дельта-8 десатурази (SEQ ID №:16) Euglena gracilis та двох різних дельта-6 жирнокислотних десатураз (SEQ ID №№:51 та 63) Rhizopus stolonifer. Фігура 9 забезпечує плазмідну карту для pY98. Фігура 10A забезпечує жирно кислотні профілі для Yarrowia lipolyfica, що експересує pY98 (SEQ ID №.76; що містить ген дельта-5-десатурази Mortierella alpha, позначений як "MaD5") або pDMW367 (SEQ ID №:23; що містить ген дельта-5-десатурази Euglena gracilis, позначений як "EgD5") та різні абсорбовані субстрати. Фігура 10B забезпечує порівняння омега-3 та омега-6 субстратної специфічності MaD5 і EgD5. Фігура 11 забезпечує плазмідну карту для таких об’єктів: (A) pKR916; (B) PKR1037; (C) pKR328. Фігура 12A забезпечує середні жирнокислотні профілі для десяти подій, що мають найвищу активність дельта-5-десатурази, коли фермент (MaD5) Mortierella alpha трансформується в зародка сої. Фігура 12B забезпечує середні жирнокислотні профілі для десяти подій, що мають найвищу активність дельта-5-десатурази, коли фермент (EgD5) Euglena gracilis трансформується в зародках сої. Жирні кислоти ідентифіковані як 16:0 (пальмітат), 18:0 (стеаринова кислота), 18:1 (олеїнова кислота), LA, ALA, EDA, SCI, DGLA, ARA, ERA, JUP1 ETA та EPA. Жирні кислоти, перелічені як "інші", включають: 18:2 (5,9), GLA, STA, 20:0, 20:1(11), 20:2 (7,11) або 20:2 (8,11) та DPA. Кожна з цих "інших" жирних кислот присутня у кількості менше ніж 3, 0 % відносно загальної кількості жирних кислот. Жирнокислотні композиції для індивідуального зародку були виражені як відсоток (мас. %) маси загальних жирних кислот та середній жирнокислотний склад – як середня величина шести індивідуальних зародків для кожної події. Фігура 12B демонструє, що активність EgD5 в зародках сої є дуже високою з середньою конверсією (коректний % дельта-5 десатурази) від 77 % до 99% у верхній десятці подій. Фігура 13 забезпечує активність дельта-5-десатураза для "коректних" субстратів ("коректний % дельта-5 десатурази"), як накреслено на осі абсцис, у порівнянні з активністю дельта-5 3 UA 102668 C2 5 10 15 десатурази для "неправильних" субстратів ("неправильний % дельта-5 десатурази"), як накреслено на осі ординат для MaD5 (див. Фігуру 12A) та EgD5 (див. Фігуру 12B). Субстратна специфічність EgD5 має перевагу для "коректних" субстратів над "неправильними" субстратами у порівнянні з MaD5. Винахід можна більш повно зрозуміти з наступного детального опису та супроводжуючого опису послідовностей, які формують частину даної заявки. Наступні послідовності відповідають 37 C.F.R. §1.821-1.825 ("Requirements for Patent Applications Containing Nucleotide Sequences and/or Amino Acid Sequence Disclosures - the Sequence Rules"") та узгоджуються зі Стандартом ST.25 (1998) Всесвітньої Організації Інтелектуальної Власності (WIPO) та перелік послідовностей задовольняє вимоги ЄПВ та PCT (Rules 5.2 та 49.5(a-bis), та Section 208 та Annex C of the Administrative Instructions). Символи та формат, використані для нуклеотидних і амінокислотних послідовностей, відповідають вимогам, викладеним в 37 C.F.R. §1.822. SEQ ID №№:1-26, 48, 49, 51-54, 61-64, 67-72 та 75-76 являють собою ORF, що кодує гени або протеїни (або їх частину) або плазміди, як ідентифіковано в Таблиці 1. Таблиця 1 Перелік номерів нуклеїнокислотних та амінокислотних послідовностей Нуклеїнокислотна протеїнова EQ ID NO. SEQ ID NO. 2 1 (1350 bp) (449 AA) Опис та аббревіатура дельта-5 десатураза Euglena gracitis("EgD5") синтетична дельта-5 десатураза, одержана з Euglena gracilis, 3 (1350 bp) кодон-оптимізована для експресії в Yarrowia lipolytica ("EgD5S") Euglena gracilis EgD5—фрагмент PT-F10-1 4 (590 bp) Euglena gracilis EgD5 —фрагментpT-EgD5-5'C2 6 (797 bp) Euglena gracilis EgD5 —5' послідовність відносно SEQ ID NO:4 7 (559 bp) nd Euglena gracilis EgD5— фрагментpT-EgD5-5'2 8 (273 bp) Euglena gracilis EgD5~5' послідовність відносно SEQ ID NO:6 9 (20 bp) Euglena gracilis EgD5-фрагментpT-EgD5-3' 10 (728 bp) Euglena gracilis EgD5—3' послідовність відносно SEQ ID N0:4 11(464 bp) дельта-5 десатураза Pythium irregulare (GenBank Accession No. — AAL13311) дельта-5 десатураза Phytophthora megasperma (GenBank Accession No. CAD53323) дельта-5 десатураза Phaeodactylum tricornutum (GenBank Accession No. AAL92562) дельта-5 десатураза Dictyostelium discoideum (GenBank Accession No. XP_640331) дельта-8 десатураза Euglena gracilis (публікація WO 2006/012325 та WO 2006/012326) дельта-8 десатураза Pavlova lutheri (CCMP459) 17 (1269 bp) Консервативна ділянка 1 — Консервативна ділянка 2 — дельта-8 сфінголіпідна десатураза Thalassiosira pseudonana (GenBank Accession No. AAX14502) Плазміда pZUF17 22 (8165 bp) Плазміда pDMW367 23 (8438 bp) Плазміда pKUNF12T6E 24 (12,649 bp) синтетичний ген C18/20 елонгази, одержаний з Thraustochytrium aureum (US 6,677,145), кодон-оптимізований для експресії 25 (819 bp) Yarmwia lipolytica ("EL2S") Плазміда pEgD5S 48 (4070 bp) Плазміда pDMW369 49 (8438 bp) stolonifer дельта-6 жирнокислотна десатураза Rhizopus (NCBI Accession No. AAX22052) дельта-8 десатураза Pavlova lutheri –частина кДНК, взята з клону 52 (695 bp) 4 2 (449 AA) 5 (196 AA) — — — -— 12 (456 AA) 13 (477 AA) 14 (469 AA) 15 (467 AA) 16 (421 AA) 18 (423 AA) 19 (7AA) 20 (7AA) 21 (476 AA) •— — — 26 (272 AA) — *•51 (459 AA) UA 102668 C2 eps1c.pk002.f22 (5' кінець інсерта кДНК) insert) Pavlova lutheri дельта-8 десатураза—fully секвенована EST eps1c.pk002.f22:fis (повноінсертна послідовність) дельта-8 десатураза Pavlova lutheri — трансляція нуклеотидів 1864 повної послідовності EST eps1c.pkOO2.f22:fis (повноінсертна послідовність; SEQ ID NO:53) дельта-8 десатураза Pavlova lutheri повна 5' кінцева послідовність з «геномної прогулянки» дельта-8 десатураза Pavlova lutheri — загальна послідовність дельта-6 жирнокислотна десатураза Rhizopus stolonifer (NCBI Accession No. ABB96724) дельта-8 десатураза Pavlova salina дельта-5 десатураза Mortierella alpina Плазміда pY5-22 Плазміда pY5-22GPD гліцеральдегід-3-фосфатдегідрогеназний промотор Yarmwia lipolytica (GPD) Плазміда pYZDE2-S Плазміда pKR136 Плазміда pY98 дельта-9 елонгаза Euglena gracilis ("EgD9e") Euglena gracilis дельта-8 десатураза ("EgDS") Плазміда pKR906 Плазміда pKR72 Плазміда pKS102 Плазміда pKR197 Плазміда pKR911 Плазміда pKR680 Плазміда pKR913 Плазміда pKR767 Плазміда pKR916 Плазміда pKR974 Плазміда pKR1032 Плазміда pKR 1037 Плазміда pKR328 Saprolegnia diclina дельта-5 десатураза ("SdD5") 5 10 15 20 53 (1106 bp) — 54 (287 AA) 61 (1294 bp) 62 (1927 bp) — 63 (459 AA) -67 (1338 bp) 69 (6473 bp) 70 (6970 bp) 64 (427 AA) 68 (446 AA) — — 71 (968 bp) 72 (8630 bp) 75 (6339 bp) 76 (8319 bp) 77 (774 bp) 78 (1263 bp) 81 (4311 bp) 82 (7085 bp) 83 (2540 bp) 84 (4359 bp) 85 (5147 bp) 86 (6559 bp) 87 (9014 bp) 88 (5561 bp) 89 (11,889 bp) 90 (5661 bp) 91 (5578 bp) 92 (11,907 bp) 93 (8671 bp) 94 (1413 bp) — — -— — — — — — -— — — — SEQ ID №№:27-30 відповідає праймеру 5-1A, 5-1 B, 5-1 C та 5-1D, відповідно, що кодує консервативну ділянку 1. SEQ ID №№:31-34 відповідає відповідає виродженим олігонуклеотидним праймерам 5-5AR, 5-5BR, 5-5CR, 5-5DR, відповідно, що кодують консервативну ділянку 2. SEQ ID №№:35-40 відповідає праймерам ODMW480, праймер CDSIII, ODMW479, DNR CDS 5’, YL791 та YL792, відповідно, використаних для 5’ RACE. SEQ ID №№:41-43 відповідає праймерам ODMW469, AUAP та ODMW470, відповідно, використаних для 3' RACE. SEQ ID №№:44-47 відповідає праймерам YL794, YL797, YL796 таYL795, відповідно, використаних для ампліфікації повноланцюгової кДНК EgD5. SEQ ID №:50 відповідає праймеру T7, використаному для секвенування кДНК бібліотеки Pavlova lutheri (CCMP459). SEQ ID №№:55 та 56 відповідає праймерам SeqE та SeqW, відповідно, використаним для секвенування клонів Pavlova lutheri (CCMP459). SEQ ID №№:57 та 58 відповідає універсальному праймеру AP1 та праймеру GSP PvDES1 відповідно, використаним для ампліфікації геномної ДНК Pavlova lutheri (CCMP459). SEQ ID №№:59 та 60 відповідає праймерам M13-28Rev та PavDES seq, відповідно, використаним для секвенування геномних інсертів Pavlova lutheri (CCMP459). SEQ ID №№:65 та 66 відповідає праймеру АР та олігануклеотидному праймеру Smart IV, відповідно, використаними для синтезу кДНК Euglena gracilis . SEQ ID №№:73 та 74 є праймерами GPD-смисловим та GPD-антисмисловим, відповідно, використовуваним для ампліфікації промотора GPD. 5 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 SEQ ID №№:79 та 80 відповідає праймерам oEugEL1-1 та oEugEL1-2, відповідно, використаними для ампліфікації дельта-9 елонгази (EgD9e) Euglena gracilis. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Усі патенти, патентні заявки та публікації, процитовані в даному описі, включені як посилання в повному обсязі. Особливо вони включають наступні заявки, що знаходяться на розгляді і є спільною власністю заявника і правонаступника: Патент США 7 125 672, Патент США 7 189 559, Патент США 7 192 762, Патент США 7 198 937, Патент США 7 202 356, Патентні заявки США № 10/840579 та № 10/840325 (зареєстровані 6 травня 2004), Патентна заявка США № 10/869630 (зареєстрована 16 червня 2004), Патентна заявка США № 10/882760 (зареєстрована 1 липня 2004), Патентні заявки США № 10/985254 та № 10/985691 (зареєстровані 10 листопада 2004), Патентна заявка США № 11/024544 (зареєстровані 29 грудня 2004), Патентна заявка США № 11/166993 (зареєстрована 24 червня 2005), Патентна заявка США № 11/183664 (зареєстрована 18 липня 2005), Патентна заявка США № 11/185301 (зареєстрована 20 липня 2005), Патентна заявка США № 11/190750 (зареєстрована 27 липня 2005), Патентна заявка США № 11/198975 (зареєстрована 8 серпня 2005), Патентна заявка США № 11/225354 (зареєстрована 13 вересня 2005), Патентна заявка США № 11/253882 (зареєстрован 19 жовтня 2005), Патентні заявки США № 11/264784 та № 11/264737 (зареєстровані 1 листопада 2005), Патентна заявка США № 11/265761 (зареєстрована 2 жовтня 2005), Патентна заявка США № 11/737,772 (зареєстрована 20 квітня 2007), Патентна заявка США № 11/787,772 (зареєстрована 17 квітня 2007), Патентна заявка США № 11/740,298 (зареєстрована 26 квітня 2007), Патентні заявки США № 60/801172 та № 60/801119 (зареєстровані 17 травня 2006), Патентна заявка США № 60/853563 (зареєстрована 23 жовтня 2006), Патентна заявка США № 60/855177 (зареєстрована 30 жовтня 2006), Патентні заявки США № 11/601563 та № 11/601564 (зареєстровані 16 листопада 2006), Патентна заявка США № 11/635258 (зареєстрована 7 грудня 2006), Патентна заявка США № 11/613420 (зареєстрована 20 грудня 2006), Патентна заявка США № 60/909790 (зареєстрована 3 кітня 2007), Патентна заявка США № 60/911925 (зареєстрована 16 квітня 2007), Патентна заявка США № 60/910831 (зареєстрована 10 квітня 2007) та Патентна заявка США № 60/915733 (BB1614) (зареєстрована 3 травня 2007). Вони додатково включають наступні заявки, що є спільною власністю заявника і правонаступника: публікація Патенту США № 2005/0136519, що стосується продукування PUFA в рослинах; та, Патент США № 7,129,089, що стосується анексинових промоторів та їх застосування в експресуванні трансгенів в рослинах. Як використано в даній заявці та в прикладеній формулі, форми однини включають множинні посилання, якщо тільки контекст ясно не вказує на інше. Таким чином, наприклад, посилання на "рослину" включає множину таких рослин, посилання на "клітину" включає одну або більше клітин та їх еквівалентів, відомих спеціалісту в даній галузі, і так далі. Згідно з об’єктом винаходу, заявники ідентифікували новий фермент дельта-5-десатурази Euglena gracilis та ген, що його кодує, що може бути використано для маніпулювання біохімічними шляхами для продукування корисних для здоров’я. Таким чином, об’єкт винаходу виявляє багато застосувань. PUFA або його похідні, отримані за допомогою способу, розкритого в даній заявці, можуть бути використані як дієтичні замінники або добавки, особливо дитячого харчування, для пацієнтів, що отримують внутрішньовенне харчування або для попереджуючого або лікувального схуднення. Альтернативно, очищена PUFA (або її похідні) можуть бути включені до складу кулінарних олій, жирів або маргаринів, зформованих таким чином, що при нормальному використанні одержувач отримав би бажану кількість для дієтичного доповнення. PUFA також може бути включена до складу дитячого харчування, нутрицевтичних добавок або інших харчових продуктів та може знайти використання як протизапальний або знижуючий рівень холестеролу агент. Необов’язково, композиції можуть бути використані для фармацевтичних цілей (для людини або ветеринарії). Збагачення людей і тварин поліненасиченими жирними кислотами, отриманими шляхом рекомбінантних засобів, може призвести до підвищених рівнів як PUFA1, так і їх метаболічного потомства. Наприклад, лікування ейкозапентаєновою кислотою (EPA) може призвести не лише до підвищених рівнів EPA, але також її низхідних продуктів, таких як ейкозаноїди (тобто, простагландинів, лейкотрієнів, тромбоксанів). Складні регуляторні механізми можуть зробити це бажаним для того, щоб комбінувати різноманітні PUFA, або для того, щоб додавати різні коньюгати PUFA з метою попередження, контролювання або подолання таких механізмів для досягнення бажаних рівнів специфічної PUFA у окремого представника. Визначення 6 UA 102668 C2 5 10 15 20 25 30 35 В цьому описі використовується багато термінів та аббревіатур. Передбачені такі визначення. "Відкрита рамка зчитування" має аббревіатуру ORF. "Полімеразна ланцюгова реакція" має аббревіатуру PCR. "Американська колекція типових культур" має аббревіатуру ATCC. "Поліненасичена жирна кислота(и)" має аббревіатуру PUFA(s). "Триацилгліцероли" мають аббревіатуру TAG. Термін "винахід" або "даний винахід", як використано в даній заявці, не обмежується якимнебуть одним специфічним втіленням згідно з даним винаходом, але в цілому стосується будьякого та всіх втілень згідно з даним винаходом, як описано у формулі та описі винаходу. Термін "жирні кислоти" відноситься до довголанцюгових аліфатичних кислот (алканових кислот) з різною довжиною ланцюга, від, приблизно, C12 до C22 (хоча відомі як довші, так і коротші кислотні ланцюги). Домінуючі ланцюгові довжини знаходяться між C16 та C22. Структура жирної кислоти представлена простою системою позначень "X:Y", де X – це повна кількість вуглецевих (C) атомів в конкретній жирній кислоті та Y – кількість подвійних зв’язків. Додаткові деталі з приводу диференціювання між "насиченими жирними кислотами" у порівнянні з "ненасиченими жирними кислотами", "мононенасиченими жирними кислотами" у порівнянні з "поліненасиченими жирними кислотами" (або "PUFA"), та "омега-6 жирними кислотами" (омега-6 або n-6) у порівнянні з "омега-3 жирними кислотами" (омега-3 або n-3) надані в патентній публікації США № 2005/0136519. Жирні кислоти описані в даній заявці простою системою позначень "X:Y", де X – це повна кількість вуглецевих (C) атомів в конкретній жирній кислоті та Y – кількість подвійних зв’язків. Цифра, що стоїть за позначенням жирної кислоти, вказує на положення подвійного зв’язку відносно карбоксильного кінця жирної кислоти з афіксом "c" для c/s-конфігурації подвійного зв’язку (наприклад, пальмітинова кислота (16:0), старинова кислота (18:0), олеїнова кислота (18:1, 9c), петроселінова кислота (18:1, 6c), LA (18:2, 9c,12c), GLA (18:3, 6c,9c,12c) та ALA (18:3, 9c,12c,15c)). Якщо з цього приводу не має інших вказівок, то 18:1, 18:2 та 18:3 відноситься до олеїнової, LA та ALA жирних кислот, відповідно. Якщо навіть спеціально не зазначене протилежне, то мається на увазі, що подвійні зв’язки знаходяться в цис-конфігурації. Наприклад, мається на увазі, що подвійні зв’язки в 18:2 (9,12) знаходяться в цис-конфігурації. Номенклатура, використана для позначення PUFA в даному описі, показана нижче в Таблиці 2. в колонці, названій "Скорочене позначення", омега-система відліку використана для позначення кількості вуглецевих атомів, кількості подвійних зв’язків та положення подвійного зв’язку біля омега-вуглецю, починаючи відлік від омега-вуглецю (який пронумерований як 1 для цієї мети). Решта Таблиці підсумовує звичайні назви омега-3 та омега-6 жирних кислот та їх прекурсорів, аббревіатури, що будуть використовуватись в описі, та хімічні назви кожної сполуки. Таблиця 2 Номенклатура поліненасичених жирних кислот та прекурсорів Загальна назва міристинова пальмітинова пальмітолеїнова стеаринова олеїнова лінолева γ- лінолева ейкозадієнова дигомо-γ- лінолева арахідонова α-ліноленова стеаринова ейкозатрієнова сціадонова юніперонова ейкозатетраєнова аббревіатура — пальмітат — — — LA GLA EDA DGLA ARA ALA STA ETrA or ERA SCI JUP ETA Хімічна назва тетрадеканова гексадеканова 9-гексадеканова октадеканова c/s-9- октадеканова c/s-9, 12-октадекадієноваc c/s-6, 9, 12-октадекатрієнова c/s-11, 14-ейкозадієнова c/s-8, 11, 14-ейкозатрієнова cis-5, 8, 11, 14-ейкозатетраєнова c/s-9, 12, 15-остадекатрієнова c/s-6, 9, 12, 15-октадекатетраєнова c/s-11, 14, 17-ейкозатрієнова c/s-5,11,14-ейкозатрієнова c/s-5,11,14,17-ейкозатетраєнова c/s-8, 11, 14, 17-ейкозатетраєнова 7 Скорочене позначення 14:0 16:0 16:1 18:0 18:1 18:2 омега-6 18:3 омега-6 20:2 омега-6 20:3 омега-6 20:4 омега-6 18:3 омега-3 18:4 омега-3 20:3 омега-3 20:3b омега-6 20:4b омега-3 20:4 омега-3 UA 102668 C2 Продовження таблиці 2 ейкозапентаєнова докозапентаїнова 10 15 20 25 30 35 40 45 50 DPA докозагексаєнова 5 EPA DHA c/s-5, 8, 11, 14, 17ейкозапентаєнова c/s-7, 10, 13, 16, 19докозапентаїнова c/s-4, 7, 10, 13, 16, 19докозагексаєнова 20:5 омега-3 22:5 омега-3 22:6 омега-3 Терміни "триацилгліцерол", "олія" та "TAG" відносяться до нейтральних ліпідів, що складаються з трьох жирнокислотних залишків, естерифікованих до молекули гліцеролу (і такі терміни використовуватимуться рівнозначно всюди в даному описі). Такі жири можуть містити довголанцюгові PUFA, а також коротші насичені та ненасичені жирні кислоти і насичені жирні кислоти з довшим ланцюгом. Таким чином, "біосинтез жирів" в загальному відноситься до синтезів TAG в клітині. "Відсоток (%) PUFA в загальній ліпідній фракції та фракції жирів" означає відсоток PUFA відносно загальних жирних кислот в таких фракціях. Термін "загальна ліпідна фракція" або "ліпідна фракція" означає суму усіх ліпідів (тобто, нейтральних і полярних) в жирах організму, в тому числі тих ліпідів, що знаходяться у фосфатидилхоліновій фракції (PC), фомфатидилетаноламіновій фракції (PE) та триацилгліцерольній фракції (TAG або олія). Проте, терміни "ліпід" та "олія" будуть використовуватиметься в описі рівнозначно. Метаболічний шлях або біосинтетичний шлях метаболізму в біохімічному сенсі можуть бути розцінені як серії хімічних реакцій, що зустрічаються в клітині, обидва каталізуються ферментами для того, щоб досягти утворення метаболічного продукту, який використовується або зберігається клітиною або ініціює інший метаболічний шлях (потім названий кроком, що генерує перенос). Багато з цих шляхів детально розроблені та крок за кроком залучають модифікування вихідної субстанції з метою її формування в продукт, що має бажану хімічну структуру. Термін "біосинтетичний шлях метаболізму PUFA" відноситься до метаболічного процесу, який перетворює олеїнову кислоту в LA, EDA, GLA1 DGLA1 ARA, ALA, STA, ETrA, ETA1 EPA, DPA та DHA. Цей процес добре описаний в літературі (наприклад, див. публікацію міжнародної заявки WO 2006/052870). Коротко, цей процес включає елонгацію вуглецевого ланцюга шляхом додавання атомів вуглецю та десатурацію молекули шляхом додавання подвійних зв’язків за допомогою ряду спеціальних десутараційних та елонгаційних ферментів (тобто, "ферментів біосинтетичного шляху метаболізму PUFA"), присутніх в мембрані ендоплазматичного ретикулюму. Зокрема, "ферменти біосинтетичного шляху метаболізму PUFA" означають будьякий з наступних ферментів (і гени, що кодують вказані ферменти), пов’язаних з біосинтезом PUFA, включаючи: дельта-4 десатуразу, дельта-5-десатуразу, дельта-6 десатуразу, дельта-12 десатуразу, дельта-15 десатуразу, дельта-17 десатуразу, дельта-9 десатуразу, дельта-8 десатуразу, дельта-9 елонгазу, C14/16 елонгазу, C16/18 елонгазу, C18/20 елонгазу та/або C20/22 елонгазу. Подходящие условия Термін "біосинтетичний шлях метаболізму омега-3/омега-6 жирних кислот" відноситься до набору генів, які у вибадку експресування у відповідних умовах кодують ферменти, що каталізують продукування будь-якої з двох або абидві омега-3 та омега-6 жирні кислоти. Типово, гени, залучені в біосинтетичний шлях метаболізму омега-3/омега-6 жирних кислот, кодують ферменти біосинтетичного шляху метаболізму PUFA. На Фігурі 1 проілюстрований репрезентативний шлях, який забезпечує перетворення міристимової кислоти в DHA через різноманітні проміжні сполуки, що демонструє яким чином і омега-3 жирні кислоти, і омега-6 жирні кислоти можуть бути одержані із спільного джерела. Як і слід було очікувати, метаболічний шлях ділиться на дві частини, де перша частина веде до утворення омега-3 жирних кислот, а друга – тільки омега-6 жирних кислоти. Та частина, в якій утворюються омега-3 жирні кислоти, в даному описі буде вказана як біосинтетичний шлях метаболізму омега-3 жирних кислот, беручи до уваги той факт, що в іншій частині утворюються лише омега-6 жирні кислоти, то вона в даному описі буде вказана як біосинтетичний шлях метаболізму омега-6 жирних кислот. Термін "функціональний", як його використано в даній заявці в контексті біосинтетичного шляху метаболізму омега-3/омега-6 жирних кислот , означає, що деякі (або усі) гени в шляху експресують активні ферменти, отримувані in vivo каталізом або субстратною конверсією. Зрозуміло, що "біосинтетичний шлях метаболізму омега-3/омега-6 жирних кислот" або "функціональний біосинтетичний шлях метаболізму омега-3/омега-6 жирних кислот" не має на 8 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 увазі те, що необхідними є всі гени, перелічені у вищевикладеному параграфі, оскільки ряд жирнокислотних продуктів потребуватиме експресії лише субпопуляції генів даного метаболічного шляху. Термін "метаболічний шлях дельта-6 десатураза/дельта-6 елонгаза" буде відноситись до біосинтетичного шляху метаболізму PUFA, що, як мінімум, включає принаймні одну дельта-6 десатуразу та принаймні одну C18/20 елонгазу, таким чином надаючи можливість біосинтезу DGLA та/або ETA з LA та ALA, відповідно, з GLA та/або STA як проміжних жирних кислот. З експресією інших десатураз та елонгаз можуть також бути синтезовані ARA, EPA1 DPA та DHA. Термін "метаболічний шлях дельта-9 елонгаза/дельта-8 десатураза" буде відноситись до біосинтетичного шляху метаболізму PUFA, що, як мінімум, включає принаймні одну дельта-9 елонгазу та принаймні одну дельта-8 десатуразу, таким чином надаючи можливість біосинтезу DGLA та/або ETA з LA та ALA, відповідно, з EDA та/або ETrA як проміжних жирних кислот. З експресією інших десатураз та елонгаз можуть також бути синтезовані ARA, EPA, DPA та DHA. Термін "проміжні жирні кислоти" відноситься до будь-якої жирної кислоти, одержаної в метаболічному шляху жирних кислот, що в подальшому можуть бути перетворені в намічений жирнокислотний продукт в цьому шляху завдяки дії інших ферментів метаболічного шляху. Наприклад, коли EPA продукується, використовуючи шлях дельта-9 елонгаза/дельта-8 десатураза, то можуть бути отримані EDA, ETrA, DGLA, ETA і ARA та розглядатись як "проміжні жирні кислоти", оскільки ці жирні кислоти в подальшому можуть бути конвертовані в EPA через дію інших ферментів метаболічного шляху. Термін "жирнокислотний побічний продукт" відноситься до будь-якої жирної кислоти, отриманої в метаболічному шляху жирних кислот, що не є ані наміченим жирнокислотним продуктом метаболічного шляху, ані "проміжними жирними кислотами" метаболічного шляху. Наприклад, коли отримують EPA, використовуючи метаболічний шлях дельта-9 елонгаза/дельта-8 десатураза, сціадонова кислота (SCl) та юніперова кислота (JUP) також можуть бути утворені дією дельта-5-десатурази на EDA або ETrA, відповідно. Вважається, що вони є " побічним жирнокислотним продуктом", так як ніколи в подальшому не можуть бути перетворені в EPA дією інших ферментів метаболічного шляху. Термін "десатураза" відноситься до поліпептиду, що може зменшити насиченість, тобто, ввести подвійний зв’язок в одну або більше жирних кислот для того, щоб одержати представляючі інтерес жирну кислоту або прекурсор. Не дивлячись на використання омегасистеми відліку в усьому описі, для посилання на специфічні жирні кислоти зручнішим є вказувати активність десатурази шляхом відліку від карбоксильного кінця субстрату, використовуючи дельта-систему. Особливий інтерес в даному описі представляють дельта-5 десатурази, які каталізують перетворення DGLA в ARA та/або ETA в EPA. Інші десатурази включають: 1.) дельта-17 десатурази, які десатурують жирні кислоти між 17 та 18 атомами вуглецю, рахуючи від карбоксильного кінця молекули, та які, наприклад, каталізують перетворення ARA в EPA та/або DGLA в ETA; 2.) дельта-6 десатурази, що каталізують перетворення LA в GLA та/або ALA в STA; 3.) дельта-12 десатурази, що каталізують перетворення олеїнової кислоти в LA; 4.) дельта-15 десатурази, що каталізують перетворення LA в ALA та/або GLA в STA; 5.) дельта-4 десатурази, що каталізують перетворення DPA в DHA; 6.) дельта-8 десатурази, що каталізують перетворення EDA в DGLA та/або ETrA в ETA; та 7.) дельта-9 десатурази, що каталізують перетворення пальмітинової в пальмітоолеїнової кислоту (16:1) та/або стеаринової в олеїнову кислоту. В рівні техніки дельта-15 та дельта-17 десатурази також інколи відносять до "омега-3 десатураз", "w-3 десатураз" та/або "омега-3 десатураз", базуючись на їх здатності перетворювати омега-6 жирні кислоти в їх омега-3 аналоги (наприклад, перетворення LA в ALA та ARA в EPA1 відповідно). В деяких втіленнях найбільш бажаним є визначення дослідним шляхом специфічності окремої жирнокислотної десатурази трансформуванням придатного хазяїна геном для жирнокислотної десатурази та визначення її дії на жирно кислотний профіль хазяїна. Термін "дельта-5-десатураза" відноситься до ферменту, який десатурує жирну кислоту між п’ятим та шостим атомами вуглецю, рахуючи від карбоксильного кінця молекули. Переважно, дельта-5-десатураза перетворює дигомо-гама-ліноленову кислоту [20:3, DGLA] в арахідонову кислоту [20:4, ARA] або перетворює ейкозатетраєнову кислоту [20:4, ETA] в ейкозапентаєнову кислоту [20:5, EPA]. Для цілей даної заявки термін "EgD5" відноситься до дельта-5-десатуразного ферменту (SEQ ID №:2), ізольованого з Euglena gracilis, закодованого в даному описі SEQ ID №:1. Подібним чином термін "EgD5S" відноситься до синтетичної дельта-5-десатурази, одержаної з Euglena gracilis, яка є кодон-оптимізованою для експресування в Yarrowia lipolytica (тобто, SEQ ID №№:3 та 2). 9 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 Терміни "ефективність перетворення" та "відсоток субстратного перетворення" відносяться до ефективності, з якою конкретний фермент (наприклад, десатураза) може перетворити субстрат в продукт. Ефективність перетворення вимірюють за такою формулою: ([продукт]/[субстрат + продукт])*100, де продукт включає безпосередній продукт та всі продукти, отримані з нього в метаболічному шляху. Термін "елонгаза" відноситься до пептиду, що може елонгувати (подовжити) вуглецевий ланцюг з одержанням кислоти, на 2 атоми вуглецю довшої ніж жирнокислотний субстрат, на який діє елонгаза. Цей процес елонгації зустрічається в багатокроковому механізмі у зв’язку з синтезом жирних кислот, як описано в публікації Патенту США № 2005/0132442. Прикладами реакцій, що каталізуються елонгазними системами, є перетворення GLA в DGLA, STA в ETA та EPA в DPA. Як правило, субстратна селективність елонгаз до деякої міри є широкою, але сегрегованою довжиною обох ланцюгів, ступенем та типом ненасиченості. Наприклад, C14/16 елонгаза буде утилізувати C14 субстрат (наприклад, міристинову кислоту), C16/18 елонгаза буде утилізувати C16 субстрат (наприклад, пальмітат), C18/20 елонгаза (також відома як дельта-6 елонгаза, можуть бути використані як взаємозаміняючі терміни) буде утилізувати C18 субстрат (наприклад, GLA, STA) та C20/22 елонгаза буде утилізувати C20 субстрат (наприклад, EPA). Подібним чином дельта-9 елонгаза є здатною каталізувати перетворення LA та ALA в EDA та ETrA, відповідно. Важливо відмітите те, що деякі елонгази володіють широкою специфічністю і, таким чином, окремий фермент може бути здатним до каталізування декількох реакцій елонгації (наприклад, таким чином діють як C16/18 елонгаза, так і C18/20 елонгаза). Термін "олійні" відноситься до тих організмів, що намагаються накопичити джерело своєї nd енергії в формі ліпідів (Weete, In: Fungal Lipid Biochemistry, 2 Ed., Plenum, 1980). Термін "олійні дріжджі" відноситься до тих мікроорганізмів, закласифікованих як дріжджі, що можуть продукувати жирові речовини. Як правило, вміст клітинного жиру або TAG олійних мікроорганізмів відповідає сигмовидній кривій, де концентрація ліпідів росте доки не досягне максимуму на пізній логарифмічній фазі або ранній стаціонарній фазі росту, а потім поступово знижується протягом пізньої стаціонарної фази та фази відмирання (Yongmanitchai та Ward, Appl. Environ. Microbiol., 57:419-25 (1991)). Це не є незвичним для жирових мікроорганізмів накопичувати в надлишку, приблизно, 25 % їх сухої маси у вигляді жирів. Приклади олійних дріжджів включають такі роди: Yarrowia, Candida, Rhodotorula, Rhodosporidium, Cryptococcus, Trichosporon та Lipomyces, але не обмежуються переліченими. Термін "Euglenophyceae" відноситься до групи одноклітинних безбарвних або фотосинтезуючих джгутикових ("євгленоїди"), що живуть в прісному, морському, грунтовому та паразитичному навколишньому середовищі. Клас характеризується осібними одноклітинними, де найбільшими є вільно плаваючі і з двома джгутиками (один з яких може бути неемергентним), що виникають з передньої інвагінації, відомої як резервуар. Фотосинтезуючі євгленоїди містять один або більше хлоропластів, які змінюються від дрібних дисків до розширених пластин або стрічок. Безбарвні євгленоїди залажать від осмотрофії або фаготрофії для асимілювання поживних речовин. Біля 1000 видів було описано і закласифіковано в, приблизно, 40 родів та 6 порядків. Приклади Euglenophyceae включають такі роди: Euglena, Eutreptiella та Tetruetreptia, але не обмежуються переліченими. Термін "консервативне амінокислотне заміщення" відноситься до заміщення амінокислотного залишку в заданому протеїні іншою амінокислотою без зміни функціональної або хімічної природи вказаного протеїну. Наприклад, з рівня техніки добре відомо, що звичайними є зміни в гені, які приводять до продукування хімічно еквівалентної амінокислоти в заданому сайті (але не впливають на структурні та функціональні властивості закодованого, згорнутого протеїну). Для цілей даного винаходу "консервативні амінокислотні заміщення" визначені як зміни в межах однієї з наступниї п’яти груп: 1. малі аліфатичні, неполярні або sслабкополярні залишки: Ala [A], Ser [S], Thr [T], (Pro [P], GIy [G]); 2. полярні, негативно заряджені залишки та їх аміди: Asp [D]1 Asn [N], GIu [E], GIn [Q]; 3. полярні, позитивно заряджені залишки: His [H], Arg [R], Lys [K]; 4. великі аліфатичні, неполярні залишки: Met [M], Leu [L], lie [I], VaI [V] (Cys [C]); і 5. великі ароматичні залишки: Phe [F], Tyr [Y], Trp [W]. Консервативні амінокислотні заміщення в основному підтримують: 1) структуру поліпептидного кістяка в ділянці заміщення; 2) заряд або гідрофобність молекули в сайті-мішені або 3) основну масу бічних ланцюгів. Додатково, в багатьох випадках для зміни активності протеїну не будуть очікуватись зміни N-термінальної та C-термінальної частин молекули протеїну. 10 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як використано в даній заявці, "нуклеїнова кислота" означає полінуклеотид та включає одно- та двоспіральний полімер дезоксирибонуклеїнової основи чи рибонуклеїнової основи. Нуклеїнові кислоти можуть також включати фрагменти та модифіковані нуклеотиди. Таким чином, терміни "полінуклеотид", "нуклеїнокислотна послідовність", "нуклеотидна послідовність" або "фрагмент нуклеїнової кислоти" використовуються як взаємозаміняючі та є полімерами РНК або ДНК,що є одно- або двоспіральними, необов’язково містять синтетичні, неприродні або змінені нуклеотидні основи. Нуклеотиди (зазвичай знаходяться в 5’-монофосфатній формі) вказуються наступними однобуквенними позначеннями: "A" для аденілату або дезоксіаденілату (для РНК або ДНК, відповідно), "C" для цитиділату або дезоксицитиділату, "G" для гуанілату або дезоксигуанілату, "U" для уридилату, "T" для дезокитимиділату, "R" для пуринів (A або G), "Y" для піримідинів (C або T), "K" для G або T, "H" для A або C, або T, "I" для інозину та "N" для будь-якого нуклеотиду. Терміни "підфрагмент, що є функціонально еквівалентним" та "функціонально еквівалентний підфрагмент" в даному описі використовуються рівнозначно. Вказані терміни відносяться до частини або підпослідовності ізольованого фрагменту нуклеїнової кислоти, в якому збережена можливість зміни генної експресії або продукування певного фенотипу, в будьякому випадку, до фрагменту або підпослідовності, що кодує активні ферменти. Наприклад, фрагмент або підфрагмент може бути використаний в структурі химерного гену, щоб продукувати бажаний фенотип в трансформованій рослині. Химерні гени можуть бути спроектовані для використання в супресії шляхом зв’язування фрагменту нуклеїнової кислоти або його підфрагменту, в будь-якому випадку, він кодує активний фермент, в смисловій або антисмисловій орієнтації відносно рослинної промоторної послідовності. Термін "консервативна ділянка" або "мотив" означає набір амінокислот, що зберігся в специфічних положеннях вздовж вирівняної послідовності еволюційно споріднених протеїнів. Не дивлячись на те, що амінокислоти в інших положеннях можуть змінюватися серед гомологічних протеїнів, амінокислоти, що є висококонсервативними в специфічних положеннях, означачають такі амінокислоти, які є незамінними в структурі, стабільності чи активності протеїну. Оскільки вони ідентифікуються за їх високим ступенем консервативності у вирівняних послідовностях сімейства протеїнових гомологів, вони можуть бути використані як ідентифікатори або "характерні ознаки" для того, щоб визначити, чи належить протеїн з недавно визначеною послідовністю до попередньо ідентифікованого протеїнового сімейства. Терміни "гомологи", "гомологічний", "по суті подібні" та "по суті споріднені" в даному описі використовуються рівнозначно. Вони відносяться до фрагментів нуклеїнових кислот, де зміни в одній або більше нуклеотидних основах не впливають на здатність фрагмента нуклеїнової кислоти медіювати генну експресію або продукування певного фенотипу. Ці терміни також відносяться до модифікацій фрагментів нукленових кислот згідно з даним винаходом, таких як делеції або вставки одного або більше нуклеотидів, що по суті не змінюють функціональні властивості одержаного фрагменту нуклеїнової кислоти відносно вихідного немодифікованого фрагменту. Зрозуміло, що спеціаліст в даній галузі прийме до уваги, що винахід охоплює не тільки специфічні ілюстративні послідовності. Крім того, кваліфікований спеціаліст визнає, що суттєво подібні послідовності нуклеїнових кислот, охоплених даним винаходом, також визначаються за їх здатністю до гібридизації (в помырно жорстких умовах, наприклад, 0,5X SSC, 0,1 % SDS1 60 ºC) з послідовностями, представленими в даному описі, або з будь-якою частиною нуклеотидної послідовності, розкритої в даному описв, та з функціональним еквівалентом будь-якої нуклеїновокислотної послідовності, розкритої в даному описі. Жорсткість умов може коригуватися, щоб екранувати помірно схожі фрагменти, такі як гомологічні послідовності з віддалено споріднених організмів, до надзвичайно подібних фрагментів, таких як гени, що дублюють функціональні ферменти близько споріднених організмів. Післягібридизаційні промивання визначають жорсткість умов. Термін "селективно гібридизують" включає посилання на гібридизацію, в жорстких гібридизаційних умовах, нуклеїнокислотної послідовності до визначеної цільової нуклеїнокислотної послідовності до помітного найвищого ступеня (наприклад, принаймні 2кратно щодо фону), ніж його гібридизація до нецільової нуклеїнокислотної послідовності та до по суті екслюзійних нецільових нуклеїнових кислот. Селективно гібридизуючі послідовності типово мають, приблизно, принаймні 80 % ідентичність послідовностей або 90 % ідентичність послідовностей, навіть включно до 100 % ідентичності послідовностей (тобто, повністю комплементарні) між собою. Термін "жорсткі умови" або "жорсткі умови гібридизації" включає посилання на умови, в яких зонд буде селективно гібридизуватись з її цільовою послідовністю. Жорсткі умови є залежними від послідовності та будуть різними за різних обставин. За допомогою коригування жорсткості 11 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 гібридизації та/або умов відмивання можуть бути ідентифіковані цільові послідовності, що на 100 % є комплементарними до зонду (гомологічне зондування). Альтернативно, жорсткість умов може бути пристосована для того, щоб дозволити деяке неспівпадання в послідовності з тим, щоб визначити нижчі ступені схожості (гетерологічне зондування). В цілому, зонд складає менше ніж, приблизно, 1000 нуклеотидів у довжину, необов’язково, менше ніж 500 нуклеотидів у довжину. Типово, жорсткі умови будуть такими, при яких концентрація солі є меншою, ніж, приблизно, 1,5 M концентрація іонів Na, типово, приблизно, від 0,01 до 1, 0 M концентрація іонів Na (або інших солей) при pH 7,0-8,3 та температура складає принаймні, приблизно, 30 ºC для коротких зондів (наприклад, від 10 до 50 нуклеотидів) та принаймні, приблизно, 60 ºC для довгих зондів (наприклад, більших ніж 50 нуклеотидів). Жорсткі умови також можуть досягатися додаванням дестабілізуючих агентів, таких як формамід. Типові слабко жорсткі умови включають гібридизацію з буферним розчином 30-35 % формаміду, 1 M NaCl, 1 % SDS (додецилсульфат натрію) при 37 ºC, та промивання в 1X-2X SSC (2OX SSC = 3,0 M Cl/0,3 M тринатрієвого цитрату) при 50-55 ºC. Типові помірно жорсткі умови включають гібридизацію в 40-45 % формаміді, 1 M Cl, 1 % SDS при 37 ºC, та відмивання в 0,5X-1X SSC при 55-60 ºC. Типові високо жорсткі умови включають гібридизацію в 50 % формаміді, 1 M Cl, 1 % SDS при 37 ºC та відмивання в 0,1X SSC при 60-65 ºC. Специфічність, типово, є функцією післягібридизаційних промивань, а вирішальними факторами були йонна сила та температура кінцевого промивного розчину. Для ДНК-ДНК гібридів Tm може бути апроксимоване з рівняння Meinkoth et al., Anal. Biochem. 138:267-284 (1984): Tm = 81,5 ºC + 16,6 (log M) + 0,41 (% GC) – 0,61 (% форм.) – 500/L, де M – це полярність моно валентних катіонів, % GC – відсотковий вміст гуанозинових та цитозинових нуклеотидів в ДНК, % форм. – відсотковий вміст формам іду в гібридизаційному розчині та L – довжина гібриду в парах основ. Tm – це температура (при визначенній йонної силі та pH), при якій 50 % комплементарна послідовність-мішень гібридизується до відмінно підібраної и. Tm знижують на, приблизно, 1 ºC для кожного 1 % неспівпадання; таким чином, Tm гібридизації та/або умови промивання можуть бути пристосовані, щоб гібридизувати послідовності з бажаною ідентичністю. Наприклад, якщо знайдені послідовності з >90 % ідентичністю, то Tm може бути знижена на 10 ºC. Як правило, жорсткі умови для специфічної послідовності та її комплементу при визначенній йонній силі та pH вибирають так, щоб температура була, приблизно, на 5 ºC нижчою термальної точки плавлення (Tm). Однак, строго жорсткі умови можуть використовувати гібридизацію та/або промивання при температурі на 1, 2, 3 або 4 ºC нижчій від термальної точки плавлення (Tm); помірно жорсткі умови можуть використовувати гібридизацію та/або промивання при температурі на 6, 7, 8, 9 або 10 ºC нижчій від термальної точки плавлення (Tm); слабко жорсткі умлви можуть використовувати гібридизацію та/або промивання при температурі на 11, 12, 13, 14, 15 або 20 ºC нижчій від термальної точки плавлення (Tm). Використовуючи рівняння, гібридизаційну і промивну композиції та бажану Tm, спеціалісту в даній гадузі техніки зрозуміло, що по-суті описані варіанти жорсткості гібридизації та/або промивних розчинів. Якщо бажана ступінь невідповідності результатів в Tm менша ніж 45 ºC (водний розчин) або 32 ºC (розчин формаміду), то це є переважним для підвищення концентрації SSC таким чином, що може бути використана вища температура. Детальне керівництво з гібридизації нуклеїнових кислот знайдене у Tijssen, Laboratory Techniques in Biochemistry та Molecular Biology-Hybridization with Nucleic Acid Probes, Part I, Chapter 2 "Overview of principles of hybridization та the strategy of nucleic acid probe assays", Elsevier, New York (1993); та Current Protocols in Molecular Biology, Chapter 2, Ausubel et al., Eds., Greene Publishing та Wiley-lnterscience, New York (1995). Умови гибридизації та/або промивання можуть бути застосовані протягом 10, 30, 60, 90, 120 або 240 хвилин. "Суттєва частина" амінокислотної або нуклеотидної послідовності є такою частиною, що містить достатню амінокислотну полідовність поліпептиду або нуклеотидну послідовність гена для того, щоб передбачувано ідентифікувати такий поліпептид чи ген, або шляхом ручного оцінювання послідовності спеціалістом в даній галузі, або шляхом комп’ютерноавтоматизованого порівняння та ідентифікації послідовностей з використанням алгоритмів, таких як BLAST (Basic Local Alignment Search Tool; Altschul, S. F., et al., J. MoI. Biol., 215:403-410 (1993)). В цілому, послідовність з десяти або більше суміжних амінокислот або тридцяти чи білше нуклеотидів є необхідною для того, щоб передбачувано ідентифікувати поліпептид або нуклеїнокислотну послідовність як гомологічну до відомого протеїну чи гена. Більше того, що 12 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 стосується нуклеотидних послідовностей, ген-специфічні олігануклеотидні и, що містять 20-30 суміжних нуклеотидів можуть бути використані в залежних від послідовності методах генної ідентифікації (наприклад, саузерн-гібридизація) та виділення (наприклад, in situ гібридизація бактеріальних колоній або бактеріофагових бляшок). В доповнення, короткі олігануклеотиди з 12-15 основ можуть бути використані як ампліфікаторні праймери в PCR для одержання конкретного нуклеїнокислотного фрагмента, що містить праймери. Відповідно, "суттєва частина" нуклеотидної послідовності містить послідовність, достатню, щоб специфічно ідентифікувати та/або виділити нуклеїнокислотний фрагмент, що містить послідовність. Невідкладна специфікація повідомляє повну амінокислотну та нуклеотидну послідовність, що кодує окремі євгленоїдні протеїни. Кваліфікований спеціаліст, якому корисні вказані в даному описі послідовності, може по-новому використовувати всі або значну частину розкритих послідовностей для цілей, відомих такому спеціалісту в даній галузі. Відповідно, даний винахід містить повні послідовності, як повідомлено в супровідному переліку послідовностей, так само як і суттєві частини цих послідовностей, як визначено вище. Термін "комплементарний" використовують, щоб описати взаємозв’язок між нуклеотидними основами, що здатні гібридизуватись між собою. Наприклад, що стосується ДНК, аденозин комплементарний тиміну та цитозин комплементарний гуаніну. Відповідно, винахід в даному описі також включає ізольовані нуклеїнокислотні фрагменти, що комплементарні повним послідовностям, як повідомлено у супровідному переліку послідовностей, так само як і ті по суті подібні нуклеїнокислотні послідовності. Терміни "гомологія" та "гомологічний" використовують в даному описі рівноцінно. Вони відносяться до фрагментів нуклеїнових кислот, де зміни в одній або більше нуклеотидних основах не впливають на здатність нуклеїнокислотного фрагмента медіювати генну експресію або продукування певного фенотипу. Ці терміни також відносяться до модифікацій фрагментів нуклеїнових кислот згідно з даним винаходом, таких як делеція або вставка одного або більше нуклеотидів, що значно не змінює функціональні властивості одержаного нуклеїнокислотного фрагмента відносно вихідного не модифікованого фрагмента. Тому зрозуміло, що спеціаліст в даній галузі буде приймати до уваги те, що винахід охоплює більше ніж специфічні приклади послідовностей. Більше того, спеціаліст в даній галузі усвідомлює, що гомологічні нуклеїновокислотні послідовності, охоплені даним винаходом, також визначаються за їх здатністю до гібридизації в помірно жорстких умовах (тобто, 0.5 X SSC1 0,1 % SDS, 60 ºC) з послідовностями, представленими в даному описі, або з будь-якою частиною нуклеотидних послідовностей, описаних в даній заявці, та є функціонально еквівалентними будь-якій нуклеїнокислотній послідовності, описаній в даній заявці. "Виродженість кодону" відноситься до природи допустимих змін генетичного коду нуклеотидної послідовності без продукування амінокислотної послідовності закодованого поліпептиду. Відповідно, винахід, що розглядається, належить до будь-якого фрагмента нуклеїнової кислоти, що кодує усі або значну частину амінокислотної послідовності закодованого поліпептиду водорості, що розглядається, яку показано в SEQ ID №:2. Кваліфікований спеціаліст добре ознайомлений з "codon-bias – схильністю кодона до кодування", що продемонстрована специфічною клітиною-хазяїном у використанні нуклеотидних кодонів, щоб специфікувати задану амінокислоту. Таким чином, синтезуючи ген для вдосконаленої експресії в клітині-хазяїні, бажано проектувати ген так, щоб його частота використання кодону наближалась до частоти використання переважного кодону клітинихазяїна. "Хімічно синтезований", як це пов’язано з послідовністю, означеє, що компоненти нуклеотидів були зібрані in vitro. Ручний хімічний синтез ДНК може бути здійснений, використовуючи добре відомі процедури, або автоматизований хімічний синтез може бути проведений, використовуючи одну або ряд комерційно доступних машин. "Синтетичні гени" можуть бути зубрані з олігануклеотидних будівельних блоків, що хімічно синтезовані з використанням процедур, відомих спеціалісту в даній галузі. Ці будівальні блоки зшивають та відпалюють до утворення генних сегментів, що потім ферментативно складають, щоб зконструювати увесь ген. Відповідно, гени можуть бути підігнаними до оптимальної генної експресії, яка базується на оптимізації нуклеотидної послідовності для того, щоб відбити "codon bias" клітини-хазяїна. Кваліфікований спеціаліст цінує вірогідність успішної експресії гена, якщо використання кодона є зміщеним до кодонів, яким віддає перевагу хазяїн. Визначення переважних кодонів може базуватись на обстеженні генів, отриманих з клітини-хазяїна, де доступна інформаційна послідовність. "Ген" відноситься до фрагменту нуклеїнової кислоти, що експресує специфічний протеїн, та може відноситись до самої кодуючої ділянки, або може включати регуляторні послідовності, 13 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 передуючі (5' некодуючі послідовності) та слідуючі (3' некодуючі послідовності) кодуючій послідовності. "Нативний ген" відноситься до гену, виявленого в природі з його власними регуляторними послідовностями. "Химерний ген" відноситься до будь-якого гена, що не є природним геном і містить регуляторні та кодуючи послідовності, які не були виявлені разом в природі. Відповідно, химерний ген може містити регуляторні послідовності та кодуючі послідовності, одержанні з різних джерел, або регуляторні послідовності та кодуючі послідовності, одержанні з того самого джерела, але упорядковані в порядку, що не зустрічається в природі. "Ендогенний ген" відноситься до природного гена в його природному місцезнаходженні в геномі організму. "Чужерідний" ген відноситься до гена, що введений в організм-хазяїн шляхом передачі генів. Чужерідні гени можуть міститиприродні гени, вставлені в ненатуральний організм, природні гени, введені в нове положення в межах природного хазяїна, або химерні. "Трансген" є геном, що введений в геном шляхом трансформаційної процедури. "Кодон-оптимізований ген" є геном, що має його частоту застосування кодонів, спроектований, щоб імітувати частоту використання кодона клітини-хазяїна. "Кодуюча послідовність " відноситься до ДНК послідовності, що кодує специфічну амінокислотну послідовність. "Придатні регуляторні послідовності" відносяться до нуклеотидних послідовностей, що знаходяться проти ходу транскрипції (5' некодуючі послідовності), в межах або по ходу транскрипції (3' некодуючі послідовності) кодуючої послідовності, та які впливають на транскрипцію, РНК-процесінг або стабільність, або трансляцію асоційованої кодуючої послідовності. Регуляторні послідовності можуть містити промотори, трансляційні лідерні послідовності, інтрони, поліаденіляційні розпізнаючі послідовності, сайти РНК-процесінга, сайти зв’язування ефектора та структури типу «стебло-петля». Термін "алель" відноситься до однієї з кількох альтернативних форм гена, що займає даний локус в хромосомі. Коли всі алелі, присутні в даному локусі хромосоми, є такими самими, то рослина є гомозиготною в цьому локусі. Якщо алелі, присутні в даному локусі хромосоми, різні, то рослина є гетерозиготною в цьому локусі. "Промотор" відноситься до послідовності ДНК, здатної контролювати експресію кодуючої послідовності або функціональної РНК. В цілому, кодуюча послідовність знаходиться в положенні 3' до промоторної послідовності. Промотори можуть бути одержані в своїй повноті з природного гена або бути складені з різних елементів, одержаних з різних промоторів, виявлених в природі, або навіть містити синтетичні сегменти ДНК. Для спеціаліста в даній галузі зрозуміло, що різні промотори можуть направляти експресію гена в різних тканинах або типах клітин або на різних стадіях розвитку, або у відповідь на різні фізіологічні умови та на умови оточуючого середовища. Промотори, що спонукають ген до експресування в більшості типах клітин та у більшості випадках, зазвичай відносяться до "конститутивних промоторів". Крім того, було визнано, що фрагменти ДНК різної довжини можуть мати ідентичну промоторну активність, так як в більшості випадків точні межі регуляторних послідовностей не були остаточно визначені. Промоторна послідовність може складатись з проксимальних та більш дистальних елементів проти ходу транскрипції, останні елементи часто відносять до енхансерів. Відповідно, "енхансер" є послідовністю ДНК, що може стимулювати промоторну активність, та може бути вродженим елементом промотора або гетерологічним елементом, вставленим для підвищення рівня або тканинної специфічності промотора. Постійно виявляються нові промотори різних типів, корисні в рослинних клітинах, чисельні приклади можуть бути знайдені в компіляції Okamuro, J. K., та Goldberg, R. B., Biochemistry of Plants, 15:1-82 (1989). "Трансляційна лідерна послідовність" відноситься до полінуклеотидної послідовності, що знаходиться між промоторною послідовністю гена та кодуючою послідовністю. Трансляційна лідерна послідовність присутня в повністю обробленій мРНК проти ходу трансляційної стартової послідовності. Трансляційна лідерна послідовність може впливати на переробку первинного транскрипту в мРНК, стабільність мРНК або ефективність трансляції. Приклади трансляційних лідерних послідовностей описані (Turner, R. та Foster, G. D., MoI. BiotechnoL, 3:225-236 (1995)). Терміни "3’ некодуючі послідовністі" та "термінатор транскрипції" відносяться до ДНКпослідовностей, що знаходяться справа і нижче кодуючої послідовності. Вони включають поліаденуляційні послідовності роспізнавання та інші послідовності, що кодують сигнали, здатні впливати на процесінг мРНК або експресію гена. Сигнал поліаденіляції зазвичай 14 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 характеризується додаванням поліаденіловокислотних ділянок до 3’-кінця мРНК-прекурсора. 3'ділянка може впливати на транскрипцію, РНК-процесінг або стабільність, або трансляцію асоційованої кодуючої послідовності. "РНК-транскрипт" відноситься до продукту, одержаного з каталізованої РНК-полімеразою транскрипції послідовності ДНК. Коли РНК-транскрипт є справжньою комплементарною копією послідовності ДНК, то він відноситься як до початкового транскрипту, може бути РНКпослідовністю, одержаною з післятранскрипційного процесінгу початкового транскрипту, так і до зрілої РНК. "Матрична РНК" або "мРНК" відноситься до РНК без інтронів та яка може бути трансльована в протеїн клітиною. "кДНК" відноситься до дволанцюгової ДНК, яка є комплементарною до та одержана з мРНК. "Смислова" РНК відноситься до РНК-транскрипту, що містить мРНК, а також може бути трансльованою в протеїн клітиною. "Антисмислова РНК" відноситься до РНК-транскрипту, який є комплементарним всьому або частині початкового транскрипту-мішені та може блокувати експресію гена-мішені (US 5 107 065; WO 99/28508). Комплементарність антисмислової РНК може бути з будь-якою частиною специфічного генного транскрипту, тобто, з 5'-некодуючою послідовністю, 3'- некодуючою послідовністю або кодуючою послідовністю. "Функціональна РНК" відноситься до антисмислової РНК1, рибосомальної РНК1 або до інших РНК, що не транслюються та ще діють на клітинні процеси. Термін "функціонально зв’язаний" відноситься до об’єднання нуклеїнокислотних послідовностей в єдиний нуклеїнокислотний фрагмент таким чином, що функція однієї знаходиться під впливом інших. Наприклад, промотор є функціонально зв’язаним з кодуючою послідовністю, коли він здатен впливати на експресію цієї кодуючої послідовності (тобто, кодуюча послідовність знаходиться під транскрипційним контролем промотора). Кодуючі послідовності сожуть бути функціонально зв’язаними з регуляторними послідовностями в смисловій та антисмисловій орієнтації. Термін "експресія", як його застосовують в даній заявці, відноситься до транскрипції та стійкого накопичування смислової (мРНК) або антисмислової РНК, одержаних з нуклеїнокислотних фрагментів згідно з даним винаходом. Експресія може також відноситись до трансляції мРНК в поліпептид. "Зрілий" протеїн відноситься до післятрансляційно обробленого поліпептиду, тобто, будьякий один з пре- або пропептидів, присутніх у вихідному продукті трансляції, був видалений. "Білок-попередник" відноситься до вихідного продукту трансляції мРНК, тобто, в якому ще присутні пре- та пропептиди. Пре- та пропептиди можуть бути внутрішньоклітинними локалізаційними сигналами, але не обмежуються ними. "Трансформація" відноситься до переносу молекули нуклеїнової кислоти в організм-хазяїн, що обумовлює генетично стійке спадкоємство. Молекула нуклеїнової кислоти може бути плазмідою, що, наприклад реплікується автономно, або може інтегруватись в геном організмахазяїна. Організми-хазяїни, що містять трансформовані фрагменти нуклеїнових кислот, вказані в даному описі як "трансгенні" або "рекомбінантні, або "трансформовані" організми. Терміни "плазміда", "вектор" та "касета" відносяться до особливих хромосомальних елементів, що часто переносять гени і не є частиною центрального метаболізму клітини, та, як правило, існують в формі кільцевого дволанцюгового фрагмента ДНК. Такі елементи можуть автономно реплікувати послідовності, геномні інтегруючі послідовності, фаги або нуклеотидні послідовності, лінійні або кільцеві, одно- чи дволанцюгові ДНК або РНК, одержані з будь-якого джерела, в яких ряд нуклеотидних послідовностей об’єднується або рекомбінується в унікальну конструкцію, що є здатною ввести промоторний фрагмент та послідовність ДНК для вибранного генного продукту разом з відповідною 3'-нетранслюючою послідовністю в клітину. "Експресійна касета" відноситься до специфічного вектора, що містить чужерідний ген та надодачу до нього елементи, які дозволяють цьому гену посилено експресуватись в чужерідному хазяїні. Термін "відсоток ідентичності", як він відомий в рівні техніки, означає співвідношення між двома або більше поліпептидними послідовностями чи двома або більше полінуклеотидними послідовностями, як визначено порівнянням послідовностей. В рівні техніки "ідентичність" також означає ступінь спорідненості між поліпептидними або полінуклеотидними послідовностями, аналогічно може бути визначена як співпадання між двома ланцюгами таких послідовностей. "Ідентичність" та "подібність" можна без перешкод розрахувати за допомогою відомих способів, що включають способи, описані в: 1.) Computational Molecular Biology (Lesk, A. M., Ed.) Oxford University: NY (1988); 2.) Biocomputing: Informatics та Genome Projects (Smith, D. W., Ed.) Academic: NY (1993); 3.) Computer Analysis of Sequence Data. Part I (Griffin, A. M., та Griffin, H. G., Eds.) Humania: NJ (1994); 4.) Sequence Analysis in Molecular Biology (von Heinje, G., Ed.) 15 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 Academic (1987); and, 5.) Sequence Analysis Primer (Gribskov, M. та Devereux, J., Eds.) Stockton: NY (1991), але не обмежуються ними. Для визначення ідентичності розробляються переважні способи для того, щоб дати краще спів падання між послідовностями, які перевіряються. Способи для визначення ідентичності та подібності кодифіковані в загальнодоступних комп’ютерних програмах. Вирівнювання послідовностей та відсоткові розрахунки ідентичності TM можуть бути проведені, використовуючи програму MegAlign біоінформаційного обчислювального комплексу LASERGEN (DNASTAR Inc., Madison, Wl). Множинне вирівнювання послідовностей проводять, використовуючи "Clustal method of alignment", який охоплює декілька різновидів алгоритму, включаючи "Clustal V method of alignment", що відповідає способу вирівнювання, поміченому Clustal V (описаний Higgins та Sharp, CABIOS1 5:151-153 (1989); TM Higgins, D.G. et al., Comput AppL Biosci., 8:189-191 (1992)) та виявленому в програмі MegAlign біоінформаційного обчислювального комплексу LASERGEN (DNASTAR Inc.). Для множинного вирівнювання значення за умовчанням відповідають GAP PENALTY=I0 та GAP LENGTH PENALTY=I0. Значення параметрів за умовчанням для попарних вирівнювань та розрахунок відсотка ідентичності протеїнових послідовностей з використанням способу Clustal V становлять KTUPLE=I, GAP PENALTY=3, WINDOW=5 та DIAGONALS SAVED=5. Для нуклеїнових кислот ці параметри будуть такими: KTUPLE=2, GAP PENALTY=5, WIND0W=4 та DIAGONALS SAVED=4. Після вирівнювання послідовності з використанням програми Clustal V, є можливим одержання "відсотка ідентичності" шляхом перегляду таблиці "віддаленість послідовностей" в тій самій програмі. Крім того, "спосіб вирівнювання Clustal W" є доступним та відповідає способу вирівнювання, поміченому Clustal W (описаний Higgins та Sharp, CABIOS, 5:151-153 (1989); TM Higgins, D.G. et al., Comput. Appl. Biosci, 8:189-191(1992)), та виявленому в програмі MegAlign v6.1 біоінформаційного обчислювального комплексу LASERGEN (DNASTAR Inc.). Значення параметрів за умовчанням для множинного вирівнювання відповідають GAP PENALTY=10, GAP LENGTH PENALTY=0.2, Delay Divergen Seqs(%)=30, DNA Transition Weight=0.5, Protein Weight Matrix=Gonnet Series, DNA Weight Matrix=IUB. Після вирівнювання послідовності з використанням програми Clustal W, є можливим одержання "відсотка ідентичності" шляхом перегляду таблиці "віддаленість послідовностей" в тій самій програмі. "Спосіб вирівнювання BLASTN" являє собою алгоритм, забезпечений National Center for Biotechnology Information (NCBI) для порівняння нуклеотидних послідовностей з використанням параметрів за умовчанням. Спеціалісту в даній галузі техніки добре відомо, що багато рівнів ідентичності послідовностей є корисними при ідентифікуванні поліпептидів з інших видів, де такі поліпептиди мають таку саму або подібну функцію чи активність. Придатні нуклеїнокислотні фрагменти (виділені полінуклеотиди згідно з даним винаходом) кодують поліпептиди, що є на принаймні, приблизно, 70 % ідентичними, переважно на принаймні, приблизно, 75 % ідентичними, та більш переважно на принаймні, приблизно, 80 % ідентичними амінокислотним послідовностям, повідомленим в даній заявці. Переважні нуклеїнокислотні фрагменти кодують амінокислотні послідовності, що є на принаймні, приблизно 85 % ідентичними амінокислотним послідовностям, повідомленим в даній заявці. Більш переважні фрагменти нуклеїновихкислот кодують амінокислотні послідовності, що є на принаймні, приблизно 90 % ідентичними амінокислотним послідовностям, повідомленим в даній заявці. Ще більш переважними є фрагменти нуклеїнових кислот, що кодують амінокислотні послідовності, що є на принаймні, приблизно, 95 % ідентичними амінокислотним послідовностям, повідомленим в даній заявці. Хоча переважні обсяги охорони описуються вище, будь-яка цілочислова ідентичність амінокислоти від 67 % до 100 % може бути корисною при описуванні даного винаходу, така як 68 %, 69 %, 70 %, 71 %, 72 %, 73 %, 74 %, 75 %, 76 %, 77 %, 78 %, 79 %, 80 %, 81 %, 82 %, 83 %, 84 %, 85 %, 86 %, 87 %, 88 %, 89 %, 90 %, 91 %, 92 %, 93 %, 94 %, 95 %, 96 %, 97 %, 98 % або 99 %. Придатні фрагменти нуклеїнових кислот мають не тільки вказані вище гомологій, а й, типово, кодують поліпептид, що має принаймні 50 аинокислот, переважно принаймні 100 амінокислот, більш переважно принаймні 150 амінокислот, ще більш переважно принаймні 200 амінокислот, та найкраще принаймні 250 амінокислот. Термін "консервативна ділянка" або "мотив" означає набір амінокислот, консервативний в специфічних положеннях вздовж вирівняної послідовності еволюційно споріднених протеїнів. В той час як амінокислоти в інших положеннях можуть змінюватись серед гомологічнх протеїнів, амінокислоти, що є висококонсервативними в специфічний положеннях, означають амінокислоти, що є незамінними в стуктурі, стабільності або активності протеїну. Так як вони ідентифікуються за їх високим ступенем консервативності у вирівняних послідовностях сімейства протеїнових гомологів, вони можуть бути використані як ідентифікатори або 16 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 "характерні ознаки" для того, щоб визначити, чи належить протеїн з недавно визначеною послідовністю до попередньо ідентифікованого протеїнового сімейства. Термін "програмне забезпечення секвенування" відноситься до будь-якого комп’ютерного алгоритму або програмного забезпечення, що є корисним для аналізу нуклеотидної або амінокислотної послідовності. "Програмне забезпечення секвенування" може бути комерційно доступним або незалежно розробленим. Типове програмне забезпечення секвенування буде включати: 1.) GCG-комплект програм (Wisconsin Package Version 9.0, Genetics Computer Group (GCG), Madison, Wl); 2.) BLASTP, BLASTN, BLASTX (Altschul et al., J. MoL Biol., 215:403-410 (1990)); 3.) DNASTAR (DNASTAR, Inc. Madison, Wl); 4.) Секвенатор (Gen Codes Corporation, Ann Arbor, Ml); та 5.) FASTA-програму, інкорпоруючу алгоритм Smith-Waterman (W. R. Pearson, Comput. Methods Genome Res., [Proc. Int. Symp.] (1994), Meeting Date 1992, 111-20. Editor(s): Suhai, Sandor. Plenum: New York, NY), але не обмежуються ними. В контексті даної заявки зрозуміло, що там, де для аналізу використовується програмне забезпечення секвенування, результати аналізу будуть базуватися на "значеннях за умовчанням" довідкової програми, якщо не вказано інше. Як використано в даній заявці, "значення за умовчанням" буде означати будьякий комплект значень або параметрів, що з самого початку загружається з програмним забезпеченням при першій ініціалізації. Що стосується алгоритму BLASTP, використаному в даній заявці, то параметри за умовчанням будуть включати Robinson та Robinson амінокислотні частоти (Robinson A.B., Robinson L.R., Proc. Natl Acad. ScL U.S.A., 88:8880- 8884 (1991)), матричний підраховувач BLOSUM62 та оцінку розривів ∆(g) = 11 + g. Термін "рослинні частини" включає диференційовані та недиференційовані тканини, включаючи такі: коріння, стовбури, пагони, листя, пилок, насіння, пухлинну тканину та різні форми клітин та культуру (тобто, одиночні клітини, протопласти, зародки та калюсну тканину). Рослинна тканина може бути в рослині або в рослинному органі, тканині або клітинній культурі. Термін "рослинний орган" відноситься до рослинної тканини або групи тканин, що складають морфологічно та функціонально чітко виражену частину рослини. Термін "геном" відноситься до: (1) повного комплекту генетичного матеріалу (гени та некодуючі послідовності), присутнього в кожній клітині організму або вірусу, або органелі; (2) повного набору хромосом, успадкованих як (гаплоїд) одиниця від одного з батьків. Стандартна рекомбінантна ДНК та методи молекулярного клонування, використані в даній заявці, є добре відомими з рівня техніки та описані Sambrook, J., Fritsch, E. F. And Maniatis, T., nd Molecular Cloning: A Laboratory Manual, 2 ed., Cold Spring Harbor Laboratory: Cold Spring Harbor, NY (1989) (в подальшому "Maniatis"); Silhavy, T. J., Bennan, M. L. та Enquist, L. W., Experiments with Gene Fusions. Cold Spring Harbor Laboratory: Cold Spring Harbor, NY (1984); та Ausubel, F. M. et al., Current Protocols in Molecular Biology, блікований Greene Publishing Assoc, та Wileylnterscience, Hoboken, NJ (1987). Терміни "рекомбінантний конструкт", "експресійний конструкт", "химерний конструкт", "конструкт", та "рекомбінантний ДНК конструкт" використовують в даному описі рівноцінно. Рекомбінантний конструкт містить синтетичну комбінацію нуклеїнокислотних фрагментів, тобто, регуляторні та кодуючи послідовності, що разом не зустрічаються в природі. Наприклад, химерний конструкт може містити регуляторні послідовності та кодуючі послідовності з різних джерел або регуляторні послідовності та кодуючі послідовності, одержані з того самого джерела, але впорядковані в спосіб, який відрізняється від того, що існує в природі. Такий конструкт може бути використаний по-окремо або може бути використаний спільно з вектором. Якщо використовується вектор, то вибір вектора буде залежати від способу, що буде застосований для трансформування клітин-хазяїв, як це відомо спеціалісту з рівня техніки. Наприклад, може бути застосований плазмідний вектор. Кваліфікований спеціаліст добре усвідомлює генетичні елементи, які повинні бути присутні в векторі для того, щоб успішно трансформувати, відібрати та розмножити клітини хазяїна, що містять будь-який виділений фрагмент нуклеїнових кислот згідно з винаходом. Кваліфікований спеціаліст буде також усвідомлювати, що різні незалежні трансформаційні події будуть одержані з різними рівнями та характером експресії (Jones et al., EMBO J. 4:2411-2418 (1985); De Almeida et al., MoI. Gen. Genetics 218:78-86 (1989)), а тому, для одержання ліній, які демонструють бажані рівні та характер експресії, повинні бути відібрані множинні події. Такий відбір може бути завершений за допомогою саузерн-аналізу експресії ДНК, нозерн-аналізу експресії мРНК, імуноблотінгом протеїнової експресії або фенотипічним аналізом поряд з іншими. Термін "експресія", як використано в даній заявці, відноситься до продукування функціонального кінцевого продукту (тобто, мРНК або протеїу [одного з двох - або прекурсору, або зрілого]). 17 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "введений" означає забезпечення нуклеїнової кислоти (тобто, експресія конструкта) або протеїну в клітині. "Введений" включає посилання на інкорпорування нуклеїнової кислоти в еукаріотичну або прокаріотичну клітину, де нуклеїнова кислота може бути інкорпорована в геном клітини, та включає посилання на тимчасове забезпечення нуклеїнової кислоти або протеїну в клітині. "Введений" включає посилання на стабільні або тимчасові методи трансляції, а також статеве схрещування. Таким чином, "введений", в контексті вставки фрагмента нуклеїнових кислот (тобто, конструкта рекомбінантної ДНК /експресія конструкта) в клітину, означає "транфекцію" або "трансформацію", або "трансдукцію" та включає посилання на інкорпорування фрагмента нуклеїнових кислот в еукаріотичну або прокаріотичну клітину, де нуклеїнокислотний фрагмент може бути інкорпорований в геном клітини (тобто, хромосому, плазміду, пластиду або мітохондріальну ДНК), конвертований в автономний реплікон або тимчасово експресований (тобто, трансфектовану мРНК). "Зрілий" протеїн відноситься до післятрансляційно обробленого поліпептиду (тобто, будьякий один з пре- або про пептидів, присутніх в початковому трансляційному продукті, що був видалений). "Прекурсор" відноситься до початкового продукту трансляції мРНК (тобто, з все ще присутніми пре- та пропептидами). Пре- та пропептиди можуть бути внутрішньоклітинними сигналами локалізації, але не обмежуються ними. "Стійка трансформація" відноситься до трансферу фрагмента нуклеїнових кислот в геном організма-хазяїна, включаючи як ядерний геном, так і геном органел, що приводить до генетично стійкого успадковування. На противагу, "тимчасова трансформація" відноситься до трасферу фрагмента нуклеїнових кислот в ядра або ДНК-вмісну органелу організма-хазяїна, що приводить до генної експресії без інтегрування або стійкого успадковування. Організми-хазяїни, що містять трансформовані нуклеїнокислотні фрагменти, відносяться до "трансгенних"організмів. Як використано в даній заявці, "трансгенний" відноситься до рослини або клітини, що містить в межах свого генома гетерологічний полінуклеотид. Переважно, гетерологічний полінуклеотид є стабільно інтегрованим в межах генома таким чином, що полінуклеотид переходить в наступні генерації. Гетерологічний полінуклеотид може бути інтегрованим в геном сам по собі або як частина експресійного конструкта. "Трансгенний" використовують в даній заяці, щоб включити будь-яку клітину, клітинну лінію, калюс, тканину, частину або всю рослину, генотип яких був змінений присутністю гетерологічної нуклеїнової кислоти, включаючи ті трансгени, що були змінені з самого початку, та ті, що були створені шляхом статевого перехрещування або нестатевого розмноження з початково трансгенного організму. Термін "трансгенний", як його використано в даній заявці, не охоплює зміни генома (хромосомного або позахромосомного) за допомогою загальприйнятих методів розведення рослин або шляхом подій, що зустрічаються в природі, таких як випадкове перехресне опилення, нерекомбінантна вірусна інфекція, нерекомбінантна бактеріальна трансформація, нерекомбінанта транспозиція або спонтанні мутації. "Антисмислове інгібування" відноситься до продукування антисмислових РНК-транскриптів, здатних пригнічувати експресію протеїну-мішені. "Співсупресор або косупресор" відноситься до продукування смислових РНК-транскриптів, здатних пригнічувати експресію ідентичних або по суті подібних чужерідних або ендогенних генів (US 5 231 020). Косупресійні конструкти в рослинах були попередньо зконструйовані шляхом фокусування на надекспресії нуклеїнокислотної послідовності, що виявляє гомологію до ендогенної мРНК в просторовій орієнтації, що приводить до зменшення усіх РНК, які мають гомологію до надекспресованої послідовності (Vaucheret et al., Plant J. 16:651-659 (1998); Gura, Nature 404:804-808 (2000)). Загальна ефективність цього феномену низька, а розширення зниження РНК дуже мінливе. Більш рання робота описала застосування "гепаринових" структур, що інкорпорують усі або частину кодуючих послідовностей мРНК в комплементарній орієнтації, що приводить до потенційної структури "стебло-петля" для експресованої РНК (публікації PCT – WO 99/53050, опублікована 21 жовтня 1999; WO 02/00904, опублікована 3 січня 2002). Такий процес підвищує частоту косупресії у відновлених трансгенних рослинах. Інша варіація описує використання послідовностей вірусів рослин для прямої супресії, або "сайленсінг", проксимальних кодуючих послідовностей мРНК (WO 98/36083, опублікована 20 серпня 1998). Обидва ці супресійні феномени не були пояснені механістично, хоча генетичні дані почали розпутувати цю складну ситуацію (Elmayan et al., Plant Ce// 10:1747-1757 (1998)). Короткий огляд: Мікробіологічний синтез жирних кислот та триацилгліцеролів В цілому, накопичення ліпідів в олійних мікроорганізмах запускається у відповідь на загальне співвідношення вуглецю і азоту, присутніх в ростовому поживному середовищі. Цей 18 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 процес, що приводить до de novo синтезу вільного пальмітату (16:0) в олійних мікроорганізма, детально описаний в публікації WO 2004/101757. Пальмітат є прекурсором похідних довголанцюгових насичених та ненасичених жирних кислот, які утворюють внаслідок дії елонгаз і десатураз (Фігура 1). TAG (основна накопичувальна одиниця для жирних кислот) утворюються через серію реакцій, які включають: 1.) естерефікацію однієї молекули ацил-CoA до гліцерол-3-фосфату за допомогою ацилтрансферази, щоб одержати лізофосфатидилову кислоту; 2.) естерефікацію другої молекули ацил-CoA за допомогою ацилтрансферази, щоб одержати 1,2діацилгліцерофосфат (зазвичай ідентифікований як фосфатидна кислота); 3.) видалення фосфатів з фосфатидної кислоти за допомогою фосфатази, щоб одержати 1,2-діацилгліцерол (DAG); 4.) додавання третьої жирної кислоти за допомогою ацилтрансферази, щоб утворився TAG. В TAG може бути об’єднаний широкий спектр жирних кислот, включаючи насичені та ненасичені жирні кислоти, коротколанцюгові та довголанцюгові жирні кислоти. Біосинтез омега-жирних кислот Метаболічний процес, в якому олеїнова кислота перетворюється в омега-3/омега-6 жирні кислоти, включає елонгацію вуглецевого ланцюга через додавання атомів вуглецю та десатурації молекули через додавання подвійних зв’язків. Для цього необхідний ряд десатураційних та елонгуючих ферментів, присутніх в мембрані ендоплазматичного ретикулюму. Проте, як видно на Фігурі 1 та як описано нижче, часто існує багато метаболічних шляхів для продукування специфічної омега-3/омега-6 жирної кислоти. Зокрема, усі метаболічні шляхи потребують початкового перетворення олеїнової кислоти в LA, першої з омега-6 жирних кислот, за допомогою дельта-12 десатурази. Потім, використовуючи "метаболічний шлях дельта-6 десатурази/дельта-6 елонгази", омега-6 жирні кислоти утворюються наступним чином: (1) LA перетворюється в GLA за допомогою дельта-6 десатурази; (2) GLA перетворюється в DGLA за допомогою C18/20 елонгази та (3) DGLA перетворюється в ARA за допомогою дельта-5 десатурази. Альтернативно, "Метаболічний шлях дельта-6 десатурази/дельта-6 елонгази" може бути застосований для утворення омега-3 жирних кислот наступним чином: (1) LA перетворюється в ALA, першу з омега-3 жирних кислот, за допомогою дельта-15 десатураз ; (2) ALA перетворюється в STA за допомогою дельта-6 десатурази; (3) STA перетворюється в ETA за допомогою C18/20 елонгаз ; (4) ETA перетворюється в EPA за допомогою дельта-5 десатураз ; (5) EPA перетворюється в DPA за допомогою C20/22 елонгаз ; та (6) DPA перетворюється в DHA за допомогою дельта-4 десатураз. Необов’язково, омега-6 жирні кислоти можуть бути перетворені в омега-3 жирні кислоти; наприклад, ETA та EPA одержують з DGLA та ARA, відповідно, за допомогою активності дельта-17 десатурази. Альтернативні метаболічні шляхи для біосинтезу омега-3/омега-6 жирних кислот застосовують дельта-9 елонгазу та дельта-8 десатуразу. Більш специфічно, LA та ALA можуть бути перетворені в EDA та ETrA, відповідно, за допомогою дельта-9 елонгази; потім дельта-8 десатураза перетворює EDA в DGLA та/або ETrA в ETA. Очікується, що спеціальні функціональні властивості, необхідні для того, щоб бути експресованими в специфічному організмі-хазяїні для продукування омега-3/омега-6 жирних кислот, будуть залежати від клітини-хазяїна (та її природного профілю PUFA та/або профілю десатураз/елонгаз), доступності субстрату та бажаних кінцевих продуктів (продукту). Кваліфікований спеціаліст в даній галузі буде здатним ідентифікувати різноманітні кандитатні гени, кодуючі кожен з ферментів, бажаних для біосинтезу омега-3/омега-6 жирних кислот. Корисні десатуразні та елонгазні послідовності можуть бути отримані з будь-якого джерела, тобто, виділені з природного джерела (з бактерій, водостей, грибів, рослин, травин і т.п.), одержаним за допомогою напівсинтетичних шляхів або синтезованими de novo. Хоча конкретне джерело десатуразних та елонгазних генів, введених в хазяїн, не є вирішальним, та міркування щодо вибору специфічного поліпептиду, який має десатуразну або елонгазну активність, включають: 1.) субстратну специфічність поліпептиду; 2.) чи є поліпептид або його компонент обмежуючим швидкість ферментом; 3.) чи є десатураза або елонгаза незамінною для синтезу бажаних PUFA; та/або, 4.) кофактори, необхідні поліпептиду. Експресований поліпептид переважно має параметри, сумісні з біохімічним оточенням його місцезнаходження в клітиніхазяїні (див. WO 2004/101757 для додаткових подробиць). В додаткових втіленнях також буде корисним розглядати конверсійну активність кожної конкретної десатурази та/або елонгази. Більшe конкретно, так як кожен фермент рідко функціонує з 100 % ефективністю перетворення субстрату в продукт, то кінцевий ліпідний профіль неочищених жирів, продукованих в клітині-хазяїні, типово, буде сумішшю різноманітних PUFA, що складаються як з бажаних омега-3/омега-6 жирних кислот, так і з супутніх проміжних 19 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 PUFA. Таким чином, конвертаційна ефективність кожного ферменту також є варіабельною з огляду на оптимізацію біосинтезу бажаних жирних кислот. Беручи до уваги кожне з вищевикладених міркувань, кандидатні гени, що мають придатні активності десатураз та елонгаз (тобто, дельта-6 десатураз, C18/20 елонгаз, дельта-5 десатураз, дельта-17 десатураз, дельта-15 десатураз, дельта-9 десатураз, дельта-12 десатураз, C14/16 елонгаз, C16/18 елонгаз, дельта-9 елонгаз, дельта-8 десатураз, дельта-4 десатураз та C20/22 елонгаз), можуть бути ідентифіковані згідно з загальнодоступною літературою (тобто, GenBank), патентною літературою та експериментальними дослідженнями організмів, здатних продукувати PUFA. Ці гени будуть придатні для введення в специфічний організм-хазяїн, щоб зробити можливим або збільшити синтез PUFA організмом. Ідентифікація послідовності нової дельта-5 десатурази Euglena gracillis В даному винаході нуклеотидна послідовність (SEQ ID №:1) може бути виділена з Euglena gracillis, що кодує дельта-5 десатуразу (SEQ ID №:2), позначену в даній заявці як "EgD5". Порівняння нуклеотидної основи EgD5 та виведених амінокислотних послідовностей з загальнодоступними базами даних виявляє, що найбільш подібні відомі послідовності є на 67 % ідентичними амінокислотній послідовності EgD5, розкритій в даній заявці, з понад 463 амінокислотами в довжину, як визначено Clustal W - способом вирівнювання. Більш переважно, амінокислотні фрагменти є принаймні, приблизно, на 70 %-80 % ідентичними послідовностям в даній заявці, де такі послідовності, що є принаймні, приблизно, на 80 %-90 % ідентичними, є особливо придатними, та такі послідовності, що є принаймні, приблизно, на 90 %-95 % ідентичними є більш переважними. Подібним чином, переважні EgD5, що кодують нуклеїнокислотні послідовності у відповідності до ORF, що розглядаються, є такими, що кодують активні протеїни, та котрі є принаймні, приблизно, на 70 %-80 % ідентичними нуклеїнокислотним послідовностям EgD5, повідомленим в даній заявці, де такі послідовності, що принаймні, приблизно, на 80 %-90 % ідентичні, є особливо придатними та такі послідовності, що принаймні, приблизно на 90 %-95 % ідентичні, є найбільш переважними. В альтернативних втіленнях переважні послідовності десатурази EgD5 можуть бути кодоноптимізованими для експресії в специфічному організмі-хазяїні. Як відомо з рівня техніки, вони можуть бути корисними засобами для подальшої оптимізації експресії ферменту в альтернативні хазяїни, оскільки застосування кодонів, які віддають перевагу певному хазяїну, може в значній мірі підвищити експресію чужерідного гена, кодуючого поліпептид. В цілому, кодони, які віддають перевагу певному хазяїну, можуть бути визначені в межах окремих видів хазяїв, що становлять інтерес, шляхом перевірки використання кодонів в протеїнах (переважно таких, що експресуються у великій кількості) та визначаючи, котрий з кодонів використовується найчастіше. Після чого, кодуюча послідовність для пептиду, що становить інтерес, тобто, має активність десатурази, може бути синтезована повністю або частково із застосуванням кодонів, що є переважними у видах-хазяїнах. В одному пераважному втіленні винаходу в даній заявці EgD5 була кодон-оптимізованою для експресії в Yarrowia lipolyticа. Це було можливо завдяки першому визначенню профілю використання кодонів Y. lipolyticа (див. WO 04/101757 та US 7 125 672) та ідентифікуванню тих кодонів, що були переважними. Тоді для подальшої оптимізації генної експресії в Y. Lipolytica була визначена консенсусна послідовність навколо ініціюючого кодону 'ATG'. Ця оптимізація призвела до модифікації в 196 bp з-поміж 1350 bp кодуючої ділянки (14,5 %) та оптимізації 189 кодонів із загальних 449 кодонів (42 %). Жодна з модифікацій в кодон-оптимізованому гені ("EgD5S"; SEQ ID №:3) не змінила амінокислотну послідовність закодованого протеїну (SEQ ID №:2). Як описано в Прикладі 11, кодоноптимізований ген був на 36 % більш ефективним, десатуруючи DGLA в ARA, ніж ген дикого типу, коли експресувався в Y. lipolytica. Кваліфікований спеціаліст в даній галузі буде спроможним використати методики даної заявки для того, щоб створити інші різні кодон-оптимізовані протеїни дельта-5 десатурази, придатні для оптимальної експресії в альтернативних хазяїнах (тобто, відмінних від Yarrowia lipolytica), базуючись на послідовності EgD5 дикого типу. Відповідно, винахід, що розглядається, належить до будь-яких кодон-оптимізованих протеїнів дельта-5 десатурази, що одержані з EgD5 дикого типу (тобто, закодованої за допомогою SEQ ID №:2). Він включає нуклеотидну послідовність, показану в SEQ ID №:3, яка кодує синтетичний протеїн дельта-5 десатурази (тобто, EgD5S), що є кодон-оптимізованою для експресії в Yarrowia lipolytica. Ідентифікація та виділення гомологів Будь яка з десатуразних послідовностей, що розглядаються, (тобто, EgD5, EgD5S) або їх частини можуть бути використані для пошуку гомологів дельта-5 десатурази в тій тому самому чи інших видах бактерій, водоростей, грибів або рослин, використовуючи програмне забезпечення секвенування. В цілому, таке комп’ютерне програмне забезпечення підбирає 20 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 подібні послідовності, призначаючи ступені гомології різним замінам, видаленням та іншим модифікаціям. Альтернативно, будь-які послідовності десатураз, що розглядаються, або їх частини можуть бути застосовані як гібридизаційні реагенти для ідентифікації дельта-5 гомологів. Ці основні компоненти нуклеїнокислотного гібридизаційного тесту включають зонд, зразок, в якому очікується ген або генний фрагмент, що розглядаються, та специфічний гібридизаційний метод. Зонди згідно з даним винаходом, типово, є одноланцюговими нуклеїнокислотними послідовностями, які комплементарні нуклеїнокислотним послідовностям, що будуть виявлені. Зонди є "здатними до гібридизації" з нуклеїнокислотною послідовністю, що буде виявлена. Хоча довжина зонда може складати від 5 основ до десяти тисяч основ, типово, придатним є зонд довжиною від, приблизно, 15 основ до, приблизно, 30 основ. Потрібно, щоб тільки частина молекули зонда була комплементарною нуклеїнокислотній послідовності, що буде виявлена. На додачу, компліментарність між зондом та послідовністю-мішенью не повинна бути досконалою. Гібридизація не зустрічається між недосконало комплементарними молекулами, в результаті чого певна фракція основ в гібридизаційні ділянці не буде спарена з властивою комплементарною основою. Методи гібридизації є добре відомими. Типово, зонд та зразок потрібно змішувати в умовах, які дозволять здійснитись нуклеїнокислотній гібридизації. Вони включають контактування зонда і проби в присутності неорганічної або органічної солі в належній концентрації та при температурних умовах. Зонд та зразок нуклеїнових кислот повинні контактувати протягом часу, достатнього для того, щоб відбулася гібридизація між зондом та зразком нуклеїнової кислоти. Концентрація проби або мішені в суміші буде визначати, час, необхідний для того, щоб гібридизація відбулася. Чим вища концентрація зонда або мішені, тим менше часу потрібно для гібридизаційного інкубування. Необов’язково, може бути доданий хаотропічний агеньт (тобто, хлорид гуанідину, тіоціанат гуанідину, тіоціанат натрію, літію тетрахлорацетат, натрію перколят, рубідію тетрахлорацетат, калію йодид, цезію трифтороацетат). Якщо бажано, може бути доданий формамід до гібридизаційної суміші, типово, 30-50 % (об./об.). Можуть використовуватися різні гібридизаційні розчини. Типово, вони містять від, приблизно, 20 до 60 об. %, переважно 30 % полярного органічного розчинника. Загальний гібридизаційний розчин містить, приблизно, 30-50 % об./об. формаміду, приблизно, від 0,15 до 1 M хлориду натрію, приблизно, від 0,05 до 0,1 M буферів (тобто, цитрат натрію, Tris-HCI, PIPES або HEPES (рівень pH, приблизно, 6-9)), приблизно, від 0,05 до 0,2 % детергента (тобто, натрію додецилсульфат), або 0,5-20 мМ EDTA, FICOLL (Pharmacia Inc.) (приблизно, 300-500 кілодекалітрів), полівінілпіролідон (приблизно, 250-500 кілодекалітрів) та сиворотковий альбумін. Також типовий гібридизаційний розчин містить немічені нуклеїнові кислоти-носії, приблизно, від 0,1 до 5 мг/мл, фрагментовану нуклеїнову ДНК (тобто, ДНК телячого тимусу або лососевих молок або дріжджову РНК), та необов’язково, приблизно, від 0,5 до 2 % мас./об. гліцину. Також можуть бути включені інші добавки, такі як різноманітні водорозчинні або водонабрякаючі агенти (тобто, поліетиленгліколь), аніонні полімери (тобто, поліакрилати або поліметакрилати) та аніонні цукристі полімери (тобто, сульфат декстрану). Нуклеїнокислотна гібридизація пристосовна до різноманітних форматів аналізу. Одним з найбільш придатких є формат сендвіч-аналізу. Сендвіч-аналіз є особливо пристосовним до гібридизації в неприродних умовах. Первинним компонентом сандвіч-аналізу є тверда підложка. До твердої підложки або адсорбується, або ковалентно зв’язується імобілізований нуклеїнокислотний зонд, що є неміченим та комплементарним до однієї з частин послідовності. В додаткових втіленнях будь-які нуклеїнокислотні фрагменти дельта-5 десатурази, описані в даній заявці (або будь-які гомологи, ідентифіковані в даному описі) можуть бути використані, щоб виділити гени, кодуючі гомологічні протеїни з того ж самого або іншого виду бактерій, водоростей, грибів або рослин. Виділення гомологічних генів з використанням послідовністьзалежних протоколів добре відоме з рівня техніки. Приклади послідовність-залежних протоколів включають: 1.) методи нуклеїнокислотної гібридизації; 2.) методи ДНК та РНК ампліфікації, як продемонстровано різноманітними застосуваннями технологій нуклеїнокислотної ампліфікації [тобто, полімеразна ланцюгова реакція (PCR), Mullis et al., патент США № 4,683,202; лігазна ланцюгова реакція (LCR), Tabor, S. et al., Proc. Natl. Acad. Set. U.S.A., 82:1074 (1985); або ампліфікації заміщенням ланцюгів (SDA), Walker, et al., Proc. Natl. Acad. ScL U.S.A., 89:392 (1992)]; та 3.) методи бібліотечних конструктів та відбір за комплементарністю, але не обмежуються ними. Наприклад, гени, що кодують подібні протеїни або поліпептиди дельта-5 десатураз, описані в даній заявці, можуть бути виділені безпосередньо, використовуючи усі або частину нуклеїнокислотних фрагментів, що розглядаються, як ДНК-гібридизаційні зонди, щоб відібрати 21 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 бібліотеки з будь-яких бажаних видів дріжджів або грибів, застосовуючи методологію добре відому спеціалістові в даній галузі техніки (де будуть переважними такі організми, що продукують ARA [або її похідні]). Специфічні олігануклеотидні зонди, що базуються на нуклеїнокислотних послідовностях, що розглядаються, можуть бути зконструйовані та синтезовані за допомогою способів, добре відомих з рівня техніки (Maniatis, supra). Більше того, повні послідовності можуть бути безпосередньо використані для синтезу ДНК-зондів за допомогою способів, добре відомох спеціалісту з рівня техніки (тобто, мічення рандомізованих праймерів ДНК, ―нік‖-трансляція або спосіб мічення кінця), а РНК-зонди – за допомогою доступних in vitro транскрипційних систем. Крім того, специфічні праймери можуть бути зконструйовані та застосовані для ампліфікації частини (або повнорозмірної) послідовності, що розглядається. Одержувані продукти ампліфікації можуть бути міченими після реакції ампліфікації та використаними як зонди для виділення повноланцюгових фрагментів ДНК в умовах належної жорсткості. Типово, в способі ампліфікації PCR-типу праймери мають різні послідовності та не є комплементарними один одному. Залежно від бажаних тестових умов послідовності праймерів конструюють таким чином, щоб забезпечити ефективну та точну реплікацію нуклеїнової кислоти-мішені. Способи конструювання праймерів для PCR є загальними та добре відомими з рівня техніки (Thein та Wallace, "The use of oligonucleotides as specific hybridization probes in the Diagnosis of Genetic Disorders", in Human Genetic Diseases: A Practical Approach, K. E. Davis Ed., (1986) pp 33-50, IRL: Herndon, VA; та Rychlik, W., In Methods in Molecular Biology. White, B. A. Ed., (1993) Vol. 15, pp 31-39, PCR Protocols: Current Methods та Applications. Humania: Totowa, NJ). Як правило, два коротких сегмента послідовностей, що розглядаються, можуть бути використані в PCR-протоколах для ампліфікування довших нуклеїнокислотних фрагментів, кодуючих гомологічні гени з ДНК або РНК. PCR також можна проводити на бібліотеці клонованих нуклеїнокислотних фрагментів, де послідовність одного праймера походить з нуклеїнокислотних фрагментів, що розглядаються, а послідовність іншого праймера скористалася поліаденіловим шляхом до 3’-кінця прекурсора мРНК, кодуючої еукаріотичні гени. Альтернативно, друга праймерна послідовність може бути заснована на послідовності, одержаній з клонуючого вектора. Наприклад, кваліфікований спеціаліст може застосувати протокол RACE (Frohman et al., Proc. Natl Acad. ScL U.S.A., 85:8998 (1988)), щоб одержати кодуючі ДНК, використовуючи PCR для ампліфікації копій ділянки між одиничною точкою в транскрипті та 3’ або 5’-кінцем. Праймери, орієнтовані в напрямку 3’ та 5'-кінця, можуть бути зконструйовані з послідовностей, що розглядаються. Використовуючи комерційно 3' RACE або 5' RACE системи (Gibco/BRL, Gaithersburg, MD)1, можуть бути виділені специфічні 3’ або 5' кДНК фрагменти (Ohara et al., Proc. Natl Acad. ScL U.S.A., 86:5673 (1989); Loh et al., Science, 243:217 (1989)). В інших втіленнях будь-які фрагменти нуклеїнових кислот дельта-5 десатурази, розкриті в даній заявці (або будь-які гомологи, тут ідентифіковані), можуть бути використані для створення нових та удосконалення жирнокислотних десатураз. Як добре відомо з рівня техніки, in vitro мутагенез і відбір, хімічний мутагенез, способи "перемішування генів" або інші засоби можуть бути застосовані для одержання мутацій виявлених в природі генів десатураз. Альтернативно, удосконалені жирні кислоти можуть бути синтезовані шляхом доменного обміну, де функціональний домен з будь-яких нуклеїнокислотних фрагментів дельта-5 десатураз, розкритих в даній заявці, заміняється функціональним доменом з альтернативного десатуразного гена, щоб таким чином одержати новий протеїн. Способи продукування різноманітних омега-3 та/бо омега-6 жирних кислот Очікується, що введення химерних генів, кодуючих дельта-5 десатурази, описані в даній заявці (тобто, RD5, RD5S або інші мутантні ферменти, кодон-оптимізовані ферменти або їх гомологи), під контролем придатного промотора призведе до підвищеного продукування ARA та/бо EPA в трансформованих організмах-хазаїнах, відповідно. Сам по собі даний винахід охоплює спосіб для безпосереднього продукування PUFA, що включає вплив на жирнокислотний субстрат (тобто, DGLA або ETA) десатуразними ферментами, описаними в даній заявці (наприклад, RD5, RD5S), таким чином, щоб субстрат перетворився в бажаний жирнокислотний продукт (тобто, ARA або EPA, відповідно). Більш конкретно, об’єктом даного винаходу є забезпечення способу для продукування ARA в клітині-хазяїні (наприклад, олійні дріжджі, соя), де клітина-хазяїн містить: (і) ізольовану нуклеотидну молекулу, кодуючу поліпептид дельта-5 десатурази, що має принаймні 67 % ідентичність при порівнянні з поліпептидом, що має амінокислотну послідовність, як вказано в SEQ ID NO:2, базуючись на алгоритмах BLASTP або не способі вирівнювання Clustal W, та, 22 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 (іі) джерело дигомо-γ-лінолевої кислоти; де клітина-хазяїн є вирощеною в таких умовах, що експресується дельта-5 десатураза і DGLA перетворюється в ARA та де ARA необов’язково відновлюється. Спеціаліст в даній галузі усвідомить, що широкий субстратний ряд дельта-5 десатурази може додатково передбачатись для застосування ферманта для перетворення ETA в EPA. Відповідно, даний винахід забезпечує спосіб для продукування EPA, де клітина-хазяїн містить: (і) ізольовану нуклеотидну молекулу, кодуючу поліпептид дельта-5 десатурази, що має принаймні 67 % ідентичність при порівнянні з поліпептидом, що має амінокислотну послідовність, як вказано в SEQ ID NO:2, базуючись на алгоритмах BLASTP або не способі вирівнювання Clustal W, та (іі) джерело ETA;де клітина-хазяїн є вирощеною в таких умовах, що експресується дельта-5 десатураза і DGLA перетворюється в ARA та де ARA необов’язково відновлюється. Альтернативно, кожний ген дельта-5 десатурази та відповідний йому ферментний продукт, описані в даній заявці, можуть бути застосовані для продукування омега-3 жирних кислот (див. патентну публікацію US 2005/0136519). Непряме продукування омега-3/омега-6 PUFA відбувається там, де жирнокислотний субстрат перетворюється побічно в бажаний жирнокислотний продукт за допомогою засобів проміжного кроку(ів) або проміжного метаболічного шляху(ів). Тому очікується, що дельта-5 десатурази, описані в даній заявці (наприклад, RD5, RD5S або інші мутантні ферменти, кодон-оптимізовані ферменти або їх гомологи), можуть експресуватись у взаємодії з додатковими генами, що кодують ферменти біосинтетичного шляху метаболізму PUFA (наприклад, дельта-6 десатурази, C18/20 елонгази, дельта-17 десатурази, дельта-15 десатурази, дельта-9 десатурази, дельта-12 десатурази, C14/16 елонгази, C16/18 елонгази, дельта-9 елонгази, дельта-8 десатурази, дельта-4 десатурази, C20/22 елонгази), щоб давати в результаті вищі рівні продукування довголанцюгових омега-3 жирних кислот (наприклад, EPA, DPA та DHA). Конкретні гени, включені в межі конкретних експресійних касет, будуть залежати від клітини-хазяїна (та профілю їх PUFA, та/бо профілю десатураз/елонгаз), доступності субстрату та бажаного кінцевого продукту(ів). В альтернативних втіленнях може бути корисним деструктування дельта-5 десатурази природного організму-хазяїна, базуючись на повних послідовностях, описаних в даній заявці, на комплементі таких повних послідовностей, суттєвих частинах тих послідовностей, кодоноптимізованих десатураз, одержаних з них, та, крім того, тих послідовностей, що є по суті гомологічними. Рослинні експресійні системи, касети вектори та трансформація В одному втіленні даний винахід стосується рекомбінантного конструкта, що містить будьякий один полінуклеотид дельта-5 десатурази згідно з даним винаходом, функціонально зв’язаний з принаймні однією регуляторною послідовністю, придатною для експресії в рослині. Промотор є послідовністю ДНК, що направляє клітинну механіку рослини до продукування РНК з суміжних кодуючих послідовностей справа і нижче (3’) промотора. Промоторна ділянка впливає на швидкість, на стадію, що розвивається, та тип клітин, в яких РНК-транскрипт гена отриманий. РНК-транскрипт обробляється для того, щоб продукувати мРНК, яка служить матрицею для трансляції послідовності РНК в амінокислотну послідовність закодованого поліпептиду. 5' нетрансльована лідерна послідовність є ділянкою мРНК зліва і вище ділянки, кодуючої протеїн, що може відігравати роль в ініціації та трансляції мРНК. Сигнал 3’ транскрипції/термінації/поліаденіляції є нетрансльованою ділянкою справа і нижче кодуючої протеїн ділянки, що функціонує в рослинній клітині для спричинення термінації РНКтранскрипта і додаткових поліадениляційних нуклеотидів до 3’-кінця РНК. Походження промотора, вибраного управляти експресію кодуючої дельта-5 десатуразу послідовності, не є важливим доти, доки він має достатню транскрипційну активність для досягнення винаходу шляхом експресування здатної до трансляції мРНК для бажаних нуклеїнокислотних фрагментів в бажаній тканині-хазяїні в потрібний час. Також для здійснення винаходу можуть бути використані гетерологічні або негеторологічні (тобто, ендогенні) промотори. Наприклад, придатні промотори включають: α´-субодиницю β-конгліцинінового промотора, «Kunitz trypsin inhibitor 3 promoter», анексиновий промотор, гліциніновий Gy1 промотор, β- субодиницю β-конгліцинінового промотора, промотор P34/Gly Bd m 3OK, альбуміновий промотор, Leg A1 промотор та Leg A2 промотор, але не обмежуються ними. Анексиновий промотор, або P34, описаний в публікації WO 2004/071178 (опубліковано 26 серпня 2004). Рівень активності анексинового промотора є зіставним з багатьма відомими сильними промоторами, такими як: (1) промотор CaMV 35S (Atanassova et al., Plant MoI. Biol. 37:275-285 (1998); Battraw та Hall, Plant MoI. Biol. 15:527-538 (1990); Holtorf et al., Plant MoI. Biol. 23 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 29:637-646 (1995); Jefferson et al., EMBO J. 6:3901-3907 (1987); Wilmink et al., Plant MoI. Biol. 28:949-955 (1995)); (2) промотори Arabidopsis oleosin (Plant et al., Plant MoI. Biol. 25:193-205 (1994); Li, Texas A&M University Ph.D. dissertation, pp. 107-128 (1997)); (3) промотори убіквітинового подовжуючого білка Arabidopsis ubiquitin (Callis et al., J Biol. Chem. 265(21): 1248693 (1990)); (4) промотор гена убіквітину томатів (Rollfinke et al., Gene. 211(2):267-76 (1998)); (5) промотор соєвого білка температурного шоку (Schoffl et al., MoI Gen Genet. 217(2-3):246-53 (1989));та (6) промотор гена H3 гістону маїсу (Atanassova et al., Plant MoI Biol. 37(2):275-85 (1989)). Іншою корисною особливістю анексинового промотора є його профіль експресії в насінні, що розвивається. Анексиновий промотор є більш активним на ранніх стадіях розвитку (до 10 днів після запилення), та до значної міри безсимптомним на більш пізніх стадіях. Профіль експресії анексинового промотора відрізняється від більшості насіння-специфічних промоторів, наприклад, промоторів запасних білків насіння, які часто забезпечують більш високу активність на пізніх стадіях розвитку (Chen et al., Dev. Genet 10:112-122 (1989); Ellerstrom et al., Plant MoI. Biol. 32:1019-1027 (1996); Keddie et al., Plant MoI. Biol. 24:327-340 (1994); Plant et al., (supra); Li1 (supra)). Анексиновий промотор має більш стандартний профіль експресії, але залишається несхожим на інші відомі насіння-специфічні промотори. Таким чином, анексиновий промотор буде дуже привабливим кандидатом, коли надекспресія або пригнічення гена в зародку є бажаними на ранніх стадіях розвитку. Наприклад, він може бути бажаним для надекспресії гена, регулюючого ранній розвиток зародка, або гена, включеного в метаболізм перед дозріванням насіння. Після ідентифікації відповідного промотора, придатного для експресії специфічної послідовності, кодуючої дельта-5 десатуразу, промотор функціонально зв’язується у сенсі орієнтації з використанням звичайних засобів, добре відомих спеціалісту в даній галузі техніки. Стандартна рекомбінантна ДНК та методи молекулярного клонування, застосовані в даній заявці, є добре відомими з рівня техніки та більш повно описані в таких документах: Sambrook, J. et al., In Molecular Cloning: A Laboratory Manual; 2 ed.; Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York, 1989 (hereinafter "Sambrook et al., 1989" ) або Ausubel, F. M., Brent, R., Kingston, R. E., Moore, D. D., Seidman, J. G., Smith, J. A. та Struhl, K., Eds.; In Current Protocols in Molecular Biology; John Wiley та Sons: New York, 1990 (hereinafter "Ausubel et al., 1990"). Як тільки рекомбінантний конструкт буде одержаний, він може потім бути введений в рослинну клітину, якій віддається перевага, за допомогою методів, добре відомих спеціалісту, обізнаному в даному рівні техніки (наприклад, трансфекція, трансформація та електропорація). Клітини олійних рослин є рослинними клітинами, яким віддається перевага. Трансформовану рослинну клітину потім культивують та відновлюють в придатних умовах, котрі роблять можливою експресію довголанцюгових PUFA, які потім не обов’язково відновлюють та очищають. Рекомбінантні конструкти згідно з даним винаходом можуть вводитись в одну рослинну клітину; або, альтернативно, кожний конструкт може вводитись в окремі рослинні клітини. Експресія в рослинній клітині може завершуватися в нетривкий або стабільний спосіб, як описано вище. В насінні можуть експресуватися бажані довголанцюгові PUFA. Також в межах контексту цього винаходу є насіння або рослинні частини, одержані з таких трансформованих рослин. Рослинні частини включають диференційовані та недиференційовані тканини, зокрема: коріння, стебла, пагони, листя, пилок, насіння, пухлинну тканину та різноманітні форми клітин та культур (наприклад, окремі клітини, протопласти, зародки та калюсна тканина), але не обмежуються переліченими. Рослинна тканина може бути в рослині або в рослинному органі, тканиною або культурою. Таким чином, даний винахід також стосується способу трансформування клітини, що включає трансформування клітини з рекомбінантним конструктом згідно з даним винаходом та відбір тих клітин, які трансформувались з рекомбінантним конструктом згідно з даним винаходом. Також становить інтерес спосіб продукування трансформованої рослини, що включає трансформування рослинної клітини з полінуклеотидами дельта-5 десатурази згідно з винаходом, що розглядається, та регенерування рослини з трансформованої рослинної клітини. Методи трансформування дводольних (перш за все з використанням Agrobacterium tumefaciens) та одержання трансгенних рослин були опубліковані, серед інших, для: бавовника (Патент США № 5,004,863; Патент США № 5,159,135); сої (Патент США № 5,569,834; Патент США № 5,416,011); галлиці капустної (Патент США № 5,463,174); арахісу (Cheng et al. Plant Cell Rep. 15:653-657 (1996); McKently et al. Plant Cell Rep. 14:699-703 (1995)); папаї (Ling, K. et al. Bio/technology 9:752-758 (1991)); та гороху (Grant et al. Plant Cell Rep. 15:254-258 (1995)). Для ознайомлення з іншими загальними методами трансформації рослин дивляться Newell, CA. (Mo/. Biotechnol. 16:53-65 (2000)). Один з цих методів трансформації використовував 24 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 Agrobacterium rhizogenes (Tepfler, M. та Casse-Delbart, F. Microbiol. Sci. 4:24-28 (1987)). Була опублікована трансформація сої з використання прямого вивільнення ДНК, застосовуючи PEGзлиття (Публікація РСТ №), електропорацію (Chowrira, G.M. et al., MoI. Biotechnol. 3:17-23 (1995); Christou, P. et at., Proc. Natl. Acad. ScL U.S.A. 84:3962-3966 (1987)), мікроін’єкцію та бомбардування частинок (McCabe, D. E. et. al., Bio/Technology 6:923 (1988); Christou et al., Plant Physiol. 87:671-674 (1988)). Існує багато різноманітних способів регенерування рослин з рослинної тканини. Специфічний спосіб регенерації буде залежати від стартуючої рослинної тканини та конкретного виду рослин, що будуть регенеруватись. Регенерація, розвиток та культивування рослин з одиничних рослинних протопластових трансформантів або з по-різному трансформованих експлантів є добре відомими з рівня техніки (Weissbach та Weissbach, In: Methods for Plant Molecular Biology, (Eds.), Academic: San Diego, CA (1988)). Ця трансформація та процес вирощування, типово, включають етапи відбору трансформованих клітин та культивування їх індивідуальних клітин через звичайні стадії зародкового розвитку. Трансгенні зародки та насіння регенеруються подібно. Одержані трансгенні вкоріненні паростки потім пересаджують у відповідне ростове середовище, таке як грунт. Переважно, регенеровані рослини самоопиляються, щоб забезпечити гомозиготні трансгенні рослини. На противагу, пилок, одержаний з регенерованих рослин, переносять на вирощені з насіння рослини агрономічно важливих ліній. З іншого боку, пилок з рослин цих важливих ліній використовують для опилення трансгенних рослин. Трансгенна рослина згідно з даним винаходом, що містить бажаний роліпептид, культивується за допомогою способів, добре відомих спеціалісту в даній галузі. В доповнення до обговорених вище процедур практикуючі фахівці знайомі із стандартними ресурсними матеріалами, що описують специфічні умови та процедури для: конструювання, маніпуляції та виділення макромолекул (наприклад, молекул ДНК, плазмід і т.п.); одержання фрагментів рекомбінантних ДНК та рекомбінантних експресійних конструктів; та відбір і виділення клонів. Дивись, наприклад: Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor: NY (1989); Maliga et al., Methods in Plant Molecular Biology, Cold Spring Harbor: NY (1995); Birren et al., Genome Analysis: Detecting Genes, Vol.1, Cold Spring Harbor: NY (1998); Birren et al., Genome Analysis: Analyzing DNA1 Vol.2, Cold Spring Harbor: NY (1998); Plant Molecular Biology: A Laboratory Manual, eds. Clark, Springer: NY (1997). Приклади олійних рослин включають: сою, види Brassica, соняшник, маїс, бавовну, льон та софлору красильну, але не обмежуються переліченими. Приклади PUFA, що мають принаймні дванадцять атомів вуглецю чотири або більше вуглець-вуглуцевих подвійних зв’язків, включають омега-3 жирні кислоти, такі як EPA, DPA та DHA, та омега-6 жирну кислоту ARA. Насіння, одержане з таких рослин, є також в межах контексту цього винаходу, так само як і олія, одержана з такого насіння. Таким чином, в одному втіленні даний винахід стосується олійної рослини, що містить: (а) перший рекомбінантний конструкт ДНК, що містить ізольований полінуклеотид, який кодує поліпептид дельта-5 десатурази, функціонально зв’заний з принаймні однією регуляторною послідовністю та (b) принаймні один додатковий рекомбінантний конструкт ДНК, який містить ізольований полінуклеотид, функціонально зв’заний з принаймні однією регуляторною послідовністю, який кодує поліпептид, вибраний з групи, що складається з дельта-4 десатурази, дельта-5 десатурази, дельта-6 десатурази, дельта-8 десатурази, дельта-9 десатурази, дельта9 елонгази, дельта-12 десатурази, дельта-15 десатурази, дельта-17 десатурази, a C14/16 елонгази, C16/18 елонгази, C18/20 елонгази та C20/22 елонгази. Додаткові десатурази обговорені, наприклад, в патентах США №№ 6 075 183, 5 968 809, 6 136 574, 5 972 664, 6 051 754, 6 410 288 та публікаціях PCT №№ WO 98/46763, WO 98/46764, WO 00/12720 та WO 00/40705. Вибір комбінації використовуваних касет зокрема залежить ві профілю PUFA та/бо профілю десатураз/елонгаз клітин олійних рослин, що будуть трансформовані, та довголанцюгових PUFA, котрі будуть експресуватися. В іншому аспекті даний винахід стосується способу одержання довголанцюгових PUFA в рослинні клітині, що включає: (a) трансформування клітини з рекомбінантним конструктом згідно з даним винаходом та (b) відбір таких трансформованих клітин, що продукують довголанцюгові PUFA. Ще в іншому аспекті даний винахід стосується способу продукування принаймні однієї PUFA в клітині сої, що включає: (a) трансформування клітини сої з першим конструктом рекомбінантної ДНК, що містить: 25 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 (і) виділений полінуклеотид, кодуючий поліпептид дельта-5 десатурази, який є функціонально зв’заним принаймні з однією регуляторною послідовністю та (іi) принаймні один додатковий конструкт рекомбінантної ДНК, який містить виділений полінуклеотид, функціонально зв’заний з принаймні однією регуляторною послідовністю, який кодує поліпептид, вибраний з групи, що складається з дельта-4 десатурази, дельта-5 десатурази, дельта-6 десатурази, дельта-8 десатурази, дельта-9 десатурази, дельта-9 елонгази, дельта-12 десатурази, дельта- 15 десатурази, дельта-17 десатурази, C14/16 елонгази, C16/18 елонгази, C18/20 елонгази та C20/22 елонгази; (b) регенерування соєвої рослини з трансформованої в кроці (а) клітини та (c) відбір такого насіння, одержаного з рослин в кроці (b), що має змінений рівень PUFA у порівнянні з рівнем в насінні, одержаному з нетрансформованої рослини сої. В інших переважних втіленнях принаймні один додатковий конструкт рекомбінантної ДНК кодує поліпептид, що має активність дельта-9 елонгази, наприклад, дельта-9 елонгази, виділеної або одержаної з lsochrysis galbana (GenBank Accession № AF390174; lgD9e), або дельта-9 елонгази, виділеної або одержаної з Euglena gracilis. В інших переважних втіленнях принаймні один додатковий конструкт рекомбінантної ДНК кодує поліпептид, що має активність дельта-8 десатурази. Наприклад, публікація WO 2005/103253 (опубліковано 22 квітня 2005) розкриває амінокислотну та нуклеїнокислотну послідовність ферменту дельта-8 десатурази з Pavlova salina (дивись також US 2005/0273885). Sayanova et al. (FEBS Lett. 580:1946-1952 (2006)) описує виділення та охарактеризування кДНК з амеби Acanthamoeba castellanii, яка живее в грунті, вказана кДНК, коли експресується в Arabidopsis, кодує C20 дельта-8 десатуразу. Також Заявники, що є співвласниками попередньої заявки з № 60/795,810, прийнятої 28 квітня 2006 (Attorney Docket № BB-1566), описують амінокислотні та нуклеїнокислотні послідовності фермента дельта-8 десатурази Pavlova lutheri (CCMP459). Патентна заявка US 60/853,563 (прийнята 23 жовтня 2006; Attorney Docket № BB1574) описує амінокислотні та нуклеїнокислотні послідовності фермента дельта-8 десатурази з Tetruetreptia pomquetensis CCMP1491, Eutreptiella sp. CCMP389 та Eutreptiella cf_gymnastica CCMP1594. Мікробіологічні експресійні системи. Касети і вектори та трансформація Гени дельта-5 десатурази та генні продукти, описані в даній заявці (тобто, дельта-5 десатурази Euglena gracils або інші мутантні ферменти, кодон-оптимізовані ферменти або їх гомологи), також можуть продукуватись в гетерологічних мікробних клітинах-хазяїнах, особливо в клітинах олійних дріжджів (наприклад, Yarrowia lipolytica). Мікробні системи експресії та вектори експресії, що містять регуляторні послідовності, які спонукають високу експресію чужерідних протеїнів, добре відомі спеціалісту, обізнаному в даному рівні техніки. Будь-який з них може використовуватися для конструювання химерних генів для одержання будь-якого з генних продуктів послідовностей, що становлять інтерес. Ці химерні гени можна потім вводити у відповідні мікроорганізми шляхом трансформації, щоб забезпечити високорівневу експресію закодованих ферментів. Вектори або ДНК-касети, корисні для трансформації придатних мікробних клітин-хазяїв, добре відомі з рівня техніки. Специфічний вибір послідовностей, присутніх в конструкті, залежить від бажаних продуктів експресії (вище), природи клітини-хазяїна та запропонованих засобів відбору трансформованих клітин від нетрансформованих клітин. До того ж, типово, вектор або касета містять послідовності, що направляють транскрипцію та трансляцію релевантного гена(ів), здатний до відбору маркер та послідовності, дозволяючі автономне реплікування або хромосомне інтегрування. Придатні вектори містять ділянку-5’ гена, що контролює транскрипційну ініціацію (наприклад, промотор) та ділянку-3' фрагмента ДНК, що контролює транскрипційну термінацію (тобто, термінітор). Вважається за краще, коли обидві контролюючі ділянки походять з трансформованих мікробних клітин-хазяїв, хоча зрозуміло, що не має необхідності отримувати такі контролюючі ділянки з природних генів специфічних видів, вибраних як продукуючі організми. Контролюючі ініціацію ділянки або промотори, що є корисними для того, щоб направляти експресію ORF дельта-5 десатурази, що розглядається, в бажані мікробні клітини-хазяїни є багато чисельними та відомими спеціалісту в даній галузі техніки. Фактично будь-який промотор, здатний направляти експресію цих генів у вибрані клітини-хазяї, є придатним для даного винаходу. Експресія в мікробних клітинах-хазяїнах може завершуватися в нестійкому режимі або в стабільному режимі. Нестійка експресія може завершуватися стимулюванням активності здатного регулюватися промотора, функціонально зв’заного з геном, що становить інтерес. Стабільна експресія може бути досягнена шляхом застосування конститутивного промотора, функціонально зв’заного з геном, що становить інтерес. Як наприклад, коли клітина 26 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 60 хазяїн є дріжджами, то забезпечуються транскрипційні та трансляційні ділянки, що функціонують в дріжджах, особливо від видів-хізяїв (наприклад, дивись WO 2004/101757 та WO 2006/052870 для переважних ініціюючих транскрипцію контролюючих ділянок для застосування в Yarrowia lipolytica). Будь-яка одна з ряду регуляторних послідовностей може використовуватися, залежно від того яка з двох, конститутивна чи ініціююча транскрипцію, є бажаною, від ефективності промотора в експресуванні ORF, що становить інтерес, від простоти конструкції і тому подібне. Нуклеотидні послідовності, що оточують ініціюючий транскрипцію кодон 'ATG', були знайдені, щоб впливати на експресію в клітинах дріжджів. Якщо бажаний поліпептид погано експресується в дріжджах, то нуклеотидні послідовності екзогенних генів можуть бути модифіковані, щоб включати ефективну ініціюючу транскрипцію послідовність дріжджів для одержання оптимальної генної експресії. Для експресії в дріжджах це може бути зроблене за допомогою сайт-направленого мутагенезу гена, що експресується неефективно, шляхом його злиття всередині рамки з ендогенним дріжджовим геном, переважно високоекспресивним геном. Альтернативно, він може визначати консенсусну послідовність, що ініціює трансляцію в хазяїні, та створювати цю послідовність в гетерологічних генах для їх оптимальної експресії в організмах, що становлять інтерес. Термінуюча ділянка може бути одержана з 3'-ділянки гена, з якого була одержана ініціююча ділянка, або з іншого гена. Відома велика кількість термінуючи ділянок, що задовільно функціонують в різноманітних хазяїнах (коли використовували обидва в тому ж самому або відмінних родах та видах від того, де вони були отримані). Термінуючу ділянку зазвичай вибирають більше для зручності, а не через які-небудь специфічні властивості. Переважно, коли мікробним господарем є клітина дріжджів, то термінуючу ділянку одержують з дріжджового гена (зокрема Saccharomyces, Schizosaccharomyces, Candida, Yarrowia або Kluyveromyces). Також відомо, що 3'-ділянки генів ссавців, кодуючих γ-інтерферон та α-2 інтерферон, функціонують в дріжджах. Контроюючі термінацію ділянки можутьбути одержані з різноманітних вроджених генів переважних хазяїв. Необов’язково, може бути зайвим сайт термінації; проте, вважається за краще, якщо він включений. Термінаційні ділянки, корисні в даному описі, включають: ~100 bp 3'-ділянку екстра целюлярної протеази Yarrowia lipolytics (XPR; GenBank Accession № M17741); термінатори ацил-coA оксидази (Aco3: Gen Bank Accession № AJ001301 та № CAA04661; Pox3: GenBank Accession № XP_503244); термінатори Pex20 (GenBank Accession № AF054613; термінатори Pex16 (GenBank Accession № U75433; термінатор Lip1 (GenBank Accession № 250020); термінатори Lip2 (GenBank Accession № AJ012632; та термінатори 3-оксоацил-coA тіолази (OCT; GenBank Accession № X69988), але не обмежуються переліченими. Як відомо спеціалісту в даній галузі, сама по собі інерція гена в клоную чий вектор не гарантує, що він буде успішно експресовинай на необхідному рівні. У відповідь на потребу високих рівнів експресіі було створено багато спеціалізованих векторів експресіі за допомогою маніпуляції з рядом різних генетичних елементів, що контролюють аспекти транскрипції, трансляції, протеїнової стабільності, кислотного обмеження та секреції з мікробних клітинхазяїв. Більш конкретно, деякі з молекулярних особливостей, якими маніпулювали, щоб контролювати експресію гена, включають: (1) природу релевантного транскрипційного промотора та термінуюючих послідовностей; (2) кількість копій клонованого гена та переноситься ген плазмідою чи є інтегрованим в геном клітини-хазяїна; (3) остаточне розташування синтезованого чужерідного протеїну в клітині; (4) ефективність транскрипції та правильне згортання протеїну в клітині хазяїна; (5) власна стабільність мРНК та протеїну клонованого гена в межах клітини-хазяїна та (6) використання кодону в межах клонованого гена, виходячи з того, що його частота наближається до частоти використання кодону, переважного для клітини-хазяїна. Кожний з цих типів модифікацій охоплений в даному винаході, оскільки направлений на сприяння подальшій оптимізації експресії дельта-5 десатурази, описаній в даній заявці. Як тільки ДНК, що кодує поліпептид, придатний для експресії у відповідній мікробній клітиніхазяїні (наприклад, олійні дріжджіі), буде отримана (наприклад, химерний ген, що містить промотор, ORF та термінатор), то вона поміщається в в плазмідний вектор, здатний до автономної реплікації в клітині-хазяїні, або безпосередньо інтегрується в геном клітини-хазяїна. Інтеграція касет експресії може відбуватись навмання в межах генома-хазяїна або може бути націленою через застосування конструктів, що містять ділянки гомології з геномом хазяїна, достатньої, щоб націлити рекомбінацію в межах локуса-хазяїна. Коли конструкти націлені на ендогенний локус, то усі або деякі транскрипційні та трансляційні регуляторні ділянки можуть бути забезпечені ендогенним локусом. 27 UA 102668 C2 5 10 15 20 25 30 35 40 45 50 55 В даному винаході переважний спосіб експресування генів в Yarrowia lipolyticа – це інтегрування лінійної ДНК в геном хазяїна; інтегрування в чисельні позиції в межах генома може бути особливо корисним, коли є бажаною високорівнева експресія генів [наприклад, в локус Ura3 (GenBank Accession № AJ306421), генний локус Leu2 (GenBank Accession № AF260230), ген Lys5 (GenBank Accession № M34929), генний локус Aco2 (GenBank Accession № AJ001300), генний локус Pox3 (Pox3: GenBank Accession № XP_503244; або Aco3: GenBank Accession № AJ001301), генний локус дельта-12 десатуразаи (WO 2004/104167), генний локус Lip1 (GenBank Accession № Z50020) та/бо генний локус Lip2 (GenBank Accession № AJ012632)]. Вигідно, ген Ura3 може бути використаний повторно в комбінації з 5-фторооротокислотною селекцієюю (моногідрат 5-фторурацил-6-карбонової кислоти; "5-FOA") (нижче), щоб дозволити генетичним модифікаціям легко інтегруватися в геном Yarrowia у не потребуючий зусиль спосіб. Коли два або більше генів експресується з окремих реплікаційних векторів, то бажано, щоб кожний вектор мав відмінні засоби селекції та не мав гомології до іншого конструкта(ів), щоб підтримувати стійку експресію та запобігти рекомбінації елементів серед конструктів. Розумний вибір регуляторних ділянок, засобів відбору та способів розмноження введеного конструкта(ів) повинний бути визначений експериментально для того, щоб усі введені гени експресувались на необхідному рівні, забезпечуючи синтез бажаних продуктів. Конструкти, що містять ген, який становить інтерес, можуть бути введені в мікробну клітинухазяїн за допомогою стандартних способів. Ці способи включають тарнсформацію (наприклад, трансформація з ацетатом літію [Methods in Enzymofogy, 194:186-187 (1991)]), протопластне злиття, болістичний удар, електропорацію, мікроін’єкції або будь-який інший спосіб, яким вводять ген, що становить інтерес, в клітину-хазяїн. Більш спеціальні способи, застосовні для олійних дріжджів (тобто, Yarrowia lipolytica) включають U.S. 4,880,741 та US 5 071 764 та Chen, D. C. et al. (Appl. Microbiol. Biotechnol., 48(2):232-235 (1997)). Для зручності, клітина-хазяїн, з якою будуть маніпулювати за допомогою будь-якого способу, щоб вона прийняла послідовність ДНК (наприклад, касету експресії), буде відноситись як до "трансформованої, так і до рекомбінантної" в даному описі. Таким чином, термін "трансформований" та "рекомбінантний" в даному описі використовуються рівнозначно. Трансформований хазяїн буде мати принаймні одну копію експресійного конструкту та може мати дві і більше, в залежності від того, чи є ген інтегрованим в геном, ампліфікованим чи присутнім на екстрахромосомальному елементі, що має чисельні кількості копій. Трансформована клітина-хазяїн може бути ідентифікована за допомогою різноманітних селекційних способів, як описано в WO 2004/101757 та WO 2006/052870. Переважними селекційними способами для використання в даній заявці є резистентність до канаміцину, гідроміцину та аміноглікозиду G418, так само як і здатність рости на середовищі, збідненому щодо урацилу, лейцину, лізину, триптофану або гістидину. Є сполука, токсична для дріжджових клітин, що володіє функціонуванням гена URA3, який кодує оротидин 5монофосфатдекарбоксилазу (OMP декарбоксилаза); таким чином, базуючись на цій токсичності, 5-FOA є особливо корисною для відбору та ідентифікації URA мутантів дріжджових штамів (Bartel, P. L. та Fields, S., Yeast 2-Hybrid System, Oxford University: New York, v. 7, pp 109147, 1997). Більш конкретно, він може першим нокаутувати природний ген Ura3 для продукування штаму, що має Ura фенотип, де відбір відбувається, базуючись на резистентності до 5-FOA. Потім, кластер складних химерних генів та новий ген Ura3 можуть бути інтегровані в + різні локуси геному Yarrowia, щоб таким чином продукувати новий штам, що має Ura фенотип. Подальша інтеграція призводить до нового штаму Ura3 (знову ідентифікують, використовуючи 5-FOA селекцію), коли нокаутується введений ген Ura3. Таким чином, ген Ura3 (в комбінації з 5FOA селекцією) може бути застосований як селекційний маркер у багаторазових циклах трансформації. Після перетворення субстрати, придатні для для дельта-5 десатурази, що розглядається (та, необов’язково інші ферменти PUFA, що коекспресуються в клітині-хазяїні), можуть продукуватия хазяїном або природним шляхом, або трансгенно, або вони можуть бути забезпечені екзогенно. Мікробні клітини-хазяї для експресії генів та нуклеїнокислотних фрагментів, що розглядаються, можуть включати хазяї, що вирощуються задля різноманітної сировини для промисловості, включаючи прості і складні карбогідрати, жирні кислоти, органічні кислоти, жири та спирти, та/бо гідрокарбонати, при широкому температурному режимі та значеннях рН. Виходячи з потреб заявника, гени, описані у винаході, що розглядається, будуть експресуватись в олійних дріжджах (зокрема в Yarrowia lipolytica); однак, через те, що апарат для транскрипції, трансляції та протеїнового біосинтезу є високо консервативним, задумано, щоб будь-яка 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDelta-5 desaturase and its using for produciton of polyunsaturated fatty acids
Автори англійськоюDamude, Howard, G., Zhu, Quinn, Qun
Назва патенту російськоюДельта-5-десатураза и ее применение в продуцировании полиненасыщенных жирных кислот
Автори російськоюДамудэ Ховард Дж., Зху Квинн Квун
МПК / Мітки
МПК: C12N 15/53, C12P 7/64, C12N 9/02
Мітки: кислот, дельта-5-десатураза, жирних, продукуванні, поліненасичених, застосування
Код посилання
<a href="https://ua.patents.su/219-102668-delta-5-desaturaza-i-zastosuvannya-v-produkuvanni-polinenasichenikh-zhirnikh-kislot.html" target="_blank" rel="follow" title="База патентів України">Дельта-5-десатураза і її застосування в продукуванні поліненасичених жирних кислот</a>
Попередній патент: Людське нейтралізуюче антитіло проти в7rp1
Наступний патент: Застосування інгібіторів dpp iv
Випадковий патент: Спосіб комплексної обробки литого металорізального інструменту