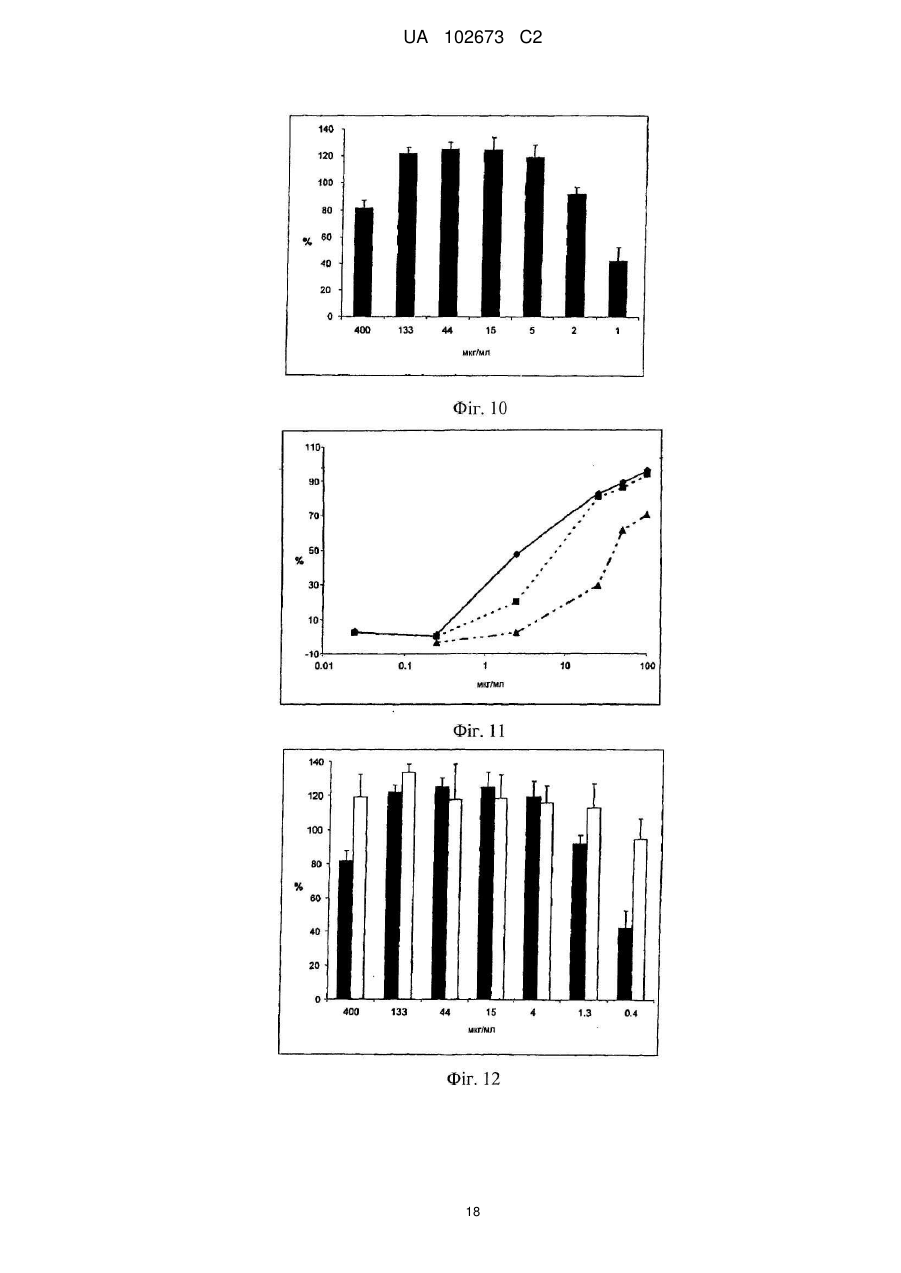
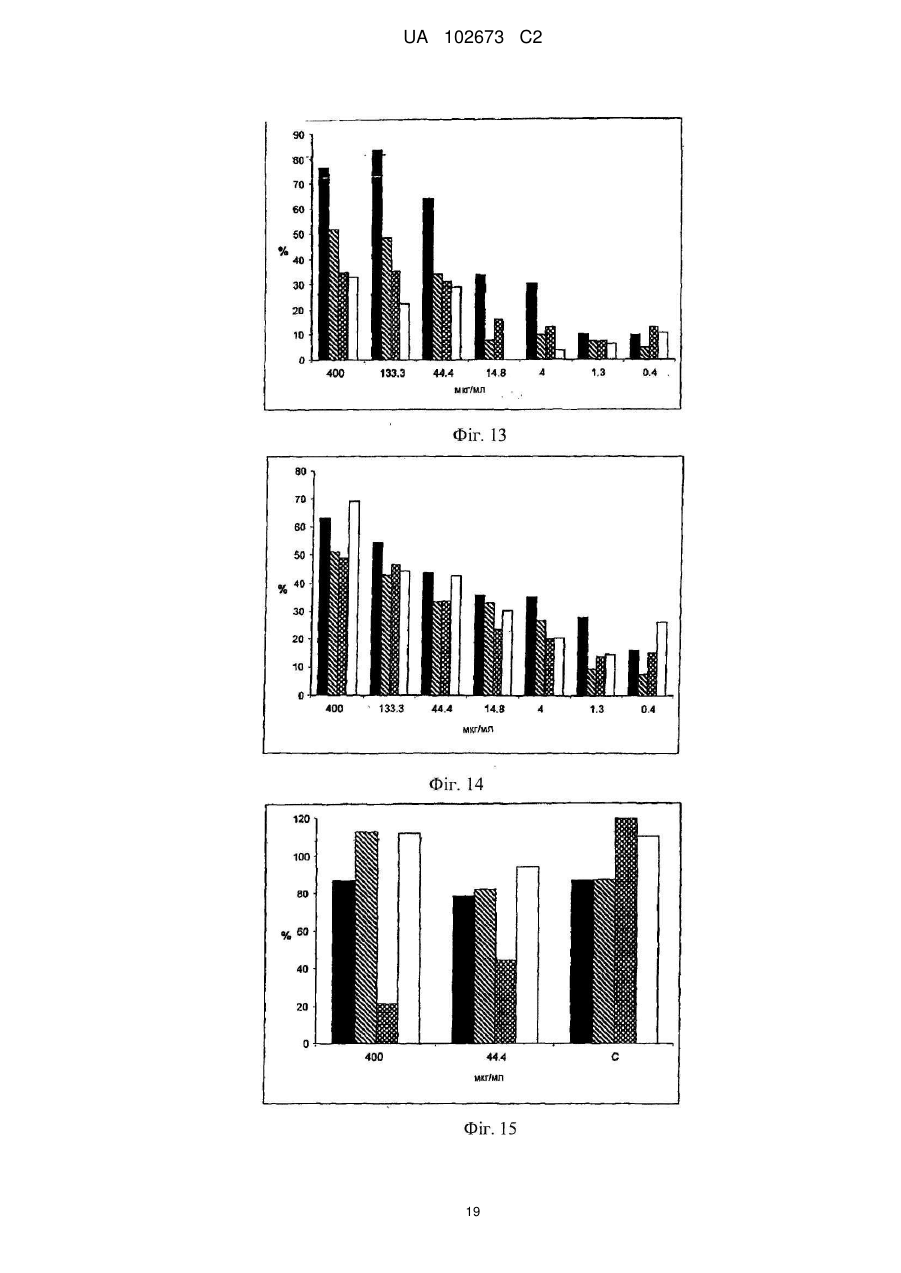
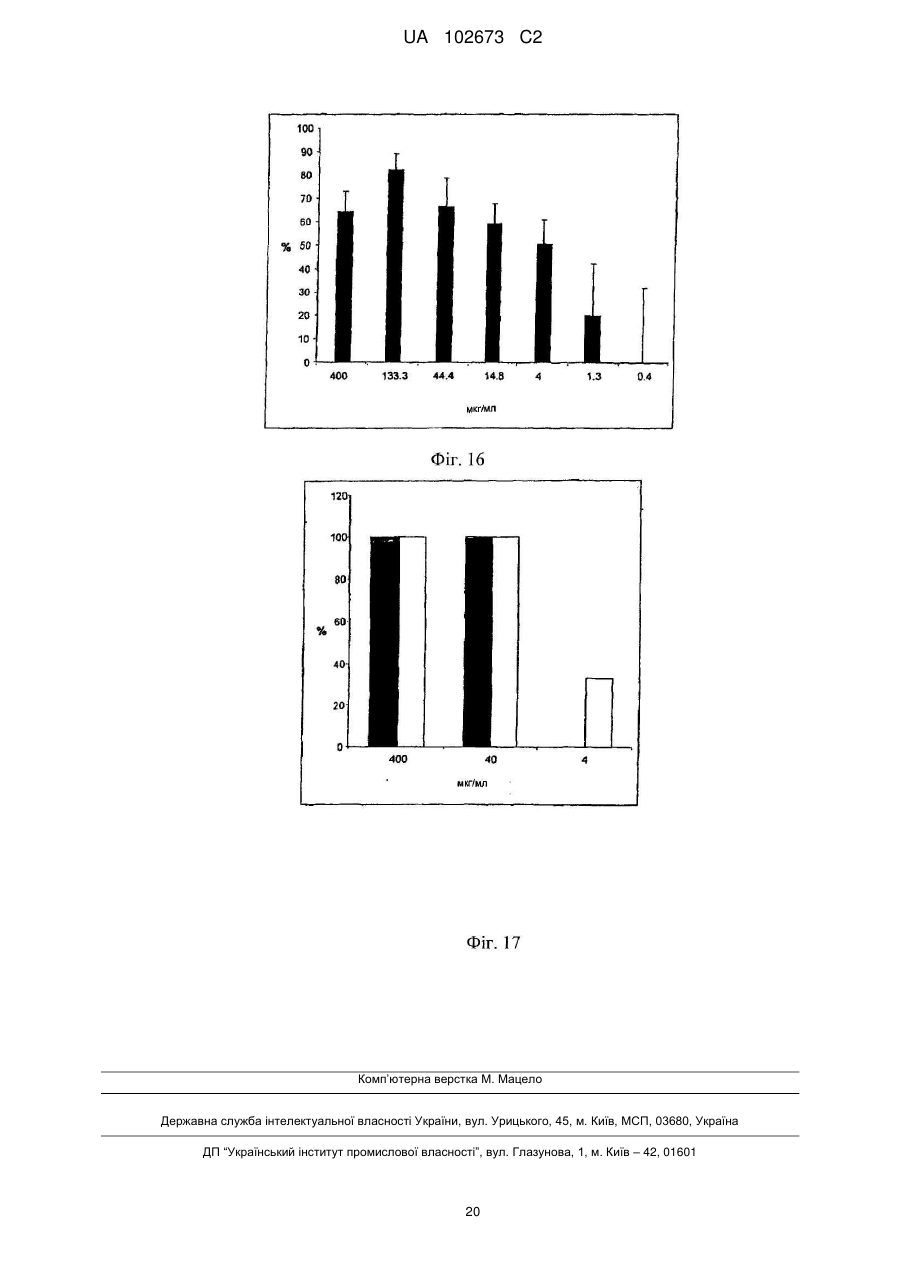
Застосування йота-карагенану як противірусного активного інгредієнта
Формула / Реферат
1. Застосування йота-карагенану у противірусно ефективній кількості як противірусного активного інгредієнта для виготовлення фармацевтичної композиції або лікарського засобу для профілактичного або терапевтичного лікування симптому, стану або захворювання, викликаного або пов'язаного з інфекцією респіраторним вірусом, вибраним із групи, що складається з параміксовірусів, вірусу грипу А людини й аденовірусу субтипу В.
2. Застосування йота-карагенану за п. 1, де зазначений параміксовірус вибраний із групи, що складається з вірусу парагрипу людини (HPV) 1 типу, HPV 2 типу, HPV 3 типу, НPV 4 типу і RSV.
3. Застосування йота-карагенану за п. 1 або 2, де зазначений патологічний стан або захворювання вибрано з групи, що складається з гострого бронхіту, хронічного бронхіту, риніту, синуситу, крупу, гострого капілярного бронхіту, фарингіту, тонзиліту, ларингіту, трахеїту, астми і пневмонії, і де симптом вибраний із групи, що складається з лихоманки, болю, запаморочення, тремтіння, потовиділення і зневоднювання.
4. Застосування йота-карагенану за будь-яким з пп. 1-3, де противірусна фармацевтична композиція або лікарський засіб адаптовані для місцевого шкірного застосування або місцевого застосування на слизистих і переважно виготовлені як лосьйон для шкіри, крем, мазь, гель, порошок, включаючи порошок для інгаляцій, спрей, піну, рідкі краплі або розчин для полоскання рота і горла.
5. Застосування за будь-яким з пп. 1-3, де противірусна фармацевтична композиція або лікарський препарат адаптовані для перорального введення і переважно виготовлені у вигляді рідкого розчину або у вигляді напівтвердого або твердого препарату, такого як сухий порошок, таблетки, капсули або драже.
6. Застосування за п. 4 або 5, де композиція є рідкою або напівтвердою і містить як готовий до застосування препарат йота-карагенан у кількості 0,01-10 %, переважно 0,01-5 %, найбільш переважно 0,1-2 % по масі, по відношенню до загальної кількості препарату.
7. Застосування за п. 5, де композиція є твердою і містить як готовий до застосування препарат йота-карагенан у кількості 0,01-10 %, переважно 0,01-5 %, найбільш переважно 0,1-2 % по масі.
8. Застосування за п. 1, де композиція додатково містить каппа-карагенан, де композиція містить 50 % або більше, переважно 70 % або більше, або 95 % або більше по масі сухої речовини йота-карагенану, по відношенню до загальної сухої маси карагенанів, що є присутніми в композиції.
9. Застосування за будь-яким з пп. 1-8, де зазначена композиція додатково містить щонайменше один фармацевтично прийнятний носій і/або допоміжну речовину, де вказана фармацевтично прийнятна допоміжна речовина вибрана з хлориду натрію і хлориду калію і
присутня в композиції у кількості 1 % або менше, переважно 0,6 % або менше.
10. Застосування за будь-яким з пп. 1-9, де композиція містить частину або весь йота-карагенан у вигляді солі, переважно у вигляді натрієвої солі.
11. Застосування за будь-яким з пп. 1-10, де композиція зафіксована за допомогою нанесення покриття або імпрегнування твердої поверхні предмета гігієни або санітарії, вибраного з групи, яка складається з санітарної рукавички, тканини або паперу, носової хустинки або серветки, ватного аплікатора, пилозахисної маски або санітарної чи медичної маски для обличчя.
12. Застосування за будь-яким з пп. 1-10, де композиція входить до складу губної помади.
13. Застосування за будь-яким з пп. 1-12, де композиція додатково містить некарагенанову фізіологічно активну сполуку, де зазначена сполука необов'язково виступає як основний активний інгредієнт.
14. Застосування за п. 13, де йота-карагенан є присутнім як протипараміксовірусний або протиортоміксовірусний ад'ювант разом з одним або декількома некарагенановими фізіологічно активними речовинами, які звичайно застосовуються при профілактиці або лікуванні інфекцій і/або запальних захворювань, алергій і/або станів ослабленої або пригніченої імунної системи.
15. Застосування за будь-яким з пп. 1-14, де симптом, стан або захворювання має місце у індивідуума, який є пацієнтом з високим ризиком, який вибраний із групи, що складається з COPD-пацієнта, пацієнта з астмою, людини з алергією, людини з ослабленою імунною, серцевою або дихальною системою і трансплантологічного пацієнта.
Текст
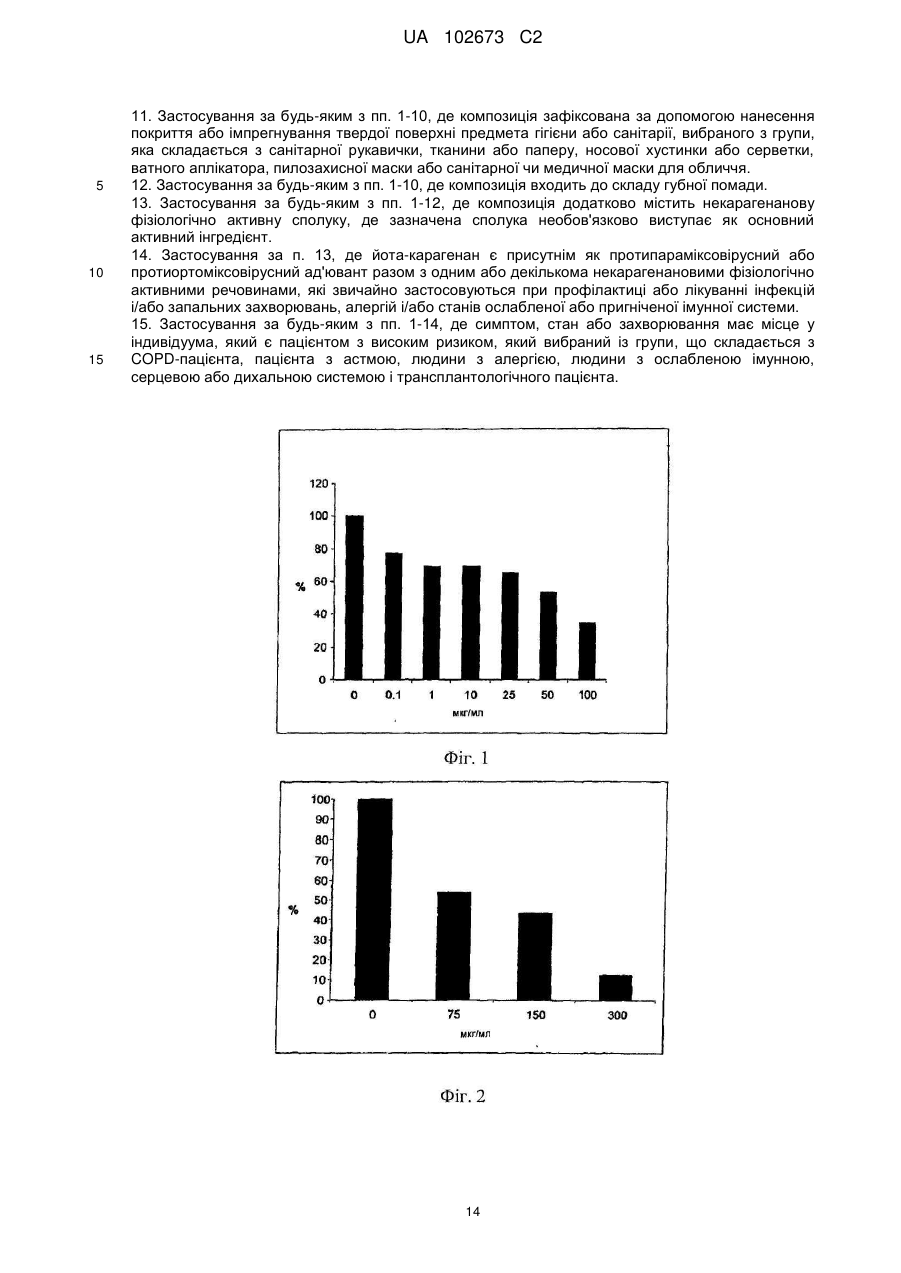
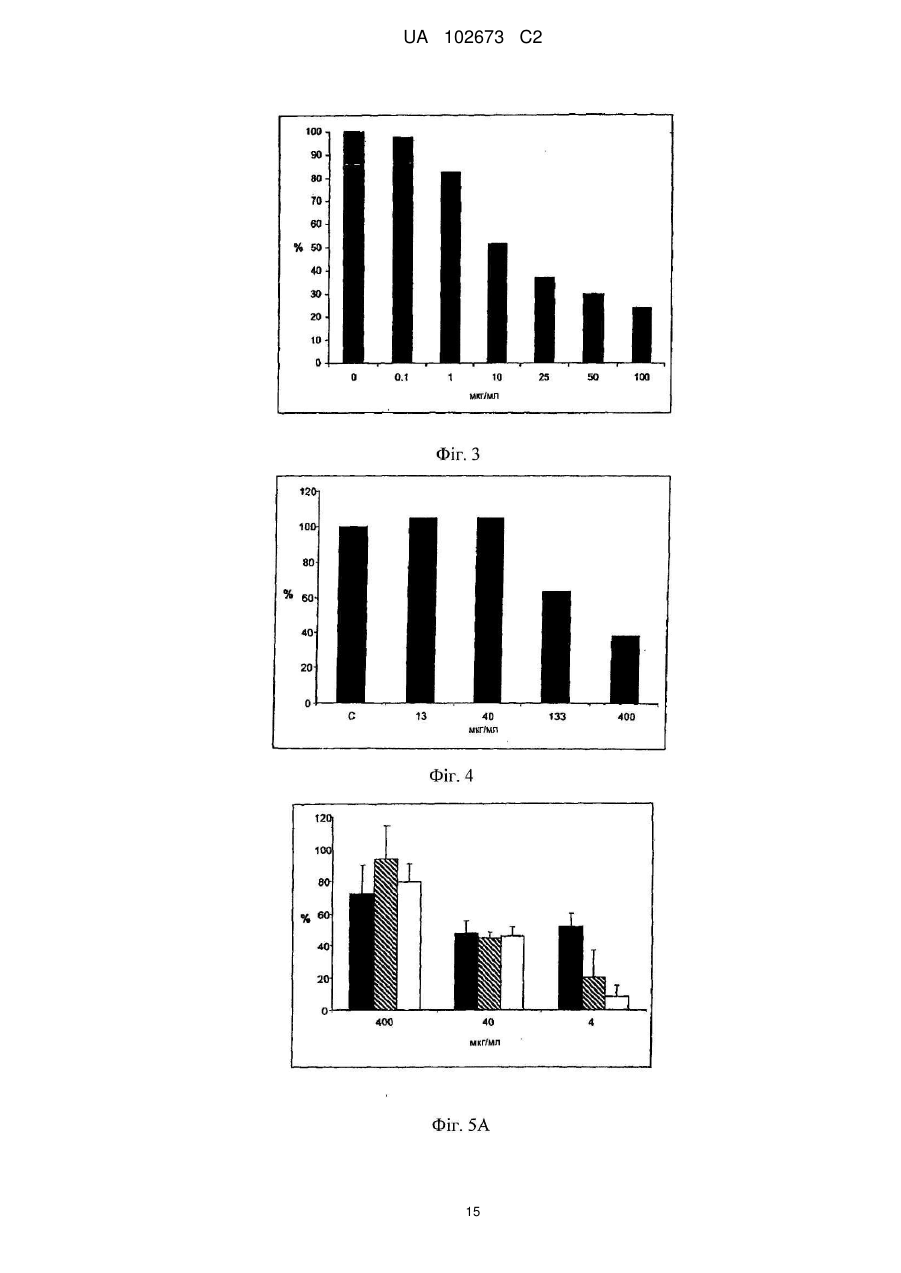
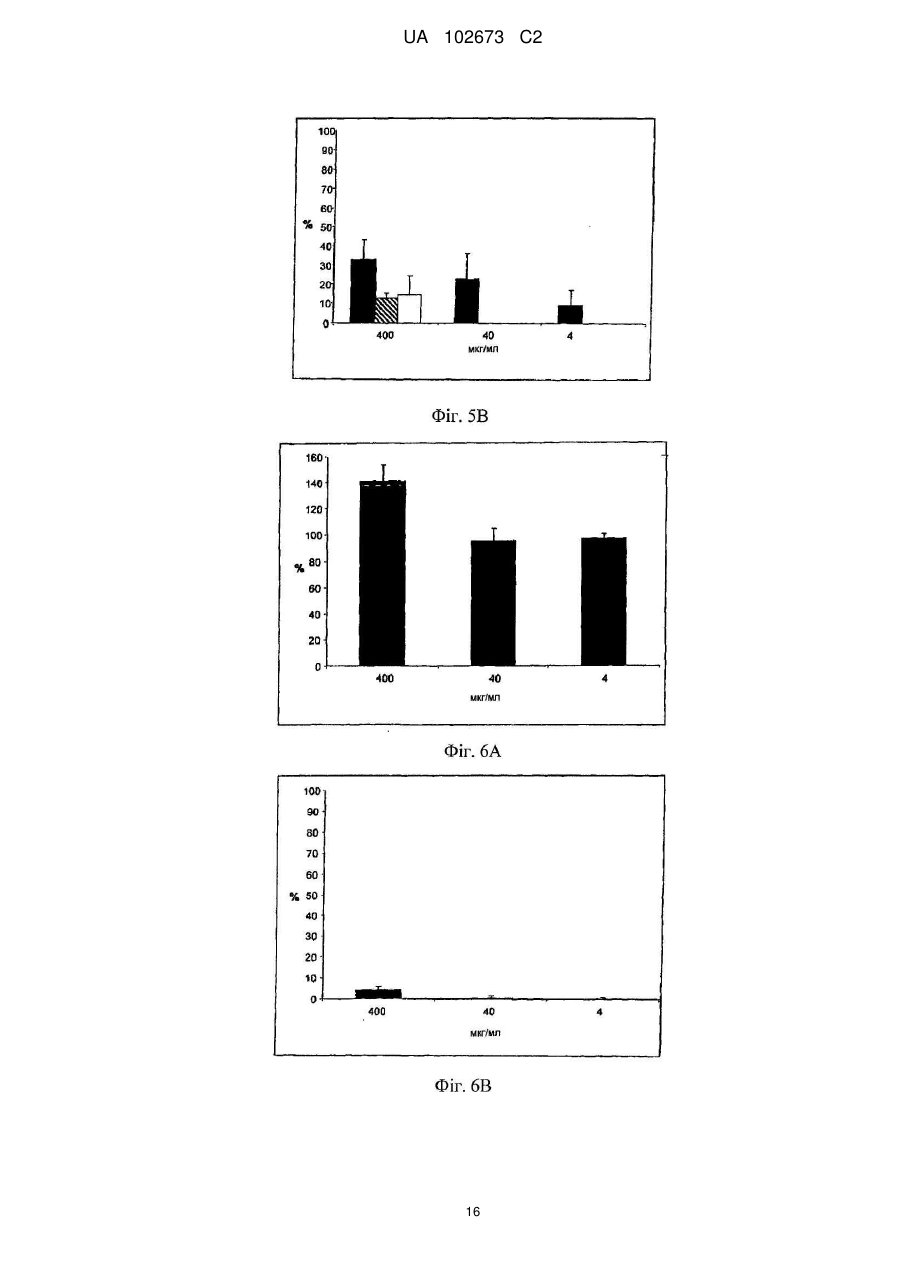
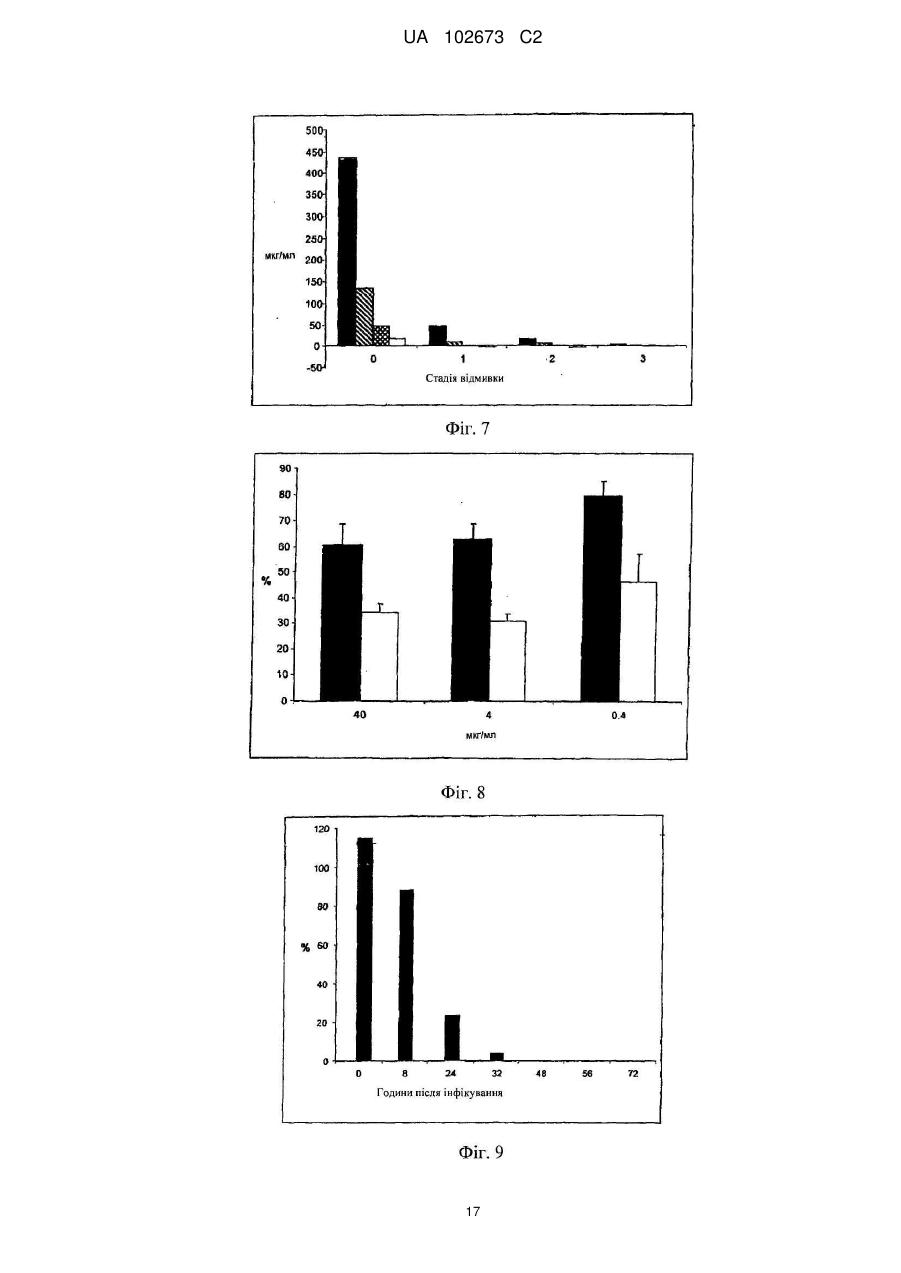
Реферат: Винахід належить до галузі медицини і стосується застосування йота- і/або каппа-карагенану як противірусного активного інгредієнта при виготовленні фармацевтичної композиції або лікарського засобу для профілактичного або терапевтичного лікування симптому, стану або захворювання, викликаного або пов'язаного з інфекцією респіраторним вірусом, зокрема параміксовірусом, вірусом грипу А людини й аденовірусом субтипу В. UA 102673 C2 (12) UA 102673 C2 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 ГАЛУЗЬ ТЕХНІКИ Даний винахід стосується сульфатованих полісахаридів, вибраних із групи карагенанів і фукоїданів і фармацевтичних композицій на їх основі, де зазначені сульфатовані полісахариди присутні як противірусні активні інгредієнти для медичного або ветеринарного застосування або застосування при лікуванні або профілактиці захворювань, викликаних або пов'язаних із потраплянням вірусу в організм індивідуума через дихальні шляхи, де вірус вибраний із групи Orthomyxoviridae, Paramyxoviridae, Adenoviridae і Coronaviridae. ПЕРЕДУМОВИ ВИНАХОДУ Orthomyxoviridae являють собою РНК-віруси, членами що найбільш виділяються є види вірусу грипу. Віруси грипу A і B являють собою два типи вірусів грипу, які викликають епідемічні захворювання у людей. Типово, вони поширюються від людини до людини, переважно респіраторно-краплинним шляхом. Сімейство Paramyxoviridae містить респіраторно-синцитіальний вірус (RSV), вірус парагрипу і вірус метапневмонії. Інфекції RSV і віруси парагрипу можуть приводити до серйозних респіраторних інфекцій у грудних дітей, дітей молодшого віку, але також можуть викликати важкі захворювання у людей похилого віку і дорослих з ослабленою імунною системою. Серед вірусів вірус парагрипу людини відомі чотири члени, які викликають серйозні респіраторні захворювання у дітей і для яких у даний час не доступна ефективна терапія або способи профілактики, ці чотири члени являють собою з 1 по 4 типи віруси парагрипу. Вважається, що спалаху вірусу парагрипу і RSV по суті сприяють збільшенню рівня смертності й госпіталізації. Пацієнти з ослабленою імунною, серцево-судинною або дихальною системами мають підвищений ризик зіштовхнутися із серйозними ускладненнями після інфекції параміксовірусом і, отже, матимуть особливу користь від противірусної терапії. Респіраторно-синцитіальний вірус (RSV), який є широко найрозповсюдженішим респіраторним патогеном, що типово уражає дітей у грудному віці і дошкільному віці в усьому світі, щорічно викликає спалахи пневмонії і бронхіту протягом зимового періоду і ранньої весни. RSV капілярний бронхіт і пневмонія вимагають госпіталізації сотень тисяч грудних дітей щороку. Пасивний захист від RSV доступний щонайменше частково при рівні успішності, що повідомлявся, 55 % при щомісячному внутрішньом'язовому введенні гуманізованих ® моноклональних анти-RSV антитіл палівізумаб (Синагіс ). Сімейство Coronaviridae включає коронавіруси і торовіруси. Відомо, що коронавіруси інфікують верхні дихальні шляхи і шлунково-кишковий тракт ссавців і птахів. Вважають, що коронавіруси є причиною великої процентної частки всіх простудних захворювань у дорослих людей. Adenoviridae являють собою ДНК-віруси, які типово інфікують верхні дихальні шляхи. В даний час відомо більше 50 різних серотипів аденовірусу людини, які розбиті на шість субтипів від A до F, які відповідальні за 5-10 % інфекцій верхніх дихальних шляхів у дітей. Приймаючи до уваги зазначене вище, вважають, що існує гостра необхідність у потужній противірусній фармацевтичній композиції, яку легко застосовувати і яка ефективна при профілактиці і лікуванні респіраторних вірусних інфекцій, викликаних членами сімейств Paramyxoviridae, Orthomyxoviridae, Coronaviridae і/або Adenoviridae. Протягом десятиліть відомо, що сульфатовані полісахариди, що містять карагенани і фукоїдан, мають противірусний ефект. Таким чином, відомий рівень техніки наповнений науковими статтями про противірусні ефекти карагенанів. У самому цікавому огляді Gonzalez M. E. et al. (1987, Antimicrob. Agents Chemother. 31, 1388-1393) повідомляють про противірусну ефективність різних сульфатованих полісахаридів, включаючи йота-карагенан, проти деяких вірусів тварин. Йота-карагенан показав противірусну активність проти оболонкових вірусів HSV1, HSV-2, вірусу лісу семліки (SFV), вірусу вісповакцини і вірусу африканської свинячої чуми (АSF) і проти голого вірусу енцефаломіокардиту (EMC). Йота-карагенан не чинив дію на оболонкові віруси - вірус везикулярного стоматиту (VSV) і вірус кору - і на голі віруси - вірус поліомієліту 1 типу й аденовірус 5 типу. Патент США 4783446 розкриває противірусну активність йота-, капа- і лямбда-карагенану проти ретровірусної інфекції, зокрема проти інфекції вірусом Т-клітинної лейкемії людини (HTLV) III. WO 88/06396 розкриває спосіб лікування ретровірусних інфекцій, включаючи HIV-інфекції, за допомогою введення карагенану або суміші карагенанів. Girond et al. (1991, Research Virol. 142, 261-270) розкривають, що сульфатовані полісахариди, подібні йота-, капа- і лямбда-карагенану, мають ефективну інгібіторну активність проти реплікації вірусу гепатиту А (HAV). 1 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 60 Baba M. et al. (1988, Antimicrob. Agents Chemother. 32, 1742-1745) розкривають деякі сульфатовані полісахариди, включаючи сульфат декстрану, полісульфат пентозану, фукоїдан і карагенан, як потужні інгібітори HSV-1, HSV-2, цитомегаловірусу людини (ЦМВ), вірусу везикулярного стоматиту (VSV), вірусу Синдбіс і HIV-1. З іншого боку, при тестуванні ці сульфатовані полісахариди виявилися неактивними проти вірусу коксаки, вірусу поліомієліту і вірусу парагрипу. EP 0293826 розкриває терапевтичне і профілактичне застосування сульфатованих полісахаридів, таких як фукоїдан і карагенани, для інгібування HIV-1 in vitro. Патент США 5658893 розкриває спосіб придушення інфекції клітин людини ротавірусом за допомогою зіткнення ротавірусу з лямбда-карагенаном. Також розкривається, що йота- і капакарагенан не виявляють активність проти ротавірусу. US 2003/181415 A розкриває, що для сульфатованих полісахаридів, включаючи сульфат целюлози, відома їх ефективність проти різних оболонкових вірусів і, зокрема проти вірусу простого герпесу (HSV), папіломавірусів і HIV. Фукоїдан являє собою сульфатований полісахарид, в основному виділюваний з різних видів коричневих морських водоростей. Існує два фармакологічних сорти фукоїданів, доступні на ринку, високомолекулярна фракція фукоїдану (HMWF) має середню молекулярну масу в діапазоні приблизно від 1000000 до 2000000 Да (наприклад, Kraeber, Germany) і низькомолекулярна фракція фукоїдану (НМФ) має середню молекулярну масу 8200 Да. Fфукоїдан в основному складається із сульфатованих ефірів фукози, тоді як U-фукоїдан складається приблизно з 20 % глюкуронової кислоти. Карагенан є родовим терміном для лінійних сульфатованих полісахаридів на основі галактози, екстрагованих з морських водоростей (Rhodophyceae). В основному він використовується як загусник, гелеутворювач, стабілізатор або емульсифікатор у фармацевтичних і харчових продуктах. Існує більше 10 структурно різних карагенанів, їх властивості залежать роду морських водоростей, з якого їх екстрагують. Три основних типи являють собою йота-, капа- і лямбда-карагенан, які трохи розрізняються за структурою і ступенем сульфатування. Йота-карагенан є м'яким гелетвірним сульфатованим галактаном, переважно виділюваним з червоних морських водоростей Gigartina stellata і Chondrus crispus. Капа-карагенан дає щільні, тверді гелі і його переважно роблять з Kappaphycus cottonii. Лямбдакарагенан, який є найрозповсюдженішою формою, часто використовується для згущення молочних продуктів. Незважаючи на те, що вже давно відома противірусна активність карагенанів проти таких вірусів як, наприклад HTV, HSV, HAV, HTLV або HPV, механізм, за допомогою якого карагенани виявляють противірусну активність, усе ще вимагає подальшого прояснення. Наприклад, Baba M. et al. (1988, Antimicrob. Agents Chemother. 32, 1742-1745) міркують про те, що сульфатовані полісахариди, включаючи капа- і лямбда-карагенан, придушують або щонайменше сприяють інгібуванню вірусної адсорбції деяких оболонкових вірусів на поверхні клітини-хазяїна. Подібним чином, US 2005/0261240 припускає, що карагенан може неспецифічно зв'язуватися з вірусом, таким чином, блокуючи клітинні рецептори вірусів. Damonte E. B. et al. (2004, Curr. Med. Chem. 11, 2399-2419) розкривають, що сульфатовані полісахариди можуть імітувати клітинний сульфат і тому блокувати клітинні рецептори вірусів, що відповідають за початкову взаємодію між вірусом і клітиною-хазяїном, тоді як Gonzalez M. E. et al. (1987, Antimicrob. Agents Chemother. 31, 1388-1393), використовуючи мічені вірусні частинки, знайшли, що віріони HSV-1 проникають усередину клітин навіть за присутності високої концентрації йота-карагенану. Вони прийшли до висновку, що щонайменше для HSV-1 карагенан придушує стадію вірусної реплікації, що йде за приєднанням вірусу і проникненням вірусу в клітину, але перед синтезом пізніх вірусних білків. Turner E. V. і Sonnenfeld G. (1979, Infection and Immunity 25, 467-469) розкривають противірусну активність лямбда-, але не капа-карагенану проти коров'ячого вірусу везикулярного стоматиту, ця противірусна активність виникає завдяки імуномодуляції, тобто завдяки індукуванню інтерферону. На закінчення, підводячи підсумок, можна привести цитату з US 5658893 "беручи до уваги різні відповідні реакції різних вірусів на сульфатовані полісахариди, ясно, що відповідна реакція конкретного вірусу на карагенан без експерименту не може бути передбачена з упевненістю. Механізм, за допомогою якого сульфатовані полісахариди, особливо, карагенани, придушують реплікацію вірусів й інфекційність може не бути однаковим, оскільки різні дослідники повідомляли про суперечні знахідках при роботі з різними вірусами і типами клітин. Професіоналу в даній галузі буде очевидно, що така речовина як сульфатований полісахарид, будучи ефективним інгібітором для одного вірусу, буде виявляти подібну дію на інший вірус". 2 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 60 У світлі вищесказаного даний винахід стосується противірусної композиції на основі карагенану і/або фукоїдану, прийнятної для профілактичного або терапевтичного лікування респіраторний вірусних інфекцій, викликаних членами сімейств Paramyxoviridae, Orthomyxoviridae, Adenoviridae і/або Coronaviridae. Усупереч винаходу авторів Fujisawa H. et al. (1987, J. gen. Virol. 68, 425-423), які повідомили про те, що інтраназальне введення карагенану не знижує титр вірусу грипу A у мишей, але навпроти навіть збільшує сприйнятливість тварин до вірусу, в залежності від кількості вірусу, використаного для інфікування, тепер з подивом було виявлено, що карагенан, зокрема йота- і капа-карагенан, безсумнівно мав противірусну дію проти різних членів Orthomyxoviridae, Paramyxoviridae, Adenoviridae і Coronaviridae. Більше того, з подивом було виявлено, що фукоїдан, особливо високомолекулярна фракція фукоїдану (HWMF), мала противірусну дію проти різних членів Orthomyxoviridae і Paramyxoviridae. Таким чином, даний винахід має за мету надати противірусну фармацевтичну композицію, прийнятну для профілактики або лікування інфекцій дихальних шляхів, викликаних вірусом, вибраним із групи, що складається з ортоміксовірусів, параміксовірусів, аденовірусів і коронавірусів, а також для захворювань або патологічних станів, пов'язаних з такими первинними вірусними інфекціями, такі захворювання або стани включають вторинні вірусні або бактеріальні інфекції, а також системні симптоми, типово пов'язані з будь-якою такою первинною або вторинною інфекцією, включаючи такі симптоми як лихоманка, біль, запаморочення, тремтіння, потовиділення і/або зневоднювання. ОПИС ВИНАХОДУ У першому варіанті здійснення даний винахід стосується використання карагенану як активного противірусного інгредієнта у виробництві фармацевтичної композиції для профілактики або лікування патологічного стану або захворювання, викликаного інфекцією респіраторним вірусом або пов'язаного з нею, де зазначений респіраторний вірус містить щонайменше один білок, прикріплений до вірусної мембрани або інтегрований в неї, білок здатний зв'язуватися з клітиною-хазяїном через рецептор, що має щонайменше один цукровий залишок, респіраторний вірус вибраний із групи, що складається з ортоміксовірусів і параміксовірусів, і карагенан вибраний із групи, що складається з йота- і капа-карагенану. "Клітина-хазяїн", що згадується в даному документі, являє собою будь-яку еукаріотичну клітину, яка за природою, тобто за природними, або подібними до природних умов є мішенню для будь-якого вірусу, згаданого надалі в даному документі, і в яку такий вірус проникає. На сучасному рівні розвитку техніки для експериментальних і лабораторних цілей використовують хазяйські клітинні лінії, які типово визнають прийнятними як моделі in vitro для тестування дії фізіологічно активних речовин і які передбачають щонайменше деяку передбачуваність результатів у відношенні порівнянності з застосуванням до людини. Крім того, даний винахід стосується фармацевтичної композиції, що містить йота- і/або капакарагенан як противірусний активний інгредієнт, і їх застосувань для профілактики або лікування захворювань, викликаних потраплянням вірусу в організм людини через дихальні шляхи або пов'язаних з ним, де зазначений вірус містить щонайменше один білок, приєднаний до його вірусної мембрани або інтегрований в неї, білок здатний зв'язуватися з клітиноюхазяїном через рецептор, що має щонайменше один цукровий залишок, і вірус вибраний із групи, що складається з ортоміксовірусів і параміксовірусів. Термін "активний противірусний інгредієнт" як застосовують у даному документі стосується сполуки, яка є безпосередньо або опосередковано ефективною при специфічному втручанні щонайменше в один з видів діяльності вірусу, вибраних із групи, що складається з проникнення вірусу в еукаріотичні клітини, реплікації вірусу в еукаріотичних клітинах, збирання вірусу, вивільнення вірусу з інфікованих еукаріотичних клітин, або яка ефективна при неспецифічному стримуванні збільшення титру вірусу або при неспецифічному зниженні рівня титру вірусу в хазяйській системі з еукаріотів або ссавців. Це також стосується сполуки, що попереджає вірусну інфекцію або знижує імовірність її одержання. Дану фармацевтичну композицію можна вводити, в залежності від обставин, до або після початку вірусної інфекції, тобто для цілей профілактичного або терапевтичного лікування, або як для профілактичного, так і для терапевтичного введення. Термін "профілактика" або "профілактичне лікування" як застосовують у даному документі стосується введення даної фармацевтичної композиції здоровій людині для того, щоб знизити сприйнятливість людини до зазначеної вірусної інфекції. Термін "терапія" або "терапевтичне лікування" як застосовують у даному документі стосується введення даної фармацевтичної композиції для того, щоб досягти зниження важкості і/або частоти симптомів, усунути симптоми і/або першопричину, попередити виникнення 3 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 симптомів і/або їх першопричини, і/або виправити або усунути шкоду, безпосередньо викликану вірусною інфекцією або опосередковано зв'язану з нею, наприклад, через вторинну інфекцію. Відомо, що ортоміксо- і параміксовіруси і деякі інші віруси прикріплюються до клітинихазяїна за допомогою зв'язування з рецепторами, розташованими на поверхні клітини-хазяїна, рецептори типово являють собою глікопротеїни або гліколіпіди, що містять цукрові залишки, що містять сіалову кислоту (N-ацил нейрамова кислота) і залишки гепарансульфату. У випадку ортоміксовірусів, наприклад, вірусів грипу, віріони зв'язуються з залишками сіалових кислот. Віруси грипу людини переважно зв'язуються з залишками сіалових кислот, що містять альфа 2-6 зв'язку, тоді як вірус пташиного грипу переважно зв'язується з залишками сіалових кислот, що містять альфа 2-3 зв'язку. У поглинання параміксовірусу клітиною залучені щонайменше два її інтегральних мембранних глікопротеїни. Один з них, типово вибраний з групи глікопротеїнів HN, H і G, залучений у приєднання до клітини, й інший глікопротеїн, тобто глікопротеїн F, опосередковує не залежне від pН злиття вірусної оболонки з мембраною клітини-хазяїна. Наприклад, респіровіруси і рубулавіруси зв'язуються з залишками сіалових кислот глікопротеїнових або гліколіпідних рецепторів клітини-хазяїна. Приєднання RSV вивчене не повністю, але приєднання до клітини-хазяїна швидше за все включає взаємодію з гепарансульфатом, глюкозаміноглікану, що є частиною позаклітинного матриксу. Поряд з розкриттям даного винаходу, було замічено, що піддаючи клітини-хазяїни впливу карагенану in vitro, зокрема йота- і/або капа-карагенану, можна пошкодити структуру клітинної поверхні зазначеної клітини-хазяїна, що, очевидно, викликає конформаційні зміни в тривимірній структурі визначених рецепторів клітинної поверхні або маскує і/або модифікує зазначені рецептори. На диво, ця зміна на поверхні клітини-хазяїна запобігала приєднанню ортоміксо- і параміксовірусів до клітин-хазяїнів навіть після видалення карагенану з клітин-хазяїнів, тобто під час відсутності карагенану в момент штучного запуску інфекції за допомогою інокулювання in vitro. Цей конкретний противірусний ефект карагенану спостерігали доти, поки штучно запущену інфекцію ініціювали не пізніше, ніж приблизно через 2 години після видалення полімеру з клітин-хазяїнів, що вказує на відносно стійкий ефект від структурних змін на клітинній поверхні, викликаних взаємодією з карагенаном. На відміну від параміксо- і ортоміксовірусів, для інших вірусів захисний ефект при відсутності карагенану в момент запуску інфекції не спостерігався, включаючи риновірус і коронавірус, тоді як захисна дія досягалося тільки в присутності карагенану. Тому, беручи до уваги експериментально доведену противірусну дію карагенану проти риновірусної інфекції, був зроблений висновок про те, що для риновірусу і, також можливо для інших вірусів, противірусний ефект може виникати скоріше через приєднання карагенанового полімеру до віріонів, ніж через хімічну або фізичну взаємодію полімеру з рецепторами клітинихазяїна. Як відзначено раніше в даному документі, композиції з карагенаном за даним винаходом можна успішно застосовувати проти ортоміксовірусної інфекції, включаючи інфекції, викликані вірусом грипу A або B, і особливо де зазначений вірус грипу A або B являє собою вірус людини, який зв'язується з клітиною-хазяїном з використанням 2-6 зв'язку в сіаловій кислоті. Інфекції з вірусом грипу людини найкраще лікувати з використанням переважно або тільки йотакарагенану або фукоїдану як противірусних активних інгредієнтів. Однак також карагенан можна успішно застосовувати проти інфекцій, де зазначений вірус грипу A являє собою пташиний вірус, який зв'язується з клітиною-хазяїном з використанням 2-3 зв'язку в сіаловій кислоті. У цьому останньому випадку з'ясувалося, що капа-карагенан є найбільш ефективним карагенаном, використання якого в силу вищесказаного є переважним застосовно до профілактики або терапевтичного лікування пташиного вірусу. При цьому було виявлено, що йота-карагенан і фукоїдан значно менш активні або навіть неактивні у відношенні пташиного вірусу грипу A. Виявлено, що види параміксовірусів, вибрані з групи, що складається з вірусу парагрипу людини (HPV) типу 1, HPV типу 2, HPV типу 3, HPV типу 4 і RSV, є сприйнятливими до лікування карагенаном. Якщо вибраним параміксовірусом є RSV, то переважно, щоб йота-карагенан або фукоїдан використовувалися як переважний або єдиний сульфатований полісахаридний інгредієнт для профілактичного або терапевтичного введення, оскільки йота-карагенан і фукоїдан давали найкращі результати при поставленні експерименту. 4 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 60 Патологічні стани або захворювання, що згадуються в даному документі в зв'язку з профілактичним або терапевтичним введенням карагенану включають гострий бронхіт, хронічний бронхіт, риніт, синусит, круп, гострий капілярний бронхіт, фарингіт, тонзиліт, ларингіт, трахеїт, астму і пневмонію. Карагенан особливо прийнятний для місцевого застосування для лікування запалень шкіри або слизистих. Карагенан, який може використовуватися при місцевому застосуванні на шкірі або слизистій відповідно до даного винаходу, має молекулярну масу в діапазоні приблизно від 15000 до 5000000 Да, і особливо переважні фракції, що мають середні молекулярні маси більше 50000 Да, і особливо фракції, що мають середні молекулярні маси в діапазоні від 50000 до 3000000 Да. Також можливе системне, наприклад, парентеральне або пероральне введення, особливо при використанні низькомолекулярних полімерів, що мають середню молекулярну масу в діапазоні від 15000 до 100000 Да. Фармацевтична композиція за даним винаходом, пристосована для парентерального застосування, може бути надана у вигляді засобу, вибраного з групи, що містить шкірні лосьйони, креми, мазі, гелі, порошки, включаючи порошки для інгаляції, спреї, піни, рідкі краплі або розчини для полоскання. Однак лікарські засоби з карагенаном також можуть бути пристосовані для перорального введення, наприклад у вигляді рідких розчинів, або напіврідких або твердих лікарських засобів, таких як порошки, таблетки, капсули, драже або будь-які інші перорально прийняті галеновські форми. Фармацевтичні композиції для застосування на слизистих включають назальні спреї або краплі і будь-які інші системи доставляння лікарського засобу, відомі в даній галузі, наприклад, розкриті в US 6391452. Коли композиція призначена для місцевого застосування і являє собою рідку або напівтверду форму, вона типово містить готову до вживання форму карагенану в кількості 0,0110 %, переважно 0,01-5 %, найбільш переважно 0,1-2 % по масі, по відношенню до загальної кількості композиції. Коли композиція являє собою тверду форму, вона типово містить готову для використання форму карагенану в кількості 0,01-10 %, переважно 0,01-5 %, найбільш переважно 0,1-2 % по масі по відношенню до загальної маси композиції. Карагенани, які можна використовувати в даному винаході, комерційно доступні, але їх також можна одержати екстрагуванням з морських водоростей відповідно до процедур екстрагування, відомих в даній галузі. Якщо не зазначено зворотне, термін "карагенан" у даному документі стосується або йота-, або капа-карагенану або їх суміші. Крім того, карагенан за даним винаходом може бути гомополімером або гетерополімером. Карагенановий гомополімер складається із субодиниць тільки одного типу, або йота- або капакарагенану, тоді як карагенановий гетерополімер містить субодиниці обох зазначених типів карагенану. Таким чином, "суміш" карагенанів також може належати до композиції матеріалів, що містить суміш різних субодиниць карагенану у вигляді частини щонайменше одного гетерополімерного карагенану, що є присутнім у зазначеній композиції. Типово, противірусні фармацевтичні композиції за даним винаходом по суті не містять карагенани, відмінні від йота- і капа-карагенану, тобто містять або йота- або капа-карагенан, або їх суміш, у кількості 80 % або більше, переважно 90 % або більше, і зокрема до 99 % (мас./мас.) або більше, по відношенню до сухої маси всіх карагенанів, що є присутніми у композиції. Для деяких застосувань композиція по суті містить тільки йота-караген, тоді як композиція для інших застосувань може містити більш ніж 50 %, переважно більш ніж 70 %, і зокрема більш ніж 95 % (мас./мас.) по сухій масі йота-карагенану, відносно загальної сухої маси всіх карагенанів, що є присутніми у композиції. Однак для інших застосувань може використовуватися композиція, яка містить більше ніж 50 %, переважно більше ніж 70 %, і зокрема більше ніж 95 % (мас./мас.) по сухій масі капакарагенану, по відношенню до загальної сухої маси всіх карагенанів, що є присутніми у композиції. Коли композиція містить щонайменше один гетерополімерний карагенан, приведені вище чисельні значення стосуються процентних часток відповідних субодиниць карагенану. Противірусні композиції з карагенаном відповідно до даного винаходу можуть додатково містити щонайменше один фармацевтично прийнятний носій і/або допоміжну речовину, яка прийнятна і дозволена для медичного застосування. Носій може являти собою розріджувач, наприклад воду, фізіологічний розчин, необов'язково фосфатно-сольовий буфер (PBS), ексципієнт або інший носій, який полегшує введення 5 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиції. Коли композиція є твердою, напівтвердою або рідкою, групи носіїв і допоміжних речовин, відповідно, можуть містити, але без обмежень, SiО 2, TiO2, зв'язувальні речовини, такі як мікрокристалічна целюлоза, полівінілпіролідон, трагакантова камедь, желатин, крохмаль, лактоза, моногідрат лактози, альгінова кислота або маїсовий крохмаль; змащувальні речовини або поверхнево-активні речовини, такі як стеарат магнію або лаурилсульфат натрію; ковзні речовини, наприклад, такі як колоїдна двоокис кремнію; підсолоджувачі, такі як цукроза або сахарин. Ще можуть бути вибрані додаткові допоміжні речовини, вибрані з групи, що складається з фізіологічно прийнятних консервантів, фармацевтично прийнятних солей лужних металів, таких як натрій, калій, літій або хлориди амонію, буферів або регуляторів pН, таких як лимонна кислота, оцтова кислота, фумарова кислота, соляна кислота, яблучна кислота, азотна кислота, фосфорна кислота, пропіонова кислота, сірчана кислота і винна кислота і поєднання зазначених кислот. Для багатьох застосувань може використовуватися композиція, що містить хлорид натрію як допоміжну речовину. Типово, фармацевтично прийнятна сіль присутня в композиції в кількості не більше ніж 1 %, переважно не більше ніж 0,6 % (мас./об.). У композиціях за даним винаходом сам карагенан теж може бути присутнім у вигляді солі, переважно у вигляді солі натрію. Переважно, щоб дані композиції для профілактичного або терапевтичного медичного застосування надавалися у вигляді стерильних препаратів, що не містять мікробів, патогенів, пірогенів і/або алергенів. Було виявлено, що карагенан не токсичний при пероральному або шкірному застосуванні або при інгаляції, навіть при застосуванні в надзвичайно високих дозах. Тому він класифікований як "загальновизнаний безпечним" (GRAS) Управлінням з продовольства і ліків (FDA). Карагенан, зокрема йота-карагенан, також можна використовувати як противірусний засіб, ефективний проти ортоміксовірусних і параміксовірусних інфекцій у різних лікарських засобах разом з іншими фізіологічно активними сполуками або лікарськими засобами як основні активні інгредієнти, де карагенан виконує роль носія або допоміжного засобу, такого як емульсифікатор або модифікатор в'язкості. Він сумісний з більшістю фармацевтичних препаратів і не викликає небажаних побічних ефектів. Тому в обсяг даного винаходу входить надання фармацевтичних композицій, що містять карагенан як допоміжну речовину, більш конкретно як противірусний, особливо протипараміксовірусний або протиортоміксовірусний засіб, ад'ювант в лікарських засобах, які типово використовують при профілактиці або лікуванні інфекцій і/або запальних захворювань, алергій і/або станів ослабленої або подавленої імунної системи. Зокрема, в обсяг даного винаходу входить використання карагенану, переважно йота-карагенану, як ефективного протигрипозного ад'юванта в поєднанні з лікарськими засобами, які можна використовувати при профілактиці або лікуванні інфекцій і/або запальних захворювань, алергій і/або станів ослабленої або подавленої імунної системи. Було помічено, що карагенан також може мати імуномодулювальну активність, особливо, здатність зміцнювати імунну систему. Однак дотепер не повністю ясно, чи пов'язана ця активність прямо з фізіологічною інтерференцією речовини чи опосередкована через його противірусну дію. Звичайно композиція за даним винаходом буде входити в засоби для місцевого застосування або на слизистих, переважно, вибраних зі спреїв, особливо назальних спреїв, порошків, крапель, розчинів для полоскання, пін, гелів, кремів, мазей, лосьйонів, пастилок і т.п. Однак фармацевтичну композицію за даним винаходом також можна наносити на тверді поверхні предметів гігієни або санітарії, наприклад, таких як гігієнічні продукти для обличчя або санітарні продукти, типово використовувані в зоні ротової порожнини і/або носа, включаючи як необмежуючі приклади папір або серветки для носа і носові хустинки. Більш конкретно, фармацевтичну композицію можна використовувати, наприклад, розпорошувати - подібно до дезінфікуючих засобів - на рукавички, гігієнічні серветки або папір, включаючи папір або серветки для носа, для того, щоб зробити вірицидний ефект, щонайменше до деякої міри, і в такий спосіб сприяти зменшенню повторюваного самоінфікування людини інфікованими кінчиками пальців, а також знижувати поширення вірусу серед інших людей, що знаходяться поблизу і контактують один з одним, наприклад, віч-на-віч. До інших предметів, покритих, імпрегнованих або просочених фармацевтичною композицією на основі карагенану, належать ватні аплікатори, пилозахисні маски або санітарні або медичні 6 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 60 маски для обличчя. Навіть до складу губної помади може входити кількість карагенану, достатня для прояву противірусного ефекту. Ці гігієнічні або санітарні продукти можуть бути використані для профілактики або для терапевтичного лікування від вірусної інфекції і можуть сприяти попередженню або зниженню ризику інфекції. Ціль даного винаходу полягає в тому, щоб надати противірусні композиції на основі карагенану для профілактичного або терапевтичного лікування людей, зокрема зі сприйнятливістю або підвищеним ризиком ортоміксо- або параміксовірусної інфекції, включаючи пацієнтів з високим ступенем ризику, вибраних із групи, що складається з COPD-пацієнтів, пацієнтів з астмою, людей, що страждають від алергій або з ослабленою імунною, серцевосудинною або дихальною системами, і пацієнтів з пересадженими органами. Відповідно до даного винаходу карагенан також можна використовувати як противірусний активний інгредієнт при виробництві фармацевтичної композиції для профілактики або терапевтичного лікування патологічного стану або захворювання, викликаного інфекцією респіраторного вірусу або пов'язаного з інфекцією респіраторного вірусу, вибраного з групи, що складається з аденовірусу і коронавірусу, аденовірус переважно являє собою аденовірус типу B (Ad50). Аденовірусні і коронавірусні інфекції найкраще лікувати з використанням композицій, в яких йота-карагенан є єдиним або переважним активним противірусним інгредієнтом. Експериментальні дослідження також підтвердили, що фукоїдан теж ефективний як противірусний активний інгредієнт у виробництві фармацевтичної композиції, яка ефективна при профілактиці або лікуванні патологічних станів або захворювань, викликаних інфекцією респіраторного вірусу або пов'язаних з нею, респіраторний вірус вибраний із групи, що складається з ортоміксо- і параміксовірусів. У цьому контексті ортоміксовірус типово являє собою вірус грипу A або B і параміксовірус типово являє собою RSV. Композиція на основі фукоїдану в готовій для використання формі для місцевого або перорального застосування може містити фукоїдан у кількості 0,01-10 %, переважно 0,01-5 %, найбільш переважно 0,1-2 % мас. на об'єм (мас./об.) або маси на масу (мас./мас.) в залежності від того, чи є композиція рідкою або напівтвердою (процентні частки мас./об.) або твердою (процентні частки мас./мас.). Додатково вона може містити щонайменше один фармацевтично прийнятний носій і/або допоміжну речовину, а також інші фізіологічно активні речовини або лікарські засоби. Наприклад, хлорид натрію часто використовують як допоміжну речовину. В основному, фармацевтично прийнятні солі можуть бути присутніми у композиціях з фукоїданом у кількості не більш ніж 1 %, переважно не більш ніж 0,6 %. КОРОТКИЙ ОПИС МАЛЮНКІВ На фіг. 1 показана ефективність йота-карагенану по зниженню бляшкоутворення вірусом грипу A/Chile/1/93 H1N1 у клітинах MDCK при різних дозах у діапазоні від кінцевої концентрації 0,1 до 100 мкг/мл. Ордината = процентна частка бляшкоутворення після інфікування клітин MDCK суспензією вірусу грипу A/Chile/1/93 H1N1, що містить різні концентрації йота-карагенану по відношенню до бляшкоутворення в клітинах MDCK, інфікованих суспензією вірусу грипу A/Chile/1/93 H1N1 без йота-карагенану (прийнято за 100 %); абсциса = різні кінцеві концентрації йота-карагенану в суспензії вірусу в мкг/мл. На фіг. 2 показана ефективність йота-карагенану по зниженню бляшкоутворення вірусом грипу A/Aichi2/68 H3N2 у клітинах MDCK при різних дозах у діапазоні від кінцевої концентрації 75 до 300 мкг/мл. Ордината = процентна частка бляшкоутворення після інфікування клітин MDCK суспензією вірусу грипу A/Aichi2/68 H3N2, що містить різні концентрації йота-карагенану по відношенню до бляшкоутворення в клітинах MDCK, інфікованих суспензією вірусу грипу A/Aichi2/68 H3N2 без йота-карагенан (прийнято за 100 %); абсциса = різні кінцеві концентрації йота-карагенану в суспензії вірусу в мкг/мл. На фіг. 3 показана ефективність йота-карагенану по зниженню бляшкоутворення вірусом парагрипу 3 у клітинах Hep-2 при різних дозах у діапазоні від кінцевої концентрації 0,1 до 100 мкг/мл. Ордината = процентна частка бляшкоутворення після інфікування клітин Hep-2 суспензією вірусу парагрипу 3, що містить різні концентрації йота-карагенану по відношенню до бляшкоутворення в клітинах Hep-2, інфікованих суспензією вірусу парагрипу 3 без йотакарагенану (прийнято за 100 %); абсциса = різні кінцеві концентрації йота-карагенану в суспензії вірусу в мкг/мл. На фіг. 4 показана ефективність попередньої обробки йота-карагенаном для зниження бляшкоутворення вірусом парагрипу 3 у клітинах HeLa при різних дозах у діапазоні від кінцевої концентрації 13 до 400 мкг/мл. Ордината = процентна частка бляшкоутворення після інфікування попередньо оброблених клітин HeLa (попередня інкубація протягом 3 годин з йотакарагенаном з наступним видаленням полімеру) суспензією вірусу парагрипу 3 по відношенню 7 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 60 до бляшкоутворення необроблених клітин HeLa (без попередньої інкубації з йота-карагенаном) (прийнято за 100 %); абсциса = різні кінцеві концентрації йота-карагенану в середовищі для попередньої інкубації в мкг/мл. C = клітини, попередньо інкубуванні з полімером карбоксиметилцелюлозою (негативний контроль). На фіг. 5 показані результати експерименту з інгібування клітинної смерті, викликаної коронавірусом, на клітинах нирки кішки (CK). Ордината = процентна частка неінфікованих клітин після інфікування по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації карагенану в суспензії вірусу (фіг. 5A) або в середовищі для попередньої інкубації (фіг. 5B) у мкг/мл; Фіг. 5A = клітини, інфіковані котячим коронавірусом FIP за присутності йота-, капа- або лямбда-карагенану; Фіг. 5B = клітини, попередньо інкубуванні протягом 3 годин з йота, капа- або лямбда-карагенаном, згодом відмиті три рази у PBS і інфіковані котячим коронавірусом FIP під час відсутності полімеру. На фіг. 6 показані результати експерименту з інгібування клітинної смерті, викликаної HRV8, на клітинах HeLa. Ордината = процентна частка неінфікованих клітин після інфікування по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації йотакарагенану в суспензії вірусу (Фіг. 6A) або в середовищі для попередньої інкубації (Фіг. 6B) у мкг/мл; Фіг. 6A = клітини, інфіковані риновірусом людини 8 типу (HRV8) за присутності йотакарагенану; Фіг. 6B = клітини, попередньо інкубуванні протягом 3 годин з йота-карагенаном, згодом три рази відмиті у PBS й інфіковані HRV8 під час відсутності йота-карагенану. На фіг. 7 показане зв'язування FITC-міченого йота-карагенану з клітинами HeLa після наступного відмивання в PBS. Ордината = обчислена концентрація йота-карагенану в мкг/мл (перерахована з одиниць флуоресцентного світіння в мкг/мл з використанням каліброваної кривої); абсциса = стадії відмивання клітин у PBS; 0 = супернатант, що містить FITC-мічений йота-карагенан, видаляли з клітин; 1 = перша стадія відмивання клітин у PBS; 2 = друга стадія відмивання клітин у PBS; 3 = третя стадія відмивання клітин у PBS. На фіг. 8 показані результати експерименту з інгібування клітинної смерті, викликаної RSV, на клітинах Vero. Ордината = процентна частка неінфікованих клітин після інфікування по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації йотакарагенану в суспензії вірусу (темні стовпчики) або в середовищі для попередньої інкубації (світлі стовпчики) у мкг/мл; темні стовпчики = клітини, інфіковані RSV у присутності йотакарагенану; світлі стовпчики = клітини, попередньо інкубуванні протягом 3 годин з йотакарагенаном, згодом три рази відмиті у PBS й інфіковані RSV під час відсутності йотакарагенану. На Фіг. 9 показані результати експерименту з інгібування клітинної смерті, викликаної RSV, на клітинах HNep. Ордината = процентна частка неінфікованих клітин після інфікування і 5 днів інкубування по відношенню до неінфікованих контрольних клітин; абсциса = моменти часу, в які додавали йота-карагенан у кінцевій концентрації 100 мкг/мл в інкубаційне середовище (години після інфікування). На фіг. 10 показані результати експерименту з інгібування клітинної смерті, викликаної RSV, на клітинах HNep. Ордината = процентна частка неінфікованих клітин після інфікування і 5 днів інкубування по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації йота-карагенану в суспензії вірусу в мкг/мл. На фіг. 11 показані результати експерименту з інгібування клітинної смерті, викликаної RSV, на клітинах HEp-2. Ордината = процентна частка неінфікованих клітин після інфікування і 6 днів інкубування при 37 °C по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації йота-, капа- або лямбда-карагенану в суспензії вірусу в мкг/мл. На фіг. 12 показані результати експерименту з інгібування клітинної смерті, викликаної RSV, на клітинах HNep. Ордината = процентна частка неінфікованих клітин після інфікування по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації йотакарагенану (темні стовпчики) і фукоїдану (світлі стовпчики) у суспензії вірусу в мкг/мл. На фіг. 13 показані результати експерименту з інгібування клітинної смерті, викликаної вірусом парагрипу 3, на клітинах HNep. Ордината = процентна частка неінфікованих клітин після інфікування по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації йота-, капа- або лямбда-карагенану або фукоїдану в суспензії вірусу в мкг/мл. На фіг. 14 показані результати експерименту з інгібування клітинної смерті, викликаної вірусом грипу H3N2 (FLU), на клітинах HNep. Ордината = процентна частка неінфікованих клітин після інфікування по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації йота-, капа- або лямбда-карагенану або фукоїдану в суспензії вірусу в мкг/мл. На фіг. 15 показана ефективність йота-, капа-, лямбда-карагенану і фукоїдану по зниженню бляшкоутворення вірусом грипу A H5N1 у клітинах MDCK у дозах 400 мкг/мл і 44 мкг/мл. 8 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 Ордината = процентна частка бляшкоутворення після інфікування клітин MDCK суспензією вірусу пташиного грипу H5N1, що містить різні концентрації йота-, капа-, лямбда-карагенану або фукоїдану по відношенню до бляшкоутворення в клітинах MDCK, інфікованих суспензією вірусу грипу H5N1 без полімеру (прийнято за 100 %); абсциса = різні кінцеві концентрації йота-, капа-, лямбда-карагенану або фукоїдану в суспензії вірусу в мкг/мл. На фіг. 16 показані результати експерименту з інгібування клітинної смерті, викликаної аденовірусом 50 типу (Ad50), на клітинах HNep. Ордината = процентна частка неінфікованих клітин після інфікування по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації йота-карагенану в суспензії вірусу в мкг/мл. На фіг. 17 показані результати експерименту з інгібування клітинної смерті, викликаної Ad50, на клітинах HNep. Ордината = процентна частка неінфікованих клітин після інфікування по відношенню до неінфікованих контрольних клітин; абсциса = різні кінцеві концентрації йотакарагенану в суспензії вірусу (темні стовпчики) або в середовищі для попередньої інкубації (світлі стовпчики) у мкг/мл; темні стовпчики = клітини, інфіковані Ad50 за присутності йотакарагенану; світлі стовпчики = клітини, попередньо інкубуванні протягом 3 годин з йотакарагенаном, згодом три рази відмиті у PBS й інфіковані Ad50 за відсутності йота-карагенану. Для того, щоб описуваний в даному документі винахід можна було зрозуміти більш повно, наведені наступні приклади. Ці приклади служать тільки ілюстративним цілям і не повинні розглядатися як обмеження цього винаходу в будь-якому відношенні. Також варто розуміти, що даний винахід також буде включати деякий ступінь змін, явно розкритих варіантів здійснення, які зможе припустити фахівець у даній галузі. ПРИКЛАДИ Приклад 1: Дія різних концентрацій йота-карагенану на бляшкоутворення вірусом грипу A на клітинах MDCK Суспензії вірусу, що містять 60-80 БЕ (pfu) вірусу грипу A/Chile/1/93 H1N1, змішували з основним розчином йота-карагенану до кінцевих концентрацій 0,1, 1, 10, 25, 50 або 100 мкг/мл. Моношари лінії клітин із нирки собаки MDCK, що злилися, у шести ямкових планшетах інфікували суспензіями вірусу протягом 60 хв при 34C. Видаляли інфекційний інокулят і промивали клітини в PBS і додавали верхній шар, що містить 0,6 % агарози. Планшети інкубували при 36C у зволоженій атмосфері з 5 % CO2 у повітрі. Через 48-60 годин після інфікування верхній шар агарози видаляли, клітини фарбували барвником кристалічним фіолетовим і підраховували видимі бляшки. Процентну частку бляшкоутворення по відношенню до неінфікованого контролю (без оброблення йота-карагенаном) визначали для кожної концентрації йота-карагенану. Як показано на фіг. 1, було виявлено, що йота-карагенан інгібує, пропорційно дозі, бляшкоутворення вірусом грипу A/Chile/1/93 H1N1 у клітинах MDCK. 50 % зниження кількості бляшок (IC50) досягали при концентрації йота-карагенану 50 мкг/мл. Приклад 2: Дія різних концентрацій йота-карагенану на бляшкоутворення вірусом грипу А на клітинах MDCK Суспензії вірусу, що містять 60-80 БОЕ вірусу грипу A/Aichi2/68 H3N2 змішували з основним розчином йота-карагенану до кінцевих концентрацій 75, 150 або 300 мкг/мл. Моношари лінії клітин із нирки собаки MDCK, що злилися, у шести ямкових планшетах інфікували суспензіями вірусу протягом 60 хв при 34C. Видаляли інфекційний інокулят і промивали клітини в PBS і додавали верхній шар, що містить 0,6 % агарози. Планшети інкубували при 37C у зволоженій атмосфері з 5 % CO2 у повітрі. Через 48-60 годин після інфікування верхній шар агарози видаляли, клітини фарбували барвником кристалічним фіолетовим і підраховували видимі бляшки. Процентну частку бляшкоутворення по відношенню до неінфікованого контролю (без йота-карагенану) визначали для кожної концентрації йота-карагенану. Як показано на фіг. 2, було виявлено, що йота-карагенан інгібує, пропорційно дозі, бляшкоутворення вірусом грипу A/Aichi/2/68 H3N2 на клітинах MDCK. Приклад 3: Дія різних концентрацій йота-карагенану на бляшкоутворення вірусом парагрипу 3 на клітинах Hep-2 Суспензії вірусу, що містять 60-80 БОЕ вірусу парагрипу 3, змішували з основним розчином йота-карагенану до кінцевих концентрацій 0,1, 1, 10, 25, 50 і 100 мкг/мл. Суміш інкубували протягом 1 години при 34C. Моношари клітин Hep-2, що злилися, у шести ямкових планшетах інфікували суспензіями вірусу протягом 60 хвилин при 34C. Видаляли інфекційний інокулят і промивали клітини в PBS і додавали верхній шар, що містить 0,6 % агарози. Лотки інкубували у зволоженій атмосфері з 5 % CO2. Через 48-60 годин після інфікування видаляли верхній шар агарози, клітини фарбували барвником кристалічним фіолетовим і підраховували видимі 9 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 60 бляшки. Процентну частку бляшкоутворення по відношенню до планшетів з неінфікованим контролем (без йота-карагенану) визначали для кожної концентрації йота-карагенану. Як показано на фіг. 3, було виявлено, що йота-карагенан інгібує, пропорційно дозі, бляшкоутворення вірусу парагрипу 3 на клітинах Hep-2. 50 % зниження кількості бляшок (IC50) досягали при концентрації йота-карагенану 10 мкг/мл. Приклад 4: Вплив попередньої інкубації з йота-карагенаном на бляшкоутворення вірусом парагрипу 3 на клітинах HeLa Моношари клітин HeLa, що злилися, інкубували три години з йота-карагенаном при концентраціях 13, 40, 133 і 400 мкг/мл. Супернатант, що містить йота-карагенан, видаляли і клітини промивали три рази у PBS й потім інфікували вірусом парагрипу 3, як описано в прикладі 3, не без додання йота-карагенану в суспензію вірусу. Процентну частку бляшкоутворення по відношенню до неінфікованого контролю (без попереднього оброблення йота-карагенаном) визначали для кожної концентрації йота-карагенану. Як показано на фіг. 4, було виявлено, що йота-карагенан придушує бляшкоутворення вірусом парагрипу 3 при концентраціях 400 і 133 мкг/мл, якщо клітини попередньо інкубували протягом трьох годин з йота-карагенаном, незважаючи на те, що йота-карагенан був відсутній у момент інфікування й у процесі всього наступного періоду інкубування при 37C. Цей результат показує, що йота-карагенан хімічно або структурно модифікує рецептори на поверхні клітинихазяїна таким чином, що рецептор-опосередковане зв'язування вірусу парагрипу 3 із клітиноюхазяїном просторово утруднюється або запобігається навіть під час відсутності модифікованого засобу карагенану. Також це доводить потужну профілактичну дію йота-карагенану. Приклад 5: Вплив попереднього оброблення еукаріотичних клітин різними карагенанами на інгібування клітинної смерті, опосередкованої коронавірусом Субконфлюентні клітини CK за присутності йота-, капа- або лямбда-карагенану в концентраціях 4, 40 і 400 мкг/мл інфікували котячим коронавірусом FIPV при moi (множинність зараження), яка дорівнює 0,1 (див. фіг. 5A). При порівнянні субконфлюентні клітини CK інкубували три години з йота-, лямбда- або капа-карагенаном при концентраціях 4, 40, і 400 мкг/мл. Супернатант, що містить карагенан, видаляли і клітини промивали три рази у PBS й інфікували котячим коронавірусом FIP (moi=0,1) за відсутності полімеру (див. фіг. 5B). Процентну частку життєздатних клітин по відношенню до неінфікованого контролю визначали для кожного карагенану і кожної концентрації. Як показано на фіг. 5A, усі три типи карагенану інгібують клітинну смерть, опосередковану коронавірусом, у клітинах CK при найвищій концентрації 400 мкг/мл. Йота-карагенан виявляє значне інгібування ще в концентрації 4 мкг/мл, тоді як капа- і лямбда-карагенан не ефективні в цих концентраціях. З фіг. 5B можна зрозуміти, що, на відміну від вірусів, які проникають у клітину через вуглеводні рецептори (див. попередні приклади), схоже, коронавірусна інфекція не інгібується за рахунок структурних або хімічних змін коронавірус-специфічного рецептора(ів) карагенаном на поверхні клітини-хазяїна, оскільки неможливо було підвищити захищеність клітини-хазяїна вище рівня 35 % інгібування навіть при найвищій експериментальній концентрації карагенану 400 мкг/мл і при попередній інкубації тривалістю три години. Також попереднє оброблення клітин-хазяїнів карагенаном значно не підвищила захищеність клітин від коронавірусної інфекції. Результати показують, що для досягнення значної захищеності від коронавірусної інфекції противірусна активна речовина, тобто карагенан, повинна бути присутньою у момент інфікування, тобто коли повинна відбутися взаємодія між вірусом і клітиною-хазяїном. Приклад 6: Вплив попереднього оброблення еукаріотичної клітини йота-карагенаном на інгібування клітинної смерті, опосередкованої HRV8 Субконфлюентні клітини HeLa інфікували риновірусом людини 8 типу (HRV8; moi=0,1) за присутності йота-карагенану в концентраціях 4, 40 і 400 мкг/мл (див. фіг. 6A). При порівнянні, субконфлюентні клітини HeLa інкубували протягом трьох годин перед інфікуванням з йотакарагенаном у концентраціях 4, 40 і 400 мкг/мл. Супернатант, що містить йота-карагенан, видаляли і клітини промивали три рази у PBS й потім інфікували з використанням HRV8 за відсутності полімеру (див. фіг. 6B). Процентну частку життєздатних клітин по відношенню до неінфікованого контролю визначали для кожної концентрації йота-карагенану. Як показано на фіг. 6A, йота-карагенан інгібує клітинну смерть, опосередковану HRV8, при всіх концентраціях. З фіг. 6B можна зрозуміти, що, на відміну від вірусів, які проникають у клітину через вуглеводні рецептори, клітинна смерть, опосередкована HRV8, не придушувалася більш ніж на 5 % навіть при концентрації 400 мкг/мл і попередній інкубації клітин протягом трьох годин йота-карагенаном. Цей результат погоджується з попередніми винаходами (дані не наведені) і показує, що для HRV8 попередня інкубація клітин-мішеней з карагенаном не значно 10 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 60 захищає клітини-мішені від інфікування, якщо карагенан відсутній у момент інфікування. Цей результат показує, що рецептор для HRV8, LDL-рецептор, не модифікується або маскується при обробленні йота-карагенаном. Приклад 7: Йота-карагенан кількісно видаляли з клітин HeLa за допомогою відмивання клітин у PBS Клітини HeLa інкубували з FITC-міченим йота-карагенаном у концентраціях 400, 133, 4 і 0,4 мкг/мл протягом 10 хвилин, потім супернатант видаляли і клітини промивали три рази в PBS. Кількість залишкового FITC-міченого карагенану визначали за допомогою флуоресцентного зчитувача (BMG-Omega) після видалення супернатанту, що містить FITC-мічений йотакарагенан і після кожної стадії відмивання. Одиниці флуоресцентного світіння перераховували в значення концентрації в мкг/мл карагенану з використанням каліброваної кривої. Як показано на фіг. 7, FITC-мічений йота-карагенан кількісно видаляли (>95 %) із клітин HeLa за допомогою відмивання клітин щонайменше три рази у PBS. Цей результат доводить, що карагенан не зв'язувався ковалентно з поверхнею клітин. Результат підтвердили в другій серії експериментів, в якій інкубаційний період збільшували з 10 хвилин до 3 годин з використанням того ж способу виявлення. Таким чином, результати підтверджують висновки, зроблені в даному документі й у прикладах, які стосуються того, що карагенан викликає модифікацію вуглеводних рецепторів на поверхні клітин-мішеней, що беруть участь у зв'язуванні з віріонами, і ця модифікація усе ще є присутньою після видалення полімеру з поверхні клітини-мішені. Приклад 8: Вплив попереднього оброблення еукаріотичної клітини йота-карагенаном на інгібування клітинної смерті, опосередкованої RSV Субконфлюентні клітини Vero інфікували в присутності йота-карагенану в концентраціях 0,4, 4 і 40 мкг/мл з використанням RSV (moi=0,1). При порівнянні, субконфлюентні клітини Vero інкубували протягом трьох годин з йота-карагенаном у концентраціях 0,4, 4 і 40 мкг/мл. Супернатант, що містить йота-карагенан, видаляли і клітини промивали три рази у PBS й інфікували RSV (moi=0,1) за відсутності карагенану. Процентну частку життєздатних клітин по відношенню до неінфікованого контролю визначали для кожної концентрації карагенану. Як показано на фіг. 8, йота-карагенан інгібує клітинну смерть, опосередковану RSV, при всіх концентраціях, навіть якщо полімер відсутній у момент і в процесі інфікування. Відомо, що RSV приєднується до клітин через гепарансульфат, вуглеводневу молекулу, яка присутня на поверхні епітеліальних клітин. Результати показують, що цей рецептор модифікується йотакарагенаном і приєднання RSV до клітинної поверхні і наступна вірусна реплікація в такий спосіб блокуються. Приклад 9: Вплив оброблення еукаріотичних клітин йота-карагенаном у різні моменти часу після інфікування на інгібування клітинної смерті, опосередкованої RSV, у клітинах HNep Субконфлюентні клітини HNep інфікували з використанням RSV (moi=0,1). Йота-карагенан додавали при кінцевій концентрації 40 мкг/мл у різні моменти часу після інфікування, як показано на фіг. 9 (0, 8, 24, 32, 48, 56 і 72 години після інфікування) і процентні частки життєздатних клітин HNep по відношенню до неінфікованого контролю визначали для кожного моменту часу. Як показано на фіг. 9, йота-карагенан значно інгібує клітинну смерть, опосередковану RSV, при концентраціях 100 мкг/мл навіть коли полімер додавали тільки через 24 години після інфікування. Цей результат показує, що йота-карагенан можна використовувати не тільки профілактично, але він також чинить противірусну дію в процесі терапевтичного лікування, коли застосовується в ранній фазі вірусної інфекції. Приклад 10: Вплив профілактичного лікування йота-карагенаном на інгібування клітинної смерті, опосередкованої RSV, у клітинах HNep Субконфлюентні клітини HNep інфікували в присутності йота-карагенану при концентраціях 400, 133, 44, 15, 5, 2 і 1 мкг/мл з використанням RSV (moi=0,1). Процентні частки життєздатних клітин HNep по відношенню до неінфікованого контролю визначали для кожної концентрації йота-карагенану. Як показано на фіг. 10, йота-карагенан значно інгібує клітинну смерть, опосередковану RSV, навіть при концентрації разом лише 1 мкг/мл, якщо полімер був присутній у процесі інфікування. Цей результат показує, що йота-карагенан можна ефективно використовувати для стратегій профілактичного втручання. Приклад 11: Вплив оброблення еукаріотичних клітин різними карагенанами на інгібування клітинної смерті, опосередкованої RSV, у клітинах HEp-2 Клітини HEp-2 у 6-ямкових планшетах інфікували в присутності йота-, капа- або лямбдакарагенану при концентрації 0,01, 0,1, 1, 10 і 100 мкг/мл вірусом RSV A2 (moi=0,001). Процентні 11 UA 102673 C2 5 10 15 20 25 30 35 40 45 50 55 частки життєздатних клітин по відношенню до неінфікованого контролю визначали для кожного карагенану і кожної концентрації. Як показано на фіг. 11, усі три типи карагенану інгібували клітинну смерть, опосередковану RSV, у клітинах HEp-2, при цьому йота-карагенан виявив самий сильний ефект. Приклад 12: Порівняння впливу оброблення еукаріотичних клітин йота-карагенаном і фукоїданом на інгібування клітинної смерті, опосередкованої RSV Субконфлюентні клітини HNep інфікували у присутності йота-карагенану і фукоїдану в концентраціях 400, 133, 44, 15, 4, 1,3 і 0,4 мкг/мл вірусом RSV (moi=0,1). Процентні частки життєздатних клітин HNep по відношенню до неінфікованого контролю визначали для кожної концентрації йота-карагенану і кожної концентрації фукоїдану. Як показано на фіг. 12, фукоїдан суттєво інгібує клітинну смерть, опосередковану RSV, у клітинах HNep при концентрації 0,4 мкг/мл, якщо полімер присутній у процесі інфікування. Тому фукоїдан є цікавим претендентом на розробляння засобів для профілактики і лікування інфекцій RSV. Приклад 13: Вплив оброблення еукаріотичних клітин різними карагенанами і фукоїданом на інгібування клітинної смерті, опосередкованої вірусом парагрипу 3 Субконфлюентні клітини HNep у присутності йота- або капа- або лямбда-карагенану або фукоїдану при концентраціях 400, 133,3, 44,4, 14,8, 4, 1,3 і 0,4 мкг/мл інфікували вірусом парагрипу 3 типи. Процентні частки життєздатних (тобто, неінфікованих) клітин HNep по відношенню до неінфікованого контролю визначали для кожного полімеру і кожної концентрації полімеру. Як показано на фіг. 13, усі три типи карагенану інгібували клітинну смерть, опосередковану вірусом парагрипу 3, у клітинах HNep, при цьому йота-карагенан виявляв самий сильний ефект. Фукоїдан також інгібував клітинну смерть, опосередковану вірусом парагрипу 3, у клітинах HNep в об'ємі, порівнянному з інгібіторною дією капа- і лямбда-карагенану. Приклад 14: Вплив оброблення еукаріотичних клітин різними карагенанами і фукоїданом на інгібування клітинної смерті, опосередкованої вірусом грипу H3N2 Субконфлюентні клітини HNep у присутності йота-, капа-, лямбда-карагенану і фукоїдану в концентраціях 400, 133,3, 44,4, 14,8, 4, 1,3 і 0,4 мкг/мл інфікували вірусом грипу H3N2. Процентні частки життєздатних клітин HNep по відношенню до неінфікованого контролю визначали для кожного полімеру і кожної концентрації полімеру. Як показано на фіг. 14, усі три типи карагенану інгібували клітинну смерть, опосередковану вірусом грипу H3N2, у клітинах HNep. Крім того, було виявлено, що фукоїдан інгібує клітинну смерть, опосередковану вірусом грипу H3N2, у клітинах HNep в об'ємі, порівняно з інгібуванням йота-карагенаном. Приклад 15: Вплив різних карагенанів і фукоїдану бляшкоутворення вірусом пташиного грипу H5N1 на клітинах MDCK Суспензії вірусу, що містять 60-80 БОЕ вірусу пташиного грипу H5N1 змішували з основним розчином полімеру або йота- або капа- або лямбда-карагенану або фукоїдану до кінцевих концентрацій полімеру 400 або 44,4 мкг/мл. Моношари лінії клітин із нирки собаки MDCK, що злилися, у шести ямкових планшетах інфікували суспензіями вірусу протягом 60 хв при 34C. Інфекційний інокулят видаляли і промивали клітини у PBS й додавали верхній шар агарози, що містить 0,6 % агарози. Планшети інкубували при 36C у зволоженій атмосфері з 5 % CO2 у повітрі. Через 48-60 годин після інфікування верхній шар агарози видаляли, клітини фарбували барвником кристалічним фіолетовим і підраховували видимі бляшки. Процентні частки бляшкоутворення по відношенню до неінфікованого контролю (без оброблення полімером) визначали для кожного полімеру і кожної концентрації полімеру. Як показано на фіг. 15, було виявлено, що на бляшкоутворення вірусом пташиного грипу H5N1 не впливали йота- і лямбда-карагенан і фукоїдан. Однак капа-карагенан інгібував, пропорційно дозі, бляшкоутворення вірусом пташиного грипу H5N1 на клітинах MDCK. Оскільки вірус пташиного грипу переважно зв'язується із залишками сіалових кислот з 2-3 зв'язком, результати показують, що капа-карагенан переважно може модифікувати такі залишки сіалових кислот, що мають 2-3 зв'язок. Приклад 16: Вплив профілактичного оброблення еукаріотичних клітин йота-карагенаном на інгібування клітинної смерті, опосередкованої аденовірусом типу B (Ad50) Субконфлюентні клітини HNep у присутності йота-карагенану в концентраціях 400, 133,3, 44,4, 14,8, 4, 1,3 і 0,4 мкг/мл інфікували вірусом Ad50. Процентні частки життєздатних клітин HNep по відношенню до неінфікованого контролю визначали для кожної концентрації йотакарагенану. 12 UA 102673 C2 5 10 15 20 Як показано на фіг. 16, йота-карагенан суттєво інгібує клітинну смерть, опосередковану Ad50, навіть у концентрації всього лише 4 мкг/мл, якщо полімер присутній у момент і в процесі інфікування. Цей результат указує на те, що йота-карагенан можна використовувати для ефективних, стратегій профілактичного втручання проти аденовірусу субтипу B (наприклад, Ad50). Однак, при тестуванні аденовірусів субтипів A, C і D у серії експериментів, як описано вище, достовірний ефект йота-карагенану не був виявлений (дані не наведені). Приклад 17: Порівняння впливу профілактичного оброблення еукаріотичних клітин йотакарагенаном на інгібування клітинної смерті, опосередкованої Ad50 Субконфлюентні клітини HNep у присутності йота-карагенану в концентраціях 400, 40 і 4 мкг/мл інфікували вірусом Ad50. При порівнянні, субконфлюентні клітини HNep інкубували протягом трьох годин з йота-карагенаном у концентраціях 400, 40 і 4 мкг/мл перед інфікуванням. Супернатант, що містить йота-карагенан, видаляли і клітини промивали три рази у PBS й інфікували вірусом Ad50 під час відсутності карагенану. Процентні частки життєздатних клітин HNep по відношенню до неінфікованого контролю визначали для кожної концентрації йотакарагенану. Як показано на фіг. 17, йота-карагенан суттєво інгібує клітинну смерть, опосередковану Ad50, при концентраціях 400 і 40 мкг/мл уприсутності й під час відсутності йота-карагенану в момент інфікування й у процесі інфекційного періоду, що спостерігався. Ці дані вказують на те, що йота-карагенан модифікує рецептор для аденовірусів субтипу B на клітинній поверхні, про який відомо, що він є вуглеводним рецептором, тоді як аденовіруси інших субтипів ймовірно проникають у клітину за допомогою інших рецепторів. ФОРМУЛА ВИНАХОДУ 25 30 35 40 45 50 55 60 1. Застосування йота-карагенану у противірусно ефективній кількості як противірусного активного інгредієнта для виготовлення фармацевтичної композиції або лікарського засобу для профілактичного або терапевтичного лікування симптому, стану або захворювання, викликаного або пов'язаного з інфекцією респіраторним вірусом, вибраним із групи, що складається з параміксовірусів, вірусу грипу А людини й аденовірусу субтипу В. 2. Застосування йота-карагенану за п. 1, де зазначений параміксовірус вибраний із групи, що складається з вірусу парагрипу людини (HPV) 1 типу, HPV 2 типу, HPV 3 типу, НPV 4 типу і RSV. 3. Застосування йота-карагенану за п. 1 або 2, де зазначений патологічний стан або захворювання вибрано з групи, що складається з гострого бронхіту, хронічного бронхіту, риніту, синуситу, крупу, гострого капілярного бронхіту, фарингіту, тонзиліту, ларингіту, трахеїту, астми і пневмонії, і де симптом вибраний із групи, що складається з лихоманки, болю, запаморочення, тремтіння, потовиділення і зневоднювання. 4. Застосування йота-карагенану за будь-яким з пп. 1-3, де противірусна фармацевтична композиція або лікарський засіб адаптовані для місцевого шкірного застосування або місцевого застосування на слизистих і переважно виготовлені як лосьйон для шкіри, крем, мазь, гель, порошок, включаючи порошок для інгаляцій, спрей, піну, рідкі краплі або розчин для полоскання рота і горла. 5. Застосування за будь-яким з пп. 1-3, де противірусна фармацевтична композиція або лікарський препарат адаптовані для перорального введення і переважно виготовлені у вигляді рідкого розчину або у вигляді напівтвердого або твердого препарату, такого як сухий порошок, таблетки, капсули або драже. 6. Застосування за п. 4 або 5, де композиція є рідкою або напівтвердою і містить як готовий до застосування препарат йота-карагенан у кількості 0,01-10 %, переважно 0,01-5 %, найбільш переважно 0,1-2 % по масі, по відношенню до загальної кількості препарату. 7. Застосування за п. 5, де композиція є твердою і містить як готовий до застосування препарат йота-карагенан у кількості 0,01-10 %, переважно 0,01-5 %, найбільш переважно 0,1-2 % по масі. 8. Застосування за п. 1, де композиція додатково містить каппа-карагенан, де композиція містить 50 % або більше, переважно 70 % або більше, або 95 % або більше по масі сухої речовини йота-карагенану, по відношенню до загальної сухої маси карагенанів, що є присутніми в композиції. 9. Застосування за будь-яким з пп. 1-8, де зазначена композиція додатково містить щонайменше один фармацевтично прийнятний носій і/або допоміжну речовину, де вказана фармацевтично прийнятна допоміжна речовина вибрана з хлориду натрію і хлориду калію і присутня в композиції у кількості 1 % або менше, переважно 0,6 % або менше. 10. Застосування за будь-яким з пп. 1-9, де композиція містить частину або весь йота-карагенан у вигляді солі, переважно у вигляді натрієвої солі. 13 UA 102673 C2 5 10 15 11. Застосування за будь-яким з пп. 1-10, де композиція зафіксована за допомогою нанесення покриття або імпрегнування твердої поверхні предмета гігієни або санітарії, вибраного з групи, яка складається з санітарної рукавички, тканини або паперу, носової хустинки або серветки, ватного аплікатора, пилозахисної маски або санітарної чи медичної маски для обличчя. 12. Застосування за будь-яким з пп. 1-10, де композиція входить до складу губної помади. 13. Застосування за будь-яким з пп. 1-12, де композиція додатково містить некарагенанову фізіологічно активну сполуку, де зазначена сполука необов'язково виступає як основний активний інгредієнт. 14. Застосування за п. 13, де йота-карагенан є присутнім як протипараміксовірусний або протиортоміксовірусний ад'ювант разом з одним або декількома некарагенановими фізіологічно активними речовинами, які звичайно застосовуються при профілактиці або лікуванні інфекцій і/або запальних захворювань, алергій і/або станів ослабленої або пригніченої імунної системи. 15. Застосування за будь-яким з пп. 1-14, де симптом, стан або захворювання має місце у індивідуума, який є пацієнтом з високим ризиком, який вибраний із групи, що складається з COPD-пацієнта, пацієнта з астмою, людини з алергією, людини з ослабленою імунною, серцевою або дихальною системою і трансплантологічного пацієнта. 14 UA 102673 C2 15 UA 102673 C2 16 UA 102673 C2 17 UA 102673 C2 18 UA 102673 C2 19 UA 102673 C2 Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 20
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of iota-carrageenan as an antiviral active ingredient
Автори англійськоюGrassauer Andreas, Prieschl-Grassauer, Eva
Назва патенту російськоюПрименение йота-каррагенана как противовирусного активного ингредиента
Автори російськоюГрассауэр Андреас, Пришл-Грассауер Ева
МПК / Мітки
МПК: A61K 31/731, A61P 31/20, A61P 31/16, A61P 31/14, A61K 31/737
Мітки: інгредієнта, застосування, противірусного, йота-карагенану, активного
Код посилання
<a href="https://ua.patents.su/22-102673-zastosuvannya-jjota-karagenanu-yak-protivirusnogo-aktivnogo-ingrediehnta.html" target="_blank" rel="follow" title="База патентів України">Застосування йота-карагенану як противірусного активного інгредієнта</a>
Попередній патент: Спосіб отримання складних ефірів жирних кислот з насіння олійних рослин
Випадковий патент: Пристрій для приведення в дію силового вимикача