Заміщені похідні 1-піперазинацилпіперидину, спосіб їх одержання і застосування у терапії
Номер патенту: 77526
Опубліковано: 15.12.2006
Автори: Ваньон Жан, Бош Мікаель, Ербер Жан-Марк, Дос Сантос Віктор, Нісато Діно, Боно Франсуаз, Тоннерр Бернар
Формула / Реферат
1. Сполука формули (І):
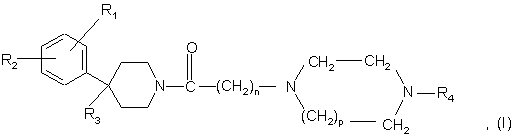
у якій:
- n дорівнює 1 або 2;
- р дорівнює 1 або 2;
- R1 - атом галогену; трифлуорметильний радикал; (С1-С4)алкіл; (С1-С4)алкокси;
трифлуорметоксильний радикал;
R2 - атом гідрогену або атом галогену;
- R3 - атом гідрогену; група -OR5; група -CH2OR5; група -NR6R7; група -NR8COR9;
група -NR8CONR10R11; група -CH2NR12R13; група -CH2NR8CONR14R15; (С1-С4)-алкокси-карбоніл; група –CONR16R17 або R3 утворює подвійний зв'язок між атомом карбону, до якого вона приєднана, і суміжним атомом карбону піперидинового кільця;
- R4 - ароматична група, вибрана з:
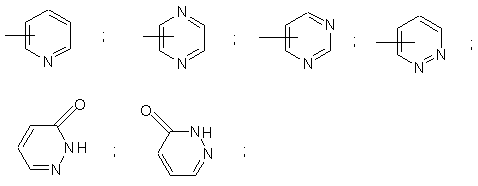
яка є незаміщеною або моно- або дизаміщеною замісником, вибраним незалежно з атома галогену; (С1-С4)алкілу; (С1-С4)алкоксилу; трифлуорметильного радикала;
- R5 - атом гідрогену; (С1-С4)алкіл; (С1-С4)алкілкарбоніл;
- R6 і R7 - кожна незалежно є атомом гідрогену або (С1-С4)алкілом;
- R8 - атом гідрогену або (С1-С4)алкіл;
- R9 - (С1-С4)алкіл або група -(CH2)m-NR6R7;
- m дорівнює 1, 2 або 3;
- R10 i R11 - кожна незалежно є атомом гідрогену або (С1-С4)алкілом;
- R12 і R13 - кожна незалежно є атомом гідрогену або (С1-С5)алкілом;
- R13 може бути також групою -(CH2)q-OH або групою -(CH2)q-S-CH3, або
- R12 i R13 разом з атомом нітрогену, до якого вони приєднані, утворюють гетероцикл, вибраний з азиридину, ацетидину, піролідину, піперидину і морфоліну;
- q дорівнює 2 або 3;
- R14 і R15 - кожна незалежно є атомом гідрогену або (С1-С4)алкілом;
- R16 і R17 - кожна незалежно є атомом гідрогену або (С1-С4)алкілом;
- R17 може бути також групою -(CH2)q-NR6R7, або
- R16 і R17 разом з атомом нітрогену, до якого вони приєднані, утворюють гетероцикл, вибраний з ацетидину, піролідину, піперидину, морфоліну і піперазину, незаміщеного або заміщеного у позиції 4 (С1-С4)алкілом; і яка має форму основи або солі приєднання кислоти, або форму гідрату або сольвату.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що
- R1 знаходиться у позиції 2, 3 або 4 фенілу і є трифлуорметильним радикалом, атомом хлору, метилом, метокси- або трифлуорметокси-радикалом, a R2 - атом гідрогену;
або
- R1 знаходиться у позиції 3 фенілу і є трифлуорметильним радикалом, a R2 знаходиться у позиції 4 фенілу і є атомом хлору; і має форму основи або солі приєднання кислоти, або форму гідрату або сольвату.
3. Сполука формули (І) за п. 1, яка відрізняється тим, що
- R3 - атом гідрогену, гідроксил, метокси, (ацетилокси)метил, гідроксиметил, диметиламін, ацетиламін, амінометил, (метиламіно)метил, (диметиламіно)метил, (діетиламіно)метил, (ізопропіламіно)метил, (N-метилізопропіламіно)метил, (ізобутиламіно)метил; (N-метилізобутиламіно)метил, (ізопентиламіно)метил, (N-метил-ізопентиламіно)метил, амінокарбоніл, ацетидин-1-ілкарбоніл; або R3 утворює подвійний зв'язок між атомом карбону, до якого вона приєднана, і суміжним атомом карбону піперидинового кільця;
і має форму основи або солі приєднання кислоти, або форму гідрату або сольвату.
4. Сполука формули (І) за п. 1, яка відрізняється тим, що
- R4 - 2-піридил, 6-метил-2-піридил, 3-(трифлуорметил)-2-піридил, 5-трифлуорметил-2-піридил, 3-хлор-5-(трифлуорметил)-2-піридил, 3-піридил, 4-піридил, 3,5-дихлор-4-піридил, 2-піразиніл, 5-хлор-2-піразиніл, 6-хлор-2-піразиніл, 2-піримідиніл, 4-(трифлуорметил)-2-піримідиніл, 6-хлор-2-піримідиніл, 4-піримідиніл, 6-хлор-4-піримідиніл, 5-піримідиніл, 3-піридазиніл, 6-хлор-3-піридазиніл, 4-піридазиніл, 3(2Н)-піридазинон-5-іл або 3(2Н)-піридазинон-4-іл;
і має форму основи або солі приєднання кислоти, або форму гідрату або сольвату.
5. Сполука формули (І) за п. 1, яка відрізняється тим, що
- n дорівнює 1 або 2;
- р дорівнює 1 або 2;
- R1 знаходиться у позиції 2, 3 або 4 фенілу і є трифлуорметильним радикалом, атомом хлору, метилом, метоксильним або трифлуорметоксильним радикалом, a R2 - атом гідрогену; або
R1 знаходиться у позиції 3 фенілу і є трифлуорметильний радикалом, a R2 знаходиться у позиції 4 фенілу і є атомом хлору;
- R3 - атом гідрогену, гідроксил, метокси, (ацетилокси)метил, гідроксиметил, диметиламін, ацетиламін, амінометил, (метиламіно)метил, (диметиламіно)метил, (діетиламіно)метил, (ізопропіламіно)метил, (N-метилізопропіламіно)метил; (ізобутиламіно)метил; (N-метилізобутиламіно)метил, (ізопентиламіно)метил, (N-метилізопентиламіно)метил, амінокарбоніл, ацетидин-1-ілкарбоніл; або R3 утворює подвійний зв'язок між атомом карбону, до якого вона приєднана, і суміжним атомом карбону піперидинового кільця;
- R4 - 2-піридил, 6-метил-2-піридил, 3-(трифлуорметил)-2-піридил, 5-(трифлуорметил)-2-піридил, 3-хлор-5-(трифлуорметил)-2-піридил, 3-піридил, 4-піридил, 3,5-дихлор-4-піридил, 2-піразиніл, 5-хлор-2-піразиніл, 6-хлор-2-піразиніл, 2-піримідиніл, 4-(трифлуорметил)-2-піримідиніл, 6-хлор-2-піримідиніл, 4-піримідиніл, 6-хлор-4-піримідиніл, 5-піримідиніл, 3-піридазиніл, 6-хлор-3-піридазиніл, 4-піридазиніл, 3(2Н)-піридазинон-5-іл, 3(2Н)-піридазинон-4-іл;
і має форму основи або солі приєднання кислоти, або форму гідрату або сольвату.
6. Сполука формули (І) за п. 1, яка відрізняється тим, що
- n дорівнює 1;
- p дорівнює 1;
- R1 знаходиться у позиції 2, 3 або 4 фенілу і є трифлуорметильним радикалом, атомом хлору, метоксильним або трифлуорметоксильним радикалом, a R2 - атом гідрогену; або
- R1 знаходиться у позиції 3 фенілу і є трифлуорметильним радикалом, a R2 знаходиться у позиції 4 фенілу і є атомом хлору;
R3 - гідроксил, диметиламін, амінометил, (метиламіно)метил, (диметиламіно)метил, (діетиламіно)метил, (ізопропіламіно)метил, (ізобутиламіно)метил, (ізопентиламіно)метил, (N-метилізопентиламіно)метил або амінокарбоніл; або R3 утворює подвійний зв'язок між атомом карбону, до якого вона приєднана, і суміжним атомом карбону піперидинового кільця;
- R4 - 2-піразиніл, 4-піримідиніл, 3(2Н)-піридазинон-5-іл або 5-(трифлуорметил)-2-піридил;
і має форму основи або солі приєднання кислоти, або форму гідрату або сольвату.
7. Спосіб одержання сполук формули (І) за п. 1, де n = 1, який відрізняється тим, що:
а1) здійснюють взаємодію сполуки формули
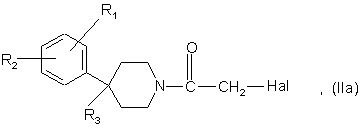
де R1, R2 і R3 є такими, що були визначені для сполуки формули (І) у п. 1, a Hal є атомом галогену, бажано хлору або брому, за умови, що, коли R3 містить гідроксильну або амінову функцію, ці функції можуть бути захищені, з сполукою формули
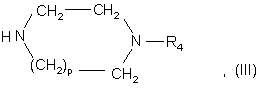
у якій р і R4 є такими, що були визначені для сполук формули (І) у п. 1; і
b1) після зняття захисту гідроксильної або амінової функції, якщо вони є у R3, одержують сполуку формули (І).
8. Спосіб одержання сполук формули (І) за п. 1, де n = 2, який відрізняється тим, що:
а2) здійснюють взаємодію сполуки формули
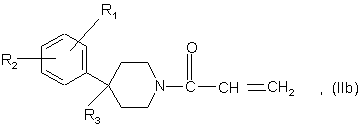
у якій R1, R2 і R3 є такими, що були визначені для сполук формули (І) у п. 1, за умови, що, коли R3 містить гідроксильну або амінову функцію, ці функції можуть бути захищені, з сполукою формули

в якій р і R4 є такими, що були визначені для сполук формули (І) у п. 1; і
b2) після зняття захисту гідроксильної або амінової функції, якщо вони є у R3, одержують сполуку формули (І).
9. Спосіб приготування сполук формули (І) за п. 1, в яких R3 є групою -CH2NR12R13, a R12 і R13 кожна є гідрогеном, який відрізняється тим, що
а3) здійснюють взаємодію сполуки формули
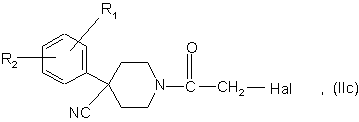
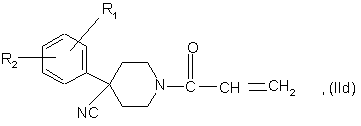
в яких R1, R2 є такими, що були визначені для сполук формули (І) у п. 1, а Hal є атомом галогену, бажано хлору або брому, з сполукою формули

в якій р і R4 є такими, що були визначені для сполук формули (І), і одержують сполуку формули
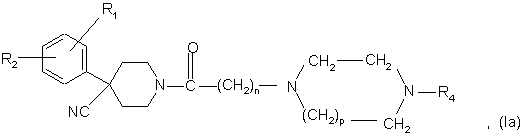
b3) ціаногрупу сполуки формули (Іа) відновлюють, одержуючи сполуку формули (І), в якій R3 є СН2NН2.
10. Сполука формули

в якій:
- n дорівнює 1 або 2;
- р дорівнює 1 або 2;
- R1 - атом галогену; трифлуорметильний радикал; (С1-С4)алкіл; (С1-С4)алкокси;
трифлуорметоксильний радикал;
- R2 - атом гідрогену або атом галогену;
- R4 - ароматична група, вибрана з:

яка є незаміщеною або моно- або дизаміщеною замісником, вибраним незалежно з атома галогену; (С1-С4)алкілу; (С1-С4)алкокси; трифлуорметильного радикала; і яка має форму основи або солі приєднання кислоти, або форму гідрату або сольвату.
11. Медикамент, який відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1 - 6 або сіль приєднання цієї сполуки з фармацевтично прийнятною кислотою, або гідрат або сольват сполуки формули (І).
12. Фармацевтична композиція, яка відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1 - 6 або її фармацевтично прийнятну сіль, гідрат або сольват і щонайменше один фармацевтично прийнятний наповнювач.
13. Застосування сполуки формули (І) за будь-яким з пп. 1 - 6 для одержання медикаменту, призначеного для профілактики або лікування центральних або периферичних нейродегенеративних хвороб; аміотрофічного латерального склерозу, розсіяного склерозу; серцево-судинних станів, периферійних нейропатій; пошкодження оптичного нерва і сітківки; травми спинного мозку і черепних травм; атеросклерозу; стенозу; рубцювання; облисіння, раків, пухлин, метастазів, лейкемій, хронічних нейропатичних і запальних болів, автоімунних хвороб, переломів кісток; кісткових захворювань.
Текст
1. Сполука формули (І): 3 77526 4 - R16 і R17 - кожна незалежно є атомом гідрогену но)метил, (діетиламіно)метил, (ізопропіламіабо (С1-С4)алкілом; но)метил, (N-метилізопропіламіно)метил; (ізобути- R17 може бути також групою -(CH2)q-NR6R7, або ламіно)метил; (N-метилізобутиламіно)метил, (ізо- R16 і R17 разом з атомом нітрогену, до якого вони пентиламіно)метил, (Nприєднані, утворюють гетероцикл, вибраний з ацеметилізопентиламіно)метил, амінокарбоніл, ацетидину, піролідину, піперидину, морфоліну і піпетидин-1-ілкарбоніл; або R3 утворює подвійний зв'яразину, незаміщеного або заміщеного у позиції 4 зок між атомом карбону, до якого вона приєднана, (С1-С4)алкілом; і яка має форму основи або солі і суміжним атомом карбону піперидинового кільця; приєднання кислоти, або форму гідрату або сольR4 2-піридил, 6-метил-2-піридил, 3вату. (трифлуорметил)-2-піридил, 5-(трифлуорметил)-22. Сполука формули (І) за п.1, яка відрізняється піридил, 3-хлор-5-(трифлуорметил)-2-піридил, 3тим, що піридил, 4-піридил, 3,5-дихлор-4-піридил, 2- R1 знаходиться у позиції 2, 3 або 4 фенілу і є піразиніл, 5-хлор-2-піразиніл, 6-хлор-2-піразиніл, 2трифлуорметильним радикалом, атомом хлору, піримідиніл, 4-(трифлуорметил)-2-піримідиніл, 6метилом, метоксиабо трифлуорметоксихлор-2-піримідиніл, 4-піримідиніл, 6-хлор-4радикалом, a R2 - атом гідрогену; піримідиніл, 5-піримідиніл, 3-піридазиніл, 6-хлор-3або піридазиніл, 4-піридазиніл, 3(2Н)-піридазинон-5-іл, - R1 знаходиться у позиції 3 фенілу і є трифлуор3(2Н)-піридазинон-4-іл; метильним радикалом, a R2 знаходиться у позиції і має форму основи або солі приєднання кислоти, 4 фенілу і є атомом хлору; і має форму основи або або форму гідрату або сольвату. 6. Сполука формули (І) за п.1, яка відрізняється солі приєднання кислоти, або форму гідрату або сольвату. тим, що 3. Сполука формули (І) за п.1, яка відрізняється - n дорівнює 1; тим, що - p дорівнює 1; - R3 - атом гідрогену, гідроксил, метокси, (ацетило- R1 знаходиться у позиції 2, 3 або 4 фенілу і є кси)метил, гідроксиметил, диметиламін, ацетилатрифлуорметильним радикалом, атомом хлору, мін, амінометил, (метиламіно)метил, (диметиламіметоксильним або трифлуорметоксильним радино)метил, (діетиламіно)метил, калом, a R2 - атом гідрогену; або (ізопропіламіно)метил, (N- R1 знаходиться у позиції 3 фенілу і є трифлуорметилізопропіламіно)метил, (ізобутиламіно)метил; метильним радикалом, a R2 знаходиться у позиції (N-метилізобутиламіно)метил, (ізопентиламі4 фенілу і є атомом хлору; но)метил, (N-метил-ізопентиламіно)метил, аміноR3 - гідроксил, диметиламін, амінометил, (метилакарбоніл, ацетидин-1-ілкарбоніл; або R3 утворює міно)метил, (диметиламіно)метил, (діетиламіподвійний зв'язок між атомом карбону, до якого но)метил, (ізопропіламіно)метил, (ізобутиламівона приєднана, і суміжним атомом карбону піпено)метил, (ізопентиламіно)метил, (Nридинового кільця; метилізопентиламіно)метил або амінокарбоніл; і має форму основи або солі приєднання кислоти, або R3 утворює подвійний зв'язок між атомом карабо форму гідрату або сольвату. бону, до якого вона приєднана, і суміжним атомом 4. Сполука формули (І) за п.1, яка відрізняється карбону піперидинового кільця; тим, що - R4 - 2-піразиніл, 4-піримідиніл, 3(2Н)-піридазинонR4 2-піридил, 6-метил-2-піридил, 35-іл або 5-(трифлуорметил)-2-піридил; (трифлуорметил)-2-піридил, 5-трифлуорметил-2і має форму основи або солі приєднання кислоти, піридил, 3-хлор-5-(трифлуорметил)-2-піридил, 3або форму гідрату або сольвату. піридил, 4-піридил, 3,5-дихлор-4-піридил, 27. Спосіб одержання сполук формули (І) за п.1, де n = 1, який відрізняється тим, що: піразиніл, 5-хлор-2-піразиніл, 6-хлор-2-піразиніл, 2піримідиніл, 4-(трифлуорметил)-2-піримідиніл, 6а1) здійснюють взаємодію сполуки формули R1 хлор-2-піримідиніл, 4-піримідиніл, 6-хлор-4піримідиніл, 5-піримідиніл, 3-піридазиніл, 6-хлор-3O R2 піридазиніл, 4-піридазиніл, 3(2Н)-піридазинон-5-іл N C CH2 Hal , (IIa) або 3(2Н)-піридазинон-4-іл; R3 і має форму основи або солі приєднання кислоти, де R1, R2 і R3 є такими, що були визначені для або форму гідрату або сольвату. сполуки формули (І) у п.1, a Hal є атомом галогену, 5. Сполука формули (І) за п.1, яка відрізняється бажано хлору або брому, за умови, що, коли R3 тим, що містить гідроксильну або амінову функцію, ці фун- n дорівнює 1 або 2; кції можуть бути захищені, з сполукою формули - р дорівнює 1 або 2; - R1 знаходиться у позиції 2, 3 або 4 фенілу і є трифлуорметильним радикалом, атомом хлору, метилом, метоксильним або трифлуорметоксильним радикалом, a R2 - атом гідрогену; або R1 знаходиться у позиції 3 фенілу і є трифлуорметильний радикалом, a R2 знаходиться у позиції 4 фенілу і є атомом хлору; - R3 - атом гідрогену, гідроксил, метокси, (ацетилокси)метил, гідроксиметил, диметиламін, ацетиламін, амінометил, (метиламіно)метил, (диметиламі CH2 HN CH2 N (CH2)p CH2 R4 , (III) у якій р і R4 є такими, що були визначені для сполук формули (І) у п.1; і b1) після зняття захисту гідроксильної або амінової функції, якщо вони є у R3, одержують сполуку формули (І). 8. Спосіб одержання сполук формули (І) за п.1, де n = 2, який відрізняється тим, що: 5 а2) здійснюють взаємодію сполуки формули R1 77526 6 R1 O R2 N O R2 C CH2 (CH2)n NC N C CH2 CH , (IIb) R3 у якій R1, R2 і R3 є такими, що були визначені для сполук формули (І) у п.1, за умови, що, коли R3 містить гідроксильну або амінову функцію, ці функції можуть бути захищені, з сполукою формули CH2 CH2 HN N (CH2)p R4 , (III) CH2 R1 O R2 N C CH2 , (IIc) Hal NC R1 O R2 N C CH CH2 , (IId) NC в яких R1, R2 є такими, що були визначені для сполук формули (І) у п.1, а Hal є атомом галогену, бажано хлору або брому, з сполукою формули CH2 CH2 HN N (CH2)p R4 , (III) CH2 в якій р і R4 є такими, що були визначені для сполук формули (І), і одержують сполуку формули R1 O R2 N NC C CH2 (CH2)n N CH2 N (CH2)p N (CH2)p CH2 R4 , (Ia) b3) ціаногрупу сполуки формули (Іа) відновлюють, одержуючи сполуку формули (І), в якій R3 є СН2NН2. 10. Сполука формули Винахід стосується заміщених похідних 1піперазинацилпіперидину, їх приготування і застосування у терапії. Сполуки згідно з винаходом виявляють спорідненість до рецептора нейротрофіну р75NTR. Нейротрофіни належать до родини протеїнів, які мають таку ж структуру і виконують ті ж функції і включають фактор росту нерва (ФРН), МНФ (Мозковий нейротрофічний фактор), нейротрофін-3 (НТ-3), нейротрофін-4/5 (НТ-4/5) і нейротрофін-6 (НТ-6). Біологічна дія цих протеїнів (виживання і диференціація) реалізується через взаємодію з мембранними рецепторами, які виявляють актив R4 , (Ia) CH2 в якій: - n дорівнює 1 або 2; - р дорівнює 1 або 2; - R1 - атом галогену; трифлуорметильний радикал; (С1-С4)алкіл; (С1-С4)алкокси; трифлуорметоксильний радикал; - R2 - атом гідрогену або атом галогену; - R4 - ароматична група, вибрана з: N в якій р і R4 є такими, що були визначені для сполук формули (І) у п.1; і b2) після зняття захисту гідроксильної або амінової функції, якщо вони є у R3, одержують сполуку формули (І). 9. Спосіб приготування сполук формули (І) за п.1, в яких R3 є групою -CH2NR12R13, a R12 і R13 кожна є гідрогеном, який відрізняється тим, що а3) здійснюють взаємодію сполуки формули CH2 N ; N ; N ; N O N N N ; O NH NH ; N ; N яка є незаміщеною або моно- або дизаміщеною замісником, вибраним незалежно з атома галогену; (С1-С4)алкілу; (С1-С4)алкокси; трифлуорметильного радикала; і яка має форму основи або солі приєднання кислоти, або форму гідрату або сольвату. 11. Медикамент, який відрізняється тим, що містить сполуку формули (І) за будь-яким з пп.1 - 6 або сіль приєднання цієї сполуки з фармацевтично прийнятною кислотою, або гідрат або сольват сполуки формули (І). 12. Фармацевтична композиція, яка відрізняється тим, що містить сполуку формули (І) за будь-яким з пп.1 - 6 або її фармацевтично прийнятну сіль, гідрат або сольват і щонайменше один фармацевтично прийнятний наповнювач. 13. Застосування сполуки формули (І) за будьяким з пп.1 - 6 для одержання медикаменту, призначеного для профілактики або лікування центральних або периферичних нейродегенеративних хвороб; аміотрофічного латерального склерозу, розсіяного склерозу; серцево-судинних станів, периферійних нейропатій; пошкодження оптичного нерва і сітківки; травми спинного мозку і черепних травм; атеросклерозу; стенозу; рубцювання; облисіння, раків, пухлин, метастазів, лейкемій, хронічних нейропатичних і запальних болів, автоімунних хвороб, переломів кісток; кісткових захворювань. ність кінази тирозину (trk-A, trk-B і trk-C) [Η. ΤΗΟΕΝΕΝ, Science, 1995, 270, 593-598; G.R. LEWIN і Y.A. BARDE, Annu. Rev. Neurosci., 1996, 19, 289-317; M.V. CHAO, J., Neurobiol, 1994, 25, 1373-1385; M. BOTHWELL, Annu. Rev. Neurosci., 1995, 18, 223-253; G. DECHANT і Y.A. BARDE, Curr. Opin. Neurobiol., 1997, 7, 413-418]. Проте числення дослідження вказують на переважаючу роль рецептора р75 в активності нейротрофінів. Рецептор p75NTR, рецептор для всіх нейротрофінів є трансмембранним глікопротеїном з родини рецепторів фактора некрозу пухлини (ФНП) [W.J. FRIEDMAN і LA. GREENE, Exp. Cell. Res., 7 77526 8 1999, 253, 131-142; J. MELDOSIS et al., Trends сно, деякі пов'язані з мієліном протеїни (пов'язані з Pharmacol. Sci., 2000, 21, 242-243]. Рецептору мієліном глікопротеїн, MAG, Nogo- і олігодендроp75NTR приписують декілька біологічних функцій: з цитний мієліновий глікопротеїн ОМдр) інгібують одного боку модуляцію спорідненості нейротрофірегенерацію нерва на центральному рівні при менів до рецепторів trk; з іншого боку, за відсутності дулярних або черепних травмах. Ці протеїни знаtrk - індукцію сигналу для смерті клітини через ходяться у мембрані олігодендроцитів, безпосереапоптоз, що здійснюється гомодимеризацією редньо суміжних до аксона, і інгібують ріст нейронів, цептора і активуванням шляху цераміду. зв'язуючись з високою спорідненістю з рецептором Апоптоз, або програмована смерть клітини, є Ного, що знаходиться у мембрані аксона. Рецепфізіологічним механізмом знищення клітин у різтор p75NTR пов'язаний з рецептором Ного і бере них тканинах. Апоптоз, зокрема, грає вирішальну участь у сигналізації під час інгібіторної дії цих роль у ембріогенезі, морфогенезі і відновленні мієлінових протеїнів у процесі росту аксонів. Отже, клітин. Апоптоз є генетично контрольованим явирецептор p75NTR грає головну роль у. регулюванні щем, яке відбувається лише на розвинених і непластичності нейронів і у нейронно-гліальних взазворотних стадіях пошкодження клітини. ємодіях і є обраним об'єктом терапії, спрямованої Численні дослідження показали, що апоптоз на регенерацію нерва. відбувається у декількох патологіях центральної На периферійному рівні сучасні дослідження нервової системи (ЦНС), таких, як, наприклад, показують зростання експресії р75 і нейротрофінів аміотрофічний латеральний склероз, розсіяний при масивному апоптозі у атеросклеротичних пошсклероз, хвороби Альцгеймера, Паркінсона і Ханкодженнях. Крім того, була відзначена проангіотингтона і пріонні хвороби. Смерть нейронів через генна і судиннорозширююча дія ФРН. Нарешті, апоптоз відбувається також дуже рано після церебула ідентифікована нова форма p75NTR, усічена у бральної і серцевої ішемії. позаклітинній частині, і була виявлена її головна Смерть клітин є переважаючим явищем також роль у васкулогенезі [D. VON SHACK et al., Nature при атеросклерозі, причому зони некрозу в основNeuroscience, 2001, 4, 977-978] Всі ці сучасні дані них атеросклеротичних пошкодженнях у людини вказують, що p75NTR у повній або усіченій формі оцінюють у 80% [M.L. BOCH3TON-PIAL3T et al., може грати вирішальну роль у судинних патоAm. J. Pathol., 1995, 146, 1-6; H. PERLMAN, логіях. Circulation, 1997, 95, 981-987]. Апоптоз є також Є відомими декілька сполук, що взаємодіють з частиною механізму смерті клітин після серцевої системою trkA/ФPH/p75NTR або мають· активність ішемічної реперфузії (Н. YAOIT et al., Cardiovasc. типу ФРН. [У заявці на патент WO 00/59893] опиRes., 2000, 45, 630-641]. сано заміщені похідні піримідину, які виявляють Деякі дослідження показали, що залежний від активність типу ФРН і/або підвищують активність p75NTR проапоптичний сигнал спостерігається у ФРН на клітинах PC 12 cells. [У заявках WO клітинах різних типів, включаючи нейтронні кліти00/69828 і WO 00/69829] описано поліциклічні спони, олігодендроцити, клітини Шванна, а також клілуки, які інгібують зв'язування ФРН з рецептором тини печінки, серця і гладких м'язів [J.M. FRADE et p75NTR у клітинах, що не експресують рецептор al., Nature, 1996, 383, 166-168; P. LASACCIAtrkA. [У заявці WO 94/11373] описано похідні піриBONNEFIL et al., Nature, 1996, 383, 716-719; M. дазинхіназолону, які зв'язуються з рецептором SOILU-HANNINEN et al., J. Neurosci., 1999, 19, нейротрофіну p75NTR. [У заявці WO 94/22866] опи4828-4838; N. TRIM et al., Am. J. Pathol., 2000, 156, сано похідні піразолхіназолону, які специфічно 1235-1243; S.Y. WANG et al., Am. J. Pathol., 2000, зв'язуються з ФРН, відвертаючи його приєднання 157, 1247-1258]. Крім того, експерименти in vivo до рецептора p75NTR, але дозволяють йому взаєNTR показали зростання експресії p75 після ішемії модіяти з рецептором trk. [У заявці WO 01/49684] мозку і серця, при яких був зареєстрований масиописано заміщені похідні тетрагідропіридину, які вний апоптоз. Ці результати показують, що p75N діють як модулятори ФНП-альфа. може грати вирішальну роль у механізмі смерті Були знайдені нові похідні 1нейронів через апоптоз, викликаний ішемією [P.P. піперазинілацилпіперидину, які мають споріднеROUXetal., J. Neurosci., 1999, 19, 6887-6896; J.A. ність до рецептора p75NTR. PARK et al., J. Neurosci., 2000,20, 9096-9103]. Винахід включає сполуки формули (І): Рецептор p75NTR описують як клітинний об'єкт для пріонного пептиду [V. DELLA-BIANC et al., J. (I) Biol. Chem., 2001, in press] і для р-амілоїдного пептиду [S. RABIZADEH et al., Proc. Natl. Acad. Sci. USA, 1994, 91, 10703-10706] і, отже, бере участь у якій: апоптичних явищах, викликаних-цими сполуками. - n дорівнює 1 або 2; Ці результати підтримують гіпотезу, згідно з якою - p дорівнює 1 або 2; р75 грає важливу роль у смерті нейронів, зумовR1 - атом галогену; трифлуорметильний радиленої інфекційним пріонним протеїном (переносна кал; (С1-С4)алкіл; (С1-С4)алкокси; трифлуорметокспонгіформічна енцефалопатія) або бетасильний радикал; амілоїдним протеїном (хвороба Альцгеймера). - R2 - атом гідрогену або атом галогену; Сучасні дослідження показують, що рецептор - R3 - атом гідрогену; група -OR5; група p75NTR може також фати важливу роль в регенеCH2OR5; група -NR6R7; група NR8COR9; група рації аксонів як співрецептор для рецептора Ного NR8CONR10R11; група -CH2NR12R13; група [WONG et al., Nature Neurosci.,2002, 5, 1302-1308; CH2NR8CONR14R15; (С1-С4)-алкоксикарбоніл; група Kerracher і Winton, Neuron, 2002, 36, 345-348]. Дій–CONR16R17. 9 77526 10 - або R3 утворює подвійний зв'язок між атомом алкільним радикалом з 1-4 атомами карбону, накарбону, до якого від приєднаний, і суміжним атоприклад, метокси-, етокси-, пропокси-, ізопропоксимом карбону піперидинового кільця; , бутокси-, ізобутокси-, втор-бутокси- або бутокси- R4 - ароматична група, вибрана серед: радикалом. Серед сполук формули (І) згідно з винаходом слід відзначити такі бажані сполуки, в яких: - R1 знаходиться у позиції 2, 3 або 4 фенілу і є трифлуорметильним радикалом, атомом хлору, метилом, метоксиабо трифлуорметоксирадикалом, і R2 - атом гідрогену; або - R1 знаходиться у позиції 3 фенілу і є трифлуорметильний радикалом, a R2 знаходиться у пози- і незаміщена або моно- або дизаміщена зації 4 фенілу і є атомом хлору; і/або місником, вибраним незалежно серед атому гало- R3 - атом гідрогену, гідроксил, метокси, (ацегену; (С1-С4)алкілу; (С1-С4)алкоксилу; трифлуорметилокси)метил, гідроксиметил, диметиламін, ацетильного радикалу; тиламін, амінометил, (метиламіно)метил, (диме- R5 - атом гідрогену; (С1-С4)алкіл; (С1тиламіно)метил, (діетиламіно)метил, С4)алкілкарбоніл; (ізопропіламіно)метил, (N- R6 і R7 - кожна незалежно є атомом гідрогену метилізопропіламіно)метил, ізобутиламіно)-метил; або (С1-С4)алкілом; (N-метилізобутиламіно)метил, (ізопентиламі- R8 - атом гідрогену або (С1-С4)алкіл; но)метил, (N-метилізопентиламіно)-метил, аміно- R9 - (С1-С4)алкіл або група -(CH2)m-NR6R7; карбоніл, ацетидин-1-ілкарбоніл; або - m дорівнює 1,2 або 3; - R3 утворює подвійний зв'язок між атомом ка- R10 і R11 - кожна незалежно є атомом гідрогербону, до якого вона приєднана, і суміжним атону або (С1-С4)алкілом; мом карбону піперидинового кільця; і/або - R12 і R13 - кожна незалежно є атомом гідроге- R4 - 2-піридил, 6-метил-2-піридил, 3ну або (С1-С5)алкілом; (трифлуорметил)-3-піридил, 5-трифлуор-метил-2- R13 може бути також групою -(CH2)q-OH або піридил, 3-хлор-5-(трифлуорметил-2-піридил, 3групою -(CH2)q-S-CH3; піридил, 4-піридил, 3,5-дихлор-4-піридил, 2- або R12 і R13 разом атомом нітрогену, до якопіразиніл, 5-хлор-2-піразиніл, 6-хлор-2-піразиніл, 2го вони приєднані, утворюють гетероцикл, вибрапіримідиніл, 4-(трифлуорметил)-2-піримідиніл, 6ний серед азиридину, ацетидину, піролідину, піпехлор-2-піримідиніл, 4-піримідиніл, 6-хлор-4ридину і морфоліну; піримідиніл, 5-піримідиніл, 3-піридазиніл, 6-хлор-3- q дорівнює 2 або 3; піридазиніл, 4-піридазиніл, 3(2Н)-піридазинон-5-іл R14 і R15 - кожна незалежно є атомом гідрогену або 3(2Н)-піридазинон-4-іл. Особливо бажаними є або (С1-С4)алкілом; сполуки формули (І), в яких: R16 і R17 - кожна незалежно є атомом гідрогену - n дорівнює 1 або 2; або (С1-С4)алкілом; - p дорівнює 1 або 2; - R17 може бути також групою -(CH2)n-NR6R7; - R1 знаходиться у позиції 2, 3 або 4 фенілу і є - або R16 і R17 разом з атомом нітрогену, до трифлуорметильним радикалом, атомом хлору, якого вони приєднані, утворюють гетероцикл, вибметилом, метоксильним або трифлуорметоксильраний серед ацетидину, піролідину, піперидину, ним радикалом, a R2 - атом гідрогену; або морфоліну і піперазину, незаміщеного або замі- R1 знаходиться у позиції 3 фенілу і є трифлущеного у позиції 4 (С1-С4)алкілом. орметильний радикалом, a R2 знаходиться у позиСполуки формули (І) можуть мати форму осції 4 фенілу і є атомом хлору; і/або нови або солі приєднання кислот. Такі солі вхо- R3 - атом гідрогену, гідроксил, метокси, (ацедять в об'єм винаходу. тилокси)метил, гідроксиметил, диметиламін, ацеЦі солі доцільно отримувати з фармацевтично тиламін, амінометил, (метиламіно)метил, (димеприйнятних кислотами, хоча інші солі інших кистиламіно)метил, (діетиламіно)метил, лот, які можуть бути використані для очищення (ізопропіламіно)метил, (Nабо ізолювання сполук формули (І), також входять метилізопропіламіно)метил; (ізобутиламіно)в об'єм винаходу. метил; (N-метилізобутиламіно)метил, (ізопентилаСполуки формули (І) можуть також існувати у міно)метил, (N-метилізопентил-аміно)метил, аміформі гідратів або сольватів, зокрема, у формі нокарбоніл, ацетидин-1-ілкарбоніл; або асоціацій або комбінацій з однією або більше мо- R3 утворює подвійний зв'язок між атомом калекулами води або з розчинником. Такі. гідрати і рбону, до якого вона приєднана, і суміжним атосольвати також входять в об'єм винаходу. мом карбону піперидинового кільця; Атом галогену є атомом атомом брому, хлору, - R4 - 2-піридил, 6-метил-2-піридил, 3флуору або йоду. (трифлуорметил)-2-піридил, 5-(трифлуорметил)-2(С1-С4)алкіл або (С1-С5)алкіл, відповідно, є ліпіридил, 3-хлор-5-(трифлуорметил)-2-піридил, 3нійним або розгалуженим алкільним радикалом з піридил, 4-піридил, 3,5-дихлор-4-піридил, 21-4 або 1-5 атомами карбону, наприклад, таким, як піразиніл, 5-хлор-2-піразиніл, 6-хлор-2-піразиніл, 2метильний, етильний, пропільний, ізопроп/льний, піримщиніл, 4-(трифлуорметил)-2-піримідиніл, 6бутильний, ізобутильний, втор-бутильний, третхлор-2-піримідиніл, 4-піримідиніл, 6-хлор-4бутильний, пентильний, ізопентильний, неопентипіримідиніл, 5-піримідиніл, 3-піридазиніл, 6-хлор-3льний або трет-пентильний радикал. піридазиніл, 4-піридазиніл, 3(2Н)-піридазинон-5-іл, (С1-С4)алкоксил є лінійним або розгалуженим 11 77526 12 3(2Н)-піридазинон-4-іл; 1-[4-[(метиламіно)метил]-4-[3у формі основи або солі приєднання кислоти і (трифлуорметил)феніл]-1-піперидил]-2-[4-(2також у формі гідрату або сольвату. Бажаними є піразиніл)-1-піперазиніл]-1-етанон; сполуки формули (І), в яких: 1-[4-[(діетиламіно)метил]-4-[3- n=1; (трифлуорметил)феніл]-1-піперидил]-2-[4-(2- p=1; піразиніл)-1-піперазиніл]-1-етанон; - R1 знаходиться у позиції 2, 3 або 4 фенілу і є 1-[4-[(ізопропіламіно)метил]-4-[3трифлуорметильним радикалом, атомом хлору, (трифлуорметил)феніл]-1-піперидил]-2-[4-(2метоксильним або трифлуорметоксильним радипіразиніл)-1-піперазиніл]-1-етанон; калом, а 1-[4-[(ізобутиламіно)метил]-4-[3- R2 - атом гідрогену; або (трифлуорметил)феніл]-1-піперидил]-2-[4-(2- R1 знаходиться у позиції 3 фенілу і є трифлупіразиніл)-1-піперазиніл]-1-етанон; орметильним радикалом, a R2 знаходиться у пози1-[4-[(ізопентиламіно)метил]-4-[3ції 4 фенілу і є атомом хлору; (трифлуорметил)феніл]-1-піперидил]-2-[4-(2- R3 - гідроксил, диметиламін, амінометил, піразиніл)-1-піперазиніл]-1-етанон; (метиламіно)метил, (диметиламіно)-метил, (діети1-[4-[(N-метилізопентиламіно)метил]-4-[3ламіно)метил, (ізопропіламіно)метил, (ізобутила(трифлуорметил)феніл]-1-піперидил]-2-[4-(2міно)метил, (ізопентиламіно)-метил, (Nпіразиніл)-1-піперазиніл]-1-етанон; метилізопентиламіно)метил або амінокарбоніл; 1-[4-гідрокси-4-[3-(трифлуорметокси)феніл]-1або піперидил]-2-[4-(2-піразиніл)-1-піперазиніл]-1R3 утворює подвійний зв'язок між атомом каретанон; бону, до якого вона приєднана, і суміжним атомом у формі основ або солі приєднання кислоти і у карбону піперидинового кільця; формі гідрату або сольвату. - R4 - 2-піразиніл, 4-піримідиніл, 3(2Н)Іншим аспектом винаходу є спосіб приготуванпіридазинон-5-іл або 5-(трифлуор-метил)-2ня сполук формули (І), в яких n=1, який відрізняпіридил; ється тим, що у формі основи або солі приєднання кислоти і а1) сполуку формули у формі гідрату або сольвату. Серед сполук формули (І) згідно з винаходом можна особливо від(IIa) значити такі сполуки: 1-[4-(амінометил)-4-[3-(трифлуорметил)феніл]де R1, R2 і R3 є такими, що визначені для спо1-піперидил]-2-[4-(2-піразиніл)-1-піперазиніл]-1луки формули (І), a Hal є атомом галогену, бажано, етанон; хлору або брому, за умови, що, коли R3 містить 5-[4-[2-[4-гідрокси-4-[3-(трифлуорметил)феніл]гідроксильну або амінову функцію, ці функції мо1-піперидил]-2-оксоетил]-1-піперазиніл]-3(2Н)жуть бути захищені, піридазинон; вводять в реакцію з сполукою формули 1-[4-гідрокси-4-[2-(трифлуорметил)феніл]-1піперидил]-2-[4-(2-піразиніл)-1-іперазиніл]-1(III) етанон; 2-[4-(4-піримідиніл)-1-піперазиніл]-1-[4-[3у якій p і R4 є такими, що визначені для сполук (трифлуорметил)феніл]-3,6-дигідро-1(2Н)формули (І); піридил]-1-етанон; b1) і після зняття захисту гідроксильної або 2-[4-(2-піразиніл)-1-піперазиніл]-1-[4-[2амінової функції, якщо вони є у R3, одержують (трифлуорметил)феніл]-3,6-дигідро-1(2Н-піридил)сполуку формули (І). 1-етанон; За необхідності сполуку формули (І) перетво1-[2-[4-(2-піразиніл)-1-піперазиніл]ацетил]-4-[3рюють в одну з її солей приєднання кислоти. (трифлуорметил)феніл]-4-піперидинкарбоксамід; Згідно з іншим аспектом, винахід включає спо1-[4-(диметиламіно)-4-[3сіб приготування сполук формули (І), в яких n=2, (трифлуорметил)феніл]-1-піперидил]-2-[4-(2який відрізняється тим, що: піразиніл)-1-піперазиніл]-1-етанон; а2) сполуку формули 1-[4-гідрокси-4-[3-(трифлуорметил)феніл]-1піперидил]-2-[4-(2-піразиніл)-1-піперазиніл]-1(IIb) етанон; 1-[4-[(диметиламіно)метил]-4-[3(трифлуорметил)феніл]-1-піперидил]-2-[4-(2у якій R1, R2 і R3 є такими, що визначені для піразиніл)-1-піперазиніл]-1-етанон; сполук формули (І), за умови, що, коли R3 містить 1-[4-(4-хлорфеніл)-3,6-дигідро-1(2Н)-піридил]гідроксильну або амінову функцію, ці функції мо2-[4-(2-піразиніл)-1-піперазиніл]-1-етанон; жуть бути захищені, вводять у реакцію з сполукою 1-[4-гідрокси-4-(3-метоксифеніл)-1-піперидил]формули 2-[4-(2-піразиніп)-1-піперазиніл]-1-етанон; 1-[4-[4-хлор-3-(трифлуорметил)феніл]-3,6(III) дигідро-1(2Н)-піридил]-2-[4-(2-піразиніл)-1піперазиніл]-1-етанон; у якій p і R4 є такими, що визначені для сполук 1-[4-[4-хлор-3-(трифлуорметил)феніл]-3,6формули (І); дигідро-1(2Н)-піридил]-2-[4-[5-(трифлуорметил)-2b2) і після зняття захисту гідроксильної або піридил]-1-піперазиніл]-1-етанон; 13 77526 14 амінової функції, якщо вони є у R3, одержують вона приєднана, і суміжним атомом карбону піпесполуку формули (І). ридинового кільця, сполуку формули За необхідності сполуку формули (І) перетворюють в одну з її солей приєднання кислоти. В операціях а1) або а2), коли сполуку формули (llа) або (llb) вводять у реакцію з сполукою фоу якій R1, R2, n, p і R4 є такими, що визначені рмули (III), реакцію проводять у присутності оснодля сполук формули (І), дегідрують, одержуючи ви, вибраної серед таких органічних основ, як сполуку формули триетиламін, Ν,Ν-діізопропілетиламін або Nметилморфолін, або серед карбонатів або бікарбонатів лужних металів, таких, як карбонат калію, (I) карбонат натрію або бікарбонат натрію, у присутності або без йодиду лужного металу, наприклад, йодиду натрію або калію. Реакцію проводять у За необхідності сполуку формули (І) перетворозчиннику, наприклад, ацетонітрилі, Ν,Ν-ДМФ, рюють в одну з її солей приєднання кислоти. толуолі або пропан-2-олі при температурі між зовДегідрування проводять, використовуючи, нанішньою до температури флегми розчинника. приклад, суміш оцтової і гідрохлорної кислот при Операціями b1) або b2) гідроксильна або амітемпературі між зовнішньою і 140°С. Реакцію можнова функції, якщо вони присутні у R3, позбавляна також проводити, використовуючи рють захисту звичайними методами, добре відомитолуолсульфонову кислоту, у розчиннику, наприми фахівцям. клад, толуолі і при температурі між зовнішньою і У одній з версій процесу, коли R3 є групою температурою флегми. CH2NR12R13, в якій R12 і R13 кожна є гідрогеном, Сполуку формули (І), в якій R3 є групою а3) сполуку формули CH2NR12R13, де R12 - Η і R13 - (С1-С5)алкіл, можна також приготувати реакцією сполуки формули (І), в якій R3 - -CH2NH2 з (С1-С5)алкілгалогенідом у присутності основи, наприклад, карбонату лужного металу, зокрема, карбонату калію у розчиннику, наприклад, ацетонітрилі, Ν,Ν-ДМФ або ТГФ при температурі між зовнішньою і температурою флегми розчинника. Ідентичну реакцію використовують для приготування сполук формули (І), в яких R12, R13 є однаковими або різними ((С1С5)алкілами. в яких R1, R2 і R3 є такими, що визначені для Сполуку формули (І), в якій R3 є групою сполук формули (І), a Hal є атомом галогену, баCH2NR12R13, в якій R12 - Η або (С1-С5)алкіл і R13 жано, хлору або брому, (С1-С5)алкіл, група -(CH2)q-OH або група -(CH2)q-Sвводять у реакцію з сполукою формули CH3, можна також приготувати реакцією сполуки формули (І), в якій R3 є -CH2-NHR12, з формальде(III) гідом або з альдегідом формули ОНС-(С1-С4)алкіл, OHC-(CH2)q-1-OH або ОНС-(СН2)q-1-S-СН3, або з в якій p і R4 є такими, що визначені для сполук відповідним кетоном, у присутності відновлювача, формули (І), наприклад, боргідриду натрію або триацетоксибоі одержують сполуку формули ргідриду натрію у присутності кислоти, наприклад, оцтової, у розчиннику, наприклад, ДХМ або ТГФ (Ia) при температурі між 0°С і зовнішньою. Сполук формули (І), в якій R3 є групою CH2NR12R13, де R12 і R13 разом з атомом нітрогену, b3) ціаногрупу сполуки формули (Іа) відновдо якого вони приєднані, утворюють азиридин, люють, одержуючи сполуку формули (І), в якій Ra можна приготувати циклізуванням відповідного є CH2NH2інтермедіату, в якому R3 є групою -CH2NH-CH2CH2За необхідності сполуку формули (І) перетвоCI, у присутності основи, наприклад, карбонату рюють в одну з її солей приєднання кислоти. лужного металу, зокрема, карбонату калію у приВ операції а3) реакцію між сполукою формули сутності йодиду лужного металу, зокрема, йодиду (llc) або (lld) і сполукою формули (III) проводять, як калію, у розчиннику, наприклад, ацетонітрилі при це було описано в операції а1) або а2) процесу температурі між зовнішньою і температурою флезгідно з винаходом. гми розчинника; відповідний інтермедіат отримуВ операції b3) відновлення ціаногрупи сполуки ють реакцією сполуки формули (І), в якій R3 є формули (Іа) проводять звичайними методами, CH2NH2, з хлорацетальдегідом, описаним вище наприклад, гідрогенуванням у присутності каталіметодом. затора, наприклад, нікелю Рейні або родію на Сполуку формули (І), в якій R3 є групою алюмінію у присутності або без амонію у розчинCH2NR12R13, де R12 і R13 разом з атомом нітрогену, нику, наприклад, метанолі Ν,Ν-ДМФ або ТГФ або до якого вони приєднані, утворюють ацетидин, суміші цих розчинників при температурі між зовніпіролідин, піперидин або морфолін, можна також шньою і 60°С. приготувати реакцією сполуки формули (І), в якій У іншому варіанті процесу, коли R3 утворює R3 - -CH2NH2, з сполукою формули НаІ-(СН2)3-НаІ, подвійний зв'язок між атомом карбону, до якого 15 77526 16 Hal-(CH2)4-Hal, Hal-(CH2)5-Hal або НаІ-СН2СН2-Ологену, бажано, хлору або брому. Реакцію провоСН2СН2-НаІ, де Hal є атомом галогену, бажано, дять у присутності основи, наприклад, триетиламіхлору або брому, у присутності основи, наприклад, ну, Ν,Ν-діізопропілетиламіну або Nкарбонату лужного металу, зокрема, карбонату метилморфоліну у розчиннику, наприклад, ДХМ, калію або у присутності йодиду лужного металу, хлороформі, ТГФ, діоксані або суміші цих розчинзокрема, йодиду калію, у розчиннику, наприклад, ників, і при температурі між 0°С і зовнішньою. ацетонітрилі, етиленгліколі або суміші цих розчинСполуки формули (lIb) отримують реакцією ників і при температурі між зовнішньою і темперасполуки формули (IV) з сполукою формули турою флегми розчинника. (VI) Сполуку формули (І) в якій R3 є групою CH2NR8CONR14R15, де R8=R14=R15=Η можна також в якій Hal і Hal' є такими, що визначені вище, в приготувати реакцією сполуки формули (І), в якій визначених вище в реакційних умовах. R3 - -CH2NH2, з триметилсилілціанатом у розчинПодібним чином сполуки формули (ІІс) або нику, наприклад, ДХМ, при температурі між зовні(lІd), відповідно, отримують реакцією сполуки фошньою і температурою флегми розчинника, з пормули дальшим гідролізом у кислотному середовищі. Сполуку формули (І), в якій R3 є групою (IVa) CONR16R17, можна також приготувати реакцією відповідного інтермедіату, в якому R3 є карбоксив якій R1 і R2 є такими, що визначені для сполом, з сполукою формули HNR16R17 звичайними лук формули (І), з сполукою формули (V) або (VI), методами пептидного приєднання; відповідний відповідно, в визначених вище реакційних умовах. інтермедіат отримують звичайними методами, Сполуки формули (V) або (VI) можуть бути обробляючи кислотою або основою сполуку форпридбані або приготовлені відомими методами. мули (І), в якій R3 є (С1-С4)алкоксикарбонілом, або Сполуки формули (III) можна придбати або реакцією сполуки формули (Іа) з сильною осноприготувати відомими методами, [наприклад, опивою, наприклад, гідроксидом лужного металу, зоксаними у J. Org. Chem., 1953, 18, 1484-1488, J. рема, гідроксидом калію, у розчиннику, наприклад, Med. Chem., 1978, 21 (6), 536-542, Chem. Pharm. толуолі або етиленгліколі при температурі між зоBull., 1991, 39 (9), 2288-2300, Tetrahedron Letters, внішньою і температурою флегми розчинника. 1998, 39, 617-620 або у WO 97/28129]. Сполуку формули (І), в якій R3 є групою Наприклад, сполуку формули (III) можна приNR8COR9, де R9 є -(CH2)m-NR6R7, можна також готувати реакцією сполуки формули приготувати реакцією відповідного інтермедіату, в якому R3 є групою -NR8CO(CH2)m-Hal і Hal є ато(VII) мом галогену, бажано, хлору, з надлишком сполуки формули HNR6R7 у розчиннику, наприклад, в якій ρ є таким, як для сполук формули (І), a ДХМ або етанолі, при температурі між зовнішньою W - гідроген або N-захисна група, з сполукою фоі температурою флегми розчинника; відповідний рмули інтермедіат отримують реакцією сполуки формули Hal-R4 (VIII) (І), в якій R3 є -NHR8, з сполукою формули Hal-COв якій R4 є такою, що визначена для сполуки (CH2)m-Hal, в якій Hal - атом галогену, бажано, формули (І), a Hal є атомом галогену, бажано, хлору або брому, у присутності основи, наприклад, хлору, брому або йоду. триетиламіну або Ν,Ν-діізопропілетиламіну, у розРеакцію проводять у присутності або без осчиннику, наприклад, ДХМ і при температурі між нови, в інертному розчиннику, наприклад, етанолі, 0°С і зовнішньою. пропан-2-олі, n-бутанолі, ацетонітрилі або толуолі, Сполуку формули (І), в якій R3 є групою при температурі між 0°С і температурою флегми CH2OR5, де R5 - атом гідрогену, можна також прирозчинника, і при використанні основи її вибираготувати обробкою кислотою або основою сполуки ють серед органічних основ, наприклад, діізопроформули (І), в якій R3 є групою - CH2OR5, де R5 є пілетиламіну або серед карбонатів лужних мета(С1-С4)алкілкарбонілом. лів, наприклад, карбонату натрію або калію. Якщо Сполуки формули (І), одержані у такий спосіб, основа не використовується, реакцію проводять з можна у подальшому відокремити від реакційного надлишком сполуки формули (VII). Реакцію можна середовища, і очистити звичайними методами, також проводити без розчинника, нагріванням сунаприклад, кристалізацією або хроматографією. міші сполук (VII) і (VIII) при температурах від 140°С Сполуки формули (І) можна ізолювати як вільдо 180°С. ну основу або сіль звичайними методами. За необхідності, коли W - N-захисна група, її Сполуки формули (llа) отримують реакцією півидаляють звичайними методами, одержуючи баперидинової похідної формули жані сполуки формули (III). Сполуки формули (VII) або формули (VIII) є ві(IV) домими або можуть бути приготовлені відомими методами. в якій R1, R2 і R3 є такими, що визначені для Сполуки формули (IV) можуть бути придбані сполук формули (І), з сполуками формули або приготовлені відомими методами, [наприклад, описаними у ЕР-0 474 561, ЕР-0 673 928 або WO (V) 96/23787]. в якій Hal і Hal' кожна є незалежно атомом гаСполуки формули (IV) звичайно отримують у 17 77526 18 формі, в якій вони були захищені на атомі нітрогевони приєднані, утворюють азиридин, ацетидин, ну піперидину; після зняття захисту одержують піролідин, піперидин або морфолін, приготовляють власне сполуки формули (IV). методами, описаними вище для сполук формули Зокрема, сполуку формули (IV), в якій R3 є (І). групою -OR5, де R5 - Η, одержують реакцією похідСполуку формули (IV), в якій Ra є -CON16R17, ної органомагнію формули де R16=R17=Η, можна також приготувати реакцією сполук формули (IVa), захищених на атомі нітрогену піперидину, з гідрогенпероксидом у присутно(IX) сті сильної основи, наприклад, гідроксиду лужного металу, зокрема, гідроксиду натрію і каталізатора в якій R1 і R2 є такими, що визначені для спофазового переходу, наприклад, заміщеної четверлук формули (І), a Hal є атомом галогену, бажано, тинної амонієвої солі, зокрема, хлориду триетилаброму, з 1-бензил-4-піперидиноном у розчиннику, монію, у розчиннику, наприклад, толуолі у суміші з наприклад, діетилетері або ТГФ при температурі водою, при температурі між зовнішньою і темпераміж зовнішньою і температурою флегми розчиннитурою флегми розчинника. ка. Сполуки формули (IVa) приготовляють відоПохідні органомагнію формули (IX) отримують мими методами, [наприклад, описаними у Bioorg. звичайними методами, добре відомими фахівцям, Med. Chem. Lett., 1999, 9, 3273-3276 і у J. Med. з відповідних галогенованих похідних. Chem., 1999, 42(23), 4778-4793]. З сполук формули (IV), в яких R3 є -ОН, сполуЗ сполук формули (IV), в яких R3 - -СН2ОН, ки формули (IV), в яких R3=-OR5, a R5 є (С1сполуки формули (IV), в яких R3 є -CH2OR5, a R5 є С4)алкілом або (С1-С4)алкілкарбонілом, відповідно, (С1-С4)алкілом або (С1-С4)алкілкарбонілом, відпоотримують алкілюванням або ацилюванням, відвідно, отримують алкілюванням або ацилюванням, повідно, методами, відомими фахівцям. відповідно, методами, відомими фахівцям. Сполуки формули (IV), в яких R3 є -ОН і які Сполуки формули (IV), в яких R3 є -CH2OR5, де мають захисну групу на атомі нітрогену піперидиR5 є атомом гідрогену, приготовляють відновленну, мають вступити у реакцію Ріттера з ацетонітням сполуки формули (IV), в якій R3 є метоксикаррилом в оцтовому середовищі для одержання бонілом, методами, відомими фахівцям. сполук формули (IV), в яких R3 є -NНСОСН3 метоСполуки формули (IV), в яких R3 є (С1дом, [описаним у ЕР-0 474 561]. Потім гідролізом у С4)алкоксикарбонілом, приготовляють естерифісильному кислотному середовищі отримують спокацією відповідного інтермедіату, в якому R3 є калуки формули (IV), в яких R3 є -NR6R7, а в якій рбоксилом, методами, відомими фахівцям; відпоR6=R7=Η. Способи, [описані у ЕР-0 673 928 або відний інтермедіат приготовляють реакцією WO 96/23787], можуть бути використані для пригосполуки формули (Vla) з сильною основою, напритування сполук формули (IV), в яких R3 є -NR6R7, a клад, гідроксидом лужного металу, зокрема, гідроR6 і/або R7 є (С1-С4)алкілом. ксидом калію, у розчиннику, наприклад, толуолі Сполуки формули (IV), в яких R3 є –NR8COR9, або етиленгліколі при температурі між зовнішньою де R9 є (С1-С4)алкілом, або R3 є -NR8CONR10R11, і температурою флегми розчинника. або R3 є -CH2NR12R13, a R12 і R13 кожна є незалежУ будь-якій операції приготування сполук фоно гідрогеном або (С1-С4)алкілом, або R3- рмули (І), або інтермедіатів формули (Іа), (llа), (llb), CH2NR8CONR14R15, або R3 є (С1(llc), (lld), (III) або (IV) може виявитись необхідним С4)алкоксикарбонілом, або R3 є -CONR16R17, отриабо бажаним захистити чутливі або реактивні фунмують методами, [описаними у WO 96/23787]. кціональні групи, наприклад, амінову, гідроксильну Сполуку формули (IV), в якій R3 є -CH2NR12R13, або карбоксильну групи, присутні на кожній з відде R12=R13=Η, отримують з сполук формули (IVa) повідних молекул. Цей захист проводять, викорисметодом, описаним вище для сполук формули (І). товуючи звичайні захисні групи, [наприклад, опиСполуку формули (IV), в якій R3 e -NR8COR9, сані у Protective Groups в Organic Chemistry, J.F.W. де R8 є -(CH2)mNR6R7, отримують методом, описаMcOmie, Ed., Plenum Press, 1973, у Protective ним вище для сполук формули (І). Groups в Organic Synthesis, T.W. Greene і P.G.M. Сполуку формули (IV), в якій R3 є -CH2NR12R13, Wuts, Ed., John Wiley & Sons, 1991 або у Protecting a R12 є Η або (С1-С5)алкілом, R13 є (С1-С5)алкілом, Groups, Kocienski P.J., 1994, Georg Thieme Verlag]. групою -(CH2)q-OH або групою -(CH2)n-S-CH3, приЗахисні групи можна видалити відповідною подаготовляють, як це було описано для сполуки форльшою операцією, використовуючи методи, які мули (І). відомі фахівцям і не пошкоджують інші молекули. Сполуку формули (IV), в якій R3 є -CH2NR12R13, N-захисними групами є звичайні N-захисні груде R12 є Η, a R13 є -СН3, можна також приготувати пи, добре відомими фахівцям, наприклад, третвідновленням відповідного інтермедіату, в якому бутоксикарбонільна, флуорфенілметоксикарбоніR3 є -CH2NHCHO, відновлювачем, наприклад, льна, бензильна, бензгідриліденна або бензилокалюмогідридом літію, у розчиннику, наприклад, сикарбонільна група. етері або ТГФ, при температурі між зовнішньою і Згідно з іншим аспектом, винахід включає спотемпературою флегми розчинника. Відповідний луки формули (Іа). Ці сполуки можуть бути викориінтермедіат отримують реакцією сполуки формули стані як інтермедіати у синтезі сполук формули (І). (IV), в якій R3 є -CH2NH2, з етилформатом при темЗгідно з ще одним аспектом, винахід включає пературі між зовнішньою і 60°С. сполуки формули Сполуку формули (IV), в якій R3 є -CH2NR12R13, де R12 і R13 разом з атомом нітрогену, до якого 19 77526 20 рафіолету/мас-спектрографія). Для сполук виконується перевірка сумісності їх (Ia) мас-спектру, одержаного у режимі позитивного електророзпилювання, з обчисленою молярною в яких масою. n дорівнює 1 або 2; Мас-спектр сполук згідно з винаходом мають в p дорівнює 1 або 2; основі пік молекулярного іону МН*. - R1 - атом галогену; трифлуорметильний раПриготування дикал; (С1-С4)алкіл; (С1-С4)алкоксил; трифлуорме1. Приготування сполук формули (IV) і (IVa) токсильний радикал; Приготування 1.1 - R2 - атом гідрогену або атом галогену; [3-(трифлуорметил)феніл]-4-піперидинол- R4 - ароматична група, вибрана серед гідрохлорид. (IV), НСІ: R1 -3-CF3; R2 - Η; R3 - -ОН. А) 1-бензил-4-[3-(трифлуорметил)феніл]-4піперидинол-гідрохлорид. Суміш 180г магнію у 2670мл ТГФ нагрівають до 30°С і домішують 33мл розчину 1670г в 1-бром3-(трифлуорметил)бензол у 1330мл ТГФ і потім повільно решту розчину, щоб створити і підтримупричому зазначені ароматичні групи є незамівати флегму ТГФ, і залишають під зворотним хощеними або моно- або дизаміщеними замісником, лодильником з перемішуванням на 2год. Після вибраним незалежно серед атому галогену, (С1цього повільно додають розчин 1000г 1-бензил-4С4)алкілу, (С1-С4)алкоксилу, трифлуорметильного піперидинону у 3200мл ТГФ і суміш гріють під зворадикалу; у формі основи або солі приєднання ротним холодильником 2год. Після охолодження кислоти і у формі гідрату або сольвату. до ЗТ реакційну суміш вносять протягом 30хвил. у Наведені нижче приклади ілюструють приготурозчин 1870г хлориду амонію у 6700мл води і сування деяких сполук згідно з винаходом. Ці прикміш залишають перемішуватись при 20-25°С на лади не є обмежуючими і є лише ілюстраціями. 2год. Після декантування органічну фазу промиНомери сполук відповідають наведеним у Таблиці вають 5330мл води і розчинник випарюють у ваку1 нижче, яка містить хімічні структури і фізичні умі. Залишок вносять у 5330мл етеру, повільно властивості сполук згідно з винаходом. додають розчин 210г НСІ (газ) у 800мл пропан-2У приготуваннях і прикладах використано такі олу, підтримуючи температуру нижче 25°С, суміш абревіатури: залишають перемішуватись на 40хвил. і утворені етер: діетиловий етер кристали відбирають відсмоктуванням. Кристали ізоетер: діізопропіловий етер вносять у 2000мл етеру і знову відділяють відсмоДМСО: диметилсульфоксид ктуванням. Після рекристалізації з суміші пропанДМФ: Ν,Ν-ДМФ 2-ол/ЕtOН (70/30; об'єм/об'єм) одержують 1080г ДХМ: дихлорметан бажаного продукту. AcOEt: етилацетат В) 4-[3-(трифлуорметил)феніл]-4-піперидинолДІПЕА: діізопропілетиламін гідрохлорид. ТФК: трифлуороцтова кислота Суміш 1000г сполуки,, одержаної у попередній БОФ: гексафлуорфосфат бензотриазол-1операції і 83г 10% паладію на карбоні (вологість ілохитрис(диметиламіно)фосфонію 50%) у 2910мл ЕtOН і 2910мл МеОН гідрогенують ПіБОФ: гексафлуорфосфат бензотриазол-1при 50°С під тиском 2 бар. Каталізатор відфільтілокситрипіролідинфосфонію ровують і промивають двічі 660мл МеОН і фільт2Ν гідрохлорний етер: 2Ν розчин гідрохлорної рат і змивки концентрують у вакуумі. Залишок внокислот в діетиловому етері сять у 3320мл етеру і залишають перемішуватись т. пл.: точка плавлення при ЗТ на 1год. 30хвил. Осад ізолюють відсмоктуЗТ: зовнішня температура ванням, промивають 280мл етеру і сушать у вакут.к.: температура кипіння умі при 40°С. Це дає 726г бажаного продукту. РХВР: рідинна хроматофафія високого розрізПриготування 1.2 нення 4-метокси-4-[3силікагель Н: силікагель 60 Η від Merck (трифлуорметил)феніл]піперидин. (Darmstadt) (IV): R2 - 3-CF3; R2 - Η; R3 - -OCH3. Буферний розчин рН - 2: розчин 16,66г KHSO4 A) трет-бутил 4-гідрокси-4-[3і 32,32г K2SO4 в 1л води. (трифлуорметил)феніл]-1-піперидинкарбоксилат. 1 Спектр протонного магнітного резонансу ( Н До 20г сполуки, одержаної у Приготуванні 1.1, ЯМР) реєструють на 200МГц у ДМСО-d6, з викориу 80мл ДХМ домішують при ЗТ 17,92г триетиламістанням піку ДMCO-d6 як еталону. Хімічні зсуви δ ну і потім краплями розчин 16,3г ди-трет-бутил надано в частках намлн. (1/млн.). Позначення сподикарбонату у 20мл ДХМ і суміш залишають пестережених сигналів: s: синглет; bs: широкий сингремішуватись при ЗТ на 18год. До реакційної сулет; d: дублет; sd: розщеплений дублет; t: триплет; міші додають воду і потім екстрагують ДХМ, оргаst: розщеплений триплет; q; квадруплет; unres. нічну фазу промивають водою і 5%-м розчином сотр.: нерозрізнений комплекс, mt: мультиплет. KHSO4 і сушать над Na2SO4 і розчинник випарюСпектр ЯМР підтверджує структури сполук. ють у вакуумі. Це дає 13г бажаного продукту після Сполуки винаходу аналізують сполученням рекристалізації з суміші ізоетер/гексан. РХ/УФ/МС (рідинна хроматографія/детектор ультB) трет-бутил 4-метокси-4-[3 21 77526 22 (трифлуорметил)феніл]-1-піперидинкарбоксилат. D) 1 -бензил-N,N-диметил-4-[3До розчину 2г сполуки, одержаної у поперед(трифлуорметил)феніл]-4-піперидинамін. ній операції, у 15мл ДМФ і 20мл ТГФ домішують Суміш 8,1г сполуки, одержаної у попередній порціями при ЗТ 0,277г гідриду натрію при конценоперації, 3,5мл 37%-го розчину формальдегіду у трації 60% у маслі і суміш залишають перемішуваводі і 10мл оцтової кислоти у 250мл ТГФ домішутись на 40хвил. Додають 1,3г метилйодиду і суміш ють порціями при ЗТ до 50г триацетоксиборгідризалишають перемішуватись на 2год. Реакційну ду натрію і суміш залишають перемішуватись при суміш концентрують у вакуумі, залишок вносять у ЗТ на ніч. Додають 200мл МеОН, реакційну суміш воду і екстрагують AcOEt, органічну фазу промигріють при 70°С 1год. і концентрують у вакуумі. вають водою, сушать над Na2SO4 і розчинник виЗалишок вносять у 1N розчин NaOH і екстрагують парюють у вакуумі. Це дає 2г бажаного продукту у ДХМ, органічну фазу промивають водою, сушать формі жовтого масла. над Na2SO4 і розчинник випарюють у вакуумі. Це C) 4-метокси-4-[3дає 8,7г бажаного продукту у формі масла, яке (трифлуорметил)феніл]піперидин. твердіє. Суміш 2г сполуки, одержаної у попередній E) N,N-диметил-4-[3-(трифлуорметил)феніл]операції, і 5мл TFF у 15мл ДХМ залишають пере4-піперидинамін. мішуватись при ЗТ на 1год. Реакційну суміш конСуміш 8,2г сполуки, одержаної у попередній центрують у вакуумі, залишок екстрагують ДХМ, операції, 5г формату амонію і 2г 10% паладію на органічну фазу промивають 5%-м розчином карбоні у 100мл МеОН залишають перемішуваNa2СО3, сушать над Na2SO4 і розчинник випарютись при ЗТ на 1год. Каталізатор відфільтровують і ють у вакуумі. Це дає 1,7г бажаного продукту у фільтрат концентрують у вакуумі. Залишок вноформі помаранчевого масла. сять у насичений розчин K2СО3 і екстрагують Приготування 1.3 AcOEt, органічну фазу сушать над Na2SO4 і розN,N-диметил-4-[3-(трифлуорметил)феніл]-4чинник випарюють у вакуумі. Це дає 4,8г бажаного піперидинамін. продукту. (IV): R1 - 3-CF3; R2 - Η; R3 - -N(CH3)2. Приготування 1.4 A) 1-бензил-4-[3-(трифлуорметил)феніл]-44-[3-(трифлуорметил)феніл]-4піперидинол. піперидинкарбонітрил-гідрохлорид. У льодяній ванні охолоджують розчин 20г спо(IVa), HCI: R, - 3-CF3; R2 - Η. луки, одержаної у Приготуванні 1.1 (вільна осноА) 2-(2,2-діетоксиетил)-4,4-діетокси-2-[3ва), і 11,3мл триетиламіну у 200мл ДХМ, і крапля(трифлуорметил)феніл]бутанонітрил. ми додають 11мл бензилброміду. Суміш Суміш 30г 3залишають перемішуватись при ЗТ на ніч, потім трифлуорметил)фенілацетонітрилу і 14,4г аміду концентрують у вакуумі, залишок вносять у насинатрію у 400мл толуолу залишають перемішувачений розчин K2СО3 і екстрагують AcOEt, органічтись при ЗТ на 5хвил., додають 66мл бромацетану фазу промивають насиченим розчином K2СО3 і льдегіддіетилацеталю і суміш гріють при 60°С пронасиченим розчином NaCI, сушать над Na2SO4 і тягом 3год., після чого концентрують у вакуумі, розчинник випарюють у вакуумі. Маслянистий зазалишок вносять у воду і екстрагують етером, орлишок вносять у пентан і осад ізолюють відсмокганічну фазу сушать над Na2SO4 і розчинник випатуванням. Це дає 17г бажаного продукту. рюють у вакуумі. Залишок хроматографують на B) N-[1-бензил-4-[3-(трифлуорметил)феніл]-4силікагелі Н, з елюентом ДХМ/AcOEt (100/5; піперидил]ацетамід. об'єм/об'єм). Це дає 26г бажаного продукту. У льодяній ванні охолоджують 60мл концентВ) 4-оксо-2-(2-оксоетил)-2-[3рованої H2SO4, краплями додають розчин 16г спо(трифлуорметил)феніл]бутанoнітрил. луки, одержаної у попередній операції, у 120мл Суміш 23,9г сполуки, одержаної у попередній ацетонітрилу, підтримуючи температуру реакційоперації, у 90мл мурашиної кислоти залишають ного середовища нижче 30°С, і суміш залишають перемішуватись при 50°С на 1год. До реакційної перемішуватись на ніч, протягом якої температура суміші додають воду, екстрагують AcOEt, органічповертається до ЗТ. Реакційну суміш вливають у ну фазу промивають водою і 10%-м розчином лід і підлужують доданням концентрованого розNaHCO3, сушать над Na2SO4 і розчинник випарючину NaOH, осад ізолюють відсмоктуванням, розють у вакуумі. Це дає 16г бажаного продукту, який чиняють у ДХМ, органічну фазу промивають вовикористовують у наступній операції. дою, сушать над Na2SO4 і розчинник випарюють у C) 1-бензил-4-[3-(трифлуорметил)феніл]-4вакуумі. Це дає 9,7г бажаного продукту після рекпіперидинкарбонітрил-гідрохлорид. ристалізації з ацетонітрилу. Суміш 16г сполуки, одержаної у попередній C) 1 -бензил-4-[3-(трифлуорметил)феніл]-4операції, 6,25мл бензиламіну, 48,6г триацетоксипіперидинамін. боргідриду натрію і 5 крапель оцтової кислоти у Суміш 9,6г сполуки, одержаної у попередній 150мл ДХМ залишають перемішуватись при ЗТ на операції, 250мл концентрованого розчину НСІ і ніч. Краплями додають 40мл МеОН і суміш гріють 250мл води гріють при 150°С протягом ночі. Полопри 60°С 1год. Реакційну суміш концентрують у вину реакційної суміші концентрують у вакуумі, вакуумі, залишок екстрагують AcOEt, органічну кислотну водну фазу підлужують доданням концефазу промивають 10%-м розчином NaHCO3 і вонтрованого розчину NaOH і екстрагують ДХМ, ордою, сушать над Na2SO4 і розчинник випарюють у ганічну фазу сушать над Na2SO4 і розчинник випавакуумі. Залишок вносять у насичений розчин НСІ рюють у вакуумі. Це дає 8,1г бажаного продукту, (газ) в етері і осад ізолюють відсмоктуванням. Це який використовують безпосередньо. дає 18г бажаного продукту. 23 77526 24 D) 4-[3-(трифлуорметил)феніл]-4фазу сушать над Na2SO4 і розчинник випарюють у піперидинкарбонітрил-гідрохлорид. вакуумі. Це дає 1,86г бажаного продукту. Суміш 2г сполуки, одержаної у попередній C) Трет-бутил [4-[3-(трифлуорметил)феніл]-4операції, і 0,2г 10% паладію на карбоні у 30мл піперидил]метилкарбамат. МеОН гідрогенують при ЗТ під атмосферним тисСуміш 1,8г сполуки, одержаної у попередній ком протягом 3год. Каталізатор відфільтровують операції, і 0,18г 10% паладію на карбоні у 20мл на Celite® і фільтрат концентрують у вакуумі. Це МеОН гідрогенують при ЗТ при атмосферному дає 1,5г бажаного продукту. тиску протягом ночі. Каталізатор відфільтровують і Цю сполуку можна також приготувати такими фільтрат концентрують у вакуумі. Це дає 1,3г батрьома операціями: жаного продукту у формі масла. А') Трет-бутил біс(2-хлоретил)карбамат. Приготування 1.6 Суміш 106г N,N-біс(24-[3-(трифлуорметил)феніл]-4хлоретил)амінгідрохлориду і 130г ди-третпіперидинкарбоксамід. бутилдикарбонату у 1500мл ДХМ домішують крап(IV): R1 - 3-CF3; R2 - Η; R3 - -CONH2. лями протягом 1год. 30хвил. при ЗТ до 83мл триеA) 1 -бензил-4-[3-(трифлуорметил)феніл]-4тиламіну, потім залишають перемішуватись при ЗТ піперидинкарбоксамід. на ніч. Реакційну суміш промивають водою, оргаСуміш 5г сполуки, одержаної в операції С Принічну фазу сушать над Na2SO4 і випарюють у вакуготування 1.4, 30мл толуолу, 30мл 30%-го розчину умі. Це дає 150г бажаного продукту, який викорисН2О2, 30мл 30%-го розчину NaOH і 0,5г аліквоти товують безпосередньо. 336 (триоктилметилхлориду амонію) гріють при В') Трет-бутил 4-ціано-4-[3100°С 48год., потім концентрують у вакуумі, зали(трифлуорметил)феніл]-1-піперидин карбоксилат. шок вносять у воду і екстрагують ДХМ, органічну Суспензію 56г гідриду натрію (концентрація фазу сушать над Na2SO4 і розчинник випарюють у 60% у маслі) 750мл ДМСО і 250мл ТГФ домішують вакуумі. Залишок хроматографують на силікагелі краплями в інертній атмосфері при ЗТ до розчину Η з елюентом ДХМ/МеОН (100/3; об'єм/об'єм). Це 120г 3-(трифлуорметил)фенілацетонітрилу у дає 2,5г бажаного продукту. 250мл ДМСО і потім повільно додають розчин 150г В) 4-[3-(трифлуорметил)феніл]-4сполуки, одержаної у попередній операції, у 250мл піперидинкарбоксамід. ДМСО і гріють при 60°С протягом ночі. Реакційну Суміш 2,5г сполуки, одержаної у попередній суміш вливають у суміш лід/Н2О і екстрагують етеоперації, і 0,25г 10% паладію на карбоні у 30мл ром, органічну фазу промивають водою і насичеМеОН гідрогенують при ЗТ під атмосферним тисним розчином NaCI, сушать над Na2SO4 і розчинком протягом 48год. Каталізатор відфільтровують і ник випарюють у вакуумі. Залишок фільтрат концентрують у вакуумі. Це дає 1,7г бахроматографують на силікагелі з елюентом ДХМ і жаного продукту. потім суміш ДХМ/AcOEt (80/20; об'єм/об'єм). Це Приготування 1.7 дає 191г бажаного продукту, який кристалізується; 4-[2-(трифлуорметил)феніл]-4-піперидинол. т. пл. =72-73°С. (IV): R1 - 2-CF3; R2 - Η; R3 - -ОН. С) 4-[3-(трифлуорметил)феніл]-4A) 1 -бензил-4-[2-(трифлуорметил)феніл]-4піперидинкарбонітрил-гідрохлорид. піперидинол. Суміш 115г сполуки, одержаної у попередній Суміш 1,52г магнію 25мл ТГФ домішують краоперації, 500мл 2N розчину НСІ в етері і 150мл плями протягом 20хвил. до розчину 14,25г 1-бромМеОН залишають перемішуватись при ЗТ на 4год. 2-(трифлуорметил)бензолу у 15мл ТГФ і суміш Кристалічний продукт ізолюють відсмоктуванням і гріють під зворотним холодильником 30хвил., піссушать. Це дає 75г бажаного продукту, т. пл. ля чого охолоджують у льодяній ванні, домішують =259°С. повільно розчин 10г 1-бензил-4-піперидинону у Приготування 1.5 30мл ТГФ і залишають перемішуватись при ЗТ на Трет-бутил [4-[3-(трифлуорметил)феніл]-43год. Реакційну суміш вливають у насичений водпіперидил]метилкарбамат. ний розчин хлориду амонію і екстрагують AcOEt, (IV): R1 - 3-CF3; R2 - Η; R3 - -CH2NHоб'єднані органічні фази промивають водою, суCOOC(CH3)3. шать над Na2SO4 і розчинники випарюють у вакууA) [1-бензил-4-[3-(трифлуорметил)феніл]-4мі. Залишок хроматографують на силікагелі з піперидил]метиламін. елюентом ДХМ/AcOEt (70/30; об'єм/об'єм). Це дає Суміш 1,5г сполуки, одержаної в операції С 4,5г бажаного продукту. Приготування 1.4, 0,15г нікелю Рейні® і 5мл водВ) 4-[2-(трифлуорметил)феніл]-4-піперидинол. ного амонію у 20мл МеОН гідрогенують при ЗТ під Суміш 4,5г сполуки, одержаної у попередній атмосферним тиском протягом ночі. Каталізатор операції, і 0,5г 10% паладію на карбоні у 100мл відфільтровують і фільтрат концентрують у вакууМеОН гідрогенують при 35°С під атмосферним мі. Це дає 1,45г бажаного продукту. тиском протягом ночі. Каталізатор відфільтровуB) Трет-бутил [1-бензил-4-[3ють і фільтрат концентрують у вакуумі. Це дає 2,7г (трифлуорметил)феніл]-4бажаного продукту після рекристалізації з ізопіперидил]метилкарбамат. Суміш 1,45г сполуки, етеру. одержаної у попередній операції, і 20мл AcOEt Приготування 1.8 нагрівають до 40°С, додають 0,9г ди-трет4-[2-(трифлуорметил)феніл]-4бутилдикарбонату і суміш гріють під зворотним піперидинкарбонітрил-гідрохлорид. холодильником 30хвил. Після охолодження до ЗТ (IVa), HCI: R1 - 2-CF3; R2 - H. домішують воду і екстрагують AcOEt, органічну А)Трет-бутил-4-ціано-4-[2 25 77526 26 (трифлуорметил)феніл]-1-піперидин-карбоксилат. Na2SO4 і розчинник випарюють у вакуумі. Це дає До суспензії 9г гідриду натрію (конц. 60% у ма9,3г бажаного продукту. слі) у 125мл ДМСО і 125мл ТГФ домішують крапB) Трет-бутил 4-(гідроксиметил)-4-[3лями при ЗТ розчин 20г 2(трифлуорметил)феніл]-1-піперидин-карбоксилат. (трифлуорметил)фенілацетонітрилу у 50мл ДМСО Суміш 9,27г сполуки, одержаної у попередній і потім повільно розчин 25г сполуки, одержаної в операції, у 150мл етеру охолоджують to 0°С, дооперації А' Приготування 1.4, у 70мл ДМСО і суміш дають 1г алюмогідриду літію і суміш залишають гріють при 60°С 24год. Реакційну суміш вливають у перемішуватись при 0°С на 4год. До реакційної 2л води і екстрагують етером, органічну фазу просуміші домішують насичений розчин NH4CI, неормивають водою, сушать над Na2SO4 і розчинник ганічні солі відфільтровують, фільтрат екстрагують випарюють у вакуумі. Залишок хроматографують AcOEt, органічну фазу сушать над Na2SO4 і розна силікагелі з елюентом ДХМ і потім ДХМ/AcOEt чинник випарюють у вакуумі. Це дає 5,5г бажаного (70/30; об'єм/об'єм). Це дає 16г бажаного продукту. продукту після рекристалізації з етеру. В) 4-[2-(трифлуорметил)феніл]-4С) Трет-бутил 4-[(ацетилокси)метил]-4-[3піперидинкарбонітрилгідрохлорид. (трифлуорметил)феніл]-1-піперидин-карбоксилат. Суміш 6г сполуки, одержаної у попередній Суміш 5,5г сполуки, одержаної у попередній операції, 150мл 2N гідрохлорного етеру і 20мл операції, і 2мл триетиламіну у 50мл ДХМ охолоМеОН залишають перемішуватись при ЗТ на джують -70°С, додають 1,1мл ацетилхлориду і 2год., потім концентрують у вакуумі, залишок вносуміш залишають перемішуватись на ніч, протягом сять в етер і осад ізолюють відсмоктуванням. Це якої температура повертається до ЗТ. До реакційдає 2,3г бажаного продукту. ної суміші додають лід, потім екстрагують ДХМ, Приготування 1.9 органічну фазу сушать над Na2SO4 і розчинник Метил 4-[3-(трифлуорметил)феніл]-4випарюють у вакуумі. Це дає 6г бажаного продукпіперидинкарбоксилат-гідрохлорид. ту. (IV), НСІ: R1 - 3-CF3; R2 - Η; R3 - -СООСН3. D) [4-[3-(трифлуорметил)феніл]-4A) 1-бензил-4-[3-(трифлуорметил)феніл]-4піперидил]метилацетат. піперидинкарбонова кислота. Суміш 6г сполуки, одержаної у попередній Суміш 5г сполуки, одержаної в операції С Приоперації, і 30мл ТГФ у 50мл ДХМ залишають пеготування 1.4 і 4,25г гранул КОН у 80мл етиленгліремішуватись при ЗТ на 1год., потім концентрують колю гріють під зворотним холодильником 3год., у вакуумі, до залишку додають лід і потім 10%-й потім охолоджують до ЗТ і домішують 100мл води, розчин №НСО3 і екстрагують ДХМ, органічну фазу підкислюють до рН=6,5 доданням 10%-го розчину сушать над Na2SO4 і розчинник випарюють у вакуНСІ, осад ізолюють відсмоктуванням і сушать у умі. Це дає 4,5г бажаного продукту. вакуумі. Це дає 3,9г бажаного продукту, т. пл. Приготування 1.11 =243°С. 4-[4-(трифлуорметил)феніл]-4-піперидинол. B) Метил 1-бензил-4-[3(IV): R1 - 4-CF3; R2 - Η; R3 - -ОН. (трифлуорметил)феніл]-4-піперидинкарбоксилатA) 1-бензил-4-[4-(трифлуорметил)феніл]-4гідрохлорид. піперидинол. Суміш 3г сполуки, одержаної у попередній Цю сполуку приготовляють за процедурою операції, і 50мл тіонілхлориду у 100мл ДХМ гріють операції Приготування 1.7, з 1,55г магнію у 25мл при 60°С 3год., потім концентрують у вакуумі, заТГФ, розчину 14,25г 1-бром-4лишок вносять у 100мл МеОН і гріють при 60°С (трифлуорметил)бензолу у 15мл ТГФ і розчину 10г протягом ночі. Концентрування у вакуумі дає 4г 1-бензил-4-піперидинону у 30мл ТГФ. Це дає 7,3г бажаного продукту, т. пл. =230°С. бажаного продукту. C) Метил 4-[3-(трифлуорметил)феніл]-4В) 4-[4-(трифлуорметил)феніл]-4-піперидинол. піперидинкарбоксилат-гідрохлорид. Суміш 4,8г сполуки, одержаної у попередній Суміш 4г сполуки, одержаної у попередній операції, і 2г 10% паладію на карбоні у 50мл МеОН операції, і 0,4г 10% паладію на карбоні у 200мл гідрогенують при 30°С під атмосферним тиском МеОН гідрогенують при ЗТ під атмосферним тис2год. Каталізатор відфільтровують і фільтрат конком протягом ночі. Каталізатор відфільтровують і центрують у вакуумі. Це дає 2,4г бажаного продукфільтрат концентрують у вакуумі. Це дає 2,5г бату після рекристалізації з ізоетеру. жаного продукту. Приготування 1.12 4-(4-хлорфеніл)-4Приготування 1.10 піперидинкарбонітрилгідрохлорид. [4-[3-(трифлуорметил)феніл]-4(IVa), HCI: R1 - 4-Cl; R2 - H. піперидил]метилацетат. А) Трет-бутил 4-(4-хлорфеніл)-4-ціано-1(IV): R1 - 3-CF3; R2 - Η; R3 - -СН2-О-СО-СН3піперидинкарбоксилат. A) 1-(трет-бутил)-4-метил 4-[3До суспензії 4,4г гідриду натрію (конц. 60% у (трифлуорметил)феніл]-1,4маслі) у 300мл ТГФ швидко домішують при ЗТ піперидиндикарбоксилат. 7,51г 4-хлорфенілацетонітрилу і потім 12г третСуміш 7г сполуки, одержаної у Приготуванні бутил біс(2-хлоретил)карбамату, гріють при 40°С 1.9, 5,33г ди-трет-бутилдикарбонату і 3,5мл трие28год. і потім залишають перемішуватись при ЗТ тиламін у 100мл ДХМ залишають перемішуватись на ніч. Додають насичений розчин хлориду амопри ЗТ на 2год., потім концентрують у вакуумі, нію, реакційну суміш концентрують у вакуумі для залишок вносять у воду і екстрагують етером, орвидалення ТГФ, після чого водну фазу екстрагуганічну фазу промивають водою, сушать над ють етером, органічну фазу промивають буфер 27 77526 28 ним розчином з рН 2 і насиченим розчином NaCI, (трифлуорметил)феніл]-4-піперидил]ацетамід. сушать над Na2SO4 і розчинник випарюють у вакуУ льодяній ванні охолоджують 30мл концентумі. Це дає 12г бажаного продукту, який викорисрованого H2SO4, краплями додають розчин 7,98г товують безпосередньо. сполуки, одержаної у попередній операції, у 60мл В) 4-(4-хлорфеніл)-4-піперидинкарбонітрилацетонітрилу при температурі нижче 15°С і суміш гідрохлорид. залишають перемішуватись при 15°С на 2 дні. РеСуміш 18г сполуки, одержаної у попередній акційну суміш вливають у лід, підлужують доданоперації, у 100мл МеОН і 20мл концентрованого ням гранул NaOH і екстрагують AcOEt, органічну розчину НСІ гріють при 40-50°С 3год. Реакційну фазу сушать над Na2SO4 і розчинник випарюють у суміш концентрують у вакуумі, залишок вносять вакуумі, одержуючи нечисту тверду речовину двічі у МеОН і кожного разу розчинник випарюють (7,86г). Залишок хроматографують на силікагелі з у вакуумі. Це дає 5,85г бажаного продукту після елюентом ДХМ/МеОН (від 97/3 до 95/5; рекристалізації з ацетону. об'єм/об'єм). Це дає 4,26г бажаного продукту після Приготування 1.13 рекристалізації з суміші ДХМ/ізоетер; т. пл. =1984-(3-метилфеніл)-4-піперидинол. 199°С. (IV): R1 - 3-СН3; R2 - Η; R3 = -ОН. C) N-[4-[4-хлор-3-(трифлуорметил)феніл]-4A) 1 -бензил-4-(3-метилфеніл)-4-піперидинол. піперидил]ацетамід-гідрохлорид. Цю сполуку приготовляють за процедурою Суміш 3,1г сполуки, одержаної у попередній операції Приготування 1.7, з 1,55г магнію у 25мл операції, і 1,05г K2СО3 у 25мл ДХМ залишають ТГФ, розчину 11г 3-бромтолуолуу 15мл ТГФ і розперемішуватись при ЗТ на 15хвил., потім охолочину 10г 1-бензил-4-піперидону у 30мл ТГФ. Одеджують льодяною ванною, додають краплями розржаний продукт хроматографують на силікагелі з чин 1,2мл 1-хлоретилхлорформату у 5мл ДХМ і елюентом ДХМ/МеОН (97/3; об'єм/об'єм). Це дає залишають перемішуватись при 4°С на 2год. Не14,5г бажаного продукту. розчинний продукт відфільтровують, фільтрат B) 4-(3-метилфеніл)-4-піперидинол. концентрують у вакуумі, залишок вносять у МеОН і Суміш 14,5г сполуки, одержаної у попередній розчинник випарюють у вакуумі. Залишок вносять операції, i 2г 10% паладію на карбоні у 500мл Меу 80мл МеОН і гріють під зворотним холодильниОН гідрогенують при 25°С під атмосферним тиском 15хвил. і розчинник випарюють у вакуумі. Це ком протягом 48год. Каталізатор відфільтровують і дає 2,7г бажаного продукту. фільтрат концентрують у вакуумі. Це дає 8,9г баD) Трет-бутил 4-(ацетиламіно)-4-[4-хлор-3жаного продукту. (трифлуорметил)феніл]-1-піперидин-карбоксилат. Приготування 1.14 Суміш 2,7г сполуки, одержаної у попередній 4-(3-метоксифеніл)-4-піперидинол. операції, 1,9мл ДІПЕА і 1,64г ди-трет(IV): R1 - 3-ОСН3; R2 - Η; R3 - -ОН. бутилдикарбонату у 20мл ДХМ залишають переA) 1-бензил-4-(3-метоксифеніл)-4-піперидинол. мішуватись при ЗТ на 2год. Суміш концентрують у Цю сполуку приготовляють за процедурою вакуумі і залишок хроматографують на силікагелі з операції приготування 1.7 з 1,55г магнію у 25мл елюентом ДХМ/МеОН (98/2; об'єм/об'єм). Це дає ТГФ, розчину 12г 3-броманізолу у 15мл ТГФ і роз1,4г бажаного продукту. чину 10г 1-бензил-4-піперидону у 30мл ТГФ. ОдеЕ) N-[4-[4-хлор-3-(трифлуорметил)феніл]-4ржаний продукт хроматографують на силікагелі з піперидил]ацетамід-гідрохлорид. елюентом ДХМ/МеОН (від 97/3 до 95/5; До суспензії 1,4г сполуки, одержаної у попереоб'єм/об'єм). Це дає 13,7г бажаного продукту. дній операції, 20мл діоксану домішують 4мл 2N B) 4-(3-метоксифеніл)-4-піперидинол. розчину гідрохлорного етеру і залишають переміСуміш 13,7г сполуки, одержаної у попередній шуватись при ЗТ на 2год. Реакційну суміш конценоперації, і 2г 10% паладію на карбоні у 500мл трують у вакуумі і одержують бажаний продукт, EtOH гідрогенують при 25°С під атмосферним тисякий використовують безпосередньо. ком протягом 48год. Каталізатор відфільтровують і Приготування 1.16 фільтрат концентрують у вакуумі. Це дає 10,8г 4-[3-(трифлуорметокси)феніл]-4-піперидинол бажаного продукту. гідрохлорид. Приготування 1.15 (IV), НСІ: R1 - 3-OCF3; R2 - Η; R3- -ОН. N-[4-[4-хлор-3-(трифлуорметил)феніл]-4A) 1 -бензил-4-[3-(трифлуорметокси)феніл]-4піперидил]ацетамід-гідрохлорид. піперидинол-гідрохлорид. (IV), НСІ: R1 - 3-CF3; R2 - 4-Сl; R3- -NHCOCH3. Цю сполуку приготовляють за процедурою A) 1-бензил-4-[4-хлор-3операції приготування 1.7, з 2г магнію у 25мл ТГФ, (трифлуорметил)феніл]-4-піперидинол. розчину 20г 1-бром-3-(трифлуорметокси)бензолу у Суміш 15г 4-[4-хлор-3-(трифлуорметил)феніл]15мл ТГФ і розчину 13г 1-бензил-4-піперидону у 4-піперидинолу, 8,3г K2СО3 і 7,18мл бензилброміду 30мл ТГФ. Гідрохлорид одержаного продукту у 80мл ДМФ залишають перемішуватись при ЗТ на утворюється у 2N розчині гідрохлорного етеру. Це 2 дні. Реакційну суміш вливають у воду і екстрагудає 24,4г бажаного продукту. ють AcOEt, нерозчинний продукт відфільтровують, В) 4-[3-(трифлуорметокси)феніл]-4органічну фазу промивають водою і насиченим піперидинол-гідрохлорид. розчином NaCI, сушать над Na2SO4 і розчинник Суміш 24г сполуки, одержаної у попередній випарюють у вакуумі. Залишок хроматографують операції, 16г формату амонію і 2г 10% паладію на на силікагелі з елюентом ДХМ/МеОН (95/5; карбоні у 500мл МеОН залишають перемішуваоб'єм/об'єм). Це дає 14,6г бажаного продукту. тись при ЗТ на 4год. Каталізатор відфільтровують і B) N-[1-бензил-4-[4-хлор-3фільтрат концентрують у вакуумі. Залишок вно 29 77526 30 сять у насичений розчин K2СО3 і екстрагують етеДХМ і потім ДХМ/МеОН (100/4; об'єм/об'єм). Це ром, органічну фазу промивають насиченим роздає 20г бажаного продукту. чином NaCI, сушать над Na2SO4 і розчинник випаE) [[1-бензил-4-[3-(трифлуорметил)феніл]-4рюють у вакуумі. Залишок вносять у 2N розчин піперидил]метил]метиламін. гідрохлорного етеру і осад ізолюють відсмоктуванДо суспензії 4г алюмогідриду літію у 400мл ням. Це дає 6,2г бажаного продукту, т. пл. =145етеру домішують при ЗТ 20г сполуки, одержаної у 146°С. попередній операції, і потім залишають перемішуПриготування 1.17 ватись при ЗТ на 16год. Потім додають послідовТрет-бутилметил [[4-[3но, 3мл води, 3мл 30%-го NaOH і 1мл води і суміш (трифлуорметил)феніл]піперидин-4залишають перемішуватись. Неорганічні солі віділ]метил]карбамат. фільтровують на Celite, фільтрат декантують, ор(IV): R1 - 3-CF3; R2 - Η; R3 - -СН2N(СН3)ганічну фазу сушать над Na2SО4 і розчинник випаСООС(СН3)3 рюють у вакуумі. Це дає 18г бажаного продукту. А) N,N-біс(2-хлоретил)бензиламін. F) Трет-бутил [[1-бензил-4-[3До охолодженої у льодяній ванні суміші 150г (трифлуорметил)феніл]-4-піперидил]метил]N,N-біс(2-хлоретил)амінгідрохлориду і 100мл бенметилкарбамат. зилброміду у 1000мл ДМФ додають краплями Суміш 18г сполуки, одержаної у попередній 120мл триетиламіну і суміш залишають перемішуоперації, і 9,6г ди-трет-бутилдикарбонату у 300мл ватись при ЗТ на ніч. Реакційну суміш концентруДХМ залишають перемішуватись при ЗТ на 1год. ють у вакуумі, залишок вносять у воду і екстрагуДо реакційної суміші додають воду, потім ексють тричі етером, органічну фазу сушать над трагують ДХМ, органічну фазу сушать над Na2SO4 Na2SO4 і розчинник випарюють у вакуумі. Це дає і розчинник випарюють у вакуумі. Залишок хрома113г бажаного продукту. тографують на силікагелі Н, з елюентом B) 1-бензил-4-[3-(трифлуорметил)феніл]-4ДХМ/МеОН (100/2; об'єм/об'єм). Це дає 21г бажапіперидинкарбонітрил-пдрохлорид. ного продукту. До суспензії 23,24г гідриду натрію (конц. 60% у G) Трет-бутилметил [4-[3маслі) у 100мл ДМСО і 100мл ТГФ домішують кра(трифлуорметил)феніл]піперидин-4-іл]метил]плями в інертній атмосфері при ЗТ розчин 50г 3карбамат. (трифлуорметил)фенілацетонітрилу у 150мл Суміш 21г сполуки, одержаної у попередній ДМСО і суміш залишають перемішуватись на операції, і 2г 10% паладію на карбоні у 300мл Ме15хвил. Додають розчин 62,43г сполуки, одержаОН гідрогенують при ЗТ під атмосферним тиском ної у попередній операції, у 150мл ДМСО і суміш протягом 12год. Каталізатор відфільтровують і залишають перемішуватись при ЗТ на ніч. Додафільтрат концентрують у вакуумі. Це дає 16г бають суміш лід/вода, систему екстрагують етером, жаного продукту. органічну фазу сушать над Na2SO4 і розчинник Приготування 1.18 випарюють у вакуумі. Залишок вносять у 1000мл 4-(3-хлорфеніл)-4-піперидинкарбонітрилгарячого ЕЮН, залишають перемішуватись при ЗТ гідрохлорид. на 48год. і кристалічний продукт ізолюють відсмок(IVa), HCI:R1 - 3-CI;R2 - H. туванням. Це дає 50г бажаного продукт. А) Трет-бутил-4-(3-хлорфеніл)-4C) [1-бензил-4-[3-(трифлуорметил)феніл] 4ціанопіперидин-1-карбоксилат. піперидил]метиламін. До суспензії 15,8г гідриду натрію (конц. 60% у 30г сполуки, одержаної у попередній операції, маслі) у 400мл ДМСО домішують краплями при ЗТ розчиняють у 10%-му розчині NaOH і екстрагують в інертній атмосфері розчин 30г 3етером, органічну фазу сушать над Na2SO4 і розхлорфенілацетонітрилу 200мл ТГФ, потім розчин чинник випарюють у вакуумі. Продукт у формі ві45,5г трет-бутил біс(2-хлоретил)карбамату у льної основи вносять у 500мл МеОН і 30мл 20%-го 200мл ДМСО і гріють при 60°С протягом ночі. Реаводного розчину амонію, додають 3г нікелю кційну суміш вливають у суміш лід/вода і екстраRaney® і систему гідрогенують при ЗТ під атмосгують етером, органічну фазу промивають водою, ферним тиском протягом ночі. Каталізатор відфісушать над Na2SO4 і розчинник випарюють у вакультровують і фільтрат концентрують у вакуумі. умі. Залишок хроматографують на силікагелі з Залишок вносять у воду і екстрагують AcOEt, орелюентом ДХМ. Це дає 33г бажаного продукту. ганічну фазу сушать над Na2SO4 і розчинник випаВ) 4-(3-хлорфеніл)-4-піперидинкарбонітрилрюють у вакуумі. Це дає 27г бажаного продукту. гідрохлорид. D) [[1-бензил-4-[3-(трифлуорметил)феніл]-4Суміш 6,7г сполуки, одержаної у попередній піперидил]метил]формамід операції, 100мл 2N розчину гідрохлорного етеру і Суміш 27г сполуки, одержаної у попередній 20мл МеОН залишають перемішуватись при ЗТ операції, і 300мл етилформату залишають перепротягом 3год., потім концентрують у вакуумі, замішуватись при ЗТ на ніч, потім гріють при 60°С лишок вносять в етер і осад ізолюють відсмокту6год. і залишають перемішуватись при ЗТ на ванням. Це дає 4,65г бажаного продукту, 48год., потім концентрують у вакуумі, залишок т. пл. =198°С. вносять у 10%-й розчин НСІ розчин, кислотну водПриготування 1.19 ну фазу промивають етером, додають лід, суміш 4-(3-метоксифеніл)-4-піперидинкарбонітрил гіпідлужують доданням 10%-го розчину NaOH і ексдрохпорид. трагують етером, органічну фазу сушать над (IVa), НСІ: R1 - 3-ОСН3; R2 - Η. Na2SO4 і розчинник випарюють у вакуумі. Залишок A) Трет-бутил 4-(3-метоксифеніл)-4хроматографують на силікагелі Н, з елюентом ціанопіперидин-1-карбоксилат. 31 77526 32 Цю сполуку приготовляють за процедурою ні 1.1 і 10мл ДІПЕА у 40мл ДХМ домішують крапоперації Приготування 1.8, з 16,3г гідриду натрію лями при ЗТ 1,63мл 2-хлорацетилхлориду і зали(конц. 60% у маслі) у 400мл ДМСО, 30г 3шають перемішуватись на 30хвил. Реакційну суметоксифенілацетонітрилу у 150мл ТГФ і 47г третміш промивають водою, органічну фазу сушать бутил біс(2-хлоретил)-карбамату у 100мл ДМСО. над Na2SO4 і розчинник випарюють у вакуумі. ЗаЦе дає 54г бажаного продукту. лишок хроматографують на силікагелі з елюентом B) 4-(3-метоксифеніл)-4-піперидинкарбонітрил ДХМ/МеОН (97/3; об'єм/об'єм). Це дає 5,5г бажагідрохлорид. ного продукту, який використовують безСуміш 48г сполуки, одержаної у попередній посередньо. операції, 300мл 2Ν розчину гідрохлорного етеру і Приготування 2.3 50мл МеОН залишають перемішуватись при ЗТ на 1-[4-гідрокси-4-[3-(трифлуорметил)феніл]-12год. Осад ізолюють відсмоктуванням і одержують піперидил]-2-пропен-1-он. 30,5г бажаного продукту, т. пл. =172°С. (llb): R1 - 3-CF3; R2 - H; R3 - -OH. Приготування 1.20 До охолодженої у льодяній ванні суміші 5г 4-(ацетидин-1-ілкарбоніл)-4-[3сполуки, одержаної у Приготуванні 1.1 і 8мл трие(трифлуорметил)феніл]піперидин тиламіну у 50мл ДХМ краплями додають 2,07мл 3бромпропіонілхлорид і залишають перемішуватись на 2год., протягом яких температура досягає ЗТ. Реакційну суміш промивають насиченим розчином А) 4-(хлорформіл)-4-[3K2СО3 і водою, органічну фазу сушать над Na2SO4 (трифлуорметил)феніл]піперидин-гідрохлорид. і розчинник випарюють у вакуумі. Залишок хромаСуміш 1г сполуки, одержаної в операціях Притографують на силікагелі з елюентом ДХМ/МеОН готувань 1.9 і 10мл тіонілхлориду у 10мл ДХМ грі(98,5/1,5 to 97/3; об'єм/об'єм). Це дає 4,6г бажаноють при 60°С протягом 2год., потім концентрують у го продукту, який використовують безпосередньо. вакуумі і одержують 1,05г бажаного продукту, який Приготування 2.4 використовують безпосередньо. 2-хлор-1-[4-метокси-4-[3В) 4-(ацетидин-1-іл карбоніл)-1-бензил-4-[3(трифлуорметил)феніл]-1-піперидил]-1-етанон. (трифлуорметил)феніл]піперидин. (llа): R1 - 3-CF3; R2 - Η; R3 - -OCH3; Hal - СІ. Суміш 1,05г сполуки, одержаної у попередній До суміші 1г сполуки, одержаної у приготуванні операції, 0,283г ацетидину і 1,15мл триетиламіну у 1.2, і 1,4мл триетиламіну у 20мл ДХМ домішують 10мл ДХМ залишають перемішуватись при ЗТ на краплями при ЗТ 0,3мл 2-хлорацетилхлориду і ніч. Додають насичений розчин K2СО3 і реакційну залишають перемішуватись при ЗТ 3год., потім суміш екстрагують ДХМ, екстракт сушaть над концентрують у вакуумі, залишок вносять у водний Na2SO4 і розчинник випарюють у вакуумі. Залишок 1N розчин НСІ і екстрагують AcOEt, органічну фазу хроматографують на силікагелі з елюентом промивають розчином NaCI, сушать над Na2SO4 і ДХМ/МеОН (97/3; об'єм/об'єм). Це дає 0,43г бажарозчинник випарюють у вакуумі. Це дає 1,2г бажаного продукту. ного продукту, який використовують безС) 4-(ацетидин-1-ілкарбоніл)-4-[3посередньо. (трифлуорметил)феніл]піперидин. Приготування 2.5 Суміш 0,43г сполуки, одержаної у попередній 2-хлор-1-[4-(диметиламіно)-4-[3операції, 1г 10% паладію на карбоні і 20мл МеОН (трифлуорметил)феніл]-1-піперидил]-1-етанон. гідрогенують при 25°С під атмосферним тиском (llа): R1 - 3-CF3; R2 - Η; R3 - -N(CH3)2; Hal - Cl. протягом ночі. Каталізатор відфільтровують і фіДо охолодженої у льодяній бані суміші 1г спольтрат концентрують у вакуумі. Це дає 0,33г бажалуки, одержаної у Приготуванні 1.3, і 1мл триетиного продукту, який використовують безламіну у 20мл ДХМ краплями додають 0,35мл 2посередньо. хлорацетилхлориду і залишають перемішуватись 2. Приготування сполук формули (II) до досягнення ЗТ, після чого концентрують у вакуПриготування 2.1 умі, залишок екстрагують AcOEt, органічну фазу 2-хлор-1 -[4-[3-(трифлуорметил)феніл]-1промивають насиченим розчином K2СО3, сушать піперидил]-1-етанон. над Na2SO4 і суміш випарюють у вакуумі. Це дає (llа): R1 - 3-CF3; R2 - Η; R3 - Η; Hal - СІ. 1,4г бажаного продукту, який використовують безДо охолодженої у льодяній ванні суміші 2,5г 4посередньо. [3-(трифлуорметил)-фенілпіперидину і 4мл триеПриготування 2.6 тиламіну у 30мл ДХМ, краплями додають 0,85мл 1-(2-хлорацетил)-4-[3-(трифлуорметил)феніл]2-хлорацетилхлориду і залишають перемішува4-піперидинкарбонітрил. тись на 3год., протягом яких температура досягає (lІe): R1 - 3-CF3; R2 - H; Hal - Cl. ЗТ. Суміш концентрують у вакуумі, залишок вноДо суміші 4,8г сполуки, одержаної у Приготусять у водний 1N розчин НСІ і екстрагують AcOEt, ванні 1.4 (вільна основа), і 2,7мл триетиламіну у органічну фазу промивають насиченим розчином 50мл ДХМ домішують краплями при ЗТ 1,5мл 2NaCI, сушать над Na2SO4 і розчинник випарюють у хлорацетилхлориду і залишають перемішуватись вакуумі. Це дає 3,1г бажаного продукту, який викопри ЗТ протягом 1год. Додають 10%-й розчин НСІ і ристовують безпосередньо. реакційну суміш декантують, органічну фазу проПриготування 2.2 мивають 10%-м розчином NaOH, сушать над 2-хлор-1-[4-гідрокси-4-[3Na2SO4 і розчинник випарюють у вакуумі. Це дає (трифлуорметил)феніл]-1-піперидил]-1-етанон. 3,42г бажаного продукту після рекристалізації з (llа): R1 - 3-CF3; R2 - Η; R3 - -OH; Hal - СІ. етеру; т. пл. =120°С. До суміші 5г сполуки, одержаної у Приготуван 33 77526 34 Приготування 2.7 Суміш 1г сполуки, одержаної у Приготуванні Трет-бутил [1-(2-хлорацетил)-4-[31.10, і 0,46мл триетиламіну у 20мл ДХМ охоло(трифлуорметил)феніл]-4-піперидил]метилджують до 0°С, додають 0,27мл 2карбамат. хлорацетилхлориду і суміш залишають перемішу(ІІа): R1 - 3-CF3; R2 - Η; R3 - ватись при 0°С на 30хвил. Додають воду і реакційCH2NHCOOC(CH3)3, Hal - Cl. ну суміш екстрагують ДХМ, органічну фазу сушать До охолодженої у льодяній ванні суміші 4,95г над Na2SO4 і розчинник випарюють у вакуумі. Це сполуки, одержаної у Приготуванні 1.5, і 6,8мл дає 0,9г бажаного продукту. триетиламіну у 50мл ДХМ домішують краплями Приготування 2.12 1,65мл 2-хлорацетилхлориду і залишають перемі2-хлор-1-[4-гідрокси-4-[4шуватись до досягнення ЗТ, потім концентрують у (трифлуорметил)феніл]-1-піперидил)-1-етанон. вакуумі, залишок вносять у насичений розчин (llа): R1 - 4-CF3; R2 - Η; R3 - -OH; Hal - СІ. K2СО3 і екстрагують AcOEt, органічну фазу промиДо охолодженої у льодяній ванні суміші 1,2г вають насиченим розчином K2СО3, буферним розсполуки, одержаної у Приготуванні 1.11, і 1,2мл чином рН=2 і насиченим розчином NaCI, сушать триетиламін у 20мл ДХМ краплями домішують над Na2SO4 і суміш випарюють у вакуумі. Залишок 0,38мл 2-хлорацетилхлорид і залишають переміхроматографують на силікагелі з елюентом шуватись на 1год., протягом якої температура поДХМ/AcOEt (80/20; об'єм/об'єм). Це дає 1,8г бажавертається до ЗТ. Додають воду і реакційну суміш ного продукту, який використовують безекстрагують ДХМ, органічну фазу сушать над посередньо. Na2SO4 і розчинник випарюють у вакуумі. Це дає Приготування 2.8 1,36g бажаного продукту, який використовують 1-(2-хлорацетил)-4-[3-(трифлуорметил)феніл]безпосередньо. 4-піперидинкарбоксамід. Приготування 2.13 (lla): R1 - 3-CF3; R2 - Η; R3 - -CONH2; Hal - Cl. 2-хлор-1-[4-(4-хлорфеніл)-4-пдрокси-1До суміші 0,7г сполуки, одержаної у Приготупіперидил]-1-етанон. ванні 1.5, і 0,37мл триетиламіну у 10мл ДХМ і (llа): R1 - 4-С1; R2 - Η; R3 - -ОН; Hal - Cl. 10мл діоксану при ЗТ домішують краплями 0,21мл Цю сполуку приготовляють, як це описано у 2-хлорацетилхлориду і залишають перемішуваПриготуванні 2.12, з 4-(4-хлорфеніл)-4тись при ЗТ на 2год., потім концентрують у вакуупіперидинолу (комерційного) і 2мі, залишок вносять у воду, осад ізолюють відсмохлорацетилхпориду. ктуванням і сушать. Це дає 0,82г бажаного Приготування 2.14 продукту, т. пл. =195-198°С. 1-(2-хлорацетил)-4-(4-хлорфеніл)-4Приготування 2.9 піперидинкарбонітрил. 2-хлор-1-[4-гідрокси-4-[2(lle):R1 - 4-Cl; R2 - H; Hal - CI. (трифлуорметил)феніл]-1-піперцдил]-1-етанон. Цю сполуку приготовляють, як це описано у (llа): R1 - 2-CF3; R2 - Η; R3 - -OH; Hal - СІ. Приготуванні 2.1, з сполуки, одержаної у ПриготуДо охолодженої у льодяній ванні суміші 1,8г ванні 1.12, і 2-хлорацетилхлориду. сполуки, одержаної у Приготуванні 1.7, і 1мл триеПриготування 2.15 тиламіну у 20мл ДХМ краплями домішують 0,65мл 2-хлор-1-[4-гідрокси-4-(3-метилфеніл)-12-хлорацетилхлориду і залишають перемішувапіперидил]-1-етанон. тись на 1год., протягом якої температура досягає (llа): R1 - 3-СН3; R2 - Η; R3 - -ОН; Hal - СІ. ЗТ. Додають воду і реакційну суміш концентрують Цю сполуку приготовляють, як це описано у у вакуумі для видалення ДХМ і екстрагують Приготуванні 2.1, з сполуки, одержаної у ПриготуAcOEt,. органічну фазу промивають водою і насиванні 1.13, і 2-хпорацетилхлориду. ченим розчином NaCI, сушать над Na2SO4 і розПриготування 2.16 чинник випарюють у вакуумі. Це дає 1,8г бажаного 2-хлор-1-[4-гідрокси-4-(3-метоксифеніл)-1продукту, який використовують безпосередньо. піперидил]-1-етанон. Приготування 2.10 (llа): R1 - 3-ОСН3; R2 - Η; R3 - -ОН; Hal - СІ. 1-(2-хлорацетил)-4-[2-(трифлуорметил)феніл]Цю сполуку приготовляють, як це описано у 4-піперидинкарбонітрил. Приготуванні 2.1, з сполуки, одержаної у Приготу(lle): R1 - 2-CF3; R2 - Η; Hal - СІ. ванні 1.14, і 2-хлорацетилхлориду. До суміш 2,1г сполуки, одержаної у ПриготуПриготування 2.17 ванні 1.8, і 2мл триетиламіну у 20мл ДХМ домішу2-хлор-1-[4-[4-хлор-3-(трифлуорметил)феніл]ють при ЗТ 0,6мл 2-хлорацетилхлориду і залиша4-гідрокси-1-піперидил]-1-етанон. ють перемішуватись на 30хвил., потім (llа): R1 - 3-CF3; R2 - 4-Сl; R3 - -ОН; Hal - СІ. концентрують у вакуумі, залишок вносять у 10%-й Цю сполуку приготовляють, як це описано у розчин НСІ розчин і екстрагують AcOEt, органічну Приготуванні 2.1, з 4-[4-хлор-3фазу промивають водою, насиченим розчином (трифлуорметил)феніл]-4-піперидинолу і 2K2СО3 і насиченим розчином NaCI, сушать над хлорацетилхлориду. Na2SO4 і розчинник випарюють у вакуумі. Це дає Приготування 2.18 2,3 r бажаного продукту. N-(2-хлорацетил)-4-[4-хлор-3Приготування 2.11 (трифлуорметил)феніл]-4-піперидил]-ацетамід. [1-(2-хлорацетил)-4-[3-(трифлуорметил)феніл](llа): R1 - 3-CF3; R2 - 4-Сl; R3 - -NHCOCH3; Hal 4-піперидил]метилацетат. СІ. (llа): R1 - 3-CF3; R2 - Η; R3 - -СН2ОСОСН3; Цю сполуку приготовляють, як це описано у Hal - СІ. Приготуванні 2.2, з сполуки, одержаної у . приготу 35 77526 36 вання 1.15, і 2-хлорацетилхлориду. Приготування 3.3 Приготування 2.19 3-(1-піперазиніл)піридазин-тригідрохлорид. 2-хлор-1-[4-гідрокси-4-[3(трифлуорметокси)феніл]-1-піперидил]-1-етанон. (llа): R1 - 3-OCF3; R2 - Η; R3 - -OH; Hal - СІ. A) Трет-бутил 4-(6-хлор-3-піридазиніл)-1Цю сполуку приготовляють, як це описано у піперазин-карбоксилат. Приготуванні 2.1, з сполуки, одержаної у приготуСуміш 13,52г трет-бутил 1вання 1.16, і 2-хлорацетилхлориду. піперазинкарбоксилату, 10,81г 3,6Приготування 2.20 дихлорпіридазину і 20мл триетиламіну у 100мл nТрет-бутил [[1-(2-хлорацетил)-4-[3бутанолу гріють під зворотним холодильником (трифлуорметил)феніл]-4-піперидил]метил]5год., потім концентрують у вакуумі і залишок хрометилкарбамат. матографують на силікагелі з елюентом (llа): R1 - 3-CF3; R2 - Η; R3 - ДХМ/AcOEt (90/10; об'єм/об'єм). Це дає 14г бажаCH2N(CH3)COOC(CH3)3; Hal - СІ. ного продукту, який використовують безпосередРозчин 14г сполуки, одержаної у Приготуванні ньо. 1.17, і 5,5мл триетиламіну у 300мл ДХМ охолоB) трет-бутил 4-(3-піридазиніл)-1джують до -40°С, повільно додають 3,1мл 2піперазинкарбоксилат. хлорацетилхлориду і суміш залишають перемішуСуміш 10,5г сполуки, одержаної у попередній ватись до досягнення ЗТ, потім концентрують у операції, і 2,5г 10% паладію на карбоні у 30мл вакуумі, залишок вносять у воду і екстрагують ДМФ і 250мл ЕtOН гідрогенують при ЗТ під атмосAcOEt, органічну фазу промивають буфером рН=2 ферним тиском протягом ночі. Каталізатор відфіі водою, сушать над Na2SO4 і розчинник випарюльтровують і фільтрат концентрують у вакуумі. ють у вакуумі. Це дає 15,33г бажаного продукту. Залишок хроматографують на силікагелі з елюенПриготування 2.21 том ДХМ/МеОН (від 97/3 до 90/10; об'єм/об'єм). Це 1-(2-хлорацетил)-4-(3-хлорфеніл)-4дає 9,1г бажаного продукту, який використовують піперидинкарбонітрил. безпосередньо. (lle): R1 - 3-Сl; Н2 - Н; Hal - СІ. C) 3-(1-піперазиніл)піридазинтригідрохлорид. Цю сполуку приготовляють, як це описано у Суміш 3,8г сполуки, одержаної у попередній Приготуванні 2.1, з сполуки, одержаної у Приготуоперації, 50мл 2N розчину НСІ в етері і 20мл Меванні 1.18, і 2-хлорацетилхлориду. ОН залишають перемішуватись при ЗТ на ніч, поПриготування 2.22 тім концентрують у вакуумі, залишок вносять в 1-(2-хлорацетил)-4-(3-метоксифеніл)-4етер і осад ізолюють відсмоктуванням. Це дає 3г піперидинкарбонітрил. бажаного продукту, який використовують безпосе(lle): R1 - 3-ОСН3; R2 - Η; Hal - СІ. редньо. Цю сполуку приготовляють, як це описано у Приготування 3.4 Приготуванні 2.1, з сполуки, одержаної у Приготу3-хлор-6-(1ванні 1.19 і 2-хлорацетилхлориду. піперазиніл)піридазинтригідрохлорид. Приготування 2.23 4-(ацетидин-1-ілкарбоніл)-1-(2-хлорацетил)-4[3-(трифлуорметил)феніл]-піперидин. Суміш 2,96г сполуки, одержаної у Приготуванні 3.3, і 30мл 6N розчину НСІ у МеОН залишають Цю сполуку приготовляють, як це описано у перемішуватись при ЗТ протягом ночі. Реакційну Приготуванні 2.1,з сполуки, одержаної у Приготусуміш концентрують у вакуумі, залишок декілька ванні 1.20, і 2-хлорацетилхлориду. разів вносять у ДХМ, кожного разу випарюючи 3. Приготуванняэ сполук формули (III). розчинник у вакуумі. Це дає 2,6г бажаного продукПриготування 3.1 ту, який використовують безпосередньо. 1-(2-піразиніл)піперазин. Приготування 3.5 4-(1-піперазиніл)піримідиндигідрохлорид. Суміш 3г піперазину, 1,04мл 2-хлорпіразин і 1,85г K2СО3 у 100мл EtOH гріють під зворотним холодильником 48год. Реакційну суміш концентрують у вакуумі, залишок вносять у воду, систему підлужують до рН=10 доданням 10%-го NaOH і екстрагують хлороформом, органічну фазу промивають водою, сушать над Nа2SО4 і розчинник випарюють у вакуумі. Це дає 1,8г бажаного продукту після рекристалізації з гексану. Приготування 3.2 1-(3-піридил)піперазин. Цю сполуку приготовляють, як це описано у Tetrahedron Letters, 1998,39, 617-620. А) Трет-бутил 4-(2-хлор-4-піримідиніл)-1піперазин-карбоксилат. Суміш 9,55г трет-бутил 1піперазинкарбоксилату, 7,64г 2,4дихлорпіримідину і 8,6г NaHCO3 у 50мл ЕtOН гріють під зворотним холодильником 1год., потім концентрують у вакуумі, залишок вносять у воду і екстрагують ДХМ, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/AcOEt (від 90/10 до 60/40; об'єм/об'єм). Дві сполуки розділяють: - менш полярна сполука - трет-бутил 4-(4хлор-2-піримідиніл)-1-піперазинкарбоксилат, оде 37 77526 38 ржано 1,75; дихлорпіридазин. - більш полярна сполука - сполука операції А), Суміш 1,7г сполуки, одержаної у попередній одержано 12,9, яку використовують безпосередоперації, і 20мл фосфорного оксихлориду гріють ньо. при 85°С 4год. Після охолодження до ЗТ реакційну B) Трет-бутил 4-(4-піримідиніл)-1-піперазинсуміш вливають у лід, водну фазу підлужують докарбоксилат-гідрохлорид. данням концентрованого розчину NaOH і екстраСуміш 12,9г сполуки, одержаної у попередній гують ДХМ, органічну фазу сушать над Na2SO4 і операції і 3,2г 10% паладію на карбоні у 300мл розчинник випарюють у вакуумі. Залишок хроматоМеОН і 100мл ДМФ гідрогенують при ЗТ під атмографують на силікагелі з елюентом ДХМ/МеОН сферним тиском 2год. Каталізатор відфільтрову(від 97/3 до 90/10; об'єм/об'єм). Це дає 1,5г бажають і фільтрат концентрують у вакуумі. Це дає 13г ного продукту, який використовують безпосередбажаного продукту, який використовують безпосеньо. редньо. C) 4-(1-піперазиніл)піридазин. C) 4-(1-піперазиніл)піримідин-дигідрохлорид. Суміш 1,3г сполуки, одержаної у попередній Суміш 4г сполуки, одержаної у попередній операції, і 0,13г 10% паладію на карбоні у 20мл операції, 50мл 2N розчину НСІ в етері і 30мл МеМеОН гідрогенують при 30°С під атмосферним ОН залишають перемішуватись при ЗТ на 2год. тиском протягом 3год. Каталізатор відфільтровуОсад ізолюють відсмоктуванням і промивають ють і фільтрат концентрують у вакуумі. Це дає етером. Це дає 3г бажаного продукту, який вико0,85г бажаного продукту, який використовують ристовують безпосередньо. безпосередньо. Приготування 3.6 Приготування 3.8 5-(1-піперазиніл)піримідин-дигідрохлорид. 5-(1-піперазиніл)-3(2Н)-піридазинонгідрохлорид. A) трет-бутил 4-(5-піримідиніл)-1піперазинкарбоксилат. Аргон бульбашками протягом 15хвил. пропускають через суміш 9,3г трет-бутил 1піперазинкарбоксилату, 7,95г 5-бромпіримідину і 6,5г трет-бутоксиду натрію у 250мл толуолу, потім гріють під зворотним холодильником, додають 0,277 ацетату паладію і 1,7мл три-третбутилфосфіну витримують під зворотним холодильником ще 24год. Додають 0,277г ацетату паладію і суміш гріють під зворотним холодильником 8год. Реакційну суміш охолоджують до ЗТ, додають воду, суміш екстрагують AcOEt, органічну фазу фільтрують і сушать над Na2SО4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ, потім ДХМ/AcOEt (50/50; об'єм/об'єм) і нарешті ДХМ/МеОН (95/5; об'єм/об'єм). Це дає 3,95г бажаного продукту після рекристалізації з суміші ДХМ/гексан/ізоетер. B) 5-(1-піперазиніл)піримідин-гідрохлорид. До суміші 3,5г сполуки, одержаної у попередній операції, у 20мл діоксану домішують при ЗТ 50мл 2N розчину НСІ в етері, залишають перемішуватись при ЗТ на 1год. і концентрують у вакуумі. Це дає жовту тверду речовину, яку використовують безпосередньо. Приготування 3.7 4-(1-піперазиніл)піридазин. A) 5-(4-бензил-1-піперазиніл)-4-хлор-3(2Н)піридазинон. Суміш 7г 1-бензилпіперазину, 6,55г 4,5дихлор-3(2Н)-піридазинону і 11г K2СО3 у 150мл ДМФ гріють при 110°С 4год. і потім концентрують у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/МеОН (95/5; об'єм/об'єм). Продукт вносять в ізоетер і перетирають і осад ізолюють відсмоктуванням. Це дає 7г бажаного продукту, який рекристалізують з ізоетеру; т. пл. =173-175°С. B) 5-(4-бензил-1-піперазиніл)-3,4 Суміш 0,8г сполуки, одержаної у Приготуванні 3.8, і 0,3г 10% паладію на карбоні у 30мл МеОН гідрогенують при 30°С під атмосферним тиском протягом 2год. Каталізатор фільтрують і фільтрат концентрують у вакуумі. Це дає 0,38г бажаного продукту, який використовують безпосередньо. Приготування 3.9 4-(1-піперазиніл)-3(2Н)-піридазинонгідрохлорид. A) 4-(4-бензил-1-піперазиніл)-5-хлор-3(2Н)піридазиноні5-(4-бензил-1-піперазиніл)-4-хлор3(2Н)-піридазинон. Суміш 2,77г 1-бензилпіперазину, 1,3г NaHCO3 і 2,6г 4,5-дихлор-3(2Н)-піридазинону у 300мл діоксану гріють при 100°С протягом ночі і потім концентрують у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/МеОН (98/2; об'єм/об'єм). Дві сполуки розділяють: менш полярна сполука - 4-(4-бензил-1піперазиніл)-5-хлор-3(2Н)-піридазинон, одержано 0,8г; більш полярна сполука, 5-(4-бензил-1піперазиніл)-4-хлор-3(2Н)-піридазинон, одержано 1,2г. B) 4-(1-піперазиніл)-3(2Н)-піридазинонгідрохлорид. Суміш 0,75г менш полярної сполуки, одержаної у попередній операції, і 0,2г 10% паладію на карбоні у 20мл МеОН і 10мл ДМФ гідрогенують при 30°С під атмосферним тиском протягом 3год. Каталізатор відфільтровують і фільтрат концентрують у вакуумі. Це дає 0,46г бажаного продукту, який використовують безпосередньо. Приготування 3.10 1-(2-піримідиніл)-1,4-діазепан. 39 77526 40 вакуумі, залишок вносять в етер і кристалічний продукт ізолюють відсмоктуванням. Це дає 1,6г бажаного продукту. До охолодженого у льодяній ванні розчину 3г Приготування 3.13 2-хлорпіримідину у 20мл ЕtOН домішують краплями розчин 13г 1,4-діазепану у 50мл ЕtOН і залишають перемішуватись на холоді протягом 30хвил. і потім при ЗТ ще 24год. Суміш концентрують у вакуумі, залишок вносять у 100мл AcOEt і 100мл насиченого розчину K2СО3, систему декантують, органічну фазу розбавляють доданням 100мл AcOEt, органічну фазу промивають насиченим розчином K2СО3, сушать над Na2SO4 і розчинник випарюють у вакуумі. Це дає бажаний продукт, який використовують безпосередньо. Приготування 3.11. 2-хлор-6-(1-піперазиніл)піразингідрохлорид A) Трет-бутил 4-(6-хлорпіразин-2-іл)-1піперазинкарбоксилат. Суміш 5г трет-бутил 1-піперазинкарбоксилату, 4г 2,6-дихлорпіразину і 9,5мл ДІПЕА у 40мл nбутанолу гріють під зворотним холодильником 3год., потім концентрують у вакуумі, залишок вносять у 100мл ЕЮН і систему залишають перемішуватись протягом ночі. Одержаний кристалічний продукт ізолюють відсмоктуванням. Це дає 4,7г бажаного продукту, т. пл. =108°С. B) 2-хлор-6-(1-піперазиніл)піразинпдрохлорид. Суміш 1,5г сполуки, одержаної у попередній операції, і 100мл 2N розчину гідрохлорного етеру у 10мл МеОН залишають перемішуватись при ЗТ протягом ночі. Осад ізолюють відсмоктуванням і промивають етером. Це дає 1,2г бажаного продукту. Приготування 3.12 4-хлор-2-(1-піперазиніл)піримідин-гідрохлорид. A) Трет-бутил 4-(4-хлорпіримідин-2-іл)-1піперазинкарбоксилат і трет-бутил 4-(2хлорпіримідин-4-іл)-1-піперазинкарбоксилат. Суміш 9,55г трет-бутил 1піперазинкарбоксилату, 7,64г 2,4дихлорпіримідину і 8,6г NaHCO3 у 90мл ЕtOН гріють при 100°С 1год., потім концентрують у вакуумі, залишок вносять у воду і екстрагують ДХМ, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/AcOEt (від 90/10 до 60/40; об'єм/об'єм). Дві сполуки розділяють: менш полярна сполука - трет-бутил 4-(4хлорпіримідин-2-іл)-1-піперазин-карбоксилат, одержано 1,75г; більш полярна сполука - трет-бутил 4-(2хлорпіримідин-4-іл)-1-піперазинкарбоксилат, одержано 12,9г. B) 4-хлор-2-(1-піперазиніл)піримідингідрохлорид. Суміш 1,75г менш полярної сполуки, одержаної у попередній операції, і 100мл 2N розчину гідрохлорного етеру у 10мл МеОН залишають перемішуватись при ЗТ на 18год., потім концентрують у Розчин 14,8г 4,6-дихлорпіримідину у 100мл ацетонітрилу охолоджують до 0-5°С, протягом 30хвил. додають розчин 20г безводного піперазину у 200мл ацетонітрилу і суміш залишають перемішуватись при 0-5°С на 2год., після чого концентрують у вакуумі, залишок вносять у 100мл 2N NaOH і екстрагують етером, органічну фазу сушать над Na2SO4 і розчинник і випарюють у вакуумі. Одержані 15г гідрохлориду є бажаним продуктом. Приклад 1: Сполука №1 Гідрохлорид 2-[4-(2-піразиніл)-1-піперазиніл]-1[4-[3-(трифлуорметил)феніл]-1-піперидил]-1етанону, 2Н2О. Суміш 0,7г сполуки, одержаної у Приготуванні 2.1, 0,39г сполуки, одержаної у Приготуванні 3.1, 0,39г йодиду калію і 0,635г K2СО3 у 30мл ацетонітрилу залишають перемішуватись при ЗТ протягом ночі. Додають воду і реакційну суміш і екстрагують AcOEt, органічну фазу промивають водою і насиченим розчином NaCI, сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/МеОН (97/3; об'єм/об'єм). Одержаний продукт вносять у 2N розчин гідрохлорного етеру і після перетирання осад ізолюють відсмоктуванням. Це дає 0,42г бажаного продукту. Мас-спектр: МН=434,3. Приклад 2: Сполука №2 1-[4-Гідрокси-4-[3-(трифлуорметил)феніл]-1піперидил]-2-[4-[5-трифлуорметил)-2-піридил]-1піперазиніл]-1-етанон-діоксалат. Суміш 0,8г сполуки, одержаної у Приготуванні 2.2, 0,575г 1-[5-(трифлуорметил)-2піридил]піперазину, 0,413г йодиду калію і 0,688г K2СО3 у 20мл ацетонітрилу залишають перемішуватись при ЗТ протягом 2год. Додають насичений розчин K2СО3, суміш екстрагують AcOEt, органічну фазу промивають водою і насиченим розчином NaCI, сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/МеОН (96/4; об'єм/об'єм). Одержаний продукт вносять в етер, додають 0,384г щавлевої кислот, систему перетирають і осад ізолюють відсмоктуванням. Це дає 1,27г бажаного продукту, т. пл. =173°С. Приклад 3: Сполука №3 1-[4-гідрокси-4-[3-(трифлуорметил)феніл]-1піперидил]-3-[4-(2-піразиніл]-1-піперазиніл]-1пропанон 1,5 оксалат, 1,5 Н2О Суміш 0,5г сполуки, одержаної у Приготуванні 41 77526 42 2.3, 0,660г сполуки, одержаної у Приготуванні 3.1, операції, 50мл 2N розчину НСІ в етері і 30мл Ме0,4мл триетиламіну і 0,23г йодиду калію у 10мл ОН залишають перемішуватись при ЗТ протягом ацетонітрилу гріють при 70°С 60год. Додають воду 4год., потім концентрують у вакуумі, залишок вноі реакційну суміш екстрагують AcOEt, органічну сять у воду, водну фазу промивають AcOEt, підфазу промивають насиченим розчином K2СО3, лужують доданням K2СО3, суміш екстрагують водою і насиченим розчином NaCI, сушать над AcOEt, органічну фазу промивають насиченим Na2SO4 і розчинник випарюють у вакуумі. Залишок розчином NaCI, сушать над Na2SO4 і розчинник хроматографують на силікагелі з елюентом випарюють у вакуумі. Продукт після випарювання ДХМ/МеОН (94/6; об'єм/об'єм). 0,77г одержаного кристалізують з AcOEt і кристали ізолюють відсмопродукту вносять в етер, додають 0,28г щавлевої ктуванням. Це дає 1,05г бажаного продукту, т. пл. кислоти і осад ізолюють відсмоктуванням. Це дає =152-153°С. 0,762г бажаного продукту, т. пл. = 113°С. Мас-спектр: МН+=463,3. Приклад 4: Сполука №4 приклад 5: Сполука №5 1-[4-(амінометил)-4-[3-(трифлуорметил)феніл]1-[4-(амінометил)-4-[3-(трифлуорметил)феніл]1-піперидил]-2-[4-(2-піразиніл)-1-піперазиніл-11-піперидил]-2-[4-(2-піримідиніл)-1-піперазиніл]-1етанон етанон-трипдрохлорид. A) 1-[2-[4-(2-піразиніл)-1-піперазиніл]ацетил]-4[3-трифлуорметил)феніл]-4-піперидинкарбонітрил. Суміш 3,42г сполуки, одержаної у Приготуванні 2.6, 1,7г сполуки, одержаної у Приготуванні 3.1, 1,7г йодиду калію і 1,42г K2СО3 у 50мл ацетонітрилу залишають перемішуватись при ЗТ на 18год. Суміш концентрують у вакуумі, залишок вносять у воду і екстрагують AcOEt, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок вносять в абсолютний ЕtOН, утворені кристали ізолюють відсмоктуванням і промивають етером. Це дає 3,5г бажаного продукту, т. пл. =138°С. B) 1-[4-(амінометил)-4-[3(трифлуорметил)феніл]-1-піперидил]-2-[4-(2піразиніл)-1-піперазиніл]-1-етанон. Суміш 3г сполуки, одержаної у попередній операції, 0,3г нікелю Raney®, 20мл 20%-го водного амонію і 200мл МеОН гідрогенують при ЗТ під атмосферним тиском 16год. Каталізатор відфільтровують і фільтрат концентрують у вакуумі. Залишок вносять у воду і екстрагують AcOEt, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Це дає 2,17г бажаного продукту після рекристалізації з AcOEt; т. пл. =155°С. Мас-спектр: МН=463,4. 1 Н ЯМР: ДМСО-d6: δ (1/млн): 1,0-1,2: гл: 2Н; 1,6-2,2: т: 4Н; 2,4-4,0: т: 16Н; 7,4-7,7: т: 4Н; 7,79: d: 1H; 8,06: dd: 1H; 8,29: d: 1H. Сполуку №4 Прикладу 4 можна також одержати двома операціями: А') Трет-бутил [1-[2-[4-(2-піразиніл)-1піперазиніл]ацетил]-4-[3-(трифлуорметил)-феніл]4-піперидил]метилкарбамат. Суміш 2,8г сполуки, одержаної у Приготуванні 2.7, 1,25г сполуки одержаної, у Приготуванні 3.1, 1,1г йодиду калію і 1,8г K2СО3 30мл ацетонітрилу залишають перемішуватись при ЗТ на 3год. Додають насичений розчин K2СО3, суміш екстрагують AcOEt, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/МеОН (97/3: об'єм/об'єм). Це дає 1,75г бажаного продукту. В') 1-[4-(амінометил)-4-[3(трифлуорметил)феніл]-1-піперидил]-2-[4-(2піразиніл)-1-піперазиніл]-1-етанон. Суміш 1,7г сполуки, одержаної у попередній A) 1-[2-[4-(2-піримідиніл)-1піперазиніл]ацетил]-4-[3-(трифлуорметил)феніл]-4піперидин-карбонітрил. Суміш 1,28г сполуки, одержаної у Приготуванні 2.6, 1,1г 2-(1-піперазиніл)піримідину, 1,23г K2СО3 і 0,79г йодиду калію у 30мл ацетонітрилу залишають перемішуватись при ЗТ на 4год., потім концентрують у вакуумі, залишок вносять у воду і екстрагують ДХМ, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі Η з елюентом ДХМ/МеОН (100/1; об'єм/об'єм). Це дає 0,9г бажаного продукту. B) 1-[4-(амінометил)-4-[3(трифлуорметил)феніл]-1-піперидил]-2-[4-(2піримщиніл)-1-піперазиніл]-1-етанонтригідрохлорид. Суміш 0,9г сполуки, одержаної у попередній операції, 0,1г нікелю Raney®, 10мл 20%-го водного амонію і 50мл МеОН гідрогенують при ЗТ під атмосферним тиском протягом 4год. Каталізатор відфільтровують і фільтрат концентрують у вакуумі. Залишок вносять у воду і екстрагують ДХМ, органічну фазу сушать над Na2SО4 і розчинник випарюють у вакуумі. Залишок вносять у 2N розчин НСІ в етері і осад ізолюють відсмоктуванням. Це дає 0,74г бажаного продукту після сушіння у вакуумі; т. пл. =198-202°С. Приклад 6: Сполука №27 2-[4-(4-піримідиніл)-1-піперазиніл]-1-[4-[3(трифлуорметил)феніл]-3,6-дигідро-1(2Н)піридил]-1 -етанондіоксалат. Суміш 0,87г сполуки №11, 5мл 35%-го розчину НСІ і 9мл оцтової кислоти гріють при 110°С 1год. Після охолодження до ЗТ додають 5%-й розчин K2СО3, суміш екстрагують AcOEt, органічну фазу промивають насиченим NaCI, сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/МеОН (95/5; об'єм/об'єм). 0,7г одержаного продукту вносять у МеОН, додають 0,12г щавлевої кислоти, систем залишають для кристалізації і осад ізолюють відсмоктуванням. Це дає 0,502г бажаного 43 77526 44 продукту, т. пл. =160°С. ду, 3,8г триацетоксиборгідриду натрію і 3 краплі Мас-спектр: МН+=432,3. оцтової кислоти у 50мл ТГФ залишають перемішуПриклад 7: Сполука №30 ватись при ЗТ протягом ночі. Реакційну суміш кон1-[4-(амінометил)-4-[2-(трифлуорметил)феніл]центрують у вакуумі, залишок вносять у 100мл 1-піперидил]-2-[4-(2-піразиніл)-1-піперазиніл]води і систему гріють при 80°С 30хвил. Після охоетанон 1,5 оксалат, 0,5 Н2О. лодження ЗТ, реакційну суміш підлужують до рН=9 доданням 10%-го розчину NaOH і екстрагують ДХМ. Органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Це дає 0,55г бажаного A) 1-[2-[4-(2-піразиніл)-1-піперазиніл]ацетил]-4продукту після рекристалізації з етеру; т. пл. [2-(трифлуорметил)феніл]-4-піперидин=118°С. карбонітрил 1,5 оксалат. Мас-спектр: МН=491,4. Суміш 1г сполуки, одержаної у Приготуванні 1 Н ЯМР: ДМСО-dб: δ (1/млн): 1,6-2,3: т: 10 Н; 2.10, 0,496г сполуки одержаної у Приготуванні 3.1, 2,35-2,7: т: 6Н; 2,8-3,3: т: 4Н; 3,4-4,0: т: 6Н; 7,4-8,4: 0,51г йодиду калію і 0,836г K2СО3 у 20мл ацетонітт: 7Н. рилу залишають перемішуватись при ЗТ протягом Приклад 10: Сполука №36 ночі. Суміш концентрують у вакуумі, залишок вно1-[4-(4-хлорфеніл)-3,6-дигідро-1-(2Н)-піридил]сять у воду і екстрагують AcOEt, органічну фазу 2-[4-(2-піразиніл)-1-піперазиніл]-1-етанон. промивають водою і насиченим розчином NaCI, сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/МеОН (97/3; об'єм/об'єм). 0,29г одержаного продукту вносять у МеОН, додають 0,057г щавлевої кислоти і осад ізолюють відсмоктуванням. Це дає 0,081г бажаного продукту, т. пл. =125-126°С. B) 1-[4-(амінометил)-4-[2(трифлуорметил)феніл]-1-піперидил]-2-[4-(2піразиніл)-1-піперазиніл]-1-етанон 1,5 оксалат, 0,5 Н2О. Суміш 0,8г сполуки, одержаної у попередній операції, 0,08г нікелю Raney®, 20мл 20%-го водного амонію і 100мл МеОН гідрогенують при ЗТ під атмосферним тиском 36год. Каталізатор відфільтровують і фільтрат концентрують у вакуумі. Залишок вносять у воду і екстрагують AcOEt, органічну фазу промивають насиченим розчином NaCI, сушать над Na2SO4 і розчинник випарюють у вакуумі. Продукт хроматографують на силікагелі з елюентом ДХМ/МеОН (90/10; об'єм/об'єм). 0,28г одержаного продукту вносять у AcOEt, додають 0,054г щавлевої кислоти і осад ізолюють відсмоктуванням. Це дає 0,26г бажаного продукту. Мас-спектр: МН=463,4. Приклад 8: Сполука №32 1-[4-(гідроксиметил)-4-[3(трифлуорметил)феніл]-1-піперидил]-2-[4-(2піразиніл)-1-піперазиніл-1-етанон. Суміш 0,6г сполуки №31 і 0,14г гранул КОН у 10мл МеОН і 5мл води гріють при 70°С протягом 10хвил. Після охолодження до ЗТ кристалічний продукт ізолюють відсмоктуванням, промивають водою і сушать. Це дає 0,3г бажаного продукту, т. пл. =223°С. Мас-спектр: МН=464,4. Приклад 9: Сполука №33 1-[4-[(диметиламіно)метил]-4-[3(трифлуорметил)феніл]-1-піперидил]-2-[4-(2піразиніл)-1-піперазиніл]-1-етанон. Суміш 0,85г сполуки №4, одержаної у Прикладі 4, 0,28мл 37%-го водного розчину формальдегі Суміш 0,907г сполуки №35 і 0,913г ртолуолсульфонової кислоти у 20мл толуолу гріють при 118°С протягом 24год. Після охолодження до ЗТ, додають 5%-й розчин K2СО3, систему екстрагують AcOEt, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок хроматографують на силікагелі з елюентом ДХМ/МеОН (97/3; об'єм/об'єм). Це дає 0,55г бажаного продукту після рекристалізації з суміші ДХМ/ізоетер; т. пл. =139-141 °С. Приклад 11: Сполука №37 1-[4-(амінометил)-4-(4-хлорфеніл)-1піперидил]-2-[4-(2-піразиніл)-1-піперазиніл-1етанон трифлуорацетат. A) 4-(4-хлорфеніл)-1-[2-[4-(2-піразиніл)-1піперазиніл]ацетил]-4-піперидин-карбонітрил. Суміш 1г сполуки, одержаної у Приготуванні 2.14, 0,56г сполуки, одержаної у Приготуванні 3.1, 0,56г йодиду калію і 0,47г K2СО3 у 20мл ацетонітрилу залишають перемішуватись при ЗТ протягом ночі, потім концентрують у вакуумі, залишок вносять у воду і екстрагують AcOEt, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Це дає 1,51г бажаного продукту, який використовують безпосередньо. B) 1-[4-(амінометил)-4-феніл-1-піперидил]-2-[4(2-піразиніл)-1-піперазиніл]-1-етанонтрифлуорацетат і 1-[4-(амінометил)-4-(4-хлорфеніл)-1піперидил]-2-[4-(2-піразиніл)-1-піперазиніл]-1етанон трифлуорацетат. Суміш 1,51г сполуки, одержаної у попередній операції, і 0,15г родію на алюмінію у 100мл МеОН гідрогенують при ЗТ під атмосферним тиском протягом 36год. Каталізатор відфільтровують і фільтрат концентрують у вакуумі. Залишок хроматографують на силікагелі Η з елюентом ДХМ/МеОН (100/5; об'єм/об'єм) і потім ДХМ/МеОН/Н2О (100/5/0,5; об'єм/об'єм/об'єм). Одержаний продукт вносять як дві сполуки у ЕtOН, додають 2N розчин гідрохлорного етеру і осад ізолюють відсмоктуванням. Осад розчиняють у воді, водну фазу промивають ДХМ, підлужують доданням 10%-го розчину 45 77526 46 NaOH і екстрагують ДХМ, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. Залишок рекристалізують з AcOEt і одержують 0,14г До суміші 1г сполуки №4, 0,16мл ацетону і 5 суміші двох сполук, яка містить 21,6% однією спокрапель оцтової кислоти у 10мл ТГФ домішують луки 75,5% сполуки №37. Сполуки розділяють при ЗТ 0,5г триацетоксиборгідриду натрію і залипрепаративною РХВР Delt Prep 4000 з колонкою шають перемішуватись при ЗТ протягом ночі. ДоPROCHROM з динамічною осьовою компресією, дають 20мл МеОН і суміш гріють при 55°С 1год., діаметром 50мм і з 380г стаціонарної фази концентрують у вакуумі, залишок вносять у 30%-й Kromasil® CIS, стисненої тиском 70бар. Мобільну розчин NaOH і екстрагують ДХМ, органічну фазу фазу елюююють з градієнтом суміші елюента А сушать над Na2SO4 і розчинник випарюють у ваку(Н2O+ТФК 0,1%) і елюента В (ацетонітрил/Н2О умі. Залишок хроматографують на силікагелі з (90%+10%)+ТФК 0,1%) з витратою потоку елюентом ДХМ/МеОН (93/7; об'єм/об'єм). Це дає 122мл/хвил. Ультрафіолетовий аналіз проводять 0,511г бажаного продукту після рекристалізації з на довжині хвилі 254нм. Після розділення 0,122г етеру; т. пл.=140-141°С. суміші продукт одержують: Мас-спектр: МН+=505,3. - 0,037г сполуки, ідентифікованої як 1-[4Приклад 14: Сполука №59 (амінометил)-4-феніл-1-піперидил]-2-[4-(21-[4-[(N-метилiзопропiламiно)метил]-4-[3піразиніл)-1-піперазиніл]-1-етанон(трифлуорметил)фенiл]-1-пiперидил]-2-[4-(2трифлуорацетат: RT=13хвил.; піразиніл)-1-піперазиніл]-1-етанон-ригідрохлорид. Мас-спектр МН=395,4. - 0,15г сполуки №37: RT=15,9хвил; Мас-спектр МН=429,4. До суміші 0,36г сполуки №58, 0,08мл 37% водПриклад 12: Сполука №57 ного розчину формальдегіду і 5 крапель оцтової 1-[4-[(метиламіно)метил]-4-[3кислоти у 10мл ТГФ домішують при ЗТ 0,605г три(трифлуорметил)феніл]-1-піперидил]-2-[4-(2ацетоксиборгідриду натрію і залишають перемішупіразиніл)-1-піперазинілі-1-етанон ватись при ЗТ на 4год. Додають 10мл МеОН і суміш гріють при 60°С 1год., потім концентрують у вакуумі, залишок вносять у 30%-й розчин NaOH і екстрагують ДХМ, екстракт сушать над Na2SO4 і A) Трет-бутилметил [[1-[2-[4-(2-піразиніл)-1розчинник випарюють у вакуумі. Залишок хроматопіперазиніл]ацетил]-4-[3-(трифлуорметил)феніл]-4графують з елюентом ДХМ/МеОН (96/4; піперидил]метил]карбамат. об'єм/об'єм). Одержаний продукт вносять у 2N Суміш 10г сполуки, одержаної у Приготуванні розчин гідрохлорного етеру і осад ізолюють відс2.20, 3,7г сполуки, одержаної у Приготуванні 3.1, моктуванням. Це дає 0,233г бажаного продукту, т. 3,7г йодиду калію і 6,2г K2СО3 у 200мл ацетонітрипл.=185-200°С. лу залишають перемішуватись при ЗТ на 5год., Мас-спектр: МН+=519,3. потім концентрують у вакуумі залишок вносять у Приклад 15: Сполука №65 воду і екстрагують AcOEt, органічну фазу сушать 1-[4-(амінометил)-4-(3-хлорфеніл)-1над Na2SO4 і розчинник випарюють у вакуумі. Запіперидил]-2-[4-(2-піразиніл)-1-піперазиніл]-1лишок хроматографують на силікагелі Η з елюенетанон. том ДХМ і потім ДХМ/МеОН (100/2; об'єм/об'єм). Це дає 10,7г бажаного продукту. B) 1-[4-[(метиламіно)метил]-4-[3(трифлуорметил)феніл]-1-піперидил]-2-[4-(2А) 4-(3-хлорфеніл)-1-[2-[4-(2-піразиніл)-1піразиніл)-1-піперазиніл]-1-етанон. піперазиніл]ацетил]-4-піперидин-карбонітрил. До розчину 8г сполуки, одержаної у попередСуміш 2,3г сполуки, одержаної у Приготуванні ній операції, у 100мл МеОН домішують 300мл 2Ν 2.21, 1,3г сполуки, одержаної у Приготуванні 3.1, розчину гідрохлорного етеру і залишають перемі1,3г йодиду калію і 2,2г K2СО3 у 40мл ацетонітрилу шуватись при ЗТ протягом ночі. Суміш концентрузалишають перемішуватись при ЗТ протягом ночі. ють у вакуумі, залишок вносять у 10%-й розчин Додають воду і реакційну суміш екстрагують NaOH і екстрагують AcOEt, органічну фазу сушать AcOEt, органічну фазу промивають насиченим над Na2SO4 і розчинник випарюють у вакуумі. Зарозчином K2СО3 і водою, сушать над Na2SO4 і розлишок хроматографують на силікагелі Η з елюенчинник випарюють у вакуумі. Залишок хроматогтом ДХМ/МеОН (100/2; об'єм/об'єм) і потім рафують на силікагелі з елюентом ДХМ/МеОН ДХМ/МеОН/вода (100/5/0,5; об'єм/об'єм/об'єм). Це (97/3; об'єм/об'єм). Це дає 2,3г бажаного продукту. дає 4,5г бажаного продукту після рекристалізації з В) 1-[4-(амінометил)-4-(3-хлорфеніл)-1ізоетеру; т. пл.=137-139°С. піперидил]-2-[4-(2-піразиніл)-1-піперазиніп]-1Мас-спектр МН=477,4. 1 етанон Н ЯМР: ДМСО-d6: δ (1/млн): 1,10: s: 1Н; 1,6Суміш 0,62г сполуки, одержаної у попередній 2,3: т: 7Н; 2,4-3,8: т: 16Н; 7,4-7,75: т: 4Н; 7,8:d:1H; операції, і 0,6г нікелю Raney® у 30мл МеОН гідро8,15:dd:1H;8,3:d:1H. генують при 28°С під атмосферним тиском протяПриклад 13: Сполука №58 гом 8год. Каталізатор відфільтровують і фільтрат 1-[4-(Ізопропіламіно)метил]-4-[3концентрують у вакуумі. Залишок хроматографу(трифлуорметил)феніл]-1-піперидил]-2-[4-(2ють на силікагелі з елюентом ДХМ/МеОН (97/3; піразиніл)-1-піперазиніл]-1-етанон об'єм/об'єм). Це дає 0,121г бажаного продукту після рекристалізації з суміші ДХМ/ізоетер суміш; т. 47 пл.=138-139°С. Мас-спектр: МН=429,3. Приклад 16: Сполука №69 1-[4-(амінометил)-4-(3-метоксифеніл)-1піперидил]-2-[4-(2-піразиніл)-1-піперазиніл]-1етанон-діоксалат 77526 48 операції, 0,2г нікелю Raney® і 10мл концентрованого водного розчину амонію у 70мл МеОН гідрогенують при 31°С під атмосферним тиском протягом 30год. Каталізатор відфільтровують і фільтрат випарюють у вакуумі. Залишок вносять у 1N розчин НСІ розчин, водну фазу промивають AcOEt, підлужують доданням 10%-го розчину NaOH, суміш екстрагують ДХМ, органічну фазу сушать над Na2SO4 і розчинник випарюють у вакуумі. 0,2г одеA) 4-(3-метоксифеніл)-1-[2-[4-(2-піразиніл)-1ржаного продукту вносять в етер, додають 0,042г піперазиніл]ацетил]-4-піперидин-карбонітрил. щавлевої кислоти і осад після перетирання ізолюСуміш 1,2г сполуки, одержаної у Приготуванні ють відсмоктуванням. Це дає 0,19г бажаного про2.22, 0,675г сполуки одержаної у Приготуванні 3.1, дукту, т. пл.=120°С. 0,68г йодиду калію і 1,2г K2СО3 у 30мл ацетонітриМас-спектр: МН=425,4. лу залишають перемішуватись при ЗТ на 4год. Наведена нижче таблиця ілюструє хімічні Додають воду, суміш екстрагують ДХМ, органічну структури і фізичні властивості деяких сполук з фазу промивають насиченим розчином K2СО3 і прикладів згідно з винаходом. водою, сушать над Na2SO4 і розчинник випарюютьУ таблиці: у вакуумі. Залишок хроматографують на силікагелі - R3 - подвійний зв'язок, який разом з суміжним з елюентом ДХМ/МеОН (97/3; об'єм/об'єм). Це дає атомом карбону піперидинового кільця, утворює 1,5г бажаного продукту, частину якого рекристаліподвійний зв'язок згідно з Прикладом 6; зують з ізоетеру; т. пл.=108°С. - Me, Et, n-Pr, i-Pr, n-Bu, i-Bu, n-Ре і i-Pe - відB) 1-[4-(амінометил)-4-(3-метоксифеніл)-1повідно, метильна, етильна, n-пропільна, ізопропіпіперидил]-2-[4-(2-піразиніл)-1-піперазиніл]-1льна, n-бутильна, ізобутильна, n-пентильна і ізоетанон діоксалат. пентильна групи. Суміш 1,3г сполуки, одержаної у попередній 49 77526 50 51 77526 52 Прикладу 1 з сполуки, одержаної у Приготуванні 2.12, і відповідної сполуки формули (III). (m) Сполуку приготовляють за процедурою Прикладу 1 з сполуки, одержаної у Приготуванні 2.13, і відповідної сполуки формули (III). (n) Сполуку приготовляють за процедурою Прикладу 1 з сполуки, одержаної у Приготуванні 2.15, і відповідної сполуки формули (III). (о) Сполуку приготовляють за процедурою Прикладу 6 з сполуки №38. (р) Сполуку приготовляють за процедурою Прикладу 1 з сполуки, одержаної у Приготуванні 2.16, і відповідної сполуки формули (III). (q) Сполуку приготовляють за процедурою Прикладу 6 з сполуки №40. (r) Сполуку приготовляють за процедурою Прикладу 1 з сполуки, одержаної у Приготуванні 2.17, і відповідної сполуки формули (III). (s) Сполук приготовляють за процедурою Прикладу 6 з сполуки №42. (t) Сполуку приготовляють за процедурою Прикладу 10 з сполуки №44. (u) Сполуку приготовляють за процедурою Прикладу 10 з сполуки Прикладу 46. (ν) Сполуку приготовляють за процедурою Прикладу 6 з сполук №48. (w) Сполуку приготовляють за процедурою Прикладу 2 з сполуки, одержаної у Приготуванні 2.18, і відповідної сполуки формули (III). (х) Сполуку приготовляють за процедурою Прикладу 1 з сполуки, одержаної у Приготуванні 2.19 і відповідної сполуки формули (III). (у) Сполуку приготовляють за процедурою Прикладу 6 з сполуки №52. (z) Сполуку приготовляють за процедурою (a) Сполуку приготовляють за процедурою операцій А' і потім В' з Прикладу 4 з сполуки, одеПрикладу 1 з сполуки, одержаної у Приготуванні ржаної у Приготуванні 2.7, і відповідної сполуки 2,2, і відповідної сполуки формули (lll). формули (III). (b) Сполуку приготовляють за процедурою (k) Сполук приготовляють за процедурою ПриПрикладу 2 з сполуки, одержаної у Приготуванні кладу 13, з сполуки №4 і відповідного альдегіду. 2,2, і відповідної сполуки формули (III). (l) Сполуку приготовляють за процедурою (c) Сполуку приготовляють за процедурою Прикладу 14. Прикладу 3, з сполуки, одержаної. у Приготуванні (m) Сполуку приготовляють за процедурою 2,3, і відповідної сполуки формули (llІ). Прикладу 1, з сполуки, одержаної у Приготуванні (d) Сполуку приготовляють за процедурою 2.23, і відповідної сполуки формули (III). Прикладу 1 з сполуки, одержаної у Приготуванні Сполуки винаходу були піддані біохімічним до2,4, і відповідної сполуки формули (III). слідженням. (e) Сполуку приготовляють за процедурою Клітинна культура: Прикладу 2 з сполуки, одержаної у Приготуванні Штам SH-SY-5Y (нейробластома людини) був 2,5, і відповідної сполуки формули (III). вирощений у звичайний спосіб у середовищі (f) Сполуку приготовляють за процедурою DMEM (Dulbecco's Modified Eagle's Medium) (Gibco Прикладу 1 з сполуки, одержаної у Приготуванні BRL, France), яке містило PCS (5%) (сироватка 2,8, і відповідної сполуки формули (III). зародка теляти) (Boehringer Mannheim, Germany), (g) Сполуку приготовляють за процедурою піруват натрію (1мМ), анти-PPLO (5мл) (антимікоПрикладу 1, з сполуки, одержаної у Приготуванні плазмічний агент: Tylocine®, приготовлений у нор2,9, і відповідної сполуки формули (III). мальному сольовому розчині, 6000мкг/мл), гента(h) Сполук приготовляють за процедурою Приміцин (0,1мг/мл) і глутамін (4мМ) у колбах для кладу 6 з сполуки №11. культур з колагеновим покриттям (Becton (і) Сполуку приготовляють за процедурою Dickinson, France). Прикладу 6 з сполуки №12. Матковий штам SK-N-BE (нейробластома лю(j) Сполуку приготовляють за процедурою дини) і клон Вер 75, що експресує рецептор 75NTR Прикладу 6 з сполуки №26. людини (SK-N-BE Вер 75), у звичайний спосіб були (k) Сполуку приготовляють за процедурою вирощені у середовищі культур DMEM, яке містиПрикладу 1, з сполуки, одержаної у Приготуванні ло PCS (5%), піруват натрію (1мМ), анти-PPLO 2.11, і відповідної сполуки формули (III). (5мл), гентаміцин (0,1мг/мл) і глутамін (4мМ). (І) Сполуку приготовляють за процедурою 53 Вивчення зв'язування 77526 54 кардіоміопатій, серцевого інфаркту, серцевої нер75NTR достатності, серцевої ішемії, церебрального інфаВивчення зв'язування 123І-ФРН (фактор росту ркту; периферійних нейропатій (діабетичного, транейронів, мічений радіоактивним йодом-125) провматичного або ятрогенного походження); водили на клітинній суспензії двох штамів - SH-SYпошкодження оптичного нерва і сітківки; травми 5Y і SK-N-BE Вер 75 методом, описаним у спинного мозку і черепних травм; атеросклерозу; Weskamp (Neuron, 1991, 6, 649-663). Неспецифічстенозу; рубцювання; облисіння. не зв'язування визначали вимірюванням повного Сполуки винаходу можуть бути також викорисзв'язування після одногодинної попередньої інкутані для лікування різних типів раку, наприклад, бації з клітинами при 37°С у присутності неміченораку легенів, щитовидної залози, підшлункової го ФРН (1мкМ). Специфічне зв'язування обчислюзалози, простати, тонкого кишечнику, прямої кишвали як різницю між виміряним повним ки, грудей, а також для лікування пухлин, метастазв'язуванням і виміряним неспецифічним зв'язузів і лейкемії. ванням. Експерименти на конкуренцію проводили Сполуки винаходу можуть бути також викорисз І25І-ФРН у концентрації 0,3нМ. Концентрації спотані для лікування хронічних нейропатичних і залук винаходу, які забезпечують 50%-не інгібування пальних болів і для лікування автоімунних хвороб, (ІС50) зв'язування 125І-ФРН з рецептором р75, є наприклад, ревматоїдного артриту. низькими і лежать у межах 10-6-10-11М. Сполуку винаходу можна також використовуВимірювання апоптозу: вати для лікування переломів кісток і для лікуванКлітин (штами нейробластоми людини SH-SYня або профілактики кісткових захворювань, на5Y і SK-N-BE Вер 75) на 24год. були розміщені у приклад, остеопорозу. чашках Петрі діаметром 35мм (Biocoat collagen І) Згідно з ще одним аспектом, винахід включає (105 клітин/комірка) у середовищі DMEM, яке місфармацевтичні композиції, які як активний інгредітило 5% PCS. Середовище видаляли, клітини єнт включають сполуку винаходу. Ці фармацевтипромивали PBS (фосфатний буферний розсіл Дючні композиції містять ефективну дозу щонайменбеко) і додавали свіже середовище, яке містило ше однієї сполук винаходу або її фармацевтично 5% PCS або середовище, яке містило ФРН у конприйнятної солі, сольват або гідрату і щонайменцентрації 10нг/мл у присутності або без сполук ше один фармацевтично прийнятий наповнювач. винаходу. Півень апоптозу виміряли через 48год. Зазначені наповнювачі вибирають залежно від після обробки для штаму SH-SY-5Y і через 24год. фармацевтичної форми і бажаного способу введля штаму SK-N-BE Вер 75 кількісним оцінювандення пацієнту серед звичайних наповнювачів, ням гістонів цитоплазми, пов'язаних з фрагментавідомих фахівцям. ми DN (виявлення смерті клітин за допомогою У фармацевтичних композиціях згідно з винаELISA, Boehringer Mannheim, Germany). Рівень ходом для орального, під'язичного, підшкірного, апоптозу репрезентували як кількість олігонуклеовнутрішньом'язового, внутрішньовенного, топічносом/105 клітин ± СВ (стандартне відхилення). Кожго, локального, внутрішньотрахеального, внутрішне значення відповідає середньому від 9 експериньоносового, трансдермального або ректального ментальних значень для 3 незалежних введення активний інгредієнт формули (І), або експериментів. Сполуки формули (І) показали інгійого сіль, сольват або гідрат, якщо необхідно, мобіторну активність відносно апоптозу, викликаного жуть застосовуватись в одиничній формі у суміші з ФРН, з значеннями ІС50 у межах 10-6-10-11М. звичайними фармацевтичними наповнювачами Отже, результатом зв'язування сполук винадля введення тваринам і людям з метою профілаходу з рецептором p75NTR є, з одного боку, на біоктики або лікування зазначених вище розладів або хімічному рівні інгібування димеризації рецептора, хвороб. індукованої нейротрофінами, і, з іншого боку, на Одиничні форми для введення пацієнту вклюклітинному рівні - інгібування проапоптозної дії, чають форми для орального : введення, наприопосередкованої рецептором p75NTR. клад, таблетки, м'які або тверді желатинові капсуТаким чином, сполуки згідно з винаходом моли, порошки, гранули і оральні розчини або жна використати для приготування медикаментів, суспензії, форми для під'язичного, щічного, внутзокрема призначених для профілактики або лікурішньотрахеального, очного або внутрішньоносовання будь-якої патології, пов'язаної з рецептором вого введення, форми для введення інгаляцією, p75NTR. форми для топічного, трансдермального, підшкірОтже, в іншому з аспекті винахід включає меного, внутрішньом'язового, внутрішньовенного дикаменти, що містять сполуку формули (І), або введення, форми для ректального введення і імсіль її приєднання фармацевтично прийнятних плантат. Для топічного застосування сполуки згідкислот, або її сольват або гідрат. но з винаходом можуть використовуватись у виСполуку винаходу можна використовувати для гляді кремів, желе, мазей або лосьйонів. лікування або профілактики різних залежних від Наприклад, одинична форма для введення p75NTR станів у людини або тварини, наприклад, сполуки винаходу у вигляді таблетки може вклюцентральних і периферійних нейродегенеративних чати такі компоненти: хвороб, зокрема, старечого слабоумства, епілепсії, сполука винаходу 50,0мг хвороби Альцгеймера, хвороби Паркінсона, хореї манітол 223,75мг Хантингтона, синдрому Дауна, пріонної хвороби, кроскамелозний натрій 6,0мг амнезії, шизофренії; аміотрофічного латерального кукурудзяний крохмаль 15,0мг склерозу, розсіяного склерозу; серцево-судинних гідроксипропілметил целюлоза 2,25мг станів, наприклад, постішемічної серцевої травми, стеарат магнію 3,0мг 125 І-ФРН з рецептором 55 77526 56 Денна доза активного інгредієнта для оральвизначає лікар, залежно від способу введення, ного введення може становити від 0,01 до 100мг/кг маси і реакції пацієнта. однією або кількома дозами, бажано, від 0,02 до Іншим аспектом винаходу є спосіб лікування 50мг/кг. зазначених вище патологій, який включає введенУ деяких випадках потрібними можуть виявиня пацієнту ефективної дози сполуки винаходу або тись менші або більші дози. Такі дози також вхооднієї з її фармацевтично прийнятних солей або її дять в об'єм винаходу. Згідно з традиційною пракгідратів або сольватів. тикою, належну дозу для кожного пацієнта визна Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted derivatives of 1-piperazineacylpiperidine, a method for the preparation thereof and their use in therapy
Автори англійськоюBono, Francoise, Nisato Dino, Wagnon Jean
Назва патенту російськоюЗамещенные производные 1-пиперазинацилпиперидина, способ их получения и применения в терапии
Автори російськоюБоно Франсуаз, Нисато Дино, Жан
МПК / Мітки
МПК: A61P 9/10, A61P 35/04, A61P 35/02, A61P 19/02, A61P 17/02, A61P 19/00, A61P 35/00, A61P 37/00, A61P 29/00, A61P 17/14, C07D 401/14, A61P 43/00, A61P 9/04, A61K 31/497, A61K 31/506, A61P 27/02, A61P 9/00, A61P 19/10, C07D 401/12, A61P 25/14, A61P 25/28, A61P 25/04, A61P 25/18, A61P 27/00, A61P 25/02, A61P 25/00, A61K 31/496, C07D 417/12, C07D 417/14, A61P 25/08, A61P 3/10, A61P 25/16
Мітки: 1-піперазинацилпіперидину, терапії, застосування, одержання, спосіб, похідні, заміщені
Код посилання
<a href="https://ua.patents.su/28-77526-zamishheni-pokhidni-1-piperazinacilpiperidinu-sposib-kh-oderzhannya-i-zastosuvannya-u-terapi.html" target="_blank" rel="follow" title="База патентів України">Заміщені похідні 1-піперазинацилпіперидину, спосіб їх одержання і застосування у терапії</a>
Попередній патент: Стенд для випробувань вузлів протезів нижніх кінцівок
Наступний патент: Похідні бензойної кислоти як модулятори ppara
Випадковий патент: Спосіб регенерації na - катіонітних фільтрів












