Похідні 4-фенілпіридину, спосіб одержання деяких з них, фармацевтична композиція та спосіб лікування захворювань, індукованих нейрокініном 1
Номер патенту: 71547
Опубліковано: 15.12.2004
Автори: Бранка Квіріко, Годел Террі, Бьос Міхаель, Хоффманн Торстен, Галлей Гвідо, Хункелер Вальтер, Шнідер Патрік, Стадлер Хайнц
Формула / Реферат
1. Сполуки загальної формули
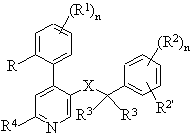 , I
, I
де R - водень, нижчий алкіл, нижча алкоксигрупа, галоген або трифторметил;
R1 - водень або галоген, або
R і R1 разом можуть означати групу -СН=СН-СН=СН-;
R2 і R2' незалежно один від одного означають водень, галоген, трифторметил, нижчу алкокси- або ціаногрупу; або
R2 і R2' разом можуть означати групу -СН=СН-СН=СН-, можливо, заміщену одним або двома замісниками, вибраними з нижчого алкілу або нижчої алкоксигрупи;
кожен R3 - водень, нижчий алкіл або разом утворюють циклоалкільну групу;
R4 - водень, -N(R5)2, -N(R5)(CH2)nOH, -N(R5)S(O)2-нижчий алкіл, -N(R5)S(O)2-феніл, -N=CH-N(R5)2, -N(R5)C(O)R5 або циклічний третинний амін -
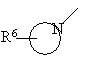
або
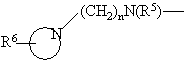 ,
,
R5 незалежно один від одного означає водень, С3-6-циклоалкіл, бензил або нижчий алкіл;
R6 - водень, гідроксигрупа, нижчий алкіл, -(СН2)nСОО-нижчий алкіл, -N(R5)CO-нижчий алкіл, гідрокси-нижчий алкіл, ціаногрупа, -(CH2)nO(CH2)nOH, -CHO або 5- або 6-членна гетероциклічна група, можливо, зв'язана через алкіленову групу,
Х - -C(O)N(R5)-, -(СН2)mO-, -(CH2)mN(R5)-, -N(R5)C(O)- або -N(R5)(CH2)m-;
n = 0-4; і
m = 1 або 2,
а також їх фармацевтично прийнятні солі з кислотами,
які мають антагоністичну активність до нейрокініну 1.
2. Сполука за п. 1, в якій Х означає -C(О)N(R5)-, a R5 - метил, етил або циклопропіл.
3. Сполука за п. 1, яка являє собою
N-(3,5-бістрифторметилбензил)-N-метил-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-4-(2-хлорфеніл)нікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-4-(2-трифторметилфеніл)нікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-4-(2-фторфеніл)нікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-4-(2-метоксифеніл)нікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-4-фенілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-етил-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-циклопропіл-4-о-толілнікотинамід,
N-[1-(3,5-бістрифторметилфеніл)етил]-N-метил-4-о-толілнікотинамід,
N-(3,5-дифторбензил)-N-метил-4-o-тoлiлнiкoтинaмiд,
N-(3,5-дихлорбензил)-N-метил-4-о-тoлiлнiкoтинaмiд,
N-(3,5-бістрифторметилбензил)-N-метил-6-(4-метилпіперазин-1-іл)-4-о-толілнікотинамід,
2'-метил-5-(4-метилпіперазин-1-іл)біфеніл-2-карбонової кислоти(3,5-бістрифторметилбензил)метиламід,
N-(3,5-бістрифторметилбензил)-N-метил-6-(4-метилпіперазин-1-іл)-4-нафтален-1-ілнікотинамід,
(4-{5-[(3,5-бістрифторметилбензил)метилкарбамоїл]-4-о-толілпіридин-2-іл}-піперазин-1-іл)оцтової кислоти етиловий ефір,
5'-[(3,5-бістрифторметилбензил)метилкарбамоїл]-4'-о-толіл-3,4,5,6-тетрагідро-2Н-[1,2']біпіридиніл-4-карбонової кислоти етиловий ефір,
N-(3,5-бістрифторметилбензил)-N-метил-6-(4-пропілпіперазин-1-іл)-4-о-толілнікотинамід,
(RS)-6-[3-(ацетилметиламіно)піролідин-1-іл]-N-(3,5-бістрифторметилбензил)-N-метил-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-6-[метил(2-морфолін-4-ілетил)аміно]-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-6-морфолін-4-іл-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-6-тіоморфолін-4-іл-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-мeтил-6-(1-oкco-![]() -тioмopфoлiн-4-iл)-4-o-тoлiлнікотинамід,
-тioмopфoлiн-4-iл)-4-o-тoлiлнікотинамід,
N-(3,5-бістрифторметилбензил)-6-(1,1-діоксо-![]() -тіоморфолін-4-іл)-N-метил-4-о-толілнікотинамід,
-тіоморфолін-4-іл)-N-метил-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-6-піперазин-1-іл-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-6-[4-(2-гідроксіетил)піперазин-1-іл]-N-метил-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-6-(4-ціанометилпіперазин-1-іл)-N-метил-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-6-{4-[2-(2-гідроксіетоксі)етил]піперазин-1-іл}-N-метил-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-6-(4-[1,2,4]-оксадіазол-3-ілметилпіперазин-1-іл)-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-N-метил-6-[4-(5-оксо-4,5-дигідро-1Н-[1,2,4]-триазол-3-ілметил)піперазин-1-іл]-4-о-толілнікотинамід,
N-(3,5-бістрифторметилбензил)-6-(4-формілпіперазин-1-іл)-N-метил-4-о-толілнікотинамід, і
N-метил-N-(2-метилнафтален-1-ілметил)-6-морфолін-4-іл-4-о-толілнікотинамід.
4. Сполука за п. 1, в якій Х означає –N(R5)C(O)-, a R5 - водень або метил.
5. Сполука за п. 4, яка являє собою
2-(3,5-бістрифторметилфеніл)-N-метил-N-[6-(4-метилпіперазин-1-іл)-4-о-толілпіридин-3-іл]ізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-[4-(2-хлорфеніл)-6-(4-метилпіперазин-1-іл)-піридин-3-іл]-N-метилізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-[4-(4-фтор-2-метилфеніл)-6-(4-метилпіперазин-1-іл)піридин-3-іл]-N-метилізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-[4-(2-хлорфеніл)піридин-3-іл]-N-метилізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-метил-N-(4-о-толілпіридин-3-іл)ізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-(4-о-толілпіридин-3-іл)ізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-метил-N-(4-о-толілпіридин-3-іл)ацетамід,
2-(3,5-бістрифторметилфеніл)-N-метил-N-(4-о-толілпіридин-3-іл)пропіонамід,
2-(3,5-бістрифторметилфеніл)-N-метил-N-(6-морфолін-4-іл-4-о-толілпіридин-3-іл)ізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-[4-(2-хлорфеніл)-6-морфолін-4-ілпіридин-3-іл]-N-метилізобутирамід,
2-(3,5-бicтpифтopмeтилфeнiл)-N-мeтил-N-{6-[мeтил-(2-мopфoлiн-4-iлeтил)аміно]-4-о-толілпіридин-3-іл}-ізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-метил-N-[6-(4-піримідин-2-ілпіперазин-1-іл)-4-о-толілпіридин-3-іл]ізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-(6-морфолін-4-іл-4-о-толілпіридин-3-іл)-ізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-[4-(2-хлорфеніл)-6-диметиламінопіридин-3-іл]ізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-метил-N-(6-піперазин-1-іл-4-о-толілпіридин-3-іл)ізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-(4-гідрокси-4'-о-толіл-3,4,5,6-тетрагідро-2Н-[1,2']біпіридиніл-5'-іл)-N-метилізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-{6-[(2-гідроксіетил)метиламіно]-4-о-толілпіридин-3-іл}-N-метилізобутирамід,
(R)-2-(3,5-бістрифторметилфеніл)-N-[6-(3-гідроксипіролідин-1-іл)-4-о-толілпіридин-3-іл]-N-метилізобутирамід,
2-(3,5-бістрифторметилфеніл)-N-мeтил-N-(6-мopфoлiн-4-iл-4-o-тoлiлпipидин-3-іл)ацетамід і
[2-(3,5-бістрифторметилфеніл)-2-метилпропіл]-[4-(4-фтор-2-метилфеніл)-6-(4-метилпіперазин-1-іл)піридин-3-іл]метиламін.
6. Спосіб одержання сполуки формули І-1, що включає
а) реакцію сполуки формули
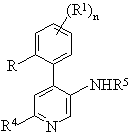 II
II
із сполукою формули
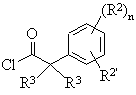 III
III
з утворенням сполуки формули
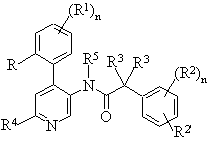 , I-1
, I-1
де R1-R5, R і n мають значення, приведені в п. 1, та якщо бажано, перетворення одержаної сполуки в фармацевтично прийнятну сіль з кислотою.
7. Фармацевтична композиція, яка містить активний інгредієнт і фармацевтично прийнятний наповнювач або носій, яка відрізняється тим, що як активний інгредієнт вона містить сполуку формули І за п. 1 або її фармацевтично прийнятну сіль у фармацевтично ефективній кількості.
8. Фармацевтична композиція за п. 6, яка відрізняється тим, що вона призначена для лікування захворювань, що індуковані нейрокініном 1.
9. Спосіб лікування захворювань, індукованих нейрокініном 1, шляхом введення лікарських засобів, що мають антагонізм до нейрокініну 1, який відрізняється тим, що як лікарський засіб вводять сполуку формули І або її фармацевтично прийнятну сіль в терапевтично ефективній кількості.
Текст
1. Сполуки загальної формули (R 1)n 2 3 71547 4 N-(3,5-бістрифторметилбензил)-N-метил-6-(42-(3,5-бістрифторметилфеніл)-N-[4-(2метилпіперазин-1-іл)-4-о-толілнікотинамід, хлорфеніл)піридин-3-іл]-N-метилізобутирамід, 2'-метил-5-(4-метилпіперазин-1-іл)біфеніл-22-(3,5-бістрифторметилфеніл)-N-метил-N-(4-окарбонової кислоти(3,5толілпіридин-3-іл)ізобутирамід, бістрифторметилбензил)метиламід, 2-(3,5-бістрифторметилфеніл)-N-(4-о-толілпіридинN-(3,5-бістрифторметилбензил)-N-метил-6-(43-іл)ізобутирамід, метилпіперазин-1-іл)-4-нафтален-1-ілнікотинамід, 2-(3,5-бістрифторметилфеніл)-N-метил-N-(4-о(4-{5-[(3,5толілпіридин-3-іл)ацетамід, бістрифторметилбензил)метилкарбамоїл]-4-о2-(3,5-бістрифторметилфеніл)-N-метил-N-(4-отолілпіридин-2-іл}-піперазин-1-іл)оцтової кислоти толілпіридин-3-іл)пропіонамід, етиловий ефір, 2-(3,5-бістрифторметилфеніл)-N-метил-N-(65'-[(3,5-бістрифторметилбензил)метилкарбамоїл]морфолін-4-іл-4-о-толілпіридин-3-іл)ізобутирамід, 4'-о-толіл-3,4,5,6-тетрагідро-2Н-[1,2']біпіридиніл-42-(3,5-бістрифторметилфеніл)-N-[4-(2-хлорфеніл)карбонової кислоти етиловий ефір, 6-морфолін-4-ілпіридин-3-іл]-N-метилізобутирамід, N-(3,5-бістрифторметилбензил)-N-метил-6-(42-(3,5-бicтpифтopмeтилфeнiл)-N-мeтил-N-{6пропілпіперазин-1-іл)-4-о-толілнікотинамід, [мeтил-(2-мopфoлiн-4-iлeтил)аміно]-4-о(RS)-6-[3-(ацетилметиламіно)піролідин-1-іл]-Nтолілпіридин-3-іл}-ізобутирамід, (3,5-бістрифторметилбензил)-N-метил-4-о2-(3,5-бістрифторметилфеніл)-N-метил-N-[6-(4толілнікотинамід, піримідин-2-ілпіперазин-1-іл)-4-о-толілпіридин-3N-(3,5-бістрифторметилбензил)-N-метил-6іл]ізобутирамід, [метил(2-морфолін-4-ілетил)аміно]-4-о2-(3,5-бістрифторметилфеніл)-N-(6-морфолін-4-ілтолілнікотинамід, 4-о-толілпіридин-3-іл)-ізобутирамід, N-(3,5-бістрифторметилбензил)-N-метил-62-(3,5-бістрифторметилфеніл)-N-[4-(2-хлорфеніл)морфолін-4-іл-4-о-толілнікотинамід, 6-диметиламінопіридин-3-іл]ізобутирамід, N-(3,5-бістрифторметилбензил)-N-метил-62-(3,5-бістрифторметилфеніл)-N-метил-N-(6тіоморфолін-4-іл-4-о-толілнікотинамід, піперазин-1-іл-4-о-толілпіридин-3-іл)ізобутирамід, N-(3,5-бістрифторметилбензил)-N-мeтил-6-(1-oкco2-(3,5-бістрифторметилфеніл)-N-(4-гідрокси-4'-отоліл-3,4,5,6-тетрагідро-2Н-[1,2']біпіридиніл-5'-іл)4 -тioмopфoлiн-4-iл)-4-o-тoлiлнікотинамід, 1l N-метилізобутирамід, 2-(3,5-бістрифторметилфеніл)-N-{6-[(2N-(3,5-бістрифторметилбензил)-6-(1,1-діоксо-1l6 гідроксіетил)метиламіно]-4-о-толілпіридин-3-іл}-Nтіоморфолін-4-іл)-N-метил-4-о-толілнікотинамід, метилізобутирамід, N-(3,5-бістрифторметилбензил)-N-метил-6(R)-2-(3,5-бістрифторметилфеніл)-N-[6-(3піперазин-1-іл-4-о-толілнікотинамід, гідроксипіролідин-1-іл)-4-о-толілпіридин-3-іл]-NN-(3,5-бістрифторметилбензил)-6-[4-(2метилізобутирамід, гідроксіетил)піперазин-1-іл]-N-метил-4-о2-(3,5-бістрифторметилфеніл)-N-мeтил-N-(6толілнікотинамід, мopфoлiн-4-iл-4-o-тoлiлпipидин-3-іл)ацетамід і N-(3,5-бістрифторметилбензил)-6-(4[2-(3,5-бістрифторметилфеніл)-2-метилпропіл]-[4ціанометилпіперазин-1-іл)-N-метил-4-о(4-фтор-2-метилфеніл)-6-(4-метилпіперазин-1толілнікотинамід, іл)піридин-3-іл]метиламін. N-(3,5-бістрифторметилбензил)-6-{4-[2-(26. Спосіб одержання сполуки формули І-1, що гідроксіетоксі)етил]піперазин-1-іл}-N-метил-4-овключає толілнікотинамід, а) реакцію сполуки формули N-(3,5-бістрифторметилбензил)-N-метил-6-(4(R1)n [1,2,4]-оксадіазол-3-ілметилпіперазин-1-іл)-4-отолілнікотинамід, N-(3,5-бістрифторметилбензил)-N-метил-6-[4-(5R оксо-4,5-дигідро-1Н-[1,2,4]-триазол-3NHR5 ілметил)піперазин-1-іл]-4-о-толілнікотинамід, N-(3,5-бістрифторметилбензил)-6-(4формілпіперазин-1-іл)-N-метил-4-оR4 N II толілнікотинамід, і із сполукою формули N-метил-N-(2-метилнафтален-1-ілметил)-6(R2)n морфолін-4-іл-4-о-толілнікотинамід. 5 O 4. Сполука за п. 1, в якій Х означає –N(R )C(O)-, a R5 - водень або метил. Cl 2' 5. Сполука за п. 4, яка являє собою R3 R3 R III 2-(3,5-бістрифторметилфеніл)-N-метил-N-[6-(4з утворенням сполуки формули метилпіперазин-1-іл)-4-о-толілпіридин-3(R1 )n іл]ізобутирамід, 2-(3,5-бістрифторметилфеніл)-N-[4-(2-хлорфеніл)6-(4-метилпіперазин-1-іл)-піридин-3-іл]-NR5 R3 R3 R метилізобутирамід, (R2)n N 2-(3,5-бістрифторметилфеніл)-N-[4-(4-фтор-2метилфеніл)-6-(4-метилпіперазин-1-іл)піридин-3O іл]-N-метилізобутирамід, R4 N R2' , I-1 5 71547 6 де R1-R5, R і n мають значення, приведені в п. 1, та 8. Фармацевтична композиція за п. 6, яка відрізякщо бажано, перетворення одержаної сполуки в няється тим, що вона призначена для лікування фармацевтично прийнятну сіль з кислотою. захворювань, що індуковані нейрокініном 1. 7. Фармацевтична композиція, яка містить актив9. Спосіб лікування захворювань, індукованих ний інгредієнт і фармацевтично прийнятний напонейрокініном 1, шляхом введення лікарських засовнювач або носій, яка відрізняється тим, що як бів, що мають антагонізм до нейрокініну 1, який активний інгредієнт вона містить сполуку формули відрізняє ться тим, що як лікарський засіб вводять І за п. 1 або її фармацевтично прийнятну сіль у сполуку формули І або її фармацевтично прийнятфармацевтично ефективній кількості. ну сіль в терапевтично ефективній кількості. Даний винахід відноситься до сполук загальної формули де R - водень, нижчий алкіл, нижча алкоксигрупа, галоген або трифторметил; R1 - водень або галоген, або R і R1 разом можуть являти собою групу СН=СН-СН=СН-; R2 і R2' незалежно один від одного являють собою водень, галоген, трифторметил, нижчу алкокси- або цианогрупу; або R2 і R2' разом можуть являти собою групу СН=СН-СН=СН -, можливо, заміщену одним або двома замісниками, вибраними з нижчого алкіла або нижчої алкоксигрупи; R3 - водень, нижчий алкіл або утворить циклоалкільну гр упу; R4 - водень, -N(R5)2, -N(R5)(CH2)nOH, 5 N(R )S(О)2-нижчий алкіл, -N(R5)S(O)2-феніл, N=CH-N(R5)2, -N(R5)C(O)R5 або циклічний третинний амін групи або групи R5 незалежно один від одного являють собою водень, С3-6-циклоалкіл, бензил або нижчий алкіл; R6 - водень, гідроксигрупа, нижчий алкіл, (СН2)nСОО-нижчий алкіл, -N(R5)CO-нижчий алкіл, гідрокси-нижчий алкіл, цианогрупа, (CH2)nO(CH2)nOH, -CHO або 5- або 6-ланцюгова гетероциклічна група, можливо, зв'язана через алкіленову груп у, X - -C(O)N(R 5)-, -(CH2) mO-, -(CH2)mN(R5)-, 5 N(R )C(O)- або -N(R5)(CH2)m-; n = 0-4 і m = 1 або 2, а також до їх фармацевтично прийнятних солей з кислотами. Сполуку формули І і їх солі відрізняються цінними терапевтичними властивостями. Несподівано було виявлено, що сполуки по даному винаходу є антагоністами рецептора нейрокиніна-1 (NK-1, речовина Р). Речовина Ρ являє собою природний ундекапептид, належний до сімейства пептидів тахикиніна, званих так завдяки їх швидкій контрактильній дії на екстраваскулярну тканину гладких м'язів. Рецептор до речовини Ρ є членом надсімейства G-протеїн-спарених рецепторів. Нейропептидний рецептор до речовини Ρ (ΝΚ1) широко поширений за всією нервовою системою ссавців (особливо в нервових вузлах головного і спинного мозку), кровоносній системі і в периферичних тканинах (особливо в дванадцатипалій і тонкій кишках) і бере участь в регуляції ряду різноманітних біологічних процесів. Центральна і периферична дії тахикинінової речовини Ρ у ссавців прийнято зв'язувати з численними запальними станами, включаючи мігрень, ревматоїдний артрит, астму і запалення внутрішніх органів, а також виклик блювотного рефлексу і модуляцію розладів центральної нервової системи (ЦНС), таких як хвороба Паркинсона (Neurosci. Res., 1996, 7, 187-214), тривожний стан (Can. J. Phys., 1997, 75, 612-621) і депресія (Science, 1998, 281, 1640-1645). У "Tachykinin Receptor and Tachykinin Receptor Antagonists", J. Auton. Pharmacol, 13, 23-93, 1993 розглянуті дані про ефективність антагоністів рецептора тахикиніна при болях, головному болю, особливо мігрені, хворобі Альцгеймера, множинному склерозу, ослабленні виведення морфіна, кардиоваскулярних змінах, набряках, таких як набряк, викликаний термічним опіком, хронічних запальних захворюваннях, таких як ревматоїдний артрит, астма/підвищена бронхіальна реактивність і інші респіраторні захворювання, включаючи алергічний риніт, запальні захворювання кишечнику, включаючи виразковий коліт і хворобу Крона, очні пошкодження і очні запальні захворювання. Крім того, розробляються антагоністи рецептора нейрокиніна-1 для лікування ряду фізіологічних розладів, пов'язаних з лишком або дисбалансом тахикиніна, зокрема, речовини Р. Приклади станів, в яких бере участь речовина Р, включають розлади центральної нервової системи, такі як тривожний стан, депресія і психоз (WO 95/16679 WO 95/18124 і WO 95/23798). Антагоністи рецептора нейрокиніна-1 також корисні для лікування порушень рухової активності і для лікування індукованої блювоти. У доповнення до цього, в The New England Journal of Medicine, Vol. 340, No. 3 190-195, 1999 описане зниження цисплатин-індукованої блювоти за допомогою селективного антагоніста рецептора 7 71547 8 нейрокиніна-1. (2-хлор-феніл)-нікотинамід, Крім того, в US 5,972,938 описаний спосіб ліN-(3,5-біс-трифторметил-бензил)-N-метил-4кування психоімунологічного або психосоматично(2-трифторметил-феніл)-нікотинамід, го розладу шляхом застосування антагоніста реN-(3,5-біс-трифторметил-бензил)-N-метил-4цептора тахикиніна, такого як антагоніст (2-фтор-феніл)-нікотинамід, рецептора NK-1. N-(3,5-біс-трифторметил-бензил)-N-метил-4Об'єктами даного винаходу є сполуки форму(2-метокси-феніл)-нікотинамід, ли І і їх фармацевтично прийнятні солі, отримання N-(3,5-біс-трифторметил-бензил)-N-метил-4вищезазначених сполук, лікарські препарати, що феніл-нікотинамід, містять їх, і їх виробництво, а також використання N-(3,5-біс-трифторметил-бензил)-N-етил-4-овищезазначених сполук в регулюванні або профітоліл-нікотинамід, лактиці хвороб, особливо хвороб і розладів вищеN-(3,5-біс-трифторметил-бензил)-Nописаного типу, або у виробництві відповідних циклопропіл-4-о-толіл-нікотинамід, лікарських препаратів. N-[1-(3,5-біс-трифторметил-феніл)-етил]-NНайбільш переважними свідченнями по данометил-4-о-толіл-нікотинамід, му винаходу є такі, які включають розлади центраN-(3,5-ди-фторбензил-N-метил-4-о-толілльної нервової системи, наприклад, лікування або нікотинамід, профілактика деяких депресивних розладів або N-(3,5-ди-хлорбензил)-N-метил-4-о-толілблювоти шляхом застосування антагоністів рецепнікотинамід, тора NK-1. Найбільш серйозним депресивним виN-(3,5-біс-трифторметил-бензил)-N-метил-6падком вважається щонайменше двотижневий (4-метил-піперазин-1-іл)-4-о-толіл-нікотинамід, період, під час якого більшу частину дня і майже 2'-метил-5-(4-метил-піперазин-1-іл)-бифеніл-2кожний день спостерігається пригнічений настрій карбонової кислоти (3,5-біс-ірифторметил-бензил)або втрата задоволення або інтересу до всього, метил-амід, або майже всіх видів активності. N-(3,5-біс-трифторметил-бензил)-N-метил-6Наступні визначення загальних термінів, що (4-метил-піперазин-1-іл)-4-нафтален-1-ілвикористовуються в даному описі, застосовні ненікотинамід, залежно від того, чи вживаються ці терміни окремо (4-{5-[(3,5-біс-трифторметил-бензил)-метилабо в поєднанні один з одним. Термін "нижчий карбамоїл]-4-о-толіл-піридин-2-іл}-піперазин-1-іл)алкіл" тут означає алкільну групу з прямим або оцтової кислоти етиловий ефір, розгалуженим ланцюгом, який містить 1-7 атомів 5’-[(3,5-біс-трифторметил-бензил)-метилвуглецю, наприклад, метил, етил, пропіл, ізопрокарбамоїл]-4’-о-толіл-3,4,5,6-тетрагідро-2Нпіл, n-бутил, і-бутил, t-бутил і т.п. [1,2']бипіридиніл-4-карбонової кислоти етиловий Переважними нижчими алкільними групами є ефір, групи з 1-4 атомами вуглецю. N-(3,5-біс-трифторметил-бензил)-N-метил-6Термін "нижча алкоксигрупа" означає групу, в (4-пропіл-піперазин-1-іл)-4-о-толіл-нікотинамід, якій алкільні залишки відповідають визначеним (RS)-6-[3-(ацетил-метил-аміно)-піролідин-1-іл]вище і зв'язані через атом кисню. N-(3,5-біс-трифторметил-бензил)-N-метил-4-оТермін "галоген" означає хлор, йод, фтор і толіл-нікотинамід, бром. N-(3,5-біс-трифторметил-бензил)-N-метил-6Термін "циклоалкіл" означає насичену карбо[метил-(2-морфолін-4-іл-етил)-аміно]-4-о-толілциклічну гр упу, вмісну 3-6 атомів вуглецю. нікотинамід, Термін "циклічний третинний амін" означає, N-(3,5-біс-трифторметил-бензил)-N-метил-6наприклад, пірол-1-іл, імідазол-1-іл, піперидин-1морфолін-4-іл-4-о-толіл-нікотинамід, іл, піперазин-1-іл, морфолін-4-іл, тіоморфолін-4-іл, N-(3,5-біс-трифторметил-бензил)-N-метил-61-оксо-тіоморфолін-4-iл або 1,1-диоксотіоморфолін-4-іл-4-о-толіл-нікотинамід, тіоморфолін-4-іл. N-(3,5-біс-трифторметил-бензил)-N-метил-6Термін "5- або 6-ланцюгова гетероциклічна (1-оксо-1l4-тіоморфолін-4-іл)-4-о-толілгрупа" означає, наприклад, піридиніл, піримідиніл, нікотинамід, оксадиазоліл, триазоліл, тетразоліл, тиазоліл, тієN-(3,5-біс-трифторметил-бензил)-6-(1,1ніл, фурил, піранил, пірроліл, імідазоліл, піразоліл, диоксо-1l6-тіоморфолін-4-іл)- N-метил-4-о-толілізотіазоліл, піперазиніл або піпериділ. нікотинамід, Термін "фармацевтично прийнятні солі з кисN-(3,5-біс-трифторметил-бензил)-N-метил-6лотами" включає солі з неорганічними і органічнипіперазин-1-іл-4-о-толіл-нікотинамід, ми кислотами, такими як соляна кислота, азотна N-(3,5-біс-трифторметил-бензил)-6-[4-(2кислота, сірчана кислота, фосфорна кислота, лигідрокси-етил)-піперазин-1-іл]-N-метил-4-о-холілмонна кислота, мурашина кислота, фумарова киснікотинамід, лота, малеїнова кислота, оцтова кислота, сукциN-(3,5-біс-трифторметил-бензил)-6-(4нова кислота, винна кислота, метансульфонова цианометил-піперазин-1-іл)-N-метил-4-о-толілкислота, р-толуолсульфонова кислота і т.п. нікотинамід, Особливо переважними є сполуки, в яких X N-(3,5-біс-трифторметил-бензил)-6-{4-[2-(2являє собою -C(O)N(R5)-, де R5 - метил, eтил або гідрокси-етокси)-етил]-піперазин-1-іл}-N-метил-4-оциклопропіл, наприклад, наступні сполуки: толіл-нікотинамід, N-(3,5-біс-трифторметил-бензил)-N-метил-4-оN-(3,5-біс-трифторметил-бензил)-N-метил-6толіл-нікотинамід, (4-[1,2,4]-оксадиазол-3-ілметил-піперазин-1-іл)-4-оN-(3,5-біс-трифторметил-бензил)-N-метил-4толіл-нікотинамід, 9 71547 10 N-(3,5-біс-трифторметил-бензил)-N-метил-6[4-(5-оксо-4,5-дигідро-1Н-[1,2,4]-триазол-3ілметил)-піперазин-1-іл]-4-о-толіл-нікотинамід, N-(3,5-біс-трифторметил-бензил)-6-(4-формілпіперазин-1-іл)-N-метил-4-о-толіл-нікотинамід,і N-метил-N-(2-метил-нафтален-1-ілметил)-6морфолін-4-іл-4-о-толіл-нікотинамід. Іншими переважними сполуками є такі, в яких із сполукою формули X являє собою -N(R5)-CO-, де R5 - водень або метил. Приклади таких сполук: 2-(3,5-біс-трифторметил-феніл)-N-метил-[6-(4метил-піперазин-1-іл)-4-о-толіл-піридин-3-іл]з утворенням сполуки формули ізобутирамід, 2-(3,5-біс-трифторметил-феніл)-N-[4-(2-хлорфеніл)-6-(4-метил-піперазин-1-іл)-піридин-3-іл]-Nметил-ізобутирамід, 2-(3,5-біс-трифторметил-феніл)-N-[4-(4-фтор2-метил-феніл)-6-(4-метил-піперазин-1-іл)-піридин3-іл]-N-метил-ізобутирамід, 2-(3,5-біс-трифторметил-феніл)-N-[4-(2-хлорде R1-R5, R і n мають значення, приведені вифеніл)-піридин-3-іл]-N-метил-ізобутирамід, ще, 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(4або о-толіл-піридин-3-іл)-ізобутирамід, b) реакцію сполуки формули 2-(3,5-біс-трифторметил-феніл)-N-(4-о-толілпіридин-3-іл)-ізобутирамід, 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(4о-толіл-піридин-3-іл)-ацетамід, 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(4о-толіл-піридин-3-іл)-пропіонамід, 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(6морфолін-4-іл-4-о-толіл-піридин-3-іл)-ізобутирамід, із сполукою формули 2-(3,5-біс-трифторметил-феніл)-N-[4-(2-хлорфеніл)-6-морфолін-4-іл-піридин-3-іл]-N-метилізобутирамід, 2-(3,5-бІс-трифторметил-феніл)-N-метил-N-{6[метил-(2-морфолін-4-іл-етил)-аміно]-4-о-толілпіридин-3-іл}-ізобутирамід, з утворенням сполуки формули 2-(3,5-біс-трифторметил-феніл)-N-метил-N-[6(4-піримідин-2-іл-піперазин-1-іл)-4-о-толіл-піридин3-іл]-ізобутирамід, 2-(3,5-біс-трифторметил-феніл)-N-(6морфолін-4-іл-4-о-толіл-піридин-3-іл)-ізобутирамід, 2-(3,5-біс-трифторметил-феніл)-N-[4-(2-хлорфеніл)-6-диметиламіно-піридин-3-іл]-ізобутирамід, 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(6де R1-R5, R і n мають значення, приведені випіперазин-1-іл-4-о-толіл-піридин-3-іл)-ізобутирамід, ще, або 2-(3,5-біс-трифторметил-феніл)-N-(4-гідроксис) відновлення сполуки формули 4’-о-толіл-3,4,5,6-тетрагідро-2Н-[1,2']бипіридиніл5'-іл)-N-метил-ізобутирамід, 2-(3,5-біс-трифторметил-феніл)-N-{6-[(2гідрокси-етил)-метил-аміно]-4-о-толіл-піридин-3іл}-N-метил-ізобутирамід, (R)-2-(3,5-біс-трифтормегил-феніл)-N-[6-(3гідрокси-піролідин-1-іл)-4-о-толіл-піридин-3-іл]-Nметил-ізобутирамід, 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(6в сполуку формули морфолін-4-іл-4-о-толіл-піридин-3-іл)-ацетамід і [2-(3,5-біс-трифторметил-феніл)-2-метилпропіл]-[4-(4-фтор-2-метил-феніл)-6-(4-метилпіперазин-1-іл)-піридин-3-іл]-метил-амін. Дані сполуки формули І і їх фармацевтично прийнятні солі можуть бути отримані способами, відомими в даній області, наприклад, способами, описаними нижче, які включають: де визначення замісників приведене вище, а) реакцію сполуки формули 11 71547 12 або d) реакцію сполуки формули де визначення замісників приведене вище, із сполукою формули з утворенням сполуки формули де Ζ = СІ, Вr, І або -OS(О) 2С6H4СН3, а визначення інших замісників приведене вище, або e) реакцію сполуки формули із сполукою формули з утворенням сполуки формули де Ζ = СІ, Вr, І або -OS(О) 2С6H4СН3, а визначення інших замісників приведене вище, або f) відновлення сполуки формули в сполуку формули або h) модифікацію одного або більше замісників R1-R6 або R в межах визначення, приведеного вище, і, якщо бажано, перетворення отриманої сполуки в фармацевтично прийнятну сіль з кислотою. Відповідно до варіанту a) DEPEA (Nетилдиізопропіламін) додають до суміші сполуку формули II, наприклад, метил-[6-(4-метилпшеразин-1-іл)-4-о-толіл-піридин-3-іл]-аміна, і сполуку формули III, наприклад, 2-(3,5-бістрифторметил-феніл)-2-метилпропіонілхлорида в дихлорметані, і перемішують суміш при температурах від 35 до 40°С. Бажану сполуку формули 1-1 ізолюють після очищення з хорошим виходом. Варіант b) характеризується реакцією сполуки формули IV із сполукою формули V з утворенням сполуки формули 1-2. Реакція проводиться по звичній методиці, наприклад, в розчиннику, такому як суміш толуола і триетіламіна. Суміш зрошується протягом ~1г. Згідно з варіантом с), сполуку формули 1-2 відновлюють в сполуку формули 1-4. Ця реакція проводиться за допомогою відновного агента, такого як LіАIH4 або BH3·THF, по звичайній методиці. Варіант d) характеризується реакцією сполуки формули VI із сполукою формули VII з утворенням сполуки формули 1-2. Реакція проводиться шляхом депротонизації сполуки формули VI при допомозі KHMDS (калію гексаметилдисилазида) і подальшого додавання сполуки формули VII. Відповідний розчинник - тетрагідрофуран. Реакція проводиться при кімнатній температурі. Згідно з варіантом e), отримують сполуку формули 1-5. Ця реакція проводиться шляхом депротонизації сполуки формули VIII гідридом натрію і подальшого додавання сполуки формули VII. Реакція проводиться по звичайній методиці. Наступний спосіб отримання сполуки формули І описаний у варіанті f). Сполуку формули 1-1 відновлюють в сполуку формули 1-3 по звичайній методиці, наприклад, при допомозі LiAlH 4 або BH3·THF. Солеоутворення здійснюється при кімнатній температурі по відомих методиках, знайомих будьякому фа хівцю в даній області. У розгляд входять не тільки солі з неорганічними кислотами, але також і солі з органічними кислотами, прикладами таких солей є гідрохлориди, гідроброміди, сульфати, нітрат, цитрати, ацетати, малеати, сукцинати, метан-сульфонати, р-толуолсульфонати і т.п. Наступні схеми 1-8 описують реакції отримання сполук формули І більш детально. Початкові речовини формул V, IX, XII, XV, XVI, XXII, XXV, XXVIII, ІХХХ і XXX є відомими сполуками і можуть бути отримані способами, відомими в даній області. У схемах використані наступні позначення: 13 PivCl пивалоїлхлорид THF тетрагідрофуран TMED A N,N,N’,N’-тетраметилетилендиамін DIPEA N-етилдиізопропіламін KHMDS калію гексаметилдисилазид 71547 14 Визначення замісників приведене вище. Визначення замісників приведене вище. Z=CI, Вr, I або OS(О)2С6Н4СН3, а визначення інших замісників приведене вище. 15 71547 16 Визначення замісників приведене вище. Визначення замісників приведене вище. Ζ=СІ , Вr, І або -OS(О)2С6Н4СН3, а визначення інших замісників приведене вище. Ζ=СІ , Вr, І або -OS(О)2С6Н4СН3, а визначення інших замісників приведене вище. Визначення замісників приведене вище. Як згадувалося раніше, сполуки формули І і їх фармацевтично прийнятні солі володіють цінними фармакологічними властивостями. Виявлено, що сполуки по даному винаходу є антагоністами рецептора нейрокиніна-1 (NK-1, речовина Р). Сполуки були досліджені відповідно до тестових методик, приведених нижче. Спорідненість досліджуваних сполук до рецептору ΝΚ1 оцінювали для людських рецепторів ΝΚ1 в клітках СНО (фибробласти з яєчника китайського хом'яка), інфікованих людським рецептором ΝΚ1 (з використанням системи експресії вірусу Semliki) і речовиною Ρ (кінцева концентрація 0,6нМ), міченим тритієм [3Н]. Проби на скріплення виконували в буфері HEPES (50мМ, рН 7,4), вмісному BSA (альбумін бичачої сироватки) (0,04%), лейпептин (8мкг/мл), МnСl4 (3мМ) і фосфорамідон (2мкМ). Проби на скріплення складалися з 250мкл мембранної суспензії (1,25x105кліток/тестову пробірку), 0,125мкл буфера з витісняючого агента і 125мкл [3Н]-речовини Р. Криві витиснення визначали при мінімум семи концентраціях сполуки. Тестові пробірки інкубували протягом 60 хвилин при кімнатній температурі, після чого вміст пробірок швидко фільтрували під вакуумом через фільтри GF/C (скловолоконно-вуглецеві), що заздалегідь просочилися протягом 60 хвилин РЕІ (поліетилениміном) (0,3%), з двома промивками по 2мл буфера HEPES (50мМ, рН 7,4). Залишкову радіоактивність фільтрів вимірювали сцинтиляційним лічильником. Всі проби виконували в трьох примірниках як мінімум в дво х окремих дослідах. Спорідненість до рецептора NK-1, приведена як рKі, знаходиться в межах 8,00-9,80 для переважних сполук. Приклади таких сполук включають: 17 71547 18 N-(3,5-біс-трифторметил-бензил)-N-метил-4-(2-хлор-феніл)-нікотинамід 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(4-о-толіл-піридин-3-іл)-ізобутирамід 2-(3,5-біс-трифторметил-феніл)-N-метил-N-{6-[метил-(2-морфолін-4-іл-етил)-аміно]-4-о-толілпІридин-3-іл}-ізобутирамід 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(6-піперазин-1-іл-4-о-толіл-піридин-3-іл)-ізобутирамід N-(3,5-біс-трифторметил-бензил)-N-метил-6-[4-(5-оксо-4,5-дигідро-1H-[1,2,4]-триазол-3-ілметил)піперазин-1-іл]-4-о-толіл-нікотинамід Сполуку формули І, а також їх фармацевтично прийнятні солі з кислотами можуть використовуватися як ліки, наприклад, в формі фармацевтичних препаратів, фармацевтичні препарати можуть застосовуватися оральним шляхом, наприклад, в формі таблеток, таблеток з оболонкою, драже, твердих і м'яких желатинових капсул, розчинів, емульсій або суспензій. Однак застосування може також здійснюватися ректальним шляхом, наприклад, в формі супозиториїв, або парентеральним шляхом, наприклад, в формі розчинів для ін'єкцій. Сполуку формули І їх фармацевтично прийнятні солі з кислотами можуть зазнавати відповідної обробки з фармацевтично інертними неорганічними або органічними наповнювачами для виробництва таблеток, таблеток з оболонкою, драже і твердих желатинових капсул. Як такі наповнювачі, наприклад, для таблеток, драже і твердих желатинових капсул можуть використовуватися лактоза, кукурудзяний крохмаль або йoго похідні, тальк, стеаринова кислота або її солі і т.д. Відповідні наповнювачі для м'яких желатинових капсул включають, наприклад, рослинні масла, віск, жири, полутверді і рідкі поліоли і т.д. Відповідні наповнювачі для виробництва розчинів і сиропів включають, наприклад, воду, поліоли, сахарозу, інвертний цукор, глюкозу і т.д. Відповідні наповнювачі для виробництва розчинів для ін'єкцій включають, наприклад, воду, спирти, поліоли, гліцерин, рослинні масла і т.д. Відповідні наповнювачі для супозиториїв включають, наприклад, природні або стверджені масла, віск, жири, полутверді або рідкі поліоли і т.д. Крім того, фармацевтичні препарати можуть містити консерванти, солюбілізатори, стабілізатори, що зволожують агенти, емульгатори, підслащувачі, барвники, ароматизатори, солі для зміни осмотичного тиску, буфери, що маскують агенти або антиоксиданти. Крім того, вони можуть містити ще і інші терапевтичні цінні речовини. Дозування можуть мінятися в широких межах і, безумовно, повинні встановлюватися відповідно до індивідуальних вимог в кожному конкретному випадку. Загалом, при оральному вживанні призначається денна доза сполуки загальної формули І приблизно від 10 до 1000мг/чол., хоч вер хня межа при необхідності може перевищува тися. Наступні приклади ілюструють даний винахід, але не обмежують його. Всі значення температури приводяться в градусах Цельсия. Приклад 1 N-(3,5-біс-трифторметил-бензил)-N-метил-4-отоліл-нікотинамід а) метил-4-о-толіл-нікотиноат Суміш 1,2г (6,9ммоль) метил-4хлорнікотиноата, 20мл диметоксиетана, 6,4мл 2N 8,20 8,47 8,70 9,0 9,54 розчину карбонату натрію, 0,4г (0,34ммоль) тетракис(трифенілфосфін)паладію (0) і 1,4г (10,3ммоль) о-толілборної кислоти нагрівали в атмосфері аргону при 80°С протягом 18 годин. Після охолоджування до кімнатної температури водну фазу відділили і двічі промили етилацетатом. Об'єднані органічні шари промили 50мл сольовим розчином, висушили (сульфатом натрію), випарили і висушили під вакуумом. Необроблене масло піддали колонковій хроматографії з отриманням виходу 1,5г (97%) вказаної сполуки у вигляді масла, що кристалізується під час зберігання при 0°С. MS (мас-спектрометрія) m/e (%): 227 (М+, 15). b) 4-о-толіл-нікотинова кислота Розчин 1,13г (5,0ммоль) метил-4-о-толілнікотиноата в 15мл етанола і 12мл 2N розчину гідроксида натрію нагрівали до зрошування протягом 1г. Відрегулювали рН до 5 і суміш двічі екстрагували етилацетатом. Об'єднані органічні шари висушили (сульфатом натрію) і випарили з отриманням 1г (94%) вказаної сполуки у вигляді брудно-білих кристалів. Т. пл. 201-202°С. с) N-(3,5-біс-трифторметил-бензил)-N-метил4-о-толіл-нікотинамід Розчин 1г (4,6ммоль) 4-о-толіл-нікотинової кислоти в 10мл дихлорметана і 2 краплини N,Nдиметилформаміда перемішували з 1мл (14ммоль) тіонілхлорида протягом 2 годин при кімнатній температурі. Розчинник видалили, а залишок розчинили в 10мл толуола і 2мл триетіламіна. Після додавання 1,3г (5,1ммоль) 3,5-бістрифторбензил-метиламіна суміш зрошували протягом години, двічі екстрагували етилацетатом і промили бікарбонатом натрію. Змішані органічні шари висушили (сульфатом натрію) і випарили. Необроблене масло піддали колонковій хроматографії і отримали вихід 1,4г (67%) вказаної сполуки у вигляді масла. MS m/e (%): 452 (М+, 5). Приклад 2 N-(3,5-біс-трифторметил-бензил)-N-метил-4(2-хлор-феніл)-нікотинамід Вказану сполуку отримали у вигляді масла, з порівнянними виходами речовин, по методиці, описаній вище для прикладу 1, з використанням охлорфенілборної кислоти замість о-толілборної кислоти на етапі а). MS m/e (%): 471 (Μ+, 3). Приклад 3 N-(3,5-біс-трифторметил-бензил)-N-метил-4(2-трифторіиетил-феніл)-нікотинамід Вказану сполуку отримали у вигляді масла, з порівнянними виходами речовин, по методиці, описаній вище для прикладу 1, з використанням отрифторметилфенілборної кислоти замість отолілборної кислоти на етапі а). 19 71547 20 MS m/e (%): 506 (М+, 15). парили до сухого стану, отримавши 100мг (41%) Приклад 4 вказаної сполуки у вигляді білих кристалів. Т. пл. N-(3,5-біс-трифторметил-бензил)-N-метил-4174-178°С. (2-фтор-феніл)-нікотинамід MS m/e (%): 479 (M+, 100). Вказану сполуку отримали у вигляді масла, з Приклад 9 порівнянними виходами речовин, по методиці, N-[1-(3,5-біс-трифторметил-феніл)-етил]-Nописаній вище для прикладу 1, з використанням ометил-4-о-толіл-нікотинамід фтор фенілборної кислоти замість о-толілборної Вказану сполуку отримали у вигляді масла, з кислоти на етапі а). порівнянними виходами речовин, по методиці, MS m/e (%): 456 (М+, 30). описаній вище для прикладу 1, з використанням 2Приклад 5 (3,5-біс-трифторфеніл)-етил-метиламіна замість N-(3,5-біс-трифторметил-бензил)-N-метил-43,5-біс-трифторбензил-метиламіна на етапі с). (2-метокси-феніл)-нікотинамід MS m/e (%): 467 (М+Н+, 100). Вказану сполуку отримали у вигляді масла, з Приклад 10 порівнянними виходами речовин, по методиці, N-(3,5-ди-фторбензил)-N-метил-4-о-толілописаній вище для прикладу 1, з використанням онікотинамід метоксифенілборної кислоти замість о-толілборної Вказану сполуку отримали у вигляді твердої кислоти на етапі а). речовини, з порівнянними виходами речовин, по MS m/e (%): 469 (М+Н+, 100). методиці, описаній вище для прикладу 1, з викоПриклад 6 ристанням 3,5-дифторбензил-метиламіна замість N-(3,5-біс-трифторметил-бензил)-N-метил-43,5-біс-трифторбензил-метиламіна на етапі с). феніл-нікотинамід MS m/e (%): 353 (М+Н+, 100). Вказану сполуку отримали у вигляді масла, з Приклад 11 порівнянними виходами речовин, по методиці, N-(3,5-ди-хлорбензил)-N-метил-4-о-толілописаній вище для прикладу 1, з використанням нікотинамід фенілборної кислоти замість о-толілборної кислоВказану сполуку отримали у вигляді масла, з ти на етапі а). порівнянними виходами речовин, по методиці, MS m/e (%): 438 (М+, 60). описаній вище для прикладу 1, з використанням Приклад 7 3,5-дихлорбензил-метиламіна замість 3,5-бісN-(3,5-біс-трифторметил-бензил)-N-етил-4-отрифторбензил-метиламіна на етапі с). толіл-нікотинамід MS m/e (%): 385 (М+Н+, 100), 387 (М+Н+, 70). Вказану сполуку отримали у вигляді масла, з Приклад 12 порівнянними виходами речовин, по методиці, N-(3,5-біс-трифторметил-бензил)-N-метил-6описаній вище для прикладу 1, з використанням (4-метил-піперазин-1-іл)-4-о-толіл-нікотинаміда 3,5-біс-трифторбензил-етіламіна замість 3,5-бісгідрохлорид (1:2) трифторбензил-метиламіна на етапі с). а) 6-хлор-Nметил-нікотинамід MS m/e (%): 465 (М-Н-, 3). До 50г (317ммоль) 2-хлорнікотинової кислоти Приклад 8 додали 230мл (3,16моль) тіонілхлорида при 0°С. N-(3,5-біс-трифторметил-бензил)-NПісля нагрівання суміші при зрошуванні протягом 2 циклопропіл-4-о-толіл-нікотинаміда гідрохлорид годин надмірний тіонілхлорид видалили шляхом (1:0,8) дистиляції. Маслянистий коричневий залишок роза) N-(3,5-біс-трифторметил-бензил)-Nчинили в 250мл дихлорметана. Розчин обробляли циклопропіл-4-о-толіл-нікотинамід газоподібним метиламіном при 0°С до припинення Розчин 106мг (0,5ммоль) 4-о-толіл-нікотинової ознак екзотермічної реакції. Результуючу суспенкислоти в 5мл дихлорметана і 2 краплини N,Nзію розбавили 1000мл дихлорметана/води. Шари диметилформаміда перемішували з 0,1мл розділили, і водний шар екстрагували трьома пор(1,4ммоль) тіонілхлорида протягом 1,5 годин при ціями по 300мл дихлорметана. Після сушки оргакімнатній температурі. Розчинник видалили, а занічного шару сульфатом натрію і концентрування лишок розчинили в 5мл дихлорметана і 0,3мл триотримали 53,2г (98%) вказаної сполуки у вигляді етіламіна. Після додавання 155мг (0,55ммоль) яскраво-жовтої твердої речовини. (3,5-біс-трифторметил-бензил)-циклопропіл-аміна MS m/e (%): 171 (М+Н+, 15). суміш перемішували при кімнатній температурі b) N-метил-6-(4-метил-піперазин-1-іл)протягом 1 години і двічі промили водою. Органічнікотинамід ний шар висушили (сульфатом магнію) і випарили. Суміш 52,0г (30,5ммоль) 6-хлор-N-метилНеоброблене масло піддали колонковій хроматогнікотинаміда і 176мл (1,58моль) 1рафії і отримали вихід 140мг (58%) вказаної спометилпіперазина нагрівали при 100°С протягом 1,5 луки у вигляді масла. години в автоклаві. Після охолоджування до кімMS m/e (%): 479 (М+, 100). натної температури надлишок 1-метилпіперазина b) N-(3,5-біс-трифторметил-бензил)-Nвидалили шляхом дистиляції. Залишок розділили циклопропіл-4-о-толіл-нікотинаміда гідрохлорид в 1000мл дихлорметана/1N водного розчину гідро(1:0,8) ксиду натрію. Шари відділили, і водний шар екстДо розчину 140мг N-(3,5-біс-трифторметилрагували трьома порціями по 500мл дихлорметабензил)-N-циклопропіл-4-о-толіл-нікотинаміда в на. Після концентрування і короткої колонкової 1мл диетилового ефіра додали 3 краплини 3N хроматографії отримали 72,3г (97%) вказаної спорозчину соляної кислоти в метанолі. Після перелуки у вигляді світло-коричневої твердої речовини. мішування протягом 15 хвилин при 0°С суміш виMS m/e (%): 235 (М+Н+, 100). 21 71547 22 c) 4-йод-N-метил-6-(4-метил-піперазин-1-іл)Вказану сполуку отримували аналогічно речонікотинамід вині з прикладу 12 з використанням 2До розчину 936мг (3,99ммоль) N-метил-6-(4хлорфенілборної кислоти замість о-толілборної метил-піперазин-1-іл)-нікотинаміда і 2,46мл кислоти на етапі d). (16,4ммоль) N,N,N’,N’-тетраметилетилендиаміна в MS m/e (%): 571 (М+Н+, 100). 20мл безводного тетрагідрофурана по краплинах Приклад 14 додали 10мл (16ммоль) 1,6Μ розчину п-бутиллітія 2-(3,5-біс-трифторметил-феніл)-N-метил-N-[6в гексані при -78°С. Через 0,5г. суміш нагріли до (4-метил-піперазин-1-іл)-4-о-толЇл-піридин-3-іл]35°С. Перемішування продовжували Протягом 3г. ізобутираміда гідрохлорид (1:2) при цій температурі. Після охолоджування до а) 1-метил-4-(5-нітро-піридин-2-іл)-піперазин 78°С додали розчин 1,52г (6,00ммоль) йоду в До розчину 20г (126ммоль) 2-хлор-5-нітро2,5мл тетрагідрофурана. Реакційну суміш залишипіридина в 200мл тетрагідрофурана по краплинах ли нагріватися до кімнатної температури протягом додали 35мл (315ммоль) 1-метилпіперазина за 10 ночі. Реакційну суміш погасили 30мл 20%-го родхвилин. Реакційну суміш зрошували ще 1,5г. Після ного розчину гідросульфіта натрію при 0°С. Після охолоджування до кімнатної температури видалиекстракції трьома порціями по 30мл етилацеггата, ли розчинник під вакуумом, а залишок перерозчисушки сульфатом натрію і концентрування отринили в 200мл етилацетата. Органічну фазу промали 1,2г коричневого масла. Колонкова хроматомили 200мл 1N розчину бікарбонату натрію, графія дала вихід 618мг (43%) вказаної сполуки. висушили (сульфа том магнію) і випарили, отримаMS m/e (%): 360 (М+, 15). вши 27,9г (розрахунково) вказаної сполуки у виd) N-метил-6-(4-метил-піперазин-1-іл)-4-огляді жовтої твердої речовини. толіл-нікотинамід MS m/e (%): 223 (М+Н+, 100). Суспензію 4,00г (11,1ммоль) 4-йод-N-метил-6b) 2,2-диметил-N-[6-(4-метил-піперазин-1-іл)(4-метил-піперазин-1-іл)-нікотинаміда і 642мг піридин-3-іл]-пропіонамід (0,555ммоль) тетракис(трифенілфосфін)паладія До розчину 27,9г (125,5ммоль) 1-метил-4-(5(0) в 60мл толуола диоксигенували потоком аргону нітро-піридин-2-іл)-піперазина в 400мл метанола протягом 30хв. Після додавання 11мл 2N водного додали 2,6г 10% паладію на активованому вугіллі. розчину карбонату натрію і 1,66г (12,2ммоль) оРеакційну суміш гідрогенізували (при температурі толілборної кислоти суміш нагрівали при зрошувід кімнатної до ~45°С, 1бар) до поглинання теованні протягом ночі. Після охолоджування до кімретичної кількості водню (біля 2 годин). Каталізанатної температури суміш розбавили водою і екстор відфільтровувати і промили двома порціями трагували трьома порціями по 50мл етилацетата. по 100мл метанола. Фільтрат випарили під вакууВодний шар піддали насиченню хлоридом натрію і мом, отримавши 28г пурпурного масла, яке, відпоекстрагували трьома порціями по 50мл дихлормевідно до результатів тонкошарової хроматографії, тана. Об'єднані органічні шари висушили сульфамістило біля 90% бажаного похідного аніліну. том натрію і концентрували. Колонкова хроматогЦей сирий продукт розчинили в суміші 400мл рафія дала вихід 2,26мг (63%) вказаної сполуки. тетрагідрофурана і 100мл диетилового ефіра. ПісMS m/e (%): 324 (М+, 5). ля охолоджування до 0°С додали однією порцією е) N-(3,5-біс-трифторметил-бензид)-N-метил30мл (215ммоль) триетіламіна. Продовжували 6-(4-метил-піперазин-1-іл)-4-о-тоділ-нікотинаміда перемішування, одночасно додавши по краплинах гідрохлорид (1:2) 26г (215ммоль) пивалоїлхлорида за 10 хвилин. До розчину 750мг (2,32ммоль) N-метил-6-(4Крижану баню видалили і перемішували реакційну метил-піперазин-1-іл)-4-о-толіл-нікотинаміда в суміш протягом 1г. при кімнатній температурі. По16мл тетрагідрофурана додали при кімнатній темтім видалили розчинник під вакуумом, а залишок пературі 3мл 1Μ розчину (3ммоль) гексаметилдисуспендували в 200мл 1N розчину бікарбонату силазида калію в теграгідрофурані. Через 1 годину натрію. Продукт екстрагували трьома порціями по до результуючої суспензії по краплинах додали 200мл дихлорметана, висушили (суль фатом на0,43мл (2,3ммоль) 3,5-біс-(трифторметил)-бензилтрію) і очистили шляхом миттєвої хроматографії броміду. Реакцію погасили водою через 1 годину і (flash chromatography) з отриманням 30г (86%) екстрагували суміш трьома порціями по 20 мл вказаної сполуки у вигляді рожевих кристалів. етилацетата. Об'єднані органічні екстракти промиMS m/e (%): 227 (М+Н+, 100). ли насиченим водним розчином хлориду натрію, c) N-[4-йод-6-(4-метил-піперазин-1-іл)-піридинвисушили сульфа том натрію і концентрували. Ко3-іл]-2,2-диметил-пропіонамід лонкова хроматографія дала вихід 950мг (74%) NРозчин 30г (108ммоль) 2,2-диметил-N-6-(4(3,5-6ic-трифторметил-бензил)-N-метил-6-(4метил-піперазин-1-іл)-піридин-3-іл]-пропіонаміда і метил-піперазин-1-іл)-4-о-толіл-нікотинаміда. Білу 58мл (380ммоль) N,N,N’,N’піну розчинили в малій кількості диетилового ефітетраметилетилендиаміна в атмосфері аргону в ру і обробили 2мл 3N розчину соляної кислоти в 650мл тетрагідрофурана охолодили в бані з сухого диетиловому ефірі. Після концентрування отримальоду до -78°С. За 1 годину додали по краплинах ли 1,02г (74%) вказаної сполуки у вигляді білої 239мл (380ммоль) 1,6N розчину n-бутиллітія в гектвердої речовини. сані. Реакційну суміш залишили нагріватися до MS m/e (%): 551 (М+Н+, 100). 30°С протягом ночі. Після охолоджування знов до Приклад 13 -78°С за 15 хвилин додали по краплинах 43,6г N-(3,5-біс-трифторметил-бензил)-4-(2-хлор(170ммоль) йоду, розчиненого в 60мл тетрагідрофеніл)-N-метил-6-(4-метил-піперазин-1-іл)фурана. Баню з сухого льоду замінили крижаною нікотинаміда гідрохлорид (1:2) банею і, коли температура реакційної суміші дося 23 71547 24 гла 0°С, за 10 хвилин додали розчин 90г g) 2-(3,5-біс-трифторметил-феніл)-N-метил-N(363ммоль) натрію тіосульфата пентагідрата в [6-(4-метил-піперазин-1-іл)-4-о-толіл-піридин-3-іл]250мл води. Потім додали 1000мл диетилового ізобутирамід ефіру і відділили органічний шар. Водний шар ексРозчин 20г (67,5ммоль) метил-[6-(4-метилтрагували двома порціями по 500мл дихлорметапіперазин-1-іл)-4-о-толіл-піридин-3-іл]-аміна і на; об'єднані органічні шари висушили (сульфатом 17,5мл (101ммоль) N-етилдиізопропіламіна в магнію) і випарили. Внаслідок миттєвої хроматог200мл дихлорметана охолодили в крижаній бані і рафії отримали 18,5г (42%) вказаної сполуки у по краплинах додали розчин 24 г (75 ммоль) 2вигляді світло-коричневого масла, яке крістализу(3,5-біс-трифторметил-феніл)2-метилється під час зберігання при кімнатній температурі. пропіонілхлорида в 50 мл дихлорметана. РеакційMS m/e (%): 403 (М+Н+, 100). ну суміш нагрівали до 35-40°С протягом 3г., знов d) 2,2-диметил-N-[6-(4-метил-піперазин-1-іл)-4охолодили до кімнатної температури і перемісили о-толіл-піридин-3-іл]-пропіонамід з 250мл насиченого розчину бікарбонату натрію. Суміш 54г (134ммоль) N-[4-йод-6-(4-метилОрганічний шар відділили, а водну фазу екстрагупіперазин-1-іл)-піридин-3-іл]-2,2-диметилвали дихлорметаном. Об'єднані органічні шари пропіонаміда, 420мл толуола, 150мл 2N розчину висушили (сульфатом магнію) і випарили. Заликарбонату натрію, 4,63г (3,9ммоль) тетрашок очистили шляхом миттєвої хроматографії з кис(трифенілфосфін)паладію (0) і 20,16г отриманням 31,6г (81%) вказаної сполуки у вигляді (147ммоль) о-толілборної кислоти нагрівали в атбілих кристалів. Т. пл. 155-157°С. мосфері аргону при 80°С протягом 12г. Після охоMS m/e (%): 579 (М+Н+, 100). лоджування до кімнатної температури водну фазу h) 2-(3,5-біс-трифторметил-феніл)-N-метил-Nвідділили і двічі промили толуолом. Об'єднані ор[6-(4-метил-піперазин-1-іл)-4-о-толіл-піридин-3-іл]ганічні шари промили 50мл сольовим розчином, ізобутираміда гідрохлорид (1:2) висушили (сульфатом натрію), випарили і висушиДо розчину 31,6г (54,6ммоль) 2-(3,5-бісли під вакуумом з отриманням 49г (розрахунково) трифторметил-феніл)-N-метил-[6-(4-метилвказаної сполуки у вигляді коричневого масла. піперазин-1-іл)-4-о-толіл-піридин-3-іл]MS m/e (%): 367 (М+Н+, 100). ізобутираміда в 250мл диетилового ефіру додали е) 6-(4-метид-тперазин-1-іл)-4-о-толід-піридинпри охолоджуванні у льоді 60мл 3N розчину соля3-іламін ної кислоти в диетиловом ефірі. Після перемішуСуспензію 56г (152ммоль) 2,2-диметил-N-[6-(4вання протягом 15хв. при 0°С суспензію випарили метил-піперазин-1-іл)-4-о-толіл-піридин-3-іл]до сухого стану, пересуспендували в 100мл диепропіонаміда в 1300мл 3N розчину соляної кислотилового ефіру, відфільтровували і висушили під ти нагрівали до 90-95°С протягом ночі. Реакційну вакуумом з отриманням 34,8г (98%) вказаної спосуміш охолодили до кімнатної температури, пролуки у вигляді білих кристалів. Т. пл. 235-238°С. мили трьома порціями по 500мл диетилового ефіMS m/e (%): 579 (М+Н+, 100). ру і профільтрували через целіт. Фільтрат розбаПриклад 15 вили 500мл води і відрегулювали рН до 7-8 2-(3,5-біс-тірифторметил-феніл)-N-[4-(2-хлоршляхом додавання 28% розчину гідроксиду натрію феніл)-6-(4-метил-піперазин-1-іл)-піридин-3-іл)-Nпри охолоджуванні у льоді. Продукт екстрагували метил-ізобутираміда гідрохлорид (1:2) чотирма порціями по 1000мл дихлорметана. Об'Вказану сполуку отримали у вигляді білих криєднані органічні шари промили 500мл сольовим сталів, з порівнянними виходами речовин, по мерозчином, висушили (суль фатом магнію) і випаритодиці, описаній вище для прикладу 14, з викорисли з отриманням 35г (82 %) вказаної сполуки у танням о-хлорфенілборної кислоти замість овигляді світло-коричневого масла. толілборної кислоти на етапі d). MS m/e (%): 283 (М+Н+, 100). MS m/e (%): 599 (М+Н+, 100), 601 (М+Н+, 43). f) метид-[6-(4-метил-піперазин-1-іл)-4-о-толілПриклад 16 піридин-3-іл]-амін 2-(3,5-біс-трифторметил-феніл)-N-[4-(4-фторРозчин 35г (124ммоль) 6-(4-метил-піперазин2-метил-феніл)-6-(4-метил-піперазин-1-іл)-піридин1-іл)-4-о-толіл-піридин-3-іламіна в 270мл тримети3-іл]-N-метил-ізобутираміда гідрохлорид (1:2) лортоформата і 8 краплин трифтороцтової кислоВказану сполуку отримали у вигляді білих крити нагрівали протягом 3г. при 130°С. Реакційну сталів, з порівнянними виходами речовин, по месуміш випарили і висушили під вакуумом протягом тодиці, описаній вище для прикладу 14, з викорис30хв. Масло, що залишилося, розчинили в 100мл танням 4-фтор-2-метилфенілборної кислоти тетрагідрофурана і додали по краплинах при охозамість о-толілборної кислоти на етапі d). лоджуванні у льоді до 9,4г (248ммоль) алюмогідMS m/e (%): 597 (М+Н+, 100). рида літію в 300мл тетрагідрофурана. Реакційну Приклад 17 суміш перемішували протягом 1г. при кімнатній 2-(3,5-біс-трифторметил-феніл)-N-[4-(2-хлортемпературі, знов охолодили до 0°С і підкислили феніл)-піридин-3-іл]-N-метил-ізобутираміда гідро(до рН 1-2) шляхом додавання 28 % розчину соляхлорид (1:1) ної кислоти. Після перемішування протягом 5хв. а) 2,2-диметил-(4-йод-піридин-3-іл)-ацетамід додали 28% розчин гідроксиду натрію до досягРозчин 91г (510ммоль) N-3-піридилпиваламіда нення рН 10. Розчин профільтрували через целіт, і 230мл (1,53моль) Ν,Ν,Ν',Ν'випарили і очистили шляхом миттєвої хроматогтетраметилетилендиаміна в атмосфері аргону в рафії з отриманням 23,6г (64%) вказаної сполуки у 2000мл тетрагідрофурана охолоджували в бані з вигляді світло-коричневого масла. сухого льоду до -78°С. За 1 годину додали по краMS m/e (%): 297 (М+Н+, 100). плинах 153мл (1,53ммоль) 10N розчину n-бутилітія 25 71547 26 в гексані. Реакційну суміш перемішували при 0°С розчину соляної кислоти. Об'єднані водні шари ще 2 години. Після охолоджування знов до -78°С відрегулювали до рН 8-9 шляхом додавання конза 1,5г. додали по краплинах 380г (1,5ммоль) йоцентрованого розчину гідроксиду натрію і екстраду, розчиненого в 300мл тетрагідрофурана. Баню гували трьома порціями по 500мл етилацетата. з сухого льоду замінили крижаною банею і залиОб'єднані органічні екстракти висушили (сульфашили реакційну суміш нагріватися до кімнатної том магнію), випарили і твердий залишок перекритемператури протягом ночі. Перемішування простализували з гексана/етилацетата з отриманням довжили і додали 1000мл води і 1000мл насичених 12,3г (77%) вказаної сполуки у вигляді білих крисрозчином натрію тіосульфата пентагідрата. Водталів. ний шар відділили і екстрагували двома порціями MS m/e (%): 219 (М+Н+, 100), 221 (М+Н+, 42) по 800мл етилацетата. Об'єднані органічні шари е) 2-(3,5-біс-трифторметил-феніл)-N-[4-(2висушили (сульфатом магнію) і випарили. Хромахлор-феніл)-піридин-3-іл]-N-метил-іpобутирамід тографічна фільтрація забезпечила вихід 75г Розчин 12,2г (55,8ммоль) [4-(2-хлор-феніл)(48%) вказаної сполуки у вигляді коричневих криспіридин-3-іл]-метил-аміна і 15,3мл (89ммоль) Nталів. етилдиізопропіламіна в 130мл дихлорметана охоMS m/e (%): 305 (М+Н+, 100). лодили в крижаній бані і по краплинах додали розb) N-[4-(2-хлор-феніл)-піридин-3-іл]-2,2чин 19г (59,6ммоль) 2-(3,5-біс-трифторметилдиметил-пропіонамід феніл)-2-метил-пропіонілхлорида в 30мл дихлорСуміш 35г (115ммоль) 2,2-диметил-(4-йодметана. Реакційну суміш нагріли до 35-40°С протяпіридин-3-іл)-ацетаміда, 400мл толуола, 120мл 2N гом 20г., знов охолодили до кімнатної температури розчину карбонату натрію, 4,0г (3,5 моль) тетраі змішали з 250мл насиченого розчину бікарбонату кис(трифенілфосфін)паладію (0) і 20,0г натрію. Органічний шар відділили, а водну фазу (128ммоль) о-хлорфенілтолілборної кислоти наекстрагували дихлорметаном. Об'єднані органічні грівали в атмосфері аргону при 80°С протягом 12 шари висушили (сульфатом магнію) і випарили. г. Після охолоджування до кімнатної температури Залишок очистили шляхом миттєвої хроматографії водну фазу відділили і двічі промили толуолом. з отриманням 24,7г (88%) вказаної сполуки у виОб'єднані органічні шари промили 50мл сольовим гляді білих кристалів. розчином, висушили (суль фатом магнію) і випариMS m/e (%): 501 (М+Н+, 100), 503 (М+Н+, 36). ли. Залишок очистили шляхом миттєвої хроматогf) 2-(3,5-біс-трифторметил-феніл)-N-[4-(2-хлоррафії з отриманням 21,6г (65%) вказаної сполуки у феніл)-піридин-3-іл]-N-метил-ізобутираміда гідровигляді білих кристалів. хлорид (1:1) MS m/e (%): 289 (М+Н+, 100), 291 (М+Н+, 40). До розчину 24,7г (54,6ммоль) 2-(3,5-бісс) 4-(2-хлор-феніл)-піридин-3-іламін трифторметил-феніл)-N-[4-(2-хлор-феніл)-піридинСуспензію 22,2г (77ммоль) N-[4-(2-хлор3-іл]-N-метил-ізобутираміда в 100мл диетилового феніл)-піридин-3-іл]-2,2-диметил-пропіонаміда в ефіру додали при охолоджуванні у льоді 60мл 3N 730мл 3N розчину соляної кислоти нагрівали до соляної кислоти в диетиловом ефірі. Після пере90-95°С протягом ночі. Реакційну суміш охолодили мішування протягом 20 хвилин при 0°С суспензію до кімнатної температури, промили трьома порцівипарили до сухого стан у, пересуспендували в ями по 130мл диетилового ефіра і додали 500мл 100мл диетилового ефіру, відфільтровували і виетилацетата. Водну фазу відрегулювали до рН 7-8 сушили під вакуумом з отриманням 26,3г (99%) шляхом додавання 28% розчину гідроксиду натрію вказаної сполуки у вигляді білих кристалів. Т. пл. при охолоджуванні у льоді. Органічну фазу відді186-188°С. лили і продукт екстрагували трьома порціями по MS m/e (%): 501 (М+Н+, 100), 503 (М+Н+, 36). 200мл етилацетата. Об'єднані органічні шари виПриклад 18 сушили (сульфа том магнію) і випарили з отриман2-(3,5-біс-трифторметил-феніл)-N-метил-N-(4ням 14,9г (95%) вказаної сполуки у вигляді білих о-толіл-піридин-3-іл)-ізобутираміда гідрохлорид кристалів. (1:1) MS m/e (%): 205 (М+Н+, 100), 207 (М+Н+, 39). Вказану сполуку отримали у вигляді білих криd) [4-(2-хлор-феніл)-піридин-3-іл]-метид-амін сталів, з порівнянними виходами речовин, по меРозчин 14,9г (72,8ммоль) 4-(2-хлор-феніл)тодиці, описаній вище для прикладу 17, з викориспіридин-3-іламіна в 80мл триметилортоформата і танням о-толілборної кислоти замість о5 краплин трифтороцтової кислоти нагрівали прохлорфенілборної кислоти на етапі b). тягом 2,5г. при 130°С. Реакційну суміш випарили і MS m/e (%): 480 (М+, 5), 255 (25), 225 (100). висушили під вакуумом за 30 хвилин. Масло, що Приклад 19 залишилося, розчинили в 130мл тетрагідрофурана 2-(3,5-біс-трифторметил-феніл)-N-(4-о-толілі додали по краплинах при охолоджуванні у льоді піридин-3-іл)-ізобутирамід 220мл (220ммоль) 1Μ боранВказану сполуку отримали у вигляді коричнететрагідрофуранового комплексу. Після перемішувого масла, з порівнянними виходами речовин, по вання протягом ночі при кімнатній температурі методиці, описаній вище для прикладу 17, з викореакційну суміш випарили, охолодили до 0°С і ристанням о-толілборної кислоти замість ообережно додали 130мл 5N розчину соляної кисхлорфенілборної кислоти на етапі b). Етап d) пролоти в етанолі. Розчин нагрівали при зрошуванні пустили, тобто, гідрохлорид не отримували. протягом 1г., знов охолодили до кімнатної темпеMS m/e (%): 467 (М+Н+, 100). ратури і додали товченого льоду. Водн у фазу Приклад 20 промили трьома порціями по 100мл диетилового 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(4ефіра, а органічні шари екстрагували 100мл 1N о-толіл-піридин-3-іл)-ацетаміда гідрохлорид (1:1) 27 71547 28 Вказану сполуку отримали з порівнянними виa) 4-(5-нітро-2-піридил)-морфолін ходами речовин по методиці, описаній вище для До розчину 20г (126ммоль) 2-хлор-5прикладу 17, з використанням о-толілборної киснітропіридина в 150мл тетрагідрофурана по краплоти замість о-хлорфенілборної кислоти на етапі линах додали 27мл (315ммоль) за 10хв. Реакційну b). Етап e) виконували таким чином: суміш зрошували ще 2г. Після охолоджування до До розчину 511мг (1,88ммоль) 3,5кімнатної температури розчинник видалили під біс(трифторметил)фенілоцтової кислоти в 8мл вакуумом, а залишок перерозчинили в 200мл етитетрагідрофурана при 0°С додали 305мг лацетата. Органічну фазу промили 200мл 1N роз(1,88ммоль) 1,1’-карбонілдиімідазола однією порчину бікарбонату натрію, висушили (сульфатом цією. Реакційну суміш перемішували протягом 2г. магнію) і випарили з отриманням 27,3г (розрахунпри кімнатній температурі і потім додали 310мг ково) вказаної сполуки у вигляді жовтої твердої (1,56ммоль) метил-(4-о-толіл-піридин-3-іл)-аміна. речовини. Т. пл. 142-143°С. Перемішування продовжували при 55°С протягом b) 2,2-диметил-N-(6-морфолін-4-іл-піридин-3ночі. Реакційну суміш випарили і осадок очистили іл)-пропіонамід шляхом миттєвої хроматографії. Гідрохлорид До розчину 27,3г (126ммоль) 4-(5-нітро-2отримали як описано в етапі f) і отримали 290мг піридил)-морфоліна в 600мл метанолу додали 2,5г (38%) вказаної сполуки у вигляді жовтих кристалів. 10% паладію на активованому вугіллі. Реакційну MS m/e (%): 453 (М+Н+, 100). суміш гідрогенізували (При температурі від кімнатПриклад 21 ної до ~45°С, 1бар) до поглинання теоретичної 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(4кількості водню (біля 3 годин). Каталізатор відфіо-толіл-піридин-3-іл)-пропіонаміда гідрохлорид льтрували і промили двома порціями по 100мл (1:1) метанолу. Фільтрат випарили під вакуумом, отриВказану сполуку отримали у вигляді білих кримавши 22,6г пурпурного масла, яке, відповідно до сталів, з порівнянними виходами речовин, по мерезультатів тонкошарової хроматографії, містило тодиці, описаній вище для прикладу 17, з викорисбіля 95% бажаного похідного аніліну. танням о-толілборної кислоти замість оЦей сирий продукт розчинили в суміші 240мл хлорфенілборної кислоти на етапі b) і з використетрагідрофурана і 60мл диетилового ефіру. Після танням 2-(3,5-біс-трифторметил-феніл)охолоджування до 0°С додали однією порцією пропіонілхлорида замість 2-(3,5-біс-трифторметил26мл (189ммоль) триетіламіна. Продовжували феніл)-2-метил-пропіонілхлорида на етапі е). перемішування, одночасно додавши по краплинах MS m/e (%): 466 (М+, 5), 241 (12), 225 (100). 23г (189ммоль) пивалоїлхлорида за 10 хвилин. Приклад 22 Крижану баню видалили і перемішували реакційну 1-(3,5-біс-трифторметил-феніл)суміш протягом 1г. при кімнатній температурі. Поциклопропанкарбонової кислоти [4-(2-хлор-феніл)тім видалили розчинник під вакуумом, а залишок піридин-3-іл]-метил-аміда гідрохлорид суспендували в 200мл 1N розчини бікарбонату а) 1-(3,5-біс-трифторметил-феніл)натрію. Продукт екстрагували трьома порціями по циклопропанкарбонової кислоти [4-(2-хлор200мл дихлорметана, висушили (суль фатом нафеніл)][-піридин-3-іл]-метил-амід трію) і випарили. Перекристализацією твердого До розчину 88мг (0,4ммоль) [4-(2-хлор-феніл)залишку з етилацетата/гексана 1:8 отримали 28,6г піридин-3-іл]-метил-аміна і 0,11мл (0,6ммоль) N(86%) вказаної сполуки у вигляді білих кристалів. етилдиізопропіламіна в 4мл дихлорметана додали MS m/e (%): 264 (М+Н+, 100). розчин 174мг (0,3ммоль) с) N-(4-йод-6-морфолін-4-іл-піридин-3-іл)-2,21-(3,5-біс-трифторметил-феніл)диметил-пропіонамід циклопропанкарбонової кислоти хлорида в 1мл Розчин 28,4г (108ммоль) 2,2-диметил-N-(6дихлорметана. Після зрошування протягом 72г. морфолін-4-іл-піридин-3-іл)-пропіонаміда і 49мл реакційну суміш двічі промили водою, висушили (324ммоль) Ν,Ν,Ν',Ν'-тетраметилетилендиаміна в (сульфатом магнію) і випарили. Хроматографія атмосфері аргону в 600мл тетрагідрофурана охозалишку (силикагель, етилацетат:гексан 7:3) залодили в бані з сухого льоду до -78°С. За 1 годину безпечила вихід 132мг (66%) вказаної сполуки у додали по краплинах 202мл (324ммоль) 1,6N розвигляді жовтого масла. чину n-бутиллітія в гексані. Реакційну суміш ЗалиMS m/e (%): 499 (М+Н+, 100). шили нагріватися до -35°С протягом ночі. Після b) 1-(3,5-біс-трифторметил-феніл)охолоджування знов до -78°С за 15 хвилин додали циклопропанкарбонової кислоти [4-(2-хдор-феніл)по краплинах 37г (146ммоль) йоду, розчиненого в піридин-3-іл]-метил-аміда гідрохлорид 60мл тетрагідрофурана. Баню з сухого льоду заміДо 125мг 1-(3,5-біс-трифторметил-феніл)нили крижаною банею і, коли температура реакциклопропанкарбонової кислоти [4-(2-хлор-феніл)ційної суміші досягла 0°С, за 10 хвилин додали піридин-3-іл]-метил-аміда додали 1,5мл 3N солярозчин 90г (363ммоль) натрію тіосульфата пентаної кислоти в метанолі. Після випарювання додали гідрата в 250мл води. Потім додали 1000мл дие3мл розчину диетилового ефіру і перемішували тилового ефіру і відділили органічний шар. Водний суспензію протягом 1г. при 0°С. Після фільтрації шар екстрагували двома порціями по 500мл дихотримали 100мг (75%) вказаної сполуки у вигляді лорметана; об'єднані органічні шари висушили білих кристалів. Т. пл. 194-196°С. (сульфатом магнію) і випарили. Внаслідок миттєПриклад 23 вої хроматографії отримали 15,6г (37%) вказаної 2-(3,5-бίc-тpифтopмeтил-фeнiл)-N-мeтил-N-(6сполуки у вигляді світло-коричневого масла, яке мopфoлiн-4-iл-4-o-тoлiл-пipидин-3-іл)кристализується під час зберігання при кімнатній ізобутираміда гідрохлорид (1:1,45) температурі. 29 71547 30 MS m/e (%): 389 (М+, 71), 358 (25), 304 (43), 57 35-40°С протягом 3г., знов охолодили до кімнатної (100). температури і перемісили з 25мл насиченого розd) 2,2-диметил-N-(6-морфолін-4-іл-4-о-толілчину бікарбонату натрію. Органічний шар відділипіридин-3-іл)пропіонамід ли, а водну фаз у екстрагували дихлорметаном. Суміш 3,50г (9,0ммоль) N-(4-йод-6-морфолінОб'єднані органічні шари висушили (сульфатом 4-іл-піридин-3-іл)-2,2-диметил-пропіонаміда, 35мл магнію) і випарили. Залишок очистили шляхом толуола, 18мл 2N розчину карбонату натрію, миттєвої хроматографії з отриманням 2,9г (розра312мг (0,27ммоль) теграхунково) вказаної сполуки у ви гляді білих кристакис(трифенілфосфін)паладію (0) і 1,34г (9,9ммоль) лів. Т. пл. 131-132°С. о-толілборної кислоти нагрівали в атмосфері аргоh) 2-(3,5-біс-трифторметил-феніл)-N-метил-Nну при 80°С протягом 12г. Після охолоджування до (6-морфолін-4-іл-4-о-толіл-піридин-3-іл)кімнатної температури водну фазу відділили і двічі ізобутираміда гідрохлорид (1:1,45) промили етилацетатом. Об'єднані органічні шари До розчину 2,9г (5,13ммоль) 2-(3,5-біспромили 50мл сольовим розчином, висушили (сутрифторметил-феніл)-N-метил-N-(6-морфолін-4льфатом натрію) і випарили. Після очищення митіл-4-о-толіл-піридин-3-іл)-ізобутираміда в 50мл тєвою хроматографією отримали 3,23г (розрахундиетилового ефіру додали при охолоджуванні у ково) вказаної сполуки у вигляді білої піни. льоду 2,8мл 3N розчину соляної кислоти в диетиMS m/e (%): 354 (М+Н+, 100). ловом ефірі. Після перемішування протягом 15хв. e) 6-морфолін-4-іл-4-о-толіл-піридин-3-іламін при 0°С суспензію випарили до сухого стану, пеСуспензію 2,93г (8,28ммоль) 2,2-диметил-N-(6ресуспендували в 100мл диетилового ефіру, відморфолін-4-іл-4-о-толіл-піридин-3-іл)-пропіонаміда фільтровували і висушили під вакуумом з отрив 80мл 3N розчину соляної кислоти і 5мл 1манням 2,82г (89%) вказаної сполуки у вигляді пропанола нагрівали до 90-95°С протягом ночі. білих кристалів. Реакційну суміш охолодили до кімнатної темпераMS m/e (%): 566 (М+Н+, 100), 588 (M+Na+, 11). тури, промили трьома порціями по 20мл диетилоПриклад 24 вого ефіру і профільтрували через целіт. Фільтрат 2-(3,5-біс-трифторметил-феніл)-Ν-[4-(2-жлоррозбавили 20мл води і відрегулювали рН до 7-8 феніл)-6-морфолін-4-іл-піридин-3-іл]-N-метилшляхом додавання 28% розчину гідроксиду натрію ізобутираміда гідрохлорид (1:1) при охолоджуванні у льоду. Продукт екстрагували Вказану сполуку отримали у вигляді білих кричотирма порціями по 100мл дихлорметана. Об'єдсталів, з порівнянними виходами речовин, по менані органічні шари промили 50мл сольовим розтодиці, описаній вище для прикладу 23, з викорисчином, висушили (сульфа том магнію) і випарили з танням 2-хлорфенілборної кислоти замість оотриманням 2,31г (розрахунково) вказаної сполуки толілборної кислоти на етапі d). у вигляді білої піни. MS m/e (%): 586 (М+Н+, 100). + MS m/e (%): 269 (М , 100). Приклад 25 f) Метил-(6-морфолін-4-іл-4-о-толіл-піридин-32-(3,5-біс-трифторметил-феніл)-N-метил-N-{6іл)-амін [метил-(2-морфолін-4-іл-етил)-аміно]-4-о-толілРозчин 2,24г (8,3ммоль) 6-морфолін-4-іл-4-опіридин-3-іл}-ізобутирамід толіл-піридин-3-іламіна в 17мл триметилортофорВказану сполуку отримали у вигляді світломата і 3 краплини трифтороцтової кислоти нагрікоричневого масла, з порівнянними виходами ревали протягом 2г. при 130°С. Реакційну суміш вичовин, по методиці, описаній вище для прикладу парили і висушили під вакуумом протягом 30хв. 23, з використанням 4-[2-(метиламіно)етил]Масло, що залишилося, розчинили в 5мл тетрагідморфоліна замість морфоліна на етапі а). Гідророфурана і додали по краплинах при охолоджухлорид не отримували. ванні у льоду до 630мг (16,6ммоль) алюмогідрида MS m/e (%): 623 (М+Н+, 100). літія в 20мл тетрагідрофурана. Реакційну суміш Приклад 26 перемішували протягом 1г. при кімнатній темпера2-(3,5-біс-трифторметил-феніл)-N-метил-N-[6турі, знов охолодили до 0°С і підкислили (до рН 1(4-піримідин-2-іл-піперазин-1-іл)-4-о-толіл-піридин2) шляхом додавання 28% розчину соляної кисло3-іл]-ізобутирамід ти. Після перемішування протягом 5хв. додали Вказану сполуку отримали у вигляді безбарв28% розчин гідроксиду натрію до досягнення рН ного масла, з порівнянними виходами речовин, по 10. Розчин профільтрували через целіт, випарили і методиці, описаній вище для прикладу 23, з викоочистили шляхом миттєвої хроматографії з отриристанням 2-(1-піперазиніл)піримідина замість манням 1,56г (66%) вказаної сполуки у вигляді морфоліна на етапі а). Гідрохлорид не отримувабілої піни. ли. MS m/e (%): 283 (М+, 100). MS m/e (%): 643 (М+Н+, 100). g) 2-(3,5-бic-тpифтopмeтил-фeнiл)-N-мeтил-NПриклад 27 (6-мopфoлiн-4-iл-4-o-тoлiл-піpидин-3-іл)2-(3,5-біс-трифторметил-феніл)-N-(6ізобугирамід морфолін-4-іл-4-о-толіл-піридин-3-іл)-ізобутирамід Розчин 1,46г (5,15ммоль) метил-(6-морфолінВказану сполуку отримали у вигляді білого по4-іл-4-о-толіл-піридин-3-іл)-аміна і 1,32мл рошку, з порівнянними виходами речовин, по ме(7,73ммоль) N-етилдиізопропіламіна в 15мл дихтодиці, описаній вище для прикладу 23, але етап f) лорметана охолодили в крижаній бані і по краплипропустили і гідрохлорид не отримували. нах додали розчин 1,8г (5,67ммоль) 2-(3,5-бісMS m/e (%): 552 (М+Н+, 100). трифторметил-феніл)-2-метил-пропіонілхлорида в Приклад 28 50мл дихлорметана. Реакційну суміш нагрівали до 2-(3,5-біс-трифторметил-феніл)-N-[4'-(2-хлор 31 71547 32 феніл)-3,4,5,6-тетрагідро-2Н-[1,2']бипіриднніл-5'N-метилетаноламіна замість морфоліна на етапі іл]-N-метил-ізобутираміда гідрохлорид (1:1) а). Гідрохлорид не отримували. Вказану сполуку отримали у вигляді білого поMS m/e (%): 554 (М+Н+, 100). рошку, з порівнянними виходами речовин, по меПриклад 34 тодиці, описаній вище для прикладу 23, з викорис(R)-2-(3,5-біс-трифторметил-феніл)-N-[6-(3танням піперидина замість морфоліна на етапі а) і гідрокси-піролідин-1-іл)-4-о-толіл-піридин-3-іл]-Nз використанням 2-хлорфенілборної кислоти заметил-ізобутирамід мість о-толілборної кислоти на етапі d). Вказану сполуку отримали у вигляді білої піни, MS m/e (%): 583 (М+, 20), 296 (78), 255 (100). з порівнянними виходами речовин, по методиці, Приклад 29 описаній вище для прикладу 23, з використанням 2-(3,5-біс-трифторметил-феніл)-N-(6(R)-3-гідроксипіролідина замість морфоліна на диметиламіно-4-о-толіл-піридин-3-іл)-N-метилетапі а). Гідрохлорид не отримували. ізобутирамід MS m/e (%): 566 (М+Н+, 100). Вказану сполуку отримали у ви гляді білої твеПриклад 35 рдої речовини, з порівнянними виходами речовин, 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(6по методиці, описаній вище для прикладу 23, з морфолін-4-іл-4-о-толіл-піридин-3-іл)-ацетамід використанням диметиламіна гідрохлорида заДо розчину 300мг (1,1ммоль) 3,5мість морфоліна на етапі а). Гідрохлорид не отрибіс(трифторметил)-фенілоцтової кислоти в 7мл мували. Т. пл. 174-175°С. Ν,Ν-диметилформаміда додали 185мг (1,14ммоль) MS m/e (%): 524 (М+Н+, 100). 1,1’-карбоніл-диімідазола і перемішували розчин Приклад 30 протягом 30хв. при кімнатній температурі. Після 2-(3,5-біс-трифторметил-феніл)-N-[4-(2-хлордодавання 283мг (1ммоль) метил-(6-морфолін-4феніл)-6-диметиламіно-піридин-3-іл]-ізобутирамід іл-4-толіл-піридин-3-іл)-аміна (як описано в етапі f) Вказану сполуку отримали у ви гляді білої твеприкладу 23) реакційну суміш нагрівали протягом рдої речовини, з порівнянними виходами речовин, ночі при 90°С. Після охолоджування до кімнатної по методиці, описаній вище для прикладу 23, з температури видалили розчинник під вакуумом, а використанням диметиламіна гідрохлорида зазалишок перерозчинили в 30мл етилацетата. Ормість морфоліна на етапі а) і з використанням 2ганічну фазу промили водою (2x30мл), сольовим хлорфенілборної кислоти замість о-толілборної розчином, висушили (суль фатом магнію) і випарикислоти на етапі d). Гідрохлорид не отримували. ли. Після миттєвої хроматографії отримали 506мг Т.пл. 162-163°С. (94%) вказану сполуку у вигляді світло-коричневої MS m/e (%): 544 (М+Н+, 100). піни. Приклад 31 MSm/e(%):538(M+H +, 100). 2-(3,5-біс-трифторметил-феніл)-N-метил-N-(6Приклад 36 піперазин-1-іл-4-о-толіл-піридин-3-іл)-ізобутирамід 2-(3,5-диметокси-феніл)-N-метил-N-(6До розчину 100мг (0,173ммоль) 2-(3,5-бісморфолін-4-іл-4-о-толіл-піридин-3-іл)-ацетамід трифторметил-феніл)-N-метил-N-[6-(4-метилДо розчину 226мг (1,15ммоль) 3,5-диметоксипіперазин-1-іл)-4-о-толіл-піридин-3-іл]фенілоцтової кислоти в 7мл Ν,Νізобутираміда (приклад 14g) і 7мг (0,035ммоль) диметилформаміда додали 244мг (1,5ммоль) 1,1’1,8-біс(диметиламіно)нафталена в 1мл 1,2карбоніл-диімідазола і перемішували розчин продихлоретана при 0°С додали 26мг (0,181ммоль) 1тягом 30хв. при кімнатній температурі. Після додахлоретилхлорформата. Після нагрівання реакційвання 283мг (1ммоль) метил-(6-морфолін-4-іл-4ної суміші протягом 1г. при 80°С розчинник видатоліл-3-іл)-аміна (як описано в етапі f) прикладу лили під вакуумом і проміжну речовина очистили 23) реакційну суміш нагрівали при 70°С протягом миттєвою хроматографією, перерозчинили в 1мл 7г. Після охолоджування до кімнатної температури метанолу і зрошували протягом 3г. Після миттєвої видалили розчинник під вакуумом, а залишок пехроматографії отримали 56мг (57%) вказаної спорерозчинили в 30мл етилацетату. Органічну фазу луки у вигляді білої піни. промили водою (2х30мл), сольовим розчином, MS m/e (%): 565 (М+Н+, 100). висушили (сульфатом магнію) і випарили. Після Приклад 32 миттєвої хроматографії отримали 347мг (75%) 2-(3,5-біс-трифторметил-феніл)-N-(4-гідроксивказаних сполук у вигляді білої піни. 4'-о-толіл-3,4,5,6-тетрагідро-2Н-[1,2’]бипіридинілMS m/e (%): 462 (М+Н+, 100). 5’-іл)-N-метил-ізобутирамід Приклад 37 Вказану сполуку отримали у вигляді білої піни, 2-(3-фтор-5-трифторметил-феніл)-N-метил-Nз порівнянними виходами речовин, по методиці, (6-морфолін-4-іл-4-о-толіл-тридин-3-іл)-ацетамід описаній вище для прикладу 23, з використанням До розчину 266мг (1,2ммоль) 3-фтор-54-гідроксипіперидина замість морфоліна на етапі трифторметил-фенілоцтової кислоти в 7мл N,Nа). Гідрохлорид не отримували. диметилформаміда додали 195мг (1,2ммоль) 1,1’MS m/e (%): 580 (M+H +, 100). карбоніл-диімідазола і перемішували розчин проПриклад 33 тягом 30хв. при кімнатній температурі. Після дода2-(3,5-біс-трифторметил-феніл)-N-{6-[(2вання 283мг (1ммоль) метил-(6-морфолін-4-іл-4гідрокси-етил)-метил-аміно]-4-о-толіл-піридин-3толіл-піридин-3-іл)-аміна (як описано в етапі f) іл}-N-метил-ізобутирамід прикладу 23) реакційну суміш нагрівали при 90°С Вказану сполуку отримали у вигляді білої піни, протягом 6г. Після охолоджування до кімнатної з порівнянними виходами речовин, по методиці, температури видалили розчинник під вакуумом, а описаній вище для прикладу 23, з використанням залишок перерозчинили в 30мл етилацетата. Ор 33 71547 34 ганічну фазу промили водою (2х30мл), сольовим льтрували, концентрували і очистили миттєвою розчином, висушили (суль фатом магнію) і випарихроматографією з отриманням 0,77г (33%) вказали. Після миттєвої хроматографії отримали 432мг ної сполуки у вигляді блідо-жовтої рідини. (88%) вказаної сполуки у вигляді яскраво-жовтої Вихідний матеріал (1,60г, 61%) був виділений. піни. MS m/e (%): 199 (М+, 3), 180 (100). + MSm/e(%):488(M+H , 100). b) 3-(3,5-біс-трифторметил-бензилоксиметил)Приклад 38 4-о-толіл-піридин |2-(3,5-біс-трифторметил-феніл)-2-метилГідрид натрію (89,1мг, 2,04ммоль, 1,1екв.) двічі пропіл]-[4-(4-фтор-2-метил-феніл)-6-(4-метилпромили n-гексаном в атмосфері аргону і суспенпіперазин-1-іл)-піридин-3-іл]-метил-аміна гідродували в 1мл диметилформаміда. По краплинах хлорид (1:3) додали (4-о-толіл-піридин-3-іл)-метанол (370мг, До суміші 400мг (0,60ммоль) 2-(3,5-біс1,86ммоль), розчинений в 4мл диметилформамітрифторметил-феніл)-N-[4-(4-фтор-2-метилда, і перемішували суміш 1 годину при кімнатній феніл)-6-(4-метил-піперазин-1-іл)-піридин-3-іл]-Nтемпературі. Додали 3,5метил-ізобутираміда гідрохлорида (1:2) (Приклад біс(трифторметил)бензил-бромід (627мг, 16) і 50мл дихлорметана додали 20мл 1N розчину 2,04ммоль, 1екв.), розчинений в 2мл диметилфогідроксиду натрію. Після струшування протягом рмаміда, і перемішували суміш 2,5г. при кімнатній 1хв. органічну фазу відділили і випарили до сухого температурі. стану. Залишок перерозчинили в 5мл тетрагідроСуміш концентрували і розподілили залишок фурана і додали 4мл 1Μ розчину боранміж водою і дихлорметаном. Органічний екстракт тетрагідрофуранового комплексу. Після нагрівання промили сольовим розчином, висушили (сульфапри 60°С протягом 3 днів додали 10мл 3N розчину том натрію), профільтрували, концентрували і соляної кислоти в диетиловом ефірі і реакційну очистили миттєвою хроматографією з отриманням суміш зрошували 4 години. Потім реакційну суміш 196мг (25%) вказаної сполуки у вигляді жовтого охолодили до кімнатної температури, промили масла. 10мл 1N розчину гідроксиду натрію, висушили (суВихідний матеріал (0,24г, 65%) був виділений. льфатом магнію) і очистили шляхом миттєвої хроMS m/e (%): 426 (М+Н+, 100). матографії, отримавши 279мг блідо-жовтого масПриклад 41 ла, яке перетворили в гідрохлорид, як описано в N-(3,5-біс-трифторметил-бензил)-N-метил-6етапі h) прикладу 23 з отриманням 153мг (37%) (4-метил-піперазин-1-іл)-4-нафтален-1-ілвказаної сполуки у вигляді блідо-жовтих кристалів. нікотинаміда гідрохлорид (1:2) MS m/e (%): 583 (М+Н+, 100). Вказану сполуку отримали у ви гляді білої твеПриклад 39 рдої речовини, з порівнянними виходами речовин, (3,5-біс-трифторметил-бензил)-метил-(4-опо методиці, описаній вище для отримання N-(3,5толіл-піридин-3-ілметил)-амін біс-трифторметил-бензил)-N-метил-6-(4-метилАлюмогідрид літію (107мг, 2,82ммоль, 3екв.) піперазин-1-іл)-4-о-толіл-нікотинаміда гідрохлорисуспендували в 7мл тетрагідрофурана при 0°С в да (Приклад 12), з використанням 1-нафтилборної атмосфері аргону. N-(3,5-біс-трифторметилкислоти замість о-толілборної кислоти на етапі d) і бензил)-N-метил-4-о-толіл-нікотинамід (Приклад 1, з використанням N-метил-6-(4-метил-піперазин-1425мг, 0,94ммоль), розчинений в 4мл тетрагідроіл)-4-нафтален-1-іл-нікотинаміда замість N-метилфурана, повільно додали при ~5°С. Суміш пере6-(4-метил-піперазин-1-іл)-4-о-толіл-нікотинаміда мішували 5 хвилин при кімнатній температурі і 1г. на етапі е). при зрошуванні. MS m/e (%): 587 (М+Н+, 100). Додали етилацетат (1мл), потім охолодили Приклад 42 суміш до кімнатної температури і по краплинах N-(3,5-біс-трифторметил-бензил)-[4-(2-хлордодали водний насичений розчин сульфату нафеніл)-6-(4-метил-піперазин-1-іл)-піридин-3трію. Суміш висушили (сульфатом натрію), профіілметил]-метил-амін; гідрохлорид (1:3) льтрували, концентрували і очистили миттєвою До розчину 260мг (0,455ммоль) N-(3,5-бісхроматографією з отриманням 93мг (23%) вказатрифторметил-бензил)-4-(2-хлор-феніл)-N-метилної сполуки у вигляді безбарвного масла. 6-(4-метил-піперазин-1-іл)-нікотинаміда (Приклад MS m/e (%): 439 (М+Н+, 100). 13) в 6,3мл безводного тетрагідрофурана додали Приклад 40 2,73мл (2,73ммоль) 1Μ розчину борана в тетрагід3-(3,5-біс-трифторметил-бензилоксиметил)-4рофурані. Суміш нагрівали при зрошуванні протяо-толіл-піридин гом 16 годин. Після охолоджування до кімнатної a) (4-о-толіл-піридин-3-іл)-метанол температури додали 12,6мл 3Ν розчину хлоровоАлюмогідрид літію (439мг, 11,6ммоль, 1екв.) дненя в диетиловом ефірі і нагрівали суміш при суспендували в 23мл тетрагідрофурана при 0°С в зрошуванні протягом 40хв. Після охолоджування атмосфері аргону. Метиловий ефір 4-о-толілдо кімнатної температури додали 1N водний рознікотинової кислоти (2,63г, 11,6ммоль), розчинечин гідроксиду натрію. Після екстракції етилацетаний в 12мл тетрагідрофурана, повільно додали том, сушки сульфа том натрію, концентрування і при ~5°С. Суміш перемішували 5 хвилин при кімподальшої миттєвої хроматографії отримали натній температурі і 1г. при зрошуванні. 165мг безбарвного масла. До розчину масла в 2мл Додали етилацетат (1мл), потім охолодили диетилового ефіру додали 3мл 3N розчину хлоросуміш до кімнатної температури і по краплинах воденя в диетиловом ефірі. Після перемішування додали водний насичений розчин сульфату насуміші протягом 45 хв. утворився осадок, який зітрію. Суміш висушили (сульфатом натрію), профібрали шляхом фільтрації. Сушка під вакуумом 35 71547 36 забезпечила вихід 144мг (47,5 ) вказаної сполуки у Приклад 44 вигляді білої твердої речовини. (4-{5-[(3,5-біс-трифторметил-бензил)-метилMS m/e (%): 557 (М+Н+, 100). карбамоїл]-4-о-толіл-піридин-2-іл}-піперазин-1-іл)Приклад 43 оцтової кислоти етиловий ефір 4-{5-[(3,5-біс-трифторметил-бензил)-метилВказану сполуку отримали у вигляді жовтої карбамоїл]-4-о-толіл-піридин-2-іл}-піперазин-1твердої речовини, з порівнянним виходом для карбонової кислоти трет-бутиловий ефір етапу b) і виходом 3% для етапу с), по методиці, a) 6-хлор-N-метил-4-о-толіл-нікотинамід описаній вище для отримання 4-{5-[(3,5-бісДо розчину 3,41г (20,0ммоль) 6-хлор-N-метилтрифторметил-бензил)-метил-карбамоїл]-4-онікотинаміда (Приклад 12, етап а)) в 80мл тетрагітоліл-піридин-2-іл}-піперазин-1-карбонової кислоти дрофурана по краплинах додали 50мл (50ммоль) трет-бутилового ефіру (Приклад 43), з викорис1Μ розчину о-толіл-магнію хлориду в те трагідротанням 1-(етоксикарбонілметил)-піперазина зафурані при 0°С. Після закінчення додавання реакмість 1-трет-бутоксикарбонілпіперазина на етапі b) ційну суміш залишили нагріватися до кімнатної і з використанням [4-(5-метилкарбамоїл-4-о-толілтемператури і перемішували протягом 1,5г. Суміш піридин-2-іл)-піперазин-1-іл]-оцтової кислоти етизнов охолодили до 0°С, після чого по краплинах лового ефіру замість 4-(5-метилкарбамоїл-4-ододали 5,7мл (100ммоль) оцтової кислоти і розчин толіл-піридин-2-іл)-піперазин-1-карбонової кислоти 5,1г (22ммоль) 2,3-дихлор-5,6-дициано-1,4трет-бутилового ефіру на етапі с). бензохінона в 18мл тетрагідрофурана. Після заMS m/e (%): 623 (М+Н+, 100). кінчення додавання реакційну суміш залишили Приклад 45 нагріватися до кімнатної температури і перемішу5'-[(3,5-біс-трифторметил-бензил)-метилвали протягом 15хв. Додали 30мл 2Ν водного розкарбамоїл]-4'-о-толіл-3,4,5,6-тетрагідро-2Нчину гідроксиду натрію і розбавили суміш 1л ети[1,2']бипіридиніл-4-карбонової кислоти етиловий лацетату і 200мл води. Шари розділили і ефір органічний шар промили чотирма порціями по Вказану сполуку отримали у ви гляді білої тве250мл 2Ν водного розчину гідроксиду натрію. Змірдої речовини, з порівнянними виходами речовин, шані водні шари екстрагували трьома порціями по по методиці, описаній вище для отримання 4-{5500мл етилацетату. Об'єднані органічні екстракти [(3,5-біс-трифторметил-бензил)-метил-карбамоїл]промили насиченим водним розчином хлориду 4-о-толіл-піридин-2-іл}-піперазин-1-карбонової натрію і висушили сульфа том натрію. Після концекислоти трет-бутилового е фіру (Приклад 43), з нтрування отримали 5,44г червоно-коричневого використанням етил-ізонипекотата замість 1-третмасла. Миттєва колонкова хроматографія забезбутоксикарбонілпіперазина на етапі b) і з викориспечила вихід 2,15г (41,3%) вказаної сполуки у витанням 5'-метилкарбамоїл-4'-о-толіл-3,4,5,6гляді світло-жовтої твердої речовини. тетрагідро-2Н-[1,2']бипіридиніл-4-карбонової кисMS m/e (%): 260 (М+, 11), Т. пл. 91-93°С. лоти етилового ефіру замість 4-(5b) 4-(5-метил-карбамоїл-4-о-толіл-піридин-2метилкарбамоїл-4-о-толіл-піридин-2-іл)-піперазиніл)-піперазин-1-карбонової кислоти трет-бутиловий 1-карбонової кислоти трет-бутилового ефіру на ефір етапі с). Суміш 8,31г (31,9ммоль) 6-хлор-N-метил-4-оMS m/e (%): 608 (М+Н+, 100). толіл-нікотинаміда, 6,53г (35,0ммоль) 1-третПриклад 46 бутоксикарбонілпіперазина, 16,7мл (95,6ммоль) NN-(3,5-біс-трифторметил-бензил)-N-метил-6етилдиізопропіламіна і каталітична кількість 4(4-пропіл-піперазин-1-іл)-4-о-толіл-нікотинамід (N,N-диметиламіно)-піридин нагрівали при зрошуВказану сполуку отримали у вигляді світлованні протягом ночі. Після охолоджування до кімжовтої твердої речовини, з порівнянними виходанатної температури суміш розчинили в дихлормеми речовин, по методиці, описаній вище для отритані і промили двома порціями 0,1N водного мання 4-{5-[(3,5-біс-трифторметил-бензил)-метилрозчину соляної кислоти. Після сушки сульфатом карбамоїл]-4-о-толіл-піридин-2-іл}-піперазин-1натрію і концентрування отримали 10,7г сирого карбонової кислоти трет-бутилового ефіру (Припродукту. Миттєва колонкова хроматографія заклад 43), з використанням 1-пропіл-піперазина безпечила вихід 6,28г (48,0%) вказаної сполуки у замість 1-трет-бутоксикарбонілпіперазина на етапі вигляді брудно-білої твердої речовини. b) і з використанням N-метил-6-(4-пропілMS m/e (%): 411 (М+Н+, 100). піперазин-1-іл)-4-о-толіл-нікотинаміда замість 4-(5с) 4-{5-[(3,5-біс-трифторметил-бензил)-метилметилкарбамоїл-4-о-толіл-піридин-2-іл)-піперазинкарбамоїл]-4-о-толіл-піридин-2-іл}-піперазин-11-карбонової кислоти трет-бутилового ефіру на карбонової кислоти трет-бутиловий ефір етапі с). Вказану сполуку отримали у ви гляді білої твеMS m/e (%): 579 (М+Н+, 100). рдої речовини, з порівнянними виходами речовин, Приклад 47 по методиці, описаній вище для отримання N-(3,5(RS)-6-[3-(ацетил-метил-аміно)-піролідин-1-іл]біс-трифторметил-бензил)-N-метил-6-(4-метилN-(3,5-біс-трифторметил-бензил)-N-метил-4-опіперазин-1-іл)-4-о-толіл-нікотинаміда (Приклад толіл-нікотинамід 12, етап е)), з використанням 4-(5-метилВказану сполуку отримали у вигляді світлокарбамоїл-4-о-толіл-піридин-2-іл)-піперазин-1жовтої твердої речовини, з порівнянними виходакарбонової кислоти трет-бутилового е фіру замість ми речовин, по методиці, описаній вище для отриN-метил-6-(4-метил-піперазин-1-іл)-4-о-толілмання 4-{5-[(3,5-біс-трифторметил-бензил)-метилнікотинаміда. карбамоїл]-4-о-толіл-піридин-2-іл}-піперазин-1MS m/e (%): 637 (М+Н+, 100). карбонової кислоти трет-бутилового ефіру (При 37 71547 38 клад 43), з використанням (RS)-3-(ацетил-метилтанола додали 689мг (1,12ммоль) Охопе при 0°С. аміно)-піролідина замість 1-третПісля закінчення додавання реакційну сумішзабутоксикарбонілпіперазина на етапі b) і з викорислишили нагріватися до кімнатної температури і танням (RS)-6-[3-(ацетил-метил-аміно)-піролідинперемішували протягом 1,5г. Після гасіння 5 мі1-іл]-N-метил-4-о-толіл-нікотинаміда замість 4-(5лілітрами 40% водного розчину гідросульфіта наметилкарбамоїл-4-о-толіл-піридин-2-іл)-піперазинтрію додали 6мл 1N розчину гідроксиду натрію, 1-карбонової кислоти трет-бутилового ефіру на щоб відрегулювати рН до 7-8. Об'єднані екстракти етапі с). висушили сульфа том натрію і концентрували з MS m/e (%): 593 (М+Н+, 100). отриманням 1,20г сирого продукту. Миттєва хроПриклад 48 матографія забезпечила вихід 1,02г (79,9%) вказаN-(3,5-біс-трифторметил-бензил)-N-метил-6ної сполуки у вигляді білої твердої речовини. [метил-(2-морфолін-4-іл-етил)-аміно]-4-о-толілMS m/e (%): 570 (М+Н+, 100). нікотинамід Приклад 52 Вказану сполуку отримали у вигляді світлоN-(3,5-біс-трифторметил-бензил)-6-(1,1жовтої твердої речовини, з порівнянними виходадиоксо-1l6-тіоморфолін-4-іл)-N-метил-4-о-толілми речовин, по методиці, описаній вище для отринікотинамід мання 4-{5-[{3,5-біс-трифторметил-бензил)-метилВказану сполуку отримали у ви гляді білої твекарбамоїл]-4-о-толіл-піридин-2-іл}-піперазин-1рдої речовини, з порівнянними виходами речовин, карбонової кислоти трет-бутилового ефіру (Припо методиці, описаній вище для отримання N-(3,5клад 43), з використанням метил-(2-морфолін-4-ілбіс-трифторметил-бензил)-N-метил-6-(1-оксо-1l4етил)-аміна замість 1-треттіоморфолін-4-іл)-4-о-толіл-нікотинаміда (Приклад бутоксикарбонілпіперазина на етапі b) і з викорис51), з використанням N-(3,5-біс-трифторметилтанням N-метил-6-[метил-(2-морфолін-4-іл-етил)бензил)-N-метил-6-(1-оксо-1l4-тіоморфолін-4-іл)-4аміно]-4-о-толіл-нікотинаміда замість 4-(5о-толіл-нікотинаміда замість N-(3,5-бісметилкарбамоїл-4-о-толіл-піридин-2-іл)- піперазинтрифторметил-бензил)-N-метил-6-тіоморфолін-41-карбонової кислоти трет-бутилового ефіру на іл-4-о-толіл-нікотинаміда. етапі с). MS m/e (%): 586 (М+Н+, 100). MS m/e (%): 595 (М+Н+, 100). Приклад 53 Приклад 49 N-(3,5-біс-трифторметил-бензил)-N-метил-6N-(3,5-біс-трифторметил-бензил)-N-метил-6піперазин-1-іл-4-о-толіл-нікотинамід морфолін-4-іл-4-о-толіл-нікотинамід До розчину 6,60г (104ммоль) 4-{5-[(3,5-бісВказану сполуку отримали у ви гляді білої тветрифторметил-бензил)-метил-карбамоїл]-4-ордої речовини, з порівнянними виходами речовин, толіл-піридин-2-іл}-піперазин-1-карбонової кислоти по методиці, описаній вище для отримання 4-{5трет-бутилового ефіру (Приклад 43) і 8,40мл [(3,5-біс-трифторметил-бензил)-метил-карбамоїл](207ммоль) метанола в 50мл етилацетата по кра4-о-толіл-піридин-2-іл}-піперазин-1-карбонової плинах додали 14,7мл (207ммоль) ацетилхлорида кислоти трет-бутилового е фіру (Приклад 43), з при 0°С. Через 4 години реакційну суміш розбавивикористанням морфоліна замість 1-третли етилацетатом і обробили 1N розчином гідробутоксикарбонілпіперазина на етапі b) і з викорисксида натрію. Шари розділили і водний шар ексттанням №-метил-6-морфолін-4-іл-4-о-толілрагували дихлорметаном. Об'єднані органічні нікотинаміда замість 4-(5-метилкарбамоїл-4-ошари висушили сульфатом натрію і концентрували толіл-піридин-2-іл)-піперазин-1-карбонової кислоти з отриманням 5,36г сирого продукту. Після миттєтрет-бутилового ефіру на етапі с). вої хроматографії отримали 4,86г (87,4%) вказаної + MS m/e (%): 538 (М+Н , 100). сполуки у вигляді світло-коричневої твердої речоПриклад 50 вини. N-(3,5-бic-тpифтopмeτил-бeнзил)-N-мeтил-6MS m/e (%): 537 (M+H +, 100). тioмopфoлiн-4-iл-4-o-тoлiл-нікотинамід Приклад 54 Вказану сполуку отримали у ви гляді білої твеN-(3,5-біс-трифторметил-бензил)-6-[4-(2рдої речовини, з порівнянними виходами речовин, гідрокси-етил)-піперазин-1-іл]-N-метил-4-о-толілпо методиці, описаній вище для отримання 4-{5нікотинамід [(3,5-біс-трифторметил-бензил)-метил-карбамоїл]Суміш 100мг (0,186ммоль) N-(3,5-біс4-о-толіл-піридин-2-іл}-піперазин-1-карбонової трифторметил-бензил)-N-метил-6-піперазин-і-іл-4кислоти трет-бутилового е фіру (Приклад 43), з о-толіл-нікотинаміда (Приклад 53), 0,030мл використанням тіоморфоліна замість 1-трет(0,42ммоль) 2-бром-етанола і 46мг (0,33ммоль) бутоксикарбонілпіперазина на етапі b) і з викорискарбонату калію в 2мл ацетонітрила перемішували танням N-метил-6-тюморфолін-4-іл-4-о-толілпротягом 70 годин при 45°С. Після охолоджування нікотинаміда замість 4-(5-метилкарбамоїл-4-одо кімнатної температури додали 10мл 1N розчину толіл-піридин-2-іл)-піперазин-1-карбонової кислоти гідроксиду натрію. Після екстракції трьома порціятрет-бутилового ефіру на етапі с). ми по 15мл етилацетата, сушки сульфатом натрію MS m/e (%): 554 (М+Н+, 100). і концентрування отримали 138мг сирого продукту. Приклад 51 Миттєва колонкова хроматографія забезпечила N-(3,5-бic-тpифтopмeтил-бeнзил)-N-мeтил-6вихід 85мг (78,6%) вказаної сполуки у вигляді білої (1-oкco-1l4-тioмopфoлiн-4-iл)-4-o-толіл-нікотинамід твердої речовини. До розчину 1,24г (2,24ммоль) N-(3,5-бісMS m/e (%): 581 (М+Н+, 100). трифторметил-бензил)-N-метил-6-тіоморфолін-4Приклад 55 іл-4-о-толіл-нікотинаміда (Приклад 50) в 25мл меN-(3,5-біс-трифторметил-бензил)-6-(4 39 71547 40 цианометил-піперазин-1-іл)-N-метил-4-о-толілмом забезпечили вихід 1,09г сирого продукту. нікотинамід Миттєва колонкова хроматографія забезпечила Вказану сполуку отримали у ви гляді білої твевихід 820мг (86,8%) вказаної сполуки у вигляді рдої речовини, з порівнянним виходом, по метосвітло-коричневої твердої речовини. диці, описаній вище для отримання N-(3,5-бісMS m/e (%): 634 (М+Н+, 100). трифторметил-бензил)-6-[4-(2-гідрокси-етил)Приклад 59 піперазин-1-іл]-N-метил-4-о-толіл-нікотинаміда N-(3,5-біс-трифторметил-бензил)-6-(4-форміл(Приклад 54), з використанням хлор-ацетонітрила піперазин-1-іл)-N-метил-4-о-толіл-нікотинамід замість 2-бром-етанола. До суміші 0,089мл (1,1ммоль) Ν,ΝMS m/e (%): 576 (М+Н+, 100). диметилформаміда і 38мг (0,56ммоль) імідазола Приклад 56 по краплинах додали 0,071мл (0,56ммоль) тримеN-(3,5-біс-трифторметил-бензил)-6-{4-[2-(2тилхлорсилана при кімнатній температурі. Реакгідрокси-етокси)-етил]-піперазин-1-іл}-N-метил-4-оційну суміш охолодили до 0°С і додали 0,10г толіл-нікотинамід (0,19ммоль) N-(3,5-бic-трифторметил-бензил)-NСуміш 400мг (0,746ммоль) N-(3,5-бісметил-6-піперазин-1-іл-4-о-толіл-нікотинаміда трифторметил-бензил)-N-метил-6-піперазин-і-іл-4(Приклад 53). Видалили крижану баню і перемішуо-толіл-нікотинаміда (Приклад 53), 0,18мл вали суміш протягом ночі. Реакцію погасили сумі(1,7ммоль) 2-(2-хлоретокси)-етанола і 0,189г шшю 2мл 1N водного розчину соляної кислоти і (1,35ммоль) карбонату калію в 8мл ацетонітрила 4мл води і екстрагували суміш етилацетатом. Об'перемішували протягом 48 годин при 85°С. Після єднані екстракти висушили сульфа том натрію і охолоджування до кімнатної температури додали концентрували. Після миттєвої колонкової хрома40мл 1Ν розчину гідроксиду натрію. Після екстрактографії отримали 81мг (82%) вказаної сполуки у ції трьома порціями по 60мл дихлорметана, сушки вигляді білої твердої речовини. сульфатом натрію і концентрування отримали MS m/e (%): 565 (М+Н+, 100). 528мг сирого продукту. Миттєва колонкова хромаПриклад 60 тографія забезпечила вихід 300мг (64,4%) вказаної N-метил-N-(2-метил-нафтален-1-ілметил)-6сполуки у вигляді світло-коричневої твердої речоморфолін-4-іл-4-о-толіл-нікотинамід вини. а) N-метил-о-морфолін-4-іл-4-о-толілMS m/e (%): 625 (М+Н+, 100). нікотинамід Приклад 57 Вказану сполуку отримали у вигляді брудноN-(3,5-біс-трифторметил-бензил)-N-метил-6білої твердої речовини, з порівнянним виходом, по (4-[1,2,4]-оксадиазол-3-ілметил-піперазин-1-іл)-4-ометодиці, описаній вище для отримання 4-{5-[(3,5толіл-нікотинамід біс-трифторметил-бензил)-метил-карбамоїл]-4-оСуміш 200мг (0,373ммоль) N-(3,5-бістоліл-піридин-2-іл}-піперазин-1-карбонової кислоти трифторметил-бензил)-N-метил-6-піперазин-і-іл-4трет-бутилового ефіру (Приклад 43, етап b), з вио-толіл-нікотинаміда (Приклад 53), 66мг користанням морфоліна замість 1-трет(0,56ммоль) 3-(хлорметил)-1,2,4-оксадиазола і бутоксикарбонілпіперазина. 62мг (0,45ммоль) карбонату калію в 4мл ацетонітMS m/e (%): 311 (M+, 63). рила перемішували при 45°С протягом 1г. і при b) N-метил-N-(2-метил-нафтален-1-ілметил)-6кімнатній температурі протягом ночі. Реакційну морфолін-4-іл-4-о-толіл-нікотинамід суміш розбавили 10мл води і екстрагували трьома Вказану сполуку отримали у ви гляді білої твепорціями по 30мл дихлорметана. Після сушки сурдої речовини, з порівнянним виходом, по метольфатом натрію і концентрування отримали 244мг диці, описаній вище для отримання N-(3,5-біссирого продукту. Миттєва колонкова хроматогратрифторметил-бензил)-N-метил-6-морфолін-4-ілфія забезпечила вихід 80мг (34,7%) вказаної спо4-о-толіл-нікотинаміда (Приклад 12, етап е)), з вилуки у вигляді червоно-коричневої твердої речокористанням 1-хлорметил-2-метилнафталена завини. мість 3,5-біс-трифторметил-бензилброміда. MS m/e (%): 619 (М+Н+, 100). MS m/e (%): 466 (М+Н+, 100). Приклад 58 Приклад 61 N-(3,5-біс-трифторметил-бензил)-N-метил-6N-метил-6-морфолін-4-іл-N-нафтален-1[4-(5-оксо-4,5-дигідро-1Н-[1,2,4}-триазол-3ілметил-4-о-толіл-нікотинамід ілметил)-піперазин-1-іл]-4-о-толіл-нікотинамід Вказану сполуку отримали у вигляді безбарвСуміш 800мг (1,49ммоль) N-(3,5-бісного в'язкого масла, з порівнянними виходами ретрифторметил-бензил)-N-метил-6-піперазин-і-іл-4човин, по методиці, описаній вище для отримання о-толіл-нікотинаміда (Приклад 53), 296мг N-метил-N-(2метил-нафтален-1-ілметил)-6(1,79ммоль) N-карбометокси-2морфолін-4-іл-4-о-толіл-нікотинаміда (Приклад хлорацетамідразона і 0,52мл (3,0ммоль) N-етил60), з використанням 1-хлорметилнафталена задиізопропіламіна в 14мл ацетонітрила перемішумість 1-хлорметил-2-метилнафталена на етапі b). вали при кімнатній температурі протягом 2г. РеакMS m/e (%): 452 (М+Н+, 100). ційну суміш розбавили 20мл води і екстрагували Приклад 62 трьома порціями по 50мл дихлорметана. Об'єднаN-(2-метокси-нафтален-1-ілметил)-N-метил-6ні екстракти висушили сульфатом натрію і конценморфолін-4-іл-4-о-толіл-нікотинамід трували. Залишок розчинили в 14мл ДМФ (димеВказану сполуку отримали у вигляді безбарвтилформамід), і додали 0,29мл (1,6ммоль) N-етилного в'язкого масла, з порівнянними виходами редиізопропіламіна. Реакційну суміш перемішували човин, по методиці, описаній вище для отримання протягом ночі. Концентрування і сушка під вакууN-метил-N-(2-метил-нафтален-1-ілметил)-6 41 71547 42 морфолін-4-іл-4-о-толіл-нікотинаміда (Приклад іл)-бензил]-N-метил-6-морфолін-4-іл-4-о-толіл60), з використанням толуол-4-сульфонової кислонікотинамід ти 2-метокси-нафтален-1-ілметилового ефіру заВказану сполуку отримали у ви гляді білої твемість 1-хлорметил-2-метилнафталена на етапі b). рдої речовини, з порівнянними виходами речовин, MS m/e (%): 482 (М+Н+, 100). по методиці, описаній вище для отримання NПриклад 63 метил-N-(2-метил-нафтален-1-ілметил)-6N-(2-метокси-бензил)-N-метил-6-морфолін-4морфолін-4-іл-4-о-толіл-нікотинаміда (Приклад іл-4-о-толіл-нікотинамід 60), з використанням толуол-4-сульфонової кислоВказану сполуку отримали у вигляді безбарвти [2-метокси-5-(5-трифторметил-тетразол-1-іл)ного в'язкого масла, з порівнянними виходами рефеніл]-метилового ефіру замість 1-хлорметил-2човин, по методиці, описаній вище для отримання метилнафталена на етапі b). N-метил-N-(2-Meran-нафтален-1-ілметил)-6MS m/e (%): 568 (М+Н+, 100). морфолін-4-іл-4-о-толіл-нікотинаміда (Приклад Приклад 69 60), з використанням 2-метокси-бензилхлорида N-(1,4-диметокси-нафтален-2-ілметил)-Nзамість 1-хлорметил-2-метилнафталена на етапі метил-6-морфолін-4-іл-4-о-толіл-нікотинамід b). Вказану сполуку отримали у вигляді безбарвMS m/e (%): 432 (М+Н+, 100). ного в'язкого масла, з порівнянними виходами реПриклад 64 човин, по методиці, описаній вище для отримання N-(5-xлop-2-мeтoкcи-бeнзил)-N-мeтил-6N-метил-N-(2-метил-нафтален-1-ілметил)-6мopфoлiн-4-iл-4-o-тoліл-нікoтинaмiд морфолін-4-іл-4-о-толіл-нікотинаміда (Приклад Вказану сполуку отримали у ви гляді білої тве60), з використанням 2-хлорметил-1,4-диметоксирдої речовини, з порівнянними виходами речовин, нафталена замість 1-хлорметил-2по методиці, описаній вище для отримання Nметилнафталена на етапі b). метил-N-(2-метил-нафтален-1-ілметил)-6MS m/e (%): 512 (М+Н+, 100). морфолін-4-іл-4-о-толіл-нікотинаміда (Приклад Приклад 70 60), з використанням 5-хлор-2-метокси5’-(3,5-біс-трифторметил-бензил)-метилбензилхлорида замість 1-хлорметил-2карбамоїл]-4'-о-толіл-3,4,5,6-тетрагідро-2Нметилнафталена на етапі b). [1,2']бипіридиніл-4-карбонова кислота MS m/e (%): 466 (М+Н+, 100). Суміш 200мг (0,33ммоль) 5'-[(3,5-бісПриклад 65 трифторметил-бензил)-метил-карбамоїл]-4'-оN-(2-хлор-5-метокси-бензил)-N-метил-6толіл-3,4,5,6-тетрагідро-2Н-[1,2’]бипіридиніл-4морфолін-4-іл-4-о-толіл-нікотинамід карбонової кислоти етилового ефіру (Приклад 45), Вказану сполуку отримали у ви гляді білої тве10мл 1N водного розчину гідроксиду натрію і 10мл рдої речовини, з порівнянними виходами речовин, метанолу перемішували при кімнатній температурі по методиці, описаній вище для отримання Nпротягом ночі. Після промивки 2 порціями етиламетил-N-(2-метил-нафтален-1-ілметил)-6цетату водний шар підкислили до рН 4 1N водним морфолін-4-іл-4-о-толіл-нікотинаміда (Приклад розчином соляної кислоти. Після екстракції дихло60), з використанням 2-хлор-5-метоксирметаном, сушки сульфатом натрію і миттєвої кобензилброміда замість 1-хлорметил-2лонкової хроматографії отримали 81мг (42%) вкаметилнафталена на етапі b). заної сполуки у вигляді білої твердої речовини. MS m/e (%): 466 (М+Н+, 100). MS m/e (%): 580 (М+Н+, 100). Приклад 66 Приклад 71 N-метил-6-морфолін-4-іл-NN-(3,5-біс-трифторметил-бензил)-N-метил-6пентафторфенілметил-4-о-толіл-нікотинамід [4-(1Н-тетразол-5-ілметил)-піперазин-1-іл]-4-оВказану сполуку отримали у ви гляді білої тветоліл-нікотинамід рдої речовини, з порівнянними виходами речовин, Суміш 0,10г (0,17ммоль) N-(3,5-біспо методиці, описаній вище для отримання Nтрифторметил-бензил)-6-(4-цианометилметил-N-(2-метил-нафтален-1-ілметил)-6піперазин-1-іл)-N-метил-4-о-толіл-нікотинаміда морфолін-4-іл-4-о-толіл-нікотинаміда (Приклад (Приклад 55), 34мг (0,52ммоль) азиду натрію і 60), з використанням 2,3,4,5,6-пентафтор36мг (0,26ммоль) триетиламонійхлорида в 1мл 1бензилброміда замість 1-хлорметил-2метил-2-пирролідона нагрівали при зрошуванні метилнафталена на етапі b). протягом 2г. Після охолоджування до кімнатної MS m/e (%): 492 (М+Н+, 100). температури додали 6мл крижаної води. Суміш Приклад 67 підкислили 1N розчином соляної кислоти до рН 1-2 N-метил-6-морфолін-4-іл-N-нафтален-2і екстрагували дихлорметаном. Після сушки об'єділметил-4-о-толіл-нікотинамід наних екстрактів сульфатом натрію, концентруВказану сполуку отримали у ви гляді білої твевання і миттєвої колонкової хроматографії отрирдої речовини, з порівнянними виходами речовин, мали 95мг (88%) вказаної сполуки у вигляді світлопо методиці, описаній вище для отримання Nкоричневої твердої речовини. метил-N-(2-метил-нафтален-1-ілметил)-6MS m/e (%): 619 (М+Н+, 100). морфолін-4-іл-4-о-толіл-нікотинаміда (Приклад Приклад 72 60), з використанням 2-хлорметил-нафталена заN-(6-бензіпаміно-4-о-толіл-піридин-3-іл)-2-(3,5мість 1-хлорметил-2-метилнафталена на етапі b). біс-трифторметил-феніл)-N-метил-ізобутирамід MS m/e (%): 452 (М+Н+, 100). а) 2-бензил-N5-метил-4-о-толіл-піридин-2,5Приклад 68 диамін N-[2-метокси-5-(5-трифторметил-тетразол-1Вказану сполуку отримували по методиці, опи 43 71547 44 саній вище для синтезу метил-(6-морфолін-4-іл-4MS m/e (%): 496 (М+Н+, 100). о-толіл-піридин-3-іл)-аміна (Приклад 23, етап f). Приклад 74 MS m/e (%): 304 (М+Н+, 100). 2-(3,5-біс-трифторметил-феніл)-N-[6b) Бензил-(5-метиламіно-4-о-толіл-піридин-2(диметиламіно-метиленаміно)-4-о-толіл-піридин-3іл)-карбамінової кислоти бензиловий ефір іл)-N-метил-ізобутирамід До розчину 2,03 (6,7ммоль) N2-бензил-N5До розчину 100мг (0,2ммоль) N-(6-аміно-4-ометил-4-о-толіл-піридин-2,5-диаміна в 100мл дихтоліл-тридин-3-іл)-2-(3,5-біс-трифторметил-феніл)лорметана і 40мл N-етилдиізопропіламіна при 0°С N-метил-ізобутираміда (Приклад 73) в 4мл Ν,Νпо краплинах додали розчин 2,1мл (14,09ммоль) диметилформаміда при 0°С додали 11мг бензилхлорформата в 50мл дихлорметана. Після (0,252ммоль) гідриду натрію у вигляді 60% диспеПеремішування протягом 2г. при кімнатній темперсії в маслі і перемішували суміш протягом 30хв. ратурі реакційну суміш промили водою (2х50мл), без охолоджування. Потім додали 28мг сольовим розчином (50мл), висушили (сульфатом (0,218ммоль) бензолсульфонілхлорида при 0°С і магнію) і випарили. Після хроматографії залишку перемішували розчин протягом ночі при кімнатній отримали 2,36г (80%) вказаної сполуки у вигляді температурі. Реакційну суміш вилили у воду і екссвітло-коричневих кристалів. Т. пл. 110-112°С. трагували етилацетатом (3x10мл). Об'єднані екстMS m/e (%): 438 (М+Н+, 100). ракти промили водою (3х20мл), сольовим розчис) Бензил-(5-([2-(3,5-біс-трифторметил-феніл)ном (20мл), висушили (сульфатом магнію) і 2-метил-пропюніл]-метил-аміно}-4-о-толіл-піридинвипарили. Після хроматографії залишку отримали 2-іл)-карбамінової кислоти бензиловий ефір 51мг (46%) вказаної сполуки у вигляді білої піни. До розчину 1,075г (2,5ммоль) бензил-(5MS m/e(%): 551 (М+Н+, 100). метиламіно-4-о-толіл-піридин-2-іл)-карбамінової Приклад 75 кислоти бензилового ефіру в 10мл дихлорметана і 2-(3,5-біс-трифторметил-феніл)-N-(61мл N-етилдиізопропіламіна при 0°С по краплинах метансульфоніламіно-4-о-толіл-піридин-3-іл) Nдодали розчин 1,15мл (3,5ммоль) 2-(3,5-бісметил-ізобутирамід трифторметил-феніл)-2-метил-пропіонової кислоДо розчину 100мг (0,2ммоль) N-(6-аміно-4-оти хлориду в 2мл дихлорметана і перемішували толіл-піридин-3-іл)-2-(3,5-біс-трифторметилсуміш протягом 3г. при кімнатній температурі. Розфеніл)-N-метил-ізобутираміда (Приклад 73) в 2мл чин промили водою (20мл), насиченим водним піридину додали 27мг (0,35ммоль) метансульфорозчином гідрокарбоната натрію (20мл) і сольовим нілхлорида і перемішували суміш протягом ночі розчином (20мл), висушили (сульфатом магнію) і при кімнатній температурі. Після випарювання випарили. Після хроматографії залишку отримали розчинника залишок розчинили в етилацетаті, дві1,15г (62%) вказаної сполуки у вигляді жовтого чі промили насиченим водним розчином гідрокармасла. бонату натрію, сольовим розчином і висушили MS m/e (%): 720 (М+Н+, 100). (сульфатом магнію). Після хроматографії залишку d) N-(6-бензіламіно-4-о-толіл-піридин-3-іл)-2отримали 24мг (42%) вказаної сполуки у вигляді (3,5-біс-трифторметил-феніл)-N-метилбілої піни. ізобутирамід MS m/e (%): 574 (М+Н+, 100). До розчину 973мг (1,35ммоль) бензил-(5-{[2Приклад 76 (3,5-біс-трифторметил-феніл)-2-метил-пропіоніл]N-(6-бензолсульфоніламіно-4-о-толіл-шридинметил-аміно}-4-о-толіл-піридин-2-іл)-карбамінової 3-іл)-2-(3,5-біс-трифторметил-феніл)-N-метилкислоти бензилового ефіру в 13мл метанола і 1мл ізобутирамід Ν,Ν-диметилформаміда додали 40мг 10% паладію До розчину 100мг (0,2ммоль) N-(6-амшо-4-она активованому вугіллі і гідрогенізували суміш толіл-піридин-3-іл)-2-(3,5-біс-трифторметил(при кімнатній температурі, 1бар) протягом 1г. Фіфеніл)-N-метил-ізобутираміда в 4мл дихлорметальтрацією каталізатора і випарюванням фільтрату на і 85мг N-етилдиізопропіламіна додали 56мг отримали 795мг (розрахунково) вказаної сполуки у (0,436ммоль) бензолсульфонілхлорида і перемівигляді жовтого масла. шували суміш протягом ночі при кімнатній темпеMS m/e (%): 586 (М+Н+, 100). ратурі. Реакційну суміш двічі промили насиченим Приклад 73 водним розчином гідрокарбонату натрію і висушиN-(6-аміно-4-о-толіл-піридин-3-іл)-2-(3,5-бісли (сульфатом магнію). Після хроматографії затрифторметил-феніл)-N-метил-ізобутирамід лишку отримали 26мг (28%) вказаної сполуки у Розчин 750мг (1,28ммоль) N-(6-бензіламіно-4вигляді білої піни. о-толіл-піридин-3-іл)-2-(3,5-біс-трифторметилMS m/e (%): 634 (М-Н+, 100). феніл)-N-метил-ізобутираміда (Приклад 73, етап Приклад А d) в 25мл 5N розчину соляної кислоти в етанолі Таблетки наступного складу виготували звивипарили до сухого стану, а залишок розчинили в чайним способом: 30мл метанолу і гідрогенізували в присутності мг/таблетка 60мг 10% паладію на активованому вугіллі (при Активна речовина 5 кімнатній температурі, 10бар) протягом 20г. Після Лактоза 45 фільтрації каталізатора і випарювання розчинника Кукур удзяний крохмаль 15 залишок розчинили в 30мл етилацетата, двічі Мікрокристалічна целюлоза 34 промили насиченим розчином гідрокарбоната наСтеарат магнію 1 трію і висушили (сульфатом магнію). Після випаВага таблетки 100 рювання розчину отримали 514мг (81%) вказаної Приклад В сполуки у вигляді світло-коричневих кристалів. Виготували капсули наступного складу: 45 71547 46 мг/капсула мг/суп. Активна речовина 10 Активна речовина 15 Лактоза 155 Супозиториальна маса 1285 Кукур удзяний крохмаль 30 Загальна вага 1300 Тальк 5 Супозиториальну масу розплавили в скляній Вага вмісту капсули 200 або стальній судині, ретельно перемісили і охолоАктивну речовину, лактозу і кукурудзяний кродили до 45°С. Після цього додали тонкодисперсхмаль спочатку змішували в змішувачі, а потім в ний порошок активної речовини і перемішували до дробарці. Суміш повернули в змішувач, додали його повного диспергування. Суміш вилили в фотальк і ретельно перемісили. Цією сумішшю за рми для супозиторіїв відповідного розміру, залидопомогою машини заповнили тверді желатинові шили охолоджуватися, потім вийняли супозиторій капсули. з форм і роздільно упакували у восковий папір або Приклад С металеву фольгу. Виготували супозиторій наступного складу: Комп’ютерна в ерстка О. Гапоненко Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-phenylpyridin derivatives, a method for the preparation of some of them, a pharmaceutical composition and a method for treating diseases induced by neurokinin 1
Автори англійськоюGalley Guido
Назва патенту російськоюПроизводные 4-фенилпиридина, способ получения некоторых из них, фармацевтическая композиция и способ лечения заболеваний, индуцированных нейрокинином 1
Автори російськоюГаллей Гвидо
МПК / Мітки
МПК: A61P 29/00, C07D 401/12, C07D 213/75, C07D 213/74, C07D 213/38, C07D 413/14, C07D 213/40, C07D 413/12, C07D 213/82, C07D 213/30, C07D 401/04, A61P 25/00
Мітки: нейрокініном, деяких, похідні, композиція, індукованих, спосіб, одержання, фармацевтична, них, лікування, захворювань, 4-фенілпіридину
Код посилання
<a href="https://ua.patents.su/23-71547-pokhidni-4-fenilpiridinu-sposib-oderzhannya-deyakikh-z-nikh-farmacevtichna-kompoziciya-ta-sposib-likuvannya-zakhvoryuvan-indukovanikh-nejjrokininom-1.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-фенілпіридину, спосіб одержання деяких з них, фармацевтична композиція та спосіб лікування захворювань, індукованих нейрокініном 1</a>
Попередній патент: Спосіб одержання солі аліфатичної карбонової кислоти
Наступний патент: Косметична композиція, крем для шкіри та маска для обличчя
Випадковий патент: Установка для посолу тушок тварин












