Ациловані нонадепсипептиди як похідні лізобактину
Номер патенту: 89800
Опубліковано: 10.03.2010
Автори: фон Нуссбаум Франц, Паульсен Хольгер, Свенструп Нільс, Бруннер Ніна, Анлауф Соня, Ендерманн Райнер, Раго Жак, Брюнінг Міхаель-Александер, Шіффер Гуідо, Шумахер Йоахім, Хартманн Ельке, Тельсер Йоахім, Фюрстнер Шанталь
Формула / Реферат
1. Сполука формули
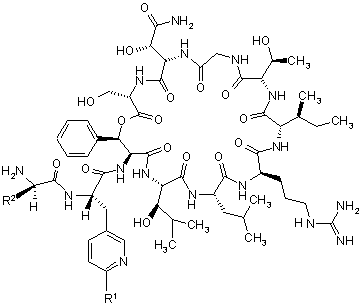 , (І)
, (І)
у якій
R1 означає водень, а
R2 означає 2,2-диметилбут-1-ил, 2-етил-2-метилбут-1-ил, 2,2-діетилбут-1-ил, 2,2-диметилпент-1-ил або триметилсилілметил, або
R1 означає трифторметил, а
R2 означає 2,2-диметилпроп-1-іл, 2,2-диметилбут-1-ил, 2-етил-2-метилбут-1-ил, 2,2-діетилбут-1-ил, 2,2-диметилпент-1-ил або триметилсилілметил,
або одна з її солей, один з її сольватів або один із сольватів її солей.
2. Сполука за п. 1, яка відрізняється тим, що
R1 означає водень, а
R2 означає 2,2-диметилбут-1-ил або триметилсилілметил, або
R1 означає трифторметил, а
R2 означає 2,2-диметилпроп-1-іл, 2,2-диметилбут-1-ил або триметилсилілметил.
3. Сполука за п. 1, яка відрізняється тим, що
R1 означає водень, а
R2 означає 2,2-диметилбут-1-ил, 2-етил-2-метилбут-1-ил, 2,2-діетилбут-1-ил або триметилсилілметил.
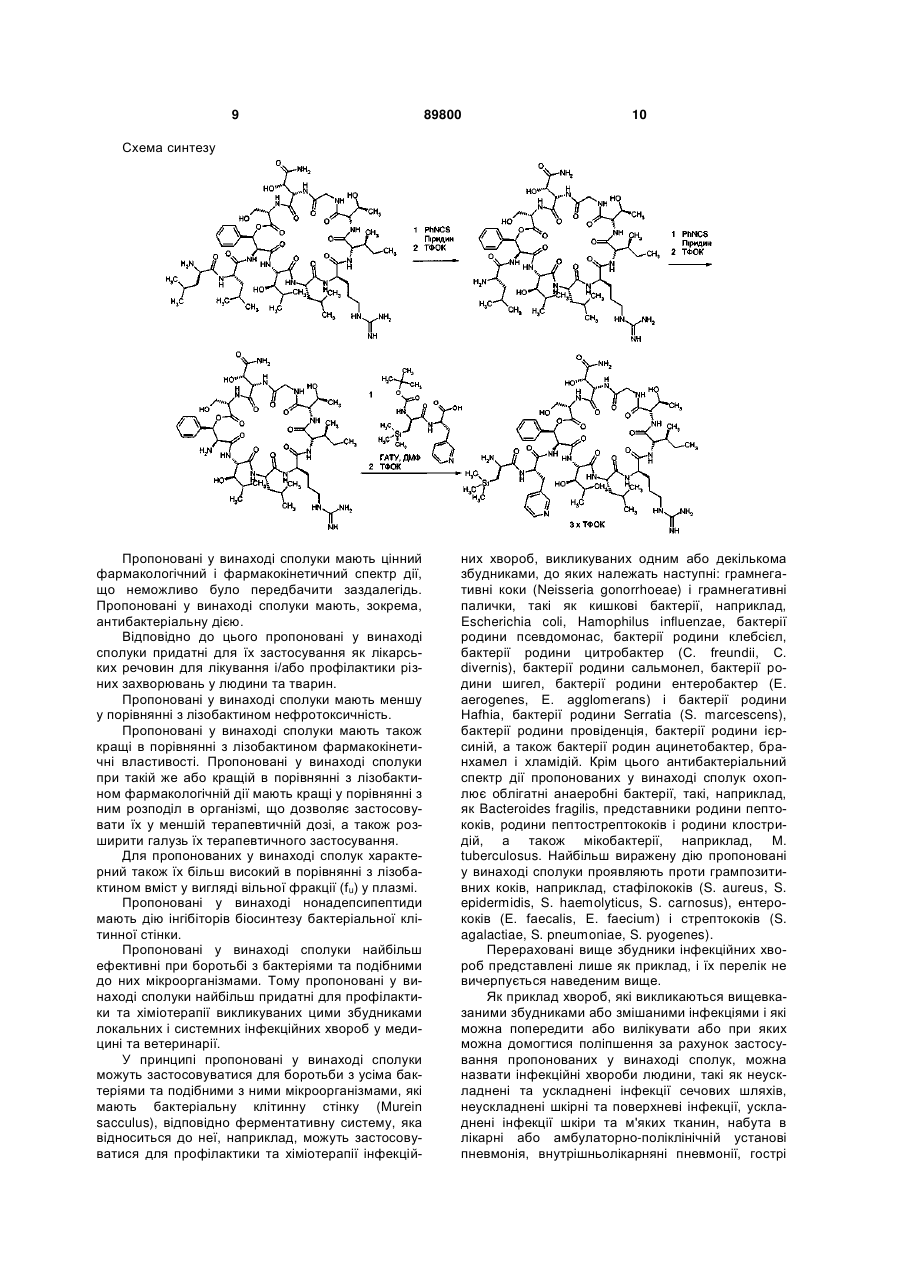
4. Сполука за п. 1, яка являє собою 3-(триметилсиліл)-D-аланіл-3-(піридин-3-іл)-L-аланіл-дез(1-D-лейцил-2-L-лейцил)лізобактин, який має наступну структуру
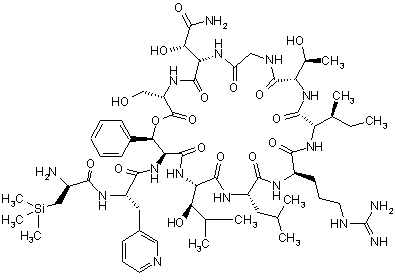 ,
,
або одна з її солей, один з її сольватів або один із сольватів її солей.
5. Спосіб одержання сполуки формули (І) за п. 1, який відрізняється тим, що сполуку формули
 (II)
(II)
піддають взаємодії із сполукою формули
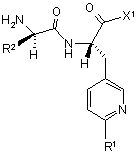 , (III)
, (III)
у якій
R1 і R2 мають зазначені для них у п. 1 значення, а
X1 означає галоген, переважно бром, хлор або фтор, або гідроксигрупу.
6. Сполука за будь-яким з пп. 1-4 для лікування і/або профілактики хвороб.
7. Застосування сполуки за будь-яким з пп. 1-4 для приготування лікарського засобу, призначеного для лікування і/або профілактики хвороб.
8. Застосування сполукиза будь-яким з пп. 1-4 для приготування лікарського засобу, призначеного для лікування і/або профілактики бактеріальних інфекцій.
9. Лікарський засіб, який містить сполуку за будь-яким з пп. 1-4 у сполученні з інертною, нетоксичною, фармацевтично прийнятною допоміжною речовиною.
10. Лікарський засіб за п. 9 для лікування і/або профілактики бактеріальних інфекцій.
11. Спосіб боротьби з бактеріальними інфекціями у людини та тварин при якому застосовують принаймні одну сполуку за будь-яким з пп. 1-4 або один лікарський засіб за п. 9, або приготовлений відповідно до п. 7 або 8 лікарський засіб в антибактеріально ефективній кількості.
Текст
1. Сполука формули C2 2 (19) 1 3 89800 1 O NH2 HO H N HO H N NH O O HO CH3 O NH CH3 O O O CH3 O O O NH O H2N HN N H HO CH3 H3 C N H CH NH2 3 HN CH3 NH (II) піддають взаємодії із сполукою формули R2 O O H2N H N H 4 X1 H N R1 , (III) у якій Даний винахід стосується нонадепсипептидів і способу їх одержання, а також їх застосування для приготування лікарських засобів, призначених для лікування і/або профілактики різних хвороб, насамперед інфекційних хвороб, які викликаються бактеріями. Клітинна стінка бактерій синтезується цілим рядом ферментів (біосинтез клітинної стінки) і відіграє важливу роль у виживанні, відповідно розмноженні мікроорганізмів. Структура цієї макромолекули, так само як і білки, що беруть участь у її синтезі, надійно законсервовані усередині бактерій. Біосинтез клітинної стінки з урахуванням його важливого значення та однаковості його протікання є ідеальною мішенню для знову розроблюваних антибіотиків (D. W. Green, The bacterial cell wall as a source of antibacterial targets, Expert Opin. Ther. Targets, 6, 2002, cc.1-19). Як типові приклади інгібіторів біосинтезу клітинної стінки бактерій можна назвати ванкоміцин і пеніциліни, в основі антибіотичної активності яких лежить зазначений механізм дії. Ці антибіотики протягом декількох десятиліть використовуються в лікарській практиці для лікування бактеріальних інфекцій, насамперед інфекцій, викликуваних грампозитивними збудниками. Однак у зв'язку з безперервною появою все нових і нових стійких до антибіотиків мікроорганізмів, наприклад, стійких до метициліну стафілококів, стійких до пеніциліну пневмококів і стійких до ванкоміцину ентерококів (F. Baquero, Gram-positive resistance: challenge for the development of new antibiotics, J. Antimicrob. Chemother., 39, 1997, доповн. A, cc.1-6; A.P. Johnson, D.M. Livermore, G.S. Tillotson, Antimicrobial susceptibility of Gram-positive bacteria: what's current, what's anticipated?, J. Hosp. Infect., 2 R і R мають зазначені для них у п.1 значення, а X1 означає галоген, переважно бром, хлор або фтор, або гідроксигрупу. 6. Сполука за будь-яким з пп.1-4 для лікування і/або профілактики хвороб. 7. Застосування сполуки за будь-яким з пп.1-4 для приготування лікарського засобу, призначеного для лікування і/або профілактики хвороб. 8. Застосування сполуки за будь-яким з пп.1-4 для приготування лікарського засобу, призначеного для лікування і/або профілактики бактеріальних інфекцій. 9. Лікарський засіб, який містить сполуку за будь-яким з пп.1-4 у сполученні з інертною, нетоксичною, фармацевтично прийнятною допоміжною речовиною. 10. Лікарський засіб за п.9 для лікування і/або профілактики бактеріальних інфекцій. 11. Спосіб боротьби з бактеріальними інфекціями у людини та тварин при якому застосовують принаймні одну сполуку за будь-яким з пп.1-4 або один лікарський засіб за п.9, або приготовлений відповідно до п.7 або 8 лікарський засіб в антибактеріально ефективній кількості. (49), 2001, доповн. A, cc.3-11), а також недавно вперше виявлених стійких до ванкоміцину стафілококів (В. Goldrick, First reported case of VRSA in the United States, Am. J. Nurs., 102, 2002, с.17), терапевтична ефективність від застосування подібних антибіотиків постійно знижується. У даному винаході пропонуються сполуки, який утворюють новий клас інгібіторів біосинтезу клітинної стінки бактерій і до яких на відміну від антибіотиків відомих класів у бактерій відсутня стійкість. В US 4754018 описана природна речовина лізобактин і деякі його похідні, які мають антибактеріальну дією. Виділення лізобактину та його антибактеріальна дія описані також в ЕР-А-196042 та JP 01-132600. У WO 04/099239 описані похідні лізобактину з антибактеріальною дією. Антибактеріальна дія лізобактину та катаносину А описана далі у O'Sullivan J. і ін., J. Antibiot, 41, 1988, cc.1740-1744, у Bonner D.P. і ін., J. Antibiot., 41, 1988, cc.1745-1751, у Shoji J. і ін., J. Antibiot, 41, 1988, cc.713-718, a також у Tymiak A.A. і ін., J. Org. Chem., 54, 1989, cc.1149-1157. В основу даного винаходу була покладена задача запропонувати інші сполуки з антибактеріальну дією, яка порівняна з антибактеріальною дією відомих речовин або переважає її, із кращою у порівнянні з відомими речовинами переносимістю, наприклад, зі зниженою нефротоксичністю, і кращим розподілом в організмі, тобто із кращими фармакокінетичними властивостями, що проявляються, наприклад, у підвищенні вільної фракції (fu), для лікування бактеріальних захворювань у людини та тварин. Об'єктом даного винаходу є сполуки формули 5 89800 (I) у якій 1 R означає водень, а 2 R означає 2,2-диметилбут-1-іл, 2-етил-2метилбут-1-іл, 2,2-діетилбут-1-іл, 2,2-диметилпент1-іл або триметилсилілметил або R1 означає трифторметил, а 2 R означає 2,2-диметилпроп-1-іл, 2,2диметилбут-1-іл, 2-етил-2-метилбут-1-іл, 2,2діетилбут-1-іл, 2,2-диметилпент-1-іл або триметилсилілметил, та їх солі, їх сольвати та сольвати їх солей. До пропонованих у винаході сполук належать сполуки формули (І) і їх солі, сольвати, сольвати солей і проліки, сполуки наведених нижче формул, які підпадають під формулу (І), і їх солі, сольвати, сольвати солей і проліки, а також сполуки зазначені нижче як приклади, які підпадають під формулу (І), і їх солі, сольвати, сольвати солей і проліки, за умови, що зазначені нижче сполуки, що підпадають під формулу (І), вже не являють собою солі, сольвати, сольвати солей і проліки. Пропоновані у винаході сполуки можуть залежно від їх структури існувати в стереоізомерних формах (енантіомерів, діастереомерів). Відповідно до цього в обсяг винаходу включені всі такі енантіомери або діастереомери та їх відповідні суміші. З подібних сумішей енантіомерів і/або діастереомерів індивідуальні стереоізомери можна виділяти відомими методами. Оскільки пропоновані у винаході сполуки можуть існувати у таутомерних формах, всі вони також включені в обсяг винаходу. До кращих солей згідно із даним винаходом належать фізіологічно нешкідливі солі пропонованих у винаході сполук. Однак в обсяг винаходу включені також солі, які як такі не придатні для фармацевтичного застосування, але можуть використатися, наприклад, для виділення або очищення пропонованих у винаході сполук, або змішані солі. Під змішаною сіллю згідно із даним винаходом мається на увазі адитивна сіль, утворена із двома або більше різними кислотами, відповідно основами, наприклад, трифторацетат-мезилат. До фізіологічно нешкідливих солей пропонованих у винаході сполук належать кислотноадитивні солі, утворені з мінеральними кислотами, карбоновими кислотами та сульфоновими кислотами, наприклад, солі, утворені з хлористоводневою кислотою, бромистоводневою кислотою, сірчаною кислотою, фосфорною кислотою, метансульфоновою кислотою, етансульфоновою 6 кислотою, толуолсульфоновою кислотою, бензолсульфоновою кислотою, нафталіндисульфоновою кислотою, оцтової кислотою, трифтороцтовою кислотою, пропіоновою кислотою, молочною кислотою, винною кислотою, яблучною кислотою, лимонною кислотою, фумаровою кислотою, малеїновою кислотою та бензойною кислотою. До фізіологічно нешкідливих солей пропонованих у винаході сполук належать також утворені зі звичайними основами солі, як кращі приклади яких можна назвати солі, утворені з лужними металами (наприклад, натрієві та калієві солі), солі, утворені із лужноземельними металами (наприклад, кальцієві та магнієві солі), і амонієві солі, одержані взаємодією з аміаком або органічними амінами з 1-16 С-атомами, як кращі приклади яких можна назвати етиламін, діетиламін, триетиламін, етилдіізопропіламін, моноетаноламін, діетаноламін, триетаноламін, дициклогексиламін, диметиламіноетанол, прокаїн, дибензиламін, Nметилморфолін, аргінін, лізин, етилендіамін і Nметилпіперидин. Сольватами згідно із даним винаходом називають ті форми пропонованих у винаході сполук, які у твердому або рідкому стані утворюють комплекс у результаті координаційної реакції з молекулами розчинника. Гідрати є окремою формою сольватів, що утворюються в результаті координаційної реакції з водою. Кращі сполуки формули (І), у якій R1 означає водень, а R2 означає 2,2-диметилбут-1-іл або триметилсилілметил або R1 означає трифторметил, а R2 означає 2,2-диметилпроп-1-іл, 2,2диметилбут-1-іл або триметилсилілметил, і їх солі, їх сольвати та сольвати їх солей. Кращі також сполуки формули (І), у якій 1 R означає водень, а R2 означає 2,2-диметилбут-1-іл, 2-етил-2метилбут-1-іл, 2,2-діетилбут-1-іл або триметилсилілметил, і їх солі, їх сольвати та сольвати їх солей. Кращі далі сполуки формули (І), у якій 1 R означає водень, а R2 означає 2,2-диметилбут-1-іл, 2-етил-2метилбут-1-іл, 2,2-діетилбут-1-іл, 2,2-диметилпент1-іл або триметилсилілметил. Найбільш кращою сполукою є 3(триметилсиліл)-D-аланіл-3-(піридин-3-іл)-Lаланілдез(1-D-лейцил-2-L-лейцил)лізобактин 7 89800 або одна з його солей, один з його сольватів або один із сольватів його солей. Об'єктом винаходу є далі спосіб одержання сполук формули (І), який полягає у тому, що сполуку формули (II) піддають взаємодії із сполуками формули (III) у якій R1 і R2 мають зазначені вище значення, а X означає галоген, переважно бром, хлор або фтор, або гідроксигрупу. Якщо X1 означає галоген, то зазначену взаємодію в загальному випадку проводять в інертних розчинниках, при необхідності у присутності основи, переважно при температурі в інтервалі від -30 до 50°С і при нормальному тиску. Як приклад інертних розчинників можна назвати тетрагідрофуран, метиленхлорид, піридин, діоксан або диметилформамід, при цьому краще використовувати метиленхлорид або диметилформамід. Як приклад основ можна назвати триетиламін, діізопропілетиламін або N-метилморфолін, при цьому краще використовувати діізопропілетиламін. 1 Якщо X означає гідроксигрупу, то вищевказану взаємодію в загальному випадку проводять в інертних розчинниках у присутності дегідратуючого агента та при необхідності в присутності основи, переважно при температурі в інтервалі від -30 до 50°С і при нормальному тиску. Як приклад інертних розчинників можна назвати галогеновані вуглеводні, такі як дихлорметан або трихлорметан, і вуглеводні, такі як бензол, нітрометан, діоксан, диметилформамід або ацетонітрил. Так само можливе використання й сумішей розчинників. Найбільш краще використовувати як розчинник дихлорметан або диметилформамід. 8 Для застосування як дегідратуючих агентів придатні, наприклад, карбодііміди, такі як Ν,Ν'діетил-, Ν,Ν'-дипропіл-, Ν,Ν'-діізопропіл-, Ν,Ν'дициклогексилкарбодіімід, гідрохлорид N-(3диметиламіноізопропіл)-N'-етилкарбодііміду (ЕДК), N-циклогексилкарбодіімід-N-пропілоксиметилполістирол (ПС-карбодіімід), карбонільні сполуки, такі як карбонілдіімідазол, 1,2-оксазолієві сполуки, такі як 2-етил-5-феніл-1,2-оксазолій-3-сульфат або 2-трет-бутил-5-метилізоксазолійперхлорат, ациламіносполуки, такі як 2-етоксі-1-етоксикарбоніл1,2-дигідрохінолін, або пропанфосфоновий ангідрид, ізобутилхлорформіат, бiс-(2-оксо-3оксазолідиніл)фосфорилхлорид, гексафторфосфат бензотриазолілокситри(диметиламіно)фосфонію, гексафторфосфат О(бензотриазол-1-іл)-N,N,N',N'-тетраметилуронію (ГБТУ), тетрафторборат 2-(2-оксо-1-(2Н)-піридил)1,1,3,3-тетраметилуронію (ТФТУ), гексафторфосфат О-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронію (ГАТУ), 1-гідроксибензотриазол (ГОБТ), гексафторфосфат бензотриазол-1-ілокситрис-(диметиламіно)фосфонію (БОФ), Nгідроксисукцинімід або їх суміші з основами. Як приклад основ можна назвати карбонати лужних металів, такі, наприклад, як карбонат натрію або калію, або гідрокарбонати лужних металів, або органічні основи, такі як триалкіламіни, наприклад, триетиламін, N-метилморфолін, Nметилпіперидин, 4-диметиламінопіридин або діізопропілетиламін. В реакції конденсації краще використовувати ГАТУ або ЕДК у присутності ГОБТ. У деяких випадках сполуки формули (III) можуть нести захисні групи, і тому в подібних випадках після завершенні взаємодії сполуки формули (II) із сполуками формули (III) такі захисні групи відщеплюють обробкою трифтороцтової кислотою згідно з відомими методиками. Вільну основу із солей сполук формули (І) можна одержувати, наприклад, додаванням основи з наступною екстракцією, осадженням або хроматографічним відділенням вільної сполуки згідно з відомими методиками, насамперед за рахунок застосування зв'язаних з полімером основ, наприклад, зв'язаного з полімером гідрокарбонату. Ще одним об'єктом винаходу є спосіб одержання сполук формули (І) або їх сольватів, який полягає в тому, що солі таких сполук або сольвати солей таких сполук шляхом додавання основи переводять у вільні сполуки. Сполуки формули (II) можна синтезувати з лізобактину (приклад 1А) шляхом подвійної деградації за Едманом за описаною в експериментальній частині в прикладі 2А методикою. Сполуки формули (III) відомі або їх можна синтезувати згідно з відомими методиками з відповідних едуктів. Одержання пропонованих у винаході сполук можна пояснити за допомогою наведеної нижче схеми синтезу. 9 89800 10 Схема синтезу Пропоновані у винаході сполуки мають цінний фармакологічний і фармакокінетичний спектр дії, що неможливо було передбачити заздалегідь. Пропоновані у винаході сполуки мають, зокрема, антибактеріальну дією. Відповідно до цього пропоновані у винаході сполуки придатні для їх застосування як лікарських речовин для лікування і/або профілактики різних захворювань у людини та тварин. Пропоновані у винаході сполуки мають меншу у порівнянні з лізобактином нефротоксичність. Пропоновані у винаході сполуки мають також кращі в порівнянні з лізобактином фармакокінетичні властивості. Пропоновані у винаході сполуки при такій же або кращій в порівнянні з лізобактином фармакологічній дії мають кращі у порівнянні з ним розподіл в організмі, що дозволяє застосовувати їх у меншій терапевтичній дозі, а також розширити галузь їх терапевтичного застосування. Для пропонованих у винаході сполук характерний також їх більш високий в порівнянні з лізобактином вміст у вигляді вільної фракції (f u) у плазмі. Пропоновані у винаході нонадепсипептиди мають дію інгібіторів біосинтезу бактеріальної клітинної стінки. Пропоновані у винаході сполуки найбільш ефективні при боротьбі з бактеріями та подібними до них мікроорганізмами. Тому пропоновані у винаході сполуки найбільш придатні для профілактики та хіміотерапії викликуваних цими збудниками локальних і системних інфекційних хвороб у медицині та ветеринарії. У принципі пропоновані у винаході сполуки можуть застосовуватися для боротьби з усіма бактеріями та подібними з ними мікроорганізмами, які мають бактеріальну клітинну стінку (Murein sacculus), відповідно ферментативну систему, яка відноситься до неї, наприклад, можуть застосовуватися для профілактики та хіміотерапії інфекцій них хвороб, викликуваних одним або декількома збудниками, до яких належать наступні: грамнегативні коки (Neisseria gonorrhoeae) і грамнегативні палички, такі як кишкові бактерії, наприклад, Escherichia coli, Hamophilus influenzae, бактерії родини псевдомонас, бактерії родини клебсієл, бактерії родини цитробактер (С. freundii, С. divernis), бактерії родини сальмонел, бактерії родини шигел, бактерії родини ентеробактер (Е. aerogenes, Ε. agglomerans) і бактерії родини Hafhia, бактерії родини Serratia (S. marcescens), бактерії родини провіденція, бактерії родини ієрсиній, а також бактерії родин ацинетобактер, бранхамел і хламідій. Крім цього антибактеріальний спектр дії пропонованих у винаході сполук охоплює облігатні анаеробні бактерії, такі, наприклад, як Bacteroides fragilis, представники родини пептококів, родини пептострептококів і родини клостридій, а також мікобактерії, наприклад, М. tuberculosus. Найбільш виражену дію пропоновані у винаході сполуки проявляють проти грампозитивних коків, наприклад, стафілококів (S. aureus, S. epidermidis, S. haemolyticus, S. carnosus), ентерококів (Ε. faecalis, Ε. faecium) і стрептококів (S. agalactiae, S. pneumoniae, S. pyogenes). Перераховані вище збудники інфекційних хвороб представлені лише як приклад, і їх перелік не вичерпується наведеним вище. Як приклад хвороб, які викликаються вищевказаними збудниками або змішаними інфекціями і які можна попередити або вилікувати або при яких можна домогтися поліпшення за рахунок застосування пропонованих у винаході сполук, можна назвати інфекційні хвороби людини, такі як неускладнені та ускладнені інфекції сечових шляхів, неускладнені шкірні та поверхневі інфекції, ускладнені інфекції шкіри та м'яких тканин, набута в лікарні або амбулаторно-поліклінічній установі пневмонія, внутрішньолікарняні пневмонії, гострі 11 загострення та вторинні бактеріальні інфекції при хронічному бронхіті, гострий середній отит, гострий синусіт, стрептококовий фарингіт, бактеріальний менінгіт, неускладнені гонококові та негонококові уретрїт/цервіцит, гострий простатит, ендокардит, неускладнені й ускладнені внутрішньочеревні інфекції, гінекологічні інфекції, запалення у ділянці таза, бактеріальний вагіноз, гострий і хронічний остеомієліт, гострий бактеріальний артрит, гранулоцитопенія (нейротропенія) у пацієнтів з пропасницею, для лікування яких застосовується емпірична терапія, а також бактеріемії, викликувані MRSA-штамами інфекції, гостра інфекційна діарея, викликувані бактерією Helicobacter pylori інфекції, одонтогенні інфекції, офтальмологічні інфекції, післяопераційні інфекції (включаючи перипроктальний абсцес, раневі інфекції, інфекції жовчних шляхів, мастит і гострий апендицит), кістозний фіброз і бронхоектазія. Пропоновані у винаході сполуки можна використовувати не тільки для профілактики або лікування інфекційних хвороб людини, але й при бактеріальних інфекціях у інших видів. Як приклади при цьому можна назвати діарею, ентеротоксемію, сепсис, дизентерію, сальмонельоз, синдром метрита-мастита-агалактита та мастит у свиней, діарею, сепсис, бронхопневмонію, сальмонельоз, пастерельоез і інфекції статевих органів у жуйних тварин (великої рогатої худоби, овець, кіз), бронхопневмонії, суглоболам, пуерперальні інфекції та сальмонельоз у коней, бронхопневмонію, діарею, дерматит, отит, інфекції сечових шляхів і простатит у собак і кішок, викликувані Е. соlі інфекції, хронічні захворювання дихальних шляхів, сальмонельоз, пастерельоз і пситакоз у домашніх птахів (курей, індичок, перепелів, голубів, декоративних птахів і інших). Пропоновані у винаході сполуки можуть також використовуватися для лікування бактеріальних захворювань промислових риб і декоративних рибок при їх розведенні та утриманні, і в цьому випадку антибактеріальний спектр дії пропонованих у винаході сполук крім вищевказаних збудників охоплює й інших збудників, таких, наприклад, як бактерії родини пастерел, бактерії родини бруцел, бактерії родини кампілобактер, бактерії родини листерій, бактерії родини еризипілотрикс, корінебактерії, бактерії родини борелій, бактерії родини трепонем, бактерії родини нокардій, бактерії родини рикетсій та бактерії родини йєрсиній. Наступним об'єктом даного винаходу є застосування пропонованих у ньому сполук для лікування і/або профілактики захворювань, насамперед бактеріальних інфекційних хвороб. Наступним об'єктом даного винаходу є застосування пропонованих у ньому сполук для лікування і/або профілактики захворювань, насамперед зазначених вище захворювань. Наступним об'єктом даного винаходу є застосування пропонованих у ньому сполук для приготування лікарського засобу, призначеного для лікування і/або профілактики захворювань, насамперед зазначених вище захворювань. Пропоновані у винаході сполуки краще застосовувати для приготування лікарських засобів, 89800 12 придатних для профілактики і/або лікування бактеріальних захворювань. Наступним об'єктом даного винаходу є спосіб лікування і/або профілактики захворювань, насамперед зазначених вище захворювань, із застосуванням пропонованих у винаході сполук в антибактеріально ефективній кількості. Наступним об'єктом даного винаходу є лікарські засоби, які містять принаймні одну пропоновану у винаході сполуку та принаймні одну або декілька інших діючих речовин і призначені насамперед для лікування і/або профілактики зазначених вище захворювань. До кращих діючих речовин, які можуть використовуватися в сполученні із пропонованими у винаході сполуками, належать сполуки з антибактеріальною дією, які мають спектр дії, відмінний від спектра дії пропонованих у винаході сполук, насамперед спектр дії, що доповнює його, і/або при застосуванні яких у комбінації із пропонованими у винаході сполуками проявляється синергетичний ефект. Пропоновані у винаході сполуки можуть мати системну і/або місцеву дію. Для цього їх можна застосовувати або вводити в організм відповідним способом, наприклад, перорально, парентерально, через легені, назально, під'язиково, лінгвально, трансбукально, ректально, нашкірно, черезшкірно, кон'юнктивально, у вуха або у вигляді імплантату, відповідно стенту. Для подібного застосування пропоновані у винаході сполуки можна використовувати в складі відповідних лікарських форм. Для перорального застосування придатні діючі відповідно до відомих з рівня техніки принципів лікарські форми зі швидким і/або модифікованим вивільненням пропонованих у винаході сполук, що містяться в таких лікарських формах у кристалічному і/або аморфному і/або розчиненому вигляді, наприклад, таблетки (таблетки без покриття або з покриттям, наприклад, покриттями, які стійкі до дії шлункового соку або починають розчинятися із затримкою або нерозчинними, що регулюють або контролюють вивільнення пропонованих у винаході сполук), таблетки, які швидко розпадаються в порожнині рота або плівки/облатки, плівки/ліофілізати, капсули (наприклад, твердо- або м'якожелатинові капсули), драже, грануляти, пелети, порошки, емульсії, суспензії, аерозолі або розчини. Парентеральне введення пропонованих у винаході сполук в організм або може відбуватися, минаючи стадію їх резорбції (наприклад, внутрішньовенно, внутрішньоартеріально, внутрішньосерцево, інтраспінально або внутрішньолюмбально), або може відбуватися, включаючи стадію резорбції (наприклад, внутрішньом'язово, підшкірно, внутрішньошкірно, черезшкірно або внутрішньочеревинно). Для парентерального застосування як лікарські форми придатні крім іншого склади для ін'єкцій та інфузій у вигляді розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Для застосування пропонованих у винаході сполук іншими способами придатні, наприклад, інгаляційні лікарські форми (зокрема, для порошкових інгаляторів, небулайзерів), назальні краплі, 13 розчини та спреї, таблетки для лінгвального, під'язикового або трансбукального застосування, плівки/облатки або капсули, супозиторії, вушні або очні препарати, вагінальні капсули, водні суспензії (примочки, бовтанки), ліпофільні суспензії, мазі, креми, трансдермальні терапевтичні системи (наприклад, пластири), емульсії типу "молочко", пасти, піни, присипки, імплантати або стенти. Пропоновані у винаході сполуки можна переводити або переробляти в зазначені вище лікарські форми (форми застосування). Для цього пропоновані у винаході сполуки можна за відомою технологією змішувати з інертними, нетоксичними, фармацевтично прийнятними допоміжними речовинами. До таких допоміжних речовин належать, зокрема, носії (наприклад, мікрокристалічна целюлоза, лактоза, маніт), розчинники (наприклад, рідкі поліетиленгліколі), емульгатори та диспергатори або змочувачі (наприклад, додецилсульфат натрію, поліоксисорбітанолеат), сполучні (наприклад, полівінілпіролідон), синтетичні та природні полімери (наприклад, альбумін), стабілізатори (наприклад, антиокислювачі, такі як аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як оксиди заліза) і поліпшувачі смаку і/або запаху. Наступним об'єктом даного винаходу є лікарські засоби, які містять принаймні одну пропоновану у винаході сполуку, звичайно разом з одним або декількома інертними, нетоксичними, фармацевтично прийнятними допоміжними речовинами, а також застосування таких лікарських засобів у вищевказаних цілях. Для досягнення необхідного ефекту пропоновані у винаході сполуки краще застосовувати в дозі, яка при внутрішньовенному введенні станорозрах. ВНІ Вос шир. d ГХ DCI ДМАП ДМСО ДМФ ЕДК ЕДКхНСІ ΕΙ ESI ESIneg ESIpos виявл. год ГАТУ PXBT BP PX-MC m m MALDI МІК 89800 14 вить приблизно від 0,001 до 100мг/кг ваги тіла, переважно приблизно від 0,1 до 10мг/кг ваги тіла, а при пероральному введенні становить приблизно від 0,01 до 50мг/кг ваги тіла, переважно від 0,5 до 10мг/кг ваги тіла. Проте в деяких випадках може знадобитися застосовувати пропоновані у винаході сполуки в дозах, які відрізняються в той або інший бік від зазначених вище кількостей, а саме: залежно від ваги тіла, шляху введення діючої речовини в організм, індивідуальної реакції на діючу речовину, типу лікарської форми та моменту часу, у який застосовують діючу речовину, відповідно інтервалу часу, через який застосовують діючу речовину. Так, зокрема, у деяких випадках цілком може виявитися достатнім застосовувати пропоновані у винаході сполуки у дозі, яка менша зазначеної вище мінімальної кількості, тоді як в інших випадках пропоновані у винаході сполуки може знадобитися застосовувати в дозі, яка перевищує вищевказану верхню межу. При застосуванні пропонованих у винаході сполук у порівняно високому дозуванні може виявитися доцільним дробити добову дозу на декілька більш дрібних разових доз і розподілити їх прийом на всю добу. У наведені нижче описах дослідів, експериментів і досліджень і в прикладах виражені у відсотках дані являють собою, якщо не зазначене інше, масові відсотки (мас. %), а виражені в частинах дані являють собою масові частини. Співвідношення між розчинниками, ступінь розведення та дані про концентрації рідинно-рідинних розчинів у кожному випадку належать до об'єму. А. Приклади Скорочення розраховано середовище із серцево-мозковим екстрактом ("Brain Heart Infusion") трет-бутилоксикарбоніл широкий сигнал (у ЯМР-спектрах) дублет (у ЯМР-спектрах) газова хроматографія пряма хімічна іонізація ("Direct Chemical Ionization") (при МС) 4-N,N-диметиламінопіридин диметилсульфоксид Ν,Ν-диметилформамід 1-етил-3-(3-диметиламінопропіл)карбодіімід (також ЕДКІ) пдрохлорид 1-етил-3-(3-диметиламінопропіл)карбодііміду іонізація електронним ударом ("Electron Impact Ionization") (при MC) іонізація електроспреєм ("Electrospray Ionization") (при MC) реєстрація в режимі визначення негативно заряджених іонів (аніонів) при масспектроскопії з ESI-іонізацією реєстрація в режимі визначення позитивно заряджених іонів (аніонів) при масспектроскопії з ESI-іонізацією виявлено година(-и) гексафторфосфат О-(7-азабензотриазол-1-іл)-N,N,N',N'-тетраметилуронію рідинна хроматографія високого тиску або високої роздільної здатністю висока роздільна здатність мас-спектроскопія в сполученні з рідинною хроматографією середній ("middle") (в УФ- і N-спектрах) мультиплет (у ЯМР-спектрах) матрична лазерна десорбційна іонізація ("Matrix-Assisted Laser Desorption/Ionization") мінімальна інгібувальна концентрація 15 xв MRSA MC NCCLS ЯМР а.ч. Pd Pd-C кількісн. ОФ-РХВТ КТ Rt s s ТФОК ТГФ ЧП УФ вид. VRSA w Z, Cbz 89800 16 хвилина(-и) стійкий до метициліну штам Staphylococcus aureus мас-спектроскопія Національний комітет з клінічних і лабораторних стандартів (США) ("National Committee for Clinical Laboratoy Standards") ядерний магнітний резонанс аналітично чистий паладій паладій на вугіллі кількісний вихід РХВТ з оберненою фазою кімнатна температура час утримання (при РХВТ) сильний ("strong") (в УФ- і N-спектрах) синглет (у ЯМР-спектрах) трифтороцтова кислота тетрагідрофуран час прольоту (часопролітна МС) ультрафіолетове випромінювання видиме випромінювання стійкий до ванкоміцину штам Stapylococcus aureus слабкий ("weak") (в УФ- і N-спектрах) бензилоксикарбоніл Загальні методи ГХ-МС РХ-МС, МС-ВР, РХВТ та гель-хроматографії Метод 1 (ЧП-МС-ВР): ЧП-МС-ВР(ЕSІ+)-спектри реєструють за допомогою приладу Micromass LCT (напруга на капілярі: 3,2кВ, напруга на конусі: 42В, температура джерела: 120°С, температура десольвації: 280°С). Для подачі зразків використовують шприц-помпу (фірма Harvard Apparatus). Стандартом є лейцин-енкефалін (Tyr-Gly-Gly-Phe-Leu). Метод 2 (препаративна РХВТ): Прилад: Gilson Abimed HPLC; УФ-детектор на 210нм; система з двох помпу; колонка: Waters SymmetryPrep™ C18, 7мкм, 300x19мм; елюент А: 0,2% трифтороцтової кислоти у воді, елюент Б: ацетонітрил; швидкість потоку: 25мл/хв.; температура колонки: КТ; 0-а хвилина 20% елюенту Б, збільшення концентрації елюенту Б з 0-ї по 10-у до 70%, зменшення концентрації елюенту Б з 10-ї по 10,1-у хвилину до 20%, по 15-у хвилину 20% елюенту Б. Метод 3 (гель-хроматографія на сорбенті Sephadex LH-20): Гель-хроматографію проводять без тиску на сорбенті Sephadex LH-20 (фірма Pharmacia). Після реєстрації УФ-активності (УФдетектор на 254нм, фірма Knauer) фракціонують (колектор фракцій ISCO Foxy 200). Розміри колонки: 32x7см (для інтервалу концентрацій 1000100мкмоль), 30x4см (для інтервалу концентрацій 100-10мкмоль) та 25x2см (для інтервалу концентрацій 10-1мкмоль). Для інтервалу концентрацій от 1 до 11ммоль використовують колонку размером 80x30см. У цьому випадку фракції збирають вручну без використання попередньо включеного УФдетектора. Співвіднесення фракцій здійснюють за допомогою РХВТ (метод 9). Метод 4 (препаративна РХВТ, сорбент Kromasil, оцтова кислота): Прилад: Gilson Abimed HPLC; УФ-детектор на 210нм; система з подвійною помпою; колонка: Kromasil-100A C18, 5мкм, 250x20мм; швидкість потоку: 25мл/хв.; елюент А: вода/0,25-0,5% оцтової кислоти, елюент Б: ацетонітрил; градієнт: з 0-ї по 3-ю хвилину 5% елюенту Б, з 3-ї по 30-у хвилину 5-100% елюенту Б, з 30-ї по 38-у хвилину 100% елюенту Б, на завершення регенерація хроматографічної колонки. Метод 5 (РХ-МС): Прилад: Micromass Quattro LCZ у сполученні з HPLC Agilent Serie 1100; колонка: Phenomenex Synergi 2μ Hydro-RP Mercury, 20x4мм; елюент А: 1л води+ 0,5мл 50%-вої мурашиної кислоти, елюент Б: 1л ацетонітрилу+ 0,5мл 50%-вої мурашиної кислоти; градієнт: з 0,0-ї хвилини 90% елюенту А з 2,5-ї хвилини 30% елюенту А з 3,0-ї хвилини 5% елюенту А з 4,5-ї хвилини 5% елюенту А; швидкість потоку: з 0,0-ї хвилини 1мл/хв., з 2,5-ї/з 3,0-ї/з 4,5-ї хвилини 2мл/хв.; піч: 50°С; УФ-виявлення на 208-400нм. Метод 6 (РХ-МС): Тип приладу для МС: Micromass ZQ; тип приладу для РХВТ: Waters Alliance 2795; колонка: Phenomenex Synergi 2μ Hydro-RP Mercury, 20x4мм; елюент А: 1л води+ 0,5мл 50%-вої мурашиної кислоти, елюент Б: 1л ацетонітрилу+ 0,5мл 50%-вої мурашиної кислоти; градієнт: з 0,0-ї хвилини 90% елюенту А з 2,5-ї хвилини 30% елюенту А з 3,0-ї хвилини 5% елюенту А з 4,5-ї хвилини 5% елюенту А; швидкість потоку: з 0,0-ї хвилини 1мл/хв., з 2,5-ї/з 3,0-ї/з 4,5-ї хвилини 2мл/хв.; піч: 50°С; УФ-виявлення на 210нм. Метод 7 (РХ-МС): Тип приладу для МС: Micromass ZQ; тип приладу для РХВТ: HP 1100 Series; УФ-детектор з діодною матрицею (УФДДМ); колонка: Phenomenex Synergi 2μ Hydro-RP Mercury, 20x4мм; елюент А: 1л води+ 0,5мл 50%вої мурашиної кислоти, елюент Б: 1л ацетонітрилу+ 0,5мл 50%-вої мурашиної кислоти; градієнт: з 0,0-ї хвилини 90% елюенту А з 2,5-ї хвилини 30% елюенту А з 3,0-ї хвилини 5% елюенту А з 4,5-ї хвилини 5% елюенту А; швидкість потоку: з 0,0-ї хвилини 1мл/хв., з 2,5-ї/з 3,0-ї/з 4,5-ї хвилини 2мл/хв.; піч: 50°С; УФ-виявлення на 210нм. Метод 8 (аналітична РХВТ): Тип приладу для РХВТ: HP 1050 Series; УФ-ДДМ: UVDAD 1100 Series; колонка: Kromasil C18, 60x2мм, 3,5мкм; 17 елюент А: вода/0,5% перхлорної кислоти, елюент Б: ацетонітрил; градієнт: з 0-ї по 0,5-у хвилину 2% елюенту Б, з 0,5-ї по 4,5-у хвилину від 2 до 90% елюенту Б, з 4,5-ї по 9,0-у хвилину 90% елюенту Б, з 9,0-ї по 9,2-у хвилину від 90 до 2% елюенту Б, з 9,2-ї по 10,0-у хвилину 2% елюенту Б; швидкість потоку: 0,75мл/хв., піч: 30°С, УФ-виявлення на 210нм. Метод 9 (аналітична РХВТ, сорбент Agilent Zorbax C8): Прилад: Agilent 1100 у сполученні з ДЦМ (G1315B), подвоєна помпа (G1312A), автоматичний пробовідбірник (G1313A), дегазатор розчинника (G1379A) та термостат хроматографічної колонки (G1316A); колонка: Agilent Zorbax Eclipse XDB-C8, 4,6 150 5мм; елюент А: 0,05% 70%-вої перхлорної кислоти у воді; елюент Б: ацетонітрил; градієнт: з 0-ї по 1-у хвилину 10% елюенту Б, збільшення концентрації елюенту Б, з 4-ї по 5-у хвилину 90% елюенту Б, зменшення концентрації елюенту Б, по 5,5-у хвилину 10% елюенту Б; швидкість потоку: 2,00мл/хв.; температура колонки: 30°С. Метод 10 (гель-хроматографія на сорбенті Sephadex LH-20): Гель-хроматографію проводять без тиску на сорбенті Sephadex LH-20 (фірма Pharmacia). Після реєстрації УФ-активності (УФдетектор на 254нм, фірма Knauer) фракціонують (колектор фракцій ISCO Foxy 200). Розміри колонки: 32 7см (для інтервалу концентрацій 1000100мкмоль), 30x4см (для інтервалу концентрацій 100-10мкмоль) та 25x2см (для інтервалу концентрацій 10-1мкмоль). Метод 11 (препаративна РХВТ, сорбент Symmetry): Прилад: Gilson Abimed HPLC; система з подвійною помпою; колонка: SymmetryPrep™ С18, фірма Waters, 7мкм, 300x19мм; елюент А: вода/0,2% трифтороцтової кислоти, елюент Б: ацетонітрил; градієнт: з 0-ї по 10-у хвилину збільшення концентрації елюенту Б з 15 до 65%, на завершення регенерація хроматографічної колонки; швидкість потоку: 25мл/хв.; УФ-виявлення на 210нм. Метод 12 (препаративна РХВТ, сорбент Kromasil): Прилад: Gilson Abimed HPLC; система з подвійною помпою; колонка: Kromasil C18, 5мкм, 100 А, 250x20мм; елюент А: 0,05% трифтороцтової кислоти у воді, елюент Б: 0,05% трифтороцтової кислоти в ацетонітрилі; градієнт: з 0-ї по 3-у хвилину 10% елюенту Б, збільшення концентрації елюенту Б, з 30-ї по 38-у хвилину 90% елюенту Б, з 38-ї по 45-у хвилину 10% елюенту Б; швидкість потоку: 20мл/хв.; УФ-виявлення на 210нм. Метод 13 (препаративна РХВТ, сорбент Waters Symmetry): Прилад: Gilson Abimed HPLC; система з подвійною помпою; колонка: Waters SymmetryPrep™ C18, 7мкм, 300 19мм; елюент А: 0,05% трифтороцтової кислоти у воді, елюент Б: 0,05% трифтороцтової кислоти в ацетонітрилі; градієнт: з 0-ї по 3-у хвилину 10% елюенту Б, збільшення концентрації елюенту Б, з 30-ї по 38-у хвилину 90% елюенту Б, з 38-ї по 45-у хвилину 10% елюенту Б; швидкість потоку: 20мл/хв.; УФвиявлення на 210нм. Метод 14 (препаративна РХВТ): Прилад: Gilson Abimed HPLC; система з подвійною помпою; 89800 18 колонка: Waters SymmetryPrep™ C18, 7мкм, 300 19мм; елюент А: вода/0,2% трифтороцтової кислоти, елюент Б: ацетонітрил; градієнт: з 0-ї по 10-у хвилину збільшення концентрації елюенту Б з 25 до 65%, на закінчення регенерація хроматографічної колонки; швидкість потоку: 25мл/хв.; УФвиявлення на 210нм. Метод 15 (хіральна РХВТ, сорбент Daicel Chiralpak): Прилад: Agilent 1100 HPLC; колонка: Daicel Chiralpak AD-H, 5мкм, 250 20мм; ізократично: 75% ізогексану, 25% 2-пропанолу з 0,2% трифтороцтової кислоти та 1% води; швидкість потоку: 1,0мл/хв.; піч: 25°С; УФ-детектор на 212нм. Метод 16 (препаративна РХВТ): Прилад: Gilson Abimed HPLC; система з подвійною помпою; колонка: YMC ODS-AQ, 5мкм, 250x30мм; елюент А: 0,05% трифтороцтової кислоти у воді, елюент Б: 0,05% трифтороцтової кислоти в ацетонітрилі; градієнт: з 0-ї по 3-у хвилину 10% елюенту Б, збільшення концентрації елюенту Б, з 30-ї по 38-у хвилину 90% елюенту Б, з 38-ї по 45-у хвилину 10% елюенту Б; швидкість потоку: 50мл/хв.; УФдетектор на 210нм. Метод 17 (ГХ-МС): Прилад: Micromass GCT, GC6890; колонка: Restek RTX-35MS, 30м на 250мкм на 0,25мкм; градієнт: 60°С (витримка протягом 0,30хв.), 50°С/хв. 120°С, 16°С/хв. 250°С, 30°С/хв. 300°С (витримка протягом 1,7хв.); постійна швидкість потоку з гелієм: 0,88мл/хв.; піч: 60°С; вхідна температура: 250°С. Метод 18 (РХВТ): Тип приладу для РХВТ: HP 1100 Series; колонка з ЕА-LLV: Zorbax Eclipse XBDC8 (фірма Agilent), 150 4,6мм, 5мкм; елюент А: 5мл НСІО2 на л води, елюент Б: ацетонітрил; градієнт: з 0-ї по 1-у хвилину 10% елюенту Б, з 1-й по 4-у хвилину збільшення концентрації елюенту Б з 10 до 90%, з 4-ї по 5-у хвилину 90% елюенту Б; швидкість потоку: 2,0мл/хв.; піч: 30°С; УФвиявлення на 210 та 254нм. Метод 19 (РХВТ): Колонка: Kromasil RP-18, 60x2мм, 3,5мкм; елюент А: 5мл НСlO4 на л води, елюент Б: ацетонітрил; градієнт: з 0-ї хвилини 2% елюенту Б, з 0,5-ї хвилини 2% елюенту Б, з 4,5-ї хвилини 90% елюенту Б, по 9-у хвилину 90% елюенту Б; швидкість потоку: 0,75мл/хв.; піч: 30°С; УФвиявлення на 210нм. Метод 20 (РХВТ): Колонка: Kromasil RP-18, 250x4мм, 5мкм; елюент А: 5мл НСIO4 на л води, елюент Б: ацетонітрил; градієнт: з 0-ї хвилини 5% елюенту Б, з 10-ї хвилини 95% елюенту Б; швидкість потоку: 1мл/хв.; піч: 40°С; УФ-виявлення на 210нм. Метод 21 (РХВТ): Колонка: Kromasil RP-18, 250x4мм, 5мкм; елюент А: 2мл НСIO4 на л води, елюент Б: ацетонітрил; ізократично: 45% елюенту Б, 55% елюенту А; швидкість потоку: 1мл/хв.; піч: 40°С; УФ-виявлення на 210нм. Метод 22 (РХ-МС): Тип приладу для МС: Micromass ZQ; тип приладу для РХВТ: HP 1100 Series; УФ-ДДМ; колонка: Grom-Sil 120 ODS-4 НЕ, 50x2мм, 3,0мкм; елюент А: вода/0,025% мурашиної кислоти на літр, елюент Б: ацетонітрил/0,025% мурашиної кислоти; градієнт: з 0-ї по 2,9-у хвилину збільшення концентрації елюенту Б з 0 до 70%, з 2,9-ї по 3,1-у хвилину збільшення концентрації 19 елюенту Б з 70 до 90%, з 3,1-ї по 4,5-у хвилину 90% елюенту Б; піч: 50°С, швидкість потоку: 0,8мл/хв., УФ-виявлення на 210нм. Метод 23 (РХВТ): Тип приладу для РХВТ: HP 1050 Series; УФ-ДДМ UVDAD 1100 Series; колонка: SymmetryPrep™ С18, фірма Waters, 50 2,1мм, 3,5мкм; елюент А: вода/0,05% трифтороцтової кислоти, елюент Б: ацетонітрил; градієнт: з 0-ї по 9-у хвилину збільшення концентрації елюенту Б з 0 до 100%, з 9-ї по 11-у хвилину 100% елюенту Б, з 11-ї по 12-у хвилину зменшення концентрації елюенту Б з 100 до 0%, на закінчення регенерація хроматографічної колонки; піч: 40°С, швидкість потоку: 0,4мл/хв., УФ-виявлення на 210нм. 19 Метод 24 (кількісна F-ЯМР-спектроскопія): Приблизно 10мг точно зваженого зразка аналізованої речовини та приблизно 20мг точно зваженого 1,4-дибромтетрафторбензолу розчиняють у 19 піридині та аналізують F-ЯМР-спектроскопією. δ74 (ТФОК) та -132,0 (1,4-дибромтетрафторбензол) інтегрують та порівнюють. Вміст ТФОК зазначають у процентах від маси зразку аналізованої речовини. Метод 25 (іонна хроматографія): Система для іонної хроматографії з пригнічувачем та детектором електропровідності; попередня колонка: A SUPP 4/5 Guard, розділювальна колонка: A SUPP 5, 4,0 250мм; елюент: 3,2-мілімолярний карбонат натрію та 2,4-мілімолярний гідрокарбонат натрію у воді; швидкість потоку: 0,7мл/хв. Зразок розчиняють в метанолі (20% от остаточного об'єму зразка), протягом 3хв. обробляють в ультразвуковій бані та додаванням води об'єм доводять до остаточного. Зразок фільтрують через фільтр, що не містить іонів, з ацетату целюлози (з розміром пор 0,45мкм) та інжектують в колонку. Кількісний аналіз проводять по відношенню до зовнішніх стандартів (0,5-10мг/л). Вихідні сполуки Приклад 1А: Бістрифторацетат аміда D1 лейцил-N -{(3S,6S,12S,15S,18R,21S,24S,27S,28R)6-[(1S)-2-аміно-1-гідроксі-2-оксоетилі-18-(3{[аміно(іміно)метил]аміно}пропіл)-12-[(1S)-1гідроксіетил]-3-(гідроксиметил)-24-[(7R)-1-гідрокси2-метилпропіл]-21-ізобутил-15-[(1S)-1метилпропіл]-2,5,8,11,14,17,20,23,26-нонаоксо-28феніл-1-окса-4,7,10,13,16,19,22,25октаазациклооктакозан-27-іл)-L-лейцину (лізобактин) 89800 20 Ферментація Культуральне середовище YM-середовище: Аrар із дріжджовим і солодовим екстрактами: D-глюкоза (4г/л), дріжджовий екстракт (4г/л), солодовий екстракт (10г/л), 1 літр очищеної пропусканням через леватит води. Перед стерилізацією (20 хвилин при 121°С) значення рН установлюють на 7,2. НРМ-середовище: Маніт (5,4г/л), дріжджовий екстракт (5г/л), м'ясний пептон (3г/л). Робочий законсервований штам: Ліофілізований штам (АТСС 53042), попередньо вирощений в 50мл YM-середовища. Ферментація в колбі: В 150мл YM-середовища або 100мл НРМ-середовища в 1-літровій колбі Ерленмейєра висівають 2мл робочого законсервованого штаму та вирощують протягом 30-48год. при 28°С на шютель-апараті при 240об./хв. Ферментація в об'ємі 30л: 300мл вирощеної шляхом ферментації в колбі культури (НРМсередовище) висівають в 30л стерильного розчину живильного середовища (з 1мл антивспінювача Antifoam SAG 5693/1). Цю культуру вирощують протягом 21год. при 28°С, 300об./хв. і вентилюванні стерильним повітрям з витратою 0,3 об'єму газу на об'єм рідини на хвилину (об./об./хв.). У процесі культивування значення рН підтримують постійним та рівним 7,2 за допомогою 1-молярної соляної кислоти. У процесі культивування витрачають у цілому 880мл молярної соляної кислоти. Основна культура (200л): У YM-середовище, розподілену порціями по 150мл по 15-ти 1літрових колбах Ерленмейєра, висівають по 2мл робочого законсервованого штаму та вирощують протягом 48год. при 28°С на шютель-апараті при 240об./хв. 2250мл цієї культури висівають в 200л стерильного розчину живильного середовища (YM-середовища) (з 1мл антивспінювача Antifoam SAG 5693/1) і вирощують протягом 18,5год. при 28°С, 150об./хв. і вентилювання стерильним повітрям з витратою 0,3об./об./хв. Для контролю процесу ферментації щогодини відбирають проби (по 50мл). 2мл цього бульйону, що містить вирощену культуру, змішують із 1мл метанолу (з 0,5% трифтороцтової кислоти) і фільтрують через фільтр із розміром пор 0,45мкм. 30мкл цієї суспензії аналізують за допомогою РХВТ (метод 18 і метод 19). Після закінчення 18,5год. бульйон, що містить основну вирощену культуру, розділяють центрифугуванням при 17000об./хв. на надосадову рідину (супернатант) і осад. Виділення Надосадова рідина (183л): Надосадову рідину після встановлення значення її рН на 6,5-7 додаванням концентрованої трифтороцтової кислоти, відповідно розчину їдкого натру вносять у колонку з іонітом Lewapol (ОС 1064, уміст 60л). Після цього елююють чистою водою, потім сумішшю води з метанолом у співвідношенні 1:1 і на завершення чистим метанолом (з 0,1% трифтороцтової кислоти). Елюйовану органічну фазу концентрують у вакуумі до водного залишку об'ємом 11,5л. Водну фазу, що залишилася, зв'язують із силікагелем C18 і розділяють (РХВТ, Biotage Flash 75, 21 75x30см, KP-C18-WP, 15-20мкм, швидкість потоку: 30мл; елюент: ацетонітрил/вода з 0,1% трифтороцтової кислоти; градієнт: 10%, 15% і 40% ацетонітрилу). Ацетонітрильную фазу, елюйовану при 40%-вій концентрації ацетонітрилу, яка містить основну кількість зазначеної в заголовку прикладу 1А сполуки, концентрують у вакуумі та потім ліофілізують (приблизно 13г). Цю твердофазову суміш розділяють порціями по 1,2г спочатку за допомогою препаративної РХВТ (метод 7), потім шляхом гель-фільтрації на колонці із сорбентом Sephadex LH-20 (5x70см, ацетонітрил/вода в співвідношенні 1:1, у кожному випадку з 0,05% трифтороцтової кислоти) і після цього за допомогою іншої препаративної РХВТ (метод 20). Таким шляхом одержують 2250мг зазначеної в заголовку прикладу 1А сполуки. Осад: Осад від центрифугування розчиняють в 4л суміші ацетону та води в співвідношенні 4:1, змішують із 2кг целіту, значення рН додаванням трифтороцтової кислоти встановлюють на 6, розмішують і центрифугують. Розчинник випарюють у вакуумі та залишок сушать виморожувановим. Одержаний ліофілізат (89,9г) розчиняють у метанолі, фільтрують, концентрують і розділяють на силікагелі (метод 21). Потім зазначену в заголовку прикладу 1А сполуку очищають шляхом гельфільтрації (колонка із сорбентом Sephadex LH-20, 5x68см, вода/ацетонітрил у співвідношенні 9:1 (з 0,05% трифтороцтової кислоти), швидкість потоку: 2,7мл/хв., об'єм фракції 13,5мл) з одержанням чистої речовини. Таким шляхом одержують 447мг зазначеної в заголовку прикладу 1А сполуки. РХВТ (метод 18): Rt=6,19хв. + МС (ESIpos): m/z=1277 (М+Н) . 1 Н-ЯМР (500,13МГц, d6-ДМСО): δ=0,75 (d, 3Н), 0,78 (d, 6Н), 0,80 (t, 3Н), 0,82 (d, 3Н), 0,90 (d, 3Н), 0,91 (d, 3Н), 0,92 (d, 3Н), 0,95 (d, 3Н), 0,96 (d, 3Н), 1,05 (m, 1H), 1,19 (d, 3Н), 1,25 (m, 2H), 1,50 (m, 4H), 1,51 (m, 2H), 1,55 (m, 1H), 1,61 (m, 1H), 1,65 (m, 1H), 1,84 (m, 1H), 1,85 (m, 1H), 1,86 (m, 1H), 1,89 (m, 1H), 1,95 (m, 1H), 2,75 (m, 2H), 3,40 (m, 1H), 3,52 (m, 2H), 3,53 (dd, 1H), 3,64 (m, 2H), 3,66 (m, 1H), 3,68 (dd, 1H), 3,73 (m, 2H), 4,00 (dd, 1H), 4,02 (шир., 1H), 4,13 (шир., 1Н), 4,32 (dd, 1H), 4,39 (t, 1H), 4,55 (m, 1H), 4,75 (dd, 1H), 5,19 (t, 1H), 5,29 (d, 1H), 5,30 (шир., 1H), 5,58 (m, 2H), 6,68 (m, 3H), 6,89 (d, 1H), 6,93 (m, 3H), 6,94 (шир., 1Н), 6,98 (d, 1H), 7,12 (шир., 1H), 7,20 (шир., 2H), 7,23 (m, 2H), 7,42 (m, 2H), 7,54 (d, 1H), 7,58 (d, 1H), 8,32 (шир., 1H), 9,18 (шир., 1H), 9,20 (m, 2H), 9,50 (шир., 1Н). 13 С-ЯМР (125,77МГц, d6-ДМСО): δ=10,3, 15,3, 19,0, 19,2, 19,6, 20,0, 20,9, 22,0, 22,4, 23,0, 23,2, 24,3, 24,4, 25,0, 25,4, 26,0, 27,8, 30,9, 35,4, 39,5, 40,8, 40,9, 41,6, 44,1, 51,5, 52,7, 55,9, 56,2, 56,4, 57,9, 58,8, 60,2, 61,1, 62,6, 70,1, 71,6, 71,7, 75,5, 128,1, 128,6, 136,7, 156,8, 168,2, 170,1, 170,4, 171,2, 171,5, 171,9, 172,2, 172,4, 173,7. Співвіднесення сигналів здійснювали відповідно до літературних джерел (Т. Kato, Η. Hinoo, Y. Terui, J. Antibiot, 61, 1988, cc.719-725). Приклад 2А: Бістрифторацетат дез(1-Dлейцил-2-L-лейцил)лізобактину (продукт деградації за Едманом2,0) 89800 22 Бістрифторацетат лізобактину (60,0г, 39,88ммоль) в атмосфері аргону розчиняють у піридині (840мл). Потім додають фенілізотіоціанат (32,35г, 239,28ммоль, 6 еквівалентів) і реакційну суміш перемішують при 37°С протягом 7 год. Після цього розчинник відганяють на роторному випарнику при температурі бані 40°С. Залишок змішують із метил-трет-бутиловим ефіром (1400мл) і інтенсивно перемішують протягом 30хв. Потім піддають вакуум-фільтрації через скляну фриту (розмір пор 3, діаметр 13см). Таким шляхом виділяють 72г проміжного продукту (продукт деградації за Едма0,5 ном ), який без переробки використовують у наступній реакції. Для цього сирий продукт в атмосфері аргону розчиняють у трифтороцтовій кислоті (1026мл) і перемішують протягом 30хв. при КТ. Потім розчин концентрують у вакуумі на роторному випарнику при температурі бані 20°С. Залишок розчиняють у метил-трет-бутиловому ефірі (1400мл) і інтенсивно перемішують до утворення порошкоподібної аморфної твердої речовини. Цю тверду речовину відфільтровують вакуум-фільтрацією через фриту (розмір пор 3, діаметр 18см). Після цього тверду речовину перемішують із діетиловим ефіром (1400мл) і знову відфільтровують. Подібну процедуру повторюють із 2 порціями дихлорметану (по 900мл). Сирий продукт сушать у вакуумі. Таким шляхом одержують 58г сирого бістрифторацетату дез(1-D-лейцил)лізобактину (продукт деградації за Едманом1,0). Одержаний сирий продукт без додаткового очищення розчиняють в атмосфері аргону в піридині (1080мл). Потім додають фенілізотіоціанат (107г, 0,80 моль, 20 еквівалентів) і реакційну суміш перемішують при 37-40°С протягом 7 год. Після цього розчинник відганяють на роторному випарнику при температурі бані 40°С. Залишок змішують із метил-трет-бутиловим ефіром (1400мл) і інтенсивно перемішують. Потім піддають вакуумфільтрації через скляну фриту (розмір пор 3, діаметр 13см). Таким шляхом виділяють 65г сирого проміжного продукту (продукт деградації за Едманом1,5), який після сушіння у вакуумі, створюваному масляною помпою, в атмосфері аргону безпосередньо розчиняють у трифтороцтовій кислоті (1240мл) і перемішують протягом 30хв. при КТ. Після цього розчин концентрують на роторному випарнику у вакуумі при температурі бані 20°С. 23 Залишок розчиняють у метил-трет-бутиловому ефірі (1400мл) і інтенсивно перемішують до утворення порошкоподібної аморфної твердої речовини. Цю тверду речовину відфільтровують вакуумфільтрацією через фриту (розмір пор 3, діаметр 18см). Після цього тверду речовину перемішують спочатку з діетиловим ефіром (1400мл), а потім з дихлорметаном (1400мл), відфільтровуючи після кожної операції перемішування. Таким шляхом одержують 55г сирого продукту. Цей продукт очищають за допомогою препаративної РХВТ (метод 14). Таким шляхом одержують 28,55г (56% від теорії) зазначеної в заголовку сполуки. РХВТ/УФ-видим. (метод 23): Rt=4,71хв. max (якісно)=220нм (s), 255-270 (w). РХ-МС (метод 22): Rt=1,65хв.; МС (ESIpos): m/z (%)=526 (100) [М+2Н]2+, 1051 (15) [М+Н]+. Приклад 3А: Метиловий ефір (2Z)-2{[(бензилокси)карбоніл]аміно}-3-(6трифторметилпіридин-3-іл)акрилової кислоти 6-трифторметилпіридин-3-карбальдегид (4,85г, 27,70ммоль) і метил{[(бензилокси)карбоніл]аміно}(диметоксифосфорил)ацетат (9,17г, 27,70ммоль, 1,0 еквівалент) розчиняють у ТГФ (70мл) і охолоджують до -70°С. При -70°С по краплях повільно додають Ν,Ν,Ν,Νтетраметилгуанідин (6,38г, 55,39ммоль, 6,95мл, 2,0 еквіваленти) і після цього перемішують спочатку протягом 4год. при -70°С, а потім протягом 12год. при КТ. Далі реакційну суміш концентрують, після чого екстрагують етилацетатом (2 рази по 100мл) шляхом струшування з водою, об'єднані органічні фази промивають насиченим розчином повареної солі та сушать над сульфатом натрію. Одержаний після концентрування у вакуумі сирий продукт хроматографують (силікагель, елюент: толуол, потім толуол/етилацетат у співвідношенні 10:1). Таким шляхом одержують 6,93г (66% від теорії) зазначеної в заголовку сполуки. РХВТ/УФ-видим. (метод 8): Rt=4,60хв. РХВТ/УФ-видим. (метод 9): Rt=4,54хв. 1 Н-ЯМР (400МГц, d6-ДМСО): δ=3,74 (s, 3Н, ОМе), 5,10 (s, 2H, СН2), 7,27 (s, 1H, РуrН), 7,337,38 (m, 5Н, АrН), 7,94 (d, J=8,5Гц, 1Н, PyrH), 8,27 (d, J=8,5Гц, 1H, PyrH), 8,93 (s, 1H, β-CH), 9,51 (s, 1H, NH). PX-MC (метод 7): Rt=2,44xв.; MC (ESIpos): m/z + (%)=381 (100) [M+H] ; MC (ESIneg): m/z (%)=379 (100) [M-H] . + ЧП-МС-ВР (метод 1): C18H16N2O4F3 [M+H] розрах. 381,1062, виявл. 381,1065. Приклад 4А: Метиловий ефір N[(бензилокси)карбоніл]-3-(6-трифторметилпіридин3-іл)-L-аланіну 89800 24 Сполуку із прикладу 3А (10,15г, 26,69ммоль) розчиняють у метанолі а.ч. (100мл). Далі через одержаний розчин за допомогою канюлі протягом приблизно 5хв. пропускають аргон, після чого додають трифлат (+)-1,2-б/с[(2S,5S)діетилфосфолано]бензол(циклооктадієн)р одію(І) (289мг, 400мкмоль, 0,015 еквіваленти). Потім гідрують протягом 12год. при тиску водню 4 бар та КТ. Після цього фільтрують через кізельгур (метанол) і елюат концентрують. Сирий продукт хроматографують (силікагель, елюент: толуол/етилацетат у співвідношенні 5:1). Таким шляхом одержують 9,9г (97% від теорії) зазначеної в заголовку сполуки. [α]20Na=-24° (с=0,093 у метанолі). РХВТ/УФ-видим. (метод 8): Rt=4,50хв. РХВТ/УФ-видим. (метод 9): Rt=4,49хв. 1 Н-ЯМР (400МГц, d6-ДМСО): δ=2,99 (dd, J=3,5, 11,0Гц, 1H, β-CH), 3,22 (dd, J=3,5, 11,0Гц, 1H, βCH), 3,66 (s, 3Н, ОМе), 4,40 (m, 1H, α-СН), 4,97 (s, 2H, СН2), 7,23 (m, 2Н), 7,29-7,33 (m, 3Н), 7,83 (d, J=6,5Гц, 1H), 7,93-7,98 (m, 2Н), 8,65 (s, 1H, NH). РХ-МС (метод 7): Rt=2,40xв; МС (ESIpos): m/z (%)=383 (100) [М+Н]+; МС (ESIneg): m/z (%)=273 (100), 381 (50) [M-H]-. ЧП-МС-ВР (метод 1): C18H18N2O4F3 [М+Н]+ розрах. 383,1219, виявл. 383,1223. Приклад 5А: Метиловий ефір 3-(6трифторметилпіридин-3-іл)-L-аланіну Сполуку із прикладу 4А (9,90г, 25,89ммоль) розчиняють у метанолі (100мл). Далі через одержаний розчин за допомогою канюлі протягом приблизно 5хв. пропускають аргон, після чого додають Pd на вугіллі (10%-вий, 990 мг). Потім гідрують протягом 12год. при тиску водню 4 бар та КТ. Після цього фільтрують через кізельгур, концентрують і сушать у вакуумі, створюваному масляною помпою. Вихід: 5,8г (90% від теорії) зазначеної в заголовку сполуки. 19>9 [α] Na=+3° (с=0,186 у метанолі). РХВТ/УФ-видим. (метод 8): Rt=3,34хв. РХВТ/УФ-видим. (метод 9): Rt=3,22хв. -1 ІЧ vmax(NaCl, см ): 3415, 1734, 1339, 1136, 1087. 1 Н-ЯМР (500МГц, d6-ДМСО): δ=2,85 (dd, J=5,5, 13,5Гц, 1H, β-CH), 3,01 (dd, J=5,5, 13,5Гц, 1H, βCH), 3,61 (s, 3Н, ОМе), 3,63-3,69 (m, 1Н, α-CH), 7,82 (d, J=7,5Гц, 1H), 7,93 (d, J=7,5Гц, 1H), 8,61 (s, 1H). 25 89800 26 РХ-МС (метод 7): Rt=1,74хв.; МС (ESIpos): m/z + (%)=249 (100) [M+H] . ЧП-МС-ВР (метод 1): C12H15N3O2F3 + [M+CH3CN+H] розрах. 290,1116, виявл. 290,1122. Приклад 6А: Метиловий ефір N-(третбутоксикарбоніл)-3-(трет-бутил)-D-аланіл-3-(6трифторметилпіридин-3-іл)-L-аланіну До розчину сполуки із прикладу 5А (6,34г, 25,54ммоль) і N-(трет-бутоксикарбоніл)-3-третбутил-D-аланіну (6,27г, 25,54ммоль, 1,0 еквівалент) у сухому ДМФ (240мл) при -30°С повільно додають N-метилморфолін (12,92г, 127,72ммоль, 14,04мл, 5 еквівалентів) і ГАТУ (9,71г, 25,54ммоль, 1 еквівалент). Реакційній суміші дають повільно нагрітися (протягом приблизно 3год.) до КТ, при цьому повноту реакції контролюють за допомогою РХВТ (метод 9). Потім додають дигідрофосфат калію (34,76г, 255,44ммоль, 10 еквівалентів) і реакційну суміш перемішують протягом 20хв., після чого фільтрують, розбавляють етилацетатом і промивають насиченим водним розчином гідрокарбонату натрію (10мл). Органічні фази сушать над сульфатом натрію, фільтрують і концентрують. Сирий продукт очищають експрес-хроматографією (силікагель, градієнт циклогексану/етилацетату в співвідношенні від 10:1 до 2:1), одержуючи 9,74г (73% від теорії) зазначеної в заголовку сполуки. [α]19,9Na=+7,0° (с=0,044 у метанолі). РХВТ/УФ-видим. (метод 8): Rt=4,89хв. РХВТ/УФ-видим. (метод 9): Rt=4,75хв. -1 ІЧ vmax (NaCl, см ): 2959, 1742, 1655, 1520, 1336, 1160, 1136, 1087, 1050, 1027. 1 Н-ЯМР (500МГц, d6-ДМСО): δ=0,74 (s, 9H, tBu), 0,97-1,00 (m, 1H, β-СН2), 1,20-1,25 (m, 1H, βΟΗ2), 1,35 (s, 9Η, OtBu), 2,99-3,05 (m, 1H, β-ΟΗ2), 3,23-3,26 (m, 1H, β-CH2), 3,66 (s, 3H, OMe), 3,94 (m, 1H, α-CH), 4,60 (m, 1H, α-CH), 6,82 (d, J=8,5Гц, 1H, NH), 7,78 (d, J=8,0Гц, 1Н, PyrH), 7,94 (d, J=8,0Гц, 1Н, PyrH), 8,34 (d, J=8,5Гц, 1H, NH), 8,64 (s, 1H, PyrH). PX-MC (метод 7): Rt=2,67xв.; MC (ESIpos): m/z + (%)=476 (100) [M+H] ; MC (ESIneg): m/z (%)=400 (80), 474 (40) [M-H]-. + ЧП-МС-ВР (метод 1): С22Н33N3О5F3 [M+H] розрах. 476,2372, виявл. 476,2364. Приклад 7А: N-трет-бутоксикарбоніл-3-третбутил-D-аланіл-3-(6-трифторметилпіридин-3-іл)-Lаланін До розчину сполуки із прикладу 6А (9,2г, 1,0 еквівалент, 19,35ммоль) у ТГФ (360мл) і воді (100мл) при -20°С додають розчин гідрату гідроксиду літію (1,16г, 2,5 еквіваленти, 48,37ммоль) у воді (20мл). Реакційній суміші дають нагрітися (протягом приблизно 1,5год.) до +15°С, при цьому повноту реакції контролюють за допомогою РХВТ (метод 9). Для переробки додають дигідрофосфат калію (26,33г, 10 еквівалентів, 193,5ммоль) (рН близько 7). Реакційну суміш фільтрують і концентрують у вакуумі. Сирий продукт очищають хроматографією (метод 10, елюент: метанол/ацетон у співвідношенні 4:1), одержуючи 4,72г (53% від теорії) продукту. 20 [α] Na=+51,3° {с=0,402 у метанолі). РХВТ/УФ-видим. (метод 8): Rt=4,63хв. РХВТ/УФ-видим. (метод 9): Rt=4,55хв. ІЧ vmax(NaC1, см-1): 3305, 2959, 1663, 1519, 1336, 1173, 1134, 1086. 1 Н-ЯМР (500МГц, d6-ДМСО): δ=0,77 (s, 9H, tBu), 1,06-1,13 (m, 1H, β-CH2), 1,23-1,26 (m, 1H, βΟΗ2), 1,34 (s, 9H, OtBu), 3,01 (t app, J=11,0Гц, 1H, βCH2), 3,23 (шир. d, J=11,0Гц, 1Н, β-ΟΗ2), 3,94 (t, J=8,0Гц, 1Н, α-CH), 4,42 (шир. s, 1H, α-CH), 6,90 (d, J=8,5Гц, 1Н, NH), 7,74 (d, J=7,5Гц, 1Н, PyrH), 7,86 (d, J=7,5Гц, 1H, PyrH), 8,00 (шир. s, 1H, NH), 8,56 (s, 1H, PyrH). PX-MC (метод 7): Rt=2,42хв; MC (ESIpos): m/z + (%)=406 (100), 462 (85) [M+H] ; MC (ESIneg): m/z (%)=460 (100) [M-H] . + ЧП-МС-ВР (метод 1): C21H31N3O5F3 [M+H] розрах. 462,2216, виявл. 462,2203. Приклад 8А: Трифторацетат N-третбутоксикарбоніл-3-трет-бутил-D-аланіл-3-(6трифторметилпіридин-3-іл)-L-аланіл-дез(1-Dлейцил-2-L-лейцил)лізобактину До розчину сполук із прикладу 2А (7,00г, 1,0 еквівалент, 5,48ммоль) і прикладу 7А (3,03г, 1,2 еквіваленти, 6,57ммоль) у сухому ДМФ (119мл) 27 при -30°С повільно додають N-метилморфолін (2,77г, 3,01мл, 5 еквівалентів, 27,38ммоль) і ГАТУ (4,37г, 2,1 еквіваленти, 11,50ммоль). Реакційній суміші дають повільно нагрітися (протягом приблизно 1год.) до КТ, при цьому повноту реакції контролюють за допомогою РХВТ/УФ-видим. (метод 9). Реакцію припиняють додаванням дигідрофосфату калію (7,45г, 10,0 еквівалентів, 54,76ммоль). Реакційну суміш очищають хроматографією (метод 10, елюент: метанол/ацетон у співвідношенні 4:1), одержуючи 12,63г (кількісн.) продукту. РХВТ/УФ-видим. (метод 8): Rt=4,78хв. РХВТ/УФ-видим. (метод 9): Rt=4,35хв. РХ-МС (метод 7): Rt=2,28хв.; МС (ESIpos): m/z 2+ + (%)=697 (100) [М+2Н] , 1493 (15) [М+Н] ; МС 2(ESIneg): m/z (%)=745 (100) [M-2Hї , 1491 (5) [M-H] . ЧП-МС-ВР (метод 1): C67H104N16O19F3 [М+Н]+ розрах. 1493,7616, виявл. 1493,7594. Приклад 9А і приклад 10А: (2S)-N-(третбутоксикарбоніл)-3-(триметилсиліл)аланін і (2R)-N(трет-бутоксикарбоніл)-3-(триметилсиліл)аланін Зазначені в заголовку сполуки синтезують за методом, описаним в М. Merget, K. Gunther, M. Bemd, Ε. Gunther, R. Tacke, J. Organomet. Chem., 628, 2001, cc.183-194. Енантіомери розділяють за допомогою препаративної РХВТ на хіральній фазі: Gilson Abimed HPLC; колонка: Daicel Chiralpak ADH, 5мкм, 250x20мм; елюент А: ізогексан, елюент Б: 0,2% оцтової кислоти/1% води/2-пропанол; ізократично; швидкість потоку: 15мл/хв.; УФ-детектор на 212нм. Співвіднесення ізомерів здійснюють шляхом порівняння даних РХВТ-аналізу з автентичним зразком N-(тpет-бутоксикарбоніл)-L-3триметилсилілаланіну (2R-сполука, Mercachem AMR 39.260). Приклад 9А: N-(трет-бутоксикарбоніл)-D-3триметилсилілаланін (2S-сполука) Хіральна РХВТ (метод 15): Rt=4,16хв., енантіомерний надлишок (е.е.) >99%. 20 [α]D =+1,1 (с=0,83 у метанолі). Приклад 10А: N-(трет-бутоксикарбоніл)-L-3триметилсилілаланін (2R-сполука) Хіральна РХВТ (метод 15): Rt=9,27хв., е.е. >99%. 20 [α]D =-1,6 (с=0,66 у метанолі). Приклад 11А: Метил-N-(трет-бутоксикарбоніл)3-(піридин-3-іл)-L-аланінат 89800 28 Зазначену в заголовку сполуку одержують за методом, описаному в В. Neises, W. Steglich, Org. Synth., 63, 1985, сс.183-187. (2S)-N-(трет-бутоксикарбоніл)-3-(піридин-3іл)аланін (25,00г, 93,88ммоль) в атмосфері аргону розчиняють в 300мл дихлорметану. Далі додають метанол (11,4мл, 9,02г, 281ммоль, 3 еквіваленти) і одну частку ДМАП.Після цього суміш охолоджують до 0°С. Потім додають ЕДК (19,80г, 103ммоль, 1,1 еквіваленти). Через 5хв. льодяну баню видаляють і перемішують протягом 1год. при КТ. Потім концентрують у вакуумі, залишок змішують із етилацетатом і екстрагують шляхом струшування з насиченим розчином гідрокарбонату натрію. Водну фазу додатково однократно екстрагують етилацетатом, після чого об'єднані органічні фази промивають спочатку 0,5-молярною лимонною кислотою, а потім ще раз насиченим розчином гідрокарбонату натрію. Органічні фази сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. Таким шляхом як залишок одержують прозоре масло, що кристалізується при сушінні у вакуумі, створюваному масляною помпою. Вихід: 23,60г (90% від теорії). РХВТ/УФ-видим. (метод 9): Rt=3,28хв. РХ-МС (метод 7): Rt=1,21хв.; МС (ESIpos): m/z (%)=281 (100) [М+Н]+. 1 H-ЯМР (400МГц, dб-ДМСО): δ=1,30 (s, 9Н), 2,86 (m, 1H), 3,04 (m, 1H), 3,63 (s, 3H), 4,22 (m, 1H), 7,28-7,39 (m, 2H), 7,69 (d, 1H), 8,43 (m, 2H). Приклад 12А: Бістрифторацетат метилового ефіру 3-(піридин-3-іл)-L-аланіну Сполуку із прикладу 11А (11,8г, 42,09ммоль) розчиняють у розчині трифтороцтової кислоти в дихлорметані (160мл, 30%-вий розчин) і перемішують протягом 30хв. при КТ. Потім концентрують у вакуумі. Залишок розчиняють у невеликій кількості води та ліофілізують. Після цього ліофілізат змішують із толуолом і концентрують у вакуумі. На завершення сушать до сталості маси у вакуумі, створюваному масляною помпою. Вихід: 17,15г (кількісн.). РХВТ/УФ-видим. (метод 9): Rt=0,88хв. РХ-МС (метод 7): Rt=0,46хв.; МС (ESIpos): m/z (%)=181 (100) [М+Н]+. 1 Н-ЯМР (400МГц, d6-ДМСО): δ=2,79 (dd, 1H), 2,92 (dd, 1H), 3,60 (s, 3H), 3,63 (m, 1H), 7,30 (m, 1H), 7,62 (d, 1H), 8,41 (m, 2H). 29 Приклад 13А: Метил-N-(трет-бутоксикарбоніл)3-(триметилсиліл)-D-аланіл-3-(тридин-3-іл)-Lаланінат Сполуку із прикладу 9А (10,31г, 39,4ммоль) і сполуку із прикладу 12А (16,10г, 39,4ммоль, 1 еквівалент) при 0°С розчиняють у ДМФ (186мл). Потім додають Ν- метилморфолін (17,34мл, 16,00г, 4 еквіваленти) і ГАТУ (22,49г, 59,16ммоль, 1,5 еквіваленти). Суміш перемішують протягом двох годин при КТ. Далі змішують із трет-бутилметиловим ефіром і промивають насиченим розчином карбонату натрію. Водну фазу додатково однократно екстрагують трет-бутилметиловим ефіром, після чого об'єднані органічні фази промивають спочатку 1-молярною водною лимонною кислотою, а потім знову насиченим розчином карбонату натрію, сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. На завершення фільтрують через силікагель (циклогексан/етилацетат у співвідношенні 2:1). Вихід: 14,1г (84% від теорії). РХВТ/УФ-видим. (метод 9): Rt=3,91хв. РХ-МС (метод 7): Rt=1,90хв.; МС (ESIpos): m/z (%)=424 (100) [М+Н]+. 1 Н-ЯМР (400МГц, d6-ДМСО): δ=-0,09 (s, 9Н), 0,56-0,75 (m, 2Н), 1,47 (s, 9Н), 2,90 (dd, 1H), 3,09 (dd, 1H), 3,62 (s, 3Н), 3,98 (m, 1H), 4,49 (m, 1H), 6,68 (d, 1H), 7,26 (dd, 1H), 7,61 (m, 1H), 8,20 (d, 1H), 8,40 (m, 2H). Приклад 14А: N-(трет-бутоксикарбоніл)-3(триметилсиліл)-D-аланіл-3-(піридин-3-іл)-L-аланін Сполуку із прикладу 13А (7,4г, 17,56ммоль) розчиняють у суміші ТГФ і води (у співвідношенні 6:4), охолоджують до 0°С і змішують із моногідратом гідроксиду літію (1,47г, 35,13ммоль, 2 еквіваленти). Після цього суміш перемішують при 0°С. Через годину додають ще один еквівалент (0,74г) моногідрату гідроксиду літію та перемішують ще протягом години. Далі у вакуумі відганяють більшу частину ТГФ, промивають двома порціями метилтрет-бутилового ефіру й потім значення рН водної фази додаванням лимонної кислоти встановлюють на 4. При цьому в осад випадає тверда речовина. Далі екстрагують трьома порціями етилацетату, що супроводжується розчиненням твердої речовини. Об'єднані органічні фази сушать над сульфатом натрію, фільтрують і концентрують. Сирий продукт очищають хроматографією (метод 3, елюент: метанол). Вихід: 6,67г (93% від теорії). РХВТ/УФ-видим. (метод 9): Rt=3,73хв. РХ-МС (метод 7): Rt=1,68хв.; 89800 30 + МС (ESIpos): m/z (%)=410 (40) [М+Н] . 1 Н-ЯМР (300МГц, d6-ДМСО): δ=-0,090 (s, 9Н), 0,56-0,75 (m, 2Н), 1,35 (s, 9Н), 2,90 (dd, 1H), 3,09 (dd, 1H), 3,98 (m, 1H), 4,41 (m, 1Н), 6,70 (d, 1H), 7,26 (dd, 1H), 7,60 (m, 1Н), 8,00 (d, 1H), 8,37 (m, 2H). Приклад 15A: Трифторацетат N-(третбутоксикарбоніл)-3-(триметилсиліл)-D-аланіл-3(піридин-3-іл)-L-аланіл-дез(1-D-лейцил-2-Lлейцил)лізобактину Сполуку із прикладу 2А (3,00г, 2,35ммоль) і сполуку із прикладу 14А (1,44г, 3,52ммоль, 1,5 еквіваленти) розчиняють у ДМФ (50мл) і охолоджують до 0°С. Після цього додають 4,7мл (4,7ммоль, 2 еквіваленти) 1-молярного розчину 4метилморфоліну в ДМФ. Потім відразу ж додають ГАТУ (1,52г, 3,99ммоль, 1,7 еквіваленти) і перемішують протягом 15хв. при 0°С. Далі по краплях додають ще 4,7мл (4,7ммоль, 2 еквіваленти) 1молярного розчину 4-метилморфоліну в ДМФ. Після цього суміш перемішують протягом 2год. при КТ. Сирий продукт піддають гель-хроматографії (метод 3). Одержаний продукт без додаткового глибокого очищення використовують у наступній реакції. Вихід: 3,6г (82% від теорії). РХВТ (метод 9): Rt=3,90хв. РХ-МС (метод 7): Rt=2,00хв.; МС (ESIpos): m/z (%)=721,8 (100) [М+2Н]2+; 1442,1 (5) [М+Н]+. Альтернативний метод: Сполуку із прикладу 2А (14,00г, 10,95ммоль) і сполуку із прикладу 14А (5,38г, 13,14ммоль, 1,2 еквіваленти) розчиняють у ДМФ (280мл) і охолоджують до -20°С. Після цього додають N-метилморфолін (5,54г, 6,02мл, 5 еквівалентів), а потім ГАТУ (6,66г, 17,52ммоль, 1,6 еквіваленти). Далі суміш повільно нагрівають до КТ і залишають перемішуватися на ніч (приблизно на 16год.). Потім при перемішуванні додають дигідрофосфат калію (14,91г, 10 еквівалентів) і перемішують ще протягом 30хв. Сирий продукт піддають гель-хроматографії (метод 3, елюент: метанол). Одержаний продукт без додаткового глибокого очищення використовують у наступній реакції. Вихід: 14,35г (61% від теорії). Приклад 16А: 2,2-диметил-1-бутаналь 31 2,2-диметил-1-бутанол (4,0г, 39ммоль) розчиняють у дихлорметані (136мл) і змішують із оксидом алюмінію (7,98г, 78ммоль, 2 еквіваленти) і із хлорхроматом піридинію (16,88г, 78ммоль, 2 еквіваленти). Після цього суміш перемішують при КТ протягом 1год. і потім фільтрують через шар силікагелю. Фільтрат обережно концентрують і залишок переганяють при нормальному тиску (температура кипіння 102°С (990мбар)). Вихід: 2,97г (75% від теорії). ГХ-МС (метод 17): Rt=2,21хв.; МС (ESIpos): m/z + (%)=99,9 (5) [М] . 1 H-ЯMP (400МГц, CDCI3) δ=0,83 (t, 3Н), 1,03 (s, 6H), 1,51 (q, 2H), 9,42 (s, 1H). Приклад 17A: Метил-(2Z)-2{[(бензилокси)карбоніл]аміно}-4,4-диметилгекс-2еноат Сполуку із прикладу 16А (2,55г, 25,46ммоль) і метиловий ефір {[(бензил окси)карбоніл]аміно}(диметоксифосфорил)оцтової кислоти (8,43г, 25,46ммоль) розчиняють в 50мл ТГФ і охолоджують до 0°С. Далі по краплях додають Ν,Ν,Ν',Ν'-тетраметилгуанідин, після чого перемішують спочатку протягом 15хв. при 0°С, а потім протягом 5 днів при КТ. Після цього суміш змішують із приблизно 20г силікагелю, концентрують і хроматографують (силікагель Biotage 40M, ZIF-SIM, циклогексан/етилацетат у співвідношенні 87:13). Вихід: 1,20г (13% від теорії). РХВТ (метод 9): Rt=3,71хв. МС (DCI): m/z (%)=323,3 (100) [M+NH4]. 1 H-ЯМР (400МГц, CDCI3): δ=0,83 (m, 3Н), 1,13 (s, 6H), 1,49 (q, 2H), 3,75 (шир. s, 3Н), 5,72 (шир. s, 1H), 6,58 (шир. s, 1H), 5,12 (s, 2H), 7,36 (m, 5H). Приклад 18А: Метил-N-[(бензилокси)карбоніл]4,4-диметил-D-Норлейцинат Сполуку із прикладу 17А (1,2г, сирий продукт, 3,26ммоль) розчиняють в етанолі а.ч. (60мл). Далі через одержаний розчин за допомогою канюлі протягом приблизно 5хв. пропускають аргон, після чого додають трифлат (+)-1,2-біс[(2R,5R)діетилфосфолано]бензол(циклооктадієн)р одію(І) (28мг, 0,04ммоль, 0,012 еквіваленти) і розчиняють при обробці в ультразвуковій бані. Після цього гідрують протягом 24год. при тиску водню 3 бар та КТ. Суміш концентрують і хроматографують (силікагель Biotage 25M, циклогексан/етилацетат у співвідношенні 9:1). Вихід: 920мг (92% від теорії). РХВТ (метод 9): Rt=4,96хв. 89800 32 РХ-МС (метод 7): Rt=2,76хв.; МС (ESIpos): m/z + (%)=308 (25) [М+Н] . 1 Н-ЯМР (400МГц, CDCI3): δ=0,80 (t, 3Н), 0,86 (s, 6H), 1,29 (q, 2H), 1,41 (dd, 1H), 1,73 (dd, 1H), 3,72 (s, 3Н), 4,40 (m, 1H), 5,02 (d, 1H), 5,11 (m, 2H), 7,35 (m, 5H). Приклад 19А: Ν-[(бензил окси)карбоніл]-4,4диметил-D-норлейцин У ТГФ (12мл) розчиняють сполуку із прикладу 18А (915мг, 2,98ммоль). Одержаний розчин охолоджують до 0°С, після чого додають 3,7мл (7,4ммоль, 2,5 еквіваленти) 2-молярного розчину моногідрату гідроксиду літію у воді та інтенсивно перемішують протягом 1год. Після цього по краплях додають лимонну кислоту (1-молярну) до одержання кислої реакції та суміш екстрагують етилацетатом. Органічний екстракт сушать над сульфатом натрію, концентрують і хроматографують (метод 16). Вихід: 434мг (50% від теорії). РХВТ (метод 9): Rt=4,54хв. РХ-МС (метод 7): Rt=2,44хв.; МС (ESIpos): m/z (%)=294 (20) [М+Н]+. 1 H-ЯМР (400МГц, d6-ДМСО): δ=0,80 (t, 3Н), 0,83 (s, 6H), 1,21 (q, 2H), 1,53 (dd, 1H), 1,60 (dd, 1H), 3,99 (m, 1H), 5,02 (s, 2H), 7,35 (m, 5H), 7,58 (d, 2H), 12,52 (шир. s, 1H). Приклад 20А: Метил-N-[(бензилокси)карбоніл]4,4-диметил-D-норлейцил-3-(піридин-3-іл)-Lаланінат Сполуку із прикладу 19А (430мг, 1,47ммоль) і сполуку із прикладу 12А (809мг, 1,47ммоль, 1 еквівалент) при 0°С розчиняють у ДМФ (5мл), після чого додають 4-метилморфолін (644мкл, 5,86ммоль, 4 еквіваленти) і ГАТУ (836мг, 2,20ммоль, 1,5 еквіваленти). Далі суміш перемішують протягом трьох годин при КТ. Після цього змішують із етилацетатом і промивають насиченим розчином гідрокарбонату натрію. Водну фазу однократно екстрагують етилацетатом, після чого об'єднані органічні фази промивають 1-молярною водною лимонною кислотою, а потім знову насиченим розчином гідрокарбонату натрію, сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. Залишок хроматографують (метод 16). Вихід: 496мг (74% від теорії). РХВТ (метод 9): Rt=3,94хв. РХ-МС (метод 7): Rt=1,85хв.; МС (ESIpos): m/z (%)=456 (100) [М+Н]+. 1 Н-ЯМР (300МГц, d6-ДМСО): δ=0,80 (m, 9Н), 1,10 (m, 3Н), 1,30 (dd, 1Н), 2,91 (dd, 1H), 3,12 (dd, 1H), 3,30 (s, 3H), 4,02 (m, 1H), 4,51 (m, 1H), 5,01 (d, 33 1H), 5,06 (d, 1H), 7,22 (dd, 1H), 7,30 (m, 5H), 7,63 (m, 1H), 8,40 (m, 2H). Приклад 21А: N-[(бензилокси)карбоніл]-4,4диметил-D-норлейцил-3-(піридин-3-іл)-L-аланін У ТГФ (5мл) розчиняють сполуку із прикладу 20А (490мг, 1,08ммоль). Одержаний розчин охолоджують до 0°С, після чого додають 1,35мл (2,7ммоль, 2,5 еквіваленти) 2-молярного розчину моногідрату гідроксиду літію у воді та інтенсивно перемішують протягом 1год. Після цього по краплях додають лимонну кислоту (1-молярну у воді) до одержання кислої реакції та суміш екстрагують етилацетатом. Органічний екстракт сушать над сульфатом натрію й концентрують. Вихід: 484мг (кількісн.). РХВТ (метод 9): Rt=3,76хв. РХ-МС (метод 7): Rt=1,88хв.; МС (ESIpos): m/z (%)=442 (100) [М+Н]+. 1 Н-ЯМР (400МГц, d6-ДМСО): δ=0,70 (m, 9Н), 1,14 (m, 3Н), 1,30 (dd, 1H), 2,64 (d, 1H), 2,75 (d, 1H), 2,89 (dd, 1H), 3,11 (dd, 1H), 4,03 (m, 1H), 4,45 (m, 1H), 4,98 (d, 1H), 5,05 (d, 1H), 7,22 (dd, 1H), 7,30 (m, 5H), 7,61 (m, 1H), 8,40 (m, 2H). Приклад 22А: Трифторацетат N[(бензилокси)карбоніл]-4,4-диметил-D-норлейцил3-(піридин-3-іл)-L-аланіл-дез(1-D-лейцил-2-Lлейцил)лізобактину Сполуку із прикладу 2А (0,28г, 0,22ммоль) і сполуку із прикладу 21А (148мг, 0,33ммоль, 1,5 еквіваленти) розчиняють у ДМФ (4мл) і охолоджують до 0°С. Після цього додають 0,47мл (0,44ммоль, 2 еквіваленти) 1-молярного розчину N-метилморфоліну в ДМФ. Потім відразу ж додають ГАТУ (141мг, 0,37ммоль, 1,7 еквіваленти) і перемішують протягом 15хв. при 0°С. Далі по краплях додають ще 0,44мл (0,47ммоль, 2 еквіваленти) 1-молярного розчину 4-метилморфоліну в ДМФ. Потім суміш залишають перемішуватися на ніч при КТ. Після цього суміш очищають на колонці із сорбентом Sephadex LH-20 (метод 3, елюент: метанол). Сирий продукт очищають за допомогою препаративної РХВТ (метод 13). Вихід: 149мг (43% від теорії). РХВТ (метод 9): Rt=3,93хв. 89800 34 РХ-МС (метод 7): Rt=2,13хв.; МС (ESIpos): m/z 2+ + (%)=737,4 (100) [М+2Н] , 1473 (2) [М+Н] . Приклади одержання пропонованих у винаході сполук Приклад1: Бістрифторацетат 3-трет-бутил-Dаланіл-3-(6-трифторметилпіридин-3-іл)-L-аланілдез(1-D-лейцил-2-L-лейцил)лізобактину До розчину сполуки із прикладу 8А (10,3г, 1,0 еквівалент, 4,48ммоль, сирий продукт) у дихлорметані (150мл) при КТ повільно по краплях додають трифтороцтову кислоту (150мл). Далі реакційну суміш перемішують при КТ (10хв.), при цьому повноту реакції контролюють за допомогою РХВТ (метод 9). Потім реакційну суміш концентрують на роторному випарнику та очищають за допомогою препаративної РХВТ (метод 11), одержуючи 3,48г (48% від теорії) продукту. РХВТ/УФ-видим. (метод 8): Rt=4,03хв. РХВТ/УФ-видим. (метод 9): Rt=3,64хв. РХ-МС (метод 7): Rt=1,69хв.; МС (ESIpos): m/z (%)=697 (100) [М+2Н]2+, 1393 (5) [М+Н]+; МС (ESIneg): m/z (%)=695 (100) [М-2Н]2-, 1391 (20) [ΜΗ]19 F-ЯМР (400МГц, d5-піридин): δ=-67 (Ar-CF3), 74 (CF3COOH), -132 (1,4-дибромтетрафторбензол як стандарт). Вміст ТФОК: 14,3мас.%. + МС-ВР (метод 1): C62H96N16O17F3 [M+H] розрах. 1393,7091, виявл. 1393,7119. Приклад 2: Тристрифторацетат 3(триметилсиліл)-D-аланіл-3-(піридин-3-іл)-Lаланіл-дез(1-D-лейцил-2-L-лейцил)лізобактину Сполуку із прикладу 15А (9,12г, 4,93ммоль, сирий продукт) розчиняють у розчині трифтороцтової кислоти в дихлорметані (65мл, 30%-вий розчин). Далі суміш перемішують при КТ протягом 20хв. Після цього відганяють розчинник. Залишок 35 сушать у вакуумі, створюваному масляною помпою, і потім очищають хроматографією (метод 14). Вихід: 5,54г (67% від теорії). РХВТ (метод 9): Rt=3,32хв. РХ-МС (метод 7): Rt=1,41хв.; МС (ESIpos): m/z (%)=671,7 (100) [М+2Н]2+. + ЧП-МС-ВР (метод 1): C60H97N16O17Si [M+H] розрах. 1341,6987, виявл. 1341,7019. 1 H-ЯМР (500МГц, d5-піридин): δ=-0,172 (s, 9Н), 0,611 (d, J=6,9Гц, 3Н), 0,881 (d, J=7,9Hi, 3Н), 0,948 (d, J=6,3Гц, 3Н), 0,954-0,997 (m, 6H), 1,135 (d, J=6,0Гц, 3Н), 1,208 (m, 2Н), 1,361 (d, J=5,4Гц, 3Н), 1,439 (m, 1H), 1,497 (m, 1H), 1,953 (m, 2H), 2,04 (m, 1H), 2,154 (m, 3H), 2,372 (m, 3H), 3,111 (m, 1H), 3,266 (m, 1H), 3,563 (d, J=14,95Гц, 1H), 3,726 (dd, J=12,2, 14,95Гц, 1Н), 3,840 (d, J=9,6Гц, 1H), 3,960 (m, 1H), 4,152 (m, 1H), 4,198 (m, 1H), 4,278 (m, 1H), 4,382 (m, 1H), 4,488 (m, 1H), 4,565 (dd, J=9,5, 9,6Гц, 1H), 4,628 (m, 1H), 4,630 (m, 1H), 4,779 (d, J=12,2Гц, 1H), 5,069 (m, 1H), 5,159 (dd, J=9,3Гц, 1H), 5,264 (m, 1H), 5,362 (s, 1H), 5,98 (d, J=9,9Гц, 1H), 6,351 (dd, J=8,5Гц, J=8,7Гц, 1Н), 7,169 (m, 1H), 7,246 (m, 1H), 7,382 (d, J=9,9Гц, 1H), 7,512 (m, 2H), 7,583-7,614 (m, 2H), 7,728 (m, 2H), 7,90 (d, J=8,7Гц, 1H), 8,126 (m, 3H), 8,341 (m, 1H), 8,576 (d, J=3,6Гц, 1H), 8,695 (m, 2H), 8,793 (m, 1H), 9,139 (шир. s, 1H), 9,715 (m, 1H), 10,957 (шир. s, 1H), 11,268 (шир. s, 1H). 13 С-ЯМР (126МГц, d5-піридин): δ=-1,8, 11,08, 15,84, 18,8, 18,8, 19,79, 20,89, 20,93, 21,65, 23,38, 24,78, 26,57, 26,88, 28,80, 31,04, 34,06, 36,84, 40,95, 41,25, 44,38, 50,94, 52,82, 55,99, 56,10, 56,74, 58,40, 59,10, 60,34, 60,72, 62,33, 62,55, 70,72, 72,06, 75,58, 75,65, 123,66, 128,25, 128,95, 129,80, 132,39, 136,77, 137,18, 149,17, 158,11, 162,15, 162,41, 162,70, 162,96, 169,01, 169,69, 170,21, 172,57, 173,27, 173,44, 173,66, 174,07, 174,36, 175,34, 175,56. 19 F-ЯМР (400МГц, d5-піридин): δ=-74 (CF3COOH), -132 (1,4-дибромтетрафторбензол як стандарт). Вміст ТФОК: 19,3мас.%. Структуру підтверджують шляхом рентгеноструктурного аналізу монокристалів. Приклад 3: Трисметансульфонат 3(триметилсиліл)-D-аланіл-3-(піридин-3-іл)-Lаланіл-дез(1-D-лейцил-2-L-лейцил)лізобактину Тристрифторацетат 3-(триметилсиліл)-Оаланіл-3-(піридин-3-іл)-L-аланіл-дез(1-D-лейцил-2L-лейцил)лізобактину (447мг, 0,27ммоль) розчиняють в 22мл води. Далі додають метансульфонову кислоту (70%-ву). Після цього суміш інтенсивно 89800 36 перемішують і потім ліофілізують. Ліофілізат розчиняють у воді (3,4мл) і додають 70%-вий розчин метансульфонату натрію (0,9мл). Потім перемішують протягом 10хв. при КТ. Після цього продукт відокремлюють центрифугуванням. Таким шляхом одержують 472мг сирого продукту. Об'єднані з декількох сумішей сирі продукти (у цілому 1053мг, 0,63ммоль) суспендують у воді (5мл) і перемішують при КТ протягом 4 днів. Після цього знову центрифугують і одержану тверду речовину сушать у вакуумі. Таким шляхом одержують 575мг (55% від теорії) продукту. РХВТ (метод 9): Rt=3,30хв. РХ-МС (метод 7): Rt=1,49хв.; МС (ESIpos): m/z 2+ + (%)=671,8 (100) [М+2Н] , 1342,1 (5) [М+Н] . 1 H-ЯМР (500МГц, d5-піридин): δ=-0,170 (s, 9Н), 0,702 (d, J=6,3Гц, 3Н), 0,867 (d, J=6,1Гц, 3Н), 0,972 (d, J=6,2Гц, 3Н), 0,966-1,069 (m, 9H), 1,186 (d, J=6,5Гц, 3Н), 1,315 (m, 2Н), 1,448-1,501 (m, 6Н), 2,010 (m, 1H) , 2,084 (m, 3Н), 2,180-2,365 (m, 4Н), 2,540 (m, 1H), 3,082 (s, 9Н), 3,166 (m, 1H), 3,325 (m, 1H), 3,623 (d, J=14,05Гц, 1H), 3,865 (dd, J=13,7, 14,05Гц, 1H), 3,967-3,986 (m, 2Н), 4,257 (m, 1H), 4,339 (m, 2Н), 4,410 (m, 1H), 4,566 (m, 1H), 4,5914,686 (m, 2Н), 4,75 (d, 1Η, J=12,1Гц, 1H), 4,859 (m, 1Н), 5,086 (m, 1H), 5,229 (m, 1H), 5,348 (m, 1H), 5,375 (s, 1H) 6,02 (d, J=10,0Гц, 1H), 6,403 (m, 1H), 7,068 (d, J=9,8Гц, 1H), 7,222 (m, 3Н), 7,544 (m, 3Н), 7,625 (m, 1H), 7,681 (m, 1H), 7,830 (d, J=7,6Гц, 1H), 7,921 (d, J=9,35Гц, 1H), 8,071 (m, 2Н), 8,188 (шир. s, 1H), 8,285 (шир. s, 1H), 8,420 (d, J=8,4Гц, 1Н), 8,614 (d, J=4,0Гц, 1H), 8,701 (m, 1H), 8,874 (шир. s, 1H), 10,175 (m, 1H), 10,279 (m, 1H), 10,941 (шир. s, 1H). 19 F-ЯMP (піридин, 400МГц, метод 24): δ=-74,0 (s, ТФОК, 0,20), -132,0 (s, 1,4дибромтетрафторбензол, 1000,0). Вміст ТФОК: 0,02мас.%. Альтернативний метод: У колонку (діаметром 35мм) набивають 32г іоніту Dowex 1X8-400 (НСІформа). Далі через колонку пропускають приблизно 60мл 1-молярного розчину гідроксиду натрію, а потім 60мл води для РХВТ. Після цього колонку кондиціонують 60мл 1-молярної метансульфонової кислоти та потім промивають приблизно 100мл води до нейтральної реакції елюату (Macherey & Nagel Tritest). Далі в 90мл води розчиняють 2,00г (1,19ммоль) тристрифторацетату 3(триметилсиліл)-D-аланіл-3-(піридин-3-іл)-Lаланіл-дез(1-D-лейцил-2-L-лейцил)лізобактину (сполука із прикладу 2), одержаний розчин подають у колонку і повільно елююють. Після цього колонку промивають приблизно 20мл води. Елюати, що містять продукт, поєднують, піддають тонкій фільтрації (через фільтр із розміром пор 0,20мкм) і ліофілізують. Потім колонки знову кондиціонують і використовують повторно. Таким шляхом з 2000мг (1,19ммоль) сполуки із прикладу 2 одержують 1,79г (1,10ммоль, 92% від теорії) зазначеної в заголовку прикладу 3 сполуки. Приклад 4: Тристрифторацетат 4,4-диметилD-норлейцил-3-(піридин-3-іл)-L-аланіл-дез(1-Dлейцил-2-L-лейцил)лізобактину 37 Сполуку із прикладу 22А (149мг, 0,09ммоль) розчиняють у метанолі, який містить 0,05% трифтороцтової кислоти (10мл). Далі додають паладій на активованому вугіллі (10%-ий, 20мг), після чого гідрують у присутності водню в цілому протягом 2,5год. при КТ і нормальному тиску. Від сирого продукту відфільтровують каталізатор і фільтрат концентрують. Залишок очищають хроматографією (метод 13). Вихід: 68мг (46% від теорії). РХВТ (метод 9): Rt=3,29хв. РХ-МС (метод 7): Rt=1,49хв.; МС (ESIpos): m/z 2+ + (%)=671,0 (100) [М+2Н] , 1340 (5) [М+Н] . ЧП-МС-ВР (метод 1): C62H98N16O17 [M+H]+ розрах. 1339,7369, виявл. 1339,7368. Приклад 5 (порівняльний): Тристрифторацетат 3-трет-бутил-D-аланіл-3-(піридин-3-іл)-L-аланілдез(1-D-лейцил-2-L-лейцил)лізобактину Приклад 6: Трисгідрохлорид (триметилсиліл)D-аланіл-3-(піридин-3-іл)-L-аланіл-дез(1-D-лейцил2-L-лейцил)лізобактину У колонку (діаметром 35мм) набивають 32г іоніту Dowex 1X8-400 (НСl-форма). Далі через колонку пропускають приблизно 60мл 1-молярного розчину гідроксиду натрію, а потім 60мл води для РХВТ. Після цього колонку кондиціонують 60мл 1молярної соляної кислоти й потім промивають 89800 38 приблизно 100мл води до нейтральної реакції елюату (Macherey & Nagel Tritest). Далі в 90мл води розчиняють 2,00г (1,19ммоль) тристрифторацетату З-(триметилсиліл)-D-аланіл-З -(піридин3-іл)-L-аланіл-дез(1-D-лейцил-2-Lлейцил)лізобактину (сполука із прикладу 2), одержаний розчин подають у колонку і повільно елююють. Після цього колонку промивають приблизно 20мл води. Елюати, які містять продукт, поєднують, піддають тонкій фільтрації (через фільтр із розміром пор 0,20мкм) і ліофілізують. Потім колонку знову кондиціонують і використовують повторно. Таким шляхом з 2000мг (1,19ммоль) сполуки із прикладу 2 одержують 1,54г (1,06ммоль, 89% від теорії) зазначеної в заголовку прикладу 6 сполуки. РХВТ (метод 9): Rt=3,30хв. РХ-МС (метод 7): Rt=1,47хв.; МС (ESIpos): m/z (%)=671,5 (100) [М+2Н]2+, 1341,4 (20) [М+Н]+. Іонообмінна хроматографія (метод 25): Сl (розрах.)=7,43%, Сl виявл.=7,1%; вміст ТФОК (виявл.)
ДивитисяДодаткова інформація
Назва патенту англійськоюAcylated nonadepsipeptides used as lysobactin derivatives
Автори англійськоюvon Nussbaum Franz, Brunner Nina, Endermann Rainer, Fuerstner Chantal, Hartmann Elke, Paulsen Holger, Ragot Jacques, Schiffer Guido, Schuhmacher Joachim, Svenstrup Niels, Telser Joachim, Anlauf Sonja, Bruning Michael-Alexander
Назва патенту російськоюАцилированные нонадепсипептиды как производные лизобактина
Автори російськоюфон Нуссбаум Франц, Бруннер Нина, Эндерманн Райнер, Фюрстнер Шанталь, Хартманн Эльке, Паульсен Хольгер, Раго Жак, Шиффер Гуидо, Шумахер Йоахим, Свенструп Нильс, Тельсер Йоахим, Анлауф Соня, Брюнинг Михаэль-Александер
МПК / Мітки
МПК: A61P 31/04, C07K 5/06, C07K 11/00
Мітки: лізобактину, похідні, ацильовані, нонадепсипептиди
Код посилання
<a href="https://ua.patents.su/23-89800-acilovani-nonadepsipeptidi-yak-pokhidni-lizobaktinu.html" target="_blank" rel="follow" title="База патентів України">Ациловані нонадепсипептиди як похідні лізобактину</a>
Попередній патент: Сигаретна упаковка і спосіб її виготовлення
Наступний патент: Похідні гідантоїну як інгібітори металопротеїназ
Випадковий патент: Подрібнювач