Пептидний димер у формі трилисника (варіанти), спосіб його одержання (варіанти) та фармацевтична композиція (варіанти)
Номер патенту: 68324
Опубліковано: 16.08.2004
Автори: Вьолдіке Хелле Фабріціус, Тім Ларс, Нільсен Пер Франклін
Формула / Реферат
1.«Клеверный» пептид, отличающийся тем, что указанный пептид содержит два «клеверных» пептидных мономера, каждый из которых содержит единственный «клеверный» домен, связанные между собой дисульфидной связью между двумя остатками цистеина, причём указанные «клеверные» пептидные мономеры являются мономерами кишечного «клеверного» фактора (ITF).
2. Пептид по п. 1, отличающийся тем, что указанные ITF мономеры представляют собой ITF мономеры человека.
3. Пептид по п. 2, отличающийся тем, что его молекулярный вес составляет приблизительно 13000.
4. Пептид по п. 2, отличающийся тем, что димер ITF состоит из двух мономеров ITF, связанных дисульфидной связью между двумя остатками цистеина в позиции 57 каждого из мономеров.
5. Пептид по п. 1-4, отличающийся тем, что он предназначен для использования в качестве медикамента.
6. Пептид по п. 5, отличающийся тем, что он предназначен для использования в качестве медикамента для лечения или профилактики желудочно-кишечных растройств.
7. "Клеверный" пептид, отличающийся тем, что указанный пептид содержит два «клеверных» пептидных мономера, каждый из которых содержит единственный «клеверный» домен, связанные между собой дисульфидной связью между двумя остатками цистеина, причём указанные «клеверные» пептидные мономеры являются мономерами пептида, связанного с раком молочной железы (pS2).
8. Пептид по п. 7, отличающийся тем, что указанные «клеверные» пептидные мономеры представляют собой мономеры рS2 человека.
9. Пептид по п. 7, отличающийся тем, что димер рS2 состоит из двух мономеров рS2, связанных дисульфидной связью между двумя остатками цистеина в позиции 58 каждого из мономеров.
10. Пептид по п. 7-9, отличающийся тем, что он предназначен для использования в качестве медикамента.
11.Способ получения «клеверного» пептидного димера, отличающийся тем, что осуществляют культивирование подходящей клетки-хозяина, трансформированной ДНК последовательностью, кодирующей мономеры кишечного «клеверного» пептидного фактора (ITF), содержащие единственный домен в форме клеверного листа, в условиях, позволяющих получение указанного пептида, выделение из культуры полученных «клеверного» пептидного мономера и «клеверного» пептидного димера по пп. 1-6 методом хроматографии и извлечение указанного «клеверного» пептидного димера.
12. Способ получения «клеверного» пептидного димера, отличающийся тем, что осуществляют культивирование подходящей клетки-хозяина, трансформированной ДНК последовательностью, кодирующей мономер пептида, связанного с раком молочной железы (pS2), содержащий единственный домен в форме клеверного листа, в условиях, позволяющих получение указанного пептида, выделение из культуры полученных «клеверного» пептидного мономера и «клеверного» пептидного димера по пп. 7-10 методом хромотографии и извлечение указанного «клеверного» пептидного димера.
13. Фармацевтическая композиция, содержащая активное соединение вместе с фармацевтически приемлемым разбавителем или носителем, отличающаяся тем, что в качестве активного соединения она содержит эффективное количество «клеверного» пептида по пп. 1-6.
14. Фармацевтическая композиция, содержащая активное соединение вместе с фармацевтически приемлемым разбавителем или носителем, отличающаяся тем, что в качестве активного соединения она содержит эффективное количество «клеверного» пептида по пп. 7-10.
Текст
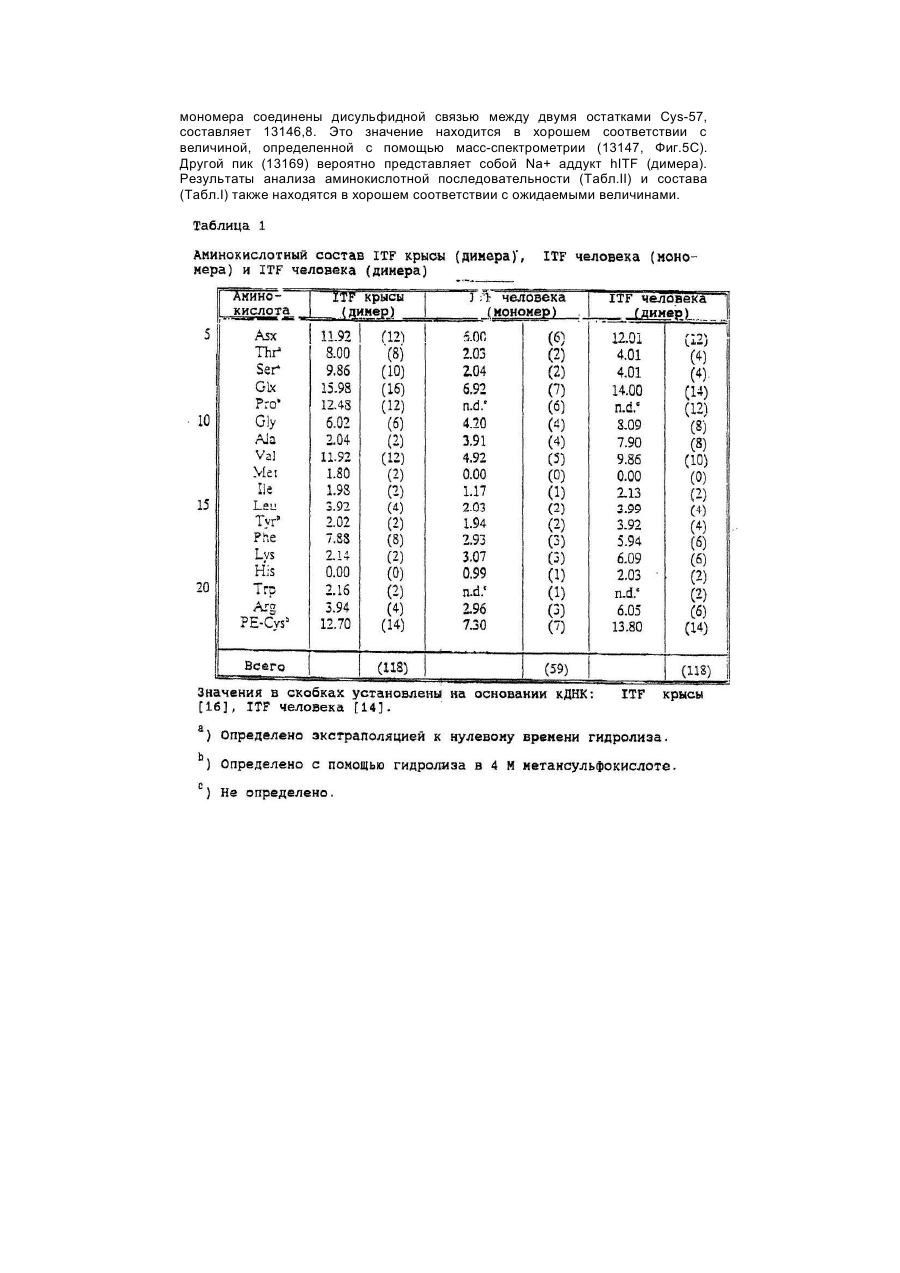
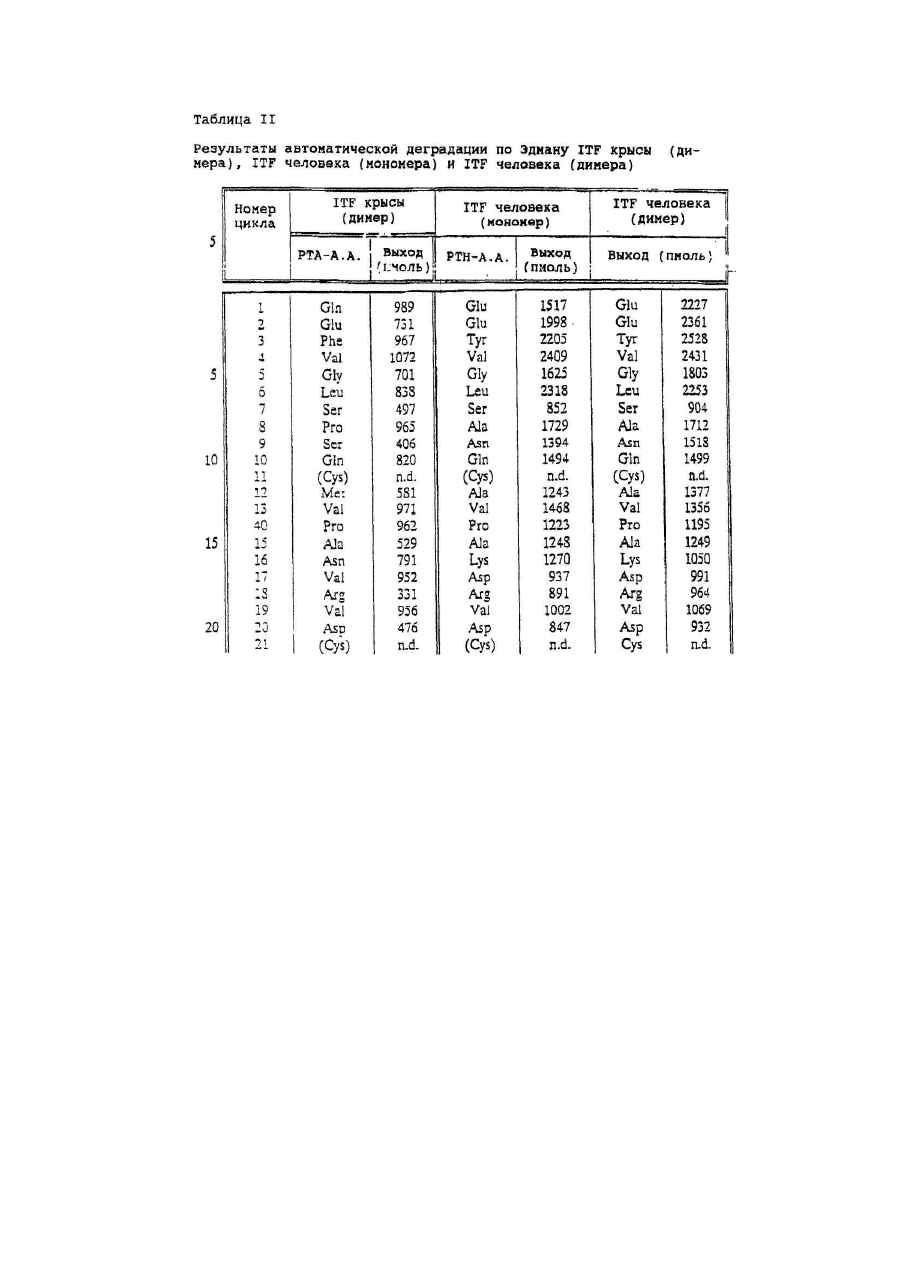
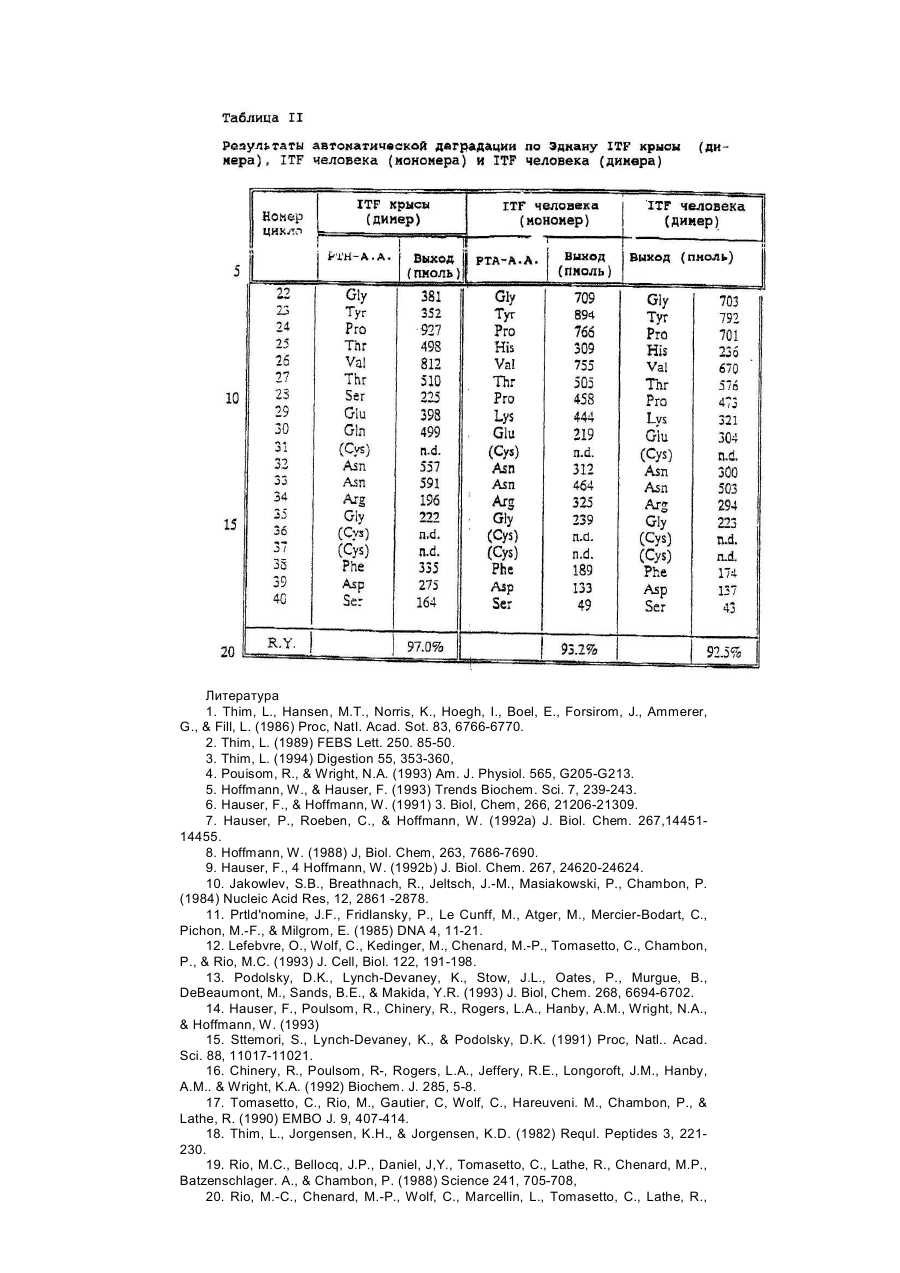
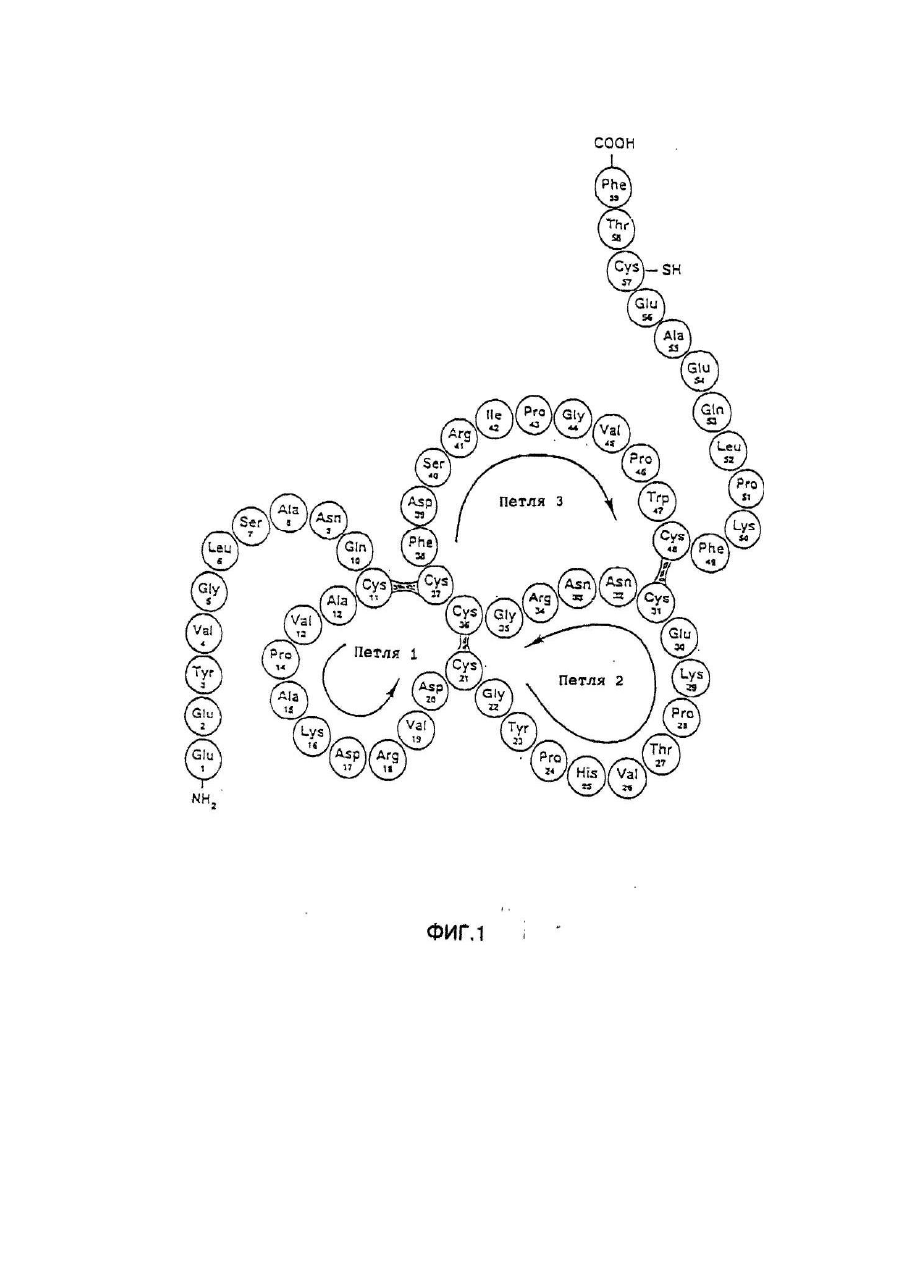
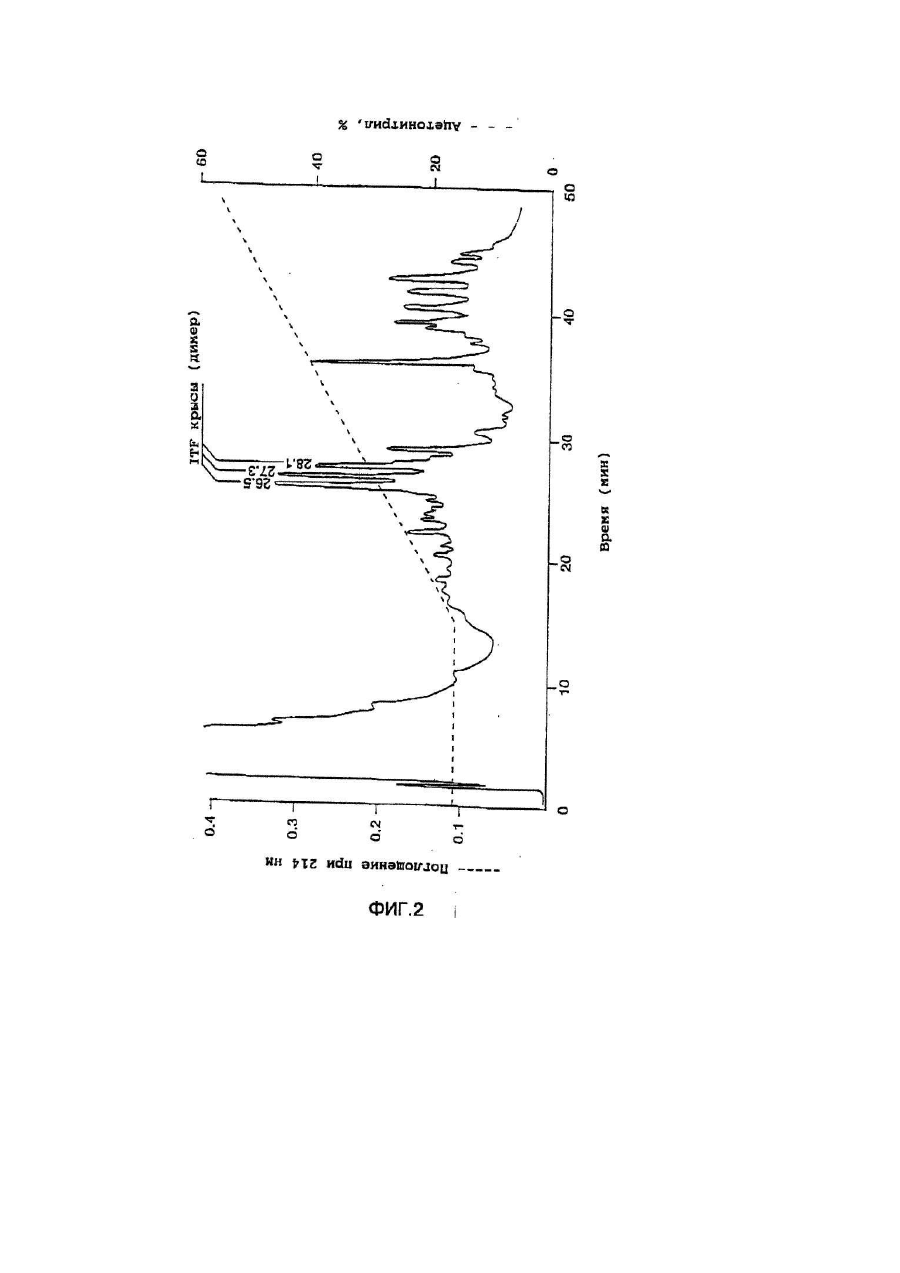
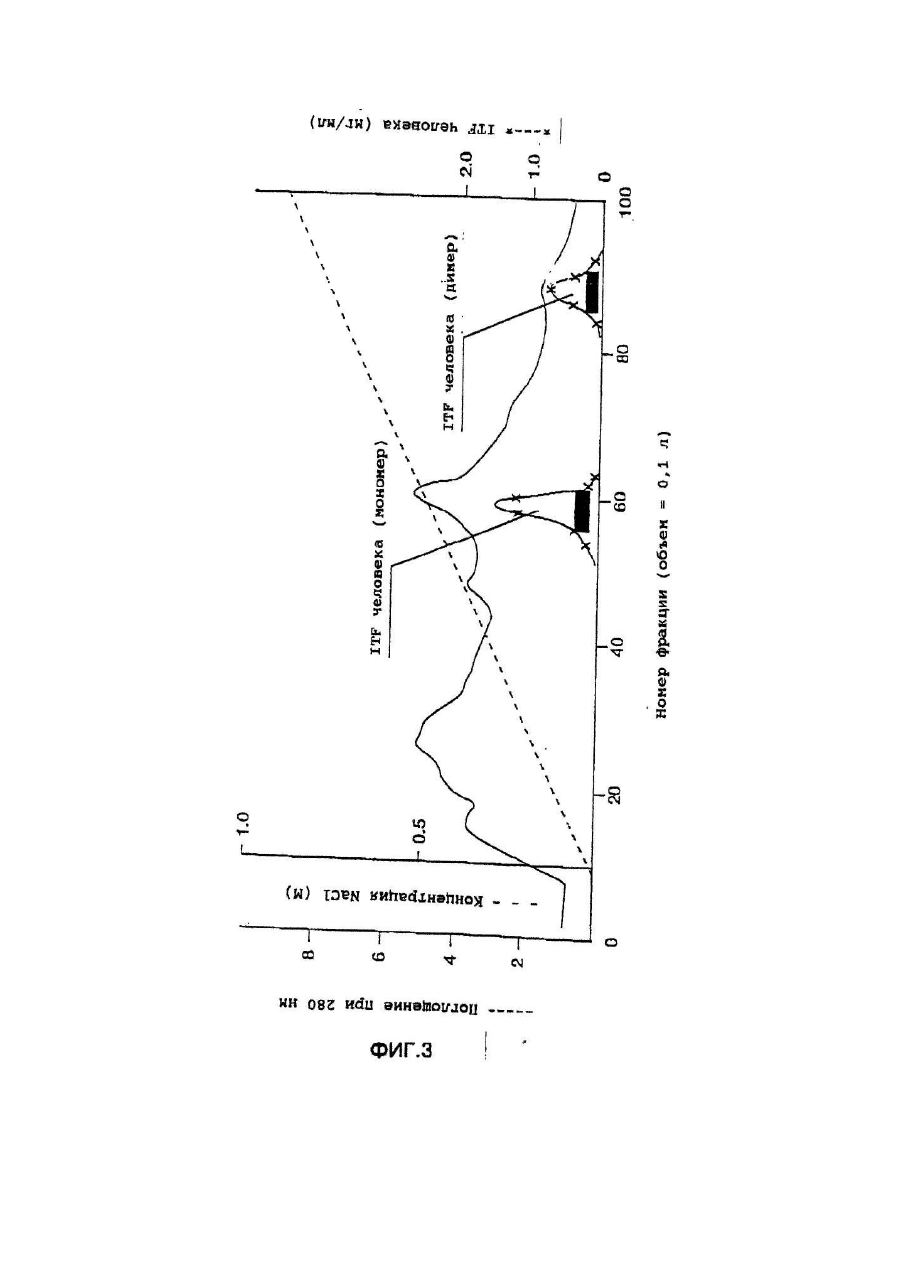
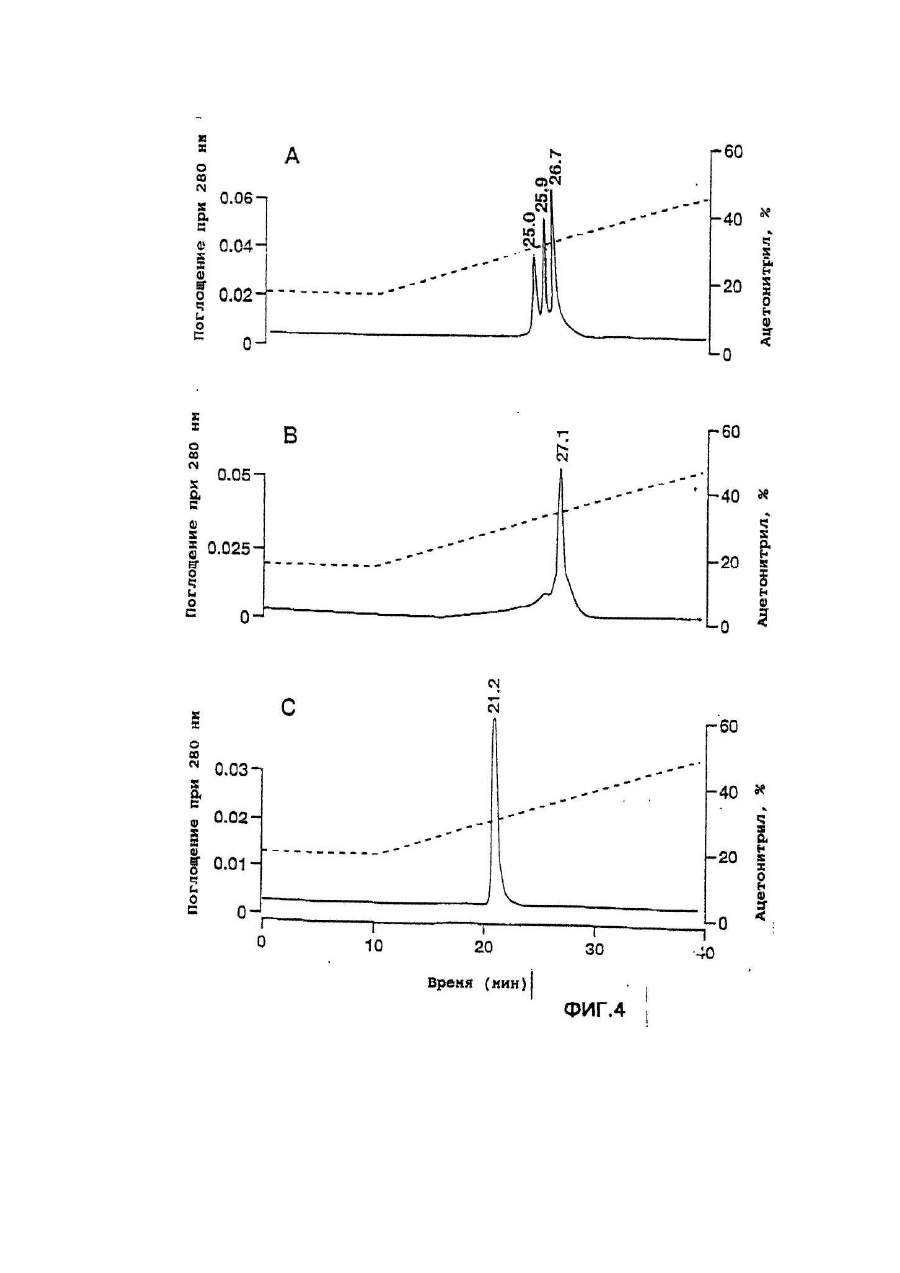
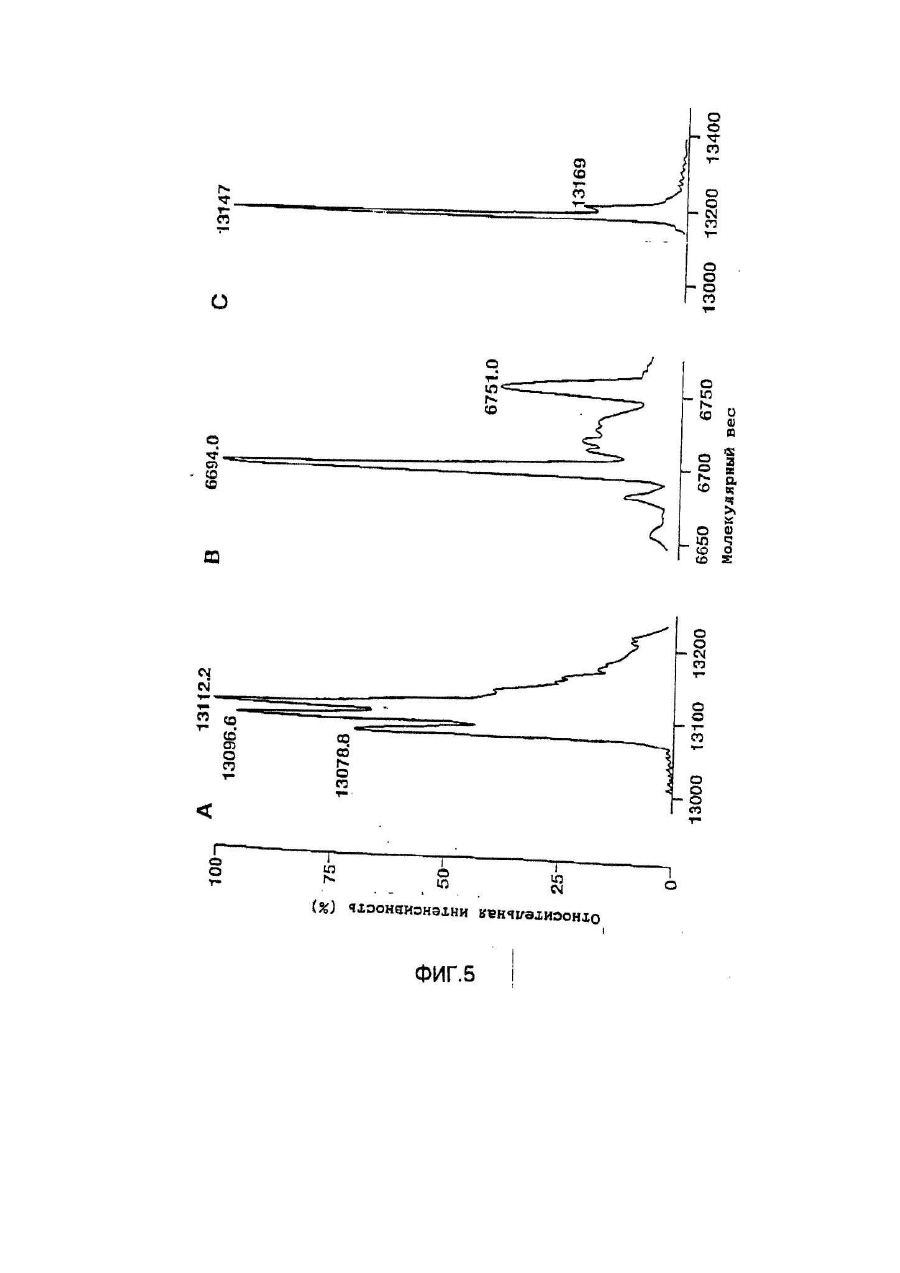
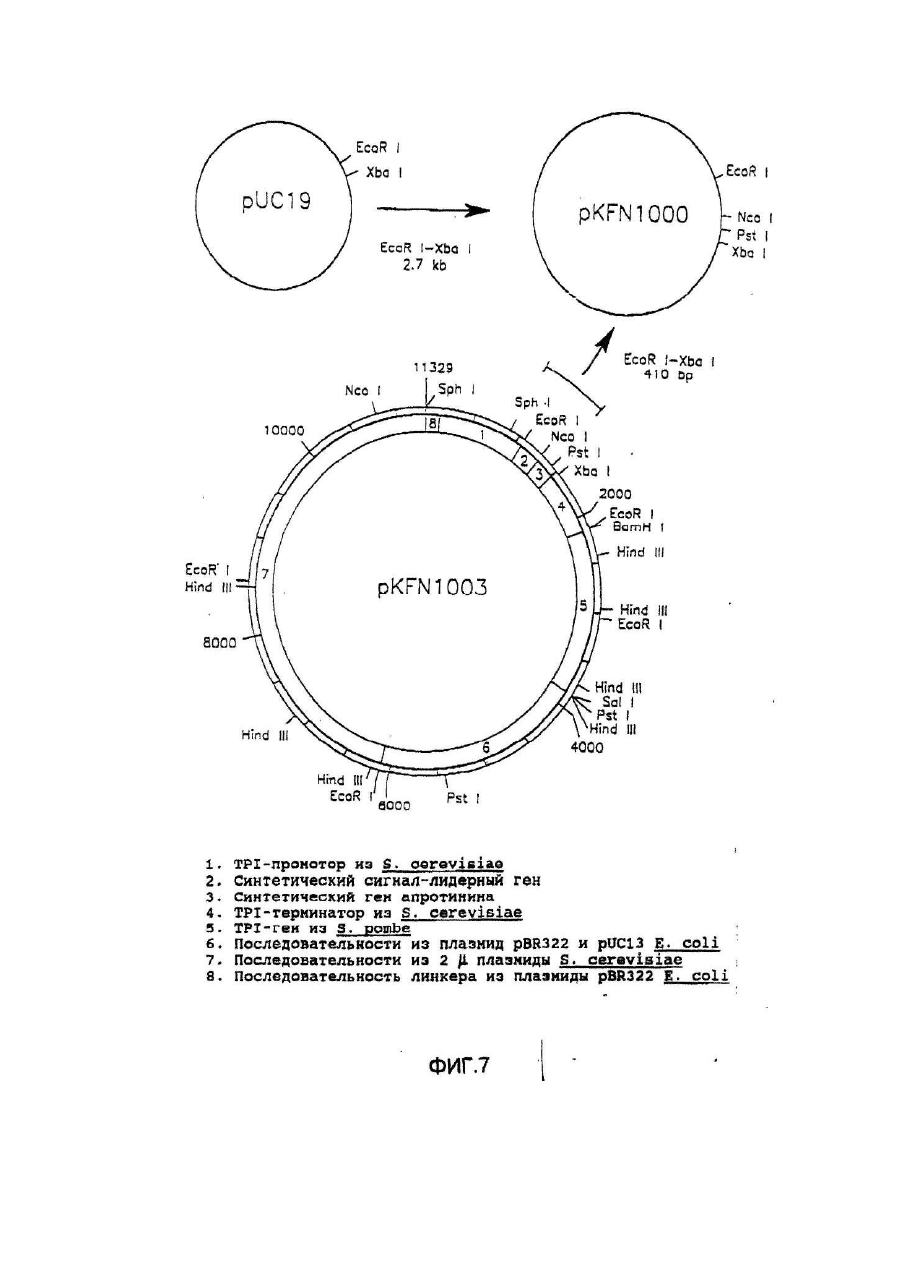
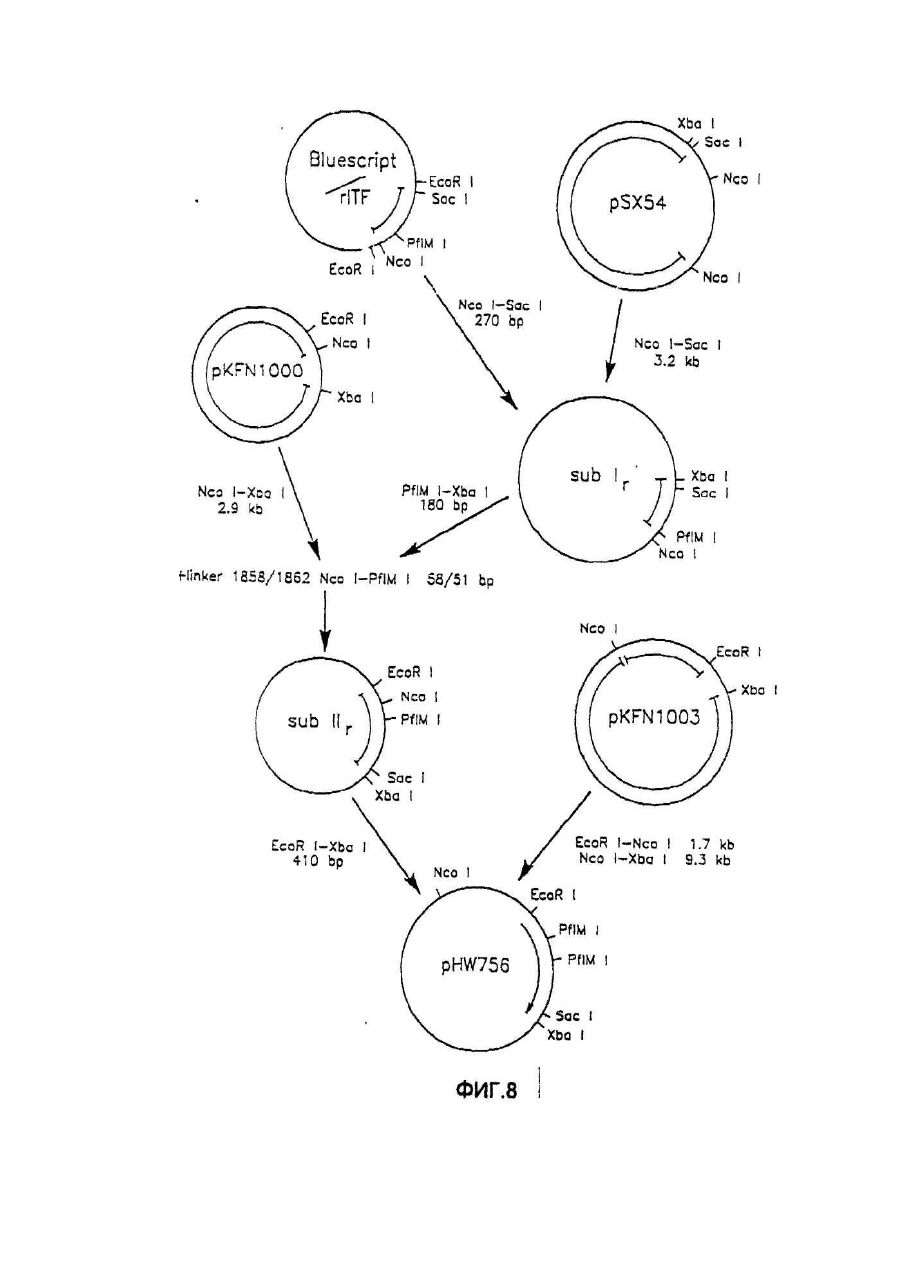
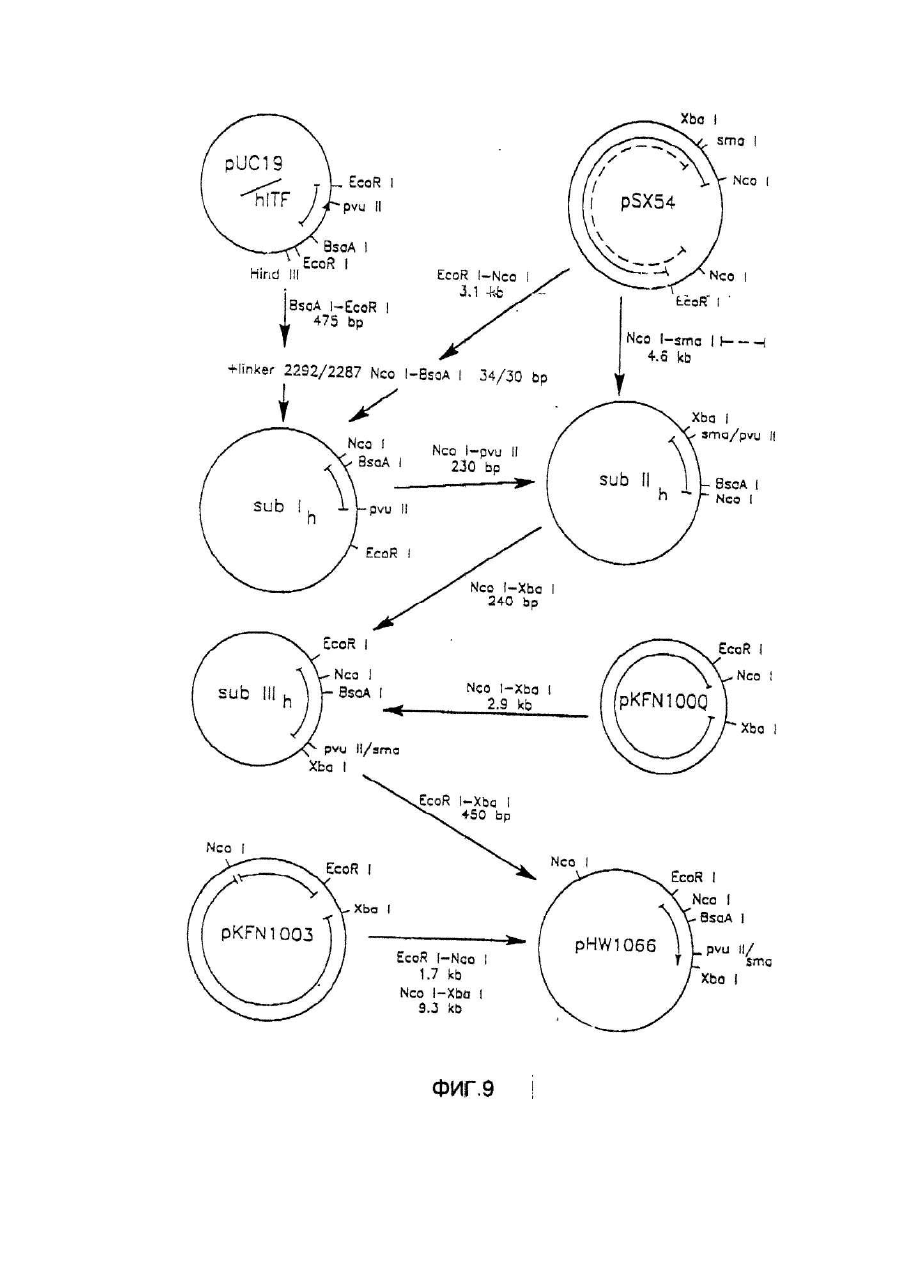
Настоящее изобретение касается дилеров "клеверных" пептидов, способов получения дилеров "клеверных" пептидов, фармацевтических составов, включающих димеры "клеверных пептидов", и их применения для лечения желудочно-кишечных расстройств. "Клеверные" пептиды образуют семейство пептидов, обнаруживаемых в основном в желудочно-кишечном тракте. "Клеверные" пептиды млекопитающих содержат один или более характерных доменов в форме клеверного листа [1], каждый из которых собран из аминокислотной последовательности, состоящей из 38 или 39; аминокислотных остатков, в которой б остатков полуцистина соединены в сочетании 1-5, 2-4 и 3-6, образуя таким образом характерную структуру в виде клеверного лиота. Известные к настоящему времени "клеверные" пептиды млекопитающих содержат или один, или два домена в форме клеверного листа (см. обзоры [3-5]), в то время как для лягушки Xenopus laavis описаны пептиды и белки, содержащие один [6], два [7], четыре [8] или шесть [9] доменов в форме клеверного листа. "Клеверными" пептидами млекопитающих, содержащими один домен, являются связанный с раком молочной железы рS2-пептид, известный к настоящему времени для человека [10, 11] и мыши [12], и кишечный "клеверный" фактор (ITF) человека [13, 14] и крысы [15, 16]. Для человека [17]," свиньи [18] и мыши [17] описан спазмолитический полипептид (SP), содержащий два домена в форме клеверного листа. у людей все три "клеверных" пептида - hpS2, hITF и hSP экспрессируются в норме в желудочно-кишечном тракте: hSP и hpS2 - в эпителиальном слое слизистой оболочки желудка [17, 19], a hITF - в эпителиальном слое слизистой оболочки танкой и толстой кишки [13]. Физиологическая роль "клеверных" пептидов не очень хорошо выяснена. Сообщалось об усилении экспрессии "клеверных" пептидов в желудочнокишечном тракте для ряда состояний, связанных с повреждением слизистой оболочки, таких как воспаление кишечника [20-22], язва желудка и двенадцатиперстной кишки [20, 23, 24]. На основании этих данных была предложена репаративная функция "клеверных" пептидов (например в [22]). Недавно авторами работ [25-27] было получено доказательство ускорения восстановления поврежденной эпителиальной слизистой оболочки в результате действия "клеверных" пептидов. Механизм, с помощью которого "клеверные" пептиды способствуют выполнению их репаративной функции, может заключаться в образовании сшивок между муциновыми гликопротеинами с формированием вязкоупругого глеевого слоя, устойчивого к действию ферментов пищеварения [3,28]. Клонирование однодоменного "клеверного" фактора кишечника крысы и человека и его применение для лечения повреждений желудочно-кишечного тракта описаны [29]. Обнаружена возможность получения димеров "клеверных" факторов, имеющих только один домен в форме клеверного листа и обладающих интересными фармакологическими свойствами. В соответствии с этим настоящее изобретение касается "клеверного" пептида, содержащего единственный домен в форме клеверного листа и существующего в виде дилера. Как отмечено выше, предполагают, что "клеверные" пептиды способствуют заживлению пептических язв и других повреждений, относящихся к слизистой оболочке, благодаря стабилизации слизистого слоя кишечного тракта, механизм подобной стабилизации в настоящее время не известен. Тем не менее рентгеноструктурный анализ (ср. [28]) панкреатического спазмолитического полилептида (PSP) свиньи, образующего два домена в форме клеверного листа, показал, что большинство имеющихся в наличии аминокислотных остатков принимают участие в формировании щели шириной 8-10А°, обнаруживаемой в каждом таком домене. Предварительные эксперименты показали, что эта щель способна вмещать часть олигосахаридной цепи, например углевода, связанного с муциновым гликопротеином. Если это так, то PSP с двумя подобными щелями могут сшивать молекулы муцинов друг с другом, помогая им образовывать защитный гель, покрывающий эпителий слизистой оболочки. Сейчас неизвестно, образуют ли in vivo димеры для осуществления схожей функции однодоменные "клеверные" пептиды (такие, как IFT и рS2) или у них другой механизм действия. Тем не менее, в настоящее время считается, что димеры таких "клеверных" пептидов действительно могут сшивать молекулы муцинов, являясь поэтому активной формой этих пептидов. Другой аспект настоящего изобретения касается способа получения димера "клеверного" пептида, содержащего единичный домен в Форме клеверного листа, способ, включающий культивирование соответствующих клеток-хозяев, трансформированных ДНК с последовательностью, кодирующей "клеверный" пептид, содержащий один домен в форме клеверного листа, в условиях, позволяющих наработку пептида, и выделение из культуры образующегося димера "клеверного" пептида. Следующий аспект настоящего изобретения касается фармацевтических составов, включающих димер "клеверного" пептида, содержащий единственный домен в форме клеверного листа, совместно с фармацевтически приемлемым разбавителем или носителем. Еще один аспект настоящего изобретения касается применения димера "клеверного" пептида, содержащего один домен в форме клеверного листа, в качестве лекарства и использования димера "клеверного" пептида, содержащего один домен в форме клеверного листа, для получения лекарства с целью профилактики и лечения желудочно-кишечных расстройств. Димером "клеверного" фактора может быть, в частности, димер кишечного "клеверного" фактора (ITF) или пептида, связанного с раком молочной железы (pS2). В частности, "клеверным" фактором является человеческий ITF, последовательность аминокислот мономера которого выглядит следующим образом: ZEYVGLSANQCAVPAKDRVDCGYPHVTPKECN NRGCCFDSRIPGVPWCPKPLQEAECTF, где Ζ представляет собой остаток Glu, Gln или pyrGlu, или его гомолог, способный димеризоваться и проявляющий схожую активность; или человеческий "pS2, последовательность аминокислот мономера которого выглядит следующим образом: ZAQTETCTVAPRERQNCGFPGVTPSQCANKGCC FDDTVRGVPWCFYPNTIDVPPEEECEF, где Ζ представляет собой остаток Glu, Gin или pyrGlu, или его гомолог, способный димеризоваться и проявляющий схожую активность. Гомологи ITF и pS2 охватывают пептиды с тем же самым характером расположения остатков цистеина и дмсульфидных связей (Фиг.1) и определенной степенью гомологии (в смысле либо идентичности аминокислотных остатков в соответствующих положениях, либо наличия консервативных замен) в петлях 1, 2 и 3. Гомология аминокислотной последовательности в области петель может варьировать в интервале от 1 до 10 аминокислотных остатков, а число аминокислотных остатков в каждой петле (кроме остатков цистеина) - от 7 до 12, предпочтительно - от 9 до 10. Гомологи ITF и pS2 могут содержать одну или более аминокислотных замен, делеций или вставок. Преимущественная природа этих изменений такова, что они не влияют в значительной мере на сворачиваемость и активность белка. Размер небольших делеций обычно составляет от 1 до 3 аминокислотных остатков в области петель и от і до 10 аминокислотных остатков в N- и Сконцевых областях; возможны одиночные амино- и карбоксиконцевые добавки, такие как аминоконцевой остаток метионина, небольшой линкерный пептид до 10 аминокислотных остатков или небольшая добавка, облегчающая очистку, такая как полигистидиновый тракт, антигенный эпитоп или связывающий домен (общие принципы см. в [30]). Примерами консервативных замен могут быть замены в райках группы основных аминокислот (например аргинина, лизина, гиотидина), кислых аминокислот (например глутаминовой и аспарагиновой аминокислот), полярных аминокислот (например глутамина и аспарагина), гидрофобных аминокислот (например лейцина, изолейцина, валина), ароматических аминокислот (например фенилаланина, триптофана, тирозина) и аминокислот с небольшим размером бокового радикала (например глицина, аланина, серина, треонина, метионина). Для специалистов в данной области должно быть очевидным, что подобные замены могут быть проведены для областей, отвечающих за функцию молекулы, в результате чего получается по-прежнему активный полипептид, существенные для активности настоящих "клеверных" пептидов аминокислоты могут быть идентифицированы в соответствии с известными специалистам методиками, такими как сайт-специфический и аланин-сканирующий мутагенез [31]. В последнем случав мутации вводят в каждый из аминокислотных остатков молекулы и получаются мутантные молекулы проверяют на биологическую активность (например, на заживление слизистой оболочки, защиту слизистой оболочки, заживление язвы желудка) с целью идентификации тех аминокислотных остатков, которые отвечают за активность молекулы. Возможен аллельный вариант гомолога, т.е. альтернативная форма гена, которая получается в результате мутации, или измененный пептид, кодируемый мутантным геном, но обладающий по существу такой же активностью как настоящий пептид. Следовательно, мутации могут быть "молчащие" (никаких изменений в кодируемом пептиде) или могут кодировать пептид с измененной аминокислотной последовательностью. Гомологом настоящего "клеверного" пептида кроме этого может быть видовой гомолог, т.е. полипептид со схожей активностью, происходящий из другого вида, например из мыши, крысы, кролика, коровы, свиньи или лягушки. В предпочтительной воплощении динар "клеверного" пептида по изобретению имеет значение молекулярного веса приблизительно 13000. Димер состоит из двух мономерных "клеверных" пептидов, связанных дисульфидной связью между двумя остатками цистеина в положении 57 для ITF-подобных мономеров или в положении 58 для рS2-подобных мономеров. Предпочтительным является получение димера "клеверного" пептида с помощью технологии рекомбинантной ДНК. С этой целью последовательность ДНК, кодирующая "клеверный" пептид, может быть выделена посредством создания библиотеки геномной или кДНК и поиска в соответствии со стандартными методиками с помощью гибридизации с синтетическими олигонуклеотидныяи зондами [32] последовательности ДНК, кодирующей пептид целиком или частично. Предпочтительной в рамках настоящего изобретения является кодирующая пептид последовательность ДНК человеческого происхождения, т.е. из биолиотеки геномной ДНК или кДНК человека. Последовательность ДНК, кодирующую "клеверный" пептид, также можно получить путем химического синтеза с помощью традиционных стандартных методов, например фосфоамида(и)тного метода, описанного в [33], или метода, изложенного в [34]. В соответствии с фосфоамида(и)тным методом олигонуклеотиды синтезируются, например, в автоматическом ДНК-синтезаторе, затем очищаются, отжигаются, лигируются и клонируются в подходящих векторах. Последовательность ДНК также может быть получена с помощью полимеразной цепной реакции с применением специфических праймеров, как например описано в [35, 36] или упомянутой выше работе [32]. Последовательность ДНК, кодирующую "клеверный" пептид, обычно вводят в реконбинантный вектор, представляющий собой любой из векторов, пригодных для проведения процедур с рокомбинантной ДНК, и выбор вектора часто зависит от природы клетки-хозяина, в которую он должен быть введен. Так данный вектор может быть автономно реплицирующимся вектором, например, существуя вне хромосомы и реплицируясь независимо от хромосомальной репликации, т.е. быть плазмидой. С другой стороны, вектором может быть один из тех векторов, которые, попадая в клетку-хозяина, интегрируются в геном клетки-хозяина и реплицируются совместно с хромосомой(ами), в которую они интегрированы. Предпочтительно, чтобы вектор являлся экспрессируемым вектором, в котором последовательность ДНК, кодирующая "клеверный" пептид, оперативно соединена с дополнительными участками, необходимыми для транскрипции ДНК. В общем случае экспрессируемый вектор происходит из плазмидной или вирусной ДНК или содержит элементы обоих. Термин "операбельно соединена" означает, что участки организованы таким образом, что функционируют во взаимодействии друг с другом для выполнения предназначенных целей, т.е. транскрипция начинается на промоторе и проходит на всем участке ДНК, кодирующем полипептид. Промотором может быть любая последовательность ДНК, демонстрирующая транскрипционную активность в выбранной клетке-хозяине, происходящая из генов, кодирующих белки как гомологичные, так и гетерологичные клетке-хозяину. Примерами подходящих для проведения транскрипции ДНК, кодирующей "клеверные" пептиды, в клетках млекопитающих промоторов являются промотор SV40 [37], промотор МТ-1 (промотор гена металлотионеина) [38] или главный поздний промотор аденовируса 2. Примером соответствующего промотора для использования в клетках насекомых является полиэдриновый промотор [39, 40], Р10-промотор [41], промотор основного белка вируса полиэдроза Autographa califоrnica [42], промотор "быстрого" раннего гена і бакуловируса [43, 44] или промотор замедленного раннего гена бакуловируса 39К [43, 44]. Соответствующими промоторами для использования в дрожжевых клеткаххозяевах являются промоторы дрожжевых гликолитических генов [45, 46], или генов алкогольдегидрогеназы [47], или TP11- [48], или АDН2-4с-промоторы [49]. Примерами подходящих для использования в нитчатых грибах как клеткаххозяевах промоторов являются, например, ADН3-промотор [50] или tpiАпромотор. В качестве примеров других полезных промоторов можно привести промоторы генов ТАКА-амилаэы из A. oryzae, аспарагиновой протеинаэы из Rhizomucor miehei, нейтральной a-амилаэы из l niqer, кислотостабяльной aамилазы из A. niqer, глюкоамилаз. (gluA) иэ Α.niqer или А. awamori, липазы из Rhizomucor miehei, щелочной протеазы из А. оryzaе, триозофосфатизамераэы из А. oryzae или ацетамидазы из A. nidu-lans. Предпочтительными являются промоторы генов ТАКА-амилазы и gluA· Соответствующие промоторы указаны, например, в [51] и [52]. Последовательность ДНК, кодирующая "клеверный" пептид, кроме того, при необходимости может быть оперативно связана с подходящим терминатором, таким как терминатор гена гормона роста человека [53] или, когда в качестве клеток-хозяев используются грибы, терминаторы ТРl1 [46] или ADH3 [50]. Вектор также может включать такие элементы, как полиаденилатные сигналы (например из Elb-области SV40 или аденовируса 5), последовательности, усиливающие транскрипцию (например энхансер SV40), и последовательности, усиливающие трансляцию (такие, например, как кодирующие РНКы аденовируса VA). Рекомбинантный вектор также может включать последовательность ДНК, дающую возможность вектору реплицироваться в рассматриваемой клеткехозяине. Примерок подобной последовательности (когда клеткой-хозяином является клетка млекопитающего) является ориджин репликации SV40. Когда клеткой-хозяином является дрожжевая клетка, соответствующими последовательностями, дающими возможность вектору реплицироваться, являются гены репликации REP 1-3 и ориджин репликации дрожжевой плазмиды 2m. Вектор также может содержать селективный маркер, например ген, продукт которого дополняет дефект клетки-хозяина, такой как ген дегидрофолатредуктазы (DHFR) или ΤΡl-ген Schizosaccha-romyces роmbе (описанный в [54]), либо ген, придающий устойчивость к лекарствам, например ампициллину, канамицину, тетрациклину, хлорамфениколу, неомицину, гигромицину или метотрексату. Для нитчатых грибов селективные маркеры включают amdS, pyrG, аrgB, nіаU или sC. Для того чтобы направить "клеверный" пептид, описанный в настоящем изобретении, по секреторному пути клетки-хозяина, в рекомбинантный вектор может быть введена секреторная сигнальная последовательность (известная также как лидерная последовательность, предпро-последовательность или предпоследовательность). Секреторная сигнальная последовательность присоединяется к последовательности ДНК, кодирующей "клеверный" пептид, в корректной рамке считывания. Обычно сигнальная последовательность располагается с 5'-конца последовательности ДНК, кодирующей пептид. В качестве секреторной сигнальной последовательности может применяться сигнальная последовательность, в норме ассоциированная с данным пептидом, либо последовательность гена, кодирующего другой секреторный белок. Для секреции из дрожжевых клеток секреторная сигнальная последовательность может кодировать любой сигнальный пептид, обеспечивающий эффективное направление экспрессированного "клеверного" пептида в секреторный путь клетки. Сигнальным пептидом может быть от природы имеющийся сигнальный пептид (либо его функциональная часть) или синтетический пептид. Было установлено, что соответствующими сигнальными пептидами являются сигнальный пептид a-фактора [54], сигнальный пептид амилазы слюны мыши [55], модифицированный сигнальный пептид карбоксипептидазы [56], сигнальный пептид BAR1 дрожжей [57] или сигнальный пептид дрожжевой аспарагиновой протеазы З (YАР3) [57]. Кроме этого для эффективной секреции в дрожжах между сигнальной последовательностью и последовательностью ДНК, кодирующей "клеверный" пептид, может быть введена последовательность, кодирующая лидерный пептид. Функция лидерного пептида заключается в том, что он позволяет экспрессированному пептиду направляться из эндоплазматического ретикулума в комплекс Гольджи и далее в секреторные визикулы для секреции в культуральную среду (т.е. направляет экспорт "клеверного" пептида через клеточную стенку или, по меньшей мере, через клеточную мембрану в периплазматическое пространство дрожжевой клетки). В качестве лидерного пептида может выступать лидерный пептид дрожжевого a-фактора (его использование описано например в [54, 59-63]). С другой стороны, лидерный пептид может быть искусственным, иными словами, не природным. Синтетический лидерный пептид может, например, быть сконструирован, как описано в [64] или [65]. С целью использования в нитчатых грибах сигнальный пептид можно удобно получать из гена, кодирующего амилазу или глюкоамилазу из Asperqillus sp., гена, кодирующего липазу или протеазу из Rhizomucor mieheі или липазу из Humicola lanuginosa. Предпочтительным является сигнальный пептид гена, кодирующего ТАКА-амилазу из A. oryzae, нейтральную a-амилазу из А. nigеr, кислотостабильную a-амилазу из A. niqer или глюкоамилазу иа А. niqer. Соответствующие сигнальные пептиды описаны в [51] и [66]. Для использования в клетках насекомых такой сигнальный пептид может быть получен на основе гена насекомого (ср. [67]), как, например, сигнальный пептид предшественника адипокинетического гормона чешуекрылого Manduca sexta (ср. [68]). Методики, применяемые для лигирования последовательностей ДНК, кодирующих "клеверный" пептид, промотор и возможно терминатор и/или секреторную сигнальную последовательность, соответственно, и введения их в подходящие вектора, содержащие информацию, необходимую для репликации, хорошо известны специалистам в даной области (ср. например [32]). Клетка-хозяин, в которую вводят последовательность ДНК, кодирующую "клеверный" пептид, может представлять собой любую клетку, способную продуцировать данный пептид в димерной форме, включая клетки дрожжей, грибов и высших зукариотов. Примерами соответствующих клеточных линий млекопитающих являются клеточные линии COS (АТСС CRL 1650), ВНК (АТСС CRL 1632, АТСС CCL 10), CHL (АТСС CCL 39) или СНО (АТСС CCL 61). Способы трансфекции клеток млекопитающих и экспрессии, введенных в них последовательностей ДНК описаны в работах [69-75]. Примеры соответствующих дрожжевых клеток включают клетки Saccharomyces spp. или Schizosaccharomyces spp., в особенности штаммы Saccharomyces cerevisiae или Saccharomyces kluyveri. Способы трансформации дрожжевых клеток гетерологичной ДНК и продуцирования в них гетерологичных полипептидов описаны, например в [38, 54, 76-78], каждый из которых, таким образом, приведен в ссылках. Трансформированные клетки отбирают по фенотипу, определяемому по селективному маркеру, обычно по устойчивости к лекарственному препарату или способности расти в отсутствии определенного компонента питательной среды, например, лейцина. Предпочтительным для использования в дрожжах является вектор POT1, описанный в [76]. Последовательности ДНК, кодирующей "клеверный" пептид, может предшествовать сигнальная последовательность, а возможно и лидерная последовательность, как, например, описано выше. Другими примерами соответствующих дрожжевых клеток являются штаммы Kluyveromyces, такие как K.lactis, Hansenula, например Η.polymorpha, или Pichia, например Р. pastoris (cp. [79, 80]). Примерами других грибных клеток являются клетки нитчатых грибов, например Asperqillus spp., Neurospora sрр.., Fusarium spp. или Trichoderma spp., в особенности A. oryzae, A. nidu-lana, A. niqer. Применение Aspergillus spp для экспрессии белков опиcано, например, в [51, 81, 82], Трансформация F.oxysporum может, например, быть проведена. Как описано в [83], a Trichoderma spp. - как в [84]. Когда в качестве клетки-хозяина используется клетка нитчатого гриба, она может быть трансформирована сконструированной по настоящему изобретению ДНК посредством интеграции последней в хромосому клетки-хозяина для получения рекомбинантной клетки-хозяина. Как правило, считается, что подобная интеграция имеет то преимущество, что введенная последовательность ДНК будет более стабильно поддерживаться в клетке. Интеграция сконструированных последовательностей ДНК в хромосому клетки-хозяина может быть осуществлена в соответствии с общепринятыми способами, например посредством гомологичной или гетерологичной рекомбинации. Трансформация клеток насекомых и продукция в них гетерологичных полипептидов может быть осуществлена, как описано в патентах [39, 42-44, 85], включенных здесь в список литературы. В качестве клеточных линий насекомых, используемых как клетки-хозяева, подходит клеточная линия Lepidoptera, например клетки Spodoptera fruqiperda или клетки Trichoplusia ni (ср.[86]). Для культивирования подходят условия, описанные, например, в [87] или [88] либо в любой из вышеупомянутых ссылок. Подвергнутые трансформации или трансфекции описанные выше клеткихозяева далее культивируют в соответствующей питательной среде в условиях, допускающих экспрессию "клеверного" пептида, после чего образовавшийся пептид полностью или частично может быть выделен из культуры в димерной форме. В качестве среды культивирования можно использовать любую общепринятую среду, пригодную для роста клеток-хозяев, например минимальную или комплексную среду, содержащую соответствующие добавки. Подходящие среды являются коммерчески доступными или их можно приготовить в соответствии с опубликованными рецептами (например в соответствии с каталогами American Type Culture Сol lection). Продуцируемый клетками "клеверный" пептид далее может быть выделен из культуральной среды с помощью общепринятых методик, включающих отделение клеток-хозяев от среды посредством центрифугирования или фильтрования, осаждение белковых компонентов супернатанта или фильтрата с помощью соли, например сульфата аммония, очистку с использованием разнообразных хроматографических методик, например ионообменной хроматографии, гель-фильтрации, аффинной хроматографии или им подобных в зависимости от типа рассматриваемого полипептида. Димер "клеверного" пептида можно вводить в фармацевтический состав по изобретению согласно любому из устоявшихся методов приготовления фармацевтических составов, например, как описано в [89]. Такой состав может быть изготовлен в пригодной для систематических инъекций или инфузий форме и таким образом может включать стерильную воду или изотонический раствор соли либо глюкозы. Составы можно стерилизовать о помощью стандартных методик стерилизации, хорошо известных специалистам в данной области. Полученные водные растворы можно сразу упаковать для использования или профильтровать в асептических условиях и высушить лиофильно; лиофилизованный препарат перед введением смешивают со стерильным водным раствором. Фармацевтический состав может содержать фармацевтически приемлемые добавочные вещества, необходимые для приближения к физиологическим условиям, такие как забуферивающие агенты, регулирующие тонус вещества и им подобные, например, ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция и т.д. Фармацевтический состав по настоящему изобретению также может быть адаптирован для назального, трансдермального и ректального введения. Фармацевтически приемлемый наполнитель или разбавитель, используемый в состава, может представлять собой любой традиционный твердый наполнитель. Примерами твердых наполнителей являются лактоза, терра альба, сахароза, тальк, желатин, агар, пектин, аравийская камедь, стеарат магния и стеариновая кислота. Подобным же образом наполнитель или разбавитель может включать любой известный специалистам способствующий выведению материал, такой как глицерилмоностеарат или глицерилдистеарат, один либо в снеси с парафином. Содержание твердого наполнителя будет широко варьировать, однако обычно будет находиться в интервале от 25мг до 1г. Концентрация "клеверного" пептида в таком составе может изменяться в широких пределах, например от приблизительно 5% до приблизительно 100% по весу. Предпочтительная концентрация лежит в области 50-100% по весу. Стандартная доза для такого состава обычно может содержать от приблизительно 1мг до приблизительно 200мг, предпочтительно от приблизительно 25мг до приблизительно 75мг, в частности, приблизительно 50мг пептида. Согласно указанному выше считается, что представляемый в данном изобретении димер "клеверного" пептида является активной формой указанного пептида. В связи с этим предполагается, что он будет полезным в случае применения его с целью предупреждения или лечения заболеваний желудочнокишечного тракта. Более конкретно предполагается использование его для лечения желудочных или пептических язв, воспалительных заболеваний кишечника, болезни крона или повреждений кишечного тракта, вызванных радиационной терапией, бактериальными либо другими инфекциями и т.д. Доза полипептида, вводимого пациенту, будет изменяться в зависимости от типа и тяжести состояния лечащегося, но обычно лежит в интервале 0,1-1,0мг/кг веса тела. Дальнейшие детали настоящего изобретения описываются в примере со ссылками на прилагаемые рисунки, где Фиг.1 Предполагаемая структура кишечного "клеверного" фактора (ITF) человека, первичная аминокислотная последовательность взята из работы [14], а дисульфидные связи расставлены исходя из гомологии с PSP и pS2 [2]. Фиг.2 Обращенно-фазная ВЭЖХ супернатанта из дрожжевого штамма HW756, экспрессирующего ITF крысы, на колонке Vydac 214ТР54. Фиг.3 Ионообменная хроматография частично очищенного ITF человека на колонке с Fast Flow SP-Сефарозой. Количество мономера и димера ITF человека определяли с помощью аналитической ВЭЖХ. Окрашенные прямоугольники указывают фракции, собранные для дальнейшей очистки мономерной и димерной форм. Пунктирная линия соответствует концентрации NaCl в элюирующем растворителе. Фиг.4 Обращенно-фазная ВЭЖХ очищенных димера ITF крысы (А), мономера ITF человека (В) и димера ITF человека (С) на колонке Vydac 214TP54 С4. Пунктирная линия показывает концентрацию ацетонитрила в элюирующем растворителе. Фиг.5 Масс-спектры очищенных ITF крысы (димера) (A), ITF человека (мономера) (В) и ITF человека (димера) (С). Фиг.6 Структура димерной формы ITF человека. Фиг.7 Рестрнкционная карта плазмиды KFN 1003. Фиг.8 Конструкция плазмиды pHW756. Фиг.9 Конструкция плазмиды pHW1066. Пример Материалы и методы Клонирование ITF крысы (rITF) и ITF челолвека (hITF) Клонирование ITF крысы и человека выполняли, как описано в [15, 16, 29] (rlTF) и [13, 14] (hITF). Конструирование плазмид, экспрессирующих rITF и hITF Согласно схемам, приведенным на Фиг.7-9, были сконструированы экспрессирующие плазмиды pHW756 для секреции ITF крысы и pHW1066 для секреции ITF человека. Экспрессирующий дрожжевой вектор pKFN1003 (описан в [90]) представляет собой производную плазмиды СРОТ [91]. Он содержит в качестве селективного маркера ТРІ-ген Schizosaccharomyces pombe (POT) [53], промотор триозофосфатизомеразы S. cerevisiae (TPI) и терминатор, контролирующий экспрессию [46]· Ген ITF крысы первоначально клонировали в Bluescript II KS(-) (Stratagene), из которого его размножали в соответствии с Фиг.8. Вспомогательный вектор pSX54, обеспечивающий полезные для клонирования сайты, составлен из pUC18 и pDN1050 [92]. Синтетический ДНК-линкер Nco1-PflM1 имеет следующую последовательность нуклеотидов: 1858: 5'-CATGGGTGAAAGATTGGAAAAGAGACAAG AGTTCGTTGGTTTGTCTCCATCCC AATGT-3' 58 н.п. 1862: 5'-TTGGGATGGAGACAAACCAACGAACTCTTG TCTCTTTTCC^TCTTTCAGC -3' 51 н.п. Линкер кодирует 8 С-концевых аминокислот лидерной последовательности, как описано в [93], с несколькими изменениями в выборе кодонов, а N-концевая часть гена ITF крысы имеет следующую последовательность: QEFVGLSPSQC, Сигнальная и лидеркая аминокислотные последовательности описаны там же: MKAVFLVLSLIGFCWAQPVTGDESSVEIPEESLIIAE NTTLANVAMAERLEKR. Ген человеческого ITF клонировали в PUC19 и размножали в соответствии с Фиг.9. Синтетический ДНК-линкер Nco1-BsaAl имеет следующую последовательность: 2292: S'-CATGGCTGAAAGATTGGAAAAGAGA GAAGAATAC-3' 34 н.п. 2287: 5'-СТАТТСТТСТСТСТТТТССААТСТТТСА СС-3' 30 н.п. Линкер кодирует в С-концевых аминокислот лидерной последовательности, как описано для конструкции rlTF, а тремя N-концевыми аминокислотами гена hITF являются EEY. Сигнальная и лидерная последовательности такие же, как и ранее. Экспрессирующими плазмидами трансформировали штамм S. cerevisiae МТ 663 (Е2-7В Х E11-36 а/a, dtpi/dtpi, pep 4-3/pep 4-3) с селекцией по росту на глюкозе в качестве единственного источника углерода. Дрожжевые трансформанты, экспрессирующие ITF крысы и человека, были названы HW756 и HW1066, соответственно. Ферментации Описанные выше трансформанты культивировали в течение 72ч. при 30°С в дрожжевой пептон-декстрозной (YPD) среде [94], дополненной дрожжевым экстрактом (60г/л). По окончании ферментации были достигнуты значения оптических плотностей при 660нм равные 153 И 232 для HW756 (rlTF) и HW1066 (hITF), соответственно. По окончании ферментации рН подводили до 2,5 с помощью 1Μ фосфорной кислоты и дрожжевые клетки удаляли центрифугированием при 3000об/мин в течении 15мин. Очистка ракомбинантного rlTF Концентрацию rlTF в дрожжевой ферментационной питательной среде и фракциях, полученных во время очистки, измеряли с помощью аналитической ВЭЖХ. Аликвоты (обычно 50-200мкл) наносили на С4 ВЭЖХ-колонку (0,46х25см) Vydac 214TP54 для обращенно-фазной хроматографии, уравновешенную 0,1% (v/v) TFA в 15% (ν/ν) ацетонитриле, при 30°С и скорости потока 1,5мл/мин. После 10мин изократического элюирования концентрацию ацетонитрила в элюирующем растворителе увеличивали в течение 40мин. до 55%. Измеряли поглощение при 214нм. Выли обнаружены три пика, элюирующиеся с временами удерживания 26,5мин., 27,3мин. и 28,2мин. (Фиг.2), представляющие собой димерные формы rlTF. Количество пептидов определяли, используя калибровочный hSP-стандарт [93]. Уровень экспрессии рекокбинантного ITF крысы в данной дрожжевой системе составлял 113мг/л. С помощью центрифугирования из ферментера вместимостью 10л было выделено 8,7л ферментационного бульона. Для понижения проводимости супернатант был разбавлен 14,8л дистиллированной воды, образец наносили на колонку (5х42см) с SP-Сефароэой Fast Flow (Pharmacia) при скорости потока 600мл/ч. Перед использованием колонку уравновешивали 50мм формиатным буфером рН 3,7. ITF крысы элюировали с колонки 50мм муравьиной кислотой рН 3,7, содержащей 50мМ NаCl. В процессе хроматографии при скорости потока 600мл/ч отбирали фракции объемом по 100мл, которые анализировали на содержание rITF. Фракции с предыдущей стадии, содержащие rITF, объединяли (2,3л) и наносили на колонку (5х10см) с Amberahromе (G-71). Перед использованием колонку уравновешивали 10мМ аммоний-ацетатным буфером рН. 4,8 при скорости потока 0,5л/ч. После нанесения колонку промывали 0,5л уравновешивающего буфера и элюировали 10нМ аммоний-ацетатным буфером рН 4,8, содержащим 60% (ν/ν) этанола, при скорости потока 0,1л/ч. Отбирали фракции, содержащие rITF, объемом 10мл. Концентрацию этанола в объединенных фракциях повышали от 60% (ν/ν) до 87% (ν/ν) добавлением 2 объемов этанола (99,9%, ν/ν) и, охлаждая полученную смесь до температуры минус 25°С в течение 16ч., осаждали rITF. Осадок собирали центрифугированием в течение 1ч. при 10000g и -25°С и перерастворяли при комнатной температуре в 130мл 20мМ муравьиной кислоты рН 3,0. Образец наносили на колонку (5х20см) с SP-Сефарозой Fast Flow (Pharmacia) при скорости потока 50мл/ч. Перед использованием колонку уравновешивали 20мМ муравьиной кислотой рН 3,0. Пептиды элюировали с колонки с помощью линейного градиента, составленного из 1,5л 50мМ муравьиной кислоты, рН 3,0 и 1,5л муравьиной кислоты, рН 3,0, содержащей 0,5Μ NaCl. В процессе хроматографии при скорости потока 80мл/ч отбирали фракции (10мл), в которых измеряли оптическую плотность при длине волны 280нм. В отобранных фракциях измеряли содержание rITF, после чего фракции, содержащие rITF, объединяли. Дальнейшую очистку ITF крысы проводили с помощью препаративной ВЭЖХ. объединенные фракции (900мл) наносили на препаративную С4 ВЭЖХ-колонку (2,2х25см) Vydac 214TP1022, уравновешенную 0,1% (v/v) TFA. Пептиды элюировали при 25°С и скорости потока 5мл/мин с помощью линейного градиента (540мл), составленного из MeСN/H2O/TFA (10:89,9:0,1 v/v/v) и MeCN/H2O/TFA (65:34,9:0,1 ν/ν/ν). Регистрировали поглощение в ультрафиолетовой области при длине волны 280нм, отбирали фракции объемом 10мл и анализировали их на содержание rITF. Содержащие rITP фракции объединяли, и полученный раствор уменьшали в объеме до 30% центрифугированием под вакуумом. Окончательное выделение rITF осуществляли лиофилизацией. Общее количество rITF, полученное из 8,7л ферментационной среды, составило 236мг, что соответствует общему 24% выходу по всем этапам очистки. Очистка рекоибинантного hITF Концентрацию hITF в дрожжевой ферментационной питательной среде и фракциях, полученных во время очистки, измеряли с помощью системы ВЭЖХ, идентичной описанной для rITF. Были обнаружены два пика, элюирующиеся с временами удерживания 21,2мин. и 27,1мин. (Фиг.2), представляющие собой по данным масс-спектрометрии и анализу последовательностей димерную и мономерную формы hITF. Уровень экспрессии рекомбинантного ITF человека в данной дрожжевой системе составил 90мг/л. С помощью центрифугирования из ферментера вместимостью 10л было выделено 8,0л ферментационного бульона. Образец диализовали против 3 смен (каждая длительностью 24ч.) по 40л 10мМ муравьиной кислоты, рн 2,5. образец наносили (0,25л/ч) на колонку (5х40см) с SP-сефарозой Fast Flow (Pharmacia), колонку промывали 5л 20мМ муравьиной кислоты, рн 2,5 и 5л муравьиной кислоты, рн 2,5, содержащей 1Μ NaCl. Отбирали фракции объемом по 100мл и анализировали их на содержание hITF (Фиг.3). С колонки были элюированы две формы hITF, одна из которых представляла мономерную форму (элюируется при 0,5Μ NaCl), а другая - динер hITF (элюируется при 0,78Μ NaСІ). Фракции, соответствующие каждой из форм, объединяли по отдельности. Каждую из двух объединенных фракций долили на три равные части (объемом примерно по 700мл) и наносили на колонку С4 Vydac 214ТР1022 (2,2х25см), уравновешенную 0,1% (v/v) TFA. Пептиды элюировали при 25°С и скорости потока 4мл/мин с помощью линейного градиента (540мл), составленного из MeCN/H2O/ TFA (10:89,9:0,1 ν/ν/ν) и MeCN/H2O/TFA (65:34,9:0,1 v/v/v). Поглощение в ультрафиолетовой области регистрировали при длине волны 280нм, отбирали фракции объемом 10мл и анализировали их на содержание hITF. Фракции, содержащие hITF (мономер) и hITF (димер), соответственно, объединяли и осаждали пептиды, добавляя этанол до концентрации 90% (ν/ν) и выдерживая смесь в течение 72ч. при -25°С. Осадок собирали центрифугированием и лиофилизовали. Общее количество, полученное из 8,0л ферментационной среды, составило 256мг для мономера hITF и 133мг для димера hITF, что соответствует общему выходу по всем этапам очистки в 50% и 65% для мономерной и димерной форм, соответственно. Характеристика реконбинантных rlTF и hITF После гидролиза в 6Μ НСІ в вакуумированных запаянных ампулах в течение 24, 48 и 96 ч образцы (50мкг) были проанализированы на автоматическом аминокислотном анализаторе фирмы Beckman (Model 121 MB). Количество остатков полуцистина определяли в виде S-β-(4-пиридилэтил)производного после восстановления дисульфидных связей трибутилфосфинон [95] с последующий взаимодействием с 4-винилпиридином [96]. Гидролиз образцов, обработанных 4 винилпиридином, проводили в 4Μ метансульфоновой кислоте или 3М меркаптоэтансульфоновой кислоте при 110°С в течение 24ч., как описано ранее. Анализ аминокислотной последовательности проводили с помощью автоматической процедуры деградации по Эдману, исльзования газо-фазовый секванатор Model 470А фирмы Applied Biosysteun [97]. Масс-спектрометрический анализ осуществляли на системе АРІ III LC/MS/MS (Sciex, Thornhill, Ont, Canada). Тройной квадрупольный прибор, позволяющий определить значение отношения массы к заряду (m/z) в интервале до 2400, соединен с интерфейсом для пневмоэлектроспрея (называемого также ионспреем) [98, 99] . Введение образца осуществляли с помощью шприцевого инфузионного насоса (Sage Instruments, Cambridge, MA) через вставной капилляр (внутр. д. 75мкм) при скорости подачи жидкости 0,5-1мкл/мин. Шкала m/z прибора была откалибрована с помощью однозарядных ионов аммониевого аддукта полипропиленгликолей (PPG) при единичном разрешении. Точность измерения масс обычно превосходит 0,02%. На фиг.4 показаны результаты аналитической ВЭЖХ для очищенных HTF (фиг.4А) и hITF (фиг.4В и 4С). Рекомбинантный HTF содержит смесь трех близких пептидов, для разделения которых не было предпринято никаких попыток. В результате масс-спектрометрического анализа были установлены три основных значения молекулярных весов - 13112,2; 13096,6 и 13078,8 (фиг.5А). Расчетное значение молекулярного веса для мономерной формы ITF крысы, в которой Cys57 имеет свободную -SH группу, составляет 6558,3. Расчетное значение молекулярного веса для димерной формы ITF крысы (например, с S-S мостиком между двумя Cys-57) составляет 13114,6. Из значений молекулярных весов, найденных для рекомбинантного ITF крысы, ясно, что все три пептида представляют собой димерную форму HTF. Для других "клеверных" пептидов, в которых N-концевым аминокислотным остатком является GІn, например PSP [17, 100], известно, что данный остаток имеет тенденцию к циклизации с образованием пирролидонкарбоновой кислоты (pyrGlu). Для ITF крысы, имеющего предсказанную N-концевую последовательность Gln-Glu-Phe-Val-Gly, разумно предположить, что N-концевой остаток Gln также способен циклизоваться с образованием pyrcilu. Подобное гіревращаниб будет приводить к уменьшению значения молекулярного веса ITF крысы (динер) на 17 (один pyrGlu) или 34 (два pyrGlu) единиц массы, соответственно. Наблюдаемые значения молекулярных весов в 13096,6 и 13078,8 (Фиг.5А) соответствуют димерной форме ITF крысы, в которой один и, соответственно, два N-концевых остатка Gln зациклизованы. Расчетные значения молекулярных весов для этих форм составляют 13097,6 и 13080,6, что находится в хорошем соответствии с экспериментально полученными величинами. Таким образом, из данных ВЭЖХ (Фиг.4А) и массспектрометрического анализа (Фиг.5А) вытекает, что рекомбинантный ITP крысы включает 3 различные димерные формы: одну, содержащую 2N-концевых Gln; одну - с 1N-концевым Gln и 1N-концевым pyrGlu; и одну - с 2N-концевыми pyrGlu. В Таблице 1 приведен аминокислотный состав ITF крысы, находящийся в хорошем соответствии с ожидаемыми величинами. Фиг.4В И 4С демонстрируют чистоту hITF (мономера) и hITF (димера), соответственно, по данным аналитической ВЭЖХ. Димерная форма (Фиг.4С) выглядит относительно чистой, в то время как для кономерной (Фиг.4В) создается видимость загрязнения материалом, элюирующимся перед пептидом. Однако при рехроматографии материала основного пика получается аналогичный вид хроматограммы (данные не приводятся). По-видимому, это в большей степени указывает на нетипичное поведение hITF (мономера) при обращенно-фазной хроматографии, нежели на наличие примесей. Похожее поведение ранее мы наблюдали для высокоочищенного PSP свиньи, а также оно отмечалось для рекомбинантного hSP высокой степени очистки [93]. С помощью масс-спектрометрического анализа основного пика hITF (мономера) было установлено значение молекулярного веса равное 6694,0 (Φиг.5Β). Значение молекулярного веса, рассчитанное на основании аминокислотной" последовательности (Фиг.1), составляет 6574,4 в предположении, что Cys-57 находится в -SH форме. Данные секвенирования (Табл.II) показывают наличие ожидаемой N-концевой последовательности: GluGlu-Tyr-Val-Gly-. Данные аминокислотного анализа (Табл.I) показывают ожидаемые величины за исключением наличия 7,3 (8) остатков цистеина. Наличие дополнительного остатка цистеина, соединенного с Cys-57, может увеличивать значение молекулярного веса до 6694,7, что очень близко к величине, найденной с помощью масс-спектрометрии (6694,0). Ввиду этого можно полагать, что в hITF (мономере) остаток Cys-57 связан дисульфидной связью с дополнительным остатком цистеина. Минорный пик (Фиг.5В) в масс-спектре может представлять собой другую производную Суs-57 или может быть обусловлен наличием в препарате примеси. Расчетное значение молекулярного веса hITF (димера), в котором два мономера соединены дисульфидной связью между двумя остатками Сys-57, составляет 13146,8. Это значение находится в хорошем соответствии с величиной, определенной с помощью масс-спектрометрии (13147, Фиг.5С). Другой пик (13169) вероятно представляет собой Na+ аддукт hITF (димера). Результаты анализа аминокислотной последовательности (Табл.II) и состава (Табл.I) также находятся в хорошем соответствии с ожидаемыми величинами. Литература 1. Thim, L., Hansen, M.T., Norris, K., Hoegh, I., Boel, E., Forsirom, J., Ammerer, G., & Fill, L. (1986) Proc, NatI. Acad. Sot. 83, 6766-6770. 2. Thim, L. (1989) FEBS Lett. 250. 85-50. 3. Thim, L. (1994) Digestion 55, 353-360, 4. Pouisom, R., & Wright, N.A. (1993) Am. J. Physiol. 565, G205-G213. 5. Hoffmann, W., & Hauser, F. (1993) Trends Biochem. Sci. 7, 239-243. 6. Hauser, F., & Hoffmann, W. (1991) 3. Biol, Chem, 266, 21206-21309. 7. Hauser, P., Roeben, C., & Hoffmann, W. (1992a) J. Biol. Chem. 267,1445114455. 8. Hoffmann, W. (1988) J, Biol. Chem, 263, 7686-7690. 9. Hauser, F., 4 Hoffmann, W. (1992b) J. Biol. Chem. 267, 24620-24624. 10. Jakowlev, S.B., Breathnach, R., Jeltsch, J.-M., Masiakowski, P., Chambon, P. (1984) Nucleic Acid Res, 12, 2861 -2878. 11. Prtld'nomine, J.F., Fridlansky, P., Le Cunff, M., Atger, M., Mercier-Bodart, C., Pichon, M.-F., & Milgrom, E. (1985) DNA 4, 11-21. 12. Lefebvre, O., Wolf, C., Kedinger, M., Chenard, M.-P., Tomasetto, C., Chambon, P., & Rio, M.C. (1993) J. Cell, Biol. 122, 191-198. 13. Podolsky, D.K., Lynch-Devaney, K., Stow, J.L., Oates, P., Murgue, B., DeBeaumont, M., Sands, B.E., & Makida, Y.R. (1993) J. Biol, Chem. 268, 6694-6702. 14. Hauser, F., Poulsom, R., Chinery, R., Rogers, L.A., Hanby, A.M., Wright, N.A., & Hoffmann, W. (1993) 15. Sttemori, S., Lynch-Devaney, K., & Podolsky, D.K. (1991) Proc, Natl.. Acad. Sci. 88, 11017-11021. 16. Chinery, R., Poulsom, R-, Rogers, L.A., Jeffery, R.E., Longoroft, J.M., Hanby, A.M.. & Wright, K.A. (1992) Biochem. J. 285, 5-8. 17. Tomasetto, C., Rio, M., Gautier, C, Wolf, C., Hareuveni. M., Chambon, P., & Lathe, R. (1990) EMBO J. 9, 407-414. 18. Thim, L., Jorgensen, K.H., & Jorgensen, K.D. (1982) Requl. Peptides 3, 221230. 19. Rio, M.C., Bellocq, J.P., Daniel, J,Y., Tomasetto, C., Lathe, R., Chenard, M.P., Batzenschlager. A., & Chambon, P. (1988) Science 241, 705-708, 20. Rio, M.-C., Chenard, M.-P., Wolf, C., Marcellin, L., Tomasetto, C., Lathe, R., Bellocq, J.-P., & Chambon, P. (1991) Gastroenterology 100, 375-379. 21. Poulsom, R., Chinery, R., Sarraf, C., Lalani, E.-N., Stamp, E., Elia, G., Wright, N.A. (1992) Gastroenterology 27, 17-28. 22. Wright, M.A., Poulsom, R., Stamp, G., van Horden, S., Sarraf, C, Elia, G, Ahnen, D., Jeffery, R., Longcroft, J., Pike, C., Rio, M.C., Chambon. P. (1993) Gastroenterology 104, 12-20. 23. Hanby, A.M., Poulsom, R.,Elia, G., Singh, S., Longcroft, J.M., & Wright, N.A. (1993) J. Pathol. 169, 355-360. 24. Wright, N.A., Pike, C., & Elia, G. (1990) Nature 343, 82-85. 25. Dignase, A., Lynch-Devaney, K., Kindon, H., Thim, L., & Podolsky, D.K. (1994) J. Clin. Invest, (в печати). 26. Playford, R.J., Marchbank, T., Chinery< R., Evison, R., Pignattelli, M., Bolton, R., Thim, L., & Hanby, A.M. (1994) Gastroenterology (в печати). 27. Babyataky, M.W., Thim, L , Podolsky, D.K. (1994) Gastroenterology 106, A43 (резюме). 28. Gajhede, M., Petersen, T.N., Henriksen, A., Petesen, J.F.W., Dauter, Z., Wilson, K.S., & Thim, L. (1993) Structure 1, 253-262. 29. WO 92/14837. 30. Ford, et.al. (1991) Protein Expression and Purification 2, 95-107. 31. Cunningham and Wells (1989) Science 244, 1081-1085. 32. Sambrook, et.al., Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory, Cold, Spring Harbor, New York, 1989. 33. Beaucage and Caruthers (1981) Tetrahedron Letters 22, 1859-1869. 34. Matthes, et.al. (1984) EMBO J. 3, 801-805. 35. US 4,683,202. 36. Saiki, et.al. (1988) Science 239, 487-491. 37. Subramani, et.al. (1981) Mol. Cell Biol. 1, 854-864. 38. Palmiter, et.al. (1983) Science 222, 809-814. 39. US 4,745,051. 40. Vasuvedan, et.al. (1992) FEBS Lett. 311. 7-11. 41. VIak, J.M., et.al. (1988) J. Gen. Virology 69, 765-776. 42. EP 397 485. 43. US 5,155,037. 44. US 5,162,222. 45. Hitzeman, et.al. (1980) J. Biol. Chen. 255, 12073-12080. 46. Alber and Kawasaki (1982) J. МоI. Appl. Gan. 1, 419-434. 47. Young, et.al. Genetic Engineering of Microorganisms for Chemicalo (Hollander et.al., eds.), Plenum Press, New York, 1982. 48. US 4,599,311. 49. Russell, et.al. (1983) Nature 304, 652-654. 50. McKnight, et.al. (1985) EMBO J. 4, 2093-2099. 51. EP 238 023. 52. EP 383 779. 53. Russel, P.R. (1985) Gene 40, 125-130. 54. US 4,870,008. 55. Hagenbuchle, O., et.al. (1981) Nature 289, 643-646, 56. Valls, L.A., et.al. (1987) Cell 48, 887-897, 57. WO 87/02670. 58. Egel-Mitani, M., et.al. (1990) Yeast 6, 127-137. 59. US 4,546,082. 60. EP 16 201. 61. EP 123 294. 62. EP 123 544. 63. EP 163 529. 64. WO 89/02463. 65. WO 92/11378. 66. EP 215 594. 67. WO S0/057S3. 68. US 5,023,328. 69. Kaufman and Sharp (1982) J, МI. Biol. 159, 601-621. 70. Southern and Berg (1982) J. МоI. Appl. Genet. 1, 327-341. 71. Loyter, et.al. (1982) Proc. Natl. Aead. Sci. USA 79, 422-426. 72. Wigler, et.al. (1978) Cell 14, 725. 73. Corsaro and Pearson (1981) Somatic Cell Genetics 7, 603. 74. Gratham and van der Eb (1973) Virology 52, 456. 75. Neumann et.al. (1982) ENBO J.1 , 841-845. 76. US 4,931,373. 77. US 5,037,743. 78. US 4,845,075. 79. Gleeson, et.al. (1986) 3. Gen. Microbiol. 132, 3459-3465. 80. US 4,882,279. 81. EP 272 277. 82. EP 184 438. 83. Malardier, et.al. (1989) Gene 78, 147-156. 84. EP 244 234. 85. US 4,879,236. 87. WO 89/01029. 88. WO 89/01028. 89. Remington's Pharmaceutical Sciences, 1985. 90. WO 90/10075. 91. Kawasaki, G, International Conference on Yeast Genetics and Molecular Biology, Sept.17-24, 1984, Edinburgh, Scotland, Abstr. P15. 92. Diderichsen, В., Poulsen, G.B-, Jorgensen, S.T. (1993) Plaemid 30, 312-315. 93. Thim, L., Norris, K., Norris, K., Nielsen, P.F., Bjorn, S.E., Chrietensen, M., Petersen, J. (1993) FEBS Lett. 318, 345-352. 94. Sherman, F., Fink, G.R., & Hicks, J.B. Methods in yeast genetics, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY. 95. Ruegg, U.Th., & Rudinger, J. (1974) Isr. J. Chew. 12, 391-401. 96. Friedman, M., KruIl, L.B., Cavins, J,F. (1970) J. Biol. Chem. 245, 3868-3871. 97. Thin, L., Hansen, M.T., & Soerensen, A.R. (1987) FEBS Lett, 212, 307-312. 98. Bruins, A.P., Covey, T.R., & Henion, j.D, (1987) Anal. Chem. 59. 2642-2646. 99. Covey, T.R., Bonner, R.F., Shushan, B.I., & Henion, J.D. (1988) Rapid Соmmun. Mass Spectrom, 2, 249-256. 100. Thim, L., Thomsen, l., Christensen, M., & Jorgensen, K.H. (1985) Biochem. Biophvs. Acta 827, 410-418.
ДивитисяДодаткова інформація
Назва патенту англійськоюDimers of "cloverleaf" peptide (variants), method for their production (variants) and pharmaceutical composition (variants)
Назва патенту російськоюПептидный димер в форме клеверного листа (варианты), способ его получения (варианты) и фармацевтическая композиция (варианты)
МПК / Мітки
МПК: A61K 38/17, A61P 35/00, C07K 14/435
Мітки: трилисника, форми, димер, композиція, пептидний, варіанти, фармацевтична, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/24-68324-peptidnijj-dimer-u-formi-trilisnika-varianti-sposib-jjogo-oderzhannya-varianti-ta-farmacevtichna-kompoziciya-varianti.html" target="_blank" rel="follow" title="База патентів України">Пептидний димер у формі трилисника (варіанти), спосіб його одержання (варіанти) та фармацевтична композиція (варіанти)</a>
Попередній патент: Електродуговий плазмотрон
Наступний патент: Таблетка валацикловіру (варіанти), спосіб її одержання (варіанти) та спосіб лікування
Випадковий патент: Сигаретна пачка і спосіб її виготовлення