Етинільні похідні як модулятори метаботропного глутаматного рецептора
Номер патенту: 110995
Опубліковано: 10.03.2016
Автори: Річчі Антоніо, Ліндеманн Лотар, Єшкє Гєорг, Рюхер Даніель, Штадлєр Хайнц, Віейра Ерік
Формула / Реферат
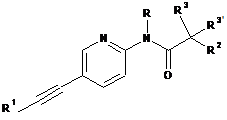
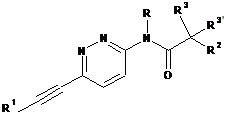
1. Етинільна похідна формули ІA, IB і ID:
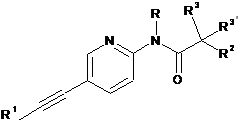 , IA
, IA 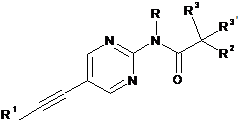 IB i
IB i
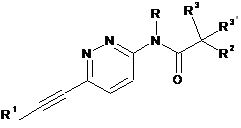 , ID
, ID
де
R1 являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, С1-4алкіл або С1-4алкоксигрупу;
R являє собою водень або С1-4алкіл;
R2 являє собою водень, С1-4алкіл, С1-4алкоксигрупу, CF3 або S-С1-4алкіл;
R3/R3' незалежно один від одного являють собою водень, С1-4алкіл або С1-4алкоксигрупу;
або R3 і R3' разом утворюють С3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце;
або її фармацевтично прийнятна кислотно-адитивна сіль, рацемічна суміш, або її відповідний енантіомер та/або оптичний ізомер, та/або стереоізомер, за винятком сполуки N-(5-((1H-піроло[2,3-В]піридин-2-іл)етиніл)піридин-2-іл)ацетаміду.
2. Етинільна похідна формули ІА за п. 1, яку вибирають з групи, що включає:
2,2-диметил-N-(5-фенілетинілпіридин-2-іл)пропіонамід,
N-(5-фенілетинілпіридин-2-іл)бутирамід,
(5-фенілетинілпіридин-2-іл)амід пентанової кислоти,
3-метил-N-(5-фенілетинілпіридин-2-іл)бутирамід,
(5-фенілетинілпіридин-2-іл)амід (RS)-2-метилпентанової кислоти,
2-метилсульфаніл-N-(5-фенілетинілпіридин-2-іл)ацетамід,
2-метокси-N-(5-фенілетинілтридин-2-іл)ацетамід,
N-[5-(3-фторфенілетиніл)піридин-2-іл]-2,2-диметилпропіонамід,
2-метокси-2-метил-N-(5-фенілетинілпіридин-2-іл)пропіонамід,
N-[5-(3-фторфенілетиніл)піридин-2-іл]-2-метокси-2-метилпропіонамід,
N-[5-(2,5-дифторфенілетиніл)піридин-2-іл]-2-метокси-2-метилпропіонамід або
N-[5-(3-хлорфенілетиніл)піридин-2-іл]-3,3,3-трифтор-2,2-диметилпропіонамід.
3. Етинільна похідна формули IB за п. 1, яку вибирають з групи що включає:
2,2-диметил-N-(5-фенілетинілпіримідин-2-іл)пропіонамід або
2,2,N-триметил-N-(5-фенілетинілпіримідин-2-іл)пропіонамід.
4. Етинільна похідна формули ID за п. 1, яку вибирають з групи що включає:
2,2-диметил-N-(6-фенілетинілпіридазин-3-іл)пропіонамід або
N-[6-(3-хлорфенілетиніл)піридазин-3-іл]-2,2-диметилпропіонамід.
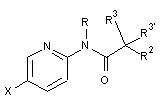
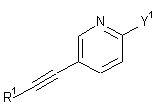
5. Спосіб одержання сполуки формули І за будь-яким з пп. 1-4, згідно з яким:
a) вводять в реакцію сполуку формули
 , 3А
, 3А 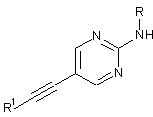 3В або
3В або 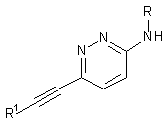 3D
3D
з придатною сполукою формули
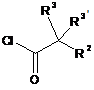 4 або
4 або 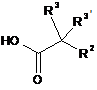 5
5
з утворенням сполуки формули
 , IA
, IA 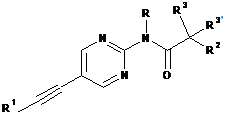 IB або
IB або
 , ID
, ID
де замісники описані в п. 1, або,
якщо потрібно, одержану сполуку перетворюють у фармацевтично прийнятну кислотно-адитивну сіль, або
b) вводять в реакцію сполуку формули
 , 6A
, 6A 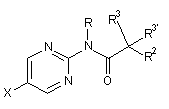 6B або
6B або 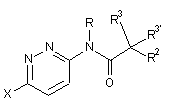 6D
6D
з придатною сполукою формули
![]() 2
2
з утворенням сполуки формули
 , IA
, IA  IB або
IB або
 , ID
, ID
де замісники описані в п. 1, або,
якщо потрібно, одержану сполуку перетворюють у фармацевтично прийнятну кислотно-адитивну сіль, або
c) вводять в реакцію сполуку формули
 , 13А
, 13А 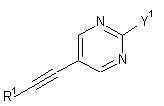 13В або
13В або 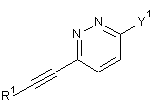 13D
13D
з придатною сполукою формули
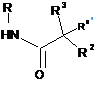
з утворенням сполуки формули
 , IA
, IA  IB або
IB або
 , ID
, ID
де замісники описані в п. 1, або,
якщо потрібно, одержану сполуку перетворюють у фармацевтично прийнятну кислотно-адитивну сіль.
6. Сполука за будь-яким з пп. 1-4 для застосування як терапевтично активної речовини.
7. Фармацевтична композиція, що включає щонайменше одну зі сполук за будь-яким з пп. 1-4, а також їх фармацевтично прийнятні солі.
8. Сполука за будь-яким з пп. 1-4, коли її застосовують у вигляді сумішей енантіомерів, діастереомерів або у енантіомерно чистій формі; а також її фармацевтично прийнятна сіль для застосування як лікарського засобу.
9. Застосування сполуки за будь-яким з пп. 1-4, а також її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування або профілактики захворювань, пов'язаних з алостеричними модуляторами рецепторів mGluR5.
10. Сполука за будь-яким з пп. 1-4 для лікування або профілактики шизофренії, когнітивних розладів, синдрому ламкої Х-хромосоми або аутизму.
Текст
Реферат: Даний винахід стосується етинільної похідної формули І: R R 3 R 3 ' N Y R W U 2 O V R 1 ,I де Y являє собою N або СН; за умови, що Y може бути тільки СН, якщо щонайменше одна з груп U, V або W являють собою N; 4 U являє собою N або C-R ; V і W являють собою незалежно N або СН; UA 110995 C2 (12) UA 110995 C2 за умови, що тільки одна з груп U, V або W може одночасно бути азотом; 4 R являє собою водень, метил або галоген; 1 R являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, нижчий алкіл або нижчу алкоксигрупу; R являє собою водень або нижчий алкіл; 2 R являє собою водень, нижчий алкіл, нижчу алкоксигрупу, CF3 або S-нижчий алкіл; 3 3' R /R незалежно один від одного являють собою водень, нижчий алкіл або нижчу алкоксигрупу; 3 3' або R і R разом утворюють С3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце; або її фармацевтично прийнятної солі приєднання кислоти, рацемічної суміші, або її відповідного енантіомера та/або оптичного ізомеру, та/або стереоізомера. Виявили, що сполуки загальної формули І є алостеричними модуляторами метаботропного глутаматного рецептора 5 підтипу (mGluR5). UA 110995 C2 Даний винахід належить до етинільного похідного формули I W R R3 N Y V U 3' R 2 R O 1 R 5 10 15 20 25 30 35 40 45 50 I де Y являє собою N або CH; за умови, що Y може бути тільки CH, якщо щонайменше одна з груп U, V або W являє собою N; 4 U являє собою N або C-R ; V і W являють собою незалежно N або CH; за умови, що тільки одна з груп U, V або W може одночасно бути азотом; 4 R являє собою водень, метил або галоген; 1 R являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, нижчий алкіл або нижчу алкоксигрупу; R являє собою водень або нижчий алкіл; 2 R являє собою водень, нижчий алкіл, нижчу алкоксигрупу, CF3 або S-нижчий алкіл; 3 3 R /R ’ незалежно один від одного являють собою водень, нижчий алкіл або нижчу алкоксигрупу; 3 3 або R і R ’ разом утворюють C3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце; або до його фармацевтично прийнятної солі приєднання кислоти, до рацемічної суміші, або до його відповідного енантіомеру та/або оптичного ізомеру та/або його стереоізомеру. Несподівано виявили, що сполуки загальної формули I є алостеричними модуляторами метаботропного глутаматного рецептора 5 підтипу (mGluR5). У центральній нервовій системі (ЦНС) передача нервових імпульсів здійснюється за рахунок взаємодії між нейротрансмітером, який випускається нейроном, з нейрорецептором. Глутамат є основним нейромедіатором збудження у головному мозку, і він відіграє особливу роль у різних функціях центральної нервової системи (ЦНС). Рецептори глутамат-залежних стимулів поділяються на дві основні групи. Рецептори першої основної групи, власне, іонотропні рецептори, формують контрольовані лігандом іонні канали. Метаботропні глутаматні рецептори (mGluR) належать до другої основної групи і, крім того, вони належать до сімейства рецепторів, спряжених з G-білком. В даний час відомі вісім різних членів цього сімейства mGluR, і деякі з них навіть мають підтипи. На підставі гомології їх послідовності, механізмів передачі сигналу і селективності агоністів, ці вісім рецепторів можна поділити на три підгрупи: mGluR1 і mGluR5 належать до I групи, mGluR2 і mGluR3 належать до II групи, і mGluR4, mGluR6, mGluR7 та mGluR8 належать до III групи. Ліганди метаботропних глутаматних рецепторів, що належать до першої групи, можна застосовувати для лікування або профілактики гострих та/або хронічних неврологічних розладів, таких як психоз, епілепсія, шизофренія, хвороба Альцгеймера, когнітивні розлади і порушення пам'яті, а також при хронічному і гострому болю. Одним з показань до лікування у зв'язку з цим є обмежена функція головного мозку, викликана операцією з відключенням або трансплантацією, поганим кровопостачанням головного мозку, пошкодженнями спинного мозку, травмами голови, гіпоксією під час вагітності, зупинкою серця і гіпоглікемією. Іншими показаннями до лікування є ішемія, хорея Гентінгтона, аміотрофічний бічний склероз (ALS), деменція, викликана СНІДом, очні травми, ретинопатія, ідіопатичний паркінсонізм або медикаментозний паркінсонізм, а також стани, які призводять до глутамат-дефіцитних функцій, таких як, наприклад, м'язові спазми, конвульсії, мігрень, нетримання сечі, нікотинова залежність, опіатна залежність, тривожність, блювота, дискінезія та депресії. Розладами, які повністю або частково опосередковані mGluR5, є, наприклад, гострі, травматичні і хронічні дегенеративні процеси в нервовій системі, такі як хвороба Альцгеймера, старече недоумство, хвороба Паркінсона, хорея Гентінгтона, аміотрофічний бічний склероз і множинний склероз, психічні захворювання, такі як шизофренія і тривожність, депресія, біль і наркоманія (Expert Opin. Ther. Patents (2002), 12 (12)). Новим напрямом для розробки селективних модуляторів є пошук сполук, які діють за алостеричним механізмом, модулюючи рецептор шляхом зв'язування з сайтом, відмінним від 1 UA 110995 C2 5 10 15 20 25 30 35 40 45 50 того, який є високо консервативним ортостеричним сайтом зв'язування. Нещодавно було виявлено, що алостеричні модулятори mGluR5 являють собою нові фармацевтичні сутності, які забезпечують обговорювану привабливу альтернативу. Алостеричні модулятори були описані, наприклад, у наступних джерелах: WO2008/151184, WO2006/048771, WO2006/129199, WO2005/04479; а також: Molecular Pharmacology, 40, 333 - 336, 1991; The Journal of Pharmacology and Experimental Therapeutics, Vol 313, No. 1, 199-206, 2005. Останніми роками були досягнуті істотні успіхи в розумінні патофізіології деяких захворювань розвитку головного мозку, що дають підставу припускати, що синтез білка у синапсах запускається шляхом активації метаботропних глутаматних рецепторів I групи. Такі розлади включають синдром ламкої Х-хромосоми, аутизм, ідіопатичний аутизм, комплекс туберозного склерозу, нейрофіброматоз 1 типу або синдром Ретта (Annu. Rev. Med., 2011, 62, 31.1 - 31.19; Neuroscience 156, 2008, 203-215). З попереднього рівня техніки відомі позитивні алостеричні модулятори. Вони є сполуками, які самі безпосередньо не активують рецептори, але істотно посилюють агоніст-стимульовані відгуки, підвищують дієвість і максимальну ефективність. Зв'язування таких сполук підвищує спорідненість глутамат-сайтових агоністів до їх позаклітинного N-кінцевого сайту зв'язування. Таким чином, алостерична модуляція є привабливим механізмом для посилення належної фізіологічної активації рецептора. Існує недолік селективних алостеричних модуляторів для рецептора mGluR5. Існуючі модулятори рецептора mGluR5, зазвичай, не мають задовільної розчинності у воді і характеризуються низькою біодоступністю при оральному введенні. Таким чином, зберігається необхідність у сполуках, які дозволяють подолати ці недоліки, і які з достатньою ефективністю забезпечують селективне алостеричне модулювання рецептора mGluR5. Сполуки формули I відрізняються тим, що вони мають цінні терапевтичні властивості. Їх можна застосовувати під час лікування або профілактики розладів, пов'язаних з алостеричними модуляторами рецептора mGluR5. Найпереважнішими призначеннями для цих сполук, які є алостеричними модуляторами, є шизофренія і когнітивний розлад. Даний винахід належить до сполук формули I, а також до їх фармацевтично прийнятних солей, у разі, коли це застосовно, до сумішей енантіомерів або діастереомерів, або їх енантіомерно або діастереомерно чистих форм, до таких сполук у вигляді фармацевтично активних речовин, до способу їх одержання, а також до застосування для лікування або профілактики розладів, пов'язаних з алостеричними модуляторами рецептора mGluR5, таких як шизофренія, когнітивний розлад, синдром ламкої Х-хромосоми або аутизм, а також до фармацевтичних композицій, що містять сполуки формули I. Наведені нижче визначення загальних термінів, використовувані в даному описі, застосовуються незалежно від того, чи зустрічається обговорюваний термін окремо або у сполученні. У даному тексті термін "нижчий алкіл" позначає насичену, тобто аліфатичну вуглеводневу групу, що включає лінійний або розгалужений вуглецевий ланцюг, що складається з 1-4 атомів вуглецю. Прикладами "алкільної" групи є метил, етил, н-пропіл та ізопропіл. Термін "алкокси" позначає групу -O-R', у якій R' є нижчим алкілом, визначеним вище. Термін "етиніл" позначає групу −C≡C-. Термін "гетероарил" позначає 5- або 6-членне ароматичне кільце, що містить щонайменше один N, O або S-гетероатом, наприклад піридиніл, піримідиніл, піразоліл, піридазиніл, імідазоліл, триазоліл, тієніл або піразиніл. Термін "фармацевтично прийнятна сіль" або "фармацевтично прийнятна сіль приєднання кислоти" охоплює солі з неорганічними і органічними кислотами, такими як хлороводнева кислота, азотна кислота, сірчана кислота, фосфорна кислота, лимонна кислота, мурашина кислота, фумарова кислота, малеїнова кислота, оцтова кислота, янтарна кислота, винна кислота, метансульфонова кислота, п-толуолсульфонова кислота і т.п. Одним з втілень даного винаходу є сполука формули I-1 W R R3 N Y V U 3' R 2 R O 1 R I-1 де 2 UA 110995 C2 5 10 15 20 25 Y являє собою N; U являє собою -CH- або N; V і W являють собою незалежно N або CH; за умови, що тільки одна з груп U, V або W може одночасно бути азотом; 1 R являє собою феніл, можливо, заміщений галогеном; R являє собою водень або нижчий алкіл; 2 R являє собою нижчий алкіл, нижчу алкоксигрупу, CF3 або S-нижчий алкіл; 3 3’ R /R незалежно один від одного являють собою водень або нижчий алкіл; або її фармацевтично прийнятна сіль приєднання кислоти, рацемічна суміш або її відповідний енантіомер та/або оптичний ізомер та/або її стереоізомер. Сполуки формули I-1 являють собою наступні речовини: 2,2-диметил-N-(5-фенілетиніл-піридин-2-іл)-пропіонамід N-(5-фенілетинілпіридин-2-іл)-бутирамід (5-фенілетинілпіридин-2-іл)-амід пентанової кислоти 3-метил-N-(5-фенілетинілпіридин-2-іл)-бутирамід (5-фенілетинілпіридин-2-іл)-амід (RS)-2-метилпентанової кислоти 2-метилсульфаніл-N-(5-фенілетинілпіридин-2-іл)-ацетамід 2,2-диметил-N-(5-фенілетинілпіримідин-2-іл)-пропіонамід 2,2,N-триметил-N-(5-фенілетинілпіримідин-2-іл)-пропіонамід 2,2-диметил-N-(6-фенілетинілпіридазин-3-іл)-пропіонамід 2-метокси-N-(5-фенілетинілпіридин-2-іл)-ацетамід N-[5-(3-фторфенілетиніл)-піридин-2-іл]-2,2-диметилпропіонамід 2-метокси-2-метил-N-(5-фенілетинілпіридин-2-іл)-пропіонамід N-[5-(3-фторфенілетиніл)-піридин-2-іл]-2-метокси-2-метилпропіонамід N-[5-(2,5-дифторфенілетиніл)-піридин-2-іл]-2-метокси-2-метилпропіонамід N-[5-(3-хлорфенілетиніл)-піридин-2-іл]-3,3,3-трифтор-2,2-диметилпропіонамід або N-[6-(3-хлорфенілетиніл)-піридазин-3-іл]-2,2-диметилпропіонамід. Одним з втілень даного винаходу є сполука формули IA N R R3 N 3' R 2 R O 1 R 30 35 40 45 50 IA де 1 R являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, нижчий алкіл або нижчу алкоксигрупу; R являє собою водень або нижчий алкіл; 2 R являє собою водень, нижчий алкіл, нижчу алкоксигрупу, CF3 або S-нижчий алкіл; 3 3’ R /R незалежно один від одного являють собою водень, нижчий алкіл або нижчу алкоксигрупу; 3 3’ або R і R разом утворюють C3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце; або її фармацевтично прийнятна сіль приєднання кислоти, рацемічна суміш, або її відповідний енантіомер та/або оптичний ізомер та/або стереоізомер. Прикладами сполуки формули IA є наступні речовини: 2,2-диметил-N-(5-фенілетинілпіридин-2-іл)-пропіонамід N-(5-фенілетинілпіридин-2-іл)-бутирамід (5-фенілетинілпіридин-2-іл)-амід пентанової кислоти 3-метил-N-(5-фенілетинілпіридин-2-іл)-бутирамід (5-фенілетинілпіридин-2-іл)-амид (RS)-2-метилпентанової кислоти 2-метилсульфаніл-N-(5-фенілетинілпіридин-2-іл)-ацетамід 2-метокси-N-(5-фенілетинілпіридин-2-іл)-ацетамід N-[5-(3-фторфенілетиніл)-піридин-2-іл]-2,2-диметилпропіонамід 2-метокси-2-метил-N-(5-фенілетинілпіридин-2-іл)-пропіонамід N-[5-(3-фторфенілетиніл)-піридин-2-іл]-2-метокси-2-метилпропіонамід N-[5-(2,5-дифторфенілетиніл)-піридин-2-іл]-2-метокси-2-метилпропіонамід або N-[5-(3-хлорфенілетиніл)-піридин-2-іл]-3,3,3-трифтор-2,2-диметилпропіонамід. Ще одним втіленням даного винаходу є сполука формули IB 3 UA 110995 C2 R R3 N N N 3' R 2 R O 1 R 5 10 15 IB де 1 R являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, нижчий алкіл або нижчу алкоксигрупу; R являє собою водень або нижчий алкіл; 2 R являє собою водень, нижчий алкіл, нижчу алкоксигрупу, CF3 або S-нижчий алкіл; 3 3’ R /R незалежно один від одного являють собою водень, нижчий алкіл або нижчу алкоксигрупу; 3 3’ або R і R разом утворюють C3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце; або її фармацевтично прийнятна сіль приєднання кислоти, рацемічна суміш, або її відповідний енантіомер та/або оптичний ізомер та/або стереоізомер. Конкретними прикладами сполук формули IB є наступні сполуки: 2,2-диметил-N-(5-фенілетинілпіримідин-2-іл)-пропіонамід або 2,2,N-триметил-N-(5-фенілетинілпіримідин-2-іл)-пропіонамід. Ще одним втіленням даного винаходу є сполука формули IC N N R R3 N 3' R 2 R O 1 R 20 25 IC де 1 R являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, нижчий алкіл або нижчу алкоксигрупу; R являє собою водень або нижчий алкіл; 2 R являє собою водень, нижчий алкіл, нижчу алкоксигрупу, CF3 або S-нижчий алкіл; 3 3’ R /R незалежно один від одного являють собою водень, нижчий алкіл або нижчу алкоксигрупу; 3 3’ або R і R разом утворюють C3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце; або її фармацевтично прийнятна сіль приєднання кислоти, рацемічна суміш, або її відповідний енантіомер та/або оптичний ізомер та/або стереоізомер. Ще одним втіленням даного винаходу є сполука формули ID N N R R3 N 3' R 2 R O 1 R 30 35 40 ID де 1 R являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, нижчий алкіл або нижчу алкоксигрупу; R являє собою водень або нижчий алкіл; 2 R являє собою водень, нижчий алкіл, нижчу алкоксигрупу, CF3 або S-нижчий алкіл; 3 3’ R /R незалежно один від одного являють собою водень, нижчий алкіл або нижчу алкоксигрупу; 3 3’ або Rі R разом утворюють C3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце; або її фармацевтично прийнятна сіль приєднання кислоти, рацемічна суміш, або її відповідний енантіомер та/або оптичний ізомер та/або стереоізомер. Прикладами сполуки формули ID є наступні речовини: 2,2-диметил-N-(6-фенілетинілпіридазин-3-іл)-пропіонамід або N-[6-(3-хлорфенілетиніл)-піридазин-3-іл]-2,2-диметилпропіонамід. 4 UA 110995 C2 Ще одним втіленням даного винаходу є сполука формули IE R R3 N N 3' R 2 R O 1 R 5 10 IE де 1 R являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, нижчий алкіл або нижчу алкоксигрупу; R являє собою водень або нижчий алкіл; 2 R являє собою водень, нижчий алкіл, нижчу алкоксигрупу, CF3 або S-нижчий алкіл; 3 3’ R /R незалежно один від одного являють собою водень, нижчий алкіл або нижчу алкоксигрупу; 3 3’ або R і R разом утворюють C3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце; або її фармацевтично прийнятна сіль приєднання кислоти, рацемічна суміш, або її відповідний енантіомер та/або оптичний ізомер та/або стереоізомер. Ще одним втіленням даного винаходу є сполука формули IF R R3 N N N 3' R 2 R O 1 R 15 20 25 30 35 40 IF де 1 R являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, нижчий алкіл або нижчу алкоксигрупу; R являє собою водень або нижчий алкіл; 2 R являє собою водень, нижчий алкіл, нижчу алкоксигрупу, CF3 або S-нижчий алкіл; 3 3’ R /R незалежно один від одного являють собою водень, нижчий алкіл або нижчу алкоксигрупу; 3 3’ або R і R разом утворюють C3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце; або її фармацевтично прийнятна сіль приєднання кислоти, рацемічна суміш, або її відповідний енантіомер та/або оптичний ізомер та/або стереоізомер. Одержання сполуки формули I за даним винаходом можна проводити паралельними або такими, що сходяться, шляхами синтезу. Способи синтезу сполук за даним винаходом представлені далі на схемах 1-5. Навички, які потрібні для проведення реакцій і очищення одержаних продуктів, відомі фахівцям в даній області техніки. Замісники та індекси, використані далі в описі способів, мають значення, розкрите в даному тексті вище. Сполуки формули I можна одержувати способами, наведеними нижче, способами, наведеними у прикладах, або аналогічними способами. Відповідні умови реакцій для конкретних реакційних стадій відомі фахівцеві в даній області техніки. Послідовність реакцій не обмежена тією, яка приведена на схемах, а, навпаки, залежно від початкових речовин та їх відносної реакційної здатності, послідовність реакційних стадій можна легко змінювати. Початкові речовини або є у продажу, або їх можна одержати способами, аналогічними способам, наведеним нижче, способами, описаними в джерелах, на які надано посилання в описі або у прикладах, або способами, відомими в даній області техніки. Дані сполуки формули I та їх фармацевтично прийнятні солі можна одержати способами, відомими в даній області техніки, наприклад, за допомогою варіанта способу, описаного нижче, що включає a) введення у реакцію сполуки формули R NH Y W U V 1 R 3 5 UA 110995 C2 з відповідною сполукою формули 3 R 3 3' R R 2 R Cl 3' R 2 R HO O O 4 або 5 з одержанням сполуки формули W 3 R R N Y 3' R 2 V O U R 1 R 5 10 I де замісники описані вище, або, за бажанням, переведення одержаної сполуки у фармацевтично прийнятні солі приєднання кислоти, або b) введення у реакцію сполуки формули 3 R R 3' R N Y W 2 R O U X V 6 з відповідною сполукою формули 1 R 2 з одержанням сполуки формули W 3 R R N Y 3' R 2 V O U R 1 R 15 I де замісники описані вище, або, за бажанням, переведення одержаної сполуки у фармацевтично прийнятні солі приєднання кислоти, або c) введення у реакцію сполуки формули Y' Y W V 1 U R 13 з відповідною сполукою формули 3 R R HN 3' R 2 20 O R з одержанням сполуки формули W 3 R R N Y 3' R 2 V U O R 1 R I де замісники описані вище, або d) введення у реакцію сполуки формули 6 UA 110995 C2 3 W R H N Y 3' R 2 V O U R 1 R I-1 з відповідною сполукою формули R-галоген з одержанням сполуки формули W 3 R R N Y 3' R 2 V U O R 1 5 R I де R являє собою галоген, а інші замісники описані вище, або, за бажанням, переведення одержаної сполуки у фармацевтично прийнятні солі приєднання кислоти. Одержання сполуки формули I далі описано детальніше у схемах 1-5 і в прикладах 1-16. 10 15 20 Етинільну сполуку формули I можна одержати, наприклад, за допомогою сполучення за Соногашира відповідного аміну 1 з відповідним чином заміщеним арилацетиленом 2 з одержанням відповідної етинільної сполуки 3. Сполучення етинільної сполуки 3 з відповідним чином заміщеним хлоридом кислоти 4 з основою, такою як піридин, у розчиннику, такому як дихлорметан, або сполучення з відповідним чином заміщеною кислотою 5 з основою, такою як основа Хуніга, і пептид-конденсуючим реагентом, таким як HATU або TBTU, у розчиннику, такому як диметилформамід (DMF), дають цільову етинільну сполуку загальної формули I. Можна також ввести замісник R на пізнішій стадії, шляхом алкілування сполуки формули I, де R=H. 25 7 UA 110995 C2 5 Загалом кажучи, послідовність стадій, використовувану для синтезу сполук формули I, також можна модифікувати у конкретних випадках, наприклад, спочатку проводячи амідне сполучення з утворенням відповідним чином заміщеного амідного похідного 6, а потім проводячи сполучення за Соногашира з відповідним чином заміщеним арилацетиленом 2, за аналогією зі способами, описаними на схемі 1. Введення замісника R можна також здійснювати у різні моменти у послідовності синтетичних стадій, шляхом алкілування відповідного проміжного продукту, де R=H. 10 15 20 Похідне етинілпіримідину формули IB можна одержати за допомогою сполучення за Соногашира відповідним чином заміщеного арилацетилену 2 з 5-бром-2метилсульфанілпіримідином 7 з одержанням відповідних метансульфанільних похідних 8. Окислення тіоефіру за допомогою окислювача, такого як mCPBA, у розчиннику, такому як дихлорметан (DCM), дає відповідне сульфонільне похідне 9. Реакція сульфонільного похідного з відповідним чином заміщеним аміном 10 у присутності основи, такої як триетиламін, у розчиннику, такому як тетрагідрофуран (THF), дає цільовий (5-фенілетинілпіримідин-2-іл)-амін 11. Сполучення сполуки 11 з відповідним чином заміщеним хлоридом кислоти 4 з основою, такою як піридин, у розчиннику, такому як дихлорметан, або сполучення з відповідним чином заміщеною кислотою 5 з основою, такою як основа Хуніга, і пептид-конденсуючим агентом, таким як гексафторфосфонат O-(7-азабензотриазол-1-іл)-1,1,3,3-тетраметилуронію (HATU) або тетрафторборат 2-(1Н-бензотриазол-1-іл)-1,1,3,3-тетраметилуронію (TBTU), у розчиннику, такому як диметилформамід (DMF), дають цільове похідне етинілпіримідину загальної формули IB. 25 8 UA 110995 C2 5 10 У деяких випадках можна також здійснити селективну реакцію дигалогенованої сполуки 12 з похідним ацетилену 2 з одержанням адукту 13. Амідогрупу можна потім безпосередньо ввести шляхом нуклеофільного приєднання (Y' = краще Cl, F) або за допомогою сполучення, яке каталізується паладієм (за Бухвальдом) (Y' = краще Br або I). Групу R можна ввести або безпосередньо на стадії сполучення, або шляхом алкілуваня сполуки загальної формули I-1. Зрозуміло, залежно від X і Y', послідовність реакцій можна змінювати, спочатку вводячи амідну групу, а потім проводячи реакцію Соногашира (X = Cl, Br, I краще Br, I), щоб ввести ацетиленову групу. 15 20 Сполуки формули I можна одержати шляхом сполучення за Соногашира відповідним чином заміщеного амідного похідного 6 з етинілтриметилсиланом 14 з одержанням відповідних 5триметилсиланілетинільних похідних 15. Сполучення за Соногашира з in situ десилілюванням 15 і відповідним чином заміщеним арилгалогенідом 16 дає цільові сполуки формули I (схема 5). Перелік прикладів: 9 UA 110995 C2 Пр. Назва Еф. (%) 2,2-Диметил-N-(5фенілетинілпіридин-2-іл)пропіонамід 19 72 N-(5-Фенілетинілпіридин-2-іл)бутирамід 70 52 (5-Фенілетинілпіридин-2-іл)амід пентанової кислоти 48 84 3-Метил-N-(5фенілетинілпіридин-2-іл)бутирамід 71 83 (5-Фенілетиніл-піридин-2-іл)амід (RS)-2-метилпентанової кислоти 48 75 2-Метилсульфаніл-N-(5фенілэтинілпіридин-2-іл)ацетамід 18 47 2,2-Диметил-N-(5фенілетинілпіримідин-2-іл)пропіонамід 56 59 2,2,N-триметил-N-(5фенілетинілпіримідин-2-іл)пропіонамід 52 74 2,2-Диметил-N-(6фенілетинілпіридазин-3-іл)пропіонамід 6 73 2-Метокси-N-(5фенілетинілпіридин-2-іл)ацетамід 49 43 N N O 1 N N O 2 N N O 3 N N O 4 N N O 5 N N S O 6 N N O N 7 N N O N 8 N N N O 9 N N O O 10 EC50 (нМ) mGlu5PAM Структура 10 UA 110995 C2 Пр. 15 44 77 68 N-[5-(3-Фторфенілетиніл)піридин-2-іл]-2-метокси-2метилпропіонамід 85 54 N-[5-(2,5-дифторфенілетиніл)піридин-2-іл]-2-метокси-2метилпропіонамід 94 47 N-[5-(3-Хлорфенілетиніл)піридин-2-іл]-3,3,3-трифтор2,2-диметилпропіонамід 19 46 7 45 N-[5-(3-Фторфенілетиніл)піридин-2-іл]-2,2диметилпропіонамід O 11 F N N O 2-Метокси-2-метил-N-(5фенілетинілпіридин-2-іл)пропіонамід O 12 N N O O F N N 14 Еф. (%) Назва N N 13 EC50 (нМ) mGlu5PAM Структура O O F F 15 F N N O F Cl N N N O 16 Cl F N-[6-(3-Хлорфенілетиніл)піридазин-3-іл]-2,2диметилпропіонамід Експериментальна частина: Приклад 1 2,2-Диметил-N-(5-фенілетинілпіридин-2-іл)-пропіонамід N N O 5 Стадія 1: 5-Фенілетинілпіридин-2-іламін N N Біс-(трифенілфосфін)-паладій(II) дихлорид (480 мг, 0,68 ммоль, 0,05 екв.) розчиняли у 50 мл THF. Додавали 2-аміно-5-йодпіридин (3 г, 13,6 ммоль) і фенілацетилен (2,79 г, 27,3 ммоль, 2,0 11 UA 110995 C2 5 екв.) при кімнатній температурі. Додавали триетиламін (5,58 мл, 40,9 ммоль, 3 екв.), трифенілфосфін (111 мг, 0,41 ммоль, 0,03 екв.) та йодид міді(I) (70 мг, 0,41 ммоль, 0,03 екв.), і цю суміш перемішували протягом 2 год при 65 °C. Реакційну суміш охолоджували і екстрагували насиченим розчином NaHCO3 і три рази етилацетатом. Органічні шари об'єднували, висушували над сульфатом натрію і випарювали досуха. Неочищений продукт суспендували у дихлорметані, фільтрували, і одержану тверду речовину випарювали досуха. Цільовий 5-фенілетинілпіридин-2-іламін (1,6 г, вихід 62%) одержували у вигляді ясно-жовтої + твердої речовини, MS: m/e = 195,3 (M+H ). Стадія 2: 2,2-Диметил-N-(5-фенілетинілпіридин-2-іл)-пропіонамід N N O 10 15 20 5-Фенілетинілпіридин-2-іламін (65 мг, 0,33 ммоль) (Приклад 1, стадія 1) розчиняли у дихлорметані (3 мл). Додавали піридин (52 мг, 53 мкл, 0,67 ммоль, 2 екв.) і півалоїлхлорид (48 мг, 50 мкл, 0,40 ммоль, 1,2 екв.), і цю суміш перемішували протягом 2 год при кімнатній температурі. Реакційну суміш екстрагували 1н розчином HCl і двічі дихлорметаном. Органічні екстракти об'єднували, висушували над сульфатом натрію і випарювали досуха. Неочищений продукт очищали флеш-хроматографією на колонці з силікагелем, елюювали сумішшю гептан:дихлорметан 50:50. Цільовий 2,2-диметил-N-(5-фенілетинілпіридин-2-іл)-пропіонамід (40 + мг, вихід 43%) одержували у вигляді ясно-жовтої твердої речовини, MS: m/e = 279,3 (M+H ). Приклад 2 N-(5-Фенілетинілпіридин-2-іл)-бутирамід N N O 25 Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = 265,3 + (M+H ), таким самим способом, як описано у Прикладі 1, стадія 2, з 5-фенілетинілпіридин-2іламіну (Приклад 1, стадія 1) і бутирилхлориду. Приклад 3 (5-Фенілетинілпіридин-2-іл)-амід пентанової кислоти N N O 30 Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = 279,3 + (M+H ), таким самим способом, як описано у Прикладі 1, стадія 2, з 5-фенілетинілпіридин-2іламіну (Приклад 1, стадія 1) і валерилхлориду. Приклад 4 3-Метил-N-(5-фенілетинілпіридин-2-іл)-бутирамід N N O 35 Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = 279,3 + (M+H ), таким самим способом, як описано у Прикладі 1, стадія 2, з 5-фенілетинілпіридин-2іламіну (Приклад 1, стадія 1) та ізовалероїлхлориду. Приклад 5 (5-Фенілетинілпіридин-2-іл)-амід (RS)-2-метилпентанової кислоти 12 UA 110995 C2 N N O 5 10 15 Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = 293,3 + (M+H ), таким самим способом, як описано у Прикладі 1, стадія 2, з 5-фенілетинілпіридин-2іламіну (Приклад 1, стадія 1) і (RS)-2-метилвалероїлхлориду. Приклад 6 2-Метилсульфаніл-N-(5-фенілетинілпіридин-2-іл)-ацетамід N N S O Стадія 1: N-(5-Бромпіридин-2-іл)-2-метилсульфанілацетамід N N S O Br 5-Бромпіридин-2-амін (1 г, 5,78 ммоль) розчиняли у DMF (40 мл) і вносили HATU (2,64 г, 6,94 ммоль, 1,2 екв.). Через 15 хвилин при кімнатній температурі додавали основу Хуніга (6,0 мл, 34,7 ммоль, 6 екв.) і 2-(метилтіо)оцтову кислоту (736 мг, 6,94 ммоль, 1,2 екв.). Цю суміш перемішували протягом 72 год при кімнатній температурі. Реакційну суміш випарювали і екстрагували три рази насиченим розчином Na2CO3 і три рази етилацетатом. Органічні шари екстрагували три рази 1н розчином HCl і випарювали досуха. Неочищений продукт суспендували у пентані, фільтрували, і одержану тверду речовину випарювали досуха. Цільовий N-(5-бромпіридин-2-іл)-2-метилсульфанілацетамід (312 мг, вихід 21%) одержували у + вигляді жовтої твердої речовини, MS: m/e = 258,9/260,8 (M+H ). Стадія 2: 2-Метилсульфаніл-N-(5-фенілетинілпіридин-2-іл)-ацетамід N N S O 20 25 Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = 283,1 + (M+H ), таким самим способом, як описано у Прикладі 1, стадія 1, з N-(5-бромпіридин-2-іл)-2метилсульфанілацетаміду (Приклад 6, стадія 1) і фенілацетилену. Приклад 7 2,2-Диметил-N-(5-фенілетинілпіримідин-2-іл)-пропіонамід N N N O Стадія 1: N-(5-Бромпіримідин-2-іл)-2,2-диметилпропіонамід N 30 N O N Br Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = + 258,0/259,9 (M+H ), таким самим способом, як описано у Прикладі 1, стадія 2, з 2-аміно-5бромпіримідину і півалоїлхлориду. 13 UA 110995 C2 Стадія 2: 2,2-Диметил-N-(5-фенілетинілпіримідин-2-іл)-пропіонамід N N O N 5 Вказану у заголовку сполуку одержували у вигляді ясно-жовтої твердої речовини, MS: m/e = + 280,1 (M+H ), таким самим способом, як описано у Прикладі 1, стадія 1, з N-(5-бромпіримідин-2іл)-2,2-диметилпропіонаміду (Приклад 7, стадія 1) і фенілацетилену. Приклад 8 2,2,N-триметил-N-(5-фенілетинілпіримідин-2-іл)-пропіонамід N N N O Стадія 1: 2-Метилсульфаніл-5-фенілетинілпіримідин S N N 10 15 20 Біс-(трифенілфосфін)-паладій(II)дихлорид (120 мг, 0,16 ммоль, 0,05 екв.) розчиняли у 50 мл THF і додавали 5-бром-2-метилсульфанілпіримідин (840 мг, 4,1 ммоль) і фенілацетилен (410 мкл, 4,1 ммоль, 1 екв.) при кімнатній температурі. Додавали триетиламін (1,36 мл, 12,3 ммоль, 3 екв.), трифенілфосфін (28 мг, 0,12 ммоль, 0,03 екв.) та йодид міді(I) (19 мг, 0,08 ммоль, 0,03 екв.), і цю суміш перемішували протягом 3 год при 65 °C. Реакційну суміш охолоджували і екстрагували один раз насиченим розчином NaHCO3 і три рази етилацетатом. Органічні шари об'єднували, висушували над сульфатом натрію, фільтрували і випарювали досуха. Неочищений продукт очищали флеш-хроматографією на силікагелі (гептан:етилацетат 100:0 -> 50:50). Цільовий 2-метилсульфаніл-5-фенілетинілпіримідин одержували у вигляді ясно-жовтої + твердої речовини (400 мг, 44%), MS: m/e = 227,3 (M+H ). Стадія 2: 2-Метансульфоніл-5-фенілетинілпіримідин N O O S N 25 30 2-Метилсульфаніл-5-фенілетинілпіримідин (360 мг, 1,60 ммоль) (Приклад 8, стадія 1) розчиняли у 20 мл дихлорметану, і декількома порціями при 0-5 °C додавали 3хлорпербензойну кислоту (870 мг, 3,50 ммоль, 2,2 екв.). Реакційну суміш перемішували протягом 4 год при кімнатній температурі. Вносили насичений розчин NaHCO3, і цю суміш екстрагували три рази етилацетатом. Органічні екстракти висушували над сульфатом натрію, фільтрували і випарювали. Неочищений продукт очищали флеш-хроматографією на силікагелі (дихлорметан). Цільовий 2-метансульфоніл-5-фенілетинілпіримідин одержували у вигляді білої + твердої речовини (400 мг, 97%), MS: m/e = 259,2 (M+H ). Стадія 3: Метил-(5-фенілетинілпіримідин-2-іл)-амін 14 UA 110995 C2 N N N 5 2-Метансульфоніл-5-фенілетинілпіримідин (100 мг, 0,38 ммоль) (Приклад 8, стадія 2), метиламін гідрохлорид (52 мг, 0,77 ммоль, 2 екв.) і Et3N (220 мкл, 1,55 ммоль, 4 екв.) суспендували у 1 мл THF і перемішували протягом 1 год при 65 °C. Реакційну суміш концентрували у вакуумі, і одержаний залишок очищали флеш-хроматографією, безпосередньо наносячи неочищену речовину на колонку з силікагелем, елюювали сумішшю (гептан:етилацетат 100:0 -> 0:100). Цільовий метил-(5-фенілетинілпіримідин-2-іл)-амін + одержували у вигляді білої твердої речовини (38 мг, 47%), MS: m/e = 210,2 (M+H ). Стадія 4: 2,2,N-триметил-N-(5-фенілетинілпіримідин-2-іл)-пропіонамід N N O N 10 15 Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = 294,0 + (M+H ), таким самим способом, як описано у Прикладі 1, стадія 2, з метил-(5фенілетинілпіримідин-2-іл)-аміну (Приклад 8, стадія 3) і півалоїлхлориду. Приклад 9 2,2-Диметил-N-(6-фенілетинілпіридазин-3-іл)–пропіонамід N N N O 20 25 До суспензії 3-хлор-6-(фенілетиніл)піридазину (CAS 77778-15-5) (200 мг, 0,93 ммоль) і піваламіду (113 мг, 1,12 ммоль, 1,2 екв.) у 4 мл толуолу додавали карбонат цезію (364 мг, 1,12 ммоль, 1,2 екв.). Цю суспензію нагрівали протягом 20 год при 120 °C і потім охолоджували до кімнатної температури. Вносили етилацетат (10 мл), і нерозчинні солі відфільтровували. Після концентрування у вакуумі, одержаний залишок очищали флеш-хроматографією, елюювали гептаном, а потім градієнтом гептан - 60% етилацетат/гептан, з одержанням 19 мг (7%) вказаної + у заголовку сполуки у вигляді ясно-жовтої твердої речовини, MS: m/e = 280,2 (M+H ). Приклад 10 2-Метокси-N-(5-фенілетинілпіридин-2-іл)-ацетамід N N O O 30 Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = 267,0 + (M+H ), таким самим способом, як описано у Прикладі 1, стадія 2, з 5-фенілетинілпіридин-2іламіну (Приклад 1, стадія 1) і 2-метоксиацетилхлориду. Приклад 11 N-[5-(3-Фторфенілетиніл)-піридин-2-іл]-2,2-диметилпропіонамід 15 UA 110995 C2 N N O F Стадія 1: N-(5-Бромпіридин-2-іл)-2,2-диметилпропіонамід N Br 5 N O Вказану у заголовку сполуку одержували у вигляді безбарвного масла, MS: m/e = + 257,1/259,0 (M+H ), таким самим способом, як описано у Прикладі 1, стадія 2, з 2-аміно-5бромпіридину і півалоїлхлориду. Стадія 2: N-[5-(3-Фторфенілетиніл)-піридин-2-іл]-2,2-диметилпропіонамід N N O F 10 Вказану у заголовку сполуку одержували у вигляді жовтої твердої речовини, MS: m/e = 297,2 + (M+H ), таким самим способом, як описано у Прикладі 1, стадія 1, з N-(5-бромпіридин-2-іл)-2,2диметилпропіонаміду (Приклад 11, стадія 1) і 3-фторфенілацетилену. Приклад 12 2-Метокси-2-метил-N-(5-фенілетинілпіридин-2-іл)-пропіонамід N N O O 15 20 25 5-фенілетинілпіридин-2-іламін (100 мг, 0,515 ммоль) (Приклад 1, стадія 1) розчиняли у дихлорметані (5 мл) і додавали 2-метокси-2-метилпропіонову кислоту (91 мг, 0,77 ммоль, 1,5 екв.), 2-бром-1-етил піридиній тетрафторборат (CAS 878-23-9) (211 мг, 0,77 ммоль, 1,5 екв.) і основу Хуніга (0,26 мл, 1,54 ммоль, 3 екв.). Цю суміш перемішували протягом 14 год при кімнатній температурі. Реакційну суміш екстрагували насиченим розчином Na2CO3 і дихлорметаном. Органічний шар висушували над сульфатом натрію і випарювали досуха. Неочищений продукт очищали в ході препаративної ВЕЖХ з одержанням цільового 2-метокси2-метил-N-(5-фенілетинілпіридин-2-іл)-пропіонаміду (70 мг, вихід 46%) у вигляді жовтого масла, + MS: m/e = 295,2 (M+H ). Приклад 13 N-[5-(3-Фторфенілетиніл)-піридин-2-іл]-2-метокси-2-метилпропіонамід N N O O F Стадія 1: N-(5-Йод-піридин-2-іл)-2-метокси-2-метилпропіонамід 16 UA 110995 C2 N 5 N O O I Вказану у заголовку сполуку одержували у вигляді безбарвного масла таким самим способом, як описано у Прикладі 12, з 2-аміно-5-йодпіридину і 2-метокси-2-метилпропіонової кислоти. Стадія 2: 2-Метокси-2-метил-N-(5-триметилсиланілетинілпіридин-2-іл)-пропіонамід N N O O Si + 10 Вказану у заголовку сполуку одержували у вигляді жовтого масла, MS: m/e = 290,8 (M+H ), таким самим способом, як описано в Прикладі 1, стадія 1, з N-(5-йод-піридин-2-іл)-2-метокси-2метилпропіонаміду (Приклад 13, стадія 1) і триметилсилілацетилену. Стадія 3: N-[5-(3-Фторфенілетиніл)-піридин-2-іл]-2-метокси-2-метилпропіонамід N N O O F 15 20 2-Метокси-2-метил-N-(5-триметилсиланілетинілпіридин-2-іл)-пропіонамід (Приклад 13, стадія 2) (90 мг, 0,31 ммоль) розчиняли у THF (8 мл). Додавали 1-фтор-3-йодбензол (83 мг, 0,37 ммоль, 1,2 екв.), Et3N (130 мкл, 0,93 ммоль, 3 екв.), біс-(трифенілфосфін)-паладій(II)дихлорид (11 мг, 15 мкмоль, 0,05 екв.) та йодид міді(I) (1,8 мг, 10 мкмоль, 0,03 екв.) у атмосфері азоту, і цю суміш нагрівали до 70 °C. При 70 °C вносили по краплинах 1M розчин TBAF у THF (370 мкл, 0,37 ммоль, 1,2 екв.). Реакційну суміш перемішували протягом 1 год при 70 °C, фільтрували через целіт, і одержаний фільтрат випарювали досуха. Неочищений продукт очищали флешхроматографією на колонці з силікагелем, елюювали сумішшю гептан:етилацетат 100:0 -> 90:10. Цільовий N-[5-(3-фторфенілетиніл)-піридин-2-іл]-2-метокси-2-метилпропіонамід (64 мг, + вихід 66%) одержували у вигляді жовтого масла, MS: m/e = 313,0 (M+H ). Приклад 14 N-[5-(2,5-Дифторфенілетиніл)-піридин-2-іл]-2-метокси-2-метилпропіонамід N N O O F 25 30 F Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = 331,0 + (M+H ), таким самим способом, як описано у Прикладі 13, стадія 3, з 2-метокси-2-метил-N-(5триметилсиланілетинілпіридин-2-іл)-пропіонаміду (Приклад 13, стадія 2) і 1,4-дифтор-2йодбензолу. Приклад 15 N-[5-(3-Хлорфенілетиніл)-піридин-2-іл]-3,3,3-трифтор-2,2-диметилпропіонамід N F N O F F Cl 17 UA 110995 C2 Стадія 1: 3,3,3-трифтор-N-(5-йодпіридин-2-іл)-2,2-диметилпропіонамід N F N O 5 F F I + Вказану у заголовку сполуку одержували у вигляді жовтого масла: m/e = 359,4 (M+H ), таким самим способом, як описано у Прикладі 12, з 2-аміно-5-йодпіридину і 3,3,3-трифтор-2,2диметилпропанової кислоти. Стадія 2: N-[5-(3-Хлорфенілетиніл)-піридин-2-іл]-3,3,3-трифтор-2,2-диметилпропіонамід N F N O F F Cl 10 Вказану у заголовку сполуку одержували у вигляді ясно-жовтого масла, MS: m/e = + 365,5/367,5 (M+H ), таким самим способом, як описано у Прикладі 1, стадія 1, з 3,3,3-трифтор-N(5-йод-піридин-2-іл)-2,2-диметилпропіонаміду (Приклад 15, стадія 1) і 3-хлорфенілацетилену. Приклад 16 N-[6-(3-Хлорфенілетиніл)-піридазин-3-іл]-2,2-диметилпропіонамід N N N O Cl Стадія 1: N-(6-Хлор-піридазин-3-іл)-2,2-диметилпропіонамід N 15 N N O Cl Вказану у заголовку сполуку одержували у вигляді білої твердої речовини, MS: m/e = + 214,2/216,2 (M+H ), таким самим способом, як описано у Прикладі 1, стадія 2, з 3-аміно-6хлорпіридазину і півалоїлхлориду. Стадія 2: N-[6-(3-Хлорфенілетиніл)-піридазин-3-іл]-2,2-диметилпропіонамід N N N O Cl 20 25 30 Вказану у заголовку сполуку одержували у вигляді ясно-жовтої твердої речовини, MS: m/e = + 314,5/316,5 (M+H ), таким самим способом, як описано у Прикладі 1, стадія 1, з N-(6-хлорпіридазин-3-іл)-2,2-диметилпропіонаміду (Приклад 16, стадія 1) і 3-хлорфенілацетилену. Біологічний аналіз і одержані дані: 2+ Аналіз внутрішньоклітинної мобілізації Ca Одержували моноклональну клітинну лінію HEK-293, стабільно трансфіковану за допомогою кДНК, що кодує людський рецептор mGlu5a; для експериментів з позитивними алостеричними модуляторами mGlu5 (PAMs) вибрали клітинну лінію з низьким рівнем експресії рецептора і низькою конститутивною активністю рецептора, щоб здійснити диференціацію агоністичної активності, залежно від активності PAM. Клітини вирощували згідно зі стандартними методиками (Freshney, 2000) у середовищі Ігла, модифікованому Дульбекко, з високим вмістом глюкози, з додаванням 1 мМ глютаміну, 10% (об/об) інактивованої нагріванням сироватки крові 18 UA 110995 C2 5 10 15 20 25 30 35 40 45 50 55 60 плодів корови, пеніциліну/стрептоміцину, 50 мкг/мл гігроміцину і 15 мкг/мл бластицидину (всі реагенти для культивування клітин і антибіотики виробництва Invitrogen, Базель, Швейцарія). 4 Приблизно за 24 год до експерименту 5x10 клітин/лунку висівали на чорних 96-лункових планшетах з прозорим дном, покритих полі-D-лізином. Клітини навантажували за допомогою 2,5 мкм Fluo-4AM у навантажувальному буфері (1xHBSS, 20 мМ HEPES) протягом 1 год при 37 °C і промивали п'ять разів навантажувальним буфером. Клітини переміщали у систему Functional Drug Screening System 7000 (Hamamatsu, Париж, Франція), додавали 11 напівлогарифмічних серійних розведень тестованих сполук при 37 °C, та інкубували клітини протягом 10-30 хв, здійснюючи запис флюоресценції в режимі он-лайн. Після закінчення цієї стадії преінкубації до клітин додавали агоніст L-глутамату у концентрації, що відповідала EC20 (як правило, близько 80 мкм), здійснюючи запис флюоресценції в режимі он-лайн. Щоб врахувати щоденні варіації у реактивності клітин, величину EC20 глутамату визначали безпосередньо перед кожним експериментом шляхом запису повної кривої залежності «доза-відгук» для глутамату. Відгук визначали як різницю між піковою і базальною флюоресценцією (тобто флюоресценцією без додавання L-глутамату), нормалізовану до максимального стимулюючого ефекту, одержаного при насичувальних концентраціях L-глутамату. Графіки будували у відсотках від максимальної стимуляції за допомогою програми XLfit, призначеної для побудови кривих, яка ітеративно відображає дані за алгоритмом Левенберга-Марквардта. Використовували рівняння для односайтового конкурентного аналізу: у = A + ((B-A)/(1+((x/C)D))), де у є відсотковою часткою від максимального стимулюючого ефекту, A - мінімальне значення у, B - максимальне значення у, C - EC50, x є log10 від концентрації конкуруючої речовини, і D нахил кривої (коефіцієнт Хілла). За цими кривими були розраховані: величина EC50 (концентрація, за якої досягається половина від максимальної стимуляції) і коефіцієнт Хілла, а також максимальний відгук у відсотках від максимального стимулюючого ефекту, одержаного при насичувальних концентраціях L-глутамату. Позитивні сигнали, одержані протягом преінкубації з тестовими PAM-сполуками (тобто перед внесенням L-глутамату у концентрації EC20), були індикатором агоністичної активності; відсутність таких сигналів свідчила про відсутність агоністичної активності. Придушення сигналу, спостережуване після додавання EC20-концентрації L-глутамату, вказувало на інгібіторну активність тестованої сполуки. У списку представлених вище прикладів приведені відповідні результати для сполук, причому всі вони мають значення EC50< 100 нМ. Сполуки формули (I) та їх фармацевтично прийнятні солі можна застосовувати як лікарські засоби, наприклад у формі лікарських препаратів. Фармацевтичні препарати можна вводити перорально, наприклад у формі таблеток, таблеток, покритих оболонкою, драже, твердих і м'яких желатинових капсул, розчинів, емульсій або суспензій. Крім того, введення можна проводити ректально, наприклад, у формі супозиторіїв, або парентерально, наприклад, у формі розчинів для ін'єкцій. Сполуки формули (I) та їх фармацевтично прийнятні солі можна процесувати з фармацевтично інертними, неорганічними або органічними наповнювачами для виробництва фармацевтичних препаратів. Як такі наповнювачі для таблеток, таблеток, покритих оболонкою, драже і твердих желатинових капсул, можна використовувати, наприклад, лактозу, кукурудзяний крохмаль або його похідні, тальк, стеаринову кислоту або її солі і т.п. Придатними наповнювачами для м'яких желатинових капсул є, наприклад, рослинні олії, віск, жири, напівтверді і рідкі поліоли і т.п.; при цьому, залежно від природи діючої речовини, у випадку м'яких желатинових капсул наповнювач, як правило, не потрібний. Придатними наповнювачами для виготовлення розчинів і сиропів є, наприклад, вода, поліоли, сахароза, інвертований цукор, глюкоза і т.п. У випадку водних розчинів для ін'єкції, приготованих з розчинних у воді солей сполук формули (I), можна використовувати ад'юванти, такі як спирти, поліоли, гліцерин, рослинні олії і т.п., але, як правило, у них немає необхідності. Придатними наповнювачами для супозиторіїв є, наприклад, природні або отверджені жири, віск, жири, напіврідкі або рідкі поліоли і т.п. Крім того, фармацевтичні препарати можуть містити консерванти, солюбілізатори, стабілізатори, зволожувальні агенти, емульгатори, підсолоджувачі, фарбники, ароматизатори, солі для зміни осмотичного тиску, буфери, маскувальні агенти або антиоксиданти. Вони також можуть містити додаткові терапевтично значущі речовини. Як згадувалося раніше, лікарські засоби, що містять сполуку формули (I) або її фармацевтично прийнятну сіль і терапевтично інертний наповнювач, також є об'єктом даного винаходу, так само як і спосіб виготовлення таких лікарських засобів, який включає приведення однієї або більше сполук формули (I) або їх фармацевтично прийнятних солей і, за бажанням, 19 UA 110995 C2 5 10 однієї або більше інших терапевтично значущих речовин, у галенову лікарську форму спільно з одним або більше терапевтично інертним носієм. Крім того, як згадувалося раніше, застосування сполук формули (I) для виготовлення лікарських засобів, ефективних для профілактики та/або лікування перелічених вище захворювань, також є об'єктом даного винаходу. Дозування можна варіювати в широких межах, і, зрозуміло, його підбирають з урахуванням індивідуальних вимог у кожному конкретному випадку. В цілому, ефективна доза для орального або парентерального введення знаходиться в діапазоні 0,01-20 мг/кг/на добу, при цьому доза 0,1-10 мг/кг/на добу краща для всіх описаних вище показань до застосування. Відповідно, добова доза для дорослої людини вагою 70 кг знаходиться в діапазоні 0,7-1400 мг на добу, краще між 7 і 700 мг на добу. Фармацевтичні композиції, що включають сполуки за даним винаходом: Таблетки наступного складу виготовляють звичайним способом: Діюча речовина Порошкоподібна лактоза Білий кукурудзяний крохмаль Полівінілпіролідон Na-карбоксиметилкрохмаль Стеарат магнію Маса таблетки мг/на таблетку 100 95 35 8 10 2 250 15 ФОРМУЛА ВИНАХОДУ 1. Етинільна похідна формули ІA, IB і ID: R R 3 R N N R 3' R 2 R N 1 , IA R R N R 3' 2 O 1 IB i 3 R N R N 3 N N O R R R 3' 2 O 20 25 30 35 R 1 , ID де 1 R являє собою феніл або гетероарил, які, можливо, містять як замісник галоген, С 1-4алкіл або С1-4алкоксигрупу; R являє собою водень або С1-4алкіл; 2 3 R являє собою водень, С1-4алкіл, С1-4алкоксигрупу, CF або S-С1-4алкіл; 3 3' R /R незалежно один від одного являють собою водень, С1-4алкіл або С1-4алкоксигрупу; 3 3' або R і R разом утворюють С3-5-циклоалкільне, тетрагідрофуранове або оксетанове кільце; або її фармацевтично прийнятна кислотно-адитивна сіль, рацемічна суміш, або її відповідний енантіомер та/або оптичний ізомер, та/або стереоізомер, за винятком сполуки N-(5-((1Hпіроло[2,3-В]піридин-2-іл)етиніл)піридин-2-іл)ацетаміду. 2. Етинільна похідна формули ІА за п. 1, яку вибирають з групи, що включає: 2,2-диметил-N-(5-фенілетинілпіридин-2-іл)пропіонамід, N-(5-фенілетинілпіридин-2-іл)бутирамід, (5-фенілетинілпіридин-2-іл)амід пентанової кислоти, 3-метил-N-(5-фенілетинілпіридин-2-іл)бутирамід, (5-фенілетинілпіридин-2-іл)амід (RS)-2-метилпентанової кислоти, 2-метилсульфаніл-N-(5-фенілетинілпіридин-2-іл)ацетамід, 20 UA 110995 C2 5 10 15 2-метокси-N-(5-фенілетинілтридин-2-іл)ацетамід, N-[5-(3-фторфенілетиніл)піридин-2-іл]-2,2-диметилпропіонамід, 2-метокси-2-метил-N-(5-фенілетинілпіридин-2-іл)пропіонамід, N-[5-(3-фторфенілетиніл)піридин-2-іл]-2-метокси-2-метилпропіонамід, N-[5-(2,5-дифторфенілетиніл)піридин-2-іл]-2-метокси-2-метилпропіонамід або N-[5-(3-хлорфенілетиніл)піридин-2-іл]-3,3,3-трифтор-2,2-диметилпропіонамід. 3. Етинільна похідна формули IB за п. 1, яку вибирають з групи що включає: 2,2-диметил-N-(5-фенілетинілпіримідин-2-іл)пропіонамід або 2,2,N-триметил-N-(5-фенілетинілпіримідин-2-іл)пропіонамід. 4. Етинільна похідна формули ID за п. 1, яку вибирають з групи що включає: 2,2-диметил-N-(6-фенілетинілпіридазин-3-іл)пропіонамід або N-[6-(3-хлорфенілетиніл)піридазин-3-іл]-2,2-диметилпропіонамід. 5. Спосіб одержання сполуки формули І за будь-яким з пп. 1-4, згідно з яким: a) вводять в реакцію сполуку формули , 3А з придатною сполукою формули R 3 R R 3' Cl R 3В або 3 R 3' HO 2 R 2 O O 4 або з утворенням сполуки формули R R 5 3 R N N R R , IA R 3' 2 O 1 IB або 3 R N N N 2 N R 3 R 1 R R R 3' O R 3D N R N 3' 2 O 20 R 1 , ID де замісники описані в п. 1, або, якщо потрібно, одержану сполуку перетворюють у фармацевтично прийнятну кислотноадитивну сіль, або b) вводять в реакцію сполуку формули 6B або , 6A 25 6D 21 UA 110995 C2 з придатною сполукою формули R 1 2 з утворенням сполуки формули R R 3 R N N R R 2 R 1 , IA R 2 1 IB або 3 R N R 3' O N R 3 N N O R R R 3' N R N 3' 2 O 5 10 R 1 , ID де замісники описані в п. 1, або, якщо потрібно, одержану сполуку перетворюють у фармацевтично прийнятну кислотноадитивну сіль, або c) вводять в реакцію сполуку формули , 13А 13D з придатною сполукою формули R R 3 R HN 13В або 3 R ' 2 O з утворенням сполуки формули R R 3 R N N R R R 2 R N 1 , IA R R N R N R 3' 2 O 1 IB або 3 R N 3 N N O 15 R R 3' 3' 2 O R 20 1 , ID де замісники описані в п. 1, або, якщо потрібно, одержану сполуку перетворюють у фармацевтично прийнятну кислотноадитивну сіль. 6. Сполука за будь-яким з пп. 1-4 для застосування як терапевтично активної речовини. 22 UA 110995 C2 5 10 7. Фармацевтична композиція, що включає щонайменше одну зі сполук за будь-яким з пп. 1-4, а також їх фармацевтично прийнятні солі. 8. Сполука за будь-яким з пп. 1-4, коли її застосовують у вигляді сумішей енантіомерів, діастереомерів або у енантіомерно чистій формі; а також її фармацевтично прийнятна сіль для застосування як лікарського засобу. 9. Застосування сполуки за будь-яким з пп. 1-4, а також її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування або профілактики захворювань, пов'язаних з алостеричними модуляторами рецепторів mGluR5. 10. Сполука за будь-яким з пп. 1-4 для лікування або профілактики шизофренії, когнітивних розладів, синдрому ламкої Х-хромосоми або аутизму. Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 23
ДивитисяДодаткова інформація
Назва патенту англійськоюEthynyl derivatives as metabotropic glutamare receptor modulators
Автори англійськоюJaeschke, Georg, Lindemann, Lothar, Ricci, Antonio, Rueher, Daniel, Stadler, Heinz, Vieira, Eric
Автори російськоюЕшке Георг, Линдэманн Лотар, Риччи Антонио, Рюхер Даниель, Штадлер Хайнц, Виэйра Эрик
МПК / Мітки
МПК: C07D 239/42, C07D 237/22, A61K 31/44, A61K 31/505, A61K 31/50
Мітки: глутаматного, рецептора, модулятори, похідні, етинільні, метаботропного
Код посилання
<a href="https://ua.patents.su/25-110995-etinilni-pokhidni-yak-modulyatori-metabotropnogo-glutamatnogo-receptora.html" target="_blank" rel="follow" title="База патентів України">Етинільні похідні як модулятори метаботропного глутаматного рецептора</a>
Попередній патент: Курильний виріб і спосіб його виготовлення
Наступний патент: Спосіб виділення нативних міцел казеїну
Випадковий патент: Консерваційний склад












