Бензодіазепіновий інгібітор бромодомену
Формула / Реферат
1. Сполука формули (І), яка являє собою 2-[(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодіазепін-4-іл]-N-етилацетамід
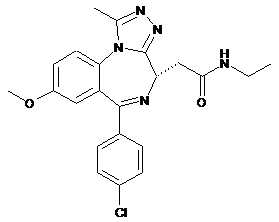 , (І)
, (І)
або її сіль.
2. Сполука формули (І) за пунктом 1, яка являє собою 2-[(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодіазепін-4-іл]-N-етилацетамід
 , (І)
, (І)
або її фармацевтично прийнятна сіль.
3. Сполука формули (І) за пунктом 1, яка являє собою 2-[(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодіазепін-4-іл]-N-етилацетамід
 (І).
(І).
4. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль за п. 2 та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів.
5. Фармацевтична композиція, яка містить сполуку формули (І) за п. 3 та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів.
6. Комбінований фармацевтичний продукт, який містить сполуку формули (І) або її фармацевтично прийнятну сіль за п. 2 або сполуку формули (І) за п. 3 разом з одним або більше іншими терапевтично активними засобами.
7. Спосіб лікування хвороби або стану, для яких показано інгібітор бромодомену, за яким суб'єкту, який цього потребує, вводять терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі за п. 2 або сполуки формули (І) за п. 3.
8. Спосіб лікування хвороби або стану за п. 7, де хвороба або стан являє собою хронічний аутоімунний та/або запальний стан.
9. Спосіб лікування хвороби або стану за п. 7, де хвороба або стан являє собою рак.
10. Спосіб лікування хвороби або стану за п. 9, де рак є вибраним з гематологічного, епітеліального раку, включаючи карциноми легень, молочних залоз та товстого кишечнику, серединні карциноми, мезенхімальні, печінкові, ниркові та неврологічні пухлини.
11. Спосіб лікування хвороби або стану за п. 10, де гематологічний рак являє собою лейкемію.
12. Спосіб лікування хвороби або стану за будь-яким з пп. 7-11, де суб'єкт являє собою людину.
Текст
Реферат: Представлений винахід стосується сполуки бензодіазепіну формули (І), способів її отримання, фармацевтичних композицій, які містять таку сполуку, та їх застосування в терапії. N N N H N N O Cl O (I) UA 105675 C2 (12) UA 105675 C2 UA 105675 C2 5 10 15 20 25 30 35 40 45 50 Заявлений винахід стосується сполуки бензодіазепіну, способів її отримання, фармацевтичних композицій, які містять таку сполуку та її застосування в терапії. Геноми еукариотичних організмів є високо організованими в ядрі клітини. Довгі ланцюги ДНК дуплексу обернуто навкруги октомеру білків пістону (які містять найбільше два екземпляри гістонів H2A, H2B H3 та H4) для утворення нуклеосоми. Тоді цю головну одиницю далі стиснуто агрегацією та згортанням нуклеосом для утворення високо ущільненої структури хроматину. Діапазон різних станів ущільнення є можливим, та щільність цієї структури змінюється протягом клітинного циклу, яка є найбільш компактною протягом процесу поділу клітини. Структура хроматину грає вирішальну роль у транскрипції регулювання гену, яка не може відбуватися ефективно через високо ущільнений хроматин. Структуру хроматину контрольовано рядом післятрансляційних модифікацій до білків гістону, більш за все − гістонів H3 та H4, та найбільше − в хвостових частинах пістону, які простягаються поза структурою ядра нуклеосоми. Ці модифікації охоплюють ацетилування, метилування, фосфорилування, убіквітинілування та SUMOylation. Ці епігенетичні знаки написано та стерто специфічними ферментами, які розміщують специфічні залишки на хвості гістону, утворюючи, таким чином, епігенетичний код, який тоді інтерпретовано клітиною для дозволу специфічного генного регулювання структури хроматину й транскрипції, таким чином. Ацетилування гістону найбільш асоційовано з активацією транскрипції гену, як модифікацією послаблень взаємодії ДНК та октомеру гістону зміною електростатики. На додаток до цієї фізичної зміни специфічні білки зв'язуються з ацетилованими залишками лізину в гістонах для зчитування епігенетичного коду. Бромодомени − малі (~110 амінокислот) чіткі домени в білках, які зв'язуються з ацетилованими залишками лізину, звичайно не тільки в контексті гістонів. Існує сімейство навколо 50 білків, відоме для вмісту бромодоменів, та вони мають діапазон функцій у клітині. Сімейство бромодомену Bet, яке містить білки, охоплює 4 білки (BRD2, BRD3, BRD4 та BRDt), які містять з'єднані послідовно бромодомени, здатні до зв'язування до двох ацетилованих залишків лізину в замкнутій близькості, збільшуючи специфічність взаємодії. Повідомлено про асоціацію BRD2 та BRD3 із гістонами вздовж активно транскрибованих генів, та можливість полегшення транскрипційної елонгації (Leroy et al, Mol. Cell. 2008 30(1):51-60), тоді як BRD4 виявляється залученим до рекрутменту комплексу pTEF-B до індукційованих генів, що призводить до фосфорилування РНК-полімерази та підвищеного транскрипційного продукту (Hargreaves et al, Cell, 2009 138(1): 129-145). Також повідомлено, що BRD4 та BRD3 сплавляються з NUT (ядерний білок у сім'янику), створюючи новий злитий онкоген, BRD4-NUT, у високо злоякісній формі епітеліальної неоплазії (French et al. Cancer Research, 2003, 63, 304-307 та French et al. Journal of Clinical Oncology, 2004, 22 (20), 4135-4139). Дані означають, що злиті білки BRD-NUT сприяють канцерогенезу (Oncogene, 2008, 27, 2237-2242). BRD-t однозначно екпресовано в сім'яники та яєчник. Сповіщено, що всі члени сімейства мають деяку функцію в контролюванні або виконанні аспектів клітинного циклу, та показано, що вони залишаються в комплексі із хромосомами протягом ділення клітини, що означає роль у підтримці епігенетичної пам'яті. Крім того, деякі віруси створюють застосування цих білків до зв'язування їх геномів до клітини-хазіїна хроматину як частину способу вірусної реплікації (You et al Cell, 2004 117(3):34960). Японська заявка на патент JP2008-156311 розкриває похідні бензімідазолу, який названо засобом зв'язування бромодомену BRD2, який має корисність стосовно розповсюдження вірусної інфекції. Заявка на патент WO2009/084693A1 розкриває ряд похідних триєнотриазолодіазепіну, які названо як інгібітори зв'язування ацетилованого гістону та бромодомену, який містить білок, які названо корисними як протиракові засоби. Знайдено сполуку, яка інгібує зв'язування бромодоменів зі спорідненими до них ацетилованими білками, конкретніше, яка інгібує зв'язування сімейства бромодоменів Bet до залишків ацетилованого лізину. Таку сполуку слід розглядати як "інгібітор бромодомену". Згідно з першим аспектом заявленого винаходу запропоновано сполуку формули (I) або її сіль 1 UA 105675 C2 5 10 15 20 25 30 35 (I) Згідно із другим аспектом заявленого винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів. Згідно із третім аспектом заявленого винаходу запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в терапії, зокрема, у лікуванні хвороб або станів, для яких є потрібним інгібітор бромодомену. Згідно із четвертим аспектом заявленого винаходу запропоновано спосіб лікування хвороб або станів, для яких є потрібним інгібітор бромодомену, у суб'єкта, який цього потребує, який полягає в застосуванні терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. Згідно з п'ятим аспектом заявленого винаходу запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування хвороб або станів, для яких є потрібним інгібітор бромодомену. Заявлений винахід стосується a сполуки формули (I) − 2-[(4S)-6-(4-хлорофеніл)-1-метил-8(метилокси)-4H-[1,2,4]триазоло[4,3-a][1,4]бензодіазепін-4-іл]-N-етилацетамід (I) або її солі. Слід розуміти, що заявлений винахід розглядає сполуки формули (I) як вільну основу та як їх солі, наприклад, як їх фармацевтично прийнятну сіль. В одному втіленні запропоновано сполуку − 2-[(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)4H-[1,2,4]триазоло[4,3-a][1,4]бензодіазепін-4-іл]-N-етилацетамід. Внаслідок можливості їх застосування в медицині солі сполук формули (I) є бажаними фармацевтично прийнятними. У ще одному втіленні запропоновано сполуку 2-[(4S)-6-(4хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-a][1,4]бензодіазепін-4-іл]-Nетилацетаміду або її фармацевтично прийнятну сіль. Придатні фармацевтично прийнятні солі можуть охоплювати кислотно-адитивні або лужноадитивні солі. Для огляду придатних солей дивись Berge et al., J. Pharm. Sci., 66:1-19, (1977). Типово, фармацевтично прийнятну сіль можна легко отримати застосуванням потрібної бажаної кислоти або основи. Отриману сіль можна осаджувати з розчину та збирати фільтруванням або можна виділяти випаровуванням розчиннику. Фармацевтично прийнятну лужно-адитивну сіль можна отримувати реакцією сполуки формули (I) із придатною неорганічною або органічною основою, (наприклад, наступним: триетиламін, етаноламін, триетаноламін, холін, аргінін, лізин або гістидин), необов'язково в придатному розчиннику, що дає лужно-адитивну сіль, яку, звичайно, виділяють, наприклад, кристалізацією та фільтруванням. Фармацевтично прийнятні лужні солі охоплюють наступне: солі амонію, солі лужного металу, як-то натрій та калій, солі лужно-земельного металу, як-то 2 UA 105675 C2 5 10 15 20 25 30 35 40 45 50 55 60 кальцій та магній, та солі з органічними основами, охоплюючи солі первинних, вторинних та третинних амінів, як-то ізопропіламін, діетиламін, етаноламін, триметиламін, дициклогексиламін та N-метил-D-глюкамін. Фармацевтично прийнятну кислотно-адитивну сіль можна отримувати реакцією сполуки формули (I) із придатною неорганічною або органічною кислотою (як-то, бромідна, хлоридна, сульфатна, нітратна, фосфатна, бурштинова, малеїнова, оцтова, пропіонова, фумарова, лимонна, виннокам'яна, молочна, бензойна, саліцилова, глутамінова, аспарагінова, птолуолсульфонова, бензолсульфонова, метансульфонова, етансульфонова, нафталінсульфонова, як-то 2-нафталінсульфонова, або гексанові кислота), необов'язково в придатному розчиннику, як-то органічний розчинник, що дає сіль, яку, звичайно, відокремлюють, наприклад, кристалізацією та фільтруванням. Фармацевтично прийнятна кислотно-адитивна саль сполуки формули (I) може містити або бути, наприклад, наступною сіллю: бромід, хлорид, сульфат, нітрат, фосфат, сукцинат, малеат, ацетат, пропіонат, фумарат, цитрат, тартрат, лактат, бензоат, саліцилат, глутамат, аспарагінат, п-толуолсульфонат, бензолсульфонат, метансульфонат, етансульфонат, нафталінсульфоноат, (наприклад, 2-нафталінсульфонат) або гексаноат. Інші фармацевтично неприйнятні солі, наприклад, форміати, оксалати або трифлуороацетати, можна застосовувати, наприклад, при відокремленні сполуки формули (I), та їх охоплено в межах цього винаходу. У межах винаходу охоплено всі можливі стехіометричні та нестехіометричні форми солей сполуки формули (I). Слід розуміти, що багато органічних сполук можуть утворювати комплекси з розчинниками, у яких вони реагують або з яких їх осаджено або кристалізовано. Ці комплекс відомі як "сольвати". Наприклад, комплекс із водою, відомий як "гідрат". Розчинники з високою точкою кипіння та/або здатні до створення гідрогенових зв'язків, як-то вода, ксилол, N-метилпіролідон, метанол та етанол, можна застосовувати для утворення сольватів. Способи ідентифікації сольватів охоплюють, але без обмеження, ЯМР та мікроаналіз. Сольвати сполуки формули (I) є в межах винаходу. У межах винаходу охоплено всі можливі стехіометричні та нестехіометричні форми сольватів сполуки формули (I). Згідно з винаходом охоплено всі проліки, сполуки формули (I) та їх фармацевтично прийнятні солі, які після застосування до реципієнта здатні забезпечувати (безпосередньо або опосередковано) сполуку формули (I) або її фармацевтично прийнятну сіль, або активний метаболіт, або його залишок. Такі похідні відомі спеціалісту в рівні техніки без надмірного експериментування. Однак, зроблено посилання на ознайомлення з Burger's Medicinal Chemistry th та Drug Discovery, 5 Edition, Vol 1: Principles та Practice, які охоплено тут посиланням, щоб поширити знання щодо таких похідних. Сполука формули (I) може бути в кристалічній або аморфній формі. Крім того, деякі із кристалічних форм сполуки формули (I) можуть існувати як поліморфи, які охоплено в межах заявленого винаходу. Поліморфні форми сполуки формули (I) можна характеризувати та розпізнавати, застосовуючи ряд звичайних аналітичних способів, охоплюючи, але без обмеження, наступне: рентгенівська дифрактограма на пороку (XRPD), інфрачервоний спектр (ІЧ), раманівський спектр, диференційна скандувальна калориметрія (ДСК), термогравіметричний аналіз (ТГА) та ядерний магнітний резонанс твердого стану (SSNMR). Сполука формули (I) − окремий виділений ізомер, як-то суттєво вільний від іншого ізомеру (тобто енантіомерно чистий), за умови − менше 10 %, конкретно − менше, приблизно, 1 %, наприклад, менше, приблизно, 0,1 % наявності іншого енантіомеру. Відокремлення ізомерів можна досягати звичайними способами, які відомі спеціалісту в рівні техніки, наприклад, фракційною кристалізацією, хроматографією або ВЕРХ. Сполука формули (I) може існувати в одній із декількох таутомерних форм. Слід розуміти, що згідно із заявленим винаходом охоплено всі таутомери сполуки формули (I) як окремі таутомери, а також як їхні суміші. Слід розуміти з попереднього, що сольвати, ізомери та поліморфні форми сполуки формули (I) та їх солі охоплено в межах винаходу Сполука формули (I) та її фармацевтично прийнятні солі можна отримувати різними способами, охоплюючи стандартні хімічні способи. Ілюстративні загальні способи синтезу показано нижче, та отримання конкретної сполуки формули (I) − в робочих прикладах. Ці способи формують подальші аспекти заявленого винаходу. Сполуку формули (I) можна отримувати згідно зі схемою реакції 1 реакцією сполуки формули (II) з EtNH2 у присутності HATU (O-(7-азабензотриазол-1-іл)-N, N,N",N’ 3 UA 105675 C2 5 тетраметилуроніум гексафлуорфосфату) або HBTU (O-бензотриазол-1-іл-N, N,N",N’тетраметилуроніум гексафлуорфосфату) та DIEA (діізопропілетиламіну) при кімнатній температурі. Альтернативно сполуки формули (I) можна отримувати реакцією сполуки формули (II) з оксалілхлоридом, а потім − додаванням EtNH2 у присутності триетиламіну. Схема 1 10 Сполуку формули (II) можна отримувати згідно зі схемою реакції 2. Придатні умови реакції полягають у реакції сполуки формули (III) з гідроксидом лужного металу, конкретно − натрій гідроксидом або літій гідроксидом. Схема 2 15 де R − C1-6алкіл, як-то метил. Сполуки формули (III), можна отримувати згідно зі схемою реакції 3 реакцією сполук формули (IV) з AcOH. Схема 3 20 25 Сполуки формули (IV) можна отримувати згідно зі схемою реакції 4 реакцією сполуки формули (VI) з гідразином нижче 15 °C, а потім − реакцією отриманого гідразону (V) з MeCOCl при 0 °C. Звичайно гідразон (V) застосовували без подальшого очищення, та він реагував з MeCOCl, наприклад, при 0 °C. Схема 4 Сполуки формули (VI), у яких R − C1-6алкіл (як-то, метил), можна отримувати згідно зі схемою реакції 5 зі сполуки формули (VII) обробкою реагентом Лоуссона або P4S10. Придатні умови реакції полягають у реакції сполук формули (VIII) з P 4S10 у 1,2-дихлоретані при, наприклад, 70 °C. 4 UA 105675 C2 Схема 5 5 Сполуки формули (VII) можна отримувати згідно зі схемою реакції 6, реакцією сполуки формули (IX) з органічною основою, як-то триетиламін, а потім − реакцією отриманого аміну (VIII) з оцтовою кислотою. Звичайно, амін (VIII) застосовано без подальшого очищення, та він реагував з AcOH, наприклад, при 60 °C. Схема 6 10 15 Сполуки формули (IX) можна отримувати згідно зі схемою реакції 7 реакцією сполук формули (XI) з ацилхлоридом (X) отриманого із захищеної аспарагінової кислоти. Схема 7 Сполуки формули (XI) можна отримувати згідно із процедурами, описаними в Synthesis 1980, 677-688. Ацилхлориди формули (X) можна отримувати згідно із процедурами, описаними в J. Org. Chem., 1990, 55, 3068-3074 та J. Chem. Soc. Perkin Trans. 1, 2001, 1673-1695. Альтернативно сполуку формули (I) можна отримувати згідно зі схемою реакції 8. Схема 8 5 UA 105675 C2 5 де R − C1-4алкіл, як-то метил. Сполуку формули (IIIA) можна отримувати згідно зі схемою реакції 9 реакцією сполуки формули (IVA) з EtNH2 у присутності HATU та DIEA, наприклад, при кімнатній температурі. Схема 9 10 Сполуку формули (IVA) можна отримувати згідно зі схемою реакції 10. Придатні умови реакції полягають у реакції сполуки формули (VI) з гідроксидом лужного металу, як-то натрій гідроксид. Схема 10 15 20 25 30 Спеціалісту в рівні техніки слід розуміти. що корисно захищати одну або більше функціональних груп сполук, описаних у способах вище. Приклади захисних груп та способів їх видалення можна знайти в T. W. Greene "Protective Groups in Organic Synthesis" (4th edition, J. Wiley та Sons, 2006). Придатні захисні групи аміну охоплюють наступне: ацил (наприклад, ацетил, карбамат (наприклад, 2",2",2’-трихлороетоксикарбоніл, бензилоксикарбоніл або тбутоксикарбоніл) та арилалкіл (наприклад, бензил), який можна видаляти гідролізом (наприклад, застосовуючи кислоту, як-то хлоридна кислота в діоксані або трифлуороцтова кислота в дихлорметані), або відновлюванням (наприклад, гідрогенолізом групи бензилу або бензилоксикарбонілу, або відновлювальним видаленням групи ’,2",2’-трихлороетоксикарбонілу, застосовуючи цинк у оцтовій кислоті). Інші придатні захисні групи аміну охоплюють наступне: трифлуороацетил (-COCF3) який можна видаляти каналізованим основою гідролізом. Слід розуміти, що в будь-якому з описаних вище шляхів, точну послідовність етапів синтезу, за якими різні групи та часточки введено в молекулу, можна змінювати. Спеціалісту в рівні техніки слід гарантувати, щоб групи або часточки, уведені на одному етапі способу, не було вражено наступними перетвореннями та реакціями, та відповідно вибирати послідовність етапів синтезу. Уважають, що деякі описані вище проміжні сполуки є новими, отже. створюють ще один аспект винаходу. Сполука формули (I) та її солі є інгібітором бромодомену, отже, її вважають потенційно корисною в лікуванні хвороб або станів, для яких бромодомен є потрібним. 6 UA 105675 C2 5 10 15 20 25 30 35 40 45 50 55 60 Отже, згідно із заявленим винаходом запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в терапії. Сполук формули (I) або фармацевтично прийнятну сіль можна застосовувати в лікуванні хвороб або станів, для яких є потрібним інгібітор бромодомену. В одному втіленні запропоновано сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні хвороб або станів, для яких бромодомен є потрібним. У ще одному втіленні запропоновано сполуку або її фармацевтично прийнятну сіль для застосування в лікуванні хронічного автоімунного та/або запального стану. У подальшому втіленні запропоновано сполуку або її фармацевтично прийнятну сіль для застосування в лікуванні раку, як-то медіальна карцинома. В одному втіленні запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування хвороб або станів, для яких є потрібним інгібітор бромодомену. У ще одному втіленні запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування хронічного автоімунного та/або запального стану. У подальшому втіленні запропоновано застосування сполуки формули (I) або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування раку, як-то серединна карцинома. В одному втіленні запропоновано спосіб лікування хвороби або стану, для якого є потрібним інгібітор бромодомену, у суб'єкта, який цього потребує, який полягає в застосуванні терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. У ще одному втіленні запропоновано спосіб лікування хронічного автоімунного та/або запального стану в суб'єкта, який цього потребує, який полягає в застосуванні терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. У подальшому втіленні запропоновано спосіб лікування раку, як-то серединна карцинома, у суб'єкта, який цього потребує, який полягає в застосуванні терапевтично ефективної кількості сполуки формули (I) або її фармацевтично прийнятної солі. В одному втіленні суб'єкт, який цього потребує, − ссавець, конкретно, людина. Як тут застосовано, термін "ефективна кількість" означає, що кількість ліків або фармацевтичного засобу, яка повинна обумовлювати біологічний або медичний відгук тканини, системи у тварини або людини, знайдено, наприклад, дослідником або лікарем-клініцистом. Крім того, термін "терапевтично ефективна кількість" означає будь-яку кількість, яка при співставленні із суб'єктом, який не отримав такої кількості, призводить до покращення лікування, зцілення, попередження, або покращення стану при хворобі, розладі, або побічній дії, або сповільнює темп розвитку хвороби або розладу. Термін також охоплює межу кількостей, ефективних для досягнення нормальної фізіологічної функції. Інгібітор бромодоменів уважають корисним у лікуванні різних хвороб або станів стосовно системного запалення або запалення тканини, запальних відгуків до інфекції або гіпоксії, клітинної активації та проліферації, ліпідного метаболізму, фібролізу та в попередженні та лікуванні вірусних інфекцій. Інгібітор бромодоменів може бути корисним у лікуванні широкого розмаїття хронічних автоімунних та запальних станів, як-то ревматоїдний артрит, остеоартрит, гостра подагра, псоріаз, системний червоний вовчак, розсіяний склероз, запальна хвороба кишечнику (хвороба Крона та виразковий коліт), астма, хронічна обструктивна хвороба дихальних шляхів, пневмоніт, міокардит, перикардит, міозит, екзема, дерматит, алопеція, вітиліго, бульозні хвороби шкіри, нефрит, васкуліт, атеросклероз, хвороба Альцгеймера, депресія, ретиніт, увеїт, склерит, гепатит, панкреатит, первинний біліарний цироз печінки, склерозувальний холангіт, хвороба Адисона, гіпофізит, тиреоїдит, діабет I типу та гостре відторгнення трансплантованих органів. Інгібітор бромодоменів може бути корисним у лікуванні широкого розмаїття гострих запальних станів, як-то гостра подагра, гігантоклітинний артеріїт, нефрит, охоплюючи люпуснефрит, васкуліт із залученням органів, як-то гломерулонефрит, васкуліт, охоплюючи гігантоклітинний артеріїт, гранулематоз Вегенера, нодозний поліартеріїт, хвороба Бехчета, хвороба Кавасакі, артеріїт Такавасу та гостре відторгнення трансплантованих органів. Інгібітор бромодоменів може бути корисним у попередженні або лікуванні хвороб або станів, які охоплюють запальні відгуки на інфекції бактеріями, вірусами, грибами, паразитами або їх токсинами, як-то сепсис, септичний синдром, септичний шок, ендотоксемія, синдром системного запального відгуку (SIRS), синдром дисфункції багатьох органів, синдром токсичного шоку, гостре ураження легенів, ARDS (синдром дихальної недостатності дорослого), гостра ниркова недостатність, фульмінантний гепатит, опіки, гострий панкреатит, післяопераційні синдроми, саркоїдоз, реакції Герксгеймера, енцефаліт, мієліт, менінгіт, малярія, SIRS, асоційований з вірусними інфекціями, як-то грип, оперізувальний лишай, простий герпес та коронавірус. 7 UA 105675 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інгібітор бромодоменів може бути корисним у попередженні або лікуванні станів, асоційованих з ішемічним реперфузійним ураженням, як-то інфаркт міокарду, цереброваскулярна ішемія (інсульт), гострі коронарні синдроми, реперфузійне ураження нирок, трансплантація органу, шунтування коронарної артерії, процедури кардіопульмонального шунтування та легеневого, ниркова, печінкова, шлунково-кишкова або периферійна емболія кінцівки. Інгібітор бромодоменів може бути корисним у лікуванні розладів ліпідного метаболізму через регулювання APO-A1, як-то гіперхолестеринемія, атеросклероз та хвороба Альцгеймера. Інгібітор бромодоменів може бути корисним у лікуванні фіброзних станів, як-то Ідіопатичний легеневий фіброз, нирковий фіброз, післяопераційний стеноз, утворення келоїду, склеродерма та серцевий фіброз. Інгібітор бромодоменів може бути корисним у попередженні та лікуванні вірусних інфекцій, як-то вірус герпесу, вірус папіломи людини, аденовірус, поксвірус та інші віруси ДНК. Інгібітор бромодоменів може бути корисним у лікуванні раку, охоплюючи наступне: гематологічна (як-то, лейкемія), епітеліальна пухлини, охоплюючи карциному легенів, молочної залози та ободової кишки, медіальну карциному, мезенхімальна, печінкова, ниркова та неврологічна пухлини. Інгібітор бромодоменів може бути корисним у лікуванні офтальмологічних симптомів, як-то сухе око. В одному втіленні хвороба або стан, для яких є потрібним інгібітор бромодомену, вибрано із хвороб, асоційованих із синдромом системного запального відгуку, як-то сепсис, опіки, панкреатит, поширена травма, крововилив та ішемія. У цьому втіленні інгібітор бромодомену слід застосовувати при особливості діагнозу для послаблення сфери дії наступного: SIRS, приступ шоку, синдром дисфункції багатьох органів, який охоплює наступне: симптом гострого легеневого ураження, ARDS, гостре ниркове, печінкове, серцеве та кишково-шлункове ураження та смертність. У ще одному втіленні інгібітор бромодомену слід застосовувати перед хірургічними або іншими процедурами асоційованими з високим ризиком наступного: сепсис, крововилив, розповсюджене враження тканин, SIRS або MODS. У конкретному втіленні хворобою або станом, для яких є потрібним інгібітор бромодомену, є сепсис, септичний синдром, септичний шок та/або ендотоксемія. У ще одному втіленні інгібітор бромодомену є потрібним для лікування гострого або хронічного панкреатиту. У ще одному втіленні бромодомен є потрібним для лікування опіків. В одному втіленні хвороб або стан, для яких є потрібним інгібітор бромодомену вибрано з наступного: інфекції та реактивації простого герпесу, лихоманковий герпес, інфекції та реактивації оперізувального герпесу, вітряна віспа, оперізувальний лишай, вірус папіломи людини, церві кальна неоплазія, аденовірусні інфекції, охоплюючи гостру респіраторну хворобу, та поксвірусні інфекції, як-то коров'яча віспа та віспа, і вірус африканської лихоманки свиней. В одному конкретному втіленні інгібітор бромодомену є потрібним для лікування вірусних інфекцій папіломи шкіри людини або церві кального епітелію. Термін "хвороби або стани, для яких інгібітор бромодомену є потрібним", охоплює будь-які або всі з вищевказаних хворобливих станів. Хоча їх можна застосовувати в терапії, сполуку формули (I) а також її фармацевтично прийнятні солі можна застосовувати як сирий хімічний продукт, звичайно він є присутнім як активний інгредієнт фармацевтичної композиції. Отже, згідно з подальшим аспектом заявленого винаходу запропоновано фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів. Отже, запропоновано фармацевтичну композицію для лікування хвороб або станів, при яких потрібен інгібітор бромодомену, який містить сполуку формули (I) або її фармацевтично прийнятну сіль. Носіям, розріджувачам або наповнювачам, застосованим у таких фармацевтичних композиціях, слід бути прийнятними, тобто сумісними з іншими інгредієнтами композиції та нешкідливими для реципієнта. Згідно із ще одним аспектом винаходу, також запропоновано спосіб отримання фармацевтичної композиції, охоплюючи змішування сполуки формули (I) або її фармацевтично прийнятної солі з одним або більше фармацевтично прийнятними носіями, розріджувачами або наповнювачами. Фармацевтична композиція може бути для застосування в лікуванні будь-яких описаних тут станів. Оскільки сполука формули (I) та її фармацевтично прийнятні солі запропоновано для застосування у фармацевтичних композиціях, легко зрозуміти, що кожну з них конкретно запропоновано, по суті, в чистій формі, наприклад, принаймні, 60 % чистоти, краще, принаймні, 8 UA 105675 C2 5 10 15 20 25 30 35 40 45 50 55 60 75 % чистоти, та конкретно, принаймні, 85 % чистоти, головним чином, принаймні, 98 % чистоти (мас. % базової маси). Фармацевтичні композиції можна надавати в одиничних формах дозування, які містять задану кількість активного інгредієнту на одиничну дозу. Переважні композиції одиничного дозування містять добову дозу або піддозу, або придатну долю дози активного інгредієнту. Отже, такі одиничні дози можна застосовувати більше одного разу на добу. Переважні композиції одиничного дозування містять добову дозу або піддозу (для застосування більше одного разу на добу), як тут вище цитовано, або придатну долю дози активного інгредієнту. Фармацевтичні композиції можна регулювати для застосування будь-яким придатним шляхом, наприклад, наступним пероральний (охоплюючи букальний або сублінгвальний), ректальний, вдихальний, інтраназальний, місцевий (охоплюючи букальний, сублінгвальний або трансдермальний), вагінальний або парентеральний (охоплюючи підшкірний, внутрішньом'язовий, внутрішньовенний або інтрадермальний) шлях. Такі композиції можна отримувати будь-яким способом, відомим у рівні техніки фармації, наприклад, поєднанням активного інгредієнту з носіями або наповнювачами. В одному втіленні фармацевтичну композицію адаптовано для перорального застосування. В одному втіленні фармацевтичну композицію адаптовано для парентерального застосування, конкретно − внутрішньовенного застосування. Фармацевтичні композиції, адаптовані для парентерального застосування, охоплюють водні та неводні стерильні розчини для ін'єкції, які можуть містити антиоксиданти, буфери, бактеріостатики та розчин, який робить композицію ізотонічною щодо крові реципієнта; та водні та неводні стерильні суспензії, які можуть охоплювати суспендувальні засоби та загущувальні засоби. Композиції можна надавати в однодозових або багатодозових контейнерах, наприклад, герметизованих ампулах та пробірках, та можна зберігати висушеному виморожуванням (ліофілізованому) стані, який потребує тільки додавання стерильного рідкого носія, наприклад, води для ін'єкцій безпосередньо перед застосуванням. Розчини та суспензії для ін'єкції, приготовані для негайного прийому, можна отримувати зі стерильних порошків, гранул та таблеток. Фармацевтичні композиції, адаптовані для перорального застосування, можна надавати як дискретні одиниці, як-то капсули або таблетки; порошки або гранули; розчини або суспензії у водних або неводних рідинах; їстівні піни або креми; або рідинні емульсії олія-у-воді або рідинні емульсії вода-в-олії. Наприклад, для пероральний застосування у формі таблетки або капсули активну складову ліків можна комбінувати з пероральним, нетоксичним фармацевтично прийнятним інертним носієм, як-то етанол, гліцерин, вода та подібне. Порошки, придатні для уведення в таблетки або капсули, можна отримувати подрібненням сполуки до придатного малого розміру (наприклад, мікронізацією) та змішування з аналогічно отриманим фармацевтичним носієм, як-то їстівний вуглевод, наприклад, крохмаль або манітол. Також можна надавати ароматизатор, консервант, барвник та розщеплювальний засіб. Капсули можна робити приготуванням порошкової суміші, як описано вище, наповнювача для утворення желатинових оболонок. Ковзні засоби та змащувачі, як-то колоїдний діоксид силіцію, тальк, магній стеарат, кальцій стеарат або твердий поліетиленгліколь можна додавати до порошкової суміші перед операцією нанесення оболонки. Розщеплювальний або солюбілізувальний засіб, як-то агар-агар, кальцій карбонат або натрій карбонат, також можна додавати для покращення придатності медикаменту в капсулі для ковтання. Крім того, коли бажано або потрібно, придатні зв'язувачі, ковзні засоби, змащувачі, підсолоджувачі, ароматизатори, розщеплювальні засоби та барвники також можна вводити в суміш. Придатні зв'язувачі охоплюють наступне: крохмаль, желатин, природні цукри, як-то глюкоза або бета-лактоза, зернові підсолоджувачі, природні та синтетичні смоли, як-то гуміарабік, трагакант або натрій альгінат, карбоксиметилцелюлоза, поліетиленгліколь, воски та подібне. Змащувачі, застосовані в цих формах дозування, охоплюють наступне: натрій олеат, натрій стеарат, магній стеарат, натрій бензоат, натрій ацетат, натрій хлорид та подібне. Розщеплювачі охоплюють, без обмеження, наступне: крохмаль, метил целюлоза, агар, бентоніт, смола ксантану та подібне. Таблетки робили, наприклад, приготуванням порошкової суміші, гранулюванням або подрібненням, додаванням змащувачу та дезінтегранту, і пресування в таблетки. Порошкову суміш отримували змішуванням придатно подрібненої сполуки з розріджувачем або основою, яку описано вище, та необов'язково зі зв'язувачем, як-то карбоксиметилцелюлоза, альгінат, желатин, або полівінілпіролідон, сповільнювач розчинення, як-то парафін, прискорювач резорбції, як-то четвертинна сіль та/або засіб всмоктування, як-то бентоніт, каолін або дикальцій фосфат. Порошкову суміш можна гранулювати зволожуванням 9 UA 105675 C2 5 10 15 20 25 30 35 40 45 50 55 зв'язувачем, як-то, паста крохмалю, рослинний клей або розчини целюлозних або полімерних матеріалів, та продавленням через сито. Як альтернатива гранулюванню, порошкову суміш можна піддавати обробці на пристрої для таблетування, та результатом є неідеально утворена маса, розколота в гранули. Гранули можна змащувати для збереження для штампування таблетки способами додавання стеаринової кислоти, солі стеарату, тальку або мінерального масла. Змащену суміш тоді пресували в таблетки. Сполуки заявленого винаходу також можна комбінувати з інертним носієм, який легко тече, та безпосередньо пресувати в таблетку без проходження через етапи гранулювання або подрібнення. Можна робити прозоре або непрозоре захисне покриття, яке складається із прошарку шелаку, покриття цукру або полімерного матеріалу та глянцевого покриття зі смоли. До цих покриттів можна додавати барвники, щоб розрізняти різні одиничні дозування. Пероральні рідини, наприклад, розчин, сиропи та еліксири можна отримувати у формі одиничного дозування, щоб надавати вміст із визначеною кількістю сполуки. Сиропи можна отримувати розчиненням сполуки у відповідно ароматизованому водному розчині, а еліксири отримували застосуванням нетоксичного спиртового наповнювача. Суспензії можна створювати диспергуванням сполуки в нетоксичному наповнювачі. Також можна додавати солюбілізатори та емульгатори, як-то етоксиловані ізостеарилові спирти та поліоксиетилен-сорбитол-етери, консерванти, смакові додатки, як-то масло перцевої м'яти або природні підсолоджувачі, або сахарин, або інші штучні підсолоджувачі, та подібне. Де це є придатним, композиції одиниці дозування для пероральний застосування можуть бути мікроінкапсульованими. Також можна отримувати склад для подовженого або вповільненого вивільнення, наприклад, покриттям або введенням часточкового матеріалу в полімери, віск або подібне. Сполуки формули (I) та їх фармацевтично прийнятні солі також можна застосовувати у формі систем постачання ліпосоми, як-то малі одношарові везикули, великі одношарові везикули та багатошарові везикули. Ліпосоми можна створювати з різних фосфоліпідів, як-то холестерин, стеариламін або фосфатидилхоліни. Фармацевтичні композиції, адаптовані для місцевого застосування, можна розробляти як мазі, креми, суспензії, лосьйони, порошки, розчини, пасти, гелі, розчини для розпилювання, аерозолі або олії. Для лікування ока або інших зовнішніх тканин, наприклад, рота та шкіри, композиції конкретно застосовують як місцеву мазь або крем. При розробці рецептури мазі активний інгредієнт можна вводити парафінованою або водорозчинною основою мазі. Альтернативно, активний інгредієнт можна вводити в крем з основою крему олія-у-воді або основ вода-в-олії. Фармацевтичні композиції, адаптовані для місцевих застосувань до ока, охоплюють наступне: краплі для ока, де активний інгредієнт розчинено або суспендовано в придатному носії, головним чином, у водному розчиннику. Форми дозування для назального або дихального застосування можна легко створювати як аерозолі, розчини, суспензії, гелі або сухі порошки. Для композицій, придатних та/або адаптованих для застосування диханням, переважним є те, що сполука формули (I) або її фармацевтично прийнятна сіль є у формі зменшеного розміру часточок, отриманого, наприклад, мікронізацією. Переважний зменшений розмір часточки (наприклад, мікронізований) сполуки або солі, визначений D50, дорівнює, приблизно, 0,5 − 10 мікронів (наприклад, визначено, застосовуючи лазерну дифракцію). Композиції аерозолю, наприклад, для дихального застосування, можуть містити розчин або тонку суспензію активної речовини у фармацевтично прийнятному водному або неводному розчиннику. Композиції аерозолю можна надавати в стерильному вигляді в однодозових або багатодозових кількостях, герметизованих у контейнері, які можна отримувати з патрону або заповнювати для застосування з пульвелізатору або інгалятору. Альтернативно, герметизований контейнер може бути пристроєм для одиничного розподілення, як-то однодозовий назальний інгалятор або аерозолевий балончик із дозатором (інгалятор із визначеною дозою), який призначено для розміщення однократного вмісту для розпилювання. Якщо форма дозування містить дозатор аерозолю, це конкретно містить придатний газвитискувач під тиском, як-то стиснуте повітря, діоксид карбону або органічний газ-витискувач, як-то гідрогенфлуорокарбон (HFC). Придатні гази-витискувачі HFC охоплюють наступне: 1,1,1,2,3,3,3-гептафлуоропропен та 1,1,1,2-тетрафлуороетан. Форми дозування аерозолю також може мати форму пульвелізатора. Стиснутий аерозоль може містити розчин або суспензію активної сполуки. Це може потребувати введення додаткових наповнювачів, наприклад, співрозчинників та/або поверхнево-активних речовин для покращення характеристик дисперсії 10 UA 105675 C2 5 10 15 20 25 30 35 40 45 50 55 та гомогенності композиції суспензії. Розчин композиції також може потребувати додавання співрозчинників, як-то етанол. Фармацевтичні композиції, придатні та/або адаптовані для дихального застосування, можуть бути у вигляді придатної для інгаляції композиції сухого порошку. Така композиція може містити порошкову основу, як-то лактоза, глюкоз, трегалоза, манітол або крохмаль, сполука формули (I) або її фармацевтично прийнятна сіль (конкретно у формі часточок зменшеного розміру, наприклад, у мікронізованій формі), та необов'язково модифікатор дії, як-то L-лейцин або інша амінокислота та/або солі металів стеаринової кислоти, як-то магній або кальцій стеарат. Конкретно, придатна для інгаляції суха порошкова композиція містить суміш сухого порошку лактози, наприклад, моногідрату лактози, та сполуки формули (I) або її фармацевтично прийнятної солі. Такі композиції можна застосовувати до пацієнта, застосовуючи придатний апарат, як-то апарат DISKUS® від GlaxoSmithKline, який, наприклад, описано в GB 2242134 A. Сполуку формули (I) та її фармацевтично прийнятні солі можна постачати як рідку композицію з дозатору рідини, наприклад, з дозатору рідини, який має сопло для розподілення або насадку для розподілення, через яку дисперговано виміряну дозу рідинної композиції до механізму насосу дозатор рідини. Такі дозатори рідини звичайно забезпечено резервуаром для багатократних виміряних доз рідкої композиції, дози постачають на послідовні запуски насосу. Сопло для розподілення або насадку можна формувати для уведення в ніздрі споживача для розподілення аерозолю рідкої композиції в носову порожнину. Дозатор рідини вищевказаного типу описано та ілюстровано в WO2005/044354 A1. Терапевтично ефективній кількості сполуки формули (I) або її фармацевтично прийнятній солі слід залежати від ряду факторів, охоплюючи, наприклад, вік та масу тварини, точні стани, які потребують лікування та їх тяжкість, характер композиції, та шлях застосування, та, зрештою, слід покладатися на розсуд лікаря або ветеринара. У фармацевтичній композиції кожна одиниця дозування для перорального або парентерального застосування конкретно містить 0,01 − 3000 мг, конкретніше, 0,5 − 1000 мг сполуки формули (I) або її фармацевтично прийнятної солі, розрахованої як вільна основа. Кожна одиниця дозування для назального або дихального застосування конкретно містить 0,001 − 50 мг, конкретніше, 0,01 − 5 мг, сполуки формули (I) або її фармацевтично прийнятної солі, розрахованої як вільна основа. Сполуку формули (I) та її фармацевтично прийнятні солі можна застосовувати в добовій дозі (для дорослого пацієнта), наприклад, пероральній або парентеральній дозі 0,01 мг − 3000 мг на добу, або 0,5 − 1000 мг на добу, або назальній або дихальній дозі − 0,001 − 50 мг на добу, або 0,01 − 5 мг на добу, сполуки формули (I) або її фармацевтично прийнятної солі, розрахованої як вільна основа. Цю кількість можна надавати в одиничній дозі на добу, або більше, звичайно в числі (як-то, дві, три, чотири, п'ять або шість) піддоз на добу, за умови тієї ж самої добової дози. Ефективну кількість її фармацевтично прийнятної солі можна визначати як пропорцію ефективної кількості сполуки формули (I) як такої. Отже, запропоновано фармацевтичну композицію, яка містить a) 0,01 − 3000 мг сполуки формули (I) або її фармацевтично прийнятної солі, та (b) 0,1 − 2 г одного або більше фармацевтично прийнятних носіїв, розріджувачів та/або наповнювачів. Сполуку формули (I) та її фармацевтично прийнятну солі можна вводити як таку або в комбінації з іншими терапевтичними засобами. Отже, комбіновані лікування згідно із заявленим винаходом містять застосування, принаймні, одної сполуки формули (I) або її фармацевтично прийнятної солі, та застосування, принаймні, одного іншого фармацевтично активного засобу. Конкретно, комбіновані лікування згідно із заявленим винаходом охоплюють застосування, принаймні, одної сполуки формули (I) або її фармацевтично прийнятної солі, та принаймні, одного іншого фармацевтично активного засобу. Сполука формули (I) та її фармацевтично прийнятні солі та інші фармацевтично активні засоби можна застосовувати разом у єдиній фармацевтичній композиції або окремо, та при роздільному застосуванні це можна робити одночасно або послідовно в будь-якій послідовності. Кількості сполуки формули (I) та її фармацевтично прийнятних солей, та інших фармацевтично активних засобів та вибір часу застосування слід вибирати таким чином, щоб досягати бажаного комбінованої терапевтичної дії. Отже, у подальшому аспекті, запропоновано комбінацію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль та, принаймні, один інший фармацевтично активний засіб. В одному втіленні запропоновано комбінований фармацевтичний продукт, який містить сполуку формули (I) або її фармацевтично прийнятну сіль разом з одним або більше іншими терапевтично активними засобами. Отже, в одному аспекті, сполуку формули (I) та фармацевтичні композиції згідно зі винаходом можна застосовувати в комбінації з, або вони охоплюють один або більше інших 11 UA 105675 C2 5 10 15 20 25 терапевтичних засобів, наприклад, вибраних із наступного: антибіотики, противірусні, глікокортикостероїди, мускаринові антагоністи та агоністи бета-2. Слід розуміти, що коли сполуку формули (I) та її фармацевтично прийнятні солі застосовано в комбінації з іншими терапевтичними засобами, які звичайно застосовують дихальним, внутрішньовенним, пероральним або інтраназальним шляхом, отриману фармацевтичну композицію можна застосовувати тими ж самими шляхами. Альтернативно, окремі складові композиції можна застосовувати різними шляхами. Згідно з винаходом в одному втіленні охоплено комбінації, які містять один або два інші терапевтичні засоби. Спеціалісту в рівні техніки зрозуміло, якщо це потрібно, придатні інші терапевтичні інгредієнти можна застосовувати у формі солей, наприклад, як солі лужного металу або солі аміну, або як кислотно-адитивні солі, або проліки, або як естери, наприклад, нижчі алкілестери, або як сольвати, наприклад, гідрати, для оптимізації активності та/або стабільності та/або фізичних характеристик, як-то розчинності, терапевтичного інгредієнту. Також слід усвідомити, що терапевтичні інгредієнти можна застосовувати в оптично чисті формі, якщо це потрібно. Вищевказані комбінації можна легко надавати для застосування у формі фармацевтичної композиції, та, отже, фармацевтичні композиції, які містять розкриту вище комбінацію разом із фармацевтично прийнятним розріджувачем або носієм представляють подальший аспект винаходу. Сполуку формули (I) можна отримувати описаними нижче способами або подібними способами. Отже, подальші інтермедіати та приклади ілюструють спосіб отримання сполуки формули (I) та будь-яким шляхом не обмежують винахід. Загальні деталі експерименту Усі температури надано в°C. Скорочення - тонкошарова ТШХ хроматографія AcOH - оцтова кислота AcCl - ацетилхлорид - піридиніум пPPTS толуолсульфонат ДХМ - дихлорметан 1,2-DCE - 1,2-дихлоретан DIC діізопропілкарбодіімід - N, NDIEA діізопропілетиламін - N, NДМФ диметилформамід - 4DMAP диметиламінопіридин - 9H- флуорен -9Fmoc ілметил)окси]карбоніл -O-(7азабензотриазол-1HATU іл)-N, N,N",N’тетраaметилуроніум гексафлуорофосфат - O - (бензотриазол-1іл) - N, N,N",N’HBTU тетраaметилуроніум гексафлуорофосфат Et2O - диетилетер EtOAc - етилацетат i-Pr2O - ді-ізопропілетер - абсолютна Конфіг. конфігурація - 2,4-біс(4Реагент Лоуссона метоксифеніл)-1,3дитіа-2,4 12 UA 105675 C2 дифосфетан-2,4дисульфід - ацетонітрил - метанол - час утримання - тетрагідрофуран - кімнатна КТ температура Pd/C - паладій на вугіллі РХ/МС стосується аналізів ВЕРХ, які супроводжували два види апаратури: a) На колонці Supelcosil LCABZ+PLUS (3 мкм, 3,3 см x 4,6 мм ID), елюючи 0,1 % HCO2H та 0,01 M амоній ацетатом у воді (розчинник A), та 95 % ацетонітрилом та 0,05 % HCO2H у воді (розчинник B), застосовуючи наступний градієнт елюювання 0-0,7 хвил. 0 %B, 0,7-4,2 хвил. 0→100 %B, 4,2-5,3 хвил. 100 %B, 5,3-5,5 хвил. 100→0 %B при швидкості потоку 3 мл/хвил… Мас-спектр (МС) регістрували на мас-спектрометрі Fisons VG Platform, застосовуючи позитивну електро-розпилювальну іонізацію [(ES+ve, що дає молекулярні іони [M+H]+ та [M+NH4]+], або негативну електро-розпилювальну іонізацію [(ES-ve, що дає молекулярний іон [M-H]-]. Аналітичні дані із цих приладів надано в наступному форматі: [M+H]+ або [M-H]-. b) На колонці Chromolith Performance RP 18 (100 × 4,6 мм id), елюючи 0,01M амоній ацетатом у воді (розчинник A) та 100 % ацетонітрилом (розчинник B), застосовуючи наступний градієнт елюювання 0-4 хвил. 0 100 % B, 4-5 хвил. 100 % B при швидкості потоку 5 мл/хвил… Мас-спектр (МС) регістрували на мікромас-спектрометр Platform-LC, застосовуючи позитивну + хімічну іонізацію атмосферного тиску [AP+ve, що дає молекулярні іони MH ] або негативну хімічну іонізацію атмосферного тиску [AP-ve, що дає молекулярні іони (M-H)-]. Аналітичні дані цих приладів надано в наступному форматі: [M+H]+ або [M-H]- упереджено акроніум − ХІАТ для точного визначення згідно із двома спектрометричними аналізами. РХ/МСВР: Аналітичну ВЕРХ супроводжувала колонка Uptisphere-hsc (3 мкм 33 × 3 мм id), елюючи 0,01M амоній ацетатом у воді (розчинник A) та 100 % ацетонітрилом (розчинник B), застосовуючи наступний градієнт елюювання 0-0,5 хвил. 5 % B, 0,5-3,75 хвил. 5100 % B, 3,754,5 100 % B, 4,5-5 1005 % B, 5-5,5 5 % B при швидкості потоку 1,3 мл/хвил… Мас-спектр (МС) регістрували на мікромас-спектрометрі LCT, застосовуючи позитивну електро-розпилювальну + іонізацію [ES+ve, що дає молекулярні іони MH ], або негативну електро-розпилювальну іонізацію [ES-ve, що дає молекулярні іони (M-H)-] способи. Спрямована на масу авто-препаративна ВЕРХ стосується способу, де матеріал очищали високоефективною рідинною хроматографією на колонці HPLCABZ+5 мкм (5 см x 10 мм i.d.) з 0,1 % HCO2H у воді та 95 % MeCN, 5 % вода (0,5 % HCO2H), застосовуючи наступний градієнт елюювання: 0-1,0 хвил. 5 %B, 1,0-8,0 хвил. 5→30 %B, 8,0-8,9 хвил. 30 %B, 8,9-9,0 хвил. 30→95 %B, 9,0-9,9 хвил. 95 %B, 9,9-10 хвил. 95→0 %B при швидкості потоку 8 мл/хвил… Колектор Gilson 202-fraction запускали мас-спектрометром VG Platform для визначення потрібної маси. 1 Спектр протонного ЯМР ( H ЯМР) регістрували при температурі навколишнього середовища на спектрометр Bruker Avance 300 DPX, застосовуючи розчинник як внутрішній стандарт та -1 хімічні зсуви протону виражали в млн у потрібному розчиннику. Для сигналів ЯМР застосовано наступні скорочення: s = синглет, d = дублет, t = триплет, q = квадруплет, dd = подвійний дублет, m = мультиплет. ТШХ (тонкошарова хроматографія) стосується застосування планшетів ТШХ від Merck, покритих гелем діоксиду силіцію 60 F254. MeCN MeOH час утр. ТГФ 5 10 15 20 25 30 35 40 Приклад 1: 2-[(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3a][1,4]бензодіазепін-4-іл]-N-етилацетамід 13 UA 105675 C2 5 10 15 20 25 30 До розчину [(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3a][1,4]бензодіазепін-4-іл]оцтової кислоти (спосіб отримання дивись для інтермедіату 1) (16,0 г, 40 ммол) у ТГФ при КТ додавали DIEA (14 мл, 80 ммол), а потім − HATU (30,4 г, 80 ммол). Реакційну суміш перемішували протягом 3 год. при цій температурі та додавали етиламін (40 мл, 2M у ТГФ, 80 ммол). Суміш перемішували протягом 48 год. перед концентруванням під зниженим тиском. Сир матеріал суспендували у воді та екстрагували ДХМ. Органічний шар сушили над Na2SO4, фільтрували та концентрували у вакуумі. Сиру тверду речовину очищали хроматографією на SiO2 (ДХМ/MeOH 95/5) та отриману тверду речовину перекристалізовували в MeCN. Тверду речовину тоді розчиняли в ДХМ та осаджували з i-Pr2O, що дало заголовну сполуку (8 г, 47 % вихід) як білу тверду речовину. 1 Rf=0,48 (ДХМ/MeOH: 90/10). Т.пл. >140 °C (стає в'язкою). Н ЯМР (300 МГц, CDCl3) δ 7,537,47 (m, 2H), 7,39 (d, J=8,9 Гц, 1H), 7,37-7,31 (m, 2H), 7,20 (dd, J=2,9 та 8,9 Гц, 1H), 6,86 (d, J=2,9 Гц, 1H), 6,40 (m, 1H), 4,62 (m, 1H), 3,80 (s, 3H), 3,51 (dd, J=7,3 та 14,1 Гц, 1H), 3,46-3,21 (m, 3H), 35 + 2,62 (s, 3H), 1,19 (t, J=7,3 Гц, 3H). РХ/МС: m/z 424 [M( Cl)+H] , час утр. 2,33 хвил. Інтермедіат 1: [(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3a][1,4]бензодіазепін-4-іл]оцтова кислота До розчину метил [(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3a][1,4]бензодіазепін-4-іл]ацетату (спосіб отримання дивись для інтермедіату 2) (28 г, 68 ммол) у ТГФ (450 мл) при КТ додавали 1N NaOH (136 мл, 136 ммол). Реакційну суміш перемішували при цій температурі протягом 5 год. перед охолодженням та гасили 1N HCl (136 мл). ТГФ видаляли під зниженим тиском, та водний шар екстрагували ДХМ. Комбіновані органічні шари сушили над Na2SO4, фільтрували та концентрували під зниженим тиском. Тверду сиру речовину перекристалізовували в CH3CN, що дало заголовну сполуку (23,9 г, 89 % вихід) як блідий 1 жовтий порошок. Н ЯМР (300 МГц, CDCl3) δ 7,55-7,48 (m, 2H), 7,41 (d, J=8,9 Гц, 1H), 7,38-7,31 (m, 2H), 7,22 (dd, J=2,9 та 8,9 Гц, 1H), 6,90 (d, J=2,9 Гц, 1H), 4,59 (dd, J=6,9 та 6,9 Гц, 1H), 3,81 (s, 3H), 3,70 (dd, J=6,9 та 25,7 Гц, 1H), 3,61 (dd, J=6,9 та 25,7 Гц, 1H), 2,63 (s, 3H). РХ/МС: m/z 397 35 + [M( Cl)+H] , час утр. 2,11 хвил. Інтермедіат 2: Метил [(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3a][1,4]бензодіазепін-4-іл]ацетат 14 UA 105675 C2 5 10 15 20 25 30 Сирий метил [(3S)-2-[(1Z)-2-ацетилгідразино]-5-(4-хлорофеніл)-7-(метилокси)-3H-1,4бензодіазепін-3-іл]ацетат (спосіб отримання дивись для інтермедіату 3) (34 г, 79 ммол), суспендували в ТГФ (200 мл) та додавали при КТ AcOH (200 мл). Реакційну суміш перемішували при цій температурі протягом ночі перед концентруванням до сухого стану. Залишок суспендували в насиченому NaHCO3 та екстрагували ДХМ. Органічний шар сушили над Na2SO4, фільтрували та концентрували у вакуумі. Тверду сиру речовину очищали хроматографією на SiO2 (ДХМ/MeOH: 90/10), що дало заголовну сполуку (28 г, 86 % вихід) як жовтий порошок. 1 Н ЯМР (300 МГц, CDCl3) δ 7,54-7,47 (m, 2H), 7,40 (d, J=8,8 Гц, 1H), 7,37-7,31 (m, 2H), 7,22 (dd, J=2,8 та 8,8 Гц, 1H), 6,89 (d, J=2,8 Гц, 1H), 4,61 (dd, J=6,4 та 7,8 Гц, 1H), 3,82 (s, 3H), 3,78 (s, 3H), 3,66 (dd, J=7,8 та 16,9 Гц, 1H), 3,60 (dd, J=6,4 та 16,9 Гц, 1H), 2,62 (s, 3H). РХ/МС m/z 411 35 + [M( Cl)+H] , час утр. 2,88 хвил. Інтермедіат 3: Метил [(3S)-2-[2-ацетилгідразино]-5-(4-хлорофеніл)-7-(метилокси)-3H-1,4бензодіазепін-3-іл]ацетат До суспензії метил [(3S)-5-(4-хлорофеніл)-7-(метилокси)-2-тіоксо-2,3-дигідро-1H-1,4бензодіазепін-3-іл]ацетату (спосіб отримання дивись для інтермедіату 4) (30,2 г, 77,7 ммол) у ТГФ (800 мл) при 0 °C краплями додавали гідразин моногідрат (11,3 мл, 233 ммол). Реакційну суміш перемішували протягом 4 год. між 0 °C та 15 °C перед охолодженням при 0 °C. Тоді повільно додавали Et3N (32,4 мл, 230 ммол) та додавали краплями AcCl (16,3 мл, 230 ммол). Суміш дозволяли нагріватися до КТ та перемішували протягом 1 год., тоді гасили водою та концентрували під зниженим тиском. Тоді отриманий водний шар екстрагували ДХМ, та органічний шар сушили над Na2SO4, фільтрували та концентрували у вакуумі, що дало сиру заголовну сполуку (34 г, 100 % вихід), яку застосовували без подальшого очищення. РХ/МС: m/z 35 429 [M( Cl)+H]+, час утр. 2,83 хвил. Інтермедіат 4: Метил [(3S)-5-(4-хлорофеніл)-7-(метилокси)-2-тіоксо-2,3-дигідро-1H-1,4бензодіазепін-3-іл]ацетат Суспензію P4S10 (85,8 г, 190 ммол) та Na2CO3 (20,5 г, 190 ммол) у 1,2-DCE (1,5 L) при КТ перемішували протягом 1 год. перед додаванням метил [(3S)-5-(4-хлорофеніл)-7-(метилокси)-2 15 UA 105675 C2 5 10 оксо-2,3-дигідро-1H-1,4-бензодіазепін-3-іл]ацетату (спосіб отримання дивись для інтермедіату 5) (40 г, 107 ммол). Перед охолодженням отриману суміш перемішували при 65 °C протягом 4 год. та фільтрували. Тверду речовину промивали ДХМ та фільтрат промивали насич. NaHCO 3. Органічний шар сушили над Na2SO4, фільтрували та концентрували під зниженим тиском. Заголовну сполуку осаджували із суміші ДХМ/i-Pr2O та фільтрували. Тоді фільтрат концентрували та очищували флеш-хроматографією (ДХМ/MeOH: 98/2), що дало ще одну порцію продукту. Заголовну сполуку отримували комбінацією двох фракцій (30,2 г, 73 %) як 35 жовтий порошок. РХ/МС: m/z 389 [M( Cl)+H]+, час утр. 3,29 хвил. Інтермедіат 5: Метил [(3S)-5-(4-хлорофеніл)-7-(метилокси)-2-оксо-2,3-дигідро-1H-1,4бензодіазепін-3-іл]ацетат 1 15 20 25 30 2 До розчину сирого метил N -[2-[(4-хлорофеніл)карбоніл]-4-(метилокси)феніл]-N -{[(9Hфлуорен-9-ілметил)окси]карбоніл}-L-α-аспарагінату (спосіб отримання дивись для інтермедіату 6) (припустимо 0,2 мол) у ДХМ (500 мл) додавали Et3N (500 мл, 3,65 мол), та отриману суміш перед концентруванням піддавали дефлегмації протягом 24 год. Отриманий сирий амін розчиняли в 1,2-DCE (1,5 L) та обережно додавали AcOH (104 мл, 1,8 мол). Тоді реакційну суміш перед концентруванням у вакуумі перемішували при 60 °C протягом 2 год. та розчиняли в ДХМ. Органічний шар промивали 1N HCl, та водний шар екстрагували ДХМ (x3). Комбіновані органічні шари промивали двічі водою, та розсолом, сушили над Na 2SO4, фільтрували та концентрували під зниженим тиском. Тверду сиру речовину перекристалізовували в MeCN, що дало заголовну сполуку (51 г) як бліду жовту тверду речовину. Фільтрат концентрували та перекристалізовували в MeCN, що дало ще 10 г інтермедіату 9 (всього: 61 г, 69 % вихід базовано на отриманому інтермедіаті 12). Rf=0,34 (ДХМ/MeOH: 95/5). РХ/МС m/z 373 35 [M( Cl)+H]+, час утр. 2,76 хвил. 1 2 Інтермедіат 6: Метил N -[2-[(4-хлорофеніл)карбоніл]-4-(метилокси)феніл]-N -{[(9H-флуорен9-ілметил)окси]карбоніл}-L-α-аспарагінат Суміш метил N-{[(9H-флуорен-9-ілметил)окси]карбоніл}-L-α-аспартил хлориду (отримано з J. Org. Chem. 1990, 55, 3068-3074 та J. Chem. Soc. Perkin Trans. 1 2001, 1673-1695) (221 г, 0,57 мол) та [2-аміно-5-(метилокси)феніл](4-хлорофеніл)метанону (спосіб отримання дивись для інтермедіату 7) (133 г, 0,5 мол) у CHCl3 (410 мл) перемішували при 60 °C протягом 1,5 год. перед охолодженням та концентрували під зниженим тиском та застосовували без подальшого 35 + очищення. РХ/МС: m/z 613 [M( Cl)+H] , час утр. = 3,89 хвил. Інтермедіат 7: [2-аміно-5-(метилокси)феніл](4-хлорофеніл)метанон 16 UA 105675 C2 5 10 15 20 25 30 35 40 45 До розчину 2-метил-6-(метилокси)-4H-3,1-бензоксазин-4-он (спосіб отримання дивись для інтермедіату 8) (40,0 г, 0,21 мол) у суміші толуолу (560 мл)/етеру (200 мл) при 0 °C додавали краплями розчин 4-хлорофенілмагній бромід (170 мл, 1M у Et2O, 0,17 мол). Реакційній суміші дозволяли нагріватися до КТ та перемішували протягом 1 год. перед гасінням 1N HCl. Водний шар екстрагували EtOAc (3 x) та комбіновану органіку промивали розсолом, сушили над Na2SO4, фільтрували та концентрували під зниженим тиском. Тоді сиру сполуку розчиняли в EtOH (400 мл) та додавали 6N HCl (160 мл). Реакційну суміш піддавали дефлегмації протягом 2 год. перед концентруванням під зниженим тиском. Отриману тверду речовину фільтрували та промивали двічі етером перед суспендуванням у EtOAc та нейтралізували 1N NaOH. Водний шар екстрагували EtOAc (3 x) та комбіновану органіку промивали розсолом, сушили над Na2SO4, фільтрували та концентрували під зниженим тиском. Заголовну сполуку отримували як жовту тверду речовину (39 г, 88 % вихід), яку застосовували без подальшого очищення. Інтермедіат 8: 2-метил-6-(метилокси)-4H-3,1-бензоксазин-4-он Розчин 5-метоксиантранілової кислоти (7,8 г, 46,5 ммол) піддавали дефлегмації в оцтовому ангідриді (60 мл) протягом 2 год., 15 перед охолодженням та концентрували під зниженим тиском. Тоді сирий залишок концентрували двічі в присутності толуолу перед фільтруванням та промивали етером, що дало заголовну сполуку (6,8 г, 77 % вихід) як бежеву тверду речовину; + РХ/МС: m/z 192 [M+H] , час утр. 1,69 хвил. Пособ отримання контрольної сполуки для застосування в біологічних аналізах Деталі експерименту способів A та B РХ-МС, як тут показано, є наступними: РХ/МС (спосіб A) проводили на колонці Supelcosil LCABZ+PLUS (3 мкм, 3,3 см x 4,6 мм ID), елюючи 0,1 % HCO2H та 0,01 M амоній ацетатом у воді (розчинник A), та 95 % ацетонітрилом та 0,05 % HCO2H у воді (розчинник B), застосовуючи наступний градієнт елюювання − 0-0,7 хвил. 0 %B, 0,7-4,2 хвил. 0→100 %B, 4,2-5,3 хвил. 100 %B, 5,3-5,5 хвил. 100→0 %B при швидкості потоку 3 мл/хвил… Мас-спектр (МС) регістрували на мас-спектрометрі Fisons VG Platform, застосовуючи позитивну електро-розпилювальну іонізацію [(ES+ve, що дає молекулярні іони [M+H]+ та [M+NH4]+] або негативну електро-розпилювальну іонізацію [(ES-ve, що дає молекулярний іон [M-H]-]. Аналітичні дані із цих приладів надано в наступному форматі: [M+H]+ або [M-H]-. РХ/МС (спосіб B) проводили на колонці Sunfire C18 (30 мм x 4,6 мм i.d. 3,5 мкм діаметр упакування) при 30 градусах по Цельсію, елюючи 0,1 об'ємн. % розчином трифлуороцтової кислоти у воді (розчинник A) та 0,1 об'ємн. % розчином трифлуороцтової кислоти в ацетонітрилі (розчинник B), застосовуючи наступний градієнт елюювання 0-0,1 хвил. 3 %B, 0,1-4,2 хвил. 3 – 100 % B, 4,2-4,8 хвил. 100 % B, 4,8-4,9 хвил. 100-3 %B, 4,9 – 5,0 хвил. 3 % B при швидкості потоку 3 мл/хвил. Визначений сигнал УФ був середньою величиною з довжини хвилі від 210 нм до 350 нм, та мас-спектр регістрували на мас-спектрометрі, застосовуючи позитивну електророзпилювальну іонізацію. Дані іонізації округляли до найближчого цілого чисельного значення. РХ/МСВР: Аналітичну ВЕРХ проводили на колонці Uptisphere-hsc (3 мкм 33 × 3 мм id), елюючи 0,01M амоній ацетатом у воді (розчинник A) та 100 % ацетонітрилом (розчинник B), застосовуючи наступний градієнт елюювання: 0-0,5 хвил. 5 % B, 0,5-3,75 хвил. 5100 % B, 3,754,5 100 % B, 4,5-5 1005 % B, 5-5,5 5 % B при швидкості потоку 1,3 мл/хвил… Мас-спектр (МС) регістрували на мікромас-спектрометрі LCT, застосовуючи позитивну електро-розпилювальну + іонізацію [ES+ve, що дає молекулярні іони MH ] або негативну електро-розпилювальну іонізацію [ES-ve, що дає молекулярні іони (M-H)-] способи. ТШХ (тонкошарова хроматографія) стосується застосування планшетів ТШХ від Merck, покритих гелем діоксиду силіцію 60 F254. 17 UA 105675 C2 Техніки хроматографії на діоксиді силіцію охоплюють наступне: автоматизовані способи (Flashmaster або Biotage SP4) або ручну хроматографію на попередньо впакованих патронах (SPE) або вручну впакованих флеш-колонок. Контрольна сполука A: 2-метил-6-(метилокси)-4H-3,1-бензоксазин-4-он 5 10 15 20 25 30 35 Розчин 5-метоксиантранілової кислоти (Lancaster) (41,8 г, 0,25 мол) піддавали дефлегмації в оцтовому ангідриді (230 мл) протягом 3,5 год. перед концентруванням під зниженим тиском. Тоді сиру сполуку концентрували двічі в присутності толуолу перед фільтруванням та промивали двічі етером для виходу заголовної сполуки (33,7 г, 71 % вихід) як a коричневої + твердої речовини; РХ/МС (спосіб A): m/z 192 [M+H] , час утр. 1,69 хвил. Контрольна сполука B: [2-аміно-5-(метилокси)феніл](4-хлорофеніл)метанон До розчину 2-метил-6-(метилокси)-4H-3,1-бензоксазин-4-ону (спосіб отримання дивись в розділі для контрольної сполуки A) (40,0 г, 0,21 мол) у суміші (760 мл) толуолу/етеру (2/1) при 0 °C краплями додавали розчину 4-хлорофенілмагній броміду (170 мл, 1M у Et2O, 0,17 мол). Реакційній суміші дозволяли нагріватися до кімнатної температури та перемішували протягом 1 год. перед гасінням 1N HCl (200 мл). Водний шар екстрагували EtOAc (3 × 150 мл) та комбіновану органіку промивали розсолом (100 мл), сушили над Na 2SO4, фільтрували та концентрували під зниженим тиском. Тоді сиру сполуку розчиняли в EtOH (400 мл) та додавали 6N HCl (160 мл). Реакційну суміш піддавали дефлегмації протягом 2 год. перед концентруванням до одної третини об'єму. Отриману тверду речовину фільтрували та промивали двічі етером перед суспендуванням у EtOAc та нейтралізували 1N NaOH. Водний шар екстрагували EtOAc (3 × 150 мл) та комбіновану органіку промивали розсолом (150 мл), сушили над Na2SO4, фільтрували та концентрували під зниженим тиском. Заголовну сполуку отримували як жовту тверду речовину (39 г, 88 % вихід); РХ/МС (спосіб A): m/z 262 [M+H]+, час утр. 2,57 хвил. 1 2 Контрольна сполука C: Метил N -[2-[(4-хлорофеніл)карбоніл]-4-(метилокси)феніл]-N -{[(9Hфлуорен-9-ілметил)окси]карбоніл}-L-α-аспарагінат Метил N-{[(9H-флуорен-9-ілметил)окси]карбоніл}-L-α-аспартил хлорид (Int. J. Peptide Protein Res. 1992, 40, 13-18) (93 г, 0,24 мол) розчиняли в CHCl3 (270 мл) та додавали [2-аміно-5(метилокси)феніл](4-хлорофеніл)метанон (спосіб отримання дивись в розділі для контрольної сполуки B) (53 г, 0,2 мол). Отриману суміш перемішували при 60 °C протягом 1 год. перед охолодженням та концентрували до об'єму 60 %. Додавали етер при 0 °C, та отриманий осад відфільтровували та відкидали. Фільтрат концентрували під зниженим тиском та застосовували без подальшого очищення. Контрольна сполука D: Метил [(3S)-5-(4-хлорофеніл)-7-(метилокси)-2-оксо-2,3-дигідро-1H1,4-бензодіазепін-3-іл]ацетат 18 UA 105675 C2 1 5 10 15 20 25 30 2 До розчину метил N -[2-[(4-хлорофеніл)карбоніл]-4-(метилокси)феніл]-N -{[(9H-флуорен-9ілметил)окси]карбоніл}-L-α-аспарагінату (спосіб отримання дивись в розділі для контрольної сполуки C) (припустимо 0,2 мол) у ДХМ (500 мл) додавали Et 3N (500 мл, 3,65 мол), та отриману суміш піддавали дефлегмації протягом 24 год. перед концентруванням. Отриманий сирий амін розчиняли в 1,2-DCE (1,5 L) та додавали обережно AcOH (104 мл, 1,8 мол). Тоді реакційну суміш перемішували при 60 °C протягом 2 год. перед концентруванням у вакуумі та розчиняли в ДХМ. Органічний шар промивали 1N HCl, та водний шар екстрагували ДХМ (x3). Комбіновані органічні шари промивали двічі водою та розсолом, сушили над Na 2SO4, фільтрували та концентрували під зниженим тиском. Тверду сиру речовину перекристалізовували в MeCN, що дало заголовну сполуку (51 г) як бліду жовту тверду речовину. Фільтрат концентрували та перекристалізовували в MeCN, що дає ще 10 г f бажаного продукту R f=0,34 (ДХМ/MeOH: 95/5). + 35 МСВР (M+H) розраховано для C19H18 ClN2O4 373,0955; знайдено 373,0957. Контрольна сполука E: Метил [(3S)-5-(4-хлорофеніл)-7-(метилокси)-2-тіоксо-2,3-дигідро-1H1,4-бензодіазепін-3-іл]ацетат Суспензію P4S10 (36,1 г, 81,1 ммол) та Na2CO3 (8,6 г, 81,1 ммол) у 1,2-DCE (700 мл) при кімнатній температурі перемішували протягом 2 год. перед додаванням метил [(3S)-5-(4хлорофеніл)-7-(метилокси)-2-оксо-2,3-дигідро-1H-1,4-бензодіазепін-3-іл]ацетату (спосіб отримання дивись в розділі для контрольної сполуки D) (16,8 г, 45,1 ммол). Отриману суміш перемішували при 70 °C протягом 2 год. перед охолодженням та фільтрували. Тверду речовину промивали двічі ДХМ, та фільтрат промивали насич. NaHCO 3 та розсолом. Органічний шар сушили над Na2SO4, фільтрували та концентрували під зниженим тиском. Сирий продукт очищали флеш-хроматографією на гелі діоксиду силіцію (ДХМ/MeOH: 99/1), що дало заголовну сполуку (17,2 г, 98 % вихід) як жовтувату тверду речовину. РХ/МС (спосіб A): m/z 389 35 [M( Cl)+H]+, час утр. 2,64 хвил + 35 МСВР (M+H) розраховано для C19H18 ClN2O3S 389,0727; знайдено 389,0714. Контрольна сполука F: Метил [(3S)-2-[2-ацетилгідразино]-5-(4-хлорофеніл)-7-(метилокси)3H-1,4-бензодіазепін-3-іл]ацетат До суспензії метил [(3S)-5-(4-хлорофеніл)-7-(метилокси)-2-тіоксо-2,3-дигідро-1H-1,4бензодіазепін-3-іл]ацетату (спосіб отримання дивись в розділі для контрольної сполуки E (9,0 г, 23,2 ммол) у ТГФ (300 мл) при 0 °C краплями додавали гідразин моногідрат (3,4 мл, 69,6 ммол). 19 UA 105675 C2 5 10 15 20 25 30 Реакційну суміш перемішували протягом 5 год. між 5 °C та 15 °C перед охолодженням до 0 °C. Тоді повільно додавали Et3N (9,7 мл, 69,6 ммол) та додавали краплями ацетил хлорид (7,95 мл, 69,6 ммол). Тоді суміші дозволяли нагріватися до кімнатної температури протягом 16 год. перед концентруванням під зниженим тиском. Сирий продукт розчиняли в ДХМ та промивали водою. Органічний шар сушили над Na2SO4, фільтрували та концентрували у вакуумі, що дало сиру заголовну сполуку (9,7 г, 98 % вихід), яку застосовували без подальшого очищення. R f=0,49 (ДХМ/MeOH: 90/10). Контрольна сполука G: Метил [(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H[1,2,4]триазоло[4,3-a][1,4]бензодіазепін-4-іл]ацетат Сирий метил [(3S)-2-[(1Z)-2-ацетилгідразино]-5-(4-хлорофеніл)-7-(метилокси)-3H-1,4бензодіазепін-3-іл]ацетат (спосіб отримання дивись в розділі для контрольної сполуки F) (припустимо 9,7 г) суспендували в ТГФ (100 мл) та додавали AcOH (60 мл) при кімнатній температурі. Реакційну суміш перемішували при цій температурі протягом 2 діб перед концентруванням під зниженим тиском. Тверду сиру речовину розтирали до порошку в i-Pr2O та фільтрували, що дало заголовну сполуку (8,7 г, 91 % за 3 етапи) як не зовсім білу тверду речовину. + МСВР (M+H) розраховано для C21H20ClN4O3 411,1229; знайдено 411,1245. Контрольна сполука H: [(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3a][1,4]бензодіазепін-4-іл]оцтова кислота До розчину метил [(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3a][1,4]бензодіазепін-4-іл]ацетату (спосіб отримання дивись в розділі для контрольної сполуки G) (7,4 г, 18,1 ммол) у ТГФ (130 мл) при кімнатній температурі додавали 1N NaOH (36,2 мл, 36,2 ммол). Реакційну суміш перемішували при цій температурі протягом 5 год. перед гасінням 1N HCl (36,2 мл) та концентрували у вакуумі. Тоді додавали воду, та водний шар екстрагували ДХМ (x3) і комбіновані органічні шари сушили над Na2SO4, фільтрували та концентрували під зниженим тиском, що дало заголовну сполуку (7 г, 98 % вихід) як бліду жовту тверду речовину. Контрольна сполука I: 1,1-диметилетил [5-({[(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)4H-[1,2,4]триазоло[4,3-a][1,4]бензодіазепін-4-іл]ацетил}аміно)пентил]карбамат Суміш [(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3a][1,4]бензодіазепін-4-іл]оцтової кислоти (спосіб отримання дивись в розділі для контрольної сполуки H) (1,0 г, 2,5 ммол), HATU (1,9 г, 5 ммол) та DIPEA (0,88 мл, 5 ммол) перемішували 20 UA 105675 C2 5 10 15 20 25 30 35 протягом 80 хвил. при кімнатній температурі, до цього додавали 1,1-диметилетил (4амінобутил)карбамат (1,05 мл, 5,0 ммол, від Aldrich). Реакційну суміш перемішували при кімнатній температурі протягом 2 год. перед концентруванням. Залишок переносили в дихлорметан та промивали 1N HCl. Водний шар екстрагували двічі дихлорметаном. Органічний шар промивали 1N натрій гідроксидом, а потім − насиченим розчином натрій хлориду, сушили над натрій сульфатом та концентрували. Залишок очищали флеш-хроматографією на діоксиді силіцію, застосовуючи дихлорметан/метанол 95/5, що дало заголовну сполуку як жовту тверду речовину (1,2 г). РХ/МС (спосіб A): час утр. = 3,04 хвил. Контрольна сполука J: N-(5-амінопентил)-2-[(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)4H-[1,2,4]триазоло[4,3-a][1,4]бензодіазепін-4-іл]ацетамід трифлуороацетат .ТФОК До розчину 1,1-диметилетил [5-({[(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H[1,2,4]триазоло[4,3-a][1,4]бензодіазепін-4-іл]ацетил}аміно)пентил]карбамату (спосіб отримання дивись в розділі для контрольної сполуки H) (0,2 г, 0,34 ммол) у дихлорметані (3 мл) краплями додавали трифлуороцтову кислоту (0,053 мл, 0,68 ммол) при 0 °C. Реакційну суміш перемішували протягом 3 год. від 0 °C до кімнатної температури. Реакційну суміш концентрували сухого стану, що дало заголовну сполуку як a гігроскопічну жовту олію (200 мг) РХ/МС (спосіб A): час утр. = 2,33 хвил. + МСВР (M+H) розраховано для C25H29ClN6O2 481,2119; знайдено 481,2162. Контрольна сполука K: Суміш 5- та 6- ізомерів Alexa Fluor 488-N-(5-амінопентил)-2-[(4S)-6-(4хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-a][1,4]бензодіазепін-4-іл]ацетаміду N-(5-амінопентил)-2-[(4S)-6-(4-хлорофеніл)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3a][1,4]бензодіазепін-4-іл]ацетамід трифлуороацетат (спосіб отримання дивись в розділі для контрольної сполуки J) (7,65 мг, 0,013 ммол) розчиняли в N, N-диметилформаміді (ДМФ) (300 мкл) та додавали до Alexa Fluor 488 сукцинімідил-естеру карбонової кислоти (5 мг, 7,77 мкмол, суміш 5 та 6 ізомерів від Invitrogen, продукт номер A-20100) у пробірку в центрифузі Eppendorf. Додавали основу Хюніга (7,0 мкл, 0,040 ммол) та суміш перемішували виорюванням протягом ночі. Через 18 год. реакційну суміш випаровували до сухого стану та залишок розчиняли в ДМСО/воді (50 %, 6,0. Ці дані демонструють, що тестоване у вищевказаному аналізі за прикладом 1 інгібувало продукування ключового запального медіатору TNFα. Це означає, що така сполука має сильний протизапальний профіль, який є придатним для реалізації як клінічно переважний при запальних розладах. 22 UA 105675 C2 5 10 15 20 Модель ендотоксемії мишей in vivo Високі дози ендотоксину (бактеріального ліпополісахариду), застосовані до тварин, створювали синдром глибокого шоку, охоплюючи сильний запальний відгук, дерегуляцію серцево-судинної функції, поліорганну недостатність та, зрештою, смертність. Ця картина відгуку дуже подібна до сепсису людини та септичного шоку, де відгук організму на важливу бактеріальну інфекцію може бути подібним загрозі життю. Для тестування сполуки формули (I) та її фармацевтично прийнятних солей групі з восьми самців мишей Balb/c інтраперитонеальною ін'єкцією надавали летальну дозу 15 мг/кг LPS. Через дев'яносто хвилин тварині інтраперитонеально вводили дозу наповнювачу (20 % циклодекстрин 1 % етанол в апірогенній воді) або сполуки (10 мг/кг). Виживання тварин спостерігали протягом 4 діб. Чисельність тварин, яки вижили протягом 4 діб (підсумовано результати багатьох експериментів) Наповнювач 4/66 (6 %) Приклад 1 24/56 (52 %) Ці дані показали, що сполука прикладу 1, тестована у вищенаведеній моделі, дала важливий ефект виживання тварин після внутрішньовенного застосування. Це означає, що сполука формули (I) має потенціал для глибокої дії на запальні відгуки в людей. Усі публікації, охоплюючи, але без обмеження, патенти та заявки на патенти, цитовані в цьому описі винаходу, уведено тут посиланнями, до того ж кожна окрема публікація була конкретно окремо потрібною для уведення тут посиланням, хоча усе тут повністю викладено. ФОРМУЛА ВИНАХОДУ 25 1. Сполука формули (І), яка являє собою 2-[(4S)-6-(4-хлорофеніл)-1-метил-8(метилокси)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодіазепін-4-іл]-N-етилацетамід N N N H N N O O Cl 30 , (І) або її сіль. 2. Сполука формули (І) за пунктом 1, яка являє собою 2-[(4S)-6-(4-хлорофеніл)-1-метил8-(метилокси)-4Н-[1,2,4]триазоло[4,3-а][1,4]бензодіазепін-4-іл]-N-етилацетамід N N N H N N O O Cl , (І) або її фармацевтично прийнятна сіль. 23 UA 105675 C2 3. Сполука формули (І) за пунктом 1, яка являє собою 2-[(4S)-6-(4-хлорофеніл)-1-метил8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодіазепін-4-іл]-N-етилацетамід N N N O 5 10 15 20 H N N O Cl (І). 4. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль за п. 2 та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів. 5. Фармацевтична композиція, яка містить сполуку формули (І) за п. 3 та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів. 6. Комбінований фармацевтичний продукт, який містить сполуку формули (І) або її фармацевтично прийнятну сіль за п. 2 або сполуку формули (І) за п. 3 разом з одним або більше іншими терапевтично активними засобами. 7. Спосіб лікування хвороби або стану, для яких показано інгібітор бромодомену, за яким суб'єкту, який цього потребує, вводять терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі за п. 2 або сполуки формули (І) за п. 3. 8. Спосіб лікування хвороби або стану за п. 7, де хвороба або стан являє собою хронічний аутоімунний та/або запальний стан. 9. Спосіб лікування хвороби або стану за п. 7, де хвороба або стан являє собою рак. 10. Спосіб лікування хвороби або стану за п. 9, де рак є вибраним з гематологічного, епітеліального раку, включаючи карциноми легень, молочних залоз та товстого кишечнику, серединні карциноми, мезенхімальні, печінкові, ниркові та неврологічні пухлини. 11. Спосіб лікування хвороби або стану за п. 10, де гематологічний рак являє собою лейкемію. 12. Спосіб лікування хвороби або стану за будь-яким з пп. 7-11, де суб'єкт являє собою людину. 25 Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzodiazepine bromodomain inhibitor
Автори англійськоюGosmini, Romain Luc Marie, Mirguet, Olivier
Автори російськоюГосмини Ромейн Люк Мари, Миргует Оливер
МПК / Мітки
МПК: A61P 35/00, C07D 487/04, A61K 31/55, A61P 43/00
Мітки: інгібітор, бромодомену, бензодіазепіновий
Код посилання
<a href="https://ua.patents.su/26-105675-benzodiazepinovijj-ingibitor-bromodomenu.html" target="_blank" rel="follow" title="База патентів України">Бензодіазепіновий інгібітор бромодомену</a>
Попередній патент: Складений контейнер
Наступний патент: Пристрій для обробки нечіткої інформації
Випадковий патент: Лабораторний стенд для дослідження селективності релейного захисту












