Спосіб підвищення стабільності до хімічного розкладання фармацевтичної композиції та застосування стабілізуючого агента у фармацевтичній коипозиції
Номер патенту: 115544
Опубліковано: 27.11.2017
Автори: Ністе Патрік Хуберт Дж., Ванхутт Філіп Марсель С., Брукс Руді Лорент Марія, Копманс Алекс Герман, Фільєрс Вальтер Фердінанд Марія, Лейс Каріна
Формула / Реферат
1. Спосіб підвищення стабільності до хімічного розкладання фармацевтичної композиції, що містить як активний інгредієнт сполуку формули (І):
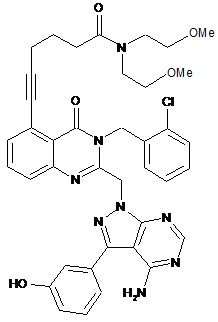 , (I)
, (I)
яка являє собою 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-хлоробензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід або його фармацевтично прийнятну сіль,
який відрізняється тим, що включає включення до вказаної композиції стабілізуючої кількості подрібненого стабілізуючого агента, вибраного з металевих солей стеаринової кислоти, таких як стеарат магнію, і металевих солей стеарилфумарату.
2. Спосіб за п. 1, який відрізняється тим, що сполука формули (І) знаходиться в формі її вільної основи.
3. Спосіб за п. 2, який відрізняється тим, що сполука формули (І) знаходиться в твердому стані та кристалічній безводній формі.
4. Спосіб за п. 3, який відрізняється тим, що сполука формули (І) знаходиться в твердому стані, кристалічній формі та має порошкову рентгенівську дифрактограму, яка містить один, два, три або чотири піки, вибрані з (±0,2) 17,6, 18,4, 22,5 і 24,2 градуса 2-тета.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що вказаний стабілізуючий агент являє собою металеву сіль стеаринової кислоти.
6. Спосіб за п. 5, який відрізняється тим, що металева сіль стеоринової кислоти являє собою стеарат магнію.
7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що активний інгредієнт мікронізований.
8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що вказана лактоза являє собою моногідрат a-лактози.
9. Застосування подрібненого стабілізуючого агента, вибраного з металевих солей стеаринової кислоти і металевих солей стеарилфумарату, в фармацевтичній композиції, що містить, як активний інгрідієнт, сполуку формули (І):
 , (I)
, (I)
яка являє собою 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-хлоробензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід або його фармацевтично прийнятну сіль, для підвищення стабільності сполуки формули (І) до хімічного розкладання.
10. Застосування за п. 9, яке відрізняється тим, що вказана сполука формули (І) знаходиться в формі її вільної основи.
11. Застосування за п. 10, яке відрізняється тим, що вказана сполука формули (І) знаходиться в твердому стані, кристалічній безводній формі.
12. Застосування за п. 10, яке відрізняється тим, що вказана сполука формули (І) знаходиться в твердому стані, кристалічній формі та має порошкову рентгенівську дифрактограму, яка містить один, два, три або чотири піки, вибрані з (±0,2) 17,6, 18,4, 22,5 і 24,2 градуса 2-тета.
13. Застосування за будь-яким з пп. 9-12, яке відрізняється тим, що вказаний стабілізуючий агент являє собою металеву сіль стеаринової кислоти.
14. Застосування за п. 13, яке відрізняється тим, що вказана металева сіль стеоринової кислоти являє собою стеарат магнію.
15. Застосування за будь-яким з пп. 9-14, яке відрізняється тим, що вказана лактоза являє собою моногідрат a-лактози.
Текст
Реферат: Запропонована суха порошкова фармацевтична композиція для інгаляції, що містить: (і) 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2-хлорбензил)-4оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід або його фармацевтично прийнятну сіль, включаючи всі його стереоізомери, таутомери і ізотопні похідні і його сольвати, в подрібненій формі як активний інгредієнт; (іі) подрібнену лактозу як носій; і (ііі) подрібнений стабілізуючий агент, вибраний з металевих солей стеаринової кислоти, таких як стеарат магнію, і металевих солей стеарилфумарату. UA 115544 C2 (12) UA 115544 C2 UA 115544 C2 5 10 15 20 25 30 35 40 45 50 Галузь техніки У даному винаході запропоновані нові сухі порошкові фармацевтичні композиції для інгаляцій, що містять сполуки, які інгібують фосфоінозитид-3-кінази (РІЗ-кінази), і їх застосування в терапії, особливо при лікуванні запальних захворювань, таких як ХОЗЛ (хронічна обструктивна хвороба легенів) і астма. Рівень техніки Ліпідкінази каталізують фосфорилування ліпідів з утворенням сполук, що беруть участь в регуляції широкого кола фізіологічних процесів, включаючи клітинну міграцію і адгезію. РІЗкінази являють собою пов'язані з мембранами білки, і належать до класу ферментів, які каталізують фосфорилування ліпідів, які самі пов'язані з клітинними мембранами. Ізоцим РІЗкінази дельта (РІЗ-киназа й) являє собою одну з чотирьох ізоформ типу І РІЗ-кінази, відповідальну за створення різних 3'-фосфорилованих фосфоінозитидів, які опосередковують клітинні сигнальні системи і беруть участь в запаленнях, сигнальних системах факторів росту, злоякісних перетвореннях і в імунітеті [See Review by Rameh, L.E. i Cantley, L.С.J. Biol. Chem., 1999, 274: 8347-8350]. Участь РІЗ-кінази в контролюванні запалень була підтверджена на деяких моделях з використанням інгібіторів рап-РІЗ-кінази, таких як LY-294002 і вортманін [ho. K. et al., J Pharmacol. Exp. Ther., 2007, 321:1-8]. Нещодавні дослідження проводилися з використанням або селективних інгібіторів РІЗ-кінази або з використанням нокаутних мишей, в яких була відсутня специфічна ізоформа ферменту. Вказані дослідження продемонстрували роль шляхів, що контролюються ферментами РІЗ-кіпази в запальних процесах. Було виявлено, що РІЗ-киназа δ с селективним інгібітором ІС-87114, який інгібує гіперчутливість дихальних шляхів, виділення IgE, експресію прозапальних цитокінів, накопичення запальних клітин в легенях і судинну проникність у овальбумін-сенсибілізованих, овальбумін-іпдукованих мишей [Lee, K.S. et al., J. Allergy Biophys. Res. Commun., 2003, 308:764-9]. Ізоформа РІЗ-кінази δ активується інсуліном і іншими факторами росту, а також сигнальною системою білка, сполученого з G-білком, і запальними цитокінами. Недавно повідомлялося, що подвійний δ/γ інгібітор РІЗ-кінази TG100115 інгібує легеневу еозинофілію і накопичення інтерлейкіну-13, а також муцину, і гіперчутливість дихальних шляхів на мишачих моделях, при введенні у вигляді аерозолів. Ті ж автори повідомляють також, що вказана сполука здатна інгібувати легеневу нейтрофілію, викликану або LPS (ліпополісахаридами), або тютюнопалінням [Doukas, J. et al., J. Pharmacol. Exp. Ther, 2009, 328:758-765]. Оскільки вона також активується оксидативним стресом, мабуть, Ізоформа РІЗ-кінази δ може служити мішенню для терапевтичних втручань у вказані захворювання, при яких спостерігаються високі рівні оксидативного стресу. Нижчележачі медіатори шляху передачі сигналу РІЗ-кінази включають Akt (серин/треонін-протеїнкіназа) і мішень рапаміцину в клітинах ссавців, фермент mTOR. Останні роботи дозволяють передбачити, що активування РІЗ-кінази δ, що приводить до фосфорилування Akt, здатне спричинити стан стійкості до кортикостероїдів в інших випадках кортикостероїд-чутливих клітин [То, Y. et al., Am. J. Respir. Crit. Care Med., 2010, 182:897-904]. Вказані спостереження привели до гіпотези, що вказаний сигнальний каскад може бути одним з механізмів, відповідальних за кортикостероїдну несприйнятливість при запаленнях, що спостерігаються у легеневих пацієнтів, страждаючих ХОЗЛ, а також у астматиків, які палять, тим самим, піддаючи свої легені підвищеному оксидативному стресу. Дійсно, передбачають, що теофілін, сполука, яку використовують при лікуванні як ХОЗЛ, так і астми, змінює на зворотне стероїдну несприйнятливість за рахунок механізму, що включає взаємодію з сигнальними шляхами, що контролюються РІЗ-кіназою δ [То, Y. et al., Am. J. Respir. Crit. Care Med., 2010, 182:897-904]. У міжнародній патентній заявці WO2011/048111 розкритий ряд сполук, які інгібують РІЗкінази, особливо РІЗ-киназу δ, включаючи 6-(2-((4-аміно-3-(3-гiдpoкcифeнiл)-lH-шpaзoлo[3,4d]пipимiдин-l-iл)мeтил)-3-(2-xлopбeнзил)-4-оксо-3,4-дигідрохіназолін-5-іл)-К,М-біс(2метоксіетил)гекс-5-иламід в формі вільної основи, який розкритий в описі як приклад 83. Вказана сполука розкрита 1 UA 115544 C2 5 10 15 20 25 30 35 40 45 Вищезгадану сполуку у вказаному описі називають "сполукою формули (І)" або "вільною основою сполуки формули (І)". До появи більш раннього винаходу заявників (WO2011/048111), відомі до того часу інгібітори РІЗ-кінази, призначалися для перорального введення. Однак небажаний наслідок такого підходу полягає в тому, що немішеневі тканини організму, особливо печінка і кишечник, мабуть, зазнають впливу фармакологічно активних концентрацій вказаного лікарського засобу. Альтернативна стратегія полягає в тому, щоб створити такі способи лікування, при яких вказаний лікарський засіб вводився безпосередньо до запаленого органу за допомогою місцевої терапії. У випадку контрольованого запалення (або створення іншого терапевтичного ефекту) в легенях цього можна досягнути шляхом інгаляції вказаного лікарського засобу, яка володіє перевагою збереження вказаного лікарського засобу переважно в легенях, тим самим, мінімізуючи ризик системної токсичності. Для досягнення тривалої дії можна використати відповідну лікарську форму, яка створює "резервуар" активного лікарського засобу. Сполука формули (І) була, відповідно, розкрита як сполука, яку можна використати для місцевого введення в легені (див. WO2011/048111). Лікарський засіб для місцевого введення в легені шляхом інгаляції, який повинний забезпечувати афінність відносно органу-мішені і тривалу ефективність, також повинен бути сформульований таким чином, щоб забезпечити заздалегідь визначену дозу вказаного лікарського засобу, який, в свою чергу, повинен володіти відтворюваними і прогнозованими властивостями. Забезпечення прийнятної і хімічної і фізичної стабільності вказаного відтворюваного лікарського засобу в лікарській формі є ключовою задачею при створенні фармацевтичних продуктів для всіх типів фармацевтичних дозованих форм. Для використання як інгаляції існують 3 основні лікарські форми - сухий порошковий інгалятор (DPI), дозуючий інгалятор (MDI) і небулайзер на водній основі (ручний або настільний). Однак більшу частину пристроїв для інгаляції, що є в продажу, складають порошкові інгалятори (DPI) і, таким чином, забезпечують загальноприйнятий спосіб доставки лікарських засобів шляхом інгаляції. Існує множина комерційних DPI продуктів, таких як фліксотид (флутиказонпропіонат), адваїр (флутиказонпропіонат/салметерол), симбікорт (будезонід/формотерол), пулмікорт (будезонід), серевент (салметерол) і форадил (формотерол). Сухі порошкові лікарські форми для інгаляцій звичайно складаються з суміші частинок лікарського засобу (розміром менше 10 мікрон і звичайно менше 5 мікрон) з розріджувачем, звичайно лактозою. Оскільки звичайні дози, що вимагаються для лікування шляхом інгаляцій, знаходяться в межах мікрограмів, розріджувач полегшує обробку і розподіл фармацевтичних засобів в індивідуальні дозовані форми, наприклад, в капсули або блістери або полегшує процес відмірювання певних доз з об'ємного контейнера, для подальшого введення пацієнту. Тому, звичайно, маса розріджувача (яким частіше за все є лактоза) може бути більше маси речовини вказаного лікарського засобу. У такому оточенні можна отримати прийнятні лікарські форми деяких продуктів простим змішуванням вказаного лікарського засобу з лактозою. Інші продукти можуть зажадати додання додаткових ексципієнтів або інших стадій обробки для того, щоб вказаний продукт відповідав вимогам контролюючих органів. Одним з таких додаткових ексципієнтів є стеарат магнію, який, як відомо, використовують для поліпшення деяких властивостей лікарських форм, що містять його. Так, в US7186401 В 2 2 UA 115544 C2 5 10 15 20 25 30 35 40 45 50 55 (Jagotec AG et al.) розкрито, що додання стеарату магнію до сухих порошкових лікарських форм для інгаляцій підвищує вологостійкість вказаних лікарських форм і дозволяє зберігати дози дуже дрібних частинок або фракції дуже дрібних частинок у вологих умовах. У WOOO/53157 (Chiesi) розкритий стеарат магнію як лубрикант, призначений для використання в сухих порошкових лікарських формах для інгаляції, який ефективний у разі збільшення дози дуже дрібних частинок деяких лікарських засобів. У US2006/0239932 (Monteith) розкрита тверда фармацевтична лікарська форма для інгаляцій, що включає деякі речовини активних інгредієнтів, які схильні до хімічної взаємодії з лактозою, лактозу і стеарат магнію. У вказаному документі розкрито, що стеарат магнію інгібує розкладання активного інгредієнта, що викликається лактозою , приблизно за рахунок реакції Майара, яка включає взаємодію аміногрупи активного інгредієнта з лактозою. У US2012/0082727 (Chiesi) розкритий спосіб інгібування або зменшення хімічного розкладання активного інгредієнта, що містить схильну до гідролізу групу, вибрану з групи, що складається з карбонатної групи, карбаматної групи і складноефірної групи, в порошковій лікарській формі для інгаляцій, що включає частинки носія (такого, як частинки лактози), причому вказаний спосіб включає покриття щонайменше частини поверхні вказаних частинок носія стеаратом магнію. Таким чином, зберігається необхідність в створенні лікарських форм селективних інгібіторів РІЗ-кінази для застосування при лікуванні інгаляціями, які будуть володіти потенціалом для забезпечення терапевтичної ефективності при астмі, ХОЗЛ і інших запальних захворюваннях легенів. Зокрема, залишається мета створення лікарської форми вказаної сполуки формули (І), яка буде володіти відповідною фізичною і хімічною стабільністю і іншими властивостями, необхідними для лікування шляхом інгаляцій. Суть винаходу У першому аспекті в даному винаході запропонована суха порошкова фармацевтична лікарська форма для інгаляцій, що включає: (і) 6-(2-((4-аміно-3-(3-гідроксифеніл)1Н-піразоло[3,4-а]піримідин-1 -іл)метил)-3-(2хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід (сполука формули (І)) або її фармацевтичне прийнятну сіль, включаючи всі її стереоізомери, таутомери і ізотопні похідні і сольвати в подрібненій формі як активний інгредієнт; (іі) подрібнену лактозу як носій; і (ііі) подрібнений стабілізуючий агент, вибраний з металевих солей стеаринової кислоти (таких як стеарат магнію) і металевих солей стеарилфумарату. Така лікарська форма тут і далі в даному описі називається "лікарською формою даного винаходу". Як роз'яснюється в розділі "Приклади", лікарські форми даного винаходу, мабуть, володіють хорошою фізичною стабільністю (за даними порошкової дифракції рентгенівських променів (XPDR) і 14 аналізів) і хорошою хімічною стабільністю (за даними ВЕРХ аналізів). Не обмежуючись якою-небудь теорією, з відкриттів авторів винаходу випливає, що алкінна група сполук формули (І) схильна до каталізованого металом оксидативного руйнування, що включає гідратування алкіну. З відкриттів авторів даного винаходу також випливає, що піримідинонове кільце сполуки формули (І) схильне до гідролітичного розщеплення. Експерименти, проведені авторами винаходу, встановили, що лікарські форми даного винаходу, що містять лактозу і металеву сіль стеаринової кислоти, таку як стеарат магнію, володіють більш високою хімічною стабільністю, ніж відповідні лікарські форми, які не містять металевих солей стеаринової кислоти, таких як стеарат магнію. Авторам даного винаходу не відомо більш ранніх повідомлень про те, що металеві солі стеаринової кислоти, такі як стеарат магнію, можуть діяти як агенти, що захищають від хімічного розкладання сполук, що містять алкін (особливо відносно каталізованого металом оксидативного руйнування, що включає гідратування алкіну) в сухих порошкових лікарських формах для інгаляцій. Авторам даного винаходу також не відомо більш ранніх повідомлень про те, що металеві солі стеаринової кислоти, такі як стеарат магнію, можуть діяти як захисний агент проти гідролітичного розщеплення лікарських засобів, що містять піримідинонове кільце. Автори винаходу екстраполювали вказані відкриття, що стосуються металевих солей стеаринової кислоти, на металеві солі стеарилфумарату. Короткий опис фігур На фіг. 1 показана картина порошкової дифракції рентгенівських променів, отримана для зразка сполуки формули (І) в безводній твердій кристалічній формі. На фіг. 2 показаний 14 спектр зразка, що складається з суміші сполуки формули (І) в безводній формі (мікронізованої) з Lactohale200® і стеаратом магнію. 3 UA 115544 C2 5 10 15 20 25 30 35 40 45 50 55 60 На фіг. З показана картина порошкової дифракції рентгенівських променів, отримана для зразка, що складається з суміші сполуки формули (І) в безводній формі (мікронізованій) з Lactohale200® і стеаратом магнію. Докладний опис переважного варіанту даного винаходу Сполука формули (І) як активний інгредієнт Сполука формули (І) являє собою подвійний інгібітор РІЗК дельта/РІЗК гамма, де термін інгібітор, як використано в даному описі, стосується сполуки, яке знижує (наприклад, щонайменше на 50%) або виключає біологічну активність білка-мішені, наприклад, РІЗК дельта ізоциму, в in vitro ферментному аналізі. Термін інгібітор дельта/гамма, як використано в даному описі, стосується того факту, що вказана сполука інгібує, до деякої міри, обидві ферментні ізоформи, хоча не обов'язково до однієї і тієї ж міри. Сполука формули (І) є активною в клітинних системах скрикування і, тим самим, демонструє, що володіє відповідними властивостями для проникнення в клітини і, тим самим, викликає внутрішньоклітинні фармакологічні ефекти. Загальні способи синтезу вказаної сполуки формули (І) розкриті в WO2011/048111, зміст якого включений в даний опис за допомогою посилання у всій повноті, і можна використати спосіб, аналогічний способу прикладу. Придатним є, якщо сполука формули (І) захищена від світла під час і після синтезу, шляхом використання, наприклад, лабораторного посуду жовтого кольору або світлонепроникної упаковки (наприклад, упаковки з фольги). Суха порошкова фармацевтична лікарська форма даного винаходу включає сполуку формули (І) як активний інгредієнт в терапевтичній і ефективній кількості. Терапевтичну і ефективну кількість сполуки формули (І) визначають як кількість, достатню для даної дози або множини розділених доз, для досягнення терапевтичного і значущого ефекту у суб'єкта, коли її вводять вказаному суб'єкту згідно зі схемою лікування. В одному з варіантів здійснення суха порошкова фармацевтична лікарська форма включає від близько 0,004% мас. до близько 50% мас. сполуки формули (І) з розрахунку на масу вказаної сухої порошкової фармацевтичної лікарської форми і з розрахунку на масу сполуки формули (І) в формі вільної основи; наприклад, від близько 0,02% мас. до близько 50% мас., від близько 0,02% мас. до близько 25% мас., від близько 0,02% мас. до близько 20% мас., або від близько 0,02% мас. до близько 15% мас. Переважно, суха порошкова фармацевтична лікарська форма включає від близько 0,1% мас. до близько 20% мас., наприклад, від близько 0,1% мас. до близько 5% мас. сполуки формули (І) з розрахунку на масу вказаної сухої порошкової фармацевтичної лікарської форми і з розрахунку на масу сполуки формули (І) в формі вільної основи. Фармацевтична лікарська форма даного винаходу може містити сполуку формули (І) як єдиний активний інгредієнт. Однак вказана фармацевтична лікарська форма може містити додаткові активні інгредієнти. Фармацевтичну лікарську форму можна також вводити спільно з одним або більше іншими активними інгредієнтами (або однією або більше фармацевтичними композиціями, що містять один або більше активних інгредієнтів). Приклади інших активних інгредієнтів перераховані нижче. Сполуку формули (І) отримують в подрібненій формі, такій, яка зручна для сухої порошкової інгаляції. Фармацевтична композиція даного винаходу звичайно може містити частинки лікарського засобу із середнім об'ємним діаметром (D50) від близько 0,5 мкм до близько 10 мкм, особливо від близько 1 мкм до близько 5 мкм. Придатним способом визначення розміру частинок є лазерна дифракція, наприклад, з використанням приладу Mastersizer 2000S від Malvern Instruments. Прилади доступні також від Sympatec. Для визначення розподілу частинок по розмірах середнє значення D50 являє собою розмір в мікронах, що розділяє розподіл частинок по розмірах на значення вище і нижче половини. Основним результатом, що отримується за допомогою лазерної дифракції, є розподіл по об'ємах, тому D50 є актуальним, і Dv50 (середнє для розподілу по об'ємах) і, як використано в даному описі, стосується розподілу частинок по розмірах, отриманого з використанням лазерної дифракції. Величини D10 і D90 (коли їх використовують в контексті зі способом лазерної дифракції, в застосуванні до значень DvlO i Dv90) стосуються розмірів частинок, де 10% розподілу лежить нижче значення D10, і 90% розподілу лежить нижче значення D90, відповідно. Частинки придатного розміру для використання в сухих порошкових лікарських композиціях для інгаляцій можна отримати будь-яким придатним способом, добре відомим фахівцям в даній галузі. Частинки лікарського засобу придатного для інгаляцій розміру можна отримати різними способами зменшення розмірів частинок, включаючи розмелювання або більш переважно 4 UA 115544 C2 5 10 15 20 25 30 35 40 45 50 55 мікронізацію, наприклад, використовуючи прилад мікронізації струминний млин (наприклад, виробництва Hosokawa Alpine). Альтернативно, частинки придатного розміру можна отримати, передусім, шляхом сушіння розпиленням, заморожування розпиленням, контрольованою кристалізацією, наприклад, осадженням, що контролюється, супер-критичною кристалізацією рідини, кристалізацією ультразвуком або іншими придатними методами кристалізації, наприклад, в апаратах безперервної кристалізації. В одному з варіантів здійснення сполука формули (І) знаходиться в формі вільної основи, в формі фармацевтичне прийнятної солі або в формі сольвату будь-кого з них. Придатним є, якщо сполука формули (І) знаходиться в формі вільної основи, наприклад, в безводній формі. Придатним є, якщо сполука формули (І) або її фармацевтичне прийнятна сіль або сольват знаходиться в формі твердої кристалічної солі. Фармацевтично прийнятні солі сполук формули (І) В одному з варіантів здійснення запропонована фармацевтичне прийнятна сіль сполуки формули (І). Мають на увазі, що фармацевтичне прийнятні солі, як використано в даному описі, включають терапевтичне активні нетоксичні форми кислотно-адитивних солей, які вказана сполука формули (І) здатна утворювати. Вказані фармацевтичне прийнятні кислотно-адитивні солі звичайно можуть бути отримані обробкою форми основи відповідною кислотою. Відповідні кислоти включають, наприклад, неорганічні кислоти, такі як гідрогалогенові кислоти, наприклад, хлористоводнева або бромистоводнева кислота, сірчана, азотна, фосфорна і подібні кислоти; або органічні кислоти, такі як, наприклад, оцтова, пропанова, гліколева, молочна, піровиноградна, щавлева (тобто етандіоєва), малонова, бурштинова (тобто бутандіоєва кислота), малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламова, саліцилова, п-аміносаліцилова, памоєва і подібні кислоти. Так, конкретні приклади солей сполук формули (І) включають кислотноадитивні солі, утворені з НС1, НВг і п-толуолсульфоновою кислотою. Сольвати Даний винахід також стосується сольватів сполук формули (І). Приклади сольватів включають гідрати і гігроскопічні продукти, такі як канальні гідрати. Безводна форма сполуки формули (І) В одному з варіантів здійснення запропонована сполука формули (І) в безводній формі. Зокрема, запропонована сполука формули (І) в безводній твердій кристалічній формі, отримана шляхом кристалізації сполуки формули (І) з 1-пропанолу. Придатним є, якщо вказаний 1пропанол є сухим, наприклад, містить максимально близько 0,9% мас./мас. води. В одному з варіантів здійснення 1-пропанол містить максимально 0,8%, 0,7%, 0,6%, 0,5%, 0,4%, 0,3%, 0,2% або 0,05% мас./мас. води. Придатним є, якщо вказаний 1-пропанол містить максимально 0,2% води. Придатним є, якщо кристалізацію здійснюють в присутності акцептора металів. Придатні акцептори металів являють собою матеріали, які адсорбують метали, причому їх легко відділяти від сполуки, що представляє інтерес (тобто сполуки формули (І)). Наприклад, функціоналізовані ді оксиди кремнію особливо придатні як акцептори металів, оскільки після того, як метал адсорбується, вказаний комплекс метал-діоксид кремнію можна потім легко відділити від сполуки, що представляє інтерес. Функціональні групи, які утворюють стабільні комплекси з іонами металів, включають групи, що містять один або більше азотних і/або сірчаних центрів, і добре відомі фахівцям в даній галузі. Прикладом придатного комерційно доступного акцептора металів є SiliaMetS® Thiol (тіольне похідне силікагелю, яке можна використати як акцептор різних металів, включаючи Pd, Pt, Cu, Ag i Pb). Придатним є, якщо акцептор металів присутній в кількості, достатній для забезпечення досяжної концентрації іонів металу нижче 20 ч./млн, переважно нижче 10 ч./млн. В одному з варіантів здійснення вказаний акцептор металу присутній в кількості 1-10% мас./мас., наприклад, 2-8% мас./мас. або 5% мас./мас. з розрахунку на масу сполуки формули (І). Придатним є, якщо кристалізацію здійснюють охолоджуванням розчину сполуки формули (І) і розчинника, починаючи з підвищеної температури (наприклад, 80-95 °C), безперервно (тобто безперервне охолоджування) або поетапно (тобто чергуючи охолоджування і витримування розчину при конкретній температурі). Відповідні температурні градієнти (безперервні або поетапні) для охолоджування включають інтервали 95-15 °C, 95-20 °C, 90-20 °C, 80-20 °C 9590 °C, 95-85 °C, 95-80 °C, 90-85 °C і 80-20 °C. В одному з варіантів здійснення вказаний розчин охолоджують від близько 80-95 °C до кімнатної температури (наприклад, близько 20-22 °C). Докладне отримання такої твердої кристалічної безводної форми сполуки формули (І) надане в прикладі 2. Кристали сполуки формули (І) в твердій кристалічній формі можна зібрати, 5 UA 115544 C2 5 10 15 20 25 30 35 використовуючи звичайні методики виділення (наприклад, використовуючи фільтрування або центрифугування). В одному з варіантів здійснення запропонована тверда кристалічна безводна форма сполуки формули (І), картина порошкової дифракції рентгенівських променів якої по суті відповідає картині, поданій на фіг. 1. Спосіб отримання даних порошкової дифракції рентгенівських променів розкритий в розділі "Загальні методики", і отримані результати обговорюються в прикладі 3. Так, запропонована сполука формули (І) в кристалічній безводній формі, картина рентгенівської порошкової дифракції якої містить щонайменше один (наприклад, один, два, три, чотири, п'ять, шість, сім, вісім, дев'ять або всі десять) піків при 5,6, 7,9, 11,2, 12,3, 15,6, 17,6, 18,4, 21,4, 22,5, 24,2 (±0,2 градус, 2-тета величини), причому вказані піки є характеристичними для кристалічної безводної форми. Піки при 17,6, 18,4, 22,5 і 24,2 є особливо характеристичними для безводної форми, і тому переважно спостерігати щонайменше один (наприклад, один, два, три або всі чотири) з вказаних піків. Проводили дослідження хімічної сумісності безводної форми сполуки (1) з лактозою. Для оцінки хімічної сумісності, композиції безводної форми сполуки формули (І) з лактозою аналізували, використовуючи ВЕРХ. Отримані результати узагальнені в прикладі 4, де вказано, що в певних умовах вказана композиція безводної форми і лактози піддається розкладанню. Продукти розкладання були досліджені, і основний продукт розкладання був ідентифікований за допомогою мас-спектрометрії як такий, що є одним або обома речовинами, зображеними як D019328: Вказаний продукт розкладання, мабуть, є результатом додання води по потрійному зв'язку алкіну і може існувати як одна або дві форми з ідентичною масою (або може існувати в обох формах), в залежності від орієнтації додання води по потрійному зв'язку. Той же самий продукт розкладання спостерігався під час вимушеного розкладання безводної форми сполуки формули (І) іонами металу. Внаслідок подальших досліджень висунене припущення, що розкладання безводної форми сполуки формули (І) вимагає присутності іонів металу і води і прискорюється при підвищених температурах. Подальше дослідження, що включає тестування підвищеної стабільності (тобто експонування речовини вказаного лікарського засобу при 80 °C в закритій ампулі, див. приклад 7), привело авторів винаходу до підтвердження того, що щонайменше утвориться продукт розкладання, зображений як DO 19492 на схемі 1 (нижче). Більше того, автори даного винаходу також прийшли до висновку, що подальший продукт розкладання (DO 19493) може утворюватися внаслідок гідролітичного розщеплення піримідинонового кільця і подальшої внутрішньомолекулярної реакції з групою алкіну. DO 19349 являє собою приблизно проміжний 6 UA 115544 C2 продукт розкладання, який спостерігався в деяких умовах температури і відносній вологості при тестуванні стабільності (дані не представлені). 5 10 15 20 25 30 35 40 45 Досліджували додання стеарату магнію до комбінації безводної форми сполуки формули (І) і лактози. Було виявлено, що вказана комбінація безводної форми сполуки формули (І) з лактозою і стеаратом магнію є фізично стабільною (приклад 5). Однак несподівано було виявлено, що додання стеарату магнію спричиняє підвищення хімічної стабільності комбінації безводної форми сполуки формули (І) і лактози (приклад 6). Аналогічний стабілізуючий ефект був виявлений і з використанням інших металевих солей стеаринової кислоти, особливо стеарату натрію і стеарату кальцію (приклад 7). Не зв'язуючись з якою-небудь теорією, мабуть, металева сіль стеаринової кислоти, така як стеарат магнію (або, приблизно, металева сіль стеарилфумарату) може діяти як захисний агент проти хімічного розкладання алкінної групи у вказаній сполуці формули (І) і проти хімічного розкладання вказаного піримідинонового кільця в сполуці формули (І), яке спостерігають, якщо безводна форма сполуки формули (І) знаходиться в суміші з лактозою. Подрібнена лактоза як носій Як використано в даному описі, термін "лактоза" стосується компонента, що містить лактозу, включаючи моногідрат α-лактози, моногідрат β-лактози, безводну α-лактозу, безводну β-лактозу і аморфну лактозу. Лактозні компоненти можна обробляти шляхом мікронізації, просіювання, розмелювання, пресування, агломерації або сушіння розпиленням. Комерційно доступні форми лактози в різних формах також включені у винахід, наприклад, Lactohale" (лактоза інгаляційної міри чистоти; Frieslandfoods), InhaLac®70 (просіяна лактоза для сухих порошкових інгаляторів; Meggle) i Respinoseo® (просіяна лактоза інгаляційної міри чистоти; DFE Pharma) продукти. В одному з варіантів здійснення лактозний компонент вибирають з групи, що складається з моногідрату α-лактози, безводної і аморфної лактози. Переважно, якщо лактоза являє собою моногідрат α-лактози. Для проникнення досить глибоко в легені, подрібнений активний інгредієнт (у випадку сполуки (І)) повинен бути придатного розміру, як описано вище. Вказані дрібні частинки будуть мати тенденцію до утворення агломератів. Використання носіїв, таких як лактоза, запобігає вказаній агломерації і може підвищити текучість. Крім того, використання носія забезпечує правильне і постійне дозування, що досягає легенів. Активний інгредієнт звичайно утворює моношар на більш великих частинках лактози, потім під час інгаляції вказаний активний інгредієнт і вказаний носій розділяються, і вказаний активний інгредієнт інгалюється, тоді як основна частина носія - ні. Як таке, використання подрібненої лактози як носія для активного інгредієнта забезпечує те, що кожна доза сухої порошкової фармацевтичної лікарської форми виділяє одну і ту саму кількість активного інгредієнта. Як правило, для запобігання агломерації дрібним активним частинкам використовують лактозу з розміром частинок приблизно або щонайменше в десять разів більше розмірів активного інгредієнта (наприклад, використовують лактозу з D50 приблизно або щонайменше в десять разів більше розмірів активного інгредієнта). В одному з варіантів здійснення суха порошкова лікарська форма даного винаходу включає подрібнену лактозу з D50 в інтервалі 40-150 мкм. Суха порошкова фармацевтична лікарська форма даного винаходу включає подрібнену лактозу як носій в кількості, достатній, щоб забезпечити правильну і постійну доставку доз активного інгредієнта в легені. В одному з варіантів здійснення вказана суха порошкова 7 UA 115544 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтична лікарська форма включає від близько 40% мас. до близько 99,88% мас., наприклад, від близько 50% мас. до близько 99,88% мас., наприклад, від близько 65% мас. до близько 99,88% мас., наприклад, від близько 75% мас. до близько 99.99% мас. подрібненої лактози з розрахунку на масу сухої порошкової фармацевтичної лікарської форми. Переважно, суха порошкова фармацевтична лікарська форма включає від близько 80% мас. до близько 99,98% мас. або, наприклад, від близько 80% мас. до близько 99,9%% мас., наприклад, від близько 85% мас. до близько 99,98% мас., наприклад, від близько 95% мас. до близько 99% мас. подрібненої лактози з розрахунку на масу вказаної сухої порошкової фармацевтичної композиції. Подрібнені металеві солі стеаринової кислоти, такі як стеарат магнію або металеві солі стеарилфумарату, як стабілізуючі агенти Прикладом металевої солі стеаринової кислоти є стеарат магнію. Альтернативні металеві солі стеаринової кислоти, які можна використати, включають солі стеаринової кислоти, утворені з металами групи І і групи II, такі як стеарат натрію, стеарат кальцію і стеарат літію. Інші металеві солі стеаринової кислоти, які можна привести, включають стеарат цинку і стеарат алюмінію. Металеві солі стеарилфумарату (наприклад, стеарилфумарат натрію), мабуть, володіють такими ж властивостями, як і металеві солі стеаринової кислоти (див. Shah et al, Drug development and Industrial pharmacy 1986, Vol. 12 No. 8-9, 1329-1346). На думку авторів винаходу їх можна використати як альтернативу металевим солям стеаринової кислоти в даному винаході. Як використано в даному описі, термін "стеарат магнію" включає тригідрат стеарату магнію, дигідрат стеарату магнію, моногідрат стеарату магнію і аморфний стеарат магнію. Стеарат магнію, як визначено в даному описі, включає допущення, яке полягає в тому, що будь-який матеріал, визначений як "стеарат магнію", може містити аж до 25% (наприклад, аж до 10%, наприклад, аж до 5%, наприклад, аж до 1%) пальмітатної солі. Звичайно металеві солі стеаринової кислоти або металеві солі стеарилфумарату можна використати в безводній формі або у вигляді гідратів, і вони можуть містити аж до 25% (наприклад, аж до 10%, наприклад, аж до 5%, наприклад, аж до 1%) пальмітатної солі. Як використано в даному описі, вираз "стабілізуючий агент, вибраний з металевих солей стеаринової кислоти, таких як стеарат магнію і металевих солей стеарилфумарату", може включати суміш металевих солей стеаринової кислоти і/або стеарилфумарату, хоча переважно використати тільки одну сіль. Металеві солі стеаринової кислоти, такі як стеарат магнію або металеві солі стеарилфумарату, звичайно отримують у вигляді тонкого порошку, який немає необхідності піддавати мікронізації. Переважно, якщо D50 металевої солі стеаринової кислоти, такої як стеарат магнію, або металевої солі стеарилфумарату більше ніж 5 мкм, наприклад, близько 10 мкм або більше ніж 10 мкм, наприклад, в інтервалі від 5 до 100 мкм, наприклад, від 5 до 50 мкм, наприклад, від 5 до 20 мкм, наприклад, від 10 до 20 мкм. Стеарат магнію можна отримати, наприклад, від Avantor (Hyqual 2257 brand) або Peter Greven. Стеарат натрію і стеарат кальцію можна, наприклад, отримати від Sigma-Aldrich. Стеарилфумарат натрію можна, наприклад, отримати від ScienceLab. Суха порошкова фармацевтична лікарська форма даного винаходу включає подрібнений стабілізуючий агент, вибраний з металевих солей стеаринової кислоти, таких як стеарат магнію, і металевих солей стеарилфумарату в кількості, достатній для забезпечення хімічної стабільності вказаної лікарської форми ("стабілізуюча кількість"). Хімічна стабільність, наприклад, демонструється, якщо утворення продукту розкладання DO 19328 (однієї або обох речовин) знаходиться на рівні менш ніж 0,2%% мас. після зберігання композиції, що містить сполуку формули (І), протягом 4 тижнів при 50 °C. Альтернативно або додатково, хімічна стабільність, наприклад, демонструється, якщо утворення продукту розкладання DO 19493 знаходиться на рівні менш ніж 0,5%% мас. після зберігання композиції, що містить сполуку формули (І), протягом 2 тижнів при 80 °C. Альтернативно або додатково, хімічна стабільність, наприклад, демонструється, якщо утворення продукту розкладання DO 19492 знаходиться на рівні менш ніж 0,4% мас. після зберігання композиції, що містить сполуку формули (І), протягом 2 тижнів при 80 °C. В одному з варіантів здійснення вказана суха порошкова фармацевтична лікарська форма містить від близько 0,01% мас. до близько 15% мас., наприклад, від близько 0,1% мас. до близько 10% мас., 10% мас., 5% мас., 2% мас. або 1% мас. подрібненого стабілізуючого агента, вибраного з металевих солей стеаринової кислоти, таких як стеарат магнію, і металевих солей стеарилфумарату з розрахунку на масу сухої порошкової фармацевтичної лікарської форми. 8 UA 115544 C2 5 10 15 20 25 30 35 40 45 50 55 Переважно, якщо суха порошкова фармацевтична лікарська форма включає від близько 0,5% мас. до близько 5% мас., наприклад, 1-2% мас./мас. подрібненого стабілізуючого агента, вибраного з металевих солей стеаринової кислоти, таких як стеарат магнію, і металевих солей стеарилфумарату з розрахунку на масу вказаної сухої порошкової фармацевтичної композиції. Придатним є, якщо стабілізуючий агент, вибраний з металевої солі стеаринової кислоти, такої як стеарат магнію, і металевих солей стеарилфумарату, присутній в кількості, достатній для забезпечення фізичної стабільності вказаної лікарської форми. Фізична стабільність, наприклад, демонструється, якщо 14 спектр і картина порошкової дифракції рентгенівських променів композиції (особливо відносно характеристичних піків сполуки формули (І)) є постійними і незміненими після зберігання композиції, що містить сполуку формули (І), протягом 4 тижнів при 50 °C. В одному з варіантів здійснення суха порошкова фармацевтична лікарська форма для інгаляцій даного винаходу включає: (і) від близько 0,02 до 50% мас. 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4а]піримідин-1-іл)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-К,М-біс(2метоксіетил)гекс-5-инаміду або його фармацевтичне прийнятної солі, включаючи всі його стереоізомери, таутомери і ізотопні похідні і сольвати в подрібненій формі, як активний інгредієнт; (іі) від близько 40% мас. до близько 99,88% мас. подрібненої лактози; і (ііі) від близько 0,1% мас. до близько 10% мас. подрібненого стабілізуючого агента, вибраного з металевих солей стеаринової кислоти (таких як стеарат магнію) і металевих солей стеарилфумарату. У наступному варіанті здійснення суха порошкова фармацевтична лікарська форма для інгаляцій даного винаходу включає: (і) від близько 0,02 до 50% мас. 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4а]піримідин-1-іл)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-К,1Ч-біс(2метоксіетил)гекс-5-инаміду в формі вільної основи; (іі) від близько 40% мас. до близько 99,88% мас. подрібненої лактози; і (ііі) від близько 0,1% мас. до близько 10% мас. подрібненого стабілізуючого агента, вибраного з металевих солей стеаринової кислоти (таких як стеарат магнію) і металевих солей стеарилфумарату. Наступний аспект даного винаходу стосується застосування стабілізуючого агента, вибраного з металевих солей стеаринової кислоти, таких як стеарат магнію, і металевих солей стеарилфумарату в фармацевтичній лікарській формі, що містить сполуку формули (І) і лактозу, для підвищення стабільності сполуки формули (І) до хімічного розкладання (особливо відносно іонів металів, каталізуючих додання води до алкінної групи і/або гідролізу піримідинонового кільця сполуки формули (І)) і способу підвищення стабільності фармацевтичної лікарської форми, що містить сполуку формули (І) і лактозу, хімічного розкладання (особливо відносно іонів металів, каталізуючих додання води до алкінної групи і/або гідролізу піримідинонового кільця сполуки формули (І)), що включає включення у вказану лікарську форму стабілізуючої кількості стабілізуючого агента, вибраного з металевих солей стеаринової кислоти, таких як стеарат магнію, і металевих солей стеарилфумарату. Придатним є, якщо вказана сполука формули (І) знаходиться в безводній твердій кристалічній формі. Переважним стабілізуючим агентом є стеарат магнію. Фармацевтичні застосування і способи введення Відповідно до одного аспекту даного винаходу запропоноване застосування фармацевтичної лікарської форми даного винаходу як інгібітора РІЗ-кінази. В одному з варіантів здійснення запропоноване застосування фармацевтичної лікарської форми даного винаходу для лікування ХОЗЛ і/або астми, зокрема ХОЗЛ або важкої астми, шляхом інгаляції, тобто шляхом місцевого введення в легені. Важливо, що введення в легені забезпечує сприятливі ефекти сполуки, що вводиться, при цьому мінімізуючи побічні ефекти для пацієнтів. В одному з варіантів здійснення фармацевтичну лікарську форму даного винаходу можна використати для сенсибілізації пацієнтів до лікування кортикостероїдами. Фармацевтичні композиції даного винаходу зручно вводити в одиничній дозованій формі і її можна отримати будь-яким способом, добре відомим фахівцям у вказаній фармацевтичній галузі, наприклад, як описано в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA., (1985). Місцеве введення в легені здійснюють, використовуючи пристрій для інгаляції. 9 UA 115544 C2 5 10 15 20 25 30 35 40 45 50 55 60 Так, аспект даного винаходу включає пристрій для інгаляції, який включає одну або більше доз фармацевтичної лікарської форми згідно з даним винаходом. Пристрої для інгаляції для сухих порошкових лікарських форм звичайно активуються диханням, так що доза виводиться з пристрою і вводиться суб'єкту за рахунок сили легенів шляхом інгаляції з мундштука. Однак необов'язково можна використати зовнішню енергію для того, щоб сприяти введенню дози. Звичайно пристрої для інгаляції включають множинні дози фармацевтичної лікарської форми згідно з даним винаходом, наприклад, 2 або 4, або 8, або 28, або 30, або 60, або більше доз. Так, пристрій для інгаляції може включати місячний запас доз. Необов'язково дози можна ділити, наприклад, так, щоб дозу вводити, використовуючи дві (або більше) інгаляції з пристрою для інгаляції. Відповідно до одного варіанту даного винаходу дози лікарської форми заздалегідь відміряються в пристрої для інгаляції. Наприклад, відміряні дози можуть міститися в кишенях блістерних смужок або в дисках або всередині капсул. В одному з варіантів здійснення дози відмірюють в капсули для використання одна за іншою в пристрої для інгаляції, пристосованому для доставки вмісту капсул суб'єкту після інгаляції. Відповідно до іншого варіанту здійснення даного винаходу дози відміряють під час використання. Такі пристрої для інгаляції включають резервуар сухого порошку і пристрій для відмірювання дози порошку (звичайно на основі фіксованого об'єму) до або під час введення. Приклади сухих порошкових пристроїв для інгаляції включають SPINHALER, ECLIPSE, ROTAHALER, HANDIHALER, AEROLISER, CYCLOHALER, BREEZHALER/NEOHALER, FLOWCAPS, TWINCAPS, X-CAPS, TURBOSPIN, ELPENHALER, DISKHALER, TURBUHALER, MIATHALER, TWISTHALER, NOVOLIZER, DISKUS, SKYEHALER, ORIEL сухий порошковий інгалятор, MICRODOSE, ACCUHALER, PULVINAL, EASYHALER, ULTRAHALER, TAIFUN, PULMOJET, OMNIHALER, GYROHALER, TAPER, CONIX, XCELOVAIR, PROHALER i CLICKHALER. Іншим прикладом є інгалятор MONODOSE. Необов'язково пристрій для інгаляції може бути упакований для зберігання для захисту від проникнення вологи. Необов'язково може бути використаний осушувач всередині упаковки або всередині пристрою. Переважно, якщо фармацевтична лікарська форма згідно з даним винаходом в пристрої для інгаляції захищена від світла. Фармацевтичні композиції згідно з даним винаходом можна також застосовувати при лікуванні респіраторних порушень, включаючи ХОЗЛ, хронічні бронхіти, емфіземи, астму, педіатричну астму, кістозний фіброз, саркоїдоз і ідіопатичний легеневий фіброз, і особливо астму, хронічні бронхіти і ХОЗЛ. Фармацевтичні композиції згідно з даним винаходом можуть містити сполуку формули (І) як єдиний активний інгредієнт, або можуть містити додаткові активні інгредієнти, наприклад, активні інгредієнти, які можна застосовувати при лікуванні вищезгаданих станів. Наприклад, можливі комбінації для лікування респіраторних порушень включають комбінації зі стероїдами (наприклад, будезоніомдом, беклометазоном, дипропіонатом, флутиказонпропіонатом, мометазонфуркатом, флутиказонфуроатом, флунізолідом, циклезонідом, триамцинолоном), бета-агоністами (наприклад, тербуталіном, бамбутеролом, салбутамолом, левалбутеролом, салметеролом, формотеролом, клетбутеролом, фенотеролом, броксатеролом, індакатеролом, репротеролом, прокатеролом, вівлантеролом) і/або ксантинами (наприклад, теофіліном), мускариновими антагоністами, (наприклад, іпратропієм, тіогтропієм, окситропієм, глікопіронієм, гликопіролатом, аклідинієм, троспієм), антагоністами лейкотрієну (наприклад, зафірлукастом, пранлукастом, зілеутоном, монтелукастом) і/або інгібіторами р38 МАР кінази. Потрібно розуміти, що будь-який з перерахованих вище активних інгредієнтів можна використати в формі фармацевтично прийнятних солей. В одному з варіантів здійснення фармацевтичну лікарську форму даного винаходу вводять в комбінації з противірусним агентом, наприклад, ацикловіром, оселтамівіром (Tamiflu®), занамівіром (Relenza®) або інтерфероном. В одному з варіантів здійснення комбінацію сполуки формули (І) і іншого активного інгредієнта(ів) спільно отримують в фармацевтичній лікарській формі даного винаходу. В іншому варіанті інший активний інгредієнт(и) вводять з одним або більше окремими фармацевтичними лікарськими формами. В одному з варіантів здійснення сполуку формули (І) спільно формулюють в фармацевтичній лікарській формі даного винаходу або спільно вводять в окремій лікарській формі з кортикостероїдом, наприклад, для застосування в підтримуючій терапії астми, ХОЗЛ або раку легенів, включаючи профілактику останнього. В одному з варіантів здійснення фармацевтичну лікарську форму даного винаходу вводять шляхом інгаляції, і кортикостероїд вводять перорально або шляхом інгаляції або в комбінації або окремо. 10 UA 115544 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтична лікарська форма даного винаходу може також повторно сенсибілізувати стан пацієнтів для лікування за допомогою кортикостероїдів, якщо раніше стан пацієнтів став важко піддаватися лікуванню ними. В одному з варіантів здійснення даного винаходу доза вказаної фармацевтичної лікарської форми, що застосовується, дорівнює дозі, відповідній для застосування як монотерапії, але її вводять в комбінації з кортикостероїдом. В одному з варіантів здійснення використовують таку дозу вказаної фармацевтичної лікарської форми, яка буде суб-терапевтичною як єдиний агент, і вводять в комбінації з кортикостероїдом, тим самим відновлюючи сприйнятливість пацієнта до останнього, у випадку, якщо пацієнт раніше став несприйнятливим до кортикостероїду. Крім того, фармацевтична лікарська форма даного винаходу може виявляти противірусну активність і виявити корисність при лікуванні вірусних загострень запальних станів, таких як астма і/або ХОЗЛ. Фармацевтичну лікарську форму даного винаходу можна також застосовувати для профілактики, лікування або ослаблення вірусу грипу, риновірусу і/або респіраторного синцитіального вірусу. В одному з варіантів здійснення описані в даному винаході фармацевтичні композиції можна застосовувати при лікуванні або для профілактики раку, зокрема раку легенів, особливо шляхом місцевого введення в легені. Так, в наступному аспекті в даному винаході запропонована фармацевтична лікарська форма, як описано в даному описі, для застосування при лікуванні одного або більше вищеперелічених станів. У наступному аспекті в даному винаході запропонована фармацевтична лікарська форма, як описано в даному описі, для виготовлення лікарського засобу для лікування одного або більш вищеперелічених станів. У наступному аспекті в даному винаході запропонований спосіб лікування вищеперелічених станів, що включає введення суб'єкту ефективної кількості фармацевтичної лікарської форми даного винаходу. Фармацевтичні композиції, описані в даному описі, можна також використати при отриманні лікарських засобів для лікування одного або більше вищеперелічених захворювань. Вираз "лікування" включає профілактику, а також терапевтичне лікування. Якщо не вказане інше, % значення, як використано в даному описі, являють собою % значення по масі (% мас.). Фармацевтичні композиції даного винаходу можуть мати перевагу, оскільки вони мають підвищену фізичну стабільність (наприклад, за даними порошкової дифракції рентгенівських променів і/або 14 аналізу), підвищену хімічну стабільність (наприклад, за даними ВЕРХ), підвищену фізичну сумісність з лактозою, підвищену хімічну сумісність з лактозою, поліпшений розподіл частинок по розмірах при введенні (такий, який виходить внаслідок підвищеної маси дуже дрібних частинок) або можуть володіти іншими сприятливими властивостями в порівнянні з аналогічними лікарськими формами, які не містять стабілізуючого агента, вибраного з металевих солей стеаринової кислоти, таких як стеарат магнію, і металевих солей стеарилфумарату. Скорочення Водн. - водний ХОЗЛ - хронічне обструктивне захворювання легенів д - дублет DCM - дихлорметан DMAP - 4-диметиламінопіридин ДМСО - диметилсульфоксид DPI - сухий порошковий інгалятор ДСК - диференціальна скануюча калориметрія ДСП - динамічна сорбція парів EDC.HC1 - гідрохлорид 1-етил-3-(3-диметиламінопропіл)карбодііміду (ES ) - іонізація електророзпиленням, режим визначення позитивних іонів EtOAc - етилацетат ВЕРХ - високоефективна рідинна хроматографія ВЕРХ-MC - високоефективна рідинна хроматографія - мас-спектрометрія год. - година (години) 14 - інфрачервоний LPS - ліпополісахарид 11 UA 115544 C2 + 5 10 15 20 25 30 35 40 45 50 55 60 (М+Н) - протонований молекулярний іон MDI - дозуючий інгалятор МеОН - метанол МЕК - метилетилкетон МГц - мегагерц хв. - хвилина (хвилини) мл - міліметр MC - мас-спектрометрія mTOR - мішень рапаміцину в клітинах ссавців m/z - відношення маса/заряд NH4OAc - ацетат амонію ЯМР - ядерний магнітний резонанс (спектроскопія) Pd(dppf)Cl2 - 1,1ʹ-біс(дифенілфосфіно)фероцен]дихлорпаладій(П) ч./млн - частин на мільйон м.ч. мільйонні частинки кв - квартет квін. - квінтет відн. вол. - відносна вологість RRT - відносний час втримання Rt - час втримання KT - кімнатна температура с -синглет т - триплет TBDMSCI - трет-бутилдиметилсилілхлорид ТГА - термогравіметричний аналіз TNFa - альфа фактор некрозу пухлини XRPD - порошкова дифракція рентгенівських променів ПРИКЛАДИ Загальні методики ВЕРХ-МС Здійснювали при використанні системи Agilent HP 1200 з колонками Agilent Extend CIS, (1,8 -1 мкм, 4,6x30 мм) при 40 °C і швидкості потоку 2,5-4,5 мл.хв , елююючи з градієнтом H2O-MeCN, що містить 0,1% об./об. мурашиної кислоти, протягом 4 хв. Інформація про градієнт: 0-3,00 хв., зміна з 95% Н2О-5% MeCN до 5% Н2О-95% MeCN; 3,00-3,01 хв., витримують при 5% Н2О-95% -1 MeCN, швидкість потоку підвищують до 4,5 мл.хв ; 3,01-3,50 хв., витримують при 5% Н2О-95% MeCN; 3,50-3,60 хв., повертають до 95% Н2О-5% MeCN; швидкість потоку знижують до 3,50 -1 мл.хв ; 3,60-3,90 хв., витримують при 95% Н2О-5% MeCN; 3,90-4,00 хв, витримують при 95% -1 Н2О-5% MeCN, швидкість потоку знижують до 2,5 мл.хв . У Φ детектування здійснюють на 254 нм, використовуючи детектор із змінною довжиною хвилі Agilent G1314B. Мас-спектри (MC) Отримували при використанні іонізації електророзпиленям (ESI) в інтервалі m/z 60-2000 при частоті відбору зразка 1,6 сек/цикл, використовуючи Agilent G1956B, в інтервалі m/z 150-850 при частоті відбору зразка 2 Гц, використовуючи Waters ZMD або в інтервалі m/z 100-1000 при частоті відбору зразка 2 Гц, використовуючи систему РХ-МС Shimadzu 2010. ЯМР спектри 1 Н ЯМР спектри (за винятком отриманих в прикладі 7) отримували на спектрометрі Bruker Avance III з робочою частотою 400 МГц при використанні як стандарт залишкового недейтерованого розчинника. 1 H ЯМР спектр, в прикладі 7, отриманий на спектрометрі Bruker Avance з робочою частотою 600 МГц, з використанням як стандарт залишкового недейтерованого розчинника. Порошкова дифракція рентгенівських променів (XRPD) Картину порошкової дифракції рентгенівських променів отримували, використовуючи дифрактометр PANalytical (Philips) X'PertPRO MPD, забезпечений рентгенівською трубкою Cu LFF (45 кВ; 40 мА; Bragg-Brentano; spinner stage), при використанні Си Κα випромінювання і наступних умов вимірювання: Тип сканування: безперервний Інтервал сканування: з 3 до 50° 2θ Розмір кроку: 0,02°/крок Час рахунку імпульсів: 30 сек/крок Час одного оберту спікера: 1 сік 12 UA 115544 C2 5 10 15 20 25 30 35 40 Тип випромінювання: СиКа Програма траєкторії пучка Програмована щілина розходності: 15 мМ Щілина Солера: 0,04 рад Фільтр пучка: 15 мм Антирозсіювальна щілина: 1° Ножовий промінь: + Дифрагована траєкторія пучка Довгий протирозсіювіальний екран: + Щілина Солера: 0,04 рад Ni фільтр: + Детектор: X'Celerator Зразки готували нанесенням на держак зразка з нульовим фоном. Інфрачервона спектрометрія (ІЧ) Використали Мікро ІЧ-спектроскопію порушеного повного внутрішнього відображення (мікроАТК) і зразок аналізували при використанні відповідних мікроАТК аксесуарів і наступних умов вимірювання: прилад: спектрометр Thermo Nexus 670 FTIR число сканувань: 32 -1 Розрізнення: 1 см -1 Довжина хвилі: від 4000 до 400 см Детектор: DTGS з вікнами КВг Розщеплювач пучка: Ge на КВг мікроАТК аксесуари: Harrick Split Pea з кристалом Si Хімічна стабільність - Високоефективна рідинна хроматографія (ВЕРХ) ВЕРХ аналіз здійснювали при використанні наступних технічних умов: Колонка Waters Xbridge CIS (150x3,0x3,5 мм) або еквівалент (колонку вважають еквівалентною, якщо її характеристики відповідають параметрам SST, і вона демонструє порівнянне розділення всіх сполук, що розглядаються ). Температура колонки 3 5 °C Температура зразка 10 °C Швидкість потоку 0,45 мл/хв. Об'єм впорскування: Об'єм проби, що вводиться, можна регулювати доти, поки не перевищуються атестаційні параметри системи (детектора і інжектора), і форма піків основної сполуки залишається прийнятною. Так, наприклад, 30 мкл вважають придатним значенням. У Φ детектування на довжині хвилі 255 нм Рухома фаза. Отримання і склад: А 10 мМ ацетат амонію (0,771 г/л)+0,1% об./об. трифтороцтової кислоти у воді В Ацетонітрил Градієнт: Час аналітичної серії становить 41 хвилину Розчинник %А %В 45 50 55 0 95 5 Час (хвилини) 36 41 0 0 100 100 35 30 70 42 95 5 48 95 5 При використання вказаного режиму ВЕРХ продукт розкладання DO 19492 елююється при RRT=0,86. Хімічна стабільність - Надефективна рідинна хроматографія (НЕРХ) НЕРХ аналіз здійснювали при використанні наступних технічних умов: Колонка Acquity ВЕН С18; 2,1x150 мм; 1,7 мкм або еквівалент (колонку вважають еквівалентною, якщо її характеристики відповідають параметрам SST, і вона демонструє порівнянне розділення всіх сполук, що розглядаються). Температура колонки 3 5 °C Температура зразка 10 °C Швидкість потоку 0,40 мл/хв. Об'єм впорскування: Об'єм проби, що вводиться, можна регулювати доти, поки не перевищуються атестаційні параметри системи (детектора і інжектора) і форма піків основної сполуки залишається прийнятною. Так, наприклад, 4 мкл вважають придатним значенням. Детектування: У Φ детектування на 255 нм 13 UA 115544 C2 Рухома фаза. Отримання і склад: А 10 мМ ацетат амонію (0,771 г/л)+0,1% об./об. трифтороцтова кислота у воді В Ацетонітрил Градієнт: Час аналітичної серії становить 41 хвилину Розчинник %А %В 0 95 5 Час (хвилини) 20 23 0 0 100 100 19 30 70 23,5 95 5 28 95 5 5 10 15 20 25 30 35 При використанні вказаного способу НЕРХ продукт розкладання DO 19492 елююється при RRT=0,92-0,93, і продукт розкладання DO 19493 елююється при RRT=0,86-0,87. Реагенти і постачальники ®: Lactohale200 постачальник Frieslandfoods. Розмір частинок (Sympatec): D10: 5-15 мкм; D50: 50-100 мкм; D90: 120-160 мкм. ® Стеарат магнію: Grade Нуqual 2257; постачальник Avantor. Розмір частинок: D10: звичайно 3 мкм; D50: звичайно 11,5 мкм (10,5-16,5 мкм ); D90: звичайно 24 мкм (18-28 мкм). Постачається у вигляді тонко подрібненого порошку. Приклад 1 - Отримання 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4-d] піримідин-1іл)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-М,Кбіс(2-метоксіетил)гекс-5-инаміду 5-бром-3-(2-хлорбензил)-2-(хлорметил)хіназолін-4(ЗН)-он (2) До розчину 2-аміно-6-бром-бензойної кислоти (3,06 г, 14,2 ммоль), що перемішується в толуолі (75 мл), охолодженому до 0 °C на бані з льодом, додають піридин (0,60 мл, 7,10 ммоль), потім додають по краплях розчин хлорацетилхлориду (2,26 мл, 28,4 ммоль) в толуолі (75 мл) протягом 1 години. Отриману реакційну суміш залишають нагріватися до кімнатної температури, потім нагрівають при 115 °C протягом 3 годин, і потім залишають охолоджуватися до кімнатної температури. Об'єм розчинника зменшують на половину випарюванням у вакуумі. Після відстоювання протягом ночі, продукт осаджується, і його збирають фільтруванням, з отриманням 2-бром-6-(2-хлорацетамідо)бензойної кислоти (1а, Х=С1) (1,44 г) у вигляді білої + + твердої речовини: m/z 290/292 (М+Н) (ES ). Отриманий фільтрат концентрують у вакуумі, і залишок ретельно розтирають зі сумішшю етанол/гептан, з отриманням 2-бром-6-(2гідроксіацетамідо)бензойної кислоти (1b, Х=ОН) (1,02 г, загальний вихід, 59%): m/z 274/276 + + (М+Н) (ES ). Як сполуку 1а, так і 1b можна використати на наступній стадії без додаткового очищення. До перемішуваної суміші сполуки (1а) (7,50 г, 27,4 ммоль), 2-хлорбензиламіну (5,00 мл, 41,05 ммоль) і триетиламіну (5,70 мл, 41,1 ммоль) в толуолі (250 мл) додають по краплях розчин трихлористого фосфору (2,60 мл, 30,1 ммоль) в толуолі (250 мл) протягом 1 години. Отриману реакційну суміш нагрівають при 110 °C протягом 24 годин, після чого гарячий розчин декантують і концентрують у вакуумі. Отриманий залишок ретельно розтирають з пропан-2олом (50 мл), з отриманням вказаної в заголовку сполуки (2) (6,41 г, 59%) у вигляді жовтої + + твердої речовини: Rt 2,67 хв.; m/z 397/399 (М+Н) (ES ). 3-(3-(трет-бутшдІшетшсшілокси)феніл)-1Н-піразоло[3,4-а]піргтідин-4-амін (6) 40 14 UA 115544 C2 5 10 15 20 25 30 35 До перемішуваної суспензії 3-йод-1Н-піразоло[3,4-с]піримідин-4-аміну (3) (8,22 г, 31,5 ммоль), 3-фенолборонової кислоти (13,0 г, 94,5 ммоль) і фосфату калію (10,0 г, 47,3 ммоль) в дегазованій суміші ДМФ/вода (3:2, 140 мл) додають Pd(dppf)Cl2 (13,0 г, 15,7 ммоль). Отриману реакційну суміш продувають азотом, нагрівають при 120 °C протягом 2 годин і потім залишають охолоджуватися до кімнатної температури. Отриману реакційну суміш розбавляють ЕЮ Ас (500 мл) і хлористоводневою кислотою (2М, 500 мл), і отриману суспензію фільтрують. Фільтрат екстрагують хлористоводневою кислотою (2М, 2x500 мл). Об'єднані органічні екстракти підлуговують насиченим водним розчином бікарбонату натрію до pH 10. Осад, що утворився, фільтрують, і отриманий фільтрат екстрагують ЕЮ Ас (3+1 л). Об'єднані органічні екстракти сушать, фільтрують, і розчинник видаляють у вакуумі, з отриманням сірої твердої речовини. Всі тверді матеріали, що утворилися під час обробки, об'єднують і ретельно розтирають з DCM, з отриманням 3-(4-аміно-1Н-піразоло[3,4-с]піримідин-3-іл)фенолу (5) (6,04 г, 84%) у вигляді сірої + + твердої речовини: m/z 228 (М+Н) (ES ). До перемішуваного розчину отриманого фенолу (5) (4,69 г, 20,66 ммоль) і імідазолу (2,10 г, 30,99 ммоль) в сухому ДМФ (100 мл) додають TBDMSC1 (4,70 г, 30,99 ммоль). Через 16 годин додають додаткову порцію імідазолу (2,10 г, 30,99 ммоль) і TBDMSC1 (4,70 г, 30,99 ммоль), і отриману суміш перемішують протягом 48 годин. Отриману реакційну суміш розбавляють водою (120 мл) і екстрагують DCM (2x200 мл). Об'єднані органічні екстракти промивають водою (2x200 мл), сушать, фільтрують і об'єм зменшують до приблизно 100 мл випарюванням у вакуумі. Отриману суспензію фільтрують, і тверду частину промивають гептаном (50 мл, з отриманням вказаної в заголовку сполуки (6) (6,05 г, 85%) у вигляді не зовсім білої твердої + речовини: m/z 343 (М+Н) (ES ). Проміжна сполука А: 2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4-а]тримідин-1-іл)метгиІ)5-бром-3-(2-хлорбензгиІ)хіназолін-4(ЗН)-он До перемішуваної суміші 5-бром-3-(2-хлорбензил)-2-(хлорметил)хіназолін-4(ЗН)-ону (2) (100 мг, 0,25 ммоль) і карбонату калію (42 мг, 0,30 ммоль) в ДМФ (2,5 мл) додають розчин 3-(3-(третбутилдиметилсилілокси)феніл)-1Н-піразоло[3,4-а]піримідин-4-аміну (6) (94 мг, 0,28 ммоль) в ДМФ (2,5 мл), і отриману реакційну суміш перемішують при кімнатній температурі протягом 18 годин. Трьома порціями додають карбонат калію (3x35 мг, 0,75 ммоль) протягом 30 годин, після чого розчинник видаляють у вакуумі, і неочищений матеріал очищають колонковою флешхроматографією, елююючи 4,5% метанолом DCM, з отриманням вказаної в заголовку проміжної сполуки А, (94 мг, 64%) у вигляді не зовсім білої твердої речовини: Rt 2,01 хв.; m/z 588/590 + + (М+Н) , (ES ). 15 UA 115544 C2 5 10 15 20 25 30 До розчину гекс-5-инової кислоти (7,11 г, 63,4 ммоль), EDC.HC1 (14,0 г, 72,9 ммоль) і DMAP (387 мг, 3,17 ммоль) в DCM (600 мл) при 0 °C додають біс(2-метоксіетил)амін (9,3 мл, 63 ммоль). Отриману суміш нагрівають до кімнатної температури протягом 20 годин, і потім промивають хлористоводневою кислотою (ЇМ, 2x500 мл) і водою (500 мл). Органічний шар сушать і випарюють у вакуумі, з отриманням вказаної в заголовку сполуки, проміжної сполуки В, у вигляді жовтого масла (16г, 97%):)) 1 Н ЯМР (400 МГц, CDC13) δ: 1,88 (3Н, м), 2,26 (2Н, м), 2,49 (2Н, м), 3,32 (6Н, з), 3,51 (4Н, м), 3,55 (4Н, м). 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4-а]піримідин-1 іл)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл),М-біс(2-метоксіетил)гекс-5инамід (І) Проміжну сполуку А (2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4-а]піримідин-1іл)(метил)-5-бром-3-(2-хлорбензил)хіназолін-4(ЗН))-он (65,7 г, 1,0екв.)), йодид міді (І) (1,06 г, 0,05 моль/моль), біс(трифенілфосфін)паладій(П)хлорид (3,92 г, 0,05 моль/моль), проміжну сполуку В (М,1Ч-біс(2-метоксіетил)гекс-5-инамід (63,42 г, 2,5 моль/моль) і диетиламін (837,05 мл; 591,21 г, 7,5 л/моль) додають в 2 л реактор, і отриману суміш дегазують, продуваючи аргоном. Отриману реакційну суміш нагрівають до 55 °C (температура кипіння із зворотним холодильником) протягом 30 хвилин, і потім перемішують при 55 °C. Через 2 години суміш охолоджують до 22 °C, потім концентрують у вакуумі, з отриманням напівтвердого темнокоричневого залишку (201,0 г). Залишок потім розчиняють в МЕК (781 мл) і додають воду (223 мл). Після інтенсивного перемішування протягом 5 хвилин шари розділяють, і водний шар видаляють. Органічний шар промивають 10% мас./об. водним NH4OAc (300 мл) і 2% мас./об. водним NaCl (112 мл), потім частково концентрують у вакуумі до отримання гетерогенної суміші в МЕК (230 г). Отриману суміш перемішують протягом 16 годин, потім фільтрують, і осад, що утворився, промивають МЕК (3x25 мл). Отриману тверду речовину сушать при 50 °C у вакуумі протягом 18 годин, з отриманням неочищеного 6-(2-((4-аміно-3-(3 -гідроксифеніл)-1 Нпіразоло[3,4-а]піримідин-1 -іл)метил)-3 -(2-хлорбензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-К,Мбіс(2-метоксіетил)гекс-5-инаміду (сполука формули (І) (54,13 г; 0,66 еквів.; 65,97% вихід). Неочищену сполуку формули (І) (53,5 г; 1,00 еквів.), метанол (7,28 мл, 0,1 л/моль) і дихлорметан (145,53 мл, 2 л/моль) перемішують в 250 мл. реакторі при 22 °C. Через 4 години тверду частину відфільтровують і промивають дихлорметаном (29 мл), потім сушать у вакуумі 16 UA 115544 C2 5 10 15 20 25 при 40 °C протягом 18 годин, з отриманням сполуки формули (І) (вказана в заголовку сполука) (45,3 г;) 0,85 еквів.); 84,67% кристалізаційний вихід) у вигляді не зовсім білої твердої речовини. Приклад 2 - Отримання сполуки формули (І) в безводній твердій кристалічній формі Всі реакції, описані в даному прикладі, проводять в струмі газоподібного азоту. Сполуку формули (І), отриману за способом прикладу 1, (14,0 г) і 1-пропанол (210 мл, 15 л/кг) додають в 400 мл кристалізаційний реактор. Отриману гетерогенну суміш перемішують і нагрівають до 90 °C (причому вказана суміш стає гомогенною при 85 °C). Після досягнення температури розчину 90 °C, додають акцептор металу (SiliaMetS® Thiol 0,7 г (5% мас./мас.), і отриману суміш нагрівають до 95 °C. Після перемішування протягом 15 хвилин при 95 °C суміш охолоджують до 90 °C і перемішують ще 2 години при 90 °C. Потім вказаний акцептор металу відфільтровують, і гомогенний фільтрат знов перемішують і нагрівають до 95 °C, потім охолоджують до 85 °C і перемішують протягом 8 годин. Потім отриманий фільтрат охолоджують протягом 8 годин до 20 °C і перемішують додатково 6 годин при 20 °C. Потім отриманий продукт відфільтровують і промивають 1-пропанолом (6 мл), потім сушать у вакуумі при 50 °C протягом 18 годин, з отриманням сполуки формули (І) в безводній формі (12,6 г, 90%) у вигляді білої твердої речовини. Вищезгаданий спосіб можна необов'язково адаптувати для полегшення кристалізації, використовуючи затравку. Приклад 3 - Аналіз порошкової дифракції рентгенівських променів сполуки формули (І) в твердій кристалічній безводній формі Аналіз порошкової дифракції рентгенівських променів безводної форми сполуки формули (І) (приклад 2) здійснюють, використовуючи спосіб, описаний в розділі "Загальні методики". Отримана дифракційна картина подана на фіг. 1. Картина порошкової дифракції рентгенівських променів демонструє дифракційні піки без присутності гало, тим самим, свідчачи про те, що обидва матеріали є кристалічними. Характеристичні піки форм представлені нижче в таблиці 1. Таблиця 1 Характеристичні піки порошкової дифракції рентгенівських променів для безводної форми сполуки формули (І) Піки порошкової дифракції рентгенівських променів (±0,2 градуси, 2-тета значення) 5,6 7,9 11,2 12,3 15,6 17,6 18,4 21,4 22,5 24,2 30 35 40 45 Приклад 4 - ВЕРХ аналіз сполуки формули (І) в безводній твердій кристалічній формі (мікронізованій) з лактозою Хімічну сумісність безводної твердої кристалічної форми сполуки формули (І) (мікронізованої) в комбінації з лактозою визначають за даними ВЕРХ аналізу. Мікронізовану безводну форму сполуки формули (1) отримують, використовуючи пристрій для мікронізації - струминний млин (1,5 бар) (виробництва Hosokawa Alpine), з отриманням наступного розподілу по розмірах частинок: D10=1,40 мкм; D50=2,77 мкм i D90=5,29 мкм (розподіл по розмірах частинок визначають, використовуючи лазерну дифракцію (прилад Malvern Mastersizer). Порцію, що тестується, відбирають з початкової маси, що містить 3,519 мг безводної форми сполуки формули (І) (мікронізованої) і 6006,64 мг Lactohale200. Отримані суміші аналізують, використовуючи ВЕРХ в момент часу нуль і після зберігання в різних умовах. Зразки зберігають в наступних умовах: (і) 1, 2, 3і 4 тижні при 50 °C (іі), 1 тиждень при 80 °C (ііі), 1, 2, 3 і 4 тижні при 40 °C/75% відносної вологості. Результати, представлені в таблиці 2, показують, що значне розкладання спостерігається після зберігання протягом 1 тижня при 80 °C, і розкладання також спостерігається після зберігання протягом 4 тижнів при 50 °C. Отримані результати свідчать про те, що безводна форма (мікронізована) сполуки формули (І) хімічно нестабільна в комбінації з лактозою, і тому вказані два компоненти несумісні в фармацевтичній лікарській формі. Пік при RRT 0,86 був віднесений до гідративаного похідного (похідних) DO 19328 представлених вище. 17 UA 115544 C2 Таблиця 2 Результати дослідження стабільності твердої кристалічної безводної форми сполуки формули (І) (мікронізованої) з лактозою Умови Т=нуль 1 тиждень 50 °C 1 тиждень 80 °C 1 тиждень 40 °C/75% відн. вол. 2 тижні 50 °C 2 тижні 40 °C/75% відн. вол. 3 тижні 50 °C 3 тижні 40 °C/75% відн. вол. 4 тижні 50 °C 4 тижні 40 °C/75% відн. вол. RRT* 0,80 0,21 0,17 0,52 0,19 0,19 0,17 0,19 0,19 0,19 0,18 RRT* 0,86 0,12 0,23 2,53 0,12 0,30 0,11 0,38 0,08 0,54 0,20 RRT* 0,97 0,78 RRT* 1,14 0,12 0,10 0,19 0,11 0,12 0,12 0,12 0,11 0,11 0,11 RRT* 1,32 0,13 0,12 0,12 0,13 0,13 0,13 0,14 0,14 0,13 0,14 * Вказаний % площі за даними ВЕРХ для RRT. Сполука формули (І) має RRT=1,0 5 10 15 20 25 30 35 40 Приклад 5 - Аналіз порошкової дифракції рентгенівських променів/ІЧ сполуки формули (І) в безводній твердій кристалічній формі з лактозою і стеаратом магнію Суміш твердої кристалічної безводної форми (мікронізованої) сполуки формули (І) з лактозою готують доданням 1% стеарату магнію (мікронізацію сполуки формули (1) здійснюють за способом прикладу 4). Отримання суміші: близько 500 мг Lactohale200* і близько 10 мг стеарату магнію додають в агатову ступку, до змішування, використовуючи товкачик і пластиковий шпатель (Feton) протягом 5 хвилин. До отриманої суміші додають близько 500 мг безводної сполуки формули (І) (мікронізованої), і суміш перемішують ще протягом 5 хвилин. Отримані суміші зберігають при різних температурах і при різній вологості і аналізують, використовуючи порошкову дифракцію рентгенівських променів і 14 в момент часу 0 і після 1 тижня і 4 тижнів зберігання. Умови протягом 1 тижня зберігання: 40 °C/75% відносна вологість відкрито; 1 тижні 50 °C закрито; і 1 тижні 80 °C закрито. Умови для визначення стабільності зберігання протягом 4 тижнів: 4 тижні при 50 °C закрито; 4 тижні 40 °C/75% відносна вологість відкрито. 14 спектр, отриманий для моменту часу нуль поданий на фіг. 2. 14 отримані для зразків при дослідженні стабільності. Яких-небудь відмінностей не спостерігають в 14 спектрах зразків, для 1 і 4 тижнів вивчення стабільності і 14 спектра, отриманого в момент часу нуль. Якої-небудь взаємодії між безводною формою, лактозою і стеаратом магнію не спостерігається, і безводна форма залишається стабільною для всіх умов зберігання. XPDR спектри, отримані для моменту часу нуль, подані на фіг. 3. Спектри порошкової дифракції рентгенівських променів отримують для зразків, використаних в дослідженнях стабільності. Отримані картини порошкової дифракції рентгенівських променів для зразків дослідження стабільності протягом 1 і 4 тижнів були ідентичні дифракційній картині для моменту часу нуль. Абсолютно очевидно, що характеристичні дифракційні піки безводної форми не змінюються в присутності Lactohale200® і стеарату магнію, свідчачи про те, що безводна форма є стабільною в присутності лактози і стеарату магнію. 14 спектри не виявляють взаємодії між безводною формою, лактозою і стеаратом магнію, і результати порошкової дифракції рентгенівських променів свідчать про те, що перетворення твердого стану безводної форми відсутнє. У результаті можна зробити висновок, що безводна форма є фізично сумісною з лактозою і стеаратом магнію. Приклад 6 - ВЕРХ аналіз сполуки формули (І) в безводній формі з лактозою і стеаратом магнію Хімічну сумісність твердої кристалічної безводної форми (мікронізованої) сполуки формули (І) в комбінації з лактозою і 1% стеарату магнію визначають за даними ВЕРХ аналізу (мікронізацію сполуки формули (І) здійснюють за способом прикладу 4). Порція, що тестується, яку відбирають з початкової маси, містить 3,704 мг безводної форми сполуки формули (І) (мікронізованої), 6017,90 мг Lactohale200 і 67,33 мг стеарату магнію. 18 UA 115544 C2 5 Представлені в таблиці 3 результати свідчать про значне підвищення хімічної стабільності в порівнянні зі стабільністю тієї ж композиції за відсутності стеарату магнію (див. таблицю 2), доказом є тільки невелика кількість речовини, що розклалася, що спостерігається після зберігання протягом 1 тижня при 80 °C (див., наприклад, RRT 0,86, 0,28%). Представлені результати передбачають, що хімічна стабільність безводної форми (мікронізованої) сполуки формули (І) з лактозою істотно підвищується при доданні до вказаної композиції стеарату магнію. Як таке, додання стеарату магнію поліпшує хімічну сумісність безводної форми (мікронізованої) сполуки формули (І) в комбінації з лактозою, так що вони повинні бути сумісні в фармацевтичній лікарській формі. 10 Таблиця 3 Результати дослідження стабільності для безводної форми сполуки формули (І) (мікронізованої) з лактозою і стеаратом магнію RRT* 0,80 0,21 0,20 0,19 0,20 0,20 0,21 0,20 0,20 0,19 0,20 Умови Т=нуль 1 тиждень 50 °C 1 тиждень 80 °C 1 тиждень 40 °C/75% відн. вол. 2 тижні 50 °C 2 тижні 40 °C/75% відн. вол. 3 тижні 50 °C 3 тижні 40 °C/75% відн. вол. 4 тижні 50 °C 4 тижні 40 °C/75% відн. вол. RRT* 0,86 0,10 0,11 0,28 0,11 0,08 0,11 0,13 0,11 0,12 0,10 RRT* 1Д4 0,12 0,11 0,11 0,11 0,11 0,11 0,11 0,11 0,11 0,10 RRT* 1,32 0,13 0,13 0,13 0,13 0,14 0,13 0,13 0,14 0,14 0,13 * Вказаний % площі за даними ВЕРХ для RRT. Сполука формули (1) має RRT=1,0 15 Приклад 7 - НЕРХ аналіз сполуки формули (І) в безводній формі з лактозою і металевими солями стеаринової кислоти Хімічну сумісність твердої кристалічної форми (мікронізованої) сполуки формули (І) в комбінації з лактозою і 1% металевими солями стеаринової кислоти (стеарат магнію, стеарат натрію і стеарат кальцію) визначають, використовуючи дані НЕРХ аналізу (мікронізацію сполуки формули (І) здійснюють за способом прикладу 4). Зразки, що тестуються, готують способом, приведеним в таблиці 4 нижче. Таблиця 4 Зразки, що тестуються, для НЕРХ аналізу після прискореного тесту на стабільність Тверда кристалічна безводна форма Зразок сполуки формули (І) (мікронізована) зразок І/зразок 2 Тільки лікарський засіб 0,50 мг/0,47 мг Лікарський засіб і лактоза 0,58 мг/0,47 мг Лікарський засіб, лактоза, 0,46мг/0,51 мг стеарат Mg Лікарський засіб, лактоза, 0,49 мг/0,45 мг стеарат Са Лікарський засіб, лактоза, 0,48 мг/0,45 мг стеарат Na Lactohale200 зразок 1/ зразок 2 Металева сіль стеаринової кислоти зразок 1/ зразок 2 749,84 мг/750,06 мг 749,97 мг/751, 59 мг 7,40 мг/7,55 мг 751,08мг/753,53мг 7,67 мг/7,80 мг 750,20 мг/750,42 мг 7,78 мг/7,59 мг 20 Зразки вміщують в ампули, закривають кришками і зберігають при 80 °C протягом 1 або 2 тижнів. Зразок 1 використовують для 1 тижневих досліджень, і зразок 2 використовують для 2 тижневих досліджень. 19 UA 115544 C2 Результати представлені в таблиці 5 нижче. Таблиця 5 Результати НЕРХ аналізу після прискореного тестування стабільності Зразок Тільки лікарський засіб Лікарський засіб і лактоза Лікарський засіб, лактоза, стеарат Mg Лікарський засіб, лактоза, стеарат Са Лікарський засіб, лактоза, стеарат Na 1 тиждень 80 °C 1 тиждень 80 °C RRT* 0,87 RRT* 0,92 0,00 0,08 0,58 0,39 2 тижні 80 °C RRT* 0,87 0,00 1,80 2 тижні 80 °C RRT* 0,92 0,08 0,77 0,28 0,29 0,06 0,18 0,11 0,19 0,17 0,19 0,00 0,09 0,00 0,09 * Вказаний % площі за даними ВЕРХ для RRT. Сполука формули (І) має RRT=1,0 5 Результати мас-спектроскопічного аналізу свідчать про те, що речовина з RRT=0,87 являє собою D019493, і речовина з RRT-0,92 являє собою D019492 (підтверджене даними ЯМР) (див. схему 1). Віднесення даних ЯМР для DO 19492 представлені в таблиці 6: Таблиця 6 1 Розподіл сигналів в спектрі Н ЯМР для D019492 1 DO 19492 10 15 20 25 H ЯМР (600 МГц, ДМСО-о!6) δ м.ч. 1,59 (квін., J=7,30 Гц, 2Н) 2,20 (т, J=7,55 Гц, 2Н) 2,46-2,49 (м, 2Н) 3,18 (д, J=7,90 Гц, 6Н) 3,29-3,39 (м, 8Н) 4,23 (с, 2Н) 5,24 (с, 2Н) 5,76 (с, 2Н) 6,08 (д, J=7,55 Гц, 1Н) 6,75 (т, J=7,55 Гц, 1Н) 6,83 (дд, J=8,12, 1,70 Гц, 1Н) 6,90 (д, J7,55 Гц, 1Н) 6,91-6,93 (м, 1Н) 7,01 (τ, J=7,55 Гц, 1Н) 7,09 (д, J=7,55 Гц, 1Н) 7,29 (м, J=7,93, 7,93 Гц, Ш) 7,32 (д, J=7,18 Гц, 1Н) 7,66 (д, J-7,93 Гц, 1Н) 7,777,82 (м, Ш) 8,17 (с, Ш) 9,67 (с, 1Н) Результати, представлені в таблиці 5, свідчать про значне підвищення хімічної стабільності лікарських форм, що містять металеві солі стеаринової кислоти, в порівнянні з такими ж композиціями без металевих солей стеаринової кислоти, про що свідчить відносно невелика кількість продуктів розкладання після зберігання протягом 1 або 2 тижнів при 80 °C. Отримані результати дозволяють передбачити, що хімічна стабільність безводної форми сполуки формули (І) з лактозою істотно підвищена за рахунок додання до вказаної композиції металевих солей стеаринової кислоти. Тому додання металевих солей стеаринової кислоти поліпшує хімічну сумісність безводної форми сполуки формули (І) в комбінації з лактозою, так що вони можуть бути сумісні в фармацевтичній лікарській формі. Приклад 8 - Отримання фармацевтичних композицій згідно з способом даного винаходу Ілюстративна фармацевтична лікарська форма даного винаходу складається з 0,5% мас. сполуки формули (І) (тверда кристалічна безводна форма, мікронізована), 98,5% мас. моногідрату лактози (інгаляційної міри чистоти) і 1,0% мас. стеарату магнію, де % мас. всіх компонентів дані з розрахунку на масу сухої фармацевтичної лікарської форми. У всьому описі і в формулі винаходу, якщо з контексту не випливає інше, потрібно розуміти, що слово «включають», і такі варіанти, як «включає» і «що включає», означають включення вказаного об'єкта, стадії, групи об'єктів або груп стадій, але не виключення якого-небудь іншого об'єкта, стадії, групи об'єктів або груп стадій. 20 UA 115544 C2 ФОРМУЛА ВИНАХОДУ 5 1. Спосіб підвищення стабільності до хімічного розкладання фармацевтичної композиції, що містить як активний інгредієнт сполуку формули (І): O OMe N OMe O Cl N N N N N N HO 10 15 20 25 30 H2N , (I) яка являє собою 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2хлоробензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід або його фармацевтично прийнятну сіль, який відрізняється тим, що включає включення до вказаної композиції стабілізуючої кількості подрібненого стабілізуючого агента, вибраного з металевих солей стеаринової кислоти, таких як стеарат магнію, і металевих солей стеарилфумарату. 2. Спосіб за п. 1, який відрізняється тим, що сполука формули (І) знаходиться в формі її вільної основи. 3. Спосіб за п. 2, який відрізняється тим, що сполука формули (І) знаходиться в твердому стані та кристалічній безводній формі. 4. Спосіб за п. 3, який відрізняється тим, що сполука формули (І) знаходиться в твердому стані, кристалічній формі та має порошкову рентгенівську дифрактограму, яка містить один, два, три або чотири піки, вибрані з (±0,2) 17,6, 18,4, 22,5 і 24,2градуса 2-тета. 5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що вказаний стабілізуючий агент являє собою металеву сіль стеаринової кислоти. 6. Спосіб за п. 5, який відрізняється тим, що металева сіль стеоринової кислоти являє собою стеарат магнію. 7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що активний інгредієнт мікронізований. 8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що вказана лактоза являє собою моногідрат -лактози. 9. Застосування подрібненого стабілізуючого агента, вибраного з металевих солей стеаринової кислоти і металевих солей стеарилфумарату, в фармацевтичній композиції, що містить, як активний інгрідієнт, сполуку формули (І): 21 UA 115544 C2 O OMe N OMe O Cl N N N N N N HO 5 10 15 H2N , (I) яка являє собою 6-(2-((4-аміно-3-(3-гідроксифеніл)-1Н-піразоло[3,4-d]піримідин-1-іл)метил)-3-(2хлоробензил)-4-оксо-3,4-дигідрохіназолін-5-іл)-N,N-біс(2-метоксіетил)гекс-5-инамід або його фармацевтично прийнятну сіль, для підвищення стабільності сполуки формули (І) до хімічного розкладання. 10. Застосування за п. 9, яке відрізняється тим, що вказана сполука формули (І) знаходиться в формі її вільної основи. 11. Застосування за п. 10, яке відрізняється тим, що вказана сполука формули (І) знаходиться в твердому стані, кристалічній безводній формі. 12. Застосування за п. 10, яке відрізняється тим, що вказана сполука формули (І) знаходиться в твердому стані, кристалічній формі та має порошкову рентгенівську дифрактограму, яка містить один, два, три або чотири піки, вибрані з (±0,2) 17,6, 18,4, 22,5 і 24,2 градуса 2-тета. 13. Застосування за будь-яким з пп. 9-12, яке відрізняється тим, що вказаний стабілізуючий агент являє собою металеву сіль стеаринової кислоти. 14. Застосування за п. 13, яке відрізняється тим, що вказана металева сіль стеоринової кислоти являє собою стеарат магнію. 15. Застосування за будь-яким з пп. 9-14, яке відрізняється тим, що вказана лактоза являє собою моногідрат -лактози. 22 UA 115544 C2 23 UA 115544 C2 Комп’ютерна верстка О. Рябко Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel pharvaceutical formulations
Автори англійськоюBroeckx, Rudy, Laurent, Maria, Filliers, Walter, Ferdinand, Maria, Nieste, Patrick, Hubert, J., Copmans, Alex, Herman, Vanhoutte, Filip, Marcel, C., Leys, Carina
Автори російськоюБрукс Руди Лорэнт Мария, Фильерс Вальтэр Фердинанд Мария, Нистэ Патрик Хуберт Дж., Копманс Алекс Герман, Ванхутт Филип Марсэль С., Лэйс Карина
МПК / Мітки
МПК: A61K 9/00, C07D 487/04, A61K 47/12, A61K 47/26
Мітки: фармацевтичний, застосування, фармацевтично, стабільності, спосіб, підвищення, композиції, хімічного, розкладання, стабілізуючого, коипозиції, агента
Код посилання
<a href="https://ua.patents.su/26-115544-sposib-pidvishhennya-stabilnosti-do-khimichnogo-rozkladannya-farmacevtichno-kompozici-ta-zastosuvannya-stabilizuyuchogo-agenta-u-farmacevtichnijj-koipozici.html" target="_blank" rel="follow" title="База патентів України">Спосіб підвищення стабільності до хімічного розкладання фармацевтичної композиції та застосування стабілізуючого агента у фармацевтичній коипозиції</a>
Попередній патент: Композиція у вигляді сухого порошку, яка містить кортикостероїд та бета-адренергічний препарат, для інгаляції
Наступний патент: Транзитний пептид хлоропластів та спосіб його одержання
Випадковий патент: Харчова композиція












