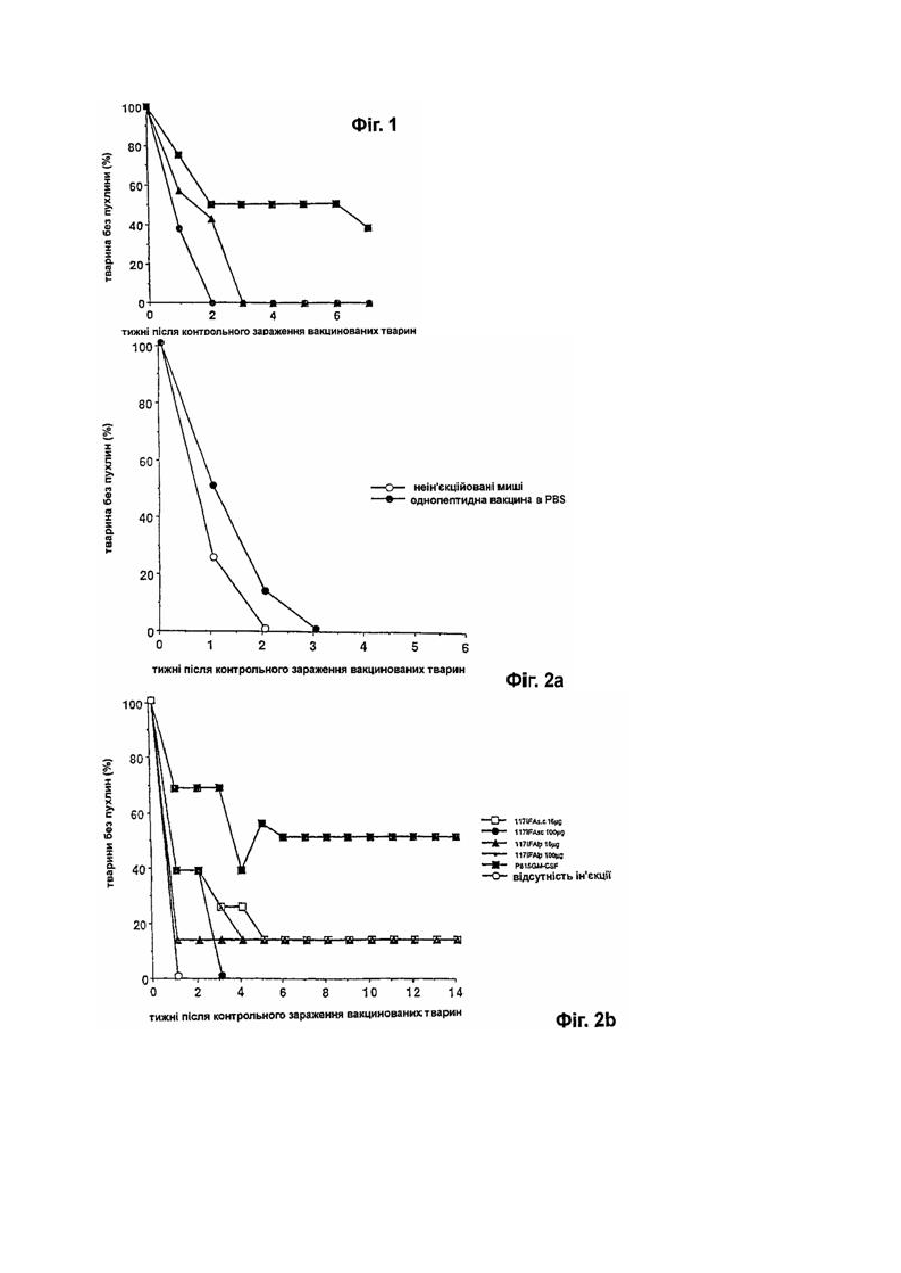
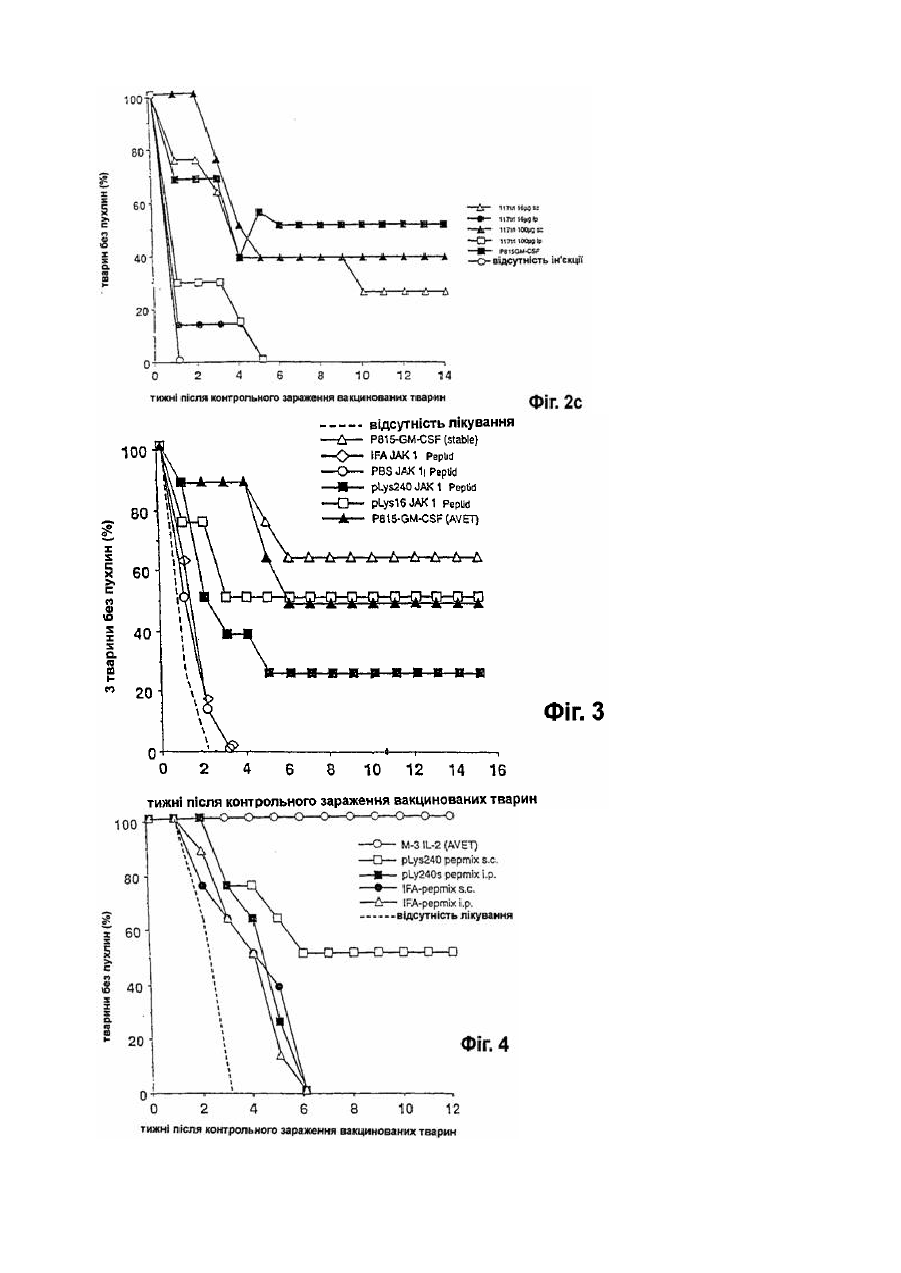
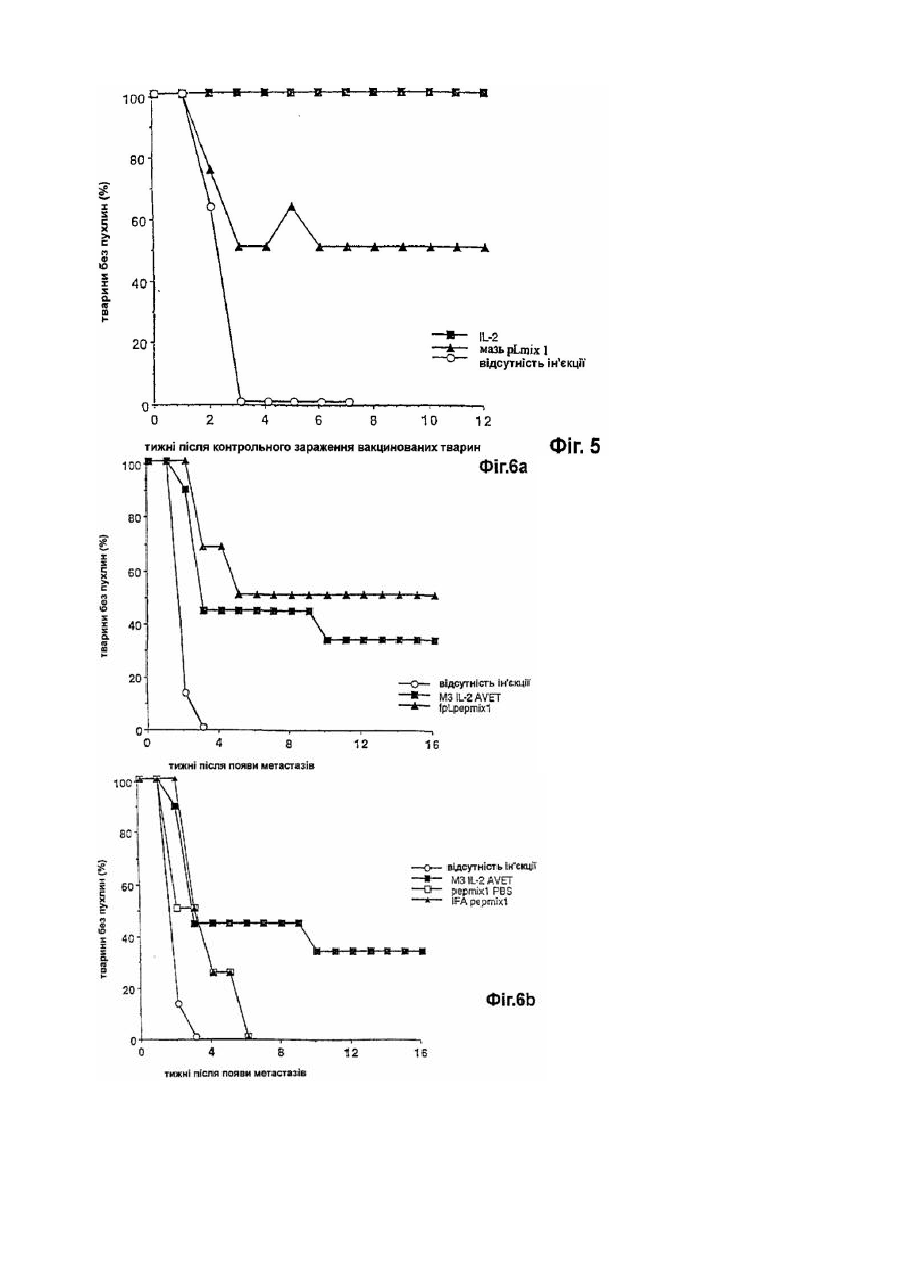
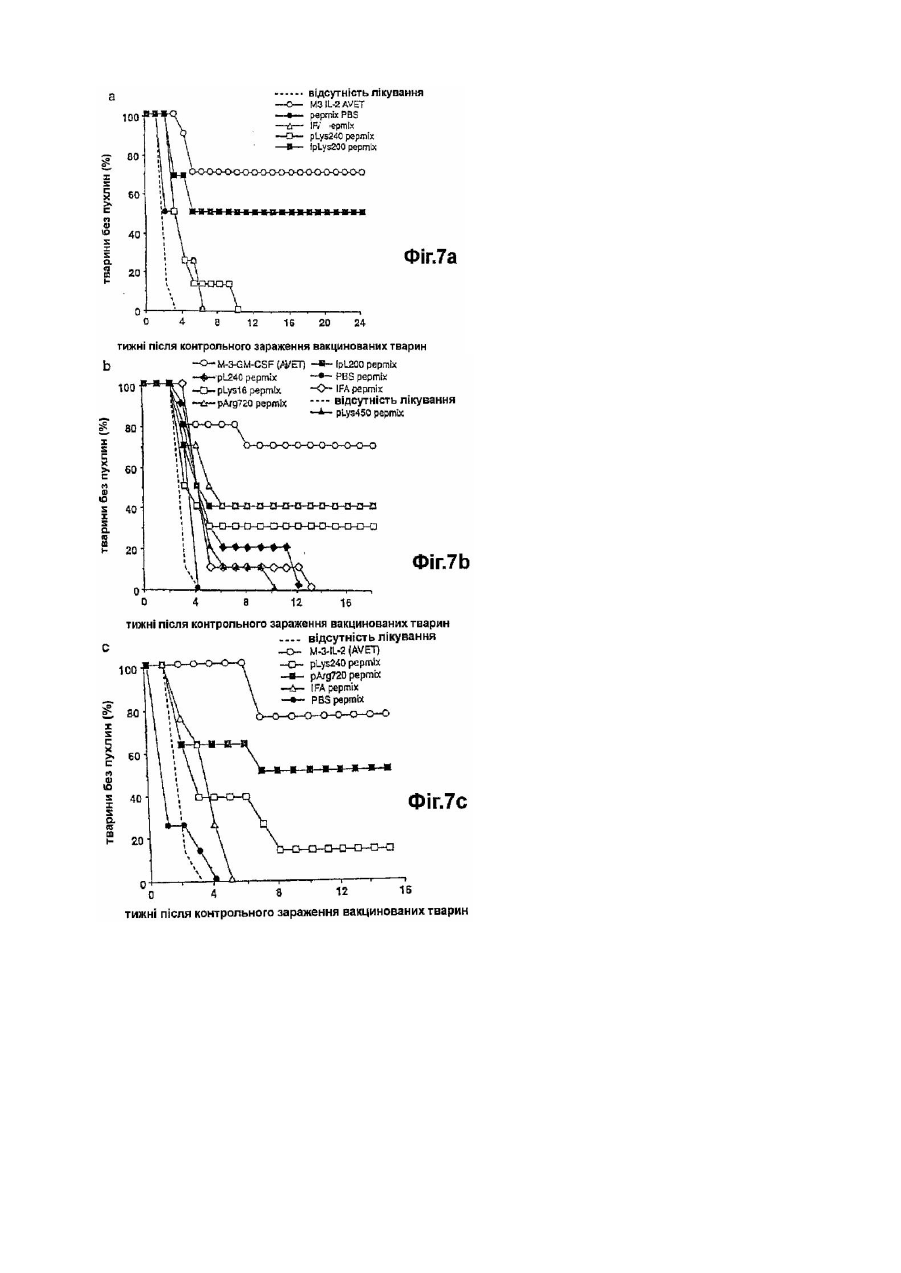
Фармацевтична композиція для імуномодуляції на основі пептидів і ад’ювантів
Номер патенту: 62927
Опубліковано: 15.01.2004
Автори: Бірнштіль Макс, Штайнлайн Петер, Швайгхоффер Томас, Шмідт Валльтер, Бушле Міхаель
Формула / Реферат
1. Фармацевтична композиція для імуномодуляції, яка містить, щонайменше, один пептид імуномодуляторної дії у сполученні з допоміжним засобом, яка відрізняється тим, що пептид є лігандом для, принаймні однієї МНС- або HLA-молекули, що експримується організмом індивідуума, який підлягає впливу, а допоміжний засіб забезпечує збільшення ступеня зв'язування пептидів з клітинами організму індивідуума і підсилення проникнення в клітини, а також підсилення імуномодуляторного ефекту пептидів.
2. Фармацевтична композиція за п.1, яка відрізняється тим, що пептид є лігандом для МНС-1-молекули.
3. Фармацевтична композиція за п.1, яка відрізняється тим, що пептид є лігандом для МНС-ІІ-молекули.
4. Фармацевтична композиція за п.1, яка відрізняється тим, що пептид є лігандом для НLA-A2-молекули.
5. Фармацевтична композиція за будь-яким з пунктів 1-4, яка відрізняється тим, що вона містить пептид, виділений із білка патогенного збудника.
6. Фармацевтична композиція за п.5, яка відрізняється тим, що пептид виділений із бактеріального білка.
7. Фармацевтична композиція за п.5, яка відрізняється тим, що пептид виділений із вірусного білка.
8. Фармацевтична композиція за одним з пп.1-4, яка відрізняється тим, що вона містить пептид, виділений з пухлинних антигенів.
9. Фармацевтична композиція за п.8, яка відрізняється тим, що пухлинні антигени виділені з пухлинних антигенів, які експримовані з організму індивідуума, що підлягає впливу.
10. Фармацевтична композиція за п.8, яка відрізняється тим, що пухлинні антигени виділені з антигенів, що часто зустрічаються.
11. Фармацевтична композиція за одним з пп.8-10, яка відрізняється тим, що пухлинні антигени являють собою антигени меланоми.
12. Фармацевтична композиція за одним з пп.1-11, яка відрізняється тим, що містить декілька пептидів, які характеризуються тим, що вони зв'язують різні види МHС з організмів індивідуумів, що підлягають впливу.
13. Фармацевтична композиція за одним з пп.1-11, яка відрізняється тим, що містить один або декілька пептидів, які виділені з імуногенного білка, або білка пухлини, або продукту їх розпаду, що мають природне походження.
14. Фармацевтична композиція за одним з пп.1-11, яка відрізняється тим, що вона містить один або декілька пептидів, відмінних від пептидів, що мають походження від імуногенного білка (білків) або антигена (антигенів) пухлини природного походження або продукту (продуктів) їх розпаду.
15. Фармацевтична композиція за п.1, яка відрізняється тим, що пептид являє собою антагоніст пептиду, який виділений із білка, що спричиняє аутоімунні захворювання.
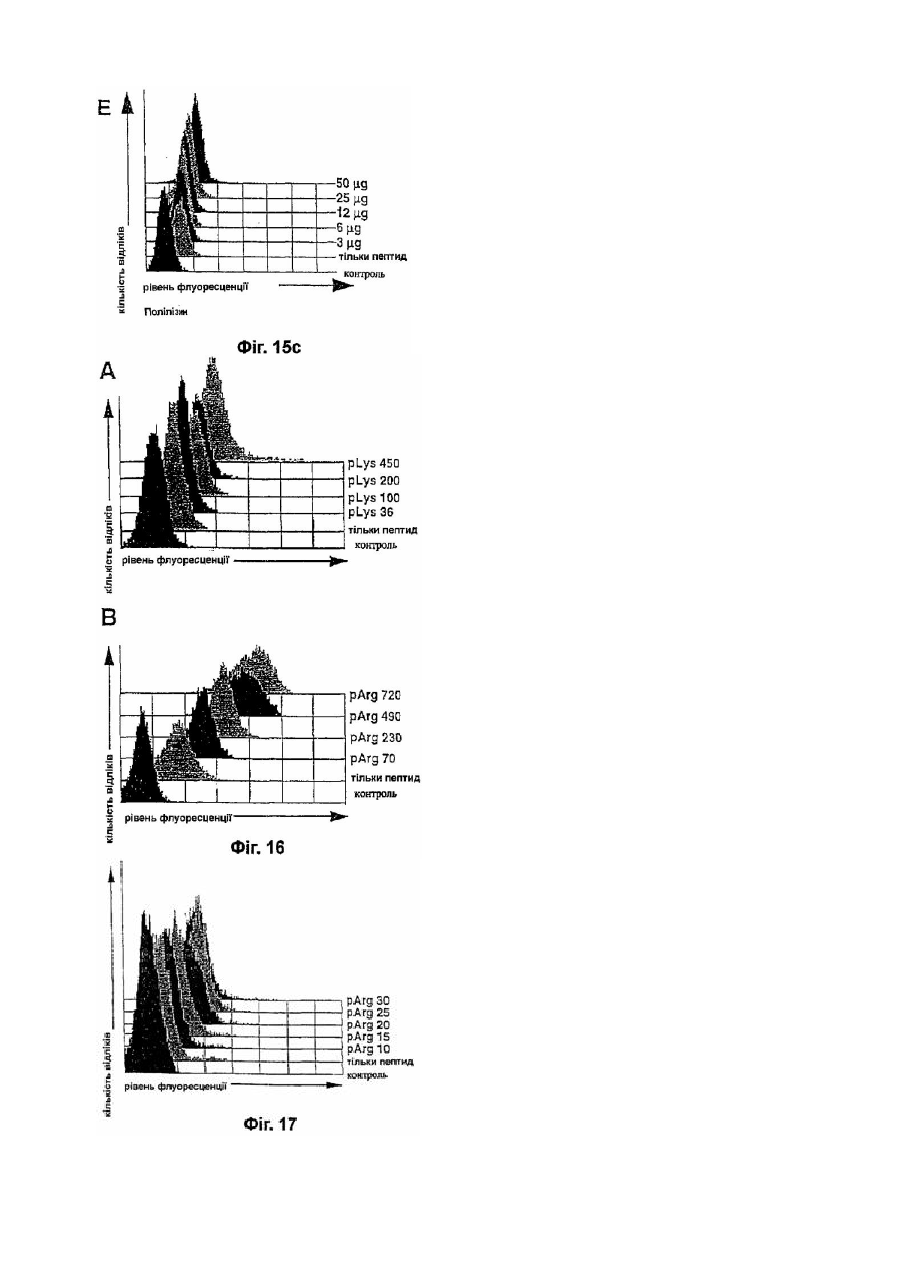
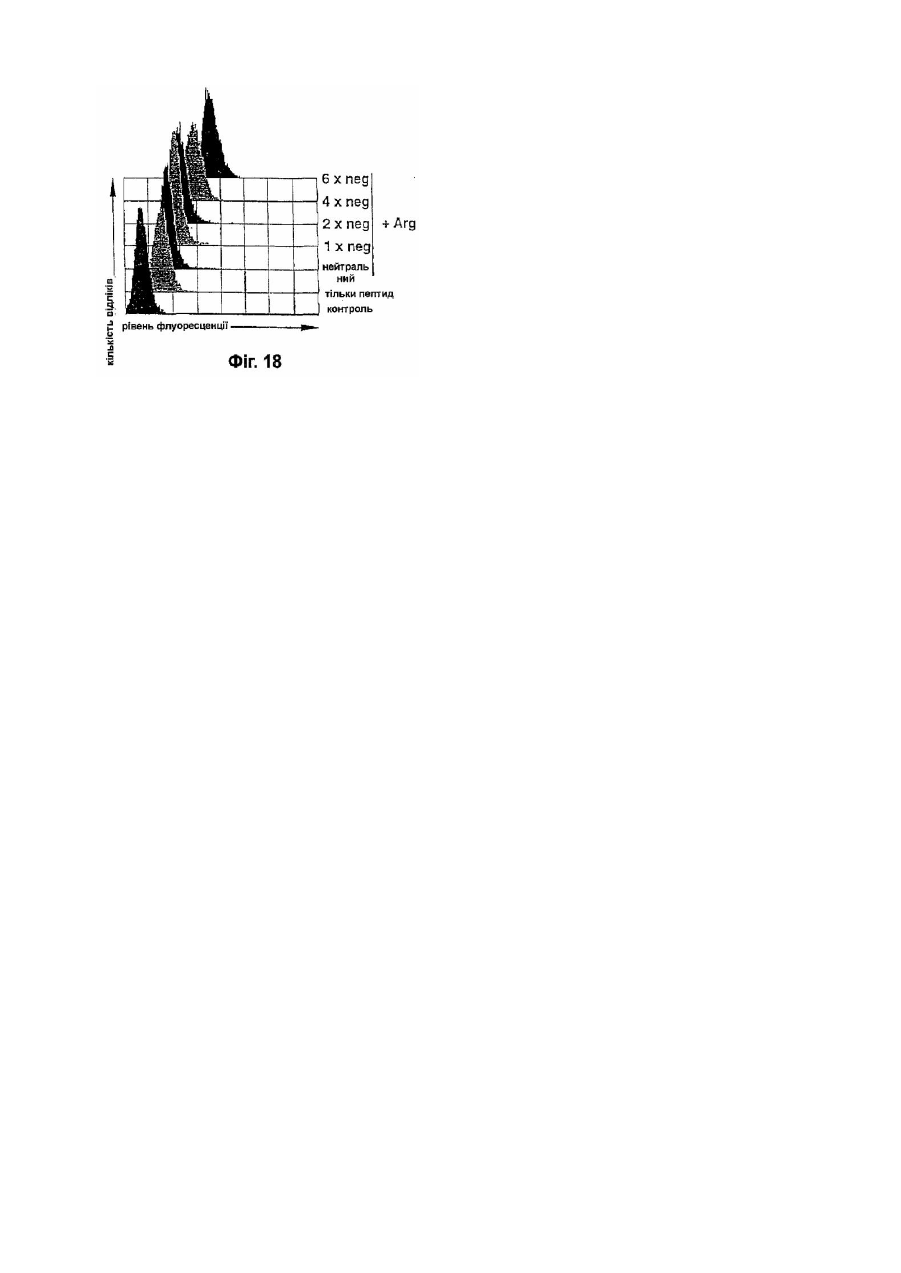
16. Фармацевтична композиція за одним з пп.1-15, яка відрізняється тим, що допоміжний засіб являє собою органічний полікатіон або суміш органічних полікатіонів.
17. Фармацевтична композиція за п.16, яка відрізняється тим, що пептид має негативний заряд.
18. Фармацевтична композиція за п.16 або 17, яка відрізняється тим, що як допоміжний засоб вона містить основні поліамінокислоти або їх суміш.
19. Фармацевтична композиція за п.18, яка відрізняється тим, що допоміжний засіб являє собою поліаргінін.
20. Фармацевтична композиція за п.18, яка відрізняється тим, що допоміжний засіб являє собою полілізин.
21. Фармацевтична композиція за одним з пп. 16-20, яка відрізняється тим, що допоміжний засіб кон'югований з клітинними лігандами.
22. Фармацевтична композиція за п.21, яка відрізняється тим, що ліганд являє собою вуглеводний залишок.
23. Фармацевтична композиція за п.22, яка відрізняється тим, що ліганд являє собою фукозу.
24. Фармацевтична композиція за п.21, яка відрізняється тим, що ліганд являє собою трансферин.
25. Фармацевтична композиція за одним з пп.1-24, яка відрізняється тим, що для парентерального введення вона являє собою розчин або суспензію пептидів і допоміжного засобу у фармацевтично прийнятному носії.
26. Фармацевтична композиція за одним з пп.1-24, яка відрізняється тим, що для місцевого застосування вона являє собою гідрогель.
Текст
Винахід стосується області імуномодуляції і являє собою подальші розробки в області терапевтичних вакцин на основі пухлинних клітин, які, головним чином, засновані на таких передумовах: існуванні якісної і кількісної різниці між пухлинними і нормальними клітинами; на тому, що імунна система має принципову властивість розпізнавати цю різницю; на тому, що імунна система може бути стимульована (за допомогою імунізації за допомогою вакцин) для розпізнавання пухлинних клітин на основі цієї різниці. Для того, щоб домогтися протипухлинної реакції, потрібно виконати, щонайменше дві умови. По-перше, необхідно експримувати антиген проти пухлинних клітин, який не зустрічається в нормальних клітинах або зустрічається обмежено, для того, щоб стала можливим якісна різниця між нормальною тканиною і тканиною пухлини. По-друге, потрібно відповідно активізувати імунну систему, щоб вона реагувала на цей антиген. Істотне утр уднення в імунотерапії пухлин перебуває в незначній імуногенності, насамперед людини. На ранніх етапах виявляють антигени, що асоціюються з пухлинами і специфічні для пухлин, які являють собою нео-епітопи і можуть бути потенційними цілями для атаки імунної системи. Якщо імунній системі не вдасться усунути пухлини, які експримують ці нео-епітопи, то це пояснюється недостатністю імунної відповіді на нео-антиген, а не є недоліками нео-епітопів. В імунотерапії раку на клітинній основі розвиваються дві загальні стратегії: з одного боку, адаптивна імунотерапія, яка використовує розвиток in vitro реактивних у відношенні пухлини Т-лімфоцитів і їх повторне введення пацієнтам; з іншого боку, активна імунотерапія, що використовує п ухлинні клітини, в очікуванні викликати або нову, або посилену імунну відповідь, яка приведе до системної відповіді пухлини. Протипухлинні вакцини на основі активної імунотерапії одержують різними способами; прикладом є опромінені пухлинні клітини, які заміщаються допоміжними імунностимулюючими засобами, такими як Coryntbakterbum parvum або Bacillus Calmette Guerin (BCG), щоб викликати імунну реакцію на антиген пухлини (Oettgen і Old, 1991). Останнім часом в активній імунотерапії проти раку використовують генетично модифіковані пухлинні клітини. Огляд різних спроб відчуження пухлинних клітин шляхом посилення імуногенності за рахунок уведення різних генів дається в Zatloukal і ін., 1993. Один з раніше відомих напрямків передбачає використання пухлинних клітин, які генетично модифікуються для продукування цитокіну. Ідентифікування й ізолювання антигенів пухлини й асоційованих із пухлиною антигенів (Tas), а також пептидів, що виділяються з них, (наприклад, описані в Wolfe! і ін., 1994а і 1994b; Carrel і ін. 1993, Lehman і ін., 1989, Tib-bets і ін. 1993, або описані в різних опублікованих міжнародних заявках WO 92/20356, WO 94/05304 WO 94/23031, WO 95/00159) є передумовою розробки подальшого напрямку застосування антигенів пухлини в якості імуногенів для вакцини проти пухлини, причому як у вигляді білків, так і у вигляді пептидів. З робіт Boon і ін., 1992; Boon і ін., 1994; Boon і ін., 1995; van Peel і ін. 1995; Van der Eynde, 1995 відомо, що злоякісну меланому представляють пептиди, що виділяються з пухлинних антигенів, у МНС-1відношенні. За допомогою протипухлинної вакцини, що представляє собою антигени пухлини як такі, дотепер не була досягнута імуногенність, достатня для того, щоб викликати клітинну імунну відповідь, яка потрібна для знищення пухлинних клітин, що містять антиген пухлини (Marchand і ін., 1995). Для досягнення того, щоб клітини, що представляють антиген ("Antigenpresenting cells", "APCs"), несли на своїй поверхні певний пептидний антиген, пропонувалося "додати пульсацію" пептидам, що в результаті приводить до наповнення клітин пептидами (Tykocinski і ін., 1996). Було також відзначено, що спільне застосування допоміжних засобів лише відносно підсилює імунну відповідь (Oettgen і Old, 1991). Третій напрямок в активній імунотерапії, що ставить завдання посилення ефективності протипухлинних вакцин, базується на ксеногенізованих (відчужених) пухлинних клітинах. Ця концепція заснована на передумові, що імунна система реагує на пухлинні клітини, які експримують сторонній білок, і в зв'язку з цим реагуванням визивається імунна відповідь проти тих антигенів, які поставляються пухлинними клітинами вакцини. Центральну роль у регулюванні специфічної імунної відповіді грає тримолекулярний комплекс, що складається з компонентів: антиген-рецептора Т-клітини, МНС (Major-Histocompatability Сотріех)-молекули і її лігандів, і є пептидним фрагментом, виділеним із білка. МНС-молекули (і відповідні молекули HLAs) являють собою пептид-рецептори, які при обов'язковій специфічності забезпечують зв'язування багатьох різних лігандів. Передумовою цього є алель-специфічні пептидні мотиви, які виявляють такі критерії специфічності: пептиди мають певну довжину, в залежності від МНС-гаплотипу, для МНС-1-гаплотипу, як правило, від восьми до десяти амінокислотних залишків. Звичайно дві з позицій амінокислотних залишків утворять так називаний "анкер", який через одну амінокислоту або через амінокислотний залишок оточений близько-спорідненими бічними ланцюгами. Точне положення анкерних амінокислот у пептиді і вимоги до їх властивостей варіюються в залежності від МНС-гаплотипів. С-термін пептидних лігандів являє собою часто аліфатичний або заряджений залишок. Такі МНС-пептид-лигандні компоненти відомі дотепер стосовно до Н-2Кd, Кb, Kk, Kkml, DЬ, HLA-A*0201, А*0205 і В*2705 гаплотипам. У рамках білкового обміну всередині клітини невироджені, вироджені і сторонні генні компоненти, наприклад, вірусні білки або антигени пухлини, розкладаються на дрібні пептиди, деякі з яких являють собою потенційні ліганди для МНС-молекул. Цим створюється передумова для їхнього пред'явлення через МНС-молекули, наслідком чого є клітинна імунна відповідь, причому, зокрема ще не до кінця вияснено, яким чином пептиди виробляються в клітині в якості МНС-лігандів. Сторонні або відчужені білки і їх фрагменти можуть бути розпізнані, зв'язані й усунуті за допомогою імуноглобуліну, що представляє імунну відповідь. Це стосується також всіх антигенів пухлини: на прикладі антигенів MUC1, СЕА і НЕР2/новий, що асоціюються з пухлинами, доведено, що імуноглобуліни, які проявляють себе специфічно щодо цих білків, можуть розпізнавати й умертвляти клітини, що містять білок. Щоб викликати специфічний пухлинноантигенну імунну відповідь були випробувані різні форми MUC1 і СЕА в якості імуногенів (наприклад, у рекомбінованик поксвекторах; Bronte і ін., журнал Immunol. 154: 5282, 1995) у дослідах на тваринних і при попередніх випробуваннях. У рамках запропонованого винаходу були продовжені міркування, використовувані при розробках клітинної протипухлинної вакцини: у той час, коли незлоякісні, нормальні клітини організму допускаються імунною системою, організм реагує на нормальну клітину, якщо вона, наприклад, на основі вірусної інфекції синтезує сторонні організму білки з імунозахистом. Причиною цього є те, що МНС-молекули представляють сторонні пептиди, які відносяться до сторонніх організму білків. Як наслідок імуносистема відзначає, що з цією клітиною відбувається щось небажане, чужорідне. APCs (сюди відносяться макрофаги.дендритні клітини, клітини Лангергана, В-клітини, а також, можливо, недавно відкриті біфенотипові клітини, які виявляють властивості як В-клітин, так і макрофагів; Tykocinski і ін., 1996) активуються,генерують новий специфічний імунітет і елімінують клітину. Пухлинні клітини містять відповідні специфічні для пухлини антигени пухлини, які не є достатньою вакциною, тому що на підставі їх незначної імуногенності ігноруються імунною системою. Якщо пухлинна клітина навантажена не стороннім білком, а стороннім пептидом, то додатково до сторонніх пептидів також і власні антигени пухлини цієї клітини сприймаються як сторонні. У результаті такого відчуження за допомогою пептиду можна досягти того, що викликана сторонніми пептидами клітинна імунна відповідь буде звернена проти антигенів пухлини. Причина незначної імуногенності пухлинних клітин може бути не тільки якісною, але і кількісною проблемою. Для пептиду, одержаного від антигену пухлини, це може означати, що він поданий МНСмолекулами, однак у концентрації, що є незначною, щоб викликати клітинну специфічну для пухлини імунну відповідь. Збільшення кількості специфічних для пухлини пептидів на пухлинній клітині повинно сприяти відчуженню пухлинної клітини, що веде до клітинної імунної відповіді. Було запропоновано антиген пухлини або одержаний із нього пептид представити на поверхні клітини, щоб він передавався за допомогою ДНК, що кодує відповідний білок або пептиду, як описано в міжнародних заявках WO 92/20356, WO 94/05303, WO 94/23031 і WO 95/00159. У німецькій заявці на патент Ρ 19543649.0 представллена клітинна вакцина, що містить в якості активного компонента пухлинні клітини, навантажені одним або декількома пептидами таким чином, що пухлинні клітини разом із пептидами розпізнаються імунною системою індивідуума як сторонні, тому що вони можуть бути з одного боку "сторонніми пептидами" або "ксенопептидами" - це значить, що вони відмінні від пептидів, отриманих від білків, які експримовані пухлинними клітинами індивідуума. Інша категорія пептидів отримана від антигенів пухлини, які експримовані клітинами індивідуума. Ці пептиди іншої категорії сприяють підвищенню імуногенності внаслідок того, що вони існують на пухлинних клітинах вакцини в концентрації, яка вище, ніж концентрація тих же пептидів на пухлинних клітинах індивідуума. В основі запропонованого винаходу лежить задача створити нову лікарську композицію, зокрема, вакцину з імуномодуляторним ефектом. У розвитку концепції клітинної вакцини, опублікованої в німецькій заявці на патент Ρ 19543649.0, у рамках запропонованого винаходу розглядається лікарська композиція, що містить пептиди з імуномодуляторною дією не з клітинами, а в сполученні з допоміжним засобом, щоб викликати або підсилити клітинну і/або гуморальну, переважно системну імунну відповідь, на патогенні збудники або антипухлинну реакцію або викликати толерантність проти білків з автоімунною дією. Несподівано було встановлено, що певні допоміжні засоби, наприклад, полікатіони, про які стало відомо в 1965 році, можуть сприяти переносу білків у клітинах (Ryser і ін., 1965; Ryser і ін., 1978; Shen і ін., 1981), підвищують імуногенність пептидів. Винахід стосується лікарської композиції, що містить один або більш пептидів з імуномодуляторною дією, білки і фрагменти білка в сполученні з допоміжним засобом. Композиція відрізняється тим, що допоміжний засіб має здатність збільшувати ступінь зв'язування пептиду, білка або фрагмента білка з клітинами організму підлягаючого лікуванню індивідуума або збільшувати ступінь проникнення в клітини і сприяти посиленню імуномодуляторного ефекту пептидів, білків або фрагментів білків. Надалі для стислості пептиди з імуномодуляторною дією, білки або фрагменти білка будуть позначені як "пептиди". Термін "пептид", якщо він не стосується безпосередньо лігандів, може тимчасово позначати фрагменти білків або білки, від яких отриманий пептид, або являє собою продукт клітинного розпаду. Під "імуномодуляторною дією" розуміється виникнення або посилення клітинної і/або гуморальної, переважно системної, імунної відповіді. У цій формі реального втілення лікарська композиція, згідно з винаходом, діє як вакцина. У кращій формі виконання пептиди є лігандами для, щонайменше, однієї МНС-молекули, яка експримується організмом підлягаючого лікуванню індивідуума. МНС-молекули людини, відповідно до міжнародних традицій, надалі будуть позначений як "HLA" (Антиген лейкоцита людини). Під "клітинною імунною відповіддю" варто розуміти, насамперед, цитотоксичний Т-клітинний імунітет, який внаслідок генерування цитотоксичних СР8-позитивних Т-клітин і СР4-позитивних помічників-Т-клітин сприяє руйнуванню пухлинних клітин або клітин, уражених патогенним збудником. Під "гуморальною імунною відповіддю" варто розуміти виробітку імуноглобулінів, які селективно розпізнають пухлинні клітини або структури, створені патогенними збудниками, і, надалі, разом з іншими системами, як наприклад, доповнення, ADCC (Цитотоксичність, що залежить від антитіл) або фагоцитоз, сприяють руйнуванню цих п ухлинних клітин, патогенних збудників або уражених ними клітин. Пептид, що міститься у вакцині, одержують від антигену або він являє собою, у випадку з білком, антиген, проти якого повинна бути викликана клітинна і/або гуморальна імунна відповідь. Цим досягається той результат, що Т-клітини розпізнають відповідно інші цитотоксичні ефекторні клітини, що містять збудник хвороби, пухлинні клітини, що містять антиген, і/або генерують антитіла. Для імунізації проти збудників хвороб, таких як бактерії, віруси, паразити, застосовують білки або пептиди, що являють собою білок відповідного збудника або отримані від нього. Насамперед, для цієї мети підходять білки, що залишаються неушкодженими високими мутаційними скупченнями цих збудників. Наприклад, HPV16/17 (Human Pappiloma Vims; Feltkamp і ін.,1995); Hepatitis В Virus Core Antigen (Vitiello і ін., 1995), Plasmo-dium Bergheu (Widmann і ін. 1992), Influenzavirus-Nukleoprotein/ Hepatitic С Virus. Реальним втіленням винаходу є білок, що сприяє виникненню протипухлинної реакції, антиген пухлини або пептид, отриманий від антигену пухлини; при цьому в якості протипухлинної вакцини використовують лікарську композицію. У випадку терапевтичного використання вакцини пептид одержують від антигену пухлини, який експримований пухлинними клітинами індивідуума. Цими антигенами пухлини є, наприклад, такі антигени, які експримовані організмом індивідуума в такій незначній концентрації, що п ухлинні клітини нерозпізнаються як сторонні. Антигени пухлини індивідуума можуть бути визначені стандартними методами в ході встановлення діагнозу і виробітки терапевтичних мір: антигени пухлини можуть бути виявлені самим простим способом імуногістохімічним за допомогою антитіл. Якщо антигенами пухлини є ферменти, наприклад тиразинази, вони можуть бути виявлені за допомогою ферментних досліджень. Для визначення антигенів пухлини з відомою послідовністю може бути притягнутий RT-PCR-метод (Boon, Т., і ін. 1994; Coulie,P., і ін. 1994; Weynants, P., і ін., 1994). Подальшими методами виявлення антигенів пухлини є дослідження на базі CTLs із специфікою, що відповідає обумовленим антигенам пухлини. Дослідження такого роду були описані Негіп і ін., 1987; Coulie і ін.,1993; Сох і ін., 1994; Rivoltini і ін.,1995; Kawakami і ін., 1995, а також у міжнародній заявці WO 94/14459. З цих джерел запозичені різні антигени пухлини або отримані від них пептидні епітопи, які застосовні в рамках запропонованого винаходу. Приклади використовуваних антигенів пухлини приведені в недавно опублікованих оглядових стаття х авторів Rosenberg, 1996 і Henderson Finn, 1996. Щодо використовуваних антигенів пухлини даний винахід не підлягає обмеженню. Протипухлинна вакцина, що містить антиген пухлини або отриманий від нього пептид, може використовува тися не тільки для терапевтичних, але і для профілактичних цілей. При профілактичному застосуванні доцільно призначати суміш пептидів, отриманих від представників антигенів пухлини, що часто зустрічаються. При терапевтичному застосуванні протипухлинної вакцини використовують один або більш пептидів, причому вважають, що вони присутні в антигенах пухлини індивідуума. Протипухлинна вакцина, згідно з винаходом, у порівнянні з клітинною вакциною має ту перевагу, що вона корисна індивідуумові на відносно ранній стадії (стадія 1 і 11) захворювання, коли ще не можна одержати досить пухлинних клітин для виготовлення клітинної вакцини. У кращому реальному втіленні винаходу пептид, через виникнення клітинної імунної відповіді, погодиться з МНС-І- або МНС-ІІ-підтипами індивідуума, що вакцинується. Таким чином пептид виявляє або містить послідовність, яка забезпечує його зв'язування з МНС-молекулою. Інше реальне втілення лікарської композиції у вигляді протипухлинної вакцини містить, крім всього іншого, поліпептид, що має імунностимулюючу дію, зокрема, цитокін. У кращій формі реального втілення винаходу в якості цитокіну використовують інтерлейкін 2(IL-2) або GM-CSF, наприклад, у дозуванні біля 1000 одиниць; інші приклади для цитокіну: IL-4, IL-12, IFN-a, IFN-b, IFN-g, IFN-w, TNF-a, а також їх сполучення, наприклад, IL-2+IFN-g, IL-2+I1L-4, IL-2+ TNF-a або TNF-a+IFN-g. Лікарська композиція у реальному втіленні згідно з винаходом служить цілі досягнення усталеності щодо білків або фрагментів білків, які викликають аутоімуноіндуковані захворювання, тобто використовується для терапії аутоімунних захворювань. Пептиди, використовувані в цій реальній формі втілення винаходу, отримані від білків, які викликають аутоімунні захворювання. На противагу застосуванню предмета винаходу в якості протипухлинної вакцини або в якості вакцини проти патогенних збудників, при якій пептиди сполучаться з ділянкою вихідного білка (пухлинний антиген або білок патогенного збудника), власне кажучи, таким чином, що пептид розпізнається в якості "оригінального антигену", при реалізації даного винаходу для лікування аутоімунних захворювань і інших подібних захворювань використовують пептиди, які виявляють щодо амінокислотної послідовності вихідного білка критичні відмінності. Ці пептиди на основі їх анкерних позицій зв'язані з МНС-молекулою, однак виявляють у своїй послідовності мутації, які є причиною того, що вони функціонують в якості антагоністів, що знову відключають активовані специфічні Т-клітини (Kerch і Alien, 1996). У якості пептидних антагоністів підходять як натуральні антагоністи, виявлені у вірусах (Bertoletti і ін., 1994), так і антагоністи, які були знайдені в результаті систематичних досліджень, наприклад, завдяки просіванню пептидних бібліотек. Прикладом пептидних антагоністів є пептиди, які здатні відключати Тклітини, специфічні для білка Myelin Basic. Вони були випробувані на ефективність в експериментах на тваринних (Brocke,1996). Пептид, який повинний викликати клітинну імунну відповідь, повинен бути зв'язаний із МНС-молекулою. Щоб мати як наслідок імунну відповідь в організмі індивідуума, індивідуум, що піддається лікуванню, повинен мати у своєму організмі відповідну HLA-молекулу. Визначення HLA-підтипу індивідуума являє собою, стосовно до виникнення клітинної імунної відповіді, одну з істотних передумов для ефективного використання пептиду для даного індивідуума. HLA-підтип пацієнта може бути визначений стандартними методами, наприклад, тестом на мікролімфотоксичність (Практична імунологія, 1989). Цей тест заснований на принципі, при якому ізольовані з крові пацієнта лімфоцити змішують із лікувальною сироваткою або з моноклональним антитілом проти визначеної HLA- молекули,у присутності доповнення (С) кролика. Позитивні клітини розчиняються і здатні прийняти барвник індикатора, у той час як непошкоджені клітини залишаються незабарвленими. Для визначення HLA-I або HLA-ll-гаплотипу індивідуума може бути також притягнута RT-PCR ("Revers Transcriptase Polymerase Chain Reaction") (Curr. глави 2 і 15). Для здійснення цього дослідження у індивідуума беруть кров і ізолюють із неї РНК. Цю РНК піддають зворотному перетворенню, внаслідок чого виникає кДНК індивідуума. кДНК служить матрицею для полімерної ланцюгової реакції з вихідними парами, які специфічно викликають збільшення DNA-фрагмента, що відповідає певному HLA-гаплотипу. Якщо після агаростулчастого електрофорезу з'являється ДНК-смуга, організм індивідуума експримує відповідну HLAмолекулу. Якщо смуга на виникає, пацієнт у цьому відношенні негативний. Визначення використовуваного згідно з винаходом пептиду за допомогою HLA-молекули відбувається відносно його анкерних амінокислот і його довжини; встановлені анкерні позиції і довжина гарантують, що пептид вписується в пептидну сполучн у борозну відповідної HLA-молекули індивідуума. Наслідком цього є стимулювання імунної системи і виникнення клітинної імунної відповіді, яка, у випадку використання отриманого від пухлинного антигену пептиду, спрямована проти пухлинних клітин індивідуума. Пептиди, використовувані в рамках запропонованого винаходу, присутні в значній по ширині смузі. їх послідовність може бути отримана від імуногенних білків природного походження або їх продуктів клітинного розпаду, наприклад від вірусних або бактеріальних пептидів, від пухлинних антигенів; вони можуть бути також антагоністами пептидів, отриманих від білків, індукованих від аутоімунних за хворювань. Відповідні пептиди можуть бути підібрані на основі відомих із літератури пептидних послідовностей. У разі виникнення клітинної імунної відповіді можуть бути визначені пептиди, наприклад на основі пептидів, отриманих від імуногенних білків різного походження (описаних стосовно до різних HLA-мотивів авторами Rammensee і ін., 1993, Rammensee і ін., 1995, Falk і ін., 1991) і які вписуються в сполучну борозну молекул відповідного HLA-підтипу. Для пептидів, що виявляють часткову послідовність білка з імуногенною дією, на основі уже відомих або при необхідності ще встановлюваних поліпептидних послідовностей, за допомогою корекції послідовностей з урахуванням HLA-специфічних вимог може бути встановлено, які пептиди представляють відповідних кандидатів. Приклади відповідних пептидів можна знайти, наприклад, у Rammensee і ін., 1993, Falk і ін., 1991, і Rammensee, 1995, а також у міжнародній заявці WO 91/09869 (HIV-пептиди); пептиди, отримані від пухлинних антигенів, описані в опублікованих міжнародних заявках на патент WO 95/00159, WO 94/05304. Посилання даються на бібліографічні джерела і на статті, що цитуються в зв'язку з розглянутою проблемою. До кращих кандидатів відносяться пептиди, імуногенність яких уже виявлена, тобто пептиди, отримані від відомих імуногенів, наприклад, вірусних або бактеріальних білків. Замість використання оригінальних пептидів, які підходять до сполучних борозен МНС-І- або МНС-ІІ молекул, тобто пептидів, отриманих незмінними від білків природного походження за допомогою встановлених мінімальних вимог щодо анкерних позицій і довжини на основі послідовності оригінальних пептидів, можуть бути зроблені зміни, якщо в результаті цих змін буде не тільки не знижена, але переважно посилена ефективна імуногенність пептиду, яка перебуває в його сполучній хімічній спорідненості з МНСмолекулою і його здатності стимулювати рецептори Т-клітин. У цьому випадку, згідно з винаходом, використовують пептиди штучного походження, які синтезують відповідно до вимог їх здатності зв'язуватися з МНС-молекулою. Так, наприклад, виходячи з Н2-Кd-ліганд Ley Phe Glu Ala lie Glu Gly Phe lie (LFEAIEGFI) можуть бути змінені амінокислоти, що не є анкерними амінокислотами, щоб одержати пептид послідовності Phe Phe На Gly Ala Leu Glu Glu He (FFIGALEEI); крім того, анкерна амінокислота Не у позиції 9 може бути замінена на Leu. Виявлення зпітопів МНС-І- або МНС-ІІ-ліганд або їх варіацій може бути досягнуте відповідно до методики, описаної в Rammensee і ін., 1995. Довжина пептиду відповідає, у випадку його узгодження з МНС-І молекулою, переважно мінімальній послідовності від 8 до 10 амінокислот із необхідними анкерними амінокислотами. МНС-ІІ-сполучний мотив, який поширюється на нові амінокислоти, виявляє підвищений ступінь виродження в анкерних позиціях. Недавно на основі рентгеноструктурного аналізу МНС-ІІ-молекул були розроблені методики, що роблять можливим точний аналіз МНС-ІI-сполучних мотивів і, виходячи з цього, варіацій пептидних послідовностей (Rammensee і ін., 1995 і оригінальні бібліографічні джерела, що цитуються там). При необхідності, пептид може бути подовжений на С-і/або на Т-термін, оскільки таке подовження не порушує здатності пептиду зв'язуватися з МНС-молекулою і оскільки подовжений пептид може на клітинному рівні реагувати на мінімальну послідовність. У реальному втіленні винаходу пептид заряджений негативно. Завдяк цьому, пептид може бути подовжений негативно зарядженими амінокислотами або негативно заряджені амінокислоти можуть бути впроваджені в пептид переважно в позиціях, що не є необхідними для розпізнавання через специфічні CTLs, або в якості анкерних амінокислот для досягнення електростатичного зв'язування пептиду з полікатіонним допоміжним засобом, таким як полілізин. У реальному втіленні винаходу антиген є присутнім не у формі пептиду, а у формі білка, фрагмента білка або суміші білків або білкових фрагментів. У рамках запропонованого винаходу використовують великі фрагменти білків або цілі білки, від яких можна гарантовано очікувати, що вони після застосування APCs пацієнтом перетворяться в пептиди, які підходять МНС-молекулі. Білок являє собою антиген або пухлинний антиген, від якого зроблені осколки, що зберегаються після перетворення. У цій формі реального втілення винаходу допоміжний засіб служить цілі уможливити або підсилити напругу клітин, особливо APCs як дендритних клітин або макрофагів, п ухлинними антигенами або фрагментами. Сприймані в такий спосіб білки або фрагменти білків перетворяться клітинами і можуть, відповідно з цим, бути подані в МНС-відповідності імуноефектних клітин і, таким чином, викликають або підсилюють імунну відповідь (Braciale і Braciale, 1991; Kovacsovics Bankavski і Rock, 1995; York und Rock, 1996). Реальне втілення винаходу, у якому білки або великі фрагменти білків введені в якості антигенів, має ту перевагу, що зберігається незначна залежність від HLA-типу індивідуума, тому що білок розпадається на велику кількість осколків і в такий спосіб стає можливим зміна у великому діапазоні "підходящих" форм пептиду. У випадку введення білків або фрагментів білків можна підтвердити ідентичність перетворених кінцевих продуктів за допомогою хімічного аналізу (розщеплення по Едману або мас-спектрометрія перетворених фрагментів; див. обзорну статтю Rammensee і ін., 1995, а також бібліографічні джерела, що цитуються в ній,) або біологічних випробувань (здатність APCs до стимулювання Т-клітин, що є специфічними для перетворених фрагментів). Вибір пептидних кандидатів, здатних викликати клітинну імунну відповідь, здійснюють традиційно в декілька етапів. В цілому кандидатів перевіряють за допомогою теста, насамперед, на їх здатність зв'язуватися з МНС-молекулою. Використовуваний при цьому метод дослідження заснований на здатності пептидів стабілізувати пусті МНС-молекули, як це описано, наприклад, у Stuber і ін., 1994, і Mclntyre і ін., 1996. При цьому пептид наноситься на клітини, здатні експримувати відповідну МНС-молекулу, але не зв'язуючі внаслідок генетичного дефекту ендогенні пептиди у МНС-відповідність. Відповідними клітинними лініями цього типу є RMA-S (миші) і Т2 (людини) або їх варіанти, що трансформуються. У такий спосіб можуть бути виявлені тільки стабілізовані від відповідного пептиду МНС- молекули. Це досягається переважно за допомогою FACS-аналізу, який заснований на проточній цитометрії (Flow Cytometry, 1989; FACS Vantage TM Users Guide, 1994, Cell Quest TM User's Guide, 1994). Стабільні МНС-молекули виявляються підходящим антиМНС-антитілом і другим (наприклад, поліклональним) антитілом, яке мітять флуоресцентним барвником, наприклад, FITC (Fiuoresceinisothiocyanat). Лазером певної довжини хвилі в потоці стимулюють окремі клітини; вимірюють флуоресценцію, що випромінюється і яка залежить від кількості пептидів, зв'язаних із клітиною. Іншим методом визначення зв'язаної з клітиною кількості пептидів є Scatchard-Plot, як описано в Sette і ін., 1994. Для цієї цілі використовують пептид, позначений, наприклад І125. Цей пептид инкубують протягом ночі з ізольованими абоотриманими рекомбінантно МНС-молекулами при температурі 4°С при по-різному дефінованих концентраціях пептиду. Для визначення неспецифічної взаємодії пептиду в деяких випробуваннях добавляють надлишок немічених пептидів, які паралізують неспецифічну взаємодію мічених пептидів. Потім неспецифічно зв'язаний пептид видаляють, наприклад, за допомогою гелієвої хроматографії. Кількість зв'язаних пептидів визначають, у сцинтиляційному лічильнику на основі емітованої радіоактивності. Обробку отриманих даних здійснюють стандартними методами. Огляд методів для характеристики МНС/пептидної взаємодії, аналізу МНС-ліганд і пептидних сполучних випробувань, здійснюваних у рамках запропонованого винаходу, можна знайти в Rammensee і ін. 1995. На наступному етапі пептидні кандидати з хорошою якістю зчеплення перевіряють на їх імуногенність. Виникнення клітинної імунної відповіді може бути підтверджене шляхом визначення пептидоспецифічного CTLs, наприклад, за допомогою методу, описаного в Current Protocols in Immunology, розділ 3, або в Blomberg і ін., 1993. Інше визначення наявності клітинної імунної відповіді дається тоді, коли при відсутності Т-клітин у піддослідної тварини (що досягається шляхом лікування тварини антитілами, які зміщають CD4- або СD8-клітини) не виникає імунна відповідь (Current Protocols in Immunology. Розділ 3). Клітинна імунна відповідь може бути виявлена також шляхом визначення реакції "затриманої надчутливості " - DTH-реакції у імунізованихих тварин. Для цього в підошву лап мишей упорскують пептиди, після чого вимірюють ступінь припухлості місця ін'єкції (Grohman і ін., 1995; Puccetti та інш., 1994). Індукція гуморальної імунної відповіді за допомогою пептидів, що є сторонніми організму антигенами, які експримовані підлягаючим лікуванню організмом у незначній концентрації, може бути визначена шляхом виявлення специфічних антитіл у сироватці. Для визначення титру антитіла в сироватці використовують Enzyme Linked Immunoassay (ELISA). При цьому специфічні антитіла визначають по їх зв'язуванню з використовуваним для імунізації пептидом за допомогою кольорової реакції. Альтернативним методом є Western Blot. При цьому специфічні антитіла сироватки зв'язані з (мобілізованим на мембрані пептидом. Зв'язані антитіла на закінчення знову підтверджуються кольоровою реакцією (посилання на обидва методи приведені в Current Protocols in Immunology. Редактор Coligan і ін., 1991). Насамперед після вакцинування за допомогою чужорідних антигенів, наприклад, вірусного походження, варто очікувати утворення антитіл. Не виключено, що специфічні антитіла можуть бути утворені замість мутованих або переекспримованих пептидів, отриманих від клітинних пухлинних антигенів. Руйнування пухлини такими антитілами може відбуватися після зв'язування антитіл із пухлинними клітинами за допомогою інших компонентів імунної системи. В якості інших компонентів можуть бути використані, наприклад, цитотоксичність (ADCC), що залежить від антитіл, або фагоцитоз за допомогою макрофагів (Roitt І.Μ., Brostoff I., Male D.K. Immunology, Churchill Living-stone). Виникнення клітинної імунної відповіді за допомогою пептидів, отриманих від білків, імуногенна дія яких невідомо, може бути піддано тестуванню, як це описано в Rivoltini і ін., 1995, або в Kawakami і ін., 1994а. Для цього потрібні Т-клітини, які здатні розпізнати потрібний пептид, якщо він поданий МНС-молекулами. У випадку наявності пептидів, які походять від пухлинних клітин, відповідні Т-клітини одержують з пухлинноінфільтрованих лімфоцитів (TILs), як це описано в Kawakami і ін., 1994Ь; у випадку наявності чужорідних пептидів такі Т-клітини одержують аналогічно з периферійної крові. Т-клітини інкубують за допомогою клітинних ліній, наприклад, Т2 (Alexander і ін., 1989) або RMA-S (Кагге й ін., 1986), змішаних із відповідним пептидом, і розчиняють їх, якщо мова йде про імуногенний пептид. Ще одна можливість тестування зв'язаних із МНС пептидних кандидатів на їх імуногенність перебуває в дослідженні сполуки пептидів із Т2-клітинами. Такий тест заснований на особливості Т-2 клітин (Alexander і ін., 1989) або RMA-S-клітин (Кагге й ін., 1986) проявляти себе дефектно в ТАР-пестидному механізмі переносу і представляти стабільно МНС-молекули тільки тоді, коли на них нанесені пептиди, подані в МНСвідповідності. Для тест використовують, наприклад, Т-2 клітини або RMA-S-клітини, які стабільно переносяться за допомогою HLA-гена, наприклад HLA-A1-і/або НLА-А2-генами. Якщо клітини змішані з пептидами, що є хорошими HLA-лігандами, у той час як вони подані в HLA-відповідності, таким чином, що можуть бути пізнані імунною системою як чужорідні, такі пептиди сприяють тому, що HLA-молекули містяться на поверхні клітини в значній кількості. Визначення HLAs на поверхні клітини, наприклад за допомогою моноклональних антитіл, дозволяє ідентифікувати відповідні пептиди (Malnati і ін.,1995; Sykulev і ін.,1994). У цьому випадку доцільно використовувати стандартний пептид із хорошою HLA-здатністю зв'язування. Зважаючи на широку застосовність лікарської композиції згідно з винаходом, доцільно використовува ти суміш декількох пептидів, кожний із яких може бути зв'язаний з іншою МНС-молекулою, переважно з одним із двох або трьох МНС-підтипів, що найбільш часто зустрічаються. За допомогою вакцини на основі суміші пептидів, які можуть бути зв'язані з цими гаплотипами, може бути охоплене широке коло пацієнтів. В реальному втіленні винаходу вакцина може містити великі послідовності пептидів. Застосовувані пептиди можуть в цьому випадку з одного боку відрізнятися тим, що вони зв'язані з різними HLA-підтипами. Цим досягається те, що о хоплюються великі або усі без винятку HLA-підтипи одного пацієнта або великої групи пацієнтів. Подальша, при відомих умовах, додаткова мінливість використовуваних пептидів може полягати в тому, що пептиди, зв'язані з певним HLA-підтипом, відрізняються щодо їх (не для HLA-сполук) визначальної послідовності, в той час як вони походять, наприклад, від різних білків тих же патогенних збудників або від різних збудників. Від такої мінливості може бути досягнуте посилення стимулювання імунної відповіді або імунізація проти різних збудників. Кількість діючих пептидів у композиції згідно з винаходом може варіюватися в широкому діапазоні. Кількість пептидів залежить, зокрема, від роду застосування і відповідного формулярія. Кількість пептидів, що вводиться, повинна складати від порядку 10mг до порядку 5000mг на дозу, в цілому - від 1.0mΓ до порядку 1000mг, зокрема, від порядку 10mг до порядку 500mΓ. Уведення може проводитися одно- або багаторазово, при багатократному застосуванні доцільно обмежитися мінімум трихкратним уведенням. Зокрема, при терапевтичному використанні застосування може здійснюватися з інтервалами (наприклад, від 1 x у тиждень до 1 x на місяць) протягом будь-якого по тривалості проміжку часу, який залежить від специфічного імунного статусу пацієнта або перебігу хвороби. Лікарська композиція, згідно з винаходом, може застосовуватися також ex vi vo: принцип можливого застосування полягає в тому, що APCs, наприклад, дендритні клітини, культивують ex vivo, клітинну культур у інкубують із композицією згідно з винаходом, і APCs, які представляють пептид у МНСвідповідністі, уводять пацієнту, що піддається лікуванню. Для цього варіанта застосування використовують відомі з бібліографічних джерел методи, наприклад, як описано в Porgador і Gilboa, 1995: Young і Inabe, 1996. Допоміжний засіб, що міститься в композиції згідно з винаходом, має властивості полегшува ти надходження пептидів у клітини або зв'язування пептиду з клітинами пацієнта і підсилювати імуногенність пептиду. Допоміжний засіб може, наприклад, щонайменше короткочасно робити проникними мембрани клітин, у які повинний потрапити пептид, щоб сприяти його проникненню в клітину. Може бути перевагою, але не обов'язково, щоб пептид був зв'язаний із допоміжним засобом, наприклад, через електростатичну взаємодію між електропроникним пептидом і полікатіонним допоміжним засобом. Уведення пептиду в клітину може бути викликане тим, що пептид на підставі своєї просторової близькості до клітинної мембрани може крізь неї проникати, як тільки допоміжний засіб забезпечить її абсорбцію. Дія допоміжного засобу може бути заснована на тому, що вона збільшує критичну для проникнення в клітину концентрацію пептиду на поверхні клітини, або вона здійснює фагоцитоз або рідинне переміщення пептиду в клітину. Є несподіваним те, що присутність допоміжного засобу підсилює не тільки проникнення пептиду в клітину, але й обумовлює посилення імуномодуляторної дії пептиду, яка може бути зведена до коректного пред'явлення пептиду через МНС-молекули. У лікарській композиції можуть бути присутніми допоміжні засоби, а також практично всі мембранопроникні субстанції, які використовуються для переносу нуклеїнових кислот у клітини; у цьому зв'язку дається посилання на публікацію міжнародної заявки WO 93/19768, де приведені субстанції такого роду. У кращій формі втілення винаходу допоміжний засіб являє собою основну поліамінокислоту або суміш основних поліамінокислот. Ступінь полімеризації поліамінокислот може варіюватися в широкому діапазоні. Вона складає від порядку 5 до порядку 1000, зокрема, від порядку 15 до порядку 500. Переважно в рамках запропонованого винаходу в якості допоміжного засобу використовують поліаргінін. Іншим кращим допоміжним засобом у рамках запропонованого винаходу є полілізин. Прикладами інших відповідних, зокрема, полікатіонних органічних сполук (основних поліамінокислот) є поліорнітин, гістон, протамін, поліетиленімін або їх суміші. Допоміжний засіб, при необхідності, може бути зв'язаний з клітинними лігандами, наприклад, із трансфертном, gp 120, LDL (низькощільний гіпопротеїн), a-фетуїном, EGF (фактор епідермального росту)пептидами або з представником інших клітинних лігандів, які описані в міжнародній заявці WO 93/07283, для переносу ДНК за допомогою ендоцитозу, що рецепторно передається, вуглеводними залишками, наприклад, манозою або фукозою (ліганди для микрофагів) або антитілами (або їх фрагментами) замість білків на поверхні клітини. При необхідності, використовують полікатіонні допоміжні засоби, наприклад, поліагринін або полілізин, які при відомих умовах зв'язані з клітинними лігандами як складова частина комплексу з ДНК, наприклад, у формі плазміду-ДНК. ДНК може бути вільна від послідовностей, що кодують функціональні білки, у цьому випадку ДНК є пустим плазмідом. У реальному втіленні винаходу ДНК містить послідовності, що кодують імуномодуляторні білки, зокрема, цитокін, наприклад, IL-2, інтерферон, GM-CSF. Щоб досліджувати механізм переносу пептидів за допомогою основних поліамінокислот, у рамках запропонованого винаходу вимірюють виділення лактатдегідрогенази (LDH). У той час, як в оброблюваних поліаргинінових пробах концентрації виділених LDH практично не були виявлені, після інкубації з полілізином у клітинних надлишкових станах були виявлені високі концентрації LDH. Ці результати дозволяють зробити висновок, що вплив полілізину може бути зведений до проникності клітинної мембрани. Не обмежуючись теорією можна сказати, що дія лікарської композиції згідно з винаходом полягає в тому, що пептид за допомогою допоміжного засобу проникає в клітини, що представляють собою ціль, або зв'язується з клітинами, що зустрічаються в ендотермальному шарі шкіри. Цільовими клітинами можуть бути такі клітини, що представляють антиген, від яких пептид при відомих умовах після здійснення процесу може бути поданий В-і/або Т-клітинами. Прикладами цільових клітин є макрофаги, фібробласти, кератиноцити, клітини Лангеранса, дендритні клітини або b-клітини. В рамках запропонованого винаходу було досліджувано, чи можуть маленькі пептиди в присутності основних поліамінокислот або глікозильованих форм полікатіонів бути прийняті в збільшеному об'ємі подібними макрофагам, що (представляють антиген клітинами (APCs). За результатами дослідження залишків цукру стало відомо, що вони приймаються макрофагами через опосередкований рецепторами ендоцитоз. Спостереження за APCs дозволило встановити, що вони являють собою in vivo (у живому організмі) тип клітин, який приймає пептиди і представляє їх іншим імунним клітинам . Результати дослідів in vitro (поза організмом), які показують, що APCs у присутності тестованих допоміжних засобів ендоцитують підвищену кількість пептидних антигенів, є посиланням на те, що ці допоміжні засоби здатні також in vivo (в організмі) підсилювати пред'явлення пептидів щодо цитотоксичних ефекторних клітин, а також викликати їх активування, що приводить до посилення імунної відповіді проти мішені, що міститься у вакцині. В якості допоміжних засобів можуть бути використані також при відомих умовах додатково до згаданих вище допоміжних засобів компоненти у формі часток. Для часток підходять матеріали, які використовують для синтезу пептидів, наприклад, силікагель або штучна смола, оскільки вони є фізіологічно сприйнятливими і з них можливо одержати частинки, які досить малі для можливості проникнення в клітину. За допомогою допоміжних засобів у формі часток можна одержати високі локальні концентрації пептиду, що полегшує його "прийняття" клітиною. Вид прийнятого допоміжного засобу, доцільність його модифікації за допомогою клітинних лігандів або додавання ДНК, а також необхідна кількість допоміжного засобу щодо пептиду можуть бути визначені емпірично, наприклад, довільно обране співвідношення пептиду до допоміжного засобу, (яке може принципово коливатися в широкому діапазоні), може бути визначене за допомогою титрування. Випробування допоміжних засобів може здійснюватися в принципі тими ж методами, що і випробування пептидів, при відомих умовах у декілька етапів.Здатність допоміжного засобу підвищува ти зв'язування і/або проникнення всередину пептиду з APCs може бути виміряна, наприклад, на першому етапі, коли APCs інкубують із міченою флуоресцентною речовиною пептидами і допоміжним засобом. Обумовлене допоміжним засобом підвищене прийняття або зв'язування може бути визначене методом проточної цитометрії через порівняння з клітинами, які змішані тільки з пептидами. На другому етапі випробовувані in vitro (поза організмом) допоміжні засоби можуть бути досліджувані на предмет того, чи впливає й у якому масштабі їх наявність у присутності пептиду на APCs, причому по описаним вище для випробування пептидів методам може бути виміряна МНС- концентрація на клітинах. Наступна можливість для випробування ефективності допоміжного засобу полягає в застосуванні in vitro моделюючої системи. При цьому APCs інкубують разом із допоміжним засобом і пептидом і вимірюють відносне активування Т-клітинного клону, який специфічно розпізнає використовуваний пептид (Coligan 1991 Lopez 1993). Ефективність формулювання може бути також доведена через клітинну імунну відповідь .за допомогою підтвердження " затриманої надчутливості" (ВТН)-реакції у імунізованих тваринах. На закінчення імуномодуляторну ефективність формулювання визначають у досліді над тваринами. Для цього можуть бути введені в дію також моделі пухлин відомими пептидними послідовностями, розпізнаваними по імунних клітинах. Вакцина, що містить пептид і допоміжний засіб, може застосовуватися в співвідношеннях, що варіюються, щодо пептиду до допоміжного засобу і загальної кількості. Ступінь захисту від росту п ухлини є мірилом ефективності протипухлинної вакцини. Лікарська композиція може прийматися парентерально, топічно, орально або локально. Переважно його застосовують парентерально, наприклад, підшкірно, внутрішньошкірно або внутрішньом'язово, переважно підшкірно або внутрішньошкірно, щоб насамперед досягти шкірних клітин (кератиноцити, фібробласти), дендритних клітин, клітин Лангерганса або макрофагів у якості клітин-мішеней. У рамках пухлинної терапії протипухлинна вакцина може застосовуватися також внутрішньопухлинно. Композиція для парентерального застосування згідно з винаходом подана у вигляді розчину або суспензії пептидів і допоміжного засобу у фармацевтично відповідному носії, переважно водному носії. У якості водного носія можуть бути використані, наприклад, вода, буферна вода, сольовий розчин (0,4%), розчин гліцину (0,3%), гіалуронова кислота й аналогічні відомі носії. Крім водних носіїв можуть бути використані такі розчинники, як, наприклад, диметилсульфоксид, пропіленгліколь, диметилформамід і їх суміші. Композиція може, крім того, містити фармацевтично відповідні допоміжні речовини, наприклад, буферні речовини, а також неорганічні солі для досягнення нормального осмотичного тиску і/або ефективної ліофілізації. Прикладами такого роду добавок є солі натрію і калію, наприклад, хлориди і фосфа ти, сахароза, глюкоза, білкові гідролізати, декстран, полівінілпірролідон або поліетиленглікоь. Композиції можуть бути стабілізовані за допомогою традиційних прийомів, наприклад, за допомогою стерильної фільтрації. Композиція у цій формі може бути розфасована безпосередньо або ліофізована і перед уживанням змішана із стерильним розчином. У реальному втіленні лікарська композиція згідно з винаходом подана у формі для топічного застосування, наприклад, для дермального або трансдермального застосування. Лікарська композиція може бути подана, наприклад, у вигляді гідрогелю на основі поліакрилової кислоти або поліакриламіду (Dolobeneâ, Merckle), у вигляді мазі, наприклад, із поліетиленгліколем (PEG) в якості сприймаючого середовища, як, наприклад, стандартна мазь DA В 8 (50% PEG 300, 50% PEG 1500), або у вигляді емульсії, насамперед мікроемульсії на основі "вода в маслі" або "масло у воді" воді при необхідності з добавкою з ліпосом. В якості прискорювача проникання підходять, зокрема, похідні сульфоксиду, наприклад, диметилсульфоксид або децилметисульфоксид, а також транскутол (діетиленглікольмоноетилефір) або циклодекстрини, піролідони, наприклад, 2-піролідон, N-метил-2-піролідон, 2-піролідон-5-карбонова кислота або N-(2-пдроксиетил)-2-піролідон, що біологічно розщеплюється, і їх складний ефір жирної кислоти, похідні карбаміду, як, наприклад, додецилкарбамід, 1,3-дидодецил карбамід і 1,3-дифенілкарбамід, терпени, наприклад, D-димони, ментон, карвол, лимонооксид або 1,8-синеол. Іншими формами реального втілення є аерозолі, наприклад, для застосування в якості розпилення в ніс або для інгаляції. Композиція згідно з винаходом може бути введена також за допомогою ліпосом, поданих у формі емульсій, піни, міцели, нерозчинних моношарів, фосфоліпідних дисперсій, шаруватих шарів і подібних їм речовин. Ці засоби, за допомогою яких уводять композицію, є сприймаючим середовищем для цілеспрямованої доставки пептидів до певної тканини, наприклад, лімфоїдної або пухлинної, або для збільшення часу напівобміну пептиду. У випадку реального втілення композиції згідно з винаходом в локальній формі вона може містити також УФ-абсорбер, що при профілактичному застосуванні проти меланоми вона діяла у той же час як засіб захисту від сонця. Фахівець може вибрати відповідні допоміжні матеріали і форми з "ReMington's Pharmaceutical Sciences" 1990. ПЕРЕЛІК КРЕСЛЕНЬ Фіг.1: Вакцинування DBA/2 мишей проти мастоцитоми Р815 за допомогою пептиду KYQAVTTTL Фіг.2: Вакцинування DBA/2 мишей проти мастоцитоми Р815 за допомогою пептиду SYFPEITHI Фіг.3: Вакцинування DBA/2 мишей проти мастоцитоми Р815 за допомогою SYFPEITHI Фіг.4: Вакцинування DBA/2 мишей проти меланоми М-3 сумішшю пептидів Фіг.5: Вакцинування DBA/2 мишей проти меланоми М-3 топічним методом застосування ліків Фіг.6: Вакцинування DBA/2 мишей проти меланоми М-3 метастазів Фіг.7: Лікування мишей, що мають М-3 мікрометастази, шляхом вакцинування сумішшю пептидів Фіг.8: Опосередковане полілізином наповнення клітин тирозиназою Фіг.9: Активування Т-клітин терапевтичної моделі після вакцинування (IFN-g-виділення з клітин селезінки вакцинованих тварин як реакція на М-3-клітини) Фіг.10: Індукція антивірусного імунітету за допомогою инфлуенцануклеокапсидпептиду ASNENMETM і фукозильованого поліліизину в якості допоміжного засобу (CTL-активування) Фіг.11: Посилення зв'язування пептидів із APCs за допомогою основних поліамінокислот Фіг.12: Забезпечення проникності клітинної мембрани за допомогою основних поліамінокислот (LDHвиділення після обробки клітин полілізином або поліаргінином Фіг.13: Уведення поліаргніну всередину пептидів Фіг.14: Переміщення пептидів із кісткового мозку в клітини, що представляють антиген Фіг.15: Підвищення ефективності переміщення пептидів у клітини, що представляють антиген, за допомогою полікатіоноактивних поліамінокислот і гістонів Фіг.16: Ефективність переміщення в залежності від ступеня полімеризації основних амінокислот Фіг.17: Переміщення пептидів із поліаргінінами, що володіють низькою молекулярною вагою Фіг.18: Вплив на ефективність переміщення в залежності від заряду пептиду У наступних прикладах, якщо немає спеціальних вказівок, були використані такі матеріали і методики: А) Клі тини а) клітинні лінії Меланомні клітинні лінії мишей Cloudman S91 (Клон М-3; АТСС №CCL53.1), мастоцитомні клітинні лінії Р815 (АТСС №Т1В 64) і моноцито- макрофагові клітинні лінії P388D1 (АТТС Т1В 63) одержують від АТСС. Клітини культивують у D MEM-середовищі з високим утримуванням глюкози ("High Glucose DM EM, life Technologies) із додаванням 10%FCS', 2ML - глутаміни і 20mг/ml гентаміцину. Клітини піддають звичайним випробуванням на відсутність зараження микоплазмой (PCR - Mycoplasma Detection Kit, Stratagene). Мурінова клітинна лінія RMA/S (лімфома миші) описана в Кагге й ін., 1986 і в Ljunggren і ін., 1990. b) клітини з кісткового мозку, що представляють антиген. Насамперед провівають стегнові кістки DBA/2-мишей. Клітини кісткового мозку культивують у DMEMсередовищі з високим утримуванням глюкози з додаванням 10% FCS, 5% конячої сироватки, 2mМ Lглуталіну і 20mм /ml генталіцину в присутності 200одиниць/мл GM-CSF-миші (Li і ін., 1989; Genzyme Cambridge, MA, USA). Усі 24 години протягом перших п'ятьох днів заміні піддають дві третини середовища, щоб видалити не зв'язані з ним гранулоцити і В-клітини (Inaba і ін., 1992). Як зв'язані, так і вільні клітини збирають у проміжку між 8 і 10 днями в результаті інкубації з PBS/5 mM EDTA і при щільності 3x104 клітин на гніздо висівають на предметне скло 8-гніздового мікроскопа (Nunc, Roskidle, Danemark). Більш 90% клітин виявляє позитивну реакцію з антитілом F4/80 (Endogen, Cambridg, MA, USA). B) Синтез пептидів Пептиди синтезують у пептидному синтезаторі (Модель 433А з Feedbackmonitor. Applied Biosystems, Foster City, Kanada) при використанні TentaGel S PHB (Rapp, Tubingen) у якості жорсткої фази за Fmocметодом (HBTU-активування Fastmocä, масштаб 0.25mmol). Пептиди розчиняють у 1М ТЕАА, рН 7.3 і піддають обчищенню методом зворотної хромотографії в Vydac С 18 - колоні. Послідовності підтверджують за допомогою мас-спектрометрії на MAT Lasermat (Firming, San Jose, Kanada). C) Перелік використовуваних пептидів пептид позначення КРЕР 117 послідовність SYFPEITHI Тирозин-кіназа JAK1 Амінокислота Нумерація в білку 355-363 МНС-гаплотип H2-Kd KPEP 118 ΚΡΕΡ 162 ΚΡΕΡ 163 ΚΡΕΡ 164 ΚΡΕΡ 143 ΚΡΕΡ 145 ΚΡΕΡ 146 ΚΡΕΡ150 KYQAVTTTL GPPHSNNFGY ISTQNHRAL LPYLGWL VF RYAEDYEEL PYLEQASRI YYVSRDTLI YYSVKKTFL ASNENMETM Tum-P198 Tum-P358 Ρ91Α Ρ815 trp-1 тирозиназа тирозиназа trp-1 инфлуенцануклеокапсид-пептид 14-22 4-13 12-20 35-43 H2-Kd H2-Dd H2-Ld H2-Ld H2-Kd H2-Kd H2-Kd H2-Kd H2-Kb Пептидні суміші Пептидна суміш 1 для М-3 протимеланомної вакцини: крер143, крер145, крер146, крер150. Пептидна суміш 3 протимастоцитомної Р815 вакцини: крер117, крер118, крер162, крерібЗ, крер164 D) Виготовлення вакцини D1) Однопептидні вакцини a) Для виготовлення однопептидної контрольної вакцини без допоміжного засобу беруть пептид у концентрації 1мг/мл у PBS. Інкубаційний період до моменту ін'єкції складає 4 години при кімнатній температурі. b) Однопептидні вакцини з полілізином (якщо надалі не зазначено нічого іншого, використовують полілізин, довжина ланцюга якого дорівнює 200) у якості допоміжного засобу готують шляхом змішування пептиду і полілізину в зазначених кількостях у HBS. Інкубаційний період до моменту ін'єкції складає 4 години при кімнатній температурі. і) Для одержання вакцини з утримуванням 16mг ефективного пептиду змішують 11.8mг полілізину з 160mг пептиду крері17 у загальному об'ємі в 1мл HBS. іі) Для одержання вакцини з утримуванням 100mг ефективного пептиду змішують 74mг полілізину з 1мг пептиду крер117 у загальному об'ємі 1мл HBS. с) Однопептидну контрольну вакцину з Incomplete Freund's Adjuvans (допоміжним засобом) (IFA) готують у результаті емульгування пептиду і IFA у зазначених кількостях. Інкубаційний період до моменту ін'єкції складає 30хв. при кімнатній температурі. і) Для контрольної вакцини, що містить 16mг ефективного пептиду, емульгують 192mг пептиду крері 17 у 600mл HBS із 600mл IFA. і) Для контрольної вакцини, що містить 100 μΓ ефективного пептиду, емульгують 1.2мг пептиду крері 17 у 600mл HBS із 600mл IFA. D2) Пептидні суміші в якості вакцини a) Пептидна суміш І у якості контрольної вакцини без допоміжного засобу з утримуванням 250mг кожного пептиду крері 43, крері45, крері 46, крері 50 у загальному об'ємі в 1мл PBS. b) Пептидна суміш III у якості контрольної вакцини без допоміжного засобу з утримуванням 250mг кожного пептиду крері 17, крері 18, крері 62, крері 63, крері64 у загальному об'ємі в 1мл PBS. c) Петидну суміш у якості вакцини з полілізином у якості допоміжного засобу готують в результаті змішування 1мг пептидної суміші 1 (що містить 250mг кожного пептиду) із 74mг полілізину в HBS. Інкубаційний період до моменту ін'єкції складає 4 години при кімнатній температурі. d) Пептидну суміш III у якості вакцини з полілізином, використовуваним як допоміжний засіб, готують у результаті змішування 1.25mг пептидної суміші 111 (що містить 250mг кожного пептиду) із 93mг полілізину з HBS. Інкубаційний період до моменту ін'єкції складає 4 години при кімнатній температурі. є) Пептидну суміш І в якості контрольної вакцини з допоміжним засобом готують у результаті емульгування 1.2мг пептидної суміші І у 600mл HBS (з утримуванням 300mг кожного пептиду) із 600mл IFA. Інкубаційний період до моменту ін'єкції складає 30 хвилин при кімнатній температурі. f) Пептидну суміш III у якості контрольної вакцини з допоміжним засобом готують у результаті емульгування 1.5мг пептидної суміші III у 600mл HBS (з утримуванням 300mг кожного пептиду) із 600mл IFA. Інкубаційний період до моменту ін'єкції складає 30 хвилин при кімнатній температурі g) Для топічного застосування з полілізином у якості допоміжного засобу інкубують 1мг пептидної суміші І (що містить 250mг кожного пептиду) із 74mг полілізину протягом 4 годин у загальному об'ємі в 400mл HBS. Отриману суміш добавляють у 1.6 гідрогелі DOLOVENE (Merckle). h) Для топічного застосування контрольної вакцини без допоміжного засобу 1мг пептидної суміші І (що містить 250mг кожного пептиду) у загальному об'ємі в 200mл HBS добавляють у 1.8г гідрогелі DOLOVENE (Merckle). і) Виготовлення зв'язаного з фукозою полілізину (довжина ланцюга: 240 або 220) здійснюють згідно з методом, описаним у МасВгоогл і ін.. 1992, причому досягається заміщення біля 40% (вихідні матеріали bфукопіраносильфеніл-ізотіоционат і полілізин одержують від SIGMA). J) Якщо використовують кон'югати трансферин/полілізин (спосіб виготовлення описаний у міжнародній заявці WO 93/07283), кількість встановлюють таким чином, що абсолютна кількість полілізину складає 75mг намг пептиду. Якщо плазмідну ДНК (пустий плазмід pSP65, LPS-вільний, Boehringer Marmheirn) інтегрують у комплексі, співвідношення складає 37.5mг DNA/75mг полілізину /1мг пептиду. У випадку використання 160mг замість 1мг пептиду кількість інших компонентів скорочують на той же коефіцієнт (6.25). Ε) Ін'єкція вакцини Перед проведенням підшкірної ін'єкції мишей у групах до 8 тварин піддають анестезії в ізольованій повітряній камері. Після 3.5хв обробки галотаном (4 % у O2, відсоток виділення 4) миші біля 1 хвилини знаходяться під наркозом; у цей час підшкірно упорскують вакцину. Внутрішньочеревну ін'єкцію проводять без попередньої анестезії. Об'єм ін'єкції кожної вакцини складає 100mл на тварину, що відповідає 100mл одиночного пептиду або пептидної суміші І на тварину. У випадку застосування пептидної суміші III кожній миші вводять 125mг загальної пептидної кількості. F) Топічне застосування вакцини На одну мишу беруть 200мг мазі, що містить 100mг пептиду або пептидної суміші І або 125mг пептидної суміші І. Мазь втирають у шкіру виголених тварин, а саме у всю поверхню спини й у вуха. Точн у кількість мазі, що втирається, контролюють за допомогою ваг. G) Застосування вакцини проти росту п ухлини на мишах Протокол випробування ефективності протиракової вакцини в профілактичних або терапевтичних цілях на мишах відповідає, якщо не було спеціальних вказівок, описаному в міжнародній заявці WO 94/21808 принципу, причому в якості мишиної моделі використовують DBA/2-модель. Приклад 1 Вакцинування DBA/2 мишей проти мастоцитоми Р815 160mг пептиду послідовності KYQAVTTTL (kpep118), отриманого від описаного в Lethe і ін., 1992 пухлинного антигену Р815, ліганду Нг-іС.змішують із 11.8mг полілізину 300 у 500mл НВС і інкубують протягом 4 годин при кімнатній температурі. Потім добавляють 500mл EBSS (Earl's буферний сольової розчин). По 100mл отриманої суміші вводять підшкірно восьми мишам із тижневим інтервалом. Після цієї попередньої імунації через тиждень з'являються пухлини, причому кожній миші контралатерально вводять 5x104 клітин мастоцитомної клітинної лінії Р815 (АТСС Nr TIB 64; ці клітини експримують пухлинний антиген, від якого одержують пептид Р815) у 100mл EBSS. Результат цього досліду поданий на Фіг.1 (зафарбовані квадрати). У паралельно проведеному досліді змішують 200mг пептиду з 500mл HBS і потім емульгують із 500mл допоміжного засобу. Попередньої імунізації (по 100mл отриманої емульсії) піддають вісім мишей, яким потім пересаджують за допомогою клітин Р815 пухлини, як описано вище (Фіг.1: зафарбовані кружки). Для проведення наступного рівнобіжного досліду клітинну протипухлинну вакцину готують таким чином: 160mг пептиду крер118 змішують із 3mг трансферин-полілізину (Tfp), 10mг pL і 6mг плазміду psp 65 (LPSвільний) у 500mл HBS-буфера. Після 30 хвилин витримки при кімнатній температурі вищезгаданий розчин добавляють у склянку з Τ 75-клітинною культурою, що містить 1.5x106 клітин алогенної фібробластової клітинної лінії Ν1ΗΗ3Τ3 (АТСС Nr CRL 1658) у 20mл DMEM-середовища (10% FCS, 20mM глюкози) і інкубують при 37°С. Через три години клітини змішують із 15мл свіжого середовища й інкубують протягом ночі при 37°С и 5% СO2. За 4 години до застосування клітини опромінюють 20Gy. Готування вакцини здійснюють за способом, описаним в міжнародній заявці WO 94/21808. Попередню імунізацію за допомогою цієї вакцини проводять із тижневим інтервалом в об'ємі 105 клітин. Через тиждень фіксують появу пухлини, як описано вище (Фіг.1 :зафарбовані трикутники). Виявлено, що вакцина, що містить пептид із полілізином, щонайкраще захищає мишей від утворення пухлини. Приклад 2 Вакцинування DBA/2 мишей проти мастоцитоми Р815 за допомогою однопептидної вакцини а) Три однопептидних вакцини, що містять або один пептид крерІІ7 у PBS (Фіг.2а), або пептид крерІІ7, емульгований у IFA (Фіг.2b),або пептид крерІІ7 із полілізином (довжина ланцюга 240) в якості допоміжного засобу (Фіг.2с) випробують на їх захисну дію проти появи Р815-пухлини. Вакцини готують за способом, описаним в розділі D. Об'єм ін'єкції складає щораз 100mл; ін'єкцію проводять підшкірно (sc) або внутрішньочеревинно (ір). Неін'єкційовані миші служать для негативного контролю, цілоклітинна вакцина, що складається із Р815-клітин, що виділяють GM-CSF - для позитивного контролю (P815-GM-CSF; 10 5 клітин у 100mл на мишу були введені підшкірно). Кожна експериментальна група складається з восьми тварин, проводять три вакцинування (sc) з інтервалом у 7 днів. Через тиждень після останнього вакцинування тварини одержують контралатеральний пухлинний виклик від 5x104 Р815клітин. Тварини щодня піддають огляду, виникнення пухлин контролюють із тижневим інтервалом. Пептид крер117 із полілізином у якості допоміжного засобу виявляє кращий протипухлинний ефект при упорскуванні по 100mг на тварину підшкірно (захищеними опинилися три з восьми тварин). Цей ефект також хороший, як ефект, що досягається за допомогою цілоклітинної вакцини (захищеними опинилися чотири з восьми тварин). Упорскування 16mг пептиду з полілізином на одну тварину менш ефективно (захищеними опинилися дві тварини), але явно краще, ніж упорскування 100mг пептиду в PBS (Фіг.2а, відсутність захисного ефекту). Також пептид, емульгований у IFA, не дає того е фекту, що досягається в сполученні з полілізином (Фіг.2с). b) У наступному експерименті на Р815-мастоцитомних мишах порівнюють два немодифікованих полілізину з різною довжиною ланцюга: короткого, із 16 лізинових гр уп (pL 16) і довгого, із 240 груп (рі_ 240). Тваринам із контрольних гр уп упорскують від 100mг пептиду крер117, розчиненого в PBS або емульгованого в IFA. Дві клітинні контрольні вакцини, що виділяють GM-CSF, використовують в якості позитивного контролю (vgl.a), причому одну вакцину одержують із стабільно стерпних Р815-клітин, а друга вакцина - за допомогою швидкоплинного переміщення за методом (AVET), описаному в Wagner і ін., 1992. Обидві цільноклітинні вакцини забезпечують четирьом-п'я ти з восьми тварин захист. Вакцини на основі пептидів, що складаються з одного пептиду або з пептиду, емульгованого в IFA, не виявляють захисного ефекту: в усі х тваринах незабаром після появи пухлини остання починає розвиватися. Якщо, однак, застосовують пептид із полілізином, вакцина захищає тварин проти появи пухлини: дві з восьми тварин захищені, якщо використовують довгий полілізин (рі 240) і чотири з восьми тварин у випадку використання короткого полілізину. Ці результати, подані на Фіг.3, показують, що одиничний пептид у сполученні з полілізином в якості допоміжного засобу, викликає ефективний протипухлинний захист, порівнянний із захистом, забезпечуваним ефективною цілоклітинною вакциною, що виділяє цитокін, який у літературі фігур ує в якості стандарту при антипухлинному вакцинуванні (Dranofi і ін., 1993; Schmidt. І ін. 1995). Приклад 3 Вакцинування DBA2 мишей проти мастоцитоми Р815 за допомогою протипухлинної вакцини, що містить Р815-одинчні пептиди або суміші Р815-пептидів. Для готування вакцини використовують такі пептиди: крері 18 (100mг на ін'єкцію) Пептидна суміш III (kpepll7, kpep118, kpep162, kpep163, kpep164). Ця пептидна суміш містить усі донині відомі Р815-пептиди; за одну ін'єкцію вводять mг кожного пептиду. В якості позитивного контролю використовують Р815-клітини, що виділяють GM-CSF. У процесі попереднього випробування крері 17 виявляє себе як пептид із кращою захисною дією проти появи Р815-пухлини, якщо використовують 100mг пептиду разом із полілізином (7.5mг полілізину /100mг пептиду у відповідності зі стандартним співвідношенням; полілізин: довжина ланцюга = 200). Незначна кількість (16mг) kpep117 менш ефективна. У цьому прикладі впорскують по 100mг kpep118 на тварину, а саме один раз тільки з полілізином (група В), один раз із транферин-полілізином (група С) і один раз із транферин-полілізином / ДНК (гр упа D). В якості контролю використовують крері 18 з IFA. В цьому експерименті один крерІІ8 не виявляє захисної дії проти появи пухлини. У проведених в прикладі 4 дослідах показано, що вакцина, що містить пептидну суміш із меланомних пептидів, виявляє захисний ефект проти меланоми. Звідси в цьому прикладі було протестовано, чи підходить концепція пептидної суміші для Р815. Пептидну суміш III застосовують один раз тільки з полілізином (група Е), один раз із трансферинполілізином (група F) і один раз із трансферинполілізином / DNA (група G). В якості контролю використовують пептидну суміш III у IFA. В якості негативного контролю використовують миші; в якості позитивного контролю - перенесені GM-CSF P815 - клітини (105 клітин на мишу). Проведені в цьому прикладі досліди розроблялися, у порівнянні з іншими дослідами, нетипово: у гр упі позитивного контролю (GM-CSF клітини, що виділяють) в усіх тварин незабаром після появи пухлини відбувався її розвиток, причому велика частина цих пухлин також швидко зникала, як і з'являлася. Можливе пояснення цьому полягає в тому, що пухлина якийсь час розвивалася, перед тим, як вона була зруйнована. Інше можливе пояснення полягає в тому, що діагностоване як пухлина здуття виникало не від росту пухлини, а було сильним імуноклітинним інфільтратом (гранульомою). Тому що тварини не піддавалися розтину, причина не була остаточно встановлена; у всякому разі передбачувані пухлини були зрештою знищені. Інший цікавий результат був отриманий у групі G, в якій тварини були піддані лікуванню за допомогою сполучення пептидної суміші III і полілізину. В усі х тварин розвивалися пухлини, але в двох із усі х тварин розмір здуття (або імуноклітинного інфільтрату) був відносно незначним, не збільшувався і миші не виглядали нездоровими. Обидві ці тварини не були умертвлені і знаходилися під подальшим спостереженням. Несподівано через дев'ять тижнів після появи пухлина виявлена не була: результат дотепер не спостерігається. Дві з восьми тварин знищили зрештою свій пухлинний тягар. Знищення пухлин могло бути також пояснено вмістом крерІІ7 у пептидній суміші, що аналогічно прикладу 2, де два з восьми тварин були захищені за допомогою 16mг крері 17, і три з восьми тварин - за допомогою 100mг крер117. Захисний ефект міг, проте, бути викликаний більш ніж одним пептидом суміші. Приклад 4 Захист DBA/2 мишей від меланоми М-3 шля хом попередньої імунізації за допомогою протипухлинної вакцини, що містить суміш пептидів. Застосовують профілактичну вакцину, що містить суміш меланомних пептидів (пептидна суміш І, розділ D2). Порядок проведення попередньої імунізації за допомогою вакцини, а також поява пухлини відповідає порядку, описаному в прикладі 2, із тією різницею, що появу п ухлини визивають використанням МЗ-клітин (105 клітин на тварину). В якості контрольної вакцини використовують цільноклітинну вакцину з М-3-клітин, яка виділяє оптимальну кількість IL-2 (1000-2000 одиниць на 105 клітин) і виготовлена за способом, описаним в Schmidt і ін., 1995. При обраних умовах випробувань ця вакцина дозволяє одержати 100%-ий захист (фіг.4). Чотирьом групам піддосліднихих тварин уводять вакцини з пептидною сумішшю. Дві гр упи одержують (або s.c або і.р) пептиди, емульговані в IFA. Інші дві гр упи одержують (або s.c. або і.р.) пептиди разом із полілізином (pL 240). Фіг.4 ілюструє захисний ефект пептидної вакцини з полілізином (pL240) в якості допоміжного засобу; 50% підданих лікуванню мишей були захищені від М-3 пухлинного виклику в порівнянні з непідданними лікуванню тваринами, у яких дуже швидко утворилися значні пухлини. Цей ефект міг бути досягнутий тільки при підшкірному упорскуванні пептидно-полілізинової вакцини або при нанесенні на шкіру гідрогелі (фіг.5). У трьох інших контрольних гр упах мишей, що піддавалися лікуванню за допомогою пептид/полілізинових вакцин і.р. або за допомогою пептидів у IFA, вакцина була в основному неефективна. Передбачувані пухлини не були відторгнуті і розвивалися, у порівнянні з пухлинами непідданних лікуванню контрольних тварин, із незначним уповільненням. Ці результати показують, що вакцина, що містить пептидну суміш, дозволяє досягти протипухлинного захисного ефекту, якщо вона містить полілізин. При обраних умовах випробувань ця пептидна вакцина була наполовину менш ефективна, ніж клітинна IL-2-вакцина, що відповідно до повідомлень, що недавно з'явилися (Zatioukal, 1993, Zatioukal, 1995), захищає до 100% тварин від появи пухлини за рахунок використання 105 живих МЗ-клітин. Приклад 5 Захист DBA/2 мишей від М-3 метастазів а) Застосовують терапевтичну вакцину, що містить суміш меланомних пептидів (пептидна суміш І, описана в розділі D2). Проводять три вакцинування (sc) із тижневим інтервалом. Перше вакцинування проводять через п'ять днів після появи метастазів; роблять щеплення проти п'ятиденних метастазів. 1.2х104 М-3 клітин уводять для утворення метастазів; використовують те хнологію, описану в міжнародній заявці WO 94/21808 і в Schmidt і ін., 1996. В якості вакцини використовують пептидну суміш І: без допоміжного засобу (pepmix 1 PBS), із IFA в якості допоміжного засобу (IFA pepmix 1) або з фукозо-модифікованим полілізином (fpl pepmix 1). Контрольні групи мишей не одержують ніякої вакцини (неін'єкційовані) або одержують приведену в прикладі 4 М-3-цільноклітинну вакцину, що виробляє IL-2. З Фіг.6 видно, що кращий ступінь захисту був досягнутий у групі, в якій застосовувалася пептидна суміш 1 із фукозо-модифікованим полілізином в якості допоміжного засобу (Фіг.6а). 50% мишей змогли відторгнути метастази (чотири миші з восьми). Цей спосіб лікування був навіть ефективніше, ніж спосіб застосування цільноклітинної вакцини, що дозволив захистити тільки 33% мишей (три з дев'ятьох). Застосування пептидно!" вакцини з IFA або без допоміжного засобу привело винятково до уповільнення приростання метастазів пухлини (Фіг.6b). b) У наступному експерименті на терапевтичній моделі досліджують захисний ефект вакцини, що містить пептидну суміш 1 і що уводиться підшкірно. Контрольні групи мишей одержують пептидну суміш у PBS (без допоміжного засобу) або з IFA. В якості допоміжного засобу використовують немодифікований полілізин 240. Крім того, в якості допоміжного засобу використовують фукозо-модифікований полілізин 200 (fpl 200). В якості контролю в цьому експерименті бере участь група тварин із IL-2 клітинною вакциною, що експримує. Як показано на фіг.7а, вакцина пептид/полілізин при лікуванні МЗ-метастазів виявилася ефективною. Характерна норма зцілення в цьому експерименті була досягнута лише при використанні фукозомодифікованого полілізину. При лікуванні таким способом 50% тварин відторгли метастази, що в порівнянні з застосуванням IL-2-вакцини, яка дозволяє в цьому випадку вилікувати 70% тварин, є хорошим результатом. с) У наступному експерименті на терапевтичній моделі тестують, як зміни і модифікації відбиваються на протипухлинному ефекті. При цьому додатково до немодифікованого і до фукозо-модифікованго полілізину 200 тестують короткий немодифікований полілізин pL 16, довгий полілізин pL 450 і наступний полікатіон, а саме поліаргінін (рАгд720). В якості позитивного контролю використовують клітинну МЗ-вакцину, що виділяє оптимальну кількість (³10ng 105 клітин) GM-CSF (Schmidt, 1995). Також у цьому досліді контрольні групи містять пептидну суміш у IFA або без будь-якого допоміжного засобу. Як і в прикладі 5b) кращий ефект був досягнутий, якщо в якості допоміжного засобу був використаний фукозополілізин, фіг.7b. У цих гр упах 40% тварин відторгли метастази, у порівнянні з 30% у групі з використанням короткого полілізину pL 16. Крім групи, що одержали пептиди разом із поліаргініном, у тварин інших груп, яким була введена пептидна вакцина, було відзначено лише нетривале уповільнення при виникненні пухлин. Немодифікований поліаргінін був у цьому експерименті також ефективний, як фукозомодифікований полілізин, що привело до відторгнення метастазів у чо тирьох тварин із десятьох. Фіг.7 ілюструє повторення цього обумовленого поліаргиніном ефекту в незалежному експерименті. Тут також вакцинування за допомогою пептидної суміші в сполученні з поліаргініном дозволило досягти в чотирьох із восьми підданих лікуванню тварин протипухлинного ефекту. Приклад 6 Наповнення клітин тирозиназою при використанні полілізину в якості допоміжного засобу. Цей приклад служить в якості досліду, який показує, що полілізин як допоміжний засіб придатний для наповнення клітин великими фрагментами білка або цілих білків, причому в якості клітин були використані М-3-клітини, що заміщають. Для наповнення клітин 160mг FITC-маркованої тирозинази (EC 1.14.18.1; сигма) змішують із 3mг полілізину (pL240) і протягом 3 годин інкубують при кімнатній температурі. Потім отриманий розчин поміщають у склянку з клітинною культурою Т75 з об'ємом 2x106 М-3 клітин і інкубують при температурі 37°С. Потім клітини були двічі промивають PBS, відокремлюють за допомогою PBS/2 mM EDTA і змішують із 1мл PBS/5 % FCS для проведення FACS-аналізу. Фіг.8 ілюстр ує наповнення М-3-клітин тирозиназою (ліва крива показує контроль, права - ступінь наповнення тирозиназою). Приклад 7 Визначення активування Т-клітин після імунізації на терапевтичній моделі Після того як вакцина пептид/полікатіон на терапевтичній моделі миші (див. приклад 5) однозначно продемонструвала свою ефективність, було досліджувано, чи веде цей спосіб лікування до активування Тклітин. Для цього проводять секрецію цитокіну в якості маркера після інкубації клітин селезінки вакцинованих тварин із парентеральними МЗ-клітинами (Kawakami і ін., 1994b). Готують одноклітинні суспензії селезінки вакцинованих і не підданих лікуванню тварин, що відбулося завдяки еритроцитомізу з гіпотонічним буфером (0.15 NH4CI, Im КНСО3, 0.1mM EDTA, ph 7.4). Зв'язані клітини видаляють, у той час як 3x106 клітин селезінки намл DMEM - середовища (10% FCS) інкубують у чашках Петри протягом 90 хвилин при температурі 37 е С Зв'язані клітини шляхом обережного добору за допомогою піпетки і спільного культивування з 1x103 парентальними клітинами культивують у різних кількісних співвідношеннях. Клітини культивують у 200mл DMEM- середовища (10% FCS), 2mM L-глутаміну і 20mг/ml гентаміцину в 96 гніздових плоскодонних чашках для тканинної культури. На дев'ятий день збирають 100 μл композиції і відповідний IFN-(- вміст заміряють із використанням комерційно придбаних комплектів ELISA-приборів (Endogen, Camdridg, MA, USA) згідно з інструкцією виробника. З'ясувалося, що після дев'ятиденної інкубації великі кількості IFN-(y середовище виділяли тільки клітини селезінки вакцинованих тварин, у той час як у Спів-культурі клітин селезінки не підданих лікуванню тварин і МЗ-клітин практично не було виявлено IFN-g. Результат цього експерименту поданий на Фіг.9. Приклад 8 Індукція антивірусного імунітету за допомогою інфлюенцануклеокапсид-пептиду ASNENMETM і фукозильованого полілізину в якості допоміжного засобу Вводять у дію вакцину, що містить на 1мг пептиду ASNENMETM 75mг fpLys. Вакцину вводять шляхом разової ін'єкції, як зазначено в методичному розділі, причому на тварину приходить 100mг пептиду/7.5mг fphys. Для контролю проводять ін'єкцію 100 μΓ одиночного пептиду (PBS) і відповідно не проводять ніякої ін'єкції (безін'єкційний контроль). RMA-S мишині лімфомні клітини інкубують протягом ночі в безсироватковому середовищі при температурі 260°С с 10mг/мл пептиду ASNENMETM. Через 10 днів після вакцинування клітини селезінки вакцинованих тварин ізолюють, змішують із наповненими пептидом RMA-S-клітинами в співвідношенні 5:1 і культивують протягом ще п'ятьох днів (Stuber і ін., 1994). Визначають число уцілілих діючих клітин селезінки в різних культура х. Потім для визначення CTL-активності за допомогою стандартного 4-х годинного дослідження на виділення європію (Blomberg і ін., 1993), клітини змішують у різних співвідношеннях із RMA-S клітинами, які раніше розбавляють пептидом ASNENMETM і внутрішньокомплексною сполукою європію. Як ілюструє Фіг.10 специфічний імунітет у цьому експерименті був досягнутий тільки завдяки вакцинуванню з пептидом і fpLys, але не у випадку, якщо був введений один пептид. Приклад 9 Випробування різних основних поліамінокислот на їх здатність підсилювати проникання всередину і/або зв'язування пептидів із APCs Для реалізації цих випробувань проводять флуоресцентні дослідження: модель пептидного антигену послідовності LFEAIEGFI (МСН Kd обмежені) позначають флуоресцентним барвником Fluorescemisothiocyanat (FITC) згідно з інструкцією виробника (Molecular Probes). Прийом або зв'язування позначеного FITC пептиду одного (імпульсне) або разом із різними концентраціями основних амінокислот (полілізин із довжиною ланцюга від 16 до 490, поліаргінін із довжиною ланцюга від 15 до 720) через МНС Kd-обмежену моноцито- макрофагову клітинну лінію P388D1 визначають методом проточної цитометрії. Для цього 1x106 P388D1 клітин інкубують у кінцевому об'ємі 1мл середовища (DMEM/10 % FCS) у тр убках центрифуги з 5mг FITC-міченого пептиду одного або із сумішшю пептиду і поліамінокислот протягом 30 хвилин при температурі 37°С, а потім інтенсивно промивають, щоб видалити незв'язаний пептид. Поліамінокислоти добавляють у концентрації 50, 25, 12, 6 і 3mг на мол. середовища, що містить 5mг FITCміченого пептиду. Порівнюють відносну флуоресцентну інтенсивність різних випробувань, щоб оцінити ефективність прийому і/або зв'язування пептиду. Результат ци х випробувань поданий на Фіг.11; випробування проводять відповідно з 25mг pL450 або PArg450. При обраних умовах поліаргінін проявив себе майже в п'ять разів ефективніше, ніж полілізин. Приклад 10 Дослідження механізму, за допомогою якого APCs приймають пептиди Пептиди можуть бути прийняті APCs за допомогою специфічних механізмів, таких як, наприклад, макропіноцитоз або рецепторно опосередкований ендоцитоз (Lanzavecchia, 1996). Альтернативний механізм полягає в тому, що поліамінокислоти можуть робити клітинну мембрану проникною й у такий спосіб сприяють дифузії пептидів із середовища в цитоплазму. a) Чи стала клітинна мембрана проникною перевіряють шляхом виміру виділення цитоплазматичного ферменту лактатдегідрогенази (LDH) після інкубації P388D1-клітин із поліамінокислотами (полілізин або поліаргінін) при ізотонічних умовах із використанням наявних у продажі приладових комплектів (Cytotox 96, Promega, Madison, Wisconsin, USA) згідно з інструкцією виробника. На підставі приведених на Фіг.12b результатів можна припустити - дія pLys полягає в тому, що він робить клітинну мембрану проникною, що проявляється у високих концентраціях цитоплазматичного ферменту, що виділяється при ізотонічних умовах. На противагу цьому після використання pArg (Фіг.12b) LDH практично не виявляється. При порівнянні проб із використанням тільки поліамінокислот і проб із використанням сумішей полілізину або поліаргініну з пептидом не було встановлено різниць у виділенні LDH. Після інкубації тільки з пептидом не було виявлено вимірної LDH-активності. b) Чи відбулося проникнення всередину мічених FITC-пептидів у присутності або при відсутності основних поліамінокислот досліджують на підставі опублікованого Midoux і ін., 1993 принципу. Від клітин частинки, що попали всередину, переносяться до ендосомів. У порівнянні з цитоплазмою або середовищем клітинної культури нейтральні рН-величини показують, що ці органели з розміром рН порядку 5 - кислі. Емітована FITC флуоресценція дуже залежить від рН. У середовищі з рН-умовами, як вони є наявними у ендосомах, флуоресценція подавлена. Звідси мічені FITC-пептиди, які від клітин передаються ендосомами, показують зменшену флуоресценцію. При додаванні монензину низьке рН-значення ендосом нейтралізується, що веде до вимірної посиленої флуоресценції мічених FITC пептидів, що попали всередину. Клітини інкубують із сумішшю з поліаргініну (середній розмір молекулярної ваги 100.000, довжина ланцюга 490) і флуоресцентно міченого пептиду при температурі 4°С або 37°С. Число інкубованих при 37°С проб зберігають і перед проточно-цитометричним аналізом при температурі 4°С обробляють 50mΜ монензину. Це дозволяє виявити, що інкубовані APCs із певними основними амінокислотами, наприклад, полілізином (pLys) і поліаргініном (pArg) підсилює прийом або зв'язування пептиду з APCs. Як випливає з Фіг.13, у клітинах, оброблених тільки пептидом або з монензином, спостерігається незначне збільшення флуоресценції. У протилежність цьому, флуоресцентні сигнали в пробах, оброблених монензином і сумішшю з поліаргініну і пептиду, були сильно збільшені. Прийому пептидів не спостерігалося, якщо проби були інкубовані при 4°С. Характерне збільшення флуоресценції після обробки монензином указує на те, що викликана pArg наповнюваність приводить до акумулювання пептидів у везикулах усередині клітин (Midoux і ін., 1993; Фіг.13). Як і очікувалося, після обробки монензином наповнених полілізином проб спостерігається незначне збільшення флуоресценції. Наповнення полілізином при 4°С обумовило збільшення флуоресценції, що вимірюється, що є подальшою вказівкою на те, що дія полілізину зводиться, головним чином до проникності клітинних мембран (Фіг.12b). Приклад 11 Дослідження наповнення APCs короткими пептидами APCs, виділені з кісткового мозку і збережені за допомогою GM-CSF, досліджують комбінацією флуоресцентно міченого пептиду з полілізином (pl_200; SIGMA) або тільки пептидом методом флуоресцентної мікроскопії. Для виявлення прийому пептидів за допомогою мікроскопа на предметне скло висівають APCs і інкубують із 40mг флуоресцентно міченого пептиду LFEAIEGFI або із сумішшю з 50 цг/мл полілізину (pL200) і 40mг пептиду LFEAIEGFI протягом 30 хвилин при температурі 37°С. Після ретельного промивання клітини фіксують 4%-им параформальдегідом, покривають антизнебарвником (Dako, Glostrup, Danemark) і флуоресцентно мікроскопійовані (Zeiss). Ядра офарблюють у контрастні кольори за допомогою 4.6-діамедино-2-феніліндолу (DAPI, SIGMA). Як показано на флуоресцентній мікрофотографії, Фіг.14, клітини, інкубовані з пептидом і полілізином (А), у порівнянні з клітинами, обробленими тільки пептидом (В), виявляють явно підвищений ступінь прийому пептидів. У той час як флуоресценція оброблених тільки пептидом (імпульсна) клітин виявляється вибірково й у формі частинок, інтенсивна флуоресценція оброблених у присутності полілізину і пептиду клітин виявляється не локалізовано і рівномірніше розподілена по клітині. Приклад 12 Кількісне визначення наповнення клітин пептидом методом проточної цитометрії а) Після того, як у результаті проведених згідно з прикладом 11 дослідах, було показано, що APCs є для наповнення маленькими пептидами чудовими клітинами-цілями, in vitro (поза організмом) проводять FACSвипробування з метою ідентифікувати підходящі для пептидної вакцини допоміжні засоби. Це дослідження уможливлює швидке кількісне випробування флуоресцентномічених пептидів; в якості пептидної моделі використовується пептид послідовності LFEAIEGFI. У цих дослідах в якості APCs використовують мишині клітинні лінії P388D1. 1x106 клітин у кінцевому об'ємі в 1мл DMEM-середовища з високим утримуванням глюкози і 10% FCS інкубують протягом 30 хвилин при 37°С з 5mг пептиду з флуорсцентною кінцевою концентрацією в 5ммоль/мл. Клітини обробляють або тільки пептидами, або комбінацією пептиду з полікатіонами або пептиду з гістонами при зростаючій концентрації (від 3 до 50mг/мл), як показано на фіг.15. Використовують такі сполуки: А: поліорнітин (середній діапазон молеклярної ваги 110,000 довжина ланцюга 580); В: насичений аргініном гістон; С: насичений лізином гістон; D: поліаргінін (середній діапазон молекулярної ваги 100,000, довжина ланцюга 490); Е: полілізин (середній діапазон молекулярної ваги 94,000, довжина ланцюга 450). У попередніх випробуваннях було встановлено, що інкубаційний період у 30 хвилин виявив максимальний ступінь прийому пептидів. Більш тривалий період обробки (4-8 годин) не виявив характерного посилення флуоресцентного сигналу. Перед проведенням аналізу клітини були 5х промиті великим об'ємом PBS, що містить 0.2% BSA. Клітини в 1мл крижаного PBS/0.2% BSA були знову сприйняті і досліджувані методом проточної цитометрії (FACScan; Becton Dicknson, San Jose, CA, USA). Поліаргінін і поліілізин виявляють себе самими ефективними допоміжними засобами; поліорнітин виявляє при обраних умовах цитотоксичний ефект. Посилення прийому пептидів, завдяки поліаргініну і полілізину, співвідноситься з концентрацією (Фіг.15d, e); ступінь прийому зростає відповідно до довжини ланцюга (Фіг.16). Виявлено, що поліаргінін із збільшенням у 0,3 рази щодо контрольного розміру виявляє більш широкий відповідний діапазон концентрації, ніж полілізин, що показує максимальне збільшення менше ніж у 0,2 рази, і що поліаргінін при усіх використовуваних довжинах ланцюга для переносу білків ефективніше, ніж полілізин (Фіг.16): поліаргінін уможливлює ефективний перенос при таких низьких концентраціях, як 3mг/мл, у той час як для полілізину необхідні концентрації 25mг/мл, щоб викликати характерне збільшення флуоресценції (Фіг.15 d, e). Щоб установити, чи існує при переносі пептидів нижня границя довжини ланцюга, синтезують поліаргініни різної довжини ланцюга (10-30 груп) і досліджують на їх здатність підвищувати перенос пептидів при високих концентраціях полікатіонів (Фіг.17).Для цих дослідів використовують пептид LFEAIEGFI, випробовувані полімери поліаргініну вводять у дію в концентрації 100mг/мол. Навіть незначне збільшення переносу пептидів було виявлено вже при самому короткому випробуваному поліаргініні. с) Основні амінокислоти - це позитивно заряджені молекули. Звідси можна припустити, що негативно заряджені пептиди за допомогою електростатичної взаємодії можуть зв'язуватися з цими полікатіонами, що, можливо, приводить до посиленого прийому пептидів. Щоб перевірити цю гіпотезу, була співставлена здатність катіоноактивних поліамінокислот приймати короткі пептиди в залежності від їх заряду в РЗ 8 8D1клітинах. У наступній таблиці подані використовувані негативно заряджені пептиди, які відповідають всім умовам, необхідним для ΜНС-1-сполуки (Rammen-see і ін., 1995). Пептид 1 отриманий від TRP миші (протеїн із родини тирозинази), пептид 2 - від інфлуенца гемаглутиніну (Schmidt і ін., 1996), пептид 3 - від тирозинази миші, пептид 4 - від Ρ 198 пухлинного антигену, пептид 5 - від бетагалактозидази (Gavin і ін., 1993). (Мг відноситься до діапазону молекулярної ваги, "fluor" - до флуоресцеїну). Таблиця Послідов нісь Mr Mrf luor 1031 1389 LFEAIEGFI 1038 1396 IFMNGTMSQV KY QAVTTTL TPHPARIGL 1127 1024 961 1485 1382 1319 Y AEDY EEL заряд заряд +f luor 6x позитив ний 4x 2 x негатив ний позитив ний нейтра льний 2 x негатив ний 1 x позитив ний 1 x негатив ний 2 x позитив ний нейтра льний 4 x негатив ний На підставі методів, застосовуваних для мічення пептиду флуоресцином, уведені два негативних заряди. Було вияснено, що після інкубації з поліаргініном пептиди (5nмоль на пробу) із найвищим числом негативних зарядів ефективніше усього переносяться в P388D1 - клітини. Це вказує на те, що іонна взаємодія між пептидом і полікатіоном підсилює перенос пептидів у клітини (Фіг.18). Проте в порівнянні з клітинами, що були оброблені тільки пептидом, також і у випадку використання нейтральних пептидів у присутності полікатіонів були прийняті великі кількості. Обробка тільки пептидом дозволила виявити в усі х випробовуваних пептидах майже ідентичні флуоресцентні сигнали; на підставі викладеного на Фіг.18 у якості "тільки пептиду" показаний флуоресцентний сигнал як такий, що заміщає, отриманий за допомогою пептиду LFEAIEGFI. ЛІТЕРАТУРА Alexander, J. и др., 1989, Immunogenetics 29, стр.380 Alired, D.C. и др., 1992, журнал Clin. Onkol 10 (4), стр.599-605 Avrameas, А. И др., 1996, Европейский журнал Immunol. 26, стр. 394-400 Behr, J.P., 1994, Bioconjug-Chem., сентябрь-октябрь 5 (5), стр. 382-9 Bertoletti, А.и др., 1994, Nature, 369,407-410 Biologic Therapy of Cancer, редакторы: DeVita V.T.Jr., Hellman, S., Rosenberg, S.A., Verlag, J.B. Lippincott Company, Philadelphia, New York, London, Hagerstown Blomberg, K. und Ulfstedt, A.C., 1993, журнал Immunol. Methods 160: стр. 27-34 Boon, Т., 1992, Ad v Cancer Res 58, стр. 177-210 Boon, Т., 1993, Спектр науки (Mai), стр. 58-66 Boon, Т. и др., 1994, Annu. Rev. Immunol. 12, стр.337-65 Boon, Т. und van der Bruggen, P., 1996, журнал Exp med 183, стр.725-729 Braciale, TJ. und Braciale V.L., 1991, Immunol. Today, стр.124-129 Brocke, S:, и др., 1996, Nature 379 (6563), стр. 343-346 Bronte, и др., 1995, журнал Immunol. 154, стр. 5282 Carrel, S. und Johnson, J.P., 1993, Current Opinion in Oncology 5, 383-389 Coligan, J.E., и др., 1991, Nature 351, стр. 290-296 Coligan, J.E., и др., 1991, Current Prot. In Immunol., Wiley, New York Coulie, P.G. и др., 1992, Int. журнал Cancer, 50, стр. 289-297 Coulie, P.G. и др., 1995, Proc Natl Acad Sci USA 92, стр., 7976-80 Coulie, P.G. и др., 1994, журнал Exp. Med. 180, стр. 35-42 Сох, АХ. и др., 1994, Science 264, 5159, стр.716-9 Current Protocols im Molecular Biology, 1995, Herausgeber: Ausubel F.M. John Wiley и Sons, Inc. Dranoff, G. и др., 1993, Proc. Natl. Acad. Sci.USA 90, стр. 3539-3543 Dranoff, G. und Mulligan, R.C., 1995 Advances in Immunology 58, стр. 417 Falk, К. и др., 1991, Nature 351, стр. 290-296 Feigner, J.H. и др., 1994, журнал Diol.Chem. 269, стр. 2550-2561 Feltkamp, M.C. и др. 1995, Eur. журнал Immunol. 25 (9), стр. 2638-2642 Fenton, R.G. и др.1993, журнал Natl. Cancer Inst. 85,16, сир.1294-302 Fisk, В. и др., 1995, журнал Exp. Med. 1881, стр. 2109-2117 Flow Cytometry, Acad, Press, Methods in Cell Biology, 1989, Vol. 33, авторы: Darzynkiewicz, Z. Und Crissman, Y.A. GeddeDahl,T. 1992, Hum Immunol. 33,4, 266-74 Grohmann,U. 1995, Eur. Immunol. 25, 2797-2802 Guarini, A. 1995, Cytokines and Molecular Therapy 1, 57064 Han,X.K. 1995, PNAS 92,9747-9752 Handbych: FACS Vantage ™ User's Guide, April 1994, Becton Dickinson Handbuch: CELL Quest ™ Software User's Guide, June 1994, Becton Dickinson Henderson, R.A., und Finn, O.J., 1996 Advances in Immunology 62, 217-256 Herin M. и др., 1987, Int. журнал Cancer, 39, стр.390 Hock, Η. и др., 1993, Cancer Research 53, стр. 714-716 Houbiers, J.G. и др. 993, Eur. журнал Immunol 23, стр. 2072-7 Huang, A.Y.C., und PardolL D.M. (1996). Proc. Natl. Acad. Sci. USA 93, стр. 9730-5 Inaba, К., и др., 1992, урнал Exp. Med. 176, стр. 1693-1702 Jung, S. и др., 1991, журнал Exp. Med. 173, 1,273-6 Kawakami, Υ. и др., 1994, Proc. Natl. Acad. Sci. USA 91, стр. 6458-62 Kawakami, Y. и др., 1994а, Proc. Natl. Acad. Sci. USA 91, 9, стр. 3515-9 Kawakami, Y. и др., 1994b, журнал Exp.Med. 180,1, стр. 347-52 Kawakami, Υ. и др., 1995, журнал Immunol. 154, стр.3961-3968 Karre, К. и др., 1986, Nature 319,20. Feb., стр. 675 Kersh, G.J. и др., 1996, Nature 380 (6574), стр. 495-498 Kovacsovics Bankowski, M. Und Rock, K.L., 1995, Science 267, стр. 243-246 Lanzavecchia, Α., 1996, Curr.Opin. Immunol.. 8, стр. 348-354 Lehmann, J.M. и др., 1989, Proc. Natl. Acad. Sci. USA 86, стр. 9891-9895 Lethe, В. И др., 1992, Eur. журнал Immunol. 22, стр. 2283-2286 Li, Η. и др., 1989, журнал Exp. Med. 169, стр. 973-986 Lill, N.L., Tevethia, M.J., Hendrickson, W.G., und Tevethia, S.S. (1992). журнал Exp. Med. 176, стр. 449-57 Ljunggren, H.G., и др., 1990, Nature 346, стр. 476-480 Loeffler, J.-P. и др., 1993, Methods Enzymol. 217, стр. 599-618 Lopez, J.A. и др., 1993, Eur. журнал Immunol. 23, стр. 217-223 MacBroom, C.R. и др., 1972, Nath. EnzymoL28, стр. 212-219 Mackiewicz, А. И др., 1995, Human Gene Therapy 6, стр. 805-811 Malnati, M.S. и др., 1995, Science 267, стр.1016-1018 Mandelboira, О. И др., 1994, Nature 369, 5 may, стр.67-71 Mabdelboim, О. И др., 1995, Nature Meticine 1,11, стр. 1179-1183 Marchand, M., и др., 1995, Int журнал Cancer 63, стр. 883-5 Mclntyre, C.A., и др., 1996, Cancer Immunol. Immunother. 42, стр. 246-250 Midoux, Р., и др., 1993, NATO ASI Series H67, стр. 49-64 Morishita, R., и др., 1993, журнал Clin. Invest. 91,6, стр. 2580-5 Nabel, G.J., и др., 1993, Proc. Natl. Acad. Sci. USA 90, стр. 11307-11311 Noguchi, Y, и др., 1994, Proc. Natl. Acad. Sci. YSA 91, стр. 3171-3175 Oettgen, H.F. und Old, L.J., 1991, Biologic Therapy of Cancer, редакторы: De Vita, V.T.Jr., Hellman, S., Rosenberg, S.A., Verlag, J.B., Lippincott Company, Philadelphia, New York, London, Hagerstown, стр. 87-119 Ostrand-Rosenberg, S., 1994, Current Opinion in Immunology 6, стр. 722-727 Pardoll, D.M., 1993, Immunology Today 14,6, стр. 310 Practical Immunology, редакторы Leslie Hudson and Frank С Hay, Blackwell Scientific Publications, Oxford, London, Edinburgh, Boston, Melbourne Peace, D.J., и др., 1991, журнал Immunol. 146,6, стр. 2059-65 Peoples, G.E. и др.,1994, журнал Immunol. 152,10, стр. 4993-9 Plautz, G.E. и др., 1993, Proc. Natl. Acad.Sci. USA 90, стр. 4645-4649 Porgador, Α., Gilboa, E., 1995, журнал Ехр. Med. 182, стр. 255-260 Puccetti, P. и др., 1995, Eur. журнал Immunol. 24, стр. 1446-1452 Rammensee, H.G., и др., 1993, Annu.Rev Immunol 11, стр. 213-44 Rammensee, H.G., и др., 1993, Current Opinion in Immunology 5, стр. 35-44 Rammensee, H.G., и др., 1995, Current Biology 7, стр. 85-96 Rammensee, H.G., и др., 1998, Current Opinion in Immunology 7, стр. 85-96 Rammensee, H.G., и др., 1995, Immunogenetics 41, стр.178-228 Remington's Pharmaceutical Sciences, 18,Auflage 1990, Mack Publishing Company, Easton, Penn. 1990 Remy, J.S. и др. 1994, Bioconjug-Chem., Nov-Dec, 5 (6), стр. 647-54 Rennie, J. und Rusting, R., 1996, Scientific American September, стр. 28-30 Rivoltini, L. И др., 1995, журнал Immunology 154, 5, стр. 2257-2265 Robbins, P.F., и др., 1994, Cancer Res 54, стр. 3124-6 Robbins, P.F., и др., 1995, журнал Immunol 154, стр. 5944-50 Robbins, P.E. und Rosenberg, S.A., 1996, журнал Exp. Med. 183, стр.1185-92 Robbins, P.E. und Kawakami, Y., 1996, Curr Opin Immunol 8, стр. 628-638 Roitt I.M., Brostoff J., Male D.K. Immunology, Churchill Livingstone Rosenberg, S.A., 1996, Annual Reviews of Medicine, 47, стр.481-491 Ryser,H.J. und Hancock, R., 1965, Science 150, стр.501-503 Ryser, H.J. und Shtn, W.C., 1978, Proc. Natl. Acad. Sci. USA 75, стр.3867-3870 Schmidt, W., и др., 1995, Proc. Natl. Acad. Sci. USA, 92, стр.4711-4714 Schmidt, W., и др., 1996, Proc. Natl. Acad.Sci. USA, 93, стр. 9759-63 Sette, А., и др. 1994, Мо ї. Immunol. 31 (11), стр. 813-822 Shen, W.C. und Ryser, H.J., 1978, Proc. Natl. Acad. Sci. USA, 75, стр.1872-1876 Shen, W.C. und Ryser, H.J., 1989, Мої. Pharmacol. 16, стр. 614-622 Shen, W.C. und Ryser, H.J, 1981, Proc. Natl. Acad. Sci USA, 78, стр. 7589-7593 Skipper, J., und Stauss, H.J., 1993, журнал Exp. Med. 177, 5, стр.1493-8 Slingluff, C.L. и др.,1994, Current Opinion in Immunology 6, стр.73-740 Stein, D. и др., 1994, журнал ЕМВО, 13,6, стр.1331-40 Stuber, G., и др.,1994, Eur. журнал Immunol 24, стр. 765-768 Sykulev, Υ. и др., 1994, Immunity 1, стр. 15-52 Theobald, M., Levine, A.J., und Sherman L.A. (1995) PNAS 92, стр. 11993-7 Tibbets, L.M., и др., 1993, Cancer, Jan. 15, Xol.71,2, стр. 315-321 Tykocinski, MX., и др., 1996, Am. журнал Pathol. 148, стр.1-16 Van der Braggen, P., и др., 1994, Eur. журнал Immunol. 24, 9, стр. 2134-40 Issn: 0014-2980 Van der Eynde, B. und Brichard, V.G., 1995, Current Opinion Immunol. 7, стр. 674-81 Van Pel, A. und Boon, Т., 1982, Proc.Natl.Acad.Sci. USA 79, стр. 4718-4722 Van Pel, А, и др., 1995, Immunological Reviews 145, стр. 229-250 Vitiello, Α., и др., 1995, журнал Clin. Inv. 95,1, стр. 341-349 Wagner, Ε., и др.,1990, Proc. Natl. Acad. Sci. USA 87, стр. 341—4 Wagner, E, и др., 1992, Proc. Natl. Acad. Sci. USA 89, стр. 6099-103 Wang, R.F., и др., 1995, журнал Exp. Med. 181, стр. 799-804 Weynants, P. и др., 1994, Int. журнал Cancer 56, стр. 826-829 Widmann, С. и др., 1992, журнал Immunol. Vethods 155 (1), стр. 95-99 Wolfel, Т. и др., 1994 a), Int. журнал Cancer 57, стр. 413-418 Wolfel, Т. и др., 1994 b), Eur. журнал Immunol. 24, стр. 759-764 York, L A. und Rock, K.L., 1996, Ann. Rev. Immunol. 14, стр. 369-396 Yoshino, I. и др.,1994 а), журнал Immunol. 152, 5, crp. 2393-400 Yoshino, I. и др., 1994 b), Cancer Res., 54,13, стр.3387-90 Young, J.W., Inaba, K., 1996, журнал Ехр. Med., 183, стр. 7-11 Zatloukal, К. и др.1993, Gene 135, стр. 199-20 Zatloukal, К. и др. 1995, журнал Immun. 154, стр. 3406-3419
ДивитисяДодаткова інформація
Назва патенту англійськоюImmunomodulating pharmaceutical composition containing peptides and adjuvants
Назва патенту російськоюФармацевтическая композиция для иммуномодуляции на основе пептидов и адъювантов
МПК / Мітки
МПК: A61K 38/02, A61K 39/39
Мітки: пептидів, композиція, фармацевтична, імуномодуляції, основі, ад'ювантів
Код посилання
<a href="https://ua.patents.su/26-62927-farmacevtichna-kompoziciya-dlya-imunomodulyaci-na-osnovi-peptidiv-i-adyuvantiv.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція для імуномодуляції на основі пептидів і ад’ювантів</a>
Попередній патент: Спосіб лікування або профілактики інтерстиціального циститу та фармацевтична композиція, яка містить дулоксетин для його лікування
Наступний патент: Пакувальний контейнер для рідких продуктів (варіанти) та заготовка для пакувального контейнера для рідких продуктів (варіанти)
Випадковий патент: Спосіб виявлення наявності корозії