Спосіб одержання 7-заміщеного-3-хінолін і 3-хінол-4-онкарбонітрилів
Номер патенту: 77799
Опубліковано: 15.01.2007
Автори: Боскеллі Дайан Харріс, Бергер Ден Мартен, Джонсон Стівен Лоренс, Ванг Йанонг Деніел
Формула / Реферат
1. Спосіб одержання 7-заміщеного-3-хіноліну або хінолонкарбонітрилу формули (І):
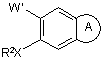 , (ІА)
, (ІА)
де ![]() являє собою кільце формули
являє собою кільце формули
 або
або 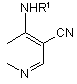
і
Х вибраний з -О-, -S-, -NH- і -NR2’-;
W' являє собою Н або -OR3;
q дорівнює цілому числу 0-5;
m дорівнює цілому числу 0-2;
n дорівнює цілому числу 2-5;
R1 являє собою алкільну групу, що містить від 1 до 6 атомів вуглецю, циклоалкільну групу, що містить від 3 до 10 атомів вуглецю, або арильне або гетероарильне кільце, вказане арильне або гетероарильне кільце необов'язково конденсовано з додатковим арильним або гетероарильним кільцем, вказані арильне або гетероарильне кільця, необов'язково конденсовані, можуть бути необов'язково заміщені від 1 до 4 замісниками, незалежно вибраними з групи, що включає -J, -NO2, -NH2, -OH, -SH, -CN, -N3, -COOH, -CONH2, NHC(O)NH2, -C(O)H, -СF3, -OCF3, -R4, -OR4, -NHR4, -NR4R4, -S(O)mR4, -NHSO2R4, -R5OH, -R5OR4, -R5NH2, -R5NHR4, R5NR4R4, -R5SH, -R5S(O)mR4, -NHR6OH, -N(R4)R6OH, -N(R4)R6OR4, -NHR6NH2, -NHR6NHR4, -NHR6NR4R4, -N(R4)R6NH2, -N(R4)R6NHR4, -N(R4)R6NHR4R4, -OR6OH, -OR6OR4, -OR6NH2, -OR6NHR4, -OR6NR4R4, -OC(O)R4, -NHC(O)R4, -NHC(O)NHR4, -OR5C(O)R4, -NHR4C(O)R4, -C(O)R4, -C(O)OR4, -C(O)NHR4, -C(O)NR4R4, -R5C(O)H, -R5C(O)R4, -R5C(O)OH, -R5C(O)OR4, -R5C(O)NH2, -R5C(O)NHR4, -R5C(O)NR4R4, -R5OC(O)R4, -R5OC(O)NH2, -R5OC(O)NHR4 і -R5OC(O)NR4R4, і групи-YR7, де Y незалежно вибраний з -С(O)-, -C(O)O-, -OC(O)-, -C(O)NH-, -NHC(O)-, -NHSO2-, -SO2NH-, -C(OH)H-, -Q(C(R8)2)q-, -(C(R8)2)q-, -(C(R8)2)qQ-, -С≡С-, цис- і транс-СН=СН- і циклоалкіл, що містить 3-10 атомів вуглецю;
Q являє собою -О-, -S(O)m-, -NH- або -NR9-;
J являє собою галоген, вибраний з фтору, хлору, брому і йоду;
R2, R2’ і R3, кожний, незалежно, вибраний з алкільної групи, що містить від 1 до 6 атомів вуглецю, алкенільної групи, що містить від 2 до 6 атомів вуглецю, або алкінільної групи, що містить від 2 до 6 атомів вуглецю, де кожна незалежна алкільна, алкенільна або алкінільна група необов'язково заміщена -NO2, ціано або -QR4,
або R2, R2’ і R3, кожний, незалежно, вибраний з групи, що включає -(C(R8)2)q-арил, -(C(R8)2)q-гeтepoapил, -(C(R8)2)q-гетероцикліл, -(C(R8)2)n-Q-(C(R8)2)q-аpил, -(C(R8)2)n-Q-(C(R8)2)q-гетероарил, -(C(R8)2)n-Q-(C(R8)2)q-гeтepoциклiл, -(C(R8)2)n-Q-(C(R8)2)n-Q-apил, -(C(R8)2)n-Q-(C(R8)2)n-Q-гeтepoapил і -(C(R8)2)n-Q-(C(R8)2)n-Q-гетероцикліл, де гетероциклільна група може бути необов'язково заміщена на атомі азоту або атомі вуглецю групою, вибраною з груп -R4, -(C(R8)2)q-apил, -(C(R8)2)q-гетероарил, -(C(R8)2)q-гетероцикліл, -(C(R8)2)q-SO2R4, або гетероциклільна група може бути необов'язково заміщена на атомі вуглецю групою -(C(R8)2)q-QR4, або гетероциклільна група може бути необов'язково заміщена на атомі азоту групою (C(R8)2)n-QR4, а також, де арильна або гетероарильна група може бути необов'язково заміщена групою, вибраною з груп -NO2, ціано, -R4, -(C(R8)2)q-арил, -(C(R8)2)q-гетероарил, -(C(R8)2)q-гетероцикліл, -(C(R8)2)q-SО2R4 і -(C(R8)2)q-QR4, і крім того, за умови, що R2 і R2’ можуть бути необов'язково взяті разом з азотом, до якого вони приєднані, утворюючи гетероциклічне кільце, що має від 3 до 8 членів кільця, один з яких являє собою необов'язково додатковий гетероатом, вибраний з азоту, кисню і сірки, де вказане утворене гетероциклічне кільце може бути необов'язково заміщене по атому вуглецю або азоту групою -R4, або вказане гетероциклічне кільце може бути необов'язково заміщене по атому вуглецю групою -(C(R8)2)q-QR4, або вказане гетероциклічне кільце може бути необов'язково заміщене по атому азоту групою -(C(R8)2)n-QR4;
R4 являє собою моновалентну групу, незалежно вибрану з алкілу, що містить від 1 до 6 атомів вуглецю, алкенілу, що містить від 2 до 6 атомів вуглецю, і алкінілу, що містить від 2 до 6 атомів вуглецю;
R5 являє собою дивалентну групу, незалежно вибрану з алкілу, що містить від 1 до 6 атомів вуглецю, алкенілу, що містить від 2 до 6 атомів вуглецю, і алкінілу, що містить від 2 до 6 атомів вуглецю;
R6 являє собою дивалентну алкільну групу, що містить від 2 до 6 атомів вуглецю;
R7 являє собою циклоалкільне кільце, що містить від 3 до 10 атомів вуглецю, необов'язково заміщене одним або декількома алкільними групами, що містять від 1 до 6 атомів вуглецю, або арильне або гетероарильне кільце, необов'язково конденсоване з додатковим арильним або гетероарильним кільцем, де вказане арильне або гетероарильне кільця, необов'язково конденсовані, можуть бути необов'язково заміщені від 1 до 4 замісниками, вибраними з групи, що включає арил, -СН2-арил, -NH-арил, -O-арил, -S(O)m-арил, -J, -NО2, -NH2, -ОН, -SH, -CN, -N3, -COOH, -CONH2, -NHC(O)NH2, -C(O)H, -CF3, -OCF2, -R4, -OR4, -NHR4, -NR4R4, -S(O)mR4, -NHSO2R4, -R5OH, -R5OR4, -R5NH2, -R5NHR4, -R5NR4R4, -R5SH, -R5S(O)mR4, -NHR6OH, -NHR6OR4, -N(R4)R6OH, -N(R4)R6OR4, -NHR6NH2, -NHR6NHR4, -NHR6NR4R4, -N(R4)R6NH2, -N(R4)R6NHR4, -N(R4)R6NHR4R4, -OR6OH, -OR6OR4, -OR6NH2, -OR6NHR4, -OR6NR4R4, -OC(O)R4, -NHC(O)R4, -NHC(O)NHR4, -OR5C(O)R4, -NHR5C(O)R4, -C(O)R4, -C(O)OR4, -C(O)NHR4, -C(O)NR4R4, -R5C(O)H, -R5C(O)R4, -R5C(O)OH, -R5C(O)OR4, -R5C(O)NH2, -R5C(O)NHR4, R5C(O)NR4R4, -R5OC(O)R4, -R5OC(O)NH2, -R5OC(O)NHR4 і -R5OC(O)NR4R4;
R8 являє собою незалежно -Н або -R4;
R9 являє собою моновалентну алкільну групу, що містить від 1 до 6 атомів вуглецю;
де арил, як тут використовується, означає моно- або біциклічне ароматичне кільце, що містить від 6 до 12 атомів вуглецю,
гетероарил, як тут використовується, означає 5- або 6-членне ароматичне кільце, яке містить від 1 до 4 гетероатомів, які можуть бути однаковими або різними, вибраними з азоту, кисню і сірки;
і гетероцикліл означає насичений або частково ненасичений моноциклічний радикал, що містить від 3 до 8 атомів кільця, вибраних з вуглецю, азоту, кисню і сірки, щонайменше з 1 і, переважно, з від 1 до 4, більш переважно, з від 1 до 2 атомами азоту, кисню або сірки як атомами кільця;
який включає взаємодію відповідної сполуки формули (ІІА)
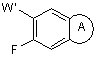 , (ІІА)
, (ІІА)
де ![]() є таким, як указано вище; зі сполукою формули R2ХH, де Х вибраний з -S-, -О-, -NH- і -NR2’-, і де R2’ і R2 такі, як визначено вище, або R2’ і R2 можуть бути необов'язково взяті з азотом, до якого вони приєднані, з утворенням гетероциклічного кільця, і у присутності основи, коли Х являє собою -О- або -S-, з одержанням 7-заміщеного-3-хінолінкарбонітрилу формули (ІА)
є таким, як указано вище; зі сполукою формули R2ХH, де Х вибраний з -S-, -О-, -NH- і -NR2’-, і де R2’ і R2 такі, як визначено вище, або R2’ і R2 можуть бути необов'язково взяті з азотом, до якого вони приєднані, з утворенням гетероциклічного кільця, і у присутності основи, коли Х являє собою -О- або -S-, з одержанням 7-заміщеного-3-хінолінкарбонітрилу формули (ІА)
 , (ІА)
, (ІА)
і, якщо бажано, перетворення сполуки формули (ІА) у відповідну фармацевтично прийнятну сіль звичайними способами, і, якщо бажано, перетворення відповідної фармацевтично прийнятної солі у сполуку формули (ІА) звичайними способами.
2. Спосіб за п. 1, за яким сполука формули ІІА, що використовується як вихідний продукт, являє собою 7-фтор-4-(заміщений аміно)-3-хінолінкарбонітрил формули 2
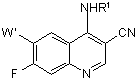 , 2
, 2
який одержаний способом, що включає наступні стадії:
а) взаємодію 7-фтор-4-оксо-1,4-дигідро-3-хінолінкарбонітрилу формули (II)
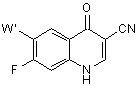 , (ІІ)
, (ІІ)
з галогенуючим реагентом з одержанням 7-фтор-3-хінолінкарбонітрилу формули 1, де Z являє собою Сl або Вr
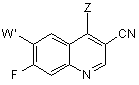 ; 1
; 1
і
b) взаємодію 7-фтор-3-хінолінкарбонітрильного продукту формули 1 з аміном формули R1NH2 у присутності гідрохлориду піридину з одержанням 7-фтор-4-(заміщеного аміно)-3-хінолінкарбонітрилу формули 2
 , 2
, 2
як указано в п. 1.
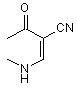
3. Спосіб за п. 1, за яким продукт формули (ІА) являє собою 7-заміщений-4-оксо-1,4-дигідро-3-хінолінкарбонітрил формули 3
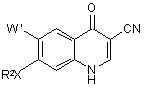 , 3
, 3
і його перетворюють в сполуку формули (І) способом, що включає наступні стадії:
а) взаємодію з галогенуючим реагентом з одержанням 7-заміщеного-4-галоген-3-хінолінкарбонітрилу формули 4, де Z являє собою Сl або Вr
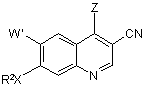 , 4
, 4
b) взаємодію 7-заміщеного-4-галоген-3-хінолінкарбонітрилу зі стадії а) з аміном R1NH2 у присутності гідрохлориду піридину з одержанням 7-заміщеного-3-хінолінкарбонітрилу формули (І)
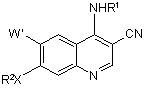 , (I)
, (I)
і, якщо бажано, перетворення сполуки формули (І) у відповідну фармацевтично прийнятну сіль звичайними способами, і, якщо бажано, перетворення відповідної фармацевтично прийнятної солі у сполуку формули (ІА) звичайними способами.
4. Спосіб за будь-яким з пп. 1-3, де галогенуючим агентом є оксихлорид фосфору або оксибромід фосфору.
5. Спосіб за будь-яким з пп. 1-4, де R1 являє собою заміщений арил.
6. Спосіб за будь-яким з пп. 1-4, де R1 вибраний з 2,4-дихлор-5-метоксифенілу;
циклопентилу;
бутилу;
3,4,5-триметоксифенілу;
3-хлор-4-[(1-метил-1Н-імідазол-2-іл)сульфаніл]фенілу;
2,4-дихлорфенілу;
2-хлор-5-метоксифенілу;
5-метокси-2-метилфенілу і 2,4-диметилфенілу.
7. Спосіб за будь-яким з пп. 1-6, де Х являє собою -О- або -S-, і де вказана основа вибрана з калію, гідриду калію, натрію і гідриду натрію.
8. Спосіб за п. 7, де вказана основа являє собою натрій або гідрид натрію.
9. Спосіб за будь-яким з пп. 1-8, де R2 вибраний з одного з наступного:
2-бутиніл;
3-диметиламіно-2,2-диметилпропіл;
3-(1,1-діоксидо-4-тіоморфолініл)пропіл;
2-[2-(1-піперазиніл)етоксі]етил;
2-тієнілметил;
бензил;
етил;
феніл;
2-метоксіетил;
піридин-4-іл;
2-(1-метилпіперидин-4-іл)етил;
2-(1-метил-3-піперидиніл)метил;
2-(1-метил-4-піперидиніл)метил;
2-(2-метоксі)етил;
3-(диметиламіно)пропіл;
3-(4-етил-1-піперазиніл)пропіл;
(1-метилпіперидин-4-іл)метил;
тетрагідро-2Н-піран-2-ілметил;
3-(1-метилпіперидин-4-іл)пропіл;
(3-(диметиламіно)пропіл)метил;
(1-метилпіперидин-4-іл)метил;
3-(1-метилпіперидин-4-іл)пропіл;
3-(4-метил-1-піперазиніл)пропіл;
(1-етилпіперидин-4-іл)метил;
(1-метилпіперидин-2-іл)метил;
піперидин-4-ілметил і
3-(диметиламіно)пропіл.
10. Спосіб за будь-яким з пп. 1-6, де Х являє собою -NH- або -NR2’- і де R2’ і R2 можуть бути необов'язково взяті з азотом, до якого вони приєднані, з утворенням гетероциклічного кільця.
11. Спосіб за п. 10, де XR2 вибраний з 4-метилпіперазин-1-ілу або (4-піролідин-1-ілпіперидин-1-ілу).
12. Спосіб за будь-яким з пп. 1-4 одержання сполуки, вибраної з групи, що включає:
7-(2-бутинілокси)-4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(3-диметиламіно-2,2-диметилпропокси)-6-метокси-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(1,1-діоксидо-4-тіоморфолініл)пропокси]-6-метокси-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-{2-[2-(1-піперазиніл)етоксі]етокси}-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-(2-тієнілметокси)-3-хінолінкарбонітрил;
7-бензилокси-4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-етилсульфаніл-6-метокси-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-фенулсульфаніл-3-хінолінкарбонітрил;
4-циклопентиламіно-6-метокси-7-(2-метоксіетокси)-3-хінолінкарбонітрил;
4-бутиламіно-6-метокси-7-(2-метоксіетокси)-3-хінолінкарбонітрил;
7-бензилтіо-4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-(піридин-4-ілокси)-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[2-(1-метилпіперидин-4-іл)етокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[2-метоксіетокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[2-(1-метил-3-піперидиніл)метокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[2-(1-метил-4-піперидиніл)метокси]-3-хінолінкарбонітрил;
6-метокси-7-[2-метоксіетокси]-4-[(3,4,5-триметоксифеніл)аміно]-3-хінолінкарбонітрил;
6-метокси-7-[(1-метилпіперидин-4-іл)метокси]-4-[(3,4,5-триметоксифеніл)аміно]-3-хінолінкарбонітрил;
4-({3-хлор-4-[(1-метил-1Н-імідазол-2-іл)сульфаніл]феніл}аміно)-6-метокси-7-[2-(2-метоксі)етокси]-3-хінолінкарбонітрил;
4-({3-хлор-4-[(1-метил-1Н-імідазол-2-іл)сульфаніл]феніл}аміно)-7-[3-(диметиламіно)пропокси]-6-(2-метоксіетокси)-3-хінолінкарбонітрил;
4-({3-хлор-4-[(1-метил-1Н-імідазол-2-іл)сульфаніл]феніл}аміно)-7-[3-(4-етил-1-піперазиніл)пропокси]-6-(2-метоксіетокси)-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-[2-метоксіетокси]-7-[(1-метилпіперидин-4-іл)метокси]3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-(2-метоксіетокси)3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-(тетрагідро-2Н-піран-2-ілметокси)-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(2-метоксіетокси)-6-(2-морфолін-4-ілетокси)-3-хінолінкарбонітрил;
4-[3-хлор-4-(1-метил-1Н-імідазол-2-ілсульфаніл)феніламіно]-6-метокси-7-(4-метилпіперазин-1-іл)-хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-{[3-(1-метилпіперидин-4-іл)пропіл]аміно}хінолін-3-карбонітрил;
4-[3-хлор-4-(1-метил-1Н-імідазол-2-ілсульфаніл)феніламіно]-7-{[3-(диметил)амінопропіл]аміно}-6-метоксихінолін-3-карбонітрил;
4-[3-хлор-4-(1-метил-1Н-імідазол-2-ілсульфаніл)феніламіно]-7-{[3-(диметиламіно)пропіл]метиламіно}-6-метоксихінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(4-метил)піперазин-1-іл)пропокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1-метилпіперидин-4-іл)метокси]-3-хінолінкарбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(2-метоксіетокси)-3-хінолінкарбонітрил;
4-[(2,4-дихлорфеніл)аміно]-6-метокси-7-(2-метоксіетокси)хінолін-3-карбонітрил;
4-[(2,4-диметил-5-метоксифеніл)аміно]-6-метокси-7-(2-метоксіетокси)хінолін-3-карбонітрил;
4-[(2-хлор-5-метоксифеніл)аміно]-6-метокси-7-(2-метоксіетокси)хінолін-3-карбонітрил;
6-метокси-7-(2-метоксіетокси)-4-[(5-метокси-2-метилфеніл)аміно]хінолін-3-карбонітрил;
4-[(2,4-диметилфеніл)аміно]-6-метокси-7-(2-метоксіетокси)хінолін-3-карбонітрил;
4-[(2,4-дихлорфеніл)аміно]-6-метокси-7-[(1-метилпіперидин-4-іл)метокси]-хінолін-3-карбонітрил;
4-[(2,4-диметил-5-метоксифеніл)аміно]-6-метокси-7-[(1-метилпіперидин-4-іл)метокси]хінолін-3-карбонітрил;
6-метокси-4-[(5-метокси-2-метилфеніл)аміно]-7-[(1-метилпіперидин-4-іл)метокси]хінолін-3-карбонітрил;
4-[(2-хлор-5-метоксифеніл)аміно]-6-метокси-7-[(1-метилпіперидин-4-іл)метокси]хінолін-3-карбонітрил;
4-[(2,4-диметилфеніл)аміно]-6-метокси-7-[(1-метилпіперидин-4-іл)метокси]-хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3-карбонітрил;
4-[(2-хлор-5-метоксифеніл)аміно]-6-метокси-7-[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3-карбонітрил;
6-метокси-4-[(5-метокси-2-метилфеніл)аміно]-7-[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3-карбонітрил;
4-[(2,4-диметилфеніл)аміно]-6-метокси-7-[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[3-(4-метил-1-піперазиніл)пропокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1-етилпіперидин-4-іл)метокси]-6-метоксихінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[(1-метилпіперидин-2-іл)метокси]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-(піперидин-4-ілметокси)хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-{[3-(диметиламіно)пропіл]аміно}-6-метоксихінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-{[3-(диметиламіно)пропіл](метил)аміно}-6-метоксихінолін-3-карбонітрил і
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[(2-метоксіетил)аміно]хінолін-3-карбонітрил.
13. Спосіб за п. 1 одержання сполуки, вибраної з групи, що включає:
4-[(2,4-дихлорфеніл)аміно]-7-(2-метоксіетокси)хінолін-3-карбонітрил;
6-бутокси-4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(2-метоксіетокси)-3-хінолінкарбонітрил;
6-метокси-7-(4-метилпіперазин-1-іл)-4-(4-феноксифеніламіно)хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-{[3-(4-метилпіперазин-1-іл)пропіл]аміно}хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7-[(3-морфолін-4-ілпропіл)-аміно]хінолін-3-карбонітрил;
4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(2,2-діетоксіетокси)-6-метоксихінолін-3-карбонітрил і
6-метокси-7-(1-метилпіперидин-4-ілметокси)-4-{[4-(піридин-3-ілокси)феніл]аміно}хінолін-3-карбонітрил.
14. Спосіб за п. 1 одержання сполуки, вибраної з групи, що включає:
6-метокси-7-(2-метоксіетокси)-4-оксо-1,4-дигідро-3-хінолінкарбонітрил;
6-метокси-7-(4-метилпіперазин-1-іл)-4-оксо-1,4-дигідрохінолін-3-карбонітрил і
7-(2-метоксіетокси)-4-оксо-1,4-дигідрохінолін-3-карбонітрил.
Текст
1. Спосіб одержання 7-заміщеного-3-хіноліну або хінолонкарбонітрилу формули (І): 2 3 77799 4 NHR6NR4R4, -N(R4)R6NH2, -N(R 4)R6NHR4, R6 являє собою дивалентну алкільну гр упу, що N(R4)R6NHR4R4, -OR6OH, -OR 6OR4 , -OR6NH2, містить від 2 до 6 атомів вуглецю; OR6NHR4, -OR6NR4R4, -OC(O)R4, -NHC(O)R4, R7 являє собою циклоалкільне кільце, що містить 4 5 4 4 4 4 NHC(O)NHR , -OR C(O)R , -NHR C(O)R , -C(O)R , від 3 до 10 атомів вуглецю, необов'язково заміщеC(O)OR 4, -C(O)NHR4, -C(O)NR4R4, -R5C(O)H, не одним або декількома алкільними групами, що R5C(O)R4, -R5C(O)OH, -R5C(O)OR 4, -R5C(O)NH2, містять від 1 до 6 атомів вуглецю, або арильне або R5C(O)NHR4, -R5C(O)NR4R4, -R5OC(O)R4, гетероарильне кільце, необов'язково конденсоваR5OC(O)NH2, -R5OC(O)NHR4 і -R5OC(O)NR4R4, і не з додатковим арильним або гетероарильним групи-YR7 , де Y незалежно вибраний з -С(O)-, кільцем, де вказане арильне або гетероарильне C(O)O-, -OC(O)-, -C(O)NH-, -NHC(O)-, -NHSO2-, кільця, необов'язково конденсовані, можуть бути SO2NH-, -C(OH)H-, -Q(C(R 8)2)q -, -(C(R8)2)q -, необов'язково заміщені від 1 до 4 замісниками, (C(R8)2)q Q-, -С≡С-, цис- і транс-СН=СН - і циклоалвибраними з групи, що включає арил, -СН2-арил, кіл, що містить 3-10 атомів вуглецю; NH-арил, -O-арил, -S(O)m-арил, -J, -NО2, -NH2, Q являє собою -О-, -S(O) m-, -NH- або -NR9-; ОН, -SH, -CN, -N 3, -COOH, -CONH2, -NHC(O)NH 2, J являє собою галоген, вибраний з фтору, хлору, C(O)H, -CF3, -OCF 2, -R 4, -OR4 , -NHR4, -NR4R4, брому і йоду; S(O)mR4, -NHSO2R4, -R5OH, -R5OR4, -R5NH2, 2 2’ 3 R , R і R , кожний, незалежно, вибраний з алкільR5NHR4, -R5NR4R4, -R5SH, -R5S(O)mR4, -NHR6OH, ної групи, що містить від 1 до 6 атомів вуглецю, NHR6OR4, -N(R4)R6OH, -N(R4)R6OR4, -NHR6NH2, алкенільної групи, що містить від 2 до 6 атомів NHR6NHR4, -NHR6NR4R4, -N(R4)R6NH2, вуглецю, або алкінільної групи, що містить від 2 до N(R4)R6NHR4, -N(R4)R6NHR4R4, -OR6OH, -OR 6OR4, 6 атомів вуглецю, де кожна незалежна алкільна, -OR6NH2, -OR6NHR4, -OR6NR4R4, -OC(O)R4 , алкенільна або алкінільна група необов'язково NHC(O)R4, -NHC(O)NHR4, -OR5C(O)R4, 4 5 4 4 4 заміщена -NO2, ціано або -QR , NHR C(O)R , -C(O)R , -C(O)OR , -C(O)NHR4, або R2, R2’ і R3, кожний, незалежно, вибраний з C(O)NR4R4, -R5C(O)H, -R5C(O)R4, -R5C(O)OH, групи, що включає -(C(R8)2)q -арил, -(C(R8)2)q R5C(O)OR 4, -R5C(O)NH2, -R5C(O)NHR4, 8 8 5 4 4 5 4 5 гeтepoapил, -(C(R )2)q -гетероцикліл, -(C(R )2)n-QR C(O)NR R , -R OC(O)R , -R OC(O)NH2 , (C(R8)2)q -аpил, -(C(R8)2)n-Q-(C(R8)2)q -гетероарил, R5OC(O)NHR4 і -R5OC(O)NR4R4; (C(R8)2)n-Q-(C(R8)2)q -гeтepoциклiл, -(C(R8)2)n-QR8 являє собою незалежно -Н або -R4; 8 8 8 (C(R )2)n-Q-apил, -(C(R )2)n-Q-(C(R ) 2)n-QR9 являє собою моновалентну алкільну групу, що 8 8 гeтepoapил і -(C(R )2)n-Q-(C(R )2) n-Q-гетероцикліл, містить від 1 до 6 атомів вуглецю; де гетероциклільна група може бути необов'язково де арил, як тут використовується, означає монозаміщена на атомі азоту або атомі вуглецю груабо біциклічне ароматичне кільце, що містить від 6 пою, вибраною з груп -R4, -(C(R8)2)q -apил, до 12 атомів вуглецю, (C(R8)2)q -гетероарил, -(C(R8)2)q -гетероцикліл, гетероарил, як тут використовується, означає 5(C(R8)2)q -SO2R4, або гетероциклільна група може або 6-членне ароматичне кільце, яке містить від 1 бути необов'язково заміщена на атомі вуглецю до 4 гетероатомів, які можуть бути однаковими або групою -(C(R8)2)q -QR4, або ге тероциклільна група різними, вибраними з азоту, кисню і сірки; може бути необов'язково заміщена на атомі азоту і гетероцикліл означає насичений або частково групою (C(R8)2)n-QR4 , а також, де арильна або гененасичений моноциклічний радикал, що містить тероарильна група може бути необов'язково замівід 3 до 8 атомів кільця, вибраних з вуглецю, азощена групою, вибраною з груп -NO2, ціано, -R4, ту, кисню і сірки, щонайменше з 1 і, переважно, з (C(R8)2)q -арил, -(C(R8)2)q -гетероарил, -(C(R8)2)q від 1 до 4, більш переважно, з від 1 до 2 атомами гетероцикліл, -(C(R8)2)q -SО2R4 і -(C(R8)2)q -QR4, і азоту, кисню або сірки як атомами кільця; крім того, за умови, що R2 і R2’ можуть бути необоякий включає взаємодію відповідної сполуки форв'язково взяті разом з азотом, до якого вони примули (ІІА) єднані, утворюючи гетероциклічне кільце, що має W' від 3 до 8 членів кільця, один з яких являє собою A необов'язково додатковий гетероатом, вибраний з азоту, кисню і сірки, де вказане утворене гетероF , (ІІА) циклічне кільце може бути необов'язково заміщене 4 по атому вуглецю або азоту групою -R , або вказаA не гетероциклічне кільце може бути необов'язково де є таким, як указано вище; зі сполукою заміщене по атому вуглецю групою -(C(R8)2)q -QR4, формули R2ХH, де Х вибраний з -S-, -О-, -NH- і або вказане гетероциклічне кільце може бути неNR2’-, і де R2’ і R2 такі, як визначено вище, або R 2’ і обов'язково заміщене по атому азоту гр упою R2 можуть бути необов'язково взяті з азотом, до (C(R8)2)n-QR4; якого вони приєднані, з утворенням гетероциклічR4 являє собою моновалентну груп у, незалежно ного кільця, і у присутності основи, коли Х являє вибрану з алкілу, що містить від 1 до 6 атомів вугсобою -О- або -S-, з одержанням 7-заміщеного-3лецю, алкенілу, що містить від 2 до 6 атомів вугхінолінкарбонітрилу формули (ІА) лецю, і алкінілу, що містить від 2 до 6 атомів вугW' лецю; 5 A R являє собою дивалентну груп у, незалежно вибрану з алкілу, що містить від 1 до 6 атомів вуглеR2X цю, алкенілу, що містить від 2 до 6 атомів вуглецю, , (ІА) і алкінілу, що містить від 2 до 6 атомів вуглецю; і, якщо бажано, перетворення сполуки формули (ІА) у відповідну фармацевтично прийнятну сіль 5 77799 6 звичайними способами, і, якщо бажано, перетвоZ рення відповідної фармацевтично прийнятної солі W' CN у сполуку формули (ІА) звичайними способами. 2. Спосіб за п. 1, за яким сполука формули ІІА, що використовується як вихідний продукт, являє собою 7-фтор-4-(заміщений аміно)-3N R2X ,4 хінолінкарбонітрил формули 2 b) взаємодію 7-заміщеного-4-галоген-31 NHR хінолінкарбонітрилу зі стадії а) з аміном R1NH2 у присутності гідрохлориду піридину з одержанням W' CN 7-заміщеного-3-хінолінкарбонітрилу формули (І) NHR1 F N ,2 W' CN який одержаний способом, що включає наступні стадії: а) взаємодію 7-фтор-4-оксо-1,4-дигідро-3N R 2X хінолінкарбонітрилу формули (II) , (I) O і, якщо бажано, перетворення сполуки формули (І) у відповідну фармацевтично прийнятну сіль звиW' CN чайними способами, і, якщо бажано, перетворення відповідної фармацевтично прийнятної солі у сполуку формули (ІА) звичайними способами. F N 4. Спосіб за будь-яким з пп. 1-3, де галогенуючим H , (ІІ) агентом є оксихлорид фосфор у або оксибромід з галогенуючим реагентом з одержанням 7-фторфосфор у. 3-хінолінкарбонітрилу формули 1, де Z являє со5. Спосіб за будь-яким з пп. 1-4, де R 1 являє собою бою Сl або Вr заміщений арил. Z 6. Спосіб за будь-яким з пп. 1-4, де R 1 вибраний з 2,4-дихлор-5-метоксифенілу; W' CN циклопентилу; бутилу; 3,4,5-триметоксифенілу; F N ;1 3-хлор-4-[(1-метил-1Н-імідазол-2і іл)сульфаніл]фенілу; b) взаємодію 7-фтор-3-хінолінкарбонітрильного 2,4-дихлорфенілу; 1 продукту формули 1 з аміном формули R NH2 у 2-хлор-5-метоксифенілу; присутності гідрохлориду піридину з одержанням 5-метокси-2-метилфенілу і 2,4-диметилфенілу. 7-фтор-4-(заміщеного аміно)-3-хінолінкарбонітрилу 7. Спосіб за будь-яким з пп. 1-6, де Х являє собою формули 2 -О- або -S-, і де вказана основа вибрана з калію, NHR1 гідриду калію, натрію і гідриду натрію. 8. Спосіб за п. 7, де вказана основа являє собою W' CN натрій або гідрид натрію. 9. Спосіб за будь-яким з пп. 1-8, де R 2 вибраний з одного з наступного: F N 2-бутиніл; ,2 3-диметиламіно-2,2-диметилпропіл; як указано в п. 1. 3-(1,1-діоксидо-4-тіоморфолініл)пропіл; 3. Спосіб за п. 1, за яким продукт формули (ІА) 2-[2-(1-піперазиніл)етоксі]етил; являє собою 7-заміщений-4-оксо-1,4-дигідро-32-тієнілметил; хінолінкарбонітрил формули 3 бензил; O етил; W' CN феніл; 2-метоксіетил; піридин-4-іл; N 2-(1-метилпіперидин-4-іл)етил; R2X H ,3 2-(1-метил-3-піперидиніл)метил; і його перетворюють в сполуку формули (І) спосо2-(1-метил-4-піперидиніл)метил; бом, що включає наступні стадії: 2-(2-метоксі)етил; а) взаємодію з галогенуючим реагентом з одер3-(диметиламіно)пропіл; жанням 7-заміщеного-4-галоген-33-(4-етил-1-піперазиніл)пропіл; хінолінкарбонітрилу формули 4, де Z являє собою (1-метилпіперидин-4-іл)метил; Сl або Вr тетрагідро-2Н-піран-2-ілметил; 3-(1-метилпіперидин-4-іл)пропіл; (3-(диметиламіно)пропіл)метил; (1-метилпіперидин-4-іл)метил; 3-(1-метилпіперидин-4-іл)пропіл; 7 77799 8 3-(4-метил-1-піперазиніл)пропіл; 4-({3-хлор-4-[(1-метил-1Н-імідазол-2(1-етилпіперидин-4-іл)метил; іл)сульфаніл]феніл}аміно)-7-[3-(4-етил-1(1-метилпіперидин-2-іл)метил; піперазиніл)пропокси]-6-(2-метоксіетокси)-3піперидин-4-ілметил і хінолінкарбонітрил; 3-(диметиламіно)пропіл. 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-[210. Спосіб за будь-яким з пп. 1-6, де Х являє сометоксіетокси]-7-[(1-метилпіперидин-4бою -NH- або -NR2’- і де R2’ і R2 можуть бути неіл)метокси]3-хінолінкарбонітрил; обов'язково взяті з азотом, до якого вони приєдна4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7ні, з утворенням гетероциклічного кільця. (2-метоксіетокси)3-хінолінкарбонітрил; 11. Спосіб за п. 10, де XR2 вибраний з 44-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7метилпіперазин-1-ілу або (4-піролідин-1(тетрагідро-2Н-піран-2-ілметокси)-3ілпіперидин-1-ілу). хінолінкарбонітрил; 12. Спосіб за будь-яким з пп. 1-4 одержання спо4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(2луки, вибраної з групи, що включає: метоксіетокси)-6-(2-морфолін-4-ілетокси)-37-(2-бутинілокси)-4-[(2,4-дихлор-5хінолінкарбонітрил; метоксифеніл)аміно]-6-метокси-34-[3-хлор-4-(1-метил-1Н-імідазол-2хінолінкарбонітрил; ілсульфаніл)феніламіно]-6-метокси-7-(44-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(3метилпіперазин-1-іл)-хінолін-3-карбонітрил; диметиламіно-2,2-диметилпропокси)-6-метокси-34-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7хінолінкарбонітрил; {[3-(1-метилпіперидин-4-іл)пропіл]аміно}хінолін-34-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(1,1карбонітрил; діоксидо-4-тіоморфолініл)пропокси]-6-метокси-34-[3-хлор-4-(1-метил-1Н-імідазол-2хінолінкарбонітрил; ілсульфаніл)феніламіно]-7-{[34-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7(диметил)амінопропіл]аміно}-6-метоксихінолін-3{2-[2-(1-піперазиніл)етоксі]етокси}-3карбонітрил; хінолінкарбонітрил; 4-[3-хлор-4-(1-метил-1Н-імідазол-24-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7ілсульфаніл)феніламіно]-7-{[3(2-тієнілметокси)-3-хінолінкарбонітрил; (диметиламіно)пропіл]метиламіно}-67-бензилокси-4-[(2,4-дихлор-5метоксихінолін-3-карбонітрил; метоксифеніл)аміно]-6-метокси-34-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(4хінолінкарбонітрил; метил)піперазин-1-іл)пропокси]-34-[(2,4-дихлор-5-метоксифеніл)аміно]-7хінолінкарбонітрил; етилсульфаніл-6-метокси-3-хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(14-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7метилпіперидин-4-іл)метокси]-3фенулсульфаніл-3-хінолінкарбонітрил; хінолінкарбонітрил; 4-циклопентиламіно-6-метокси-7-(24-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(2метоксіетокси)-3-хінолінкарбонітрил; метоксіетокси)-3-хінолінкарбонітрил; 4-бутиламіно-6-метокси-7-(2-метоксіетокси)-34-[(2,4-дихлорфеніл)аміно]-6-метокси-7-(2хінолінкарбонітрил; метоксіетокси)хінолін-3-карбонітрил; 7-бензилтіо-4-[(2,4-дихлор-5-метоксифеніл)аміно]4-[(2,4-диметил-5-метоксифеніл)аміно]-6-метокси6-метокси-3-хінолінкарбонітрил; 7-(2-метоксіетокси)хінолін-3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-74-[(2-хлор-5-метоксифеніл)аміно]-6-метокси-7-(2(піридин-4-ілокси)-3-хінолінкарбонітрил; метоксіетокси)хінолін-3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-76-метокси-7-(2-метоксіетокси)-4-[(5-метокси-2[2-(1-метилпіперидин-4-іл)етокси]-3метилфеніл)аміно]хінолін-3-карбонітрил; хінолінкарбонітрил; 4-[(2,4-диметилфеніл)аміно]-6-метокси-7-(24-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7метоксіетокси)хінолін-3-карбонітрил; [2-метоксіетокси]-3-хінолінкарбонітрил; 4-[(2,4-дихлорфеніл)аміно]-6-метокси-7-[(14-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7метилпіперидин-4-іл)метокси]-хінолін-3[2-(1-метил-3-піперидиніл)метокси]-3карбонітрил; хінолінкарбонітрил; 4-[(2,4-диметил-5-метоксифеніл)аміно]-6-метокси4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-77-[(1-метилпіперидин-4-іл)метокси]хінолін-3[2-(1-метил-4-піперидиніл)метокси]-3карбонітрил; хінолінкарбонітрил; 6-метокси-4-[(5-метокси-2-метилфеніл)аміно]-7-[(16-метокси-7-[2-метоксіетокси]-4-[(3,4,5метилпіперидин-4-іл)метокси]хінолін-3триметоксифеніл)аміно]-3-хінолінкарбонітрил; карбонітрил; 6-метокси-7-[(1-метилпіперидин-4-іл)метокси]-44-[(2-хлор-5-метоксифеніл)аміно]-6-метокси-7-[(1[(3,4,5-триметоксифеніл)аміно]-3метилпіперидин-4-іл)метокси]хінолін-3хінолінкарбонітрил; карбонітрил; 4-({3-хлор-4-[(1-метил-1Н-імідазол-24-[(2,4-диметилфеніл)аміно]-6-метокси-7-[(1іл)сульфаніл]феніл}аміно)-6-метокси-7-[2-(2метилпіперидин-4-іл)метокси]-хінолін-3метоксі)етокси]-3-хінолінкарбонітрил; карбонітрил; 4-({3-хлор-4-[(1-метил-1Н-імідазол-24-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7іл)сульфаніл]феніл}аміно)-7-[3[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3(диметиламіно)пропокси]-6-(2-метоксіетокси)-3карбонітрил; хінолінкарбонітрил; 9 77799 10 4-[(2-хлор-5-метоксифеніл)аміно]-6-метокси-7-[313. Спосіб за п. 1 одержання сполуки, вибраної з (1-метилпіперидин-4-іл)пропокси]хінолін-3групи, що включає: карбонітрил; 4-[(2,4-дихлорфеніл)аміно]-7-(26-метокси-4-[(5-метокси-2-метилфеніл)аміно]-7-[3метоксіетокси)хінолін-3-карбонітрил; (1-метилпіперидин-4-іл)пропокси]хінолін-36-бутокси-4-[(2,4-дихлор-5-метоксифеніл)аміно]-7карбонітрил; (2-метоксіетокси)-3-хінолінкарбонітрил; 4-[(2,4-диметилфеніл)аміно]-6-метокси-7-[3-(16-метокси-7-(4-метилпіперазин-1-іл)-4-(4метилпіперидин-4-іл)пропокси]хінолін-3феноксифеніламіно)хінолін-3-карбонітрил; карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-74-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7{[3-(4-метилпіперазин-1-іл)пропіл]аміно}хінолін-3[3-(4-метил-1-піперазиніл)пропокси]хінолін-3карбонітрил; карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-74-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1[(3-морфолін-4-ілпропіл)-аміно]хінолін-3етилпіперидин-4-іл)метокси]-6-метоксихінолін-3карбонітрил; карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(2,24-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7діетоксіетокси)-6-метоксихінолін-3-карбонітрил і [(1-метилпіперидин-2-іл)метокси]хінолін-36-метокси-7-(1-метилпіперидин-4-ілметокси)-4-{[4карбонітрил; (піридин-3-ілокси)феніл]аміно}хінолін-34-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7карбонітрил. (піперидин-4-ілметокси)хінолін-3-карбонітрил; 14. Спосіб за п. 1 одержання сполуки, вибраної з 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-{[3групи, що включає: (диметиламіно)пропіл]аміно}-6-метоксихінолін-36-метокси-7-(2-метоксіетокси)-4-оксо-1,4-дигідро-3карбонітрил; хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-{[36-метокси-7-(4-метилпіперазин-1-іл)-4-оксо-1,4(диметиламіно)пропіл](метил)аміно}-6дигідрохінолін-3-карбонітрил і метоксихінолін-3-карбонітрил і 7-(2-метоксіетокси)-4-оксо-1,4-дигідрохінолін-34-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7карбонітрил. [(2-метоксіетил)аміно]хінолін-3-карбонітрил. Даний винахід відноситься до способу одержання 7-заміщених-3-хінолінкарбонітрилів і проміжних сполук, що використовуються для одержання 7-заміщених-3-хінолінкарбонітрилів і їх фармацевтично прийнятних солей. Протеїнкінази являють собою ферменти, які каталізують перетворення фосфатної групи при АТР до амінокислотного залишку білка, такого як тирозин, серин, треонін або гістидин. Регуляція цих протеїнкіназ має величезне значення для контролю великої різноманітності клітинних подій, включаючи проліферацію і міграцію. Специфічні протеїнкінази залучені до різних станів, включаючи рак [Traxler, P. Μ., Εхр. Opin. Ther. Patents, 8, 1599 (1998); Bridges, A. J., Emerging Drags, 3, 279 (1998)], рестеноз [Mattsson, E., Trends Cardiovas. Med. 5, 200 (1995); Shaw, Trends Pharmacol. Sci. 16, 401 (1995)], атеросклероз [Raines, E. W., Bioessays, 18, 271 (1996)], ангіогенез [Shawver, L. K., Drag Discovery Today, 2, 50 (1997); Folkman, J., Nature Medicine, 1, 27 (1995)] і остеопороз [Boyce, J. Clin. Invest., 90, 1622 (1992)] та інсульт [Paul, R. et al, Nature Medicine, 7 (2), 222 (2001)]. Ефективне одержання сполук, які інгібують протеїнтирозинкінази і можуть використовуватись при лікуванні раку, має величезне значення. Сполуки, описані в W09843960 (патент США 6002008), являють собою похідні 3хінолінкарбонітрилу, які інгібують протеїнтирозинкінази і можуть використовуватись для лікування раку. Вищезгадані сполуки одержували способами, які ефективні для первинного одержання заданих сполук. Однак бажане нове, ефективне аль тернативне джерело важливих проміжних сполук, ефективних для одержання похідних 3хінолінкарбонітрилу. Крім того, бажаний альтернативний спосіб одержання 7-заміщених-3хінолінкарбонітрилів. Додатковий ряд нових 3-хінолінкарбонітрилів, які також є високоефективними інгібіторами протеїнтирозинкіназ і ефективні для лікування раку, був описаний в опублікованій заявці WO 00/18740. Також в ній були описані відповідні способи одержання 3-хінолінкарбонітрилів, однак, в даній галузі досі існує потреба у ще більш прийнятних способах одержання важливих проміжних речовин і кінцевих продуктів, ефективних для одержання 3хінолінкарбонітрилів, які можуть використовуватись при лікуванні раку. Отже, способи одержання 7-заміщених-3хінолінкарбонітрилів і проміжних сполук, сприяючих їх одержанню, мають велику цінність. Об'єктом даного винаходу є альтернативний спосіб одержання 7-заміщених-3хінолінкарбонітрилів і проміжних сполук, які можуть використовуватись у способі одержання 7заміщених-3-хінолінкарбонітрилів, які володіють великою ефективністю як інгібітори протеїнкіназ, які можуть використовуватись для лікування раку. Об'єктом даного винаходу є новий спосіб одержання 7-заміщених-3-хінолінкарбонітрилів шляхом заміщення 7-фтор групи у 7-фтор-4(заміщених аміно)хінолінкарбонітрилів. Додатковим об'єктом даного винаходу є новий спосіб одержання 7-заміщених-4-оксо-1,4-дигідро3-хінолінкарбонітрилів шляхом заміщення 7-фтор 11 77799 12 групи у 7-фтор-4-оксо-1,4-дигідро-3гетероциклілу, де гетероциклільна група може хінолінкарбонітрилів. бути необов'язково заміщена на вуглеці або азоті Даний винахід відноситься до способу одергрупою, вибраною з -R4, -(C(R8)2)q -арилу, -(C(R8)2)q жання 7-заміщених-З-хінолінкарбонітрилів формугeтepoapилy, -(C(R8)2)q -гeтepoциклiлy, -(C(R8)2)q ли (І) QR4, або гетероциклільна група може бути необов'язково заміщена на вуглеці -(C(R)2)q -QR4, або гетероциклільна група може бути необов'язково заміщена на азоті -(C(R8)2)n-QR4, і також, де арильна або гетероарильна група може бути необов'язково заміщена групою, вибраною з -NO2, ціано, -R4, -(C(R8)2)q -арилу, -(С(R8)2)g -гетероарилу, (С(R8)2)g -гетероциклілу, -(C(R8)2)q -SO2R4 і де: (C(R8)2)q -QR4 і додатково передбачається, що R2 і 2 X вибраний з -О-, -S-, -NH- і -NR '-; R2' можуть бути необов'язково, взяті разом з атоW являє собою Η або -OR3; мом азоту, до якого вони приєднані, утворювати q дорівнює цілому числу від 0 до 5; гетероциклічне кільце, яке необов'язково містить m дорівнює цілому числу від 0 до 2; додатковий гетероатом, вибраний з азоту, кисню і n дорівнює цілому числу від 2 до 5; сірки, де вказане утворене гетероциклічне кільце 1 R являє собою алкільну гр упу, що містить від може бути необов'язково заміщене на атомі вугле1 до 6 атомів вуглецю, циклоалкільну гр упу, що цю або азоту гр упою -R4, або вказане гетероциклімістить від 3 до 10 атомів вуглецю, або арил, що чне кільце може бути необов'язково заміщене на містить від 6 до 12 атомів вуглецю, або гетероариатомі вуглецю -(C(R8)2)q -QR4, або вказане гетерольне кільце, вказане арильне або гетероарильне циклічне кільце може бути необов'язково заміщене кільце необов'язково конденсоване з додатковим на атомі азоту -(C(R8)2)n-QR4; R4 являє собою моарильним або гетероарильним кільцем, де гетероновалентну групу, незалежно вибрану з алкілу, що арил визначений як 5- або 6-членна ароматична складається з 1-6 атомів вуглецю, алкенілу, що кільцева група, що містить, принаймні, від одного складається з 2-6 атомів вуглецю і алкінілу, що до 4 гетероатомів, вибраних з О, S і N; вказані складається з 2-6 атомів вуглецю; R5 являє собою арильні або гетероарильні кільця, необов'язково бівалентну гр упу, незалежно вибрану з алкілу, що конденсовані, можуть необов'язково бути заміщені складається з 1-6 атомів вуглецю, алкенілу, що від 1 до 4 замісниками, незалежно вибраними з складається з 2-6 атомів вуглецю, і алкінілу, що групи, що складається з -J, -NO2, -NH2, -OH, -SH, складається з 2-6 атомів вуглецю; CN, -N3, -COOH, -CONH 2, -NHC(O)NH2, -C(O)H, R6 являє собою бівалентну алкільну групу, що CF3, -OCF3 , -R4, -OR 4, -NHR4, -R4R4, -S(O) mR4, складається з 2-6 атомів вуглецю; NHSO2R4, -R5OH, -R 5OR4, -R5NH2, -R5NHR4, R7 являє собою циклоалкільне кільце, що 5 4 4 5 5 4 6 R NR R , -R SH, -R S(O)mR , -NHR OH, складається з 3-10 атомів вуглецю, необов'язково N(R4)R6OH, -N(R4)R6OR4, -NHR6NH2, -NHR 6NHR4, заміщених однією або декількома алкільними груNHR6NR4R4, -N(R4)R6NH2, -N(R 4)R6NHR4, пами, що складаються з 1-6 атомів вуглецю, або N(R4)R6NHR4R4, -OR6OH, -OR 6OR4 , -OR6NH2, арильне або гетероарильне кільце, необов'язково OR6NHR4, -OR6NR4R4, -OC(O)R4, -NHC(O)R4, конденсоване з додатковим арильним або гетероNHC(O)NHR4, -OR6C(O)R4 , -NHR5C(O)R4, -C(O)R 4, арильним кільцем, де вказане арильне або гетеC(O)OR 4, -C(O)NHR4, -C(O)NR4R4, -R5C(O)H, роарильне кільце, необов'язково конденсоване, R5C(O)R4, -R5C(O)OH, -R5C(O)OR 4, -R5C(O)NH2, може бути необов'язково заміщено від 1 до 4 заміR5C(O)NHR4, -R5C(O)NR4R4, -R5OC(O)R4, сниками, вибраними з групи, що містить арил, R5OC(O)NH2, -R5OC(O)NHR4 і -R5OC(O)NR4R4, і СН2-арил, -NH-арил, -О-арил, -S(O)m-арил, -J, YR7 груп, де Υ незалежно вибраний з -С(О)-, NO2, -NH2, -OH, -SH, -CN, -N 3 , -COOH, -CONH2, С(О)О-, -ОС(О)-, -C(O)NH-, -NHC(O)-, -NHSO2-, NHC(O)NH2, -C(O)H, -CF3, -OCF3, -R4 , -OR4 , -NHR4, 8 8 SO2NH-, -C(OH)H-, -Q(C(R )2)q -, -(C(R )2)q -, -NR4R4, -S(O)mR4, -NHSO2R4, -R5OH, -R 5OR4 , (C(R8)2)q Q-, -C C-, цис- і транс-СН=СН- і циклоалкіR5NH2, -R5NHR4, -R5NR4R4, -R5SH, -R 5S(O) mR4, лу, що містить 3-10 атомів вуглецю; NHR6OH, -NHR6OR4, -N(R4)R6OH, -N(R4)R6OR4, Q являє собою -О-, -S(O) m-, -NH- або -NR9-; NHR6NH2, -NHR 6NHR4, -NHR 6NR4R4, -N(R4)R6NH2, J являє собою галоген, вибраний з фтору, N(R4)R6NHR4, -N(R4)R6NHR4R4, -OR6OH, -OR 6OR4, хлору, брому і йоду; -OR6NH2, -OR6NHR4, -OR6NR4R4, -OC(O)R4 , R2, R2' і R3 кожний незалежно вибраний з алкіNHC(O)R4, -NHC(O)NHR4, -OR5C(O)R4, 5 4 4 4 льної групи, що містить від 1 до 6 атомів вуглецю, NHR C(O)R , -C(O)R , -C(O)OR , -C(O)NHR4, алкенільної групи, що містить від 2 до 6 атомів C(O)nR4R4, -R5C(O)H, -R5C(O)R4 , -R5C(O)OH, вуглецю або алкінільної групи, що містить від 2 до R5C(O)OR 4, -R5C(O)NH2 , -R5C(O)NHR4, 5 4 4 5 4 6 атомів вуглецю, де кожна алкільна, алкенільна R C(O)NR R , -R OC(O)R , -R5OC(O)NH2 , або алкінільна група незалежно необов'язково R5OC(O)NHR4 і -R5OC(O)NR4R4; R8 являє собою -Н заміщена -NO2, ціано або -QR4, або кожний R2, R2' і або -R4; R9 являє собою моновалентну алкільну R3 незалежно вибраний з -(C(R8)2)q -арилу, груп у, що містить від 1 до 6 атомів вуглецю; і (C(R8)2)q -гетероарилу, -(С(R8)2)g -гетероциклілу, і їх фармацевтично прийнятних солей; який (C(R8)2)n-Q-(C(R8)2)q -арилу, -(C(R8)2)h-Q-(C(R8)2)q включає в себе стадію: гeтepoapилy, -(C(R8)2)n-Q-(C(R8)2)q -гeтepoциклiлy, a) взаємодії 7-фтор-4-оксо-1,4-дигідро-3(C(R8)2)n-Q-(C(R8)2) n-Q-арилу, -(C(R8)2)n-Q-(C(R8)2)nхінолінкарбонітрилу формули (II) Q-гeтepoapилy і -(C(R8)2)n-Q-(C(R8)2)n-Q 13 77799 з галогенуючим агентом формули PO(Z)3 з одержанням 7-фтор-3-хінолінкарбонітрилу 1, де Ζ являє собою СІ або Вr 14 зі сполукою формули R2 XH, де X вибраний з S-, -О-, -NH- і NR2'-, і де R2 ' і R2 такі, як визначено вище, або R2 і R2' взяті разом з атомом азоту, до якого кожний з них приєднаний, можуть необов'язково утворювати гетероциклічне кільце, і у присутності основи, якщо X являє собою -О- або -S-, з одержанням 7-заміщеного-3-хінолінкарбонітрилу формули (І), b) взаємодії 7-фтор-3-хінолінкарбонітрилу формули 1 стадії а) з аміном формули Р1NН2, наприклад, у присутності гідрохлориду піридину, з одержанням 7-фтор-4-(заміщений аміно)-3хінолінкарбонітрилу формули 2 c) взаємодії 7-фтор-4-(заміщений аміно)-3хінолінкарбонітрилу формули 2 стадії b) зі сполукою формули R2XH, де X вибраний з -S-, -О-, -NH- і -NR2'-, і де R2 і R2' такі, як визначено вище, або R2 і R2', взяті разом з атомом азоту, до якого кожний з них приєднаний, можуть необов'язково утворювати гетероциклічне кільце, і у присутності основи, якщо X являє собою -О- або -S-, з одержанням 7заміщеного-3-хінолінкарбонітрилу формули (І) і якщо бажано, стадію перетворення сполуки формули (І) у відповідну фармацевтично прийнятну сіль звичайними способами, і, якщо бажано, перетворення відповідної фармацевтичної солі до сполуки формули (І) звичайними способами. Даний винахід також відноситься до способу одержання 7-заміщених-3-хінолінкарбонітрилів формули (І) і, якщо бажано, стадію перетворення сполуки формули (І) до відповідної фармацевтично прийнятної солі звичайними способами і, якщо бажано, перетворення відповідної фармацевтично прийнятної солі до сполуки формули (І) звичайними способами. Даний винахід також відноситься до способу одержання 7-заміщених-З-хінолінкарбонітрів формули (І) де змінні такі, як визначено вище, який включає в себе стадію: a) взаємодії 7-фтор-4-оксо-1,4-дигідро-3хінолінкарбонітрилу формули (II) зі сполукою формули R2 XH, де X вибраний з S-, -О-, -NH- і -NR2'-, і де R2 і R2' такі, як визначено вище, або R2 і R2', взяті разом з атомом азоту, до якого кожний з них приєднаний, можуть необов'язково утворювати гетероциклічне кільце, і у присутності основи, якщо X являє собою -О- або -S-, з одержанням 7-заміщеного-4-оксо-1,4-дигідро-3хінолінкарбонітрилу формули 3 де змінні такі, як визначено вище, який включає в себе стадію: взаємодії 7-фтор-4-(заміщений аміно)-3-хінолінкарбонітрилу формули 2 b) взаємодії 7-заміщеного-4-оксо-1,4-дигідро-3 15 77799 16 хінолінкарбонітрилу стадії а) з галогенуючим агеннижченаведеними схемами реакцій. Шляхи одертом, наприклад, формули PO(Z)3, з одержанням 7жання 7-заміщених-3-хінолінкарбонітрилів за дазаміщеного-4-галоген-3-хінолінкарбонітрилу 4, де ним винаходом, що відносяться до формули (І), Ζ являє собою СІ або Вr описані нижче, починаючи зі схеми 1. 7-Фтор-4оксо-1,4-дигідро-3-хінолінкарбонітрили формули (II), де W являє собою -Η або -OR3, перетворювали до 7-фтор-3-хінолінкарбонітрилів І, де Ζ являє собою групу хлору або брому, шля хом обробки галогенуючим агентом, який включає в себе, але ними не обмежується, оксихлорид фосфору і оксибромід фосфору, або нерозбавленим, або, необов'язково, у присутності розчинника, який вклюc) взаємодії 7-заміщеного-4-галоген-3чає в себе, але ними не обмежується, хінолінкарбонітрилу стадії b) з аміном R'NH2, надихлорметан. Взаємодія 7-фтор-3приклад, у присутності гідрохлориду піридину, з хінолінкарбонітрилу і з аміном R1NH2 1а, де R1 одержанням 7-заміщеного-3-хінолінкарбонітрилу такий, як визначено тут, може здійснюватись в формули (І) розчиннику, такому як 2-етоксіетанол у присутності каталітичної або еквівалентної кількості гідрохлориду піридину з утворенням проміжних 7-фтор-4(заміщених аміно)-3-хінолінкарбонітрилів 2, де W такий, як визначено тут. Переважно, амін R1NH2 1a являє собою заміщений анілін, де R1 являє собою заміщений арил. Заміщення 7-фторгруппи 7-фтор4-(заміщений аміно)-3-хінолінкарбонітрилів 2 алкоі, якщо бажано, стадію перетворення сполуки ксидним або тіоалкоксидним аніоном приводить до формули (І) до відповідної фармацевтично прийнутворення 7-заміщених-3-хінолінкарбонітрилів ятної солі звичайними способами, і якщо бажано, формули (І). Цю реакцію можна здійснювати, виперетворення відповідно фармацевтично прийнякористовуючи як співрозчинник надлишок R2OH тної солі до сполуки формули (І) звичайними споабо тіолу R2SH, або, необов'язково, можна викособами. ристати співрозчинник, такий як Ν,ΝДаний винахід також відноситься до способу диметилформамід, диметилсульфоксид або Nодержання 7-заміщеного-4-оксо-1,4-дигідро-3метилпіролідон. Аніон може бути одержаний зі хінолінкарбонітрилу формули 3 спирту або тіолу 2а, де X являє собою О або S, використовуючи основи. Відповідні основи включають в себе натрій, гідрид натрію, калій і гідрид калію. Переважними основами є натрій і гідрид натрію. Якщо можливо, можуть використовуватись комерційно доступні натрієві солі спирту або тіолу 2а, де X являє собою О або S. Взаємодія сполуки формули R2XH 2а, де X являє собою -NH-, -NR2'-, і де R2' і R2 , взяті разом з атомом азоту, до якого де змінні такі, як визначено вище, який вклювони приєднані, можуть, необов'язково, утворювачає в себе стадію: взаємодії 7-фтор-4-оксо-1,4ти гетероциклічне кільце, приводить до одержання дигідро-3-хінолінкарбонітрилу формули (II) 7-заміщених-3-хінолінкарбонітрилів формули (І). зі сполукою формули R2 XH, де X вибраний з S-, -О-, -NH- і NR2'-, і де R2 і R2', взяті разом з атомом азоту, до якого кожний з них приєднаний, можуть необов'язково утворювати гетероциклічне кільце, і у присутності основи, якщо X являє собою -О- або -S-, з одержанням 7-заміщеного-4-оксо1,4-дигідро-3-хінолінкарбонітрилу формули 3. Спосіб за даним винаходом проілюстрований У цьому випадку прикладами R1 у формулі є 2, 4-дихлор-5-метоксифеніл; циклопентил; бутил; 3,4,5-триметоксифеніл; 3-хлор-4-(1-метил-1Німідазол-2-іл)сульфаніл]феніл; 2,4-дихлорфеніл; 2хлор-5-метоксифеніл; 5-метокси-2-метилфеніл і 2, 4-диметилфеніл. У цьому випадку прикладами R2 в формулі є: 2-бутиніл; 3-диметиламіно-2,2-диметилпропіл; 3(1,1-діоксидо-4-тіоморфолініл)пропіл; 2-[2-(1 17 77799 18 піперазиніл)етокси]етил; 2-тієнілметил; бензил; іл)сульфаніл]феніл}аміно)-6-метокси-7-[2-(2етил; феніл; 2-метоксіетил; піридин-4-іл; 2-(1метокси)етокси]-3-хінолінкарбонітрил; метилпіперидин-4-іл)етил; 2-(1-метил-34-({3-Хлор-4-[(1-метил-1Н-імідазол-2піперидиніл)метил; 2-(1-метил-4іл)сульфаніл]феніл}аміно)-7-[3піперидиніл)метил; 2-(2-метокси)етил; 3(диметиламіно)пропокси]-6-(2-метоксіетокси)-3(диметиламіно)пропіл; 3-(4-етил-1хінолінкарбонітрил; піперазиніл)пропіл; (1-метилпіперидин-4-іл)метил; 4-({3-Хлор-4-[(1-метил-1Н-імідазол-2тетрагідро-2Н-піран-2-ілметил; 3-(1іл)сульфаніл]феніл}аміно)-7-[3-(4-етил-1метилпіперидин-4-іл)пропіл; (3піперазиніл)пропокси]-6-(2-метоксіетокси)-3(диметиламіно)пропіл)метил-3-(4-метил)піперазинхінолінкарбонітрил; 1-іл)пропіл; (1-метилпіперидин-4-іл)метил; 14-[(2,4-дихлор-5-метоксифеніл)аміно]-6-[2метилпіперидин-4-іл)метил; 3-(1-метилпіперидинметоксіетокси]-7-[(1-метилпіперидин-4-іл)метокси]4-іл)пропіл; 3-(4-метил-1-піперазиніл)пропіл; (13-хінолінкарбонітрил; етилпіперидин-4-іл)метил; (1-метилпіперидин-24-[(2,4-дихлор-5-метоксифеніл)аміно]-6іл)метил; піперидин-4-ілметил і 3етокси-7-(2-метоксіетокси)-3-хінолінкарбонітрил; (диметиламіно)пропіл. 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6Переважна сполука формули (І), одержана метокси-7-(тетрагідро-2Н-піран-2-ілметокси)3способом за даним винаходом, вибрана з групи, хінолінкарбонітрил; що включає: 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(27-(2-Бутинілокси)-4-[(2,4-дихлор-5метоксіетокси)-6-(2-морфолін-4-ілетокси)3метоксифеніл)аміно]-6-метокси-3хінолінкарбонітрил; хінолінкарбонітрил; 4-[3-Хлор-4-(1-метил-1Н-імідазол-24-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(3ілсульфаніл)феніламіно]-6-метокси-7-(4диметиламіно-2,2-диметилпропокси)-6-метокси-3метилпіперазин-1-іл)хінолін-3-карбонітрил; хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-64-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(1,1метокси-7-{[3-(1-метилпіперидин-4діоксидо-4-тіоморфолініл)пропокси]-6-метокси-3іл)пропіл]аміно}хінолін-3-карбонітрил; хінолінкарбонітрил; 4-[3-Хлор-4-(1-метил-1Н-імідазол-24-[(2,4-дихлор-5-метоксифеніл)аміно]-6ілсульфаніл)феніламіно]-7-{[3метокси-7-{2-[2-(1-піперазиніл)етокси]етокси}-3(диметил)амінопропіл]аміно}-6-метоксихінолін-3хінолінкарбонітрил; карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-64-[3-Хлор-4-(1-метил-1Н-імідазол-2метокси-7-(2-тієнілметокси)-3-хінолінкарбонітрил; ілсульфаніл)феніламіно]-7-{[37-Бензилокси-4-[(2,4-дихлор-5(диметиламіно)пропіл]метиламіно}-6метоксифеніл)аміно]-6-метокси-3метоксихінолін-3-карбонітрил; хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(44-[(2,4-дихлор-5-метоксифеніл)аміно]-7метил)піперазин-1-іл)пропокси]-3етилсульфаніл-6-метокси-3-хінолінкарбонітрил; хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-64-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1метокси-7-фенілсульфаніл-3-хінолінкарбонітрил; метилпіперидин-4-іл)метокси]-34-Циклопентиламіно-6-метокси-7-(2хінолінкарбонітрил; метоксіетокси)-3-хінолінкарбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(24-Бутиламіно-6-метокси-7-(2-метоксіетокси)-3метоксіетокси)-3-хінолінкарбонітрил; хінолінкарбонітрил; 4-[(2,4-дихлорфеніл)аміно]-6-метокси-7-(27-Бензилтіо-4-[(2,4-дихлор-5метоксіетокси)хінолін-3-карбонітрил; метоксифеніл)аміно]-6-метокси-34-[(2,4-диметил-5-метоксифеніл)аміно]-6хінолінкарбонітрил; метокси-7-(2-метоксіетокси)хінолін-3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-64-[(2-Хлор-5-метоксифеніл)аміно]-6-метокси-7метокси-7-(піридин-4-ілокси)-3-хінолінкарбонітрил; (2-метоксіетокси)хінолін-3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-66-Метокси-7-(2-метоксіетокси)-4-[(5-метокси-2метокси-7-[2-(1-метилпіперидин-4-іл)етокси]-3метилфеніл)аміно]хінолін-3-карбонітрил; хінолінкарбонітрил; 4-[(2,4-диметилфеніл)аміно]-6-метокси-7-(24-[(2,4-дихлор-5-метоксифеніл)аміно]-6метоксіетокси)хінолін-3-карбонітрил; метокси-7-[2-метоксіетокси]-3-хінолінкарбонітрил; 4-[(2,4-дихлорфеніл)аміно]-6-метокси-7-[(14-[(2,4-дихлор-5-метоксифеніл)аміно]-6метилпіперидин-4-іл)метокси]хінолін-3метокси-7-[2-(1-метил-3-піперидиніл)метокси]-3карбонітрил; хінолінкарбонітрил; 4-[(2,4-диметил-5-метоксифеніл)аміно]-64-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[(1-метилпіперидин-4-іл)метокси]хінолінметокси-7-[2-(1-метил-4-піперидиніл)метокси]-33-карбонітрил; хінолінкарбонітрил; 6-Метокси-4-[(5-метокси-2-метилфеніл)аміно]6-Метокси-7-[2-метоксіетокси]-4-[(3,4,57-[(1-метилпіперидин-4-іл)метокси]хінолін-3триметоксифеніл)аміно]-3-хінолінкарбонітрил; карбонітрил; 6-Метокси-7-[(1-метилпіперидин-4-іл)метокси]4-[(2-Хлор-5-метоксифеніл)аміно]-6-метокси-74-[(3,4,5-триметоксифеніл)аміно]-3[(1-метилпіперидин-4-іл)метокси]хінолін-3хінолінкарбонітрил; карбонітрил; 4-({3-Хлор-4-[(1-метил-1Н-імідазол-24-[(2,4-диметилфеніл)аміно]-6-метокси-7-[(1 19 77799 20 метилпіперидин-4-іл)метокси]хінолін-3фосфор у, або нерозбавленим, або, необов'язково, карбонітрил; у присутності співрозчинника, який включає в себе, 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6але ними не обмежується, дихлорметан, давала 7метокси-7-[3-(1-метилпіперидин-4заміщені-4-галоген-3-хінолінкарбонітрили 4, які іл)пропокси]хінолін-3-карбонітрил; потім взаємодіяли з аміном 1а, де R1 такий, як ви4-[(2-Хлор-5-метоксифеніл)аміно]-6-метокси-7значено тут, може здійснюватись в розчиннику, [3-(1-метилпіперидин-4-іл)пропокси]хінолін-3такому як 2-етоксіетанол, у присутності каталітичкарбонітрил; ної або еквівалентної кількості гідрохлориду піри6-Метокси-4-[(5-метокси-2-метилфеніл)аміно]дину з утворенням проміжних 7-заміщених-37-[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3хінолінкарбонітрилів формули (І). Переважно, амін карбонітрил; R1NH2 1a являє собою заміщений анілін, де R1 4-[(2,4-диметилфеніл)аміно]-6-метокси-7-[3-(1являє собою заміщений арил. метилпіперидин-4-іл)пропокси]хінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[3-(4-метил-1піперазиніл)пропокси]хінолін-3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[(1етилпіперидин-4-іл)метокси]-6-метоксихінолін-3карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-[(1-метилпіперидин-2-іл)метокси]хінолін3-карбонітрил; 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-7-(піперидин-4-ілметокси)хінолін-3Переважна сполука формули (І), одержана карбонітрил; способом за даним винаходом, являє собою: 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-{[34-[(2,4-дихлорфеніл)аміно]-7-(2(диметиламіно)пропіл]аміно}-6-метоксихінолін-3метоксіетокси)хінолін-3-карбонітрил; карбонітрил; 6-Бутокси-4-[(2,4-дихлор-54-[(2,4-дихлор-5-метоксифеніл)аміно]-7-{[3метоксифеніл)аміно]-7-(2-метоксіетокси)-3(диметиламіно)пропіл]-(метил)аміно}-6хінолінкарбонітрил; метоксихінолін-3-карбонітрил; і 6-Метокси-7-(4-метилпіперазин-1-іл)-4-(44-[(2,4-дихлор-5-метоксифеніл)аміно]-6феноксифеніламіно)хінолін-3-карбонітрил; і метокси-7-[(2-метоксіетил)аміно]хінолін-36-Метокси-7-(1-метилпіперидин-4-ілметокси)карбонітрил. 4-{[4-(піридин-3-ілокси)феніл]аміно}хінолін-3Альтернативний шлях одержання 7карбонітрил. заміщених-3-хінолінкарбонітрилів формули (І), як Переважна сполука формули 3, одержана за описано у схемі 2. 7-Фтор-4-оксо-1,4-дигідро-3способом за даним винаходом, вибрана з групи, хінолінкарбонітрили формули (II), де W' такий, як що включає: визначено тут, перетворюють до 7-заміщених-46-Метокси-7-(2-метоксіетокси)-4-оксо-1,4оксо-1,4-дигідро-3-хінолінкарбонітрилів 3, заміщудигідро-3-хінолінкарбонітрил; ючи 7-фтор груп у аніоном алкокси або тіоалкокси. 6-Метокси-7-(4-метил-піперазин-1-іл)-4-оксоЦю взаємодію можна здійснювати, використовую1,4-дигідрохінолін-3-карбонітрил; і чи як розчинник надлишок спирту або тіолу, або, 7-(2-Метоксіетокси)-4-оксо-1,4-дигідрохіноліннеобов'язково, можна використати співрозчинник, 3-карбонітрил. такий як Ν,Ν-диметилформамід, диметилсульфокВідповідно до альтернативного підходу, як посид або N-метилпіролідон. Аніон може бути одерказано на схемі 3, для одержання 7-заміщений-3жаний зі спирту або тіолу 2а, де X являє собою О хінолінкарбонітрилів формули (І) використовується або S, відповідно, використовуючи основи. Прийнзахисна група для гідроксигрупи при С-6 3ятні основи включають в себе натрій, гідрид нахінолінкарбонітрилі 5. Захисна група позначена як трію, калій і гідрид калію. Переважними основами R3' і включає в себе, але цим не обмежується, грує натрій і гідрид натрію. Якщо можливо, можуть пи, включаючи бензил та ізопропіл, які можуть використовува тись комерційно доступні натрієві бути видалені з одержанням 6-гідрокси похідного солі спирту або тіолу 2а, де X являє собою О або 6. Зокрема, якщо R3' являє собою бензильну захиS. Взаємодія 7-фтор-4-оксо-1,4-дигідро-3сну гр уп у, бажана гідроксигрупа може бути одерхінолінкарбонітрилів формули (II) зі сполукою фожана обробкою трифтороцтовою кислотою у прирмули R2XH 2а, де X являє собою -NH-, -NR2'-, і де сутності тіоанізолу. Крім того, якщо R3' являє R2' і R2, взяті разом з атомом азоту, до якого вони собою ізопропільну захисну групу, бажане 6приєднані, можуть, необов'язково, утворювати гідрокси похідне 6 може бути одержане обробкою гетероциклічне кільце, приводить до одержання 7трихлоридом алюмінію. Подальша взаємодія 6заміщених-4-оксо-1,4-дигідро-3гідрокси похідного 6 зі спиртом R3OH 6а у присутхінолінкарбонітрилів 3. Обробка 7-заміщених-4ності трифенілфосфіну (Ph3P), де Ph являє собою оксо-1,4-дигідро-3-хінолінкарбонітрилів 3 галогефеніл, і діетилазодикарбоксилату (DEAD) в рознуючим агентом PO(Z)3, де Ζ являє собою групу чиннику, такому як тетрагідрофуран, приводить до хлору або брому, яка включає в себе, але ними не одержання 4-галоген-3-хінолінкарбонітрилів 7. обмежується, оксихлорид фосфор у, оксибромід 21 77799 22 етил(етоксиметилен)ціаноацетатом, або самим по собі, або, необов'язково, у присутності співрозчинника, такого як толуол, при температурі в області від приблизно 60 до приблизно 120°С, з подальшою циклізацією при нагріванні, переважно, в евтектичній системі розчинників, яка включає суміш 3:1 дифенілового ефіру (Ph-O-Ph) і біфенілу (PhPh) при температурі в діапазоні від приблизно 240 до приблизно 260°С, що приводить до одержання Додаткові проміжні сполуки можуть бути оде7-фтор-4-оксо-1,4-дигідро-3-хінолінкарбонітрилів ржані, як показано на схемі 4, де 4-галоген-3формули (II). Альтернативно, анілін 12 піддають хінолінкарбонітрили 8, в яких R2 і R3', такі, як вивзаємодії з діетил(етоксиметилен)малонатом, або значено тут вище, піддають захисту, що приводить самим по собі, або, необов'язково, у присутності до одержання 6-гідроксихінолінів 9, використовуюспіврозчинника толуолу, при температурі в області чи реакційні умови такі, як вказані для видалення від приблизно 60 до приблизно 120°С. Подальша захисних груп на схемі 3. Наступна взаємодія 6циклізація при нагріванні, переважно, в евтектичгідрокси похідних 9 зі спиртом R3OH 6а у присутній системі розчинників, яка включає суміш 3:1 ності трифенілфосфіну (Ph3P), де Ph являє собою дифенілового ефіру і бі фенілу при температурі в феніл, і діетилазодикарбоксилату (DEAD) в розобласті від приблизно 240 до приблизно 260°С чиннику, такому як тетрагідрофуран, приводить до приводить до одержання складного ефіру 13. Гідодержання 4-галоген-3-хінолінкарбонітрилів 10, які роліз складного ефіру 13, переважно, в лужних можуть бути потім піддані взаємодії з аміном умовах, таких як гідроксид натрію в спиртовому R'NH2 1a, що приводить до одержання 7розчиннику, таким як етанол, при температурі кизаміщених-3-хінолінкарбонітрилїв 11. Переважно, піння зі зворотним холодильником, приводить до амін R'NH2 la являє собою заміщений анілін, де R' одержання карбонової кислоти 14. Перетворення являє собою заміщений арил. карбонової кислоти 14 в первинний амід 15 може бути здійснено за допомогою обробки активуючим агентом, який включає Ν,Ν-карбонілдіімідазол (GDI) або оксалілхлорид, з подальшим додаванням або газоподібного аміаку, або переважно водного розчину гідроксиду амонію. Дегідрування первинного аміду 15 за допомогою реагенту, такого як хлорангідрид ціануронової кислоти, в розчиннику, такому як Ν,Ν-диметилформамід, що приводить до одержання 7-фтор-4-оксо-1,4-дигідро-3хінолінкарбонітрилів формули (II). 7-Заміщені-4-оксо-1,4-дигідро-3хінолінкарбонітрили 3 і 7-заміщені-4-галоген-3хінолінкарбонітрили 4 являють собою ключові проміжні сполуки, що використовуються при одержанні 7-заміщених-3-хінолінкарбонітрилів формули (І). На схемі 5 показані два альтернативних шляхи одержання додаткових ключових проміжних сполук, 7-фтор-4-оксо-1,4-дигідро-3хінолінкарбонітрилів формули (II). Аніліни 12 можуть бути оброблені Альтернативно, сполуки формули (ІІ) можуть бути одержані, як показано на схемі 6, виходячи з відповідної антранілової кислоти або її складного ефіру 16, де R10 являє собою Η або алкіл, що містить від 1 до 6 атомів вуглецю, шляхом взаємодії з Ν,Ν-диметилформамід диметилацеталем або, переважно, з Ν,Ν-диметилформамід діетилацеталем, необов'язково, у присутності співрозчинника толуолу при близько 100-130°С з одержанням амідину 17. Взаємодія аніону ацетонітрилу, що, переважно, утворюється при взаємодії н-бутиллітію з 23 77799 24 ацетонітрилом в інертному розчиннику, такому як вище. Приклади алкокси груп включають в себе, тетрагідрофуран, при близько -78°С, з амідином але цим не обмежуються, метокси, етокси, н17 приводить до одержання сполук формули (II). пропокси, ізо-пропокси, н-бутокси, і трет-бутокси. Циклоалкіл, як тут використовується, означає насичену кільцеву систему, що містить від 3 до 10 атомів вуглецю. Переважним є вміст 3 або 7 атомів вуглецю. Приклади циклоалкільних кілець включають в себе, але цим не обмежуються, циклопропіл, циклобутил, циклопентил, циклогексил і тому подібне. Арил, як тут використовується, означає моно або біциклічне ароматичне кільце, що містить від 6 до 12 атомів вуглецю. Моноциклічні кільця, переважно, містять 6 членів, і біцикличні кільця, переважно, містять 8, 9, 10 або 12 членні кільцеві структури. Приклади арильних груп включають в себе феніл, альфа-нафтил, бета-нафтил, інден і тому подібне, незалежно заміщене одним або декількома замісниками, і, більш переважно, від 1 до 4 замісниками. Гетероарил означає незаміщене або необов'язково заміщене моноциклічне 5 або 6 членне кільСполуки за даним винаходом одержують з наце, яке містить від 1 до 4, або, зокрема, 1 або 2 ступних джерел: (а) комерційно доступні вихідні гетероатоми, які можуть бути однаковими або різпродукти, (b) відомі вихідні продукти, які можуть ними. Азот, кисень і сірка є переважними гетеробути одержані методами, описаними в літературі, атомами, за умови, що гетероарил не містить зв'яабо (с) нові проміжні сполуки, описані за допомозку О-О, S-S або S-O. Конкретні приклади гою схем і представлених тут експериментальних включають в себе тіофен, фуран, пірол, піразол, методів. імідазол, 1,2,3-триазол, 1,2,4-триазол, тетразол, Реакції здійснюють в розчиннику, відповідному тіазол, оксазол, ізотіазол, ізоксазол, 1,3,4для реагентів і продуктів, що використовуються, і оксадиазол, 1,2,4-оксадіазол, 1,3,4-тіадіазол, піривідповідному для здійснення необхідних перетводин, піримідин, піразин, пиридазин і 1,3,5-триазин. рень. Фахівцеві в галузі органічного синтезу зроГетероарильне кільце може бути окислене, коли зуміло, що різні функціональні групи, представлені гетероатом являє собою атом азоту, з одержанв молекулах, повинні відповідати хімічним переням відповідного N-оксиду, включаючи піридин-Nтворенням, що пропонуються. Їх необхідно оцінюоксид, або гетероциклічне кільце може містити вати з точки зору послідовності стадій синтезу, карбонільну гр упу на одному з атомів вуглецю, захисних груп, якщо бажано, і умов видалення наприклад як в 1,3,4-оксадіазол-2-оні. захисних гр уп. Біциклічний гетероарил, як тут використовуЗамісники, що є у вихідних продуктів, повинні ється, відноситься до насичених або частково небути сумісні з деякими реакційними умовами. Такі насичених біцикличних конденсованих кілець, що вимоги до замісників, які повинні відповідати реакмістять від 8 до 20 кільцевих атомів, що містять від ційним умовам, відомі фахівцям в даній галузі. 1 до 4 гетероатомів, які можуть бути однаковими Якщо необхідно, реакції проводять в атмосфері або різними, незалежно вибраними з азоту, кисню інертного газу. і сірки, необов'язково заміщеними від 1 до 3 незаФармацевтично прийнятні солі є похідними талежно вибраними замісниками, які можуть бути ких органічних і неорганічних кислот як: оцтова, однаковими або різними, за умови, що біцикличмолочна, лимонна, винна, янтарна, яблучна, маний гетероарил не містить зв'язку О-О, S-S або Sлонова, глюконова, хлористоводнева, бромистоO. Конкретні приклади включають в себе: індол, 2, воднева, фосфорна, азотна, сірчана, метансуль3-дигідроіндол, 2-індазол, ізоіндазол, хінолін, ізохіфонова і подібні відомі прийнятні кислоти. нолін, тетрагідрохінолін, бензофуран, бензотіоАлкіл, як тут використовується, означає радифен, бензімідазол, бензотриазол, бензотіазол, кал з розгалуженим або прямим ланцюгом, що бензоксазол, бензізоксазол, 1,2-бензопіран, циномістить від 1 до 6 атомів вуглецю, необов'язково лін, фталазин, хіназолін, 1,8-нафтиридин, піризаміщений. до[3,2-b]піридин, піридо[3,4-b]піридин, піридо[4,3Алкеніл, як тут використовується, означає раb]піридин, піридо[2,3-d]піримідин, пурин і птеридин дикал з розгалуженим або прямим ланцюгом, що і тому подібне. Одне або обидва кільця біцикличмістить від 2 до 6 атомів вуглецю, необов'язково ної кільцевої системи можуть бути частково насизаміщений. Ланцюг містить щонайменше один ченими, або повністю насиченими, і біциклична подвійний зв'язок. група може бути окислена по атому азоту, з одерАлкініл, як тут використовується, означає ражанням відповідного N-оксиду, такого як хінолін-Nдикал з розгалуженим або прямим ланцюгом, що оксид, або біциклична кільцева система може місмістить від 2 до 6 атомів вуглецю, необов'язково тити карбонільну групу на одному з атомів вуглезаміщений. Ланцюг містить щонайменше один цю, наприклад як в 2-інданоні. потрійний зв'язок. Гетероцикліл, гетероциклільна група або гетеАлкокси, як тут використовується, означає алроциклічне кільце означає насичений або частково кіл-О-групу, в якій алкільні групи такі, як описані 25 77799 26 ненасичений моноциклічний радикал, що містить, хінолінкарбоксамід переважно, від 3 до 8 кільцевих атомів, більш пеСуміш 7-фтор-6-метокси-4-оксо-1,4-дигідро-3реважно, від 3 до 7 кільцевих атомів, і, найбільш хінолінкарбонової кислоти (1,0г, 4,21ммоль) і Ν,Ν'переважно, від 5 до 6 кільцевих атомів, вибраних з карбонілдіімідазолу (1,51г, 9,28ммоль) в 14мл Ν,Νвуглецю, азоту, кисню і сірки, і при щонайменше 1 диметилформаміді нагрівають при 65°С протягом і, переважно від 1 до 4, більш переважно від 1 до 2 2год., потім охолоджують до кімнатної температуатомів азоту, кисню або сірки у вигляді кільцевих ри і виливають в 200мл водного гідроксиду амонію атомів. Конкретні приклад включають в себе, але на бані з крижаною водою. Розчин залишають пецим не обмежуються, морфолін, тіоморфолін, тіоремішуватись при кімнатній температурі протягом морфолін-S-оксид, тіоморфолін-S,S-діоксид, піпеночі і потім концентрують до невеликого об'єму. ридин, N-алкілпіперидин, піперазин, NДодають крижану воду з подальшим підкисленням алкілпіперазин, піролідин, азиридин, оксиран, тетоцтовою кислотою. Одержаний твердий продукт рагідротіофен, тетрагідрофуран, 1,2-піран, 1,4збирають шляхом фільтраційного промивання піран, діоксан, 1,3-діоксолан і тетрагідропіран. Геводою з одержанням 821мг 7-фтор-6-метокси-4тероциклільне кільце може бути окислене по триоксо-1,4-дигідро-3-хінолінкарбоксаміду у вигляді заміщеному атому азоту з одержанням відповіднотвердого продукту, т. пл. >300°С. го N-оксиду, наприклад, як в N-етилпіперазин-NMS 236, 8 (М+Н)+ оксиді, або гетероциклільне кільце може містити Дані аналізу для C11H9FN2O 3 -0,2 Н2 О карбонільну гр упу на одному з атомів вуглецю, Обчислено: С 55,09; Η 3,94; Ν 11,68. наприклад, як в піролідиноні. Для полегшення поЗнайдено: С 55,00; Η 3,63; Ν 11,49. дальшого розуміння винаходу, наступні необмеПосилальний приклад 4 жувальні приклади представлені для ілюстрації 7-Фтор-6-метокси-4-оксо-1,4-дигідро-3способу за даним винаходом. хінолінкарбонітрил Посилальний приклад 1 Суміш 7-фтор-6-метокси-4-оксо-1,4-дигідро-3Етил 7-фтор-6-метокси-4-оксо-1,4-дигідро-3хінолінкарбоксаміду (700мг, 3,0ммоль) і хлорангідхінолінкарбоксилат риду ціануронової кислоти (341мг, 1,65ммоль) в Суміш 3-фтор-4-метоксіаніліну (3,00г, 15мл Ν,Ν-диметилформаміду нагрівають при 65°С 21,26ммоль) і малонату діетилетоксиметилену протягом 6 годин, потім охолоджують до кімнатної (4,59г, 21,26ммоль) нагрівають при 110°С протятемператури і додають ще 206мг хлорангідриду гом 1 години, потім охолоджують до кімнатної теціануронової кислоти. Суміш нагрівають при 65°С мператури. Додають гексан, і тверді продукти збипротягом 4 годин, потім перемішують протягом рають шляхом фільтрації. Цей продукт ночі при кімнатній температурі. Реакційну суміш суспендують в 45мл суміші 3:1 дифенілового ефівиливають в крижану воду і нейтралізують насиру:біфенілу, і суміш нагрівають зі зворотним холоченим бікарбонатом натрію. Тверді продукти збидильником протягом 2 годин з одержанням розчирають шляхом фільтраційного промивання водою і ну коричневого кольору. Реакційну суміш гексаном з одержанням 610мг сирого продукту. охолоджують до кімнатної температури і додають Очищення за допомогою колонкової флешгексан. Одержаний твердий продукт збирають хроматографії, елююючи з градієнтом від 3% мешляхом фільтраційного промивання гексаном з танолу в дихлорметані до 10% метанолу в ди хлоодержанням 2,62г етил 7-фтор-6-метокси-4-оксорметані, приводить до одержання 272мг 7-фтор-61,4-дигідро-3-хінолінкарбоксилату у вигляді тверметокси-4-оксо-1,4-дигідро-3-хінолінкарбонітрилу, дого продукту, т. пл. >300°С. т. пл. 147-149°С. MS 265,9 (М+Н)+ MS 216,8 (М-Н)Дані аналізу для C13H12FNO 4 Дані аналізу для C11Η7FΝ2Ο2 - 0,1 дихлормеОбчислено: С 58,87; Η 4,56; Ν 5,28. тан Знайдено: С 58,66; Η 4,16; Ν 5,14. Обчислено: С 58,80; Η 3,19; Ν 12,36. Посилальний приклад 2 Знайдено: С 59,06; Η 2,96; Ν 11,97. 7-Фтор-6-метокси-4-оксо-1,4-дигідро-3Посилальний приклад 4 хінолінкарбонова кислота 7-Фтор-6-метокси-4-оксо-1,4-дигідро-3Суміш етил 7-фтор-6-метокси-4-оксо-1,4хінолінкарбонітрил дигідро-3-хінолінкарбоксилату (2,2г, 8,30ммоль) і Суміш 3-фтор-4-метоксіаніліну (15,31г, 13,2мл 1н гідроксиду натрію і 40мл етанолу нагрі108ммоль) і етил(етоксиметилен)ціаноацетату вають зі зворотним холодильником протягом 3 (18,36г, 108ммоль) в толуолі нагрівають при 100годин, потім охолоджують до кімнатної температу110°С протягом 4,5 годин, потім охолоджують до ри. Додають воду, і суміш підкисляють оцтовою кімнатної температури. Додають суміш 1:1 гексану кислотою. Одержаний твердий продукт збирають і етилацетату і суміш охолоджують на крижаній шляхом фільтраційного промивання водою з одебані. Тверді продукти збирають, промивають гекржанням 1,90г 7-фтор-6-метокси-4-оксо-1,4саном з одержанням першого збору в кількості дигідро-3-хінолінкарбонової кислоти у вигляді 26,10г і другого збору в кількості 1,24г. Порцію в твердого продукту, т. пл. 265-267°С. 2,0г цього продукту додають до 18мл суміші 3:1 MS 238,1 (М+Н)+ дифенілового ефіру:біфенілу, і нагрівають до киДані аналізу для C11H8FNO4 - 1,2 Н2О піння зі зворотним холодильником. Цю суміш наОбчислено: С 51,04; Η 4,03; N 5,41. грівають зі зворотним холодильником протягом 4 Знайдено: С 50,98; Η 3,95; Ν 5,33. годин, потім охолоджують і виливають в гексан. Посилальний приклад 3 Тверді продукти збирають шляхом фільтрації і 7-Фтор-6-метокси-4-оксо-1,4-дигідро-3промивають етилацетатомі гексаном з одержан 27 77799 28 ням 624мг 7-фтор-6-метокси-4-оксо-1,4-дигідро-3Знайдено: С 55,23; Η 4,30; Ν 8,87. хінолінкарбонітрилу у вигляді твердого продукту Посилальний приклад 8 коричневого кольору. Фільтрат концентрують, за4-Г(2,4-дихлор-5-метоксифеніл)аміно]-7-фторлишок розчиняють в етилацетаті і додають гексан. 6-метокси-3-хінолінкарбонітрил Одержаний твердий продукт збирають фільтруСуміш 4-хлор-7-фтор-6-метокси-3ванням з одержанням 1,07г 7-фтор-6-метокси-4хінолінкарбонітрилу (4,12г, 18ммоль) 2,4-дихлор-5оксо-1,4-дигідро-3-хінолінкарбонітрилу у вигляді метоксіаніліну (4,56г, 24ммоль) [Theodoridis, G.; твердого продукту жовтого кольору. Pestic. Sci. 1990, 30, 259) і гідрохлориду піридину Посилальний приклад 5 (2,31г, 19,9ммоль) в 45мл 2-етоксіетанолу нагрі4-Хлор-7-фтор-6-метокси-3-хінолінкарбонітрил вають при 120°С протягом 3 годин, потім охолоСуміш 7-фтор-6-метокси-4-оксо-1,4-дигідро-3джують до кімнатної температури. Реакційну суміш хінолінкарбонітрилу (1,0г, 4,59ммоль) і 14г оксихдодають до водного бікарбонату натрію і перемілориду фосфор у нагрівають зі зворотним холодишують протягом 20 хвилин. Тверді продукти збильником протягом 30 хвилин потім концентрують у рають шляхом фільтрації з одержанням 4,89г 4вакуумі. Залишок розподіляють між водним розчи[(2,4-дихлор-5-метоксифеніл)аміно]-7-фтор-6ном бікарбонату натрію і етилацетатом. Органічметокси-3-хінолінкарбонітрилу, т. пл. >260°С. ний шар сушать над сульфа том магнію, фільтруHRMS теоретично 392,03634; знайдено ють і концентрують на силікагелі. Очищення за 392,03556 (М+Н)+ допомогою колонкової флеш-хроматографії, елюДані аналізу для C18H12Cl2FN3 O2 - 2,0 Н2О юючи з градієнтом від 1:5 етилацетат:гексан до 1:1 Обчислено: С 50,48; Η 3,77; Ν 9,81. етилацетат:гексан, приводить до одержання 631мг Знайдено: С 50,41; Η 2,82; Ν 9,78. 4-хлор-7-фтор-6-метокси-3-хінолінкарбонітрилу, т. Посилальний приклад 9 пл. 160-162°С. 4-Циклопентиламіно-7-фтор-6-метокси-3MS 236,9 (М+Н)+ хінолінкарбонітрил Дані аналізу для C11H6ClFN2O Суміш 4-хлор-7-фтор-6-метокси-3Обчислено: С 55,83; Η 2,56; Ν 11,84. хінолінкарбонітрилу (400мг, 1,69ммоль) і циклопеЗнайдено: С 55,66; Η 2,84; Ν 11,91. нтиламіну (307мг, 3,72ммоль) в 11мл 2Посилальний приклад 6 етоксіетанолу нагрівають при 100°С протягом 1,5 6-Метокси-7-(2-метоксіетокси)-4-оксо-1,4годин, потім охолоджують до кімнатної температудигідро-3-хінолінкарбонітрил ри. Реакційну суміш концентрують у вакуумі, і до Натрій (84мг, 3,67ммоль) додають до 3,6мл 2залишку додають водний бікарбонат натрію. Після метоксіетанолу, і суміш нагрівають зі зворотним перемішування протягом 20 хвилин, тверді продухолодильником протягом 90 хвилин. Додають 7кти збирають шляхом фільтрації. Очи щення за фтор-6-метокси-4-оксо-1,4-дигідро-3допомогою препаративної тонкошарової хроматохінолінкарбонітрил (200мг, 0,92ммоль), і реакційну графії, елююючи 5% метанолом в дихлорметані, з суміш нагрівають зі зворотним холодильником подальшим розтиранням в діетиловому ефірі і протягом 4 годин, потім перемішують при кімнатній гексані, дають 359мг 4-циклопентиламіно-7-фтортемпературі протягом ночі. Реакційну суміш вили6-метокси-3-хінолінкарбонітрилу, т. пл. 162-164°С. вають в крижану воду і підкисляють оцтовою кисMS 286,13 (М+Н)+ лотою. Тверді продукти збирають шляхом фільтДані аналізу для C16H16FN3 O - 0,25 Н2 О рації, промиваючи етилацетатом і гексаном, з Обчислено: С 66,31; Η 5,74; Ν 14,50. одержанням 234мг 6-метокси-7-(2-метоксіетокси)Знайдено: С 66,38; Η 5,80; Ν 14,45. 4-оксо-1,4-дигідро-3-хінолінкарбонітрилу, т. пл. Посилальний приклад 10 >300°С. 4-Бутиламіно-7-фтор-6-метокси-3MS 272,9 (М-Н)хінолінкарбонітрил Дані аналізу для C14H14N2O4 - 0,15 етилацетаСуміш 4-хлор-7-фтор-6-метокси-3ту хінолінкарбонітрилу (300мг, 1,27ммоль) і бутилаОбчислено: С 60,99; Η 5,31; Ν 9,75. міну (205мг, 2,80ммоль) в 10мл 2-етоксіетанолу Знайдено: С 61,12; Η 5,29; Ν 9,49. нагрівають при 80°С протягом 1,5 годин, потім Посилальний приклад 7 охолоджують до кімнатної температури. Реакційну 4-Хлор-6-метокси-7-(2-метоксіетокси)-3суміш концентрують у вакуумі, і до залишку додахінолінкарбонітрил ють водний бікарбонат натрію. Після перемішуСуміш 6-метокси-7-(2-метоксіетокси)-4-оксовання протягом 20 хвилин тверді продукти збира1,4-дигідро-3-хінолінкарбонітрилу (180мг, ють шляхом фільтрації. Очищення за допомогою 0,66ммоль) і 2,02г оксихлориду фосфору нагрівапрепаративної тонкошарової хроматографії, елюють зі зворотним холодильником протягом 40 хвиюючи 2% метанолом в дихлорметані, приводить лин, потім концентрують у вакуумі. Залишок додадо одержання 230мг 4-бутиламіно-7-фтор-6ють у воду, і рН встановлюють таким, що дорівнює метокси-3-хінолінкарбонітрилу, т. пл. 155-156°С. 8, шляхом додавання водного бікарбонату натрію. MS 274,2 (М+Н)+ Тверді продукти збирають шляхом фільтрації, Дані аналізу для C15H16FN3 O - 0,2 Н 2О промиваючи водою і гексаном, з одержанням Обчислено: С 65,06; Η 5,98; Ν 15,17. 169мг 4-хлор-6-метокси-7-(2-метоксіетокси)-3Знайдено: С 65,02; Η 5,91; Ν 15,03. хінолінкарбонітрилу, т. пл. 178-180°С. Посилальний приклад 11 MS 292,9 (М+Н)+ 6-Бензилокси-7-фтор-4-оксо-1.4-дигідро-3Дані аналізу для C14H14N2O 4 - 0,60 Н2O хінолінкарбонітрил Обчислено: С 55,39; Η 4,70; Ν 9,23. Суміш 4-бензилокси-3-фторанилина (6,06г, 29 77799 30 27,9ммоль) (US 5622967) і етил (етоксиметихвилин, потім перемішують при кімнатній темперален)ціаноацетату (5,08г, 30,0ммоль) нагрівають турі протягом ночі. Реакційну суміш концентрують при 120°С протягом 45 хвилин, потім охолоджують у вакуумі і очищають за допомогою колонкової до кімнатної температури. Цей твердий продукт флеш-хроматографії, елююючи з градієнтом від додають порціями до суміші 3:1 дифенілового 1% етилацетату в гексані до 5% етилацетату в ефіру:бі фенілу при 245°С. Цю суміш нагрівають гексані, що приводить до одержання 4-хлор-6при 245°С протягом 3 годин, потім охолоджують і етокси-7-фтор-3-хінолінкарбонітрилу, т. пл. 165тверді продукти збирають шляхом фільтрації, 166°С. промивають гексаном і діетиловим ефіром з одерMS 251,0 (М+Н)+ жанням 2,60г 6-бензилокси-7-фтор-4-оксо-1,4Дані аналізу для C12H8CIFN2O дигідро-3-хінолінкарбонітрилу, т. пл. >250°С. Обчислено: С 57,50; Η 3,22; Ν 11,18. MS 293,1 (М-Н)Знайдено: С 57,24; Η 3,41; Ν 11,09. Посилальний приклад 12 Посилальний приклад 15 6-Бензилокси-4-хлор-7-фтор-37-Фтор-6-метокси-4-[(3,4,5хінолінкарбонітрил триметоксифеніл)аміно]-3-хінолінкарбонітрил Суміш 7-фтор-6-метокси-4-оксо-1,4-дигідро-3Суміш 4-хлор-7-фтор-6-метокси-3хінолінкарбонітрилу (645мг, 2,19ммоль) і 10мл хінолінкарбонітрилу (500мг, 2,11ммоль), 3,4,5оксихлориду фосфору нагрівають при 115°С протриметоксіаніліну (515мг, 2,81ммоль) і гідрохлоритягом 1,5 годин, потім концентрують у вакуумі. ду піридину (270мг, 2,33ммоль) в 20мл 2Залишок обробляють крижаним водним розчином етоксіетанолу нагрівають зі зворотним холодильгідроксиду амонію, і одержаний твердий продукт ником протягом 4 годин, потім охолоджують до збирають фільтруванням. Очищення за допомокімнатної температури. Реакційну суміш виливагою колонкової флеш-хроматографії, елююючи з ють у водний розчин бікарбонату натрію і переміградієнтом від 1% етилацетату в гексані до 6% шують при кімнатній температурі протягом 15 хвиетилацетату в гексані, приводить до одержання лин. Твердий продукт збирають фільтруванням і 284мг 6-бензилокси-4-хлор-7-фтор-3розподіляють між водою і етилацетатом. Органічхінолінкарбонітрилу, т. пл. 159-160°С. ний шар сушать над сульфа том магнію, фільтруMS 313,13 (М+Н)+ ють і концентрують у вакуумі. Розтирання залишку Дані аналізу для C17H10ClFN2O з етилацетатом і діетиловим ефіром приводить до Обчислено: С 65,15; Η 3,06; Ν 8,82. одержання 512мг 7-фтор-6-метокси-4-[(3,4,5Знайдено: С 65,29; Η 3,22; Ν 8,96. триметоксифеніл)аміно]-3-хінолінкарбонітрилу, т. Посилальний приклад 13 пл. 215-217°С. 4-Хлор-7-фтор-6-гідрокси-3-хінолінкарбонітрил MS 384,10 (М+Н)+ Суміш 6-бензилокси-4-хлор-7-фтор-3Дані аналізу для C20H18Cl2FN3 О4 - 0,8 Н2О хінолінкарбонітрилу (733мг, 2,34ммоль) і 1мл тіоОбчислено: С 60,39; Η 4, 97; Ν 10,56. анізолу в 12мл трифтороцтової кислоти нагрівають Знайдено: С 60,75; Η 4,86; Ν 10,16. зі зворотним холодильником протягом 9 годин, Посилальний приклад 16 потім концентрують у вакуумі. Залишок обробля2-Φτορ-1-(2-метоксіетокси)-4-нітробензол ють крижаною водою і потім підлуговують до рН 9Суміш 2-фтор-5-нітрофенолу (10,0г, 10 шляхом додавання водного гідроксиду амонію. 63,7ммоль), 2-брометилметилового ефіру (15,0г, Одержаний твердий продукт збирають фільтру107,9ммоль) і карбонату калію (26,5г, 192ммоль) в ванням і промивають діетиловим ефіром. Фільтрат 40мл Ν,Ν'-диметилформаміду нагрівають при 70°С екстрагують 10% метанолом в етилацетаті. Оргапротягом 4 годин, потім охолоджують до кімнатної нічний шар сушать над сульфатом натрію, фільттемператури і виливають на лід. Твердий продукт рують і концентрують у вакуумі. Залишок об'єднузбирають фільтруванням, промивають водою і ють з твердим продуктом, одержаним спочатку, і сушать з одержанням 12,0г 2-фтор-1-(2цей продукт розчиняють в 5% метанолі в етилацеметоксіетокси)-4-нітробензолу, т. пл. 62-63°С. таті і абсорбують на силікагелі. Очищення за доMS 216,02 (М+Н)+ помогою колонкової флеш-хроматографії, елюююДані аналізу для C9H10FNO4 чи з градієнтом від гексану до зменшеної кількості Обчислено: С 50,24; Η 4,68; Ν 6,51. етилацетату в гексані до 5% метанолу в етилацеЗнайдено: С 50,24; Η 4,67; Ν 6,49. таті приводить до одержання 260мг 4-хлор-7Посилальний приклад 17 фтор-6-гідрокси-3-хінолінкарбонітрилу, т. пл. 3-Фтор-4-(2-метоксіетокси)анілін >250°С. Суміш 2-фтор-1-(2-метоксіетокси)-4MS 220,9 (М-Н)нітробензолу (12,0г, 55,7ммоль), порошку заліза Дані аналізу для C10H4ClFN2O (10,3г, 180ммоль) і хлориду амонію (14,5г, Обчислено: С 53,96; Η 1,81; Ν 12,58. 270ммоль) в 170мл етанолу і 50мл води нагріваЗнайдено: С 54,23; Η 2,02; Ν 12,06. ють зі зворотним холодильником протягом 1,5 гоПосилальний приклад 14 дин, потім фільтрують гарячим через пад з діато4-Хлор-6-етокси-7-фтор-3-хінолінкарбонітрил мової землі, промиваючи етанолом. Фільтрат До суміші при 0°С 4-хлор-7-фтор-6-гідрокси-3охолоджують до кімнатної температури і тверді хінолінкарбонітрилу (185мг, 0,83ммоль), трифеніпродукти, що випали в осад, видаляють фільтрулфосфін у (392мг, 1,49ммоль) і етанолу (153мг, ванням. Фільтрат концентрують до невеликого 3,32ммоль) в 15мл тетрагідрофурану додають об'єму і розподіляють між етилацетатом і водою. діетилазодикарбоксилат (260мг, 1,80ммоль). РеаОрганічний шар сушать над сульфатом магнію, кційну суміш ви тримують при 0°С протягом 45 фільтрують і концентрують у вакуумі з одержан 31 77799 32 ням 9,45г 3-фтор-4-(2-метоксіетокси)анілін у ви8, суміш 4-хлор-6-етокси-7-фтор-3гляді рідини коричневого кольору. хінолінкарбонітрилу (197мг, 0,78ммоль), 2,4MS 186,13 (М+Н)+ дихлор-5-метоксіаніліну (220мг, 1,14ммоль) і гідроДані аналізу для C9H12FNO2 - 0,2еквів. Н2О хлориду піридину (120мг, 1,04ммоль) приводить Обчислено: С 57,25; Η 6,62; Ν 7,46. до одержання, після обробки флешЗнайдено: С 57,55; Η 6,27; Ν 7,50. хроматографією, елююючи з градієнтом від дихПосилальний приклад 18 лорметану до 1% метанолу в дихлорметані, 183мг 4-Хлор-7-фтор-6-(2-метоксіетокси)-34-[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7хінолінкарбонітрил фтор-3-хінолінкарбонітрилу, т. пл. 184-186°С. Слідуючи способу за посилальний прикладом MS 406,0 (М+Н) 4, суміш 3-фтор-4-(2-метоксіетокси)аніліну (6,39г, Дані аналізу для C19H14CI2 FN3O 2 - 0,5 Н2 О 34,5ммоль) і етил(етоксиметилен)ціаноацетату Обчислено: С 54,96; Η 3,64; Ν 10,12. (5,84г, 34,5ммоль) приводить до одержання 7,62г Знайдено: С 54,99; Η 3,59; Ν 10,05. твердого продукту коричневого кольору. Слідуючи Посилальний приклад 22 способу за посилальний прикладом 5, цей твердий 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-фторпродукт перетворюють в 6,0г 4-хлор-7-фтор-6-(26-(2-метоксіетокси)-3-хінолінкарбонітрил метоксіетокси)-3-хінолінкарбонітрилу, т. пл. 130Суміш 4-хлор-7-фтор-6-(2-метоксіетокси)-3138°С. хінолінкарбонітрилу (1,00г, 3,59ммоль), 2,4MS 281,02, 282,98 (М+НН дихлор-5-метоксіаніліну (727мг, 3,77ммоль) і гідроДані аналізу для C3H10ClFN2O2 - 0,1екв. Н2О хлориду піридину (620мг, 5,34ммоль) у 18мл 2Обчислено: С 55,27; Η 3,64; Ν 9,92. етоксіетанолу нагрівають при 100-105°С протягом Знайдено: С 55,02; Η 3,64; Ν 9,64. 2 годин. Реакційну суміш прохолоджують до кімнаПосилальний приклад 19 тної температури і потім виливають у крижаний 4-({3-Хлор-4-[(1-метил-1Н-імідазол-2насичений розчин бікарбонату натрію. Тверді проіл)сульфаніл]феніл}аміно)-7-фтор-6-(2дукти збирають, промивають водою і потім обробметоксіетокси)-3-хінолінкарбонітрил ляють метанолом і дихлорметаном. Суміш фільтСуміш 4-хлор-7-фтор-6-(2-метоксіетокси)-3рують і фільтрат концентрують. Твердий продукт хінолінкарбонітрилу (2,72г, 9,7ммоль), 3-хлор-4-[(1залишок переводять у суспензію в гексані, і тверді метил-1Н-імідазол-2-іл)тіо]бензаміду (US4973599) продукти збирають шляхом фільтрації з одержан(2,56г, 10,6ммоль) і гідрохлориду піридину (1,2г, ням 1,15г 4-[(2,4-дихлор-5-метоксифеніл)аміно]-710,4ммоль) в 35мл 2-етоксіетанолу нагрівають при фтор-6-(2-метоксіетокси)-3-хінолінкарбонітрилу, т. 110°С протягом 1,5год., потім охолоджують до пл. 170-172°С. кімнатної температури. Тверді продукти збирають HRMS теоретично 436,06256; знайдено шляхом фільтрації, промивають діетиловим ефі436,06093 (М+Н)+ ром і суспендують в насиченому розчині бікарбоДані аналізу для C20H16CI2 FN3O 3 - 0,4 Н2 О нату натрію. Після перемішування протягом 1,5 Обчислено: С 54,16; Η 3,81; N 9,48. годин тверді продукти збирають шляхом фільтраЗнайдено: С 53,90; Η 3,89; Ν 9,36. ції з одержанням 2,92г 4-({3-хлор-4-[(1-метил-1НПосилальний приклад 23 імідазол-2-іл)сульфаніл]феніл}-аміно)-7-фтор-6-(26-Бензилокси-4-гідрокси-7-(2-метоксіетокси)-3метоксіетокси)-3-хінолінкарбонітрилу, т. пл. 265хінолінкарбонітрил 270°С. Слідуючи способу, що використовується при MS 484,05 (М+Н)+ одержанні за посилальним прикладом 6, взаємоДані аналізу для C23H19CIFN5 O2S - 1,7 Н2О дія 6-бензилокси-4-гідрокси-7-фтор-3Обчислено: С 53,69; Η 4,39; Ν 13,61. хінолінкарбонітрилу і 2-метоксіетанолу приводить Знайдено: С 53,47; Η 4,11; Ν 13,39. до одержання 6-бензилокси-4-гідрокси-7-(2Посилальний приклад 20 метоксіетокси)-3-хінолінкарбонітрилу з виходом 4-({3-Хлор-4-[(1-метил-1Н-імідазол-286%, т. пл. >250°С. іл)сульфаніл]феніл}аміно)-7-фтор-6-метокси-3MS 351,2 (М+Н)+ хінолінкарбонітрил Посилальний приклад 24 Слідуючи способу за посилальним прикладом 6-Бензилокси-4-хлор-7-(2-метоксіетокси)-319, суміш 4-хлор-7-фтор-6-метокси-3хінолінкарбонітрил хінолінкарбонітрилу (2,30г, 9,72ммоль), 3-хлор-4Слідуючи способу, що використовується при [(1-метил-1Н-імідазол-2-іл)тіо]бензаміду одержанні за посилальним прикладом 12, взаємо(US4973599) (2,56г, 10,6ммоль) і гідрохлориду підія 6-бензилокси-4-гідрокси-7-(2-метоксіетокси)-3ридину (1,2г, 10,4ммоль) приводить до одержання хінолінкарбонітрил з фосфороксихлоридом приво3,00г 4-({3-хлор-4-[(1-метил-1Н-імідазол-2дить до одержання 6-бензилокси-4-хлор-7-(2іл)сульфаніл]феніл}аміно)-7-фтор-6-метокси-3метоксіетокси)-3-хінолінкарбонітрилу з виходом хінолінкарбонітрилу, т. пл. 290-294°С. 67%, т. пл. 142-145°С. MS 440,20, 442,21, 443,22 (М+Н)+ MS 369,1 (M+H)+ Дані аналізу для C21H15ClFN5OS - 0,4 Н2О Дані аналізу для C20H17CIN2O 3 Обчислено: С 56,41; Η 3,56; Ν 15,67. Обчислено: С 65,13; Η 4,65; Ν 7,60. Знайдено: С 56,63; Η 3,25; Ν 15,28. Знайдено: С 64,92; Η 4,90; Ν 7,48. Посилальний приклад 21 Посилальний приклад 25 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-64-Хлор-6-гідрокси(2-метоксіетокси)-3етокси-7-фтор-3-хінолінкарбонітрил хінолінкарбонітрил Слідуючи способу за посилальним прикладом Суміш 6-бензилокси-4-хлор-7-(2 33 77799 34 метоксіетокси)-3-хінолінкарбонітрилу (512мг, Обчислено: С 56,22; Η 4,31; N 11,40. 1,39ммоль) і 0,9мл тіоанізолу в 7,5мл трифтороцЗнайдено: С 55,91; Η 4,44; Ν 11,10. тової кислоти нагрівають зі зворотним холодильПосилальний приклад 29 ником протягом 3 годин, потім концентрують у ва6-метокси-7-(4-метил-піперазин-1-іл)-4-оксокуумі. Залишок обробляють крижаною водою і 1,4-дигідрохінолін-3-карбонітрил потім підлуговують до рН 9-10 шляхом додавання Суміш 200мг (0,92ммоль) 7-фтор-6-метокси-4водного гідроксиду амонію. Одержану суспензію оксо-1,4-дигідрохінолін-3-карбонітрилу (посилальекстрагують етилацетатом. Органічний шар проний приклад 24) і 551мг (5,50ммоль) Nмивають насиченим сольовим розчином, сушать метилпіперазину в 1мл 1-метил-2-піролідинону над сульфатом натрію, фільтрують і концентрують нагрівають при 90°С протягом 8 годин, потім при у вакуумі. Розтирання з діетиловим ефіром приво105°С протягом ще 16 годин. Розчинники видалядить до одержання 302мг 4-хлор-6-гідрокси-7-(2ють у вакуумі. До маслянистого залишку, що заметоксіетокси)-3-хінолінкарбонітрилу, т. пл. 174лишився, додають 2мл води і 5мл метанолу. Роз175°С. чинники знову видаляють у вакуумі. Сирий продукт MS 279,0 (М+Н)+ очищають за допомогою хроматографії на силікаДані аналізу для С 13Н11СlN2О3 - 0,8 Н2О гелі, використовуючи градієнт метиленхлоОбчислено: С 53,27; Η 4,33; Ν 9,56. рид/метанол (9:1 до 4:1) з одержанням 152мг 6Знайдено: С 53,39; Η 4,36; Ν 9,71. метокси-7-(4-метил-піперазин-1-іл)-4-оксо-1,4Посилальний приклад 26 дигідрохінолін-3-карбонітрилу у вигляді твердого 6-Бутокси-4-хлор-7-(2-метоксіетокси)-3продукту жовтого кольору, розкл. >235°С. 1 хінолінкарбонітрил Н ЯМР (ДМСО-d 6): d 2,33 (с, 3Н), 3,13 (шир. с, Слідуючи способу, що використовується при 4Н), 3,32 (шир. с, 4Н), 3,89 (с, 3Н), 6,98 (с, 1Н), 7,43 одержанні за посилальним прикладом 14, взаємо(с, 1Н), 8,55 (с, 1Н), 12,43 (шир. с, 1Н). дія 4-хлор-6-гідрокси-7-(2-метоксіетокси)-3MS (ES, метод негативних іонів): m/z обчислехінолінкарбонітрилу з трифенілфосфіном, діетилано для C16H19N4O 2: 298,1, знайдено: 297,2 (М-Н)-. зодикарбоксилатом і н-бутанолом приводить до Посилальний приклад 30 одержання 6-бутокси-4-хлор-7-(2-метоксіетокси)-3Етил 2{[(1Е)хінолінкарбонітрилу з виходом 71 %, т. пл. 128(диметиламіно)метилиден]аміно}-4-фторбензоат 130°С. Суспензію 2-аміно-4-фторбензойної кислоти MS 335,1 (М+Н)+ (10,2г, 65,8ммоль) і діетилацеталю диметилфорДані аналізу для C17H19CIN2O 3 маміду (58мл) нагрівають зі зворотним холодильОбчислено: С 60,99; Η 5,72; Ν 8,37. ником протягом 6 годин. Розчин охолоджують до Знайдено: С 61,05; Η 5,82; Ν 8,10. кімнатної температури і концентрують у вакуумі. Посилальний приклад 27 Темну олію пропускають через пад з вологого си4-Хлор-7-фтор-6-(2-морфолін-4-ілетокси)-3лікату магнію, елююючи за допомогою метиленхінолінкарбонітрил хлориду з одержанням 17,16г етил 2-{[(1Е)Слідуючи способу, що використовується при (диметиламіно)метилиден]аміно}-4-фторбензоату одержанні за посилальним прикладом 14, взаємоу вигляді червоної олії. дія 4-хлор-7-фтор-6-гідрокси-3-хінолінкарбонітрилу MS 239,1 (М+Н)+ з трифенілфосфіном, діетилазодикарбоксилатом і Дані аналізу для C12H15FN2 O2 - 0,20 Н2О 4-(2-гідроксіетил)морфоліном приводить до одерОбчислено: С 59,59; Η 6,42; Ν 11,58. жання 4-хлор-7-фтор-6-(2-морфолін-4-ілетокси)-3Знайдено: С 59,84; Η 6,25; Ν 11,29. хінолінкарбонітрилу з виходом 57%. За допомогою Посилальний приклад 31 препаративної тонкошарової хроматографії одер7-Фтор-4-гідроксихінолін-3-карбонітрил жують аналітичний зразок, елююючи 1% метаноДо розчину 2,5Μ н-бутиллітію в тетрагідрофулом в етилацетаті, т. пл. 163-164°С. рані (53,6мл, 134ммоль) у 54мл тетрагідрофурану MS 336,1 (М+Н)+ при -78°С додають краплями розчин ацетонітрилу Дані аналізу для C16H15CIFN3 O2 - 0,13 етила(7,1мл, 136ммоль) у 100мл тетрагідрофурану. Пісцетат ля перемішування при -78°С протягом 10 хвилин, Обчислено: С 57,15; Η 4,66; Ν 12,10. додають протягом 1,5 годин розчин етил 2-{[(1Е)Знайдено: С 57,03; Η 4,60; Ν 11,96. (диметиламіно)метиліден]аміно}-4-фторбензоату Посилальний приклад 28 (14,5г, 60,9ммоль) у 100мл тетрагідрофурану. Піс4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-фторля перемішування при -78°С протягом 2 годин, 6-(2-морфолін-4-ілетокси)-3-хінолінкарбонітрил температурі реакції дають можливість повільно Слідуючи способу за посилальним прикладом піднятись до -10°С. Суміш потім охолоджують до 8, суміш 4-хлор-7-фтор-6-(2-морфолін-4-ілетокси)78°С, і краплями додають оцтову кислоту (18,3г, 3-хінолінкарбонітрилу (136мг, 0,41ммоль), 2,4305ммоль). Реакційної суміші дають нагрітись до дихлор-5-метоксіаніліну (90,5мг, 0,47ммоль) і гідкімнатної температури і перемішують протягом 3 рохлориду піридину (95мг, 0,82ммоль) приводить днів. Осад збирають шляхом фільтраційного продо одержання, після препаративної тонкошарової мивання тетрагідрофураном, водою, діетиловим хроматографії, елююючи 7% метанолом в дихлоефіром, етилацетатом і потім ще діетиловим ефірметані, 58мг 4-[(2,4-дихлор-5ром з одержанням 7,95г 7-фтор-4-гідроксихінолінметоксифеніл)аміно]-7-фтор-6-(2-морфолін-43-карбонітрилу у вигляді твердого продукту не ілетокси)-3-хінолінкарбонітрилу, т. пл. 166-168°С. зовсім білого кольору, т. пл. >250°С. MS 488, 9 (М-Н)MS 187,0 (М-Н)-. Дані аналізу для C23H21CI2 FN4O 3 Дані аналізу для C10H5FN2O - 0,20 Н2О 35 77799 36 Обчислено: С 62,63; Η 2,84; Ν 14,61. 4-Хлор-6-метокси-7-(4-метилпіперазин-1Знайдено: С 62,55; Η 2,71; Ν 14,29. іл)хінолін-3-карбонітрил Посилальний приклад 32 Реакційну суміш 0,3г (1,01ммоль) 6-метокси-74-Хлор-7-фторхінолін-3-карбонітрил (4-метил-піперазин-1-іл)-4-оксо-1,4-дигідрохінолінСуміш 7-фтор-4-гідроксихінолін-3-карбонітрилу 3-карбонітрилу в 5мл оксихлориду фосфору нагрі(2,02г, 10,7ммоль) і декілька крапель Ν,Νвають при 105°С протягом 45 хвилин. Після оходиметилформаміду в 16,0мл тіонілхлориду нагрілоджування суміш концентрують досуха у вакуумі вають зі зворотним холодильником протягом 1,5 з одержанням твердого продукту коричневого когодин. Реакційну суміш концентрують у вакуумі і льору. До цього продукту додають 5мл толуолу, і додають толуол (20мл), і суміш знову концентрурозчин знову концентрують досуха. До залишку ють у вакуумі з одержанням 2,18г 4-хлор-7краплями додають охолоджений на льоду насичефтор хінолін-3-карбонітрилу у вигляді твердого ний водний розчин карбонату натрію. Цю суміш продукту жовтого кольору, т. пл. 163-165°С. екстрагують 5X25мл 95:5 сумішшю метиленхлоMS 207,0 (М+Н)+ рид/метанол. Органічний шар суша ть над сульфаПосилальний приклад 33 том магнію. Сульфат магнію видаляють фільтру4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-фторванням, і розчинник видаляють у вакуумі з 3-хінолінкарбонітрил одержанням 0,255г 4-хлор-6-метокси-7-(4Слідуючи способу за посилальним прикладом метилпіперазин-1-іл)-хінолін-3-карбонітрилу у ви8, суміш 4-хлор-7-фтор-3-хінолінкарбонітрилу гляді твердого продукту жовтого кольору, т. пл. (2,10г, 10,2ммоль), 2,4-дихлор-5-метоксіаніліну 177-179°С. (2,15г, 11,2ммоль) і гідрохлориду піридину (1,18г, MS (ES, метод позитивних іонів): m/z обчисле10,2ммоль) приводять до одержання 1,78г 4-[(2,4но протягом C16H17ClN4O: 316,1, знайдено: 317,0 дихлор-5-метоксифеніл)аміно]-7-фтор-3(М+Н)+. хінолінкарбонітрилу, т. пл. 199-201°С. Дані аналізу для C16H17ClN4O - 0,1 Н 2О MS 360,0 (М-Н)Обчислено: С 60,32; Η 5,36; Ν 17,59. Дані аналізу для C17H10Cl2FN3 O - 0,4 Н2 О Знайдено: С 60,00; Η 5,35; Ν 17,82. Обчислено: С 55,28; Η 2,95; Ν 11,38. Наступні посилальні приклади 37-41 здійснюЗнайдено: С 55,45; Η 2,98; Ν 11,13. ють способом, аналогічним способу за посилальПосилальний приклад 34 ним прикладом 8, і використовуючи відповідний 7-(2-Метоксіетокси)-4-оксо-1,4-дигідрохінолінзаміщений анілін. 3-карбонітрил Посилальний приклад 37 Суміш гідриду натрію (500мг, 12,5ммоль) і 74-[(2,4-Дихлорфеніл)аміно1-7-фтор-6фтор-4-гідроксихінолін-3-карбонітрилу (1,30г, метоксихінолін-3-карбонітрил 6,9ммоль) в 2-метоксіетанолі (30мл) нагрівають зі т. пл. 226-229°С; Мас спектр 362,0 (ES+) зворотним холодильником протягом ночі. Додають Посилальний приклад 38 додаткову кількість гідриду натрію (250мг, 4-[(2,4-Диметил-5-метоксифеніл)аміно]-76,25ммоль), і реакційну суміш нагрівають зі зворофтор-6-метоксихінолін-3-карбонітрил тним холодильником протягом ночі. Додають дот. пл. 152-153°С; Мас спектр 350,0 (ES+) даткову кількість гідриду натрію (250мг, Посилальний приклад 39 6,25ммоль), і реакційну суміш нагрівають зі зворо4-[(2-Хлор-5-метоксифеніл)аміно]-7-фтор-6тним холодильником протягом 8 годин. Реакційну метоксихінолін-3-карбонітрил суміш охолоджують до кімнатної температури і т. пл. 237°С з розкл.; Мас спектр 356,0 (ES-) розподіляють між етилацетатом і насиченим розПосилальний приклад 40 чином бікарбонату натрію. Основний шар підкис7-Фтор-6-метокси-4-[(5-метокси-2ляють водним НСl, і одержаний твердий продукт метилфеніл)аміно]-хінолін-3-карбонітрил збирають фільтруванням з одержанням 1,05г 7-(2т. пл. 169-171°С; Мас спектр 338,0 (ES +) метоксіетокси)-4-оксо-1,4-дигідрохінолін-3Посилальний приклад 41 карбонітрилу у вигляді твердого продукту, т. пл. 4-[(2,4-Диметилфеніл)аміно]-7-фтор-6>250°С. метоксихінолін-3-карбонітрил MS 243,1 (М-Н)т. пл. 184-185°С; Мас спектр 320,1 (ES-) Дані аналізу для C13H12N2O 3 - 0,25 Н2О Посилальний приклад 42 Обчислено: С 62,77; Η 5,07; Ν 11,26. 4-Хлор-6-метокси-7-[(1-метилпіперидин-4Знайдено: С 62,53; Η 4,68; Ν 11,22. іл)метокси]хінолін-3-карбонітрил Посилальний приклад 35 Суміш 7-фтор-6-метокси-4-оксо-1,4-дигідро-34-Хлор-7-(2-метоксіетокси)хінолін-3хінолінкарбонітрилу (1,5г, 6,9ммоль) і (1карбонітрил метилпіперидин-4-іл)метанолу (1,8г, 13,7ммоль) Слідуючи способу за посилальним прикладом [WO 200471212] і 60% дисперсії гідриду натрію в 32, 7-(2-метоксіетокси)-4-оксо-1,4-дигідрохінолін-3мінеральному маслі (0,8г, 34,4ммоль) нагрівають карбонітрил (800мг, 3,28ммоль), тіонілхлорид і при 110°С протягом 2 годин. Реакційну суміш гакаталітична кількість Ν,Ν-диметилформамід присять метанолом, концентрують, і піддають азеотводять до одержання 748мг 4-хлор-7-(2ропному відганянню з толуолом з одержанням метоксіетокси)хінолін-3-карбонітрилу твердого 2,25г твердого продукту коричневого кольору. Супродукту не зовсім білого кольору, т. пл. 143міш цього твердого продукту і оксихлориду фос145°С. фору (15мл, 159ммоль) нагрівають зі зворотним MS 263,2 (М+Н)+ холодильником протягом 30 хвилин, потім конценПосилальний приклад 36 трують у вакуумі. Залишок розподіляють між вод 37 77799 38 ним розчином бікарбонату натрію і метиленхлоридіоксидо-4-тіоморфолініл)пропокси]-6-метокси-3дом. Органічний шар сушать над сульфатом нахінолінкарбонггрил трію, фільтрують і концентрують на силікагелі. Суміш натрію (48мг, 2,1ммоль) в 2мл 3-(1,1Очищення методом колонкової хроматографії, діоксотіоморфолініл)-1-пропанол [WO 20047212] елююючи з градієнтом від 1:9 метанагрівають при 100°С протягом 1 години. Додають нол:метиленхлорид до 0, 05:1:5 триетила4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-фтор-6мін:метанол:метиленхлорид приводить до одерметокси-3-хінолінкарбонітрил (200мг, 0,51ммоль), і жання 1,6г 4-хлор-6-метокси-7-[(1-метилпіперидинреакційну суміш нагрівають при 100°С протягом 4 4-іл)метокси]хінолін-3-карбонітрил, т. пл. 166годин, потім охолоджують до кімнатної температу168°С. ри. Реакційну суміш виливають в насичений розMS 346(M+H)+ чин бікарбонату натрію, і тверді продукти збираДані аналізу для C18H20ClN3O2 - 1 HCI + 0,5 ють шляхом фільтрації. Залишок очищають за Н2О допомогою колонкової флеш-хроматографії, елюОбчислено: С 54,72; Η 5,54; Ν 10,50. юючи за допомогою 5% метанолу в дихлорметані Знайдено: С 54,72; Η 6,07; Ν 10,05. з одержанням 88мг 4-[(2,4-дихлор-5Приклад 1 метоксифеніл)аміно]-7-[3-(1,1-діоксидо-47-(2-Бутинілокси)-4-[(2,4-дихлор-5тіоморфолініл)пропокси]-6-метокси-3метоксифеніл)аміно]-6-метокси-3хінолінкарбонітрилу, т. пл. 118-120°С. хінолінкарбонітрил HRMS теоретично 565,10735; знайдено Суміш 2-бутин-1-олу (2,02г, 28,8ммоль) і на565,10674 (М+Н)+ трію (65мг, 1,53ммоль) нагрівають при 120°С проДані аналізу для C25H26CI2N 4O5S - 1,1 Н2О тягом 20 хвилин. Додають 4-[2,4-дихлор-5Обчислено: С 51,30; Η 4,86; Ν 9,57. метоксифеніл)аміно]-7-фтор-6-метокси-3Знайдено: С 51,11; Η 4,70; Ν 9,26. хінолінкарбонітрил (150мг, 0,38ммоль), і реакційну Приклад 4 суміш нагрівають при 120°С протягом ночі, потім 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6охолоджують до кімнатної температури. Реакційну метокси-7-{2-[2-(1-піперазиніл)етокси]етокси}-3суміш додають у воду і підкисляють оцтовою кисхінолінкарбонітрил лотою. Тверді продукти збирають шляхом фільтСуміш натрію (50мг, 2,2ммоль) в 1мл 2-[2-(1рації і очищають за допомогою колонкової флешпіперазиніл)етокси]етанолу нагрівають при 120°С хроматографії, елююючи з градієнтом від 3:7 етипротягом 2 годин. Додають 4-[(2,4-дихлор-5лацетат:гексан до 1:1 етилацетаттексан, з одерметоксифеніл)аміно]-7-фтор-6-метокси-3жанням 116мг 7-(2-бутинілокси)-4-[(2,4-дихлор-5хінолінкарбонітрил (150мг, 0,38ммоль), і реакційну метоксифеніл)аміно]-6-метокси-3суміш нагрівають при 140-145°С протягом 2 годин, хінолінкарбонітрилу, т. пл. 193-197°С. потім охолоджують до кімнатної температури. РеMS 442,1 (М+Н)+ акційну суміш розподіляють між насиченим розчиДані аналізу для С 22Н17СІ2Н 3О3 ном бікарбонату натрію і етилацетатом. ОрганічОбчислено: С 59,74; Η 3,87; Ν 9,50. ний шар сушать над сульфатом магнію, Знайдено: С 59,65; Η 3,75; Ν 9,30. фільтрують і концентрують у вакуумі. Залишок Приклад 2 очищають за допомогою колонкової флеш4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-(3хроматографії, елююючи з градієнтом від 3% медиметиламіно-2,2-диметилпропокси)-6-метокси-3танол в дихлорметані до 1% гідроксиду амонію і хінолінкарбонітрил 30% метанолу в дихлорметані з подальшою переСуміш натрію (48мг, 2,1ммоль) в 2мл 3кристалізацією з ацетону і гексану з одержанням диметиламіно-2,2-диметилпропанол нагрівають 124мг 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6при 100°С протягом 20 хвилин. Додають 4-(2,4метокси-7-{2-[2-(1-піперазиніл)етокси]етокси)-3дихлор-5-метоксифеніл)аміно]-7-фтор-6-метоксихінолінкарбонітрилу, т. пл. 88-90°С. 3-хінолінкарбонітрил (200мг, 0,51ммоль) і реакційMS 273,4, 274,2 ну суміш нагрівають при 100°С протягом 7 годин, Дані аналізу для C26H29CI2N5 O4 - 1,5 Н2О - 0,2 потім охолоджують до кімнатної температури. Реацетон акційну суміш розподіляють між насиченим розчиОбчислено: С 54,60; Η 5,70; Ν 11,97. ном бікарбонату натрію і етилацетатом. ОрганічЗнайдено: С 54,68; Η 5,75; Ν 11,76. ний шар промивають водою, суша ть над Приклад 5 сульфатом натрію, фільтрують і концентрують у 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6вакуумі. Залишок очищають за допомогою колонметокси-7-(2-тієнілметокси)-3-хінолінкарбонітрил кової флеш-хроматографії, елююючи за допомоДо суміші гідриду натрію (37мг, 1,54ммоль) у гою 1:1 гексану:етилацетату з одержанням 58мг 43мл диметилсульфоксиду додають 2[(2,4-дихлор-5-метоксифеніл)аміно]-7-(3тіофенеметанол (48мг, 0,42ммоль). Розчин передиметиламіно-2,2-диметилпропокси)-6-метокси-3мішують при кімнатній температурі протягом 45 хінолінкарбонітрилу, т. пл. 178-180°С. хвилин. Додають 4-[(2,4-дихлор-5HRMS теоретично 503,16113; знайдено метоксифеніл)аміно]-7-фтор-6-метокси-3503,16112 (М+Н)+ хінолінкарбонітрил (150мг, 0,38ммоль), і реакційну Дані аналізу для C25H28CI2N 4O3 -1,2 Н2О суміш нагрівають при 100°С протягом ночі, потім Обчислено: С 57,19; Η 5,84; Ν 10,67. охолоджують до кімнатної температури. Реакційну Знайдено: С 57,27; Η 6,19; Ν 10,49. суміш виливають у насичений розчин бікарбонату Приклад 3 натрію, і тверді продукти збирають шляхом фільт4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-[3-(1,1рації. Очищення за допомогою колонкової флеш 39 77799 40 хроматографії, елююючи за допомогою 1:1 гексаЗнайдено: С 54,32; Η 4,06; Ν 9,50. ну:етилацетату приводять до одержання 61мг 4Приклад 8 [(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-74-[(2,4-Дихлор-5-метоксифеніл)аміно]-6(2-тієнілметокси)-3-хінолінкарбонітрилу, т. пл. 194метокси-7-фенілсульфаніл-3-хінолінкарбонітрил 196°С. Суміш тіофеноксиду натрію (181мг, MS 485,9, 488,0 (М+Н)+ 1,37ммоль) і 4-[(2,4-дихлор-5-метоксифеніл)аміно]Дані аналізу для C23H17CI2N 3O3S 7-фтор-6-метокси-3-хінолінкарбонітрилу (100мг, Обчислено: С 56,80; Η 3,52; Ν 8,64. 0,27ммоль) у 3мл тетрагідрофурану нагрівають зі Знайдено: С 56,71; Η 3,74; Ν 8,46. зворотним холодильником протягом ночі. Додають Приклад 6 N-метилпіролідон (2мл), і реакційну суміш нагрі7-Бензилокси-4-[(2,4-дихлор-5вають при 120°С протягом 1 години, потім при метоксифеніл)аміно]-6-метокси-3140°С протягом 45 хвилин. Додають додаткову хінолінкарбонітрил кількість 100мг тіофеноляту натрію, і реакційну До суміші гідриду натрію (122мг, 3,04ммоль) в суміш нагрівають при 140°С протягом 3 годин. Ре6мл диметилсульфоксиду додають бензиловий акційну суміш розподіляють між етилацетатом і спирт (91мг, 0,84ммоль). Розчин перемішують при водою. Органічний шар сушать над сульфатом кімнатній температурі протягом 40 хвилин. Доданатрію, фільтрують і концентрують у вакуумі. Зають 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-фторлишок очищають за допомогою колонкової флеш 6-метокси-3-хінолінкарбонітрил (300мг, хроматографії, елююючи за допомогою 1:4 етила0,76ммоль), і реакційну суміш нагрівають при цетаттексан з одержанням 36мг 4-[(2,4-дихлор-5100°С протягом 3 годин, потім охолоджують до метоксифеніл)аміно]-6-метокси-7-фенілсульфанілкімнатної температури і залишають перемішува3-хінолінкарбонітрилу, т. пл. 220-222°С. тись протягом ночі. Реакційну суміш виливають в MS 481,7, 483,7 (М+Н)+ насичений бікарбонат натрію, і тверді продукти Дані аналізу для C24H17CI2N 3O2S збирають шляхом фільтрації. Очищення за допоОбчислено: С 54,62; Η 4,03; Ν 9,56. могою колонкової флеш-хроматографії, елююючи Знайдено: С 54,32; Η 4,06; Ν 9,50. за допомогою 10% етилацетату в дихлорметані, Приклад 9 приводить до одержання 267мг 7-бензилокси-44-Циклопентиламіно-6-метокси-7-(2[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-3метоксіетокси)-3-хінолінкарбонітрил хінолінкарбонітрилу, т. пл. 198-200°С. Суміш 4-циклопентиламіно-7-фтор-6-метоксиHRMS теоретично 480,08763; знайдено 3-хінолінкарбонітрил (150мг, 0,53ммоль) і гідриду 480,08725 (М+Н)+ натрію (53мг, 2,21ммоль) в 1,6мл 2-метоксіетанолу Дані аналізу для С 25Н19СI2N 3О3 нагрівають зі зворотним холодильником протягом Обчислено: С 62,51; Η 3,99; Ν 8,75. 30 хвилин, потім охолоджують до кімнатної темпеЗнайдено: С 62,31; Η 4,20; Ν 8,70. ратури. Реакційну суміш розподіляють між водним Приклад 7 розчином бікарбонату натрію і етилацетатом. Ор4-[(2,4-дихлор-5-метоксифеніл)аміно]-7ганічну фазу сушать над сульфатом натрію, фільетилсульфаніл-6-метокси-3-хінолінкарбонітрил трують і концентрують у вакуумі. Очищення за До суміші гідриду натрію (82мг, 2,04ммоль) в допомогою препаративної тонкошарової хромато6мл тетрагідрофурану додають етантіол (77мг, графії, елююючи за допомогою 5% метанолу в 1,12ммоль) в 6мл тетрагідрофурану. Реакційну дихлорметані, з подальшим розтиранням в метасуміш перемішують при кімнатній температурі пронолі і діетиловому ефірі, приводить до одержання тягом 2 годин. За допомогою шприца додають 95мг 4-циклопентиламіно-6-метокси-7-(2розчин 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7метоксіетокси)-3-хінолінкарбонітрилу, т. пл. 87фтор-6-метокси-3-хінолінкарбонітрилу (200мг, 90°С. 0,51ммоль) в 7мл тетрагідрофурану, і реакційну MS 342,23 (М+Н)+ суміш нагрівають при 70°С протягом 5 годин, потім Дані аналізу для C19H23N3O 3 - 0,20 Н2О охолоджують до кімнатної температури. Об'єм Обчислено: С 65,12; Η 6,90; Ν 11,99. реакційної суміші зменшують концентруванням у Знайдено: С 64,88; Η 6,88; Ν 12,13. вакуумі, і потім розподіляють між етилацетатом і Приклад 10 водою. Водний шар екстрагують додатковою кіль4-Бутиламіно-6-метокси-7-(2-метоксіетокси)-3кістю етилацетату, і органічні шари об'єднують і хінолінкарбонітрил промивають водою. Органічний шар сушать над Суміш 4-бутиламіно-7-фтор-6-метокси-3сульфатом магнію, фільтрують і концентрують у хінолінкарбонітрилу (150мг, 0,55ммоль) і гідриду вакуумі. Залишок очищають за допомогою колоннатрію (55мг, 2,29ммоль) в 1,7мл 2-метоксіетанолу кової флеш-хроматографії, елююючи з градієнтом нагрівають зі зворотним холодильником протягом від 10% до 30% етилацетату в гексані з одержан30 хвилин, потім охолоджують до кімнатної темпеням 154мг 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7ратури. Реакційну суміш розподіляють між водним етилсульфаніл-6-метокси-3-хінолінкарбонітрилу, т. розчином бікарбонату натрію і етилацетатом. Орпл. 212-214°С. ганічну фазу сушать над сульфатом натрію, фільHRMS теоретично 434,04913; знайдено трують і концентрують у вакуумі. Очищення за 434,04989 (М+Н)+ допомогою препаративної тонкошарової хроматоHRMS теоретично 867,09098; знайдено графії, елююючи за допомогою 5% метанолу в 867,09317 (2М+Н)+ дихлорметані, з подальшим розтиранням в етилаДані аналізу для С 25Н19СІ2N 3О3 - 0,3 Н2О цетаті, приводить до одержання 135мг 4Обчислено: С 54,62; Η 4,03; Ν 9,56. бутиламіно-6-метокси-7-(2-метоксіетокси)-3 41 77799 42 хінолінкарбонітрилу, т. пл. 99-102°С. 3-хінолінкарбонітрил (200мг, 0,51ммоль), і реакMS 330,24 (М+Н)+ ційну суміш нагрівають при 135°С протягом 5 го1 дин. Протягом подальших 4 годин в реакційну суН ЯМР (ДМСО-d6) d 0,94 (т, 3Н), 1,42 (м, 2Н), міш додатково додають 128мг гідриду натрію при 1,70 (м, 2Н), 3,32 (с, 3Н), 3,33 (с, 3Н), 3,70-3,78 (м, 130°С. Реакційну суміш розподіляють між етила4Н), 4, 23 (м, 2Н), 7,23 (с, 1Н), 7,62 (с, 1Н), 7,85 (т, цетатом і водою. Органічний шар сушать над су1Η), 8,31 (с, 1Н). льфатом натрію, фільтрують і концентрують у ваПриклад 11 7-Бензилтіо-4-[(2,4-дихлор-5куумі. Залишок очищають за допомогою препаративної тонкошарової хроматографії, елюметоксифеніл)аміно]-6-метокси-3юючи 20% метанолом в дихлорметані з одержанхінолінкарбонітрил ням 105мг 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6Суміш гідриду натрію (169мг, 4,2ммоль), бенметокси-7-[(2-(1-метилпіперидин-4-іл)етокси]-3зил меркаптану (145мг, 1,2ммоль) і 4-[(2,4-дихлор5-метоксифеніл)аміно]-7-фтор-6-метокси-3хінолінкарбонітрилу, т. пл. 190-191°С. MS515, 19(М+Н)+ хінолінкарбонітрилу (250мг, 0,64ммоль) в 1мл тетДані аналізу для C26H28CI2N 4O3 - 1,0 Н2О рагідрофурану нагрівають при 70°С протягом 1 Обчислено: С 58,53; Η 5,67; Ν 10,50. години, потім перемішують при кімнатній темпераЗнайдено: С 58,65; Η 5,57; Ν 10,34. турі протягом ночі. При додаванні 1мл диметилсульфоксиду одержують розчин. Додають додаткову Приклад 14 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6кількість гідриду натрію і бензилмеркаптану, і реаметокси-7-[2-метоксіетокси]-3-хінолінкарбонітрил кційну суміш нагрівають при 100°С. Реакційну суСуміш натрію (118мг, 5,11ммоль) і 2міш розподіляють між етилацетатом і водою. Орметоксіетанолу (5мл) нагрівають при 120-130°С ганічний шар сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. Залишок протягом 3 годин. Додають 4-[(2,4-дихлор-5метоксифеніл)аміно]-7-фтор-6-метокси-3очищають за допомогою препаративної тонкошахінолінкарбонітрил (500мг, 1,28ммоль) і реакційну рової хроматографії, елююючи за допомогою 1:2 суміш нагрівають при 120-125°С протягом 1 годиетилацетату хексану з одержанням 150мг 7ни. Температур у реакційної суміші підвищують до бензилтіо-4-[(2,4-дихлор-5-метоксифеніл)аміно]-6метокси-3-хінолінкарбонітрилу, т. пл. 123-125°С. 140-150°С і цю температур у підтримують протягом 2,5 годин. Реакційну суміш охолоджують до кімнаMS 494,03 (М-Н)тної температури і розбавляють охолодженим на Дані аналізу для C25H19CI2N 3O2S - 0,5 Н2О крижаній бані водним розчином бікарбонату наОбчислено: С 59,40; Η 3,99; Ν 8,31. трію. Твердий продукт збирають шляхом фільтраЗнайдено: С 59,45; Η 3,98; Ν 8,12. Приклад 12 ційного промивання водою і гексаном. Очищення за допомогою колонкової флеш-хроматографії, 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6елююючи 2% метанолом в дихлорметані, привометокси-7-(піридин-4-ілокси)-3-хінолінкарбонітрил дить до одержання 550мг 4-[(2,4-дихлор-5Суміш гідриду натрію (128мг, 3,2ммоль) і 4метоксифеніл)аміно]-6-метокси-7-[2гідроксипіридину (750мг, 7,89ммоль) в 5мл Ν,Ν'диметилформаміду нагрівають при 100°С протяметоксіетокси]-3-хінолінкарбонітрилу, т. пл. 210212°С. гом 1 години. Додають 4-[(2,4-дихлор-5MS 448,2 (М+Н)+ метоксифеніл)аміно]-7-фтор-6-метокси-3Дані аналізу для C21H19CI2N 3O4 хінолінкарбонітрил (200мг, 0,51ммоль), і реакційну Обчислено: С 56,26; Η 4,27; Ν 9,37. суміш нагрівають при 130°С протягом 2 годин. Додають додатково 21мг гідриду натрію і реакційну Знайдено: С 56,02; Η 4,16; Ν 9,12. Приклад 15 суміш нагрівають при 130°С протягом ще 30 хви4-[(2,4-дихлор-5-метоксифеніл)аміно]-6лин. Реакційну суміш розподіляють між етилацетаметокси-7-[2-(1-метил-3-піперидиніл)метокси]-3том і водою. Органічний шар сушать над сульфахінолінкарбонітрил том натрію, фільтрують і концентрують у вакуумі. Залишок очищають нагріванням з метанолом і До розчину 4-[(2,4-дихлор-5метоксифеніл)аміно]-7-фтор-6-метокси-3дихлорметаном з одержанням 130мг 4-[(2,4хінолінкарбонітрилу (250мг, 0,64ммоль) і 1дихлор-5-метоксифеніл)аміно]-6-метокси-7метилпіперидин-3-метанолу (165мг, 1,28ммоль) в (піридин-4-ілокси)-3-хінолінкарбонітрилу, т. пл. 6мл Ν,Ν'-диметилформаміду при 135°С порціями 267-269°С. MS 467, 11 (M+H)+ додають гідрид натрію (92мг, 3,8ммоль). Після 1 години в реакційну суміш при 135°С додають доДані аналізу для C23H16CI2N4 O3 - 0,2 етилацедатково 92мг гідриду натрію. Після 30 хвилин реатат кційну суміш виливають в насичений розчин бікарОбчислено: С 58,89; Η 3,33; Ν 11,55. бонату натрію. Після перемішування протягом 15 Знайдено: С 58,84; Η 3,41; Ν 11,60. Приклад 13 хвилин твердий продукт збирають фільтруванням. Залишок очищають за допомогою колонкової 4-[(2,4-дихлор-5-метоксифеніл)аміно]-6флеш-хроматографії, елююючи з градієнтом від метокси-7-[2-(1-метилпіперидин-4-іл)етокси]-35% метанолу в ди хлорметані до 1% гідроксиду хінолінкарбонітрил амонію в 10% метанолі в дихлорметані. Після доСуміш гідриду натрію (128мг, 3,2ммоль) і 1метил-4-піперидинетанолу (180мг, 1,25ммоль) [ЕР даткового очищення за допомогою колонкової флеш-хроматографії, елююючи з градієнтом від 0581538] в 5мл Ν,Ν'-диметилформаміді нагрівають 5% метанолу в дихлорметані до 25% метанолу в при 110°С протягом 1 години. Додають 4-[(2,4дихлорметані, одержують 4-[(2,4-дихлор-5дихлор-5-метоксифеніл)аміно]-7-фтор-6-метокси 43 77799 44 метоксифеніл)аміно]-6-метокси-7-[(2-(1-метил-3приводять до одержання, після здійснення колонпіперидиніл)метокси]-3-хінолінкарбонітрил, т. пл. кової флеш-хроматографії, елююючи з градієнтом 176-178°С. від 3:1 етилацетату:метанолу до 2% водного гідMS 499,09 (М-Н)роксиду амонію в 3:1 етилацетаті:метанолі, 143мг Дані аналізу для C25H26CI2N 4O3 - 0,3 Н2О 6-метокси-7-[(1-метилпіперидин-4-іл)метокси]-4Обчислено: С 59,25; Η 5,29; Ν 11,06. [(3,4,5-триметоксифеніл)аміно]-3Знайдено: С 59,18; Η 5,20; Ν 10,91. хінолінкарбонітрилу, т. пл. з розм'якш. при 65°С. Приклад 16 MS 493,26 (М+Н)+ 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6Дані аналізу для C27H32N4O 5 - 2,5 Н2О метокси-7-[2-(1-метил-4-піперидиніл)метокси]-3Обчислено: С 60,32; Η 6,94; Ν 10,42. хінолінкарбонітрил Знайдено: С 60,28; Η 6,71; Ν 10,35. До розчину 4-[(2,4-дихлор-5Приклад 19 метоксифеніл)аміно]-7-фтор-6-метокси-34-({3-Хлор-4-[(1-метил-1Н-імідазол-2хінолінкарбонітрилу (600мг, 1,53ммоль) і 1іл)сульфаніл]феніл}аміно)-6-метокси-7-[2-(2метилпіперидин-4-метанолу (395мг, 3,06ммоль) метокси)стокси]-3-хінолінкарбонітрил [WO 20047212] в 10мл Ν,Ν'-диметилформаміді при Суміш натрію (78мг, 3,4ммоль) в 2мл 2-(2135°С порціями додають гідрид натрію (362мг, метоксіетокси)етанолі нагрівають при 100°С про9,06ммоль). Після 45 хвилин реакційну суміш витягом 1 години. Додають 4-({3-хлор-4-[(1-метилливають в насичений розчин бікарбонату натрію. 1Н-імідазол-2-іл)сульфаніл]феніл}аміно)-7-фтор-6Після перемішування протягом 15 хвилин твердий метокси-3-хінолінкарбонітрил (300мг, 0,68ммоль), і продукт збирають фільтруванням. Залишок очиреакційну суміш нагрівають при 140°С протягом щають за допомогою колонкової флеш3,5 годин, потім охолоджують до кімнатної темпехроматографії, елююючи з градієнтом від 5% мератури. Реакційну суміш виливають в насичений танолу в дихлорметані до 25% метанолу в ди хлорозчин бікарбонату натрію і тверді продукти збирметані. Розтирання в діетиловому ефірі приворають шляхом фільтрації, промиваючи водою. дить до одержання 396мг 4-[(2,4-дихлор-5Очищення за допомогою колонкової флешметоксифеніл)аміно]-6-метокси-7-[(2-(1-метил-4хроматографії елююючи з градієнтом від 2% метапіперидиніл)метокси]-3-хінолінкарбонітрилу, т. пл. нолу в ди хлорметані до 3% метанолу в дихлорме200-202°С. тані з подальшою перекристалізацією з ацетону і MS 501,3 (М+Н)+ гексану приводить до одержання 262мг 4-({3-хлорДані аналізу для C25H26CI2N 4O3 - 0,8 Н2О 4-[(1-метил-1Н-імідазол-2-іл)сульфаніл]феніл}Обчислено: С 58,21; Η 5,39; Ν 10,86. аміно)-6-метокси-7-[2-(2-метокси)етокси]-3Знайдено: С 58,19; Η 5,23; Ν 10,67. хінолінкарбонітрилу, т. пл. 222-224°С. Приклад 17 MS 540,35, 542,39 (М+Н)+ 6-метокси-7-[2-метоксіетокси]-4-[(3,4,5Дані аналізу для C26H26CIN5O 4S - 0,5 Н2О триметоксифеніл)аміно]-3-хінолінкарбонітрил Обчислено: С 56,87; Η 4,96; Ν 12,76. Суміш гідриду натрію (80мг, 2,0ммоль) і 6Знайдено: С 56,75; Η 4,78; Ν 12,72. метокси-7-фтор-4-[(3,4,5-три-метоксифеніл)аміно]Приклад 20 3-хінолінкарбонітрилу (203мг, 0,53ммоль) у 24-((3-Хлор-4-[(1-метил-1Н-імідазол-2метоксіетанолі (6мл) нагрівають зі зворотним хоіл)сульфаніл]феніл}аміно)-7-[3лодильником протягом 2 годин. Додають додатко(диметиламіно)пропокси]-6-(2-метоксіетокси)-3ва кількість гідриду натрію (80мг, 2,0ммоль), і реахінолінкарбонітрил кційну суміш нагрівають зі зворотним Слідуючи способу за прикладом 19, 4-({3-хлорхолодильником протягом 4 годин. Реакційну суміш 4-[(1-метил-1Н-імідазол-2охолоджують до кімнатної температури і розподііл)сульфаніл]феніл}аміно)-7-фтор-6-(2ляють між етилацетатом і насиченим розчином метоксіетокси)-3-хінолінкарбонітрилу (300мг, бікарбонату натрію. Органічний шар сушать над 0,62ммоль) і 2мл 3-диметиламіно-1-пропанолу сульфатом магнію, фільтрують і концентрують у приводять до одержання 115мг 4-({3-хлор-4-[(1вакуумі. Розтиранням залишку в етилацетаті і діеметил-1Н-імідазол-2-іл)сульфаніл]феніл}аміно)-7тиловому ефірі приводить до одержання 178мг 6[3-(диметиламіно)пропокси]-6-(2-метоксіетокси)-3метокси-7-[2-метоксіетокси]-4-[(3,4,5хінолінкарбонітрилу, т. пл. 194-203°С. триметоксифеніл)аміно]-3-хінолінкарбонітрилу, т. MS 567,31 (М+Н)+, 284,16 (М+2Н)2+ пл. 188-190°С. Дані аналізу для С 28Н31СIN6О 3S - 1,4 Н2О MS 440,22 (М+Н)+ Обчислено: С 56,77; Η 5,75; Ν 14,19. Дані аналізу для C23H25N3O 6 - 1,0 Н2О Знайдено: С 56,61; Η 5,35; Ν 13,90. Обчислено: С 60,38; Η 5,95; Ν 9,19. Приклад 21 Знайдено: С 60,44; Η 5,98; Ν 9,15. 4-({3-Хлор-4-[(1-метил-1Н-імідазол-2Приклад 18 іл)сульфаніл]феніл}аміно)-7-[3-(4-етил-16-Метокси-7-[(1-метилпіперидин-4-іл)метокси]піперазиніл)пропокси]-6-(2-метоксіетокси)-34-[(3,4,5-триметоксифеніл)-аміно]-3хінолінкарбонітрил хінолінкарбонітрил Слідуючи способу за прикладом 15, 4-({3-хлорСлідуючи способу, що використовується при 4-[(1-метил-1Н-імідазол-2одержанні за прикладом 15, 6-метокси-7-фтор-4іл)сульфаніл]феніл}аміно)-7-фтор-6-(2[(3,4,5-триметоксифеніл)аміно]-3метоксіетокси)-3-хінолінкарбонітрил (300мг, хінолінкарбонітрил (230мг, 0,60ммоль) і 10,62ммоль) і 1-етил-4-(3-гідроксипропіл)піперазин метилпіперидин-3-метанол (200мг, 1,55ммоль) (540мг, 3,1ммоль) приводять до одержання 155мг 45 77799 46 4-((3-хлор-4-[(1-метил-1Н-імідазол-2Знайдено: С 57,67; Η 4,93; Ν 8,49. іл)сульфаніл]феніл}аміно)-7-[3-(4-етил-1Приклад 25 піперазиніл)пропокси]-6-(2-метоксіетокси)-34-[(2,4-дихлор-5-метоксифеніл)аміно]-6хінолінкарбонітрилу, т. пл. 188-190°С. метокси-7-(тетрагідро-2Н-піран-2-ілметокси)-3MS 318,68 (М+2Н)+2 хінолінкарбонітрил Дані аналізу для C32H38CIN7O 3S - 1,0 Н2О Слідуючи способу, що використовується при Обчислено: С 58,74; Η 6,16; Ν 14,99. одержанні за прикладом 15, 4-[(2,4-дихлор-5Знайдено: С 58,84; Η 5,91; Ν 14,73. метоксифеніл)аміно]-6-етокси-7-фтор-3Приклад 22 хінолінкарбонітрил (250мг, 0,64ммоль) і тетрагід4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6-[2ропіран-2-метанол приводять до одержання 177мг метоксіетокси]-7-[(1-метилпіперидин-4-іл)метокси]4-[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-73-хінолінкарбонітрил (тетрагідро-2Н-піран-2-ілметокси)-3Слідуючи способу, що використовується при хінолінкарбонітрилу, т. пл. 193-196°С. одержанні за прикладом 15, 4-[(2,4-дихлор-5MS 485,9 (М-Н)метоксифеніл)аміно]-7-фтор-6-[2-метоксіетокси]-3Дані аналізу для C24H23CI2N 3O4 хінолінкарбонітрил (300мг, 0,69ммоль) і 1Обчислено: С 59,03; Η 4,75; Ν 8,60. метилпіперидин-4-метанол (178мг, 1,38ммоль) Знайдено: С 59,06; Η 4,84; Ν 8,39. приводять до одержання, після здійснення препаПриклад 26 ративної тонкошарової хроматографії, елююючи 4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(220% метанолом в етилацетаті, 165мг 4-[(2,4метоксіетокси)-6-(2-морфолін-4-ілетокси)-3дихлор-5-метоксифеніл)аміно]-6-[2-метоксіетокси]хінолінкарбонітрил 7-[(1-метилпіперидин-4-іл)метокси]-3Слідуючи способу, що використовується при хінолінкарбонітрилу, т. пл. 153-155°С. одержанні за прикладом 15, 4-[(2,4-дихлор-5MS 545,19 (М+Н)+ метоксифеніл)аміно]-7-фтор-6-(2-морфолін-4Дані аналізу для C27H30CI2N 4O4 - 0,7 Н2О ілетокси)3-хінолінкарбонітрил (102мг, 0,21ммоль) і Обчислено: С 58,11; Η 5,67; Ν 10,04. 2-метоксіетанол приводять до одержання 86мг 4Знайдено: С 58,04; Η 5,74; Ν 9,99. [(2,4-дихлор-5-метоксифеніл)аміно]-7-(2Приклад 23 метоксіетокси)-6-(2-морфолін-4-ілетокси)-34-[(2,4-Дихлор-5-метоксифеніл)аміно]-6хінолінкарбонітрилу, т. пл.158-159°С. етокси-7-(2-метоксіетокси)3-хінолінкарбонітрил MS 544,9 (М-Н)Слідуючи способу, що використовується при Дані аналізу для C26H28Cl2N4O 5 - 1,3 Н2 О одержанні за прикладом 17, 4-[(2,4-дихлор-5Обчислено: С 54,70; Η 5,40; Ν 9,81. метоксифеніл)аміно]-6-етокси-7-фтор-3Знайдено: С 54,57; Η 5,24; Ν 9,79. хінолінкарбонітрил (138мг, 0,34ммоль) і 2Приклад 27 метоксіетанол приводять до одержання 105мг 44-[3-Хлор-4-(1-метил-1Н-імідазол-2[(2,4-дихлор-5-метоксифеніл)аміно]-6-етокси-7-(2ілсульфаніл)феніламіно]-6-метокси-7-(4метоксіетокси)3-хінолінкарбонітрилу, т. пл. 215метилпіперазин-1-іл)-хінолін-3-карбонітрил 217°С. Суміш 200мг (0,455ммоль) 4-[3-хлор-4-(1MS 462,1 (М+Н)+ метил-1Н-імідазол-2-ілсульфаніл)феніламіно]-7Дані аналізу для C22H31CI2N 3O4 - 0,3 Н2О фтор-6-метоксихінолін-3-карбонітрилу (посилальОбчислено: С 56,49; Η 4,66; Ν 8,99. ний приклад 20) і 273мг (2,73ммоль) NЗнайдено: С 56,59; Η 4,64; Ν 8,95. метилпіперазину в 1мл 1-метил-2-піролідинону Приклад 24 нагрівають при 105°С протягом 16 годин. Розчин6-Бутокси-4-[(2,4-дихлор-5ники видаляють у вакуумі. До залишку додають метоксифеніл)аміно]-7-(2-метоксіетокси)-310мл-ову порцію води, внаслідок чого в осад вихінолінкарбонітрил падає твердий продукт оранжево-червоного коСуміш 6-бутокси-4-хлор-7-(2-метоксіетокси)-3льору. Твердий продукт фільтрують і промивають хінолінкарбонітрилу (184мг, 0,55ммоль), 2,4водою. Після сушіння у вакуумі твердий продукт дихлор-5-метоксіаніліну (127мг, 0,66ммоль) і гідросуспендують в етилацетаті і перемішують протяхлориду піридину (76мг, 0,66ммоль) в 5мл 2гом 1 години. Твердий продукт фільтрують, проетоксіетанолу нагрівають при 120°С протягом 7 мивають етилацетатом і сушать у вакуумі з одергодин. Реакційну суміш охолоджують до кімнатної жанням 0,175г 4-[3-хлор-4-(1-метил-1Н-імідазол-2температури і концентрують у вакуумі. До залишку ілсульфаніл)феніламіно]-6-метокси-7-(4додають діетиловий ефір, і тверді продукти збиметилпіперазин-1-іл)хінолін-3-карбонітрилу у вирають і суспендують в насиченому водному бікаргляді твердого продукту жовтого кольору, т. пл. бонаті натрію. Після перемішування протягом 1 270-272°С. 1 години тверді продукти збирають шляхом фільтН ЯМР (ДМСО-d 6): d 2,24 (с, 3Н), 3,19 (шир. с, рації і промивають водою. Очищення методом 4Н), 3,32 (шир. с, 4Н), 3,60 (с, 3Н), 3,92 (с, 3Н), 6,58 препаративної тонкошарової хроматографії, елю(д, J=6,3Гц, 1Н), 7,10 (дд, J=1,5Гц, J=6,6Гц, 1Н), юючи 7% метанолом в дихлорметані, приводить 7,15 (д, J=0,9Гц, 1Н), 7,24 (с, 1Н), 7,37 (д, J=1,8Гц), до одержання 93мг 6-бутокси-4-[(2,4-дихлор-57,53 (д, J=0,6Гц), 7,60 (с, 1Н), 8,48 (с, 1Н), 9,52 (с, метоксифеніл)аміно]-7-(2-метоксіетокси)-31Н). хінолінкарбонітрилу, т. пл. 166-167°С. MS (ES, метод негативних іонів): m/z обчислеMS 488,0 (М-Н)но для C26H26ClN7OS: 519,2, знайдено: 518,3 (MДані аналізу для C24H25CI2N 3O4 - 0,5 Н2О H)Обчислено: С 57,72; Η 5,25; Ν 8,41. Дані аналізу для C26H26ClN7OS - 1,0 Н 2О 47 77799 48 Обчислено: С 58,04; Η 5,25; Ν 18,22. Дані аналізу для C27H30ClN7OS - 0,50 Н2 О Знайдено: С 58,16; Η 4,94; Ν 17,95. Обчислено: С 59,49; Η 5,73; Ν 17,99 Приклад 28 Знайдено: С 59,61; Η 5,59; Ν 17,84. 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6Приклад 31 метокси-7-{[3-(1-метилпіперидин-44-[(2,4-дихлор-5-метоксифеніл)аміно]-7-[3-(4іл)пропіл]аміно}хінолін-3-карбонітрил метил)піперазин-1-іл)пропокси]-3Слідуючи способу, що використовується при хінолінкарбонітрил одержанні за прикладом 27, 250мг (0,64ммоль) 4Слідуючи способу, що використовується при [(2,4-дихлор-5-метоксифеніл)аміно]-7-фтор-6одержанні за прикладом 15, 4-[(2,4-дихлор-5метоксихінолін-3-карбонітрилу піддають взаємодії метоксифеніл)аміно]-7-фтор-3-хінолінкарбонітрил з 600мг (3,80ммоль) 3-(1-метилпіперидин-4(200мг, 0,55ммоль) і 3-(4-метилпіперазин-1іл)пропіламіну в 2мл 1-метил-2-піролідинону при іл)пропанол приводять до одержання 71мг 4-[(2,4105°С протягом 18 годин з одержанням 130мг 4дихлор-5-метоксифеніл)аміно]-7-[3-(4[(2,4-дихлор-5-метоксифеніл)аміно]-6-метокси-7метил)піперазин-1-іл)пропокси]-3{[3-(1-метилпіперидин-4-іл)пропіл]аміно}хінолін-3хінолінкарбонітрилу, т. пл. 154-155°С. карбонітрилу у вигляді твердого продукту, т. пл. MS 497,9 (М-Н)122-124°С. Дані аналізу для C25H27CI2N 5O2 - 0,8 Н2О MS (ES, метод позитивних іонів): m/z обчислеОбчислено: С 58,32; Η 5,60; Ν 13,60. но для C27H31CI2N5 O: 573,2, знайдено: 528,2 Знайдено: С 58,32; Η 5,30; Ν 13,28. (М+Н)+. Приклад 32 Дані аналізу для C27H31CI2N 5O 4-[(2,4-дихлор-5-метоксифеніл)аміно1-7-[(1Обчислено: С 61,36; Η 5,91; Ν 13,25. метилпіперидин-4-іл)метокси]-3-хінолінкарбонітрил Знайдено: С 60,96; Η 5,76; Ν 12,90. Слідуючи способу, що використовується при Приклад 29 одержанні за прикладом 15, 4-[(2,4-дихлор-54-[3-Хлор-4-(1-метил-1Н-імідазол-2метоксифеніл)аміно]-7-фтор-3-хінолінкарбонітрил ілсульфанілУфеніламіно]-7-([3(200мг, 0,55ммоль) і 1-метил-1-піперидин-4(диметил)амінопропіл]аміно)-6-метоксихінолін-3метанол приводять до одержання 75мг 4-[(2,4карбонітрил дихлор-5-метоксифеніл)аміно]-7-[(1Слідуючи способу, що використовується при метилпіперидин-4-іл)метокси]-3одержанні за прикладом 27, 150мг (0,34ммоль) 4хінолінкарбонітрилу, т. пл. 191-193°С. [3-хлор-4-(1-метил-1Н-імідазол-2MS 468,8 (М-Н)ілсульфаніл)феніламіно]-7-фтор-6-метоксихінолінДані аналізу для C24H24CI2N 4O2 - 0,6 Н2О 3-карбонітрилу піддають взаємодії з 209мг Обчислено: С 59,78; Η 5,27; Ν 11,62. (2,05ммоль) N,N-диметил-1,3-пропандіаміну в 1мл Знайдено: С 59,87; Η 5,11; Ν 11,70. 1-метил-2-піролідинону при 105°С протягом 16 Приклад 33 годин з одержанням 99мг 4-[3-хлор-4-(1-метил-1Н4-[(2,4-дихлор-5-метоксифеніл)аміно]-7-(2імідазол-2-ілсульфаніл)феніламіно]-7-{[3метоксіетокси)-3-хінолінкарбонітрил (диметиламіно)пропіл]аміно}-6-метоксихінолін-3Слідуючи способу, що використовується при карбонітрилу у вигляді твердого продукту оранжеодержанні за прикладом 15, 4-[(2,4-дихлор-5во-червоного кольору, т. пл. 198-200°С. метоксифеніл)аміно]-7-фтор-3-хінолінкарбонітрил MS (ES, метод позитивних іонів): m/z обчисле(300мг, 0,83ммоль) і 2-(метокси)етанол приводять но для C26H28ClN7OS: 521,2, знайдено: 522,4 до одержання 194мг 4-[(2,4-дихлор-5(М+Н)+. метоксифеніл)аміно]-7-(2-метокси)етокси]-3Дані аналізу для C26H28ClN7OS - 0,75 Н2 О хінолінкарбонітрилу, т. пл. 182-183°С. Обчислено: С 58,31; Η 5,55; Ν 18,31. MS 416,1 (М-Н)Знайдено: С 58,00; Η 5,16; Ν 17,93. Дані аналізу для C20H17CI2N 3O3 Приклад 30 Обчислено: С 57,43; Η 4,10; N 10,05. 4-[3-Хлор-4-(1-метил-1Н-імідазол-2Знайдено: С 57,36; Η 4,09; Ν 9,89. ілсульфаніл)-феніламіно]-7-{[3Приклад 34 (диметиламіно)пропіл]метиламіно}-64-[(2,4-дихлорфеніл)аміно]-7-(2метоксихінолін-3-карбонітрил метоксіетокси)-3-хінолінкарбонітрил Слідуючи способу, що використовується при Суміш 4-хлор-7-(2-метоксіетокси)-3одержанні за прикладом 27, 150мг (0,34ммоль) 4хінолінкарбонітрилу (262мг, 1,0ммоль), 2,4[3-хлор-4-(1-метил-1Н-імідазол-2дихлораніліну (195мг, 1,2ммоль) і гідрохлориду ілсульфаніл)феніламіно]-7-фтор-6-метоксихінолінпіридину (140мг, 1,2ммоль) в 10мл 2-етоксіетанолу 3-карбонітрилу піддають взаємодії з 238мг нагрівають зі зворотним холодильником протягом (2,05ммоль) N,N,N'-триметил-1,3-пропандіаміну в 30 хвилин. Реакційну суміш охолоджують до кім1мл 1-метил-2-піролідинону при 105°С протягом натної температури, розподіляють між етилацета16 годин з одержанням 121мг 4-[3-хлор-4-(1том і насиченим розчином бікарбонату натрію. метил-1Н-імідазол-2-ілсульфаніл)феніламіно]-7Органічний шар промивають сумішшю 1:1 насиче{[3-(диметил)амінопропіл]метиламіно}-6ного розчину бікарбонату натрію і 5н гідроксидом метоксихінолін-3-карбонітрилу у вигляді твердого натрію. Органічний шар сушать над сульфатом продукту оранжево-червоного кольору, т. пл. 196магнію, фільтрують і концентрують у вакуумі. 201°С. Очищення методом колонкової хроматографії, MS (ES, метод позитивних іонів): m/z для елююючи з градієнтом від 1:1 етилацетат: гексан C27H30CIN7 OS: 535, 2, знайдено: 536,1 (М+Н)+. до повністю етилацетатом, приводить до одер 49 77799 50 жання 103мг 4-[(2,4-дихлорфеніл)аміно]-7-(2Приклад 43 метоксіетокси)-3-хінолінкарбонітрилу, т. пл. 1446-Метокси-4-[(5-метокси-2-метилфеніл)аміно]145°С. 7-[(1-метилпіперидин-4-іл)метокси]хінолін-3MS 388,0 (М-Н)карбонітрил Дані аналізу для C19H15CI2N 3O2 т. пл. >250°С; Мас спектр 445,2 (ES-) Обчислено: С 58,78; Η 3,89; Ν 10,82. Приклад 44 Знайдено: С 58,86; Η 3,90; Ν 10,76. 4-[(2-Хлор-5-метоксифеніл)аміно]-6-метокси-7Приклад 35 [(1-метилпіперидин-4-іл)метокси]хінолін-36-Метокси-7-(4-метилпіперазин-1-іл)-4-(4карбонітрил феноксифеніламіно)хінолін-3-карбонітрил т. пл. 106-108°С; Мас спектр 467, 2 (ES+) Реакційну суміш, що містить 0,12г (0,38ммоль) Приклад 45 4-хлор-6-метокси-7-(4-метилпіперазин-1-іл)хінолін4-[(2,4-Диметилфеніл)аміно]-6-метокси-7-[(13-карбонітрилу, 0,077г (0,42ммоль) 4-феноксіанілін метилпіперидин-4-іл)метокси]хінолін-3-карбонітрил і 0,044г (0,38ммоль) гідрохлориду піридину в 2мл т. пл. 190-191°С; Мас спектр 429,2 (ES-) 2-етоксіетанолу, нагрівають при 115°С протягом Приклад 46 45 хвилин. Після охолоджування, суміш фільтру4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6ють, промивають холодним 2-етоксіетанолом, пометокси-7-[3-(1-метилпіперидин-4тім етилацетатом. Після сушіння у вакуумі твердий іл)пропокси]хінолін-3-карбонітрил продукт суспендують в насиченому розчині карбот. пл. 144-145°С; Мас спектр 529,2 (ES+) нату натрію, перемішують протягом 45 хвилин і Приклад 47 збирають шляхом фільтрації. Продукт реакції про4-[(2-Хлор-5-метоксифеніл)аміно]-6-метокси-7мивають водою і сушать у вакуумі з одержанням [3-(1-метилпіперидин-4-іл)пропокси]хінолін-30,11г 6-метокси-7-(4-метилпіперазин-1-іла)-4-(4карбонітрил феноксифеніламіно)хінолін-3-карбонітрилу у вит. пл. 117-120°С; Мас спектр 485,2 (ES+) гляді твердого продукту жовтого кольору, т. пл. з Приклад 48 розм'якш. при 93°С. 6-Метокси-4-[(5-метокси-2-метилфеніл)аміно]MS (ES, метод негативних іонів): m/z обчисле7-[3-(1-метилпіперидин-4-іл)пропокси]хінолін-3но для C28H27N5O 2: 465,2, знайдено: 464,2 (М-Н)-. карбонітрил Дані аналізу для C28H27N5O 2 - 1,0 Н2О т. пл. 163-166°С; Мас спектр 475,3 (ES+) Обчислено: С 69,55; Η 6,04; Ν 14,48. Приклад 49 Знайдено: С 69,68; Η 5,83; Ν 14,40. 4-[(2,4-Диметилфеніл)аміно]-6-метокси-7-[3-(1Наступні приклади 36-40 здійснені за спосометилпіперидин-4-іл)пропокси]хінолін-3бом, аналогічним описаному в прикладі 17, і при карбонітрил використанні відповідного спирту. т. пл. 159-162°С; Мас спектр 459,3 (ES+) Приклад 36 Приклад 50 4-[(2,4-Дихлорфеніл)аміно]-6-метокси-7-(24-[(2,4-Дихлор-5-метоксифеніл)аміно]-6метоксіетокси)хінолін-3-карбонітрил метокси-7-[3-(4-метил-1т. пл. 170-171 °С; Мас спектр 415,9 (ES+) піперазиніл)пропокси]хінолін-3-карбонітрил Приклад 37 т. пл. 125-128°С; Мас спектр високого розді4-[(2,4-Диметил-5-метоксифеніл)аміно]-6лення: 530,17274 розрах.: 530,17203 метокси-7-(2-метоксіетокси)-хінолін-3-карбонітрил Приклад 51 т. пл. 143-145°С; Мас спектр 408,2 (ES+) 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-[(1Приклад 38 етилпіперидин-4-іл)метокси]-6-метоксихінолін-34-[(2-Хлор-5-метоксифеніл)аміно]-6-метокси-7карбонітрил (2-метоксіетокси)хінолін-3-карбонітрил т. пл. 192-195°С; Мас спектр 515,2 (ES+) т. пл. 179-181°С; Мас спектр 412,2 (ES-) Приклад 52 Приклад 39 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-66-Метокси-7-(2-метоксіетокси)-4-[(5-метокси-2метокси-7-[(1-метилпіперидин-2-іл)метокси]хінолінметилфеніл)аміно]хінолін-3-карбонітрил 3-карбонітрил т. пл. 116-119°С; Мас спектр 394,2 (ES+) т. пл. 178-179°С; Мас спектр 499,0 (ES-) Приклад 40 Приклад 53 здійснений за способом, аналогіч4-[(2,4-Диметилфеніл)aміно]-6-метокси-7-(2ним описаному в прикладі 1, і при використанні метоксіетокси)хінолін-3-карбонітрил відповідного спирту. т. пл. 107-109°С; Мас спектр 378,2 (ES+) Приклад 53 Наступні приклади 41-52 здійснені за спосо4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6бом, аналогічним описаному у прикладі 16, і при метокси-7-(піперидин-4-ілметокси)хінолін-3використанні відповідного спирту. карбонітрил Приклад 41 т. пл. 134-138°С; Мас спектр 485,3 (ES-) 4-[(2,4-Дихлорфеніл)аміно]-6-метокси-7-[(1Наступні приклади 54-57 здійснені за спосометилпіперидин-4-іл)метокси]хінолін-3-карбонітрил бом, аналогічним описаному в прикладі 27, і при т. пл. 224-225°С; Мас спектр 469,0 (ES-) використанні відповідного аміну. Приклад 42 Приклад 54 4-[(2,4-Диметил-5-метоксифеніл)аміно]-64-[(2,4-Дихлор-5-метоксифеніл)аміно]-7-{[3метокси-7-[(1-метилпіперидин-4-іл)метокси]хінолін(диметиламіно)пропіл]аміно}-6-метоксихінолін-33-карбонітрил карбонітрил т. пл. 160-162°С; Мас спектр 461,3 (ES+) т. пл. 165-167°С; Мас спектр 474,1 (ES+) 51 77799 52 Приклад 55 ржання 203мг 6-метокси-7-[(1-метилпіперидин-44-[(2,4-[(2,4-Дихлор-5-метоксифеніл)аміно]-7іл)метокси]-4-{[4-(піридин-3{[3-(диметиламіно)пропіл](метил)аміно}-6ілокси)феніл]аміно}хінолін-3-карбонітрилу, т. пл. метоксихінолін-3-карбонітрил 182-184°С. т. пл. 116-117°С; Мас спектр 486,2 (ES-) MS 496,3 (М+Н)+ Приклад 56 Дані аналізу для C29H29N5O 3 - 0,6 НС1 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6Обчислено: С 67,30, Η 5,77, Ν 13,54. метокси-7-[(2-метоксіетил)аміно]-хінолін-3Знайдено: С 67,23, Η 5,65, Ν 13,38. карбонітрил Приклад 58 т. пл. 165-166°С; Мас спектр 445,1 (ES-) 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6Приклад 57 метокси-7-{[3-(4-метилпіперазин-16-Метокси-7-(1-метилпіперидин-4-ілметокси)іл)пропіл]аміно}хінолін-3-карбонітрил 4-{[4-(піридин-3-ілокси)феніл]аміно}хінолін-3MS 529,2 (ES+) карбонітрил Приклад 59 Слідуючи способу, що використовується при 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-6одержанні за посилальним прикладом 22, суміш 4метокси-7-[(3-морфолін-4-ілпропіл)аміно]хінолін-3хлор-6-метокси-7-[(1-метилпіперидин-4карбонітрил іл)метокси]хінолін-3-карбонітрилу (200мг, MS 516,1 (ES+) 0,58ммоль) і 4-(піридин-3-ілокси)феніламіну Приклад 60 (161,5мг, 0,87ммоль) [Cacciola, J.; Fe vig, Stouten, 4-[(2,4-Дихлор-5-метоксифеніл)аміно]-1-(2,2P. F. W.; Ale xander, Knabb, Wexler, R. W. Bioorg. діетоксіетокси)-6-метоксихінолін-3-карбонітрил Med. Chem. Let. 2000, 10, 1253] приводить до одеMS 506,2 (ES+). Комп’ютерна в ерстка О. Гапоненко Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of 7-substituted-3-quinolinecarbonitriles
Назва патенту російськоюСпособ получения 7-замещенных-3-хинолин и 3-хинол-4-он карбонитрилов
МПК / Мітки
МПК: C07D 215/56, A61P 35/00, C07D 405/12, A61K 31/4709, C07D 401/12, A61K 31/4704, C07D 401/14, A61K 31/554, A61P 43/00, C07D 409/12, C07D 215/54
Мітки: спосіб, 3-хінол-4-онкарбонітрилів, 7-заміщеного-3-хінолін, одержання
Код посилання
<a href="https://ua.patents.su/26-77799-sposib-oderzhannya-7-zamishhenogo-3-khinolin-i-3-khinol-4-onkarbonitriliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 7-заміщеного-3-хінолін і 3-хінол-4-онкарбонітрилів</a>
Попередній патент: Спосіб ампутації гомілки
Наступний патент: Прес імпульсного штампування
Випадковий патент: Ківш драглайна






























