Сполука-інгібітор сигнального шляху notch
Формула / Реферат
1. Сполука, яка має структуру:
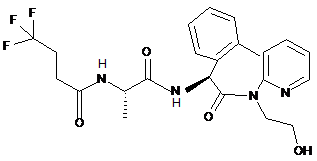 ,
,
Сполука 1
або її фармацевтично прийнятна(ий) сіль або гідрат.
2. Сполука, яка має структуру:
 ,
,
Сполука 1
або її фармацевтично прийнятна сіль.
3. Фармацевтична композиція, яка містить сполуку за п. 1 або її фармацевтично прийнятну(й) сіль або гідрат разом із фармацевтично прийнятним носієм.
4. Сполука за п. 1 або її фармацевтично прийнятна(ий) сіль або гідрат для застосування в лікуванні раку, яким є Т-клітинний гострий лімфобластний лейкоз, гострий лімфобластний лейкоз, гострий мієлоїдний лейкоз, хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак легенів, рак підшлункової залози, гліобластома, колоректальний рак, рак голови та шиї, рак шийки матки, рак передміхурової залози, рак печінки, плоскоклітинний рак (порожнини рота), рак шкіри або медулобластома.
5. Сполука за п. 1 або її фармацевтично прийнятна(ий) сіль або гідрат для використання в лікуванні раку, яким є Т-клітинний гострий лімфобластний лейкоз, хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак підшлункової залози, гліобластома або колоректальний рак.
6. Застосування сполуки за п. 1 або її фармацевтично прийнятної(ого) солі або гідрату для виготовлення лікарського засобу для лікування раку, яким є Т-клітинний гострий лімфобластний лейкоз, гострий лімфобластний лейкоз, гострий мієлоїдний лейкоз, хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак легенів, рак підшлункової залози, гліобластома, колоректальний рак, рак голови та шиї, рак шийки матки, рак передміхурової залози, рак печінки, плоскоклітинний рак (порожнини рота), рак шкіри або медулобластома.
7. Застосування сполуки за п. 1 або її фармацевтично прийнятної(ого) солі або гідрату для виготовлення лікарського засобу для лікування раку, яким є Т-клітинний гострий лімфобластний лейкоз, гострий лімфобластний лейкоз, хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак підшлункової залози, гліобластома або колоректальний рак.
8. Сполука за п. 1, яка являє собою кристалогідрат, що характеризується порошковою рентгенограмою, одержаною з використанням джерела випромінення СuКa, яка має пік при 22,97±0,2 градуса 2-тета в комбінації з одним або декількома піками при 11,96±0,2 градуса 2-тета, 18,81±0,2 градуса 2-тета, 20,78±0,2 градуса 2-тета або 21,07±0,2 градуса 2-тета при температурі та відносній вологості, які відповідають умовам навколишнього середовища.
Текст
Реферат: Цей винахід пропонує сполуку або її фармацевтично прийнятну сіль чи гідрат і фармацевтичну композицію, яка містить згадану сполуку або її фармацевтично прийнятну сіль чи гідрат, корисну як інгібітор сигнального шляху Notch для лікування раку. UA 110834 C2 (12) UA 110834 C2 UA 110834 C2 5 10 15 20 25 30 Сигнальний шлях Notch являє собою еволюційно збережений шлях, який відіграє суттєву роль у розвитку і тканинному гомеостазі в ссавців. Рецептори і ліганди Notch, які містять однопрохідні трансмембранні домени, експресуються на клітинній поверхні, і з цієї причини сигнальний шлях Notch є особливо важливим в опосередкуванні зв'язку між сусідніми клітинами, які експресують ці рецептори і ліганди. Існують чотири відомі рецептори Notch, знайдені у гризунів і людини, які позначають Notch 1, Notch 2, Notch 3, Notch 4. Ці рецептори Notch являють собою гетеродимерні білки, які складаються з позаклітинних та внутрішньоклітинних доменів, які первісно синтезуються у вигляді окремого поліпептиду. Взаємодія рецептор-ліганд ініціює ряд протеолітичних розщеплень поліпептиду рецептора Notch, у яких бере участь активність γсекретази. Активність γ-секретази відщеплює внутрішньоклітинний домен Notch від клітинної поверхні, який транслокується в ядро з утворенням комплексу фактора транскрипції. Внутрішньоклітинний домен Notch (NICD) являє собою активну форму білка. Різні функції сигнального шляху Notch включають проліферацію, диференціювання, апоптоз, ангіогенез, міграцію та самовідновлення. Ці різноманітні ролі сигнального шляху Notch під час розвитку і підтримки нормальних тканин аберантно активуються при різних формах раку. До онкогенних функцій сигнального шляху Notch належать інгібування апоптозу і стимулювання клітинної проліферації. У каскаді активації Notch γ-секретаза відіграє ключову роль. Як наслідок, інгібітори γсекретази активно досліджують на предмет їх здатності блокування активації рецептора Notch. Сполуки, наведені як приклад у WO 98/28268, такі як 7C-203, є типовими представниками таких інгібіторів γ-секретази. Незважаючи на заяви, на ринку не з'явилось будь-яких хіміотерапевтичних засобів-інгібіторів Notch. Існує необхідність в представленні сполук, які мають інгібуючу активність відносно сигнального шляху Notch. Існує також потреба в сполуках, які мають інгібуючу активність відносно γ-секретази. Існує також необхідність у сполуках, які мають різні структурні характерні особливості, які можуть сприяти інгібуючій активності відносно Notch. Існує також потреба в сполуках, які демонструють інгібуючу активність відносно сигнального шляху Notch і бажані in vivo властивності розподілу, метаболізму та виділення. Фігура 1 являє собою характерну порошкову рентгенограму сполуки Прикладу 2. За одним з аспектів цей винахід пропонує сполуку-інгібітор сигнального шляху Notch, яка має структуру: F F F H N O N H O N N O OH 35 40 45 , Сполука 1 або її фармацевтично прийнятну сіль чи гідрат. За другим аспектом цей винахід пропонує фармацевтичну композицію, яка містить 4,4,4трифтор-N-[(1S)-2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1метил-2-оксоетил]бутанамід або його фармацевтично прийнятну сіль чи гідрат в поєднанні із фармацевтично прийнятним носієм. У конкретному варіанті здійснення цього винаходу згадана фармацевтична композиція містить 4,4,4-трифтор-N-[(1S)-2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7Hпіридо[2,3-d][3]бензазепін-7-іл]аміно]-1-метил-2-оксоетил]бутанамід або його фармацевтично прийнятну сіль чи гідрат разом із фармацевтично прийнятним носієм і факультативно іншими терапевтичними інгредієнтами. За третім аспектом цей винахід пропонує спосіб інгібування сигнального шляху Notch у пацієнта, що страждає на рак, який включає введення терапевтично ефективної кількості 4,4,4трифтор-N-[(1S)-2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1метил-2-оксоетил]бутанаміду або його фармацевтично прийнятної солі чи гідрату пацієнту, що цього потребує. За четвертим аспектом цей винахід пропонує спосіб лікування раку, яким є Т-клітинний гострий лімфобластний лейкоз, гострий лімфобластний лейкоз, гострий мієлоїдний лейкоз, 1 UA 110834 C2 5 10 15 20 25 30 35 40 45 50 55 60 хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак легенів, рак підшлункової залози, гліобластома, колоректальний рак, рак голови та шиї, рак шийки матки, рак передміхурової залози, рак печінки, плоскоклітинний рак (порожнини рота), рак шкіри або медулобластома, у пацієнта, який включає введення пацієнту, що цього потребує, терапевтично ефективної кількості 4,4,4-трифтор-N-[(1S)-2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7Hпіридо[2,3-d][3]бензазепін-7-іл]аміно]-1-метил-2-оксоетил]бутанаміду або його фармацевтично прийнятної солі чи гідрату. За п'ятим аспектом цей винахід пропонує спосіб лікування раку, яким є Т-клітинний гострий лімфобластний лейкоз, гострий лімфобластний лейкоз, хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак підшлункової залози, гліобластома або колоректальний рак, у пацієнта, який включає введення пацієнту, що цього потребує, терапевтично ефективної кількості 4,4,4-трифтор-N-[(1S)-2-[[(7S)-5-(2-гідроксіетил)-6оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1-метил-2-оксоетил]бутанаміду або його фармацевтично прийнятної солі чи гідрату. За шостим аспектом цей винахід пропонує сполуку, яка являє собою 4,4,4-трифтор-N-[(1S)2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1-метил-2оксоетил]бутанамід, або її фармацевтично прийнятну сіль чи гідрат для застосування в терапії. За сьомим аспектом цей винахід пропонує сполуку, яка являє собою 4,4,4-трифтор-N-[(1S)2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1-метил-2оксоетил]бутанамід, або її фармацевтично прийнятну сіль чи гідрат для застосування при лікуванні раку, яким є Т-клітинний гострий лімфобластний лейкоз, гострий лімфобластний лейкоз, гострий мієлоїдний лейкоз, хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак легенів, рак підшлункової залози, гліобластома, колоректальний рак, рак голови та шиї, рак шийки матки, рак передміхурової залози, рак печінки, плоскоклітинний рак (порожнини рота), рак шкіри або медулобластома. За восьмим аспектом цей винахід пропонує сполуку, яка являє собою 4,4,4-трифтор-N-[(1S)2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1-метил-2-оксоетил] бутанамід, або її фармацевтично прийнятну сіль чи гідрат для застосування при лікуванні раку, яким є Т-клітинний гострий лімфобластний лейкоз, гострий лімфобластний лейкоз, хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак підшлункової залози, гліобластома або колоректальний рак. За дев'ятим аспектом цей винахід пропонує застосування сполуки, яка являє собою 4,4,4трифтор-N-[(1S)-2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1метил-2-оксоетил]бутанамід, або її фармацевтично прийнятної солі чи гідрату для виготовлення лікарського засобу для лікування раку, яким є Т-клітинний гострий лімфобластний лейкоз, гострий лімфобластний лейкоз, гострий мієлоїдний лейкоз, хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак легенів, рак підшлункової залози, гліобластома, колоректальний рак, рак голови та шиї, рак шийки матки, рак передміхурової залози, рак печінки, плоскоклітинний рак (порожнини рота), рак шкіри або медулобластома. За десятим аспектом цей винахід пропонує застосування сполуки, яка являє собою 4,4,4трифтор-N-[(1S)-2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1метил-2-оксоетил]бутанамід, або її фармацевтично прийнятної солі чи гідрату для виготовлення лікарського засобу для лікування раку, яким є Т-клітинний гострий лімфобластний лейкоз, гострий лімфобластний лейкоз, хронічний мієлоїдний лейкоз, еритролейкоз, рак молочної залози, рак яєчника, меланома, рак підшлункової залози, гліобластома або колоректальний рак. Термін "пацієнт" означає ссавця, а термін "ссавець" охоплює, але без обмеження цим, людину. Термін "терапевтично ефективна кількість" або "ефективна кількість" означає дозу сполуки або її фармацевтично прийнятної солі чи гідрату, або фармацевтичної композиції, яка містить згадану сполуку або її фармацевтично прийнятну сіль чи гідрат, необхідну для інгібування сигнального шляху Notch у пацієнта, що страждає на рак, і або знищення ракових клітинмішеней, або уповільнення чи зупинки розвитку раку у пацієнта. Очікувані дози Сполуки 1 або її фармацевтично прийнятної солі чи гідрату становлять 0,1-200 мг на пацієнта за добу. Очікується, що доза, якій віддається перевага, становитиме 1-175 мг на пацієнта за добу. Очікується, що доза, якій віддається найбільша перевага, становитиме 5-150 мг на пацієнта за добу. Точну дозу, необхідну для лікування пацієнта, і тривалість періоду лікування визначатиме лікар-куратор з урахуванням стадії і тяжкості захворювання, а також конкретних потреб і реакції окремого пацієнта. Незважаючи на те, що була запропонована схема приймання лікарського засобу, побудована на добовій дозі, ця схема може бути скоригована для забезпечення більш 2 UA 110834 C2 5 10 15 20 25 30 35 40 45 50 55 60 оптимальної терапевтичної користі для пацієнта і для лікування та зменшення інтенсивності симптомів слизової ентеропатії (гіперсекреція та накопичення слизу в шлунково-кишковому тракті). Крім дозування раз на добу, доцільним може бути дозування через день (Q2D); через день протягом п'ятиденного періоду з подальшими двома днями без дозування (TIW) або кожен третій день (Q3D). Схемам приймання лікарського засобу через день, TIW або кожен третій день віддають перевагу разом з введенням дексаметазону (перед введенням, одночасно з введенням або після введення Сполуки 1) для лікування і зменшення інтенсивності симптомів слизової ентеропатії. Терміни "лікування" і "лікувати" означають охоплення повного спектра впливу для раку, на який страждає пацієнт, наприклад, введення активної сполуки для полегшення, уповільнення або зміни на протилежний напрямку розвитку одного або декількох симптомів і уповільнення розвитку раку, навіть якщо рак фактично не усунений. Згаданим пацієнтом, який підлягає лікуванню, є ссавець, зокрема, людина. Сполуці за цим винаходом за варіантом, якому віддають перевагу, надають форму фармацевтичної композиції з використанням фармацевтично прийнятного носія, і вводять її різноманітними шляхами. За варіантом, якому віддають перевагу, такі композиції призначені для перорального введення. Такі фармацевтичні композиції і способи їх одержання є добре відомими в цій галузі. Дивись, наприклад, REMINGTON: THE SCIENCE AND PRACTICE OF th PHARMACY (A. Gennaro, et al., eds., 19 ed., Mack Publishing Co., 1995). У конкретному варіанті здійснення цього винаходу фармацевтична композиція містить 4,4,4-трифтор-N-[(1S)-2-[[(7S)-5(2-гідроксіетил)-6-оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1-метил-2-оксоетил]бутанамід або його фармацевтично прийнятну сіль чи гідрат разом з фармацевтично прийнятним носієм і факультативно іншими терапевтичними інгредієнтами, зокрема, для лікування раку загалом або раку конкретного типу. Сполука за цим винаходом здатна реагувати з численними неорганічними і органічними кислотами з утворенням фармацевтично прийнятних солей приєднання кислоти. Такі фармацевтично прийнятні солі і загальна методика їх одержання є добре відомими в цій галузі. Дивись, наприклад, P. Stahl, et al., HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION AND USE, (VCHA/Wiley-VCH, 2002); S.M. Berge, et al., "Pharmaceutical Salts", Journal of Pharmaceutical Sciences, Vol. 66, No. 1, January 1977. Сполука 1 або її фармацевтично прийнятна сіль чи гідрат можуть бути одержані за різноманітними методиками, відомими в цій галузі, а також описаними нижче. Конкретні стадії синтезу можуть бути по-різному об'єднані для одержання Сполуки 1 або її фармацевтично прийнятної солі чи гідрату. Сполука 1 має назву: 4,4,4-трифтор-N-[(1S)-2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7H-піридо[2,3d][3]бензазепін-7-іл]аміно]-1-метил-2-оксоетил]бутанамід; і також може мати назву: N-[(1S)-2[[(7S)-6,7-дигідро-5-(2-гідроксіетил)-6-оксо-5H-піридо[3,2-a][3]бензазепін-7-іл]аміно]-1-метил-2оксоетил]-4,4,4-трифторбутанамід; для однозначної ідентифікації Сполуки 1 можуть використовуватись й інші назви. Слід розуміти, що Сполука 1 зображена у вигляді окремого стереоізомера. Існують два хіральні центри, які спричинюють виникнення чотирьох стереоізомерів. У значенні, вживаному у цьому описі, посилання на Сполуку 1 охоплюють також рацемічні суміші, які містять Сполуку 1. У цьому описі позначення (R)- та (S)- за системою Кана-Інгольда-Прелога вжиті для позначення конкретних ізомерів. Конкретні стереоізомери можуть бути одержані стереоспецифічним синтезом із використанням енантіомерно чистих або збагачених вихідних матеріалів. Конкретні стереоізомери з будь-яких вихідних матеріалів, проміжних хімічних сполук або рацемічних сумішей, у тому числі Сполука 1, можуть бути виділені за допомогою методів, добре відомих в цій галузі, таких як методи, описані в Stereochemistry of Organic Compounds, E.I. Eliel and S.H. Wilen (Wiley 1994) та Enantiomers, Racemates, and Resolutions, J., Jacques, A. Collet, and S.H. Wilen (Wiley 1991), у тому числі хроматографії на хіральних нерухомих фазах, ферментативного розділення, фракційної кристалізації або хроматографії діастереомерів, утворених з цією метою, наприклад, діастереомерних солей. Незважаючи на те, що цей винахід охоплює усі суміші, які містять сполуку за цим винаходом, варіантом здійснення цього винаходу, якому віддають перевагу, є Сполука 1. Крім того, було виявлено, що Сполука 1 існує у вигляді атропоізомерів, або конкретних конформерів. У водних розчинах через 24 год. при температурі навколишнього середовища за 1 допомогою Н ЯМР і рідинної хроматографії з мас-спектроскопічним детектуванням (LC-MS) виявляють 8-9 % атропоізомеру 2 (неосновний атропоізомер) у стані рівноваги з атропоізомером 1 (основний атропоізомер). У органічних розчинниках через 24 год. при 1 температурі навколишнього середовища за допомогою Н ЯМР і LC-MS виявляють приблизно 3 UA 110834 C2 5 10 15 20 25 30 1-2 % атропоізомеру 2 у стані рівноваги з атропоізомером 1. Незважаючи на виявлення за 1 допомогою Н ЯМР і LC-MS аналізу, атропоізомер 2 виділенню не піддається. Сполуки, які використовують як вихідний матеріал в синтезі сполуки за цим винаходом, є добре відомі і, у разі відсутності на ринку, можуть бути легко синтезовані з використанням конкретних наданих посилань за допомогою стандартних методик, що традиційно використовуються фахівцями у цій галузі або містяться у загальних довідкових посібниках. До прикладів відомих методик і методів належать ті, які описані в загальних довідкових посібниках, таких як Comprehensive Organic Transformations, VCH Publishers Inc, 1989; Compendium of Organic Synthetic Methods, Volumes 1-10, 1974-2002, Wiley Interscience; Advanced th Organic Chemistry, Reactions Mechanisms, and Structure, 5 Edition, Michael B. Smith and Jerry th March, Wiley Interscience, 2001; Advanced Organic Chemistry, 4 Edition, Part B, Reactions and Synthesis, Francis A. Carey and Richard J. Sundberg, Kluwer Academic/Plenum Publishers, 2000 тощо, а також у посиланнях, наведених у цьому описі. Проміжні хімічні сполуки та Сполука 1 названі із застосуванням програми SymaxDraw, версія 3.2, за структурами, відповідно до постійно застосовуваних назв ІЮПАК. До розчину 4,4,4-трифторомасляної кислоти (7,131 г, 48,7 ммоль) в дихлорметані (162 мл) при температурі навколишнього середовища в атмосфері азоту послідовно додають гідрохлорид L-аланінбензилового складного ефіру (7,00 г, 32,5 ммоль), діізопропілетиламін (28,30 мл, 162,3 ммоль), гідрат 1-гідроксибензотриазолу (7,46 г, 48,7 ммоль) і гідрохлорид 1-(3диметиламінопропіл)-3-етилкарбодііміду (9,33 г, 48,7 ммоль), і перемішують протягом 20 год. Додають 20 % водний розчин лимонної кислоти (150 мл, 162 ммоль), суміш перемішують протягом 5 хв, і шари розділяють. Водний шар екстрагують дихлорметаном (100 мл). Об'єднані органічні шари промивають насиченим водним розчином бікарбонату натрію (150 мл), сушать сульфатом магнію, та концентрують. Залишок очищають флеш-хроматографією з елююванням сумішшю гексан:етилацетат (від 4:1 до 2:1), та одержують вказану в заголовку сполуку у вигляді 25 білої твердої речовини (9,22 г, 30,4 ммоль, 94 %). MS (m/z): 304(M+1); [α]Na =-44,6° (c=5,0, метанол). 35 40 До розчину бензил-(2S)-2-(4,4,4-трифторбутаноїламіно)пропаноату (8,80 г, 29 ммоль) в метанолі (88 мл) при температурі навколишнього середовища однією порцією додають паладій на вугіллі (5 %, 1,76 г, 0,8 ммоль). Суміш знегажують (вакуумування/продування азоту), насичують воднем (одна атмосфера), і перемішують в атмосфері водню (29 ммоль) протягом 5 ® год. Фільтрують через Celite , промивають відфільтрований осад метанолом, фільтрат 4 UA 110834 C2 концентрують, та одержують вказану в заголовку сполуку у вигляді твердої білої речовини (6,11 25 г, 28,7 ммоль, 99 %). MS (m/z): 214 (M+1); [α]Na =-24,7° (c=5,0, метанол). Препаративна методика 3 Метил-2-(2-бромфеніл)ацетат 5 10 15 20 25 30 35 40 До розчину 2-бромфенілоцтової кислоти (150,0 г, 683,6 ммоль) в дихлорметані (1,50 л), охолодженого на водяній бані при температурі навколишнього середовища, додають диметилформамід (2,1 мл, 27,3 ммоль), після чого протягом 7 хв додають тіонілхлорид (52,3 мл, 717,8 ммоль). Суміш перемішують протягом 5 год., додають метанол (41,5 мл, 1,0 моль) протягом 5 хв. Розчин протягом ночі барботують азотом. Концентрують, та одержують вказану в 1 заголовку сполуку у вигляді безбарвного масла з кількісним виходом (166,0 г, 724,7 ммоль). H ЯМР (300 МГц, CDCl3): 7,57 (d, J=7,9 Гц, 1H), 7,30-7,26 (m, 2H), 7,19-7,12 (m, 1H), 3,80 (s, 2H), 3,72 (s, 3H). Препаративна методика 4 Метил-2-[2-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)феніл]ацетат Суспензію метил-2-(2-бромфеніл)ацетату (156,6 г, 684 ммоль), біс(пінаколато)дибору (194,9 г, 752 ммоль) і ацетату калію (135,6 г, 1,4 моль) в N-метилпіролідоні (940 мл) знегажують трьома циклами (вакуумування/продування азоту). Додають хлорид (1,1'біс(дифенілфосфіно)фероцен)паладію(II) (11,4 г, 13,7 ммоль), і нагрівають при температурі 80C. Через 15 год. додають хлорид (1,1'-біс(дифенілфосфіно)фероцен)паладію(II) (11,4 г, 13,7 ммоль), і перемішують при температурі 90 °C протягом 24 год. Охолоджують до температури навколишнього середовища, заливають сумішшю льоду і води (3 л), і додають метил-трет® бутиловий простий ефір (1 л). Суміш перемішують, фільтрують через шар Celite , і шари розділяють. Водний шар екстрагують метил-трет-бутиловим простим ефіром (2500 мл). Об'єднані органічні шари промивають водою (2500 мл), розсолом (500 мл), сушать сульфатом натрію, і концентрують. Залишок очищають флеш-хроматографією з елююванням сумішшю гексан:етилацетат (9:1), та одержують вказану в заголовку сполуку у вигляді білої твердої речовини (160,6 г, 581,6 ммоль, 85 %). MS (m/z): 277(M+1). Препаративна методика 5 5,7-Дигідропіридо[2,3-d][3]бензазепін-6-он До розчину 2-аміно-3-бромпіридину (88,5 г, 511,7 ммоль) в 1,4-діоксані (550 мл) і воді (550 мл) додають карбонат калію (235,7 г, 1,71 моль). Суміш знегажують трьома циклами (вакуумування/продування азоту), додають ацетат паладію(II) (6,4 г, 28,4 ммоль) та тетрафторборат три-t-бутилфосфонію (16,5 г, 56,9 ммоль), і перемішують в атмосфері азоту при температурі 88C. Протягом трьох хвилин додають краплями розчин метил-2-[2-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2-іл)феніл]ацетату (157,0 г, 568,5 ммоль) в 1,4-діоксані (550 мл), і суміш перемішують при температурі 88C протягом 20 хв. Суміш охолоджують до температури 50C, додають воду (100 мл), і шари розділяють. Водний шар екстрагують етилацетатом (2100 мл), об'єднані органічні шари сушать сульфатом натрію, і концентрують. 5 UA 110834 C2 5 10 15 20 25 30 35 40 Концентровану речовину розчиняють в N-метилпіролідоні (314 мл), охолоджують на льодяній бані, і краплями додають сірчану кислоту (314 мл, 5,9 моль) для підтримання температури на рівні приблизно 45 °C. Суміш перемішують при температурі 140 °C протягом 90 хв. Охолоджують до температури навколишнього середовища, додають лід (4 кг), і підлуговують шляхом додання порціями 50 % водного розчину NaOH, доки рН розчину не досягне рівня 7-8. Суспензію охолоджують до температури 10-15 °C, відфільтровують тверді речовини, і промивають водою (2 л), гексанами (1 л) і метил-трет-бутиловим простим ефіром (1 л). Висушують у вакуумі при температурі 40 °C. Речовину обробляють сумішшю 10 % метанолу/дихлорметан при нагріванні зі зворотним холодильником, і одержаний розчин фільтрують у гарячому стані (4). Об'єднані фільтрати концентрують, та одержують вказану в заголовку сполуку у вигляді світло-коричневої твердої речовини (85 г, 404,3 ммоль, 71 %). MS (m/z): 211(M+1). Препаративна методика 6 5-[2-(трет-Бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін-6-он До суспензії 5,7-дигідропіридо[2,3-d][3]бензазепін-6-ону (86,0 г, 409,1 ммоль) в диметилформаміді (860 мл) додають карбонат цезію (186,6 г, 572,7 ммоль), (2-брометокси)трет-бутилдиметилсилан (88,0 мл, 409,1 ммоль) та йодид натрію (6,1 г, 40,9 ммоль), і перемішують при температурі 70 °C протягом 20 год. Суміш охолоджують до температури навколишнього середовища, заливають льодом і водою (100 мл), додають етилацетат (200 мл). ® Суміш фільтрують через Celite , після чого промивають етилацетатом (100 мл). Шари фільтрату розділяють, водний шар екстрагують етилацетатом (250 мл). Об'єднані органічні шари промивають водою (2100 мл), розсолом (100 мл), сушать сульфатом натрію, і концентрують. Одержану речовину розчиняють у тетрагідрофурані (1,28 л), додають паладієвий поглинач ® SiliaBond (16,7 г), і перемішують при температурі навколишнього середовища протягом 20 год. Фільтрують через шар діоксиду кремнію, промивають тетрагідрофураном (200 мл), концентрують, та одержують вказану в заголовку сполуку (155 г, 420,6 ммоль) у вигляді світлокоричневого масла, яке кристалізується з кількісним виходом. MS (m/z): 369(M+1). Спосіб 2: Суміш 5,7-дигідропіридо[2,3-d][3]бензазепін-6-ону (22,5 г, 106,9 ммоль) і диметилформаміду (500 мл) нагрівають до температури 100 °C протягом 5 хв. Охолоджують до температури 40 °C, додають карбонат цезію (104,3 г, 320,1 ммоль) та (2-брометокси)-трет-бутилдиметилсилан (29,9 мл, 138,9 ммоль), і перемішують при температурі навколишнього середовища протягом ночі. Нагрівають до температури 60 °C протягом приблизно 2 год., після чого охолоджують до температури навколишнього середовища. Залишок розподіляють між етилацетатом (1 л) і водою (3 л), водний шар піддають зворотному екстрагуванню етилацетатом (2500 мл), об'єднані органічні шари промивають розсолом (2500 мл). Об'єднані органічні шари сушать сульфатом натрію, і концентрують. Залишок очищають флеш-хроматографією з елююванням сумішшю етилацетат:гексан (від 0:100 до 100:0), та одержують вказану в заголовку сполуку у вигляді масла (39,4 г, 106,9 ммоль, 89 %). MS (m/z): 369(M+1). Препаративна методика 7 5-[2-(трет-Бутил(диметил)силіл)оксіетил]-7- гідроксіімінопіридо[2,3-d][3]бензазепін-6-он 6 UA 110834 C2 5 До розчину 5-[2-(трет-бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін-6-ону (155,0 г, 420,6 ммоль) в тетрагідрофурані (1,6 л) при температурі -5 °C додають 2-метилпропан2-олат калію (66,1 г, 588,8 ммоль), і перемішують протягом 10 хв. Додають краплями ізоамілнітрит (61,9 мл, 462,6 ммоль) при температурі -5 °C, і суміш перемішують протягом 10 хв. Заливають сумішшю льод/вода (2 л), і екстрагують етилацетатом (3200 мл). Об'єднані органічні шари промивають розсолом (200 мл), сушать сульфатом натрію. Додають толуол (1 л), концентрують (3), та одержують вказану в заголовку сполуку у вигляді густого коричневого масла (160,0 г, 402,5 ммоль, 96 %). MS (m/z): 398(M+1). 10 15 20 25 30 До розчину 5-[2-(трет-бутил(диметил)силіл)оксіетил]-7-гідроксіімінопіридо[2,3d][3]бензазепін-6-ону (155,0 г, 389,9 ммоль) в суміші дихлорметану (620 мл) і метанолу (310 мл) на водяній бані з температурою навколишнього середовища додають декількома порціями трифтороцтову кислоту (124,0 мл, 1,64 моль). Додають декількома порціями цинк (76,5 г, 1,2 моль) так, щоб внутрішня температура підтримувалась на рівні 33-38 °C. Перемішують протягом ® 15 год. при температурі навколишнього середовища. Суміш фільтрують через Celite , промивають сумішшю 10 % метанол/дихлорметан (100 мл), і фільтрат концентрують. Додають дихлорметан (0,5 л) і лід (500 г), перемішують, і підлуговують 50 % водним розчином NaOH. Тверді речовини відфільтровують, шари фільтрату розділяють. Водний шар екстрагують дихлорметаном (2100 мл), і об'єднані органічні шари концентрують. Тверді речовини суспендують в гексані, після чого фільтрують, сушать під високим вакуумом, та одержують рацемат вказаної в заголовку сполуки у вигляді світло-жовтої твердої речовини (74,0 г, 274,8 ® ммоль, 71 %). Цю речовину очищають на колонці Chiralpak AD з елююванням сумішшю етанол (0,2 % розчин диметилетиламіну):ацетонітрил (від 0:100 до 100:0), та одержують вказану в заголовку сполуку (35,0 г, 130 ммоль, 33,3 %) у вигляді білої твердої речовини. MS (m/z): 25 270(M+1); [α]Na =+187,83° (c=6,9, метанол). Препаративна методика 9 7-Азидо-5-[2-(трет-бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін-6-он 7 UA 110834 C2 5 10 15 20 25 30 35 Гідрид калію (приблизно 2 ложки, 35 % (мас.) в мінеральному маслі) промивають гексанами, і декантують для видалення масла, додають тетрагідрофуран (60 мл), і охолоджують до температури -78 °C. Розчин 2,4,6-трис(1-метилетил)бензолсульфонілазиду (37,6 г, 121,6 ммоль) в тетрагідрофурані (60 мл) сушать сульфатом натрію протягом 45 хв. Розчин азиду декантують в суспензію гідриду калію протягом 15 хв. Охолоджувальну баню видаляють, і розчин витримують протягом 45 хв для нагрівання до температури навколишнього середовища; сухий розчин азиду відділяють. Розчин діізопропіламіну (17,0 мл, 121,0 ммоль) і тетрагідрофурану (50 мл) охолоджують до температури -78 °C, протягом 5 хв додають краплями н-бутиллітій (52,1 мл, 130,3 ммоль). Охолоджувальну баню видаляють, і розчин витримують протягом 15 хв для нагрівання, після чого знову охолоджують до температури -78 °C. Одержаний розчин протягом 5-10 хв вносять за допомогою канюлі до розчину 5-[2-(трет-бутил(диметил)силіл)оксіетил]-7Hпіридо[2,3-d][3]бензазепін-6-ону (34,3 г, 93,1 ммоль) в тетрагідрофурані (400 мл), що має температуру -78C. Перемішують протягом однієї години при температурі -78 °C, потім видаляють охолоджувальну баню, і витримують протягом 15 хв для нагрівання (до температури приблизно -45 °C). Охолоджують до температури -78 °C, і протягом 5-10 хв додають за допомогою канюлі сухий розчин 2,4,6-трис(1-метилетил)бензолсульфонілазиду. Баню видаляють, і витримують протягом 1 год. для нагрівання до температури від -5C до 0 °C. Охолоджують на бані з льодо-водяною сумішшю, і протягом 13 хв додають краплями оцтову кислоту (26,7 мл, 465,3 ммоль). Витримують протягом 65 хв для нагрівання до температури навколишнього середовища, і гасять насиченим розчином бікарбонату натрію (1 л). Реакційну суміш розбавляють етилацетатом (600 мл) і водою (2 л), шари розділяють, водний шар піддають зворотному екстрагуванню етилацетатом (2400 мл). Об'єднані органічні шари промивають насиченим водним розчином бікарбонату натрію (500 мл) і розсолом (500 мл), сушать сульфатом натрію, і концентрують. Залишок очищають флеш-хроматографією з елююванням сумішшю етилацетат:гексан (від 0:100 до 100:0), та одержують вказану в заголовку сполуку у вигляді масла (39,8 г, 92,3 ммоль, 99 %). MS (m/z): 410(M+1). Препаративна методика 10 7-Аміно-5-[2-(трет-бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін-6-он Паладій на вугіллі (2,2 г, 1,0 ммоль, 5 % на вугіллі) додають до продутого азотом розчину 7азидо-5-[2-(трет-бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін-6-ону (39,8 г, 92,3 ммоль) в етанолі (923 мл). Тричі вакуумують/насичують воднем, і перемішують в атмосфері водню (одна атмосфера) при температурі навколишнього середовища протягом ночі. ® Фільтрують через Celite , промивають етанолом та етилацетатом, концентрують, та одержують 8 UA 110834 C2 5 10 15 20 25 вказану в заголовку сполуку у вигляді прозорого масла (36,6 г, 89,9 ммоль, 97 %). MS (m/z): 384(M+1). Препаративна методика 11 трет-Бутил-N-[(1S)-2-[[5-[2-(трет-бутил(диметил)силіл)оксіетил]-6-оксо-7H-піридо[2,3d][3]бензазепін-7-іл]аміно]-1-метил-2-оксоетил]карбамат Суміш 7-аміно-5-[2-(трет-бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін-6-ону (36,3 г, 89,9 ммоль), дихлорметану (360 мл), триетиламіну (16,3 мл, 116,9 ммоль), 3гідрокситриазоло[4,5-b]піридину (15,9 г, 116,9 ммоль) та (2S)-2-(третбутоксикарбоніламіно)пропіонової кислоти (22,5 г, 116,9 ммоль) охолоджують до температури 0 °C. Додають гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду (22,4 г, 116,9 ммоль), і через 5 хв лишають для нагрівання до температури навколишнього середовища протягом ночі. Промивають водою (2500 мл), насиченим водним розчином бікарбонату натрію (2300 мл), розсолом (300 мл), після чого сушать сульфатом натрію, і концентрують. Залишок очищають флеш-хроматографією з елююванням сумішшю ізопропіловий спирт:гексан (від 5:95 до 10:90), та одержують вказану в заголовку сполуку у вигляді білої піни (43,14 г, 77,77 ммоль, 86,50 %). MS (m/z): 555(M+1). Препаративна методика 12 (2S)-2-Аміно-N-[5-(2-гідроксіетил)-6-оксо-7Н-піридо[2,3-d][3]бензазепін-7-іл]пропанамід Протягом 5 хв до розчину трет-бутил-N-[(1S)-2-[[5-[2-(трет-бутил(диметил)силіл)оксіетил]-6оксо-7H-піридо[2,3-d][3]бензазепін-7-іл]аміно]-1-метил-2-оксоетил]карбамату (5,56 г, 10,0 ммоль) і дихлорметану (30 мл), температура якого становить 0 °C, додають трифтороцтову кислоту (30 мл, 396,76 ммоль), витримують для нагрівання, і перемішують при температурі навколишнього ® середовища протягом 5 год. Залишок очищають флеш-хроматографією на колонці SCX (Isolute SCX-2 6) з елююванням спочатку метанолом, а потім сумішшю етилацетат:метанол (2н розчин) (1:1), та одержували вказану в заголовку сполуку у вигляді білої твердої речовини (3,48 г, 10,2 ммоль) з кількісним виходом. MS (m/z): 341(M+1). 9 UA 110834 C2 5 10 15 20 25 30 35 40 45 До суспензії (7S)-7-аміно-5-(2-гідроксіетил)-7H-піридо[2,3-d][3]бензазепін-6-ону (34,8 г, 129,2 ммоль) в дихлорметані (696 мл) при температурі 0C послідовно додають (2S)-2-(4,4,4трифторбутаноїламіно)пропіонову кислоту (28,9 г, 135,7 ммоль, одержану по суті так, як було описано вище в Препаративній методиці 2), гідрохлорид 1-(3-диметиламінопропіл)-3етилкарбодііміду (29,7 г, 155,1 ммоль), і перемішують протягом 5 хв. Додають моногідрат 1гідроксибензотриазолу (24,7 г, 155,1 ммоль), витримують протягом однієї години при перемішуванні, і потім нагрівають до температури навколишнього середовища. Додають (2S)-2(4,4,4-трифторбутаноїламіно)пропіонову кислоту (0,6 г, 2,6 ммоль), і перемішують протягом 15 хв при температурі навколишнього середовища. Додають воду (600 мл), відфільтровують білу тверду речовину, і шари фільтрату розділяють. Органічний шар промивають водою (3200 мл), сушать сульфатом натрію, концентрують, та одержують світло-коричневу піну. Одержану речовину суспендують у 50 % суміші метил-трет-бутилового простого ефіру та гексанів (500 мл), відфільтровують тверді речовини, сушать під високим вакуумом, та одержують 65 г твердих речовин. До розчину одержаних раніше твердих речовин (65,0 г, 140,0 ммоль) в метанолі (195 мл), температура якого становить 10 °C, додають воду (195 мл) та бікарбонат калію (14,0 г, 140,0 ммоль), і перемішують при температурі навколишнього середовища протягом 29 год. Концентрують, і екстрагують дихлорметаном (350 мл). Об'єднані органічні шари промивають водою (320 мл), сушать сульфатом натрію, і концентрують. Залишок очищають флешхроматографією з елююванням сумішшю метанол:дихлорметан (98:2, 7н розчин у аміаку). Одержану речовину розтирають спочатку з 50 % сумішшю метил-трет-бутилового простого ефіру з гексаном, потім розтирають з метил-трет-бутиловим простим ефіром (500 мл). Тверді речовини промивають метил-трет-бутиловим простим ефіром (200 мл) та гексаном (200 мл), тверді речовини сушать під високим вакуумом, та одержують вказану в заголовку сполуку у 25 вигляді не зовсім білої твердої речовини (42,0 г, 90,4 ммоль, 65 %). MS (m/z): 270(M+1); [α]Na =153,40° (c=5,0, метанол). Спосіб 2: До суміші (2S)-2-аміно-N-[5-(2-гідроксіетил)-6-оксо-7Н-піридо[2,3-d][3]бензазепін-7іл]пропанаміду (3,4 г, 10,0 ммоль), дихлорметану (40 мл), 3-гідрокситриазоло[4,5-b]піридину (1,8 г, 13,0 ммоль), 4,4,4-трифторбутанової кислоти (1,9 г, 13,0 ммоль) та триетиламіну (1,8 мл, 13,0 ммоль), температура якої становить 0C, додають гідрохлорид 1-(3-диметиламінопропіл)-3етилкарбодііміду (2,50 г, 13,0 ммоль). Витримують протягом ночі для нагрівання до температури навколишнього середовища при перемішуванні. Додають воду (40 мл), і розподіляють між дихлорметаном (100 мл) і водою (50 мл). Шари розділяють, водний шар піддають зворотному екстрагуванню дихлорметаном, об'єднані органічні шари промивають насиченим водним розчином бікарбонату натрію (2100 мл). Бікарбонатні шари піддають зворотному екстрагуванню дихлорметаном (25 мл), об'єднані органічні шари сушать сульфатом натрію, і концентрують. Залишок очищають флеш-хроматографією з елююванням сумішшю метанол (2н розчин аміаку):дихлорметан (від 0:100 до 5:95), та одержують 3,77 г суміші діастереомерів. ® Матеріал очищають на колонці Chiralpak AD з елююванням сумішшю етанол (0,2 % розчин диметилетиламіну):ацетонітрил (від 0:100 до 100:0), та одержують вказану в заголовку сполуку у вигляді білої твердої речовини (1,7 г, 3,7 ммоль, 37 %). MS (m/z): 465(M+1). Препаративна методика 13 Метил-2-(2-бромфеніл)ацетат 10 UA 110834 C2 5 10 15 20 25 30 35 2-бромфенілоцтову кислоту (500,0 г, 2,33 моль) змішують з метанолом (5,0 л) в атмосфері азоту. Додають краплями концентровану сірчану кислоту (185,8 мл) при температурі 20-35C, після чого нагрівають до температури 60-65 °C при перемішуванні протягом 3-4 год. Реакційну суміш охолоджують до температури 45 °C, і концентрують під зниженим тиском при температурі нижче 45 °C до об'єму приблизно 750 мл. Реакційну суміш охолоджують до температури 1030 °C, і додають дихлорметан (2,5 л). Доводять рН до рівня 7-8 гідроксидом натрію (7 %, 380,0 мл), і шари розділяють. Органічну фазу концентрують досуха під зниженим тиском при температурі нижче 45 °C, та одержують вказану в заголовку сполуку (516,5 г, 97,0 %) у вигляді масла жовтого кольору. Препаративна методика 14 5,7-Дигідропіридо[2,3-d][3]бензазепін-6-он Метил-2-(2-бромфеніл)ацетат (1,0 кг, 4,36 моль), діоксан (11,0 л) і N-метил-2-піролідон (7,0 л) змішують при кімнатній температурі. До цієї суміші додають біс(пінаколато)дибор (1,2 кг, 4,58 моль) і ацетат калію (855,9 г, 8,72 моль), після чого одержаний розчин знегажують шляхом пропускання газоподібного азоту через цей розчин протягом 2-3 год. В атмосфері азоту завантажують продукт приєднання дихлориду [1,1'-біс(дифенілфосфіно)фероцен]паладію(II) до дихлорметану (71,2 г, 97,2 ммоль), після чого реакційну суміш нагрівають до температури 8090 °C протягом 18-20 год., та одержують метил-2-[2-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)феніл]ацетату у вигляді розчину, який використовують без виділення. Реакційну суміш охолоджують до температури 15-25 °C, і додають 2-аміно-3-бромпіридин (675,0 г, 3,90 моль) та розчин ортофосфату калію (2,41 кг, 11,3 моль) у воді (3,0 л). Розчин знегажують пропусканням газоподібного азоту через цей розчин протягом 2-3 год., і додають продукт приєднання дихлориду [1,1'-біс(дифенілфосфіно)фероцен]паладію(II) до дихлорметану (106,8 г, 130,8 ммоль), після чого реакційну суміш нагрівають до температури 80-90 °C протягом 18-40 год. Реакційну суміш охолоджують до температури 50-60 °C, і повільно додають розчин, утворений з насиченого розчину бікарбонату натрію (13,0 л), насиченого розчину хлориду натрію (13,0 л) і води (13,0 л). Суміш перемішують протягом 2-3 год. при температурі 50-60 °C, охолоджують до температури 15-25 °C, і перемішують протягом 18-20 год. Одержані тверді речовини відфільтровують, і відфільтрований осад промивають водою (22,0 л). Тверді речовини переносять у чисту реакційну посудину, додають етилацетат (5,0 л), і суміш нагрівають до температури 60-70 °C протягом 2-3 год. Розчин охолоджують до температури 15-25 °C, перемішують протягом 1-2 год., і одержані тверді речовини відфільтровують. Відфільтрований осад промивають етилацетатом (2750 мл), одержані тверді речовини сушать у вакуумі, та одержують вказану в заголовку сполуку (644,0 г, 68,1 %) у вигляді не зовсім білої твердої речовини. Препаративна методика 15 5-[2-(трет-Бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін-6-он 11 UA 110834 C2 5 10 15 20 25 30 Додають 5,7-дигідропіридо[2,3-d][3]бензазепін-6-он (33,8 г, 0,16 моль) в ацетонітрил (340,0 мл), і перемішують при температурі 20-30 °C протягом 0,5-1 год. Додають карбонат цезію (104,6 г, 0,32 моль) та (2-брометокси)-трет-бутилдиметилсилан (42,2 г, 0,18 моль), і реакційну суміш нагрівають до температури 70-80 °C протягом 18-20 год. Реакційну суміш охолоджують до температури 20-25 °C, і фільтрують через діатомову землю (50,6 г). Відфільтрований осад промивають ацетонітрилом (250,6 мл), і фільтрат концентрують при зниженому тиску до загального об'єму приблизно 67,5 мл. Додають толуол (152 мл), активоване вугілля (2,53 г), і суміш нагрівають до температури 60-70 °C протягом 1-2 год. Суміш охолоджують до температури 25-35 °C, і реакційну суміш фільтрують через діатомову землю (50,6 г). Відфільтрований осад промивають толуолом (17,0 мл), концентрують при зниженому тиску, та одержують вказану в заголовку сполуку у вигляді світло-коричневого масла, яке кристалізується при відстоюванні (56,8 г, 92,2 %). Препаративна методика 16 5-[2-(трет-Бутил(диметил)силіл)оксіетил]-7-гідроксіімінопіридо[2,3-d][3]бензазепін-6-он Об'єднують 5-[2-(трет-бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін-6-он (30,0 г, 0,08 моль) і толуол (300,0 мл), і одержану реакційну суміш охолоджують до температури -10-0С. Додають трет-бутоксид калію (18,2 г, 0,16 моль) та ізоамілнітрит (13,34 г, 0,11 моль), після чого перемішують протягом 3-5 год. Реакційну суміш переносять в охолоджений (0-5 °C) двофазний розчин етилацетату (210 мл) та води (510мл), і перемішують протягом 15-30 хв. Реакційну суміш нагрівають до температури 15-25 °C, і шари розділяють. Водний шар екстрагують додатковою кількістю етилацетату (120 мл) та метил-трет-бутиловим простим ефіром (120 мл), і органічні шари об'єднують. Органічні шари концентрують при зниженому тиску до об'єму розчину приблизно 60-90 мл, після чого додають толуол (240 мл) і етилацетат (75 мл). Розчин фільтрують через силікагель (45,0 г), силікагель промивають сумішшю толуолу (210 мл) та етилацетату (60 мл), і фільтрат концентрують при зниженому тиску до об'єму приблизно 75 мл. Додають гептан (120 мл), суміш концентрують до об'єму приблизно 60 мл, і одержані тверді речовини відфільтровують. Відфільтрований осад промивають гептаном (25 мл), сушать у вакуумі, та одержують вказану в заголовку сполуку (28,3 г, 72,5 %) у вигляді жовтої твердої речовини. Препаративна методика 17 7-Аміно-5-[2-(трет-бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін-6-он 12 UA 110834 C2 5 Об'єднують 5-[2-(трет-бутил(диметил)силіл)оксіетил]-7-гідроксіімінопіридо[2,3d][3]бензазепін-6-он (206,0 г, 0,52 моль) і тетрагідрофуран (2,3 л) в автоклаві в атмосфері азоту. До одержаної реакційної суміші додають нікель Ренея (232,0 г, 1,13 екв. у масовому 2 відношенні), і вводять водневу атмосферу (87 фунт/дюйм (599,8 кПа)). Реакційну суміш перемішують при температурі 60-65 °C протягом 24 год. Суміш фільтрують через діатомову землю, і цей допоміжний фільтрувальний матеріал промивають тетрагідрофураном (500 мл). Фільтрат концентрують, та одержують вказану в заголовку сполуку (196,0 г, 93,2 %) у вигляді коричневого масла. MS (m/z): 384 (M+1). 10 15 20 25 30 Об'єднують 7-аміно-5-[2-(трет-бутил(диметил)силіл)оксіетил]-7H-піридо[2,3-d][3]бензазепін6-он (166,0 г, 0,43 моль), дихлорметан (2,2 л) і L-Boc-аланін (106,4 г, 0,56 моль) в атмосфері азоту. Додають гідроксибензотриазол (1,46 г, 10,8 ммоль) і триетиламін (102,5 мл, 0,74 моль), підтримуючи внутрішню температуру нижче 30С. Додають порціями 1-етил-3-(3диметиламінопропіл)карбодіімід (128,2 г, 0,67 моль), і перемішують протягом 16-18 год. при температурі 20-30С. Реакційну суміш очищають хроматографією на силікагелі (300 г силікагелю) з елююванням дихлорметаном (2498 мл). Дихлорметанові розчини об'єднують, і об'єднаний розчин промивають водою (23,3 л). Органічну фазу концентрують при зниженому тиску до об'єму від 300 мл до 400 мл, і додають етилацетат (664,0 мл). Суміш концентрують при зниженому тиску до об'єму 300-400 мл, і додають етилацетат (664 мл). Суміш концентрують при зниженому тиску до об'єму 300-400 мл, і додають етилацетат (1,3 л). Додають тригідрат тетра-нбутиламонійфториду (149,4 г, 0,47 моль), і перемішують протягом 16-18 год. при температурі 20-30С. Додають водний розчин хлориду натрію (20 %, 1,6 л), шари розділяють, і органічну фазу знову промивають водним розчином хлориду натрію (20 %, 1,6 л). Органічний шар концентрують до об'єму приблизно 800-900 мл, і суміш перемішують протягом 12-16 год. при температурі 20-30С. Одержані тверді речовини відфільтровують, відфільтрований осад промивають етилацетатом (91,3 мл). Фільтрат очищають хроматографією на силікагелі (300 г силікагелю) з елююванням етилацетатом (2500 мл), та одержують вказану в заголовку сполуку (82,6 г, діастереомерний надлишок 85,2 %, енантіомерний надлишок 100 %, вихід 51,2 %) у вигляді жовтого масла. MS (m/z): 441 (M+1). 13 UA 110834 C2 5 10 15 20 25 Об'єднують трет-бутил-N-[(1S)-2-[[5-(2-гідроксіетил)-6-оксо-7H-піридо[2,3-d][3]бензазепін-7іл]аміно]-1-метил-2-оксоетил]карбамат (54,0 г, 0,12 моль) і ацетонітрил (212,7 мл) в атмосфері азоту. Додають краплями хлористоводневу кислоту (317,5 мл, 4н, 1,27 моль) для підтримування внутрішньої температури нижче 30 °C, і реакційну суміш перемішують протягом 16-18 год. при температурі 20-30С. Додають воду (324,0 мл) та дихлорметан (430 мл), і шари розділяють. Органічний шар викидають, до водної фази додають дихлорметан (645 мл), і рН доводять до приблизно 10, використовуючи водний розчин гідроксиду натрію (20 %, 252 мл). Шари розділяють, водний шар екстрагують додатковою кількістю дихлорметану (2430 мл), органічні фази об'єднують. Об'єднану органічну фазу концентрують при зниженому тиску при температурі нижче 45 °C до об'єму приблизно 130-150 мл, і додають тетрагідрофуран (322 мл). Розчин концентрують при зниженому тиску при температурі нижче 45 °C до об'єму приблизно 200-220 мл, і додають додаткову кількість тетрагідрофурану (213 мл). Реакційну суміш концентрують при зниженому тиску до об'єму приблизно 250-270 мл, і нагрівають до температури 60-65 °C протягом 2-3 год. Реакційну суміш повільно охолоджують до температури 5-15 °C, і перемішують протягом 5-8 год. Одержані тверді речовини відфільтровують, відфільтрований осад промивають етилацетатом (56 мл). Тверді речовини переносять у чисту реакційну посудину, додають етилацетат (150 мл), і нагрівають до температури 60-65 °C протягом 2-3 год., після чого розчин повільно охолоджують до температури 5-15 °C. При цій температурі розчин перемішують протягом 2-3 год., і одержані тверді речовини збирають шляхом фільтрації. Відфільтрований осад промивають етилацетатом (45 мл), і тверді речовини сушать в печі при зниженому тиску й при температурі нижче 60 °C, та одержують вказану в заголовку сполуку (21,0 г, діастереомерний надлишок 99,2 %, енантіомерний надлишок 100 %, вихід 51,0 %) у вигляді не зовсім білої твердої речовини. MS (m/z): 341 (M+1). 30 35 40 Об'єднують (2S)-2-аміно-N-[(7S)-5-(2-гідроксіетил)-6-оксо-7Н-піридо[2,3-d][3]бензазепін-7іл]пропанамід (45,0 г, 132,2 ммоль) і диметилформамід (452,9 мл) в атмосфері азоту. Охолоджують до температури 0-5 °C, і додають N-етилдіізопропіламін (77,4 мл, 444,0 ммоль), 4,4,4-трифтормасляну кислоту (19,9 г, 139,3 ммоль) і моногідрат гідроксибензотриазолу (22,3 г, 153,1 ммоль). Розчин перемішують протягом 5-10 хв, і додають однією порцією гідрохлорид 1етил-3-(3-диметиламінопропіл)карбодііміду (30,6 г, 159,6 ммоль). Реакційну суміш нагрівають до температури 20-25C, і перемішують протягом 1-2 год. Додають етилацетат (1,4 л) та воду (1,8 л), і перемішують протягом 0,5-1 год. Фази розділяють, органічний шар промивають водним розчином бікарбонату натрію (5 %, 1,0 л), і розчин концентрують при зниженому тиску до об'єму 200-300 мл. Додають етанол (522 мл), і розчин концентрують при зниженому тиску до об'єму 14 UA 110834 C2 5 10 15 20 25 30 35 40 200-300 мл. Повторюють тричі. Додають етанол (180 мл) та 5 % розчин карбонату калію (34,6 мл), і перемішують протягом 0,5-1 год. при температурі 20-25 °C. Додають воду (667 мл), вносять кристали-затравки гідрату 4,4,4-трифтор-N-[(1S)-2-[[(7S)-5-(2-гідроксіетил)-6-оксо-7Hпіридо[2,3-d][3]бензазепін-7-іл]аміно]-1-метил-2-оксоетил]бутанаміду (0,4 г, 0,86 ммоль) (кристали-затравки можуть бути одержані з твердих речовин, одержаних з попередніх партій продукту, або можуть бути одержані із застосуванням інших загальновідомих і використовуваних фахівцями у цій галузі методів, таких як перекристалізація невеликої аліквоти), і перемішують протягом 2-3 год. при температурі 20-25 °C. Фільтрують, і відфільтрований осад двічі промивають сумішшю етанолу (63 мл) і води (42 мл). Одержані тверді речовини сушать в печі при зниженому тиску при температурі нижче 40 °C, та одержують вказану в заголовку сполуку (41,9 г, діастереомерний надлишок 99,6 %, енантіомерний надлишок 100 %, вихід 65,3 %) у вигляді твердої речовини від білого до не зовсім білого кольору. MS (m/z): 465(M-H2O+1). Порошковий рентгеноструктурний аналіз сполуки Прикладу 2 Порошкові рентгенограми кристалічних твердих речовин одержують за допомогою порошкового рентгенівського дифрактометра Bruker D4 Endeavor, оснащеного джерелом CuKa (λ=1,54060 Å) і детектором Vantec, що працює при 35 кВ і 50 мА. Зразок сканують у межах 4-40 2θ з величиною кроку, що становить 0,0087° 2θ, при швидкості сканування 0,5 с/крок, з 0,6 мм розходженням, фіксованим рівнем антирозсіювання 5,28 мм та 9,5 мм діафрагмами детектора. Сухим порошком наповнюють кварцовий тримач зразка; поверхню розгладжують із застосуванням предметного скла. З кристалографії добре відомо, що, для будь-якої конкретної кристалічної форми, відносна інтенсивність дифракційних піків може варіювати через переважну орієнтацію, що є наслідком певних факторів, таких як морфологія і габітус кристалу. У разі наявності впливу переважної орієнтації, інтенсивність піків змінюється, однак характеристичні позиції піків поліморфних модифікацій залишаються незмінними. (Наприклад, дивись: U.S. Pharmacopia 33-National Formulary 28 Chapter Characterization of Crystalline Solids by X-ray Powder Diffraction (XRPD) Official October 1, 2010-February 1, 2011). Окрім того, з кристалографії також добре відомо, що, для будь-якої конкретної кристалічної форми, кутові положення піків можуть дещо змінюватись. Наприклад, положення піків можуть зсуватись унаслідок зміни температури або вологості, при яких аналізується зразок, зміщення зразка або наявності чи відсутності внутрішнього стандарту. У даному разі, змінність положення піків ±0,2 2θ буде враховувати зазначені потенційні зміни без перешкоджання однозначній ідентифікації згаданої кристалічної форми. Кристалічна форма може бути підтверджена на основі будь-якої унікальної комбінації відмінних піків (у градусах 2θ), як правило, піків, що більше виступають. Порошкову рентгенограму кристалічної форми одержують при температурі (19-25C) і відносній вологості (20-60 %), які відповідають умовам навколишнього середовища. Таким чином, одержаний зразок сполуки Прикладу 2 характеризується порошковою рентгенограмою, одержаною з використанням джерела випромінення CuKα як такий, що має дифракційні піки (значення 2-тета), наведені нижче у Таблиці 1. Форма є кристалічною і має пік при 22,97 градуса в комбінації з одним або декількома піками, вибраними з групи, яку складають 11,96, 18,81, 20,78 і 21,07 градусів 2-тета, з допуском у 0,2 градуса на кути дифракції. Таблиця 1: Порошкові рентгенографічні піки сполуки Прикладу 2 Пік 1 2 3 4 5 6 7 8 9 10 11 12 13 Кут (° 2-тета) 7,573 9,177 11,96 13,063 14,036 14,352 15,223 16,845 17,12 17,828 18,481 18,809 19,396 15 Інтенсивність % 0,8 2,3 50,4 24,6 21,5 2,9 32,4 15,8 11,8 23,4 10,6 25,3 11,7 UA 110834 C2 Таблиця 1: Порошкові рентгенографічні піки сполуки Прикладу 2 Пік 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 5 10 15 Кут (° 2-тета) 20,102 20,778 21,068 22,713 22,967 23,407 23,625 24,11 24,772 25,028 25,311 25,868 26,586 27,979 28,27 29,033 29,54 29,9 30,556 30,766 31,703 32,186 33,015 33,822 34,007 34,451 34,728 35,381 35,601 36,052 36,272 36,866 37,73 38,232 38,608 39,139 Інтенсивність % 28 44,2 63,8 36,8 100 7,4 2,4 5,3 49 6,5 11,5 1,8 14,6 25,6 6,6 3,6 14,3 12,2 9,9 11,5 1,3 10,1 1,4 3,4 2 1,1 0,5 2,7 5,8 3,2 3,5 7,2 0,8 0,2 1,2 1,5 Твердотільний ЯМР сполуки Прикладу 2 13 Спектри ЯМР знімали методом C кросполяризації/обертання під магічним кутом (CP/MAS) (твердотільний ЯМР або SSNMR) ЯМР-спектрометра Avance II 400 МГц виробництва Bruker (позначення Lilly K299547), який працює при частоті коливання атомів вуглецю 100,622 МГц та оснащений 4 мм зонду з потрійним резонансом виробництва Bruker (K299551). Для повного пригнічення бічних смуг (TOSS) разом із кросполяризацією застосовують розв'язку SPINAL64 (70,8 Вт) і сформований за допомогою RAMP100 CP (імпульс частинки, помножений на швидкість світла) імпульс ядра H. Параметри збирання даних: ширина 90 радіочастотного імпульсу на протони – 2,5 мкс, час контактування – 3,5 мс, час повторення імпульсу – 5 с, частота обертання під магічним кутом – 10 кГц, спектральна ширина – 30 кГц, час збирання -1 даних – 34 мс і кількість сканів – 10587. Хімічні зсуви співвідносять з адамантаном (δ=29,5 млн ) 13 -1 у окремому експерименті. C ЯМР (твердотільний): δ (млн ) 18,65, 27,52, 28,76, 47,66, 49,96, 55,02, 58,88, 122,87, 126,49, 129,73, 131,37, 132,31, 137,28, 145,01, 149,17, 168,53, 170,30, 175,55. Титрування сполуки Прикладу 2 за Карлом Фішером Титрування за Карлом Фішером виконують із застосуванням кулонометра Brinkmann ® Methrohm 756 KF. Контрольний стандарт визначають із застосуванням Hydranol як стандарт 16 UA 110834 C2 5 10 15 20 25 30 35 40 45 50 55 60 води з подвоєнням. Зразок пропускають через прилад тричі, і реєструють середній відсоток води для визначення кількості води в зразку. Середній результат титрування сполуки Прикладу 2 за Карлом Фішером показує 3,9 % води. Теоретичний відсоток одномольного еквівалента води в сполуці Прикладу 2 становить 3,7 %. Рак все частіше визнають як гетерогенний набір захворювань, початок і розвиток яких індукується аберантним функціонуванням одного або декількох генів, які регулюють репарацію ДНК, стабільність геному, проліферацію клітин, некроз клітин, адгезію, ангіогенез, інвазію і метастазування в клітинному і тканинному мікросередовищі. Варіантна або аберантна функція "ракових" генів може бути результатом природного поліморфізму ДНК, змін кількості копій в геномі (шляхом ампліфікації, делеції, втрати хромосом або дуплікації), змін в генній та хромосомній структурі (шляхом хромосомної транслокації, інверсії або іншої перебудови, що призводить до розрегулювання експресії гена) і точкових мутацій. Ракові пухлини можуть бути викликані однією аберантною функцією гена і підтримуватись тією ж самою аберантною функцією гена, або їх підтримка та прогресування посилюється додатковими аберантними функціями генів. Крім генетичних хромосомних аберацій, згаданих вище, кожен із раків може також включати епігенетичні модифікації геному, у тому числі метилування ДНК, геномний імпринтинг і модифікації гістонів ацетилюванням, метилуванням або фосфорилуванням. Епігенетична модифікація може відігравати певну роль в індукуванні та/або підтримуванні злоякісної пухлини. Були складені, підтримуються і регулярно оновлюються в режимі он-лайн великі каталоги цитогенетичних аберацій раку людини (дивись The Mitelman Database of Chromosome Aberrations in Cancer at the US National Cancer Institute (NCI) Cancer Genome Anatomy Project (CGAP), веб-сторінка: http://cgap.nci.nih.gov). Ця база даних включає хромосомні аберації щонайменше деяких зі злоякісних пухлин, які розглядаються в цьому винаході. Проект The Wellcome Trust Sanger Institute Cancer Genome Project у режимі он-лайн підтримує докладний список "Cancer Gene Census" усіх генів людини, які були причинно пов'язані з онкогенезом (дивись http://www.sanger.ac.uk/genetics/CGP/Census), а також базу даних COSMIC (Catalogue of Somatic Mutations in Cancer) соматичних мутацій при ракових захворюваннях людини (дивись http://www.sanger.ac.uk/genetics/CGP/cosmic). Ще одним джерелом, що містить значний обсяг інформації стосовно цитогенетичних змін, причинно пов'язаних з різними видами раку, є Atlas of Genetics and Cytogenetics in Oncology and Haematology (http://atlasgeneticsoncology.org//Anomalies/ Anomliste.html#MDS). Ці бази даних також включають хромосомні аберації принаймні деяких зі злоякісних пухлин, які розглядаються в цьому винаході. Діагностика ракових злоякісних новоутворень за допомогою біопсії, імунофенотипування та інших тестів є відомою і широко використовується. На додаток до методів диференційного фарбування хромосом з високим розділенням і передових технологій візуалізації хромосом, хромосомні аберації в підозрюваних випадках раку можуть бути визначені за допомогою цитогенетичного аналізу, такого як гібридизація in situ із флуоресцентною міткою (FISH), каріотипування, спектральне каріотипування (SKY), мультиплексна FISH (M-FISH), порівняльна геномна гібридизація (CGH), сукупності однонуклеотидних поліморфізмів (чипи SNP), та інших діагностичних тестів та аналізів, відомих і використовуваних фахівцями в цій галузі. Онкогенна роль Notch вперше була зафіксована відносно Т-клітинного лейкозу, який спричинює транслокацію внутрішньоклітинного домену Notch1 в промоторну ділянку рецептора Т-клітин типу β, що призводить до надекспресії внутрішньоклітинного домену Notch1 (Grabher et al. Nature Review Cancer, 2006(6):347-359; Weng et al. Science, 2004(306):269-271). Надекспресія внутрішньоклітинного домену Notch1 в гемопоетичних клітинах-попередниках мишей викликала у мишей Т-клітинний гострий лімфобластний лейкоз, схожий на людський. Окрім Т-клітинного гострого лімфобластного лейкозу, з'являється все більше доказів того, що Notch сигнали є онкогенними у інших ракових захворюваннях через численні механізми, у тому числі ампліфікацію рецепторів і надекспресію лігандів та/або рецепторів, у тому числі у разі гострого лімфобластного лейкозу, гострого мієлоїдного лейкозу, хронічного мієлоїдного лейкозу і еритролейкозу. Аберантний конститутивний сигнальний шлях Notch унаслідок мутації або надекспресії лігандів та/або рецепторів також припустимий в певних випадках солідних злоякісних пухлин, у тому числі раку молочної залози, раку яєчників (Park et al. Cancer Research, 2006(66):6312-6318), меланоми (Gast et al. Genes, Chromosomes & Cancer, 2010(49):733-745), раку легенів, недрібноклітинного раку легенів (Westhoff et al. PNAS, 2009 (106):22293-22298), раку підшлункової залози, гліобластоми, колоректального раку, раку голови і шиї, раку шийки матки, раку передміхурової залози, раку печінки, плоскоклітинного раку (ротової порожнини), раку шкіри і медулобластоми (Ranganathan et al., Nature Review Cancer, 2011(11):338-351 and 17 UA 110834 C2 5 10 15 20 25 30 35 40 45 50 55 60 Supplementary information S1 (table)). Інгібування сигнального шляху Notch являє собою привабливу мету для забезпечення терапевтичної користі для пацієнтів, що страждають на рак, хвороба яких була індукована аберантною активацією конститутивного сигнального шляху Notch. Shih et al. Cancer Research, 2007(67)1879-1882. Наведені нижче in vitro та in vivo дослідження демонструють активність інгібування і ефективність Сполуки 1 проти різних конкретних ліній ракових клітин. Ці дослідження, як правило, визнаються фахівцями у цій галузі як такі, що свідчать про клінічну хіміотерапевтичну активність щодо людини. Як вважають, інгібування розщеплення внутрішньоклітинного домену Notch γ-секретазою є ефективним для кожного з рецепторів Notch1, Notch2, Notch3 і Notch4. Дослідження, що підтверджують активність і ефективність інгібування сигнального шляху Notch, можуть бути проведені по суті так, як описано нижче, або за допомогою аналогічних досліджень, що дають аналогічні дані. Візуалізаційне дослідження накопичення Notch1 N1ICD клітинним ядром Клітини HEK293ΔE12 (лінію клітин HEK293 одержують методами генної інженерії для стабільної експресії мишачої Notch1 кДНК, що кодує амінокислоту 1703-2183, NP_032740.3, з послідовністю сигнального пептиду з 23 амінокислот, MPRLLTPLLCLTLLPALAARGLR (SEQ ID NO: 1), на її N-кінці) висівають з розрахунку 5000 клітин/лунка в 96-лункові планшети, інкубують в модифікованому за способом Дульбекко середовищі Ігла з високим вмістом глюкози і 5 % фетальної бичачої сироватки при температурі 37 °C, 5 % СО2, протягом 24 год. Клітини обробляють досліджуваною сполукою, яку вводять при 10-кратному розведенні 1:3 в діапазоні від 1000 нМ до 0,05 нМ і з кінцевою концентрацією диметилсульфоксиду (DMSO), яка становить 0,2 %. Після 24 год. обробки досліджуваною сполукою планшети послідовно піддають таким стадіям обробки: впродовж 30 хв при кімнатній температурі (RT) фіксують клітини фіксатором ™ PREFER (100 мкл/лунка); впродовж 20 хв при кімнатній температурі за допомогою 0,1 % ® розчину TRITON X100 в забуференому фосфатом фізіологічному розчині (PBS) (100 мкл/лунка) підвищують коефіцієнт проникності клітин; кожен планшет тричі промивають PBS (100 мкл/лунка); додають 50 мкл/лунка кролячого анти-N1ICD (внутрішньоклітинний домен Notch1) антитіла в розведенні 1:2000 в PBS з 1 % бичачого сироваткового альбуміну, і інкубують впродовж 1,5 год. при температурі 37 °C; кожен планшет тричі промивають PBS (100 мкл/лунка); інкубують з 50 мкл/лунка козячого антикролячого IgG Alexa 488 в розведенні 1:1000 в PBS з 1 % бичачого сироваткового альбуміну, і інкубують впродовж 1 год. при температурі 37 °C; кожен планшет тричі промивають PBS (100 мкл/лунка), і впродовж 30 хв додають 15 мкМ розчин (100 мкл/лунка) йодиду пропідію з 50 мкг/мл РНКази для забарвлення ядер. Планшети сканують за допомогою мікропланшетного цитометра для лазерного сканування флуоресценції ACUMEN ™ EXPLORER (TTP LABTECH LTD) для визначення загальної кількості клітинних ядер на лунку і загальної площини ядер на лунку з флуоресценцією при 655-705 нм (емісія ДНК-зв'язаного йодиду пропідію) і з флуоресценцією зв'язування антитіл з N1ICD на ядерній ділянці при 505530 нм. Головним результатом дослідження є відношення загальної флуоресценції ядерної N1ICD до загальної ядерної площини, нормалізований сигнал ядерної N1ICD. Відносний профіль цитотоксичності виражають як відсоток (%) кількості клітин до контрольних клітин з 0,2 % DMSO. Антитіло, яке розпізнає розщеплений Notch1 або N1ICD, одержують проти людського пептиду, що відповідає амінокінцевому сайту розщеплення людського Notch1 на Val1744. У необроблених контрольних клітинах N1ICD, одержаний з Notch1, буде транслокуватись і накопичуватись в ядрі. Коли клітини обробляють сполукою, яка інгібує розщеплення Notch 1, сигнал ядерної N1ICD буде зменшуватися. Вплив концентрації та IC 50 визначають шляхом підгонки кривої до чотирипараметричного логістичного рівняння для сигналу ядерної N1ICD, тоді як відсоток кількості клітин наносять на ту саму криву для аналізу профілю цитотоксичності. В результаті дослідження, яке проводять по суті так, як описано вище, визначають середню IC50 для Сполуки 1, що дорівнює 0,41 нМ (n=7). Ця сполука не впливає на кількість клітин до концентрації 1000 нМ. Ці дані свідчать про те, що Сполука 1 має спорідненість до Notch 1 та інгібує внутрішньоклітинне накопичення внутрішньоклітинного домену Notch 1 сигнального пептиду. Інгібування розщеплення N1ICD в лініях пухлинних клітин людини Для оцінювання ефективності Сполуки 1 відносно здатності до інгібування розщеплення N1ICD, використовують декілька ліній пухлинних клітин людини. A2780 являє собою лінію клітин людського яєчника (Sigma-Aldrich, номер за каталогом: 93112519); MIA PaCa-2 являє собою лінію клітин людської підшлункової залози (ATCC (Американська колекція типових культур), номер за каталогом: CRL-1420); BxPC-3 являє собою лінію клітин людської підшлункової залози (ATCC, номер за каталогом: CRL-1687); SW480 являє собою лінію клітин людської прямої кишки (ATCC, номер за каталогом: CCL-228); HCT 116 являє собою лінію клітин людської прямої кишки 18 UA 110834 C2 5 10 15 20 25 30 35 40 45 50 55 60 (ATCC, номер за каталогом: CCL-247); DLD-1 являє собою лінію клітин людської прямої кишки (ATCC, номер за каталогом: CCL-221); MDA-MB-231 являє собою лінію клітин людської молочної залози (ATCC, номер за каталогом: HTB-26); U-87 MG являє собою лінію клітин людської гліобластоми (ATCC, номер за каталогом: HTB-14); A375 являє собою лінію клітин людської злоякісної меланоми (ATCC, номер за каталогом: CRL-1619); CCRF-CEM являє собою лінію клітин людського гострого лімфобластного лейкозу (ALL) (ATCC, номер за каталогом: CCL-119); SUP-T1 являє собою лінію клітин людського T-клітинного лімфобластного лейкозу (ATCC, номер за каталогом: CRL-1942); K-562 являє собою лінію клітин людського хронічного мієлоїдного лейкозу (CML), яка відрізняється присутністю гібридного транскрипту, який складається з генів Bcr та Abl1 (ATCC, номер за каталогом: CCL-243); Jurkat, клон E6-1 являє собою лінію клітин людського гострого T-клітинного лейкозу (ATCC, номер за каталогом: TIB152); MOLT-3 являє собою лінію клітин людського гострого лімфобластного лейкозу (ALL) (ATCC, номер за каталогом: CRL-1552); MOLT-4 являє собою лінію клітин людського гострого лімфобластного лейкозу (ALL) (ATCC, номер за каталогом: CRL-1582); HEL 92.1.7 являє собою лінію клітин людського еритролейкозу (ATCC, номер за каталогом: TIB-180). Кожну клітинну лінію одержують від Американської колекції типових культур (ATCC) за вказаним номером ATCC, за виключенням лінії клітин A2780, яку одержують від компанії Sigma-Aldrich за вказаним каталожним номером. Згадані клітини культивують у відповідному культуральному середовищі при температурі 37 °C у 5 % CO2 при атмосферній вологості. Культуральним середовищем для лінії клітин A2780 людського раку яєчника є RPMI-1640 (без фенолового червоного) з 2,05 мМ Lглутаміну, доповнене 2 мМ L-глутаміну, 0,01 мг/мл інсуліну і 10 % фетальної бичачої сироватки (FBS); культуральним середовищем для лінії клітин HCT 116 людського колоректального раку є середовище МакКоя 5A з 1,5 мМ L-глутаміну, 0,075 % бікарбонату натрію і 10 % FBS; культуральним середовищем для лінії клітин SW480 людського колоректального раку є середовище RPMI-1640 з 2,05 мМ L-глутаміну, 20 мМ ГЕПЕС-буфера і 10 % FBS; культуральним середовищем для лінії клітин U-87 MG людської гліобластоми є мінімальне підтримувальне середовище/збалансований сольовий розчин Ерла з 2 мМ L-глутаміну, 0,1 мМ замінних амінокислот (NEAA), 1 мМ пірувату натрію і 10 % FBS; культуральним середовищем для лінії клітин MIA PaCa-2 людського раку підшлункової залози є модифіковане за способом Дульбекко середовище Ігла (DMEM) без пірувату натрію, з високим вмістом глюкози (4500 мг/мл), 4 мМ L-глутаміну, 2,5 % конячої сироватки і 10 % FBS; культуральним середовищем для лінії клітин K-562 людського хронічного мієлоїдного лейкозу є DMEM з високим вмістом глюкози (4500 мг/мл), 4 мМ L-глутаміну, 10 мМ ГЕПЕС-буфера, 0,1 мМ NEAA, 1 мМ пірувату натрію і 10 % FBS; культуральним середовищем для лінії клітин Jurkat, клон E6-1, людського гострого Tклітинного лейкозу є RPMI-1640 з 2,05 мМ L-глутаміну, 2,5 г/л глюкози, 10 мМ ГЕПЕС-буфера, 1 мМ пірувату натрію, 0,075 % бікарбонату натрію і 10 % FBS; культуральним середовищем для лінії клітин A-375 людської злоякісної меланоми і лінії клітин MDA-MB-231 людської аденокарциноми молочної залози є DMEM з високим вмістом глюкози (4500 мг/мл), 4 мМ Lглутаміну і 10 % FBS; культуральним середовищем для лінії клітин BxPC-3 людської аденокарциноми підшлункової залози, лінії клітин DLD-1 людської колоректальної аденокарциноми, лінії клітин SUP-T1 людського лімфобластного лейкозу, лінії клітин MOLT-3 людського ALL, лінії клітин Molt-4 людського ALL, лінії клітин CCRF-CEM людського ALL і лінії клітин HEL 92.1.7 людського еритролейкозу є RPMI-1640 з 2,05 мМ L-глутаміну, 2,5 г/л глюкози, 20 мМ ГЕПЕС-буфера, 1 мМ пірувату натрію і 10 % FBS. При досягненні 80-90 % конфлюентності, клітини обробляють сполукою, яку вводять при 10-кратному розведенні 1:3 в діапазоні від 50 нМ нм до 0,0025 нМ і з кінцевою концентрацією диметилсульфоксиду (DMSO), яка становить 0,01 %. Після 24 год. обробки досліджуваною сполукою планшети послідовно піддають таким стадіям обробки: клітини збирають після трипсинізації, один раз промивають PBS, охолодженим до температури 0C, і піддають лізису в 100 мкл охолодженого до температури 0C лізисного буфера (25 мМ трис-буфера, pH 7,5, 10 мкг/мл інгібітора ® трипсину/хімотрипсину, 10 мкг/мл апротиніну, 60 мМ бета-гліцерофосфату, 1 % Triton X-100, 10 мМ NaF, 2,5 мМ пірофосфату, 150 мМ NaCl, 15 мМ етилендіамінтетраоцтової кислоти (EDTA), pH 8,0, 5 мМ етиленгліколь-біс(2-аміноетиловий простий ефір)-N, N,N,N-тетраоцтової кислоти (EGTA), pH 8,0, 1 мМ ванадату натрію, 10 мкг/мл лейпептиду, 1 мМ дитіотреїтолу, 1 мкМ мікроцистину-LR, 10 мкг/мл N-п-тозил-L-фенілаланінхлорметилкетону (TPCK), 2 мМ гідрохлориду Nα-п-тозил-L-аргінін метилового складного ефіру (TAME), 15 мМ ди(трис)-4нітрофенілфосфату (PNPP), 0,1 мМ гідрохлориду 4-(2-аміноетил)бензолсульфонілфториду (AEBSF), 5 мМ бензамідину, 1 мкМ окадаєвої кислоти), що містить 1 таблетку Complete (Roche ™ Complete , номер за каталогом: 11 697 498 001) і 1 коктейль інгібіторів протеаз (Sigma Aldrich, P8340). Лізат інкубують на льоду впродовж 15 хв з короткими періодами інтенсивного 19 UA 110834 C2 5 10 15 20 перемішування через кожні 5 хв і обробкою ультразвуком впродовж 1 хв на льоду. Зразки центрифугують при температурі 4C в еппендорфівській центрифузі при 30000 об/хв протягом 30 хв, і відбирають для аналізу 80 мкл супернатанту. Загальну концентрацію білка визначають ™ за допомогою набору Pierce BCA Protein Assay Kit (Thermo Scientific, Rockford, штат Іллінойс) із ™ застосуванням планшет-рідера Thermomax (компанія Molecular Devices, Sunnyvale, штат Каліфорнія). Рівні N1ICD визначають за допомогою розробленого на замовлення N1ICD ELISA (твердофазний імуноферментний аналіз). Досліджувану речовину іммобілізують за допомогою розробленого на замовлення кролячого моноклонального антитіла, специфічного для ® розщепленого Notch1 (Val1744), і виявляють за допомогою C-кінцевого Notch1 SULFO-TAG (Meso Scale Diagnostics, Gaithersburg, штат Меріленд) поліклонального овечого антитіла (R&D Systems, Minneapolis, штат Міннесота). Лізати розбавляють до 1 мкг/мкл охолодженим до температури 0C ELISA трис лізисним буфером R60TX (Meso Scale Diagnostics, Gaithersburg, ™ штат Меріленд), що містить 1 таблетку Complete (Roche Complete mini, номер за каталогом: 11 836 153 001) і 1 коктейль інгібіторів протеаз (Sigma Aldrich, P8340), і 25 мкл додають на планшет для проведення ELISA. Інкубування 25 мкг кожного білкового лізату здійснюють при кімнатній температурі протягом однієї години для іммобілізації досліджуваної речовини ™ ідентифікуючим антитілом. Планшети зчитують за допомогою Sector Imager 6000 (Meso Scale Discovery, Gaithersburg, штат Меріленд). Показники N1ICD з видаленими фоновими значеннями нормалізують за загальним вмістом білка і виражають як відсоток (%) інгібування відносно групи, яка одержувала носій. Значення IC50 визначають шляхом підгонки даних впливу концентрації до моделі 4-параметричної сигмоїдної кривої залежності "доза-ефект" (зі змінним ® нахилом) за допомогою пакету програм GraphPad Prism 4. Значення IC50 Сполуки 1 для різних ліній пухлинних клітин наведені у Таблиці 1. Таблиця 1 Лінії клітин A2780 MIA PaCa-2 BxPC-3 SW480 HCT 116 DLD-1 MDA-MB-231 U-87 MG A-375 CCRF-CEM SUP-T1 K-562 Jurkat MOLT-3 MOLT-4 HEL 92.1.7 IC50 (нМ) 1,03 0,71 0,39 0,10 0,72 0,98 0,50 0,28 0,48 0,76 1,24 0,74 5,95 0,61 0,74 0,23 25 30 35 40 Дані в Таблиці 1 свідчать про ефективність Сполуки 1 відносно її здатності до інгібування утворення сигнального пептиду N1ICD шляхом інгібування активності γ-секретази і, як наслідок, накопичення сигнального пептиду N1ICD в конкретних лініях пухлинних клітин людини. Дослідження in vivo ефективності і цільового інгібування Дослідження на тваринах Для оцінювання ефективності in vivo і фармакодинамічного впливу Сполуки 1 на інгібування сигнального шляху Notch, використовують декілька одержаних від пацієнтів клітинних ліній і 6 6 6 ксенотрансплантатних моделей. Клітини ліній A2780 (210 ), SW480 (610 ), HCT 116 (610 ), U6 6 87 MG (610 ) і A-375 (1010 ) у суміші з матрігелем (1:1) (об'ємом 0,2 мл) імплантують шляхом підшкірної ін'єкції у задню лапку "голих" мишей-самиць віком 6-8 тижнів (Harlan Laboratories). 6 Клітини лінії K-562 (610 ) у суміші з матрігелем (1:1) (об'ємом 0,2 мл) імплантують шляхом підшкірної ін'єкції у задню лапку "голих" мишей-самиць лінії CD1 віком 6-8 тижнів (Charles River 6 Laboratories). Клітини лінії HEL 92.1.7 (710 ) у суміші з матрігелем (1:1) (об'ємом 0,2 мл) імплантують шляхом підшкірної ін'єкції у задню лапку мишей-самиць із тяжким комбінованим імунодефіцитом лінії CB17 віком 6-8 тижнів (Taconic Farms). Одержані від пацієнтів пухлини 20 UA 110834 C2 5 10 15 20 25 30 35 40 45 50 55 60 подрібнюють на шматочки величиною 1-2 мм, змішують з матригелем (1:1) в об'ємі 0,2 мл, та імплантують шляхом підшкірної ін'єкції у задню лапку "голих" мишей-самиць віком 6-8 тижнів (Harlan Laboratories). Одержані від пацієнтів пухлинні моделі включають: гліобластому людини (EL 2144), потрійний негативний інвазивний рак протоку молочної залози людини (EL 1997) і рак товстої кишки людини (EL 1989, EL 1986 і EL 2056). Зразки одержують зі згоди пацієнта і схвалення лікарні (IU Health, Methodist Hospital, Indianapolis, штат Індіана, США 46206). Загалом до складу кожної групи входить від 7 до 10 мишей. Безпосередньо перед імплантацією A2780, SW480, HEL 92.1.7, А-375, К-562 і одержаних від пацієнтів пухлинних моделей, тварин опромінюють (загальне опромінення організму в дозі 450 рентген). Миші одержують нормальний раціон ad libitum. Лікування починають з перорального введення (через шлунковий зонд) сполуки або носія (1 % розчин Na-CMC (карбоксиметилцелюлоза) в 0,25 % Tween-80) в об'ємі 3 0,2 мл, коли розмір пухлини досягає 150±50 мм . У зазначені моменти часу після лікування тварин умертвляють шляхом удушення у камері з CO 2 і зміщення хребців. Пухлини видаляють, і використовують їх для дослідження фармакодинамічної реакції. Ріст пухлин і масу тіла постійно контролюють з плином часу, щоб оцінити ефективність і ознаки токсичності. Двовимірні визначення величини пухлин здійснюють двічі на тиждень, і об'єм пухлин розраховують за формулою: (об'єм пухлини)=[(L)(W2)(П/6)], де L – середня довжина, а W – середня ширина. Дані щодо об'єму пухлин перетворюють на логарифмічну шкалу, щоб зрівняти розбіжності в часі і між експериментальними групами. Об'єм пухлин у логарифмічному масштабі аналізують за допомогою двофакторного дисперсійного аналізу з повторними вимірюваннями за часом і ™ ™ лікуванням з використанням алгоритмів MIXED програмного забезпечення SAS (версія 8.2). Кореляційна модель для повторних вимірювань є просторовим показником. Групи, які піддають ™ лікуванню, порівнюють з контрольною групою в кожний момент часу. Алгоритм MIXED також використовують окремо для кожної групи, яку піддають лікуванню, для обчислення скоригованих середніх значень та середніх квадратичних помилок в кожний момент часу. Результати обох аналізів забезпечують автокореляцію для кожної тварини і компенсують втрати даних у разі, коли тварин з великими пухлинами видаляють з дослідження на ранній стадії. Скориговані середні значення та середні квадратичні помилки наносять на криву для кожної групи, яку піддають лікуванню, залежно від часу. Протипухлинну активність виражають у вигляді відсотка інгібування росту пухлини (TGI %), і обчислюють шляхом порівняння об'єму пухлин в групі, яку піддають лікуванню, з групою, яка одержує носій. Відсоток інгібування росту пухлини (% TGI) і показник статистичної значущості (величина р) для Сполуки 1, які визначають по суті так, як описано вище, в узагальненому вигляді наведені в Таблиці 2. Дослідження N1ICD Для оцінювання рівнів N1ICD в пухлинах від замороженої пухлини відрізають шматок масою приблизно 75 мг, і подрібнюють його перед гомогенізацією (фактичну масу записують). ™ Заморожені зразки пухлин переносять у пробірки Lysing Matrix-D , і ресуспендують в охолодженому до температури 0C лізисному буфері XY (25 мМ трис-буфера, pH 7,5, 10 мкг/мл ® інгібітора трипсину/хімотрипсину, 10 мкг/мл апротиніну, 60 мМ бета-гліцерофосфату, 1 % Triton X-100, 10 мМ NaF, 2,5 мМ пірофосфату, 150 мМ NaCl, 15 мМ етилендіамінтетраоцтової кислоти (EDTA), pH 8,0, 5 мМ етиленгліколь-біс(2- аміноетиловий простий ефір)-N, N,N,N-тетраоцтової кислоти (EGTA), pH 8,0, 1 мМ ванадату натрію, 10 мкг/мл лейпептиду, 1 мМ дитіотреїтолу, 1 мкМ мікроцистіну-LR, 10 мкг/мл N-п-тозил-L-фенілаланінхлорметилкетону (TPCK), 2 мМ гідрохлориду Nα-п-тозил-L-аргінін метилового складного ефіру (TAME), 15 мМ ди(трис)-4нітрофенілфосфату (PNPP), 0,1 мМ гідрохлориду 4-(2-аміноетил)бензолсульфонілфториду (AEBSF), 5 мМ бензамідину, 1 мкМ окадаєвої кислоти), що містить 1 таблетку Complete (Roche ™ Complete , номер за каталогом: 11 697 498 001) і 1 коктейль інгібіторів протеаз (Sigma Aldrich, P8340) у співвідношенні маса:об'єм 75 мг/мл буфера. Тканини гомогенізують у гомогенізаторі Fast Prep FP120 (Thermo Scientific, Rockford, штат Іллінойс) зі швидкістю 6,0 протягом 30 с при температурі +4 °C, з подальшим 15 хв інкубуванням на льоду. Це повторюють в цілому 2-3 цикли до завершення гомогенізації. Лізати центрифугують в еппендорфівській центрифузі при температурі 4 °C і 30000 об/хв протягом 15 хв для видалення дебрису. Відбирають 400 мкл супернатанту, переносять у нову еппендорфівську пробірку, і піддають циклу заморожування/відтавання. Зразки повторно центрифугують в еппендорфівській центрифузі при температурі 4 °C і 30000 об/хв протягом 30 хв, після чого відбирають 120 мкл супернатанту для проведення аналізу. Загальну концентрацію білка визначають за допомогою набору Pierce BCA ™ Protein Assay Kit (Thermo Scientific, Rockford, штат Іллінойс) із застосуванням планшет-рідера ™ Thermomax (Molecular Devices, Sunnyvale, штат Каліфорнія). Рівні N1ICD визначають за допомогою розробленого на замовлення N1ICD ELISA (твердофазний імуноферментний аналіз). Досліджувану речовину іммобілізують за допомогою розробленого на замовлення 21 UA 110834 C2 5 10 15 кролячого моноклонального антитіла, специфічного для розщепленого Notch1 (Val1744), і ® виявляють за допомогою C-кінцевого Notch1 SULFO-TAG (Meso Scale (Discovery, Gaithersburg, штат Меріленд) поліклонального овечого антитіла (R&D Systems, Minneapolis, штат Міннесота). Лізати розбавляють до 2 мкг/мкл охолодженим до температури 0C ELISA трис лізисним буфером (R6OTX) (Meso Scale (Discovery, Gaithersburg, штат Меріленд), що містить 1 таблетку ™ Complete (Roche Complete mini, номер за каталогом: 11 836 153 001) і 1 коктейль інгібіторів протеаз (Sigma Aldrich, P8340), і 25 мкл додають на планшет для проведення ELISA. Інкубування 50 мкг кожного білкового лізату виконують при кімнатній температурі впродовж однієї години для іммобілізації досліджуваної речовини з ідентифікуючим антитілом. Планшети ™ зчитують за допомогою Sector Imager 6000 (Meso Scale (Discovery, Gaithersburg, штат Меріленд). Показники N1ICD з видаленими фоновими значеннями нормалізують за загальним вмістом білка, і виражають як відсоток (%) інгібування відносно групи, яка одержувала носій. Відсоток інгібування N1ICD та показник статистичної значущості (величина р), визначені за методом Даннета у пухлинах, зібраних через 4 год. після останньої дози Сполуки 1, аналізують по суті так, як описано вище, узагальнені результати аналізів наведені в Таблиці 2. Таблиця 2 Пухлинна модель A2780 A2780 Доза (мг/кг) 10 10 Схема A2780 3 A2780 A2780 A2780 A2780 3 10 8 7 Q2D (через 2 дні)11 Q3D (через 3 дні)8 (BID)(двічі на день) QD(кожного дня)7+(BID)Q2D(через 2 дні)7 QD21 Q2D13 Q2D13 Q2D13 A2780 6 Q2D13 A2780 3 Q2D13 A2780 1,5 QD26 SW480 8 (Понеділок, середа, п'ятниця)5 HCT 116 8 (Понеділок, середа, п'ятниця)4 U-87 MG 8 (Понеділок, середа, п'ятниця)4 A-375 8 (Понеділок, середа, п'ятниця)4 K-562 8 (Понеділок, середа, п'ятниця)4 HEL 92.1.7 8 Q2D14 10 8 10 8 10 8 8 (Q2D7), 11-добова перерва, (Понеділок, середа, п'ятниця)4 (Q2Dx7), 11-добова перерва, (Понеділок, середа, п'ятниця)3 Q2D8 (Понеділок, середа, п'ятниця)5 (Понеділок, середа, п'ятниця)5 EL1997 EL1989 EL2144 EL2056 EL1986 20 Відсоток TGI (величина p) 56,55 (
ДивитисяДодаткова інформація
Назва патенту англійськоюNotch pathway signaling inhibitor compound
Автори англійськоюHipskind, Philip, Arthur, Stephenson, Gregory, Alan
Автори російськоюХипскинд Филип Артур, Стефенсон Грэгори Алан
МПК / Мітки
МПК: A61P 35/02, A61K 38/05, C07D 401/04, C07K 5/06, A61P 35/00
Мітки: notch, сигнального, сполука-інгібітор, шляху
Код посилання
<a href="https://ua.patents.su/28-110834-spoluka-ingibitor-signalnogo-shlyakhu-notch.html" target="_blank" rel="follow" title="База патентів України">Сполука-інгібітор сигнального шляху notch</a>
Попередній патент: Спосіб і пристрій для мінімізації розподілу повітря та суспензії при протіканні гіпсової суспензії
Наступний патент: Спосіб каскадного перетворення механічної енергії в електричну
Випадковий патент: Спосіб обробки зварних виробів із конструкційних сталей












