Похідні бензилу та піридинілу як модулятори сигнального шляху hedgehog
Номер патенту: 100684
Опубліковано: 25.01.2013
Автори: Маківан Майкл А., Пейкерт Стефан, Каркі Раджеш, Хі Фенг, Юсуфф Наіїм, Келлехер Джозеф, ІІІ, Лей Джон, Даі Міао, Джаін Ріші Кумар, Перез Лоренс Блес, Лламас Луїс, Міллер-Мослін Керен
Формула / Реферат
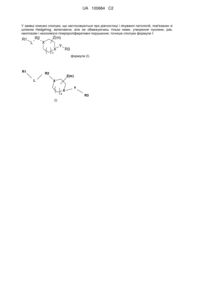
1. Сполука формули І
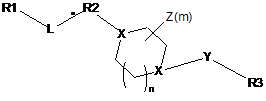 (I)
(I)
або її фармацевтично прийнятні солі,
у якій
R1 являє собою необов'язково заміщений феніл;
R2 являє собою гетероцикл, у якому щонайменше один гетероатом являє собою N і який є необов'язково заміщеним;
L являє собою нижчий алкіл, (СН2)1-2-А, А-(СН2)1-2 або СН2-А-СН2 і А являє собою О, S, NH або N-алкіл, де нижчий алкіл є необов'язково заміщеним нижчим алкілом або одним або більшою кількістю атомів фтору;
X являє собою N або СН і щонайменше один X являє собою N;
Y являє собою зв'язок, СН2, С(О) або SO2;
R3 являє собою арил або гетероцикл, що є заміщеним;
Z являє собою Н, нижчий алкіл, нижчу алкоксигрупу, оксогрупу, C(O)OR6 або -CN;
де нижчий алкіл і нижча алкоксигрупа є необов'язково заміщеними одним або більшою кількістю атомів галогенів, -ОН, -CN, -NH2 або оксогрупою і два Z, зв'язані з одним атомом, можуть утворювати циклоалкільне кільце і m приймає значення від 0 до 3;
замісниками фенілу, арилу або гетероциклу в R1, R2 або R3 можуть бути один або більша кількість із наступних замісників: алкіл, циклоалкіл, алкоксигрупа, циклоалкоксигрупа, галоген, -CN, оксогрупа, арил, карбалкоксигрупа, OCF3, CF3, ОН, -C(O)N(R6)2, C(O)R6, -C(O)OR6, -N(R6)2, -NHC(O)R6, -SO2(R6), - SO2N(R6)2, CH2OC(O)N(R6)2, -CH2N(R6)2, -NHC(O)OR6, NHC(O)N(R6)2, -СН2NНС(О)R6, CH2NHC(O)N(R6)2, CH2NHSO2(R6), CH2NHC(O)OR6-OC(O)R6, NHC(O)R6, О-арил, гетероцикл або О-гетероцикл, у яких алкіл, гетероцикл, циклоалкіл, циклоалкоксигрупа, N(R6)2, арил, карбалкоксигрупа і алкоксигрупа є необов'язково заміщеними одним або більшою кількістю з наступних замісників: галоген, -ОСН3, -OCF3, -OH, -NH2, алкіл, OR6, оксогрупа, -N(H)0-2-R6, -CN, -C(O)N(R6)2, С(О)R6, C(O)OR6, -N(R6)2, NHC(O)R6, -SO2(R6), -SO2N(R6)2, OSO2R6, -СН2N(R6)2, -CH2NHC(O)R6, -OС(O)R6, арил, NHC(O)(R6), О-арил, гетероцикл, О-гетероцикл або циклоалкіл; R6 являє собою Н, алкіл, алкеніл, арил, гетероцикл, або два R6, зв’язані з одним атомом можуть утворити циклоалкіл, арил або гетероцикл; і алкіл, алкеніл, арил, гетероцикл, циклоалкіл або гетероцикл є необов'язково заміщеними за допомогою ОН, оксогрупи, алкоксигрупи, NR6, N-алкілу, ацилу, арилу або групи гетероцикл; гетероцикл являє собою 5-7-членне моноциклічне гетероциклічне кільце, що може бути ароматичним або неароматичним, містити 1-4 кільцевих гетероатоми, вибраних із групи, що включає N, О і S; або 8-12-членну конденсовану кільцеву систему, що включає щонайменше одне 5-7-членне гетероциклічне кільце, що може бути ароматичним або неароматичним, містити 1, 2 або 3 кільцевих гетероатоми, вибраних з групи, що включає N, О і S, і цей гетероцикл є необов'язково заміщеним; арил являє собою ароматичний радикал, що містить від 6 до 14 кільцевих атомів вуглецю і не містить кільцевих гетероатомів, де зазначена арильна група може бути моноциклічною або конденсованою біциклічною або трициклічною, яка може бути незаміщеною або містити один або більшу кількість замісників; і n приймає значення 0, 1, 2 або 3.
2. Сполука за п. 1, у якій:
R2 вибраний з групи, що включає:
 ,
, 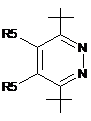 ,
,  i
i 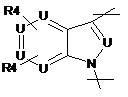 ,
,
де N зв'язаний з L,
де U являє собою С(Н)0-1 або N і не більше двох U являють собою N;
R4 незалежно являє собою Н, -N(R6)2, -ОН, галоген, -CN, -C(O)OR6, -C(O)N(R6)2, нижчий алкіл або нижчу алкоксигрупу, де нижчий алкіл і нижча алкоксигрупа є необов'язково заміщеними одним або більшою кількістю атомів галогенів, -ОН, -CN, -NH2, -NO2, -C(O)NH2, -С(О)NH(С1-С6-алкіл), -C(O)N(C1-C6-алкіл)2, -С(О)(С1-С6-алкіл), -NНС(О)(С1-С6-алкіл), NН(С1-С6-алкіл), -N(С1-С6-алкіл)2, -SO2(C1-C6-алкіл), -SO2NH2, -SO2NH(C1-C6-алкіл);
R5 являє собою Н, арил, гетероцикл, нижчий алкіл, нижчу алкоксигрупу або циклоалкіл, які є необов'язково заміщеними одним або більшою кількістю з наступних замісників: галоген, циклоалкіл, арил, гетероцикл, і де щонайменше один R5 не являє собою Н; і L являє собою нижчий алкіл.
3. Сполука за п. 1, у якій R2 вибраний з групи, що включає:
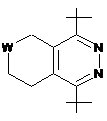 ,
,  ,
, 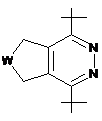 ,
, 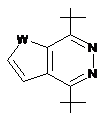 i
i  ,
,
де W являє собою О, NR7 або SO2
і R7 являє собою Н, зв'язок, нижчий алкіл або нижчий ацил.
4. Сполука за п. 1, у якій R2 являє собою:

і R3 являє собою гетероцикл.
5. Сполука за п. 2, у якій:
R3 являє собою арил або гетероцикл; і, якщо R3 являє собою гетероцикл, то щонайменше одним кільцевим гетероатомом є N;
U являє собою С(Н)0-1;
R4 являє собою Н, СН3, галоген або -CN;
L являє собою СН2;
X являє собою N;
Y являє собою зв'язок; і
Z являє собою Н або СН3.
6. Сполука за п. 5, у якій:
R2 позначає
 ;
;
R4 являє собою Н і U являє собою С(Н)0-1,
R3 являє собою феніл, піридин, піразин, піридазин або піримідин,
Z являє собою Н або СН3 і
n дорівнює 1.
7. Сполука за п. 5, у якій:
R2 вибраний із групи, що включає:
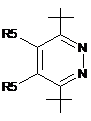 ,
,  ,
,  i
i 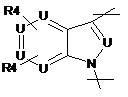 ,
,
де N зв'язаний з L;
та щонайменше один R5 являє собою СН3.
8. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1.
9. Спосіб лікування ссавця, що страждає від патології, в яку залучений сигнальний шлях Hedgehog, що включає введення ссавцеві, який потребує лікування, терапевтично ефективної кількості сполуки за п. 1.
10. Сполука, вибрана з групи, що включає:
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-нікотинонітрил;
1-бензил-4-[4-(5-трифторметилпіридин-2-іл)-піперазин-1-іл]-фталазин;
1-бензил-4-[4-(5-трифторметилпіридин-2-іл)-[1,4]-діазепан-1-іл]-фталазин;
6-[4-(4-піридин-4-ілметилфталазин-1-іл)-піперазин-1-іл]-нікотинонітрил;
етиловий ефір 4-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-бензойної кислоти;
1-(4-фенілпіперазин-1-іл)-4-піридин-4-ілметилфталазин;
1-бензил-4-[4-(4-трет-бутилфеніл)-піперазин-1-іл]-фталазин;
1-[4-(4-трет-бутилфеніл)-піперазин-1-іл]-4-піридин-4-ілметилфталазин;
1-[4-(4-трет-бутилфеніл)-піперазин-1-іл]-4-(3,5-дихлорбензил)-фталазин;
4-[4-(4-трет-бутилфеніл)-піперазин-1-іл]-6-метил-1-піридин-4-ілметилфталазин;
1-(2-метилпіридин-4-ілметил)-4-(4-фенілпіперазин-1-іл)-фталазин;
1-бензил-4-(4-фенілпіперидин-1-іл)-фталазин;
1-(4-фенілпіперидин-1-іл)-4-піридин-4-ілметилфталазин;
1-(2-метилпіридин-4-ілметил)-4-(4-фенілпіперидин-1-іл)-фталазин;
1-піридин-4-ілметил-4-[4-(3-трифторметилфеніл)-піперазин-1-іл]-фталазин;
4-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-бензойна кислота;
1-бензил-4-[4-(3-хлор-5-трифторметилпіридин-2-іл)-[1,4]-діазепан-1-іл]-фталазин;
1-бензил-4-(4-хінолин-2-ілпіперазин-1-іл)-фталазин;
6-[4-(4-бензилфталазин-1-іл)-[1,4]-діазепан-1-іл]-нікотинонітрил;
4-(4-піридин-4-ілметилфталазин-1-іл)-3,4,5,6-тетрагідро-2Н-[1,2']-біпіразиніл;
4-(4-бензилфталазин-1-іл)-3,4,5,6-тетрагідро-2Н-[1,2']-біпіразиніл;
1-(2-метилпіридин-4-ілметил)-4-(4-піридин-2-ілпіперазин-1-іл)-фталазин;
1-піридин-4-ілметил-4-(4-піридин-2-ілпіперазин-1-іл)-фталазин;
1-бензил-4-(4-піридин-2-ілпіперазин-1-іл)-фталазин;
1-бензил-4-(4-піримідин-2-ілпіперазин-1-іл)-фталазин;
1-піридин-4-ілметил-4-(4-піридин-4-ілпіперазин-1-іл)-фталазин;
1-бензил-4-(3-метил-4-п-толілпіперазин-1-іл)-фталазин;
1-(3-метил-4-п-толілпіперазин-1-іл)-4-піридин-4-ілметилфталазин;
1-(2-метилпіридин-4-ілметил)-4-(3-метил-4-п-толілпіперазин-1-іл)-фталазин;
1-бензил-4-[4-(3,4-дихлорфеніл)-піперазин-1-іл]-фталазин;
1-бензил-4-(4-нафталін-2-ілпіперазин-1-іл)-фталазин;
1-(4-нафталін-2-ілпіперазин-1-іл)-4-піридин-4-ілметилфталазин;
1-(2-метилпіридин-4-ілметил)-4-(4-нафталін-2-ілпіперазин-1-іл)-фталазин;
1-бензил-4-(4-нафталін-1-ілпіперазин-1-іл)-фталазин;
1-(2-метилпіридин-4-ілметил)-4-(4-нафталін-1-ілпіперазин-1-іл)-фталазин;
1-(4-нафталін-1-ілпіперазин-1-іл)-4-піридин-4-ілметилфталазин;
1-бензил-4-(4-піридин-4-ілпіперазин-1-іл)-фталазин;
1-бензил-4-(4-о-толілпіперазин-1-іл)-фталазин;
2-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піримідин-5-карбонітрил;
1-бензил-4-(4-піримідин-2-іл-[1,4]-діазепан-1-іл)-фталазин;
1-бензил-4-[4-(4-метилпіримідин-2-іл)-[1,4]-діазепан-1-іл]-фталазин;
1-бензил-4-[4-(5-пропілпіримідин-2-іл)-піперазин-1-іл]-фталазин;
1-бензил-4-[4-(5-етилпіримідин-2-іл)-піперазин-1-іл]-фталазин;
1-бензил-4-[4-(5-пропілпіримідин-2-іл)-[1,4]-діазепан-1-іл]-фталазин;
1-бензил-4-[4-(5-етилпіримідин-2-іл)-[1,4]-діазепан-1-іл]-фталазин;
2-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-6-метокси-3Н-піримідин-4-он;
1-бензил-4-[4-(4-метилпіримідин-2-іл)-піперазин-1-іл]-фталазин;
1-бензил-4-[4-(4,6-диметилпіримідин-2-іл)-піперазин-1-іл]-фталазин;
1-бензил-4-[4-(5-хлор-3-фторпіридин-2-іл)-піперазин-1-іл]-фталазин;
1-бензил-4-[4-(4-трифторметилпіримідин-2-іл)-піперазин-1-іл]-фталазин;
1-бензил-4-[4-(2,5-дифторпіридин-3-іл)-піперазин-1-іл]-фталазин;
1-бензил-4-[4-(3,5-дифторпіридин-2-іл)-піперазин-1-іл]-фталазин;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-нікотинамід;
етиловий ефір 6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-нікотинової кислоти;
2-{6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-іл}-пропан-2-ол;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-нікотинова кислота;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-N-(2-гідроксіетил)-N-метилнікотинамід;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-N-етил-N-(2-гідроксіетил)-нікотинамід;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-N-(2-гідроксіетил)-нікотинамід;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-N-(2-метоксіетил)-нікотинамід;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-N-(2-метоксіетил)-N-метилнікотинамід;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-N-(2-диметиламіноетил)-нікотинамід;
{6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-іл}-(4-метилпіперазин-1-іл)-метанон;
{6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-іл}-піперазин-1-ілметанон;
{6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-іл}-морфолін-4-ілметанон;
N-бензил-6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-нікотинамід;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-N-циклогексилметилнікотинамід;
6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-N-пропілнікотинамід;
{6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-іл}-(3-гідроксипіролідин-1-іл)-метанон;
{6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-іл}-тіазолідин-3-ілметанон;
{6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-іл}-(1-оксо-1-лямбда*4*-тіазолідин-3-іл)-метанон;
метиловий ефір ({6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-карбоніл}-аміно)-оцтової кислоти;
1-бензил-4-[4-(4-трифторметилфеніл)-піперазин-1-іл]-фталазин;
6-{4-[4-(3-трифторметилбензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(4-ціанобензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(3,4-диметоксибензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(4-хлорбензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(3-хлорбензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-[4-(4-фенетилфталазин-1-іл)-піперазин-1-іл]-нікотинонітрил;
6-[4-(4-нафталін-2-ілметилфталазин-1-іл)-піперазин-1-іл]-нікотинонітрил;
6-{4-[4-(4-трифторметилбензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(4-метоксибензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(3-ціанобензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(4-бромбензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(3-бромбензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(1-фенілетил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(4-метилбензил)-фталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
N-{6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-ілметил}-ацетамід;
С-{6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-іл}-метиламін;
4-[4-(4-піридин-4-ілметилфталазин-1-іл)-піперазин-1-іл]-бензиламін;
4-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-бензиламін;
4-[5-({6-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-піридин-3-ілметил}-карбамоїл)-пентил]-8-етил-3,8,9,10-тетрагідро-2Н-1,6,11-триокса-8,13-діаза-4-азоніапентацен;
N-{4-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-бензил}-ацетамід;
N-{4-[4-(4-піридин-4-ілметилфталазин-1-іл)-піперазин-1-іл]-бензил}-ацетамід;
бензиловий ефір {4-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-бензил}-карбамінової кислоти;
бензиловий ефір {4-[4-(4-піридин-4-ілметилфталазин-1-іл)-піперазин-1-іл]-бензил}-карбамінової кислоти;
N-{4-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-бензил}-пропіонамід;
N-{4-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-бензил}-2-метоксіацетамід;
N-{4-[4-(4-бензилфталазин-1-іл)-піперазин-1-іл]-бензил}-3-метилбутирамід;
6-[4-(1-бензилізохінолін-4-іл)-піперазин-1-іл]-нікотинонітрил;
6-{4-[1-(3-ціанобензил)-ізохінолін-4-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[1-(3-хлорбензил)-ізохінолін-4-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[1-(3-трифторметилбензил)-ізохінолін-4-іл]-піперазин-1-іл}-нікотинонітрил;
6-[4-(4-бензилізохінолін-1-іл)-піперазин-1-іл]-нікотинонітрил;
4-{4-[6-(4-фторбензил)-4-метилпіридазин-3-іл]-піперазин-1-іл}-бензонітрил;
4-{4-[6-(4-фторбензил)-5-метилпіридазин-3-іл]-піперазин-1-іл}-бензонітрил;
4-{4-[6-(4-бензил)-4-метилпіридазин-3-іл]-піперазин-1-іл}-нікотинонітрил;
4-{4-[6-(4-бензил)-5-метилпіридазин-3-іл]-піперазин-1-іл}-нікотинонітрил;
6-бензил-4-метил-3-[4-(5-трифторметилпіридин-2-іл)-піперазин-1-іл]-піридазин;
6-бензил-5-метил-3-[4-(5-трифторметилпіридин-2-іл)-піперазин-1-іл]-піридазин;
6-(4-фторбензил)-4-метил-3-[4-(5-трифторметилпіридин-2-іл)-піперазин-1-іл]-піридазин;
6-(4-фторбензил)-5-метил-3-[4-(5-трифторметилпіридин-2-іл)-піперазин-1-іл]-піридазин;
4-{4-[6-(4-хлорбензил)-4-метилпіридазин-3-іл]-піперазин-1-іл}-нікотинонітрил;
4-{4-[6-(4-хлорбензил)-5-метилпіридазин-3-іл]-піперазин-1-іл}-нікотинонітрил;
4-{4-[6-(4-фторбензил)-4,5-диметилпіридазин-3-іл]-піперазин-1-іл}-нікотинонітрил;
4-{4-[4-(4-фторбензил)-5,6,7,8-тетрагідрофталазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
6-{4-[4-(4-фторбензил)-6,7-дигідро-5Н-циклопента[d]піридазин-1-іл]-піперазин-1-іл}-нікотинонітрил;
3-{4-[1-(4-фторбензил)-1Н-індол-3-іл]-піперидин-1-карбоніл}-бензонітрил;
4-[1-(4-фторбензил)-1Н-індол-3-іл]-5'-трифторметил-3,4,5,6-тетрагідро-2Н-[1,2]-біпіридиніл;
4-[3-(5'-трифторметил-3,4,5,6-тетрагідро-2Н-[1,2']-біпіридиніл-4-іл)-індол-1-ілметил]-бензонітрил;
4-[1-бензил-1H-індол-3-іл)-5'-трифторметил-3,4,5,6-тетрагідро-2Н-[1,2]-біпіридиніл;
4-[1-(4-фторбензил)-1Н-індол-3-іл]-3,4,5,6-тетрагідро-2Н-[1,2']-біпіридиніл-5'-карбонітрил;
4-[1-(4-бромбензил)-1Н-індол-3-іл]-5'-трифторметил-3,4,5,6-тетрагідро-2Н-[1,2]-біпіридиніл;
4-(1-бензил-1Н-індол-3-іл)-3,4,5,6-тетрагідро-2Н-[1,2']-біпіридиніл-5'-карбонітрил;
{4-[1-(4-фторбензил)-1Н-індол-3-іл]-піперидин-1-іл}-(3-фторфеніл)-метанон;
4-{4-[1-(4-фторбензил)-1Н-індол-3-іл]-піперидин-1-карбоніл}-бензонітрил;
3-{4-[1-(4-фторбензил)-1Н-індол-3-іл]-піперидин-1-карбоніл}-бензонітрил;
{4-[1-(4-фторбензил)-1Н-індол-3-іл]-піперидин-1-іл}-(4-трифторметилфеніл)-метанон і
{4-[1-бензил-1Н-індол-3-іл]-піперидин-1-іл}-(4-трифторметилфеніл)-метанон.
Текст
Реферат: UA 100684 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 100684 C2 У заявці описані сполуки, що застосовуються при діагностиці і лікуванні патологій, пов'язаних зі шляхом Hedgehog, включаючи, але не обмежуючись тільки ними, утворення пухлини, рак, неоплазію і незлоякісні гіперпроліферативні порушення; точніше сполуки формули І: R1 Z(m) R2 X L X Y R3 n R1 формула (I). R2 L Z(m) X X n (I) Y R3 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рівень техніки Передача сигналу білком Hedgehog (Hh) уперше виявлена у дрозофіл, як важливий механізм регуляції формування структури ембріона або процес, за допомогою якого клітини ембріону утворюють упорядковані просторові угруповання диференційованих тканин (NussleinVolhard et al. (1980) Nature 287, 795-801). У клітинах ссавців ідентифіковані три гени Hedgehog, Sonic Hedgehog (Shh), Indian Hedgehog (Ihh) і Desert Hedgehog (Dhh). Гени Hedgehog кодують секретовані білки, які піддаються посттрансляційним модифікаціям, включаючи аутокаталітичне розщеплення, і модифікацію ліпідів (пальмітоілювання) на N-кінці і модифікацію холестерину на C-кінці. Модифікований ліпідом N-кінцевий білок Hedgehog викликає сигнальну активність на шляху білка і комунікація між клітинами виникає внаслідок відправлення розчинного білка Hedgehog від клітини, що сигналізує, і його прийому клітиною, що відповідає. У клітинах, що відповідають, рецептор Patched (Ptch), що містить 12 трансмембранних спіралей, діє як негативний регулятор передачі сигналу Hh і білок Smoothened (Smo), що містить 7 трансмембранних спіралей, як позитивний регулятор передачі сигналу Hh. У стані спокою вільний Ptch (тобто не пов'язаний з Hh) стехіометрично придушує активність шляху, що індуціюється Smo (Taipale et al. (2002) Nature 418: 892); однак на єднальному ліганд білкові Hh репресія Smo послабляється і результуючий каскад сигналів приведе до активації і ядерної транслокації факторів транскрипції Gli (Gli1, Gli2 і Gli3). Розташовані в прямому напрямку гени-мішені транскрипції передачі сигналу білком Hh включають Wnts, TGF і Ptc і Gli1, які є елементами регуляторної петлі позитивного і негативного зворотного зв'язку. Генами-мішенями передачі сигналу за допомогою Hh також є кілька генів клітинного циклу і генів, що регулюють проліферацію, такі як c-myc, циклін D і E. Відомо, що передача сигналу білком Hh регулює всілякі біологічні процеси, такі як проліферацію і диференціацію клітин і утворення органу тканиноспецифічним і залежним від дози чином. При розвитку нервових трубок Shh експресується у вентральній пластинці нервової трубки і направляє диференціацію специфічних підтипів нейронів, включаючи моторні і допамінергічні нейрони. Також відомо, що Hh регулює проліферацію клітин-попередників нейронів, таких як невроцити-зерна мозочка і нервові стовбурові клітини. При розвитку шлунково-кишкового тракту для розвитку підшлункової залози необхідний низький рівень передачі сигналу білком Hh, тоді як високий рівень передачі сигналу білком Hh блокує розвиток підшлункової залози. Також відомо, що Hh відіграє важливу роль у проліферації стовбурових клітин і органогенезі шкіри, передміхурової залози, яєчок і кісткового мозку. Звичайно передача сигналу білком Hh точно регулюється під час проліферації, диференціації клітин і формування структури ембріону. Однак аберантна активація шляху передачі сигналу Hedgehog внаслідок мутацій, які конститутивно активують цей шлях, наприклад, може привести до патологічних наслідків. Наприклад, мутації, що ведуть до втрати функції Patched виявлені при синдромі Горліна (спадкоємний синдром, що характеризується високим ризиком ракових захворювань шкіри і головного мозку, також відомий, як синдром базально-клітинного невуса (СБКН)); і мутації Smo і Gli, що ведуть до втрати функції, пов'язані з базально-клітинною карциномою і гліобластомою. Базально-клітинна карцинома (БКК) є найпоширенішою формою раку шкіри, що щорічно виявляється більш, ніж в 90000 американців. Виявлено, що конститутивна активація Hh стимулює онкогенез при БКК, медулобластомі (найпоширеніша пухлина головного мозку), рабдоміосаркомі, раці підшлункової залози, дрібноклітинному раку легенів, раку передміхурової залози і раку молочної залози. Крім участі в онкогенезі передача сигналу білком Hh також бере участь у метастазуванні раку передміхурової залози. Передача сигналу білком Hh може брати участь у багатьох інших типах пухлин і такі взаємозв'язки, мабуть будуть ще виявлятися; такі дослідження активно проводяться в багатьох центрах з вивчення раку в усьому світі. Для проліферації цих ракових клітин необхідна активація шляху Hh і блокування шляхів передачі сигналу Hh часто придушує проліферацію ракових клітин. У дійсності, антагоніст Hh циклопамін і Gli1 siРНК можуть ефективно блокувати проліферацію цих ракових клітин і можуть зменшити розмір пухлини в моделях ксенотрансплантату, вказуючи на те, що нові антагоністи Hh можуть стати новими хіміотерапевтичними засобами лікування цих типів раку. На експериментальних моделях на тваринах показано, що антагоніст Hh циклопамін придушує метастазування раку передміхурової залози. Крім участі у раку передача сигналу білком Hh також відіграє важливу роль у нормальному гомеостазі і регенерації тканин. Шлях Hh активується після ушкодження сітківки, жовчної протоки, легенів, кістки і передміхурової залози на моделях мишей. Шлях Hh також завжди є активним у волосяних фолікулах, кістковому мозку і деяких областях центральної нервової 1 UA 100684 C2 5 10 15 20 25 системи (ЦНС) і для доброякісної гіперплазії передміхурової залози і утворення кровоносних судин при ексудативній дегенерації жовтої плями необхідна активність шляху Hedgehog. Процеси регенерації клітин можна блокувати антитілами анти-Shh і циклопаміном. Тому невеликі молекули - антагоністи шляху передачі сигналу Hh можуть бути застосовані для лікування нейрональних проліферативних захворювань, доброякісної гіперплазії передміхурової залози, при ексудативній дегенерації жовтої плями, псоріазі, проліферативних захворюваннях кісткового мозку і лейкозах, остеопетрозі та випадінні волосся. Дані про те, що конститутивна активація Smo приводить до раку (наприклад, БКК) і що Smo може бути онкогенним при його вивільненні при інгібуванні за допомогою Ptch, вказують на застосованість антагоністів Smo як терапевтичних засобів для лікування таких порушень (Stone et al. (1996) Nature 384: 129). Тому молекули, які модулюють активність шляху передачі сигналу Hedgehog, наприклад, які модулюють активність Smo, є терапевтично корисними. Короткий виклад суті винаходу Даний винахід в цілому відноситься до нових сполук, призначених для діагностики і лікування патологій, пов'язаних зі шляхом Hedgehog, включаючи, але не обмежуючись тільки ними, утворення пухлини, рак, неоплазію і незлоякісні гіперпроліферативні порушення. Даний винахід відноситься до нових сполук, нових композицій, способів їх застосування і способів їх одержання, і такі сполуки звичайно є фармакологічно корисними як засоби для лікування, механізм дії яких включає придушення онкогенезу, росту пухлини і життєдіяльності пухлини за допомогою засобів, які інгібують шлях передачі сигналу Hedgehog і Smo. Сполуки і способи, запропоновані у даному винаході (наприклад, сполука формули I), відносяться до інгібування активації шляху передачі сигналу Hedgehog, наприклад, шляхом інгібування аберантних станів росту, обумовлених такими фенотипами, як втрата функції Ptc, посилення функції Hedgehog, посилення функції Smoothened або посилення функції Gli, і включає взаємодію клітини зі сполуками, запропонованими у даному винаході (наприклад, сполукою формули I), у кількості, достатній для придушення нормальної активності Ptc, придушення нормальної активності Hedgehog або активності Smoothened (наприклад, для обігу або придушення аберантного стану росту). Даний винахід відноситься до сполук формули (I): R1 R2 L Z(m) X X n 30 35 40 45 50 Y R3 (I) і їх фармацевтично прийнятних солей, у яких R1 позначає арил або het, що може бути незаміщеним або заміщеним; R2 позначає het, у якому щонайменше одним гетероатомом є N і який може бути незаміщеним або заміщеним; L позначає нижч. алкіл, (CH2)1-2-A, -A-(CH2)1-2 або CH2-A-CH2 і A позначає O, S, NH або NАлкіл, де нижч. алкіл може бути незаміщеним або заміщеним нижч. алкілом або одним або більшою кількістю атомів фтору; X позначає N або CH і щонайменше один X позначає N; Y позначає зв'язок, CH2, C(O) або SO2; R3 позначає арил або het, що може бути незаміщеним або заміщеним; Z позначає H, нижч. алкіл, нижч. алкоксигрупу, оксогрупу, C(O)OR6 або -CN; де нижч. алкіл і нижч. алкоксигрупа можуть бути незаміщеними або заміщеними одним або більшою кількістю атомів галогенів, -OH, -CN, -NH2, або оксогруп і два Z, пов'язані з одним атомом, можуть утворити циклоалкільне кільце і m дорівнює від 0 до 3; замісниками фенілу, арилу або het в R1, R2 або R3 можуть бути один або більша кількість із наступних замісників: алкіл, циклоалкіл, алкоксигрупа, циклоалкоксигрупа, галоген, -CN, оксогрупа, арил, карбалкоксигрупа, OCF3, CF3, OH, -C(O)N(R6)2, C(O)R6, -C(O)OR6, -N(R6)2, NHC(O)R6, -SO2(R6), - SO2N(R6)2; CH2OC(O)N(R6)2, -CH2N(R6)2, -NHC(O)OR6, NHC(O)N(R6)2, CH2NHC(O)R6, CH2NHC(O)N(R6)2, CH2NHSO2(R6), CH2NHC(O)OR6-OC(O)R6, NHC(O)R6, O-арил, het або O-het, у яких алкіл, het, циклоалкіл, циклоалкоксигрупа, N(R6)2, арил, карбалкоксигрупа і алкоксигрупа можуть бути незаміщеними або заміщеними одним або більшою кількістю з наступних замісників: галоген, -OCH3, -OCF3, -OH, -NH2, алкіл або6, оксогрупу, -N(H)0-2-R6, -CN, C(O)N(R6)2, C(O)R6, C(O)OR6, -N(R6)2, NHC(O)R6, -SO2(R6), - SO2N(R6)2, OSO2R6, -CH2N(R6)2, CH2NHC(O)R6, -OC(O)R6, арил, NHC(O)(R6), O-арил, het, O-het або циклоалкіл; 2 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 R6 позначає H, алкіл, алкеніл, арил, het, або два R 6 у одного атому можуть утворити циклоалкіл, арил або het; і алкіл, алкеніл, арил, het, циклоалкіл, або het можуть бути незаміщеними або заміщеними за допомогою OH, оксогрупи, алкоксигрупи, NR 6, N-алкілу, ацилу, арилу або групи het; het позначає 5- - 7-членне моноциклічне гетероциклічне кільце, що може бути ароматичним або неароматичним, що містить 1-4 кільцевих гетероатоми, обраних із групи, що включає N, O і S; або 8- - 12-членну конденсовану кільцеву систему, що включає щонайменше одне 5- - 7членне гетероциклічне кільце, що може бути ароматичним або неароматичним, що містить 1, 2 або 3 кільцевих гетероатоми, обраних із групи, що включає N, O і S, і цей het є незаміщеним або заміщеним; арил позначає ароматичний радикал, що містить від 6 до 14 кільцевих атомів вуглецю і не містить кільцевих гетероатомів, де зазначена арильна група може бути моноциклічною або конденсованою бициклічною або трициклічною, що може бути незаміщеною або містити один або більшу кількість замісників; і n дорівнює 0, 1, 2 або 3. В одному варіанті здійснення даного винаходу R 1 позначає феніл, що може бути незаміщеним або заміщеним, і R3 позначає арил або het який є заміщеним. Даний винахід також відноситься до фармацевтичних композицій, що включають терапевтично ефективні кількості сполук формули I, визначених вище у даному винаході, або їх фармацевтично прийнятні солі і фармацевтичний носій. Сполуки, запропоновані у даному винаході, як додатково описано нижче, включають невеликі молекули - інгібітори або антагоністи синтезу, експресування, продукування, стабілізації, фосфорилювання, зміни положення в клітині і/або активності Smo. Сполуки, запропоновані у даному винаході, включають, але не обмежуються тільки ними, сполуки формули I. Одним об'єктом даного винаходу є способи застосування сполук для інгібування залежного від Smo шляху активації. Іншим об'єктом даного винаходу є способи застосування сполук для інгібування незалежного від Hedgehog (ліганду) шляхи активації. У деяких варіантах здійснення способи, запропоновані у даному винаході, можна використовувати для протидії фенотиповим ефектам небажаної активації шляху Hedgehog, таким як мутації, обумовлені посиленням функції Hedgehog, втратою функції Ptc або посиленням функції Smoothened. Наприклад, спосіб, запропонований у даному винаході, може включати взаємодію клітини (in vitro або in vivo) з антагоністом Smo, таким як сполука, запропонована у даному винаході (наприклад, сполука формули I) або інша невелика молекула в кількості, достатній для придушення залежного від Smoothened і/або незалежного від Hedgehog шляху активації. Сполуки і способи, запропоновані у даному винаході, можна використовувати для регулювання проліферації і/або диференціації клітин in vitro і/або in vivo, наприклад, при утворенні тканин зі стовбурних клітин, або для попередження росту гіперпроліферативних клітин. В іншому кращому варіанті здійснення взаємодія клітини зі сполукою, запропонованою у даному винаході (наприклад, сполукою формули I), або її введення в клітину приводить до придушення проліферації клітин, придушення росту і/або життєдіяльності пухлинних клітин, і/або придушенню онкогенезу. Таким чином, інший кращий варіант здійснення відноситься до способів гальмування і/або придушення шляху Hh шляхом використання сполук, запропонованих у даному винаході (наприклад, сполуки формули I) у пухлинних клітинах. У способах, запропонованих у даному винаході, можна використовувати сполуки, запропоновані у даному винаході (наприклад, сполуку формули I), приготовлені у вигляді фармацевтичних препаратів, що включають фармацевтично прийнятний інертний наповнювач або носій, і зазначені препарати можна вводити пацієнтові для лікування патологічних станів, включаючи небажану проліферацію клітин, таку як ракові захворювання і/або пухлини (такі як медулобластома, базально-клітинна карцинома і т.п.) і незлоякісні гіперпроліферативні порушення. Один варіант здійснення даного винаходу відноситься до сполуки і способу придушення синтезу, експресування, продукування, стабілізації, фосфорилювання, зміни положення в клітині і/або активності білка Smo у клітині in vitro або in vivo, що включає взаємодію зазначеної клітини зі сполукою, запропонованою у даному винаході (наприклад, сполукою формули I), або її введення в зазначену клітину. Іншим об'єктом даного винаходу є сполука і спосіб діагностики, попередження і/або лікування ослаблень, порушень і/або дисфункцій клітин; гіперпластичних, гіперпроліферативних і/або злоякісних патологічних станів; і/або метастазування пухлинних клітин у ссавця, що характеризуються наявністю і/або експресуванням гену або генного продукту Smo (наприклад, 3 UA 100684 C2 5 білка Smo), що включає сполуки формули (I) і їх введення ссавцеві в терапевтично ефективній кількості. Докладний опис винаходу В одному варіанті здійснення сполука формули (I) додатково включає сполуку, у якій R 2 вибраний із групи, що включає: R4 U U R5 N N U R4 U U N N U U R5 R4 R4 , N U , , R4 U U U U і 10 15 R4 N U (де N пов'язаний з L), де U позначає C(H)0-1 або N і не більше двох U позначають N; R4 незалежно позначає H, -N(R6)2, -OH, галоген, -CN, -C(O)OR6, -C(O)N(R6)2, -NH2, нижч. алкіл або нижч. алкоксигрупу, де нижч. алкіл і нижч. алкоксигрупа можуть бути незаміщеними або заміщеними одним або більшою кількістю атомів галогенів, -OH, -CN, -NH2, -NO2, -C(O)NH2, -C(O)NH(C1-C6-алкіл), -C(O)N(C1-C6-алкіл)2, -C(O)(C1-C6-алкіл), -NHC(O)(C1-C6-алкіл), NH(C1-C6алкіл), -N(C1-C6-алкіл)2, -SO2(C1-C6-алкіл), -SO2NH2, -SO2NH(C1-C6 –алкіл); R5 позначає H, арил, het, нижч. алкіл, нижч. алкоксигрупу або циклоалкіл, які можуть бути незаміщеними або заміщеними одним або більшою кількістю з наступних замісників: галоген, циклоалкіл, арил, het, і де щонайменше один R5 не позначає H і L позначає нижч. алкіл. В іншому варіанті здійснення R2 може бути вибраний із групи, що включає: N W N N N , W 20 N N , W W N N N N , N N , або де W позначає O, NR7 або SO2 і R7 позначає зв'язок, H, нижч. алкіл або нижч. ацил. В іншому варіанті здійснення сполука формули I включає сполуку, у якій R 2 позначає: N N 25 30 і R3 позначає het. В іншому варіанті здійснення сполука формули (I) включає сполуку, у якій: R1 позначає арил або het, що може бути незаміщеним або заміщеним; і, якщо R 1 позначає het, то щонайменше одним кільцевим гетероатомом є N; R3 позначає арил або het, що може бути незаміщеним або заміщеним; і, якщо R3 позначає het, то щонайменше одним кільцевим гетероатомом є N; U позначає C(H)0-1; R4 позначає H, CH3, галоген або –CN; L позначає CH2; X позначає N; Y позначає зв'язок; і Z позначає H або CH3. Ще один варіант здійснення даного винаходу відноситься до сполуки формули (I), у якій: R 1 позначає феніл, піридин або нафтил, що може бути незаміщеним або заміщеним; R 2 позначає 4 UA 100684 C2 R4 U U N U N U R4 5 ; R4 позначає H і U позначає C(H)0-1, R3 позначає феніл, піридин, піразин, піридазин, або піримідин, що може бути незаміщеним або заміщеним; Z позначає H або CH3; і n дорівнює 1. Ще один варіант здійснення даного винаходу відноситься до сполуки формули (I), у якій: R 1 позначає феніл, що може бути незаміщеним або заміщеним; і R2 вибраний із групи, що включає: R4 U U R5 N R4 U N U U N R5 R4 , N U U U , R4 , R4 U U U U R4 10 15 20 25 30 35 40 U N (де N пов'язаний з L); і щонайменше один R5 позначає CH3. В іншому варіанті здійснення даний винахід відноситься до фармацевтичної композиції, що включає терапевтично ефективну кількість сполуки формули I. В іншому варіанті здійснення даний винахід відноситься до способу лікування ссавця, що страждає від патології, пов'язаної зі шляхом Hedgehog, що включає введення зазначеному ссавцеві, що потребує такого лікування, терапевтично ефективної кількості сполуки формули I. У даному описі термін "лікування" включає профілактичне або попереджувальне лікування, а також виліковує або придушує захворювання лікування, включаючи лікування пацієнтів, підданих ризику виникнення порушення, зазначеного у даному винаході (наприклад, порушення, пов'язаного з Hedgehog (наприклад, раку)), а також захворілих пацієнтів. Цей термін включає лікування, призначене для затримки прогресування захворювання. "Пригніченням і/або оберненням", наприклад, пов'язаного з Hedgehog порушення (наприклад, раку), заявники вважають усунення зазначеного пов'язаного з Hedgehog порушення (наприклад, діабету) або його приведення в менш важкий стан, ніж до лікування або без проведення лікування. "Вилікування" при використанні у даному винаході означає забезпечувану шляхом лікування ремісію пов'язаного з Hedgehog порушення (наприклад, раку) або його безперервних нападів у пацієнта. Терміни "профілактика" або "попередження" означають блокування виникнення або рецидиву метаболічних порушень, наприклад, діабету. "Лікування" означає терапію, попередження і профілактику і краще означає введення пацієнтові лікарського засобу або виконання лікувальних процедур для профілактики (попередження) або вилікування, або зменшення ступеня прояву або ймовірності виникнення порушення, захворювання або патологічного стану або прояву, якщо пацієнт страждає захворюванням. "Діагностика" означає постановку діагнозу, прогноз, моніторинг, опис, підбір пацієнтів, включаючи учасників клінічних досліджень, і виявлення пацієнтів, підданих ризику виникнення порушення або страждаючих від конкретного порушення або клінічного прояву, і тих, які з найбільшою ймовірністю будуть реагувати на конкретне лікування, або оцінку або моніторинг реакції пацієнта на конкретне лікування. "Суб'єкт" або "пацієнт" означає ссавця, краще - людини, що потребує лікування патологічного стану, порушення або захворювання. "Сполука (сполуки), запропонована у даному винаході" при використанні у даному винаході включають, але не обмежуються тільки ними, сполуки формули I (наприклад, сполуки формул (I), включаючи всі її варіанти). Сполука, запропонована у даному винаході, включаює сполуки, спеціально перераховані у даному винаході, включаючи перераховані в прикладах, наведених у даному винаході. 5 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Затримка прогресування" при використанні у даному винаході означає, що введення сполуки, запропонованої у даному винаході (наприклад, сполуки формули I), пацієнтам на попередній стадії або ранній стадії пов'язаного з Hedgehog порушення (наприклад, раку) попереджає подальший розвиток або сповільнює розвиток захворювання у порівнянні з розвитком захворювання без введення активної сполуки. "Посилення функції Hedgehog" означає аберантну модифікацію або мутацію гену Ptc, гену Hedgehog або гену Smoothened, або зміну (наприклад, зменшення) ступеня експресування такого гену, що приводить до фенотипу, який подібний із взаємодією клітини з білком Hedgehog, наприклад, аберантну активацію шляху Hedgehog. Посилення функції може включати втрату здатності генного продукту Ptc регулювати ступінь експресування генів Gli, наприклад, Gli1, Gli2, і Gli3, або втрату здатності регулювати процесінг, стабільність, локалізацію або активність білків Gli, наприклад, Gli1, Gli2, і Gli3. Термін "посилення функції Hedgehog" у даному винаході також використовується для зазначення будь-якого подібного клітинного фенотипу (наприклад, прояв надмірної проліферації), який спостерігається внаслідок зміни шляху передачі сигналу Hedgehog, що відбувається де-небудь, включаючи, але не обмежуючись тільки ними, модифікацію або мутацію самого Hedgehog. Наприклад, пухлинна клітина з аномально високою швидкістю проліферації внаслідок активації шляху передачі сигналу Hedgehog буде мати фенотип "посилення функції Hedgehog" навіть якщо в цій клітині Hedgehog не піддався мутації. “Втрата функції Patched" означає аберантну модифікацію або мутацію гену Ptc або зменшення ступеня експресування такого гену, що приводить до фенотипу, який подібний із взаємодією клітини з білком Hedgehog, наприклад, аберантну активацію шляху Hedgehog. Втрата функції може включати втрату здатності генного продукту Ptc регулювати ступінь експресування, процесінг, стабільність, локалізацію, регуляцію або активність генів і білків Gli, наприклад, Gli1, Gli2, і Gli3. "Посилення функції Gli" означає аберантну модифікацію або мутацію гену Gli або підвищений ступінь експресування цього гену, що приводить до фенотипу, який подібний із взаємодією клітини з білком Hedgehog, наприклад, аберантну активацію шляху Hedgehog. "Посилення функції Smoothened" означає аберантну модифікацію або мутацію гену Smo або підвищений ступінь експресування цього гену, що приводить до фенотипу, який подібний із взаємодією клітини з білком Hedgehog, наприклад, аберантну активацію шляху Hedgehog. При використанні у даному винаході "невелика органічна молекула" означає органічну сполуку (або органічну сполуку, що утворила комплекс із неорганічною сполукою (наприклад, металом)), яка має молекулярну масу, рівну менше 3 кДа, і краще - менше 1,5 кДа. При використанні у даному винаході термін "репортерний ген" використовується взаємозамінним чином з терміном "маркерний ген" і означає нуклеїнову кислоту, яка легко виявляє і/або кодує генний продукт, який легко виявляється, такий як люцифераза. Транскрипційні і трансляційні контрольні послідовності являють собою регуляторні послідовності ДНК, такі як промотори, підсилювачі, термінатори і т.п., які забезпечують експресування послідовності, що кодує, у клітині-хазяїні. В еукаріотних клітинах контрольними послідовностями є сигнали поліаденілювання. "Промотуюча послідовність" являє собою регуляторну ділянку ДНК, здатну зв'язувати РНКполімеразу в клітині та ініціювати транскрипцію послідовності, що кодує, у прямому напрямку (у напрямку 3'). Для визначення даного винаходу промотуюча послідовність зв'язана по своєму 3'кінцю сайтом ініціації транскрипції і розташовується у зворотному напрямку (у напрямку 5') із включенням мінімальної кількості основ або елементів, необхідних для ініціювання транскрипції в ступені, що відрізняється від фону. У промотуючій послідовності виявляється сайт ініціації транскрипції (звичайно обумовлений, наприклад, шляхом картирування з нуклеазою S1), а також домени зв'язування білка (консенсусні послідовності), що забезпечують зв'язування РНКполімерази. Послідовність, Що Кодує, "перебуває під контролем" транскрипційних і трансляційної контролюючих послідовностей у клітині, коли РНК-полімераза транскрибує послідовність, що кодує, у мРНК, яка потім піддається сплайсингу за допомогою транс-РНК і транслюється в білок, що кодується послідовністю, що кодує. Вираження "фармацевтично прийнятний" означає сполуки і композиції, які при введенні людині є фізіологічно стерпними і звичайно не приводять до алергійних або аналогічних небажаних реакцій, таких як розлади шлунка, запаморочення і т.п.. При використанні у даному винаході, термін "фармацевтично прийнятний" краще означає затверджений регулятивним органом федерального уряду або уряду штату, або зазначений у Фармакопеї США або іншій загальновизнаній Фармакопеї, як такий, що застосовується для тварин і ще краще - для людини. 6 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "носій" означає розріджувач, допоміжну речовину, інертний наповнювач або розчинник, разом з яким вводять сполуку. Такі фармацевтичні носії можуть являти собою стерильні рідини, такі як вода або олії, включаючи олії, отримані з нафти, і олії тваринного, рослинного або синтетичного походження, такі як арахісова олія, соєва олія, мінеральна олія, кунжутна олія і т.п. Як носії, особливо для розчинів, призначених для ін'єкцій, краще використовувати воду або водні фізіологічні розчини і водні розчини декстрози і гліцерину. Придатні фармацевтичні носії описані в публікації "Remington's Pharmaceutical Sciences" by E. W. Martin. Вираження "терапевтично ефективна кількість" використовується у даному винаході для зазначення кількості, достатньої для щонайменше приблизно 15 %, краще - щонайменше приблизно 50 %, ще краще - щонайменше приблизно 90 % ослаблення клінічно значимого дефіциту активності, функції і відповіді реципієнта, і найкраще - його попередження. Альтернативно, терапевтично ефективної кількості досить для забезпечення поліпшення клінічно значимого стану/симптому в реципієнта. "Засіб" означає всі речовини, які можна використовувати для приготування фармацевтичних і діагностичних композицій, або якими можуть бути сполуки, нуклеїнові кислоти, поліпептиди, фрагменти, ізоформи, варіанти або інші речовини, які незалежно можна використовувати для таких цілей, усе відповідно до даного винаходу. "Аналог" при використанні у даному винаході означає невелику органічну сполуку, нуклеотид, білок або поліпептид, що має подібну або таку ж активністю або функцію (функції), як сполука, нуклеотид, білок або поліпептид або сполука, що має необхідну активність і терапевтичний вплив відповідно до даного винаходу (наприклад, придушує ріст пухлини), але не обов'язково включає послідовність або структуру, що подібна або ідентична з послідовністю або структурою кращого варіанту здійснення. "Похідне" означає сполуку, білок або поліпептид, що включає амінокислотну послідовність вихідного білка або поліпептиду, що змінена шляхом заміщень, видалень або додатків амінокислотних залишків, або нуклеїнову кислоту або нуклеотид, що модифікований шляхом введення або видалень, додатків або мутацій нуклеотидних замісників. Похідне нуклеїнової кислоти, нуклеотиду, білка або поліпептиду виконує подібну або таку ж функцію, як вихідний поліпептид. "Інгібітори", або "антагоністи" означають інгібуючі молекули, ідентифіковані за допомогою проведених in vitro і in vivo досліджень функції шляху Hh, наприклад, антагоністи Smo. Інгібітори та антагоністи краще означають сполуки або засоби, які послабляють передачу сигналів для шляху Hh. Інгібітори можуть являти собою сполуки, які послабляють, блокують або попереджають передачу сигналів для цього шляху. "Порушення (порушення), пов'язане з Hedgehog" при використанні у даному винаході включає порушення, пов'язані з руйнуванням або аберацією шляху Hedgehog, а також порушення, пов'язані з нормальними, але небажаними станами росту, пов'язані з активацією шляху Hedgehog. "Порушення (порушення), пов'язане з Hedgehog" включають, але не обмежуються тільки ними, утворення пухлини, рак, неоплазію, злоякісні гіперпроліферативні порушення і незлоякісні гіперпроліферативні порушення. "Порушення (порушення), пов'язане з Hedgehog" також включають доброякісну гіперплазію передміхурової залози, псоріаз, екссудативну дегенерацію жовтої плями, остеопетроз і небажаний ріст волосся. При використанні у даному винаході, термін "рак" включає сóлідні пухлини ссавців, а також злоякісні захворювання крові. "Солідні пухлини ссавців" включають ракові захворювання голови та шиї, легенів, мезотеліому, захворювання середостіння, стравоходу, шлунку, підшлункової залози, гепатобіліарної системи, тонкого кишечника, ободової кишки, ободової і прямої кишки, прямої кишки, ануса, нирок, уретри, сечового міхура, передміхурової залози, пенісу, яєчок, полових органів жінок, яєчників, молочної залози, ендокринної системи, центральної нервової системи, включаючи головний мозок; саркоми м'яких тканин і кісток; і меланому шкірного і внутрішньочного походження. Термін "злоякісні захворювання крові" включає дитячі лейкози і лімфоми, хворобу Ходжкіна, лімфоми лімфоцитарного і шкірного походження, гострий і хронічний лейкоз, плазмоклітинну неоплазію і ракові захворювання, пов'язані зі СНІД (синдром набутого імундефіциту). Крім того, можна лікувати рак на будь-якій стадії прогресування, такий як первинний, метастатичний і рецидивуючий рак. Інформація про численні типи раку наведена, наприклад, у публікаціях American Cancer Society або, наприклад, Wilson et al. (1991) Harrison's Principles of Internal Medicine, 12th Edition, McGraw-Hill, Inc. В об'єм даного винаходу входять застосування в медицині та ветеринарії. Ракові захворювання, які особливо добре піддаються лікуванню сполуками і способами, запропонованими у даному винаході, включають, але не обмежуються тільки ними, гліоми, 7 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 медулобластоми, примітивні нейроектодермальні пухлини (ПНЕДП), базально-клітинну карциному (БКК), дрібноклітинні ракові захворювання легенів, крупноклітинні ракові захворювання легенів, пухлини шлунково-кишкового тракту, рабдоміосаркоми, саркоми м'яких тканин, пухлини підшлункової залози, пухлини сечового міхура і пухлини передміхурової залози. При використанні у даному винаході, термін "злоякісне гіперпроліферативне порушення (порушення)" включає, але не обмежується тільки ними, ракові захворювання, нейрональні проліферативні порушення, проліферативні захворювання кісткового мозку і лейкози. При використанні у даному винаході, термін "незлоякісне гіперпроліферативне порушення (порушення)" включає, але не обмежується тільки ними, незлоякісні і ненеопластичні проліферативні порушення, такі як гіперплазію гладких м'язів у кровоносних судинах, утворення рубців на шкірі і фіброз легень. При використанні у даному винаході термін "арил" визначається, як ароматичний радикал, що містить 6-14 кільцевих атомів вуглецю і не містить кільцевих гетероатомів. Арильна група може бути моноциклічною або конденсованою бициклічною або трициклічною. Вона може бути незаміщеною або містити один або більшу кількість, краще - 1 або 2 замісники, де замісники є такими, як описано у даному винаході. Як визначено у даному винаході, арильний фрагмент може бути повністю ароматичним незалежно від того, чи є він моноциклічним або біциклічним. Однак, якщо він містить більше одного кільця, визначеного у даному винаході, то термін "арил" включає фрагменти, у яких щонайменше одне кільце є повністю ароматичним, а інше кільце (кільця) може бути частково ненасиченим або насиченим або повністю ароматичним. "Het" при використанні у даному винаході означає гетероарильні і гетероциклічні сполуки, що містять щонайменше один кільцевий гетероатом S, O або N. Ще краще, якщо "het" означає 5- – 7-членне гетероциклічне кільце, що містить 1-4 гетероатоми, обраних із групи, що включає N, O і S, або 8- – 12-членнну конденсовану кільцеву систему, включаючи щонайменше одне 5- – 7-членне гетероциклічне кільце, що містить 1, 2 або 3 гетероатомів, обраних із групи, що включає N, O і S. Приклади het при використанні у даному винаході включають, але не обмежуються тільки ними, незаміщений і заміщений піролідил, тетрагідрофурил, тетрагідротіофурил, піперидил, піперазил, пуриніл, тетрагідропіраніл, морфолінову групу, 1,3діазапаніл, 1,4-діазапаніл, 1,4-оксазепаніл, 1,4-оксатіапаніл, фурил, тієніл, пірил, піроліл, піразоліл, триазоліл, тетразоліл, індазоліл, оксадиазоліл, імідазоліл, піролідил, піролідиніл, тіазоліл, оксазоліл, піридил, піразоліл, піразиніл, піримідиніл, ізоксазоліл, піразиніл, хіноліл, ізохіноліл, піридопіразиніл, піролопіридил, фуропіридил, індоліл, бензофурил, бензотіофурил, бензоіндоліл, бензотієніл, піразоліл, піперидил, пиперазиніл, індолініл, морфолініл, бензоксазоліл, піролохіноліл, піроло[2,3-b]піридиніл, бензотриазоліл, оксобензооксазоліл, бензо[1,3]диоксоліл, бензоімідазоліл, хінолініл, інданіл і т.п. Гетероарили входять в об'єм визначення het. Прикладами гетероарилів є піридил, піримідиніл, хіноліл, тіазоліл і бензотіазоліл. Найбільш кращими het є піридил, піримідиніл і тіазоліл. het може бути незаміщеним або заміщеним так, як описано у даному винаході. Краще, якщо він є незаміщеним або, якщо він є заміщеним, то заміщений по атому вуглецю галогеном, краще - фтором або хлором, гідроксигрупою, C1-C4-алкілом, таким як метил або етил, C1-C4-алкоксигрупою, краще метоксигрупою або етоксигрупою, нітрогрупою, -O-C(O)-C1-C4-алкілом або -C(O)-O-C1-C4алкілом, SCN або нітрогрупою або по атому азоту C1-C4-алкілом, краще - метилом або етилом, O-C(O)-C1-C4-алкілом або -C(O)-O-C1-C4-алкілом, такими як карбметоксигрупа або карбетоксигрупа. Якщо два замісники разом з атомом азоту, з яким вони зв'язані, утворюють het, варто розуміти, що утворене гетероциклічне кільце являє собою кільце, що містить азот, таке як азиридин, азетидин, азол, піперидин, піперазин, морфолін, пірол, піразол, тіазол, оксазол, піридин, піримідин, ізоксазол і т.п., де такий het може бути незаміщеним або заміщеним, як визначено вище у даному винаході. При використанні у даному винаході "галоген" означає фтор, хлор, бром або йод, краще фтор або хлор. Якщо не зазначено інше, то "алкіл", окремо або в комбінації, включає алкіл, що має лінійний або розгалужений ланцюг, такий як метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, третбутил, н-пентил і розгалужений пентил, н-гексил і розгалужений гексил і т.п. "Циклоалкільна" група означає C3-C10-циклоалкіл, що містить 3-10 кільцевих атомів вуглецю і може являти собою, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил або циклооктил, циклононіл і т.п. Циклоалкільна група може бути моноциклічною або конденсованою бициклічною. Крім того, кращою циклоалкільною групою є циклопентил або циклогексил. Найкраще, якщо циклоалкіл позначає циклогексил. Циклоалкільна група може бути повністю насиченою або частково ненасиченою, хоча краще, якщо вона є повністю насиченою. 8 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як визначено у даному винаході, вона виключає арильні групи. Циклоалкільні групи можуть бути незаміщеними або заміщеними кожним із замісників, визначених нижче, краще - галогеном, гідроксигрупою або C1-C6-алкілом, таким як метил. Незаміщений означає, що єдиним замісником є водень. За винятком випадків, описаних у даному винаході, будь-який визначений вище арил, het, алкіл, алкеніл, алкініл або циклоалкіл, може бути незаміщеним або незалежно містити до 4, краще - 1, 2 або 3 замісники, обраних із групи, що включає: галоген (такий як Cl або Br); гідроксигрупу; нижч. алкіл (такий як C1-C3-алкіл); нижч. алкіл, що може бути заміщений кожним із замісників, визначених у даному винаході; нижч. алкеніл; нижч. алкініл; нижч. алканоїл; нижч. алкоксигрупу (таку як метоксигрупу); арил (такий як феніл або нафтил); заміщений арил (такий як фторфеніл або метоксифеніл); арил-нижч. алкіл, такий як бензил, моно- або диаміно-нижч. алкіл (такий як диметиламіногрупа); нижч. алканоїламіногрупу, ацетиламіногрупу; аміно-нижч. алкоксигрупу (таку як етоксиаміногрупу); нітрогрупу; ціаногрупу; ціано-нижч. алкіл; карбоксигрупу; нижч. карбалкоксигрупу (таку як метоксикарбоніл; н-пропоксикарбоніл або ізопропоксикарбоніл), нижч. арилоїл, такий як бензоїл; карбамоїл; N-моно- або N, N-ди-нижч. алкілкарбамоїл; складноефірну групу нижч. алкілкарбамінової кислоти; амідинову групу; гуанідинову групу; уреїдну групу; меркаптогрупу; сульфогрупу; нижч. алкілтіогрупу; сульфоаміногрупу; сульфонамідну групу; бензосульфонамідну групу; сульфонатну групу; сульфаніл-нижч. алкіл (такий як метилсульфаніл); сульфоаміногрупу; арилсульфонамідну групу; галогензаміщену або незаміщену арилсульфонатну групу (таку як хлорфенілсульфонатну групу); нижч. алкілсульфініл; арилсульфініл; арил-нижч. алкілсульфініл; нижч. алкіларилсульфініл; нижч. алкансульфініл; арилсульфоніл; арил-нижч. алкілсульфоніл; нижч. арилалкіл; нижч. алкіларилсульфоніл; галоген-нижч. алкілмеркаптогрупу; галоген-нижч. алкілсульфоніл, такий як трифторметансульфоніл; фосфоно(-P(=O)(OH)2); гідрокси-нижч. алкоксифосфорил або ди-нижч. алкоксифосфорил; сечовину і заміщену сечовину; ефір алкілкарбамінової кислоти або карбамати (такі як етил-N-феніл-карбамат); або нижч. алкіл (наприклад, метил, етил або пропіл). В одному варіанті здійснення зазначені вище алкільні, циклоалкільні і арильні групи незалежно є незаміщеними або містять як замісників нижч. алкіл, арил, арил-нижч. алкіл, карбоксигрупу, нижч. карбалкоксигрупу і краще - галоген, -OH, -SH, -OCH3, -SCH3, -CN, -SCN або нітрогрупу. Як визначено у даному винаході, термін "нижч. алкіл" при використанні окремо або в комбінації означає алкіл, що містить 1-6 атомів вуглецю. Алкільна група може мати лінійний або розгалужений ланцюг і є такою, як визначено вище у даному винаході. Термін "нижч. алкеніл" означає алкенільну групу, що містить 2-6 атомів вуглецю. Алкенільна група являє собою гідрокарбільну групу, що містить щонайменше один вуглець-вуглецевий подвійний зв'язок. Як визначено у даному винаході, вона може бути незаміщеною або заміщеною замісниками, що описпні у даному винаході. Вуглець-вуглецеві подвійні зв'язки можуть перебувати між будь-якими двома атомими вуглецю алкенільної групи. Краще, якщо вона містить 1 або 2 вуглець-вуглецеві подвійні зв'язки і ще краще - один вуглець-вуглецевий подвійний зв'язок. Алкенільна група може мати лінійний або розгалужений ланцюг. Приклади включають, але не обмежуються тільки ними, етиніл, 1-пропеніл, 2-пропеніл, 1-бутеніл, 2бутеніл, 2-метил-1-пропеніл, 1,3-бутадієніл і т.п. Термін "нижч. алкініл" при використанні у даному винаході означає алкінільну групу, що містить 2-6 атомів вуглецю. Алкінільна група являє собою гідрокарбільну групу, що містить щонайменше один вуглець-вуглецевий потрійний зв'язок. Вуглець-вуглецевий потрійний зв'язок може перебувати між будь-якими двома атомими вуглецю алкінільної групи. Краще, якщо алкінільна група містить 1 або 2 вуглець-вуглецеві потрійні зв'язки і ще краще - один вуглецьвуглецевий потрійний зв'язок. Алкінільна група може мати лінійний або розгалужений ланцюг. Приклади включають етиніл, 1-пропініл, 2-пропініл, 1-бутиніл, 2-бутиніл і т.п. При використанні у даному винаході термін "арилалкіл" означає арильну групу, приєднану до основного ланцюга за допомогою місточкової алкіленової групи. Приклади включають бензил, фенетил, нафтилметил і т.п. Кращим арилалкілом є бензил. Аналогічним чином, ціаноалкільна група означає ціаногрупу, приєднану до основного ланцюга за допомогою місточкової алкіленової групи. З іншого боку, термін "алкіларил" означає алкільну групу, приєднану до основного ланцюга за допомогою місточкової феніленової групи. Приклади включають, але не обмежуються тільки ними, метилфеніл, етилфеніл і т.п. При використанні у даному винаході термін "нижч. алканоїл" означає нижч. алкільний ланцюг, у якому один з атомів вуглецю замінений групою C=O. Група C=O може перебувати на 9 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 одному з кінців замісники або в середині фрагмента. Приклади включають, але не обмежуються тільки ними, форміл, ацетил, 2-пропаноїл, 1-пропаноїл і т.п. Термін "алкоксигрупа" означає алкільну групу, визначену у даному винаході, пов'язану з головним ланцюгом за допомогою атому кисню. Приклади включають, але не обмежуються тільки ними, метоксигрупу, етоксигрупу і т.п. Термін "карбалкоксигрупа" означає алкоксикарбонільну групу, пов'язану з головним ланцюгом за допомогою карбонільної групи (C(O)). Приклади включають, але не обмежуються тільки ними, метоксикарбоніл, етоксикарбоніл і т.п. При використанні у даному винаході "оксо" означає кисень, зв'язаний подвійним зв'язком (тобто =O). Також варто розуміти, що позначення C(O) означає групу -C=O, незалежного від того, чи входить вона в кетон, альдегід або кислоту, або похідне кислоти. Аналогічним чином, S(O) означає групу -S=O. Фармацевтично прийнятні солі будь-яких кислотних сполук, запропонованих у даному винаході, означають солі, утворені з основами, а саме, солі катіонів, такі як солі лужних і лужноземельних металів, таких як натрій, літій, калій, кальцій, магній, а також солі амонію, такі як солі амонію, триметиламонію, диетиламонію і трис(гідроксиметил)-метиламонію. Аналогічним чином, солі приєднання з кислотами, такі як утворені з неорганічними кислотами, органічними карбоновими кислотами і органічними сульфоновими кислотами, наприклад, із хлористоводневою кислотою, малеїновою кислотою і метансульфоновою кислотою, є можливими, якщо частиною структури є основна група, така як аміногрупа або піридильна група. Відповідно до винаходу було встановлено, що шляхи передачі сигналу, регульовані за допомогою Hh і/або Smo, можна модулювати сполуками, запропонованими у даному винаході. В одному варіанті здійснення сполуки і способи, запропоновані у даному винаході, включають сполуки формули (I), призначені для інгібування залежного від Smo шляху активації. Іншим об'єктом даного винаходу є сполуки і способи, призначені для інгібування незалежного від Hedgehog (ліганду) шляху активації. У деяких варіантух здійснення сполуки і способи, запропоновані у даному винаході, можна використовувати для протидії фенотиповим ефектам небажаної активації шляху Hedgehog, таким як мутації, обумовлені посиленням функції Hedgehog, втратою функції Ptc або посиленням функції Smoothened. Наприклад, сполуки, запропоновані у даному винаході, і спосіб, запропонований у даному винаході, може включати взаємодію клітини (in vitro або in vivo) з антагоністом Smo, таким як сполука формули (I) у кількості, достатній для придушення залежного від Smoothened і/або незалежного від Hedgehog шляху активації. В одному варіанті здійснення сполуки, запропоновані у даному винаході (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом блокування тривимірної структури білка Smo у неактивній конформації або перешкоджання утворенню активної конформації Smo. В іншому варіанті здійснення сполуки, запропоновані у даному винаході (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом запобігання ендогенно активують лігандів Smo від зв'язування з Smo або від активації Smo (тобто впливу шляхом негативної кооперації з ендогенними агоністами). В іншому варіанті здійснення сполуки, запропоновані у даному винаході (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом посилення зв'язування ендогенно інактивуючих лігандів Smo з Smo або інактивації Smo (тобто впливу шляхом позитивної кооперації з ендогенним антагоністом). В іншому варіанті здійснення сполуки, запропоновані у даному винаході (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом запобігання локалізації Smo у плазматичній мембрані. В іншому варіанті здійснення сполуки, запропоновані у даному винаході (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом запобігання передачі сигналу від Ptch до Smo у присутності або за відсутності ліганду Hh. В іншому варіанті здійснення сполуки, запропоновані у даному винаході (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом запобігання стабілізації Smo. В іншому варіанті здійснення сполуки, запропоновані у даному винаході (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом запобігання фосфорилювання Smo по центрам, що активують. В іншому варіанті здійснення сполуки, запропоновані у даному винаході (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом посилення фосфорилювання Smo по центрам, що інгібують. У ще одному варіанті здійснення сполуки, запропоновані у даному винаході (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом запобігання активації розташованих у прямому напрямку мішеней, що відбувається з допомогою Smo, таких як фактор транскрипції Gli. В іншому варіанті здійснення сполуки, запропоновані у даному винаході 10 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 (наприклад, сполуки формули I) інгібують передачу сигналу білком Hh шляхом здійснення інактивації, секвестрації і/або руйнування Smo. В іншому варіанті здійснення способи, запропоновані у даному винаході можна використовувати для регулювання проліферації і/або диференціації клітин in vitro і/або in vivo, наприклад, при утворенні тканини зі стовбурних клітин, або для попередження росту гіперпроліферативних клітин. В іншому кращому варіанті здійснення взаємодія клітини зі сполукою, запропонованою у даному винаході (наприклад, сполукою формули I), або її введення в клітину приводить до придушення проліферації клітин, придушенню росту і/або життєдіяльності ракових/пухлинних клітин, і/або придушенню онкогенезу. Таким чином, інший кращий варіант здійснення відноситься до способів гальмування і/або придушення шляху Hh шляхом використання сполук, запропонованих у даному винаході (наприклад, сполуки формули I) у пухлинних клітинах. У ще одному варіанті здійснення в способах, запропонованих у даному винаході використовуються сполуки, запропоновані у даному винаході (наприклад, сполука формули I), приготовлені у вигляді фармацевтичного препарату, що включає фармацевтично прийнятний інертний наповнювач або носій, і зазначені препарати можна вводити пацієнтові для лікування патологічних станів, включаючи небажану проліферацію клітин, таку як ракові захворювання і/або пухлини (такі як медулобластома, базально-клітинна карцинома і т.п.) і незлоякісні гіперпроліферативні порушення. Один варіант здійснення даного винаходу відноситься до способу придушення синтезу, експресування, продукування і/або активності білка Smo у клітині in vitro або in vivo, що включає взаємодію зазначеної клітини зі сполукою, запропонованою у даному винаході (наприклад, сполукою формули I), або її введення в зазначену клітину. Інший варіант здійснення даного винаходу відноситься до способу діагностики, попередження і/або лікування ослаблень, порушень і/або дисфункцій клітин; гіперпластичних, гіперпроліферативних і/або злоякісних патологічних станів; і/або метастазування пухлинних клітин у ссавця, що характеризуються наявністю і/або експресуванням гену або генного продукту Smo (наприклад, білка Smo), що включає введення ссавцеві терапевтично ефективної кількості засобу, що інгібує або придушує синтез і/або експресування, і/або активність, тобто сполуки, запропонованої у даному винаході (наприклад, сполуки формули I). Тому особливо передбачається, що сполуки формули I, які перешкоджають активності передачі сигналів для Hh, Ptc або Smoothened, також будуть здатні інгібувати проліферацію (або інші біологічні наслідки) у нормальних клітинах і/або клітинах, що мають фенотип втрати функції Patched, фенотип посилення функції Hedgehog, фенотип посилення функції Smoothened або фенотип посилення функції Gli. Таким чином, передбачається, що в деяких варіантах здійснення ці сполуки можуть бути застосовані для інгібування активності Hedgehog у нормальних клітинах, наприклад, у тих, які не містять генетичних мутацій, які активують шлях Hedgehog. У кращих варіантах здійснення сполуки здатні інгібувати щонайменше частину біологічних активностей білків Hedgehog, краще - специфічно в клітинах-мішенях. Таким чином, способи, запропоновані у даному винаході, включають застосування сполук формули I, які перешкоджають інгібуванню шляху передачі сигналу Hedgehog за допомогою Ptc, наприклад, шляхом інгібування активації Smoothened або розташованих у прямому напрямку компонентів шляху передачі сигналу, шляхом регулювання репарації і/або функціональних характеристик всіляких клітин, тканин і органів, включаючи нормальні клітини, тканини і органи, а також ті, які мають фенотип втрати функції Ptc, посилення функції Hedgehog, посилення функції Smoothened або посилення функції Gli. Наприклад, спосіб, запропонований у даному винаході, застосуємо для терапевтичних і косметичних цілей у діапазоні, що включає регуляцію утворення і відновлення нервових тканин, кісток і хрящів, регуляцію сперматогенезу, регуляцію доброякісної гіперплазії передміхурової залози, регуляцію утворення кровоносних судин при ексудативній дегенерації жовтої плями, псоріазу, регуляцію гладких м'язів, регуляцію легень, печінки та інших органів, що утворюються з первинної кишки, регуляцію гематопоетичної функції, регуляцію росту шкіри і волосся і т.п. Крім того, спосіб, запропонований у даному винаході, можна використовувати для клітин у культурі (in vitro), або для клітин цілої тварини (in vivo). У деяких варіантах здійснення сполука формули I може інгібувати активацію шляху Hedgehog шляхом зв'язування з Smoothened або з її розташованими в прямому напрямку білками. Один варіант здійснення даного винаходу відноситься до застосування фармацевтичних препаратів, що включають як активний інгредієнт модулятор шляху передачі сигналу Hedgehog, такий як сполуку формули I, антагоніст Smoothened, такий як описаний у даному винаході, 11 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 приготовлений у кількості, достатній для інгібування in vivo проліферації або інших біологічних наслідків втрати функції Ptc, посилення функції Hedgehog, посилення функції Smoothened або посилення функції Gli. Лікування суб'єктів шляхом введення сполук, запропонованих у даному винаході (наприклад, сполуки формули I), може бути ефективним і для людей, і для тварин. Тварини, для яких застосовується даний винахід, включають і свійських тварина, і домашню худобу, яких тримають як домашніх тварин або для комерційних цілей. Прикладами є собаки, кішки, велика рогата худоба, коні, вівці, свині, кози і лами. Даний винахід також відноситься до способів і сполук, призначених для інгібування активації шляху передачі сигналу Hedgehog, наприклад, для інгібування нормальних, але небажаних станів росту, наприклад, доброякісної гіперплазії передміхурової залози або утворення кровоносних судин при ексудативній дегенерації жовтої плями, обумовленій фізіологічною активацією шляху передачі сигналу Hedgehog, що включає взаємодію клітини зі сполукою формули I, у кількості, достатній для придушення активності Smoothened або придушення активності Gli, наприклад, для обігу або придушення нормального стану росту. Даний винахід відноситься до способів і сполук, призначених для інгібування активації шляху передачі сигналу Hedgehog, наприклад, для інгібування аберантних станів росту, обумовлених такими фенотипами, як фенотип втрати функції Ptc, посилення функції Hedgehog, посилення функції Smoothened або посилення функції Gli, що включає взаємодію клітини зі сполукою формули I у кількості, достатній для придушення активності Smoothened або придушення активності Gli, наприклад, для обігу або придушення аберантного стану росту. Представники сімейства сигнальних молекул Hedgehog опосередковують багато коротко- і довгострокових процесів формування структурної організації при розвитку хребетних. Формування структурної організації являє собою активність, при якій ембріонульні клітини утворюють упорядковані просторові структури диференційованих тканин. Фізична складність вищих організмів виникає під час ембріогенезу внаслідок взаємодії між внутрішньою лінією диференціювання клітин і зовнішніх сигналів, що йдуть до клітини. Індуктивні взаємодії важливі для формування ембріонульної структурної організації при розвитку хребетних від раннього утворення плану організму до утворення системи органів і до утворення різних типів клітин під час диференціації тканини. Вплив взаємодії клітин при розвитку змінюється: клітини, що відповідають, переходять від одного шляху диференціації клітин до іншого шляху індукування клітин, які відрізняються від клітин, що відповідають, і в індукованих, і в неіндукованих станах (індукції). Іноді клітини приводять до диференціації сусідніх клітин, такій як власна (гомогенетична індукція); в інших випадках клітина придушує диференціацію сусідніх клітин, таку як власна. Взаємодії клітин на ранній стадії розвитку можуть бути послідовними, такій, що початкова індукція між двома типами клітин приводить до прогресивної ампліфікації розмаїтості. Крім того, індуктивні взаємодії відбуваються не тільки в ембріонах, але і у зрілих клітинах, і можуть призвести до утворення і підтримування морфологічних характеристик, а також індуціювати диференціацію. Група генів Hedgehog хребетних включає трьох представників, які існують у ссавців, відомих, як Desert (Dhh), Sonic (Shh) і Indian (Ihh) Hedgehogs, які всі кодують секретовані білки. Ці різні білки Hedgehog включають сигнальний пептид, висококонсервативну N-кінцеву ділянку і ще дивергентніший C-кінцевий домен. Біохімічні дослідження показали, що аутопротеолітичне розщеплення попередника білка Hh протікає шляхом первісного утворення складного тіоефірного проміжного продукту, що потім розщеплюється при нуклеофільному заміщенні. Ймовірно, що нуклеофільний реагент являє собою невелику ліпофільну молекулу, що ковалентно зв'язується з C-кінцевим кінцем N-пептиду, приєднуючи його до поверхні клітини. Біологічні прояви є значними. У результаті приєднання на поверхні клітин, що продукують Hedgehog, створюється висока локальна концентрація N-кінцевого пептиду Hedgehog. Цей Nкінцевий пептид, що необхідний і достатній для коротко- і довгострокової активності шляху передачі сигналу Hedgehog. Smoothened (Smo) кодує трансмембранний білок, що містить 1024 амінокислоти, який діє, як приймач сигналу Hedgehog (Hh). Білок Smo містить 7 гідрофобних доменів, що входять у мембрану, позаклітинну область із кінцевими аміногрупами і внутрішньоклітинну область із кінцевими карбоксигрупами. Smo має певну подібність із пов'язаними з білком G рецепторами і найбільш гомологічний сімейству (Fz) серпентинових білків (Alcedo et al. (1996) Cell 86: 221). Неактивним шлях передачі сигналу Hedgehog є тоді, коли трансмембранний білковий рецептор Patched (Ptc) інгібує стабілізацію, фосфорилювання і активність Smoothened (Smo). Фактор транскрипції Gli, розташований у прямому напрямку компонент шляху передачі сигналу Hh, захищається від входу в ядро шляхом взаємодії із цитоплазматичними білками, включаючи 12 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 60 Fused (Fu) і Suppressor fused (Sufu). Внаслідок цього придушується транскрипційна активація генів-мішеней Hedgehog. Активація шляху передачі сигналу ініціюється шляхом зв'язування кожного із трьох лігандів ссавців (Dhh, Shh або Ihh) з Ptc. Зв'язування лігандів за допомогою Hh змінює взаємодію Smo і Ptc, обертаючи придушення Smo, після чого Smo переміщається від внутрішніх структур клітини до плазматичної мембрани. Локалізація Smo на плазматичній мембрані ініціює гени-мішені активації шляху передачі сигналу Hh незалежним від Hh чином. (Zhu et al. (2003) Genes Dev. 17(10):1240) Каскад, активований за допомогою Smo, приводить до переміщення активної форми фактора транскрипції Gli на ядрі. Активація Smo за допомогою переміщеного ядерного Gli активує експресію гену-мішені шляху передачі сигналу Hh, включаючи Wnts, TGF, і Ptc і сам Gli. Підвищені рівні передачі сигналу Hedgehog достатні для ініціювання утворення раку і необхідні для життєздатності пухлини. Ці ракові захворювання включають, але не обмежуються тільки ними, рак передміхурової залози (Karhadkar et al. (2004) Nature 431:707; Sanchez et al. (2004) PNAS 101(34):12561), рак молочної залози (Kubo et al. (2004) Cancer Res. 64(17):6071), медулобластому (Berman et al. (2002) Science 297(5586):1559), базально-клітинну карциному (БКК) (Williams et al. (2003) PNAS 100(8):4616); Xie et al. (1998) Nature 391(6662):90), рак підшлункової залози (Thayer et al. (2003) Nature 425(6960):851; Berman et al. (2003) Nature 425(6960):846), дрібноклітинний рак легень (Watkins et al. (2003) Nature 422(6929):313), гліому (Kinzler et al. (1988) Nature 332:371), ракові захворювання травного тракту (Berman et al. (2003) Nature 425(6960):846) і ракові захворювання стравоходу (Ma et al. (2006) Int J Cancer 118(1):139. Відповідно до викладеного вище, даний винахід також відноситься до способу попередження або лікування будь-яких захворювань або порушень, описаних вище, у суб'єкта, що потребує такого лікування, який включає введення зазначеному суб'єктові терапевтично ефективної кількості сполуки, запропонованої у даному винаході (наприклад, сполуки формули I), або її фармацевтично прийнятної солі. Для кожного із зазначених вище випадків застосування необхідна доза змінюється залежно від шляху введення, конкретного патологічного стану, що піддається лікуванню, і необхідного ефекту. У людей, що страждають синдромом Горліна, спадкоємним синдромом, що характеризується високим ризиком ракових захворювань шкіри і головного мозку, також відомим, як синдром базально-клітинного невуса (СБКН), з високою частотою розвивається базально-клітинна карцинома (БКК) і з меншою частотою інші сóлідні пухлини (наприклад, медулобластоми), внаслідок втрати у зародку функції мутації в Ptch. Для цих пацієнтів, а також для інших пацієнтів, що страждають від БКК без синдрому Горліна, у яких спостерігається соматична втрата функції мутації в Ptch, передбачається відсутність реакції на лікування, пов'язане з лігандами Hedgehog. Однак вони повинні реагувати на інгібітори шляху передачі сигналу Hh, розташовані в прямому напрямку від лігандів Hh, такі як сполуки, запропоновані у даному винаході (наприклад, сполуку формули I), які можуть діяти як інгібітори Smo. Аналогічним чином, інші сóлідні пухлини внаслідок мутації в Patched або Smo не будуть реагувати на пов'язане з лігандом Hh інгіюування, але будуть реагувати на блокування Smo (наприклад, шляхом введення сполук, запропонованих у даному винаході). Введення і фармацевтичні композиції: Даний винахід відноситься до застосування фармацевтичних композицій, що включають сполуки формули (I) при терапевтичному (і, у ще ширшому контексті даного винаходу, профілактичному) лікування порушення (порушень), пов'язаного з Hedgehog. Звичайно сполуки, запропоновані у даному винаході, вводять у терапевтично ефективних кількостях по кожному зі звичайних і застосовних шляхів, відомих у даній галузі техніки, окремо або в комбінації з одним або більшою кількістю терапевтичних засобів. Терапевтично ефективна кількість може значно змінюватися залежно від важкості захворювання, віку і відносного стану здоров'я суб'єкта, активності сполуки, що використовується, та інших факторів. Звичайно вказують, що задовільні результати спостерігаються при системному введенні в добових дозах, що складають приблизно від 0,03 до 2,5 мг/(кг маси тіла). Показана добова доза для більшого ссавця, наприклад, людини, перебуває в діапазоні від приблизно 0,5 до приблизно 100 мг і її звичайно вводять, наприклад, у вигляді розділених доз до чотирьох разів на добу або у формі пролонгованої дії. Придатні для перорального введення разові дозовані форми містять приблизно від 1 до 50 мг активного інгредієнта. Сполуки, запропоновані у даному винаході, можна вводити у вигляді фармацевтичних композицій будь-яким звичайним шляхом, зокрема, ентерально, наприклад, перорально, наприклад, у вигляді таблеток або капсул, або парентерально, наприклад, у вигляді розчинів або суспензій для ін'єкцій, місцево, наприклад, у вигляді лосьйонів, гелів, мазей або кремів, або в назальній формі або у формі супозиторію. До фармацевтичних композицій, що включають 13 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 сполуку, запропонована у даному винаході, у вільній формі або у формі фармацевтично прийнятної солі разом із щонайменше одним фармацевтично прийнятним носієм або розріджувачем можна виготовити звичайним чином за технологіями змішування,гранулювання або нанесення покриттів. Наприклад, композиції для перорального введення можуть являти собою таблетки або желатинові капсули, що включають активний інгредієнт разом з a) розріджувачами, наприклад, лактозою, декстрозою, сахарозою, манітом, сорбітом, целюлозою і/або гліцином; b) речовинами, що змазують, наприклад, діоксидом кремнію, тальком, стеариновою кислотою, її магнієвою або кальцієвою сіллю і/або поліетиленгліколем; для таблеток також з c) сполучними, наприклад, алюмосилікатом магнію, крохмальною пастою, желатином, трагакантовою камеддю, метилцелюлозою, натрієвою сіллю карбоксиметилцелюлози і/або полівінілпіролідоном; при необхідності з d) речовинами, що забезпечують розпад, наприклад, крохмалями, агаром, альгіновою кислотою або її натрієвою сіллю, або шипучими сумішами; і/або e) абсорбентами, барвниками, смаковими добавками і підсолоджувачами. Композиції для ін'єкцій можуть являти собою водні ізотонічні розчини або суспензії, і супозиторії можна приготувати з емульсій або суспензій жирних речовин. Композиції можуть бути стерилізовані і/або можуть містити допоміжні речовини, такі як, консервуючі, стабілізуючі або емульгуючі агенти, що сприяють розчиненню речовини, солі для регулювання осмотичного тиску і/або буфери. Крім того, вони також можуть містити інші терапевтично корисні речовини. Композиції, що підходять для крізьшкірного введення, включають терапевтично ефективну кількість сполуки, запропонованої у даному винаході, з носієм. Кращі носії включають фармакологічно прийнятні розчинники, що усмоктуються, призначені для сприяння проходженню через шкіру пацієнта. Наприклад, крізьшкірні пристрої являють собою пов'язку, що включає виворітний шар, резервуар, що містить сполуку необов'язково з носіями, необов'язково регулюючий швидкість бар'єрний елемент для доставки сполуки в шкіру пацієнта з регульованою і заздалегідь заданою швидкістю протягом тривалого періоду часу і засоби для закріплення пристрою на шкірі. Також можна використовувати матричні крізьшкірні препарати. Композиції, що підходять для місцевого введення, наприклад, на шкіру або в очі, краще являють собою водні розчини, мазі, креми або гелі, добре відомі в даній області техніки. Вони можуть містити солюбілізатори, стабілізатори, засоби, що підсилюють тонічність, буфери і консерванти. Сполуки, запропоновані у даному винаході, можна вводити в терапевтично ефективних кількостях у комбінації з одним або більшою кількістю терапевтичних засобів (фармацевтичні комбінації). Наприклад, синергетичний ефект може проявлятися при використанні імуномодулюючих або протизапальних або інших протипухлинних терапевтичних засобів. Коли сполуки, запропоновані у даному винаході, вводять разом з іншими засобами, зрозуміло, дози сполук, що спільно вводяться, будуть змінюватися залежно від типу використовуваного спільно лікарського засобу, конкретного лікарського засобу, що використовується, який піддається лікуванню патологічного стану і т.п. Даний винахід також відноситься до фармацевтичних комбінацій, наприклад, до набору, що включає: a) перший засіб, що є сполукою, запропонованою у даному винаході, описаною у даному винаході, у вільній формі або у формі фармацевтично прийнятної солі, і b) щонайменше один додатковий засіб. Набір може включати інструкції з його введення. Терміни "спільне введення" або "комбіноване введення" і т.п. при використанні у даному винаході означає введення обраних терапевтичних засобів одному пацієнтові і включає режими лікування, при яких засоби необов'язково вводять по тому самому шляху введення або в один і той самий час. Термін "фармацевтична комбінація" при використанні у даному винаході означає препарат, що отриманий змішуванням або об'єднанням більше одного активного інгредієнта та включає і фіксовані, і нефіксовані комбінації активних інгредієнтів. Термін "фіксована комбінація" означає, що активні інгредієнти, наприклад, сполуку формули I і додатковий засіб, обидва вводять пацієнтові одночасно у вигляді одного препарату або дозованої форми. Термін "нефіксована комбінація" означає, що активні інгредієнти, наприклад, сполуку формули I і додатковий засіб, обидва вводять пацієнтові у вигляді окремих препаратів одночасно, окремо або послідовно без накладення спеціальних обмежень за часом, і при такому введенні в організмі пацієнта створюються терапевтично ефективні рівні цих 2 сполук. Останнє також відноситься до змішаного лікування, наприклад, із введенням 3 або більшої кількості активних інгредієнтів. Способи одержання сполук, запропонованих у даному винаході Типові приклади синтезу сполук, запропонованих у даному винаході, наприклад, сполук формули (I), наведені у даний заявці в розділі "Приклади". 14 UA 100684 C2 5 10 15 20 25 30 35 40 45 50 55 Сполуку, запропонована у даному винаході, можна одержати у вигляді фармацевтично прийнятної солі приєднання з кислотою за реакцією вільної основи сполуки з фармацевтично прийнятною неорганічною або органічною кислотою. Альтернативно, фармацевтично прийнятну сіль приєднання з основою сполуки, запропонованої у даному винаході, можна одержати за реакцією сполуки у формі вільної кислоти з фармацевтично прийнятною неорганічною або органічною основою. Альтернативно, солі сполук, запропонованих у даному винаході, можна одержати з використанням солей вихідних речовин або проміжних продуктів. Вільні кислоти або вільні основи сполук, запропонованих у даному винаході, можна одержати з відповідної молекулярної солі з основою або кислотою відповідно. Наприклад, сполуку, запропонована у даному винаході, у вигляді солі приєднання з кислотою можна перетворити у відповідну вільну основу шляхом обробки придатною основою (наприклад, розчином гідроксида амонію, гідроксида натрію і т.п.). Сполуку, запропонована у даному винаході, у вигляді солі приєднання з основою можна перетворити у відповідну вільну кислоту шляхом обробки придатною кислотою (наприклад, хлористоводневою кислотою і т.п.). Пролікарські похідні сполук, запропонованих у даному винаході, можна одержати за методиками, відомим фахівцям із загальною підготовкою в даній області техніки (додаткові подробиці див., наприклад, у публікації Saulnier et al., (1994), Bioorganic and Medicinal Chemistry Letters, Vol. 4, p. 1985). Похідні сполук, що містять захисні групи, запропоновані у даному винаході, можна одержати за методиками, відомим фахівцям із загальною підготовкою в даній галузі техніки. Докладний опис методик, що застосовуються для введення захисних груп і їх видалення, наведено в публікації T. W. Greene, "Protecting Groups in Organic Chemistry", 3rd edition, John Wiley and Sons, Inc., 1999. Сполуки, запропоновані у даному винаході, можна легко одержати або утворити при здійсненні способу, запропонованого у даному винаході, у вигляді сольватів (наприклад, гідратів). Гідрати сполук, запропонованих у даному винаході, можна легко одержати шляхом перекристалізації з водної/органічної суміші розчинників з використанням таких органічних розчинників, як діоксан, тетрагідрофуран або метанол. Сполуки, запропоновані у даному винаході, можна одержати у вигляді своїх індивідуальних стереоізомерів за реакцією рацемічної суміші сполуки з оптично активним поділяючим реагентом з утворенням пари диастереоізомерних сполук, з наступним поділом диастереоізомерів і виділенням оптично чистих енантіомерів. Хоча поділ енантіомерів можна виконувати з використанням ковалентних диастереоізомерних похідних сполук, запропонованих у даному винаході, кращими є дисоціюючі комплекси (наприклад, кристалічні диастереоізомерні солі). Диастереоізомери мають неоднакові фізичні характеристики (наприклад, температурами кипіння, температурами плавлення, розчинностями, реакційною здатністю і т.п.) і їх можна легко розділити з урахуванням цих розходжень. Диастереоізомери можна розділити за допомогою хроматографії, або, краще за методиками поділу/виділення, заснованим на розходженні розчинностей. Потім виділяють оптично чистий енантіомер разом з поділяючим реагентом за допомогою будь-якої придатної методики, що не приводить до рацемізації. Більш докладний опис методик, що застосовуються для виділення стереоізомерів сполук з їх рацемічної суміші наведено в публікації Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates і Resolutions", John Wiley And Sons, Inc., 1981. Приклади Даний винахід додатково пояснюється, але не обмежується наведеними нижче типовими прикладами, які призначені для ілюстрації даного винаходу, і їх не слід розглядати, як обмежуючі. Структуру кінцевих продуктів, описаних у даному винаході, підтверджують за допомогою стандартних аналітичних методик, наприклад, за допомогою спектрометричних і спектроскопічних методик (наприклад, МС і ЯМР). Використані абревіатури є такими, як прийнято в даній галузі техніки. Очищення сполук проводять за допомогою стандартних методик, наприклад, за допомогою кристалізації, флеш-хроматографії або ВЕЖХ зі зверненою фазою. У прикладах використовують наступні абревіатури: Список Абревіатур БІНАФ (±)-(1,1'-БІНАФталин-2-2’-диил)біс(дифенілфосфин) ДХМ Дихлорметан ДИЕА Диетиламін ДІПЕА Диізопропілетиламін ДМФ Диметилформамід 15 UA 100684 C2 5 ВЕРХ Високоефективна рідинна хроматографія МС ВРЗ Мас-спектрометрія високої роздільної здатності HBTU O-Бензотриазол-1-іл-N,N,N',N'-тетраметилуронійгексафторфосфат HOBt 1-Гідрокси-1H-бензотриазол РХ/МС Рідинна хроматографія/мас-спектрометрія NMM N-метилморфолін NMP N-метилпіролідин КТ Кімнатна температура ТГФ Тетрагідрофуран Синтез сполук Фталазини Як показано на схемі 1, сполуки формули Ia, b, c можна одержати або за шляхом A, тобто шляхом заміщення хлору в проміжному продукті типу II на заміщену аміногрупу, або із проміжного продукту типу III з використанням шляху B (пряме нуклеофільне заміщення) або шляху C (за умов амінування Бухвальда). Схема 1. Синтез проміжних продуктів: 1-Хлор-4-(3,5-дихлорбензил)-фталазин (сполука 1) 10 N N Cl Cl Cl 15 20 У круглодонній колбі об'ємом 50 мл 4-(3,5-дихлорбензил)-4-фталазин-1-он (200 мг, 0,655 ммоля, 1 екв.) розчиняють у дихлоретані (5 мл) і додають ДИЕА (101 мкл, 0,721 ммоля, 1,1 екв.), потім повільно додають POCl3 (67,9 мкл, 0,721 ммоля, 1,1 екв.). Реакційну суміш перемішують і кип'ятять зі зворотним холодильником при 60°C протягом 12 год., потім розчин охолоджують льодом і обробляють насиченим розчином бікарбонату натрію (5 мл). Додають дихлорметан (210 мл) і суміш промивають водою (10 мл). Об'єднані органічні фракції сушать над сульфатом магнію і концентрують при зниженому тиску. Залишок розтирають із етилацетатом і сушать у високому вакуумі і одержують продукт у вигляді білої порошкоподібної речовини (222 мг, вихід 44 %). 1-(5-(Диметилфосфорил)піридин-2-іл)піперазин (сполука 2) 16 UA 100684 C2 N O 5 10 15 N P NH До розчину трет-бутил-4-(5-бромпіридин-2-іл)піперазин-1-карбоксилату (250 мг, 0,730 ммоля) в 2,5 мл безводного ТГФ при -78ºC в атмосфері аргону додають 2,5 M розчин нбутиллітію (320 мкл, 0,80 ммоля). Після перемішування протягом 45 хв. до реакційної суміші додають диметилфосфонійхлорид (164,4 мг, 1,46 ммоля) в 1 мл безводного ТГФ. Реакційну суміш нагрівають при -30ºC протягом 3 год. Реакцію зупиняють насиченим водним розчином хлориду амонію і суміш піддають розподілу між ДХМ і розсолом. Органічний шар сушать над Na2SO4 і концентрують і одержують неочищену речовину. Отриману тверду речовину очищають за допомогою флеш-хроматографії на силікагелі, елююванням сумішшю 20-100 % EtOAc:гептан. Фракції, що містять бажаний продукт, поєднують і концентрують і одержують майже білу тверду речовину (100 мг, вихід 40,3 %). Бажану сполуку із захисною групою Boc розчиняють в 2-PrOH (1 мл) і додають 4 н. розчин HCl. Реакційну суміш нагрівають при 70 ºC протягом 30 хв. і концентрують і одержують бажану сполуку у вигляді гідрохлориду. МС (m/z, MH+): виміряно 240,2; розраховано 240,3 2,2,2-Трифтор-1-(6-(піперазин-1-іл)піридин-3-іл)етанол (сполука 3) F F F N N NH HO 20 25 30 Трифторацетальдегідгідрат (1,7 г, 14,6 ммоля) при 95ºC при перемішуванні по краплях додають до суміші, що складається з пентаоксиду фосфору (1 г, 7,3 ммоля) і 4 мл концентрованої сірчаної кислоти. Свіжоотриманий газоподібний трифторацетальдегід збирають за допомогою уловлювача, наповненого твердим діоксидом вуглецю, і при -78ºC в атмосфері аргону по краплях додають до розчину трет-бутил-4-(5-бромпіридин-2-іл)піперазин-1карбоксилату (1 г, 2,92 ммоля) у ТГФ і 2,5 M розчину н-бутиллітію в гексанах (1,3 мл, 3,2 ммоля). Після додавання реакційну суміш нагрівають до кімнатної температури і перемішують протягом 2 год. Реакцію зупиняють при -78 ºC насиченим водним розчином хлориду амонію і суміш піддають розподілу між ДХМ і розсолом. Органічний шар сушать над Na 2SO4 і концентрують і одержують коричневу тверду речовину. Неочищену речовину очищають за допомогою флешхроматографії на силікагелі, елююванням сумішшю 10-80 % EtOAc:гептан. Фракції, що містять бажаний продукт, поєднують і концентрують і одержують жовту липку тверду речовину (450 мг, вихід 42,6 %). Бажану сполуку із захисною групою Boc (380 мг, 1,1 ммоля) перемішують в 20 % розчині ТФК (трифтороцтова кислота) у ДХМ (5 мл) протягом 10 хв. Реакційну суміш концентрують і одержують бажаний продукт у вигляді його солі із ТФК (260 мг, вихід 95 %). МС (m/z, MH+): виміряно 262,2; розраховано 262,25 1,1,1,3,3,3-Гексафтор-2-(6-(піперазин-1-іл)піридин-3-іл)пропан-2-ол (сполука 4) F F F N N F NH OH F F 35 40 45 Газоподібний трифторацетальдегід збирають за допомогою уловлювача, наповненого твердим діоксидом вуглецю, і при -78ºC в атмосфері аргону по краплях додають до розчину трет-бутилового ефіру 4-(5-бром-піридин-2-іл)-піперазин-1-карбонової кислоти (1 г, 2,92 ммоля) у ТГФ і 2,5 M розчину н-бутиллітію в гексанах (1,29 мл, 3,2 ммоля). Після додавання реакційну суміш нагрівають до кімнатної температури і перемішують протягом 1 год. Реакцію зупиняють при -78ºC насиченим водним розчином хлориду амонію і суміш піддають розподілу між ДХМ і розсолом. Органічний шар сушать над Na2SO4 і концентрують і одержують ясно-жовту тверду речовину. Неочищену речовину очищають за допомогою флеш-хроматографії на силікагелі, елююванням сумішшю 10-80 % EtOAc:гептан. Фракції, що містять бажаний продукт, поєднують і концентрують і одержують безбарвну липку тверду речовину (450 мг, вихід 35,9 %). Бажану сполуку із захисною групою Boc (200 мг, 0,466 ммоля) перемішують протягом 10 хв в 50 % розчині ТФК у ДХМ (5 мл). Реакційну суміш концентрують і одержують бажаний продукт у вигляді його солі із ТФК (150 мг, вихід 98 %). МС (m/z, MH+): виміряно 330,0; розраховано 329,25 3-(6-(Піперазин-1-іл)піридин-3-іл)оксетан-3-ол (сполука 5) 17 UA 100684 C2 N N O NH OH 5 10 15 До розчину трет-бутилового ефіру 4-(5-бром-піридин-2-іл)-піперазин-1-карбонової кислоти (250 мг, 0,73 ммоля) в 3,5 мл безводного ТГФ при -78ºC в атмосфері аргону додають 1,6 M розчин н-бутиллітію (500 мкл, 0,80 ммоля). Після перемішування протягом 45 хв. до реакційної суміші додають оксетан-3-он (131 мг, 1,82 ммоля) в 200 мкл ДХМ. Реакційну суміш перемішують при -78ºC протягом 2 год. і при кімнатній температурі протягом 16 год. Реакцію зупиняють насиченим водним розчином хлориду амонію і суміш піддають розподілу між ДХМ і розсолом. Органічний шар сушать над Na2SO4 і концентрують і одержують неочищену речовину. Отриману тверду речовину очищають за допомогою флеш-хроматографії на силікагелі, елююванням сумішшю 20-100 % EtOAc:гептан. Фракції, що містять бажаний продукт, поєднують і концентрують і одержують майже білу тверду речовину (80 мг, вихід 32,7 %). Бажану сполуку із захисною групою Boc (140 мг, 0,417 ммоля) розчиняють у ДХМ і до суміші додають лутидин (194 мкл, 1,67 ммоля). Реакційну суміш охолоджують до 0ºC, до неї додають триметилсилілтрифторметансульфонат (1,25 ммоля, 228 мкл) і перемішують при 0ºC протягом 2 год. Реакційну суміш виливають на лід і піддають розподілу між ДХМ і водою. Органічний шар сушать над Na2SO4 і концентрують і одержують коричневу маслянисту тверду речовину (70 мг, вихід 71 %). МС (m/z, MH+): виміряно 236,4; розраховано 236,3 6-((S)-3-Метилпіперазин-1-іл)-нікотинонітрил (сполука 6) N N 20 25 30 NH N Триетиламін (4,13 г, 3 мл, 40,8 ммоля, 4 екв.) додають до розчину 6-хлорнікотинонітрилу (1,38 г, 10 ммолей, 1 екв.) і (S)-2-метилпіперазину (1,00 г, 10 ммолей, 1 екв.) у ДМФ (15 мл) і отриманий розчин перемішують при КТ протягом 14 год. У ході реакції утвориться білий осад триетиламінгідрохлориду. Додають воду (15 мл) і EtOAc (100 мл), органічний шар відокремлюють, сушать над сульфатом натрію і концентрують при зниженому тиску і одержують білий залишок. Потім тверду речовину сушать у високому вакуумі і одержують бажаний продукт у вигляді білої твердої речовини (1,4 г, 69 %). 1 H ЯМР (400 МГц, хлороформ-d) част./млн 8,38 (s, 1H), 7,58 (d, J=9,60 Гц, 1H), 6,59 (d, J=9,09 Гц, 1H), 4,19-4,31 (m, 2H), 3,08-3,15 (m, 1H), 2,92-3,04 (m, 1H), 2,81-2,91 (m, 2H), 2,57-2,65 (m, 1H), 1,15 (d, J=6,32 Гц, 3H). 6-((R)-3-Метилпіперазин-1-іл)-нікотинонітрил (сполука 7) N N 35 40 N NH Триетиламін (5,51 г, 4 мл, 54,6 ммоля, 2,7 екв.) додають до розчину 6-хлорнікотинонітрилу (2,76 г, 20 ммолей, 1 екв.) і (R)-2-метилпіперазину (2,00 г, 20 ммолей, 1 екв.) у ДМФ (15 мл) і отриманий розчин перемішують при КТ протягом 36 год. У ході реакції утвориться білий осад триетиламінгідрохлориду. Додають воду (15 мл) і EtOAc (100 мл), органічний шар відокремлюють, сушать над сульфатом натрію і концентрують при зниженому тиску і одержують білий залишок. Потім тверду речовину сушать у високому вакуумі і одержують бажаний продукт у вигляді білої твердої речовини (2,3 г, 59 %). 1 H ЯМР (400 МГц, хлороформ-d) част./млн 8,32 (d, J=2,40 Гц, 1H), 7,52 (dd, J=9,09, 2,27 Гц, 1H), 6,52 (d, J=8,97 Гц, 1H), 4,14-4,24 (m, 2H), 3,01-3,07 (m, 1H), 2,72-2,94 (m, 3H), 2,52 (dd, J=12,76, 10,36 Гц, 1H), 1,07 (d, J=6,32 Гц, 3H). 6-((2R, 5S)-2,5-Диметилпіперазин-1-іл)-нікотинонітрил (сполука 8) N N 45 N NH (2S, 5R)-2,5-Диметилпіперазин (200 мг, 1,75 ммоля), 6-хлорнікотинонітрил (1,75 ммоля) і триетиламін (5,25 ммоля) поєднують в 0,875 M розчині 1-метил-2-піролідинону. Реакційну суміш нагрівають за допомогою мікрохвильового випромінювання при 150 °C протягом 30 хв. Суміш піддають розподілу між етилацетатом і водою, органічну фазу збирають. Водний шар повторно 18 UA 100684 C2 5 промивають етилацетатом і органічні фази поєднують. Сушать над сульфатом натрію, фільтрують і концентрують. Очищення за допомогою препаративної ВЕРХ дають бажану сполуку (вихід 9 %). 1 H ЯМР (400 МГц, хлороформ-d) част./млн 8,32 (d, J=2,15 Гц, 1H), 7,51 (dd, J=9,09, 2,40 Гц, 1H), 6,46 (d, J=9,09 Гц, 1H), 4,24-4,37 (m, 1H), 3,87 (d, J=10,99 Гц, 1H), 3,19-3,36 (m, 3H), 2,61 (dd, J=13,07, 3,09 Гц, 1H), 1,48 (br. s., 1H), 1,20 (d, J=6,69 Гц, 3H), 1,12 (d, J=6,82 Гц, 3H). 1-Бензил-4-піперазин-1-ілфталазин (сполука 9) N N HN 10 15 У посудину для мікрохвильового реактора додають 1-бензил-4-хлорфталазин (1,06 г, 4,18 ммоля) і піперазин (1,82 г, 20,9 ммоля), потім NMP (5 мл) і триетиламін (6,62 мл, 12,5 ммоля). Посудину герметично закривають і опромінюють у мікрохвильовому реакторі при 180°C (умови високої потужності) протягом 30 хв. Додають дихлорметан (10 мл) і одержують осад, що промивають додатковою кількістю дихлорметану і сушать при зниженому тиску і одержують продукт у вигляді білої порошкоподібної речовини (745 мг, вихід 58 %). 1-Бензил-4-[1,4]-диазепам-1-ілфталазин (сполука 10) HN 20 N N N N У посудину для мікрохвильового реактора додають 1-бензил-4-хлорфталазин (1,11 г, 4,35 ммоля) і гомопіперазин (2,20 г, 21,7 ммоля), потім NMP (5 мл) і триетиламін (1,84 мл, 13,1 ммоля). Посудину герметично закривають і опромінюють у мікрохвильовому реакторі при 180°C (умови високої потужності) протягом 30 хв. Додають дихлорметан і суміш промивають водою. Об'єднані органічні фракції сушать над сульфатом магнію і випаровують при зниженому тиску і одержують бажану сполуку у вигляді жовтого олії (640 мг, вихід 41,5 %). 1-Бензил-4-((R)-3-метилпіперазин-1-іл)-фталазин (сполука 11) N N HN 25 30 35 N У посудині для мікрохвильового реактора твердий Na2CO3 (200 мг, 1,9 ммоля, 1,9 екв.) додають до розчину 1-бензил-4-хлорфталазину (250 мг, 0,98 ммоля, 1 екв.) і (R)-2метилпіперазину (400 мг, 4,0 ммоля, 4,0 екв.) у діоксані (5 мл). Посудину герметично закривають і опромінюють у мікрохвильовому реакторі при 150°C (умови високої потужності) протягом 30 хв. Реакційну суміш фільтрують і концентрують, потім розбавляють за допомогою EtOAc (50 мл) і водою (15 мл). Органічну фракцію промивають водою і потім розсолом, потім сушать над сульфатом натрію. Розчинник випаровують при зниженому тиску і одержують бажану сполуку у вигляді білої твердої речовини (180 мг, вихід 58 %). 1 H ЯМР (400 МГц, хлороформ-d) част./млн 8,08 (d, J=7,07 Гц, 1H) 8,00 (d, J=7,71 Гц, 1H) 7,69-7,79 (m, 2H) 7,34-7,39 (m, 2H) 7,25-7,32 (m, 2H) 7,20 (d, J=7,20 Гц, 1H) 4,61-4,65 (m, 2H) 3,76-3,82 (m, 2H) 3,13-3,30 (m, 4H) 2,85 (dd, J=12,63, 10,23 Гц, 1H) 1,17 (d, J=6,32 Гц, 3H) МС (m/z, MH+): виміряно 319,1 1-Бензил-4-((S)-3-метилпіперазин-1-іл)-фталазин (сполука 12) N N HN 40 N Твердий Na2CO3 (400 мг, 3,8 ммоля, 3,8 екв.) додають до розчину 1-бензил-4хлорфталазину (250 мг, 0,98 ммоля, 1 екв.) і (S)-2-метилпіперазину (400 мг, 4,0 ммоля, 4,0 екв.) у діоксані (5 мл). Отриману суспензію нагрівають при 100°C протягом 48 год. Реакційну суміш концентрують, додають EtOAc (50 мл) і воду (15 мл). Органічну фракцію промивають водою і потім розсолом, потім сушать над сульфатом натрію. Розчинник випаровують при зниженому тиску і одержують бажану сполуку у вигляді білої твердої речовини (200 мг, вихід 64 %). 19 UA 100684 C2 H ЯМР (400 МГц, хлороформ-d) част./млн 7,97 (d, J=7,07 Гц, 1H) 7,89 (d, J=8,21 Гц, 1H) 7,58-7,68 (m, 2H) 7,24-7,28 (m, 2H) 7,14-7,22 (m, 2H) 7,06-7,11 (m, 1H) 3,69 (d, J=12,38 Гц, 2H) 3,61 (s, 2H) 3,03-3,20 (m, 4H) 2,74 (dd, J=12,63, 10,23 Гц, 1H) 1,07 (d, J=6,32 Гц, 3H) МС (m/z, MH+): виміряно 319,1 2-Хлорпіримідин-5-карбонітрил (сполука 13) 1 5 N N Cl N 10 15 (Одержують відповідно до методики, описаної в публікації: Organic Synthesis, Vol 4, p. 182.) В 3-горлечкову круглодонну колбу поміщають 5,4 мл концентрованої HCl (65 ммолей). Розчин охолоджують до 0°C і порціями додають 2-аміно-5-ціанопіримідин (515 мг, 4,28 ммоля) і перемішують до одержання гомогенного розчину. Потім розчин охолоджують до -15°C. До реакційної колби приєднують краплинну лійку об'ємом 100 мл і потім при перемішуванні протягом 20 хв по краплях додають охолоджений розчин NaNO 2 (592 мг, 8,6 ммоля) в 5 мл води. (Температуру підтримують рівною від -15 до -10°C.) Розчин перемішують протягом ще 1 год. і температурі дають піднятися до -5°C. Потім суміш обережно нейтралізують 30 % розчином NaOH до pH рівного приблизно 7, стежачи за тим, щоб температура не піднімалася вище 0°C. Розчин екстрагують за допомогою EtOAc (320 мл), сушать над MgSO4, фільтрують і випаровують і одержують жовту тверду речовину (159 мг, вихід 21,3 %). 1-(6-Хлорпіридин-3-іл)піролідин-2-он (сполука 14) O N N 20 25 30 Cl У посудині із кришкою, що загвинчується, ємністю в 2 драхми до розчину 2-хлор-5йодпіридину (200 мг, 0,84 ммоля) в 4 мл безводного діоксану додають 2-піролідинон (60,8 мкл, 0,79 ммоля), K2CO3 (415,6 мг, 3 ммоля), CuI (15,9 мг, 0,084 ммоля) і N, N'-диметил-1,2етандиамін (11,8 мкл, 0,083 ммоля). Посудину вакуумують і продувають азотом. Реакційну суміш кип'ятять зі зворотним холодильником протягом 18 год. Реакційну суміш фільтрують крізь целіт і фільтрат концентрують і одержують неочищену речовину. Суміш очищають за допомогою флеш-хроматографії на силікагелі, елююванням сумішшю 50-100 % EtOAc:гептан. Фракції, що містять бажаний продукт, поєднують і концентрують і одержують бажаний продукт у вигляді білої твердої речовини (160 мг, вихід: 97,4 %). МС (m/z, MH+): виміряно 197,1; розраховано 197,64 1-(6-Хлорпіридин-3-іл)циклопропанол (сполука 15) OH N Cl 35 40 До суспензії метил-6-хлорпіридин-3-карбоксилату (1 г, 5,83 ммоля) в 17 мл безводного ефіру додають 3 M розчин етилмагнійброміду (8,5 мл, 26 ммолей) в ефірі і перемішують протягом 1 год., потім до реакційної суміші додають ізопропоксид титану (1,73 мл, 5,84 ммоля). Суміш перемішують в атмосфері аргону протягом 16 год. Реакцію зупиняють насиченим водним розчином хлориду амонію і значення pH водного середовища доводять до 3 1 н. розчином HCl. Суміш піддають розподілу між ДХМ і розсолом. Органічний шар сушать над Na 2SO4 і концентрують і одержують неочищену речовину. Отриману тверду речовину очищають за допомогою флеш-хроматографії на силікагелі, елююванням сумішшю 10-80 % EtOAc:гептан. Фракції, що містять бажаний продукт, поєднують і концентрують і одержують коричневу маслянисту тверду речовину (180 мг, вихід: 18,2 %). МС (m/z, MH+): виміряно 170,1; розраховано 170,61 2-(4-трет-Бутоксикарбонілпіперазин-1-іл)-піримідин-5-карбонова кислота (сполука 16) HO O N N O 45 N N O У суху 3-горлечкову круглодонну колбу об'ємом 250 мл в атмосфері N 2 додають 5-бром-2-(4Boc-піперазин-1-іл)-піримідин (1,00 г, 2,91 ммоля), потім ТГФ (20,0 мл). У колбу вставляють низькотемпературний термометр. Колбу витримують у лазні із твердим діоксидом вуглецю протягом 15 хв. до досягнення внутрішньої температури рівної -74°C і по краплях додають нBuLi (2,92 мол, 7,29 ммоля). Реакційну суміш перемішують протягом 1,5 год. і потім крізь 20 UA 100684 C2 5 реакційну суміш пропускають CO2 протягом 45 хв., підтримуючи внутрішню температуру рівною -70 °C. Потім колбу витягають із лазні і реакційній суміші дають нагрітися до 0°C, потім реакцію зупиняють водою. Органічну фазу екстрагують дихлорметаном. Об'єднані органічні шари промивають розсолом і сушать над Na2SO4, фільтрують і концентрують при зниженому тиску. Неочищену сполуку розтирають із дихлорметаном і метанолом і одержують невелику кількість чистого продукту. Неочищену речовину очищають за допомогою флеш-хроматографії на силікагелі (0-20 % метанолу в CH2Cl2) і одержують бажану сполуку (235 мг, вихід 27 %). Метиловий 2-(4-трет-бутоксикарбонілпіперазин-1-іл)-піримідин-5-карбонової кислоти (сполука 17) O O N N N 10 15 O O N У висушеній у сушильній шафі круглодонній колбі до 2-(4-трет-бутоксикарбонілпіперазин-1іл)-піримідин-5-карбоновій кислоті (150 мг, 0,486 ммоля) в атмосфері азоту додають метанол (1,0 мл) і бензол (3,7 мл) і реакційну суміш перемішують протягом 10 хв. Додають триметилсилілдиазометан (0,34 мл, 0,678 ммоля) і реакційну суміш перемішують протягом 1 год. Потім додають крижану оцтову кислоту (0,05 мл) до зникнення жовтого фарбування. Реакційну суміш концентрують при зниженому тиску і випаровують разом з бензолом. Залишок сушать у високому вакуумі і одержують бажану сполуку у вигляді білої твердої речовини (155 мг, вихід 99 %). Метиловий ефір 2-піперазин-1-ілпіримідин-5-карбонової кислоти (сполука 18) O N O N NH .ТФК N 20 25 Метиловий ефір 2-(4-трет-бутоксикарбонілпіперазин-1-іл)-піримідин-5-карбонової кислоти (140 мг, 0,434 ммоля) в атмосфері N2 розчиняють у дихлорметані (3,0 мл). Додають трифтороцтову кислоту (0,83 мл, 10,85 ммоля) і реакційну суміш перемішують протягом 2 год. Реакційну суміш концентрують при зниженому тиску і кілька разів випаровують разом з дихлорметаном. Залишок сушать у високому вакуумі і одержують бажану сполуку у вигляді його солі із ТФК (130 мг, вихід 90 %). Метиловий ефір 6-гідроксиметилнікотинової кислоти (сполука 19) O O N S O O O 30 35 40 45 У висушену в сушильній шафі круглодонну колбу в атмосфері N2 додають метил-6(гідроксиметил)нікотинат (500 мг, 2,99 ммоля), потім дихлорметан (20,0 мл). Додають триетиламін (2,85 мл, 20,93 ммоля) і потім колбу витримують у лазні з льодом протягом 50 хв. По краплях додають метансульфонілхлорид (0,81 мл, 10,47 ммоля). Реакційну суміш перемішують при зниженій температурі протягом 45 хв. і потім перемішують при кімнатній температурі протягом ночі. Потім реакційну суміш виливають в охолоджену льодом воду. Органічні фази екстрагують дихлорметаном. Об'єднані органічні шари промивають розсолом і сушать над Na2SO4, фільтрують і концентрують при зниженому тиску. Потім залишок у високому вакуумі і одержують бажану сполуку (365 мг, вихід 50 %). Синтез сполук прикладів 1-38 за шляхом A. Загальна методика приєднання амінів до 1-хлорфталазинів У посудину для мікрохвильового реактора, оснащений мішалкою, додають необхідні 1хлорфталазин (2 ммоля, 1 екв.) і амін (2,6 ммоля, 1,3 екв.). Додають NMP (3 мл), потім триетиламін (3,2 мл, 6 ммолей, 3 екв.). Посудину герметично закривають і опромінюють у мікрохвильовому реакторі при 180°C (умови високої потужності) протягом 30 хв. Потім до реакційної суміші додають воду (50 мл) і одержують осад, що відокремлюють фільтруванням, промивають додатковою кількістю холодної води і потім сушать у вакуумі. Потім продукти очищають або за допомогою флеш-хроматографії на силікагелі або за допомогою ВЕРХ зі зверненою фазою. Приклад 1: 6-[4-(4-Бензилфталазин-1-іл)-піперазин-1-іл]-нікотинонітрил 21 UA 100684 C2 N N 5 10 N N N N Відповідно до загальної методики реакція 1-бензил-4-хлорфталазину (515 мг, 2,02 ммоля, 1 екв.) і 6-піперазинонікотинонітрилу (495 мг, 2,63 ммоля, 1,3 екв.) дає 430 мг бажаного продукту у вигляді білої твердої речовини (вихід 51 %). 1 H ЯМР (400 МГц, CDCl3): =3,65 (m, 4H), 3,96 (m, 4H), 4,64 (s, 2H), 6,71 (d, J=9 Гц, 1H), 7,19 (t, J=7 Гц, 1H), 7,27 (t, J=7 Гц, 2H), 7,33-7,36 (m, 2H), 7,67 (dd, J=9, 2 Гц, 1H), 7,73-7,82 (m, 2H), 8,02-8,12 (m, 2H), 8,45 (d, J=2,53 Гц, 1H). МС-ВР (m/z, MH+): виміряно 407,1987 Приклади 2-38 і 106-119: У представленій нижче таблиці (таблиця 1) наведені приклади сполук, отриманих за шляхом A, за методикою, аналогічною описаній вище. ТАБЛИЦЯ 1 Приклад Структура N F F 2 МС [m/z; M+1] N N N N 450 F N N 3 N N N 464 F F F N N N N N N 4 408 N O N N N N 5 453 O N N N N 6 382 N N N N N 7 437 N N N N 8 438 N N N N N 9 Cl 506 Cl N N N N 10 452 N N N N N 11 396 N 22 UA 100684 C2 ТАБЛИЦЯ 1 Приклад Структура МС [m/z; M+1] N N N 12 380 N N N 13 381 N N N N 14 395 N N N 15 N N 450 N F F F O O N N 16 N 425 N N N 17 N N N 498 F F Cl F N N N N N 18 432 N N N 19 N N 421 N N N N N N 20 384 N N N N N N N 21 383 N N N N N N 22 397 N N N N N N 23 383 N N N N N N 24 382 23 UA 100684 C2 ТАБЛИЦЯ 1 Приклад Структура N N N 25 МС [m/z; M+1] N N 383 N N N N N N 26 383 N N N 27 N N 28 N N 409 N N 410 N N N N N 29 424 N Cl N N 30 Cl N N 450 N N 31 N N 32 N N 431 N N 432 N N N N N 33 446 N N N 34 431 N N N N 35 446 N N N N N 36 N 432 N N 24 UA 100684 C2 ТАБЛИЦЯ 1 Приклад Структура МС [m/z; M+1] N N N N N 37 382 N N N N N N 38 395 N N 106 381 O N N N P N N 107 458 O N N N N 108 395 N HO N N N N 109 480 F F 110 F F F F HO F F F N N N N N OH N N N N N 111 548 454 O F F F N N N N 112 438 N H N N HN N 113 419 H N N N N 114 420 N O N N N 115 438 O N N N N 116 405 25 UA 100684 C2 ТАБЛИЦЯ 1 Приклад Структура N 117 N N N N N N N N N N N 118 421 N N N N 119 МС [m/z; M+1] 421 N N 435 Перетворення сполуки прикладу 1 у сполуки наведених нижче прикладів шляхом приєднання по Гриньяру: Приклад 120: 2-(6-(4-(4-Бензилфталазин-1-іл)піперазин-1-іл)піридин-3-іл)пропан-2-амін N N N N N NH2 5 10 15 20 У посудину об'ємом 40 мл додають гідрат хлориду церію (III) (454,8 мг, 1,84 ммоля) і нагрівають у високому вакуумі при 150 C протягом 2 год. Гарячу посудину заповнюють азотом і охолоджують до кімнатної температури, потім додають 2 мл ТГФ. Суміш перемішують протягом 2 год. і потім при -78°C додають 3 M розчин метилмагнійброміду в ТГФ (0,62 мл, 1,9 ммоля). Реакційну суміш перемішують в атмосфері аргону протягом 30 хв. До суміші, що містить MeCeCl2, додають розчин сполуки 1 (250 мг, 0,62 ммоля) у ТГФ (1 мл). Реакційну суміш обережно нагрівають до кімнатної температури і перемішування продовжують протягом ночі. Суміш фільтрують крізь целіт і випаровують і одержують неочищену речовину. Неочищену речовину очищають за допомогою напівпрепаративної ВЕРХ, елююванням сумішшю 10-100 % ацетонітрил:вода (обидві рухливі фази модифіковані за допомогою 3 % н-PrOH). Фракції, що містять бажаний продукт, поєднують і сушать виморожуванням і одержують білу тверду речовину (100 мг, вихід: 37,2 %). МС-ВР (m/z, MH+): виміряно 439,2618; розраховано 439,2610 Перетворення сполуки прикладу 120 у сполуки наведених нижче прикладів шляхом амідування: Приклад 121: N-(2-(6-(4-(4-Бензилфталазин-1-іл)піперазин-1-іл)піридин-3-іл)пропан-2-іл)-2метоксиацетамід N N N N N NH O O 25 30 До розчину сполуки прикладу 120 (70 мг, 0,16 ммоля) в 2 мл безводного ДХМ додають ЕДХ·HCl (ЕДХ - 1-етилен-3-(3-диметиламінопропіл)карбодиімід) (31 мг, 0,16 ммоля), каталітична кількість ДМАП (диметиламінопіридин) и ТЕА (триетиламін) (44 мкл, 0,32 ммоля). Реакційну суміш перемішують при кімнатній температурі протягом 16 год. Суміш концентрують і неочищену речовину очищають за допомогою напівпрепаративної ВЕРХ, елююванням 10-100 % ацетонітрилом у воді (обидві рухливі фази модифіковані за допомогою 3 % н-PrOH). Фракції, що містять бажаний продукт, об'єднують і сушать виморожуванням і отримують білу тверду речовину (60 мг, вихід: 74,1 %). МС-ВР (m/z, MH+): виміряно 511,2810; розраховано 511,2821 Приклади 122-123: У представленій нижче таблиці (таблиця 1a) наведені приклади сполук, отриманих шляхом амідування за методикою, аналогічною описаній вище. 35 26 UA 100684 C2 ТАБЛИЦЯ 1a O O N HN 122 N N N N 425 O O 123 HN N N N N 573 N Перетворення сполуки прикладу 115 у сполуки наведених нижче прикладів шляхом приєднання по Гриньяру: Приклад 124: 2-{4-[1-4-Бензилфталазин-1-іл]-піперидин-4-іл}-феніл}-пропан-2-ол HO N N N 5 10 15 До розчину сполуки прикладу 115 (100 мг, 0,127 ммоля) у ТГФ (5 мл) при -78 °C по краплях додають MeMgBr (85 мкл, 3,0 M розчин в Et2O, 0,5 ммоля). Реакційну суміш перемішують при КТ протягом 4 год. і реакцію зупиняють насиченим водним розчином NH 4Cl (3 мл). Додатково додають воду і органічний шар екстрагують за допомогою EtOAc. Об'єднані органічні шари промивають водним розчином NaHCO3 і концентрують. Очищення неочищеного продукту за допомогою ВЕРХ із детектуванням при довжині хвилі, рівній 220 нм, з використанням ацетонітрилу у воді (від 10 до 100 % з 3 % 1-пропанолу) дає бажаний продукт у вигляді пофарбованої в жовтий колір порошкоподібної речовини (54 мг, 54 %). 1 H ЯМР (400 МГц, ДМСО-d6): =8,16 (m, 2H), 7,89 (m, 2H), 7,16-7,44 (m, 9H), 4,59 (s, 2H), 3,89 (d, J=12,6 Гц, 2H), 3,11 (t, J=11,7 Гц, 2H), 2,78 (m, 1H), 2,01 (m, 4H), 1,42 (s, 6H). МС-ВР (m/z, MH+): виміряно 438,2546; розраховано 438,2545 Перетворення сполуки прикладу 116 у сполуки наведених нижче прикладів шляхом відновлення/ацетилування: Приклад 125: 4-[1-(4-Бензилфталазин-1-іл)-піперидин-4-іл]-бензиламін H2N N N N 20 25 30 До розчину сполуки прикладу 116 (2,5 г, 6,19 ммоля) в MeOH при 0°C додають NiCl2 (962 мг, 7,42 ммоля) і NaBH4 (1,17 г, 30,9 ммоля). Реакційну суміш нагрівають при кімнатній температурі протягом ще 10 год., потім фільтрують і промивають за допомогою ДХМ. Органічний шар видаляють і одержують неочищений продукт. Очищення неочищеного продукту за допомогою ВЕРХ при використанні ацетонітрилу у воді (від 10 до 100 % з 3 % 1-пропанолу) з детектуванням при довжині хвилі, рівній 220 нм, дає бажану сполуку у вигляді білої твердої речовини (1,5 г, 59 %). 1 H ЯМР (400 МГц, ДМСО-d6): =8,09 (m, 2H), 7,83 (m, 2H), 7,16-7,44 (m, 9H), 4,51 (s, 2H), 3,83 (d, J=12,6 Гц, 2H), 3,63 (s, 2H), 3,03 (t, J=10,6 Гц, 2H), 2,72 (m, 1H), 1,93 (m, 4H). МС (m/z, MH+): виміряно 408,55 Приклад 126: N-{4-[1-(4-Бензилфталазин-1-іл)-піперидин-4-іл)-бензил}-ацетамід O H N N N N 35 До розчину сполуки прикладу 125 (60 мг, 0,147 ммоля) в MeOH (4 мл) додають надлишок оцтового ангідриду і реакційну суміш перемішують при кімнатній температурі протягом 4 год. Розчин концентрують і промивають за допомогою ДХМ, потім реакцію зупиняють водним 27 UA 100684 C2 5 розчином NaHCO3. Органічний шар видаляють і одержують неочищений продукт. Очищення неочищеного продукту за допомогою ВЕРХ із детектуванням при довжині хвилі, рівній 220 нм, з використанням ацетонітрилу у воді (від 10 до 100 % з 3 % 1-пропанолу) дає бажану сполуку (40 мг, 60 %). 1 H ЯМР (400 МГц, ДМСО-d6): =8,22 (s, 1H), 8,12 (m, 2H), 7,83(m, 2H), 7,14-7,27 (m, 9H), 4,51 (s, 2H), 4,16 (d, J=5,5 Гц, 2H), 4,82 (d, J=12,1 Гц, 2H), 3,03 (t, J=11,6 Гц, 2H), 2,43 (m, 1H), 1,89 (m, 4H), 1,80 (s, 3H). МС-ВР (m/z, MH+): виміряно 451,2479; розраховано 451,2498 Приклад 127: 1-Бензил-4-[4-(4-нітрофеніл)-піперидин-1-іл]-фталазин N N O2N 10 15 20 N До розчину 1-бензил-4-хлорфталазину (1,08 г, 4,04 ммоля) у 8 мл NMP додають 4-(4нітрофеніл)-піперидин (1 г, 4,85 ммоля) і ТЕА (1,68 мл, 12,12 ммоля). Реакційну суміш нагрівають у мікрохвильовому реакторі при 150°C протягом 45 хв. До реакційної суміші додають воду і одержують осад і тверду речовину збирають фільтруванням і сушать у вакуумі. Отриману тверду речовину очищають за допомогою ВЕРХ із детектуванням при довжині хвилі, рівній 220 нм, з використанням ацетонітрилу у воді (від 20 до 100 % з 3 % 1-пропанолу) і одержують бажану сполуку (1,4 г, 78 %). 1 H ЯМР (400 МГц, ДМСО-d6): =8,21 (m, 4H), 7,91 (m, 2H), 7,67 (d, J=8,6 Гц, 2H), 7,16-7,34 (m, 5H), 4,59 (s, 2H), 3,97 (d, J=12,6 Гц, 2H), 3,13 (t, J=10,1 Гц, 2H), 3,02 (m, 1H), 2,05 (m, 4H). МС (m/z, MH+): виміряно 424,50 Приклад 128: 4-[1-(4-бензилфталазин-1-іл)-піперидин-4-іл]-феніламін N N H2 N 25 30 N До розчину сполуки прикладу 20 (120 мг, 0,269 ммоля) в MeOH (8 мл) додають Pd/C (57 мг) і реакційну суміш перемішують в атмосфері водню при кімнатній температурі протягом 12 год. Для видалення Pd/C реакційну суміш фільтрують і органічний розчинник видаляють у вакуумі і одержують неочищений продукт. Неочищений продукт очищають за допомогою ВЕРХ із детектуванням при довжині хвилі, рівній 220 нм, з використанням ацетонітрилу у воді (від 30 до 100 % з 3 % 1-пропанолу) і одержують бажану сполуку (100 мг, 94 %). 1 H ЯМР (400 МГц, ДМСО-d6): =8,15 (m, 2H), 7,87 (m, 2H), 7,17-7,34 (m, 5H), 7,09 (d, J=8,6 Гц, 2H), 6,54 (d, J=11,6 Гц, 2H), 4,85 (s, 2H), 3,86 (d, J=12,7 Гц, 2H), 3,07 (t, J=5,6 Гц, 2H), 2,65 (m, 1H), 1,90 (m, 4H). МС (m/z, MH+): виміряно 394,52 Приклад 129: N-{4-[1-(1-(4-Бензилфталазин-1-іл)-піперидин-4-іл)-феніл]-ацетамід O N N N 35 40 45 50 N 4-[1-(4-Бензилфталазин-1-іл)-піперидин-4-іл]-феніламін (100 мг, 0,241 ммоля), ацетилхлорид (23,9 мкл, 0,336 ммоля) і ТЕА (62,4 мкл, 0,448 ммоля) змішують у ДМФ (5 мл) і суміш перемішують при кімнатній температурі протягом 12 год. Потім суміш фільтрують крізь целіт і промивають за допомогою MeOH. Органічний розчинник видаляють і одержують неочищений продукт. Очищення неочищеного продукту за допомогою ВЕРХ із детектуванням при довжині хвилі, рівній 220 нм, з використанням ацетонітрилу у воді (від 30 до 100 % з 3 % 1-пропанолу) дає бажану сполуку (12 мг, 11 %). 1 H ЯМР (400 МГц, ДМСО-d6): =9,86 (s, 1H), 8,13 (m, 2H), 7,91 (m, 2H), 7,18-7,54 (m, 9H), 4,59 (s, 2H), 3,89 (d, J=12,7 Гц, 2H), 3,10 (t, J=10,1 Гц, 2H), 2,77 (m, 1H), 2,01 (s, 3H), 1,99 (m, 4H). МС-ВР (m/z, MH+): виміряно 437,2322; розраховано 437,2341 Синтез сполук прикладів 39-54 і 130-147 за шляхом B. Загальна методика приєднання амінів до гетероарилхлоридів. У посудині для мікрохвильового реактора об'ємом 2 мл поєднують необхідні амінофталазин III (0,33 ммоля, 1 екв.) і гетероарилхлорид (0,46 ммоля, 1,4 екв.). Додають триетиламін (68 мкл, 0,49 ммоля, 1,5 екв.) і NMP (1 мл). Посудину герметично закривають і опромінюють у мікрохвильовому реакторі (умови високої потужності) при 180°C протягом 15 хв. Потім до реакційної суміші додають воду (15 мл) і одержують осад, що відокремлюють фільтруванням, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;benzyl and pyridinyl derivatives as modulators of the hedgehog signaling pathway
Автори англійськоюDai, Miao, He, Feng, Jain, Rishi Kumar, Karki, Rajesh, Kelleher, Joseph, III, Lei, John, Llamas, Luis, Mcewan, Michael A., Miller, Moslin, Karen, Perez, Lawrence Blas, Peukert, Stefan, Yusuff, Naeem
Назва патенту російськоюПроизводные бензила и пиридинила как модуляторы сигнального пути hedgehog
Автори російськоюДаи Миао, Хи Фенг, Джаин Риши Кумар, Карки Раджеш, Келлехер Джозеф, ИИИ, Лей Джон, Лламас Луис, Макиван Майкл А., Миллер-Мослин Керен, Перез Лоренс Блес, Пейкерт Стефан, Юсуфф Наиим
МПК / Мітки
МПК: C07D 403/12, A61K 31/4545, C07F 9/58, C07D 491/048, C07D 401/04, C07D 401/14, A61K 31/502, C07D 401/12, C07D 487/04, C07D 237/30, C07D 401/06, C07D 417/14, C07D 405/14, C07D 237/28
Мітки: сигнального, hedgehog, похідні, шляху, модулятори, піридинілу, бензилу
Код посилання
<a href="https://ua.patents.su/90-100684-pokhidni-benzilu-ta-piridinilu-yak-modulyatori-signalnogo-shlyakhu-hedgehog.html" target="_blank" rel="follow" title="База патентів України">Похідні бензилу та піридинілу як модулятори сигнального шляху hedgehog</a>
Попередній патент: Елемент захисту цінного документа та спосіб його виготовлення
Наступний патент: Пестицидні комбінації
Випадковий патент: Спосіб діагностики форм гострої та хронічної венозної недостатності нижніх кінцівок