Гетероциклічні похідні або їх солі, що мають антагоністичну активність по відношенню до фат-ацетеру
Формула / Реферат
1. Устройство для отведения жидкого смазочного материала из устройства подшипника для вращающегося вокруг оси вала, причем устройство подшипника содержит снабжаемый смазочным материалом опирающий вал подшипник и, по меньшей мере, одно соседнее с ним уплотнительное устройство, которое имеет окружающее вал уплотнение и лежащее между ним и подшипником окружающее вал и ограниченное снаружи стенкой сборное пространство для сбора из подшипника смазочного материала и отвода его по сливному трубопроводу, отличающееся тем, что в сборном пространстве установлена воронка для улавливания смазочного материала и отведения его в сливной трубопровод.
2. Устройство по пункту 1, отличающееся тем, что воронка примкнута к валу.
3. Устройство для отведения жидкого смазочного материала из устройства подшипника для вращающегося вокруг оси вала, причем устройство подшипника содержит снабжаемый смазочным материалом опирающий вал подшипник и, по меньшей мере, одно соседнее с ним уплотнительное устройство, которое имеет окружающее вал уплотнение и лежащее между ним и подшипником окружающее вал и ограниченное снаружи стенкой сборное пространство для сбора из подшипника смазочного материала и отвода его по сливному трубопроводу, отличающееся тем, что стенка сборного пространства представляет собой цилиндрическую поверхность, образующая которой параллельна оси вала, а направляющая образована, по меньшей мере, частью витка спирали и замыкающим ее промежуточным отрезком, а сливной трубопровод соединен со стенкой в области промежуточного отрезка.
4. Устройство по любому из пунктов 1-3, отличающееся тем, что сливной трубопровод установлен вертикально.
5. Устройство по любому из пунктов 1-4, отличающееся тем, что к сборному пространству подключен инжекционный трубопровод для отведения смазочного материала, причем инжекционный трубопровод со сливным трубопроводом представляет собой струйный насос с инжекционным трубопроводом в качестве трубопровода приводного средства.
6. Устройство по пункту 5, отличающееся тем, что к сливному трубопроводу подключен первый всасывающий трубопровод, который для отсасывания текучей среды, преимущественно смазочного материала, пара, воды или воздуха, соединен с уплотнением.
7. Устройство по любому из пунктов 5 или 6, отличающееся тем, что к сливному трубопроводу подключен второй всасывающий трубопровод, который для отсасывания текучей среды, преимущественно смазочного материала, пара, воды или воздуха, соединен со сборным пространством.
8. Устройство по любому из пунктов 1-7, отличающееся тем, что оно установлено с возможностью отвода жидкого смазочного материала из устройства подшипника в турбинной установке, преимущественно в паротурбинной установке.
9. Устройство по пункту 8, отличающееся тем, что оно установлено с возможностью отвода жидкого смазочного материала из устройства подшипника, который является торцовым подшипником, расположенным в паровом пространстве турбинной установки.
10. Устройство по любому из пунктов 1-9, отличающееся тем, что оно установлено с возможностью отвода жидкого смазочного материала из устройства подшипника, который является подшипником скольжения.
Текст
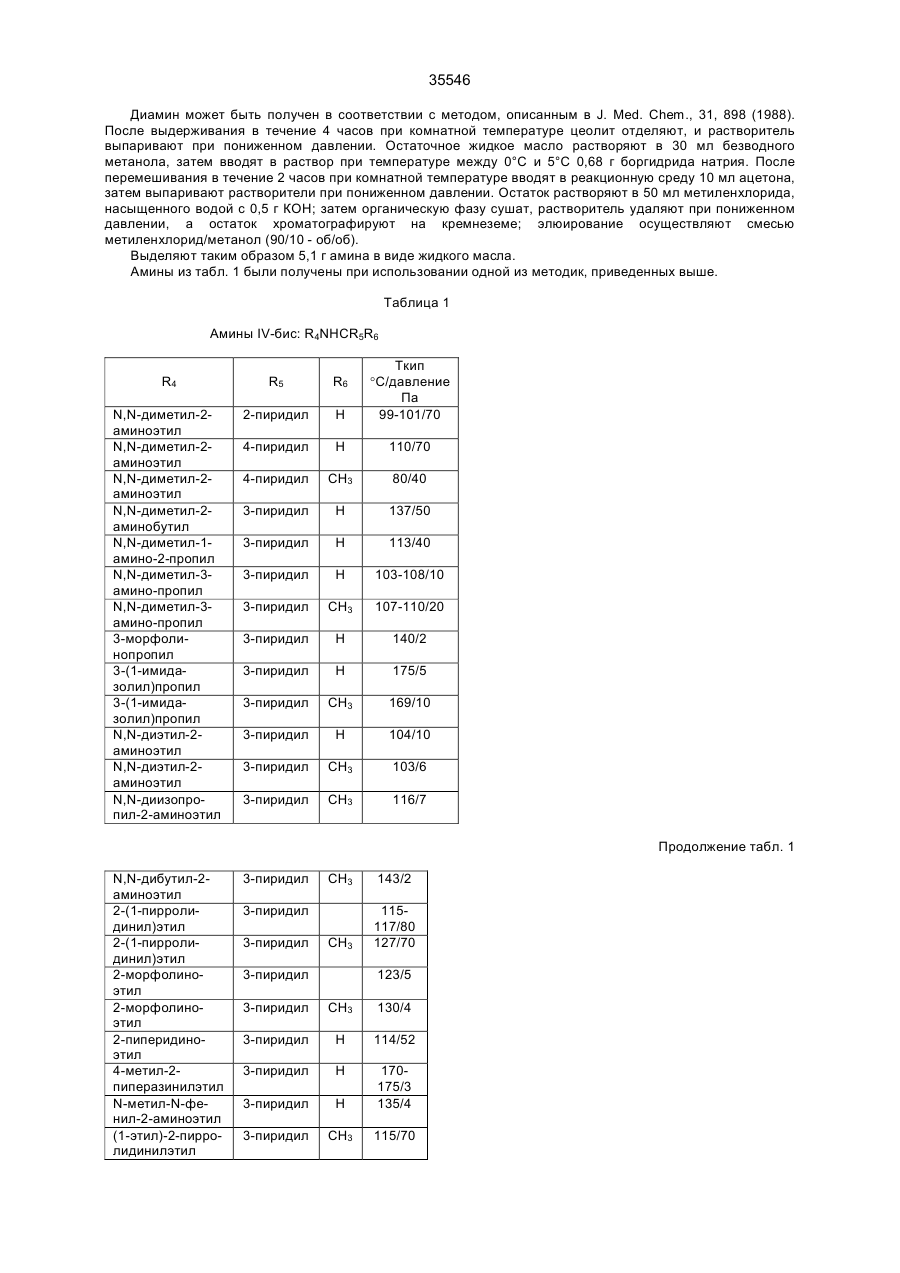
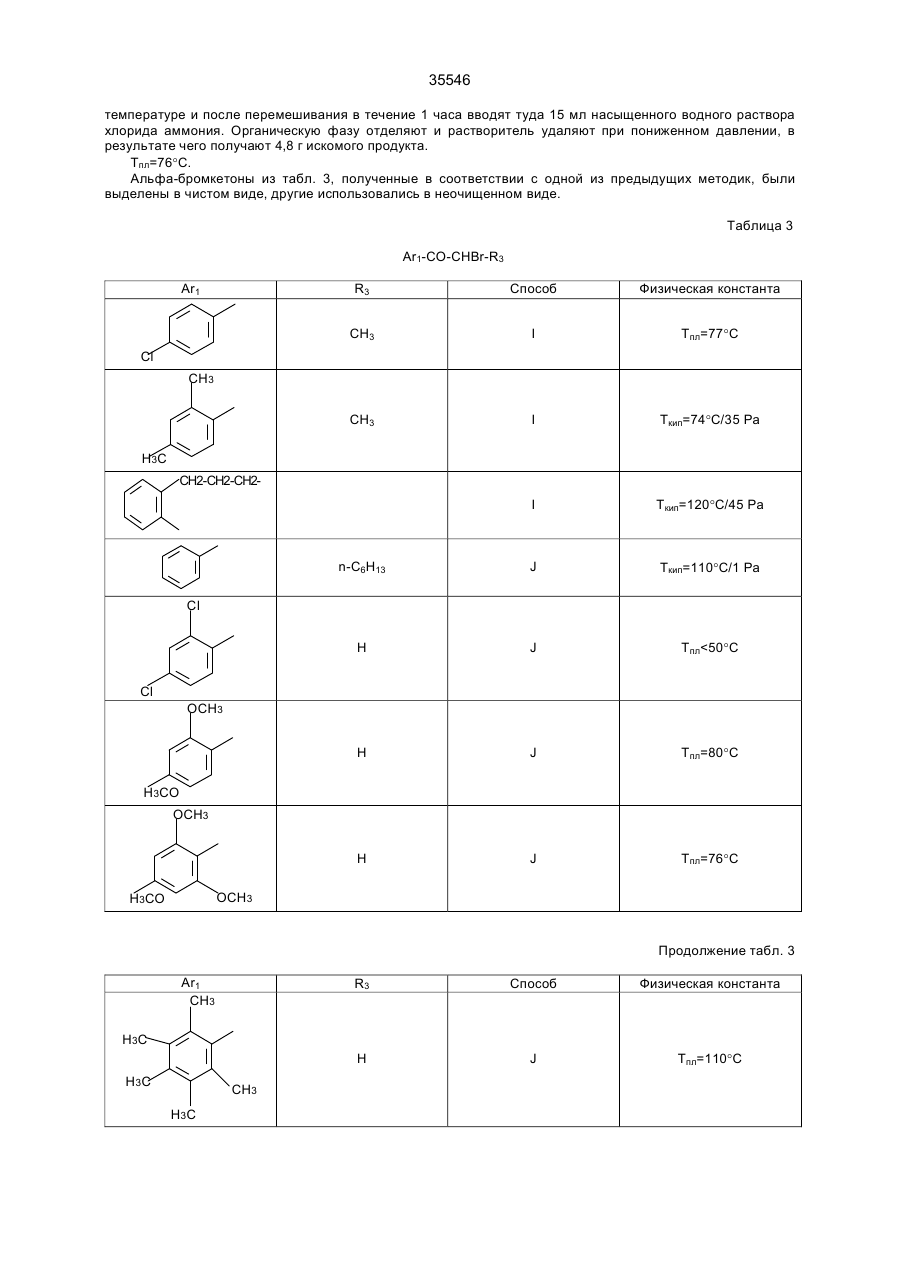
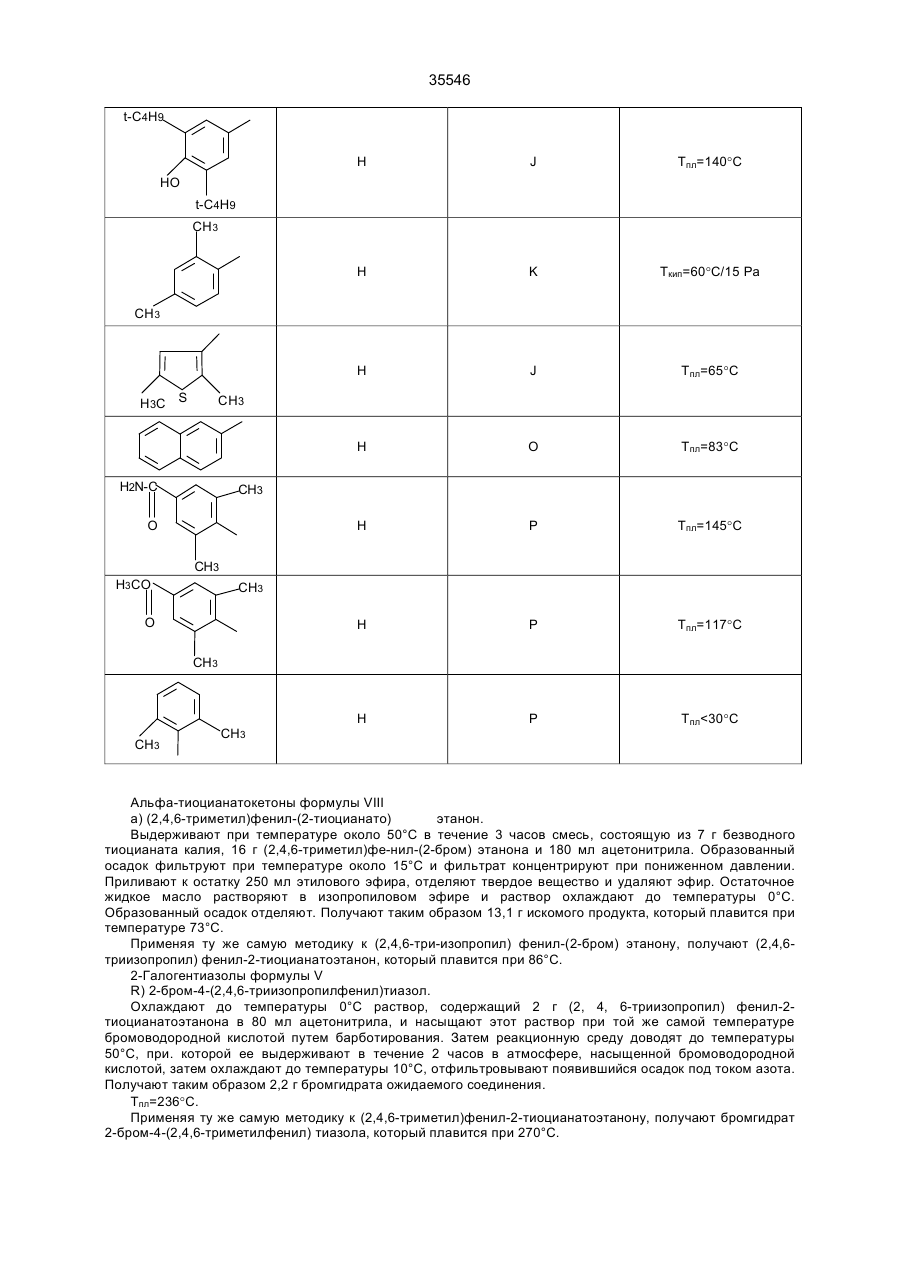
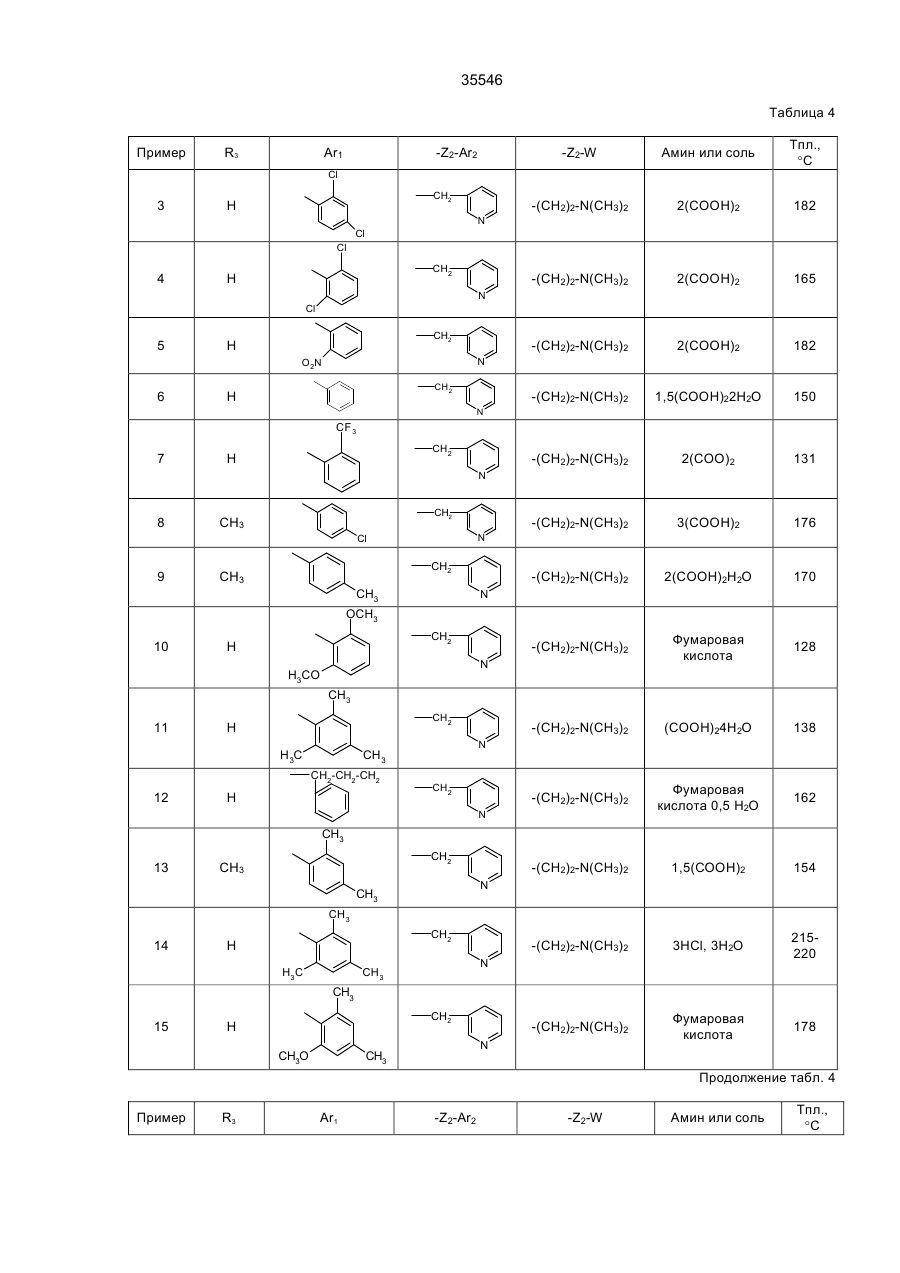
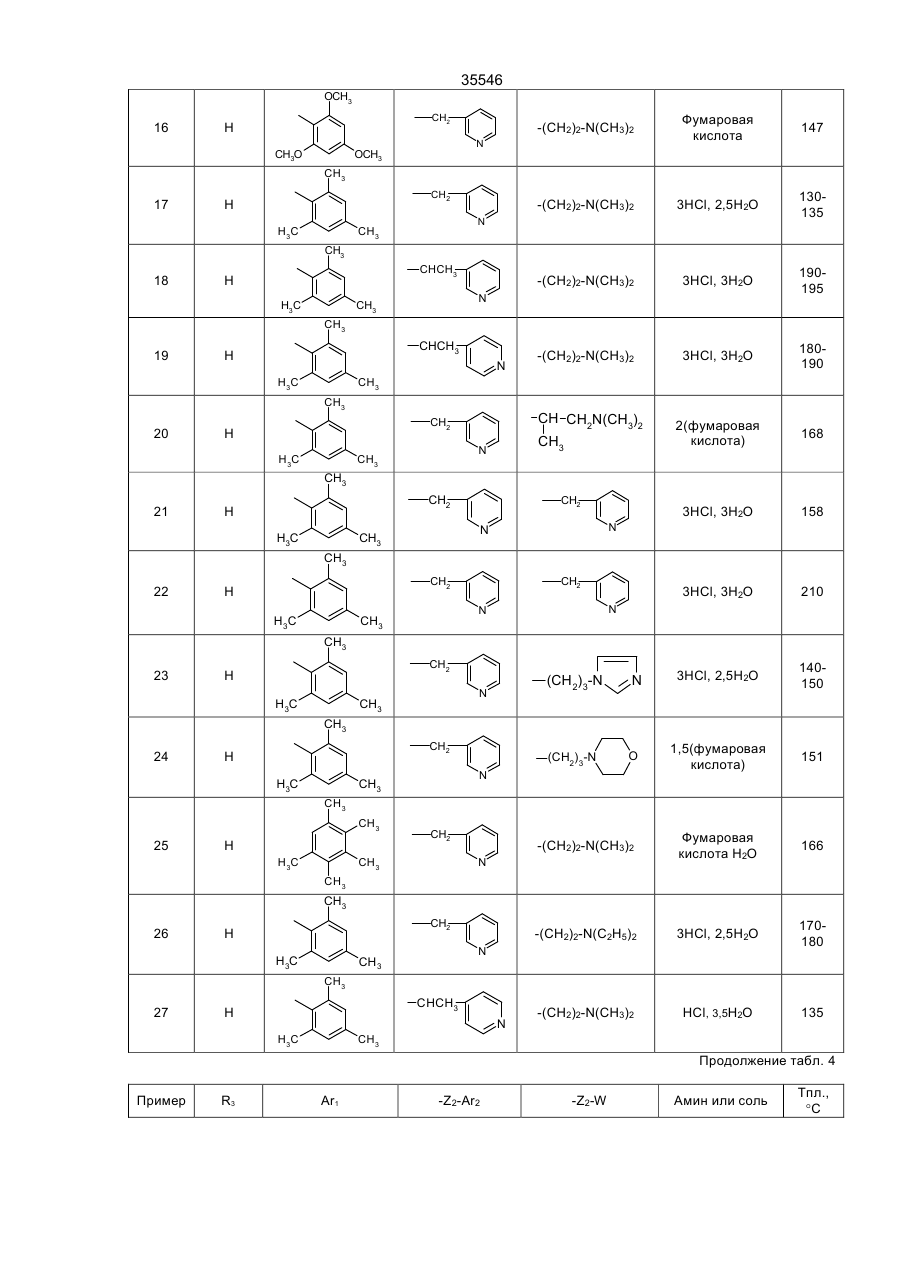
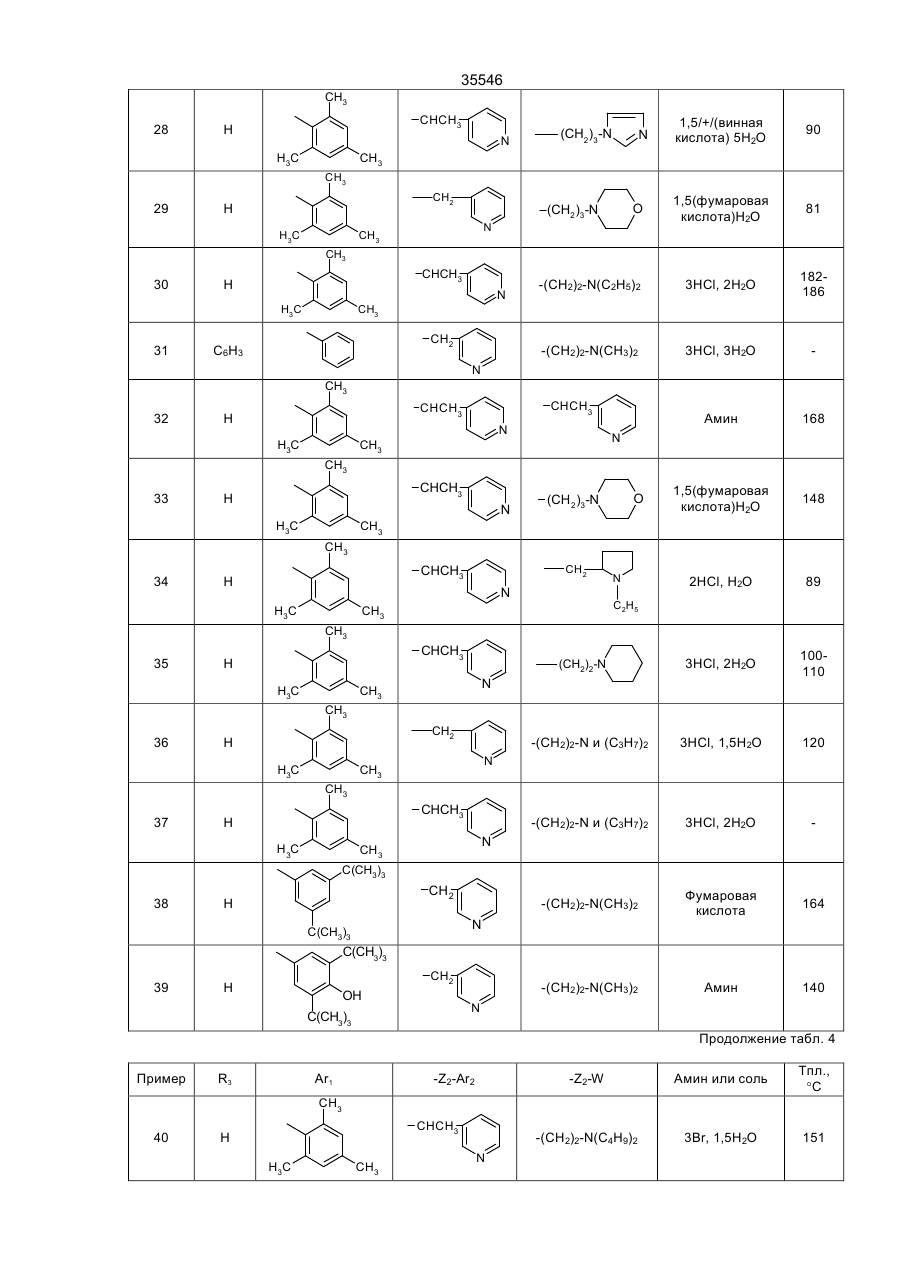
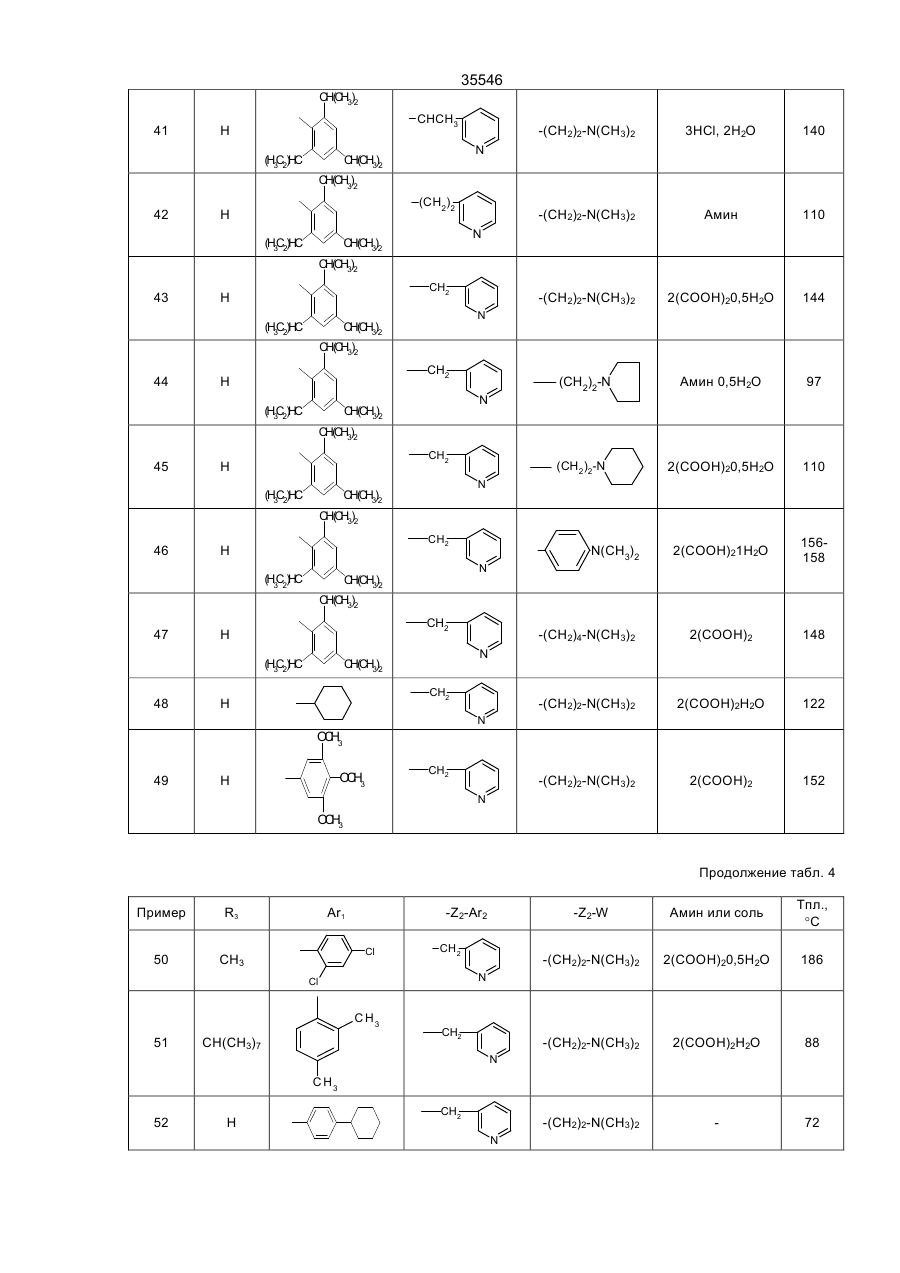
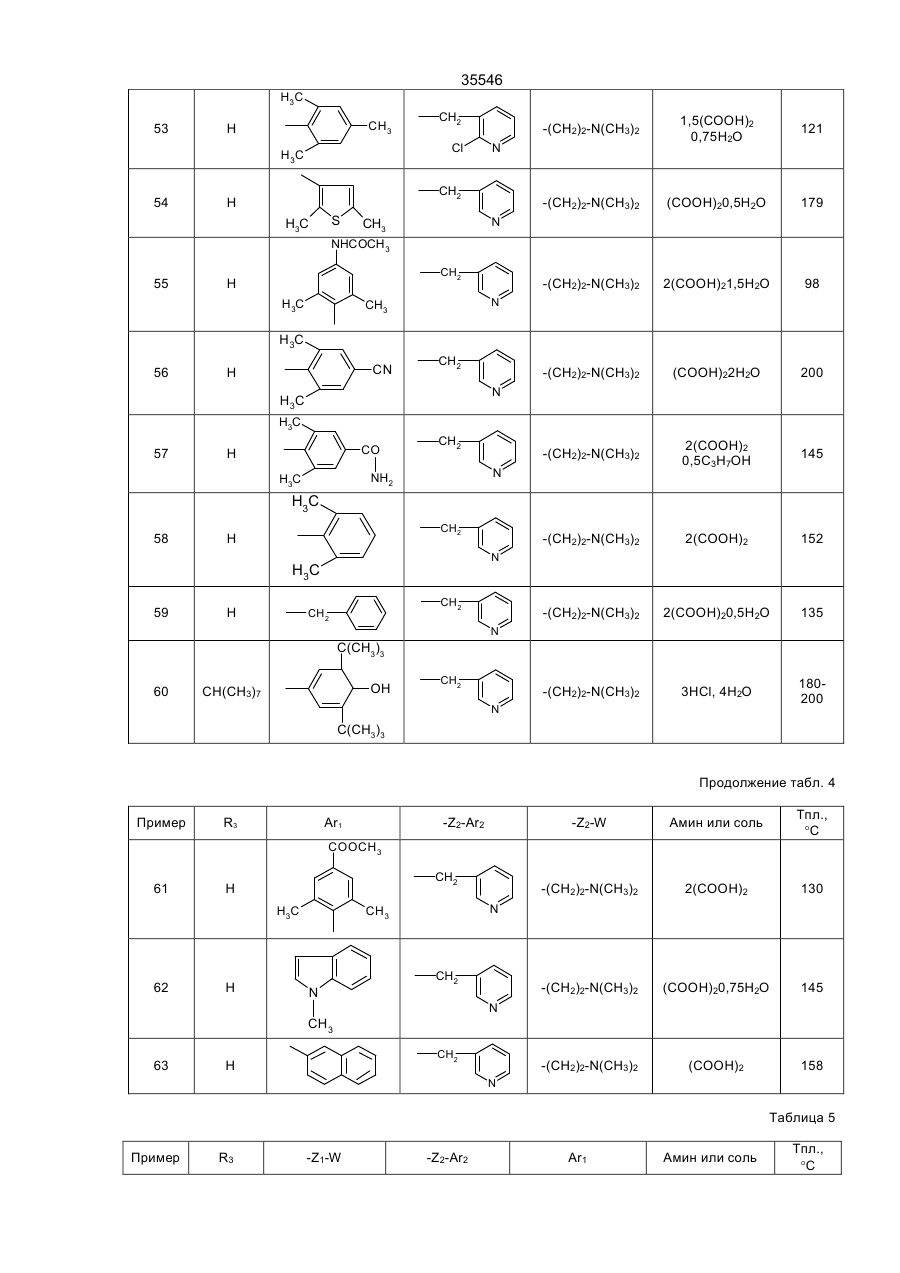
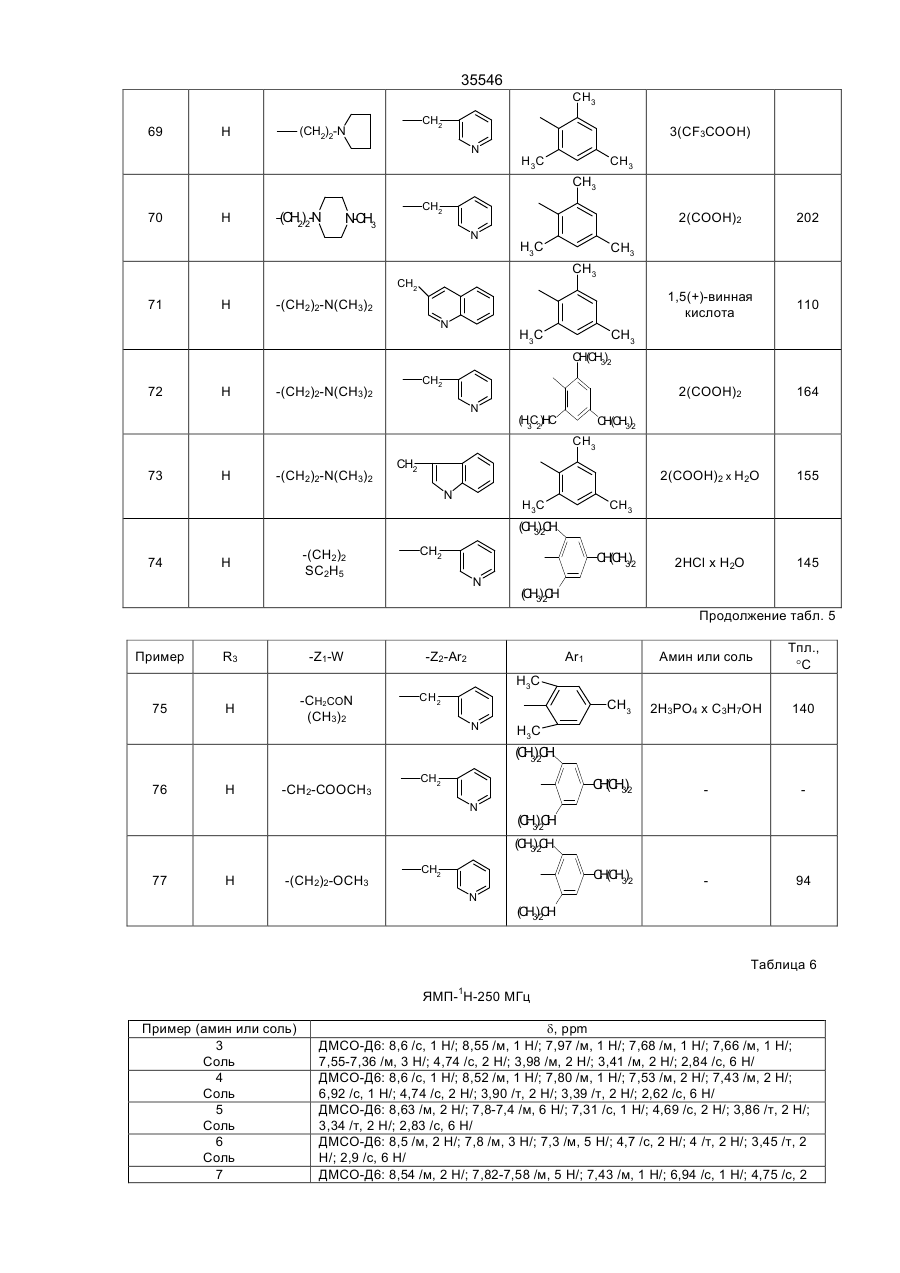
35546 Настоящее изобретение относится к гетероциклическим производным, обладающим антагонистической активностью в отношении к ФАТ-ацетеру. В патенте ЕП-А-0 283390 описаны производные 2-аминотриазола формулы: R' 3 R' S 2 N R' H N R' 1 в которой R'2 означает, в частности, ароматическую группу, R'3 означает водород или алкильную группу C1C4, a R'4 представляет собой амино алкильную группу, в которой азот аминогруппы может принадлежать, в частности, гетероциклу, такому как пиридин, пирролидин, пиперидин или пиперазин; эти соединения являются агонистами центральных мускариновых рецепторов и обладают активностью, стимулирующей холинэргическую передачу в центральной нервной системе. Известны 2-амино-4, 5-дифенилоксазолы, дизамещенные на аминогруппе гидроксилом или алкилом, имеющие противотромбозную активность (патенты ФР-1538009), а также монозамещенные на аминогруппе алкилом и гидроксиалкилом, имеющие противовоспалительную активность (патенты DE-2518882). Среди производных 2-амино-4-фенил-1,2,4-тиазолов можно указать противомалярийные производные, описанные в J.Het. Chem., 10, 611 (1973), в которых аминофункция замещена диалкиламиноалкилом и тиадиазолилом, или анестезирующие средства, описанные в СН-497453, которые замещены на аминофункции алкилом и аминоалкилом. Среди производных 2-амино-4-фенил-1,2,4-оксадиазола можно назвать местные анестезирующие средства и вазодилататоры (сосудорасширяющие средства), описанные в патенте ФР-2148430, которые являются дизамещенными на аминофункции диалкиламиноалкилом. Соединения в соответствии с изобретением не имеют ни одну из этих активностей, однако являются антагонистами ФАТ-ацетера (фактор активации тромбоцитов); они отвечают формуле: R3 B Ar1 A N N Z2-Ar2 (І) Z1-W в которой: А представляет собой О или S; В представляет собой С или N; Z1 представляет собой алкилен C1-C4 или фенилен; Z2 представляет собой алкилен C1-C4; W представляет собой группу NR1R2, где R1 является Н или алкилом C1-C4, a R2 является Н, алкилом C1-C4, CONQ1Q2 или CSNQ1Q2, в которых Q1 и Q2 представляют собой независимо друг от друга Н или алкил C1-C4, SО2Q3 или СОQ3, в которых Q3 представляет собой алкил C1-C4, COOQ4, где Q4 представляет собой алкил C1-C4, или R1 и R2, вместе с атомом азота образуют насыщенный гетероцикл морфолина, пирролидина, пиперидина или 4-(С1С3)алкилпиперазина, или W означает N-оксид аминов NR1R2, где R1 и R2 означают C1-C4-алкил, или W означает C1-C4-алкокси или C1-C4-тиоалкоксигруппу, группу COOQ5, где Q5 означает C1-C5-алкил, или W группа CONQ1Q2, пиридил или имидазолил; RЗ - отсутствует, когда В - атом азота, или представляет собой атом водорода, C1-C8-алкил или атом галогена; Аr1 – фенил, который может быть замещен одной или несколькими группами, выбираемыми из хлора, C1-C4-алкила, C1-C4-алкокси, гидроксигруппы, карбоксигруппы, COOQ6, где Q6 - С1-С4-алкил; карбоксамидогруппы, цианогруппы, аминогруппы, ацетаминогруппы, нитрогруппы, трифторметила, или Аr1 - тиенил, индолил, нафтил, бензил или циклогексил; или Аr1 и R3, взятые вместе, образуют группу (CH2)3 в которой углерод фенила является связанным с положением 4 гетероцикла, Аr2 - хинолил, индолил или пиридил, которые могут быть замещены С1-С3-алкилом или хлором; или соли этих производных с кислотами или основаниями. Алкильная, алкиленовая, алкокси-, тиоалкокси-группа являются линейными или разветвленными. Соли с фармацевтически приемлемыми кислотами или основаниями являются предпочтительными, однако соли, которые позволяют выделить соединения формулы I, в частности очистить их, также являются объектами изобретения. Предпочитают соединения, в которых В представляет собой атом углерода и, в частности, производные тиазола, в которых Аr1 представляет собой фенильное кольцо, по меньшей мере, ортозамещенное, или те, в которых Ar1 представляет собой фенил без заместителя в орто-положении, а R3 представляет собой галоген или алкил С1-С3; W является предпочтительно алкокси- или тиоалкоксигруппой С1-С3 или еще NR1R2, где R1, R2 представляют собой независимо друг от друга Н или алкил C1-С4, или NR1R2 образуют насыщенный гетероцикл; наконец, предпочитают, чтобы Z1 представлял собой этилен или пропилен. 35546 Среди последних соединений предпочтительная группа соединений может быть представлена формулой II: S R3 N N Z2 (ІІ) N (CH2)n Ar1 N R1 R2 в которой R1 и R2 каждый представляют собой атом водорода или алкил С1-С3 или образуют вместе с атомом азота, с которым они связаны, пирролидинил или пиперидиногруппу, Z2 представляет собой СН2 или СНСН3, R3 представляет собой Н, а Ar1 представляет собой фенильную группу, несущую, по меньшей мере, один заместитель в орто-положении, или RЗ представляет собой Сl, Вr или алкил C1-C6, a Ar1 представляет собой фенил, замещенный, в случае необходимости, причем заместители фенильных групп выбираются среди, атомов галогена и алкильной или алкоксигрупп C1-C4, a n равняется 2 или 3. Соединения, представляющие особый интерес, отвечают формуле III: R' X' S R N CH N N (CH2) 2 X' N X' R1 R2 в которой R3 представляет собой Н или галоген, такой как Вr или Cl, R' представляет собой Н или СН3, X' представляет содой алкил C1-C4, a R1 и R2 каждый раздельно представляют собой Н или алкил С1-С3 или вместе с атомом азота, с которым они связаны, образуют пирролидинил или пиперидиногруппу, причем пиридильная группа замещена в положении 2 или 3. Среди предпочтительных соединений можно указать, например, N-[N',N'-димeтил-2-aминoэтил]-N-[3пиpидилмeтил]-2-aминo-4-(2,4,6-триизопро-пилфенил)тиазол, N-[N',N’-диметил-2-амино-этил]-N-[3пиридилметил]-2-амино-4-(2,4,6-триметилфе-нил)тиазол, N-[N',N'-диметил-2-аминоэтил]-N-[3пиридилметил]-2-амино-4-(2,4-дихлорфенил)-5-метилтиазол (или оксазол) и N-[N',N'-диметил-2аминоэтил]-N-[3-пиридилметил]-2-амино-4-(2,4,6-триизопропилфенил)-5-хлор-(или бром) тиазол. Соединения формулы I могут быть получены в результате реакции вторичного амина формулы IV с гетероциклом формулы V, содержащим заместитель X, который является нуклеофугом, таким как галоген или сульфонат, в соответствии с реакционной схемой (а): R3 A B X Z2-Ar2 HN N Z1-W Ar1 + V IV R3 B Ar1 Z2-Ar2 A N N Z1-W I в которой А, В, R3, Ar1, Z2, Аr2, Z1, W имеют те же самые значения, что и для формулы I, за исключением того, что R3 -галоген, или Аr1, Аr2, W представляют собой соответствующие группы, в которых реакционноспособные функции были защищены классическим образом, когда А представляет собой О или S, а В представляет собой С, то предпочитают, чтобы Х являлся Вr, и замещение осуществляют в апротонном растворителе, обычно неполярном, таком как алифатический или ароматический углеводород, предпочтительно в присутствии основания для нейтрализации образуемой кислоты; когда А представляет собой О или S, а В представляет собой N, то предпочитают, чтобы Х означал Сl, и замещение 35546 осуществляют в инертном растворителе, таком как спирт, алифатический или ароматический углеводород, кетон или хлорсодержащий растворитель, как например, метиленхлорид. Можно также получать соединения формулы I, исходя из соединений формулы V, в две стадии, проводя сначала реакцию с первичным амином Ar2-Z2-NH2 или W-Z1-NH2, а затем действуя галогенидом или сульфонатом соответственно формулы W-Z1-У или Ar2-Z2-У на полученный вторичный амин, предпочтительно в присутствии основания. Когда А представляет содой O, а В представляет собой N, то в соединении формулы V, используемом на первой стадии, Х может представлять содой ССl3. В случае, когда соединения формулы I содержат тиазол в качестве гетероцикла, можно также получать непосредственно аминотиазол, замещенный соответствующим образом: либо в результате реакции тиомочевины, замещенной соответствующим образом, с альфагалогенированным кетоном, либо в результате реакции вторичного амина с альфа-тиоцианатокетоном в соответствии с реакционной схемой (b): Z2-Ar2 N C NH2 + Ar1-CO-CHX-R3 Z1-W VI S VII R3 Z2-Ar2 S N Z1-W N Ar1 I в которой W, R3, Z1, Z2, Ar1 и Аr2 имеют те же самые значения, что и для формулы I, за исключением значения галогена для R3 или того, что W, Ar1, Аr2 представляют собой соответствующие группы, в которых реакционно-способные функции были защищены классическим образом, а Х представляет собой атом галогена, особенно хлор или бром, а предпочтительно - бром, или в соответствии с реакционной схемой (с): Z2-Ar2 NH + Ar1-CO-CH-R3 SC Z1-W VIII IV R3 N Z2-Ar2 S N Ar1 N Z1-W I в которой W, R3, Z1, Z2, Ar1 и Аr2 имеют те же самые значения,. что и для формулы I, за исключением значения галогена для R3 или того, что W, Аr1, Аr2 представляют собой соответствующие группы, в которых реакционно-способные функции были защищены классическим образом. В случае схемы (b) можно, в случае необходимости, использовать соединение VII, защитив предварительно карбонильную функцию в виде ацетальной группы, которая будет отщепляться в ходе циклообразующей конденсации; реакционные условия являются такими, которые обычно используются в реакции этого типа, и можно сослаться в этом случае на журнал: G. Vernin, Heterocyclic Compounds, 34, (I), 165-269 (1979) J.V. Metzger Ed.J. Wiley and Sons. В частности, реакция осуществляется в полярном растворителе при температуре, заключенной между 40°С и 100°С. Среди подходящих растворителей можно назвать спирты, такие как этанол, метанол или изопропанол; алифатические кислоты, такие как уксусная кислота; нитрилы, такие как ацетонитрил; простые эфиры, такие как диоксан или тетрагидрофуран. Предпочтительно добавляют сильную кислоту в реакционную среду для ускорения реакции, если тиомочевины формулы VI не распадаются в кислой среде. В случае схемы (с), как правило, раствор соединений IV и VIII в инертном растворителе, таком как алифатический или ароматический углеводород, выдерживается в течение нескольких часов при перемешивании при температуре, заключенной между комнатной температурой, т.е. примерно 20°С, и температурой дефлегмации выбранного растворителя, предпочтительно, при температуре, заключенной между 60°С и 110°С. 35546 Если используемые соединения формул IV-VIII содержат функции, которые могли бы реагировать в рабочих условиях, применяемых для получения соединений формулы I, то эти функции предварительно защищаются; так, когда W представляет собой NR1R2, a R1 и/или R2 являются Н, то можно блокировать аминофункцию в виде карбамата, в частности, фиксируя на азоте трет-бутоксикарбонильную группу, которая, как известно, легко отщепляется при действии безводной кислоты, такой как трифторуксусная кислота или хлороводородная кислота; если Аr1, Аr2 или W содержат кислотную функцию, то предварительно получают соединение формулы I, содержащее соответствующую функцию сложного эфира алкила C1-C4, которая гидролизуется обычным образом в основной среде или, в случае необходимости, в кислой среде; если Аr1 или Аr2 содержат функцию первичного амина, то можно предварительно получить соединение формулы I, содержащее ацетамидную функцию, которую гидролизуют в кислой или основной среде. Вместе с тем, в случаях, когда W представляет собой NR1R2, где R2 является группой CONQ1Q2, CSNQ1Q2, SQ2Q3, СОQ3, можно получать соединения формулы I, исходя из соединений, в которых R2 представляет собой Н. Соединения формулы I, в которых R3 является атомом галогена, получают при действии галогена, Cl2, Br2 или HСl, на соответствующее соединение формулы I, в котором R3 представляет собой Н, применяя, в частности, метод, описанный для тиазолов в J. Am. Chem. Soc., 68, 453-458 (1946). Продукты формулы I выделяют из реакционной среды и очищают классическими методами с учетом их физико-химических свойств и, в частности, их основного характера. Некоторые из этих продуктов являются маслянистыми жидкостями, и тогда их предпочитают выделять в виде соли присоединения минеральной или органический кислоты, соли, которая иногда находится в виде гидрата или сольвата; соли получают при действии кислоты на соединение формулы I в растворе, например, в спирте или простом эфире, и выделяют либо путем осаждения, либо путем выпаривания растворителя; можно превращать в соль все аминофункции молекулы или только некоторые в зависимости от условий реакции и используемой кислоты. N-оксид аминофункции может быть получен при действии подходящего окислителя на соединение формулы I, в частности, при действии 2-(фенилсульфонил)-3-фенилоксазиридина, в соответствии со способом, описанным в J. Org. Chem., 53, p. 5856 (1988). В этих условиях атомы азота гетероцикла и Аr2 не окисляются. Большинство продуктов формул IV-VIII не выпускается в продажу, а некоторые являются новыми, но они могут быть получены при помощи способов, принцип которых известен сам по себе и осуществление которых было описано для аналогичных продуктов. Так, вторичные амины формулы IV могут быть получены, исходя из первичных аминов Ar2-Z2-NH2 или W-Z1-NH2, в которых реакционно-способные функции, в случае необходимости, защищены: либо в результате реакции нуклеофильного замещения, в которой на первичный амин действуют, в зависимости от случая, соединением формулы Ar2-Z2-Y или формулы W-Z1-Y, где Y представляет собой атом галогена или сульфонатную группу ZSO2, в которой Z представляет собой алкил C1-C4 или фенил, замещенный, в случае необходимости; либо в результате конденсации первичного амина с кетоном или альдегидом в дегидратирующей среде с последующим восстановлением образованного имина классическим образом при помощи гидрида металла или при помощи водорода в присутствии катализатора, такого как Pd, согласно следующей реакционной схеме (d): R4NH2-R5COR6®R4-N=CR5R6®R4-NH-CHR5R6, IV-бис в которой R4 представляет собой Z2Ar2, в случае, когда –CHR5R6 представляет собой Z1W, или R4 представляет собой Z1W в случае, когда –СНR5R6 представляет собой Z2Ar2, в соответствии со способом, описанным, в частности, в Methoden Org. Chem. ic IV (Id) 355-363, (1981). Кетоны формулы VII могут быть получены в результате галогенирования кетонов формулы Аr1СОСН2R3, которые обычно являются известными и часто имеются в торговле; в противном случае они могут быть получены, в частности, по реакции Фриделя-Крафтса между Ar1H и R3CH2COCI в присутствии кислоты Льюиса. Альфа-бромированные кетоны получают, исходя из Аr1СОСН2R3, в частности, при действии брома в растворителе, таком как уксусная кислота, четыреххлористый углерод или простой эфир, такой как этиловый эфир, при действии бромида двухвалентной меди, применяя метод, описанный в J. Org. Chem. 29, p. 3459-3461 (1964), под действием трибромида четвертичного аммония, как описано в Bull. Chem. Soc. Japan., 60, 1159-1160 и 2667-2668 (1987); альфа-хлорированные кетоны могут быть получены под действием дихлориодатов четвертичного аммония, как описано в Synthesis, p. 545-546 (1988). В некоторых случаях преимущественным является получение альфа-бромированных кетонов согласно реакции Фриделя-Крафтса между ароматическим производным формулы Аr2Н и хлорангидридом кислоты R3-CHBr-COCI, применяя метод, описанный в Methoden der Org. Cheiaic, VII (2a), p. 110-132 (1977). Наконец, когда R3 представляет собой Н, то можно исходить из хлорангидрида кислоты Аr1СОСl, на который воздействуют диазометаном, с последующей реакцией гидролиза полученного диазокетона под действием водородной кислоты, по методу, описанному, в частности, в Org. Synth. Coil. vol. 3, p. 119-120. Тиомочевины формулы VI могут быть получены при посредничестве соединения с формулой IX: 35546 Z2-Ar2 N-C-NH-Q Z1-W S получающегося при реакции между вторичным амином формулы IV и изотиоцианатом формулы Q-N=C=S, где Q представляет собой ацильную группу, способную к отщеплению в кислой среде, в частности, группу ацетил, бензоил или триметилацетил, а предпочтительно - триметилацетил; само производное Q-N=C=S получается при действии хлорангидрида карбоновой кислоты на тиоцианат металла в безводном растворителе, таком как ацетон или метилэтилкетон. Соединение формулы IV получают при действии сильной кислоты на соединения формулы IX, например, при действии водного раствора НСl при температуре от 10°С до 100°С, в частности, при действии 2н НСl. Тиоцианатокетоны формулы VIII могут быть получены при действии тиоцианата металла на соответствующий альфа-галогенированный кетон формулы VII в безводном растворителе, применяя способ Черняка, описанный, в частности, в Heterocyclic Compounds, 34 (I), p. 271-273 (1979). 2-Галогентиазолы формулы V, в которой А является S, а В является С, могут быть получены при действии в безводной среде галогеноводородной кислоты на раствор тиоцианатокетона формулы VIII в соответствии со способом, описанным в Heterocyclic Compounds, 34 (I), p. 273-276 (1979). 2-Галогеноксазолы формулы V, в которой А является О, а В является С, могут быть получены, исходя из оксазолин-2-она, в частности, при действии фосфорилхлорида в присутствии третичного амина в соответствии с реакционной схемой (e): R3 O O R3 Cl O (V) N N Ar1 Ar1 как описано в Chem. Ber., 92, 1928 (1959). Что касается способов получения оксазолинонов можно сослаться на статью Y.S. Rao и R. Filler в журнале Heterocyclie Compounds, 45, p 660-665 (1986), I.J. Turchi, Ed.J. Wiley and Sons. Можно, в частности, получить их в результате циклодегидратации карбаматов формулы Х в соответствии с реакционной схемой (f): O O R3 H Ar1-C-C-O-C-NH2 O R3 O Ar1 N X причем сами карбаматы получают, исходя из альфа-гидроксилированных кетонов Ar1-CO-CHOH-R3. 5-Хлор-1,2,4-тиадиазолы могут быть получены при действии перхлорметилмеркаптана на амидин Ar1C(NH)NH2 в соответствии с известным способом, описанным в частности, в Chem. Ber., 90, 182-187 (1957). 5-Хлор-1,2,4-оксадиазолы могут быть получены при действии агента хлорирования на 1,2,4оксадиазолин-5-он, в частности, при действии оксихлорида фосфора в присутствии амина, как описано в Yaku gaku Zasshi, 84, 1061-1064 (1964) (Chem. Abs., 62, 5270 d). Наконец, 5-трихлорметил-1,2,4-оксадиазолы могут быть получены при действии трихлоруксусного ангидрида на амидоксим Ar1C(NOH)NH2, как описано в Helv. Chem. Acta 46, 1067-1073 (1963). Примеры получения промежуточных соединений и соединений формулы. I, а также их физикохимические характеристики даны ниже. Специалист сам выберет способ, наиболее соответствующий получению данного соединения формулы I, учитывая имеющиеся в наличии исходные вещества, реакционную способность промежуточных соединений и их стабильность. Соединения формулы I и их соли являются антагонистами ФАТ-ацетера. Этот фосфолипид является биологическим медиатором, химическая структура которого была определена в 1979 г., как структура 1-Огексадецил-2-О-ацетил-Sn-глицеро-3-фосфорилхолина, однако высвобождение которого базофилами в ходе анафилактических реакций было выявлено еще в 1972 г. Этот медиатор имеет различные физиологические активности, среди которых можно указать потенцилизирующий эффект агрегации тромбоцитов, эффект конструктора гладкой мускулатуры и бронхов и вызывающий воспаление эффект, а также гипотензивную активность. Можно сослаться на статью, опубликованную в ISI Atlas of Science Pharmacology 1(3), p. 187-198 (1987), которая рассматривает виды физиологической активности ФАТ и терапевтическое применение антагонистов этого фосфолипида, ответственного за многочисленные патологии, в частности, в качестве фактора, усложняющего патологию. Известны различные методы выявления антагонистической активности по отношению к ФАТ. Так, in vitro изучалось ингибирование агрегации тромбоцитов у кролика, вызванной ФАТ-ацетером в соответствии с методом, описанным в Thrombosis Research 41, 211-226 (1986). В этом опыте большинство 35546 соединений формулы I или их соли имеют показатель Cl50 (концентрацию, ингибирующую 50% агрегации, вызванной ФАТ, введенным в среду с концентрацией 4х10-10 М) менее 10-6М, а для многих продуктов он составляет порядка 10-9М, тогда как при тех же самых условиях соединение, называемое WEB 2086, являющееся известным антагонистом, описанным в J. PharmacoI. Exper. Therap. 241, 974-981 (1987), имеет показатель Cl50 около 5·10-8 M. Среди наиболее активных соединений, у которых Cl50 составляет порядка 10-3 М и которые имеют продолжительность действия, большую, чем у WEB 2086, можно указать соединения формулы II, которая описана выше. В тех же самых экспериментальных условиях соединения формулы I при концентрации 10-4 М являются неактивными по отношению к агрегации, вызванной арахидоновой кислотой при концентрации 10-4 М, или 5'-аденозиндифосфатом при концентрации 10-5 М. Были использованы также разные методы выявления у животных ингибирования антагонистами эффектов, вызванных ФАТ, например, ингибирование бронхоспазма, вызванного у морской свинки, которое описано в Thromb. Haemostas., 56 (I), 40-44 (1986), и ингибирование защиты против системного летального шока у мышей, которое описано в J. PharmacoI. Exp. Ther., 247, (2), 617-23 (1988). Так, соединения формулы III, описанной выше, полностью ингибируют бронхоспазм, вызванный инъекцией внутривенным путем 100 нг/кг ФАТ, когда они вводятся за 1 час до инъекции, либо внутривенной инъекцией дозы 1 мг/кг, либо оральным путем с дозой 3 мг/кг; эти же самые соединения уменьшают на 50% смертность мышей, если они вводятся (за 1 час до внутривенной инъекции мышам 100 мкг/кг ФАТ) с дозой порядка 0,5 мг/кг внутривенным путем и с дозой 10 мг/кг оральным путем. Среди таких соединений, соединение N-[N',N'-диметил-2-аминоэтил]-N-[3-пиридилметил]-2-амино-4[2,4,6-триизопропилфенил] тиазол полностью ингибирует бронхоспазм, вызванный у морских свинок, при введении его с дозой 1 мг/кг внутривенным путем или с дозой 3 мг/кг через рот, на период в течение более 96 часов. С другой стороны, при оральной дозе 5 мг/кг следующие соединения: N-[N',N'-диметил-2-ами-ноэтил]N-[3-пиридилметил]-2-амино-4-[2,4,6-три-изопропилфенил]тиазол, N-[N',N'-диметил-2-ами-ноэтил]-N-[3пиридилметил]-2-амино-4-[2,4,6-три-изопропилфенил]-5-хлор- (или 5-бром) тиазол, N-[N',N'-диметил-2аминоэтил]-N-[3-пиридилметил]-2-амино-4-[2,4-дихлорфенил]-5-метилтиазол (или оксазол) защищают мышей от общего летального шока, вызванного ФАТ при дозе 100 мкг/кг. Соединения согласно изобретению могут входить в качестве активного компонента в фармацевтические композиции в комбинации с эксципиентами, используемыми обычно для введения оральным, ректальным, парентеральным путем или через слизистую оболочку. Единичные и дневные дозы зависят от соединения, от природы и тяжести болезни, от больного, а также от пути введения; в общем случае для орального пути единичная доза для взрослого может составлять от 5 до 500 мг, тогда как для внутривенного пути она составляет от 0,05 мг до 10 мг, причем эти дозы являются сопоставимыми с дозами, при которых фармакологическая активность этих соединений проявляется у животных без видимого токсического эффекта. Композиции приемлемы, в частности, при лечении астмы, некоторых аллергических или воспалительных состояний, сердечно-сосудистых болезней, среди которых атеросклероз, тромбозы, гипотония или аритмии, церебральные и сердечные ишемии, и различных почечных патологий, среди которых гломерулонефриты, или в качестве контрацептивного агента. В последующем изложении описано получение промежуточных соединений формул IV-VIII. Упоминаемые температуры плавления (Тпл) являются мгновенными; температуры кипения (Ткип) были измерены в ходе перегонки при пониженном давлении. Амины формулы IV A) N,N-диизопропил-N'-(3-пиридилметил)этан-диамин, (R1=R2=CH(CH3)2; Z1=(CH2)2; Z2=CH2; Аr2=3пиридил). В инертной атмосфере прибавляют 16,9 г 3-пиридилкарбоксальдегида к раствору, содержащему 25 г N,N-диизопропил-этандиамина в 150 мл толуола, в присутствии молекулярного сита (цеолита) 4 А. После 1 часа выдерживания при комнатной температуре отфильтровывают цеолит и выпаривают растворитель при пониженном давлении около 30°С; извлекают остаточное жидкое масло посредством 150 мл безводного метанола и охлаждают раствор между 0 и 10°С. Затем прибавляют порциями 6 г боргидрида натрия и возвращают к комнатной температуре; после нескольких часов перемешивания вводят в реакционную среду 10 мл 1н водного раствора НСl, затем прибавляют 10 н водный раствор NaOH до рН=8 перед проведением экстракции конечного продукта метиленхлоридом. Органическую фазу сушат на сульфате натрия, фильтруют и концентрируют при пониженном давлении около 70°С. Полученное жидкое масло перегоняют под вакуумом. Получают 30,1 г ожидаемого соединения. Ткип=115°С/5 Па В) N,N-диметил-N'-(3-пиридилметил) этандиамин, R1=R2=СН3; Z1=(CH2)2; Z2=СН2; Аr2=3-пиридил). В инертной атмосфере прибавляют 4 г N,N-диметилэтандиамина к охлажденному раствору, содержащему 4,7 г 3-пиридинкарбоксальдегида в 40 мл абсолютного этанола в присутствии цеолита 4 А. После 1 часа выдерживания при комнатной температуре отфильтровывают цеолит и к раствору, охлажденному между 0°С и 10°С, прибавляют 1,82 г боргидрида натрия. После 12 часов перемешивания при комнатной температуре концентрируют реакционную среду при пониженном давлении и приливают 10 мл 1 н водного раствора НСl к остатку; затем добавляют концентрированный раствор КОН до рН, превышающего 8, и экстрагируют реакционную среду этиловым эфиром; органическую фазу сушат и растворитель удаляют при пониженном давлении. Полученное жидкое масло перегоняют под вакуумом. Получают 5,4 г ожидаемого соединения, 35546 Ткип=84°С/40 Па. C) N,N-диметил-N',-[1-(3-пиридил) этил] этандиамин, (R1=R2=СН3; Z1=(CH2)2; Z2=CHCH3; Аr2=3-пиридил). В колбе, оборудованной сепаратором Дин Старк, нагревают с обратным холодильником в течение примерно 5 часов 30 г 3-ацетил-пиридина, 28,4 г N, N-диметилэтандиамина и 20 мг паратолуолсульфокислоти в 300 мл безводного бензола. После концентрирования при пониженном давлении около 50°С извлекают остаточное жидкое масло посредством 300 мл безводного метанола и при температуре, меньшей 10°С, прибавляют 10 г боргидрида натрия, затем обрабатывают реакционную среду в условиях, описанных в соответствии с пунктом А. После перегонки получают 38 г ожидаемого соединения. Ткип=96°C/60 Па. D) N-(пиперидиноэтил)-N-[1-(3-пиридил)этил] амин. N (NR1R2 ; Z1=(CH2)2; Z2=CH-CH3; Аr2=3-пиридил). В колбе, оборудованной сепаратором Дин Старк, нагревают с обратным холодильником в течение примерно 3 часов 7,26 г 3-ацетил-пиридина, 8 г пиперидиноэтиламина, 0,2 г пара-толуол сульфокислоти в 100 мл толуола. Выпаривают под вакуумом растворитель при температуре около 60°С и извлекают жидкое масло в 100 мл безводного метанола; затем при температуре около 5°С прибавляют 2,3 г боргидрида натрия порциями. После перемешивания в течение ночи при комнатной температуре прибавляют 10 мл ацетона для разрушения избытка боргидрида и спустя 15 минут прибавляют 15 мл 5 н водного раствора NaOH. После концентрирования под вакуумом экстрагируют остаток посредством метиленхлорида 3 раза по 50 мл. Органические фазы сушат на безводном сульфате магния, фильтруют и концентрируют под вакуумом. После перегонки получают 11,5 г ожидаемого соединения. Ткип=115°С/42 Па. Е) N,NN-[1-ди(3-пиридил) этил] амин. (W=3-пиpидил; Z1=Z2=CHCH3; Аr2=3-пиридил) При температуре около 5°С прибавляют порциями 8,8 г цианоборгидрида натрия к раствору, содержащему 24,3 г 3-ацетилпиридина и 157 г ацетата аммония в 600 мл метанола, и температуру доводят до примерно 20°С. После перемешивания в течение примерно 14 часов при комнатной температуре в реакционную среду вводят 50 г 3-ацетилпиридина, затем после нескольких часов перемешивания в реакционную среду, охлажденную до температуры 5°С, вводят 5 г цианоборгидрида натрия. Затем дают вернуться к комнатной температуре и после перемешивания в течение примерно 14 часов концентрируют досуха при температуре около 50°С. Затем остаток подкисляют под тягой до рН, близкого 2, путем добавления 12 н водного раствора НСl, фильтруют, а фильтрат доводят примерно до рН=8 в результате прибавления 10 н водного раствора NaOH. Водную фазу экстрагируют этилацетатом и после сушки органической фазы и удаления растворителя остаточное жидкое масло перегоняют под вакуумом при температуре около 140°С и давлении 21 Па. Получают таким образом 32 г амина. Хлоргидрат, полученный при действии НСl на амин в растворе в 400 мл изопропанола, плавится при температуре выше 250°С. Можно выделить 2 диастереоизомера в результате дробного осаждения в водном метаноле. F) N,N-диметил-N'-[2-(3-пиридил)этил]этанди-амин, (R1=R2=CH3; Z1=(CH2)2; Z2=(CH2)2; Аr2=3-пиридил). Нагревают в течение примерно 30 часов при температуре около 60°С 11 г хлоргидрата 2-хлорэтил-3пиридина, 16,3 г N, N-диметилэтан-диамина, 18,5 г бикарбоната натрия и 13 г йодида калия в 150 мл этанола. Выпаривают растворитель и извлекают остаток посредством 100 мл воды перед тем, как прибавить 10 н водный раствор NaOH до рН=8; затем водную фазу экстрагируют 3 раза по 80 мл этилацетатом. Объединенные органические фазы сушат на сульфате магния, фильтруют и концентрируют под пониженным давлением. Остаточное жидкое масло перегоняют, в результате чего получают 6,7 г ожидаемого продукта. Ткип=100-107°C/10 Па G) N-(трет-бутилоксикарбонил)-N-метил-N'-(3-пиридилметил)этандиамин, (R1= СН3; R2=трет-С4Н9ОСО; Z1=(CH2)2; Z2=CH2; Аr2=3-пиридил). При перемешивании к смеси, состоящей из 6 г N-метил-N'-(3-пиридилметил) этандиамина, 95 мл диоксана, 20 мл воды и 1,74 г оксида магния, прибавляют очень медленно при температуре около 3°С, 5,9 г дикарбоната дитретбутила в 60 мл диоксана. Спустя 15 минут в реакционную среду вводят 15 мл примерно 2 н раствора гидроксида натрия; затем осадок отделяют, а фильтрат концентрируют при пониженном давлении; остаток растворяют в примерно 200 мл этилацетата, затем сушат на карбонате калия, и растворитель удаляют при пониженном давлении после фильтрования твердых веществ. Остаточное жидкое масло очищают методом хроматографии на кремнеземе при элюировании этиловым эфиром, а затем смесью метиленхлорид/метанол (95/5 об/об). N,N'-дикарбамат элюируют первым, затем искомый продукт (вес 3,9 г) до карбамата, образованного на азоте, несущем метилпиридильную группу. Н) N-(3-пиридилметил)-N'-(трет-бутилоксикар-бонил)этандиамин, (R1 СН3; = R2=трет-С4Н9ОСО; Z1=(CH2)2; Z2=CH2; Аr2=3-пиридил). При температуре около 5°С вводят 2,92 г 3-пиридилкарбоксальдегида в раствор, содержащий 4,82 г N(трет-бутилоксикарбонил) этандиамина в 50 мл толуола в присутствии дегидратирующего агента (цеолит 4 А). 35546 Диамин может быть получен в соответствии с методом, описанным в J. Med. Chem., 31, 898 (1988). После выдерживания в течение 4 часов при комнатной температуре цеолит отделяют, и растворитель выпаривают при пониженном давлении. Остаточное жидкое масло растворяют в 30 мл безводного метанола, затем вводят в раствор при температуре между 0°С и 5°С 0,68 г боргидрида натрия. После перемешивания в течение 2 часов при комнатной температуре вводят в реакционную среду 10 мл ацетона, затем выпаривают растворители при пониженном давлении. Остаток растворяют в 50 мл метиленхлорида, насыщенного водой с 0,5 г КОН; затем органическую фазу сушат, растворитель удаляют при пониженном давлении, а остаток хроматографируют на кремнеземе; элюирование осуществляют смесью метиленхлорид/метанол (90/10 - об/об). Выделяют таким образом 5,1 г амина в виде жидкого масла. Амины из табл. 1 были получены при использовании одной из методик, приведенных выше. Таблица 1 Амины IV-бис: R4NHCR5R6 R4 R5 R6 N,N-диметил-2аминоэтил N,N-диметил-2аминоэтил N,N-диметил-2аминоэтил N,N-диметил-2аминобутил N,N-диметил-1амино-2-пропил N,N-диметил-3амино-пропил N,N-диметил-3амино-пропил 3-морфолинопропил 3-(1-имидазолил)пропил 3-(1-имидазолил)пропил N,N-диэтил-2аминоэтил N,N-диэтил-2аминоэтил N,N-диизопропил-2-аминоэтил 2-пиридил Н Tкип °С/давление Па 99-101/70 4-пиридил Н 110/70 4-пиридил СН3 80/40 3-пиридил Н 137/50 3-пиридил Н 113/40 3-пиридил Н 103-108/10 3-пиридил СН3 107-110/20 3-пиридил Н 140/2 3-пиридил Н 175/5 3-пиридил СН3 169/10 3-пиридил Н 104/10 3-пиридил СН3 103/6 3-пиридил СН3 116/7 Продолжение табл. 1 N,N-дибутил-2аминоэтил 2-(1-пирролидинил)этил 2-(1-пирролидинил)этил 2-морфолиноэтил 2-морфолиноэтил 2-пиперидиноэтил 4-метил-2пиперазинилэтил N-метил-N-фенил-2-аминоэтил (1-этил)-2-пирролидинилэтил 3-пиридил СН3 143/2 СН3 115117/80 127/70 3-пиридил 3-пиридил 3-пиридил 123/5 3-пиридил СН3 130/4 3-пиридил Н 114/52 3-пиридил Н 3-пиридил Н 170175/3 135/4 3-пиридил СН3 115/70 35546 2-пиридилметил 3-пиридилметил N,N-диметил-4аминофенил N,N-диметил-2аминоэтил N,N-диметил-2аминоэтил N,N-диметил-2аминоэтил 2-метоксиэтил 2-этилтиоэтил N,N-диметилкарбамилметил 3-пиридил 3-пиридил 3-пиридил Н Н Н 3-хинолил Н (N-метил)3-пиридил 3-пиридил Н 135/4 142/5 160166/40 165170/40 140/5 Н 126/120 3-пиридил 3-пиридил 3-пиридил Н Н Н 78/94 70/13 142/4 Тиомочевины формулы VI 1) N-(N',N'-диметил-2-аминоэтил)-N-(3-пири-дилметил) тиомочевина, (R1=R2= СН3; Z1=(СН2)2; Z2=CH2; Аr2=З-пиридил). а) триметилацетилизотиоцианат: медленно прибавляют 18,7 г триметилацетилхлорида к охлажденной до температуры примерно 4°С суспензии, содержащей 15,1 г тиоцианата калия в 150 мл безводного ацетона. Оставляют с перемешиванием в течение примерно 3 часов при той же температуре. b) в предыдущую реакционную среду медленно прибавляют, выдерживая температуру менее 10°С, 20 г N-(диметил-2-ами-ноэтил)-N-(3-пири-дилметил) амина. После одного часа выдерживания при комнатной температуре выпаривают реакционную среду досуха при пониженном давлении и температуре около 60°С и извлекают остаток в метиленхлориде перед тем, как промыть разбавленным раствором аммиака; выпаривают растворитель при пониженном давлении и извлекают полученное жидкое масло посредством примерно 100 мл концентрированной хлороводородной кислоты, которую доводят до температуры примерно 80°С в течение 1 часа. После охлаждения доводят до рН=8 путем прибавления ледяного раствора аммиака, затем экстрагируют 3 раза метиленхлоридом; органические фазы сушат на сульфате магния, удаляют твердые вещества и концентрируют при пониженном давлении и температуре около 60°С. Полученное жидкое масло (41 г) может использоваться в таком виде на следующей стадии или очищаться методом хроматографии при обычном давлении на кремнеземе (элюент: метиленхлорид/метанол - 8/2 об/об). Чистый продукт кристаллизуется в этилацетате. Тпл=104°С. Тиомочевины как промежуточные вещества для синтеза соединений были получены при использовании этой методики; температуры плавления некоторых из них фигурируют в табл. 2. Таблица 2 Тиомочевины: W-Z1 N Ar2-Z2 W-Z1 2-пиридилметил 3-пиридилметил N,N-диметил-2аминоэтил N,N-диэтил-2аминоэтил N,N-диизопропил-2-аминоэтил N,N-диизопропил-2-аминоэтил 2-(1-пиперидинил)этил 2-морфолиноэтил 2-морфолиноэтил N,N-диметил-3аминопропил N,N-диметил-3аминопропил Ar1-Z2 3-пиридилметил 3-пиридилметил 1-(3-пиридил)этил Тпл°С 143 140 89 3-пиридилметил 78 3-пиридилметил 86 1-(3-пиридил)этил 122 3-пиридилметил 107 3-пиридилметил 136137 145146 70 1-(3-пиридил)этил 3-пиридилметил 1-(3-пиридил)этил 90 C S NH2 35546 3-морфолинопропил 3-(1-имидазолил)пропил N,N-диметил-4аминофенил N,N-диметил-4аминобутил N,N-диметил-2аминоэтил 3-пиридилметил 146 3-пиридилметил 3-пиридилметил 136138 180 3-пиридилметил 82 (2-хлор)-3-пиридилметил 162 Альфа-бромкетоны формулы VII J) (2,4,6-триметил)фенил-(2-бром)этанон (VII: Аr1=2, 4, 6-(СН3)3-С6Н2; R3-H; X=Br). Медленно вводят 52 г брома при температуре 10°С в раствор, содержащий 50 г (2, 4, 6триметилфенил) этанона в 100 мл уксусной кислоты. После перемешивания в течение 1 часа при этой температуре и в течение 2 часов при температуре около 20°С реакционную среду приливают к объему ледяной воды и экстрагируют этиловым эфиром. Декатированную органическую фазу промывают 5% водным раствором NаНСО3, затем водой и после сушки на МgS04 концентрируют при пониженном давлении и температуре около 60°С. Получают 66 г жидкого масла, которое может быть очищено дистилляцией или кристаллизацией в пентане при температуре около 20°С. Тпл
ДивитисяДодаткова інформація
Назва патенту англійськоюHeterocyclic derivatives or salts thereof having antagonistic activity relative to paf-acether
Автори англійськоюBernat Andre, Herbert Jean-Marc, Valette Gerard
Назва патенту російськоюГетероциклические производные или их соли, обладающие антагонистической активностью по отношению к фат-ацетеру
Автори російськоюБерна Андрэ, Эрбер Жан-Марк, Валетт Жерар
МПК / Мітки
МПК: A61K 31/425, A61K 31/41, A61K 31/44, A61P 29/00, A61P 7/02, A61K 31/495, C07D 417/12, A61P 37/08, C07D 413/12, C07D 417/14, A61K 31/40, C07D 521/00, A61K 31/42, A61P 9/08, A61P 43/00, A61P 9/00, A61P 11/14, A61K 31/47, A61P 9/10, C07D 413/14, A61P 11/00
Мітки: відношенню, похідні, гетероциклічні, антагоністичну, мають, солі, активність, фат-ацетеру
Код посилання
<a href="https://ua.patents.su/28-35546-geterociklichni-pokhidni-abo-kh-soli-shho-mayut-antagonistichnu-aktivnist-po-vidnoshennyu-do-fat-aceteru.html" target="_blank" rel="follow" title="База патентів України">Гетероциклічні похідні або їх солі, що мають антагоністичну активність по відношенню до фат-ацетеру</a>
Попередній патент: Спосіб одержання похідних 4-оксохіноліну або хромону
Наступний патент: Похідні урацилу, що проявляють гербіцидну активність
Випадковий патент: Пристрій для аналізу вмісту домішок в атмосферному повітрі