Спосіб одержання збагачених бета-аномером нуклеозидів
Номер патенту: 41261
Опубліковано: 17.09.2001
Автори: Томас Едвард Мебрі, Ларрі Вейн Хертел, Лаурі Мішель Потіт, Та-Сен Чоу, Дуглас Петтон К'єлл, Річард Елмер Холмс, Чарлз Девід Джоунс, Кора Сю Гроссман
Формула / Реферат
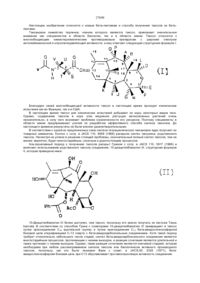
1. Способ получения обогащенных бета-аномером нуклеозидов общей формулы (I):
где Т- фтор,
R представляет нуклеозид, выбранный из группы, состоящей из радикалов
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена,
R2 выбран из группы, состоящей из гидрокси, галогена, первичного амина или вторичного амина,
R4 , R5 и R6 независимо выбраны из группы, состоящей из водорода, -ОН, -NH2, -N(алкил)W, галогена,
Q выбран из группы, состоящей из СН, CR8 или N, где R8 выбран из группы, состоящей из галогена или циано, отличающийся тем, что осуществляют SN2 замещение, необязательно в подходящем растворителе, сульфонилоксигруппы (Y) в обогащенном альфа-аномером карбогидрате формулы (II):
где Х независимо выбран из гидроксизащитных групп,
Т имеет значения, определенные выше, по крайней мере молярным эквивалентом нуклеоснования (R"), выбранного из группы, состоящей из
где R1, R2, R4, R5, R6 и Q имеют значения, определенные выше,
Z представляет собой гидроксизащитную группу,
W представляет аминозащитную группу,
М+ представляет катион,
причем SN2 замещение проводят при температуре 17... (-120) °С и деблокирование с образованием соединения формулы (I).
2. Способ по п. 1, отличающийся тем, что R" выбрано из группы, состоящей из
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена,
Z представляет гидроксизащитную группу,
W представляет аминозащитную группу,
Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенной алкилсульфонилокси и замещенной арилсульфонилокси группы,
причем процесс осуществляют в растворе, имеющем концентрацию карбогидрата более 20 мас. % на единицу объема растворителя, а в качестве растворителя используют инертный растворитель с температурой кипения более 70° С.
3. Способ по п. 1, отличающийся тем, что R" выбран из группы, состоящей из
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена,
R2 выбран из группы, состоящей из гидрокси, галогена, первичного амино или вторичного амино,
Z представляет гидроксизащитную группу,
W представляет аминозащитную группу,
Y выбран из группы, состоящей из трифторметансульфонилокси, 1,1,1-трифторэтансульфонилокси, октафторбутансульфонилокси и нонафторбутансульфонилокси,
причем SN2 замещение проводят при температуре от (-120) до 25 °С с использованием низкозамерзающего инертного растворителя.
4. Способ по п. 1, отличающийся тем, что R" выбран из группы, состоящей из
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена,
Z представляет гидроксизащитную группу,
W представляет аминозащитную группу,
Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенного алкилсульфонилокси и замещенного арилсульфонилокси, причем процесс проводят в присутствии катализатора.
5. Способ по п. 4, отличающийся тем, что катализатор выбирают из высокоионизированных солей, которые являются по существу растворимыми в растворителе и содержат ненуклеофильный анион.
6. Способ по п. 4 или 5, отличающийся тем, что растворитель выбирают из полярных, ненуклеофильных растворителей.
7. Способ по п. 1, отличающийся тем, что R" выбран из группы, состоящей из
где R2 выбран из группы, состоящей из гидрокси, галогена, первичного амино или вторичного амино,
R4, R5, R6 независимо выбраны из группы, состоящей из водорода, -ОН, -NH2, -N(алкил)W, галогена,
Q выбран из группы, состоящей из СН, CR8 и N, где R8 выбран из группы, состоящей из галогена или циано,
Z представляет гидроксизащитную группу,
W представляет аминозащитную группу,
М+ представляет катион,
Y выбран из группы, состоящей из трифторметансульфонилокси, 1,1,1-трифторэтансульфонилокси, октафторбутансульфонилокси и нонафторбутансульфонилокси,
и растворителем является инертный растворитель с температурой замерзания ниже 26 °С.
8. Способ по п. 1, отличающийся тем, что процесс осуществляют в отсутствии растворителя и R" выбирают из группы, состоящей из
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена,
Z представляет собой гидроксизащитную группу,
W представляет аминозащитную группу, где Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенного алкилсульфонилокси и замещенного арилсульфонилокси.
9. Способ по п. 8, отличающийся тем, что реакцию проводят при температуре от 100 до 160 °С.
10. Способ по п. 1, отличающийся тем, что R" выбирают из группы, состоящей из
где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена,
R2 выбран из группы, состоящей из гидрокси, галогена, первичного амино и вторичного амино,
R4, R5, R6 независимо выбраны из группы, состоящей из водорода, -ОН, -NH2, -N(алкил)W, галогена,
Q выбран из группы, состоящей из СН, CR8 и N, где R8 выбран из группы, состоящей из галогена или циано,
Z представляет гидроксизащитную группу,
W представляет аминозащитную группу,
Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенного алкилсульфонилокси и замещенного арилсульфонилокси.
11. Способ по любому из пп. 1-10, отличающийся тем, что гидроксизащитная группа Х соединения формулы (II) представляет бензоил.
12. Способ по любому из пп. 1-10, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет собой метансульфонилокси.
13. Способ по п. 2, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси.
14. Способ по п. 4, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси.
15. Способ по п. 5, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси.
16. Способ по п. 6, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси.
17. Способ по п. 8, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси.
18. Способ по п. 9, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси.
19. Способ по п. 10, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси.
20. Способ по п. 1, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет трифторметансульфонилокси.
Текст
1. Способ получения обогащенных бетааномером нуклеозидов общей формулы (I): (I) (19) UA (11) 41261 , где Т- фтор, R представляет нуклеозид, выбранный из группы, состоящей из радикалов где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена, где R1, R2, R4, R5 , R6 и Q имеют значения, определенные выше, Z представляет собой гидроксизащитную гр уппу, W представляет аминозащитную группу, М+ представляет катион, 41261 причем SN2 замещение проводят при температуре 17...(-120)°С и деблокирование с образованием соединения формулы (I). 2. Способ по п. 1, отличающийся тем, что R" выбрано из группы, состоящей из которые являются по существу растворимыми в растворителе и содержат ненуклеофильный анион. 6. Способ по п. 4 или 5, отличающийся тем, что растворитель выбирают из полярных, ненуклеофильных растворителей. 7. Способ по п. 1, отличающийся тем, что R" выбран из группы, состоящей из где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена, Z представляет гидроксизащитную гр уппу, W представляет аминозащитную группу, Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенной алкилсульфонилокси и замещенной арилсульфонилокси группы, причем процесс осуществляют в растворе, имеющем концентрацию карбогидрата более 20 мас. % на единицу объема растворителя, а в качестве растворителя используют инертный растворитель с температурой кипения более 70°С. 3. Способ по п. 1, отличающийся тем, что R" выбран из группы, состоящей из где R2 выбран из группы, состоящей из гидрокси, галогена, первичного амино или вторичного амино, R4, R5, R6 независимо выбраны из группы, состоящей из водорода, -ОН, -NH2, -N(алкил)W, галогена, Q выбран из группы, состоящей из СН, CR8 и N, где R8 выбран из группы, состоящей из галогена или циано, Z представляет гидроксизащитную гр уппу, W представляет аминозащитную группу, М+ представляет катион, Y выбран из группы, состоящей из трифторметансульфонилокси, 1,1,1-трифторэтансульфонилокси, октафторбутансульфонилокси и нонафторбутансульфонилокси, и растворителем является инертный растворитель с температурой замерзания ниже 26°С. 8. Способ по п. 1, отличающийся тем, что процесс осуществляют в отсутствии растворителя и R" выбирают из группы, состоящей из где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена, R2 выбран из группы, состоящей из гидрокси, галогена, первичного амино или вторичного амино, Z представляет гидроксизащитную гр уппу, W представляет аминозащитную группу, Y выбран из группы, состоящей из трифторметансульфонилокси, 1,1,1-трифторэтансульфонилокси, октафторбутансульфонилокси и нонафторбутансульфонилокси, причем SN2 замещение проводят при температуре от (-120) до 25°С с использованием низкозамерзающего инертного растворителя. 4. Способ по п. 1, отличающийся тем, что R" выбран из группы, состоящей из где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена, Z представляет собой гидроксизащитную гр уппу, W представляет аминозащитную группу, где Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенного алкилсульфонилокси и замещенного арилсульфонилокси. 9. Способ по п. 8, отличающийся тем, что реакцию проводят при температуре от 100 до 160°С. 10. Способ по п. 1, отличающийся тем, что R" выбирают из группы, состоящей из где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена, Z представляет гидроксизащитную гр уппу, W представляет аминозащитную группу, Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенного алкилсульфонилокси и замещенного арилсульфонилокси, причем процесс проводят в присутствии катализатора. 5. Способ по п. 4, отличающийся тем, что катализатор выбирают из высокоионизированных солей, 2 41261 мулы (II) представляет собой метансульфонилокси. 13. Способ по п. 2, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси. 14. Способ по п. 4, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси. 15. Способ по п. 5, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси. 16. Способ по п. 6, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси. 17. Способ по п. 8, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси. 18. Способ по п. 9, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси. 19. Способ по п. 10, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет метансульфонилокси. 20. Способ по п. 1, отличающийся тем, что сульфонилоксигруппа Y соединения формулы (II) представляет трифторметансульфонилокси. где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галогена, R2 выбран из группы, состоящей из гидрокси, галогена, первичного амино и вторичного амино, R4, R5, R6 независимо выбраны из группы, состоящей из водорода, -ОН, -NH2, -N(алкил)W, галогена, Q выбран из группы, состоящей из СН, CR8 и N, где R8 выбран из группы, состоящей из галогена или циано, Z представляет гидроксизащитную гр уппу, W представляет аминозащитную группу, Y выбран из группы, состоящей из алкилсульфонилокси, арилсульфонилокси, замещенного алкилсульфонилокси и замещенного арилсульфонилокси. 11. Способ по любому из пп. 1-10, отличающийся тем, что гидроксизащитная группа Х соединения формулы (II) представляет бензоил. 12. Способ по любому из пп. 1-10, отличающийся тем, что сульфонилоксигруппа Y соединения фор Данное изобретение относится к процессу стереоселективного гликозилирования для получения 2'-дезоксифторнуклеозидов и к промежуточным продуктам данного процесса. Непрерывный интерес, проявляемый к синтезу 2'-дезоксифторнуклеозидов и их аналогов, основывается на их успешном использовании в качестве терапевтических агентов для лечения вирусных и раковых заболеваний. Соединением, представляющим особый интерес, является гемцитабин; см. европейское патентное описание № 211354 и патент США 4526988. Поскольку эти соединения являются бета-нуклеозидами, существует потребность в предоставлении таких соединений с высоким выходом. Существенной стадией в процессе синтеза 2'дезоксифторнуклеозидов является конденсация или гликозилирование нуклеооснования и карбогидрата (углевода) с образованием N-гликозидной связи. Однако процессы синтеза 2'-дезоксинуклеозидов, как правило, являются нестереоседективными и приводят к образованию смесей альфа- и бета-нуклеозидов. Например, процесс по патенту США 4526988 не приводил к стереоселективному получению 2-дезокси-2,2-дифтор-бета-нуклеозидов, а вместо этого да вал 4:1 аномерное отношение α и β 2-дезокси-2,2-дифторнуклеозида. Даже оптимизация защитных групп не смогла увеличить соотношение альфа и бета за пределы 1:1; см. патент США 4965374, по которому использовались карбогидрат с бензоильными защитными или блокирующими группами. Согласно настоящему изобретению предлагается стереоселективный процесс гликозилирования для получения обогащенного бета-аномером нуклеозида формулы: (I) , где Т выбран из водорода или фтора, и R представляет нуклеозид, выбранный из группы, состоящей из 3 41261 и где R1 выбран из группы, состоящей из водорода, алкила, замещенного алкила и галоида; R2 выбран из группы состоящей из гидрокси, галоида, азидо, первичного амино и вторичного амино; R3 выбран из группы, состоящей из водорода, алкила и галоида; R4, R5, R6 независимо выбраны из группы, состоящей из водорода, -OH, -NH2, N (алкила), галоида, алкокси и тиоалкила; R7 выбран из группы, состоящей из водорода, галоида, циано, алкила, алкокси, алкоксикарбонила, тиоалкила, тиокарбоксамида и карбоксамида; Q выбран из группы, состоящей из CН, СR8 и N; где R8 выбран из группы, состоящей из галоида, карбоксамида, тиокарбоксамида, алкоксикарбонила и нитрила, включающий SN2 нуклеофильное замещение сульфонилокси группы (Y) обогащенного альфа-аномером карбогидрата формулы: (II) , где Х независимо выбран из гидрокси-защитных групп, и Т имеет значения, определенные выше; по крайней мере, молярным эквивалентом нуклеооснования (R"), выбранного из группы, состоящей из: где: R1-R7 и Q имеют значения, определенные выше; Z представляет гидрокси-защитную гр уппу (т.е. группу, защищающую гидрокси-группу); W представляет амино-защитную группу и M+ представляет катион; и деблокирование с образованием соединения формулы (І). На протяжении данного описания все температуры представлены в градусах Цельсия, все пропорции, процентные содержания и аналогичные выражены в весовых единицах, а все смеси в объемных единицах, если не указано иное. Аномерные смеси выражены в виде соотношения вес/вес или в процентах. Термин "лактол" один или в сочетании с другими относится к 2-дезокси-2,2-дифтор-D-рибофу-ранозе или 2-дезокси-2-фтор-D-рибофуранозе. Термин "ксилолы" сам по себе или в сочетании относится ко всем изомерам ксилола и их смесям. Термин "карбогидрат" один или в сочетании относится к активированному лактолу, в котором гидрокси группа в С-1 положении замещена желаемой удаляемой или уходящей группой. Термин "галоид" сам по себе или в сочетании относится к хлору, йоду, фтору или брому. Термин "алкил" сам по 4 41261 себе или в сочетании относится к алифатическим углеводородным группам с прямой, циклической и разветвленной цепью, которые содержат от 1 до 7 атомов углерода, и предпочтительно, содержат до 4 атомов углерода, таким как метил, этил, нпропил, изопропил, н-бутил, трет-бутил, н-пентил, н-гексил, 3-метилпентил и аналогичные группы, или к замещенным алифатическим углеводородным группам с прямой, циклической или разветвленной цепью, таким как хлорэтил, 1,2-дихлорэтил и аналогичные. Tepмин "алкокси" один или в сочетании относится к соединениям общей формулы АО; где А представляет алкил. Термин "арил" один или в сочетании относится к карбоциклическим или гетероциклическим группам, таким как фенил, нафтил, тиенил и их замещенные производные. Термин "тиоалкил" один или в сочетании относится к общей формуле BS: где В представляет алкил или водород. Термин "сложный эфиp" один или в сочетании относится к общей формуле ЕООС, где Е представляет алкил или арил. Термин "ароматический" один или в сочетании относится к бензольно/подобным структурам, содержащим (4n+2) делокализованных p электронов. Термины "сульфонат" или "сульфонилокси" сами по себе или в сочетании относятся к соединениям общей формулы ВSО3, где В представляет алкил, замещенный алкил, арил или замещенный арил. Термин "замещенный" один или в сочетании относится к замещению одной или большим числом групп, выбранных из циано, галоида, карбоалкокси, толуоила, нитро, алкокси, алкила и диалкиламино. Фраза "обогащенный аномером" одна или в сочетании относится к аномерной смеси, в которой соотношение конкретных аномеров составляет выше чем 1:1 и включает по существу чистый анонер. Термин "концентрированный" один или в сочетании относится к раствору, в котором весовое содержание карбогидрата, растворенного в растворителе, составляет выше чем 20% по весу на единицу объема растворителя. Например, растворение 100 грамм карбогидрата в 200 миллилитрах растворителя даст 50-процентный раствор карбогидрата. Термин "сопряженный анион" относится к аниону общей формулы ВSО3-, где В имеет значения, определенные выше. Термин "аномеризация" одни или в сочетании относится к эпимеризации в С-1 положении рибофуранолильного производного. В соответствии с настоящим процессом гликозилирования обогащенные бета-аномером 2'-дезокси-2', 2'-дифторнуклеозиды и 2'-дезокси-2'-фторнуклеозиды формулы (I) получаются с помощью взаимодействия обогащенного альфа-аномером карбогидрата формулы (II) с, по крайней мере, молярным эквивалентом нуклеооснования (R") и деблокирования получающегося в результате нуклеозида, как показано ниже: Считается, что реакция гликозилирования протекает через SN2 замещение (вытеснение). Следовательно, обогащенные бета-аномером нуклеозидные продукты настоящего изобретения получаются стереоселективно в результате реакции нуклеооснования с обогащенным альфа-аномером карбогидратом. Лактольные исходные материалы, подходящие для использования при получении обогащенного альфа-аномером карбогидрата формулы (II), используемого в настоящем процессе гликозилирования, являются известными и свободно синтезируются с помощью стандартных процедур, обычно применяемых специалистами в данной области техники. Например, в патенте США 4526988, упомянутом здесь для сведения, раскрывается синтез 2,2дифтор-2-дезокси-D-рибофуранозных промежуточных соединений формулы (III) , где X представляет гидрокси-защитную гр уппу. Кроме того, авторы Reichman и др., Carbohydr. Res., 42, 233 (1975) раскрывают синтез 2-дезокси2-фтор-D-рибофураноз формулы (IV) , где Х представляет гидрокси-защитную гр уппу. В предпочтительном воплощении настоящего процесса применяется обогащенное альфа-аномером 2,2-дифтор-2-дезокси-D-рибофуранозо-3,5дибензоатное промежуточное соединение формулы (III). Ключевой основой настоящего изобретения является обнаружение того, что новое обогащенное альфа-аномером карбогидратное промежуточное соединение формулы (III) или (IV) может вводиться в реакцию в условиях н уклеофильного замещения, которые благоприятствуют инверсии (т.к. SN2), давая обогащенные бета-аномером нуклеозиды формулы (I). Для достижения эффективной реакции между нуклеооснованием и обогащенным альфа-аномером карбогидратом формулы (II) к лактолу должна быть присоединена стереоселективно соответствующая удаляемая группа (V) для активации лактола и генерирования обогащенного альфа-аномером карбогидрата формулы (II). Однако конкретная выбранная удаляемая группа зависит от выбранного нуклеооснования и выбранных условий реакции гликозилирования. Получение обогащенного альфа-аномером карбогидратного промежуточного соединения формулы (II) предпочтительно осуществляется по методике, описанной в двух находящихся совместно на рассмотрении заявках США 07/902301 и 07/902305. В заявке № 07/902301 описывается стереселективный процесс получения обогащенного α где Y, X, Т, R" и R имеют значения, определенные выше. 5 41261 аномером промежуточного соединения формулы (II), где Т представляет фтор, с помощью взаимодействия лактола формулы (III) с аминовым основанием, имеющим показатель рКа от 8 до 20, в низко замерзающем инертном растворителе; доведения температуры реакционной смеси до примерно -40°С…-120°С; и добавления сульфонирующего реагента. Аминовое основание предпочтительно выбирается из группы, состоящей из триэтиламина, трибутиламина, дибутиламина, диэтилметиламина, диметилэтиламина, бензилметиламина, Nметилморфолина, трипропиламина, дипропилэтиламина, N,N-диметилбензиламина, диизопропилэтиламина, диэтиламина, 1,8-диазабицикло (5.4.0) ундец-7-ена и 1,5-диазабицикло (4.3.0) нон5-ена. Количество основания, предпочтительно применяемое, изменяется в пределах примерно от 1 молярного эквивалента до 2 молярных эквивалентов и более, предпочтительно примерно от 1,2 молярного эквивалента до 1,5 молярных эквивалентов. Реакция осуществляется в инертном растворителе, имеющем точку замерзания предпочтительно ниже -78°С. Предпочтительные растворители выбираются из группы, состоящей из дихлорметана, 1,2-дихлорэтана, дихлорфторметана, ацетона, толуола, анизола, хлорбензола, и их смесей. Температура смеси растворителей составляет предпочтительно примерно ниже -78°С. Например, соединение формулы III, в которой Х представляет бензоил, добавлялось к дихлорметану и триэтиламину при комнатной температуре в течение 30 минут. Затем температура реакции понижалась. Данные 19F ЯМР снимались при различных температурах и показали, что по мере того как температура понижалась, происходило увеличение α:β аномерного отношения ионизированного лактола: Температура Соотношение альфа/бета 19°С 2,0:1 -3°С 2,3:1 -23°С 2,5:1 -43°С 3,0:1 -63°С 3,6:1 -83°С 4,4:1 Ионизированный лактол затем захватывается в растворе при более низкой температуре и более высоком отношении альфа-аномера добавлением сульфонирующего (сульфирующего) агента, образуя обогащенный α-аномером карбогидрат формулы (II). Таким образом, с помощью соответствующего подбора температуры можно варьировать соотношение α и β карбогидратного промежуточного исходного материала. Удаляемая группа (V) присоединяется к лактолу с помощью сульфирования. Сульфирующие реагенты предпочтительно выбираются из группы, состоящей из замещенных и незамещенных сульфир ующи х алкилгалогенидов, замещенных и незамещенных арил-сульфирующи х галогенидов и ангидридов алкилсульфокислот и ангидридов арилсульфокислот, таких как метансульфонилгалогенид, этансульфониогалогенид, 2-хлор-1-этансульфонилгалогенид, п-нитробензолсульфонилга логенид, 2,4-динитробензолсульфонилгалогенид, бромбензолсульфонилгалогенид, дибромбензолсульфонилгалогенид, ангидрид бензолсульфокислоты, ангидрид п-бромбензолсульфокислоты и ангидрид метансульфокислоты, и замещенных и незамещенных фторалкил- и фторарил сульфирующи х галогенидов и ангидридов фторалкил- и фторарил-сульфокислот, таких как трифторметансульфонилангидрид, трифторметансульфонилгалогенид, 1,1,1-трифторэтансульфонилгалогенид, 1,1,1-трифторэтансульфонил ангидрид, галоидангидрид октафтор-замещенной кислоты, ангидрид октафтор-замещенной кислоты, галоидангидрид и ангидрид нонафтор-замещенной кислоты, в зависимости от желаемой удаляемой группы; более предпочтительным является метансульфонилгалогенид. Обогащенные α-аномером карбогидратные промежуточные продукты, полученные из нонизированных лактолов, особенно карбогидраты, содержащие трифторметансульфонилокси, являются нестабильными при комнатной температуре и поэтому предпочтительно подвергаются peaкции с нуклеооснованием на месте. Вследствие реакционноспособности сульфирующих реагентов может быть также желательным осуществлять реакцию гликозилирования периодическим или непрерывным способом для операций в крупном масштабе. Обогащенные α-аномером промежуточные соединения формулы (II), в которой Т представляет водород, могут получаться аналогичным образом, за исключением того, что в качестве исходного материала используется лактол формулы (IV). В заявке США 07/902305 описывается еще один стереоселективный процесс получения обогащенных α-аномером промежуточных соединений формулы (II), где Т представляет фтор, с помощью обработки бета-аномера рибофуранозилсульфоната формулы (V) , где Y представляет сульфонат и каждый Х независимо выбран из гидрокси-защитных групп, источником сопряженного аниона сульфокислоты, при повышенных температурах, в инертном растворителе. Сопряженный анион сульфокислоты может получаться с помощью ряда приемов, известных специалистам в данной области. Они включают: (а) нейтрализацию алкил- или арил-сульфокислоты, такой как 1-метансульфокислота, пметилбензолсульфокислота, этансульфокислота, п-толуолсуль фокислота, бензолсульфокислота, пбромбензолсульфокислота и камфорсульфокислота, щелочнометаллическим основанием, таким как гидроокись натрия, гидрид натрия, гидроокись калия, трет-бутилат калия, метилат натрия и аналогичные; (b) нейтрализацию алкил или арил-сульфокислот аминовым основанием, таким как триэтиламин, триметиламин, N,N-диметилбензиламин или N-метилморфолин, или ароматическим азотным основанием, таким как пиридин. 6 41261 Примеры сопряженных анионов сульфокислот, получаемых с помощью данного метода, включают триэтиламмоний-метан-сульфонат, метансульфонат триметиламмония, метансульфонат N,N-диметилбензиламмония, пиридинийметансульфонат, триэтиламмоний (п-бромбензол)сульфонат, тетраэтиламмоний (п-бромбензол)сульфонат, тетраэтиламмоний (п-толуол)сульфонат, пиридиний (п-толуол)сульфонат и пиридиний-3нитро-бензолсульфонат; более предпочтительным является метансульфонат триэтиламмония; и, наконец (с) сопряженный анион сульфокислоты может получаться на месте по реакции 2-дезокси-2,2дифтор-D-рибофуранозы с сульфоновым ангидридом, таким как бензолсульфоновый ангидрид, пбромбензолсульфоновый ангидрид или метансульфо ангидрид, в основании, таком как триэтиламин. Продукты реакции представляют собой, например, 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-ди-0-бензоил-1-метансульфонат и триэтиламмонийметансульфонат. Бета-аномерный рибофуранозилсульфонат и сопряженный анион сульфокислоты нагреваются при температуре примерно от 50°С до 130°С и более предпочтительно до температуры дефлегмации смеси растворителей. Растворители, подходящие для использования в процессе аномеризации должны быть инертными по отношению к условиям реакции; предпочтительными являются ацетонитрил, 1,2дихлорэтан, 1,1,2-трихлорэтан, хлорбензол, бромбензол, дихлорбромметан, анизол, глим, диглим, метил трет-бутиловый эфир, тетрагидрофуран, диоксан, этилацетат, толуол, ксилолы, пиридин, Nметилпирролидинон, N,N-диметилформамид, 1,3диметил-2-имидазолидинон, N,N-диметилацетамид, и их смеси; наиболее предпочтительными являются анизол, толуол, глим, ацетонитрил и их смеси. Для увеличения растворимости и нуклеофильности металлических солей, используемых в качестве источника сопряженного аниона сульфокислоты может добавляться катализатор, выбранный из кроун-эфиров или катализаторов переноса фаз; предпочтительные катализаторы выбираются из 18-Kрoун-6, 15-Кроун-5, 12-Kpoун-4 и трис [2(2-метоксиэтокси)-этил]амина. Данный процесс осуществляется в а тмосферных условиях и предпочтительно безводных, и по существу завершается за период примерно от 15 минут до 24 часов. Получающиеся в результате обогащенные α-аномером карбогидраты формулы (II) получаются с аномерным отношением примерно от 2,3:1 до 3,0:1 альфа к бета. Обогащенные α-аномером промежуточные соединения формулы (II), где Т представляет водород, могут получаться aнaлогичным образом, за исключением того, что в качестве исходного материала используется лактол формулы (IV). Реакции гликозилирования обычно требуют защиты гидрокси групп лактола перед их использованием для того, чтобы воспрепятствовать реакции их гидрокси групп с нуклеооснованием, или разложению каким-либо образом. Гидрокси-защитными группами (X), подходящими для использования, в настоящем процессе гликозилирова ния являются группы, независимо выбранные из известных защитных групп, используемых в синтетической органической химии. Каждая выбранная гидрокси-защитная группа предпочтительно способна эффективно вводиться в лактол и легко удаляется из него после того, как реакция гликозилирования завершается. Гидрокси-защитные группы, известные в технике, описываются в гл. 3 работы Protective Groups in Organic Chemistry, MeOmil изд. Пленум Пресс, Нью-йорк (1973) и гл. 2 работы Protective Groups in Organic Synthesis, Green, John, J.Wiley and Sons, Нью-йорк (1981); предпочтительными являются сложные эфиробразующие гр уппы, такие как формил, ацетил, замещенный ацетил, пропионил, бутинил, пиваламидо, 2-хлорацетил, бензоил, замещенный бензоил, феноксикарбонил, метоксиацетил; карбонатные производные, такие как феноксикарбонил, этоксикарбонил, трет-бутоксикарбонил, винилоксикарбонил, 2,2,2-трихлорэтоксикарбонил и бензилоксикарбонил; алкильные простой эфиробразующие гр уппы, такие как бензил, дифенилметил, трифенилметил, трет-бутил, метоксиметил, тетрагидропиранил, аллил, тетрагидротиенил, 2метоксиэтилокси-метил; и силильные простойэфир-образующие группы, такие как триалкилсилил, триметилсилил, изопропидиалкилсилил, алкилдиизопропилоилил, триизопропилсилил, третбутилдиалкилсилил и 1,1,3,3-тетраизопропилдисилоксанил; карбаматы, такие как N-фенилкарбамат и N-имидазоил-карбамат; однако более предпочтительными являются бензоил, монозамещенный бензоил и дизамещенный бензоил, ацетил, пивалоил, трифенилметиловые эфиры, и силильные простой эфир-образующие группы, особенно, трет-бутилдиметилсилил; причем наиболее предпочтительной является бензоил. При присоединении гидрокси-защитных групп к лактолу применяются обычные условия реакции и зависят от характера выбранной конкретно гидрокси-защитной группы. Типичные реакционные условия описаны в патенте США 4526988. В соответствии с настоящим процессом применяется, по крайней мере, эквимолярное количество нуклеооснованя (R") относительно количества применяемого карбогидрата. Однако более предпочтительно использовать избыток нуклеооснования в пределах примерно от 1 молярного эквивалента до 30 молярных эквивалентов; более предпочтительно примерно от 10 молярных эквивалентов до 20 молярных эквивалентов и наиболее предпочтительно примерно от 15 до 20 молярных эквивалентов. Применяемые здесь нуклеооснования (R") обычно известны химикам-органикам и нет необходимости в обсуждении их синтеза. Однако для того, чтобы быть полезными в настоящем процессе гликозилирования, нуклеооснования или их таутомерные эквиваленты, которые несут амино или гидрокси группы, должны предпочтительно содежать защитные группы, такие как первичные амино-защитные группы (W) и/или гидроксизащитные группы (Z), в зависимости от характера нуклеооснования. Защищающие гр уппы препятствуют гидрокси или амино группам давать возможность конкурентных реакционных участков для обогащенного α-аномером карбогидрата. Защит 7 41261 ные группы присоединяются к нуклеооснованию (R") перед тем, как оно подвергается реакции с обогащенным альфа-аномером карбогидратом формулы II, и после этого они удаляются. Процедура присоединения защитных гр упп к нуклеооснованиям описывается в патенте США 4526988. Предпочтительные амино-защитные группы (W) для пиримидиновых нуклеооснований выбираются из группы, состоящей из силильных образующи х простой эфир-групп, таких как триалкилсилил, трет-бутилдиалкилсилил и трет-бутилдиарилсилил; карбаматов, таких как трет-бутоксикарбонил бензилоксикарбонил, 4-метоксибензилоксикарбонил и 4-нитробензилоксикарбонил; формила, ацетила, бензоила и пиваламидо; образующи х простой эфир-групп, таких как метоксиметил, трет-бутил, бензил, аллил и тетрагидропиранил; более предпочтительной группой является триметилсилил. Предпочтительные амино-защитные группы (W) для пуриновых нуклеооснований выбираются из группы, состоящей из алкилкарбоксамидов, галоидалкилкарбоксамидов и арилкарбоксамидов, таких как 2-триалкилсилилэтоксиметил, 4-метоксибензил, 3,4-диметоксибензил, третбутил, фталамидо, тетрагидропиранил, тетрагидрофуранил, метоксиметиловый эфир, метокситиометил, тритил, пиваламидо, трет-бутилдиметилсилил, трет-гексилдиметилсилил, триизопропилсилил, трихлорэтоксикарбонил, трифторацетил, нафтоил, формил, ацетил; сульфонамидов, таких как сульфонамидо и арилсульфонамидо, и более предпочтительной является пиваламидо. Помимо того, что она служит в качестве группы, защищающей амино группу, пиваламидо защитная группа увеличивает растворимость заведомо нерастворимых производных пуриновых нуклеооснований и направляет реакцию N-гликозидного сочетания пуриновых оснований в сторону 9 региоизомера в противоположность 7 региоизомеру. Предпочтительные гидрокси-защитные группы (Z) для пиримидиновых нуклеооснований выбираются из силильных образующи х простой эфиргрупп, таких как триалкилсилил; карбаматов, таких как трет-бутоксикарбонил, бензилоксикарбонил, 4метоксибензилоксикарбонил и 4-нитробензилоксикарбонил; карбоциклических сложных эфиров, таких как формил, ацетил и пиваламидо; предпочтительной является триметилсилил. Предпочтительные гидрокси-защитные группы (Z) для пуриновых нуклеооснований выбираются из группы, состоящей из образующих простой эфир-групп, таких как бензил, трет-бутил, тритил, те трагидропиранил, тетрагидрофуранил, метоксиметил, тритил; сложных эфиров, таких как формил, ацетилпропионил, пиваламидо, бензоил, замещенный бензоил; карбонатов, таких как карбобензокси, трет-бутоксикарбонил, карбэтокси, винилоксикарбонил; карбаматов, таких как N,N-диалкилкарбамоил; триалкилсилиловых эфиров, таких как третбутилтриметилсилил, трет-гексилдиметилсилил, триизопропилсилил; более предпочтительной является пиваламидо. Давая защитные группы нуклеооснованиям настоящего процесса, данные защитные группы сами по себе могут быть защищены. Например, Nацетилцитозин может зaщищaтьcя триметилсилилом, давая бис-триметилсилил-N-ацетилцитозин. В дополнение к изложенному часто целесообразно превращать любые кето-кислородные атомы нуклеооснования в энольную форму. Это делает нуклеооснование более ароматическим и усиливает реакционноспособность нуклеооснования по отношению к обогащенному альфа-аномером карбогидрату формулы (II). Наиболее удобно энолизировать кето-кислородные aтoмы и обеспечивать их силильными защитными группами. Хотя и не существенно, целесообразно, чтобы реакция между обогащенным α-аномером карбогидратом формулы (II) и нуклеооснованием осуществлялась в сухой атмосфере, например, в сухом воздухе, азоте или аргоне. Это объясняется тем, что некоторые производные нуклеооснований, такие как силилированные производные нуклеооснований, являются чувствительными к влаге. Любые растворители, используемые для получения нуклеооснования, могут перед реакцией гликозилирования удаляться или смешиваться с реакционным растворителем при условии, что данная смесь является инертной по отношению к реакции гликозилирования. В случае, когда реакция гликозилирования осуществляется в реакционном растворителе, растворитель должен быть инертньм по отношению к peaкции гликозилирования. Однако, как упоминалось ранее, конкретный применяемый растворитель для реакции будет зависеть от условий peaкции гликозилирования (например, температуры реакции, растворителя), удаляемой группы и применяемого нуклеооснования. Реакция гликозилирования может осуществляться при температуре в пределах примерно от 170°С до -120°С в атмосферных условиях и обычно в основном завершается примерно через 5 минут - 20 часов. За ходом настоящего процесса можно следить с помощью процедур, хорошо известных специалистам в данной области техники, таких как жидкостная хроматография высокого давления (HPLC) или тонкослойная хроматография, которые могут использоваться для обнаружения образования нуклеозидного продукта. Когда реакция проводится в растворе, предпочитается, чтобы использовался высококипящий инертный растворитель и раствор, имеющий концентрацию карбогидрата, по крайней мeре, 20 процентов карбогидрата. Предпочитается концентрация карбогидрата примерно от 20% до 70%; и наиболее предпочтительно примерно от 30% до 50%. Подходящий интервал реакционных температур составляет примерно от 70°С до 170°С. Высококипящий растворитель имеет предпочтительно точку кипения выше примерно 70°С и выбирается из группы, состоящей из ненуклеофильных, ароматических, галоидалкильных, алкокси и галоид-замещенных ароматических растворителей, и их смесей. Предпочтительными растворителями являются 1,2-дихлорэтан, 1,1,2-трихлорэтан, глим, диглим, толуол, ксилолы, анизол, дихлорбромметан, хлорбензол, дибромхлорметан, трибромметан, дибромметан, ацетонитрил, пропионитрил, диоксан, и их смеси; причем более предпочтительным является анизол. 8 41261 Обогащенный альфа-аномером карбогидрат формулы (II), используемый с высококипящими растворителями, содержит сульфонилокси группу выбранную из алкилсульфонилокси, арилсульфонилокси, замещенных алкилсульфонилокси и замещенных арилсульфонилокси групп, такую как метансульфонилокси, 2-хлор-1-этансульфонилокси, толуолсульфонилокси, п-нитробензолсульфонилокси и п-бромбензолсульфонилокси. Нуклеооснование (R"), предпочитаемое для использования с высококипящими растворителями, представляет собой соединение, выбранное из группы, состоящей из нилокси, предпочтительная температура реакции варьирует примерно от -20°С до 25°С и более предпочтительной является температура примерно от 0°С до 25°С. Нуклеооснования (R"), предпочтительные для использования в условиях низких температур, являются соединениями, выбранными из группы, состоящей из где R1, R2 , R3, Z и W имеют значения, определенные выше. Нуклеооснование (R") может необязательно превращаться в соль катиона металла для усиления его нуклеофильной реакционноспособности с обогащенным α-аномером карбогидратом формулы (II) (т.е. анионное гликозилирование). Эти катионные соли нуклеооснований приготавливаются с помощью добавления к нуклеооснованию в растворителе основания. Основание может выбираться из группы, состоящей из трет-бутилата натрия, гидрида натрия, метилата натрия, этилата натрия, гидрида лития, гидрида калия, гидроокиси калия, метилата калия, этилата калия и т-бутилата калия. Альтернативно, основание может выбираться из триалкиламина или тетраалкиламмония. Подходящие инертные растворители для реакции могут выбираться из группы, состоящей из ацетонитрила, диметилформамида, диметилацетамида, 1,3-диметил-2имидазолидинона, тетрагидрфурана, сульфолана, N-метилпирролидинона, диметилсульфоксида и их смесей. Растворитель может удаляться перед реакцией гликозилирования или смешиваться с растворителем для реакции гликозилирования при условии, что смесь является по существу инертной по отношению к реакции гликозилирования. Подходящие температуры реакции варьируют примерно от 23°С до 130°С. Нуклеооснование (R") предпочтительно выбирается из группы, состоящей из следующи х где R1, R3, Z и N имеют значения, определенные выше. Когда обогащеный α-аномером карбогидрат формулы (II) содержит фторсульфонилокси группу, он является нестабильным при температурах выше комнатной температуры. Поэтому реакции гликозилировання с применением этих сульфонилокси групп должны осуществляться при температуре, равной или ниже комнатной температуры. Когда реакция гликозилирования проходит в эти х условия х, растворитель должен быть низкозамерзающим. Предпочтительный интервал температур для реакции составляет примерно от 25°С до -120°С. В этом случае предпочтительные растворители выбираются из группы, состоящей из дихлометана, 1,2-дихлорэтана, дихлорфторметана, ацетона, толуола, анизола, хлорбензола, и их смесей; более предпочтительным является дихорметан. Однако oптимальная температура реакции гликозилирования, проводимой при низких температурах зависит от удаляемой группы (V). Например, когда удаляемой группой является трифторметансульфонилокси, предпочтительный интервал температуры реакции составляет примерно от -50°С до 25°С; причем более предпочтительной является температура примерно от -20°С до 25°С. Однако, когда удаляемой группой является 1,1,1-трифторэтансульфонилокси, октафторбутансульфонилокси или нанофторбутансульфо 9 41261 до 160°C; и наиболее предпочтительной является температура примерно от 130°С до 150°С. Обогащенный α-аномером карбогидрат формулы (II) в условия х конденсации содержит сульфонилокси группу, выбранную из алкилсульфонилокси, арилсульфонилокси, замещенной алкилсульфонилокси и замещенной арилсульфонилокси, такую как метансульфонилокси, 2-хлор-1-этансульфонилокси, толуолсульфонилокси, п-нитробензолсульфонилокси и п-бромбензолсульфонилокси. Нуклеооснование (R"), подходящее для использования в условиях сплавления, предпочтительно выбирается из группы, состоящей из где R1-R7, Q, Z, W и М+ имеют значения, определенные выше. Обогащенный альфа-аномером карбогидрат формулы (II) в эти х условиях содержит сульфонилокси группу, выбранную из алкилсульфонилокси, арилсульфонилокси, замещенной алкилсульфонилокси, замещенной арилсульфонилокси, фтор-алкилсульфонилокси и фтор-арилсульфонилокси, такую как трифторметансульфонилокси, 1,1,1-трифторэтансульфонилокси, октафторбутансульфонилокси, нанофторбутансульфонилокси, метансульфонилокси, 2-хлор-1-этансульфонилокси, толуолсульфонилокси, п-нитробензолсульфонилокси и п-бромбензолсульфонилокси. Как отмечалось ранее, фтор-сульфонилокси группы формулы (II) имеют тенденцию быть нестабильными при более высоких температурах и указанная выше реакция с солью нуклеооснования с катионом метала должна проводиться с использованием низкозамерзающего инертного растворителя с такими группами. Предпочтительные температы для реакции варьируют примерно от 25°С до -120°С. Реакция гликозилирования может также проводиться в отсутствии растворителя (т.е. гликозилирование в расплаве). Очевидно, применяемая температура должна быть достаточной для превращения обогащенного α-аномером карбогидратного промежуточного соединения формулы (II) и нуклеооснования в фазу расплава. Предпочтительные температуры реакции варьируют примерно от 100°C до 160°С; однако более предпочтительной является температура примерно от 110°С где R1, R3, Z и W имеют значения, определенные выше. Настоящий процесс может также промотироваться катализатором. Когда применяется катализатор, он существенно снижает количество требуемого нуклеооснования, увеличивает стереоселективность, снижает стоимость переработки увеличивает производительность, упрощает выделение продукта и уменьшает необходимую температуру peaкции, давая возможность использовать менее термостойкие карбогидраты. Поэтому в настоящем процессе желательно применяется катализатор, которым является соль содержащая ненуклеофильный aнион. Предпочтительными являются cоли металлов группы IА, IIА или четвертичные аммониевые соли. Катализатор должен быть растворимым в реакционном растворителе и высокоионизированным. Предпочтительными являются солевые катализаторы, выбранные из группы, состоящей из калиевой, бариевой, цезиевой и триалкиламмониевой солей трифторметансульфокислоты, нанофторбутансуль фокислоты, серной кислоты, хлорной, азотной и трифторуксусной кислоты; более предпочтительными являются калиевая или цезиевая соли трифторметансульфокислоты. Подходящая температура реакции находится в интервале примерно от 50°С до 100°С. 10 41261 Растворитель предпочтительно выбирается из полярных ненуклеофильных растворителей, таких как глим, диглим, анизол, ацетонитрил, пропионитрил, диоксан и их смеси; при этом более предпочтительным является ацетонитрил. Обогащенный α-аномером карбогидрат формулы (II) в каталитических усло виях предпочтительно содержт сульфонилокси группу, выбранную из алкилсульфонилокси и арилсульфонилокси групп, такую как метансульфонилокси, 2-хлор-1этансульфонилокси, толуолсульфонилокси, п-нитробензолсульфонилокси и п-бромбензолсульфонилокси. Нуклеооснование (R") для использования в каталитических уловия х, предпочтительно выбирается из группы требуется, по крайней мере, один эквивалент основания. Ацильные защитные группы могут также удаляться с помощью кислотных катализаторов, таких как метансульфокислота, соляная, бромистоводородная, серная кислоты или с помощью кислотных ионообменных смол. Предпочтительно осуществлять такой гидролиз при относительно высоких температурах, таких как температура дефлегмации смеси, но могут использоваться и такие низкие температуры, как температура окружающей среды, когда применяются особенно сильные кислоты. Удаление простых эфирных защитных гр упп осуществляется с помощью известных методов, например, с помощью этантиола и хлористого алюминия. Трет-бутилдиметилсилильная защитная группа требует кислотных условий, таких как контакт с газообразным галоидоводородом, для ее удаления. Удаление защитных гр упп может удобно осуществлясться в спиртовых растворителях, особенно водных спиртах, таких как метанол. Однако реакция деблокирования может таке осуществляться в любом удобном растворителе, таком как полиолы, включающие этиленгликоль, простые эфиры, такие как тетрагидрофуран, кетоны, такие как ацетон и метилэтилкетон или диметилсульфоксид. В предпочтительном воплощении реакция деблокирования применяет аммиак для удаления бензоильной защитной группы гидрокси группы при температуре примерно 10°С. Предпочтительно однако использовать избыток основания в данной реакции, хотя количество избытка основания не является существенным. В соответствии с настоящим процессом обогащенные β-аномером нуклеозиды получаются при аномерном соотношении α к β выше, чем от 1:1 до 1:9. Получающийся в результате обогащенный βаномером нуклеозид формулы (I) может экстрагироваться и/или выделяться из реакционной смеси, как описано в патенте США 4965374, который включен сюда для сведения. Следующие примеры иллюстрируют конкретные аспекты настоящего изобретения, но они не предназначены для ограничения его объема в каком-либо отношении и не должен пониматься как ограничительные. Пример 1 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 10 эквивалентами бис-триметилсилилцитозина Бис-триметилсилилцитозин получался с помощью объединения 2,44 г цитозина, 5,15 мл гексаметилдисилазана и 580 мг сульфата аммония с 5 мл ксилолов и нагревания раствора с обратным холодильником при 120°С в течение 1 часа. Добавлялись дополнительно 5 мл гексаметилдисилазана для образования гомогенного раствора, который нагревался с обратным холодильником в течение 30 минут. Ксилолы и избыток гексаметилдисилазана удалялись, и образовывался желатинообразный бис-триметилсилилцитозин. 5,6 г бис где R1, R2 , R3, Z и W имеют значения, определенные выше. Конечной фазой реакционной последовательности является удалениe защитных групп X, Z и/или W (т.е. деблокирование) из блокированного нуклеозида формулы (I). После удаления защитных групп получается то же caмоe аномерное соотношение нуклеозидов. Большинство силил и силил-амино защитных групп легко отщепляется с помощью использования протонного растворителя, такого как вода или спирт. Ацильные защитные группы, такие как бензоил и ациламино защитные группы удаляются с помощью гидролиза сильным основанием при температуре примерно от 0°С до 100°С. Сильными или умеренно сильными основаниями для использования в данной реакции являются основания, которые имеют рКа (при 25°С) примерно от 8,5 до 20. Такие основания включают гидроокиси щелочных металлов, такие как гидроокись натрия или калия; алкоголяты щелочных металлов, такие как метилат натрия или третбутилат калия; амиды щелочных металлов; амины, такие как диэтиламин, глиоксиламин, аммиак и аналогичные; и другие обычные основания, такие как гидразин и аналогичные. Для каждой защитной 11 41261 триметилсилилцитозина помещалось в 20 мл ксилолов. Ксилолы удалялись, и бис-триметилсилилцитозин снова помещался в 20 мл ксилолов. Бистриметилсилилцитозин выпаривался досуха и помещался в 5 мл ксилолов. 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-α-метансульфоната подвергался реакции с бис-триметилсилилцитозиновым раствором при 127°С в течение 3,5 часов. Анализ жидкостной хроматографии высокой разрешающей способности (HPLC) подтверждал завершение реакции. Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась до 60°С, разбавлялась в 100 мл этилацетата и промывалась 200 мл 1 норм. соляной кислоты. Образовывалась эмульсия, и два слоя, которые образовывались, разделились. Органический слой промывался последовательно 100 мл 5% бикарбоната натрия и 100 мл насыщенного раствора хлорида натрия, затем сушились над сульфатом магния. Количественный анализ HPLC этилацетатного слоя показал, что выход блокированного бета-аномерного нуклеозида составил 50%. Аномерное отношение бета к альфа блокированного нуклеозида было 2,2:1. Пример 2 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 5 эквивалентами бис-триметилсилилцитозина. К 2,8 г бис-триметилсилилцитозина добавлялось 3 мл ксилолов, и раствор нагревался до 120°С до тех пор, пока бис-триметилсилилцитозин не солюбилизировался. 1 г 2-дезокси-2,2-дифторD-рибофуранозил-3,5-дибензоил-1-α-метансульфоната, растворенного в 2 мл ксилолов, нагревался и подвергался реакции с бис-триметилсилилцитозиновым раствором при 130°С в течение 16 часов. Анализ НРLС подтверждал завершение реакции. Аномерное отношение бета к альфа блокированного нуклеозида было 1,1:1. Для экстрагирования нуклеозидного продукта реакционная смесь разбавлялась 150 мл этилацетата и промывалась 150 мл 1 норм. соляной кислоты. Имела место эмульсия, и два слоя, которые образовывались, разделялись. Органический слой промывался последовательно 100 мл воды и 100 мл 5% бикарбоната натрия, затем сушился над сульфатом магния. Для более точного анализа HPLС 1 мл органического слоя выпаривался досуха и помещался в 1 мл ацетонитрила. Количественный анализ НРLС органического слоя в ацетонитриле указал на то, что выход блокированного бета-аномерного нуклеозида составил 36%. Пример 3 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она в виде хлоргидратной соли с 15 эквивалентами бис-триметилсилилцитозина Бис-триметилсилилцитозин приготавливался с помощью объединения 18,33 г цитозина и 10 мл анизола с 64,3 мл N-метил-N-(триметилсилил)трифторацетамида и нагревания раствора при 80°С в течение 30 минут. 5,0 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоил-1-α-метансульфоната, растворенного в 10 мл анизола, подвергались взаимодействию с раствором бис-триметилсилилцитозина при 105°С в течение 5 часов. Аномерное отношение бета к альфа блокированного нуклеозида составляло 5,4:1. Для выделения нуклеозидного продукта реакционная смесь охлаждалась до 60°С, разбавлялась 75 мл этилацетата и промывалась 200 мл 1 норм. соляной кислоты. Образовался полупрозрачный раствор, содержащий твердые частицы. Раствор подогревался до 60-70°С в течение 15 минут, фильтровался, и выделенное твердое вещество пpoмывалось последовательно 20 мл этилацетата, затем сушилось в вакуумной печи при 40°С в течение 16 часов. Получающийся в результате нуклеозидный продукт весил 4,0 г, т.пл. 252-256°С. Количественный анализ НРLС подтвердил, что продукт представлял хлоргидратную соль блокированного бета-аномерного нуклеозида с выходом 75 процентов. Пример 4 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 10 эквивалентами бис-триметилсилилцитозина Бис-триметилсилилцитозин приготавливался с помощью процедуры, описанной в примере 1, за исключением того, что использовалось 20 г цитозина, 380 мл гексаметилдисилазана, 1,18 г сульфата аммония и 48 мл ксилолов. Бис-триметилсилилцитозин растворялся в 24 мл ксилола. 9,6 г 2дезокси-2,2-дифтор-D-рибофуранозин-3,5-дибензоил-1-толуолсульфоната в соотношении альфа к бета 70:30 растворялось в 24 мл ксилолов и подвергалось реакции с раствором бис-триметилсилилцитозина в течение 1 часа. Анализ НPLС подтверждал завершение реакции. Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась до 65°С и добавлялось 100 мл этилацетата. Раствор выдерживался при 65°С и промывался 200 мл 1 норм. соляной кислоты. Получалась эмульсия, и два слоя, которые образовывались, разделялись. Органический слой промывался 200 мл 5% бикарбоната натрия, затем сушился над сульфатом магния. Аномерное отношение бета к альфа блокированного нуклеозида составляло 1,1:1. Количественный анализ HPLC указал на то, что выход блокированного бета-аномера нуклеозида составил 27 процентов. Пример 5 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивалентами тритриметилсилилцитозина Бис-триметилсилилцитозин приготавливался с помощью смешения 10 г цитозина с 175 мл гексаметилдисилазана и 25 мг сульфата аммония в атмосфере азота и нагревания раствора при 120°С в течение 2 часов. Смесь охлаждалась до 80°С и разбавлялась 100 мл-ми этилацетата. Гексаметилдисилазан и этилацетат в последствии атмосферно отгонялись при температуре 145°С. Данная процедура повторялась дважды, затем получающийся в результате бис-триметилсилилци 12 41261 тозин добавялся к 15 мл анизола и охлаждался до 100-115°С. 5,75 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-α-метансульфоната, растворенного в 10 мл aнизола, перемешивалось при 45°С до тех пор, пока не образовывался гомогенный раствор, и подвергалось реакции с раствором бис-триметилсилилцитозина при 115°С-120°С в течение 7 часов. Анализ НРLС подтверждал завершение реакции. Аномерное отношение бета к альфа блокированного нуклеозида составило 7,3:1. Для выделения нуклеозидного продукта реакционная смесь охлаждалась до 88°С, разбавлялась 34 мл-ми этилацетата и промывалась 125 мл-ми 4 норм. соляной кислоты. Образовалась суспензия, содержащая твердые частицы, перемешивалась в течение 1,5 часов при 80°С и фильтровалась. Фильтрат промывался 50 мл-ми 4 норм. соляной кислоты и сушился в вакуумной печи при 45°С. Получающийся в результате нуклеозидный продукт весил 4,6 г. Количественный анализ HPLC доказал, что выход блокированного бета-аномера нуклеозида составил 79,5 процентов. Примep 6 Получение обогащенной бета-аномером хлоргидратной соли 1-(2'-дезокси-2',2'-дифтор-3',5'-ди0-бензоил-D-рибофуранозил)-4-аминопиримидин2-она с 20 эквивалентами бис-триметилсилилцитозина Бис-триметилсилилцитозил приготавливался с помощью процедуры, описанной в примере 5. Раствор охлаждался до 100°С. 5,75 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-α-метансульфоната, растворенного в 10 мл анизола, перемешивалось при 45°С до тех пор, пока не образовывался гомогенный раствор, и подвергалось взаимодействию с бис-триметилсилилцитозиновым раствором при 110°С-115°С в течение 16 часов. Анализ HPLC подтвердил, что оставалось только 3,9% непрореагировавшего 2-дезокси-2,2-дисфтор-D-рибофуранозил-3,5-дибензоил-1-α-метансульфоната. Аномерное отношение бета к альфа блокированного нуклеозида составляло 7,2:1. Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась и разбавлялась 69 мл-ми этилацетата при 65°С. Реакционная смесь затем объединялась с 185 мл 4 норм. соляной кислоты. Смесь нагревалась с обратным холодильником в течение 1 часа при 78°С для образования суспензии. Суспензия фильтровалась, и твердое вещество промывалось 60 мл-ми 4 норм. соляной кислоты и сушилось в вакуумной печи при 45°С. Нуклеозидный продукт весил 3,62 г. Количественный анализ HPLC подтвердил, что продукт представлял хлоргидратную соль блокированного бета-аномера нуклеозида с выходом 64,2%. Пример 7 Получение обогащенного бета-аномером 9-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-5-аминопурина с 15 эквивалентами бистриметилсилиладенина Бис-триметилсилиладенин приготавливался с помощью объединения 7 г аденина и 109 мл гексаметилдисилазана с 250 мг сульфата аммония и нагревания смеси при 100-115°С в течение 8 часов. Раствор нагревался с обратным холодильником в течение дополнительных 30 минут, и избыток гексаметилдисилазана впоследствии удалялся, а 14,5 г бис-триметилсилиладенина растворялось в 3 мл анизола, 1,58 г 2-дезокси-2,2-дифторD-рибофуранозил-3,5-дибензоил-1-α-метансульфоната подвергалось реакции с раствором бистриметилсилиладенина при 105-110°С в течение 24 часов. Анализ HPLC подтвердил завершение peaкции. Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась до 30°С, разбавлялась 50 мл-ми этилацетата и промывалась 75 мл-ми 4 норм. соляной кислоты. Образовалась эмульсия, и органический слой отделялся и промывался последовательно 75 мл 5% бикарбоната натрия и 75 мл нaсыщенного раствора хлористого натрия, затем сушился над сульфатом магния. Аномерное отношениe бета к альфа блокированного нуклеозида составило 6:1. В следующей таблице показано, как концентрация карбогидрата и выбраный карбогидрат влияют на аномерное соотношение нуклеозидного продукта. Таблица Основание Растворитель Ксилолы -"-"-"-"-"Анизол -"-"-" Карбо. α-OMs α-OMs α-OMs α-OMs α-OMs 50:50 α/β-OMs α-OMs α-OMs α-OMs α-OMs Цитозин -"-"-"-"-" 1,5 1,5 5 10 10 1,5 127°С 127°С 130°С 127°С 120°С 125°С 20% 50% 20% 50% 20% 50% Нуклеозид соотношение α/β 1,5:1 1,5:1 1:1,1 1:2,2 1:1,6 3:1 -"-"-"5-F-цитозин 2 3 15 10 105°С 105°С 105°С 115°С 20% 50% 50% 50% 1,3:1 1:1,3 1:5,4 1:6 Основание Эквивалент Температура (R') (R') 13 Карбо. Конц. Выход 14%β 15%β 36%β 50%β 32%β 12%β 18%β 22%β 75%β(α) N/D 41261 Продолжение таблицы Растворитель Анизол Ксилолы Ксилолы Ксилолы -"-"Анизол -"-" Карбо. α-OMs 70:30 α/β-OТs 70:30 α/β-OТs 70:30 α/β-OТs 70:30 α/β-OТs 85:15 α/β-OВs α-OMs α-OMs α-OMs 5-F-Урацил Цитозин 5 3 130°С 123°С 50% 20% Нуклеозид соотношение α/β 1:6 1,7:1 Цитозин 5 125°С 20% 1,7:1 N/D Цитозин 10 125°С 20% 1:1,1 27%β -" 10 125°С 20% 1,8:1 23%β Ацетил Цитозин -"Аденин Цитозин 5 110°С 20% 1:1 N/D 20 15 20 115°С 110°С 115°С 25% 50% 25% 1:7,3 1:6 1:7,2 79,5%β(α) N/D 64%β Основание Эквивалент Температура (R') (R') (N/Д) обозначает не определялся. Карбогидраты (карбо) являются гидроксизащищенными и включают…. α- или β-ОМs представляет альфаили бета-2,2-дифтор-2-дезокси-D-рибофуранозил3,5-дибензоил-1-метансульфонат; β или α-ОТs представляет бета- или альфа-2,2-дифтор-2дезокси-D-рибофуранозил-3,5-дибензоил-1-толуолсульфонат; и α- или β-OBs представляет альфа- или бета-2,2-дифтор-2-дезокси-D-рибофуранозил-3,5-дибензоил-1-бромбензолсульфонат. 70:30 α:β-ОТs карбогидраты получались путем аномеризации β-ОТs солью п-толуолсульфокислоты. Выходы даны в расчете на количество карбогидрата и вычислялись в результате количественного анализа HPLC с обратной фазой, где соответствующий пик раствора продукта сравнивался со стандартом, 1-(2'-дезокси-2',2'-дифтор-3',5'ди-0-бензоил-β-D-рибофуранозил)-4-аминопиримидин-2-оном, за исключением в случае (а), который дает выход выделенного продукта. (*) Концентрация карбогидрата (Карбо. Конц.) выражена в процентах карбогидрата по весу (граммы) на единицу объема растворителя (миллилитры). Группой, защищающей нуклеооснование, в каждом примере является триметилсилил. Пример 8 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина К 5,78 г цитозина добавлялось 112 мл гексаметилдисилазана и 100 мг сульфата аммония. Раствор нагревался до 115-120°С в течение 1,5 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Смесь охлаждалась до 60°С и растворялась в 40 мл 1,2дихлорметана, образуя гомогенньй раствор бистриметилсилилцитозина. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 10 мл дихлорметана и 0,54 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 30 минут, о хлаждался до -78°С и подвергался реакции с 0,57 мл трифторметансульфонил-ангидрида, в 0,50 мл дихлорметана, образуя обогащенное альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-трифторметансульфонатное проме Карбо. Конц. Выход N/D 6%β жуточное соединение в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65°С. Анализ 19F ядерномагнитного резонанса (ЯМР) обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонатного промежуточного соединения при 65°С дал следующие данные: 19F ЯМР (300 МГц, СДСI3), d-77 (с., 3F, CF3SO2-)-III (д., J=257 Гц, IF, альфа-аномер), -122 (д., J=242 Гц, IF, бета-аномер), -124 (д., J=257 Гц, IF, альфа-аномер), -126 млн.дол. (д., J=242 Гц, IF, бета-аномер). Следует заметить, что все сдвиги 19 F Я МР пиков даны относительно гексафторбензола, которому пердписана частота -162,9 млн.дол. Спектр 19F ЯМР также указал на фтор-протон сочетания, однако характер этих сочетаний не определялся. Раствор обогащенного альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при -65°С, и реакционной температуре давали возможность подниматься до 23°С, и образовывался названный в заголовке блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида было 1,9:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 100 мл дихлорметана и 200 мл 1 норм. соляной кислоты. Органический слой отделялся и промывался 200 мл-ми 5% бикарбоната натрия. Органический слой снова отделялся и промывался 200 мл-ми насыщенного хлористого натрия. Целевой нуклеозидный продукт выпадал в осадок из органического слоя. Количественный анализ HPLC показал выход блокированного бета-аномера нуклеозида 42 процента. 1Н ЯМР (ДМСО); d=4,74 (4'Н), 4,79 (5'Н), 5,84 (5Н), 5,88 (3'Н), 6,44 (1'Н), 7,56 (NH2), 7,68 (6Н). 13 С Я МР (ДМСО): d=63,46 (5'с), 71,80 (3'С), 75,71 (4'С), 84,64 (1'С), 95,12 (5'С), 121,86 (2'С), 141,93 (6'С), 154,48 (2С), 165,87 (4С). Пример 9 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофу 14 41261 ранозил)-4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина Раствор бис-триметилсилилцитозина приготавливался суспендированием 5,78 г цитозина в 75 мл дихлорметана и добавлением 20,57 мл Nметил-N-триметилсилилтрифторацетамида и охлаждением получающегося раствора до -30°C. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 10 мл дихорметана и 0,55 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 30 минут, о хлаждался до -78°С и подвергался реакции с 0,57 мл трифторметансульфонилангидрида в 1 мл дихлорметана, образуя обогащенный альфа-аномером 2дезокси-2,2-дифтор-D-pибoфуpaнoзил-3,5-дибeнзoил-1-тpифтopмeтансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65°С. Обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в виде раствора подвергался реакции с раствором бис-триметилсилилцитозина при -30°С, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC. Аномерное отношение бета к альфа блокированного нуклеозида составило 2,3:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 200 мл 1 норм. соляной кислоты. Органический слой отделялся и промывался 5% карбонатом натрия. Количественный анализ HPLC органического слоя показал выход блокированного бета-аномерного нуклеозида 45%. Пример 10 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивалентами бис-триметилцитозина Раствор бис-триметилсилилцитозина приготавливался с помощью процедуры, описанной в примере 8, и охлаждался до -15°С. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 10 мл дихлорметана и 0,54 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 30 минут, о хлаждался до -78°С и подвергался реакции с 0,57 мл трифторметансульфонил-ангидрида в 0,5 мл дихлорметана, образуя обогащенный альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65°С. Обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонатный раствор подвергался реакции с раствором бис-триметилсилицитозина при -15°С, образуя целевой блокированный нулеозид, что подтверждалось данньми анализа HPLC. Аномерное отношение бета и альфа блокированного нуклеозида составило 2,3:1. Для экстрагирования нуклеозидного продукта из реакционной смеси дихлорметан удалялся, и получающийся остаток растворялся в 21 мл анизола, а затем 40 мл воды, а затем нагревался до 90°С. Твердые вещества, которые образовывались, удалялись из раствора. Органичесюй и водный слои отделялись, и органический слой впо следствии промывался дополнительным количеством 10 мл воды. Из органического слоя выпадал в осадок бета-аномерный нуклеозидный продукт. Количественный анализ HPLC обнаружил выход блокированного бета-аномера нуклеозида 58%. Пример 11 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина Раствор бис-триметилсилилцитозина приготавливался путем суспендирования 5,78 г цитозина в 20 мл дихлорметана и добавления 20,57 мл N-метил-N-триметилсилилтрифторацетамида в 10 мл дихлорметана и охлаждения получающегося раствора до 0°С. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 10 мл дихлорметана и 0,55 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 30 минут, о хлаждался до -78°С и подвергался реакции с 0,57 мл трифторметансульфонил-ангидрида в 1 мл дихлорметана, образуя обогащенный альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонамид в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65°С. Обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе подвергался реакции с раствором бистриметилсилилцитозина при 0°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида было 2,5:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 250 мл 1 норм. соляной кислоты. Органический слой отделялся и промывался 200 мл 5% карбоната натрия. Количественный анализ HPLC органического слоя обнаружил выход блокированного бетааномерного нуклеозида 49 процентов. Пример 12 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-ацетамидопиримидин-2-она с 10 эквивалентами бис-триметилсилил-N-ацетилцитозина К 4 г N-ацетилцитозина добавлялось 56 мл гексаметилдисилазана и 698 мг сульфата аммония. Данный раствор нагревался до 115-120°С в течение 4 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Смесь oxлаждалась до -50°С и растворялась в 50 мл 1,2-дихлорэтана. 1,2-дихлорэтан удалялся и получающийся твердый остаток растворялся снова в 50 мл 1,2-дихлорэтана. 1,2-дихлорэтан снова удалялся, и образовывался маслянистый остаток. Маслянистый остаток брался в 2,5 мл 1,2дихлорэтана, образуя гомогенный раствор бистриметилсилил-N-ацетилцитозина. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 2 мл сухого ди хлорметана. Данный раствор охлаждался до -78°С и подвергался реакции с 0,55 мл триэтиламина и 0,58 мл трифторметансульфонил-ангидрида, образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфонат в растворе. Принима 15 41261 лись меры для поддержания температуры реакционной смеси ниже -65°С. Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната подвергался реакции с раствором бистриметилсилил-N-ацетилцитозина при 23°С. Реакционная смесь перемешивалась при -60°С в течение полутора часов, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида было 2:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 50 мл дихлорметана. Органический слой отделялся и промывался последовательно 50 мл 5% бикарбоната натрия, затем 50 мл 1 норм. соляной кислоты и 50 мл насыщенного хлорида натрия. Количественный анализ HPLC органического слоя показал выход блокированного бета-аномерного нуклеозида 15 процентов. Пример 13 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина К 5,78 г цитозина добавлялось 112 мл гексаметилдисилазана в 50 мг сульфата аммония. Смесь нагревалась до 115-120°С в течение 3 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Данный раствор затем охлаждался до 27°С, и образовывался твердый остаток, который помещался в 35 мл дихлорметана, образуя гомогенный раствор бистриметилсилилцитозина. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 10 мл дихлорметана и 0,54 мл триэтиламина. Раствор охлаждался до -78°С и подвергался реакции с 0,57 мл трифторметансульфонил-ангидрида в 0,50 мл дихлорметана, образуя обогащенный альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65°С. Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната подвергался реации с раствором бис-триметилсилилцитозина при 27°С, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC и указывало на то, что оставалось 11 процентов непрореагировавшего обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-трифторметансульфоната. Аномерное отношение бета к альфа блокированного нуклеозида было 2,2:1. Количественный анализ HPLC показал выход блокированного бетааномерного нуклеозида 54%. Пример 14 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина К 5,78 г цитозина добавлялось 112 мл гексаметилдисилазана и 50 мг сульфата аммония. Данный раствор нагревался до 115-120°С в течение 2 часов при перемешивании, и избыток гекса метилдисилазана впоследствии удалялся. Получающееся в результате масло охлаждалось до 23°С, образуя твердый остаток, который помещался в 35 мл дихлорметана, образуя гомогенный раствор бис-тримтетилсилилцитозина, и охлаждался до 0°С. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 9 мл дихлорметана и 0,54 мл триэтиламина. Раствор охлаждался до -78°С и подвергался реакции с 0,57 мл трифторметансульфонил-ангидрида в 0,50 мл дихлорметана, образуя обогащенный альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе. Принимались меры для поддержания тетературы реакционной смеси ниже -65°С. Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при 23°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида составило 2,2:1. Для экстрагирования нуклеозидного продукта из реакционной смеси смесь промывалась дважды 150 мл-ми 1 норм. соляной кислоты. Органический слой отделялся, промывался 150 мл-ми 5% бикарбоната натрия и промывался снова 150 мл-ми насыщенного хлористого натрия. Количественный анализ HPLC органического слоя показал выход блокированного бета-аномерного нуклеозида 49 процентов. Пример 15 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 30 эквивалентами бис-триметилсилилцитозина К 5,9 г цитозина добавлялось 112 мл гексаметилдисилазана и 25 мг сульфата аммония. Раствор нагревался до 120-125°С в течение 3 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Получающийся в результате твердый остаток помещался в 35 мл дихлорметана и охлаждался до 10°С, образуя гомогенный раствор бис-триметилсилилцитозина. К 655 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 0,55 мл дихлорметана и 0,36 мл триэтиламина. Раствор перемешивался при 23°С в течение 30 минут, о хлаждался до -78°С и подвергался реакции с 0,35 мл трифторметансульфонил-ангидрида в 0,50 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65°С. Раствор обогащенного альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при 10°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклезида составило 2,7:1. Количественный анализ HPLC показал выход блокированного бетааномерного нуклеозида 60 процентов. 16 41261 Пример 16 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина К 5,78 г цитозина добавлялось 112 мл гексаметилдисилазана и 50 мг сульфата аммония. Раствор нагревался до -115-120°С в течение полутора часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Получающийся в результате твердый остаток помещался в 40 мл 1,2-дихлорметана при 23°С, образуя гомогенный раствор бис-триметилсилилцитозина. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 10 мл дихлорметана с 1,2 мл триэтиламина. Раствор охлаждался до -78°С и подвергался реакции с 0,57 мл трифторметансульфонил-ангидрида в 0,50 мл дихлорметана, образуя обогащенный альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе. Приминимались меры для поддержания температуры реакционной смеси ниже -65°С, раствор обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при 23°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом НРLС. Аномерное отношение бета к альфа блокированного нуклеозида составило 2,8:1. Количественный анализ НРLС показал выход блокированного бета-аномерного нуклеозида 50%. Пример 17 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина К 5,78 г цитозина добавлялось 112 мл гексаметилдисилазана и 50 мг сульфата аммония. Смесь нагревалась до 115-120°С в течение 1,5 часов при перемешивании, и избыток гексаметилдисилазана впоследствии удалялся. Получающийся в результате твердый остаток помещался в 40 мл дихлорметана при 23°С, образуя гомогенный раствор бис-триметилсилилцитозина. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 10 мл дихлорметана и 0,54 мл триэтиламина. Раствор перемешивался при 23°С в течение 30 минут, о хлаждался до -78°С и подвергался взаимодействию с 0,57 мл трифторметансульфонил-ангидрида в 0,50 мл дихлорметана, образуя обогащенный альфа-аноме ром 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65°С. Раствор обогащенного альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметан-сульфоната подвергался реакции с бис-триметилсилилцитозином в растворе при 23°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида было 2,5:1. Количественный анализ HPLC показал выход блокированного бетааномера нуклеозида 68 процентов. Пример 18 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивалентами бис-триметилсилилцитозина К 5,78 г цитозина добавлялось 5 мл дихлорметана, 20,6 мл N-метил-N-триметилсилилтрифторацетамида и 5 мл дихлорметана, образуя гомогенный раствор бис-триметилсилилцитозина. К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 3 мл дихлорметана и 0,55 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 30 минут, о хлаждался до -78°С и подвергался реакции с 0,57 мл трифторметансульфонил-ангидрида в 1 мл дихлорметана, образуя обогащенный альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже -65°С. Раствор обогащенного альфа-аномером 2-дезокси-2,2-дифторD-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната подвергался реакции с раствором бис-триметилсилилцитозина при 25°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом HPLC. Аномерное отношение бета к альфа блокированного нуклеозида составляло 2,5:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 250 мл 1 норм. соляной кислоты. Органический слой отделялся и промывался 250 мл-ми 5% карбоната натрия. Количественный анализ HPLC органического слоя показал выход блокированного бетааномерного нуклеозида 50 процентов. В таблице показано, каким образом растворитель, число молярных эквивалентов пиримидиннуклеозидных производных влияют на аномерное отношение и выход нуклеозидного продукта. Таблица Растворитель Дихлорметан -"-"-"-"и 1,2-дихлорэтан (R') Основание Цитозин -"-"-"-" (R') Основание Эквивалент 20 20 20 20 20 17 α/β Температура Нуклеозидное отношение -25°С 1:2,5 -30°С 1:2,3 0°С 1:2,5 23°С 1:2,2 23°С 1:1,8 β Выход 44% 45% 49% 49% 31% 41261 Продолжение таблицы Цитозин (R') Основание Эквивалент 20 -" 20 23°С 1:2,8 50% -"-"-"-"-"-"-" 20 20 20 20 30 1,5 3 23°С -15°С 27°С 23°С 10°С 23°С 23°С 1:2,5 1:2,3 1:2,2 1:2,2 1:2,7 1:1 1:1,3 68% 58% 54% 49% 60% 17% 6% Урацил 2 -20°С 1:1 N/D Цитозин N-ацетил 3,5 10 -78°С -60°С 1,3:1 1:2 10% 15% Цитозин Цитозин -"5-F-урацил 10 10 15 -78°С 0°С 23°С 1:3 1:2,5 1:1 28% 32% N/D (R') Основание Растворитель Дихлорметан и 1,2-дихлорэтан Дихлорметан и 1,2-дихлорэтан Дихлорметан Дихлорметан -"-"-"-"-"и 1,2-дихлорэтан Дихлорметан и 1,2-дихлорэтан Дихлорметан Дихлорметан и 1,2-дихлорэтан 1,2-дихлорэтан Дихлорметан -" Карбогидратом, используемым для получения блокированных нуклеозидов, в таблице был обогащенный альфа-аномером 2-дезокси-2,2-дифторD-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат. (N/D) означает не определялся. Данные выхода представлены в расчете на количество карбогидрата и вычислялись по результатам количественного анализа НРLС с обратной фазой, при котором пик соответствующего раствора продукта сравнивался со стандартом. Защитной группой для указанного выше нуклеозидного основания является триметилсилил. Пример 19 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она Цитозин (12,0 г), гексаметилдисилазин (60 мл) и сульфат аммония (10 мг) нагревались с обратным холодильником при 125°С в течение 30 минут, образуя гомогенный раствор. Гексаметилдисилазан удалялся с помощью перегонки, образуя бис-триметилсилилцитозин. 2-дезокси-2',2'-дифтор-D-рибофуранозил-3,5-дибензоил-1-α-метансульфонат (1,15 г) подвергался реакции с бистриметилсилилцитозином (6,89 г, 10 экв.) в анизоле (2 мл) и ацетонитриле (3 мл) при 80°С в присутствии калиевой соли нанофтор-1-бутансульфоновой кислоты (0,5 г) в течение 16 часов. Анализ НРLС подтвердил завершение реакции и указывал на выход ин ситу 33 процента. Аномерное отношение бета к альфа целевого соединения составило 3:1. Пример 20 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с сульфатом калия 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (1,15 г) подвергался реакции с бис-триметилсилилцитозином α/β Температура Нуклеозидное отношение 23°С 1:1,9 β Выход 42% (6,89 г, 10 эквив.), полученным, как описано в примере 19, в ацетонитриле (2,0 мл) при 80°С в присутствии сульфата калия (0,5 г) в течение 72 часов. Анализ НРLС подтвердил завершение реакции и показал выход ин ситу 65 процентов. Аномерное отношение бета к альфа целевого соединения составило 4,7:1. Пример 21 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с тетрабутиламмониевой солью трифторметансульфокислоты 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (0,29 мл) подвергался реакции с биc-триметилсилилцитозином (6,89 г, 10 экв.), полученным, как описано в примере 19, в ацетонитриле (3,0 мл) при 80°С в присутствии тетрабутиламмониевой соли трифторметансульфокислоты (1,5 ммоля) (полученной ин ситу с помощью обработки тетрабутиламмонийгидроксида (1,5 мл 1 молярного раствора в метаноле) трифторметансульфокислотой (0,13 мл)), затем перегонки для удаления метанола в течение 4 часов. Анализ HPLС подтвердил завершение реакции и показал выход ин ситу 45 процентов. Аномерное отношение бета к альфа целевого соединения было 7,1:1. Пример 22 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с сульфатом бария 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (1,5 г) подвергался взаимодействию с бис-триметилсилилцитозином (6,89 г, 10 экв.), полученным, как описано в примере 19, в ацетонитриле (3,0 мл) при 75°С в присутствии сульфата бария (1,0 г) в течение 18 41261 20,5 часов. Анализ НРLС показал выход ин-ситу 36 процентов. Аномерное отношение бета к альфа целевого соединения было 11,2:1. Пример 23 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с сульфатом цезия 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (1,15 г) подвергался реакции с бис-триметилсилилцитозином (6,89 г, 10 экв.), полученным, как описано в примере 19, в ацетонитриле (3,0 мл) при 75°С в присутствии сульфата цезия (1,0 г) в течение 21 часа. Анализ НРLС показал выход ин-ситу 24 процента. Аномерное отношение бета к альфа целевого соединения было 14,9:1. Пример 24 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с цезиевой солью трифторметансульфоновой кислоты 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (1,15 г) подвергался взаимодействию с бис-триметилсилилцитозином (6,89 г, 10 экв.), полученным, как описано в примере 19, в ацетонитриле (3,0 мл) при 75°С в присутствии цезиевой соли трифторметансульфоновой кислоты (полученной ин-ситу с помощью обработки 0,13 мл трифторметансульфоновой кислоты избытком карбоната цезия) в течение 20,5 часов. Анализ НРLС подтвердил завершение реакции и показал выход ин-ситу 65 процентов. Аномерное отношение бета к альфа целевого соединения составило 7,2:1. Пример 25 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с бариевой солью трифторметансульфоновой кислоты 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (1,15 г) подвергался взаимодействию с бис-триметилсилилцитозином (6,89 г, 10 эквив.) полученным, как описано в примере 19, в ацетонитриле (3,0 мл) при 75°С в присутствии бариевой соли трифторметансульфокислоты (полученной ин-ситу с помощью обработки 0,13 мл трифторметансульфокислоты избытком карбоната бария) в течение 20,5 часов. Анализ НРLС показал выход ин-ситу 25 процентов. Аномерное отношение бета к альфа целевого соединения 14,4:1. Пример 26 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с калиевой солью трифторметансульфокислоты 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (2,3 г, 12,6 экв.) подвергался реакции с бис-триметилсилилцитозином (16,1 г), полученным, как описано в примере 19, в ацетонитриле (8,0 мл) при 75°С и в присутствии калиевой соли трифторметансульфокислоты (полученной ин-ситу с помощью обработки трифторметансульфокислоты (0,26 мл) карбонатом калия (1,0 г)) в течение 45 часов. Анализ НРLС показал выход ин-ситу 69,8 процентов. Аномерное отношение бета к альфа целевого соединения составило 7,2:1. Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась до температуры между 70°С и 80°С и объединялась с 40 мл 4 норм. соляной кислоты. Продукт выпадал в осадок фильтровался и сушился. Количественный анализ НРLС показал выход выделенного продукта 62,4 процента. Пример 27 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с калиевой солью трифторметансульфоновой кислоты 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (2,3 г) подвергался взаимодействию с бис-триметилсилилцитозином (16,1 г, 12,6 эквив.), полученным, как описано в примере 19, в пропионитриле (8,0 мл) при 90°С и в присутствии калиевой соли трифторметансульфокислоты, полученной ин-ситу путем обработки трифторметансульфокислоты, (0,26 мл) карбонатом калия (1,0 г) в течение 21 часа. Анализ НРLС подтвердил завершение реакции. Аномерное отношение бета к альфа целевого соединения было 6,7:1. Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась до температуры между 70°С и 80°С и объединялась с 40 мл 4 норм. соляной кислоты. Продукт выпадал в осадок, фильтровался и сушился. Количественный анализ НРLС показал выход выделенного продукта 59,3%. Сравнительный пример 28 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она без катализатора 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (1,15 г) подвергался реакции с бис-триметилсилилцитозином (6,09 г, 10 эквив.), полученным, как описано в примере 19, в анизоле (4 мл) при 110°С в течение 20 часов. Анализ НРLС подтвердил завершение реакции и показал выход ин-ситу 77 процентов. Аномерное отношение бета к альфа целевого соединения было 3,4:1. Сравнительный пример 29 Получение обогащенного 1-(2'-дезокси-2',2'дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4аминопиримидин-2-она без катализатора 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-метансульфонат (1,15 г) подвергался реакции с бис-триметилсилилцитозином (6,08 г, 10 экв.), полученным, как описано в примере 19, в пропионитриле (4 мл) при 85°С в присутствии цезиевой соли трифторметансульфокислоты (полученной ин-ситу с помощью обработки трифторметансульфокислоты (0,13 мл) с избытком карбоната цезия) в течение 20 часов. Анализ НРLС подтвердил завершение реакции и показал выход ин-ситу 70 процентов. Аномерное отношение бета к альфа целевого продукта составило 6,7:1. 19 41261 Пример 30 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2'2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-2,6-дипиваламидоаминопурина с 2 эквивалентами калиевой соли 2,6-дипиваламидоаминопурина К 100 мг 2-дезокси-2,2-дифтор-1-рибофуранозил-3,5-дибензоата добавлялось 1 мл дихлорметана и 0,036 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, охлаждался до -40°С и подвергался реакции с 0,045 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфонат в растворе. 185 мг суспензии 2,6-дипиваламидоаминопурина приготавливалось в 1,5 мл ацетонитрила и поддерживалось безводной в атмосфере азона. К суспензии добавлялось 65 мг трет-бутилата калия, и получающаяся в результате смесь перемешивалась при 23°С в течение 10 минут, образуя калиевую соль 2,6-дипиваламидоаминопурина. Соль охлаждалась до 0°С и подвергалась реакции с обогащенным альфа-аномером раствором 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 22°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом НРLС. Аномерное отношение бета к альфа блокированного нуклеозида было 2:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 норм. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл-ми насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Количественный анализ НРLС показал объединенный выход блокированного бета- и альфааномера нуклеозида 42 процента. Пример 31 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-2,6-дипиваламидоаминопурина с 2 эквивалентами калиевой соли 2,6-дипиваламидоаминопурина К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 0,55 мл триэтиламина и 8,33 мл дихлорметана при 23°С. Смесь охлаждалась до -78°С и подвергалась реакции с 0,53 мл трифторметансульфонового ангидрида в 0,50 мл дихлорметана, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоат-1-трифторметансульфонат в растворе. Принимались меры для поддержания температуры реакционной смеси ниже –65°С. 1,85 г суспензии 2,6-дипиваламидоаминопурина приготавливалось в 30 мл ацетонитрила и содержалось безводной в атмосфере азота. К данной суспензии добавлялось 651 мг трет-бутилата калия, и получающаяся в результате смесь перемешивалась при 23°С в течение 15 минут, образуя калиевую соль 2,6-дипиваламидоаминопурина. Суспензия соли добавлялась к 20 мл сухого дихлорметана, охлаждалась до 0°С и подвергалась реакции с обогащенным альфа-аномером раствором 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 23°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом НРLС. Аномерное отношение бета к альфа блокированного нуклеозида было 2:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 50 мл этилацетата и 50 мл 1 норм. соляной кислоты. Органический слой отделялся и промывался 50 мл-ми 5% бикарбоната натрия. Органический слой отделялся и промывался 50 мл-ми насыщенного водного хлористого натрия и сушился над сульфатом магния. Пример 32 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-6-хлорпурина с 2 эквивалентами калиевой соли 6-хлорпурина К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0,515 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, охлаждался до -40°С и подвергался реакции с 0,621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфонат в растворе. 155 мг суспензии 6-хлорпурина приготавливалось в 3 мл ацетонитрила и поддерживалась безводной в атмосфере азота. К суспензии добавлялось 130 мг трет-бутилата калия, и получающаяся в результате смесь перемешивалась при 23°С в течение 10 минут, образуя калиевую соль 6хлорпурина. Суспензия соли охлаждалась до 0°С и подвергалась реакции с 2 мл раствора обогащенного альфа-аномером 2-дезокси-2,2-дифторD-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 22°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом НРLС. Аномерное отношение бета к альфа блокированного нуклеозида было 2:1. Для экстрагированного нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата 1 мл воды, 1 мл 1 норм. соляной кислоты и 2 мл насыщенного водного раствора хлорида натрия. Органический слой отделялся, промывался 5 мл-ми насыщенного водного раствора бикарбоната натрия и 5 мл солевого раствора и сушился над сульфатом магния. Количественный анализ НРLС показал выход блокированного бета-аномера нуклеозида 27%. Пример 33 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-2,6-дихлор-3-деазапурина с 2 эквивалентами калиевой соли 2,6-дихлор-3-деазапурина К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0,515 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, охлаждался до -40°С и подвергался реакции с 0,621 мл трифторметансульфонового ангидрида, 20 41261 образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-2,2трифторметансульфонат в растворе. 82 мг суспензии 2,6-дихлор-3-деазапурина получалось в 1,5 мл ацетонитрила и содержалось в безводных условиях в атмосфере азота, 49 мг трет-бутилата калия добавлялось к суспензии, и получающаяся в результате смесь перемешивалась при 23°С в течение 10 минут, образуя калиевую соль 2,6-дихлор-3-деазапурина. Суспензия соли охлаждалась до 0°С и подвергалась взаимодействию с обогащенным альфа-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонатом в растворе, перемешивалась в течение 1 часа и подогревалась до 20°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом НРLС. Аномерное отношение бета к альфа блокированного нуклеозида составило 2,5:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 норм. соляной кислоты и 2 мл насыщенного водного раствора хлорида натрия. Органический слой отделялся, промывался 5 мл-ми насыщенного водного раствора бикарбоната натрия и 5 мл солевого раствора и сушился над сульфатом магния. Количественный анализ НРLС показал объединенный выход блокированного бета-аномерного нуклеозида 21 процент, т.пл. 127-129°С. Пример 34 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-2,6-дихлорпурина с 2 эквивалентами калиевой соли 2,6-дихлорпурина К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0,515 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, затем охлаждался до -40°С и подвергался реакции с 0,621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфонат в растворе. Приготавливалась суспензия 220 мг 2,6-дихлорпурина в 3 мл ацетонитрила и содержалась безводной в атмосфере азота. Добавлялось 130 мг трет-бутилата калия, и получающаяся в результате смесь перемешивалась при 23°С в течение 10 минут, образуя калиевую соль 2,6-дихлорпурина. Суспензия соли охлаждалась до 0°С и подвергалась реакции с обогащенным альфааномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонатным раствором, перемешивалась в течение 1 часа и подогревалась до 22°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом НРLС. Аномерное отношение бета к альфа блокированного нуклеозида составило 2,5:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 норм. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл-ми насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Количественный анализ НРLС показал выход блокированного бета-аномерного нуклеозида 22 процента. Пример 35 Получение обогащенного бета-аномером 1-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-3-карбоэтокси-1,2,4-триазола с 2 эквивалентами калиевой соли 3-карбоэтокси-1,2,4триазола К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0,515 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, охлаждался до -40°С и подвергался реакции с 0,621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфонат в растворе. Приготавливалась суспензия 164 мг сложного эфира триазола в 3 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 131 мг трет-бутилата калия, и получающаяся смесь перемешивалась при 23°С в течение 10 минут, образуя калиевую соль 3-карбоэтокси-1,2,4триазола. Суспензия соли охлаждалась до 0°С и подвергалась реакции с 2 мл раствора обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната, перемешивалась в течение 40 минут и подогревалась до 15°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом НРLС. Аномерное отношение бета к альфа блокированного нуклеозида было 2,5:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 норм. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл-ми насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Количественный анализ НРLС показал выход блокированного бета-аномера нуклеозида 14 процентов. Пример 36 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-2-амино-6-хлорпурина с 2 эквивалентами калиевой соли 2-амино-6-хлорпурина К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0,515 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, охлаждался до -40°С и подвергался реакции с 0,621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфонат в растворе. Приготавливалась суспензия 197 мг 2-амино6-хлорпурина в 3 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 130 мг трет-бутилата калия, и получающаяся смесь перемешивалась при 23°С в течение 10 минут, образуя калиевую соль 2-амино-6-хлорпурина. 21 41261 Суспензия соли охлаждалась до 0°С и подвергалась реакции с 2 мл раствора обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоал-1-трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 22°С, образуя целевой блокированный нуклеозид, что подтверждалось анализом НРLС. Аномерное отношение бета к альфа блокированного нуклеозида составило 2:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 100 мл этилацетата, 10 мл води, и образовывался осадок. Осадок отфильтровывался, промывался 5 мл-ми насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Количественный анализ НРLС показал выход блокированного бета-аномера нуклеозида 14 процентов. Пример 37 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-2,6-дипиваламидоаминопурина с 2 эквивалентами калиевой соли 2,6-дипиваламидоаминопурина К 3,78 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 30 мл дихлорметана и 1,39 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, о хлаждался до -40°С и подвергался реакции с 1,68 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе. Суспензия 6,99 г 2,6-дипиваламидоаминопурина, приготавливалась в 100 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 2,46 г трет-бутилата калия и получающаяся смесь перемешивалась при 23°С в течение 10 минут и сушилась до постоянного веса в вакууме при 40°С, образуя калиевую соль 2,6дипиваламидоаминопурина. Суспензия соли добавлялась к 100 мл дихлорметана oxлаждалась до 0°С и подвергалась реакции с раствором обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 22°С, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа НРLС. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 500 мл этилацетата, 20 м льда, 20 мл 1 норм. соляной кислоты и 35 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 25 мл насыщенного водного раствора бикарбоната натрия, 25 мл солевого раствора и сушился над сульфатом магния. Аномерное отношение бета к альфа блокированного нуклеозида составило 1,8:1. Количественный анализ НРLС показал выход блокированного бета-аномера нуклеозида 28 процентом, т.пл. 138-139°С. Пример 38 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-6-пиваламидоаминопурина с 2 экви валентами калиевой соли 6-пиваламидоаминопурина К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0,515 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, охлаждался до -40°С и подвергался реакции с 0,621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфонат в растворе. Приготавливалась суспензия 255 мг 6-пиваламидоаминопурина в 3 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялся 131 мг трет-бутилата калия, и получающаяся смесь перемешивалась при 23°С в течение 10 минут, образуя калиевую соль 6-пиваламидоаминопурина. Суспензия соли охлаждалась до 0°С и подвергалась реакции с раствором обогащенного альфа-аномером 2-дезокси-2,2-дифторD-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 22°С, образуя конечный блокированный нуклеозид, что подтверждалось данными анализа НРLС. Аномерное отношение бета к альфа блокированного нуклеозида было 2:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 норм. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Количественный анализ НРLС показал объединенный выход блокированного бета- и альфааномера нуклеозида 28 процентов. Пример 39 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-8-бром-7-циано-7-деаза-6-пиваламидопурина с 2 эквивалентами калиевой соли 8бром-7-циано-7-деаза-6-пиваламидопурина К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана и 0,515 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, охлаждался до -40°С и подвергался реакции с 0,621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфонат в растворе. Приготавливалась суспензия 187 мг 8-бром-7циано-7-деаза-6-пиваламидопурина в 3 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 65 мг трет-бутилата калия, и получающаяся смесь перемешивалась при 23°С в течение 10 минут, образуя калиевую соль 8бром-7-циано-7-деаза-6-пивалоиламидопурина. Суспензия соли oxлаждалась до 0°С и подвергалась реакции с 1 мл раствора обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-1-трифторметалсульфоната перемешивалась в течение 1 часа, и подогревалась до 20°С, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа НРLС. 22 41261 Аномерное отношение бета к альфа блокированного нуклеозида было 2:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 2 норм. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл-ми насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Количественный анализ НРLС показал объединенный выход блокированного бета- и альфааномера нуклеозида 24 процента. Пример 40 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-2,6-дипиваламидоаминопурина с 2 эквивалентами калиевой соли 2,6-дипиваламидоаминопурина в различных реакционных растворителях К 1 г 2-дезокси-2,2-дифтор-D-рибофуранозил3,5-дибензоата добавлялось 10 мл дихлорметана и 0,36 мл триэтилaминa. Данный раствор перемешивался при 23°С в течение 15 минут, о хлаждался до -40°С и подвергался реакции с 0,45 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе. Приготавливалась суспензия 1,85 г 2,8-дипиваламидоаминопурина в 30 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 0,65 г трет-бутилата калия, и получающаяся смесь перемешивалась при 25°С в течение 10 минут, образуя калиевую соль 2,6дипиваламидоаминопурина. Суспензия соли сушилась в вакууме при 40°С, образуя белое твердое вещество с постоянным весом. 207 мг пуриновой соли суспензировалось в 1,5 мл растворителя, показанного в опытах А-F в таблице, представленной ниже, в атмосфере азота при 0°С и подвергаюсь реакции с 1 мл раствора обогащенного альфа-аномером 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната, смесь перемешивалась в течение 1 часа и подогревалась до 0°С, образуя блокированный целевой нуклеозид, что подтверждалось данными анализа НРLС. Аномерные отношения бета к альфа блокированного нуклеозида показаны ниже. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл воды, 1 мл 1 норм. соляной кислоты и 2 мл насыщенного водного раствора хлорида натрия. Органический слой отделялся, промывался 2 мл-ми насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Количественный анализ НРLС показал выход блокированного бета-аномера нуклеозида, приведенный ниже. β/α Соотноβ Опыт Растворитель шение Выход (%) нуклеозида А Тетрагидрофуран 1,3:1 45 В Толуол 1,8:1 49 С Этилацетат 1,6:1 47 D Дихлорэтан 2,1:1 55 Е Трет-бутиловый спирт 3,5:1 53 F Ацетонитрил 1,6:1 40 Пример 41 Получение обогащенного бета-аномером 9[(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-2-ацетамидо-6-дифенилкарбамоилоксипурина с 2 эквивалентами калиевой соли 2ацетамидо-6-дифенилкарбамоилоксипурина К 1,4 г 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 14 мл дихлорметана н 0,515 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, охлаждался до -40°С и подвергался реакции с 0,621 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2,2дифтор-2-дезокси-D-рибофуранозил-3,5-дибензоил-1-трифторметансульфонат в растворе. Приготавливался раствор 2,56 г 2-ацетамидо6-дифенилкарбамоилоксипурина в 50 мл гopячeгo диметилформамида и поддерживался безводным в атмосфере азота. Раствор охлаждался до 25°С, и добавлялось 0,74 г трет-бутилата калия. Получающаяся смесь перемешивалась при 23°С в течение 10 минут и выпаривалась до масла, которое растиралось с эфиром, собиралось на фильтре и сушилось в вакууме при 40°С, давая калиевую соль 2-ацетамидо-6-дифенилкарбамоилоксипурина. 496 мг пуриновой соли суспензировалось в 3 мл дихлорметана, суспензия охлаждалась до 5°С и подвергалась реакции с раствором обогащенного альфа-аномера 2-дезокси-2,2-дифтор-Dрибофуранозил-3,5-дибензоил-1-трифторметансульфоната, перемешивалась в течение 1 часа и подогревалась до 25°С, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC. Аномерное отношение бета к альфа блокированного нуклеозида было 1,8:1. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл води, 1 мл 1 норм. соляной кислоты и 2 мл насыщенного водного раствора хлорида натрия. Органический слой отделялся, промывался 5 мл-ми насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Выход блокированного бета-аномера нуклеозида был 5 8%. Пример 42 Получение обогащенного бета-аномером 9-[1(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)]-2,6-дипиваламидоаминопурина с 7 эквивалентами 2,6-калиевой соли 2,6-дипиваламидоаминопурина 23 41261 К 100 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата добавлялось 3 мл дихлорметана и 0,036 мл триэтиламина. Данный раствор перемешивался при 23°С в течение 15 минут, охлаждался до -78°С и подвергался реакции с 0,045 мл трифторметансульфонового ангидрида, образуя обогащенный альфа-аномером 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1трифторметансульфонат в растворе. Приготавливалась суспензия 1,85 г, 2,6-дипиваламидоаминопурина в 30 мл ацетонитрила и поддерживалась безводной в атмосфере азота. Добавлялось 0,65 г трет-бутилата калия, и получающаяся смесь перемешивалась при 23°С в течение 10 минут и сушилась в вакууме при 40°С, образуя калиевую соль 2,6-дипиваламидоаминопурина, которая охлаждалась до -78°С. Пуриновая соль подвергалась реакции с раствором обогащенного альфа-аномером 2-дезокси-2,2-дифторD-рибофуранозил-3,5-дибензоил-1-трифторметансульфоната при 23°С, перемешивалась в течение 1,5 часов и подогревалась до 22°С, образуя целевой блокированный нуклеозид, что подтверждалось данными анализа HPLC. Для экстрагирования нуклеозидного продукта из реакционной смеси добавлялось 25 мл этилацетата, 1 мл льда, 1 мл 1 норм. соляной кислоты и 2 мл насыщенного водного раствора хлористого натрия. Органический слой отделялся, промывался 5 мл насыщенного водного раствора бикарбоната натрия, 5 мл солевого раствора и сушился над сульфатом магния. Аномерное отношение бета к альфа блокированного нуклеозида составило 2,7:1. Пример 43 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 3 эквивалентами бис-триметилсилилцитозина Бис-триметилсилилцитозин приготавливался путем объединения 292 мг цитозина с 2 мл гексаметилдисилазана, 11 мг сульфата аммония и 5 мл ксилолов и нагревания раствора с обратным холодильником в течение одного часа с образованием гомогенного раствора. Избыток ксилолов и гексаметилдисилазана удалялся, оставляя расплавленный остаток бис-триметилсилилцитозина. К расплавленному бис-триметилсилилцитозину добавлялось 400 мг 2-дезокси-2,2-дифтор-Dрибофуранозил-3,5-дибензоил-1-α-метансульфоната, растворенного в 2 мл ксилолов, и ксилолы удалялись. Температура реакционной смеси поддерживалась при 160°С в течение 15 минут. Анализ HPLC подтвердил завершение реакции. Аномерное отношение альфа к бета блокированного нуклеозидного продукта составляло 1:1,3. Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась, разбавлялась 50 мл этилацетата и промывалась 50 мл-ми 1 норм. соляной кислоты. Пример 44 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-кетопиримидин-2-она с 3 эквивалентами бис-триметилсилилурацила Бис-триметилсилилурацил приготавливался с помощью объединения 295 мг урацила с 5 мл гексаметилдисилазана, 11 мг сульфата аммония и 10 мл 1,2-дихлорэтана. Раствор нагревался до 110°C в течение одного часа, образуя гомогенный раствор, и избыток ксилолов и гексаметилдисилазана удалялся, давая расплавленный бис-триметилсилилурацил. К расплавленному бис-триметилсилилурацилу добавлялось 200 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-α-метансульфоната. Температура реакционной смеси поддерживалась при 150°С в течение 2 часов. Анализ HPLC подтверждал завершение реакции. Аномерное отношение альфа к бета блокированного нуклеозидного продукта было 1:1,8. Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась, разбавлялась 50 мл-ми этилацетата и промывалась 50 мл-ми 1 норм. соляной кислоты. Пример 45 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 10 эквивaлeнтaми бис-триметилсилилцитозина К 1,12 г расплавленного бис-триметилсилилцитозина добавлялось 200 мг 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-α-метансульфоната. Температура реакционной смеси поддерживалась при 130°С в течение 1 часа. Анализ HPLC подтвердил завершение реакции. Аномерное отношение блокированного нуклеозидного продукта бета к альфа было 1,7:1. Для экстрагирования нуклеозидного продукта реакционная смесь разбавлялась 100 мл этилацетата и промывалась 100 мл 1 норм. соляной кислоты. Количественный анализ HPLC opгaнического слоя показал, что выход блокированного бета-аномера нуклеозида был 50%. Пример 46 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-ацетамидопиримидин-2-она с 3 эквивалентами бис-триметилсилил-N-ацетилцитозина К 500 мл бис-триметилсилил-N-ацетилцитозина добавлялось 980 мг 2-дезокси-2,2-дифтор-Dрибофуранозил-3,5-дибензоил-1-α-метансульфоната. Температура реакционной смеси поддерживалась при 108°С в течение 3 часов. Анализ HPLC подтверждал завершение реакции. Аномерное отношение бета к альфа блокированного нуклеозидного продукта составляло 1,4:1. Для экстрагирования нуклеозидного продукта реакционная смесь охлаждалась, разбавлялась 25 мл этилацетата и промывалась 25 мл 1 норм. соляной кислоты. Водный слой промывался 30 мл этилацетата. Количественный анализ HPLC этилацетатного слоя показал, что выход блокированного бета-аномера нуклеозида был 34 процента. Пример 47 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-ацетамидопиридин-2-она с 3 эквивалентами бис-триметилсилил-N-ацетилцитозина К 393 мг расплавленного бис-триметилсилилN-ацетилцитозина добавлялось 200 мг 2-дезокси 24 41261 2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-αметансульфоната. Температура реакционной смеси поддерживалась при 100°С в течение 1 часа. Аномерное отношение бета к альфа блокированного нуклеозидного продукта составил 2,3:1. Для экстрагирования нуклеозидного продукта реакционная смесь разбавлялась 40 мл-ми этилацетата и промывалась 25 мл-ми 1 норм. соляной кислоты. Количественный анализ HPLC органического слоя показал, что выход бета-аномера нуклеозида составил 27 процентов. Пример 48 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-аминопиримидин-2-она с 20 эквивaлeнтaми бис-триметилсилилцитозина Бис-триметилсилилцитозин получался с помощью объединения 4,9 г цитозина с 90 мл гексаметилдисилазана, 581 мг сульфата аммония и 2 мл ксилолов и нагревания раствора в течение двух часов с образованием гомогенного раствора. Избыток гексаметилдисилазана удалялся, и образовывался белый остаток. К раствору бистриметилсилилцитозина добавлялся 1 г 2-дезокси 2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-αметансульфоната, растворенного в 5 мл ацетонитрила, и ацетонитрил удалялся. Температура реакционной смеси поддерживалась при 130°С под вакуумом в течение 1 часа. Анализ HPLC доказал завершение реакции. Аномерное отношение бета к альфа блокированного нуклеозидного продукта составило 3,9:1. Для экстрагирования нуклеозидного продукта, реакционная смесь разбавлялась 100 мл-ми дихлорметана и промывалась последовательно 100 мл 1 норм. соляной кислоты и 200 мл 5% бикарбоната натрия, а затем 200 мл насыщенного хлористого натрия. Органический слой сушился над сульфатом магния, фильтровался и выпаривался до 1,03 г желтого твердого вещества. Количественный анализ HPLC показал, что выход бета-аномера нуклеозида составил 43 процента. В следующей таблице показано, как выбранный карбогидрат, температура реакции и количество молярных эквивалентов нуклеозида влияют на выход и аномерное отношение нуклеозидного продукта. Таблица Карбо 1:1 α:β-OMs α-OMs α-OMs α-OMs α-OMs α-OMs α-OMs α-OMs α-OMs Основание (R') Цитозин -"-"Урацил N-Ацетил Цитозин N-Ацетил Цитозин Цитозин Основание (R') Эквив. 1,5 3,0 10,0 3,0 3,0 130°С 160°С 130°С 150°С 115°С α/β Нуклеозидное отношение 3:1 1:1,3 1:1,7 1:1,8 1:1,4 3,0 110°С 1:2,3 27%β 20,0 130°С 1:4 43%β Температура (N/D) означает не определялся. Карбогидраты (карбо.) являются гидрокси-защищенными. Обозначения α или β-ОМs представляют альфа- или бета-2,2-дифтор-2-дезокси-D-рибофуранозил-3,5дибензоил-1-метансульфонат и β- или α-ОТs, представляют бета- или альфа-2,2-дифтор-2-дезокси-D-рибофуранозил-3,5-дибензоил-1-толуолсульфонат. Данные выхода представлены в расчете на общее количество карбогидрата и вычислены с помощью количественного HPLС анализа в обратной фазе, при котором пик соответствующего раствора продукта сравнивался со стандартом 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-бета-D-рибофуранозил)-4-аминопиримидин-2-оном. Защитной группой нуклеозидного основания в каждом примере является триметилсилил. Пример 49 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-пиваламидопиримид-2-она в ацетонитриле N-пиваламидоцитозин (1,0 г, 5,5 ммолей) суспензировался в ацетонитриле (15,0 мл) и обрабатывался трет-бутилатом калия (0,062 г, 5,5 ммоля) и перемешивался в атмосфере азота при 25°С, образуя калиевую соль N-пивалоилцитозина. Выход N/D N/D 50%β N/D 34%β 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5дибензоил-1-α-(п-бромбензол/сульфонат) (2,99 г, 5,0 ммолей) в ацетонитриле (10,0 мл) добавлялся к указанной выше соли, и вся смесь подвергалась реакции в течение 5,5 часов при 65°С, образуя блокированный нуклеозид. Анализ HPLC подтверждал завершение реакции и показал аномерное отношение бета к альфа 3,9:1. Для выделения нуклеозидного продукта реакционная смесь распределялась между этилацетатом и водой, и органический слой промывался бикарбонатом натрия и сушился над сульфатом магния. Хроматография на колонке (силикагель, толуол/этилацетат 6:4) дала 0,700 г целевого продукта с вы ходом 20 процентов, т.пл. 191-193°С. Пример 50 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-(N-пиваламидо)-аминопиримид-2-она в ацетонитриле N-пиваламидоцитозин (0,098 г, 0,5 ммоля) суспендировался в ацетонитриле (1,5 мл) и обрабатывался трет-бутилатом калия (0,062 г, 0,55 ммоля) и перемешивался в атмосфере азота при 25°С, давая калиевую соль N-пивалоилцитозина. 25 41261 К выше указаной соли добавлялся 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-αиодид (0,244 г 0,5 ммоля) в ацетонитриле (1,5 мл), и вся смесь подвергалась взаимодействию в течение 24 часов при 60°С, давая блокированный нуклеозид. Анализ HPLC подтвердил завершение реакции и показал аномерное отношение бета к альфа 1,13:1. Пример 51 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-1,2,4-триазол-3-карбонитрила в ацетонитриле 1,2,4-триазол-3-карбонитрил (0,101 г, 1,03 ммоля) суспендировался в ацетонитриле (10 мл и обрабатывался гидридом натрия) (0,0445 г, 1,12 ммоля) и перемешивался в атмосфере азота при 25°С с образованием соответствующей натриевой соли триазола. К указанной выше соли добавлялся 2-дезокси-2,2-дифтор-Dрибофуранозил-3,5-дибензоил-1-α-бромид (0,451 г, 1,02 ммоля) в ацетонитриле (10 мл), и вся смесь подвергалась реакции в течение 78 часов при 82°С, образуя блокированный нуклеозид. Анализ HPLC подтвердил завершение реакции и показал аномерное отношение бета к альфа 1,2:1. Для выделения нуклеозидного продукта реакционная смесь выпаривалась, образуя маслянистое твердое вещество, разбавлялась этилацетатом, промывалась бикарбонатом натрия и сушилась над сульфатом магния и концентрировалась. Остаток кристаллизовался из этанола, давая 30 мг целевого продукта с выходом 6%, т.пл. 225-228°С, МС/FD/М/Z 455 (M+1). Элементный анализ для С 22Н16F2N4О 5: (Теоретический) С 58,15, Н 3,55, N 12,33. (Эмпирический) C 58,36, Н 3,79, N 12,10. Пример 52 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-1,2,4-триазол-3-карбонитрила в ацетонитриле 1,2,4-триазол-3-карбонитрил (0,272 г, 2,89 ммоля) суспендировался в ацетонтриле (20 мл), обрабатывался гидридом натрия (0,094 г, 2,7 ммоля) и перемешивался в атмосфере азота при 25°С, образуя натриевую соль триазола. К указанной моли добавлялся 2-дезокси-2,2дифтор-D-рибофуранозил-3,5-дибензоил-1-αиодид (0,941 г, 1,9 ммоля) в ацетонитриле (20 мл), и вся смесь подвергалась реакции в течение 48 часов при 82°С, образуя блокированный нуклеозид. Анализ HPLC подтвердил завершение реакции и показал аномерное отношение бета к альфа 3,5:1. Для выделения нуклеозидного продукта реакционная смесь выпаривалась, образуя маслянистое твердое вещество, разбавлялась этилацетатом, промывалась бикарбонатом натрия, сушилась над сульфатом магния и концентрировалась. Остаток кристаллизовался из этанола, давая 0,421 г целевого продукта; т.пл. 225-226°С с выходом 48%. МС/FD/М/Z 455 (M+1). Элементный анализ для С 22Н16F2N4О 5: (Теоретический) С 58,15, Н 3,55, N 12,33. (Эмпирический) С 58,35, Н 3,65, N 12,33. Пример 53 Получение обогащенного (9) региоизомербета-аномером 1-(2'-дезиокси-2',2'-дифтор-3',5'-ди0-бензоил-D-рибофуранозил)-6-цианопурина в N,N-диметилацетамиде 6-цианопурин (0,2 г, 6,35 ммолей) суспендировался в N,N-диметилацетамиде (12 мл) и обрабатывался гидратом натрия (0,396 г, 8,25 ммолей) и перемешивался в атмосфере азота при 25°С, давая натриевую соль 6-цианопурина. К указанной выше соли добавлялся дезокси-2дифтор-D-рибофуранозил-3,5-дибензоил-1-αиодид (3,09 г, 6,35 мл) в N,N-диметилацетамиде (4 мл), вся смесь подвергалась реакции в течение 5 часов при 70°С, образуя блокированный нуклеозид. Анализ HPLC подтверждал завершение реакции и показывал аномерное отношение бета к альфа 1,2:1. Для выделения нуклеозидного продукта реакционная смесь охлаждалась, растворитель удалялся в вакууме, остаток растворялся в этилацетате, промывался 0,2 М раствором хлористого лития, сушился над сульфатом магния и концентрировался. Хроматография на колонке (силикагель, толуол/этилацетат 9:1) давала 0,21 г целевого продукта с выходом 6,5%. МС(FD) 506 (М+1). Элементный анализ для С 25Н17F 2N5О 5: (Теоретический) С 59,41, Н 3,39, N 13,86. (Эмпирический) С 59,85, Н 3,49, N 13,48. Пример 54 Получение обогащенного (9) региоизомербета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди0-бензоил-D-рифуранозил)-2,6-(дипиваламидо)диаминопурина в N,N-диметилацетамиде 2,6-(дипиваламидо/диаминопурин) (0,159 г, 0,5 ммоля) (суспендировался в N,N-диметилацетамиде (1,0 мл) и обрабатывался трет-бутилатом калия (0,062 г, 0,55 ммоля) и перемешивался в атмосфере азота при 25°С, образуя калиевую соль 2,6-(дипивалоид)диаминопурина. К указанной выше соли добавлялся 2-дезокси2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-α(п-бромбензол)-сульфонат (0,299 г, 0,5 ммоля) в N,N-диметилацетамиде (0,5 мл), и вся смесь подвергалась реакции в течение 6 часов при 60°С, образуя блокированный нуклеозид. Анализ HPLC подтверждал завершение реакции и указал на аномерное отношение бета к альфа 1,9:1 целевого продукта. Для выделения нуклеозидного продукта реакционная смесь охлаждалась, и растворитель удалялся под вакуумом. Остаток разбавлялся этилацетатом, промывался бикарбонатом натрия, сушился над сульфатом магния и концентрировался до масла. Хроматография на колонке (силикагельтолуол/этилацетат 1:1) давала 0,141 г как альфа, так и бета нуклеозидных продуктов с выходом 28%. МС (FD) 679 (M+1). Пример 55 Получение обогащенного (9) региоизомербета-аномером 1-(2'-дезокси-2',2'-дифтор-3',5'-ди0-бензоил-D-рибофуранозил)-2,6-(дипиваламидо)диаминопурина в ацетонитриле 26 41261 2,6-(дипиваламидо/диаминопурин) (0,159 г, 0,5 ммоля) суспендировался в ацетонитриле (1,5 мл) и обрабатывался трет-бутилатом калия (0,062 г, 0,55 ммоля) и перемешивался в атмосфере азота при 25°С с образованием калиевой соли 2,6-(дипиваламидо)диаминопурина. К указанной соли добавлялся 2-дезокси-2,2дифтор-D-рибофуранозил-3,5-дибензоил-1-αиодид (0,244 г, 0,5 ммоля) в ацетонитриле (1,5 мл), и вся смесь подвергалась реакции в течение 16 часов при 60°С, образуя блокированный нуклеозид. Анализ HPLC подтвердил завершение реакции и указал на аномерное отношение бета к альфа 2,2:1. Для выделения нуклеозидного продукта реакционная смесь разбавлялась этилацетатом, органический слой промывался бикарбонатом натрия, сушился над сульфатом магния, отделялся и концентрировался до масла. Хроматография на колонке (силикагель, толуол/этилацетат 1:1) с последующей перекристаллизацией давала 0,085 г целевого продукта с выходом 25%. МС (FD) 679 (М+1). Пример 56 Получение обогащенного бета-аномером 1-(2'дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рибофуранозил)-4-(бензиламино)-пиримид-2-она в N,Nдиметилацетамиде N-бензилцитозин (0,099 г, 0,493 ммоля) суспендировался в N,N-диметилацетамиде (2,0 мл) и обрабатывался гидридом натрия (0,0256 г, 0,534 ммоля) перемешивался в атмосфере азота при 25°С с образованием натриевой соли Nбензилцитозина. К указанной соли добавлялся 2-дезокси-2,2дифтор-D-рибофуранозил-3,5-дибензоил-1-αиодид (0,201 г, 0,411 ммоля) в N,N-диметилацетамиде (1,5 мл), и вся смесь подвергалась реакции в течение 5 часов при 23°С, образуя блокированный нуклеозид. Анализ HPLC подтверждал завершение реакции и указывал на аномерное отношение бета к альфа 1,9:1. Реакционные растворители удалялись под вакуумом, и остаток растворялся в этилацетате, промывался бикарбонатом натрия, сушился над сульфатом магния и концентрировался до масла. Хроматография на колонке (силикагель, толуол/этилацетат 9:1) давала 0,015 г целевого продукта с выходом 6,5 процентов. МС (FD) 562 (М+2). Пример 57 Получение обогащенного бета-аномером этил-1-(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоилD-рибофуранозил)-1,2,4-триазол-3-карбоксилата в N,N-диметилацетамиде Этил-1,2,4-триазол-3-карбоксилат (0,723 г, 5,13 ммолей) суспендировался в N,N-диметилацетамиде (2,5 мл), обрабатывался гидридом натрия (0,123 г, 5,13 ммолей) и перемешивался в атмосфере азота при 25°С с образованием натриевой соли триазола. К указанной соли добавлялся 2-дезокси-2,2дифтор-D-рибофуранозил-3,5-дибензоил-1-αиодид (2,0 г, 4,11ммоля) в N,N-диметилацетамиде (2,5 мл), и вся смесь подвергалась реакции в те чение 24 часов при 23°С, образуя блокированный нуклеозид. Анализ HPLC подтвердил завершение реакции и показал на аномерное отношение бета к альфа 3:1. Сырая реакционная смесь очищалась с помощью удаления растворителя при пониженном давлении и применении хроматографии на колонке (силикагель, толуол/этилацетат 9:1). Объединенный теоретический выход альфа и бета региоизомеров (А и В ниже) блокированных нуклеозидов составил 67 процентов. А. Этил-1-(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-β-D-рибофуранозил)-1,2,4-триазол-3-карбоксилат (436 мг, 21,2% выход). Перекристаллизация "А" из смеси этилацетат:изооктан давала 267 мг чистого бета-аномера с выходом 13%. В. Этил-1-(2'-дезокси-2',2'-дифтор-3',5'-ди-0-бензоил-D-рифуранозил)-1,2,4-триазол-5-карбоксилат (855 мг, 41,5% выход). Пример 58 Получение обогащенного бета-аномером 2дезокси-2,2-дифтор-D-рибофуранозил-1-β-(2-амино-6-хлорпурина) в диметилацетамиде К суспензии 2-амино-6-хлорпурина (82,6 ммоля, 14,0 г) в диметил-ацетамиде (900 мл) при 0°С в атмосфере азота добавлялся порошкообразный гидроксид калия (99,12 ммоля, 5,55 г). Смесь перемешивалась в течение 30 минут, образуя раствор. Добавлялся 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоил-1-α-иодид (82,6 ммоля, 40,31 г) в диметилацетамиде (450 мл). Реакционная смесь оставлялась подогреваться до комнатной температуры и перемешивалась в атмосфере азота на протяжении ночи. Продукт экстрагировался добавлением этилацетата и солевого раствора. Органический слой промывался последовательно 1 норм. соляной кислотой, насыщенным раствором бикарбоната натрия, водой и солевым раствором. Органический слой затем сушился над сульфатом натрия и выпаривался в вакууме. Сырой продукт очищался с помощью хроматографии на силикагеле, давая 3:1 аномерное отношение бета к альфа 2-дезокси-2,2-дифтор-D-рибо 27 41261 фуранозил-3,5-дибензоил-1-(2-амино-6-хлорпурин). 1 Н ЯМР (300 МГц, СДзОД), d 4,68 (м., 2Н), 4'-Н, 5' а-Н), 4,90 (м., 1Н, 5' b-Н), 6,02 (м., 1Н, 3'-H), 6,29 (м., 1H, 1'-H), 7,53 (м., 6Н, Вz), 7,92 (с., 1Н, 8'-Н), 8,05 (м., 4Н, Вz). Дибензоильное промежуточное соединение (0,49 ммоля, 260 мг) деблокировалось суспендированием его в метаноле при 0°С и насыщением смеси безводным аммиаком. Получающийся раствор подогревался до комнатной температуры и перемешивался на протяжении ночи. Раствор затем продувался азотом и выпаривался. Целевой продукт затем очищался с помощью промывки неполярным растворителем, таким как метиленхлорид, для удаления бензоатных побочных продуктов. Бета-аномер отделялся с помощью HPLC в обратной фазе. 1 Н ЯМР (300 МГц, СДзОД), d 3,90 (м., 3Н, 4'-Н, 5'-Н), 4,58 (м., 1Н, 3'-Н), 6,27 (дд., 1Н, 1'-Н), 8,31 (с., 1Н, 8-Н). Получение 1 Обогащенный альфа-аномером 2-дезокси-2,2дифтор-D-рибофуранозил-3,5-ди-0-бензоил-1-метансульфонат К раствору 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата (40 мг) в метиленхлориде (0,5 мл) добавлялся триэтиламин (0,025 мл). После перемешивания при комнатной температуре в течение 30 минут вся смесь охлаждалась до -78°С, затем добавлялся метансульфонилхлорид (0,01 мл). Температура реакции поддерживалась между -78°С и 80°С в течение 30 минут, затем подогревалась до комнатной температуры. Анализ HPLC показал, что реакция завершилась. Аномерное отношение целевого соединения альфа к бета, по данным определения с помощью 19 F ЯМР анализа: было 4:1. Получение 2 Альфа-аномер 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-ди-0-бензоил-1-метансульфоната К раствору 2-дезокси-2,2-дифтор-D-рибофуранозил-3,5-дибензоата (60 г, 95% чистоты) в дихлорметане (600 мл) добавлялся триэтиламин (31,5 мл, 1,5 эквивалента). После перемешивания при комнатной температуре в течение 30 минут смесь охлаждалась до -78°С. Спустя 5 минут к смеси добавлялся метансульфонилхлорид (14 мл, 1,2 экв.) в ди хлорметане (140 мл). Температура реакции поддерживалась между -78°С и -80°С в атмосфере азота в течение одного часа. Анализ HPLC показал, что реакция завершалась. Аномерное отношение целевого соединения по данным анализа HPLC было 3,53:1 альфа к бета. Для выделения целевого соединения реакционная смесь промывалась водой, 1 норм. раствором СНІ и 5% бикарбоната натрия (300 мл каждого). Органический слой отделялся и сушился над безводным сульфатом магния. Целевое соединение (31,5 г) получалось с выходом 46 процентов, т.пл. 88-89°С; (α)D (с 1,01, СНCl3)+84,2; (α)365 ам +302,0°. Элементный анализ: С20Н18О8SF2: Вычислено: С 52,63, Н 3,98, F 8,33, S 7,02 (456,4). Найдено: С 52,92, Н 3,82, F 8,33, S 7,30; 1 Н ЯМР (СДСI3), d=3,17 (СН3), 4,66 и 4,76 (С5Н), 4,84 (С-4Н), 5,57 (С-3Н), 6,13 (С-1Н), 13С ЯМР (СДСI3), d=40,22 (СН3), 62,51 (С-5Н), 71,03 (С-3Н), JС,F=18,3, 38,5 Гц), 82,75 (С-4Н), 99,59 (С-1Н, JС,F=25,5, 48,3 Гц), 122,24 (С-2Н, JС,F=259, 288 Гц). Получение 3 Обогащенный альфа-аномером 2-дезокси-2,2дифтор-D-рибофуранозил-3,5-ди-0-бензоил-1метансульфонат К аномерной смеси 2-дезокси-2,2-дифтор-Dрибофуранозил-3,5-ди-0-бензоил-1-метансульфоната (1,0 г, 97% бета-аномера) в ацетонитриле (10 мл) добавлялся N,N-диметилбензиламмонийметансульфонат (100 мг). Смесь перемешивалась и нагревалась до температуры дефлегмации. Анализ HPLC использовался для определения отношения альфа к бета целевого продукта и показал следующее: Время/часы Альфа/бета 0 1:32 16 1,0:1,4 24 2,3:1,0 Получение 4 Обогащенный альфа-аномером 2-дезокси-2,2дифтор-D-рибофуранозил-3,5-ди-0-бензоил-1метансульфонат К аномерной смеси 2-дезокси-2,2-дифтор-Dрибофуранозил-3,5-ди-0-бензоил-1-метансульфоната (29,1 г, 50% бета-аномер) в дихлорметане и н-пропилацетате … нагревалась до 90°С для удаления дихлорметана. Смесь охлаждалась до 5060°С, и добавлялась смесь триэтиламина (5,33 мл, 0,55 экв.) и метансульфо-кислота (2,04 мл, 0,55 экв.). Получающаяся в результате смесь нагревалась до 95-97°С и перемешивалась. Смесь содержала 23,2 г 2-дезокси-2,2-дифтор-Dрибофуранозил-3,5-ди-0-бензоил-1-метансульфоната. Для определения отношения альфа к бета целевого продукта использовался анализ HPLC и показал следующее: Время (часы) Альфа/бета 4 3:1 28 41261 __________________________________________________________ ДП "Український інститут промислової власності" (Укрпатент) Україна, 01133, Київ-133, бульв. Лесі Українки, 26 (044) 295-81-42, 295-61-97 __________________________________________________________ Підписано до друку ________ 2002 р. Формат 60х84 1/8. Обсяг ______ обл.-вид. арк. Тираж 50 прим. Зам._______ ____________________________________________________________ УкрІНТЕІ, 03680, Київ-39 МСП, вул. Горького, 180. (044) 268-25-22 ___________________________________________________________ 29
ДивитисяДодаткова інформація
Автори англійськоюLarry Wayne Hertel
Автори російськоюЛарри Вейн Хертел
МПК / Мітки
МПК: C07H 19/14, C07H 1/00, C07H 19/06, C07H 19/056, C07H 19/16, C07H 19/04
Мітки: бета-аномером, одержання, спосіб, нуклеозидів, збагачених
Код посилання
<a href="https://ua.patents.su/29-41261-sposib-oderzhannya-zbagachenikh-beta-anomerom-nukleozidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання збагачених бета-аномером нуклеозидів</a>
Попередній патент: Сигнальний пристрій
Наступний патент: Перекидний покажчик
Випадковий патент: Агрегат для стикування заправної магістралі пускової установки ракети