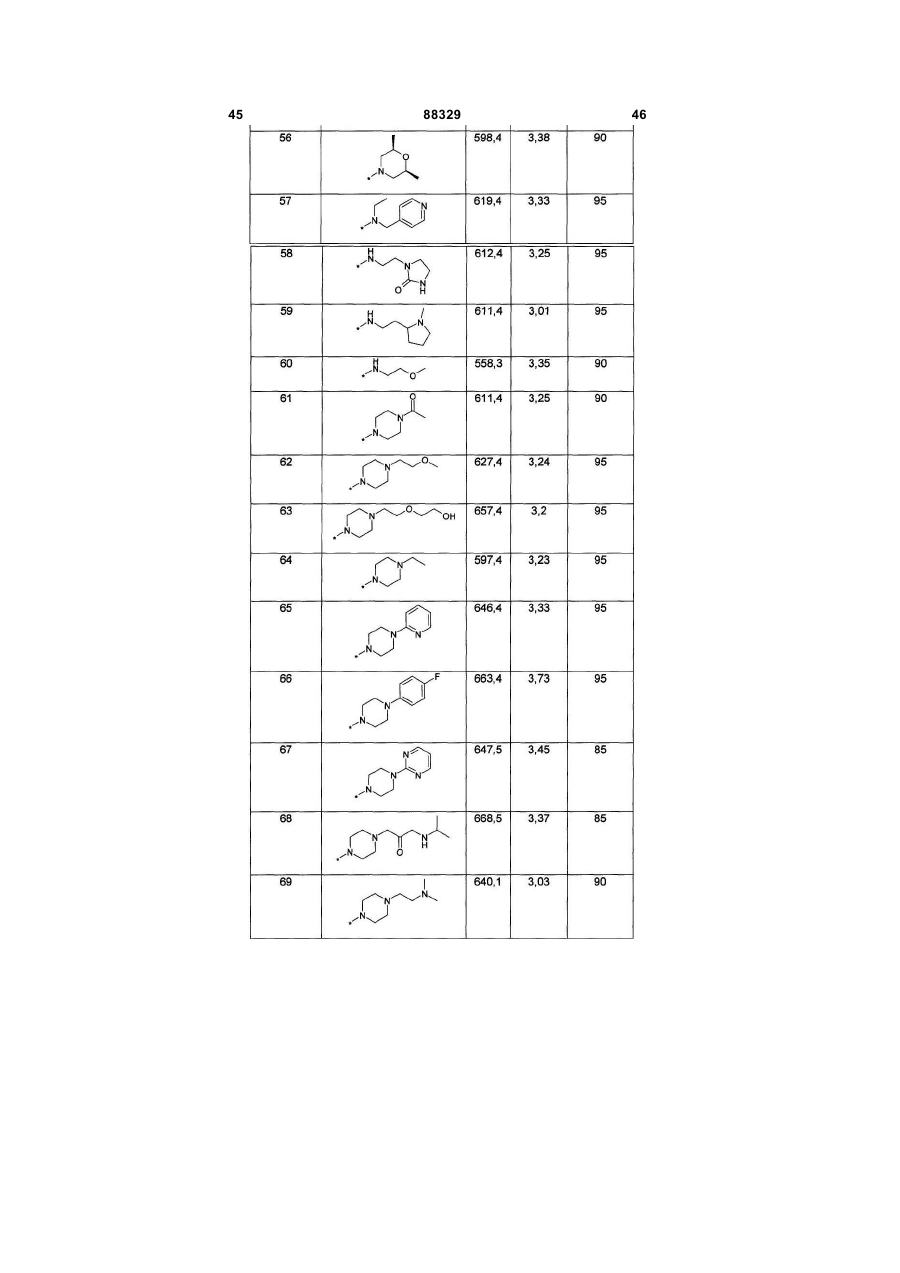
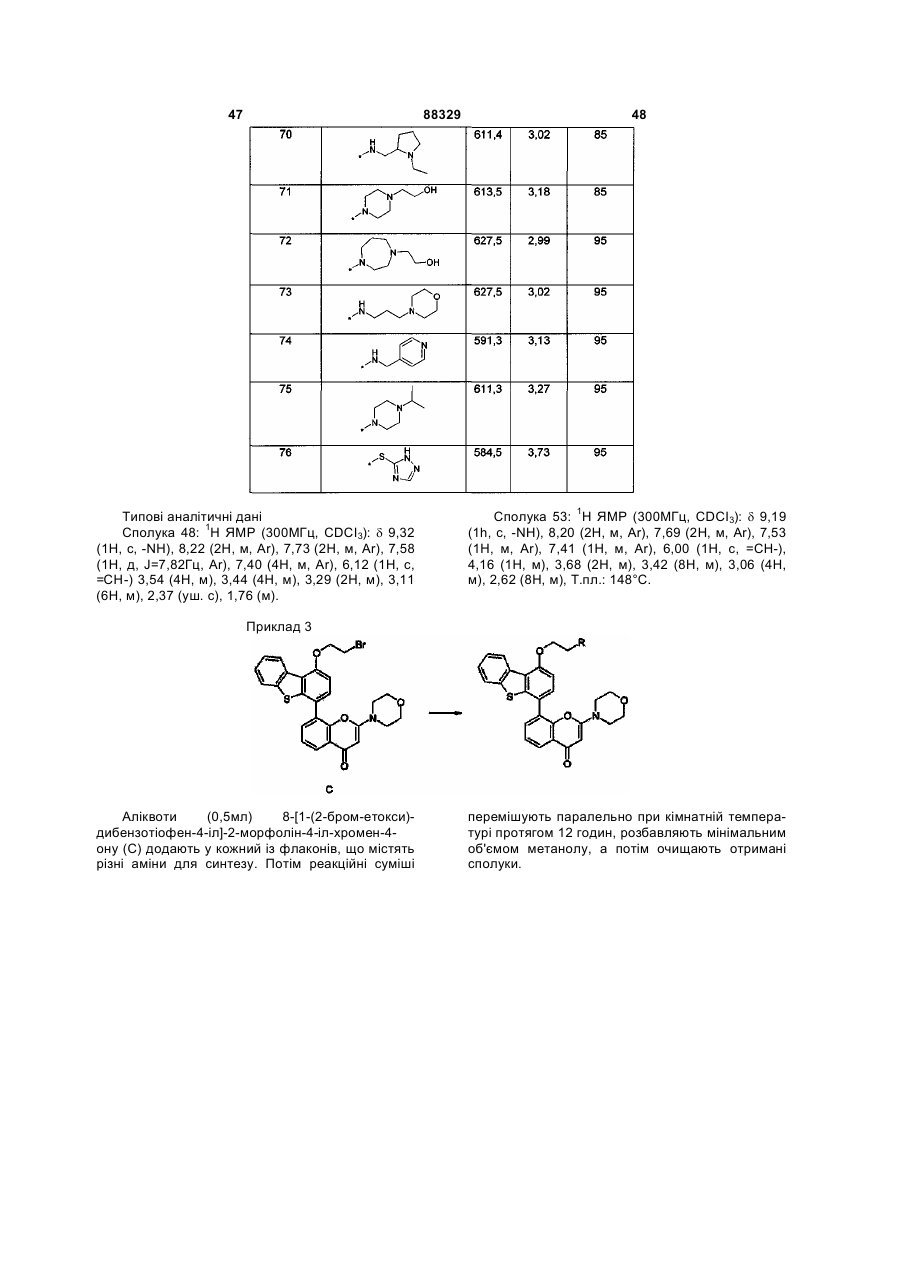
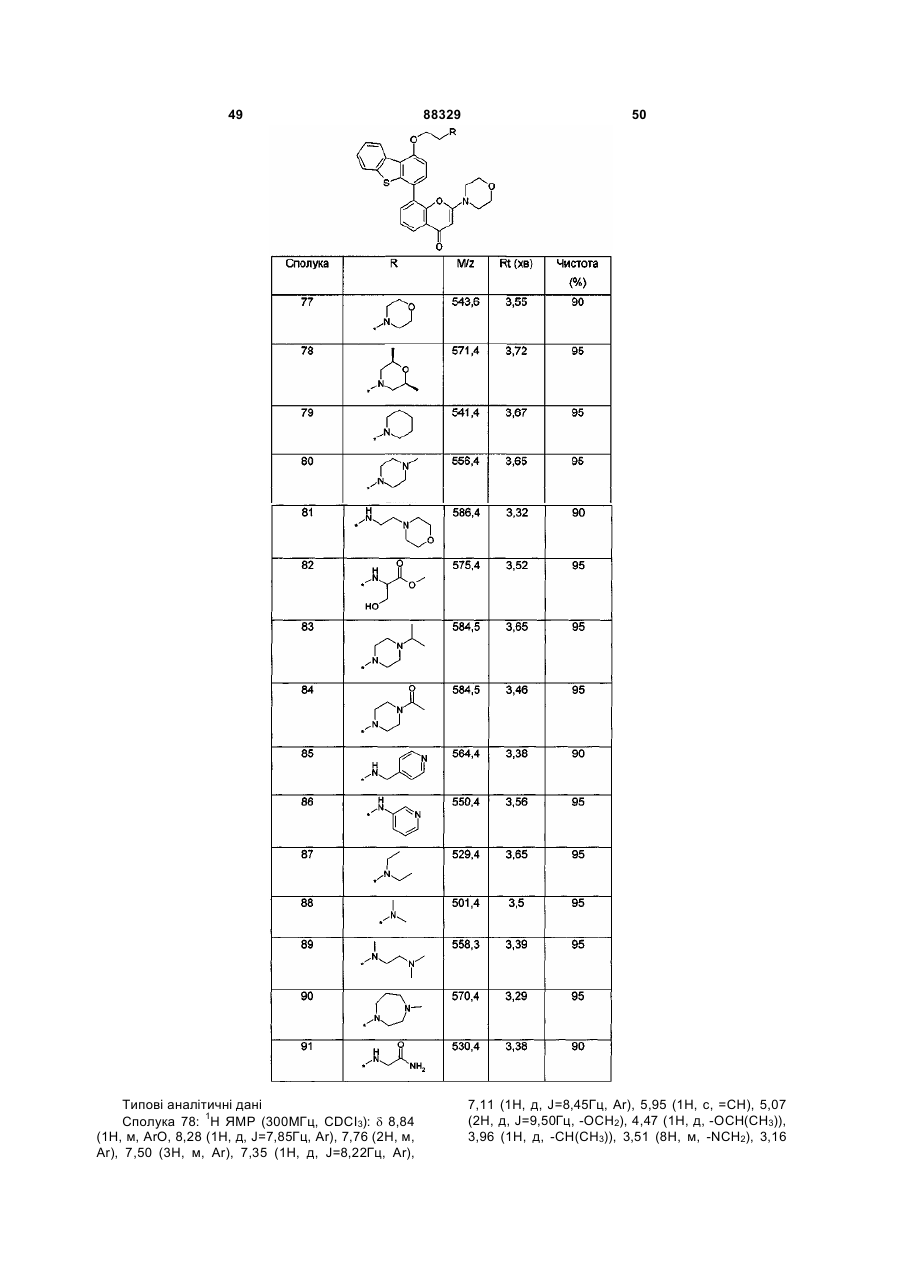
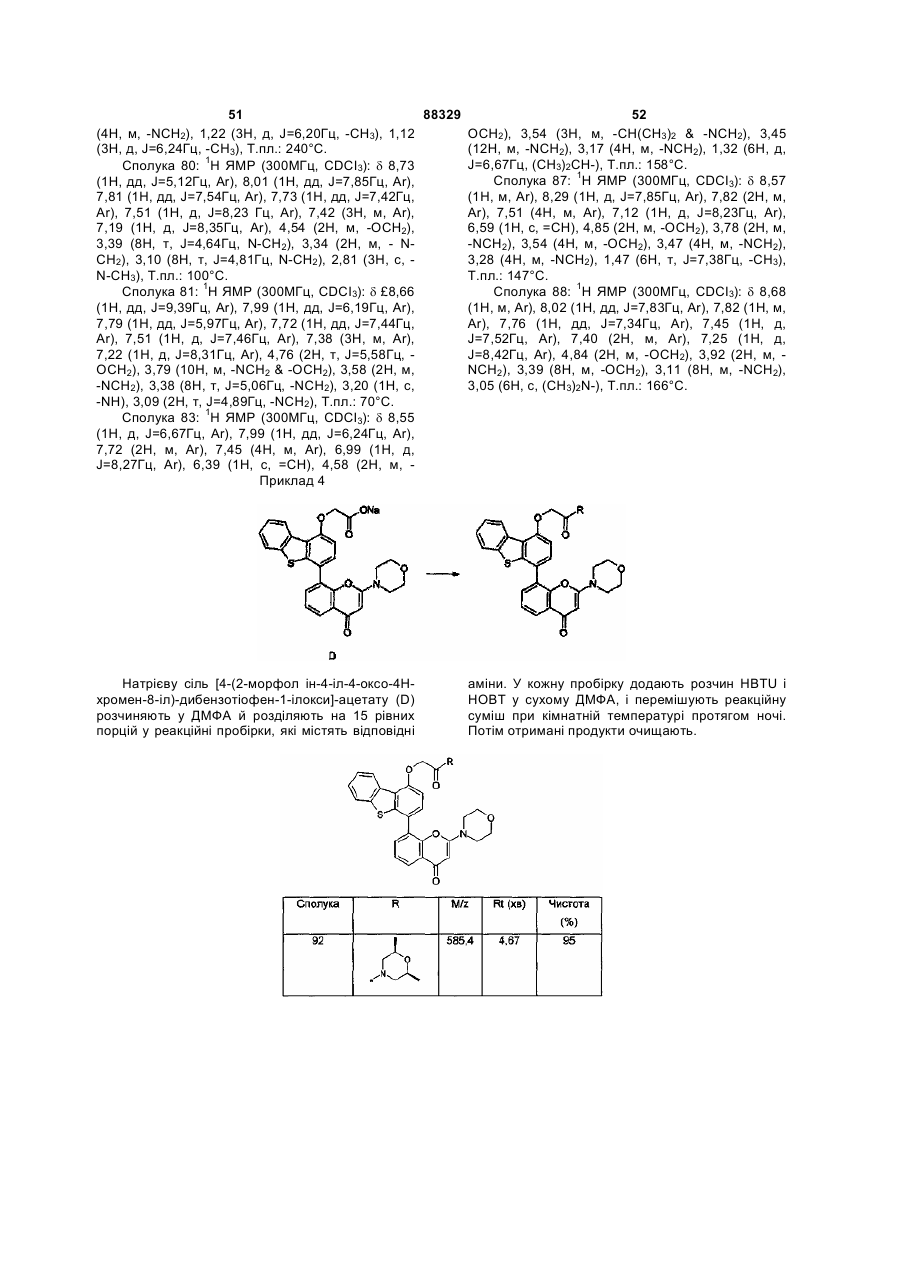
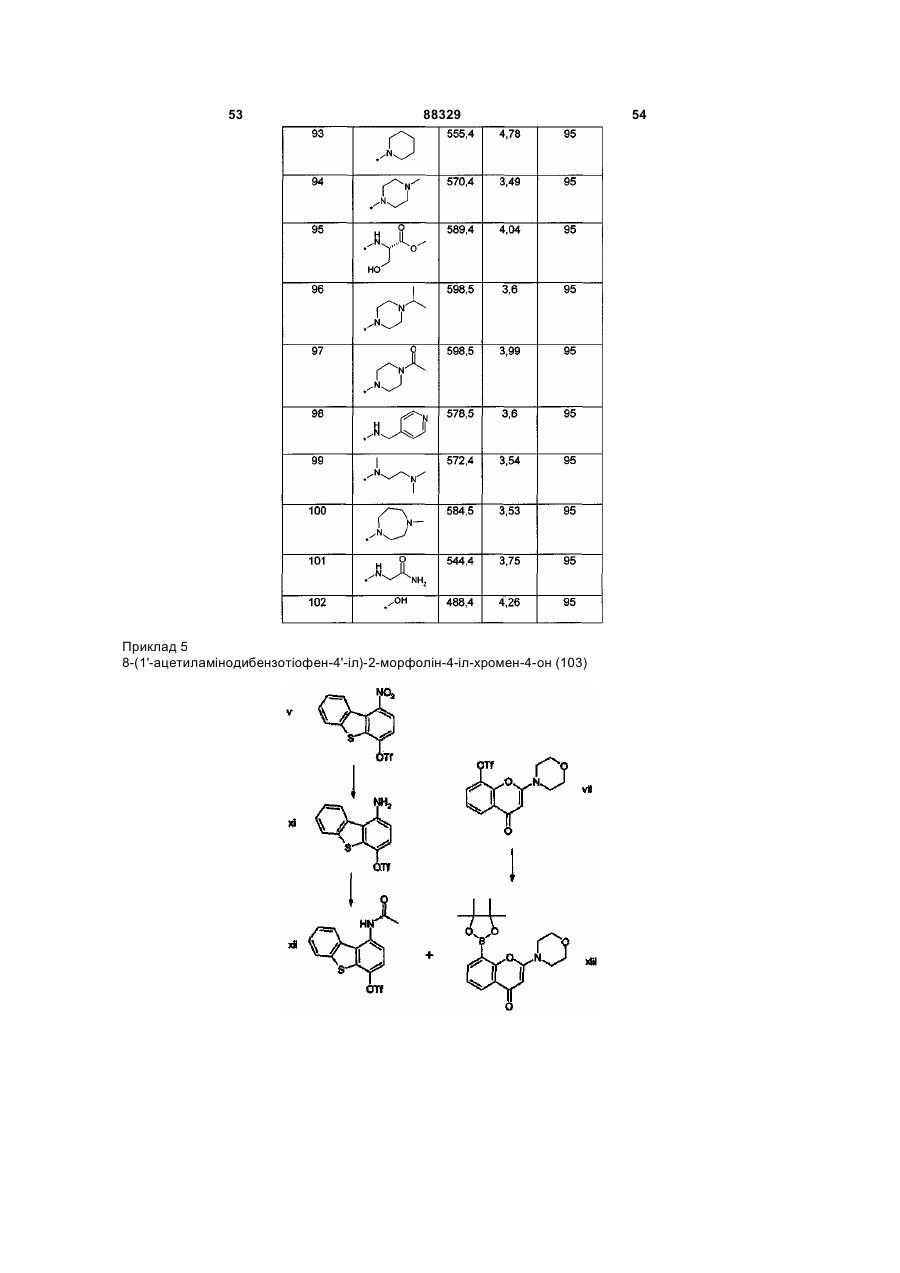
Інгібітори днк-пк
Номер патенту: 88329
Опубліковано: 12.10.2009
Автори: Рігоро Лоран Жан Мартен, Мартін Нілл Моррісон Барр, Мінер Кейт Аллан, Хаммерсон Марк Джеффрі, Сміт Грейм Камерон Маррі, Хардкасл Іан Роберт, Голдінг Бернард Томас, Сараванан Каппусамі, Гріффін Роджер Джон, Кертін Нікола Джейн, Н'юелл Девід Річард, Калверт Хіларі Алан
Формула / Реферат
1. Сполука формули І:
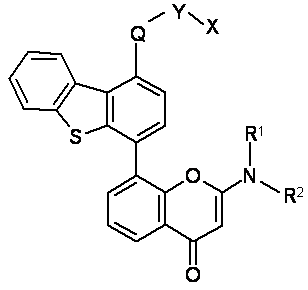 (I)
(I)
і її ізомери, солі, сольвати, хімічно захищені форми й проліки, яка відрізняється тим, що:
R1 і R2 незалежно вибрані з водню, можливо, заміщеної С1-7алкільної групи, С3-20гетероциклічної групи або С5-20арильної групи, або вони спільно можуть утворювати, разом з атомом азоту, до якого вони приєднані, гетероциклічне кільце, можливо, заміщене, котре містить від 4 до 8 атомів;
Q являє собою -NH-C(=O)- або -О-;
Y являє собою С1-5алкіленову групу, можливо, заміщену;
X вибраний з SR3 або NR4R5, причому,
R3 або R4 і R5 незалежно вибрані з водню, можливо, заміщеного С1-7алкілу, С5-20арилу або С3-20гетероциклічної групи, або R4 і R5 можуть утворювати, разом з атомом азоту, до якого вони приєднані, гетероциклічне кільце, можливо, заміщене, котре містить від 4 до 8 атомів;
якщо Q являє собою -О-, X додатково вибраний з -C(=O)-NR6R7, причому R6 і R7 незалежно вибрані з водню, можливо, заміщеного С1-7алкілу, С5-20арилу або С3-20гетероциклічної групи, або R6 і R7 можуть утворювати, разом з атомом азоту, до якого вони приєднані, можливо, заміщене гетероциклічне кільце, яке містить від 4 до 8 атомів; і
якщо Q являє собою -NH-C(=O)-, -Y-X можна додатково вибирати з С1-7алкілу.
2. Сполука за п. 1, яка відрізняється тим, що Q являє собою -NH-С(=О)- або -О-.
3. Сполука за п. 2, яка відрізняється тим, що X являє собою NR4R5.
4. Сполука за п. 3, яка відрізняється тим, що Y являє собою, можливо, заміщену С1-3алкіленову групу.
5. Сполука за п. 4, яка відрізняється тим, що Y являє собою С1-2алкіленову групу.
6. Сполука за будь-яким з пп. 1-5, яка відрізняється тим, що R4 і R5 або незалежно один від одного вибрані з Н і, можливо, заміщеного С1-7алкілу, або R4 і R5 утворюють, разом з атомом азоту, до якого вони приєднані, можливо, заміщене азотовмісне гетероциклічне кільце, яке містить від 4 до 8 атомів.
7. Сполука за п. 1 формули II:
 , (II)
, (II)
яка відрізняється тим, що:
R1, R2 і Q мають ті ж значення, які визначені для формули І;
n дорівнює від 1 до 7; і
R8 вибраний з водню, можливо, заміщеного С1-7алкілу, можливо, заміщеного С5-20арилу й ацилу.
8. Сполука за будь-яким з пп. 1-5 або 7, яка відрізняється тим, що R1 і R2 утворюють, разом з атомом азоту, до якого вони приєднані, гетероциклічне кільце, яке містить від 4 до 8 атомів.
9. Сполука за п. 8, яка відрізняється тим, що R1 і R2 утворюють, разом з атомом азоту, до якого вони приєднані, гетероциклічне кільце, яке містить 6 атомів.
10. Сполука за п. 8, яка відрізняється тим, що R1 і R2 утворюють, разом з атомом азоту, до якого вони приєднані, морфолін або тіоморфолін.
11. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-10, фармацевтично прийнятний носій або розріджувач.
12. Сполука за будь-яким з пп. 1-10 для застосування в способі лікування.
13. Застосування сполуки за будь-яким з пп. 1-10 для приготування ліків для лікування захворювання, яке характеризується поліпшенням при інгібуванні ДНК-ПК.
14. Застосування за п. 13, яке відрізняється тим, що ліки застосовують як допоміжну речовину при лікуванні раку або для підвищення чутливості пухлинних клітин до впливу іонізуючої радіації або хіміотерапевтичного засобу.
15. Застосування за п. 13, яке відрізняється тим, що вказані ліки застосовують для лікування захворювання, яке викликається ретровірусом.
Текст
1. Сполука формули І: Y X Q C2 2 (19) 1 3 88329 4 ни приєднані, гетероциклічне кільце, яке містить 6 n Q атомів. N 10. Сполука за п. 8, яка відрізняється тим, що R1 і N R2 утворюють, разом з атомом азоту, до якого воR8 ни приєднані, морфолін або тіоморфолін. R1 11. Фармацевтична композиція, яка містить сполуS ку за будь-яким з пп. 1-10, фармацевтично прийнO N ятний носій або розріджувач. R2 12. Сполука за будь-яким з пп. 1-10 для застосування в способі лікування. 13. Застосування сполуки за будь-яким з пп. 1-10 O , (II) для приготування ліків для лікування захворюваняка відрізняється тим, що: ня, яке характеризується поліпшенням при інгібуR1, R2 і Q мають ті ж значення, які визначені для ванні ДНК-ПК. формули І; 14. Застосування за п. 13, яке відрізняється тим, n дорівнює від 1 до 7; і що ліки застосовують як допоміжну речовину при 8 R вибраний з водню, можливо, заміщеного С1лікуванні раку або для підвищення чутливості пух7алкілу, можливо, заміщеного С5-20арилу й ацилу. линних клітин до впливу іонізуючої радіації або 8. Сполука за будь-яким з пп. 1-5 або 7, яка відріхіміотерапевтичного засобу. зняється тим, що R1 і R2 утворюють, разом з ато15. Застосування за п. 13, яке відрізняється тим, мом азоту, до якого вони приєднані, гетероциклічщо вказані ліки застосовують для лікування захвоне кільце, яке містить від 4 до 8 атомів. рювання, яке викликається ретровірусом. 1 9. Сполука за п. 8, яка відрізняється тим, що R і R2 утворюють, разом з атомом азоту, до якого во Даний винахід стосується сполук, які діють як інгібітори ДНК-ПК, їх застосування й синтезу. ДНК-залежна протеїнкіназа (ДНК-ПК) являє собою ядерну серин/треонінову протеїнкіназу, яка активується при зв'язуванні із ДНК. Згідно із біохімічними і генетичними даними ця кіназа складається з великої каталітичної субодиниці, яка називається DNA-PKcs, і регуляторного компонента, який називається Ku. Показано, що ДНК-ПК є ключовим учасником як процесу репарації двониткових розривів (ДР) ДНК, так і апарата рекомбінації V(D)J. Крім того, недавно було показано, що ДНКПК залучена в багато інших процесів, включаючи модуляцію структури хроматину й збереження теломер [Smith, G. С. М. and Jackson, S.P., Genes and Dev. 13: 916-934 (1999)]. Вважається, що ДР ДНК є найбільш летальними ушкодженнями, з якими може зштовхнутися клітина. Щоб боротися із серйозною загрозою, що являють собою ДР ДНК, еукаріотичні клітини виробили декілька механізмів для опосередкування їх репарації. У вищих еукаріот переважним із цих механізмів є негомологічне з'єднання кінців ДНК (NHEJ), також відоме як незаконна рекомбінація. ДНК-ПК відіграє ключову роль у цьому механізмі. Було продемонстровано як in vitro, так і in vivo, що активність ДНК-ПК підвищена й корелює зі стійкістю пухлинних клітин до іонізуючої радіації (IP) і біфункціональних алкілувальних агентів [Muller C, et al., Blood, 92, 2213-2219 (1998), Sirzen F., et al., Eur. J. Cancer, 35, 111-116 (1999)]. Таким чином, припускають, що механізм стійкості клітин і пухлин зв'язаний з підвищеною активністю ДНК-ПК. Отже, інгібування ДНК-ПК низькомолекулярним інгібітором може бути ефективним у випадку пухлин, механізмом стійкості яких зв'язаний з підвищеною експресією ДНК-ПК. Також раніше було знайдено, що інгібітор ФІ-3кінази (фосфатидилінозитол-3-кінази) LY294002: також здатний інгібувати функцію ДНК-ПК in vitro [Izzard, R.A., et al., Cancer Res. 59: 2581-2586 (1999)]. Для LY294002 концентрація ІС50 (концентрація, при якій втрачається 50% активності ферменту) у відношенні ДНК-ПК становить ~1mΜ, як і у відношенні ФІ-3-кінази. Далі було показано, що LY294002 також здатен слабко сенсибілізувати клітини до дії IP [Rosenzweig, K.E., et al., Clin. Cancer Res. 3: 1149-1156 (1999)]. Патент WO 03/024949 описує ряд класів сполук, застосовних як інгібітори ДНК-ПК, включаючи 2-аміно-хромен-4-они загальної структури: з яких: 5 88329 6 вони приєднані, можливо заміщене гетероциклічне являє собою один із прикладів. Для цієї сполукільце, яке містить від 4 до 8 атомів у кільці; ки визначена ІС50, що дорівнює 10-12нМ, і SER, що Q являє собою -NH-C(=O)- або -О-; дорівнює 1,3 (способи см. нижче). Υ являє собою С1-5 алкіленову групу, можливо, Інші приклади інгібіторів ДНК-ПК включають 1заміщену; (2-гідрокси-4-морфолін-4-іл-феніл)-етанон X вибраний з SR3 або NR4R5, [Kashishian, A., et al., Mol. Cancer Ther, 2, 1257причому R3, або R4 і R5 незалежно вибрані з 1264 (2003)]: водню, можливо заміщеного С1-7 алкілу, С5-20 арилу, або С3-20 гетероциклічної групи, або R4 і R5 можуть утворювати, разом з атомом азоту, до якого вони приєднані, можливо заміщене гетероциклічне кільце, яке містить від 4 до 8 атомів в кільці; якщо Q являє собою -О-, X додатково вибраний з -C(=O)-NR6R7, де R6 і R7 незалежно вибрані з водню, можливо заміщених С1-7 алкілу, С5-20 арилу, або С3-20 гетероциклічної групи, або R6 і R7 можуть і SU11752 [Ismail, I. H., et al., Oncogene, 23, утворювати, разом з атомом азоту, до якого вони 873-882 (2004)] приєднані, гетероциклічне кільце, можливо, заміщене, що має від 4 до 8 атомів у кільці; а якщо Q являє собою -NH-C(=O)-, -Y-X можна додатково вибирати з С1-7 алкілу. В другому своєму аспекті, даний винахід забезпечує композицію, яка містить сполуку відповідно до першого аспекту винаходу, і фармацевтично прийнятний носій або розріджувач. У третьому аспекті даний винахід забезпечує сполуку відповідно до першого аспекту для застосування в способі лікування. На основі встановленої задіяності ДНК-ПК у У четвертому своєму аспекті даний винахід процесах репарації ДНК, і того факту, що низькостосується застосування сполуки відповідно до молекулярні інгібітори, як показано, сенсибілізують вказаного першого аспекту для приготування меклітини ссавців у культурі до радіаційного й хімічдикаменту для лікування захворювання, яке хараного впливу, ліки - специфічні інгібітори ДНК-ПК ктеризується поліпшенням при інгібуванні ДНК-ПК. можна застосовувати як агенти, які підвищують Переважно, медикамент відповідно до четверефективність як хіміотерапії, так і радіотерапії ратого аспекту даного винаходу селективно інгібує ка. Інгібітори ДНК-ПК також можуть виявитися коактивність ДНК-ПК у порівнянні з інгібуванням ФІрисні при лікуванні захворювань, які викликаються 3-кінази та/або білком ATM (Ataxia-Telangiectasia ретровірусами. Наприклад, було продемонстроваMutated). Селективність є важливою умовою, тому но, що втрата активності ДНК-ПК значно припиняє що інгібування інших членів сімейства ФІ-3-кінази процес інтеграції ретровірусу [Daniel R, et al., може привести до небажаних побічних ефектів, Science, 284:644-7 (1999)]. зв'язаних із втратою функції вказаних ферментів. Автори даного винаходу виявили споріднені Зокрема, вказані сполуки можна застосовувасполуки, які демонструють подібні або поліпшені ти при виготовленні ліків для: рівні інгібування ДНК-ПК, у той же час мають інші (а) використання як допоміжної речовини при корисні властивості для застосування їх як активлікуванні раку або для підвищення чутливості пухних лікарських препаратів, зокрема, поліпшену линних клітин до обробки іонізуючою радіацією розчинність. або хіміотерапевтичними засобами; і Відповідно, перший аспект винаходу забезпе(б) лікування захворювань, які викликаються чує сполуку формули І: ретровірусами. Наступний аспект винаходу стосується вказаної активної сполуки, для застосування в способі лікування тіла людини або тварини, переважно у формі фармацевтичної композиції. Інший аспект даного винаходу стосується способу інгібування ДНК-ПК in vitro або in vivo, який включає приведення в контакт клітини з ефективною кількістю описаної тут активної сполуки. Визначення С1-7 алкіл: термін «С1-7 алкіл», при використанні в даному описі, стосується одновалентного залишку, отриманого шляхом відриву атома водню і її ізомери, солі, сольвати, хімічно захищені від С1-7 вуглеводневої сполуки, що містить від 1 до форми й проліки, які відрізняються тим, що: 7 атомів вуглецю, яка може бути аліфатичною або R1 і R2 незалежно вибрані з водню, можливо аліциклічною, або їх комбінацією, і яка може бути заміщеної С1-7 алкільної групи, С3-20 гетероциклічнасиченою, частково ненасиченою або повністю ної групи, або С5-20 арильної групи, або вони моненасиченою. жуть утворювати, разом з атомом азоту, до якого 7 88329 8 Приклади насичених лінійних С1-7 алкільних роциклічних груп включають цукри, у циклічній груп без обмеження включають: метил, етил, нформі, наприклад, фуранози й піранози, включаюпропіл, н-бутил і н-пентил (аміл). чи, наприклад, рибозу, ликсозу, ксилозу, галактозу, Приклади насичених розгалужених С1-7 алкісахарозу, фруктозу й арабінозу. льних груп без обмеження включають: ізо-пропіл, Приклади С3-20 гетероциклічних груп, які місiзо-бутил, втор-бутил, трет-бутил і нео-пентил. тять один атом сірки, включений у кільце, без обПриклади насичених аліциклічних С1-7 алкільмеження включають: похідні тіїрану, тієтану, тіоланих груп (які також називаються «С3-7 циклоалкільну (тетрагідротіофену), тіану (тетрагідротіопірану) і ними» групами) без обмеження включають такі тієпану. групи, як циклопропіл, циклобутил, циклопентил і Приклади С3-20 гетероциклічних груп, які місциклогексил, а також заміщені групи (наприклад, тять два атоми кисню, включених у кільце, без групи, які містять вказані групи), такі як метил цикобмеження включають: похідні діоксолану, діоксалопропіл, диметилциклопропіл, метил циклобутил, ну й діоксепану. диметилциклобутил, метилциклопентил, диметилПриклади С3-20 гетероциклічних груп, які місциклопентил, метилциклогексил, диметилциклогетять два атоми азоту, включених у кільце, без обксил, циклопропіл метил і циклогексил метил. меження включають: похідні імідазолідину, піразоПриклади ненасичених С1-7 алкільних груп, які лідину (діазолідин), імідазоліну, піразоліну містять один або більше вуглець-вуглецевих по(дигідропіразол) і піперазину. двійних зв'язків (які також називають «С2-7 алкеніПриклади С3-20 гетероциклічних груп, які місльними» групами) без обмеження включають: ететять один атом азоту, включений у кільце, і один ніл (вініл, -СН Н 2), 2-пропеніл (аліл, -СНС = атом кисню, включений у кільце, без обмеження СН СН2), ізопропеніл (-С(СН3)=СН2), бутеніл, пен= включають: похідні тетрагідрооксазолу, дигідрооктеніл і гексеніл. сазолу, тетрагідроізооксазолу, дигідроізооксазолу, Приклади ненасичених С1-7 алкільних груп, які морфоліну, тетрагідрооксазину, дигідрооксазину й містять один або більше вуглець-вуглецевих пооксазину. трійних зв'язків (які також називають «С2-7 алкініПриклади С3-20 гетероциклічних груп, які місльними» групами) без обмеження включають: етитять один атом кисню, включений у кільце, і один ніл і 2-пропініл (пропаргіл). атом сірки, включений у кільце, без обмеження Приклади ненасичених аліциклічних (карбоцивключають: похідні оксатіолану й оксатіану (тіоклічних) С1-7 алкільних груп, які містять один або ксан). більше вуглець-вуглецевих подвійних зв'язків (які Приклади С3-20 гетероциклічних груп, які містакож називають «С3-7 циклоалкенільними» групатять один атом азоту, включений у кільце, і один ми) без обмеження включають незаміщені групи, атом сірки, включений у кільце, без обмеження такі як циклопропеніл, циклобутеніл, циклопентевключають: похідні тіазоліну, тіазолідину й тіомоніл і циклогексеніл, а також заміщені групи (наприрфоліну. клад, групи, які містять вказані групи) такі як цикІнші приклади С3-20 гетероциклічних груп, без лопропенілметил і циклогексенілметил. обмеження включають: оксадіазин і оксатіазин. С3-20 гетероциклічний: термін «С3-20 гетероцикПриклади гетероциклічних груп, які додатково лічний», при використанні в даному описі, стосумістять одну або більше оксо- (=O) груп, без обється одновалентного залишку, отриманого шлямеження включають: похідні: хом видалення атома водню від кільцевого атома С5 гетероциклів, таких як фуранон, пірон, піроС3-20 гетероциклічної сполуки, причому вказана лідон (піролідинон), піразолон (піразолінон), імідасполука містить одне кільце, або два або більше золідон, тіазолон і ізотіазолон; кільця (наприклад, спіросполуки, конденсовані, С6 гетероциклів, таких як піперидинон (піперимісточкові), і містить від 3 до 20 атомів у кільці, з дон), піперидиндіон, піперазинон, піперазиндіон, яких від 1 до 10 являють собою гетероатоми, які піридазинон і піримідинон (наприклад, цитозин, входять до складу кільця, при цьому принаймні тімін, урацил) і барбітурова кислота; одне із вказаних кілець є гетероциклічним кільцем. конденсованих гетероциклів, таких як оксінПереважно, кожне кільце містить від 3 до 7 атомів дол, пуринон (наприклад, гуанін), бензоксазолінон, у кільці, з яких від 1 до 4 становлять гетероатоми, бензопірон (наприклад, кумарин); які входять до складу кільця. «С3-20» означає атоциклічних ангідридів (-С(=О)-О-С(=О)- у кільці), ми, які входять у кільце, незалежно від того, чи є включаючи, але не обмежуючись цим, малеїновий вони атомами вуглецю або гетероатомами. ангідрид, янтарний ангідрид і глутаровий ангідрид; Приклади С3-20 гетероциклічних груп, які місциклічних карбонатів (-O-С(=O)-O- у кільці), татять один атом азоту, включений у кільце, без обких як етиленкарбонат і 1,2-пропіленкарбонат; меження включають: похідні азиридину, азетидиімідів (-C(=O)-NR-C(=O)- у кільці), включаючи, ну, піролідинів (тетрагідропірол), піроліну але не обмежуючись цим, сукцинімід, малеїнімід, (наприклад, 3-піролін, 2,5-дигідропірол), 2Н-піролу фталімід і глутарімід; або 3H-піролу (ізопірол, ізоазол), піперидину, дигілактонів (циклічних складних ефірів, -O-С(=O)дропіридину, тетрагідропіридину й азепіну. у кільці), включаючи, але не обмежуючись цим, bПриклади С3-20 гетероциклічних груп, які міспропіолактон, g-бутиролактон, d-валеролактон (2тять один атом кисню, включений у кільце, без піперидон), і e-капролактон; обмеження включають: похідні оксирану, оксетану, лактамів (циклічних амідів, -NR-C(=O)- у кільоксолану (тетрагідрофуран), оксолу (дигідрофуці), включаючи, але не обмежуючись цим, bран), океану (тетрагідропіран), дигідропірану, пірапропіолактам, g-бутиролактам (2-піролідон), dну (С6) і оксепіну. Приклади заміщених С3-20 гетевалеролактам і e-капролактам; 9 88329 10 циклічних карбаматів (-O-C(=O)-NR- у кільці), них самих і додаткових замісників, перерахованих таких як 2-оксазолідон; нижче. циклічних сечовин (-NR-C(=O)-NR- у кільці), Галоген: -F, -СІ, -Br, і -І. таких як 2-імідазолідон і піримідин-2,4-діон (наприГідрокси: -ОН. клад, тімін, урацил). Простий ефір: -OR, де R являє собою замісник С5-20 арил: термін «С5-20 арил», при викориспростого ефіру, наприклад, С1-7 алкільну групу (яку танні в даному описі, стосується одновалентного також називають С1-7 алкоксильною групою, обгозалишку, отриманого шляхом відриву атома водню ворюється нижче), С3-20 гетероциклічну групу (яку від атома ароматичного кільця в С5-20 ароматичній також називають С3-20 гетероциклілокси групою), сполуці, причому вказана сполука містить одне або С5-20 арильну групу (яку також називають С5-20 арилокси групою), переважно С1-7 алкільну групу. кільце, або два або більше кільця (наприклад, С1-7 алкокси: -OR, де R являє собою С1-7 алкіконденсованих), і містить від 5 до 20 атомів у кільльну групу. Приклади С1-7 алкоксильних груп без цях, причому принаймні одне із вказаних кілець є обмеження включають: -ОСН3 (метокси), ароматичним кільцем. Переважно, кожне кільце ОСН2СН3 (етокси) і -ОС(СН3)3 (трет-бутокси). містить від 5 до 7 атомів у кільці. Оксо (кето, -он): =O. Приклади циклічних споВсі атоми в кільці можуть бути атомами вуглелук і/або груп, які містять як замісник оксогрупу цю, як в «карбоарильних групах», у такому випадку (=O) без обмеження включають: карбоциклічні, вказану групу легко можна називати «С5-20 карбоатакі як циклопентанон і циклогексанон; гетероцикрильною» групою. лічні, такі як пірон, піролідон, піразолон, піразоліПриклади С5-20 арильних груп, які не містять нон, піперидон, піперидиндіон, піперазиндіон і імігетероатомів у кільці (тобто С5-20 карбоарильних дазолідон; циклічні ангідриди, які включають, але груп) без обмеження включають: похідні бензолу не обмежені цим, малеїновий ангідрид і янтарний (тобто феніл) (С6), нафталіну (С10), антрацену ангідрид; циклічні карбонати, такі як пропіленкар(С14), фенантрену (С14), нафтацену (С18), і пірену бонат; іміди, що включають, але не обмежені цим, (С16). сукцинімід і малеїнімід; лактони (циклічні складні Приклади арильних груп, які містять конденсоефіри, -О-С(=О)-у кільці), що включають, але не вані кільця, одне з яких не є ароматичним кільцем, без обмеження включають: похідні індену й флуообмежені цим, b-пропіолактон, g-бутиролактон, dрену. валеролактон, і e-капролактон; і лактами (циклічні Як варіант, атоми кільця можуть включати аміди, -NH-C(=O)- у кільці), що включають, але не один або більше гетероатомів, включаючи, але не обмежені цим, b-пропіолактам, g-бутиролактам (2обмежуючись цим, кисень, азот і сірку, як в «гетепіролідон), d-валеролактам, і e-капролактам. роарильних групах». У цьому випадку вказану груІміно (іміни): =NR, де R являє собою замісник пу легко можна називати «С5-20 гетероарильною» іміну, наприклад, водень, С1-7 алкільну групу, С3-20 групою, де «С5-20» означає атоми, які входять у гетероциклічну групу, або С5-20 арильну групу, пекільце, незалежно від того, чи є вони атомами вугреважно водень або С1-7 алкільну групу. Приклади лецю або гетероатомами. Переважно, кожне кільіміногруп без обмеження включають: =NH, =NMe, це містить від 5 до 7 атомів у кільці, з яких від 0 до =NEt, і =NPh. 4 є гетероатомами, які входять у кільце. Форміл (карбальдегід, карбоксальдегід): Приклади С5-20 гетероарильних груп без обмеС(=О)Н. ження включають: С5 гетероарильні групи - похідні Ацил (кето): -C(=O)R, де R являє собою замісфурану (оксол), тіофену (тіол), піролу (азол), іміник ацилу, наприклад, С1-7 алкільну групу (яку тадазолу (1,3-діазол), піразолу (1,2-діазол), триазокож називають С1-7 алкілацил або С1-7 алканоїл), лу, оксазолу, ізооксазолу, тіазолу, ізотіазолу, окС3-20 гетероциклічну групу (яку також називають С3садіазолу й оксатриазолу; і С6 гетероарильні групи 20 гетероциклілацил), або С5-20 арильну групу (яку - похідні ізоксазину, піридину (азин), піридазину також називають С5-20 арилацил), переважно С1-7 (1,2-діазин), піримідину (1,3-діазин, наприклад, алкільну групу. Приклади ацильних груп без обмецитозин, тімін, урацил), піразину (1,4-діазин), триження включають: -С(=О)СН3 (ацетил), азину, тетразолу й оксадіазолу (фуразан). С(=О)СН2СН3 (пропіоніл), -С(=О)С(СН3)3 (бутирил), Приклади С5-20 гетероциклічних груп (деякі з і -C(=O)Ph (бензоїл, фенон). яких є С5-20 гетероарильними групами), які містять Карбокси (карбонова кислота): -СООН. конденсовані кільця, без обмеження включають: Складний ефір (карбоксилат, ефір карбонової С9 гетероциклічні групи - похідні бензофурану, кислоти, оксикарбоніл): -C(=O)OR, де R являє соізобензофурану, індолу, ізоіндолу, пурину (наприбою замісник ефіру, наприклад, С1-7 алкільну груклад, аденін, гуанін), бензотіофену, бензимідазопу, С3-20 гетероциклічну групу, або С5-20 арильну лу; С10 гетероциклічні групи - похідні хіноліну, ізогрупу, переважно С1-7 алкільну групу. Приклади хіноліну, бензодіазину, піридопіридину, складноефірних груп без обмеження включають: хіноксаліну; С13 гетероциклічні групи - похідні карС(=О)ОСН3, -С(=О)ОСН2СН3, -С(=О)ОС(СН3)3, і базолу, дибензотіофену, дибензофурану; С14 геC(=O)OPh. тероциклічні групи - похідні акридину, ксантену, Ацилокси (обернений складний ефір): феноксантину, феназину, феноксазину, фенотіазіOC(=O)R, де R являє собою ацилоксильний замісну. ник, наприклад, С1-7 алкільну групу, С3-20 гетероциВищеописані С1-7 алкільні, С3-20 гетероциклічні клічну групу, або С5-20 арильну групу, переважно й С5-20 арильні групи, самі по собі або як частина С1-7 алкільну групу. Приклади ацилокси груп без іншого замісника самі можуть, можливо, бути заобмеження включають: -ОС(=О)СН3 (ацетокси), міщені однією або більше групами, вибраними з 11 88329 12 ОС(=О)СН2СН3, -ОС(=О)С(СН3)3, -ОС(=О)Рп, і OC(=O)CH2Ph. Амідо (карбамоїл, карбаміл, амінокарбоніл, карбоксамід): -C(=O)NR1R2, де R1 і R2 незалежно один від одного являють собою замісники аміну, як Аміно: -NR1R2, де R1 і R2 незалежно один від це визначено для аміногруп. Приклади амідогруп одного являють собою замісники аміну, наприбез обмеження включають: -C(=O)NH2, клад, водень, С1-7 алкільну групу (яку також назиC(=O)NHCH3, -C(=O)N(CH3)2, -C(=O)NHCH2CH3, і вають С1-7 алкіламіно або ди-С1-7 алкіламіно), С3-20 C(=O)N(CH2CH3)2, а також амідогрупи, у яких R1 і гетероциклічну групу, або С5-20 арильну групу, пе2 R , разом з тим атомом азоту, до якого вони приреважно водень або С1-7 алкільну групу, або у виєднані, утворюють гетероциклічну структуру, нападку «циклічної» аміногрупи, R1 та R2, разом з приклад, як у піперидинокарбонілі, морфолінокартим атомом азоту, до якого вони приєднані, утвобонілі, тіомрфолінокарбонілі й піперазинокарбонілі рюють гетероциклічне кільце, яке містить від 4 до 1 2 1 Ациламідо (ациламіно): -NR C(=O)R , де R 8 атомів у кільці. Приклади аміногруп без обмеявляє собою замісник аміду, наприклад, водень, ження включають: -NH2, -NHCH3, -NHC(CH3)2, С1-7 алкільну групу, С3-20 гетероциклічну групу, або N(CH3)2, -N(CH2CH3)2, і -NHPh. Приклади циклічних С5-20 арильну групу, переважно водень або С1-7 аміногруп без обмеження включають: азиридин, 2 алкільну групу, a R являє собою замісник ацилу, азетидин, піролідин, піперидин, піперазин, морфонаприклад, С1-7 алкільну групу, С3-20 гетероциклічлін і тіоморфолін. ну групу, або С5-20 арильну групу, переважно воІміно: =NR, =NR, де R являє собою замісник день або С1-7 алкільну групу. Приклади ациламідіміну, наприклад, водень, С1-7 алкільну групу, С3-20 них груп без обмеження включають: -NHC(=O)CH3, гетероциклічну групу, або С5-20 арильну групу, пе-NHC(=O)CH2CH3, і -NHC(=O)Ph. R1 і R2 можуть реважно водень або С1-7 алкільну групу. разом утворювати циклічну структуру, наприклад, Амідин: -C(=NR)NR2, де кожний з R являє сосукцинімідил, малеімідил і фталімідил: бою замісник амідину, наприклад, водень, С1-7 алкільну групу, С3-20 гетероциклічну групу, або С5-20 арильну групу, переважно Η або С1-7 алкільну групу. Прикладом амідинової групи є -C(=NH)NH2. Карбазоїл (гідразинокарбоніл): -C(O)-NN-R1, де 1 R являє собою замісник аміну, як це визначено для аміногруп. Приклади азиногруп без обмеження включають: -C(O)-NN-H, -C(O)-NN-Me, -C(O)NN-Et, -C(O)-NN-Ph, i -C(O)-NN-CH2-Ph. 1 2 3 1 2 Ацилуреїдо: -N(R )C(O)NR C(O)R де R і R Нітро: -NO2. незалежно один від одного являють собою уреїдНітрозо: -NO. ние замісники, наприклад, водень, С1-7 алкільну Азидо: -N3. групу, С3-20 гетероциклічну групу, або С5-20 арильну Ціано (нітрил, карбонітрил): -СN. групу, переважно водень або С1-7 алкільну групу. Ізоціано: -NC. R3 являє собою ацильну групу, як це визначено Ціанато: -OCN. для ацильних груп. Приклади ацилуреїдних груп Ізоціанато: -NCO. без обмеження включають: -NHCONHC(O)H, Тіоціано (тіоціанато): -SCN. NHCONMe(O)H, -NHCONEt(O)H, NHCONMe(O)Me, Ізотіоціано (ізотіоціанато): -NCS. -NHCONEt(O)Et, -NMeCONHC(O)Et, Сульфгідрил (тіол, меркапто): -SH. NMeCONHC(O)Me, NMeCONHC(O)Et, Тіоефір (сульфід): -SR, де R являє собою заNMeCONMe(O)Me, -NMeCONEt(O)Et, і місник тіоефіру, наприклад, С1-7 алкільну групу (яку NMeCONHC(O)Ph. також називають С1-7 алкілтіо групою), С3-20 гетеКарбамат: -NR1-C(O)-OR2 де R1 являє собою роциклічну групу, або С5-20 арильну групу, перевазамісник аміну, як це визначено для аміногруп, a жно С1-7 алкільну групу. Приклади С1-7 алкілтіогруп 2 R являє собою складноефірну групу, як це визнабез обмеження включають: -SCH3 і -SCH2CH3. чено для складноефірних груп. Приклади карбаДисульфід: -SS-R, де R являє собою замісник матних груп без обмеження включають: -NH-C(O)дисульфіду, наприклад, С1-7 алкільну групу, С3-20 O-Me, -NMe-С(О)-О-Ме, -NH-C(O)-O-Et, -NМе-С(О)гетероциклічну групу, або С5-20 арильну групу, пеО-t-бутил, і -NH-C(O)-O-Ph. реважно С1-7 алкільну групу (яку також називають 1 2 1 2 Тіоамідо (тіокарбаміл)· -C(=S)NR R , де R і R в даному описі С1-7 алкілдисульфідом). Приклади незалежно один від одного являють собою замісС1-7 алкілдисульфідних груп без обмеження вклюники аміну, як це визначено для аміногруп. Причають: -SSCH3 і -SSCH2CH3. клади тіоамідогруп без обмеження включають: Сульфон (сульфоніл): -S(=O)2R, де R являє C(=S)NH2, -C(=S)NHCH3, -C(=S)N(CH3)2, і собою замісник сульфону, наприклад, С1-7 алкільну C(=S)NHCH2CH3. групу, С3-20 гетероциклічну групу, або С5-20 арильну Тетразоліл: п’ятичленне ароматичне кільце, групу, переважно С1-7 алкільну групу. Приклади яке містить чотири атоми азоту й один атом вуглесульфонових груп без обмеження включають: цю: S(=O)2CH3 (метансульфоніл, мезилат), -S(=O)2CF3 (трифлат), -S(=O)2CH2CH3, -S(=O)2C4F9 (нонафлат), -S(=O)2CH2CF3 (трезилат), -S(=O)2Ph (фенілсульфоніл), 4-метилфенілсульфоніл (тозилат), 4 13 88329 14 бромфенілсульфоніл (брозилат), і 4-нітрофеніл (нозилат). Сульфін (сульфініл, сульфоксид): -S(=O)R, де R являє собою замісник сульфіну, наприклад, С1-7 алкільну групу, С3-20 гетероциклічну групу, або С5-20 арильну групу, переважно С1-7 алкільну групу. Приклади сульфінових груп без обмеження включають: -S(=O)CH3 і -S(=O)CH2CH3. Сульфонілокси: -OS(=O)2R, де R являє собою замісник сульфонілоксилу, наприклад, С1-7 алкільну групу, С3-20 гетероциклічну групу, або С5-20 арильну групу, переважно С1-7 алкільну групу. Приклади сульфонілоксильних груп без обмеження включають: -OS(=O)2CH3 і -OS(=O)2CH2CH3. Сульфінілокси: -OS(=O)R, де R являє собою замісник сульфінілоксилу, наприклад, С1-7 алкільну групу, С3-20 гетероциклічну групу, або С5-20 арильну групу, переважно С1-7 алкільну групу. Приклади сульфінілоксильних груп без обмеження включають: -OS(=O)CH3 і -OS(=O)CH2CH3. Сульфаміно: -NR1S(=O)2OH, де R1 являє собою замісник аміну, як це визначено для аміноФосфорамідити: -OP(OR1)-NR22, де R1 і R2 явгруп. Приклади сульфамінових груп без обмеженляють собою замісники фосфорамідиту, наприня включають: -NHS(=O)2OH і -N(CH3)S(=O)2OH. клад, -Н, (можливо, заміщену) С1-7 алкільну групу, Сульфонаміно: -NR1S(=O)2R, де R1 являє соС3-20 гетероциклічну групу, або С5-20 арильну групу, бою замісник аміну, як це визначено для амінопереважно -Н, С1-7 алкільну групу, або С5-20 арильгруп, a R являє собою замісник сульфонаміну, нану групу. Приклади фосфорамідитних груп без приклад, С1-7 алкільну групу, С3-20 гетероциклічну обмеження включають: -OP(OCH2CH3)-N(CH3)2, групу, або С5-20 арильну групу, переважно С1-7 алOP(OCH2CH3)-N(i-Pr)2, і -OP(OCH2CH2CN)-N(i-Pr)2. кільну групу. Приклади сульфонамінових груп без Фосфорамідати: -OP(=O)(OR1)-NR22, де R1 і R2 обмеження включають: -NHS(=O)2CH3 і являють собою замісники фосфорамідату, наприN(CH3)S(=O)2C6H5. клад, -Н, (можливо, заміщену) С1-7 алкільну групу, Сульфінаміно: -NR1S(=O)R, де R1 являє собою С3-20 гетероциклічну групу, або С5-20 aрильну групу, замісник аміну, як це визначено для аміногруп, a R переважно -Н, С1-7 алкільну групу, або С5-20 арильявляє собою замісник сульфінаміну, наприклад, ну групу. Приклади фосфорамідатних груп без С1-7 алкільну групу, С3-20 гетероциклічну групу, або обмеження включають: -OP(=O)(OCH2CH3)С5-20 арильну групу, переважно С1-7 алкільну групу. N(CH3)2, -OP(=O)(OCH2CH3)-N(i-Pr)2, і Приклади сульфінамінових груп без обмеження OP(=O)(OCH2CH2CN)-N(i-Pr)2. включають: -NHS(=O)CH3 і -N(CH3)S(=O)C6H5. У багатьох випадках замісники самі можуть Сульфаміл: -S(=O)NR1R2, Де R1 і R2 незалежно бути заміщеними. Наприклад, С1-7 алкоксильна один від одного являють собою замісники аміну, як група може бути заміщена, наприклад, С1-7 алкіце визначено для аміногруп. Приклади сульфамілом (яка також називається С1-7 алкіл-С1-7 алкокси льних груп без обмеження включають: -S(=O)NH2, групою), наприклад, циклогексилметокси, С3-20 -S(=O)NH(CH3), -S(=O)N(CH3)2, -S(=O)NH(CH2CH3), гетероциклічною групою (яка також називається -S(=O)N(CH2CH3)2, і -S(=O)NHPh. С5-20 гетероцикліл-С1-7 алкокси групою), наприклад, Сульфонаміно: -NR1S(=O)2R, де R1 являє софталімідоетокси, або С5-20 арильною групою (яка бою замісник аміну, як це визначено для амінотакож називається С5-20 арил-С1-7 алкокси групою), груп, a R являє собою замісник сульфонаміну, нанаприклад, бензилокси. приклад, С1-7 алкільну групу, С3-20 гетероциклічну С1-5 алкілен: Термін «С1-5 алкілен», при викогрупу, або С5-20 арильну групу, переважно С1-7 алристанні в даному описі, стосується бідентатнoго кільну групу. Приклади сульфонамінових груп без залишку, отриманого шляхом відриву двох атомів обмеження включають: -NHS(=O)2CH3 і водню, або від того самого атома вуглецю, або від N(CH3)S(=O)2C6H5. Особливим класом сульфонадвох різних атомів вуглецю, аліфатичної лінійної мінових груп є похідні сультамів - у цих групах вуглеводневої сполуки, яка містить від 1 до 5 атоодин з R1 і R являє собою С5-20 арильну групу, пемів вуглецю (якщо не визначено інакше), що може реважно феніл, тоді як інший з R1 і R являє собою бути насиченим, частково ненасиченим або повнібідентатну групу, зв'язану з С5-20 арильною групою, стю ненасиченим. Таким чином, термін «алкілен» таку як бідентатна група, похідна від С1-7 алкільної включає підкласи «алкенілен», «алкінілен» і т.д., групи. Приклади таких груп включають, але не обговорювані нижче. обмежені цим: Приклади насичених С1-5 алкіленових груп без обмеження включають: -(СН2)n- де n являє собою ціле число від 1 до 5, наприклад, -СН2- (метилен), -СН2СН2- (етилен), -СН2СН2СН2- (пропілен), і СН2СН2СН2СН2- (бутилен). 15 88329 16 Приклади частково ненасичених С1-5 алкіленових груп без обмеження включають: -СН =СН- (вінілен), -СН=СН-СН 2-, -СН2-СН=СН2-, -СН=СН-СН 2СН2-, -СН=СН-СН 2-СН2-СН2-, -СН=СН-СН=СН - і СН= СН-СН= СН-СН2-. Помітимо, що спеціально включено в термін Перераховані вище групи-замісники можуть «ізомер» сполуки з одним або більше ізотопним бути замісниками алкіленової групи. заміщенням. Наприклад, Η може знаходитися в Інші Форми будь-якій ізотопній формі, включаючи 1Н, 2Н (D), і Вищенаведені значення також охоплюють до3 Н (Т); С може знаходитися в будь-якій ізотопній бре відомі іонні, сольові, сольватні й захищені фоформі, включаючи 12С, 13С, і 14С; О може знаходирми вказаних замісників. Наприклад, термін «картися в будь-якій ізотопній формі, включаючи 16О і бонова кислота «(-СООН) також включає аніонну 18 О; тощо. (карбоксилат) форму (-COO ), її сіль або сольват, Якщо не обговорено інакше, посилання на а також загальновідомі захищені форми. Подібним конкретну сполуку включає всі її ізомерні форми, образом, термін «аміногрупа» охоплює протоновключаючи (повністю або частково) рацемічні й вану форму (-N+HR1R2), сіль або сольват аміноінші їх суміші. Способи одержання (наприклад, групи, наприклад, гідрохлорид, а також загальноасиметричний синтез) і розділення (наприклад, відомі захищені форми аміногрупи. Подібним дрібна кристалізація й хроматографічні засоби) чином, термін «гідроксильна група» також включає вказаних ізомерних форм або відомі фахівцям, аніонну форму (-O-), її сіль або сольват, а також або легко одержувані шляхом пристосування назагальновідомі захищені форми гідроксильної груведених у даному описі способів або відомих спопи. собів, відомим чином. Ізомери, солі, сольвати, захищені Форми й Якщо не обговорено інакше, посилання на проліки конкретну сполуку також включає іонні, сольові, Деякі сполуки можуть існувати в одній або бісольватні й захищені її форми, наприклад, обговольше конкретних геометричних, оптичних, енантірювані нижче. омерних, діастереомерних, епімерних, стереоізоМоже бути зручно або переважно одержувати, мерних, таутомерних, конформаційних або очищати та/або обробляти відповідну сіль вказаної аномерних формах, включаючи, але не обмежуюактивної сполуки, наприклад, фармацевтично причись цим, цис- і транс-форми; Е- і Z-форми; с-, t-, і йнятну сіль. Приклади фармацевтично прийнятних r-форми; ендо- і екзо-форми; R-, S-, і мезо-форми; солей обговорюються в Berge et al., 1977, D- і L-форми; d- і І-форми; (+) і (-) форми; кето-, "Pharmaceutically Acceptable Salts", J. Pharm. Sci., єнол- і єнолят-форми; син- і анти-форми; синкліVol. 66, pp. 1-19. нальні й антиклінальні форми; a- і b-форми; аксіаНаприклад, якщо сполука являє собою аніон льні й екваторіальні форми; форми «ванни», «кріабо містить функціональну групу, яка може бути сла», «твіст-», «конверту» і «напівкрісла»; і їх аніонною (наприклад, -СООН може являти собою комбінації, які тут і далі спільно називаються «ізоСОО-), то сіль може бути утворена підходящим мерами» (або «ізомерними формами»). катіоном. Приклади підходящих неорганічних катіПомітимо, що крім обговорюваних нижче тауонів без обмеження включають: іони лужних метатомерних форм, спеціально виключених із застолів, такі як Na+ і K+, лужноземельні катіони, такі як совуваного в даному описі терміну «ізомери», вони Са2+ і Мg2+, і інші катіони, такі як АІ3+. Приклади являють собою структурні ізомери (або ізомери підходящих органічних катіонів без обмеження положення) (тобто такі ізомери, які відрізняються включають: іон амонію (тобто, NH4+) і заміщені іони порядком сполуки атомів, а не розташуванням амонію (наприклад, NH3R+, NH2R2+, NHR3+, NR4+). атомів у просторі). Наприклад, посилання на метоПрикладами деяких підходящих заміщених іонів ксигрупу -ОСН3, не можна розглядати як посиланамонію є похідні: етиламіну, діетиламіну, дициклоня на її структурний ізомер, гідроксиметильну гругексиламіну, триетиламіну, бутиламіну, етилендіпу -СН2ОН. Подібним чином посилання на ортоаміну, етаноламіну, діетаноламіну, піперазину, хлорфеніл не можна розглядати як посилання на бензиламіну, фенілбензиламіну, холіну, меглуміну його структурний ізомер, мета-хлорфеніл. Однак, й трометаміну, а також амінокислот, таких як лізин посилання на клас структур цілком можуть вклюі аргінін. Прикладом четвертинного амонієвого іона чати структурно ізомерні форми, які попадають у є N(CH3)4+. вказаний клас (наприклад, С1-7 алкіл включає нЯкщо сполука є катіонною або містить функціпропіл і iзо-пропіл; бутил включає н-, ізо-, втор- і ональну групу, яка може являти собою катіон (натрет-бутил; метоксифеніл включає орто-, мета- і приклад, -NH2 може являти собою -NH3+), то сіль пара-метоксифеніл). може бути утворена підходящим аніоном. ПриклаОписане вище виключення не стосується тауди підходящих неорганічних аніонів без обмежентомерних форм, наприклад, кето-, єнол- і єнолятня включають: похідні наступних неорганічних кисформам, як наприклад, наступні таутомерні пари: лот: соляної, бромоводневої, йодоводневої, кето/єнол (зображені нижче), імін/єнамін, сірчаної, сірчистої, азотної, азотистої, фосфорної амід/іміновий спирт, амідин/амідин, нітрозо/оксим, й фосфористої. Приклади підходящих органічних тіокетон/єнтіол, N-нітрозо/гідроксіазо й нітро/ацианіонів без обмеження включають: похідні наступнітро. них органічних кислот: оцтової, пропіонової, янтарної, гліколевої, стеаринової, пальмітинової, молочної, яблучної, памової, винної, лимонної, 17 88329 18 глюконової, аскорбінової, малеїнової, гідроксиманітровератрилоксіаміду (-NH-Nvoc), у вигляді 2леїнової, фенілоцтової, глутамінової, аспарагінотриметилсилитетилоксіаміду (-NH-Теос), у вигляді вої, бензойної, коричної, піровиноградної, саліци2,2,2-трихлоретилоксіаміду (-NH-Тrос), у вигляді лової, сульфанілової, 2-ацетоксибензойної, алілоксіаміду (-NH-Alloc), у вигляді 2(фумарової, фенолсульфонової, толуолсульфонофенілсульфоніл)етилоксіаміду (-NH-Psec); або, у вої, метансульфонової, етансульфонової, етандипідходящих випадках, у вигляді N-оксиду (>NO$). сульфонової, щавлевої, пантотенової, ізетимоноНаприклад, група карбонової кислоти може вої, валеріанової, лактобіонової і глюконової. бути захищена у вигляді складного ефіру, наприПриклади підходящих полімерних аніонів без обклад: у вигляді С1-7 алкілового складного ефіру меження включають: похідні наступних полімерних (наприклад, метиловий складний ефір, mкислот: дубильної кислоти, карбоксиметилцелюлобутиловий складний ефір); С1-7 галоалкілового зи. складного ефіру (наприклад, С1-7 тригалоалкіловий Може бути зручно або переважно одержувати, складний ефір); триС1-7 алкілсиліл-С1-7 алкілового очищати та/або обробляти відповідний сольват складного ефіру; або С5-20 арил-С1-7 алкілового вказаної активної сполуки. Термін «сольват», при складного ефіру (наприклад, бензиловий складний використанні в даному описі в загальноприйнятоефір, нітробензиловий складний ефір); або у виму розумінні, стосується комплексу розчиненої гляді аміду, наприклад, у вигляді метиламіду. речовини (наприклад, активної сполуки, солі актиНаприклад, тіольна група може бути захищена вної сполуки) і розчинника. Якщо розчинник являє у вигляді тіоефіру (-SR), наприклад, у вигляді: бенсобою воду, сольват легко можна називати гідразилового тіоефіру, ацетамідометилового тіоефіру том, наприклад, моногідрат, дигідрат, тригідрат і (-S-CH2NHC(=O)CH3). т.д. Може бути легко або переважно одержувати, Може бути зручно або переважно одержувати, очищати та/або обробляти активну сполуку у фоочищати та/або обробляти вказану активну сполурмі проліки. Термін «проліки», який використовуку в хімічно захищеній формі. Термін «хімічно зається у даному описі, стосується сполуки, яка, підхищена форма», при використанні в даному описі, даючись метаболізму (наприклад, in vivo), дає стосується сполуки, у якій одна або більше з реакбажану активну сполуку. Як правило, проліки є ційноздатних функціональних груп захищені від неактивними, або міні активними, ніж активна спонебажаних хімічних реакцій, тобто, знаходяться у лука, але можуть забезпечувати поліпшену обробформі захищеної або захисної групи (також відоку, введення або метаболічні властивості. мої як замаскована група або група, що маскує, Наприклад, деякі проліки являють собою або заблокована або група, що блокує). Завдяки складні ефіри вказаної активної сполуки (напризахисту реакційноздатної функціональної групи клад, фізіологічно прийнятний метаболічно лабіможна проводити реакції, які задіюють інші незальний складний ефір). У процесі метаболізму хищені реакційноздатні функціональні групи, не складноефірна група (-C(=O)OR) розщеплюється, роблячи впливу на захищену групу; захисні групи з утворенням активного ліки. Такі складні ефіри можна видаляти, звичайно на наступній стадії, не можуть бути утворені шляхом етерифікації, наприроблячи істотного впливу на частину молекули, що клад, будь-якої з карбоксильних груп (-С(=О)ОН) у залишилася. [Див., наприклад, Protective Groups in вихідній сполуці, при необхідності, з попереднім Organic Synthesis (Т. Green and P. Wuts, Wiley, захистом інших реакційноздатних груп у вихідній 1999)]. сполуці, а потім зняттям захисту, якщо потрібно. Наприклад, гідроксильна група може бути заПриклади таких метаболічно лабільних складних хищена у вигляді простого ефіру (-OR) або у виефірів включають такі, у яких R являє собою С1-7 алкіл (наприклад, -Me, -Et); С1-7 аміноалкіл (напригляді складного ефіру (-OC(=O)R), наприклад, mклад, аміноетил; 2-(N,N-діетиламіно)етил; 2-(4бутиловий простий ефір; бензиловий, бензгідриморфоліно)етил); і ацилокси-С1-7 алкіл (наприклад, ловий (дифенілметиловий) або тритиловий (триацилоксиметил, ацилоксіетил; наприклад півалілофенілметиловий) простий ефір; триметилсилілоксиметил; ацетоксиметил; 1-ацетоксіетил; 1-(1вий або m-бутилдиметилсиліловий простий ефір; метокси-1-метил)етил-карбоксилоксіетил; 1або складний ефір оцтової кислоти (-ОС(=О)СН3, (бензоїлокси)етил; ізопропоксиОАс). карбонілоксиметил; 1-ізопропоксиНаприклад, альдегідна або кетонна група мокарбонілоксіетил; циклогексил-карбонілоксиметил; же бути захищена у вигляді ацеталю або кеталю 1-циклогексил-карбонілоксіетил; циклогексилоксивідповідно, у яких карбонільна група (>С=О ) перекарбонілоксиметил; 1-циклогексилокситворена в діефір (>C(OR)2), шляхом реакції, накарбонілоксіетил; (4-тетрагідропіранілокси)приклад, з первинним спиртом. Альдегідна або карбонілоксиметил; 1-(4-тетрагідропіранілокси)кетонна група легко відновлюється шляхом гідрокарбонілоксіетил; (4-тетрагідропіраніл)лізу з використанням великого надлишку води в карбонілоксиметил; і 1-(4-тетрагідропіраніл)присутності кислоти. карбонілоксіетил). Наприклад, аміногрупа може бути захищена, Також, деякі проліки активуються ферментанаприклад, у вигляді аміду або уретану, наприми, з утворенням активної сполуки, або такої споклад, у вигляді: метиламіду (-NHCO-CH3); бензилуки, яка, піддаючись подальшій хімічній реакції, локсіаміду (-NHCO-OCH2C6H5, -NH-Cbz); у вигляді дає активну сполуку. Наприклад, проліки може m-бутоксіаміду (-NHCO-OC(CH3)3, -NH-Boc); 2являти собою похідне цукру або інший кон'югат біфеніл-2-пропоксіаміду (-NHCOглікозиду, або може являти собою похідне складOC(CH3)2C6H4C6H5, -ΝΗ-Bpoc), у вигляді 9ного ефіру амінокислоти. флуоренілметоксіаміду (-NH-Fmoc), у вигляді 6 19 88329 20 Селективне інгібування. 'Селективне інгібування' має на увазі інгібування одного ферменту в значно більшому ступені, ніж інгібування одного або більше інших ферментів. Вказану селективність вимірюють шляхом порівняння концентрації сполуки, необхідної для інгібування 50% активності (ІС50) одного ферменту з концентрацією тієї ж сполуки, необхідної для інгібування 50% активності (ІС50) іншого ферменту (см. нижче). Результат представляють у вигляді коефіцієнта. Якщо коефіцієнт вище 1, то досліджуу якій: вана сполука проявляє деяку селективність у своїй R1, R2 і Q такі ж, як визначено у формулі І; дії як інгібітора. n являє собою ціле число від 1 до 7, переважСполуки згідно із даним винаходом переважно но від 1 до 4 і найбільш переважно 1 або 2; проявляють селективність вище, ніж 3, 10, 20 або і 50 до ДНК-ПК у порівнянні з активністю у відноR8 вибраний з водню, можливо заміщеного С1шенні ФІ-3-кінази. алкілу, (переважно С1-4 алкілу, можливо, заміще7 Сполуки згідно із даним винаходом переважно ного), можливо заміщеного С5-20 арилу, (переважпроявляють селективність вище, ніж 5, 10, 50 або но С6 арилу, можливо, заміщеного), і ацилу (при100 до ДНК-ПК у порівнянні з активністю у відночому замісник ацилу переважно являє собою С1-4 шенні ATM. алкіл). Переважно, щоб значення ІС50, застосовувані Переваги для R6 і R7 можуть бути такими ж, як для визначення селективності, були визначені з і для R4 і R5, представлених вище. використанням способів, описаних у патенті WO У формулі І (і у формулі II), якщо R1 і R2 утво03/024949, зміст якого повністю включено сюди за рюють, разом з атомом азоту, до якого вони придопомогою посилання. єднані, гетероциклічне кільце, яке містить від 4 до Подальші переваги 8 атомів, воно може бути частиною С4-20 гетероциЯкщо Q являє собою -NH-C(=O)-, X переважно клічної групи, визначеної вище (за винятком мініявляє собою NR4R5. Далі переважно, щоб Υ являв мум 4 атомів у кільці), яка повиннамістити не месобою можливо заміщену С1-3 алкіленову групу, нше одного атома азоту в кільці. Переважно, щоб більш переважно, можливо заміщену С1-2 алкілеR1 і R2 утворювали, разом з атомом азоту, до яконову групу, і найбільш переважно, С1-2 алкіленову го вони приєднані, гетероциклічне кільце, яке місгрупу. тить 5, 6 або 7 атомів, більш переважно 6 атомів. Якщо Q являє собою -О- і X являє собою Окремі кільця, які містять один атом азоту NR4R5, то Υ переважно являє собою можливо завключають азетидин, піролідин (тетрагідропірол), міщену С1-3 алкіленову групу, більш переважно, піролін (наприклад, 3-піролін, 2,5-дигідропірол), можливо заміщену С1-2 алкіленову групу, і най2Н-пірол або 3H-пірол (ізопірол, ізоазол), піперибільш переважно, С1-2 алкіленову групу. дин, дигідропіридин, тетрагідропіридин, і азепін; У деяких варіантах реалізації R4 і R5 переваждва атоми азоту включають імідазолідин, піразоліно незалежно один від одного вибрані з Η і мождин (діазолідин), імідазолін, піразолін (дигідропіраливо заміщеного С1-7 алкілу, більш переважно з Η і зол), і піперазин; один атом азоту й один атом кисможливо заміщеного С1-4 алкілу, і найбільш переню включають тетрагідрооксазол, дигідрооксазол, важно з Η і можливо заміщеного С1-2 алкілу. Перететрагідроізооксазол, дигідроізооксазол, морфоважні можливі замісники без обмеження включалін, тетрагідрооксазин, дигідрооксазин, і оксазин; ють: гідрокси, метокси, -ΝΗ2, можливо заміщений один атом азоту й один атом сірки включають тіаС6-арил, і можливо заміщений С5-6гетероцикліл. золін, тіазолідин і тіоморфолін. В інших варіантах реалізації, R4 і R5 утворюПереважними кільцями є ті, які містять один ють, разом з атомом азоту, до якого вони приєдгетероатом додатково до атома азоту, і особливо нані, можливо заміщене азотвмісне гетероциклічпереважними гетероатомами є кисень і сірка. Тане кільце, яке містить від 4 до 8 атомів. ким чином, переважні групи включають морфолін, Переважно, гетероциклічне кільце містить від 5 до тіоморфолін, тіазолін. Переважні групи без інших 7 атомів у кільці. Приклади переважних груп вклюгетероатомів включають піролідин. чають морфолін, піперидин, піперазин, гомопіпеНайбільш переважними групами є морфолін і разин і тетрагідропірол. Вказані групи можуть бути тіоморфолін. заміщеними, і особливо переважною групою є піЯк відзначено вище, вказані гетероциклічні перазинова, можливо, заміщена, причому замісник групи самі можуть бути заміщеними; переважним переважно знаходиться при пара-атомі азоту. Пекласом замісників є С1-7 алкільна група. Якщо гереважні N-замісники включають можливо заміщетероциклічна група являє собою морфолін, заміний С1-4 алкіл, можливо заміщений С6 арил, і ацил щувана група або групи переважно являють собою (з С1-4 алкільною групою як замісник ацилу). метил або етил, і більш переважно метил. ОкреДеякі переважні сполуки згідно із даним винамий метильний замісник найбільш переважно знаходом можуть бути представлені формулою II: ходиться в положенні 2. Також як перераховані вище групи з одним кільцем, розглядають кільця з містками або місточковими зв'язками. От приклади таких типів кілець, у яких група містить атом азоту й атом кисню: 21 Вони називаються 8-окса-3-азабіцикло[3.2.1]окт-3-ил, 6-окса-3-азабіцикло[3.1.0]гекс-3-ил, 2-окса-5-азабіцикло[2.2.1]гепт-5-ил, і 7-окса-3-азабіцикло[4.1.0]гепт-3-ил, відповідно. Загальні способи синтезу Сполуки формули І, у яких Q являє собою -NHC(=O)-, можуть бути представлені формулою 1: 88329 22 Сполуки формули 1, у яких -Y-X являє собою С1-7 алкіл, можна синтезувати шляхом взаємодії сполуки формули 3 зі сполукою формули 4а: у присутності органічної основи, наприклад, триетиламіну. Сполуки формули 3 можна синтезувати шляхом відновлення сполуки формули 5: з використанням підходящого відновлюючого агента, наприклад, цинку в оцтовій кислоті. Сполуки формули 5 можна синтезувати шляхом сполучення за Сузукі сполук формули 6 і 7: Вказані сполуки, у випадку якщо -Y-X не є С1-7 алкілом, можуть бути отримані зі сполук формули 2: у якій L являє собою хлор або бром, шляхом взаємодії з відповідним аміном або тіолом. Вказана реакція може проводитися при кімнатній температурі або при нагріванні, якщо необхідно. Сполуки формули 2 можна синтезувати шляхом взаємодії сполуки формули 3: зі сполукою формули 4: у присутності органічної основи, наприклад, триетиламіну. Вказаний спосіб описаний у патенті WO 03/024949 (Методика синтезу 7с) - використаний складний ефір боронової кислоти можна замінити еквівалентними боровмісними групами. Методики для сполук формули 7 описані в патенті WO 03/024949 (Методика синтезу 6). Сполуки формули 1, у яких -Y-X являє собою С1-7 алкіл, також можна синтезувати шляхом сполучення за Сузукі сполук формули 8 і 9: 23 88329 24 Сполуки формули 8 можна синтезувати зі споку перетворює аміногрупу в сіль фтороборат діалуки формули 10: зонію, наприклад, з використанням HBF4 і бутилнітриту, яку потім гідролізують з використанням, наприклад, водного оксиду міді (І) - нітрату міді (II). Сполуки формули І, у яких Q являє собою -О- і X являє собою -C(=O)-NR6R7 можуть бути представлені у вигляді формули 15: шляхом взаємодії з відповідним ангідридом кислоти, наприклад, у піридині. Сполуки формули 9 можна синтезувати зі сполук формули 8 шляхом взаємодії з підходящої боровмісним реагентом. Сполуки формули І, у яких Q являє собою -О- і X вибраний з SR3 або NR4R5, можуть бути представлені у вигляді формули 11: у якій X" означає NR6R7. Вказані сполуки можна синтезувати зі сполук формули 16: у якій X' представляє SR3 або NR4R5. Вказані сполуки можна синтезувати зі сполук формули 12: шляхом взаємодії з відповідним аміном у присутності HBTU (О-бензотриазол-1-іл-Ν,Ν,Ν',Ν'тетраметилуронійгексафторфосфат) і НОВТ (1гідроксибензотриазол гідрат). Сполуки формули 16 можна одержати зі сполук формули 17: у якій L являє собою хлор або бром, шляхом взаємодії з відповідним аміном або тіолом. Вказану реакцію можна проводити при кімнатній температурі або при нагріванні, якщо необхідно. Сполуки формули 12 можна синтезувати шляхом взаємодії сполуки формули 13: шляхом взаємодії з гідроксидом натрію в метанолі. Сполуки формули 17 можна одержати зі сполук формули 10 шляхом взаємодії зі сполукою формули 18: зі сполукою формули 14: у присутності, наприклад, карбонату калію. Сполуки формули 13 можна синтезувати зі сполук формули 3 з використанням процедури діазотування-гідролізу. Вказана процедура спочат у присутності, наприклад, карбонату калію. Застосування сполук відповідно до винаходу Даний винахід представляє активні сполуки, а саме, активні 8-[1-заміщені-дибензотіофен-4-іл]-2морфолін-4-іл-хромен-4-они. Термін «активні», при використанні в даному описі, стосується таких сполук, які здатні інгібувати активність ДНК-ПК, і зокрема включає як сполуки із власною активністю (ліки), так і проліки вказаних сполук, причому самі вказані проліки можуть про 25 88329 26 являти малу або взагалі не проявляти власної трішньокапсульну, внутрішньоочноямкову, внутріактивності. шньоочеревинну, внутрішньотрахеальну, підшкірОдин спосіб аналізу, якому можна використону, внутрішньосуглобову, субарахноїдальну й вувати з метою виміряти інгібування ДНК-ПК, яке надчревну; шляхом імплантації депо, наприклад, здійснюється конкретною сполукою, описаний у підшкірно або внутрішньом'язнво. прикладах нижче. Суб'єкт може являти собою еукаріот, тварину, Даний винахід далі представляє спосіб інгібухребетну тварину, ссавця, гризуна (такого як, навання ДНК-ПК у клітині, який включає приведення приклад, морська свинка, хом'як, щур, миша), вказаної клітини в контакт із ефективною кількістю представника сімейства мишачих (наприклад, миактивної сполуки, переважно у формі фармацевша), собачих (наприклад, собака), котячих (напритично прийнятної композиції. Вказаний спосіб моклад, кішка), кінських (наприклад, кінь), приматів, жна застосовувати in vitro або in vivo. мавпоподібних (наприклад, мавпа або людинопоНаприклад, зразок клітин (наприклад, з пухлидібна мавпа), мавп (наприклад, ігрунка, павіан), ни) можна виростити in vitro і привести в контакт із людиноподібних мавп (наприклад, горила, шимвказаними клітинами активну сполуку разом з агепанзе, орангутанг, гібон), або людини. нтами, які мають відому лікувальну дію, при цьому Композиції буде спостерігатися поліпшення лікувального Незважаючи на те, що можливо вводити актиефекту вказаної сполуки на вказані клітини. вну сполуку саму по собі, переважно представити Даний винахід далі забезпечує активні сполуїї у вигляді фармацевтичної композиції (наприки, які інгібують активність ДНК-ПК, а також спосоклад, складу), що містить принаймні одну активну би інгібування активності ДНК-ПК, який включають сполуку, як визначено вище, разом з одним або приведення клітини в контакт із ефективною кільбільше фармацевтично прийнятним носієм, допокістю вказаної активної сполуки, як in vitro, так і in міжною речовиною, наповнювачем, розріджуваvivo. чем, буфером, стабілізатором, консервантом, Крім цього, даний винахід забезпечує активні змащувальною речовиною або іншою речовиною, сполуки для використання в способі лікування ордобре відомою фахівцям у даній галузі й, можлиганізму тварини або людини. Вказаний спосіб мово, іншим терапевтичним або профілактичним же включати призначення вказаному суб'єктові агентом. терапевтично ефективної кількості активної сполуТаким чином, даний винахід далі представляє ки, переважно у формі фармацевтичної композифармацевтичні композиції, як описано вище, і споції. соби приготування фармацевтичних композицій, Термін «лікування», при використанні в даноякі включають змішування принаймні однієї активму описі в контексті лікування станів, стосується, ної сполуки, як визначено вище, з одним або більзагалом, лікування й терапії, як тварини так і люше з фармацевтично прийнятним носієм, розрідини (наприклад у ветеринарних застосуваннях), джувачем, буфером, допоміжним речовиною, при якій одержують якийсь бажаний терапевтичстабілізатором або іншою речовиною, як описано в ний ефект, наприклад, уповільнення розвитку стаданій заявці. ну, зменшення швидкості розвитку захворювання, Термін "фармацевтично прийнятний", який визупинку швидкості розвитку захворювання, поліпкористовується у даному описі, стосується сполук, шення стану й вилікування захворювання. Також у матеріалів, композицій і/або дозувальних форм, які даний термін включене лікування як міра профілаз медичної точки зору придатні для використання в ктики (тобто попередження захворювання). контакті із тканинами суб'єкта, (наприклад, людиТермін «терапевтично ефективна кількість», ни), без надмірної токсичності, подразнення, алерпри використанні в даному описі, стосується кільгічної реакції, або інших проблем або ускладнень, кості активної сполуки або речовини, композиції відповідно до розумного співвідношення користі й або дозування, що містить активну сполуку, яка ризику. Усякий носій, наповнювач і т.д. повинен ефективна для одержання бажаного терапевтичтакож бути "прийнятним" у тому розумінні, щоб ного ефекту, відповідно до розумного співвіднобути сумісним з іншими компонентами композиції. шення користі й ризику. Підходящі носії, наповнювачі й т.д. можна Призначення знайти в стандартних фармацевтичних прописах, Активну сполуку або фармацевтичну композинаприклад, Remington's Pharmaceutical Sciences. цію, яка містить активну сполуку, можна вводити 18th edition, Mack Publishing Company, Easton, Pa., суб'єктові будь-яким загальновідомим шляхом 1990. введення, як системно/периферично, так і в місце Композиції легко можуть бути представлені у бажаної дії, без обмеження включаючи, введення: формі одиничного дозування, і можуть бути пригоперорально (наприклад, шляхом проковтування); товлені будь-якими способами, добре відомими у місцево (включаючи, наприклад, трансдермально, фармакології. Вказані способи включають стадію інтраназально, внутрішньоочно, трансбукально й зв'язування активної сполуки з носієм, який скласублінгвально); легенево (наприклад, шляхом індається з одного або більше допоміжних компонегаляційної або інсуфляційної терапії, з викориснтів. У цілому, композиції готують шляхом однорітанням, наприклад, аерозолю, наприклад, через дного й ретельного зв'язування активної сполуки з рот або ніс); ректально; вагінально; парентеральрідкими носіями або ретельно здрібненими тверно, наприклад, шляхом ін'єкції, включаючи підшкідими носіями, або з ними обома, і потім при необрну, внутрішньошкірну, внутрішньом'язову, внутхідності, додання продукту форми. рішньовенну, внутрішньоартеріальну, Композиції можуть існувати у формі рідин, внутрішньосерцеву, інтратекальну, спінальну, внурозчинів, суспензій, емульсій, еліксирів, сиропів, 27 88329 28 таблеток, льодяників, гранул, порошків, капсул, бік; і полоскання, що містять активну сполуку в облаток, пігулок, ампул, супозиторіїв, песаріїв, підходящому рідкому носії. мазей, гелів, паст, кремів, спреїв, туманів, димів, Композиції, які підходять для місцевого внутлосьйонів, масел, кульок, електуаріїв, або аерозорішньоочного введення також включають очні кралів. плі, у яких активна речовина розчинена або суКомпозиції, які підходять для перорального спендована в підходящому носії, особливо у введення (наприклад, шляхом проковтування) моводному розчиннику активної сполуки. жуть бути представлені у вигляді окремих одиКомпозиції, придатні для назального введенниць, таких як капсули, облатки або таблетки, коня, якщо носій являє собою тверду речовину, жна з яких містить заздалегідь визначену кількість включають великий порошок, що має розмір часактивної сполуки; у вигляді порошку або гранул; у тинок, наприклад, у межах від близько 20 до бливигляді розчину або суспензії у водній або неводзько 500 мікронів, який вводять при диханні, тобто, ній рідині; у вигляді рідкої емульсії типу масло-ушляхом швидкого вдихання через носовий хід з воді або рідкій емульсії типу воді-у-маслі; у вигляді контейнера з порошком, який утримується близько кульки; у вигляді електуарію; або у вигляді пасти. до носа. Підходящими композиціями, у яких носій Таблетка може бути виготовлена загальновіявляє собою рідину для введення, є, наприклад, домими методами, наприклад, пресуванням або назальний спрей, краплі в ніс, або аерозоль для відливанням, можливо, з одним або більше доповведення за допомогою небулайзера, включаючи міжними компонентами. Пресовані таблетки моводні або масляні розчини активної речовини. жуть бути виготовлені шляхом пресування в підКомпозиції, придатні для введення за допомоходящому апарату активної сполуки в сипкій гою інгаляцій, включають такі, які представлені у формі, такій як порошок або гранули, можливо, вигляді аерозольного спрею в упаковці під тиском, змішаним з одним або більше сполучних (наприз використанням підходящого пропеленту, такого клад, повідон, желатин, гуміарабік, сорбіт, трагаяк дихлордифторметан, трихлорфторметан, дихкант, гідроксипропілметилцелюлоза) наповнювачів лортатрафторетан, діоксид вуглецю, або інші підабо розріджувачів (наприклад, лактоза, мікрокрисходящі гази. талічна целюлоза, кислий фосфат кальцію); змаКомпозиції, придатні для місцевого введення щувальних речовин (наприклад, стеарат магнію, через шкіру, включають мазі, креми й емульсії. тальк, двоокис кремнію); дезінтегруючих агентів Якщо композиція являє собою мазь, активну спо(наприклад, натрієва сіль гліколяту крохмалю, кролуку можна за бажанням застосовувати або з пасповідон, кроскарбоксиметилцелюлоза натрію); рафіновою основою мазі, або з основою мазі, що поверхнево-активних або диспергуючих або змозмішується з водою, мазі. Як варіант, активна спочувальних агентів (наприклад, лаурилсульфат лука може бути приготовлена у вигляді крему з натрію); і консервантів (наприклад, метил-посновою крему типу масло-у-воді. За бажанням, гідроксибензоат, пропіл-п-гідроксибензоат, сорбіводна фаза крему може включати, наприклад, як нова кислота). Відлиті таблетки можуть бути вигомінімум близько 30% за вагою багатоатомного товлені шляхом відливання на підходящому апаспирту, тобто, спирту, який містить дві або більше рату суміші порошкоподібної сполуки, зволоженої гідроксильні групи, такого як пропіленгліколь, буінертним рідким розріджувачем. Таблетки можуть, тан-1,3-діол, маніт, сорбіт, гліцерин, поліетиленгліможливо, бути покриті оболонкою або мати бороколь і їх суміші. Місцеві композиції можуть за базенку, і можуть бути розроблені таким чином, щоб жанням включати сполуку, яка поліпшує забезпечити повільне або контрольоване вивільвсмоктування або проникнення активної сполуки нення активної сполуки, для чого використовують, через шкіру або інші ділянки впливу. Приклади наприклад, гідроксипропілметилцелюлозу в різних таких речовин, які поліпшують проникнення через співвідношеннях, щоб забезпечити бажаний прошкіру, включають диметилсульфоксид і споріднені філь вивільнення. Таблетки за бажанням можна до нього аналоги. покрити кишковорозчинним покриттям, щоб забезУ випадку, якщо композиція отримана у вигляпечити вивільнення не в шлунку, а в інших відділах ді емульсії для місцевого застосування, масляна травного тракту. фаза може, можливо, містити тільки емульгатор Композиції, придатні для місцевого введення, (інакше відомий як емульгувальний агент), або (наприклад, трансдермального, інтраназального, може містити суміш принаймні одного емульгатора внутрішньоочного, трансбукального або сублінгз жиром або маслом, або з жиром і маслом разом. вального) можуть бути виготовлені у вигляді мазі, Переважно, разом з гідрофільним емульгатором крему, суспензії, лосьйону, порошку, розчину, пасдо складу входить і ліпофільний емульгатор, який ти, гелю, спрею, аерозолю або масла. Як варіант, діє як стабілізатор. Також переважно включити до композиція може являти собою пластир або перескладу, як жир, так і масло. Емульгатор(и) разом в'язний матеріал, такий як бинт або лейкопластир, або без стабілізатора(ів), утворюють так званий просочений активними сполуками й, можливо, одемульгуючий віск, а вказаний віск разом з маслом ним або більше носіями або розріджувачами. і/або жиром утворює так звану емульгуючу основу Композиції, які підходять для місцевого ввемазі, що створює масляну дисперговану фазу в дення через рот, включають льодяники, які містять кремоподібних композиціях. активну сполуку в ароматизованій основі, звичайПідходящі емульгатори й стабілізатори емульно сахарозі й гуміарабіку або трагаканті; пастилки, сій включають Твін 60, Спан 80, цетостеариловий які містять активну сполуку в інертній основі, такій спирт, міристиловий спирт, гліцерилмоностеарат і як желатин або гліцерин, або сахароза й гуміаралаурилсульфат натрію. Вибір підходящих масел або жирів для композиції заснований на одержанні 29 88329 30 вну сполуку до компонентів крові або до одного бажаних косметичних властивостей, тому що розабо більше органів. чинність активної сполуки в більшості масел, що Дозування підходять для використання у фармацевтичних Слід взяти до уваги, що підходящі дозування емульсійних композиціях може бути дуже низкою. активних сполук і композицій, що містять активні Тому крем повинен бути переважно нежирним, сполуки, можуть змінюватися від пацієнта до паціякий не забруднює і який легко змивається продуєнта. Визначення оптимального дозування може, ктом підходящої консистенції, щоб уникнути протізагалом, включати зрівноважування рівня терапекання з тюбиків або інших контейнерів. Можна вивтичної користі щодо якого-небудь ризику або некористовувати одно- або двоосновні алкільні безпечних побічних ефектів лікування згідно із складні ефіри, із прямою або розгалуженим ланданим винаходом. Вибраний рівень дозування цюгом, такі як діізоадипінат, ізоцетилстеарат, проможе залежати від багатьох факторів, включаючи, піленгліколевий діефір жирних кислот кокосової але не обмежуючись цим, активність конкретної олії, ізопропілмиристат, децилолеат, ізопропілпасполуки, спосіб введення, час введення, швидкість льмітат, бутилстеарат, 2-етилгексилпальмітат або виведення сполуки, тривалість лікування, інші ліки, суміш складних ефірів з розгалуженим ланцюгом, сполуки та/або речовини, які використовуються відому як Crodamol CAP, причому три останні спільно, а також вік, стать, вагу, стан, загальне складних ефіри є переважними. Їх можна викорисздоров'я, і попередню історію хвороби пацієнта. товувати окремо або в сполученні, залежно від Кількість сполуки й шлях введення можуть, в останеобхідних властивостей. точному підсумку, бути залишені на розсуд тераЯк варіант, можна використовувати ліпіди з певта, хоча в загальному дозування повинна бути високою температурою плавлення, такі як білий такою, щоб домогтися такої місцевої концентрації вазелін і/або вазелінове масло, або інші мінеральв ділянці впливу, що дає бажаний ефект, не виклині масла. каючи істотних шкідливих або небезпечних побічКомпозиції, які підходять для ректального ввених ефектів. дення можуть являти собою супозиторій з підхоВведення in vivo можна здійснювати однією дящою основою, що містить, наприклад, олію кадозою, постійно або періодично (наприклад, окрекао або саліцилат. мими дозами через відповідні інтервали) протягом Композиції, які підходять для вагінального курсу лікування. Способи визначення найбільш введення можуть являти собою песарії, тампони, ефективних способів і дозування введення добре креми, гелі, пасти, піни або спреї, що містять, крім відомі фахівцям і можуть змінюватися залежно від активної сполуки, такі носії, які відомі в даній галузі композиції, яку використовують для лікування, як підходящі. мети лікування, цільових клітин, що підлягають Композиції, які підходять для парентерального лікуванню й суб'єкта, який підлягає лікуванню. введення (наприклад, шляхом ін'єкції, включаючи Одиничне або багаторазове введення можна прошкірну, підшкірну, внутрішньом'язову, внутрішньоводити відповідно до рівня дози й схеми, які вибивенну й внутрішньошкірну), включають водні й рає лікуючий терапевт. неводні ізотонічні, апірогенні, стерильні розчини У цілому, підходяща доза активної сполуки для ін'єкцій, які можуть містити антиоксиданти, буфери, консерванти, стабілізатори, бактеріостазнаходиться в межах від близько 100mΓ до близько тичні речовини, і розчинені речовини, які роблять 250мг на кілограм ваги тіла суб'єкта в день. Якщо композицію ізотонічною по відношенню до передактивною сполукою є сіль, складний ефір, проліки бачуваного реципієнта; а також водні й неводні тощо, кількість, яку вводять, обчислюють на основі стерильні суспензії, які можуть включати суспенвихідної сполуки, і таким чином, фактичну вагу, яку дуючі агенти й загущуючі агенти, а також ліпосоми слід використовувати, пропорційно збільшують. або інші системи мікрочастинок, розроблені для Приклади доставки активної сполуки до компонентів крові Наведені далі приклади призначені винятково або до одному або більше органам. Приклади піддля того, щоб проілюструвати даний винахід, і не ходящих ізотонічних носіїв для використання в призначені обмежувати сферу охоплення даного вказаних композиціях включають хлорид натрію винаходу, описану в даній заявці. для ін'єкцій, розчин Рінгера або лактований розчин Скорочення Рінгера для ін'єкцій. Як правило, концентрація акДля зручності, багато хімічних залишків предтивної сполуки в розчині становить від приблизно ставлені з використанням загальновідомих скоро1нг/мл до приблизно 10mг/мл, наприклад, від причень, включаючи, але не обмежуючись цим, метил (Me), етил (Et), н-пропіл (nРr), iзо-пропіл (іРr), нблизно 10нг/мл до приблизно 1mг/мл. Композиції бутил (nBu), трет-бутил (tBu), н-гексил (nНех), цикможуть знаходитися в запечатаних контейнерах на логексил (сНех), феніл (Ph), біфеніл (biPh), бензил одну дозу або багато доз, наприклад, ампулах або (Вn), нафтил (naph), метокси (МеО), етокси (ЕtO), флаконах, і можуть зберігатися у висушеному суббензоїл (Bz), і ацетил (Ас). лімацією (ліофілізованому) вигляді, так що безпоДля зручності, багато хімічних сполук предстасередньо перед використанням потрібно тільки влені з використанням загальновідомих скорочень, додати стерильний рідкий носій, наприклад, воду включаючи, але не обмежуючись цим, метанол для ін'єкцій. Ін'єкційні розчини й суспензії, призна(МеОН), етанол (EtOH), ізо-пропанол (і-РrOН), мечені для негайного використання, можна готувати тилетилкетон (МЕК), простий ефір або діетиловий з порошків, гранул і таблеток. Композиції можуть ефір (Et2O), оцтова кислота (АсОН), дихлорметан існувати у формі ліпосом або інших мікрочастин(метиленхлорид, ДХМ), трифтороцтова кислота кових систем, які розроблені, щоб доставити акти 31 88329 32 (ТФОК), диметилформамід (ДМФА), тетрагідрофуран (ТГФ), і диметилсульфоксид (ДМСО). Загальні експериментальні способи Тонкошарову хроматографію проводили з використанням Merck Kieselgel 60 F254 пластин на скляній основі. Пластини проявляли з використанням УФ лампи (254нм). Для швидкісної хроматографії використовували силікагель 60 (розмір частинок 40-63m), що постачається E.M.Merck. 1H ЯМР спектри знімали на частоті 300МГц на приладі Bruker DPX-300. Хімічні зсуви встановлювали відносно тетраметилсилану. Очищення й ідентифікація бібліотечних зразків Зразки очищали на пристроях Gilson LC. Рухома фаза А - 0,1% водний розчин ТФОК, Рухома фаза В - ацетонітрил, швидкість потоку 6мл/хв., градієнт - звичайно починали з 90% А/10% В проДибензотіофен-4-ол (і) тягом 1 хвилини, підвищували до 97% В через 15 До охолодженого (-78°С) розчину дибензотіохвилин, витримували на цьому рівні протягом 2 фену (20,8г, 113ммоль) у безводному ТГФ (400мл) хвилин, потім поверталися до початкових умов. додають трет-бутиллітій (1,7М у пентані; 100мл, 170ммоль). Реакційну суміш перемішують при Колонка: Jones Chromatography Genesis 4m C18, 78°С протягом 1 години, потім залишають зігрітися 10мм´250мм. Виявлення піків ґрунтувалося на УФдо кімнатній температурі й перемішують у такий детектуванні на довжині хвилі 254нм. спосіб протягом 16 годин. Потім суміш охолоджуМас-спектри знімали на приладі Finnegan LCQ ють до 0°С і додають бромід етилмагнію (1М в у режимі позитивних іонів. Рухома фаза А - 0,1% ТГФ; 170мл, 170ммоль) до янтарної реакційної водний розчин мурашиної кислоти, Рухома фаза В суміші повільним потоком через порожнисту голку. - ацетонітрил, швидкість потоку 2мл/хв., градієнт Реакційну суміш знову залишають зігрітися до кімпочинали з 95% А/5% В протягом 1 хвилини, піднатної температури, після чого перемішують у тавищували до 98% В через 5 хвилин, витримували кий спосіб протягом 30 хвилин. Приєднують до на цьому рівні протягом 3 хвилин, потім повертареакційної посудини зворотний холодильник перед лися до початкових умов. Колонка: Phenomenex 5m тим, як барботувати кисень через розчин протягом Luna C18, 4,6мм´50мм. Уф-детектування на дов40 хвилин. Потім суміш перемішують ще протягом жині хвилі 254нм, PDA (аналіз розподілу імпульсів) 1 години, після чого обережно виливають у колодетектування - сканування від 210 до 600нм. тий лід і підкисляють до рН 3 концентрованою НСІ. Мас-спектри інших сполук Потім суміш екстрагують із використання етилацеМас-спектри не бібліотечних сполук і проміжтату (3´80мл). Потім органічні екстракти обробляних речовин знімали на приладі Micromass ZQ (з ють 3М розчином гідроксиду натрію до досягнення однією квадрупольною лінзою, що діє в режимі рН 10. Основний водний шар відокремлюють, підіонізації при електророзпиленні), з використанням кисляють до рН 3 2М НСІ, при цьому випадає в помпи для ВЕРХ Waters 600 HPLC і автодозатора осад масляниста тверда речовина. Її розчиняють у 2700 Autosampler. діетиловому ефірі (150мл), висушують над MgSO4, Рухома фаза А - 0,1% мурашина кислота у вофільтрують і концентрують у вакуумі, а потім переді, Рухома фаза В - 0,1% мурашина кислота в ацекристалізовують з етанолу:води (1:1) (250мл) щоб тонітрилі, швидкість потоку 2,0мл/хв., градієнт: від одержати забарвлену в темно-жовтий колір тверду 5% B до 95% В за 3 хвилини, витримували на цьоречовину, яка відповідає цільовій сполуці (21,6г, му рівні протягом 3 хвилин. Колонка: різні, але 96%) і не потребує подальшого очищення, m/z завжди С18 50мм´4,6мм (Currently Genesis 4m, (PX-MC, ESP), RT=3,64хв, (М+Н)=201,1 Jones Chromatogrpahy), PDA детектування: Waters 4-метокси-дибензотіофен (іі) 996, область сканування 210-400нм. Синтез клюДо розчину дибензотіофен-4-олу (і) (14,2г, чових проміжних речовин 71,0ммоль) в ацетоні (500мл) додають порошко(а) морфолін-4-іл-8-(1'-нітродибензотіофен-4'подібний карбонат калію (14,72г, 106,5ммоль) і іл)хромен-4-он (viii) метилйодид (4,43мл, 71ммоль). Суміш нагрівають зі зворотним холодильником і перемішують у такий спосіб протягом 16 годин. Потім суміш охолоджують і фільтрують через пластину CeliteÔ. Отриманий фільтрат концентрують у вакуумі, щоб одержати маслянистий залишок, що розбавляють дихлорметаном (100мл) і промивають 1Μ NaOH і насиченим розчином солі. Органічний шар висушують над MgSO4, фільтрують і концентрують у вакуумі, щоб одержати забарвлену в темножовтий колір тверду речовину, яка відповідає цільовій сполуці й використовується без якогонебудь подальшого очищення (15,2г, 100 %) m/z (PX-MC, ESP), RT=4,22хв, (M+H)=215,1 33 88329 34 4-метокси-1-нітро-дибензотіофен (iiі) тім посудина вакуумують і продувають аргоном 4-метикси-дибензотіофен (іі) (4,3г, 20,0ммоль) три рази. Додають діоксан (20мл) і перемішують розчиняють у льодяній оцтовій кислоті (60мл) і реакційну суміш при 90°С впродовж 12 годин. Реадодають до вказаного розчину паруючу азотну кційну суміш розбавляють дихлорметаном (100мл) кислоту (3,37мл) по краплях, стежачи за тим, щоб і органічний шар послідовно промивають водою температура суміші не піднімалася вище 25°С. (3´30мл), розчином солі (1´30мл), висушують Жовту суспензію перемішують ще протягом 45 (Na2SO4) і випарюють розчинник у вакуумі, щоб хвилин, після чого обережно виливають у воду одержати нітроборонатовий складний ефір (vi), (200мл) і перемішують протягом 15 хвилин. Жовту який використовують без подальшого очищення. тверду речовину видаляють фільтруванням і реСуміш речовини vi (280мг, 0,79ммоль), хроменонтельно промивають більшою кількістю води, а по8-трифлату (vii) (298мг, 0,79ммоль), PdCI2(dppf) тім гексану. Отриманий у такий спосіб залишок (19,3мг, 0,024ммоль), і Cs2CO3 (770мг, 2,36ммоль) потім висушують у вакуумній печі, щоб одержати тричі продувають аргоном і додають ТГФ (20мл). цільову сполуку у вигляді жовтої твердої речовини, Реакційну суміш перемішують зі зворотним холояку використовують без якого-небудь подальшого дильником протягом 12 годин. Видаляють розчиночищення (5,19г, 97%) m/z (PX-MC, ESP), ники у вакуумі й розчиняють залишок у дихлормеRT=4,15хв, (М+Н)=260,1 тані (100мл), промивають водою (2´30мл), 1-нітро-дибензотіофен-4-ол (iv) розчином солі (1´30мл), висушують (Na2SO4) і виТвердий гідрохлорид піридину (1кг, 8,7моль) парюють розчинник у вакуумі, щоб одержати цідодають до 4-метокси-1-нітро-дибензотіофену (ііі) льовий продукт (viii). Чорновий продукт очищають (35,44г, 187ммоль) і реакційну суміш добре переза допомогою колонкової хроматографії з викорисмішують перед нагріванням до 165°С при безпетанням 2-5% метанолу в ДХМ. рервному перемішуванні. Суміш підтримують у т. пл.=179°С; Rf=0,28 (ДХМ/МеОН 95/5); РХвказаному стані протягом 8 годин, охолоджують, МС ES+ 460. ІЧ (плівка): 1681, 1619, 1559, 1404см1 розбавляють водою (500мл) і екстрагують дихло; УФ:lmах=240нм. 1Н ЯМР (300МГц, CDCI3): d 8,27 рметаном (3´200мл). 3Μ розчин гідроксиду натрію (дд, J=7,8; 1,6Гц, 1Н); 8,09 (д, J=7,5Гц, 1Н); 7,83 (д, додають до органічного екстракту доти, поки з J=7,9Гц, 1Н); 7,78 (д, J=7,1Гц, 1Н); 7,66 (дд, J=7,5; розчину не випаде темна тверда речовина. Фільт1,6Гц, 1Н); 7,42-7,52 (м, 4Н); 5,45 (з, 1Н); 3,40-3,47 рат відокремлюють і підкисляють рідина до рН 1 (м, 4Н); 3,00-3,03 (м, 4Н). 13С ЯМР (75МГц, CDCI3): концентрованої НСІ. Отриману яскраво-жовту тве5176,9; 162,5; 150,8; 151,7; 143,4; 140,5; 135,9; рду речовину, яка утворилася при підкисленні, 133,5; 131,6; 129,0; 127,5; 127,4; 127,0; 125,8; відокремлюють шляхом фільтрування, промива125,6; 125,4; 124,1; 123,1; 120,8; 87,6; 66,0; 44,9. ють водою й висушують, щоб одержати цільову (б) 8-(1'-амінодибензотіофен-4'-іл)-2-морфолінсполуку, яка є достатньо чистою, щоб бути вико4-іл-хромен-4-он (iх) ристаною без якого-небудь подальшого очищення (35,44г, 77 %) m/z (PX-MC, ESP), RT=3,69хв, (М+Н)=246,2, (М-Н)=244,1 1-нітро-дибензотіофен-1-іловий ефір трифторметансульфонової кислоти (ν) До охолодженого (-5°С) суспензії 1-нітродибензотіофен-4-олу (iv) (5,37м, 22,0ммоль) у дихлорметані (75мл) додають триетиламін (9,20мл, 66,00ммоль), при цьому суспензія повністю розчиняється. Потім до вказаної суміші додають ангідрид трифторметансульфонової кислоти (5,85мл, До розчину похідного нітродибензотіофену 33,00ммоль) по краплях через шприц. Потім суміш (viii) (810мг, 1,77ммоль) в оцтовій кислоті (30мл) перемішують при вказаній температурі протягом 1 додають порошок цинку (1,16г, 17,70ммоль) і пегодини, після чого виливають у колотий лід. Залиремішують реакційну суміш при кімнатній темпешають доти, поки лід не розтане, і екстрагують ратурі протягом ночі. Реакційну суміш відфільтросуміш із використанням СН2СІ2 (3´20мл). Об'єднавують через celite, промивають послідовно ні органічні шари висушують (MgSO4) фільтрують і метанолом (4´50мл) і ДХМ (2´50мл) і випарюють концентрують у вакуумі, щоб одержати м'яке янтаоб'єднані фільтрати при зниженому тиску. Тверду рне масло, яке елююють через шар силікагелю речовину, що залишилася, розмішують у воді (очищений СН2СІ2) щоб одержить цільову сполуку (100мл) і додають водний розчин аміаку (25мл). в досить чистій формі, щоб використовувати її без Отриману тверду речовину, яка випала в осад, якого-небудь подальшого очищення (8,30г, 99 %) збирають шляхом фільтрації й очищають за допоm/z (РХ-МС, ESP), RT=4,40хв, не іонізується. могою хроматографії на силікагелі, застосовуючи морфолін-4-іл-8-(1'нітродибензотіофен-4'як елюент 2-5% метанол у ДХМ. iл)хромен-4-он (viii) Rf=0,28 (ДХМ/МеОН 95/5); ІЧ (плівка): 3326, У чисту суху посудину поміщають 13211, 2962, 2902, 2851, 1729, 1615, 1555, 1Н ЯМР нітродибензотіофен-1-іловий ефір трифторметан(300МГц, CDCI3): 68,14-8,20 (м, 2Н); 7,74 (дд, сульфонової кислоти (ν) (250мг, 0,66ммоль), бісJ=7,7; 1,1Гц, 1Н); 7,67 (дд, J=7,4; 1,7Гц, 1Н); 7,34пінаколатодиборон (185мг, 0,73ммоль), ацетат 7,49 (м, 4Н); 7,22 (д, J=7,8Гц, 1Н); 6,82 (д, J=7,8Гц, калію (390мг, 3,98ммоль), PdCI2(dppf) (dppf=1,1'1Н); 5,48 (с, 1Н, =СН); 4,55 (уш. с, -NH, 2Н); 3,42біс(дифенілфосфіно)фероцен) (27мг, 0,033ммоль), 3,46 (м, 4Н); 3,03-3,06 (м, 4Н), 13С ЯМР (75МГц, і dppf (19мг, 0,033ммоль) в атмосфері аргону. По 35 88329 36 Водний розчин фільтрують, щоб виділити продукт CDCI3): d 177,6; 162,5; 151,7; 144,2; 141,6; 138,9; у вигляді коричневої твердої речовини, яку очи135,8; 134,1; 132,8; 129,1; 128,9; 126,0; 125,7; щають за допомогою колонкової хроматографії на 125,3; 125,1; 125,0; 123,8; 123,7; 123,1; 123,0; силікагелі з використанням 2-5% метанолу/ДХМ. 122,0; 113,1; 87,18; 66,4; 45,0, (e) 8-[1-(2-бром-етокси)-дибензотіофен-4-іл]-2(в) 2-хлор-N-[4-(2-морфолін-4-іл-4-оксо-4Нморфолін-4-іл-хромен-4-он (С) хромен-8-іл)-дибензотіофен-1-іл]-ацетамід (А) До розчину похідного амінодибензотіофену (іх, 1мл. екв.) у сухому ДМА (12мл) додають триетиламін (2,2мл. екв.) і хлорацетилхлорид (1,1мл. екв.), і перемішують реакційну суміш при кімнатній температурі протягом 4 годин. (г) 3-бром-N-[4-(2-морфолін-4-іл-4-оксо-4Нхромен-8-іл)-дибензотіофен-1-іл]-пропіонамід (В) До розчину похідного амінодибензотіофену (іх; 1мл. екв.) у сухому ДМА додають триетиламін (2,2мл. екв.) і 3-бромпропіонілхлорид (1,1мл. екв.), і перемішують реакційну суміш при кімнатній температурі протягом 4 годин. (д) 8-(1 -гідрокси-дибензотіофен-4-іл)-2морфолін-4-іл-хромен-4-он (х) Похідне амінодибензотіофену (іх) (1ммоль) суспендують в етанолі (40мл) і додають HBF4 (15ммоль) по краплях при кімнатній температурі. Після перемішування протягом 15 хвилин реакційна суміш перетворюється в прозорий розчин, який охолоджують до 0°С і додають m-бутилнітрит (2ммоль). Через 30 хвилин реакційну суміш розбавляють ефіром (80мл). Тверду речовину, яка випала в осад, відфільтровують, промивають ефіром (2´20мл) і висушують. Вказану тверду речовину додають до розчину нітрату міді (300ммоль) в 1л води, що містить закис міді (1ммоль), і перемішують протягом 1 години при кімнатній температурі. До розчину 1-гідроксидибензотіофену (x; 1мл. екв.) у сухому ДМФ (20мл) додають карбонат калію (1,1мл. екв.) і диброметан (1,1мл. екв.), і перемішують реакційну суміш при кімнатній температурі протягом 12 годин. (ж) [4-(2-морфолін-4-іл-4-оксо-4Н-хромен-8-іл)дибензотіофен-1-ілокси]-ацетат натрію (D) Гідроксильну сполуку (х) суспендують у сухому ДМФ, додають карбонат калію, потім метилбромацетат, і перемішують реакційну суміш при 60°С впродовж ночі. Після завершення реакції реакційну суміш виливають у воду й екстрагують етилацетатом. Органічний шар промивають водою, розчином солі, висушують і концентрують, щоб одержати метиловий ефір у вигляді жовтої твердої речовини. За здійсненням реакції спостерігають за допомогою ВЕРХ і РХ-МС. Складний ефір розчиняють у метанолі й додають водний розчин NaOH. Реакційну суміш перемішують при 60°С впродовж 1 години, після чого ВЕРХ і РХ-МС показали відсутність метилового ефіру. Реакційну суміш випарюють досуха у вакуумі, щоб одержати натрієву сіль (D). Приклад 1 Аліквоти (0,5мл) 2-хлор-N-[4-(2-морфолін-4-іл4-оксо-4Н-хромен-8-іл)-дибензотіофен-1-іл]ацетаміду (А) додають у кожний із флаконів, що 37 88329 38 містять різні аміни для синтезу. Потім реакційні мальним об'ємом метанолу, а потім очищають суміші перемішують паралельно при кімнатній отримані сполуки. температурі протягом 12 годин, розбавляють міні 39 88329 40 41 Типові аналітичні дані Сполука 1: 1Н ЯМР (300МГц, CDCI3): d 10,27 (1Н, с, -ΝΗ), 8,44 (1Η, м, Ar), 8,29 (1Н, д, J=7,85Гц, Ar), 8,04 (1Н, д, J=8,04Гц, Ar), 7,86 (2Н, м, Ar), 7,55 (4Н, м, Ar), 6,59 (1Н, с, =СН-), 4,01 (4Н, м, NCH2CH2-), 3,82 (2Н, с, -NCH2), 3,53 (4Н, м, NCH2CH2-), 3,26 (4Н, м, -NCH2CH2-), 3,18 (4Н, м, NCH2CH2-), Т.пл.: 165°С. Сполука 2: 1Н ЯМР (300МГц, CDCI3): d 10,80 (1Н, с, -ΝΗ), 8,26 (1Η, м, Ar), 8,19 (1Н, дд, J=1,6Гц, Ar), 7,70 (2Н, м, Ar), 7,48 (2Н, м, Ar), 7,38 (3H, м, Ar), 6,15 (1Н, с, =СН-), 4,10 (2Н, с, -NCH2), 3,42 (6Н, м, -NCH2CH2-), 3,09 (7Н, м, -NCH2CH2-), 1,95 (5Н, м, -CH2CH2), Т.пл.: 188°С. Сполука 17(oil): 1Н ЯМР (300МГц, CDCI3): d 10,15 (1Н, с, -ΝΗ), 8,22 (2Н, m, J=7,93Гц, Ar), 7,74 (2Н, m, J=7,64Гц, Ar), 7,58 (1Н, д, J=7,95Гц, Ar), 7,50 (1Н, д, J=7,67Гц, Ar), 7,36 (3H, м, Ar), 6,58 (1Н, с, =СН-), 3,53 (2Н, с, -NCH2), 3,45 (4Н, м, NCH2CH2-), 3,20 (6Н, м, -NCH2CH2-), 3,03 (2Н, м, NCH2), 2,91 (6Н, с, -NCH3), 2,56 (3H, с, -NCH3). Сполука 18: 1Н ЯМР (300МГц, CDCI3): d 10,26 (1Н, с, -ΝΗ), 8,32 (1Η, д, J=6,42Гц, Ar), 8,20, (1Н, д, J=6,36Гц, Ar), 7,90 (1Н, м, Ar), 7,74 (2Н, м, Ar), 7,47 (4Н, м, Ar), 6,40 (1Н, с, =СН-), 3,96 (2Н, м, NCH2), 3,77 (2Н, с, -ОСН2), 3,44 (4Н, м, -NCH2CH2), 3,27 (2Н, д, J=11,57Гц, -NCH2), 3,15 (4Н, с, NCH2CH2-), 2,50 (2Н, м, -NCH2), Т.пл.: 152°С. Сполука 27: 1Н ЯМР (300МГц, CDCI3): d 9,90 (1Н, с, -ΝΗ), 8,38 (1Н, м, Ar), 8,22 (3H, м, Ar), 7,77 (3H, м, Ar), 7,45 (4Н, м, Ar), 6,89 (2Н, м, Ar), 6,32 88329 42 (1Н, S, =СН-), 3,89 (2Н, bs, -NCH2), 3,51 (4Н, с, NCH2CH2-), 3,46 (4Н, м, -NCH2CH2-), 3,17 (4Н, м, NCH2CH2-), 3,03 (4Н, м, -NCH2CH2-), Т.пл.: 171°С. Приклад 2 Аліквоти (0,5мл) 3-бром-N-[4-(2-морфолін-4іл-4-оксо-4Н-хромен-8-іл)-дибензотіофен-1-іл]пропіонаміду (В) додають у кожний із флаконів, що містять різні аміни для синтезу. Потім реакційні суміші перемішують паралельно при кімнатній температурі протягом 12 годин, розбавляють мінімальним об'ємом метанолу, а потім очищають отримані сполуки. 43 88329 44 45 88329 46 47 88329 Типові аналітичні дані Сполука 48: 1Н ЯМР (300МГц, CDCI3): d 9,32 (1Н, с, -ΝΗ), 8,22 (2Η, м, Ar), 7,73 (2Н, м, Ar), 7,58 (1Н, д, J=7,82Гц, Ar), 7,40 (4Н, м, Ar), 6,12 (1Н, с, =СН-) 3,54 (4Н, м), 3,44 (4Н, м), 3,29 (2Н, м), 3,11 (6Н, м), 2,37 (уш. с), 1,76 (м). 48 Сполука 53: 1Н ЯМР (300МГц, CDCI3): d 9,19 (1h, с, -ΝΗ), 8,20 (2Н, м, Ar), 7,69 (2Н, м, Ar), 7,53 (1Н, м, Ar), 7,41 (1Н, м, Ar), 6,00 (1Н, с, =СН-), 4,16 (1Н, м), 3,68 (2Н, м), 3,42 (8Н, м), 3,06 (4Н, м), 2,62 (8Н, м), Т.пл.: 148°С. Приклад 3 Аліквоти (0,5мл) 8-[1-(2-бром-етокси)дибензотіофен-4-іл]-2-морфолін-4-іл-хромен-4ону (С) додають у кожний із флаконів, що містять різні аміни для синтезу. Потім реакційні суміші перемішують паралельно при кімнатній температурі протягом 12 годин, розбавляють мінімальним об'ємом метанолу, а потім очищають отримані сполуки. 49 Типові аналітичні дані Сполука 78: 1Н ЯМР (300МГц, CDCI3): d 8,84 (1Н, м, ArО, 8,28 (1Н, д, J=7,85Гц, Ar), 7,76 (2Н, м, Ar), 7,50 (3H, м, Ar), 7,35 (1Н, д, J=8,22Гц, Ar), 88329 50 7,11 (1Н, д, J=8,45Гц, Ar), 5,95 (1Н, с, =СН), 5,07 (2Н, д, J=9,50Гц, -ОСН2), 4,47 (1Н, д, -ОСН(СН3)), 3,96 (1Н, д, -СН(СН3)), 3,51 (8Н, м, -NCH2), 3,16 51 88329 52 (4Н, м, -NCH2), 1,22 (3H, д, J=6,20Гц, -СН3), 1,12 ОСН2), 3,54 (3H, м, -СН(СН3)2 & -NCH2), 3,45 (3H, д, J=6,24Гц, -СН3), Т.пл.: 240°С. (12Н, м, -NCH2), 3,17 (4Н, м, -NCH2), 1,32 (6Н, д, J=6,67Гц, (СН3)2СН-), Т.пл.: 158°С. Сполука 80: 1Н ЯМР (300МГц, CDCI3): d 8,73 Сполука 87: 1Н ЯМР (300МГц, CDCI3): d 8,57 (1Н, дд, J=5,12Гц, Ar), 8,01 (1Н, дд, J=7,85Гц, Ar), 7,81 (1Н, дд, J=7,54Гц, Ar), 7,73 (1Н, дд, J=7,42Гц, (1Н, м, Ar), 8,29 (1Н, д, J=7,85Гц, Ar), 7,82 (2Н, м, Ar), 7,51 (1Н, д, J=8,23 Гц, Ar), 7,42 (3H, м, Ar), Ar), 7,51 (4Н, м, Ar), 7,12 (1Н, д, J=8,23Гц, Ar), 7,19 (1Н, д, J=8,35Гц, Ar), 4,54 (2Н, м, -ОСН2), 6,59 (1Н, с, =СН), 4,85 (2Н, м, -ОСН2), 3,78 (2Н, м, 3,39 (8Н, т, J=4,64Гц, N-CH2), 3,34 (2Н, м, - N-NCH2), 3,54 (4Н, м, -ОСН2), 3,47 (4Н, м, -NCH2), CH2), 3,10 (8Н, т, J=4,81Гц, N-CH2), 2,81 (3H, с, 3,28 (4Н, м, -NCH2), 1,47 (6Н, т, J=7,38Гц, -СН3), N-СН3), Т.пл.: 100°С. Т.пл.: 147°С. Сполука 81: 1Н ЯМР (300МГц, CDCI3): d £8,66 Сполука 88: 1Н ЯМР (300МГц, CDCI3): d 8,68 (1Н, дд, J=9,39Гц, Ar), 7,99 (1Н, дд, J=6,19Гц, Ar), (1Н, м, Ar), 8,02 (1Н, дд, J=7,83Гц, Ar), 7,82 (1Н, м, 7,79 (1Н, дд, J=5,97Гц, Ar), 7,72 (1Н, дд, J=7,44Гц, Ar), 7,76 (1Н, дд, J=7,34Гц, Ar), 7,45 (1Н, д, Ar), 7,51 (1Н, д, J=7,46Гц, Ar), 7,38 (3H, м, Ar), J=7,52Гц, Ar), 7,40 (2Н, м, Ar), 7,25 (1Н, д, 7,22 (1Н, д, J=8,31Гц, Ar), 4,76 (2Н, т, J=5,58Гц, J=8,42Гц, Ar), 4,84 (2Н, м, -ОСН2), 3,92 (2Н, м, ОСН2), 3,79 (10Н, м, -NCH2 & -ОСН2), 3,58 (2Н, м, NCH2), 3,39 (8Н, м, -ОСН2), 3,11 (8Н, м, -NCH2), -NCH2), 3,38 (8Н, т, J=5,06Гц, -NCH2), 3,20 (1Н, с, 3,05 (6Н, с, (CH3)2N-), Т.пл.: 166°С. -NH), 3,09 (2Н, т, J=4,89Гц, -NCH2), Т.пл.: 70°С. Сполука 83: 1Н ЯМР (300МГц, CDCI3): d 8,55 (1Н, д, J=6,67Гц, Ar), 7,99 (1Н, дд, J=6,24Гц, Ar), 7,72 (2Н, м, Ar), 7,45 (4Н, м, Ar), 6,99 (1Н, д, J=8,27Гц, Ar), 6,39 (1Н, с, =СН), 4,58 (2Н, м, Приклад 4 Натрієву сіль [4-(2-морфол ін-4-іл-4-оксо-4Нхромен-8-іл)-дибензотіофен-1-ілокси]-ацетату (D) розчиняють у ДМФА й розділяють на 15 рівних порцій у реакційні пробірки, які містять відповідні аміни. У кожну пробірку додають розчин HBTU і НОВТ у сухому ДМФА, і перемішують реакційну суміш при кімнатній температурі протягом ночі. Потім отримані продукти очищають. 53 88329 Приклад 5 8-(1'-ацетиламінодибензотіофен-4'-іл)-2-морфолін-4-іл-хромен-4-он (103) 54 55 (а) 4-трифторметансульфонілдибензотіофен-1-іламін (хі) Розчин льодяної оцтової кислоти (80мл), що містить порошкоподібний Zn (1,17г, 17,96ммоль) і сполуку 1-нітро-дибензотіофен-4-іловий ефір трифторметансульфонової кислоти (ν) (1,13г, 2,99ммоль, 1екв.) перемішують при кімнатній температурі протягом ночі. Після завершення реакції розчин фільтрують через пластину CeliteÔ. Потім осад на CeliteÔ промивають дихлорметаном і концентрують органічну фазу у вакуумі. Чорновий продукт очищають за допомогою швидкісної хроматографії (Si2O) (ДХМ/бензин 4/6, потім 6/4), одержуючи бажану сполуку у вигляді білої твердої речовини (0,84г, вихід 80%). Т. пл.=108°С; Rf=0,34 (ДХМ/бензин 6/4); РХМС m/z 348 [М+1] 1 Н ЯМР (300МГц, CDCI3): d 8,06-8,09 (г, 1Н); 7,77-7,81 (г, 1Н); 7,36-7,44 (г, 2Н); 7,14 (д, J=8,6Гц, 1Н); 6,63 (д, J=8,6Гц, 1Н); 3,94 (с, NH2). 13 C ЯМР (75МГц, CDCI3): 6143,9; 138,8; 136,9; 135,4; 134,1; 126,6; 125,4; 124,8; 123,6; 123,3; 119,7; 119,4 (к, J=317Гц, CF3); 113,0. (б) трифлат 1-ацетиламінодибензотіофену (хіі) До розчину трифлату амінодибензотіофену (200мг, 0,58ммоль) у піридині (4,0мл) по краплях додають оцтовий ангідрид (0,29мл, 2,88ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 12 годин, розбавляють водою (20мл) і екстрагують етилацетатом (3´10мл). Об'єднані органічні шари промивають послідовно водою (2´20мл), насиченим водним розчином бікарбонату натрію (1´20мл) і розчином солі (1´20мл), висушують (Na2SO4) і випарюють у вакуумі. Тверду речовину, що залишилася, розтирають із бензином, щоб одержати цільову сполуку (хіі). РХ/МС (в МеОН): Тr=3.15хв. 1Н ЯМР (300МГц, CDCI3): 59,51 (1Н, з, NH), 8,48 (1Н, д, J=8,1Гц), 8,25 (1Н, д, J=7,42Гц), 7,71-7,53 (4Н, г), 2,33 (3H, з, -СН3). 13С ЯМР (75МГц, CDCI3): 5139,81, 135,34, 129,05, 126,56, 124,19, 120,00, 24,09. (в) 2-морфолін-4-іл-8-(4,4,5,5,-тетраметил[1,3,2°діоксаборолан-4-іл)-4а,8а-дигідро-хромен4-он (хiii) Суспензію 2-морфолін-4-іл-8трифторметансульфоніл-хромен-4-ону (vii) (1,0г, 2,637ммоль), біс(пінаколато)диборону (0,803г, 3,165ммоль) і ацетату калію (0,776г, 7,911ммоль), в 1,4-діоксані (30мл) дегазують шляхом барботування азоту через розчин під час обробки ультразвуком протягом 15 хвилин. Потім до реакцій 88329 56 ної суміші додають (1,1'біс(дифенілфосфіно)фероцен-дихлор паладій (II), (107мг, 0,132ммоль) і 1,1біс(дифенілфосфіно)фероцен (73мг, 0,132ммоль). Реакційну суміш нагрівають до 90°С у атмосфері N2 протягом 16 годин. Після закінчення реакції розчин розбавляють ефіром і промивають органічний шар насиченим розчином NaCI, висушують над MgSO4 і концентрують у вакуумі, щоб одержати цільову сполуку у вигляді чорної твердої речовини (0,80г, вихід 85%), яку потім використовують без очищення. РХ-МС m/z 358 [М+1]; 1Н ЯМР (300МГц, CDCI3): d 8,20 (д, J=6,3Гц, 1Н); 7,94 (д, J=7,2Гц, 1Н); 7,27 (т, J=7,5Гц, 1Н); 5,51 (з, 3H); 3,74-3,78 (г, 4Н); 3,613,64 (г, 4Н); 1,19 (з, 12Н); 13С ЯМР (75МГц, CDCI3): d 178,0; 162,0; 158,1; 140,6; 129,6; 124,7; 86,8; 84,3; 83,5; 66,5; 45,1; 25,4; 24,9. (г) 8-(1'-ацетиламінодибензотіофен-4'-іл)-2морфолін-4-іл-хромен-4-он (103) уміш хіі (100мг, 0,26ммоль), хііі (100мг, 0,28ммоль), Pd(PPh3)4 (14,5мг, 0,013ммоль) і карбонату калію (106мг, 0,768ммоль) тричі продувають аргоном у вакуумі, і додають діоксан (15мл). Реакційну суміш перемішують при 85°С протягом 12 годин. Суміш розбавляють ДХМ (50мл) і органічний шар промивають послідовно водою (2´20мл), розчином солі (1´20мл), висушують (Na2SO4) і випарюють розчинник у вакуумі. Тверду речовину, що залишилася, очищають за допомогою хроматографії на силікагелі, використовуючи 5% метанол у ДХМ у як елюент, щоб одержати цільову сполуку (103). Rt=3,73хв; m/z=471,4; чистота=95% Біологічні приклади Інгібування ДНК-ПК Для дослідження інгібуючої дії сполук згідно із даним винаходом на ДНК-ПК К in vitro, при визначенні значень IC50 використовували наступну експериментальну систему. ДНК-ПК ссавців (500нг/мл) виділили з ядерного екстракту, отриманого із клітин HeLa [Gell, D. and Jackson S.P., Nucleic Acids Res. 27:3494-3502 (1999)] із застосування хроматографії на Qсефарозі, S-сефарозі й гепаринізованій агарозі. Активність ДНК-ПК (250нг) вимірювали при 30°С, у кінцевому об'ємі 40mΙ, у буфері, що містив 25мМ Hepes, рН 7,4, 12.5мМ МgСІ2, 50мМ КСІ, 1мМ DTT, 10% гліцеролу, 0.1% NP-40 і 1г субстрату GST-p53N66 (66 залишків амінокислот з N-кінця р53 людини дикого типу у вигляді білка злиття із глутатіон S-трансферазою) з використанням 96лункових поліпропіленових планшетів. До вказаної робочої суміші додавали різні концентрації 57 88329 58 інгібітора (з кінцевою концентрацією DMSO 1%). зультаті активності ДНК-ПК застосовували станПісля інкубування протягом 10хв, для ініціації дартну процедуру ELISA з використанням антитіл реакції додавали АТФ до кінцевої концентрації проти р53, фосфорилованого за серином 15 (Cell Signaling Technology). Перед додаванням хемо50mΜ і двониткову ДНК довжиною 30 нуклеотидів люмінісцуючого реагенту (NEN Renaissance) до (кінцева концентрація 0,5нг/мл). Після інкубуванпланшета ELISA, його обробляли вторинними ня протягом 1год із погойдуванням, додавали антитілами проти кролика, кон'югованими з перо150мкл забуференого фосфатом фізіологічного ксидазою хрону (Pierce). Сигнал хемолюмінісценрозчину (PBS) і потім переносили 5мкл суміші в ції вимірювали за допомогою зчитуючого прилунки 96-лункового білого матового планшета, строю TopCount NXT (Packard). кожна з яких містила 45мкл PBS і залишали на Активність ферменту для кожної сполуки об1год, щоб субстрат GSTp53N66 міг зв'язатися з числювали за допомогою наступного рівняння: лунками. Для детектування фосфорилування послідовності р53 за залишком серину 15 у ре% Інгібуванн = я æ ö (число клітин за хв. - сер. число клітин за хв. негативного контролю´ 100 ) = 100 - ç ç сер. число клітин за хв. позитивног контролю - сер. число клітин за хв. негативного контролю÷ ÷ о è ø Вказані результати обговорюються нижче як значення IC50 (концентрація, при якій активність ферменту інгібується на 50%). Значення визначили для діапазону різних концентрацій, звичайно від 10мкМ до 0,01мкМ. У порівнянні значень IC50 визначали найбільш ефективні сполуки (інгібітори). Вплив на виживаність клітин (Survival Enhancement Ratio, SER) SER являє собою відношення збільшення кількості померлих клітин під дією інгібітора ДНКПК після опромінення в дозі 2Гр, у порівнянні з неопроміненими контрольними клітинами. Використовували фіксовану концентрацію інгібіторів ДНК-ПК, рівну 100нМ. Опромінення проводили на пристрої Faxitron 43855D з інтенсивністю 1Гр за хвилину. Значення SER для дози 2Gy розраховували за наступною формулою: Виживаніст клітин у присутності інгібітора ДНК - ПК ь ´ Виживаніст контрольних клітин ь Виживаніст клітин після опроміненн ь я ´ Виживаніст клітин після опроміненн в присутності інгібітора ДНК - ПК ь я SER = Рівень смертності клітин відслідковували із застосуванням стандартного аналізу виживаності клонів (clonogenic survival assay). Коротко, на 6-ти лункові планшети висівали клітини HeLa у концентрації, що приводить до появи 100-200 колоній на лунку, планшети поміщали в СО2 інкубатор, щоб дати клітинам прикріпитися. Через чотири години до клітин додавали досліджувану сполуку або розріджувач, як контроль. Потім, клітини інкубували протягом 1год у присутності сполуки перед їх опроміненням дозою 2Гр за допомогою рентгенівської установки Faxitron 43855D. Після опромінення клітини інкубували протягом 16 годин, після чого проводили заміну культуральної рідини на свіже середовище, яке не містило інгібітора ДНК-ПК. Через 8 днів утворені колонії фік Комп’ютерна верстка О. Гапоненко сували й фарбували барвником Giemsa (Sigma, Poole, UK) після чого підраховували із застосуванням автоматичного лічильника колоній (Oxford Optronics Ltd, Oxford, UK). Дані обробляли, як описано вище. Всі сполуки інгібували ДНК-ПК зі значеннями ІС50 менше ніж приблизно 100нМ. Сполуки, які особливо ефективно інгібували ДНК-ПК зі значеннями IC50 менше, ніж приблизно 10нМ включали сполуки: 5, 18, 23, 24, 25, 26, 29, 32, 51, 53, 60, 81, 82, 83, 84, 85, 86, 88, 90, 91, 95. Всі сполуки демонстрували значення SER рівні 1 або більше. Для наступних сполук значення SER становило 2 або більше: 1,4, 13, 24, 26, 32, 34, 38, 40, 41, 48, 53, 56, 80, 82, 84, 88, 89. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDna-pk inhibitors
Автори англійськоюSmith Greame Cameron Murray, Martin Niall Morrison Barr, Menear Keith Allan, Hummersone Marc Geoffrey, Rigoreau Laurent Jean Martin, Griffin Roger John, Golding Bernard Thomas, Newell David Richard, Calvert Hilary Alan, Curtin Nicola Jane, Hardcastle Ian Robert, Saravanan Kappusamy
Назва патенту російськоюИнгибиторы днк-пк
Автори російськоюСмит Грейм Камерон Марри, Мартин Нилл Моррисон Барр, Минер Кейт Аллан, Хаммерсон Марк Джеффри, Ригоро Лоран Жан Мартен, Гриффин Роджер Джон, Голдинг Бернард Томас, Ньюэлл Девид Ричард, Калверт Хилари Алан, Кертин Никола Джейн, Хардкасл Иан Роберт, Сараванан Каппусами
МПК / Мітки
МПК: A61K 31/551, C07D 409/14, A61P 35/00, C07D 409/04
Мітки: інгібітори, днк-пк
Код посилання
<a href="https://ua.patents.su/29-88329-ingibitori-dnk-pk.html" target="_blank" rel="follow" title="База патентів України">Інгібітори днк-пк</a>
Попередній патент: Оцінка дисперсії шуму в безпровідному зв’язку для об’єднання рознесення і масштабування відповідно до логарифмічної правдоподібності
Наступний патент: Установка для одержання продуктів анодного окиснення розчину хлоридів лужних або лужноземельних металів
Випадковий патент: Двороторна електрична машина