Похідні триазолоанілінопіримідину для застосування як противірусні засоби
Номер патенту: 94601
Опубліковано: 25.05.2011
Автори: Спенсер Кіт Чарлз, Дженненз Лін, Чана Суріндер, Фрейзер Іан Джон, Пілкінгтон Крістофер Джон, Томас Александер Джеймс Флойд, Тібергін Наталі, Мет'юз Нейл
Формула / Реферат
1. Похідна хіназоліну формули (І) або її фармацевтично прийнятна сіль:
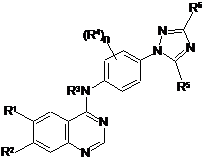 , (I)
, (I)
де:
R1 означає галоген, С1-6-алкіл, С1-4-галоалкіл, С1-6-алкокси, С1-4-галоалкокси або залишок -А, -А-А', -A-Het-A', -A-L-A', -A-Het-L-A', -A-L-Het-A', -A-Het-L-Het'-A' або -A-Het-L-Het'-L';
R2 означає водень, галоген, С1-4-алкіл, С1-4-алкокси, С1-4-галоалкіл, С1-4-галоалкокси або залишок -Het-A', -Het-L-A', -Het-L-Het'-A' або -Het-L-Het'-L';
R3 означає водень або C1-6-алкіл;
кожний R4 є однаковим або різним і означає галоген, С1-4-алкіл, С1-4-алкокси або С1-4-галоалкіл;
R5 означає водень, С1-4-алкіл, С1-4-галоалкіл, С1-4-алкокси, С1-4-аміноалкіл або залишок -Het-L-Het'-L';
R6 означає водень, С1-4-алкіл, С1-4-галоалкіл, С1-4-алкокси, С1-4-аміноалкіл або залишок -Het-L-Het'-L', -CO-X або -L-X, де Х означає -OR', -NR'R" або 5-10-членну гетероарильну або гетероциклільну групу, де R' і R" означають незалежно водень або С1-4-алкіл;
n приймає значення нуль, 1 або 2;
кожна група А і А' є однаковою або різною й означає фенільну, 5-10-членну гетероарильну, 5-10-членну гетероциклільну або С3-6-карбоциклільну групу, яка є необов'язково конденсованою з додатковою фенільною, 5-10-членною гетероарильною, 5-10-членною гетероциклільною або С3-6-карбоциклільною групою;
кожний Het і Het' є однаковим або різним і означає -О-, -S- або -NR'-, де R' означає водень або С1-4-алкіл;
кожний L є однаковим або різним і означає С1-4-алкілен; і
кожний L' є однаковим або різним і означає водень або С1-4-алкільну, С1-4-галоалкільну, С1-4-гідроксіалкільну або С1-4-аміноалкільну групу,
фенільні, гетероарильні, гетероциклільні й карбоциклільні залишки у R1, R2 і R6 є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з атомів галогенів і С1-4-алкілу, С1-4-алкокси, С1-4-галоалкілу, С1-4-галоалкокси, гідрокси, ціано, нітро й -NR'R", де кожний R' і R" є однаковим або різним і означає водень або С1-4-алкіл.
2. Сполука за пунктом 1, де R1 означає галоген, С1-4-алкіл, С1-2-алкокси або залишок -А, -А-А', -A-Het-A', -A-L-A', -A-Het-L-A', -A-L-Het-A', -A-Het-L-Het'-A' або -A-Het-L-Het'-L'.
3. Сполука за пунктом 1 або 2, де R1 означає галоген, С1-4-алкіл, С1-2-алкокси, -А, -А-А', -A-Het-L-A' або -A-Het-L-Het'-L'.
4. Сполука за будь-яким з попередніх пунктів, де R1 означає -А, -А-А', -А-Het-A', -A-L-A', -A-Het-L-A', -A-L-Het-A', -A-Het-L-Het'-A' або -A-Het-L-Het'-L', де А означає фенільну групу, яка є необов'язково конденсованою з додатковою фенільною, 5-6-членною гетероарильною, 5-10-членною гетероциклільною або С3-6-карбоциклільною групою.
5. Сполука за будь-яким з попередніх пунктів, де R2 означає водень, галоген, С1-4-алкіл, С1-4-алкокси, С1-4-галоалкіл, С1-4-галоалкокси або залишок -Het-L-А' або-Het-L-Het'-L'.
6. Сполука за будь-яким з попередніх пунктів, де R2 означає водень, С1-4-алкокси, С1-4-галоалкокси або залишок -Het-L-A' або -Het-L-Het'-L'.
7. Сполука за будь-яким з попередніх пунктів, де кожна група А є однаковою або різною й означає фенільну або 5-6-членну гетероарильну групу, і необов'язково конденсована з додатковою фенільною, 5-6-членною гетероарильною або 5-6-членною гетероциклільною групою.
8. Сполука за будь-яким з попередніх пунктів, де кожна група А' є однаковою або різною й означає неконденсований феніл, 5-6-членний гетероарил або 5-6-членний гетероцикліл.
9. Сполука за будь-яким з попередніх пунктів, де фенільні, гетероарильні, гетероциклільні й карбоциклільні залишки в групах А і А' є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, С1-4-алкілу, С1-4-алкокси, С1-4-галоалкілу й С1-4-галоалкокси.
10. Сполука за будь-яким з попередніх пунктів, де фенільні, гетероарильні, гетероциклільні й карбоциклільні залишки в групах А і А' є незаміщеними або заміщені 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, С1-4-алкілу й С1-4-алкокси.
11. Сполука за будь-яким з попередніх пунктів, де кожна група А є однаковою або різною й означає неконденсовану фенільну або 5-6-членну гетероарильну групу або феніл, конденсований з додатковою фенільною, 5-6-членною гетероарильною або 5-6-членною гетероциклільною групою, зазначена група А є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, С1-4-алкілу й С1-4-алкокси.
12. Сполука за будь-яким з попередніх пунктів, де кожна група А' є однаковою або різною й означає неконденсовану 5-6-членну гетероарильну або гетероциклільну групу, яка є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, С1-4-алкілу й С1-2-алкокси.
13. Сполука за будь-яким з попередніх пунктів, де n приймає значення 0 або 1.
14. Сполука за будь-яким з попередніх пунктів, де R3 означає водень.
15. Сполука за будь-яким з попередніх пунктів, де R5 означає водень або С1-4-алкіл.
16. Сполука за будь-яким з попередніх пунктів, де R6 означає водень, С1-4-алкіл, С1-4-галоалкіл, С1-4-алкокси, С1-4-аміноалкіл або -СО-Х, де Х означає -COR', -NR'R'' або 5-6-членну гетероарильну або гетероциклільну групу, яка є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, вибраними з галогену, С1-4-алкілу, С1-4-галоалкілу або С1-4-алкокси, і R' і R'' є однаковими або різними й означають водень або С1-2-алкіл.
17. Сполука за будь-яким з попередніх пунктів, де кожний Het і Het' є однаковим або різним і означає -О-, -S- або -NR'-, де R' означає водень або С1-2-алкіл.
18. Сполука за будь-яким з попередніх пунктів, де кожний Het означає -О-.
19. Сполука за будь-яким з попередніх пунктів, де кожний Het' є однаковим або різним і означає -О- або -NR'-, де R' означає водень або С1-2-алкіл.
20. Сполука за будь-яким з попередніх пунктів, де кожний L' є однаковим або різним і означає водень або С1-2-алкільну, С1-2-галоалкільну, С1-2-гідроксіалкільну або С1-2-аміноалкільну групу.
21. Сполука за будь-яким з попередніх пунктів, де:
R1 означає галоген, С1-4-алкіл, C1-2-алкокси, -А, -А-А', -A-O-L-A' або -А-O-L-Het'-L';
R2 означає водень, С1-4-галоалкокси або залишок -O-L-A' або -O-L-Het'-L';
R3 означає водень;
R4 означає С1-2-алкіл;
n приймає значення нуль або 1;
R5 означає водень або С1-4-алкіл;
R6 означає водень, С1-4-алкіл, С1-4-галоалкіл, С1-4-алкокси, С1-4-аміноалкіл або -СО-Х, де Х означає -OR', -NR'R'' або 5-6-членну гетероциклільну групу, яка є незаміщеною або заміщена С1-2-алкільною групою, і R' і R'' є однаковими або різними й означають водень або С1-2-алкіл;
кожна група А є однаковою або різною й означає неконденсовану фенільну або 5-6-членну гетероарильну групу або означає фенільне кільце, конденсоване з додатковою фенільною, 5-6-членною гетероарильною або 5-6-членною гетероциклільною групою, зазначена група А є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, С1-4-алкілу й С1-4-алкокси;
кожна А' є однаковою або різною й означає незаміщену 5-6-членну гетероарильну або гетероциклільну групу;
кожний Неt' є однаковим або різним і означає -О- або -NR'-, де R' означає водень або С1-2-алкіл;
кожний L є однаковим або різним і означає метилен, н-етилен або н-пропілен; і
кожний L' є однаковим або різним і означає водень, С1-2-алкіл, C1-2-галоалкіл, С1-2-гідроксіалкіл або С1-2-аміноалкіл.
22. Сполука за пунктом 21, де R1 означає -А, -А-А', -A-O-L-A' або -A-O-L-Неt'-L' і кожна група А означає неконденсовану фенільну групу, або означає фенільну групу, конденсовану з додатковою фенільною, 5-6-членною гетероарильною або 5-6-членною гетероциклільною групою.
23. Похідна хіназоліну за будь-яким з попередніх пунктів, яка має формулу (Іb), або її фармацевтично прийнятна сіль:
 , (Ib)
, (Ib)
де:
кожний R4 є однаковим або різним і означає галоген, С1-4-алкіл або С1-4-алкокси;
n приймає значення 0, 1 або 2;
кожний R' є однаковим або різним і означає галоген, С1-4-алкіл або С1-4-алкокси; і
m приймає значення 0, 1 або 2.
24. Похідна хіназоліну за будь-яким з попередніх пунктів, яка має формулу (Іс), або її фармацевтично прийнятна сіль:
 , (Іс)
, (Іс)
де:
кожний R4 є однаковим або різним і означає галоген, С1-4-алкіл або С1-4-алкокси;
n приймає значення 0, 1 або 2; і
R'' означає -A', -Het-A', -L-A', -Het-L-A', -L-Het-A', -Het-L-Het'-A' або -Het-L-Het'-L', де A', Het, L, Het' і L' визначені у будь-якому з попередніх пунктів.
25. Похідна хіназоліну формули (І), яка визначена у будь-якому з попередніх пунктів, для застосування при лікуванні людей або тварин.
26. Фармацевтична композиція, яка містить похідну хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій або розріджувач.
27. Застосування похідної хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятної солі для приготування лікарського засобу для лікування або запобігання зараженню вірусами сімейства flaviviridae.
28. Застосування за пунктом 27, де зараження вірусами сімейства flaviviridae являє собою зараження пестивірусами.
29. Застосування за пунктом 28, де зараження пестивірусами являє собою зараження вірусом бичачої вірусної діареї, вірусом класичної чуми свиней або вірусом прикордонної хвороби овець.
30. Застосування за пунктом 27, де зараження flaviviridae являє собою зараження флавівірусами.
31. Застосування за пунктом 30, де зараження флавівірусами являє собою зараження вірусом жовтої пропасниці, вірусом пропасниці денге, вірусом японського енцефаліту або вірусом кліщового енцефаліту.
32. Застосування за пунктом 27, де зараження flaviviridae являє собою зараження гепацивірусами.
33. Застосування за пунктом 32, де зараження гепацивірусами являє собою зараження вірусом гепатиту С.
34. Застосування за пунктом 33, де лікарський засіб додатково містить
(а) інтерферон або його похідну і/або
(b) рибавірин або його похідну.
35. Застосування за пунктом 34, де похідна інтерферону являє собою PEG-інтерферон і/або похідна рибавірину являє собою вірамідин.
36. Застосування за пунктом 34 або 35, де лікарський засіб додатково містить інтерферон a.
37. Застосування за пунктом 34 або 35, де лікарський засіб додатково містить інтерферон a2а або a2b.
38. Застосування за пунктом 34 або 35, де лікарський засіб додатково містить інтерферон a8.
39. Застосування за пунктом 34, де лікарський засіб додатково містить інтерферон b.
40. Продукт, який містить:
(a) похідну хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятну сіль; і
(b) інтерферон або похідну інтерферону, який(яка) визначений(а) у будь-якому з пунктів 34-39, і/або рибавірин або похідну рибавірину, який(яка) визначений(а) у пункті 34 або 35;
для одночасного, роздільного або послідовного застосування для лікування людей або тварин.
41. Фармацевтична композиція, яка містить
(а) похідну хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятну сіль, і
(b) інтерферон або похідну інтерферону, який(яка) визначений(а) у будь-якому з пунктів 34-39,
разом з фармацевтично прийнятним носієм або розріджувачем.
42. Застосування похідної хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятної солі для приготування лікарського засобу, застосовуваного для лікування або запобігання зараженню HCV, шляхом спільного введення з інтерфероном або похідною інтерферону, який(яка) визначений(а) у будь-якому з пунктів 34-39.
43. Застосування інтерферону або похідної інтерферону, який(яка) визначений(а) у будь-якому з пунктів 34-39, для приготування лікарського засобу, застосовуваного для лікування або запобігання зараженню HCV, шляхом спільного введення з похідною хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятною сіллю.
44. Спосіб лікування хворого, який страждає від або сприйнятливий до зараження вірусами сімейства flaviviridae, які визначені у будь-якому з пунктів 27-33, який включає введення зазначеному хворому ефективної кількості похідної хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятної солі.
Текст
1. Похідна хіназоліну формули (І) або її фармацевтично прийнятна сіль: R6 C2 2 (19) 1 3 й -NR'R", де кожний R' і R" є однаковим або різним і означає водень або С1-4-алкіл. 1 2. Сполука за пунктом 1, де R означає галоген, С1-алкіл, С1-2-алкокси або залишок -А, -А-А', -A-Het4 A', -A-L-A', -A-Het-L-A', -A-L-Het-A', -A-Het-L-Het'-A' або -A-Het-L-Het'-L'. 1 3. Сполука за пунктом 1 або 2, де R означає галоген, С1-4-алкіл, С1-2-алкокси, -А, -А-А', -A-Het-L-A' або -A-Het-L-Het'-L'. 4. Сполука за будь-яким з попередніх пунктів, де 1 R означає -А, -А-А', -А-Het-A', -A-L-A', -A-Het-L-A', A-L-Het-A', -A-Het-L-Het'-A' або -A-Het-L-Het'-L', де А означає фенільну групу, яка є необов'язково конденсованою з додатковою фенільною, 5-6членною гетероарильною, 5-10-членною гетероциклільною або С3-6-карбоциклільною групою. 5. Сполука за будь-яким з попередніх пунктів, де 2 R означає водень, галоген, С1-4-алкіл, С1-4алкокси, С1-4-галоалкіл, С1-4-галоалкокси або залишок -Het-L-А' або-Het-L-Het'-L'. 6. Сполука за будь-яким з попередніх пунктів, де 2 R означає водень, С1-4-алкокси, С1-4-галоалкокси або залишок -Het-L-A' або -Het-L-Het'-L'. 7. Сполука за будь-яким з попередніх пунктів, де кожна група А є однаковою або різною й означає фенільну або 5-6-членну гетероарильну групу, і необов'язково конденсована з додатковою фенільною, 5-6-членною гетероарильною або 5-6членною гетероциклільною групою. 8. Сполука за будь-яким з попередніх пунктів, де кожна група А' є однаковою або різною й означає неконденсований феніл, 5-6-членний гетероарил або 5-6-членний гетероцикліл. 9. Сполука за будь-яким з попередніх пунктів, де фенільні, гетероарильні, гетероциклільні й карбоциклільні залишки в групах А і А' є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, С1-4-алкілу, С1-4-алкокси, С1-4галоалкілу й С1-4-галоалкокси. 10. Сполука за будь-яким з попередніх пунктів, де фенільні, гетероарильні, гетероциклільні й карбоциклільні залишки в групах А і А' є незаміщеними або заміщені 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, С1-4-алкілу й С1-4-алкокси. 11. Сполука за будь-яким з попередніх пунктів, де кожна група А є однаковою або різною й означає неконденсовану фенільну або 5-6-членну гетероарильну групу або феніл, конденсований з додатковою фенільною, 5-6-членною гетероарильною або 5-6-членною гетероциклільною групою, зазначена група А є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, С1-4-алкілу й С1-4-алкокси. 12. Сполука за будь-яким з попередніх пунктів, де кожна група А' є однаковою або різною й означає неконденсовану 5-6-членну гетероарильну або гетероциклільну групу, яка є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, С1-4алкілу й С1-2-алкокси. 13. Сполука за будь-яким з попередніх пунктів, де n приймає значення 0 або 1. 94601 4 14. Сполука за будь-яким з попередніх пунктів, де 3 R означає водень. 15. Сполука за будь-яким з попередніх пунктів, де 5 R означає водень або С1-4-алкіл. 16. Сполука за будь-яким з попередніх пунктів, де 6 R означає водень, С1-4-алкіл, С1-4-галоалкіл, С1-4алкокси, С1-4-аміноалкіл або -СО-Х, де Х означає COR', -NR'R'' або 5-6-членну гетероарильну або гетероциклільну групу, яка є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, вибраними з галогену, С1-4-алкілу, С1-4-галоалкілу або С1-4-алкокси, і R' і R'' є однаковими або різними й означають водень або С1-2-алкіл. 17. Сполука за будь-яким з попередніх пунктів, де кожний Het і Het' є однаковим або різним і означає -О-, -S- або -NR'-, де R' означає водень або С1-2алкіл. 18. Сполука за будь-яким з попередніх пунктів, де кожний Het означає -О-. 19. Сполука за будь-яким з попередніх пунктів, де кожний Het' є однаковим або різним і означає -Оабо -NR'-, де R' означає водень або С1-2-алкіл. 20. Сполука за будь-яким з попередніх пунктів, де кожний L' є однаковим або різним і означає водень або С1-2-алкільну, С1-2-галоалкільну, С1-2гідроксіалкільну або С1-2-аміноалкільну групу. 21. Сполука за будь-яким з попередніх пунктів, де: 1 R означає галоген, С1-4-алкіл, C1-2-алкокси, -А, -АА', -A-O-L-A' або -А-O-L-Het'-L'; 2 R означає водень, С1-4-галоалкокси або залишок O-L-A' або -O-L-Het'-L'; 3 R означає водень; 4 R означає С1-2-алкіл; n приймає значення нуль або 1; 5 R означає водень або С1-4-алкіл; 6 R означає водень, С1-4-алкіл, С1-4-галоалкіл, С1-4алкокси, С1-4-аміноалкіл або -СО-Х, де Х означає OR', -NR'R'' або 5-6-членну гетероциклільну групу, яка є незаміщеною або заміщена С1-2-алкільною групою, і R' і R'' є однаковими або різними й означають водень або С1-2-алкіл; кожна група А є однаковою або різною й означає неконденсовану фенільну або 5-6-членну гетероарильну групу абоозначає фенільне кільце, конденсоване з додатковою фенільною, 5-6-членною гетероарильною або 5-6-членною гетероциклільною групою, зазначена група А є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, С1-4-алкілу й С1-4-алкокси; кожна А' є однаковою або різною й означає незаміщену 5-6-членну гетероарильну або гетероциклільну групу; кожний Неt' є однаковим або різним і означає -Оабо -NR'-, де R' означає водень або С1-2-алкіл; кожний L є однаковим або різним і означає метилен, н-етилен або н-пропілен; і кожний L' є однаковим або різним і означає водень, С1-2-алкіл, C1-2-галоалкіл, С1-2-гідроксіалкіл або С1-2-аміноалкіл. 1 22. Сполука за пунктом 21, де R означає -А, -А-А', -A-O-L-A' або -A-O-L-Неt'-L' і кожна група А означає неконденсовану фенільну групу, або означає фенільну групу, конденсовану з додатковою феніль 5 94601 ною, 5-6-членною гетероарильною або 5-6членною гетероциклільною групою. 23. Похідна хіназоліну за будь-яким з попередніх пунктів, яка має формулу (Іb), або її фармацевтично прийнятна сіль: N (R4)n N N (R') m HN N N , (Ib) де: 4 кожний R є однаковим або різним і означає галоген, С1-4-алкіл або С1-4-алкокси; n приймає значення 0, 1 або 2; кожний R' є однаковим або різним і означає галоген, С1-4-алкіл або С1-4-алкокси; і m приймає значення 0, 1 або 2. 24. Похідна хіназоліну за будь-яким з попередніх пунктів, яка має формулу (Іс), або її фармацевтично прийнятна сіль: N (R4)n N N (R'') m HN N N , (Іс) де: 4 кожний R є однаковим або різним і означає галоген, С1-4-алкіл або С1-4-алкокси; n приймає значення 0, 1 або 2; і R'' означає -A', -Het-A', -L-A', -Het-L-A', -L-Het-A', Het-L-Het'-A' або -Het-L-Het'-L', де A', Het, L, Het' і L' визначені у будь-якому з попередніх пунктів. 25. Похідна хіназоліну формули (І), яка визначена у будь-якому з попередніх пунктів, для застосування при лікуванні людей або тварин. 26. Фармацевтична композиція, яка містить похідну хіназоліну формули (І), яка визначена у будьякому з пунктів 1-24, або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій або розріджувач. 27. Застосування похідної хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятної солі для приготування лікарського засобу для лікування або запобігання зараженню вірусами сімейства flaviviridae. 28. Застосування за пунктом 27, де зараження вірусами сімейства flaviviridae являє собою зараження пестивірусами. 29. Застосування за пунктом 28, де зараження пестивірусами являє собою зараження вірусом бичачої вірусної діареї, вірусом класичної чуми свиней або вірусом прикордонної хвороби овець. 30. Застосування за пунктом 27, де зараження flaviviridae являє собою зараження флавівірусами. 6 31. Застосування за пунктом 30, де зараження флавівірусами являє собою зараження вірусом жовтої пропасниці, вірусом пропасниці денге, вірусом японського енцефаліту або вірусом кліщового енцефаліту. 32. Застосування за пунктом 27, де зараження flaviviridae являє собою зараження гепацивірусами. 33. Застосування за пунктом 32, де зараження гепацивірусами являє собою зараження вірусом гепатиту С. 34. Застосування за пунктом 33, де лікарський засіб додатково містить (а) інтерферон або його похідну і/або (b) рибавірин або його похідну. 35. Застосування за пунктом 34, де похідна інтерферону являє собою PEG-інтерферон і/або похідна рибавірину являє собою вірамідин. 36. Застосування за пунктом 34 або 35, де лікарський засіб додатково містить інтерферон . 37. Застосування за пунктом 34 або 35, де лікарський засіб додатково містить інтерферон 2а або 2b. 38. Застосування за пунктом 34 або 35, де лікарський засіб додатково містить інтерферон 8. 39. Застосування за пунктом 34, де лікарський засіб додатково містить інтерферон . 40. Продукт, який містить: (a) похідну хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятну сіль; і (b) інтерферон або похідну інтерферону, який(яка) визначений(а) у будь-якому з пунктів 34-39, і/або рибавірин або похідну рибавірину, який(яка) визначений(а) у пункті 34 або 35; для одночасного, роздільного або послідовного застосування для лікування людей або тварин. 41. Фармацевтична композиція, яка містить (а) похідну хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятну сіль, і (b) інтерферон або похідну інтерферону, який(яка) визначений(а) у будь-якому з пунктів 34-39, разом з фармацевтично прийнятним носієм або розріджувачем. 42. Застосування похідної хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятної солі для приготування лікарського засобу, застосовуваного для лікування або запобігання зараженню HCV, шляхом спільного введення з інтерфероном або похідною інтерферону, який(яка) визначений(а) у будь-якому з пунктів 34-39. 43. Застосування інтерферону або похідної інтерферону, який(яка) визначений(а) у будь-якому з пунктів 34-39, для приготування лікарського засобу, застосовуваного для лікування або запобігання зараженню HCV, шляхом спільного введення з похідною хіназоліну формули (І), яка визначена у будь-якому з пунктів 1-24, або її фармацевтично прийнятною сіллю. 44. Спосіб лікування хворого, який страждає від або сприйнятливий до зараження вірусами сімейства flaviviridae, які визначені у будь-якому з пунктів 27-33, який включає введення зазначеному хво 7 94601 8 рому ефективної кількості похідної хіназоліну формули (І), яка визначена у будь-якому з пунктів 1 24, або її фармацевтично прийнятної солі. Даний винахід стосується ряду похідних хіназоліну, які є придатними для лікування або запобігання зараження вірусами сімейства flaviviridae. Віруси сімейства flaviviridae являють собою невеликі, ікосаедричні віруси з оболонкою, які містять плюс-нитки РНК (позитивний геном). Сімейство складається із трьох родів: флавівірусів, пестивірусів і гепацивірусів. Більшість з вірусів сімейства flaviviridae є важливими патогенами людини. Більш того, рід гепацивірусів включає вірус гепатиту C. Проте, у наш час ще не існує ефективного і безпечного шляху лікування зараження вірусами flaviviridaes. У заявці WO 98/02434 описані хіназоліни як інгібітори протеїн-тирозинкіназ. Жодна із спеціально описаних у цьому документі сполук не несе триазоліланілінову групу в 6-му положенні. Несподівано виявлено, що похідні хіназоліну формули (I) проявляють активність в інгібуванні реплікації вірусів сімейства flaviviridae і, тому, є ефективними для лікування або запобігання зараження цими вірусами. Даний винахід, отже, пропонує похідну хіназоліну формули (I) або її фармацевтично прийнятну сіль - n приймає значення нуль, 1 або 2; - кожна група A і A´ є однаковою або різною й означає фенільну, 5-10-членну гетероарильну, 510-членну гетероциклільну або C3-6 карбоциклільну групу, яка є необов'язково конденсованою з додатковою фенільною, 5-10-членною гетероарильною, 5-10-членною гетероциклільною або C3-6 карбоциклільною групою; - кожний Het і Het´ є однаковим або різним і означає -O- , -S- або -NR´-, де R´ означає водень або C1-4 алкіл; - кожний L є однаковим або різним і означає C1-4 алкілен; і - кожний L´ є однаковим або різним і означає водень або C1-4 алкільну, C1-4 галоалкільну, C1-4 гідроксіалкільну або C1-4 аміноалкільну групу, фенільні, гетероарильні, гетероциклільні й карбоциклільні залишки в R1, R2 і R6 є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з атомів галогенів і C1-4 алкілу, C1-4 алкокси, C1-4 галоалкілу, C1-4 галоалкокси, гідрокси, ціано, нітро й NR´R´´, де кожний R´ і R´´ є однаковим або різним і означає водень або C1-4 алкіл. В іншому варіанті здійснення, даний винахід пропонує похідну хіназоліну формули (I), яка визначена вище, або її фармацевтично прийнятну сіль, де: 1 - R означає галоген, C1-6 алкіл, C1-4 галоалкіл, C1-6 алкокси, C1-4 галоалкокси або залишок -A, -AA´, -A-Het-A´, -A-L-A´, -A-Het-L-A´, -A-L-Het-A´, -AHet-L-Het´-A´ або -A-Het-L-Het´-L´; 2 - R означає водень, галоген, C1-4 алкіл, C1-4 алкокси, C1-4 галоалкіл, C1-4 галоалкокси або залишок -Het-A´, -Het-L-A´, -Het-L-Het´-A´ або -Het-LHet´-L´; 3 - R означає водень або C1-6 алкіл; 4 - кожний R є однаковим або різним і означає галоген, C1-4 алкіл, C1-4 алкокси або C1-4 галоалкіл; 5 - R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси, C1-4 аміноалкіл або залишок -Het-LHet´-L´; 6 - R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси, C1-4 аміноалкіл або залишок -Het-LHet´-L´, -CO-X або -L-X, де × означає -OR´, -NR´R´´ або 5-10-членну гетероарильну або гетероциклільну групу, де R´ і R´´ означають незалежно водень або C1-4 алкіл; - n приймає значення нуль, 1 або 2; - кожна група A і A´ є однаковою або різною й означає фенільну, 5-10-членну гетероарильну, 510-членну гетероциклільну або C3-6 карбоциклільну групу, яка є необов'язково конденсованою з додатковою фенільною, 5-10-членною гетероарильною, 5-10-членноюї гетероциклільною або C3-6 карбоциклільною групою; - кожний Het і Het´ є однаковим або різним і означає -O- , -S- або -NR´-, де R´ означає водень 6 R N 4 (R )n N N 5 R 3 RN (I) 1 R 2 R N N де: 1 - R означає галоген, C1-6 алкіл, C1-4 галоалкіл, C1-6 алкокси, C1-4 галоалкокси або залишок -A, -AA´, -A-Het-A´, -A-L-A´, -A-Het-L-A´, -A-L-Het-A´, -AHet-L-Het´-A´ або -A-Het-L-Het´-L´; 2 - R означає водень, галоген, C1-4 алкіл, C1-4 алкокси, C1-4 галоалкіл, C1-4 галоалкокси або залишок -Het-A´, -Het-L-A´, -Het-L-Het´-A´ або -Het-LHet´-L´; 3 - R означає водень або C1-6 алкіл; 4 - кожний R є однаковим або різним і означає галоген, C1-4 алкіл, C1-4 алкокси або C1-4 галоалкіл; 5 - R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси, C1-4 аміноалкіл або залишок -Het-LHet´-L´; 6 - R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси, C1-4 аміноалкіл або залишок -Het-LHet´-L´, -CO-X або -L-X, де × означає -OR´, -NR´R´´ або 5-10-членну гетероарильну або гетероциклільну групу, де R´ і R´´ означають незалежно водень або C1-4 алкіл; 9 або C1-4 алкіл; - кожний L є однаковим або різним і означає C1-4 алкілен; і - кожний L´ є однаковим або різним і означає водень або C1-4 алкільну, C1-4 галоалкільну або C1-4 гідроксіалкільну групу, фенільні, гетероарильні, гетероциклільні й карбоциклільні залишки в A і A´ є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з атомів галогенів і C1-4 алкілу, C1-4 алкокси, C1-4 галоалкілу, C1-4 галоалкокси, гідрокси, ціано, нітро й -NR´R´´, де кожний R´ і R´´ є однаковим або різним і означає водень або C1-4 алкіл. Використовуваний тут термін C1-6 алкільна група або залишок являє собою нерозгалужену або розгалужену алкільну групу або залишок, який містить від 1 до 6 атомів вуглецю, наприклад, від 1 до 4 атомів вуглецю. Приклади C1-6 алкільних груп і залишків включають C1-4 алкільні групи й залишки, наприклад, метил, етил, н-пропіл, ізо-пропіл, нбутил, ізо-бутил і трет-бутил. З метою уникнення невизначеності, якщо в групі присутні два алкільних залишки, вони можуть бути однаковими або різними. Використовуваний тут термін C1-4 алкіленова група або залишок означає нерозгалужену або розгалужену алкіленову групу або залишок. Приклади включають метиленову, н-етиленову й нпропіленову групи й залишки. Використовуваний тут термін галоген звичайно означає хлор, фтор, бром або йод і переважно означає хлор, бром або фтор, більш краще - хлор, фтор або йод. Використовуваний тут термін C1-6 алкоксигрупа звичайно означає зазначену C1-6 алкільну групу, приєднану до атома кисню. Галоалкільна або галоалкоксигрупа звичайно означає зазначену алкільну або алкоксигрупу, заміщену одним або декількома зазначеними атомами галогену. Звичайно вона заміщена 1, 2 або 3 зазначеними атомами галогену. Кращі галоалкоксигрупи включають алкоксигрупи, заміщені одним або двома атомами хлору, більш краще одним атомом хлору. Особливо кращі галоалкільні групи включають -O-(CH2)3Cl. Інші кращі галоалкільні й галоалкоксигрупи включають пергалоалкільні й пергалоалкоксигрупи, такі як -CX3 і -OCX3, де × означає зазначений атом галогену, наприклад хлор і фтор. Особливо кращими галоалкільними групами є -CF3 і -CCl3. Використовуваний тут термін C1-4 гідроксіалкільна група означає C1-4 алкільну групу, заміщену одним або декількома гідроксигрупами. Звичайно вона заміщена однією, двома або трьома гідроксигрупами. Переважно вона заміщена однією єдиною гідроксигрупою. Кращою гідроксіалкільною групою є -(CH2)2-OH. Використовуваний тут термін C1-4 аміноалкільна група означає C1-4 алкільну групу, заміщену однією або декількома -NR´R´´ групами, де кожний R´ і R´´ є однаковим або різним і означає водень або C1-4 алкіл. Звичайно вона заміщена однією, двома або трьома -NR´R´´ групами, де кожний R´ і R´´ є однаковим або різним і означає водень або C1-4 алкіл. Переважно кожний R´ і R´´ є однаковим 94601 10 або різним і означає водень або C1-2 алкіл, більш краще водень або метил. Переважно C1-4 алкільна група заміщена однією єдиною -NR´R´´ групою, як визначено вище. Більш краще C1-4 алкільна група заміщена однією єдиною групою -N(CH3)2. Використовуваний тут термін 5-10-членна гетероарильна група або залишок означає моноциклічне 5-10-членне ароматичне кільце, таке як 5або 6-членне кільце, яке містить, принаймні, один гетероатом, наприклад 1, 2 або 3 гетероатоми, вибраних з O, S і N. Приклади включають піридильну, піразинільну, піримідинільну, піридазинільну, фуранільну, тієнільну, піразолідинільну, піролільну, оксадіазолільну, оксазолільну, ізоксазолільну, тіазолільну, тіадіазолільну, імідазолільну та піразолільну групи. Фуранільна, тієнільна, піридильна й піримідильна групи є кращими. Коли A або A´ означає 5-10-членний гетероарильный залишок, конденсований з фенільною, 510-членною гетероарильною, 5-10-членною гетероциклільною або C3-6 карбоциклільною групою, він звичайно конденсований з фенільним, 5-6членним гетероарильним або 5-6-членним гетероциклільним кільцем. Більш краще він конденсований з фенільним кільцем. Коли A або A´ означає фенільну групу, конденсовану з додатковою фенільною, 5-10-членною гетероарильною, 5-10-членною гетероциклільною або C3-6 карбоциклільною групою, вона переважно конденсована з фенільним, 5-6-членним гетероарильним або 5-6-членним гетероциклільним кільцем. Більш краще вона конденсована з 5-6членним гетероарильним або гетероциклільним кільцем. Найбільш краще вона конденсована з 1,4діоксациклогексановим кільцем. Використовуваний тут термін 5-10-членна гетероциклільна група або залишок означає моноциклічне неароматичне, насичене або ненасичене C5-C10 карбоциклічне кільце, у якому один або декілька, наприклад 1, 2 або 3, атомів вуглецю замінені на залишок, вибраний з N, O, S, S(O) і S(O)2. Звичайно він означає 5-6-членне кільце. Придатні гетероциклільні групи й залишки включають піразолідинільну, піперидильну, піперазинільну, тіоморфолінільну, S-оксотіоморфолінільну, S,S-діоксо-тіоморфолінільну, морфолінільну, піролідинільну, піролінільну, імідазолідинільну, імідазолінільну, 1,3-діоксоланільну, 1,4-діоксоланільну, 1,2-діоксациклогексильну, 1,3діоксациклогексильну, 1,4-діоксациклогексильну й піразолінільну групи й залишки. Кращими гетероциклільними групами є піперазинільна, піролідинільна, морфолінільна й 1,4-діоксациклогексанільна групи, зокрема морфолінільна й 1,4діоксациклогексанільна групи. Коли A або A´ означає зазначений 5-10членний гетероциклільний залишок, конденсований з додатковою фенільною, 5-10-членною гетероарильною, 5-10-членною гетероциклільною або C3-6 карбоциклільною групою, він переважно конденсований з фенільним, 5-6-членним гетероарильним або 5-6-членним гетероциклільним кільцем. Більш краще він конденсований з фенільним кільцем. 11 З метою уникнення невизначеності, незважаючи на те, що вищенаведені визначення гетероарильных і гетероциклільних груп стосуються “N” залишку, який може бути присутнім у кільці, кваліфікованому хіміку також є очевидним, що N-атом може протонуватися (або нести замісник, як визначено вище), якщо він приєднаний до кожного з розташованих поруч атомів кільця через одинарний зв'язок. Використовуваний тут термін C3-6 карбоциклічний залишок означає моноциклічне неароматичне насичене або ненасичене вуглеводневе кільце, яке має від 3 до 6 атомів вуглецю. Переважно він означає насичене вуглеводневе кільце (тобто, циклоалкільний залишок), що має від 3 до 6 атомів вуглецю. Приклади включають циклопропіл, циклобутил, циклопентил і циклогексил. Коли A або A´ означає зазначену C3-6 карбоциклільну групу, конденсовану з додатковою фенільною, 5-10-членною гетероарильною, 5-10-членною гетероциклільною або C3-6 карбоциклільною групою, вона переважно конденсована з фенільним, 5-6-членним гетероарильним або 5-6-членним гетероциклільним кільцем. Коли зазначені фенільний, гетероарильний, гетероциклільний і карбоциклільний залишки заміщені двома або трьома замісниками, переважно не більш ніж один замісник вибраний із ціано та нітро. Звичайно фенільні, гетероарильні, гетероцик1 2 6 лільні й карбоциклільні залишки в R , R і R є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, C1-4 алкілу, C1-4 алкокси, C1-4 галоалкілу, C1-4 галоалкокси, гідрокси й -NR´R´´, де кожний R´ і R´´ є однаковим або різним і означає водень або C1-4 алкіл. Більш звичайно, у цьому 6 варіанті, циклічна група в R є незаміщеною, а фенільні, гетероарильні, гетероциклільні й карбоцик/ лільні залишки в групах A і A є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, C14 алкілу, C1-4 алкокси, C1-4 галоалкілу, C1-4 галоалкокси, гідрокси й -NR´R´´, де кожний R´ і R´´ є однаковим або різним і означає водень або C1-4 алкіл. Переважно фенільні, гетероарильні, гетероци1 2 6 клільні й карбоциклільні залишки в R , R і R є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, C1-4 алкілу, C1-4 алкокси, C1-4 галоалкілу й C1-4 галоалкокси. Більш звичайно, у цьому кращому варіанті, циклічна група в 6 R є незаміщеною й фенільні, гетероарильні, гете/ роциклільні й карбоциклільні залишки в A і A є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, C1-4 алкілу, C1-4 алкокси, C1-4 галоалкілу й C1-4 галоалкокси. Більш краще фенільні, гетероарильні, гетеро1 2 6 циклільні й карбоциклільні залишки в R , R і R є незаміщеними або заміщені 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, наприклад хлору й фтору, гідрокси, C1- 4 алкілу, наприклад, метилу й C1-4 алкокси. 94601 12 Більш звичайно, у цьому варіанті, циклічна група в 6 R є незаміщеною й фенільні, гетероарильні, гетероциклільні й карбоциклільні залишки в групах A і / A є незаміщеними або заміщені 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, наприклад хлору й фтору, C1-4 алкілу, наприклад, метилу й C1-2 алкокси. Звичайно кожна група A є однаковою або різною й означає фенільну, 5-6-членну гетероарильну або 5-6-членну гетероциклільну групу, яка є необов'язково конденсованою з додатковою фенільною, 5-6-членною гетероарильною, 5-6-членною гетероциклільною або C3-6 карбоциклільною групою. Переважно кожна група A є однаковою або різною й означає фенільну або 5-6-членну гетероарильну групу, яка є необов'язково конденсованою з додатковою фенільною, 5-6-членною гетероарильною або 5-6-членною гетероциклільною групою. Більш краще кожна група A є однаковою або різною й означає неконденсовану фенільну або 5-6членну гетероарильну групу або означає фенільне кільце, конденсоване з додатковою фенільною, 56-членною гетероарильною або 5-6-членноюї гетероциклільною групою. Коли A означає 5-6членну гетероарильну групу, вона переважно означає піримідинільну, фуранільну або тієнільну групу. Коли A означає конденсовану групу, вона переважно означає фенільну групу, конденсовану з 5-6-членною гетероциклільною групою, найбільш краще 1,4-діоксациклогексильною групою. Група A звичайно є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, C1-4 алкілу й C1-4 алкокси. Більш звичайно, ці замісники вибрані з галогену, C1-4 алкілу й C1-2 алкоксигруп. Звичайно кожна група A´ є однаковою або різною й означає фенільну, 5-6-членну гетероарильну або 5-6-членну гетероциклільну групу, і необов'язково конденсована з додатковою фенільною, 5-6-членної гетероарильною, 5-6-членною гетероциклільною або C3-6 карбоциклільною групою. Більш звичайно група A΄ означає неконденсований феніл, 5-6-членний гетероарил або 5-6-членний гетероцикліл. Найбільш краще A΄ означає неконденсовану 5-6-членну гетероарильну або гетероциклільну групу, наприклад піридил, піролідиніл і морфолініл, зокрема піридил і морфолініл. Звичайно група A´ є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, C1-4 алкілу й C1-2 алкокси. Переважно група A΄ є незаміщеною. Звичайно Het означає -O- , -S- або -NR´-, де R´ означає водень або C1-2 алкіл. Більш краще Het означає -O- або -NR´-, де R´ означає водень або C1-2 алкіл. Більш краще Het означає -O- . Звичайно Het´ означає -O- , -S- або -NR´-, де R´ означає водень або C1-2 алкіл. Більш краще Het´ означає -O- або -NR´-, де R´ означає водень або C1-2 алкіл. Коли Het´ означає -NR´-, R´ переважно означає метил. Звичайно кожний L є однаковим або різним і означає C1-4 алкілен. Більш краще кожний L незалежно вибраний з метилену, н-етилену або н 13 пропілену. Переважно кожний L´ є однаковим або різним і означає водень або C1-2 алкільну, C1-2 галоалкільну, C1-2 гідроксіалкільну або C1-2 аміноалкільну / групу. Звичайно ці кращі залишки L вибрані з водню й C1-2 алкільних, C1-2 галоалкільних і C1-2 гідроксіалкільних груп. Більш краще кожний L´ є однаковим або різним і означає водень, C1-2 алкіл, C1-2 аміноалкіл або C1-2 гідроксіалкіл. Звичайно ці більш кращі / залишки L вибрані з водню, C1-2 алкілу й C1-2 гідроксіалкілу. Коли L´ означає C1-2 алкіл, він переважно означає метильну групу. Коли L´ означає C1-2 гідроксіалкіл, він переважно означає -(CH2)2OH. Коли / L означає C1-2 аміноалкіл, він переважно означає (CH2)2-N(CH3)2. 1 1 Коли R означає -A, R звичайно означає фенільну або 5-6-членну гетероарильну групу й необов'язково конденсований з додатковою фенільною, 5-6-членною гетероарильною або 5-6членною гетероциклільною групою. Більш краще 1 R означає феніл, 5-6-членний гетероарил або феніл, конденсований з додатковою фенільною, 56-членною гетероарильною або 5-6-членною гете1 роциклільною групою. Більш краще R означає феніл, піримідиніл, фураніл або тієніл, або означає фенільну групу, конденсовану з 1,4діоксациклогексильною групою. 1 1 Коли R означає -A, R звичайно є незаміщеним або заміщений 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, C1-4 алкілу й C1-4 алкокси. Звичайно ці кращі замісники вибрані з галогену, C1-4 алкілу й C1-2 алкокси. Кращим галогеновим замісником є фтор. Кращим C1-4 алкільним замісником є метил. Кращі C1-2 алкокси замісники включають метокси й етокси. 1 1 Коли R означає -A-A´, R звичайно означає залишок -феніл-A´, де A´ означає неконденсовану 5-6-членну гетероциклільну групу. Більш краще A´ означає морфолініл. 1 1 Коли R означає -A-Het-L-Het´-L´, R звичайно означає залишок -феніл-O-L-Het´-L´. L звичайно означає н-етилен. Het´ звичайно означає -O- або NR´-, де R´ означає водень або C1-2 алкіл. Більш краще Het´ означає -O- або -NMe- . L´ звичайно означає метил або C1-2 аміноалкіл, наприклад / (CH2)2-N(CH3)2. Переважно L означає метил. 1 1 Коли R означає -A-Het-L-A´, R звичайно означає залишок -феніл-O-L-A´. L звичайно означає метилен або н-пропілен, переважно метилен. A´ звичайно означає 5-6-членний гетероарил або 5-6-членну гетероциклільну групу. Звичайно група A´ є не конденсованою. Більш краще A´ означає неконденсовану 5-6-членну гетероарильну або гетероциклільну групу, більш краще незаміщену піридильну, піролідинільну або морфолінільну групу. Більш звичайно, у цьому варіанті ці кращі групи / A вибрані з неконденсованих 5-6-членних гетероарильных груп, переважно незаміщених піридильних груп. 1 Коли R означає -A-A´, -A-Het-A´, -A-L-A´, -AHet-L-A´, -A-L-Het-A´, -A-Het-L-Het´-A´ або -A-Het-LHet´-L´, група A звичайно є незаміщеною або за 94601 14 міщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, C1-4 алкілу й C1-2 алкокси. Більш краще група A є незаміщеною або заміщена атомом галогену, зокрема фтору. Найбільш краще група A є незаміщеною. 1 Подібним чином, коли R означає -A-A´, -A-Het-A´, A-L-A´, -A-Het-L-A´, -A-L-Het-A´, -A-Het-L-Het´-A´ або -A-Het-L-Het´-L´, звичайно група A´ є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, C1-4 алкілу й C1-2 алкокси. Більш краще група A´ є незаміщеною. 1 Коли R означає галоген, він звичайно являє собою атом хлору, брому або йоду, більш краще атом брому або йоду, найбільш краще атом йоду. 1 Коли R означає C1-6 алкіл, він звичайно являє собою C1-4 алкільну групу, наприклад третбутильну групу. 1 Коли R означає C1-4 алкоксигрупу, вона звичайно являє собою C1-2 алкоксигрупу, більш краще метоксигрупу. 1 Переважно R означає галоген, C1-4 алкіл, C1-2 алкокси або залишок -A, -A-A´, -A-Het-A´, -A-L-A´, A-Het-L-A´, -A-L-Het-A´, -A-Het-L-Het´-A´ або -A-HetL-Het´-L´, де A, A´, Het, Het´, L і L´ визначено вище. 1 Більш краще R означає галоген, наприклад, бром і йод, C1-4 алкіл, C1-2 алкокси, -A, -A-A´, -A1 Het-L-A´ або -A-Het-L-Het´-L´. Більш краще R означає галоген, наприклад бром і йод, C1-4 алкіл, C1-2 алкокси, -A, -A-A´, -A-O-L-A´ або -A-O-L-Het´-L´. В подальшому варіанті винаходу, R1 означає / / / / / A, -A-A , -A-Het-A , -A-L-A , -A-Het-L-A , -A-L-Het-A , / / / / A-Het-L-Het -A або -A-Het-L-Het -L , де A означає фенільну групу, яка є необов'язково конденсованою з додатковою фенільною, 5-10-членною гетероарильною, 5-10-членною гетероциклільною або / / / C3-6 карбоциклільною групою, і A , Het, L, Het і L визначені вище. 2 Коли R означає C1-4 галоалкокси, він переважно заміщений 1 або 2 атомами галогенів. Кращи2 ми атомами галогенів є атоми хлору. Коли R означає C1-4 галоалкокси, він переважно означає O-(CH2)3-Cl. 2 2 Коли R означає -Het-L-A´, R звичайно означає залишок -O-L-A´. L переважно означає нпропілен. A´ звичайно означає неконденсовану 56-членну гетероциклільну групу, наприклад мор2 фолін. Коли R означає -Het-L-A´, група A´ переважно є незаміщеною. 2 Коли R означає -Het-L-Het´-L´, Het´ переважно означає -O- або -NR´-, де R´ означає водень або C1-2 алкіл. Більш краще Het´ означає -NMe- . Коли 2 R означає -Het-L-Het´-L´, Het переважно означає 2 O- . Коли R означає -Het-L-Het´-L´, L переважно 2 означає н-пропілен. Коли R означає -Het-L-Het´L´, L´ переважно означає -(CH2)2-OH. 2 Переважно R означає водень, галоген, C1-4 алкіл, C1-4 алкокси, C1-4 галоалкіл, C1-4 галоалкокси або залишок -Het-L-A´ або -Het-L-Het´-L´, де Het, 2 Het´, L, L´ і A´ визначено вище. Більш краще R означає водень, C1-4 алкокси, C1-4 галоалкокси або залишок -Het-L-A´ або -Het-L-Het´-L´, де Het, Het´, L, L´ і A´ визначено вище. 2 Більш краще R означає водень, C1-4 галоалкокси або залишок -Het-L-A´ або -Het-L-Het´-L´, де 15 Het, Het´, L, L´ і A´ визначено вище. 3 Переважно R означає водень або C1-2 алкіл. 3 Більш краще R означає водень. 4 Переважно кожний R є однаковим або різним і означає галоген або C1-4 алкіл. Більш краще кожний R4 є однаковим або різним і означає C1-2 алкіл, зокрема метил. Переважно n приймає значення нуль або 1. Більш краще n приймає значення нуль. 5 Переважно R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси або C1-4 аміноалкіл. Більш 5 краще R означає водень або C1-4 алкіл, більш краще водень або метил, найбільш краще водень. 6 / / // Звичайно × у залишку R означає -OR , -NR R або 5-6-членну гетероарильну або гетероцикліль/ // ну групу, де R і R визначені вище. Звичайно зазначена гетероарильна або гетероциклільна група є незаміщеною або заміщена одним або двома незаміщеними замісниками, вибраними з галогену, C1-4 алкілу, C1-4 галоалкілу й C1-4 алкокси. Переважно зазначена гетероарильна або гетероциклільна група являє собою гетероциклільну групу, зокрема піперазинільну групу, яка є незаміщеною або за/ // міщена C1-2 алкільною групою. Звичайно R і R у / // залишку -NR R є однаковими або різними й означають водень або C1-2 алкіл. Звичайно R6 означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси, C1-4 аміноалкіл або -CO-X, де × визначений вище. 6 Переважно R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси або C1-4 аміноалкіл. Більш 6 краще R означає водень. Кращими сполуками винаходу є ті, у яких: 1 - R означає галоген, C1-4 алкіл, C1-2 алкокси або залишок -A, -A-A´, -A-Het-A´, -A-L-A´, -A-Het-LA´, -A-L-Het-A´, -A-Het-L-Het´-A´ або -A-Het-L-Het´L´; 2 - R означає водень, галоген, C1-4 алкіл, C1-4 алкокси, C1-4 галоалкіл, C1-4 галоалкокси або залишок -Het-L-A´ або -Het-L-Het´-L´; 3 - R означає водень або C1-2 алкіл; 4 - R означає водень, галоген або C1-4 алкіл; 5 - R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси або C1-4 аміноалкіл; 6 - R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси, C1-4 аміноалкіл або -CO-X, де × озна/ / // чає -OR , -NR R або 5-6-членну гетероарильну або гетероциклільну групу, яка є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, вибраними з галогену, C1-4 алкілу, C1-4 галоалкілу або / // C1-4 алкокси, і R і R є однаковими або різними й означають водень або C1-4 алкіл; - n приймає значення нуль або 1; - кожна група A є однаковою або різною й означає фенільну або 5-6-членну гетероарильну групу, і необов'язково конденсована з додатковою фенільною, 5-6-членною гетероарильною або 5-6членною гетероциклільною групою; - кожна група A´ є однаковою або різною й означає неконденсований феніл, 5-6-членний гетероарил або 5-6-членний гетероцикліл; - кожний Het і Het´ є однаковим або різним і означає -O- , -S- або -NR´-, де R´ означає водень або C1-2 алкіл; - кожний L є однаковим або різним і означає C1-4 алкілен; і 94601 16 - кожний L´ є однаковим або різним і означає водень або C1-2 алкільну, C1-2 галоалкільну, C1-2 гідроксіалкільну або C1-2 аміноалкільну групу; фенільна, гетероарильна, гетероциклільна групи в A і A´ є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, C1-4 алкілу, C1-4 алкокси, C1-4 галоалкілу й C1-4 галоалкокси. Подальшими кращими сполуками винаходу є ті, у яких: 1 - R означає галоген, C1-4 алкіл, C1-2 алкокси або залишок -A, -A-A´, -A-Het-A´, -A-L-A´, -A-Het-LA´, -A-L-Het-A´, -A-Het-L-Het´-A´ або -A-Het-L-Het´L´; 2 - R означає водень, галоген, C1-4 алкіл, C1-4 алкокси, C1-4 галоалкіл, C1-4 галоалкокси або залишок -Het-L-A´ або -Het-L-Het´-L´; 3 - R означає водень або C1-2 алкіл; 4 - R означає водень, галоген або C1-4 алкіл; 5 - R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси або C1-4 аміноалкіл; 6 - R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси або C1-4 аміноалкіл; - n приймає значення нуль або 1; - кожна група A є однаковою або різною й означає фенільну або 5-6-членну гетероарильну групу, і необов'язково конденсована з додатковою фенільною, 5-6-членною гетероарильною або 5-6членною гетероциклільною групою; - кожна група A´ є однаковою або різною й означає неконденсований феніл, 5-6-членний гетероарил або 5-6-членний гетероцикліл; - кожний Het і Het´ є однаковим або різним і означає -O- , -S- або -NR´-, де R´ означає водень або C1-2 алкіл; - кожний L є однаковим або різним і означає C1-4 алкілен; і - кожний L´ є однаковим або різним означає водень або C1-2 алкільну, C1-2 галоалкільну або C1-2 гідроксіалкільну групу; фенільна, гетероарильна, гетероциклільна групи в A і A´ є незаміщеними або заміщені 1, 2 або 3 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, C1-4 алкілу, C1-4 алкокси, C1-4 галоалкілу й C1-4 галоалкокси. Подальшими кращими сполуками винаходу є сполуки, у яких: 1 - R означає галоген, C1-4 алкіл, C1-2 алкокси, / / / / A, -A-A , -A-O-L-A або -A-O-L-Het -L ; 2 - R означає водень, C1-4 галоалкокси або за/ / / лишок -O-L-A або -O-L-Het -L ; 3 - R означає водень; 4 - R означає C1-2 алкіл; - n приймає значення нуль або 1; 5 - R означає водень або C1-4 алкіл; 6 - R означає водень, C1-4 алкіл, C1-4 галоалкіл, C1-4 алкокси, C1-4 аміноалкіл або -CO-X, де × озна/ / // чає -OR , -NR R або 5-6-членну гетероциклільну групу, яка є незаміщеною або заміщена C1-2 алкі/ // льною групою, і R і R є однаковими або різними й означають водень або C1-2 алкіл; - кожна група A є однаковою або різною й означає неконденсовану фенільну або 5-6-членну гетероарильну групу або означає фенільне кільце, 17 94601 конденсоване з додатковою фенільною, 5-6членною гетероарильною або 5-6-членною гетероциклільною групою, зазначена група A є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, гідрокси, C1-4 алкілу й C1-4 алкокси; / - кожна A є однаковою або різною й означає незаміщену 5-6-членну гетероарильну або гетероциклільну групу; - кожний Het´ є однаковим або різним і означає -O- або -NR´-, де R´ означає водень або C1-2 алкіл; - кожний L є однаковим або різним і означає метилен, н-етилен або н-пропілен; і / - кожний L є однаковим або різним і означає водень, C1-2 алкіл, C1-2 галоалкіл, C1-2 гідроксіалкіл або C1-2 аміноалкіл. Звичайно в цих подальших кращих сполуках / / винаходу, R1 означає -A, -A-A , -A-O-L-A або -A-O/ / L-Het -L , і кожна група A означає неконденсовану фенільну групу, або означає фенільну групу, конденсовану з додатковою фенільною, 5-6-членною гетероарильною або 5-6-членною гетероциклільною групою. Подальшими кращими сполуками винаходу є похідні хіназоліну формули (Ia) і їх фармацевтично прийнятні солі: N N N 18 N 4 (R )n N N HN (Ib) (R')m N N де: 4 - кожний R є однаковим або різним і означає галоген, C1-4 алкіл або C1-4 алкокси, переважно C1-4 алкіл, більш краще C1-2 алкіл; - n приймає значення 0, 1 або 2; / - кожний R є однаковим або різним і означає галоген, C1-4 алкіл або C1-4 алкокси, переважно C1-2 алкокси; і - m приймає значення 0, 1 або 2. Подальшими кращими сполуками винаходу є похідні хіназоліну формули (Ic) і їх фармацевтично прийнятні солі. N 4 (R )n HN N N (Ic) (R'')m N HN (Ia) 1 R 2 N N де: 1 - R означає галоген, C1-4 алкіл, C1-2 алкокси, A, -A-A´, -A-O-L-A´ або -A-O-L-Het´-L´; 2 - R означає водень, C1-4 галоалкокси або залишок -O-L-A´ або -O-L-Het´-L´; - кожна група A є однаковою або різною й означає феніл, 5-6-членний гетероарил або феніл, конденсований з додатковою фенільною, 5-6членною гетероарильною або 5-6-членною гетероциклільною групою, зазначена група A є незаміщеною або заміщена 1 або 2 незаміщеними замісниками, які є однаковими або різними й вибрані з галогену, C1-4 алкілу й C1-2 алкокси; - кожна група A´ є однаковою або різною й означає незаміщену 5-6-членну гетероарильну або гетероциклільну групу; - кожний Het´ є однаковим або різним і означає -O- або -NR´-, де R´ означає водень або C1-2 алкіл; - кожний L є однаковим або різним і означає метилен, н-етилен або н-пропілен; і - кожний L´ є однаковим або різним і означає водень, C1-2 алкіл або C1-2 гідроксіалкіл. Подальшими кращими сполуками винаходу є похідні хіназоліну формули (Ib) і їх фармацевтично прийнятні солі R N де: 4 - кожний R є однаковим або різним і означає галоген, C1-4 алкіл або C1-4 алкокси, переважно C1-4 алкіл, більш краще C1-2 алкіл; - n приймає значення 0, 1 або 2; і // / / / / - R означає -A , -Het-A , -L-A , -Het-L-A , -L-Het/ / / / / / A , -Het-L-Het -A або -Het-L-Het -L , де A , Het, L, / / Het і L визначені вище. Особливо кращі сполуки формули (I) включають: 1. (6-Йод-хіназолін-4-іл)-(4-[1,2,4]триазол-1-ілфеніл)-амін. 2. (6-трет-Бутил-хіназолін-4-іл)-(4[1,2,4]триазол-1-іл-феніл)-амін. 3. [7-(3-Хлор-пропокси)-6-метокси-хіназолін-4іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін. 4. [6-Метокси-7-(3-морфолін-4-іл-пропокси)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін. 5. [6-(3,4-Дифтор-феніл)-хіназолін-4-іл]-(4[1,2,4]триазол-1-іл-феніл)-амін. 6. [6-(4-Хлор-3-фтор-феніл)-хіназолін-4-іл]-(4[1,2,4]триазол-1-іл-феніл)-амін. 7. [6-(3-Фтор-4-метокси-феніл)-хіназолін-4-іл](4-[1,2,4]триазол-1-іл-феніл)-амін. 8. [6-(4-Етокси-3-фтор-феніл)-хіназолін-4-іл](4-[1,2,4]триазол-1-іл-феніл)-амін. 9. {6-[3-Фтор-4-(2-метоксі-етокси)-феніл]хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)-амін. 10. [6-(3,4-Диметокси-феніл)-хіназолін-4-іл]-(4[1,2,4]триазол-1-іл-феніл)-амін. 11. [6-(3,4-Діетокси-феніл)-хіназолін-4-іл]-(4[1,2,4]триазол-1-іл-феніл)-амін. 12. {6-[4-(2-Диметиламіно-етокси)-феніл] 19 хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)-амін. 13. {6-[4-Піридин-4-ілметокси)-феніл]хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)-амін. 14. [6-(4-Морфолін-4-іл-феніл)-хіназолін-4-іл](4-[1,2,4]триазол-1-іл-феніл)-амін. 15. [6-(2,3-Дигідро-бензо[1,4]діоксин-6-іл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін. 16. [6-(2-Метокси-піримідин-5-іл)-хіназолін-4іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін. 17. (6-Тіофен-2-іл-хіназолін-4-іл)-(4[1,2,4]триазол-1-іл-феніл)-амін. 18. [6-(4-Метил-тіофен-2-іл)-хіназолін-4-іл]-(4[1,2,4]триазол-1-іл-феніл)-амін. 19. (6-Фуран-2-іл-хіназолін-4-іл)-(4-[1,2,4триазол-1-іл-феніл)-амін. 20. {6-[4-(2-Диметиламіно-етокси)-3-фторфеніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)амін. 21. (6-Бром-хіназолін-4-іл)-(4-[1,2,4]триазол-1іл-феніл)-амін. 22. N-(2-{2-Фтор-4-[4-(4-[1,2,4]триазол-1-іл/ / феніламіно)-хіназолін-6-іл]-фенокси}-етил)-N,N ,N триметил-етан-1,2-діамін. 23. [6-(3-Ізопропокси-4-метокси-феніл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін. 24. [6-(4-Фтор-3-ізопропокси-феніл)-хіназолін4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін. 25. {6-[3-Фтор-4-(3-піролідин-1-іл-пропокси)феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)амін. 26. {6-[3-Фтор-4-(3-морфолін-4-іл-пропокси)феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)амін. 27. [6-(3,4-Диметокси-феніл)-хіназолін-4-іл]-(2метил-4-[1,2,4]триазол-1-іл-феніл)-амін. 28. 1-(4-{6-[3-Фтор-4-(2-метоксі-етокси)-феніл]хіназолін-4-іламіно}-феніл)-5-метил-1H[1,2,4]триазол-3-карбонову кислоту. 29. 1-{4-[6-(3,4-Диметокси-феніл)-хіназолін-4іламіно]-феніл}-5-метил-1H-[1,2,4]триазол-3карбонову кислоту. 30. Диметиламід 1-{4-[6-(3,4-диметокси-феніл)хіназолін-4-іламіно]-феніл}-5-метил-1H[1,2,4]триазол-3-карбонової кислоти. 31. Метиламід 1-(4-{6-[3-фтор-4-(2-метоксіетокси)-феніл]-хіназолін-4-іламіно}-феніл)-5метил-1H-[1,2,4]триазол-3-карбонової кислоти. 32. Диметиламід 1-(4-{6-[3-фтор-4-(2-метоксіетокси)-феніл]-хіназолін-4-іламіно}-феніл)-5метил-1H-[1,2,4]триазол-3-карбонової кислоти. 94601 20 33. (6-Бром-хіназолін-4-іл)-(2-метил-4[1,2,4]триазол-1-іл-феніл)-амін. 34. [1-(4-{6-[3-Фтор-4-(2-метоксі-етокси)феніл]-хіназолін-4-іламіно}-феніл)-5-метил-1H[1,2,4]триазол-3-іл]-(4-метил-піперазин-1-іл)метанон. 35. 2-Метокси-4-[4-(4-[1,2,4]триазол-1-ілфеніламіно)-хіназолін-6-іл]-фенол. 36. 2-Метокси-5-[4-(4-[1,2,4]триазол-1-ілфеніламіно)-хіназолін-6-іл]фенол. 37. {6-[3-Фтор-4-(2-метоксі-етокси)-феніл]хіназолін-4-іл}-(2-метил-4-[1,2,4]триазол-1-ілфеніл)-амін. і їх фармацевтично прийнятні солі. Сполуки формули (I), які містять один або декілька хіральних центрів можуть застосовуватися в енантіомерно або діастереомерно чистому вигляді, або у вигляді суміші ізомерів. З метою уникнення невизначеності, сполуки формули (I) можуть, бажано, використовуватися у вигляді сольватів. Далі, з метою уникнення невизначеності, сполуки винаходу можуть застосовуватися в будь-якій таутомерній формі. Використовуваний тут термін, фармацевтично прийнятна сіль означає сіль із фармацевтично прийнятною кислотою або основою. Фармацевтично прийнятні кислоти включають як неорганічні кислоти, такі як соляна, сірчана, фосфорна, пірофосфорна, бромисто-воднева або азотна кислота й органічні кислоти, такі як лимонна, фумарова, малеїнова, яблучна, аскорбінова, бурштинова, винна, бензойна, оцтова, метансульфонова, етансульфонова, бензолсульфонова або птолуолсульфонова кислота. Фармацевтично прийнятні основи включають гідроксиди лужного металу (наприклад, натрію або калію) і лужноземельного металу (наприклад, кальцію або магнію) і органічні основи, такі як алкіламіни, аралкіламіни й гетероциклічні аміни. Сполуки винаходу можуть бути одержані, наприклад, відповідно до наступних реакційних схем. 3 5 6 У наступних схемах, групи R , R і R , для ясності, показані у вигляді атомів водню. Подібним чином, 4 групи R упущені (тобто, n приймає значення нуль). Аналогічні сполуки, де один або декілька 3 5 6 радикалів R , R і R є іншими, ніж водень і/або де n приймає значення 1 або 2 можуть бути одержані шляхом використання відповідним чином функціоналізованих похідних 4-триазоліланіліну, які несуть 3 4 5 6 придатні замісники в положеннях R , R , R і R . 21 94601 22 Схема 1 H O R1 O O R1 NH2 O N R2 N N R2 (III) (II) N N N N i) хлорування я R1 N ii) анілін, розчинник N R2 (I) Відповідно до схеми 1, перетворення сполук формули (II) на сполуки формули (I) завершається перетворенням 4-гідроксигрупи сполук формули (II) на придатну групу, яка відходить (наприклад, хлор) з використанням реагенту, такого як тіонілхлорид, як розчинник з добавкою каталітичного активатора (наприклад, диметилформаміду), і наступної реакції з 4-триазоліланіліном у придатному розчинником (наприклад, ацетонітрилі). Відповідно до схеми 1, перетворення сполук формули (III) у сполуки формули (II) добре відоме спеціалісту в даній галузі техніки, і може бути без зусиль виконано з використанням формаміду як розчинника і при підвищеній температурі (наприклад, при нагріванні зі зворотним холодильником). 1 Сполуки формули (I), у якій R означає -A, -AA´, -A-Het-A´, -A-L-A´, -A-Het-L-A´, -A-L-Het-A´, -AHet-L-Het´-A´ або -A-Het-L-Het´-L´ можуть бути альтернативно одержані шляхом реакції, показаної на схемі 2 нижче. Реакцію звичайно проводять у присутності оцтової кислоти при температурі близько 120°C і протягом близько 1 години. Схема 2 N N N N A 4-триазоліл-анілін N R2 N N (IV) Сполуки формули (IV), використовувані як вихідна речовина в схемі 2, можуть бути одержані за допомогою однієї з реакцій, зображених на схемі 3 нижче. На схемі 3, групи S1 і S2 можуть являти захисні групи, такі як бензильні групи, які можна замістити бажаними групами за допомогою відомих з рівня техніки методик наступної реакції. Зняття захисних груп можна проводити до або після перетворення сполуки формули (IV) на сполуки формули (I). Відповідно до схеми 3, обробка сполук формули (VIII) металоорганічним реагентом (VII), або обробка сполук формули (VI) металоорганічним реагентом (V), без зусиль проводиться в придатному розчиннику (такому, як тетрагідрофуран, диметилформамід, толуол або пропан-2-ол) і при прийнятній температурі (наприклад, у діапазоні від температури навколишнього середовища до температури флегми). Реакцію зручно виконувати при паладієвому каталізі (наприклад, 10 мол.% A R2 N N (I) трис(дибензиліденацетон)дипаладію (II), 10 мол.% дихлорбіс(трифенілфосфін)-паладію (0), 1 мол.% хлориду біс(бензонітрил)паладію (II) або 0.02 мол.% тетракіс(трифенілфосфін)паладію (0)) у присутності органічної основи (наприклад триетиламіну) або неорганічної основи (наприклад 2 н. карбонату натрію або фосфату калію). У тих випадках, коли реагент (VII) являє собою органостанан (наприклад, M = SnBu3), як очевидно для спеціаліста в даній галузі техніки, реакція являє собою приклад сполучення Стілле, при здійсненні якого може бути корисним застосування додаткових добавок (наприклад, хлориду літію), оксиду срібла, і яке без зусиль здійснюється в толуолі при температурі флегми. У тих випадках, коли реагент (VII) являє собою похідну боронової кислоти, як очевидно для спеціаліста в даній галузі техніки, реакція являє собою приклад сполучення Сузукі-Міяури, що може без зусиль здійснюватися при 60°C у пропан-2-олі. 23 94601 Як очевидно спеціалісту в даній галузі техніки, група × у зображених на схемі 3 сполуках являє 24 собою придатну групу, яка відходить, таку як I або Br. Схема 3 N S1 X + R2 N (VIII) N N + N (V) S2 M Pd каталіз (VII) M R2 A N S1 Pd каталіз A S2 X (VI) Вихідні речовини у вищенаведеній реакційній схемі є відомими речовинами, або можуть бути одержані за аналогією з відомими способами. Сполуки даного винаходу є терапевтично корисними. Даний винахід, отже, пропонує похідну хіназоліну формули (I), яка визначена вище, або її фармацевтично прийнятну сіль, для застосування для лікування людей або тварин. Також пропонується фармацевтична композиція, яка включає похідну хіназоліну формули (I), яка визначена вище, або її фармацевтично прийнятну сіль, і фармацевтично прийнятний носій або розріджувач. Зазначена фармацевтична композиція звичайно містить аж до 85 мас.% сполуки винаходу. Більш звичайно, вона містить аж до 50 мас.% сполуки винаходу. Кращі фармацевтичні композиції є стерильними й апірогенними. Далі, пропоновані винаходом фармацевтичні композиції звичайно містять сполуки винаходу, які є по суті чистим оптичним ізомером. Як роз'яснено вище, сполуки винаходу перешкоджають зараженню вірусами flaviviridae. Даний винахід, отже, пропонує застосування похідної хіназоліну формули (I), яка визначена вище, або її фармацевтично прийнятної солі, для приготування лікарського засобу для лікування або запобігання зараження вірусами flaviviridae. Також пропонується спосіб лікування хворого, який страждає від або сприйнятливого до зараження вірусами flaviviridae, який включає введення зазначеному хворому ефективної кількості похідної хіназоліну формули (I) або її фармацевтично прийнятної солі. Сімейство flaviviridae складається із трьох родів. Вони являють собою гепацивіруси, флавівіруси й пестивіруси. Сполуки винаходу є активними для лікування або запобігання зараження гепацивірусами, флавівірусами або пестивірусами. Типове зараження пестивірусами, яке можна лікувати за допомогою сполук винаходу, включає вірус бичачої вірусної діареї, вірус класичної чуми свиней і вірус прикордонної хвороби овець. Типове зараження флавівірусами, яке можна лікувати за допомогою сполук винаходу, включає вірус жовтої пропасниці, вірус пропасниці денге, Вірус японського енцефаліту та вірус кліщового де A = феніл або 5-6 членний гетероарил X= Br або I M=метал S1 N A S2 R2 (IV) N NMe2 енцефаліту. Типове зараження гепацивірусами, яке можна лікувати за допомогою сполук винаходу, включає вірус гепатиту С. Сполуки даного винаходу є особливо активними відносно гепатиту C. Отже, зазначеним флавівірусом є вірус гепатиту С. Сполуки винаходу можуть вводитися в різні лікарські форми. Таким чином, вони можуть вводитися перорально, наприклад, у вигляді таблеток, пастилок, коржів, водних або масляних суспензій, диспергувальних порошків або гранул. Сполуки винаходу можуть також вводитися парентерально або підшкірно, внутрішньовенно, внутрішньом'язово, внутрішньогрудинно, трансдермально або за допомогою інфузійних методик. Сполуки можуть також вводитися у вигляді супозиторіїв. Сполуки винаходу звичайно вводять у форму для введення разом з фармацевтично прийнятним носієм або розріджувачем. Наприклад, тверді пероральні форми можуть містити, разом з активною сполукою, розріджувачі, наприклад, лактозу, декстрозу, сахарозу, целюлозу, кукурудзяний крохмаль або картопляний крохмаль; змазку, наприклад кремнезем, тальк, стеаринову кислоту, стеарат магнію або кальцію і/або поліетиленгліколі; сполучні речовини; наприклад крохмаль, гуміарабік, желатин, метилцелюлозу, карбоксиметилцелюлозу або полівінілпіролідон; дезагрегувальні агенти, наприклад крохмаль, альгінову кислоту, альгіинати або натрійкрохмальгліколят; шипучі суміші; барвники; замінники цукру; змочувальні речовини, такі, як лецитин, полісорбати, лаурилсульфати; і, загалом, нетоксичні й фармакологічні інертні речовини, використовувані у фармацевтичних препаратах. Такі фармацевтичні препарати можна виготовляти відомими способами, наприклад, за допомогою змішування, гранулювання, таблетування, покриття цукром, або за допомогою процесу нанесення покриттів у вигляді плівки. Рідкі дисперсії для перорального введення можуть являти сиропи, емульсії й суспензії. Сиропи можуть містити як носії, наприклад, сахарозу або сахарозу із гліцерином і/або маніт і/або сорбіт. Суспензії й емульсії можуть містити як носій, 25 наприклад, природну камедь, агар, альгінат натрію, пектин, метилцелюлозу, карбоксиметилцелюлозу або полівініловий спирт. Суспензія або розчини для внутрішньом’язових ін'єкцій можуть містити, разом з активною сполукою, фармацевтично прийнятний носій, наприклад стерильну воду, маслинову олію, етилолеат, гліколі, наприклад пропілeнгліколь, і при бажанні, прийнятну кількість гідрохлориду лідокаїну. Розчини для ін'єкцій або інфузій можуть містити як носій, наприклад, стерильну воду або, переважно, вони можуть знаходитися у вигляді стерильних водних ізотонічних сольових розчинів. Сполуки даного винаходу можуть застосовуватися в сполученні з відомими антивірусними агентами. Кращими відомими антивірусними агентами щодо цього є інтерферон і рибавірин, і їх похідні, які є відомими препаратами для лікування гепатиту C (Clinical Microbiology Reviews, Jan. 2000, 67-82). Тому зазначений лікарський засіб звичайно додатково включає інтерферон і/або рибавірин або їх похідні. Далі, даний винахід пропонує фармацевтичну композицію, яка включає: (а) похідну хіназоліну формули (I), яка визначена вище, або її фармацевтично прийнятну сіль; (b) інтерферон або його похідну і/або рибавірин або його похідну; і (c) фармацевтично прийнятний носій або розріджувач. Також пропонується продукт, який містить: (a) похідну хіназоліну формули (I), яка визначена вище, або її фармацевтично прийнятну сіль; і (b) інтерферон або його похідну і/або рибавірин або його похідне, для роздільного, одночасного або послідовного застосування для лікування людей або тварин. Кращою похідною інтерферону є PEGінтерферон. Кращою похідною рибавірину є вірамідин. Крім того, як встановлено, сполуки винаходу й інтерферон синергічно впливають один на одного. Тому звичайно компонент (b) вищевказаної(-ого) фармацевтичної композиції або продукту являє собою інтерферон, більш звичайно, інтерферон типу I, переважно інтерферон α. Переважно, інтерферон являє собою інтерферон α2b, який звичайно є пегильованим, наприклад, PEG-Intron (Schering Plough Corp), або продукт на основі злитих білків, такий як Albuferon (Human Genome Sciences). Інтерферон α2b можна також вводити в препарати для контрольованого вивільнення. Іншим кращим інтерфероном є інтерферон α2a. Переважно, інтерферон α2a є пегильованим, наприклад, являє інтерферон Pegasys (Roche) і Roferon A (Roche). Іншим кращим інтерфероном є інтерферон α8 (Riotech). Іншим кращим інтерфероном є інтерферон alfacon-1 (Intermune), переважно пегильований інтерферон alfacon-1. В іншому варіанті здійснення, інтерферон являє собою інтерферон β, переважно інтерферон β1a (Serono SA). В іншому варіанті здійснення, інтерферон яв 94601 26 ляє собою інтерферон гама (Intarcia). Переважно, інтерферон міститься в препараті або пристрої, який дозволяє вивільнятися інтерферону контрольованим способом. Прикладами є методики імплантації DUROS, розроблені ALZA Corp. і методики доставки лікарських засобів SABER, розроблені Durect Corp. Даний винахід також пропонує застосування похідної хіназоліну формули (I), яка визначена вище, або її фармацевтично прийнятної солі, для приготування лікарського засобу, застосовуваного для лікування або запобігання зараження HCV, шляхом спільного введення зазначеного інтерферону або похідної інтерферону. Також пропонується застосування зазначеного інтерферону або похідної інтерферону, для приготування лікарського засобу, застосовуваного для лікування або запобігання зараження HCV, шляхом спільного введення похідної хіназоліну формули (I), яка визначена вище, або її фармацевтично прийнятної солі. Пацієнту вводять терапевтично ефективну кількість сполуки винаходу й, при необхідності, зазначеного інтерферону або похідної інтерферону. Типова доза знаходиться в діапазоні від близько 0.01 до 100 мг на кг ваги тіла, відповідно до активності визначеної сполуки, віку, ваги й режиму суб'єкта, який підлягає лікуванню, типу та серйозності хвороби й частоти та шляху введення. Переважно, добові дози знаходяться у діапазоні від 0.05 до 16 мг на кг ваги тіла, більш краще, від 0.05 до 1.25 мг на кг ваги тіла. Сполуки даного винаходу можна також використовувати з іншими противірусними засобами. Кращими противірусними засобами в цьому смислі є циклоспорини, інтерлейкін 2, інтерлейкін 6, інтерлейкін 12, інтерферируюча РНК або антисмислова РНК, застосування яких для лікування гепатиту C відоме. Сполуки даного винаходу можуть також використовуватися в сполученні з іншими інгібіторами послідовностей нуклеїнової кислоти HCV або мішеней HCV протеїнів. Кращі мішені HCV протеїну включають HCV серин-протеазу, як проілюстровано за допомогою VX-950 від Vertex і SCH503034 від Scering Plough, і інгібітори протеази й HCV полімерази, як проілюстровано за допомогою HCV-796 від Wyeth, HCV гелікази, HCV NS4B і HCV NS5A. Далі, сполуки даного винаходу можуть також використовуватися в сполученні з інгібіторами входу HCV у клітину або інгібітором взаємодії HCV із протеїнами клітини-хазяїна. Нижченаведені приклади ілюструють винахід. Вони, однак, не обмежують винахід будь-яким чином. Щодо цього, важливо розуміти, що окремі аналізи, використовувані в експериментальному розділі, призначені тільки для вказівки антивірусної активності. Багато аналізів придатні для визначення такої активності, і тому не є визначальним негативний результат, який одержаний у будьякому окремому аналізі. ПРИКЛАДИ Матеріали та методи: Всі температури наведені в °C. Тонкошарову хроматографію (ТШХ) проводили на покритій Si 60G пластмасовій пластині з УФ254 індикатором 27 (Polygram). Всі спектри ЯМР, якщо не зазначено 6 інакше, одержані на 250МГц в d -ДМСО, хімічне зусилля виражене в м.част., константи спінспінової взаємодії (J) наведені для видимих мультиплетностей. “Упарювання” має на увазі, що розчинник видаляли у вакуумі. Всі тверді речовини сушили при 40°C. УМОВИ РХ-МС Зразки аналізували на мас-спектрометрі MicroMass ZMD, використовуючи электророзпилення з одночасним детектуванням позитивних негативних іонів. Колонка: Synergi Hydro-RP, 30 × 4.6 мм I.D, 4 мкм. Градієнт: 95:5 - 5:95 об./об. H2O/CH3CN + 0.05% мурашиної кислоти протягом 4.0 хв., утримання 3 хв., повернення до 95:5 об./об. H2O/CH3CN + 0.05% мурашиної кислоти протягом 0.2 хвилини й утримання при 95:5 об./об. H2O/CH3CN + 0.05% мурашиної кислоти протягом 3 хвилин. Детектування: PDA 250 - 340 нм. Швидкість потоку: 1.5 мл/хв. Час утримання (rt), у всіх випадках, виражений у хвилинах. Експериментальна частина: Проміжна сполука 1: 2-Аміно-5-йодбензонітрил Одержували методом, описаним А. Росовскім і H. Ченом (A. Rosowsky & H. Chen) в J. Org. Chem. 2001, 66, 7522-7526. 1 H ЯМР (CDCl3) 7.64 (1H, s), 7.55 (1H, dd, J 8.5, 2.5Гц), 6.53 (1H, d, J 8.5Гц), 4.66 (2H, br s); РХМС rt 2.42 m/z 243 ЕР Проміжна сполука 2: N'-(2-Ціано-4-йод-феніл)N,N-диметил-формамідин Розчин 2-аміно-5-йодбензонітрилу (50 г, 0.2 моль) у ДМФА-ДМА (2.5 екв., 6 мл) нагрівали до 120 протягом 2 годин. Надлишок ДМФА-ДМА видаляли шляхом упарювання з одержанням зазначеної в заголовку сполуки у вигляді в'язкого коричневого масла (61 г, кількісний). При стоянні масло твердіє при 4°. 1 H ЯМР (CDCl3) 7.79 (1H, d, J 1.9Гц), 7.65 (1H, dd, J 1.9, 8.5Гц), 7.57 (1H, s), 6.70 (1H, d, J + 8.2Гц), 3.08 (6H, s); РХ-МС rt 2.1 M/z 300 ЕР Проміжна сполука 3: 2-Аміно-5бромбензонітрил Розчин 2-амінобензонітрилу (11.8 г, 0.1 моль) в AcOH (120 мл) обробляли бромідом амонію (10.3 г, 0.105 моль) і перекисом водню (10.2 мл, 35% у воді, 0.105 моль). Цю суміш перемішували при кімнатній температурі протягом близько 24 годин доти, поки РХМС аналіз не показував завершення реакції. Суміш упарювали для видалення AcOH, і залишок перемішували з 30%-вим водним розчином NaOH доти, поки він не ставав лужним. Одержану в результаті тверду речовину видаляли шляхом фільтрування й промивали водою перед сушінням. Тверду речовину потім розчиняли в надлишку ДХМ. Розчин упарювали до початку випадання осаду й потім залишали стояти до завершення кристалізації. Одержану в результаті тверду речовину видаляли шляхом фільтрування й промивали невеликою кількістю ДХМ. Це приво 94601 28 дило до бажаної сполуки у вигляді кремової кристалічної твердої речовини (19.2 г, 97%). 1 H ЯМР 7.61 (1H, d, J 2.5Гц), 7.43 (1H, dd, J 9, 2.5Гц), 6.75 (1H, d, J 9Гц), 6.28 (2H, br s); РХ-МС rt 2.24 Проміжна сполука 4: N'-(4-Бром-2-ціанофеніл)-N,N-диметил-формамідин Розчин 2-аміно-5-бромбензонітрилу (10.25 г, 52 ммоль) у ДМФА-ДМА (20 мл) нагрівали зі зворотним холодильником протягом 1 години. Суміш охолоджували й упарювали досуха перед розтиранням з трет-бути-метиловим-ефіром (TБМЕ) (10 мл). Потім додавали бензин (30 мл), тверду речовину затирали, і залишали стояти протягом 1 години. Твердий продукт відфільтровували й промивали TБМЕ/бензином (1:2) одержуючи тверду кристалічну речовину (11.95 г, 91.2%). 1 H ЯМР (CDCl3) 7.55 (1H, d, J 2Гц), 7.51 (1H, s), 7.41 (1H, dd, J 2, 9Гц), 6.75 (1H, d, J 9Гц), 3.01 (6H, s); РХ-МС rt 1.95 m/z 252/254 ЕР Проміжна сполука 5: 2-Аміно-5-(4,4,5,5тетраметил-[1,3,2]діоксаборолан-2-іл)-бензонітрил Суміш PdCl2 (dppf) (3.35 г), ацетату калію (12.07 г) і біс(пінаколато)бору (12.48 г) у сухому ДМФА (80 мл) обробляли проміжною сполукою 1 (10 г) і нагрівали до 80° протягом 4 годин. Охолоджену суміш розподіляли між водою (400 мл) і ДХМ (400 мл). Водну фазу далі екстрагували ДХМ (2 × 100 мл) і об'єднані органічні фази сушили й упарювали. Залишок очищали за допомогою хроматографії на силікагелі (90 г, РХСТ) за допомогою 10-30%-вого EtOAc у бензині як елюант. Упарювання фракцій, які містять продукт і розтирання з додатковою кількістю бензину давало бажаний продукт у вигляді білої твердої речовини (6.91 г, 69%). 1 H ЯМР (CDCl3) 7.87 (1H, s), 7.72 (2H, d, J 8.21), 6.7 (1H, d, J 8.2Гц), 4.57 (2H, br s), 1.31 (12H, + s); РХ-МС rt 2.84 m/z 244 ЕР Проміжна сполука 6: N'-[2-Ціано-4-(4,4,5,5тетраметил-[1,3,2]діоксаборолан-2-іл)-феніл]-N,Nдиметил-формамідин Суспензію проміжної сполуки 5 (750 мг) у ДМФА-ДМА (1 мл) нагрівали до 100º під N2 протягом 30 хв і потім охолоджували до кімнатної температури. Розчинник видаляли й залишок очищали за допомогою ТФЕ на силікагелі (5 г) із застосуванням 10%-вого EtOAc у бензині як елюант. Це давало зазначену в заголовку сполуку у вигляді прозорого масла, яке кристалізувалося при стоянні (915 мг, 100%). 1 H ЯМР (CDCl3) 7.98 (1H, s), 7.817 (1H, d, J 8.2Гц), 7.62 (1H, s), 6.92 (1H, d, J 7.6Гц), 3.1 (3H, s), 3.07 (3H, s), 1.33 (12H, s); РХ-МС rt 2.73m/z 300 + ЕР Проміжна сполука 7: 4-(4-Йод-феноксиметил)піридин Суміш 4-йодфенолу (1 г) K2CO3 (порошкоподібний, 1.88 г) і 4-піколілхлориду (822 мг) в ацетоні (15 мл) нагрівали зі зворотним холодильником протягом 16 годин. Додавали додаткову порцію 4піколілхлориду (411 мг) і нагрівання продовжували протягом 6 годин. Охолоджували, фільтрували, і фільтрат адсорбували на силікагелі й очищали за допомогою РХСТ (35 г Si, градієнтне елююванння 29 протягом 30 хвилин 10-50%-вим EtOAc у бензині). Це давало, при упарюванні, білу тверду речовину (710 мг, 50%). 1 H ЯМР (CDCl3) 8.64 (2H, d, J 5.69Гц), 7.6 (2H, d, J 8.85Гц), 7.35 (2H, d, J 5.69Гц), 6.76 (2H, d, J 8.85Гц), 5.08 (2H, s) Проміжна сполука 8: 4-Бром-1,2-діетоксибензол До суміші, що добре перемішується, діетоксибензолу (500 мг) і броміду амонію (323 мг, 1.1 екв.) в MeCN (20 мл) додавали оксон (2.03 г, 1.1 екв.). Цю суспензію перемішували при кімнатній температурі протягом 4 годин і потім фільтрували, а фільтрат концентрували з одержанням зазначеної в заголовку сполуки (723 мг, > 90%), яку використовували без додаткового очищення. 1 H ЯМР (CDCl3) 6.98 (2H, m), 6.73 (1H, d, J 8.85Гц), 4.05 (4H, m), 1.44 (6H, m); РХ-МС rt 2.48 + m/z 279 ЕР Проміжна сполука 9: 4-Бром-1-(2-брометокси)2-фторбензол До розчину, що перемішували, 4-бром-2фторфенолу (3.5 г, 18.3 ммоль, 1 екв.), 2брометанолу (3.44 г, 27.5 ммоль, 1.5 екв.) і трифенілфосфіну (7.21 г, 27.5 ммоль, 1.5 екв.) у ТГФ (50 мл) при 0°C, під азотом, по краплях за допомогою шприца додавали DEAD (4.78 г, 27.5 ммоль, 1.5 екв.). Реакційній суміші потім дозволяли нагрітися до кімнатної температури. Через 2 години реакційну суміш упарювали досуха у вакуумі, і кремовий залишок поміщали на верх короткої колонки із силікагелем і промивали сумішшю 9:1 уайтспірит:EtOAc (3 × 50 мл). Фільтрат концентрували з одержанням зазначеної в заголовку сполуки у вигляді прозорого масла (5.28 г, 97%). 1 H-ЯМР (ДМСО-d6) 3.57 (t, 2H), 4.26 (t, 2H), 6.80 (m,1H), 7.12 (m, 1H), 7.19 (m, 1H). РХ-МС rt 2.90 m/z, не іонна. Проміжна сполука 10: N-[2-(4-бром-2фторфеноксі)етил]-N’,N’,N'-триметилетан-1,2діамін Суміш проміжної сполуки 9 (3 г, 10 ммоль, 1 екв.), N,N,N’-триметилетилендиаміну (1.54 г, 15 ммоль, 1.5 екв.) і карбонату калію (2.09 г, 15 ммоль, 1.5 екв.) в ацетоні нагрівали зі зворотним холодильником. Через 1 годину реакційній суміші дозволяли охолонути до кімнатної температури й потім фільтрували. Фільтрат упарювали у вакуумі з одержанням блідо-жовтогарячого сиропу. Сироп очищали за допомогою колонкової флешхроматографії, елююючи спочатку 100% CH2Cl2 і потім 100:8:1 CH2Cl2:EtOH:NH3. Зазначену в заголовку сполуку виділяли у вигляді блідожовтогарячого сиропу (2.24 г, 70%). Rf = 0.12 (100:8:1 CH2Cl2:EtOH:NH3). 1 H-ЯМР (ДМСО-d6) 2.41 (s, 3H), 2.57 (s, 6H), 2.82 (m, 4H), 2.91 (t, 2H), 4.14 (t, 2H), 6.89 (m, 1H), 7.21 (m, 1H), 7.27 (m, 1H). РХ-МС rt 1.79 m/z 320 + ЕР Проміжна сполука 11: N’-(3-ціано-4’-{2-[(2диметиламіноетил)метиламіно]етокси}-3’фторбіфеніл-4-іл)-N,N-диметилформамідин Суміш проміжної сполуки 10 (950 мг, 2.98 ммоль, 1 екв.), біс(пінаколато)дибору (1.51 г, 5.95 ммоль, 2 екв.), ацетату калію (1.02 г, 10.43 ммоль, 94601 30 . 3.5 екв.) і PdCl2(dppf)2 CH2Cl2 (245 мг, 0.30 моль, 0.1 екв.) у ДМФА (10 мл) нагрівали під азотом при 80°C. Через 16 годин реакційній суміші дозволяли охолонути до кімнатної температури й упарювали у вакуумі з одержанням коричневого залишку. Залишок екстрагували EtOAc (3 × 20 мл) а екстракти поєднували й упарювали у вакуумі досуха з одержанням коричневого масла (1.09 г). Суміш масла (1.09 г), N’-(2-ціано-4-йодфеніл)-N,Nдиметилформаміду (811 мг, 2.71 ммоль) і тетракіс(трифенілфосфін)паладію (162 мг, 0.14 ммоль) у ДМЕ (10 мл) і насиченому водному розчині Na2CO3 (5 мл) нагрівали зі зворотним холодильником. Через 20 годин реакційній суміші дозволяли охолонути до кімнатної температури й потім упарювали у вакуумі з одержанням коричневого залишку. Залишок очищали за допомогою колонкової флеш-хроматографії, елююючи 800:8:1, 200:8:1 і 100:8:1 CH2Cl2:EtOH:NH3. Зазначену в заголовку сполуку виділяли у вигляді блідокоричневого масла (273 мг, 22%). Rf = 0.08 (100:8:1 CH2Cl2:EtOH:NH3). 1 H-ЯМР (ДМСО-d6) 2.20 (s, 6H), 2.33 (s, 3H), 2.41 (t, 2H), 2.57 (t, 2H), 2.81 (t, 2H), 3.03 (s, 3H), 3.05 (s, 3H), 4.11 (t, 2H), 6.95 (m, 2H), 7.17 (m, 2H), 7.58 (m, 2H), 7.61 (m, 1H). РХ-МС rt 1.86 m/z 412 + ЕР Проміжна сполука 12: 2-Метокси-5-бромфенол Одержували методом, описаним Мейєром (Meyers) і Снайдером (Snyder) в J. Org. Chem, 1993, 58,1, 42. 1 H ЯМР (CDCl3) 7.00 (1H, d, J 2.25Гц), 6.90 (1H, dd, J 8.5, 2.25Гц), 6.66 (1H, d, J 8.75Гц), 5.57 (1H, s), 3.81 (3H, s) Проміжна сполука 13: 5-Бром-2-фторфенол Одержували методом, описаним М. Елліотом (M Elliott), Н. Джанес (N Janes) і Б. Камбаєм (B Khambay) в GB2187731. 1 H ЯМР (CDCl3) 7.08 (1H, m), 6.89 (2H, m), 5.14 (1H, s) Проміжна сполука 14: 4-Бром-2-ізопропокси-1метокси-бензол До розчину проміжної сполуки 12 (279 мг, 1.37 ммоль) у ДМФА (5 мл) додавали карбонат калію (945 мг, 6.85 ммоль) і 2-йодпропан (684 мкл, 6.85 o ммоль). Реакційну суміш перемішували при 90 протягом 4 годин. Аналіз за допомогою РХ-МС показував, що залишалося 20% вихідного фенолу, тому додавали іншу порцію 2-йодпропану (684 o мкл, 6.85 ммоль) і суміш перемішували при 90 протягом ночі. РХ-МС аналіз показував витрату всього вихідного фенолу, тому реакційну суміш фільтрували й фільтрат розбавляли водою (50 мл) і тричі екстрагували етилацетатом. Об'єднані екстракти сушили над сульфатом магнію, фільтрували й упарювали при зниженому тиску одержуючи темне коричневе масло (294 мг, 87%). 1 6 H ЯМР (D -ДМСО) 6.93 (2H, m), 6.68 (1H, d, J 8.75Гц), 4.43 (1H, m), 3.75 (3H, s), 1.31 (6H, d, J 6Гц); РХ-МС rt 2.80 Проміжна сполука 15: 4-Бром-1-фтор-2ізопропокси-бензол До розчину проміжної сполуки 13 (262 мг, 1.37 ммоль) у ДМФА (5 мл) додавали карбонат калію 31 (945 мг, 6.85 ммоль) і 2-йодпропан (684 мкл, 6.85 o ммоль). Реакційну суміш перемішували при 90 протягом 4 годин. Аналіз за допомогою РХМС показував, що залишалося 20% вихідного фенолу, тому додавали іншу порцію 2-йодпропану (684 o мкл, 6.85 ммоль) і суміш перемішували при 90 протягом ночі. РХМС аналіз показував витрату всього вихідного фенолу, тому реакційну суміш фільтрували й фільтрат розбавляли водою (50 мл) і тричі екстрагували етилацетатом. Об'єднані екстракти сушили над сульфатом магнію, фільтрували й упарювали при зниженому тиску, одержуючи темно-коричневе масло (274 мг, 86%). 1 6 H ЯМР (D -ДМСО) 7.00 (1H, dd, J 2.25Гц), 6.92 (2H, m), 4.45 (1H, m), 1.30 (6H, d, J 6.25Гц) РХ-МС rt 2.93 Проміжна сполука 16: 4-Аміно-3'-ізопропокси4'-метокси-біфеніл-3-карбонітрил До розчину проміжної сполуки 14 (294 мг, 1.2 ммоль) у диметоксіетані (4 мл) додавали проміжну сполуку 5 (439 мг, 1.8 ммоль) і, далі, насич. водн. карбонат натрію (2 мл) і тетракіс(трифенілфосфін)паладію (0) (139 мг, 0.12 ммоль). Цю реакційну суміш перемішували при 80° протягом ночі. РХМС аналіз показував витрату вихідної речовини, тому реакційну суміш розбавляли водою й тричі екстрагували дихлорметаном. Об'єднані екстракти сушили над сульфатом магнію, фільтрували й упарювали при зниженому тиску. Колонкова хроматографія (градієнт 0 - 50% EtOAc у петролейному ефірі) приводила до бажаного продукту у вигляді жовтої твердої речовини (137 мг, 40%). 1 H ЯМР (CDCl3) 7.47 (2H, m), 6.94 (2H, m), 6.87 (1H, d, J 9Гц), 6.75 (1H, d, J 8.5Гц), 4.55 (1H, quin, J 6.25Гц), 4.37 (2H, s), 3.81 (3H, s), 1.34 (6H, d, J 6.25 Гц); РХ-МС rt 2.70 Проміжна сполука 17: 4-Аміно-4'-фтор-3'ізопропокси-біфеніл-3-карбонітрил До розчину проміжної сполуки 15 (274 мг, 1.18 ммоль) у диметоксіетані (4 мл) додавали проміжну сполуку 5 (439 мг, 1.8 ммоль) і, далі, насич. водн. карбонат натрію (2 мл) і тетракіс(трифенілфосфін)паладій (0) (139 мг, 0.12 ммоль). Цю реакційну суміш перемішували при 80 протягом ночі. РХМС аналіз показував витрату вихідної речовини, тому реакційну суміш розбавляли водою й тричі екстрагували дихлорметаном. Об'єднані екстракти сушили над сульфатом магнію, фільтрували й упарювали при зниженому тиску. Колонкова хроматографія (градієнт 0 - 50% EtOAc у петролейному ефірі) приводила до бажаного продукту у вигляді жовтої твердої речовини (196 мг, 60%). 1 H ЯМР (CDCl3) 7.41 (2H, m), 6.97 (3H, m), 6.72 (2H, d, J 8Гц), 4.53 (1H, quin, J 6Гц), 4.40 (2H, s), 1.33 (6H, d, J 6Гц); РХ-МС rt 2.86 Проміжна сполука 18: N'-(3-Ціано-3'ізопропокси-4'-метокси-біфеніл-4-іл)-N,N-диметилформамідин Розчин проміжної сполуки 16 (137 мг, 0.41 ммоль) у ДМФА-ДМА (2 мл) перемішували при 80 протягом ночі. РХМС аналіз показував витрату вихідної речовини. Реакційну суміш упарювали 94601 32 при зниженому тиску й потім повторно розчиняли в толуолі й знову упарювали при зниженому тиску. Колонкова хроматографія (градієнт 20 - 40% EtOAc у петролейному ефірі) приводила до бажаної сполуки у вигляді темного жовтого масла, яке тверділо при стоянні (120 мг, 87%). 1 H ЯМР (CDCl3) 7.63 (1H, d, J 2Гц), 7.57 (1H, s), 7.54 (1H, dd, J 8.5Гц, 2.25Гц), 7.00 (2H, s), 6.91 (2H, m), 4.54 (1H, quin, J 6Гц), 3.82 (1H, s), 3.05 (6H, d, J 6.5Гц), 1.35 (6H, d, J 6Гц); РХ-МС rt 2.40 m/z 338 + ЕР Проміжна сполука 19: N'-(3-Ціано-4'-фтор-3'ізопропокси-біфеніл-4-іл)-N,N-диметилформамідин Розчин проміжної сполуки 17 (196 мг, 0.60 ммоль) у ДМФА-ДМА (2 мл) перемішували при 80 протягом ночі. РХМС аналіз показував витрату вихідної речовини. Реакційну суміш упарювали при зниженому тиску й потім повторно розчиняли в толуолі й знову упарювали при зниженому тиску. Колонкова хроматографія (градієнт 20 - 40% EtOAc у петролейному ефірі) приводила до бажаної сполуки у вигляді темного жовтого масла, яке тверділо при стоянні (190 мг, 97%). 1 H ЯМР (CDCl3) 7.57 (2H, m), 7.49 (1H, dd, J 8.5Гц, 2.25Гц), 6.99 (4H, m), 4.53 (1H, quin, J 6Гц), 3.02 (6H, d, J 5.75Гц), 1.32 (6H, d, J 6Гц); РХ-МС rt + 2.71 m/z 326 ЕР Проміжна сполука 20: 1-(3-Метил-4-нітрофеніл)-1H-[1,2,4]триазин В 50 мілілітрову круглодонну колбу завантажували 4-фтор-2-метил-1-нітробензол (0.5 г, 3.22 ммоль), Na2CO3 (0.36 г, 3.38 ммоль) і 1,2,4-триазол (0.22 г, 3.22 ммоль) у ДМФА (сухий 10 мл). Суміш перемішували при 125°C протягом 24 годин під азотом. ДМФА упарювали досуха й сирий продукт поміщали в силікагелеву колонку й елюювали 2.5% MeOH:ДХМ. Виділяли 0.47 г (72%) білої твердої речовини. 1 H ЯМР (D6-ДМСО) 9.52 (1H, s), 8.39 (1H, s), 8.27 (1H, d, J = 8.85Гц), 8.13 (1H, d, J = 1.89Гц), 8.02 (1H, dd, J = 8.85Гц, 2.53Гц), 2.68 (3H, s); РХ+ МС rt 2.26 m/z 205 ЕР Проміжна сполука 21: 2-Метил-4[1,2,4]триазол-1-іл-феніламін В 50 мілілітрову круглодонну колбу завантажували проміжну сполуку 20 (0.47 г, 2.3 ммоль) і EtOH (10 мл). До цієї суміші, що перемішували при кімнатній температурі додавали SnCl2·2H2О (2.5 г, 11.5 ммоль). Суміш потім нагрівали до 80 при 80°C протягом 4 год. Суміші дозволяли охолонути і pH розчину встановлювали на 8 за допомогою додавання 2 н. NaOH. Суміш фільтрували, упарювали досуха і потім розподіляли між ДХМ:H2О (50 мл:25 мл). Водний шар відокремлювали і промивали знову ДХМ (25 мл). Фракції ДХМ поєднували і пропускали через гідрофобну фриту для видалення води. Фільтрат упарювали досуха, одержуючи коричневу тверду речовину 0.3 г (75%). 1 H ЯМР (D6-ДМСО) 9.02 (1H, s), 8.15 (1H, s), 7.43 (1H, d, J = 1.89Гц), 7.37 (1H, dd, J = 8.20Гц, 2.52Гц), 6.76 (1H, d, J = 8.85Гц), 5.20 (2H, s), 2.18 + (3H, s); РХ-МС rt 1.33 m/z 175 ЕР Проміжна сполука 22: N'-[3-Ціано-3'-фтор-4'-(2метоксі-етокси)-біфеніл-4-іл]-N,N-диметил 33 формамідин Стадія 1: 4-Бром-2-фтор-1-(2-метоксі-етокси)бензол Суміш 4-фторфенолу (9.8 мл), порошкоподібного карбонату калію (2 екв., 24 г) і брометилметилового ефіру (1.1 екв., 20.16 мл) в ацетоні (60 мл) нагрівали зі зворотним холодильником протягом ночі. Охолоджену реакційну суміш розбавляли водою й екстрагували EtOAc. Об'єднані органічні фази промивали водним карбонатом натрію, сушили (Na2SO4) і упарювали з одержанням продукту у вигляді рухливого масла (22 г, кількісний). 1 H ЯМР (CDCl3) 7.14 (2H, m), 6.84 (1H, t, J 8.85Гц), 4.09 (2H, m), 3.69 (2H, m), 3.38 (3H, s); РХМС rt 2.67 m/z, не іонна Стадія 2: 3-Фтор-4-(2-метоксі-етокси)фенілборонова кислота До розчину 4-бром-2-фтор-1-(2-метоксіетокси)-бензолу (4.98 г) у ТГФ (40 мл) додавали невеликий кристал йоду й потім порціями Mg (730 мг, 1.5 екв.). Після додавання, суміш нагрівали зі зворотним холодильником протягом 4 годин. Сіру суміш охолоджували до -78°, додавали триметилборат (1.2 екв., 2.25 мл) і залишали нагріватися протягом ночі. Додавали 1 н. HCl (водн., 60 мл) і перемішували протягом 30 хвилин перед екстрагуванням ефіром (2 × 50 мл). Об'єднані органічні фази сушили, концентрували й одержану в результаті тверду речовину розтирали з ефіром/бензином, виділяли шляхом фільтрування й сушили з одержанням зазначеної в заголовку сполуки у вигляді кремової твердої речовини (3.122 г, 73%) 1 H ЯМР (CDCl3) 8.04 (2H, br s), 7.53 (2H, m), 7.12 (1H, t, J 8.85Гц), 4.17 (2H, m), 3.67 (2H, m), 3.3 (3H, s); РХ-МС rt 1.97 m/z 213 ЕР Стадія 3: N'-[3-Ціано-3'-фтор-4'-(2-метоксіетокси)-біфеніл-4-іл]-N,N-диметил-формамідин Суміш 3-фтор-4-(2-метоксіетокси)фенілборонової кислоти (1.83 г, 1.2 екв.), проміжної сполуки 2 (2.32 г), карбонату калію (1.29 г, 1.2 екв.) у суміші ДМФА/H2O (3:1, 40 мл) обробляли дихлор(бісбензонітрил)паладієм (II) (1%, 30 мг) і перемішували в атмосфері N2 протягом 4 годин. Суміш розбавляли водою (100 мл), фільтрували й потім екстрагували EtOAc (2 × 50 мл) і ці органічні екстракти додавали до осаду на фільтрі, сушили й упарювали. Залишок розчиняли в ДХМ, завантажували в коротку силікагелеву колонку й елюювали порціями при відсмоктуванні сумішшю ДХМ/EtOH/NH3 400-200:8:1. При упарюванні, це давало коричневе масло, яке розтирали із сумішшю ДХМ/ефір/бензин і для кристалізації розбавляли додатковим бензином (60 мл). Зазначену в заголовку сполуку виділяли шляхом фільтрування у вигляді кремової твердої речовини (1.665 г, 63%) 1 H ЯМР (CDCl3) 7.74 (1H, d, J 1.9Гц), 7.7 (1H, s), 7.60 (1H, dd, J 8.85, 1.9Гц), 7.29 (3H, m), 7.1 (1H, d, J 8.2Гц), 7.05 (1H, d, J8.85Гц), 4.28 (2H, m), 3.84 (2H, m), 3.52 (3H, s), 3.16 (3H, s), 3.14 (3H, s); РХ+ МС rt 2.32 m/z 342 ЕР Проміжна сполука 23: N'-(3-Ціано-3',4'диметокси-біфеніл-4-іл)-N,N-диметил-формамідин Проміжну сполуку 4 (2.52 г, 10 ммоль) і 3,4диметоксифенілборонову кислоту (1.9 г, 1.2 екв.) у 94601 34 ізо-PrOH (30 мл) обробляли 2 н. водним карбонатом натрію (10 мл) і тетракіс-(трифенілфосфін) паладієм (0) (5 мг, 0.04 мол.%) і нагрівали при перемішуванні до 60°. Через 2 години ступінь протікання реакції, відповідно РХМС, становила близько 80%. Потім реакційну суміш охолоджували й розбавляли водою (30 мл). Одержану в результаті тверду речовину відфільтровували й промивали додатковою водою (2 × 20 мл) перед сушінням шляхом відсмоктування. Тверду речовину двічі суспендували в ефірі (2 × 5 мл) і відсмоктували, і на закінчення сушили з одержанням біфенільної проміжної сполуки у вигляді грязно-білої твердої речовини (2.24 г, 72%). 1 6 H ЯМР (D -ДМСО) 7.99 (1H, s) 7.91 (1H, d, J 1.9Гц), 7.79 (1H, dd, J 8.2, 1.9Гц), 7.2 (3H, m), 6.99 (1H, d, J 8.2Гц), 3.84 ( 3H, s), 3.78 (3H, s), 3.08 (3H, s) 3.01 (3H, s); РХ-МС rt 2.31 m/z 309 ЕР Проміжна сполука 24: 1-(4-Аміно-феніл)-5метил-1H-[1,2,4]триазол-3-карбонова кислота Розчин 5-метил-1-(4-нітрофеніл)-1H-1,2,3триазол-3-карбонової кислоти (100 мг, 0.403 ммоль) у метанолі (8 мл) інжектували зі швидкістю 1 мл/хвилину в гідрогенізатор “H-Cube”, який сполучає утворення ендогенного водню й доступну картриджну систему (Pd/C), у якому, при атмосферному тиску, температуру підтримували на значенні 25°C. Одержаний розчин концентрували з одержанням білої твердої речовини (82 мг, 93%). 1 6 H ЯМР (D -ДМСО) 8.72 (1H, шир. s), 8.59 (1H, шир. s), 7.42 (2H, d, J 8Гц), 7.23 (1H, d, J 8Гц), 6.99 (2H, d, J 8Гц), 6.70 (1H, d, J 8Гц), 2.48 (3H, s), 2.45 (3H, s) Проміжна сполука 25: Диметиламід 1-(4-Амінофеніл)-5-метил-1H-[1,2,4]триазол-3-карбонової кислоти Стадія 1: Диметиламід 5-метил-1-(4нітрофеніл)-1H-[1,2,4]триазол-3-карбонової кислоти До розчину 5-метил-1-(4-нітрофеніл)-1H-1,2,4триазол-3-карбонової кислоти (Key organics, 400 мг, 1.61 ммоль) і основи Х'юніга (667 мкл, 3.86 ммоль) у ДХМ:ДМФА (6 мл:1 мл) при -10°C по краплях додавали ізобутилхлорформіат (250 мкл, 1.93 ммоль). Реакційну суміш перемішували 30 хвилин при -10°C, і потім повільно додавали 2M розчин диметиламіну (965 мкл, 1.93 ммоль). Суміші дозволяли нагрітися до кімнатної температури й перемішували протягом ще однієї години. Сиру суміш промивали насиченим NaHCO3, екстрагували й сушили над МgSO4. Після упарювання одержану жовту тверду речовину безпосередньо використовували в наступній реакції без додаткового + очищення (412 мг, 93%). РХ-МС rt 2.09 m/z 275 ЕР 1 6 H ЯМР (D -ДМСО) 8.42 (2H, d, J 7Гц), 7.95 (2H, d, J 7Гц), 3.13 (3H, s), 3.03 (3H, s), 2.62 (3H, s) Стадія 2: Диметиламід 1-(4-Аміно-феніл)-5метил-1H-[1,2,4]триазол-3-карбонової кислоти Розчин метиламіду 5-метил-1-(4-нітрофеніл)1H-1,2,3-триазол-3-карбонової кислоти зі стадії 1 (100 мг, 0.36 ммоль) у метанолі (8 мл) інжектували зі швидкістю 1 мл/хвилину в гідрогенізатор “HCube”, який сполучає утворення ендогенного водню й доступну картриджну систему (Pd/C), у якому, 35 при атмосферному тиску, температуру підтримували на значенні 25°C. Одержаний розчин концентрували з одержанням білої твердої речовини (87 мг, 98%). РХ-МС: rt + 1.54 m/z 245 ЕР 1 6 H ЯМР (D -ДМСО) 8.71 (1H, шир. s), 8.54 (2H, d, J 7Гц), 7.12 (2H, d, J 7Гц), 3.13 (3H, s) 3.03 (3H, s), 2.62 (3H, s) Приклад 1: (6-Йод-хіназолін-4-іл)-(4[1,2,4]триазол-1-іл-феніл)-амін 4-Хлор-6-йодхіназолін (WO9609294 A1, 150 мг) обробляли 4-триазоліланіліном (28 мг, 1 екв.) в MeCN і кип'ятили зі зворотним холодильником протягом 6 годин. Охолоджували протягом ночі й фільтрували з одержанням зазначеної в заголовку сполуки (70 мг). 1 H ЯМР 11.75 (1H, br s), 9.4 (2H, s), 9.04 (1H, s), 8.43 (1H, d, J 8.85Гц), 8.34 (1H, s), 8.0 (4H, m), + 7.82 (1H, d, J 8.85Гц); РХ-МС rt 2.32 m/z 415 ЕР Приклад 2: (6-трет-Бутил-хіназолін-4-іл)-(4[1,2,4]триазол-1-іл-феніл)-амін Розчин 2-аміно-5-трет-бутилбензойної кислоти (комерційний, 500 мг) і ацетат формамідину (404 мг) в EtOH (5 мл) кип'ятили зі зворотним холодильником протягом 18 годин. Охолоджену суміш фільтрували й осад промивали льодяним EtOH і сушили з одержанням гідроксихіназоліну (394 мг), який додавали до тіонілхлориду (10 мл) і ДМФА (кат.) і нагрівали зі зворотним холодильником протягом ночі. Охолоджену суміш розбавляли EtOAc і виливали в насичений гідрокарбонат натрію (водн.). Органічну фазу відокремлювали, сушили й упарювали з одержанням коричневої твердої речовини (327 мг), яку порціями (105 мг) безпосередньо обробляли 4-триазоліланіліном (125 мг) в MeCN (4 мл) при кип'ятінні зі зворотним холодильником протягом ночі. Охолоджену суміш розподіляли між ДХМ і гідрокарбонатом натрію й органічну фазу упарювали. Очищення за допомогою хроматографії з використанням суміші ДХМ:EtOH:NH3 (200:8:1) як елюант давало бажану сполуку. 1 H ЯМР 10.16 (1H, s), 9.48 (1H, s), 8.77 (1H, s), 8.62 (1H, s), 8.41 (1H, d), 8.2 (4H, m), 7.95 (1H, d), 1.64 (9H, s); РХ-МС rt 2.18 m/z 343 ЕР Приклад 3: [7-(3-Хлор-пропокси)-6-метоксихіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)амін N'-[5-(3-хлор-пропокси)-2-ціано-4-метоксифеніл]-N,N-диметил-формамідин (WO03055491, 580 мг), 4-(1,2,4-триазоліл)анілін (314 мг) і AcOH (4 мл) нагрівали до 90° протягом 1 години перед охолодженням. Маслянисту рідину упарювали й суспензію, яка в результаті утворилася, розчиняли в MeOH, обробляли ультразвуком і білий порошок, який в результаті утворився, фільтрували й сушили, одержуючи зазначену в заголовку сполуку (765 мг). 1 H ЯМР 9.65 (s, 1H), 9.25 (s, 1H), 8.5 (s, 1H), 8.23 (s, 1H), 8.02 (d, 2H, J 9Гц), 7.89 (s, 1H), 7.87 (d, 2H, J=9), 7.24 (s, 1H), 4.28 (t, 2H, J=6), 3.95 (s, 3H), 3.83 (t, 2H, J 6Гц), 2.27 (q, 2H, J 6Гц); РХ-МС rt 2.13 + m/z 411 ЕР Приклад 4: [6-Метокси-7-(3-морфолін-4-ілпропокси)-хіназолін-4-іл]-(4-[1,2,4]триазол-1-ілфеніл)-амін 94601 36 Сполуки прикладу 3 (118.6 мг, 0.289 ммоль), морфолін (120 мкл) і диметилацетамід (1.1 мл) нагрівали до 90° протягом 12 годин перед охолодженням, упарювали й очищали маслянисту рідину, яка в результаті утворилася, за допомогою колонкової хроматографії з використанням суміші 200:8:1, ДХМ:MeOH:NH3 як елюант. Масло перекристалізували з MeCN з одержанням зазначеної в заголовку сполуки у вигляді безбарвних кристалів, (126 мг). 1 H ЯМР 9.55 (s, 1H), 8.57 (s, 1H), 8.02 (s, 1H), 7.80 (d, 2H, J 8.9) 7.35 (s, 1H), 7.19 (d, 2H, J=8.9), 4.38 (t, 2H, J 6Гц), 4.15 (s, 3H), 4-3.92 (m, 4H), 3.833.75 (m, 4H), 3.36-3.28 (m, 4H); РХ-МС rt 1.78 m/z + 462 ЕР Приклад 5: [6-(3,4-Дифтор-феніл)-хіназолін-4іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: N'-(3-Ціано-3',4'-дифтор-біфеніл-4іл)-N,N-диметил-формамідин Суміш 3,4-дифторфенілборонової кислоти (Lancaster, 396 мг, 1.5 екв.), проміжної сполуки 2 (500 мг) і тетракіс(трифенілфосфін)паладію (0) (5%, 96 мг) нагрівали в ДМЕ/2 н. карбонаті натрію (водн., 2:1, 13.5 мл) зі зворотним холодильником протягом 16 годин. Суміш упарювали, залишок промивали водою й ефіром та сушили з одержанням світло-коричневої твердої речовини (386 мг, 81%). 1 H ЯМР (CDCl3) 7.57 (1H, d, J = 2Гц), 7.54 (1H, s), 7.45 (1H, dd, J = 8.5, 2.25Гц), 7.13 (3H, m), 6.90 (1H, d, J = 8.5Гц), 3.0 (3H, s), 2.99 (3H, s); РХ+ МС rt 2.51; m/z 286 ЕР Стадія 2: [6-(3,4-Дифтор-феніл)-хіназолін-4-іл](4-[1,2,4]триазол-1-іл-феніл)-амін Суміш формамідину зі стадії 1 (150 мг) і 4триазоліл-аніліну (88 мг, 1 екв.) в AcOH (2 мл) нагрівали до 80° протягом 16 годин. Охолоджували, концентрували й обережно обробляли гідрокарбонатом натрію (водн.). Одержану в результаті тверду речовину виділяли фільтруванням, промивали водою, потім додавали ДХМ:EtOH:NH3 (20:8:1) і ще раз фільтрували. Фільтрат упарювали до моменту утворення осаду, який відфільтровували, промивали ефіром і сушили з одержанням зазначеної в заголовку сполуки (82 мг, 34%). 1 H ЯМР 10.0 (1H, s), 9.18 (1H, s), 8.75 (1H, s), 8.54 (1H, s), 8.12 (2H, m), 7.97 (1H, m), 7.92 (2H, m), 7.78 (3H, m), 7.66 (1H, m), 7.53 (1H, m); РХ-МС rt + 2.52 m/z 401 ЕР Приклад 6: [6-(4-Хлор-3-фтор-феніл)-хіназолін4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: N'-(4'-Хлор-3-ціано-3'-фтор-біфеніл4-іл)-N,N-диметил-формамідин Суміш 4-хлор-3-фторфенілборонової кислоти (Combiblocks, 759 мг, 1.3 екв.), проміжної сполуки 2 (1 г) і тетракіс(трифенілфосфін)паладію (0) (5%, 193 мг) нагрівали в ДМЕ/2 н. карбонаті натрію (водн., 2:1, 27 мл) зі зворотним холодильником протягом 16 годин. Суміш фільтрували, фільтрат упарювали, залишок промивали насиченим гідрокарбонатом натрію, водою й ефіром і сушили з одержанням продукту (310 мг). 1 H ЯМР (CDCl3) 7.58 (1H, d, J 2.0Гц), 7.53 (1H, s), 7.46 (1H, dd, J 8.5, 2.25Гц), 7.31 (1H, t, J 8.0Гц), 7.14 (1H, m), 7.12 (1H, m), 6.9 (1H, d, J 37 8.5Гц), 3.0 (3H, s), 2.98 (3H, s); РХ-МС rt 2.70; m/z + 302 ЕР Стадія 2: [6-(4-Хлор-3-фтор-феніл)-хіназолін-4іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Суміш формамідину зі стадії 1 (300 мг) і 4триазоліл-аніліну (167 мг, 1 екв.) в AcOH (3 мл) нагрівали до 80° протягом 2 годин. Охолоджували, і одержану в результаті тверду речовину виділяли фільтруванням, промивали гідрокарбонатом натрію, водою й MeCN. Тверду речовину очищали за допомогою колонкової хроматографії на силікагелі, використовуючи ДХМ:EtOH:NH3 (400:8:1 200:8:1) як елюант, з одержанням зазначеної в заголовку сполуки. 1 H ЯМР 10.36 (1H, br s), 9.29 (1H, s), 8.93 (1H, s), 8.63 (1H, s), 8.25 (2H, m), 8.03 (3H, m), 7.86 (2H, d, J 9.25Гц), 7.81 (3H, m); РХ-МС rt 2.61 m/z 418 + ЕР Приклад 7: [6-(3-Фтор-4-метокси-феніл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: N'-(3-Ціано-3'-фтор-4'-метоксибіфеніл-4-іл)-N,N-диметил-формамідин Суміш 3-фтор-4-метоксифенілборонової кислоти (Aldrich, 427 мг, 1.5 екв.), проміжної сполуки 2 (500 мг) і тетракіс(трифенілфосфін)паладію (0) (5%, 96 мг) нагрівали в ДМЕ/2 н. карбонаті натрію (водн., 2:1, 13.5 мл) зі зворотним холодильником протягом 16 годин. Суміш упарювали, залишок промивали водою й ефіром і сушили з одержанням світло-коричневої твердої речовини (436 мг, 88%). 1 H ЯМР (CDCl3) 7.71 (1H, d, J = 2.25Гц), 7.67 (1H, s), 7.59 (1H, dd, J = 9.12 2.25Гц), 7.32 (1H, m), 7.27 (1H, m), 7.05 (2H, m), 3.96 (3H,s), 3.14 (3H, s), + 3.12 (3H, s); РХ-МС rt 2.33 m/z 298 ЕР Стадія 2: [6-(3-Фтор-4-метокси-феніл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Суміш формамідину зі стадії 1 (200 мг) і 4триазоліл-аніліну (112 мг, 1 екв.) в AcOH (2 мл) нагрівали до 80° протягом 16 годин. Охолоджували, концентрували й обережно обробляли гідрокарбонатом натрію (водн.). Одержану в результаті тверду речовину виділяли фільтруванням, промивали водою потім додавали ДХМ:EtOH:NH3 (20:8:1) і ще раз фільтрували. Фільтрат упарювали до моменту утворення осаду, який відфільтровували, промивали ефіром і сушили з одержанням зазначеної в заголовку сполуки (129 мг, 47%). 1 H ЯМР 10.06 (1H, s), 9.29 (1H, s), 8.81 (1H, s), 8.63 (1H, s), 8.23 (2H, m), 8.07 (2H, d, J 10.0Гц), 7.93 (1H, s), 7.88 (2H, m), 7.83 (1H, m), 7.73 (1H, d, J 7.50Гц), 7.35 (1H, t, J 8.75Гц), 3.92 (3H, s); РХ-МС + rt 2.42 m/z 413 ЕР Приклад 8: [6-(4-Етокси-3-фтор-феніл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: N'-(3-Ціано-4'-етокси-3'-фторбіфеніл-4-іл)-N,N-диметил-формамідин Суміш 4-етокси-3-фторфенілборонової кислоти (Combiblocks, 800 мг, 1.3 екв.), проміжної сполуки 2 (1 г) і тетракіс(трифенілфосфін)паладію (0) (5%, 193 мг) нагрівали в ДМЕ/2 н. карбонаті натрію (водн., 2:1, 27 мл) зі зворотним холодильником протягом 16 годин. Суміш фільтрували, фільтрат упарювали, залишок промивали насиченим гідрокарбонатом натрію, водою й ефіром і сушили з 94601 38 одержанням продукту (410 мг). 1 H ЯМР 7.71 (1H, d, J = 2.0Гц), 7.67 (1H, s), 7.60 (1H, dd, J = 8.5 2.25Гц), 7.31 (1H, m), 7.25 (1H, m), 7.02 (2H, m), 4.17 (2H, q, 7.0Гц), 3.14 (3H, s), 3.12 (3H, s), 1.5 (3H, t, 7.0Гц); РХ-МС rt 2.51 m/z + 312 ЕР Стадія 2: [6-(4-Етокси-3-фтор-феніл)-хіназолін4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Суміш формамідину зі стадії 1 (400 мг) і 4триазоліл-аніліну (214 мг, 1 екв.) в AcOH (3 мл) нагрівали до 80° протягом 2 годин. Охолоджували, і одержану в результаті тверду речовину виділяли фільтруванням, промивали гідрокарбонатом натрію, водою й MeCN і сушили з одержанням чистої, зазначеної в заголовку сполуки. 1 H ЯМР 10.27 (1H, br s), 9.29 (1H, s), 8.86 (1H, s), 8.63 (1H, s), 8.26 (1H, s), 8.22 (1H, dd, J 8.75 2.5Гц), 8.10 (2H, d, J 7.50Гц), 7.88 (4H, m), 7.72 (1H, d, 7.5Гц), 7.34 (1H, t, 7.5Гц), 4.21 (2H, q, 7.5Гц), + 1.41 (3H, t, 7.5Гц); РХ-МС rt 2.53 m/z 427 ЕР Приклад 9: {6-[3-Фтор-4-(2-метоксі-етокси)феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)амін Стадія 1: 4-Бром-2-фтор-1-(2-метоксі-етокси)бензол Суміш 4-фторфенолу (9.8 мл), порошкоподібного карбонату калію (2 екв., 24 г) і брометилметилового ефіру (1.1 екв., 20.16 мл) в ацетоні (60 мл) нагрівали зі зворотним холодильником протягом ночі. Охолоджену реакційну суміш розбавляли водою й екстрагували EtOAc. Об'єднані органічні фази промивали водним карбонатом натрію, сушили (Na2SO4) і упарювали з одержанням продукту у вигляді рухливого масла (22 г, кількісний). 1 H ЯМР (CDCl3) 7.14 (2H, m), 6.84 (1H, t, J 8.85Гц), 4.09 (2H, m), 3.69 (2H, m), 3.38 (3H, s); РХМС rt 2.67 m/z, не іонна. Стадія 2: 3-Фтор-4-(2-метоксі-етокси)фенілборонова кислота До розчину 4-бром-2-фтор-1-(2-метоксіетокси)-бензолу (4.98 г) у ТГФ (40 мл) додавали невеликий кристал йоду й потім порціями Mg (730 мг, 1.5 екв.). Після додавання, суміш нагрівали зі зворотним холодильником протягом 4 годин. Сіру суміш охолоджували до -78°, додавали триметилборат (1.2 екв., 2.25 мл) і залишали нагріватися протягом ночі. Додавали 1 н. HCl (водн., 60 мл) і перемішували протягом 30 хвилин перед екстрагуванням ефіром (2 × 50 мл). Об'єднані органічні фази сушили, концентрували й одержану в результаті тверду речовину розтирали з ефіром/бензином, виділяли шляхом фільтрування й сушили з одержанням зазначеної в заголовку сполуки у вигляді кремової твердої речовини (3.122 г, 73%). 1 H ЯМР 8.04 (2H, br s), 7.53 (2H, m), 7.12 (1H, t, J 8.85Гц), 4.17 (2H, m), 3.67 (2H, m), 3.3 (3H, s); РХ-МС rt 1.97 m/z 213 ЕР Стадія 3: N'-[3-Ціано-3'-фтор-4'-(2-метоксіетокси)-біфеніл-4-іл]-N,N-диметил-формамідин Суміш 3-фтор-4-(2-метоксіетокси)фенілборонової кислоти (1.83 г, 1.2 екв.), проміжної сполуки 2 (2.32 г), карбонату калію (1.29 г, 1.2 екв.) у суміші ДМФА/H2O (3:1, 40 мл) обробляли дихлор(бісбензонітрил)паладієм (II) (1%, 30 мг) і 39 перемішували в атмосфері N2 протягом 4 годин. Суміш розбавляли водою (100 мл), фільтрували й потім екстрагували EtOAc (2 × 50 мл) і ці органічні екстракти додавали до осаду на фільтрі, сушили й упарювали. Залишок розчиняли в ДХМ, завантажували в коротку силікагелеву колонку й елюювали порціями при відсмоктуванні сумішшю ДХМ/EtOH/NH3 400-200:8:1. При упарюванні, це давало коричневе масло, яке розтирали із сумішшю ДХМ/ефір/бензин і для кристалізації розбавляли додатковим бензином (60 мл). Зазначену в заголовку сполуку виділяли шляхом фільтрування у вигляді кремової твердої речовини (1.665 г, 63%). 1 H ЯМР (CDCl3) 7.74 (1H, d, J 1.9Гц), 7.7 (1H, s), 7.60 (1H, dd, J 8.85, 1.9Гц), 7.29 (3H, m), 7.1 (1H, d, J 8.2Гц), 7.05 (1H, d, J8.85Гц), 4.28 (2h, m), 3.84 (2H, m), 3.52 (3H, s), 3.16 (3H, s), 3.14 (3H, s); РХ+ МС rt 2.32 m/z 342 ЕР Стадія 4: {6-[3-Фтор-4-(2-метоксі-етокси)феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)амін Суміш формамідину зі стадії 3 (594 мг) і 4триазоліл-аніліну (279 мг, 1 екв.) в AcOH (6 мл) нагрівали до 125 протягом 2 годин. Після охолодження й розведення водою (20 мл), жовтий осад виділяли фільтруванням, суспендували з 1 н. NaOH і промивали водою. Після сушіння, цю речовина розтирали із сумішшю MeOH/вода/ацетон ~ 10:5:5 з одержанням, після фільтрування й сушіння, блідо-кремової твердої речовини (510 мг, 64%). 1 H ЯМР 10.1 (1H, br s), 9.27 (1H, s), 8.8 (1H, s), 8.58 (1H, s), 8.24 (1H, s), 8.18 (1H, d, J 8.85Гц), 8.03 (2H, d, J8.85Гц), 7.84 (4H, m), 7.68 (1H, d, J9.5Гц), 7.35 (1H, t, J 8.85Гц), 4.26 (2H, m), 3.72 (2H, m), 3.35 (3H, перекривається з H2O); РХ-МС rt + 2.4 m/z 457 ЭР Приклад 10: [6-(3,4-Диметокси-феніл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: N'-(3-Ціано-3',4'-диметокси-біфеніл-4іл)-N,N-диметил-формамідин Проміжну сполуку 4 (2.52 г, 10 ммоль) і 3,4диметоксифенілборонову кислоту (1.9 г, 1.2 екв.) у ізо-PrOH (30 мл) обробляли 2 н. водним карбонатом натрію (10 мл) і тетракіс(трифенілфосфін)паладієм (0) (5 мг, 0.04 мол.%) і нагрівали при перемішуванні до 60°. Через 2 години РХМС аналіз показував ступінь протікання реакції 80%. Потім реакційну суміш охолоджували й розбавляли водою (30 мл). Одержану в результаті тверду речовину відфільтровували й промивали додатковою водою (2 × 20 мл) перед сушінням шляхом відсмоктування. Тверду речовину двічі суспендували в ефірі (2 × 5 мл) відсмоктували, і на закінчення сушили з одержанням біфенільної проміжної сполуки у вигляді грязно-білої твердої речовини (2.24 г, 72%). 1 H ЯМР 7.99 (1H, s) 7.91 (1H, d, J 1.9Гц), 7.79 (1H, dd, J 8.2, 1.9Гц), 7.2 (3H, m), 6.99 (1H, d, J 8.2Гц), 3.84 ( 3H, s), 3.78 (3H, s), 3.08 (3H, s) 3.01 (3H, s); РХ-МС rt 2.31 m/z 309 Стадія 2: [6-(3,4-Диметокси-феніл)-хіназолін-4іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Формамідин зі стадії 1 (2.96 г, 9.6 ммоль) і 4триазоліланілін (1.54 г, 9.6 ммоль) в AcOH (10 мл) нагрівали зі зворотним холодильником протягом 3 94601 40 годин. Охолоджений розчин розбавляли ефіром (200 мл) і осад, який одержували, відфільтровували. Осад на фільтрі промивали ефіром, сушили при відсмоктуванні й потім суспендували з 2 н. NaOH (100 мл) при перемішуванні протягом 30 хвилин. Одержану в результаті тверду речовину знову виділяли фільтруванням, промивали водою й сушили з одержанням блідо-жовтої твердої речовини (3.81 г, 93%). 1 H ЯМР 10.11 (1H, s), 9.30 (1H, s), 8.80 (1H, s), 8.65 (1H, s), 8.26 (1H, s), 8.23 (1H, s), 8.10 (2H, d, J 10Гц), 7.92 (2H, d, J 10Гц ), 7.88 (1H, d, J7.5Гц), 7.47 (2H, перекрив. s), 7.16 (1H, d, J7.5Гц), 3.93 + (3H, s), 3.85 (3H, s); РХ-МС rt 2.17 m/z 425 ЕР Приклад 11: [6-(3,4-Діетокси-феніл)-хіназолін4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Суміш проміжної сполуки 8 (200 мг) і проміжної сполуки 6 (490 мг) поєднували з тетракіс(трифенілфосфін)паладієм (0) (95 мг) у ДМЕ (3 мл) і карбонатом натрію (1 мл) і нагрівали до 100º протягом ночі. Охолоджену суміш розбавляли водою й екстрагували ДХМ. Органічні фази поєднували, концентрували й порціями очищали за допомогою колонкової хроматографії, використовуючи CH2Cl2/EtOH/NH3 (200:8:1) з одержанням продукту сполучення. Порцію цієї речовини (70 мг) нагрівали в оцтовій кислоті (1 мл) з 4триазоліланіліном (37 мг) при 80 протягом 1 години. Суміш упарювали, підлуговували насиченим NaHCO3 і осад, який утворився, виділяли шляхом фільтрування й промивали водою й ефіром, сушили, промивали EtOAc, MeCN, потім ефіром і сушили з одержанням зазначеної в заголовку сполуки (32 мг, 34%). 1 H ЯМР 10.4 (1H, br s), 9.27 (1H, s), 8.82 (1H, s), 8.6 (1H, s), 8.23 (1H, s), 8.16 (2H, d, J 8.85Гц), 7.95 (2H, d, J 8.85Гц), 7.44 (2H, m), 7.13 (1H, d, J 8.2Гц), 4.15 (4H, m), 1.37 (6H, m); РХ-МС rt 2.44, + m/z 453 ЕР Приклад 12: {6-[4-(2-Диметиламіно-етокси)феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)амін Стадія 1: N'-[3-Ціано-4'-(2-диметиламіноетокси)-біфеніл-4-іл]-N,N-диметил-формамідин 4-(2-Диметиламіно-етокси)-боронову кислоту (одержана згідно методу Ч. Жоу (C. Zhou) і Р.Ч. Ларока (R.C. Larock), Journal of Organic Chemistry, т. 70, №. 10, сс. 3765, 915 мг, 1.2 екв.), проміжну сполуку 2 (934 мг) і карбонат калію (1.2 екв., 520 мг) у суміші ДМФА/H2O (3:1, 20 мл) обробляли дихлор(бісбензонітрил)паладієм (II) (1%, 12 мг) і перемішували в атмосфері N2 протягом 4 годин. Суміш упарювали й розподіляли між водою й EtOAc. Об'єднані органічні фази сушили й концентрували перед завантаженням у ТФЕ (20 г, Si) і елюювали порціями при відсмоктуванні градієнтною сумішшю ДХМ - ДХМ/EtOH/NH3 - 200:8:1. При упарюванні це давало коричневе масло (1.0 г, кількісний). 1 H ЯМР (CDCl3) 7.71 (1H, d, J2.5Гц), 7.64 ( 1H, s), 7.6 (1H, dd, J8.2, 2.5Гц), 7.44 (2H, d, 8.2Гц), 6.98 (3H, m), 4.1 (2H, m), 3.11 (3H, s), 3.08 (3H, s) 2.75 (2H, m), 2.29 (6H, s); РХ-МС rt 1.71 m/z 337 + ЕР 41 Стадія 2: {6-[4-(2-Диметиламіно-етокси)феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)амін Суміш формамідину зі стадії 1 (528 мг) і 4триазоліланіліну (294 мг) в AcOH (5 мл) нагрівали до 125° протягом 3 годин. Після охолодження, суміш розбавляли й підлуговували 1 н. NaOH (80 мл). кремовий осад, який утворився, виділяли фільтруванням і сушили з одержанням зазначеної в заголовку сполуки (495 мг, 70%). 1 H ЯМР 10.3 (1H, br s), 9.34 (1H, s), 8.9 (1H, s), 8.67 (1H, s), 8.31 (1H, s), 8.23 (1H, dd, J 8.85, 1.9Гц), 8.15 (2H, d, J 8.85Гц), 7.92 (4H, m), 7.19 (2H, d, J 8.85Гц), 4.2 (2H, m), 2.72 (2H, m), 2.3 (6H, s); + РХ-МС rt 1.96 m/z 452 ЕР Приклад 13: {6-[4-Піридин-4-ілметокси)-феніл]хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: 4-Аміно-4'-(піридин-4-ілметокси)біфеніл-3-карбонітрил Суміш проміжної сполуки 5 (835 мг, 1.5 екв.), проміжної сполуки 7 (710 мг) і тетракіс(трифенілфосфін)паладію (0) (5%, 263 мг) нагрівали в ДМЕ/2 н. карбонаті натрію (водн., 2:1, 15 мл) при 80 протягом 16 годин. Обробка водою й розподілення між водою й EtOAc давало залишок, який очищали РХСТ (35 г Si, градієнтне елююванння протягом 30 хвилин 10-100%-вим EtOAc у бензині). Це давало, при упарюванні, зазначену в заголовку сполуку (310 мг, 45%). 1 H ЯМР (CDCl3) 8.63 (2H, m), 7.5 (2H, m), 7.38 (3H, m), 6.99 (2H, d, J 8.65Гц), 6.79 (1H, d, J 8.65Гц), 5.127 (2H, s), 4.42 (2H, br s) Стадія 2: {6-[4-Піридин-4-ілметокси)-феніл]хіназолін-4-іл}-(4-[1,2,4]триазол-1-іл-феніл)-амін Проміжну сполуку стадії 1 (310 мг) обробляли ДМФА-ДМА (5 мл) у ДМФА (3 мл) при 80 протягом 3 годин. Суміш упарювали, залишок розчиняли в толуолі й знову упарювали, одержуючи блідожовту тверду речовину, яку сушили протягом ночі. Порцію цієї речовини (74 мг) обробляли 4триазоліланіліном (57 мг) в AcOH (1 мл) при 80 протягом 2 годин. Охолоджену суміш підлуговували водн. гідрокарбонатом натрію й осад, який утворився, фільтрували, промивали водою, ефіром і MeCN з одержанням зазначеної в заголовку сполуки (88 мг, 59%). 1 H ЯМР 10.5 (1H, brs), 9.26 (1H, s), 8.87 (1H, s), 8.59 (3H, m), 8.23 (1H, s), 8.1 (3H, m), 7.84 (5H, m) 7.47 (5H, m), 7.18 (2H, m), 5.29 (2H, s); РХ-МС rt + 2.23 m/z 472 ЕР Приклад 14: [6-(4-Морфолін-4-іл-феніл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: N'-(3-Ціано-4'-морфолін-4-іл-біфеніл4-іл)-N,N-диметил-формамідин Суміш 4-морфолінілфенілборонової кислоти (Maybridge, 992 мг, 1.5 екв.), проміжної сполуки 2 (955 мг) і тетракіс(трифенілфосфін)паладію (0) (5%, 185 мг) нагрівали в ДМЕ/2 н. карбонаті натрію (водн., 2:1, 12 мл) при 90° протягом 16 годин. Обробка водою й розподілення між водою й EtOAc давало коричневий залишок, який очищали на ТФЕ (Si, 20 г) при елююванні з відсмоктуванням порціями суміші ДХМ/EtOH/NH3 600-200:8:1. Це давало коричневу тверду речовину, яку розтирали із сумішшю ДХМ/бензин і фільтрували з одержан 94601 42 ням світло-коричневої твердої речовини (430 мг, 40%). 1 H ЯМР(CDCl3) 7.45 (3H, m), 7.29 (2H, d, J 8.85 Гц), 6.81 (3H, m), 3.71 (4H, m), 3.03 (4H, m), + 2.94 (3H, s), 2.91 (3H, s); РХ-МС rt 2.16 m/z 335 ЕР Стадія 2: [6-(4-Морфолін-4-іл-феніл)-хіназолін4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Суміш формамідину зі стадії 1 (76 мг) і 4триазоліланіліну (24 мг) в AcOH (2 мл) нагрівали до 125° протягом 1 години. Після охолодження, суміш розбавляли й підлуговували 1 н. NaOH (20 мл). осад, який утворився, виділяли фільтруванням, промивали ДХМ, потім розтирали із сумішшю MeOH/ацетон. Фільтрат концентрували з одержанням зазначеної в заголовку сполуки (22 мг) у вигляді світло-зеленої твердої речовини. 1 H ЯМР 10.45 (1H, br s), 9.3 (1H, s), 8.88 (1H, s), 8.6 (1H, s), 8.26 (1H, s), 8.14 (3H, m), 7.87 (5H, m), 7.12 (2H, d, J 8.85Гц), 3.78 (4H, m), 3.21 (4H, m); + РХ-МС rt 2.28 m/z 450 ЕР Приклад 15: [6-(2,3-Дигідро-бензо[1,4]діоксин6-іл)-хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)амін Стадія 1: N'-[2-Ціано-4-(2,3-дигідробензо[1,4]діоксин-6-іл)-феніл]-N,N-диметилформамідин 1,4-(Етилендіокси)бензол-6-боронову кислоту (Lancaster, 785 мг, 1.2 екв.), проміжну сполуку 2 (1.08 г) і тетракіс(трифенілфосфін)паладій (0) (205 мг) нагрівали в ДМЕ/2 н. карбонаті натрію (водн., 2:1, 12 мл) при 80 протягом 18 годин. Обробка водою й розподілення між водою й EtOAc давало коричневу тверду речовину, яку очищали на ТФЕ (Si, 20 г) при елююванні з відсмоктуванням порціями суміші ДХМ/EtOH/NH3 600-200:8:1. Це давало світло-коричневу тверду речовину (430 мг, 41%). 1 H ЯМР(CDCl3) 7.68 (1H, d, J 2.5Гц), 7.63 (1H, s), 7.56 (1H, dd, J 8.2, 2.5Гц), 6.96 (4H, m), 4.29 (4H, s), 3.1 (3H, s), 3.08 (3H, s). РХ-МС rt 2.22 m/z 308 + ЕР Стадія 2: [6-(2,3-Дигідро-бензо[1,4]діоксин-6іл)-хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Суміш формамідину зі стадії 1 (304 мг) і 4триазоліланіліну (75 мг) в AcOH (2 мл) нагрівали до 125° протягом 1,5 годин. Після охолодження, суміш розбавляли й підлуговували 1 н. NaOH (20 мл). осад, який утворився, виділяли шляхом фільтрування й сушили з одержанням зазначеної в заголовку сполуки (136 мг, 71%) у вигляді жовтої твердої речовини. 1 H ЯМР 10.07 (1H, s), 9.28 (1H, s), 8.78 (1H, s), 8.62 (1H,s), 8.25 (1H, s), 8.16 (1H, d, J 8.85Гц), 8.07 (2H, d, J 8.85Гц), 7.86 (2H, d, J 8.85Гц), 7.82 (1H, d, J 8.85Гц), 7.47 (1H, d, J 1.9Гц), 7.38 (1H, dd, J 8.2, 1.9Гц), 7.03 (1H, d, J 8.85Гц) 4.32 (4H, s); РХ+ МС rt 2.35 m/z 423 ЕР Приклад 16: [6-(2-Метокси-піримідин-5-іл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: 2-Аміно-5-(2-метокси-піримідин-5-іл)бензонітрил Суміш проміжної сполуки 3 (602 мг), 2метоксипіримідин-5-боронової кислоти (Frontier, 1.5 екв., 706 мг), і тетракіс(трифенілфосфін)паладію (0) (352 мг) нагрівали в ДМЕ/2 н. карбонаті натрію (водн., 2:1, 20 мл) при 43 100° протягом 12 годин. Обробка водою й розподілення між водою й EtOAc давало коричневу тверду речовину, яку очищали на ТФЕ (Si, 20 г) при елююванні ДХМ (4 × 10 мл), потім EtOAc (4 × 10 мл), з одержанням твердої речовини, яку розтирали із сумішшю ДХМ/бензин, і фільтрували з одержанням світло-коричневої твердої речовини (660 мг). 1 H ЯМР 8.85 (2H, s), 7.8 (1H, s), 7.6 (>3H, m), 6.88 (1H, d, J 8.85Гц), 6.3 (2H, s), 3.93 (3H, s); РХМС rt 2.39 m/z 226 ЕР Стадія 2: [6-(2-Метокси-піримідин-5-іл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Продукт зі стадії 1 (645 мг) нагрівали в ДМФАДМА (4 мл) протягом 2 годин. Після охолодження суміш упарювали й розтирали з ефіром/бензином з одержанням формамідину у вигляді твердої речовини (664 мг). Порцію цієї речовини (56 мг) обробляли 4-триазоліл-аніліном (35 мг) в AcOH (1.5 мл) при 100 протягом 2 годин, охолоджували й розбавляли водою (25 мл). Підлуговували NaOH, фільтрували й тверду речовину сушили з одержанням зазначеної в заголовку сполуки (66 мг). 1 H ЯМР 10.04 (1H, s), 9.24 (1H, s), 9.13 (2H, s), 8.86 (1H, s), 8.63 (1H, s), 8.25 (2H, m), 8.04 (2H, m), 7.89 (3H, m), 3.99 (3H, s); РХ-МС rt 2.32 m/z 395 ЕР Приклад 17: (6-Тіофен-2-іл-хіназолін-4-іл)-(4[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: N'-(2-Ціано-4-тіофен-2-іл-феніл)-N,Nдиметил-формамідин Суміш проміжної сполуки 2 (2 г), хлориду літію (1.42 г), дихлорбіс-(трифенілфосфін)паладію (II) (0.235 г) і 2-(трибутилстанніл)тіофену (2.74 г) у толуолі (40 мл) нагрівали до 120° протягом 24 год. Охолоджену реакційну суміш упарювали й завантажували у силікагелеву колонку й елюювали ДХМ:MeOH (2.5%) з одержанням зазначеної в заголовку сполуки (0.4 г). 1 H ЯМР 8.02 (1H, s), 7.88 (1H, d, J 1.9Гц), 7.74 (1H, dd, J 8.85, 2.5Гц), 7.52 (1H, s), 7.50 (1H, s), 7.2 (1H, d, J 8.85Гц), 7.11 (1H, t, J 4.4Гц), 3.09 (3H, s), + 3.0 (3H, s); РХ-МС rt 2.32 m/z 256 ЕР Стадія 2: (6-Тіофен-2-іл-хіназолін-4-іл)-(4[1,2,4]триазол-1-іл-феніл)-амін Суміш формамідину зі стадії 1 (151 мг) і 4триазоліланіліну (100 мг) в AcOH (5 мл) нагрівали до 125° протягом 3 годин. Охолоджену реакційну суміш підлуговували 2 н. NaOH і осад виділяли шляхом фільтрування й очищали за допомогою колонкової хроматографії на силікагелі, використовуючи як елюант ДХМ:MeOH (2.5%). Це давало зазначену в заголовку сполуку (200 мг). 1 H ЯМР 10.1 (1H, s), 9.3 (1H, s), 8.83 (1H, s), 8.63 (1H, s), 8.26 (1H, s), 8.19 (1H, d, J 8.85Гц), 8.07 (2H, d, J 8.85Гц), 7.92 (2H, d, J 8.85Гц), 7.85 (1H, d, J 8.85Гц), 7.76 (1H, d, J 2.5Гц), 7.70 (1H, d, J 5Гц), 7.27 (1H, m); РХ-МС rt 2.39 m/z 369 ЕР Приклад 18: [6-(4-Метил-тіофен-2-іл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін Стадія 1: 2-Аміно-5-(4-метил-тіофен-2-іл)бензонітрил Суміш проміжної сполуки 3 (1 г), 4-метил-2тієнілборонової кислоти (Acros, 2 екв., 1.44 г) і тетракіс(трифенілфосфін)паладію (0) (586 мг) нагрі 94601 44 вали в ДМЕ/2 н. карбонаті натрію (водн., 2:1, 30 мл) при 100° протягом 2.5 год. Обробка водою й розподілення між водою й EtOAc давало коричневу тверду речовину, яку розтирали із сумішшю ДХМ/бензин, фільтрували й промивали ефіром з одержанням світло-коричневої твердої речовини (865 мг, 80%). 1 H ЯМР 7.6 (1H, d, J 2.52Гц), 7.54 (1h, dd, J 8.85, 2.5Гц), 7.16 (1H, s), 6.98 (1H, s), 6.80 (1H, d, J 8.85Гц), 6.25 (2H, br s), 2.19 (3H, s); РХ-МС rt 2.91 + m/z 215 ЕР Стадія 2: N'-[2-Ціано-4-(4-метил-тіофен-2-іл)феніл]-N,N-диметил-формамідин Продукт зі стадії 1 (850 мг) нагрівали в ДМФАДМА (1.32 мл) протягом 1,5 годин. Після охолодження суміш розбавляли ефіром, фільтрували й промивали додатковим ефіром з одержанням формамідину у вигляді сірої твердої речовини (564 мг). Порцію цієї речовини (54 мг) обробляли 4триазоліл-аніліном (35 мг) в AcOH (1.5 мл) при 100 протягом 2 годин, охолоджували й розбавляли водою (25 мл). Підлуговували NaOH, фільтрували й тверду речовину сушили з одержанням зазначеної в заголовку сполуки (54.4 мг, 70%). 1 H ЯМР 10.0 (1H, s), 9.18 (1H, s) 8.67 (1H, s), 8.51 (1H, s), 8.14 (1H, s), 8.0 (3H, m), 7.8 (2H, d), 7.72 (1H, d, J 8.85Гц), 7.48 (1H, s), 7.15 (1H, s), 2.2 + (3H, s); РХ-МС rt 2.72 m/z 385 ЕР Приклад 19: (6-Фуран-2-іл-хіназолін-4-іл)-(4[1,2,4-триазол-1-іл-феніл)-амін Стадія 1: N'-(2-Ціано-4-фуран-2-іл-феніл)-N,Nдиметил-формамідин Суміш проміжної сполуки 2 (1 г), хлориду літію (0.71 г), дихлорбіс(трифенілфосфін)паладію (II) (0.717 г) і 2-(трибутилстанніл)фурану (1.31 г) у толуолі (25 мл) нагрівали до 90° протягом 24 год. Охолоджену реакційну суміш упарювали й завантажували в силікагелеву колонку та елюювали ДХМ і, далі, ДХМ:MeOH (2.5%) з одержанням продукту (0.32 г). 1 H ЯМР 8.05 (1H, s), 7.91 (1H, d, J 1.9Гц), 7.8 (1H, dd, J 8.85, 1.9Гц), 7.73 (1H, d, J 1.9Гц), 7.25 (1H, d, J 8.85Гц), 6.95 (1H, d, J 3.2Гц), 6.58 (1H, m), 3.1 (3H, s), 3.02 (3H, s); РХ-МС rt 2.04 m/z 240 ЕР Стадія 2: (6-Фуран-2-іл-хіназолін-4-іл)-(4-[1,2,4триазол-1-іл-феніл)-амін Формамідин зі стадії 1 (100 мг) і 4триазоліланілін (73 мг) в AcOH (3 мл) нагрівали до 125° протягом 3 годин. Охолоджену реакційну суміш упарювали й очищали за допомогою колонкової хроматографії на силікагелі, використовуючи як елюант ДХМ:MeOH (2.5%). Це приводило до продукту (54 мг). 1 H ЯМР 10.14 (1H, s), 9.28 (1H, s), 8.87 (1H, s), 8.62 (1H, s), 8.25 (2H, m), 8.06 (2H, m), 7.9 (4H, m), 7.16 (1H, m), 6.73 (1H, m); РХ-МС rt 2.25 m/z 353 ЕР Приклад 20: {6-[4-(2-Диметиламіно-етокси)-3фтор-феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-ілфеніл)амін Стадія 1: [2-(4-Бром-2-фтор-фенокси)-етил]диметил-амін Розчин 4-бром-2-фторфенолу (20 ммоль, 2.19 мл), диметиламіноетилхлориду·HCl (25 ммоль, 3.6 г), порошкоподібного карбонату калію (80 ммоль, 45 11.06 г) в сухому етанолі (200 мл) та сухому толуолі (200 мл) нагрівали до 80º протягом ночі. Охолоджену реакційну суміш упарювали у вакуумі й розподіляли між етилацетатом і водою. Об'єднані органічні фази промивали водним карбонатом натрію, сушили (Na2SO4) і упарювали з одержанням продукту у вигляді жовтого масла. Очищення за допомогою хроматографії з використанням як елюант суміші ДХМ:EtOH:NH3 (200:8:1) давало бажану сполуку вигляді тьмяного масла (4.11 г, 78%). Стадія 2: 3-Фтор-4-(2-диметиламін-етокси)фенілборонова кислота До розчину [2-(4-бром-2-фтор-фенокси)-етил]диметил-аміну зі стадії 1 (4.1 г) у ТГФ (40 мл) додавали невеликий кристал йоду й потім порціями Mg (570 мг, 1.5 екв.). Після додавання, суміш нагрівали зі зворотним холодильником протягом 1 години. Сіру суміш охолоджували до -78°, до неї по краплях додавали триметилборат (1.2 екв., 2.1 мл) і залишали нагріватися протягом ночі. Додавали 1 н. HCl (водн., 60 мл) і перемішували протягом 30 хвилин перед екстрагуванням ефіром (2 × 50 мл). Об'єднані органічні фази сушили, концентрували й одержану в результаті тверду речовину розтирали із сумішшю ацетон/ефір, виділяли шляхом фільтрування й сушили з одержанням зазначеної в заголовку сполуки у вигляді коричневої твердої речовини (2.6 г, 73%). Продукт використовували сирим без додаткового очищення. Стадія 3: N'-[3-Ціано-3'-фтор-4'-(2-метоксіетокси)-біфеніл-4-іл]-N,N-диметил-формамідин Суміш 3-фтор-4-(2-диметиламін-етокси)фенілборонової кислоти (1.96 г, 1.2 екв.), проміжної сполуки 2 (2.14 г), карбонату калію (1.19 г, 1.2 екв.) у суміші ДМФА/H2O (3:1, 20 мл) обробляли дихлор(бісбензонітрил)паладієм (II) (1%, 27 мг) і перемішували в атмосфері N2 протягом 2 годин. Суміш розбавляли водою (200 мл), фільтрували й потім екстрагували етилацетатом (2 × 50 мл) і ці органічні екстракти додавали до осаду на фільтрі, сушили й упарювали з одержанням коричневої твердої речовини. Залишок розчиняли в ДХМ, завантажували в коротку силікагелеву колонку й елюювали порціями при відсмоктуванні сумішшю ДХМ/EtOH/NH3 400-200:8:1. При упарюванні це давало бежеву тверду речовину (1.88 г, 74%). + РХ-МС rt 1.75 m/z 355 ЕР Стадія 4: {6-[4-(2-Диметиламіно-етокси)-3фтор-феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-ілфеніл)амін До розчину формамідину зі стадії 3 (250 мг, 0.73 ммоль) в оцтовій кислоті (2 мл) додавали 4триазоліланілін (117 мг, 0.73 ммоль). Реакційну суміш нагрівали до 125°C протягом 2 годин. Суміш охолоджували й додавали 15 мл 2 н. NaOH. Продукт дробили й виділяли фільтруванням. Тверду речовину очищали на колонці (SiOH), використовуючи суміш ДХМ:EtOH:NH3 400-200:8:1, і виділяли у вигляді жовтої твердої речовини (258 мг, 75%). 1 6 H ЯМР (D -ДМСО) 10.06 (1H, шир. s), 9.29 (1H, s), 8.81 (1H, s) 8.63 (1H, s), 8.25 (2H, m), 8.09 (1H, s), 8.05 (1H, s), 7.83 (4H, m), 7.70 (1H, d, J 94601 46 10Гц), 7.39 (1H, t, J 10Гц), 4.21 (2H, t, J 7.5Гц), 2.68 (2H, t, J 7.5Гц), 2.24 (6H, s). + РХ-МС rt 1.99 m/z 470 ЕР Приклад 21: (6-Бром-хіназолін-4-іл)-(4[1,2,4]триазол-1-іл-феніл)-амін Розчин N'-(4-бром-2-ціано-феніл)-N,Nдиметил-формамідину (0.5 г, 2 ммоль, 1 екв.) і 4[1,2,4]триазол-1-іл-феніламіну (0.32 г, 2 ммоль, 1 екв.) в оцтовій кислоті (4 мл) нагрівали зі зворотним холодильником при перемішуванні протягом 2 годин, і потім залишали охолонути. Після охолодження, додавання діетилового ефіру приводило до жовтого осаду. Осад збирали фільтруванням, промивали діетиловим ефіром і потім сушили у вакуумі, одержуючи бажану сполуку у вигляді ацетатної солі. (0.53 г, 62%). 1 H-ЯМР (ДМСО-d6) 1.88 (s, 3H), 7.77 (d, 1H), 7.90 (d, 2H), 8.02 (dd, 1H), 8.08 (d, 2H), 8.25 (s, 1H), 8.68 (s, 1H), 8.90 (d, 1H), 9.29 (dd, 1H), 10.04 (s, + 1H). РХ-МС rt 2.30 m/z 368 ЕР Приклад 22: N-(2-{2-Фтор-4-[4-(4-[1,2,4]триазол-1-іл-феніламіно)хіназолін-6-іл}етил)N’,N’,N'-триметилетан-1,2-діамін Розчин проміжної сполуки 11 (96 мг, 0.23 ммоль, 1 екв.) і 4-(1H-1,2,4-триазол-1-іл)аніліну (38 мг, 0.24 ммоль, 1.05 ммоль) в оцтовій кислоті (2 мл) нагрівали зі зворотним холодильником. Через 1 годину реакційній суміші дозволяли охолонути до кімнатної температури, після чого її упарювали у вакуумі й обробляли насиченим водним розчином K2CO3 до припинення виділення бульбашок газу. Суміш, яка утворилася, потім упарювали досуха у вакуумі з одержанням коричневого залишку. Залишок очищали, застосовуючи колонкову флешхроматографію, елююючи сумішшю CH2Cl2:EtOH:NH3 зі співвідношенням компонентів спочатку 200:8:1 і потім 100:8:1. Зазначену в заголовку сполуку виділяли у вигляді кремової твердої речовини (48 мг, 40%). Rf = 0.39 (40:8:1 1 CH2Cl2:EtOH:NH3). H-ЯМР (ДМСО-d6) 2.11 (s, 6H), 2.17 (s, 3H), 2.43 (m, 2H), 2.68 (t, 2H), 4.08 (t, 2H), 7.23 (m, 1H), 7.56 (m, 1H), 7.75 (m, 3H), 7.93 (m, 2H), 8.08 (m, 2H), 8.50 (s, 1H), 8.68 (s, 1H), 9.14 (s, + 1H), 9.92 (br. s, 1H). РХ-МС rt 2.08 m/z 527 ЕР Приклад 23: [6-(3-Ізопропокси-4-метоксифеніл)-хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)амін До розчину проміжної сполуки 18 (60 мг, 0.18 ммоль) в оцтовій кислоті (1 мл) додавали 4триазоліланілін (35 мг, 0.22 ммоль) і розчин перемішували при 80 протягом 2 годин. РХМС аналіз показував витрату вихідної речовини. Реакційну суміш охолоджували, і надлишок оцтової кислоти видаляли шляхом упарювання при зниженому тиску. Залишок обробляли насич. водн. гідрокарбонатом натрію до припинення виділення бульбашок газу. Осад, який утворився, фільтрували, а одержані тверді речовини сушили у вакуумі. Очищення за допомогою препаративної хроматографії приводило до бажаної сполуки у вигляді кремової твердої речовини (18 мг, 22%). 1 6 H ЯМР (D -ДМСО) 10.21 (1H, bs), 9.07 (1H, s), 8.57 (1H, s), 8.42 (1H, s), 8.04 (1H, s), 8.00 (1H, dd, J 47 8.75Гц, 1.5Гц), 7.90 (2H, d, J 9Гц), 7.72 (1H, s), 7.68 (2H, d, J 3.25Гц), 7.27 (2H, s), 6.96 (1H, d, J 9Гц), 4.53 (1H, quin, J 6Гц), 3.64 (3H, s), 1.12 (6H, d, J 6.25Гц) + РХ-МС rt 2.48 m/z 454 ЕР Приклад 24: [6-(4-Фтор-3-ізопропокси-феніл)хіназолін-4-іл]-(4-[1,2,4]триазол-1-іл-феніл)-амін До розчину проміжної сполуки 19 (95 мг, 0.29 ммоль) в оцтовій кислоті (1 мл) додавали 4триазоліланілін (56 мг, 0.35 ммоль) і розчин перемішували при 80 протягом 2 годин. РХМС аналіз показував витрату вихідної речовини. Реакційну суміш охолоджували, і надлишок оцтової кислоти видаляли шляхом упарювання при зниженому тиску. Залишок обробляли насич. водн. гідрокарбонатом натрію до припинення виділення бульбашок газу. Осад, який утворився, фільтрували й одержані тверді речовини сушили у вакуумі. Очищення за допомогою препаративної хроматографії приводило до бажаної сполуки у вигляді кремової твердої речовини (33 мг, 25%). 1 6 H ЯМР (D -ДМСО) 10.24 (1H, bs), 9.27 (1H, s), 8.82 (1H, s), 8.64 (1H, s), 8.36 (1H, s), 8.24 (1H, s), 8.22 (1H, dd, J 9Гц, 1.75Гц), 8.09 (2H, d, J 9Гц), 7.92 (3H, m), 7.64 (1H, dd, J 8.25Гц, 2Гц), 7.46 (1H, m), 4.87 (1H, quin, J 6Гц), 1.36 (6H, d, J 6Гц) + РХ-МС rt 2.66 m/z 441 ЕР Приклад 25: {6-[4-(2-Диметиламіно-етокси)-3фтор-феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол-1-ілфеніл)амін Стадія 1: 4-Бром-1-(3-хлор-пропокси)-2-фторбензол Суміш 2-фтор-4-бромфенолу (162.6 ммоль, 31.07 г), порошкоподібного карбонату калію (731.7 ммоль, 103 г), 1-бром-3-хлорпропану (270 ммоль, 26.6 мл) в ацетонітрилі (250 мл) нагрівали зі зворотним холодильником протягом 3 годин. Охолоджену реакційну суміш фільтрували через целіт і упарювали у вакуумі. Це давало бліде масло (43.5 г, 100%). 1 H ЯМР (CDCl3) 6.99 (2H, t, J 8.75Гц), 6.67 (1H, t, J 8.75Гц), 3.97 (2H, t, J 6.00Гц), 3.57 (2H, t, J 6.00Гц ), 2.04 (2H, m). Стадія 2: 1-[3-(4-Бром-2-фтор-фенокси)пропіл]-піролідин Суміш 4-бром-1-(3-хлор-пропокси)-2-фторубензолу зі стадії 1 (0.046 ммоль, 11.94 г) і піролідину (0.138 ммоль, 11.43 мл) у ДМА (50 мл) нагрівали зі зворотним холодильником протягом 48 год. Охолоджену реакційну суміш розподіляли між етилацетатом і насиченим NaHCO3. Об'єднані органічні фази сушили над сульфатом магнію, концентрували й виділяли коричневе масло (13.5 г, 98%). 1 H ЯМР (CDCl3) 7.11 (2H, m), 6.79 (1H, t, J 8.75Гц), 4.01 (2H, t, J 6.25Гц), 2.52 (2H, t, J 7Гц), 2.42 (6H, m), 1.95 (3H, m), 1.69 (1H, m, перекривається з H2O) Стадія 3: 3-Фтор-4-(3-піролідин-1-іл-пропокси)фенілборонова кислота Розчин 1-[3-(4-бром-2-фтор-фенокси)пропіл]піролідину зі стадії 2 (5.31 г, 17.57 ммоль) у ТГФ (10 мл) по краплях додавали до суспензії Mg, що перемішували, (640 мг, 1.5 екв.) у ТГФ (2 мл) і 94601 48 невеликого кристалу йоду. Після додавання, суміш нагрівали зі зворотним холодильником протягом 3 годин. Сіру суміш охолоджували до -78°, до неї по краплях додавали триметилборат (1.2 екв., 2.4 мл) і залишали нагріватися протягом ночі. Додавали 2 н. HCl (водн., 60 мл) і перемішували протягом 30 хвилин перед екстрагуванням ефіром (2 × 50 мл). Об'єднані органічні фази сушили, концентрували, і коричневе масло, яке одержали, розтирали із сумішшю ацетон/ефір/бензин, з одержанням коричневої твердої речовини. Продукт використовували сирим без додаткового очищення. 1 H ЯМР (d6-ДМСО) 8.08 (2H, шир. s), 7.55 (1H, t, J 8.75Гц), 7.15 (2H, m), 4.04 (2H, t, J 6.25Гц), 2.50 (3H, m), 2.45 (6H, m), 1.84 (3H, m) Стадія 4: N'-[3-Ціано-3'-фтор-4'-(3-піролідин-1іл-пропокси)-біфеніл-4-іл]-N,N-диметилформамідин Суміш 3-фтор-4-(3-піролідин-1-іл-пропокси)фенілборонової кислоти (3.074 г, 2 екв.), проміжної сполуки 2 (1.72 г, 1 екв.), карбонату калію (0.954 г, 1.2 екв.) у суміші ДМФА/H2O (3:1, 40 мл) обробляли дихлор(бісбензонітрил)паладієм (II) (2%, 44 мг) і перемішували в атмосфері N2 протягом 18 год. Суміш розбавляли водою (200 мл) і екстрагували етилацетатом (2 × 50 мл). Після сушіння над сульфатом натрію органічні фази упарювали до коричневої смоли. Залишок розчиняли в ДХМ, завантажували в коротку силікагелеву колонку й елюювали порціями при відсмоктуванні сумішшю ДХМ/EtOH/NH3 200:8:1 - 50:8:1 з одержанням після упарювання світло-коричневої твердої речовини (1.63 г, 71%). + РХ-МС rt 1.99 m/z 395 ЕР Стадія 5: {6-[3-Фтор-4-(3-піролідин-1-ілпропокси)-феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол1-іл-феніл)амін До розчину формамідину зі стадії 4 (257 мг, 0.653 ммоль) в оцтовій кислоті (3 мл) додавали 4триазоліланілін (115 мг, 0.73 ммоль). Реакційну суміш нагрівали до 125°C протягом 1 години. Суміш охолоджували, підлуговували 15 мл 2 н. NaOH і екстрагували етилацетатом. Після сушіння над сульфатом натрію органічні фази упарювали до жовтої твердої речовини. Тверду речовину розтирали із сумішшю ДХМ/Et2O/бензин і виділяли у вигляді жовтого твердого продукту (163 мг, 44%). 1 H ЯМР (D6-ДМСО) 10.07 (1H, шир. s), 9.29 (1H, s), 8.83 (1H, s), 8.64 (1H, s) 8.26 (2H, m), 8.07 (2H, m), 7.85 (5H, m), 7.69 (1H, d, J 10Гц), 7.35 (1H, dd, J 10Гц, 5Гц), 4.22 (2H, t, J 7.5Гц), 2.46 (6H, m, перекривається з H2O), 2.08 (2H, t, J 7.5Гц), 1.70 (4H, m) + РХ-МС rt 2.13 m/z 509 ЕР Приклад 26: {6-[-3-Фтор-4-(3-морфолін-4-ілпропокси)-феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол1-іл-феніл)амін Стадія 1: 4-Бром-1-(3-хлор-пропокси)-2-фторбензол Суміш 2-фтор-4-бромфенолу (162.6 ммоль, 31.07 г), порошкоподібного карбонату калію (731.7 ммоль, 103 г), 1-бром-3-хлорпропану (270 ммоль, 26.6 мл) в ацетонітрилі (250 мл) нагрівали зі зворотним холодильником протягом 3 годин. Охолоджену реакційну суміш фільтрували через целіт і 49 упарювали у вакуумі. Це давало бліде масло (43.5 г, 100%). 1 H ЯМР (CDCl3) 6.99 (2H, t, J 8.75Гц), 6.67 (1H, t, J 8.75Гц), 3.97 (2H, t, J 6.00Гц), 3.57 (2H, t, J 6.00Гц ), 2.04 (2H, m) Стадія 2: 4-[3-(4-Бром-2-фтор-фенокси)пропіл]-морфолін Суміш 4-бром-1-(3-хлор-пропокси)-2-фторубензолу зі стадії 1 (0.038 ммоль, 10.02 г) і морфоліну (0.114 ммоль,10.1 мл) у ДМА (50 мл) нагрівали зі зворотним холодильником протягом 48 год. Охолоджену реакційну суміш розподіляли між етилацетатом і насиченим NaHCO3. Об'єднані органічні фази сушили над сульфатом магнію, концентрували й виділяли коричневе масло (12 г, 98%). 1 H ЯМР (CDCl3) 7.36 (1H, m), 7.32 (1H, m), 6.98 (1H, t, J 8.75Гц), 4.24 (2H, t, J 6.25Гц), 3.87 (4H, m), 2.62 (6H, m), 2.12 (2H, m) + РХ-МС rt 1.98 m/z 320 ЕР Стадія 3: 3-Фтор-4-(3-морфолін-1-іл-пропокси)фенілборонова кислота Розчин 4-[3-(4-бром-2-фтор-фенокси)-пропіл]морфоліну зі стадії 2 (5.08 г, 15.96 ммоль) у ТГФ (10 мл) по краплях додавали до суспензії Mg, що перемішували, (582 мг, 1.5 екв.) у ТГФ (2 мл) і невеликого кристалу йоду. Після додавання, суміш нагрівали до 90° протягом 1 години. Сіру суміш охолоджували до -78º, до неї по краплях додавали триметилборат (1.2 екв., 2.15 мл) і залишали нагріватися протягом ночі. Додавали 2 н. HCl (водн., 60 мл) і перемішували протягом 30 хвилин перед екстрагуванням ефіром (2 × 50 мл). Потім до водного шару додавали триетиламін і екстрагували етилацетатом і ефіром. Об'єднані органічні фази сушили, концентрували з одержанням коричневого масла (3.8 г, 84%). Продукт використовували сирим без додаткового очищення. 1 H ЯМР (D6-ДМСО) 8.08 (2H, шир. s), 7.55 (1H, t, J 8.75Гц), 7.15 (2H, m), 4.04 (2H, t, J 6.25Гц), 3.57 (4H, m), 2.37 (6H, m), 1.84 (2H, m) + РХ-МС: rt 1.95 m/z 284 ЕР Стадія 4: N'-[3-Ціано-3'-фтор-4'-(3-морфолін-1іл-пропокси)-біфеніл-4-іл]-N,N-диметилформамідин Суміш 3-фтор-4-(3-морфолін-1-іл-пропокси)фенілборонової кислоти (3.8 г, 1.5 екв.), проміжної сполуки 2 (2.67 г, 1 екв.), карбонату калію (1.48 г, 1.2 екв.) у суміші ДМФА/H2O (3:1, 40 мл) обробляли дихлор(бісбензонітрил)паладієм (II) (2%, 68 мг) і перемішували в атмосфері N2 протягом 18 год. Суміш розбавляли водою (200 мл) і екстрагували EtOAc (2 × 50 мл). Після сушіння над сульфатом натрію органічні фази упарювали до коричневої смоли. Залишок розчиняли в ДХМ, завантажували в коротку силікагелеву колонку й елюювали порціями при відсмоктуванні сумішшю ДХМ/EtOH/NH3 200:8:1 з одержанням після упарювання рухомої коричневої твердої речовини (3.16 г, 85%). Продукт твердів при стоянні. 1 H ЯМР (CDCl3) 7.79 (1H, шир. s), 7.42 (1H, m), 7.02 (1H, m), 6.79 (3H, m) 3.88 (2H, m), 3.49 (4H, m), 2.87 (2H, d, J 5.5Гц), 2.73 (3H, s), 2.66 (3H, s), 2.30 (5H, m), 1.75 (2H, m) + РХ-МС rt 1.91 m/z 411 ЕР 94601 50 Стадія 5: {6-[3-Фтор-4-(3-морфолін-4-ілпропокси)-феніл]-хіназолін-4-іл}-(4-[1,2,4]триазол1-іл-феніл)амін До розчину формамідину зі стадії 4 (429 мг, 1.045 ммоль) в оцтовій кислоті (3 мл) додавали 4триазоліланілін (184 мг, 1.15 ммоль). Реакційну суміш нагрівали до 125°C протягом 1 години. Суміш охолоджували, підлуговували 15 мл 2 н. NaOH і осад, який утворився, виділяли шляхом фільтрування, потім розчиняли в ДХМ і очищали за допомогою колонкової хроматографії на силікагелі за допомогою суміші ДХМ/EtOH/NH3 400:8:1 - 50:8:1 з одержанням після упарювання кремової твердої речовини (136 мг, 25%). + РХ-МС rt 2.1 m/z 526 ЕР 1 H ЯМР (D6-ДМСО) 10.06 (1H, шир. s), 9.29 (1H, s), 8.82 (1H, s), 8.65 (1H, s) 8.21 (2H, m), 8.07 (2H, m), 7.83 (4H, m), 7.69 (1H, d, J 10Гц), 7.32 (1H, dd, J 10Гц, 5Гц), 4.17 (2H, t, J 7.5Гц), 3.58 (4H, t, J 2.5Гц), 3.34 (2H, m, перекривається з H2O), 2.40 (4H, t, J 2.5Гц), 1.92 (2H, t, J 7.5Гц). Приклад 27: [6-(3,4-Диметокси-феніл)хіназолін-4-іл]-(2-метил-4-[1,2,4]триазол-1-ілфеніл)-амін До реакційної пробірки карусельного пристрою додавали формамідин (приклад 10, стадія 1) (0.05 г, 0.16 ммоль), проміжну сполуку 21 (0.031 г, 0.18 ммоль) і AcOH (1.5 мл). Суміш залишали збовтуватися при 120°C протягом 3 годин. Суміші дозволяли охолонути, упарювали досуха й поміщали в силікагелеву колонку та елюювали 2.5% MeOH: ДХМ. Виділяли 0.015 г, (21%) білої твердої речовини. 1 H ЯМР (D6-ДМСО) 9.69 (1H, s), 9.10 (1H, s), 8.54 (1H, s), 8.23 (1H, s), 8.06 (1H, s), 8.02 (1H, m), 7.69-7.24 (6H, m), 6.94 (1H, d, J = 8.85Гц), 3.71 (3H, s), 3.64 (3H, s), 2.11 (3H, s) + РХ-МС rt 2.18 m/z 438 ЕР Приклад 28: 1-(4-{6-[3-Фтор-4-(2-метоксіетокси)-феніл]-хіназолін-4-іламіно}-феніл)-5метил-1H-[1,2,4]триазол-3-карбонова кислота До розчину проміжної сполуки 22 (55 мг, 0.16 ммоль) в оцтовій кислоті (3 мл) додавали проміжну сполуку 24 (42 мг, 0.19 ммоль). Реакційну суміш нагрівали до 100°C протягом 2 годин. Суміш охолоджували й додавали 15 мл 2 н. NaOH. Продукт дробили й виділяли фільтруванням. Тверду речовину очищали за допомогою препаративної ВЕРХ і виділяли у вигляді білого твердого продукту (26 мг, 32%). 1 H ЯМР (D6-ДМСО) 10.15 (1H, шир. s), 8.82 (1H, s), 8.56 (1H, s) 8.15 (1H, d, J 7.5Гц), 8.00 (2H, d, J 7.5Гц), 7.80 (2H, m), 7.68 (1H, d, J 7.5Гц), 7.56 (2H, d, J 7.5Гц), 7.32 (1H, t, J 7.5Гц), 4.27 (3H, s), 3.73 (3H, s); РХ-МС: rt 2.31 m/z 512 ЕР Приклад 29: 1-(4-{6-[3,4-Диметокси-феніл]хіназолін-4-іламіно}-феніл)-5-метил-1H[1,2,4]триазол-3-карбонова кислота До розчину проміжної сполуки 23 (50 мг, 0.16 ммоль) в оцтовій кислоті (3 мл) додавали проміжну сполуку 24 (42 мг, 0.19 ммоль). Реакційну суміш нагрівали до 100°C протягом 2 годин. Суміш охолоджували й додавали 15 мл 2 н. NaOH. Продукт дробили й виділяли фільтруванням. Тверду речовину очищали за допомогою препаративної ВЕРХ і 51 виділяли у вигляді білого твердого продукту (27 мг, 34%). 1 H ЯМР (D6-ДМСО) 10.11 (1H, шир. s), 8.82 (1H, s), 8.68 (1H, s) 8.26 (1H, dd, J 10Гц, J 2.5Гц), 8.14 (2H, d, J 10Гц), 7.87 (1H, d, J 10Гц), 7.67 (2H, d, J 10Гц), 7.46 (2H, dd, J 10Гц, J 2.5Гц), 7.14 (1H,d, J 10Гц), 3.93 (3H, s), 3.85 (3H, s); РХ-МС: rt 2.16 + m/z 482 ЕР Приклад 30: Диметиламід 1-{4-[6-(3,4диметокси-феніл)-хіназолін-4-іламіно]-феніл}-5метил-1H-[1,2,4]триазол-3-карбонової кислоти До розчину проміжної сполуки 23 (50 мг, 0.16 ммоль) в оцтовій кислоті (3 мл) додавали проміжну сполуку 25 (49 мг, 0.19 ммоль). Реакційну суміш нагрівали 2 години до 100°C. Суміш охолоджували й додавали 15 мл 2 н. NaOH. Продукт дробили, і тверду речовину збирали фільтруванням. Тверду речовину очищали за допомогою препаративної ВЕРХ і виділяли у вигляді білого твердого продукту (23 мг, 28%). 1 H ЯМР (D6-ДМСО) 10.09 (1H, шир. s), 8.82 (1H, s), 8.67 (1H, s) 8.26 (1H, dd, J 8.75Гц, J 1.5Гц ), 8.13 (2H, d, J 8.75Гц), 7.87 (1H, d, J 8.7Гц), 7.66 (2H, d, J 8.7Гц), 7.46 (2H, m), 7.14 (1H,d , J 8.7Гц), 3.93 (3H, s), 3.85 (3H, s), 3.15 (3H, s), 3.03 (3H, s), + 2.55 (3H, s); РХ-МС: rt 2.22 m/z 510 ЕР Приклад 31: Метиламід 1-(4-{6-[3-фтор-4-(2метоксі-етокси)-феніл]-хіназолін-4-іламіно}-феніл)5-метил-1H-[1,2,4]триазол-3-карбонової кислоти Стадія 1: Метиламід 5-метил-1-(4-нітрофеніл)1H-[1,2,4]триазол-3-карбонової кислоти До розчину 5-метил-1-(4-нітрофеніл)-1H-1,2,4триазол-3-карбонової кислоти (Key Organics, 400 мг, 1.61 ммоль) і основи Х’юніга (667 мкл, 3.86 ммоль) у ДХМ:ДМФА (6 мл:1 мл) при -10°C по краплях додавали ізобутилхлорформіат (250 мкл, 1.93 ммоль). Реакційну суміш перемішували 30 хв. при -10°C і потім повільно додавали 2M розчин метиламіну (965 мкл, 1.93 ммоль). Суміші дозволяли нагрітися до кімнатної температури й перемішували протягом ще однієї години. Сиру суміш промивали насиченим NaHCO3, екстрагували й сушили над МgSO4. Після упарювання одержану тверду речовину безпосередньо використовували в наступній реакції без додаткового очищення (374 + мг, 89%). РХ-МС: rt 2.01 m/z 261 ЕР 1 H ЯМР (d-ДМСО) 8.42 (2H, d, J 7Гц), 7.95 (2H, d, J 7Гц), 2.73 (3H, d, J 4.75Гц), 2.60 (3H, s) Стадія 2: Метиламід 1-(4-аміно-феніл)-5метил-1H-[1,2,4]триазол-3-карбонової кислоти Розчин метиламіду 5-метил-1-(4-нітрофеніл)1H-[1,2,4]триазол-3-карбонової кислоти зі стадії 1 (100 мг, 0.38 ммоль) у метанолі (8 мл) інжектували зі швидкістю 1 мл/хвилину в гідрогенізатор “HCube”, який сполучає утворення ендогенного водню й доступну картриджну систему (Pd/C), у якому, при атмосферному тиску, температуру підтримували на значенні 25°C. Одержаний розчин концентрували з одержанням білої твердої речовини (86 мг, 97%). РХ-МС: rt + 1.15 m/z 231 ЕР 1 H ЯМР (d-ДМСО) 8.61 (1H, шир. s), 8.54 (2H, d, J 7Гц), 7.12 (2H, d, J 7Гц), 2.73 (3H, d, J 4.75Гц), 2.60 (3H, s) 94601 52 Стадія 3: Метиламід 1-(4-{6-[3-фтор-4-(2метоксі-етокси)-феніл]-хіназолін-4-іламіно}-феніл)5-метил-1H-[1,2,4]триазол-3-карбонової кислоти До розчину проміжної сполуки 22 (50 мг, 0.16 ммоль) в оцтовій кислоті (3 мл) додавали метиламід 1-(4-аміно-феніл)-5-метил-1H-[1,2,4]триазол-3карбонової кислоти зі стадії 2 (44 мг, 0.19 ммоль). Реакційну суміш перемішували 2 години при 100°C. Суміш охолоджували й додавали 15 мл 2 н. NaOH. Продукт дробили, і тверду речовину збирали фільтруванням. Тверду речовину очищали за допомогою препаративної ВЕРХ і виділяли у вигляді білого твердого продукту (6 мг, 8%). РХ-МС: + rt 2.33 m/z 528 ЕР 1 H ЯМР (d-ДМСО) 10.02 (1H, шир. s), 8.74 (1H, s), 8.56 (1H, s) 8.21 (1H, dd, J 8.75Гц, J 1.5Гц ), 8.01(2H, d, J 8.7Гц), 7.79 (2H, m), 7.60 (2H, d, J 8.7Гц), 7.57 (1H, s), 7.27 (1H, t, J 8.7Гц), 4.15 (2H, t, J 4.5Гц ), 3.62 (2H, t, J 4.5Гц), 3.24 (3H, s), 2.67 (3H, d, J 4.7Гц), 2.44 (3H, s) Приклад 32: Диметиламід 1-(4-{6-[3-фтор-4-(2метоксі-етокси)-феніл]-хіназолін-4-іламіно}-феніл)5-метил-1H-[1,2,4]триазол-3-карбонової кислоти До розчину проміжної сполуки 22 (50 мг, 0.16 ммоль) в оцтовій кислоті (3 мл) додавали проміжну сполуку 25 (47 мг, 0.19 ммоль). Реакційну суміш нагрівали 2 години до 100°C. Суміш охолоджували й додавали 15 мл 2 н. NaOH. Продукт дробили, і тверду речовину збирали фільтруванням. Тверду речовину очищали за допомогою препаративної ВЕРХ і виділяли у вигляді білого твердого продукту (23 мг, 27%). 1 H ЯМР (d-ДМСО) 10.09 (1H, шир. s), 8.83 (1H, s), 8.66 (1H, s) 8.22 (1H, dd, J 7.5Гц, J 1.5Гц ), 8.14 (1H, d, J 5Гц), 8.10 (1H, s), 7.85 (2H, m), 7.70 (2H, s), 7.66 (1H, s), 7.33 (1H,dd , J 10Гц, J 7.5Гц), 4.25 (2H, t, J 5Гц ), 3.71 (2H, t, J 5Гц), 3.14 (3H, s), 3.01 (3H, s), 2.67 (3H, s), 2.44 (3H, s); РХ-МС: rt + 2.37 m/z 542 ЭР Приклад 33: (6-Бром-хіназолін-4-іл)-(2-метил4-[1,2,4]триазол-1-іл-феніл-амін До реакційної пробірки карусельного пристрою додавали 6-бром-4-хлор-хіназолін (0.1 г, 0.41 ммоль), Проміжну сполуку Y (0.078 г, 0.45 ммоль) і CH3CN (безводний, 4 мл) і суміш перемішували при 90°C під азотом протягом 24 год. Оранжевий осад, який утвориться, відфільтровували й промивали водою, 1 н. NaOH і знову водою, і сушили у вакуумі при 40°C. Виділяли 0.1 г (51%) твердої речовини. 1 H ЯМР (D6-ДМСО) 9.26 (1H, s), 9.05 (1H, s), 8.76 (1H, s), 8.20 (1H, s), 8.17 (1H, d, J = 1.26Гц), 7.85 (2H, bs), 7.81 (1H, s), 7.74 (1H, dd, J = 8.85Гц, 2.53Гц), 7.47 (1H, d, J = 8.21Гц), 2.25 (3H, s); РХ+ МС rt 2.19 m/z 382 ЕР Приклад 34: [1-(4-{6-[3-Фтор-4-(2-метоксіетокси)-феніл]-хіназолін-4-іламіно}-феніл)-5метил-1H-[1,2,4]триазол-3-іл]-(4-метил-піперазин1-іл)метанон Стадія 1: [5-Метил-1-(4-нітро-феніл)-1H[1,2,4]триазол-3-іл]-(4-метил-піперазин-1-іл)метанон. До розчину 5-метил-1-(4-нітрофеніл)-1H-1,2,4триазол-3-карбонової кислоти (Key Organics, 400 мг, 1.61 ммоль) і основи Х’юніга (667 мкл, 3.86 53 ммоль) у ДХМ:ДМФА (6 мл:1 мл) при -10°C по краплях додавали ізобутилхлорформіат (250 мкл, 1.93 ммоль). Реакційну суміш перемішували 30 хвилин при -10°C і потім повільно додавали метилпіперазин (214 мкл, 1.93 ммоль). Суміші дозволяли нагрітися до кімнатної температури й перемішували протягом ще однієї години. Сиру суміш промивали насиченим NaHCO3, екстрагували й сушили над MgSO4. Після упарювання одержану тверду речовину безпосередньо використовували в наступній реакції без додаткового очищення (335 + мг, 63%). РХ-МС: rt 1.26 m/z 330 ЕР 1 H ЯМР (D6-ДМСО) 8.39 (2H, d, J 7Гц), 7.92 ((2H, d, J 7Гц), 3.58 (4H, m), 3.30 (4H, m), 2.58 (3H, s), 2.15 (3H, s) Стадія 2:[1-(4-Аміно-феніл)-5-метил-1H[1,2,4]триазол-3-іл]-(4-метил-піперазин-1іл)метанон Розчин [5-метил-1-(4-нітро-феніл)-1H[1,2,4]триазол-3-іл]-(4-метил-піперазин-1-іл)метанону зі стадії 1 (100 мг, 0.302 ммоль) у метанолі (8 мл) інжектували зі швидкістю 1 мл/хвилину в гідрогенізатор “H-Cube”, який сполучає утворення ендогенного водню й доступну картриджну систему (Pd/C), у якому, при атмосферному тиску, температуру підтримували на значенні 25°C. Одержаний розчин концентрували з одержанням білої твердої речовини (87 мг, 96%). РХ-МС: rt + 2.22 m/z 301ЕР 1 H ЯМР (D6-ДМСО) 8.60 (1H, шир. s), 7.51 (2H, d, J 7Гц), 7.09 ((2H, d, J 7Гц), 3.58 (4H, m), 3.30 (4H, m), 2.58 (3H, s), 2.15 (3H, s) Стадія 3: [1-(4-{6-[3-фтор-4-(2-метоксі-етокси)феніл]-хіназолін-4-іламіно}-феніл)-5-метил-1H[1,2,4]триазол-3-іл]-(4-метил-піперазин-1іл)метанон До розчину проміжної сполуки 22 (55 мг, 0.16 ммоль) в оцтовій кислоті (3 мл) додавали [1-(4аміно-феніл)-5-метил-1H-[1,2,4]-триазол-3-іл]-(4метил-піперазин-1-іл)метанон зі стадії 2 (58 мг, 0.19 ммоль). Реакційну суміш нагрівали 2 години до 100°C. Суміш охолоджували й додавали 15 мл 2 н. NaOH. Продукт дробили, і тверду речовину збирали фільтруванням. Тверду речовину очищали за допомогою препаративної ВЕРХ і виділяли у вигляді білого твердого продукту (25 мг, 26%). + РХ-МС: rt 2.11 m/z 597 ЕР 1 H ЯМР (D6-ДМСО) 10.32 (1H, шир. s), 9.05 (1H, s), 8.88 (1H, s) 8.45 (1H, dd, J 7.5Гц, J 1.5Гц), 8.35 (1H, d, J 5Гц), 8.31 (1H, s), 8.08 (2H, m), 7.92 (2H, s), 7.86 (1H, s), 7.58 (1H,dd, J 10Гц, J 7.5Гц), 4.47 (2H, t, J 5Гц), 3.95 (2H, t, J 5Гц), 3.88 (4H, m), 3.57 (3H, перекривається з H2O), 3.53 (4H, перекривається з H2O), 2.78 (3H, s), 2.43 (3H, s) Приклад 35: 2-Метокси-4-[4-(4-[1,2,4]триазол1-іл-феніламіно)-хіназолін-6-іл]-фенол Стадія 1: N'-(3-Ціано-4'-гідрокси-3'-метоксибіфеніл-4-іл)-N,N-диметил-формамідин Суміш боронату (Aldrich, 2-метокси-4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2-іл)фенол, 500 мг, 1.2 екв.) і проміжної сполуки 2 (1 екв., 498 мг), карбонату калію (1.2 екв., 276 мг) у суміші ДМФА/H2O (3:1, 12 мл) обробляли PdCl2(PhCN)2 (2%, 13 мг) і перемішували при кімнатній температурі під N2 протягом 12 год. Суміш розбавляли 94601 54 водою (50 мл) і фільтрували через пластмасову фриту з відсмоктуванням. Осад на фільтрі промивали діетиловим ефіром і сушили у вакуумі з одержанням темно-червоної твердої речовини (390 мг, 79%), 1 H ЯМР (D6-ДМСО) 3.18 (6H, d); 3.98 (3H, s); 6.94 (1H, d), 7.2 (1H, d); 7.32 (3H, m); 7.88 (1H, d); 7.99 (1H, s); 8.11 (1H, s); 9.23 (1H, s); РХМС rt 1.93 + m/z 295 ЕР Стадія 2: 2-Метокси-4-[4-(4-[1,2,4]триазол-1-ілфеніламіно)-хіназолін-6-іл]-фенол Суміш N'-(3-ціано-4'-гідрокси-3'-метоксибіфеніл-4-іл)-N,N-диметил-формамідину (220 мг) і триазоліланіліну (113 мг) в оцтовій кислоті (2 мл) нагрівали до 125 протягом 2 годин. Охолоджену суміш розбавляли водою й фільтрували при відсмоктуванні протягом ночі. Одержану в результаті тверду речовину обробляли ультразвуком при нагріванні в ацетоні (20 мл) і фільтрували. Тверду речовину сушили з одержанням зазначеної в заголовку сполуки у вигляді жовтої твердої речовини (28 мг). 1 H ЯМР (D6-ДМСО) 3.86 (3H, s); 6.88 (1H, d); 7.28 (1H, d); 7.36 (1H, s); 7.82 (3H, m); 8.03 (2H, m); 8.15 (2H, m); 8.56 (1H, s); 8.69 (1H, s); 9.2 (2H, s); + 9.98 (1H, s); РХ-МС rt 2.14 m/z 411 ЕР Приклад 36: 2-Метокси-5-[4-(4-[1,2,4]триазол1-іл-феніламіно)-хіназолін-6-іл]-фенол Цю сполуку можна одержати методом, описаним у прикладі 35, відповідний боронат приготовляють із 5-бром-2-метоксифенолу, який одержували за реакцією Зандмейєра (див. JOC, 1993, 58, 1,42). Необхідну боронову кислоту/боронат можна одержати шляхом боронування, яке каталізується паладієм із застосуванням біс(пінаколато)борану, або за допомогою тимчасового захисту фенолу, а саме, дигідропіраном, наступного літування, реакції із триметоксиборатом і наступного гідролізу із супутнім видаленням захисної групи. Приклад 37: {6-[3-Фтор-4-(2-метоксі-етокси)феніл]-хіназолін-4-іл}-(2-метил-4-[1,2,4]триазол-1іл-феніл)-амін Цю сполуку можна одержати методом, описаним у прикладі 27, використовуючи відповідний формамідин, описаний як проміжна сполука 22. Приклад 38: активність HCV реплікону Речовини: Реплікон лінії клітин HCV● 1b реплікон (Huh.7) описаний в Science 285, 110-113. ○ Huh-9B: лінія клітин печінки з персистуючим біцистронним HCV генотипом 1b, кодуюча послідовність: [I 389lucubineo_3-3’_ET] включає злитий білок люциферази світляків-убіквітин-неоміцин фосфотрансфераза й EMCV-IRES регульованою неструктурною HCV (NS3-NS5B) кодуючою послідовністю, що включає адаптивні мутації культури клітин E1202 G, T1280I та K1846 T (Lohmann et al, 2001). Метод Цей аналіз здійснювали, використовуючи всі 96 лунки плоскодонних 96-лункових планшетів. Планшети підготовляли за один день до додавання сполук. Аналіз потім здійснювали 4 дні з ELISA 55 контролем змін, що відбуваються, на 5-й день. День 1 Підготовка планшетів для досліджень Експоненціально зростаючі моношари Huh-9B промивали стерильною PBS для видалення сироватки та обробляли трипсином для відділення клітин від колби. Клітини суспендували в середовищі для вирощування й підраховували, використовуючи підрахункову камеру. Один з пари 96 лункових план4 шетів засівали Huh-9B при густині 10 клітин/лунку при загальному об’ємі середовища для вирощування без антибіотиків 100 мкл/лунку, як представлено нижче. Один із планшетів являв собою непрозорий білий 96-лунковий планшет, використовуваний для визначення IC50 на основі люциферазного сигналу (згаданий далі як планшет для реплікону), інший із планшетів являв собою 96-лунковий планшет, використовуваний для паралельного визначення токсичності ліків за допомогою забарвлення метиленовим синім (згаданий далі як токс. планшет). Лунки G12 і H12 токс. планшета залишали без клітин для застосування як буфер для зняття тільки фонових значень. Планшети потім інкубували при 37 ºC у середовищі 5%-вого CO2 протягом 24 годин до одержання 90% моношару клітин, що зливаються. День 2 Додавання сполуки та розведення сполуки Подвоєні розведення кожної сполуки приготовляли в окремому 96-лунковому плоскодонному планшеті великої місткості шляхом розведення у два рази розчину з вихідною концентрацією, використовуючи для аналізів середовище для вирощування без антибіотиків. П'ять сполук (C1 - C5) тестували на кожному аналітичному планшеті, як показано нижче, плюс контрольні сполуки, які також включали в кожний планшет. Сполуки тестували у 8 точках серії подвоєних розведень. Вихідне розведення кожної сполуки, яка підлягає дослідженню, становило 25 мкМ і 12.5 мкМ - для контрольного сполуки. Лунки тільки із ДМСО (A1 і A2) при 1% забезпечували сигнал, що відповідає максимальному (100%) детектування люциферази. Попередні експерименти, проведені з метою оптимізації, показували незначний люциферазний сигнал від клітин, що не містять реплікон, причому рівень детектування контрольних лунок для визначення фону (неспецифічного), як прийнято, не включали. Сигнал із ДМСО лунки при 1% (максимальний сигнал) становив проміжок дослідження. З 2 × 96-ямкових планшетів для розведень, 100 мкл кожного розведення сполуки переносили, використовуючи багатоканальну піпетку в аналогі 94601 56 чні лунки планшета для реплікону й токс. планшета, що містять по 100 мкл середовища, одержуючи бажану кінцеву концентрацію. День 5 Етап детектування люциферази в планшеті для реплікону Середовище переносили з лунок в Virkon і планшети промивали один раз теплою PBS і обережно сушили. У кожну лунку багатоканальною піпеткою додавали 20 мкл буфера для лізису. Лізати були стабільними в цій точці протягом декількох годин. Буфер для люциферазного аналізу поміщали в люмінометр (Lmax, Molecular Devices). M-інжектор заповнювали 4 × 300 мкл буфера для люциферазного аналізу. Планшет, що підлягає аналізу, поміщали в люмінометр і 100 мкл буфера для люциферазного аналізу автоматично інжектували в одну лунку з наступними 4 секундами програми вимірювань. Через одну секунду затримки інжектували іншу лунку з 100 мкл буфера для люциферазного аналізу з наступними 4 секундами програми вимірювань й так далі, доти, поки всі 96 лунок не були проаналізовані. Коли зняття вимірів закінчили, інжекційну систему люмінометра промивали знесоленою водою. Одержані дані обробляли, використовуючи програмний пакет SOFTmax від Lmax Pro software. Визначення токсичності у токс. планшеті Середовище переносили з лунок в Virkon і планшети обережно сушили. До кожної лунки, включаючи контрольні (G12 та H12), додавали 100 мкл 0.5%-вого розчину метиленового синього в 50%-вому метанолі. Планшети залишали при кімнатній температурі принаймні на 1 годину. Планшети потім обережно промивали шляхом занурення в пластикову ємність із водою, обережно сушили й залишали відкритими доти, поки вони не були повністю сухими. Барвник розчиняли шляхом додавання 100 мкл 1%-вого лауроїлсаркозину до кожної лунки й перемішування протягом 1 години при 37°C. Показання знімали на спектрофотометрі SpectraMax при довжині хвилі 620 нм, використовуючи програмний пакет SOFTmax Pro software. Результати: Файл даних SOFTmax експортували в Excel або текстовий файл. Аналіз даних, стандартних чотирьох параметрів нелінійної регресії, одержаних для кожної сполуки, потім використовували для розрахунку IC50. У вищезгаданому аналізі дані по усіх лунках, що дублюються, усереднювали. Значення "% від контролю" потім розраховували для кожної концентрації у вигляді процентної частки від контрольної лунки із ДМСО. 57 *** Приклад № 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 94601 58 Реплікон IC50 Реплікон TD50 ** ** 25 мкМ, * * > 20 мкМ 2.0 АНТАГОНІЗМ 0.008 мкл / мл 0.067 мкМ ПІК 0.336 6 мкл / мл 0.2 мкМ Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюTriazoloanilinopyrimidine derivatives for use as antiviral agents
Автори англійськоюMathews Neil, Thomas Alexander James Floyd, Spencer Keith Charles, Tiberghien Nathalie, Pilkington Christopher John, Jennens Lyn, Chana Surinder, Fraser Ian John
Назва патенту російськоюПроизводные триазолоанилинопиримидина для применения в качестве противовирусного средства
Автори російськоюМетьюз Нейл, Томас Александер Джеймс Флойд, Спенсер Кит Чарлз, Тибергин Натали, Пилкингтон Кристофер Джон, Дженненз Лин, Чана Суриндер, Фрейзер Иан Джон
МПК / Мітки
МПК: C07D 403/14, C07D 403/12, A61K 31/505, C07D 401/14, C07D 405/14, C07D 409/14, A61P 31/14
Мітки: похідні, засоби, противірусні, застосування, триазолоанілінопіримідину
Код посилання
<a href="https://ua.patents.su/29-94601-pokhidni-triazoloanilinopirimidinu-dlya-zastosuvannya-yak-protivirusni-zasobi.html" target="_blank" rel="follow" title="База патентів України">Похідні триазолоанілінопіримідину для застосування як противірусні засоби</a>
Попередній патент: Індолсульфонамідні модулятори рецепторів прогестерону
Наступний патент: Інгібітори вірусної полімерази
Випадковий патент: Спосіб корекції системи антиоксидантного захисту у хворих на вегетативну дистонію з артеріальною гіпертензією












