Похідні 2-аміно-3-(імідазол-2-іл)-піридин-4-ону і їх застосування як інгібіторів кінази рецептора vegf
Номер патенту: 109942
Опубліковано: 26.10.2015
Автори: Рітцелер Олаф, Брон Ален, Лассалль Жільбер, Лорж Франц, Дюкло Олів'є, Стрюб Орелі, Мартен Валері
Формула / Реферат
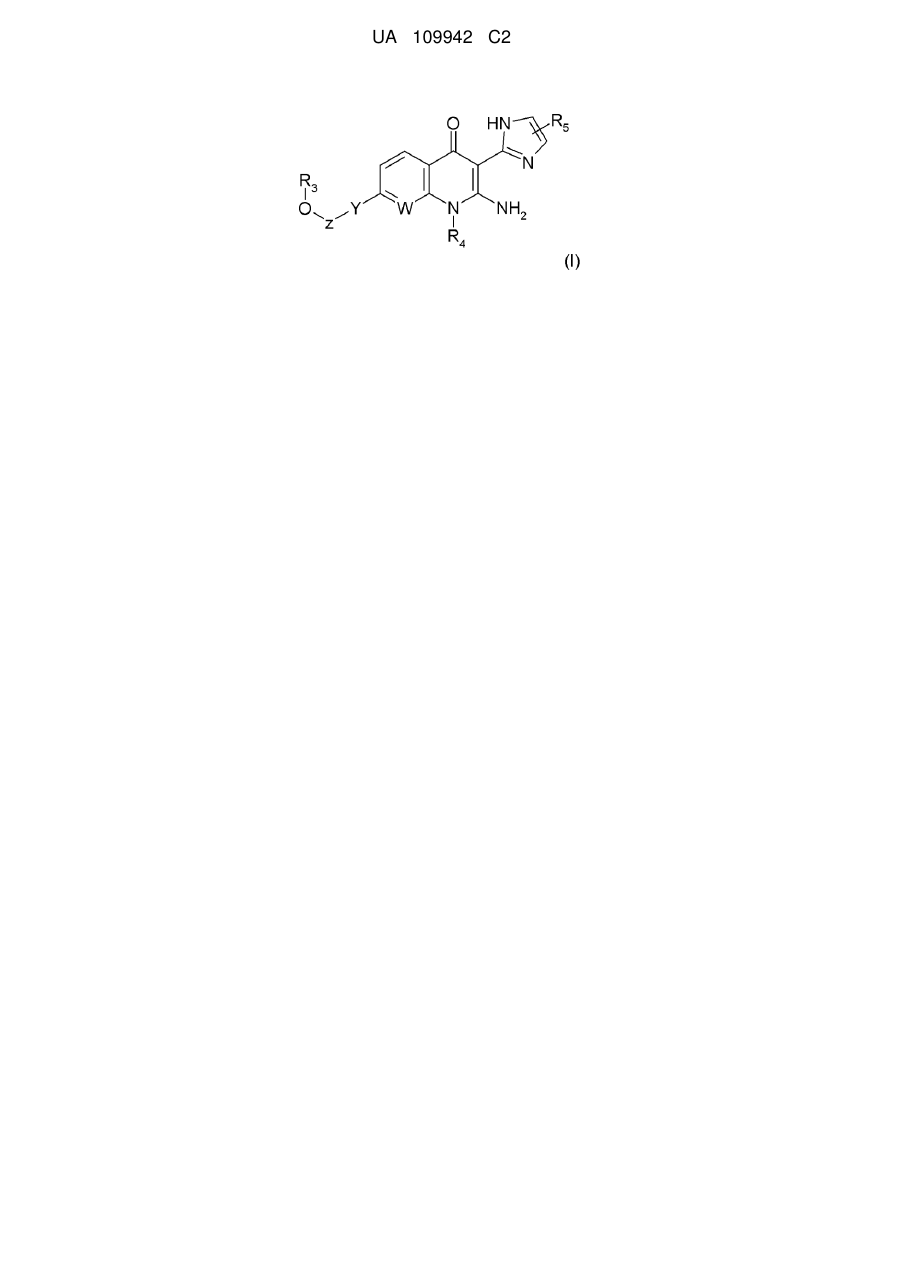
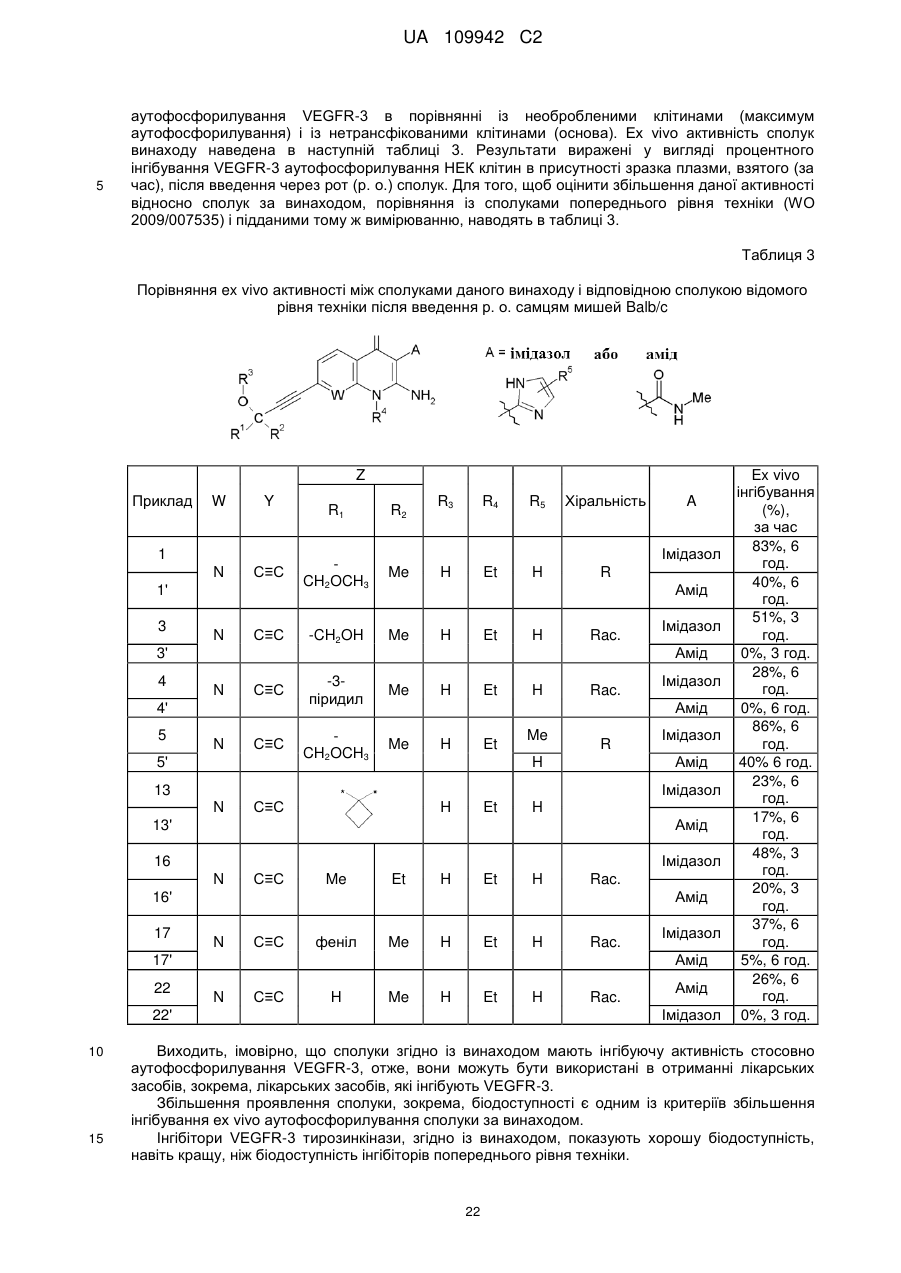
1. Сполука, яка відповідає формулі (І):
 , (I)
, (I)
в якій:
- W являє собою атом азоту або групу СН;
- Y являє собою С2-С3-алкінілен, 1,4-фенілен, необов'язково заміщений R7, який являє собою один або більше атомів галогену;
- Z являє собою зв'язок або групу CR1R2;
- R1 і R2, незалежно один від одного, являють собою групу, вибрану із атома водню, С1-С6-алкільної групи, трифторметильної групи, групи (CH2)nOR6, С3-С7-циклоалкілу, гетероарилу або арилу, необов'язково заміщеного одним або більше атомами галогену;
- R1 і R2 можуть утворювати разом із атомом вуглецю, до якого вони приєднані, С3-С7-циклоалкіл;
- R3 являє собою атом водню;
- R4 являє собою групу, вибрану із С1-С6-алкільної групи, групи (CH2)nOR6, C3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом;
- R5 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи;
- R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи;
- n дорівнює 1, 2 або 3;
у формі основи або кислотно-адитивної солі,
або її енантіомер або діастереоізомер або їх суміш.
2. Сполука формули (І) за п. 1, в якій W являє собою атом азоту або групу СН, у формі основи або кислотно-адитивної солі.
3. Сполука формули (І) за п. 1 або 2, в якій W являє собою атом азоту, у формі основи або кислотно-адитивної солі.
4. Сполука формули (І) за будь-яким із пп. 1-3, в якій Y являє собою С2-С3-алкінілен, більш конкретно етинілен, у формі основи або кислотно-адитивної солі.
5. Сполука формули (І) за будь-яким із пп. 1-4, в якій:
- Z являє собою зв'язок, групу CR1R2;
- R1 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи, групи (СН2)nOR6, С3-С7-циклоалкілу, арилу або 5- або 6-членного гетероарилу;
- R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу;
- R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи;
- n дорівнює 1, 2 або 3;
у формі основи або кислотно-адитивної солі.
6. Сполука формули (І) за будь-яким із пп. 1-5, в якій:
- Z являє собою групу CR1R2;
- R1 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу, арилу або 5- або 6-членного гетероарилу;
- R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу;
- R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; і
- n дорівнює 1, 2 або 3;
у формі основи або кислотно-адитивної солі.
7. Сполука формули (І) за будь-яким із пп. 1-6, в якій R4 являє собою групу, вибрану із С1-С6-алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом, у формі основи або кислотно-адитивної солі.
8. Сполука формули (І) за будь-яким із пп. 1-7, в якій R4 являє собою С1-С6-алкіл, більш конкретно етил, у формі основи або кислотно-адитивної солі.
9. Сполука формули (І) за будь-яким із пп. 1-8, в якій R5 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи, у формі основи або кислотно-адитивної солі.
10. Сполука формули (І) за будь-яким із пп. 1-9, в якій R5 являє собою атом водню, у формі основи або кислотно-адитивної солі.
11. Сполука формули (І) за будь-яким із пп. 1-10, в якій:
- W являє собою атом азоту або групу СН;
- Y являє собою С2-С3-алкілен, 1,4-фенілен, необов'язково заміщений R7, який являє собою атом галогену;
- Z являє собою зв'язок або групу CR1R2;
- R1 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу, арилу або 5- або 6-членного гетероарилу, необов'язково заміщеного атомом галогену;
- R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу;
- R3 являє собою атом водню;
- R4 являє собою групу, вибрану із С1-С6-алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом;
- R5 являє собою групу, вибрану із атома водню або C1-С6-алкільної групи;
- R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи;
- n дорівнює 1, 2 або 3;
у формі основи або кислотно-адитивної солі.
12. Сполука формули (І) за будь-яким із пп. 1-11, в якій R1 і R2 разом із атомом вуглецю, до якого вони приєднані, утворюють С3-С7-циклоалкіл, у формі основи або кислотно-адитивної солі.
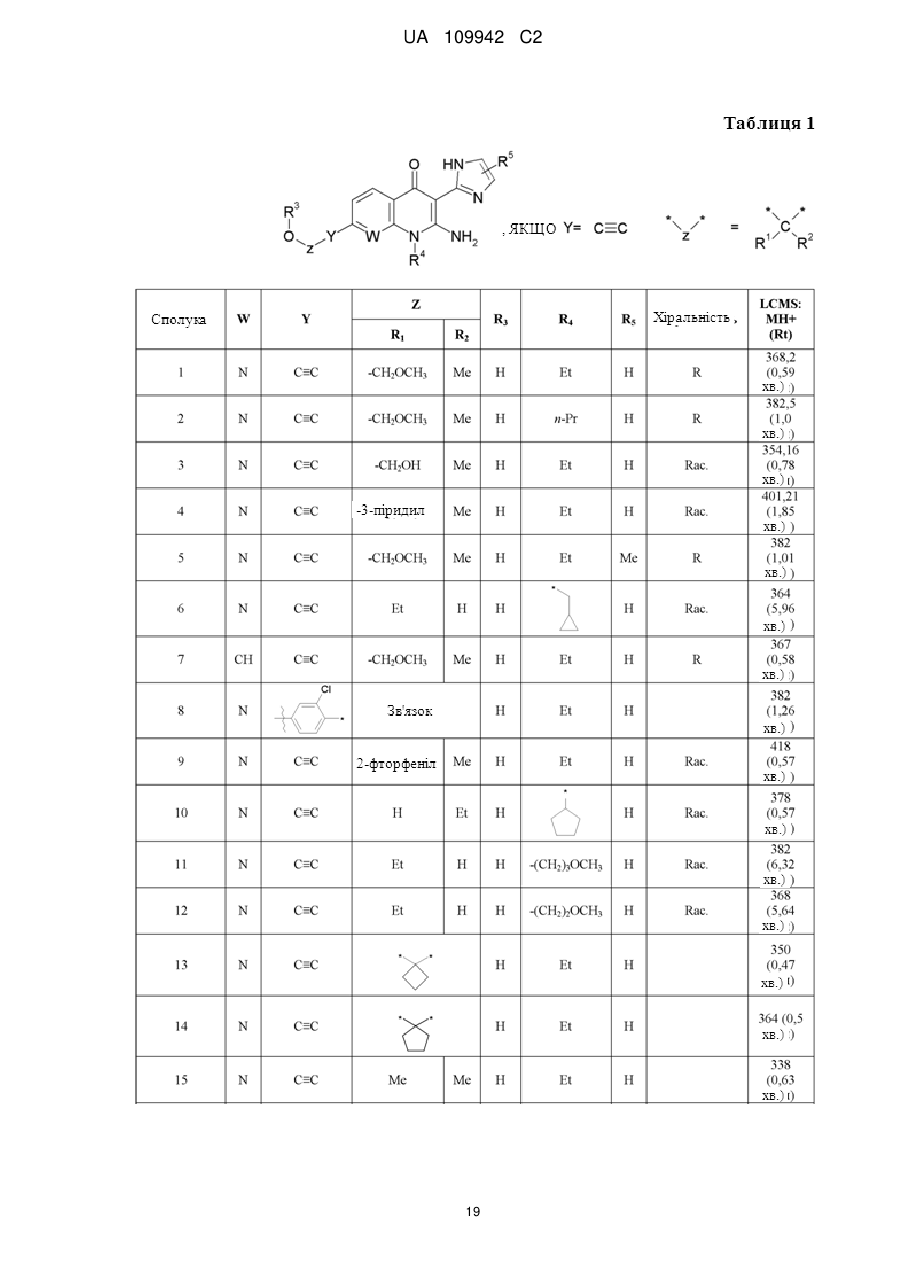
13. Сполука формули (І) за п. 1, вибрана з групи, що складається з:
2-аміно-1-етил-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-пропіл-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-7-(3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-(3-гідрокси-3-піридин-2-ілбут-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-[(3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл]-3-(4-метил-1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-(циклопропілметил)-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-eтил-7-[(3R)-3-гiдpoкcи-4-мeтoкcи-3-мeтилбyт-1-иніл]-3-(1Н-імідазол-2-іл)-1Н-хінолін-4-ону;
2-аміно-7-(3-хлор-4-гідроксифеніл)-1-етил-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-[3-(2-фторфеніл)-3-гідроксибут-1-иніл]-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-циклопентил-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1-(3-метоксипропіл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1-(2-метоксіетил)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-[(1-гідроксициклобутил)етиніл]-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-[(1-гідроксициклопентил)етиніл]-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-(3-гідрокси-3-метилбут-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-(3-гідрокси-3-метилпент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-(3-гідрокси-3-фенілбут-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-[3-(3-фторфеніл)-3-гідроксибут-1-иніл]-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-3-(1Н-імідазол-2-іл)-7-(4,4,4-трифтор-3-гідрокси-3-фенілбут-1-иніл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-7-(3-циклопропіл-3-гідроксибут-1-иніл)-1-етил-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-[3-гідрокси-3-(тіофен-2-іл)бут-1-иніл]-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-(3-гідроксибут-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-(3-гідроксигекс-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-(3-гідрокси-4-метилпент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-1-етил-7-(3-гідрокси-3-фенілпроп-1-ініл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону;
2-аміно-7-((3R)-3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1Н-імідазол-2-іл)-1,8-нафтиридин-4(1Н)-ону;
2-аміно-7-((3S)-3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1Н-імідазол-2-іл)-1,8-нафтиридин-4(1Н)-ону;
2-аміно-1-етил-7-((3S)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин-4(1H)-ону.
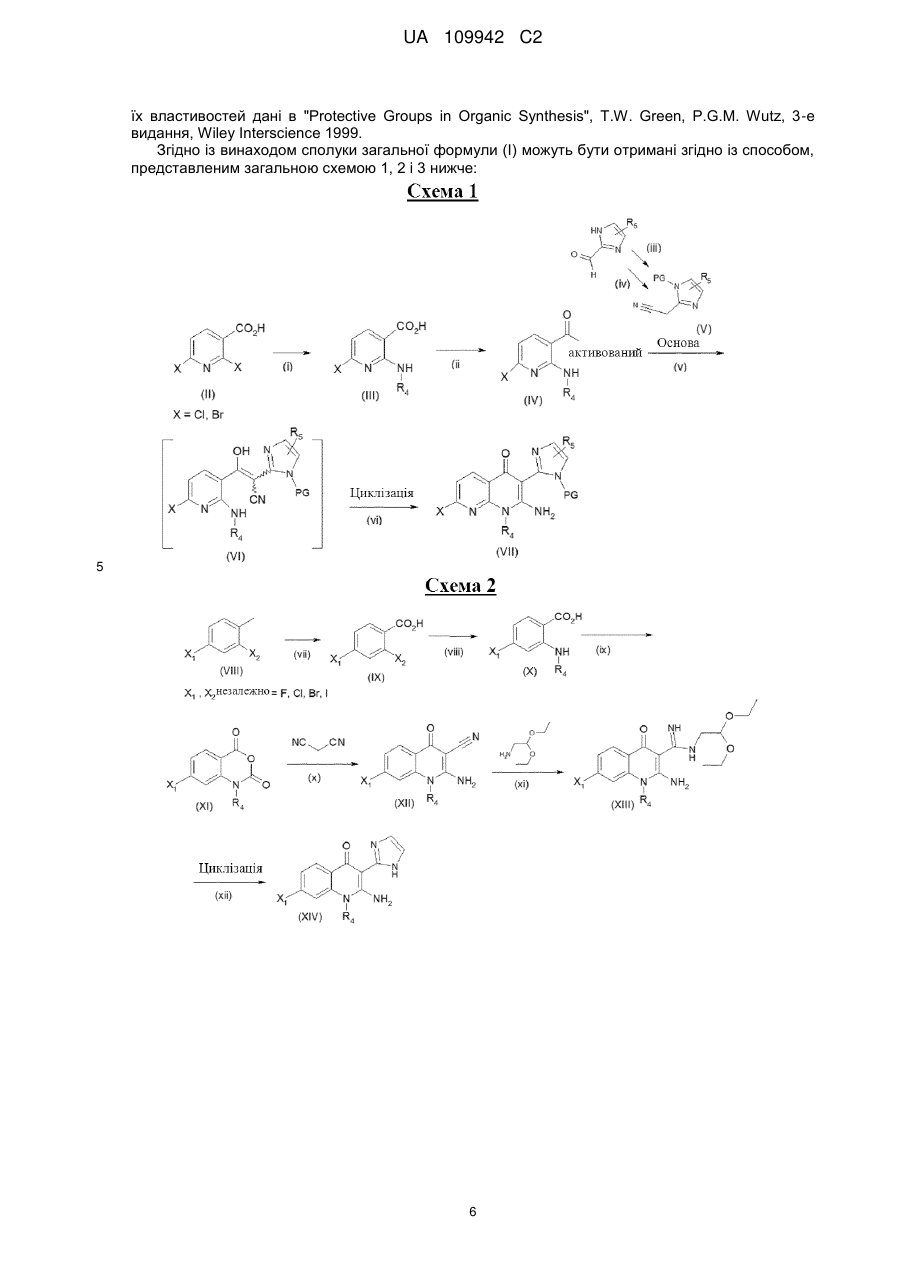
14. Спосіб отримання сполуки формули (І) за будь-яким із пп. 1-13, який характеризується тим, що сполуку формули (VII):
 , (VII)
, (VII)
в якій X являє собою хлор або бром, a R4 і R5 мають значення, як визначено в загальній формулі (І) за будь-яким із пп. 1-14,
піддають реакції із сполукою загальної формули (XVa):
 , (XVa)
, (XVa)
в якій R1, R2 і R3 мають значення, як визначено в загальній формулі (І), за будь-яким із пп. 1-13,
або піддають реакції із сполуками загальної формули (XVb):
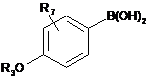 , (XVb)
, (XVb)
в якій R3 і R7 мають значення, як визначено в загальній формулі (І), за будь-яким із пп. 1-13,
загальноприйняту стадію зняття захисту проводять до або після реакції сполуки формули (VII) із сполукою загальної формули (XVa) або із сполукою загальної формули (XVb).
15. Лікарський засіб, який містить сполуку формули (І) за будь-яким із пп. 1-13 або її фармацевтично прийнятну сіль або енантіомер або діастереоізомер або їх суміш.
16. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-13 або її фармацевтично прийнятну сіль або енантіомер, або діастереоізомер або їх суміш, а також щонайменше один фармацевтично прийнятний ексципієнт.
17. Комбінація сполуки формули (І) за будь-яким із пп. 1-13 із щонайменше одним терапевтичним агентом, вибраним із:
- алкілуючих агентів,
- інтеркалюючих агентів,
- антимікротубулінових агентів,
- антимітотичних агентів,
- антиметаболітів,
- антипроліферативних агентів,
- антибіотиків,
- імуномодулюючих речовин,
- протизапальних агентів,
- інгібіторів кінази,
- антиангіогенних агентів,
- антиваскулярних агентів,
- естрогенних і андрогенних гормонів.
18. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування захворювань, в які залучений VEGFR-3.
19. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування раку і метастазів.
20. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування захворювань, таких як гліобластома, множинна мієлома, мієлодиспластичний синдром, саркома Капоші, шкірна ангіосаркома, солідні пухлини, лімфома, меланома, рак грудей, колоректальний рак, рак легень, включаючи недрібноклітинний рак, рак підшлункової залози, рак простати, рак нирок, рак голови і шиї, рак печінки, рак яєчників, рак дихального тракту і грудної клітки або інші пухлини, які експресують VEGFR-3 або залучають процес ангіогенезу або лімфоангіогенезу.
21. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування неонкологічних проліферативних захворювань і патологічного ангіогенезу, пов'язаного із VEGFR-3.
22. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування захворювань, вибраних із групи, яка складається із артрозу, рестенозу, псоріазу, гемангіоми, лімфангіоми, глаукоми, гломерунефриту, діабетичної нефропатії, нефросклерозу, тромботичного мікроангіопатичного синдрому, цирозу печінки, атеросклерозу, відторгнення трансплантованого органа, захворювань очей, які включають процес ангіогенезу або лімфоангіогенезу.
23. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування хронічного або нехронічного запалення, інфікування мікроорганізмами і аутоімунних захворювань, таких як ревматоїдний артрит.
24. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування рідкісних захворювань, таких як лімфангіолейоміоматоз або хвороба Горхема.
Текст
Реферат: Винахід стосується сполук загальної формули (І); способу їх отримання і терапевтичного застосування. O R5 HN N R3 O z Y W N R4 NH2 (I) UA 109942 C2 (12) UA 109942 C2 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід стосується похідних 7-фенол- або 7-алкініл-3-(імідазол-2-іл)-1,8-нафтиридин4-ону і їх можливих хінолінонових аналогів, які є інгібіторами кіназної активності рецептора VEGF, їх отримання і їх терапевтичного застосування. Сімейство білків VEGF (фактор росту ендотелію судин) зв'язується із трьома структурно спорідненими рецепторними тирозинкіназами, відомими як VEGF-R1 (Flt-1), VEGF-R2 (KDR), VEGF-R3 (Flt-4). Всі три рецептори є життєво важливими для розвитку судинної системи під час ембріогенезу і під час індукованого пухлиною ангіогенезу. У доповнення VEGFR-3 грає важливу роль у розвитку лімфатичної системи і в індукованому пухлиною лімфоангіогенезі. Зокрема, WO 2009/007535 описує заміщені похідні 7-алкініл-4-оксо-1,8-нафтиридин-3карбоксамідів, які є інгібіторами кіназної активності рецептора VEGF. Сполуки даного винаходу відрізняються від цих сполук попереднього рівня техніки щонайменше присутністю імідазольного кільця в 3-положенні біциклу. Критеріями, які потрібно брати до уваги при розробці лікарського засобу, є вплив сполуки на тканини і її ефективність. Дані критерії могли б бути підвищені шляхом поліпшення щонайменше одного із наступних показників серед ефективності, абсорбції, розподілу, метаболізму, виведення із організму і токсичності. Залишається необхідність в усуненні інгібіторів кіназної активності рецептора VEGF із підвищеною активністю, і це успішно досягається із новими сполуками згідно із винаходом. Перший об'єкт винаходу стосується сполук, відповідних загальній формулі (I), представленій далі. Інший об'єкт винаходу стосується способів отримання сполук загальної формули (I). Інший об'єкт винаходу стосується застосування сполук загальної формули (I), особливо в лікарських засобах і фармацевтичних композиціях. Сполуки за винаходом відповідають загальній формулі (I): в якій: - W являє собою атом азоту або групу СН; - Y являє собою С2-С3-алкінілен, 1,4-фенілен, необов'язково заміщений R7, який являє собою один або більше атом(ів) галогену; - Z являє собою зв'язок або групу СR1R2; - R1 і R2, незалежно один від одного, являють собою групу, вибрану із атома водню, С 1-С6алкільної групи, трифторметильної групи, групи (CH2)nOR6, С3-С7-циклоалкілу, гетероарилу або арилу, необов'язково заміщеного одним або більше атомом(ами) галогену; - R1 і R2 можуть утворювати разом із атомом вуглецю, до якого вони приєднані, С 3-С7циклоалкіл; - R3 являє собою атом водню; - R4 являє собою групу, вибрану із С1-С6-алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом; - R5 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - n дорівнює 1, 2 або 3. Сполуки формули (I) можуть включати один або більше асиметричних атомів вуглецю. Вони можуть, таким чином, існувати у вигляді енантіомерів або діастереомерів. Ці енантіомери і діастереомери, а також їх суміші, включаючи рацемічні суміші, становлять частину винаходу. Сполуки формули (I) можуть існувати у вигляді основ або кислотно-адитивних солей. Такі адитивні солі становлять частину винаходу. Ці солі можуть бути отримані із фармацевтично прийнятними кислотами, але солі інших кислот, які також є корисними, наприклад, для очищення або виділення сполук формули (I), також становлять частину винаходу. У контексті даного винаходу застосовують наступні позначення: - атом галогену: атом фтору, хлору, брому або йоду; 1 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 - Сt-Сz: ланцюг на основі вуглецю, який можливо містить від t до z атомів вуглецю, в якому t і z можуть мати значення від 1 до 7; наприклад, С1-С3: ланцюг на основі вуглецю, який можливо містить від 1 до 3 атомів вуглецю; - алкіл: лінійна або розгалужена насичена аліфатична група. Приклади, які можуть бути згадані, включають метил, етил, н-пропіл, ізопропіл, бутил, ізобутил, трет-бутил, пентил, і т. д.; - алкілен: бівалентний радикал, отриманий із алкану шляхом видалення атома водню від кожного із двох кінцевих атомів вуглецю ланцюга, необов'язково заміщеного алкільною групою; наприклад, С1-С3-алкілен являє собою лінійний або розгалужений двовалентний ланцюг на основі вуглецю із 1-3 атомів вуглецю, більш конкретно метилен, етилен, метилетилен або пропілен; - алкенілен: бівалентний радикал, отриманий із алкену шляхом видалення атома водню від кожного із двох кінцевих атомів вуглецю ланцюга, необов'язково заміщеного алкільною або алкенільною групою; наприклад, С2-С3-алкенілен являє собою лінійний або розгалужений двовалентний ланцюг на основі вуглецю із 2-3 атомів вуглецю, більш конкретно етенілен або пропенілен; - алкінілен: бівалентний радикал, отриманий із алкіну шляхом видалення атома водню від кожного із двох кінцевих атомів вуглецю ланцюга, необов'язково заміщеного алкільною, алкенільною або алкінільною групою; наприклад, С2-С3-алкінілен являє собою лінійний або розгалужений двовалентний ланцюг на основі вуглецю із 2-3 атомів вуглецю, більш конкретно етинілен або пропінілен; - циклоалкіл: насичена або частково ненасичена циклічна алкільна група. Приклади, які можуть бути згадані, включають циклопропільну, циклобутильну, циклопентильну, циклогексильну, циклопропенільну, циклобутенільну, циклопентенільну, циклогексенільну групи і т. д.; - циклоалкілокси: радикал-О-циклоалкіл, в якому циклоалкільна група є такою, як визначено вище; - фторалкіл: алкільна група, в якій один або більше атомів водню замінені атомом фтору; - алкокси: радикал-О-алкіл, в якому алкільна група є такою, як визначено вище; - фторалкокси: алкоксигрупа, в якій один або більше атомів водню замінені атомом фтору; - тіоалкіл або алкілтіо: радикал-S-алкіл, в якому алкільна група є такою, як визначено вище; - арил: моноциклічна або біциклічна ароматична група, яка містить від 6 до 10 атомів вуглецю. Приклади арильних груп, які можуть бути згадані, включають фенільну і нафтильну групи; - арилен: бівалентна група, отримана із арилу шляхом видалення атома водню від двох кільцевих атомів вуглецю. Приклади ариленової групи, які можуть бути згадані, включають феніленову групу; - гетероцикл: насичена або частково ненасичена 5-7-членна моноциклічна група, яка включає від 1 до 3 гетероатомів, вибраних із О, S і N. Приклади гетероциклів, які можуть бути згадані, включають азетидиніл, піперидиніл, азепініл, морфолініл, тіоморфолініл, піперазиніл, гомопіперазиніл, дигідрооксазоліл, дигідротіазоліл, дигідроімідазоліл, дигідропіроліл або тетрагідропіридил, [1,3]діоксоліл, [1,3]діоксиніл, дигідро[1,4]діоксиніл, дигідро[1,2]оксазиніл, дигідро[1,3]оксазиніл, дигідрооксазоліл, дигідроізоксазоліл, дигідро[1,4]оксазиніл, тетрагідро[1,3]оксазепініл, тетрагідро[1,4]оксазепініл, тетрагідро[1,3]діазепініл і тетрагідро[1,4]діазепініл; - гетероарил: 5-12-членна моноциклічна або біциклічна ароматична група, яка містить від 1 до 5 гетероатомів, вибраних із О, S і N. Приклади моноциклічних гетероарилів, які можуть бути згадані, включають імідазоліл, піразоліл, тіазоліл, оксазоліл, ізотіазоліл, ізоксазоліл, фурил, тієніл, оксадіазоліл, тіадіазоліл, триазоліл, тетразоліл, піридил, піразиніл, піримідиніл, піридазиніл і триазиніл. Приклади біциклічних гетероарилів, які можуть бути згадані, включають індоліл, ізоіндоліл, бензофурил, бензотіофеніл, бензоксазоліл, бензімідазоліл, індазоліл, бензотієніл, ізобензофурил, ізобензотіазоліл, піроло[2,3-с]піридил, піроло[2,3-b]піридил, піроло[3,2-b]піридил, піроло[3,2-с]піридил, піроло[1,2-а]піридил, хіноліл, ізохіноліл, цинолініл, хіназолініл, хіноксалініл, піроло[1,2-а]імідазоліл, імідазо[1,2-а]піридил, імідазо[1,2-а]піридазиніл, імідазо[1,2-с]піримідиніл, імідазо[1,2-а]піримідиніл, імідазо[1,2-а]піразиніл, імідазо[4,5b]піразиніл, імідазо[4,5-b]піридил, імідазо[4,5-с]піридил, піразоло[2,3-а]піридил, піразоло[2,3а]піримідиніл, піразоло[2,3-а]піразиніл, тіазоло[5,4-b]піридил, тіазоло[5,4-с]піридил, тіазоло[4,5с]піридил, тіазоло[4,5-b]піридил, оксазоло[5,4-b]піридил, оксазоло[5,4-с]піридил, оксазоло[4,5с]піридил, оксазоло[4,5-b]піридил, ізотіазоло[5,4-b]піридил, ізотіазоло[5,4-с]піридил, ізотіазоло[4,5-с]піридил, ізотіазоло[4,5-b]піридил, ізоксазоло[5,4-b]піридил, ізоксазоло[5,4с]піридил, ізоксазоло[4,5-с]піридил і ізоксазоло[4,5-b]піридил. 2 UA 109942 C2 - "оксо" означає "=О"; - "тіо" означає "-S-". У контексті даного винаходу використовуються наступні скорочення і емпіричні формули: трет-бутилоксикарбоніл йодид міді (I) дихлорметан високоефективна рідинна HPLC хроматографія рідинна хроматографія/масLC/MS спектрометрія dba дибензиліденацетон DCM дихлорметан DME диметоксіетан DMF диметилформамід ДМСО диметилсульфоксид dppf 1,1'-біс(дифенілфосфіно)фероцен °С градус Цельсія Et3N триетиламін год. година(и) HCl соляна кислота ІЧ інфрачервоний MeOH метанол хв. хвилини мл мілілітр MgSO4 сульфат магнію NaCl хлорид натрію NH4Cl хлорид амонію NH4OH гідроксид амонію NaHCO3 бікарбонат натрію Na2SO4 сульфат натрію ЯМР ядерно-магнітний резонанс Rt час утримування SEM [2-(триметилсиліл)етокси]метил THF тетрагідрофуран TOSMIC тозилметилізоціанід Тритил трифенілметил 2-дициклогексилфосфіно-2', 4', 6'Xphos триізопропілбіфеніл Boc CuI CH2Cl2 5 10 15 20 Серед сполук загальної формули (I), які є об'єктами винаходу, першу підгрупу сполук складають сполуки, для яких W являє собою атом азоту або групу СН. Серед сполук загальної формули (I), які є об'єктами винаходу, другу підгрупу сполук складають сполуки, для яких W являє собою атом азоту. Серед сполук загальної формули (I), які є об'єктами винаходу, третю підгрупу сполук складають сполуки, для яких Y являє собою С2-С3-алкінілен, більш конкретно етинілен. Серед сполук загальної формули (I), які є об'єктами винаходу, четверту підгрупу сполук складають сполуки, для яких: - Z являє собою зв'язок, групу СR1R2; - R1 являє собою групу, вибрану із атома водню, С 1-С6-алкільної групи, групи (CH2)nOR6, С3С7-циклоалкілу, арилу або 5- або 6-членного гетероарилу, необов'язково заміщеного одним або більше атомом(ами) галогену; - R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу; - R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - n дорівнює 1, 2 або 3. Серед сполук загальної формули (I), які є об'єктами винаходу, п'яту підгрупу сполук складають сполуки, для яких: - Z являє собою групу СR1R2; 3 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 - R1 являє собою групу, вибрану із атома водню, С 1-С6-алкільної групи, групи (CH2)nOR6, С3С7-циклоалкілу, арилу або 5- або 6-членного гетероарилу; - R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу; - R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; і - n дорівнює 1, 2 або 3. Коли Y являє собою С2-С3-алкінілен, більш конкретно етинілен, тоді Z являє собою групу CR1R2, причому R1 і R2 мають значення, визначені вище. Серед сполук загальної формули (I), які є об'єктами винаходу, шосту підгрупу сполук складають сполуки, для яких R4 являє собою групу, вибрану із С1-С6-алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом. Серед сполук загальної формули (I), які є об'єктами винаходу, сьому підгрупу сполук складають сполуки, для яких R4 являє собою С1-С6-алкіл, більш конкретно етил. Серед сполук загальної формули (I), які є об'єктами винаходу, восьму підгрупу сполук складають сполуки, для яких R5 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи. Серед сполук загальної формули (I), які є об'єктами винаходу, дев'яту підгрупу сполук складають сполуки, для яких R5 являє собою атом водню. Серед сполук загальної формули (I), які є об'єктами винаходу, десяту підгрупу сполук складають сполуки, для яких об'єднані визначення W, Е, Z, R3, R4 і R5, дані вище. Серед сполук загальної формули (I), які є об'єктами винаходу, одинадцяту підгрупу сполук складають сполуки, для яких: - W являє собою атом азоту або групу СН; - Y являє собою С2-С3-алкінілен, 1,4-фенілен, необов'язково заміщений атомом галогену; - Z являє собою зв'язок, групу СR1R2; - R1 являє собою групу, вибрану із атома водню, С 1-С6-алкільної групи, групи (CH2)nOR6, С3С7-циклоалкілу, арилу або 5- або 6-членного гетероарилу, необов'язково заміщеного атомом галогену; - R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу; - R3 являє собою атом водню; - R4 являє собою групу, вибрану із С1-С6-алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом; - R5 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - n дорівнює 1, 2 або 3. Серед сполук загальної формули (I), які є об'єктами винаходу, дванадцяту підгрупу сполук складають сполуки, для яких: - W являє собою атом азоту або групу СН; - Y являє собою групу С2-С3-алкінілен; - Z являє собою групу СR1R2; - R1 являє собою групу, вибрану із атома водню, С 1-С6-алкільної групи, групи (CH2)nOR6, С3С7-циклоалкілу, арилу або 5- або 6-членного гетероарилу, необов'язково заміщеного атомом галогену; - R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу; - R3 являє собою атом водню; - R4 являє собою групу, вибрану із С1-С6-алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом; - R5 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - n дорівнює 1, 2 або 3. Серед сполук загальної формули (I), які є об'єктами винаходу, тринадцяту підгрупу сполук складають сполуки, для яких R1 і R3 утворюють разом із атомом вуглецю, до якого вони приєднані, С3-С7-циклоалкіл. Само собою зрозуміло, кожна із цих підгруп, згаданих вище, може бути об'єднана із однією або більше іншими підгрупами, і відповідні сполуки також є об'єктами винаходу. Серед сполук загальної формули (I), які є об'єктами винаходу, особливо можуть бути згадані наступні сполуки: 1: 2-аміно-1-етил-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1H[1,8]нафтиридин-4-он; 2: 2-аміно-1-пропіл-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1H[1,8]нафтиридин-4-он; 4 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 3: 2-аміно-7-(3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1H-імідазол-2-іл)-1H[1,8]нафтиридин-4-он; 4: 2-аміно-1-етил-7-(3-гідрокси-3-піридин-2-ілбут-1-иніл)-3-(1H-імідазол-2-іл)-1H[1,8]нафтиридин-4-он; 5: 2-аміно-1-етил-7-[(3R)-3-гідрокси-4-метокси-3-метилбут-1-ин-1-іл]-3-(4-метил-1H-імідазол2-іл)-1,8-нафтиридин-4(1H)-он; 6: 2-аміно-1-(циклопропілметил)-7-(3-гідроксипент-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1H)-он; 7: 2-аміно-1-етил-7-[(3R)-3-гідрокси-4-метокси-3-метилбут-1-ин-1-іл]-3-(1H-імідазол-2іл)хінолін-4(1H)-он; 8: 2-аміно-7-(3-хлор-4-гідроксифеніл)-1-етил-3-(1H-імідазол-2-іл)-1,8-нафтиридин-4(1H)-он; 9: 2-аміно-1-етил-7-[3-(2-фторфеніл)-3-гідроксибут-1-ин-1-іл]-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1H)-он; 10: 2-аміно-1-циклопентил-7-(3-гідроксипент-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин4(1Н)-он; 11: 2-аміно-7-(3-гідроксипент-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1-(3-метоксипропіл)-1,8нафтиридин-4(1Н)-он; 12: 2-аміно-7-(3-гідроксипент-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1-(2-метоксіетил)-1,8нафтиридин-4(1Н)-он; 13: 2-аміно-1-етил-7-[(1-гідроксициклобутил)етиніл]-3-(1H-імідазол-2-іл)-1,8-нафтиридин4(1H)-он; 14: 2-аміно-1-етил-7-[(1-гідроксициклопентил)етиніл]-3-(1H-імідазол-2-іл)-1,8-нафтиридин4(1H)-он; 15: 2-аміно-1-етил-7-(3-гідрокси-3-метилбут-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин4(1Н)-он; 16: 2-аміно-1-етил-7-(3-гідрокси-3-метилпент-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин4(1Н)-он; 17: 2-аміно-1-етил-7-(3-гідрокси-3-фенілбут-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин4(1Н)-он; 18: 2-аміно-1-етил-7-[3-(3-фторфеніл)-3-гідроксибут-1-ин-1-іл]-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1H)-он; 19: 2-аміно-1-етил-3-(1Н-імідазол-2-іл)-7-(4,4,4-трифтор-3-гідрокси-3-фенілбут-1-ин-1-іл)-1,8нафтиридин-4(1Н)-он; 20: 2-аміно-7-(3-циклопропіл-3-гідроксибут-1-ин-1-іл)-1-етил-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1H)-он; 21: 2-аміно-1-етил-7-[3-гідрокси-3-(тіофен-2-іл)бут-1-ин-1-іл]-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1H)-он; 22: 2-аміно-1-етил-7-(3-гідроксибут-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин-4(1Н)-он; 23: 2-аміно-1-етил-7-(3-гідроксипент-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин-4(1Н)-он; 24: 2-аміно-1-етил-7-(3-гідроксигекс-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин-4(1Н)-он; 25: 2-аміно-1-етил-7-(3-гідрокси-4-метилпент-1-ин-1-іл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин4(1Н)-он; 26: 2-аміно-1-етил-7-(3-гідрокси-3-фенілпроп-1-ін-1-іл)-3-(1H-імідазол-2-іл)-1,8-нафтиридин4(1Н)-он; 27: 2-аміно-7-((3R)-3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1Н)-он; 28: 2-аміно-7-((3S)-3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1Н)-он; 29: 2-аміно-1-етил-7-((3S)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1Н)-он. Далі в тексті термін "відхідна група" означає групу, яка може бути легко відщеплена від молекули шляхом розриву гетеролітичного зв'язку із втратою електронної пари. Дана група, таким чином, може бути легко замінена іншою групою, наприклад, під час реакції заміщення. Такими відхідними групами є, наприклад, галогени або активована гідроксильна група, така як метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат, і ін. Приклади відхідних груп і посилання на їх отримання дані в "Advances in Organic Chemistry", J. March, 5-е видання, Wiley Interscience, 2001. Далі в тексті термін "захисна група" (PG) означає групу, яка може бути негайно включена в хімічну структуру із метою тимчасової інактивації частини молекули під час реакції і, яка може бути легко видалена на наступній стадії синтезу. Приклади захисних груп і посилання відносно 5 UA 109942 C2 їх властивостей дані в "Protective Groups in Organic Synthesis", T.W. Green, P.G.M. Wutz, 3-е видання, Wiley Interscience 1999. Згідно із винаходом сполуки загальної формули (I) можуть бути отримані згідно із способом, представленим загальною схемою 1, 2 і 3 нижче: 5 6 UA 109942 C2 5 10 15 20 25 30 35 40 45 Згідно із схемою 1 на стадії (i) 2,6-дигалогеннікотинову кислоту формули (II) піддають монозаміщенню у 2-положенні аміном формули R4-NH2 (де R4 має значення, як визначено раніше відносно сполуки формули (I)), при кімнатній температурі або при температурі від 50°С до 100°С, із звичайним нагрівом або мікрохвильовим нагріванням і в протонному розчиннику, такому як спирт, наприклад, етанол, н-бутанол, трет-бутанол або вода. Кислоту (III), отриману на стадії (i), потім активують до похідного формули (IV), на наступній стадії (ii), або у вигляді фторангідриду шляхом активації ціанурилфториду при кімнатній температурі в присутності основи, такої як триетиламін або піридин, і в апротонному розчиннику, такому як дихлорметан або THF, як описано авторами G. Olah і іншими в Synthesis (1973), 487, або у вигляді імідазолу шляхом активації карбонілдіімідазолу в полярному апротонному розчиннику, такому як DMF або THF, або будь-якими іншими методами, відомими фахівцям в даній галузі, такими, як описані авторами Mukaiyama і Tanaka в Chem. Lett. (1976), 303 або авторами Ishikawa і Sasaki в Chem. Lett. (1976), 1407. Ціанометилімідазоли формули (V) отримують шляхом проведення двох стадій із імідазол-2карбоксальдегіду, незаміщеного або заміщеного в положенні (4,5) імідазолу. На стадії (iii) вільний азот імідазол-2-карбоксальдегіду захищають захисною групою, позначеною PG на схемі 1, наприклад, такої як SEM, Boc або тритильна група, в звичайних робочих умовах, відомих фахівцям в даній галузі, як описано, наприклад, в "Protective Groups in Organic Synthesis", Green et al., 3-е видання (John Wiley & Sons, Inc. New York). Якщо застосовано, два ізомери Tau і Pi захищеного імідазолу отримують і використовують без розмежування в подальших реакціях. Захищений імідазол-2-карбоксальдегід потім перетворюють на стадії (iv) в ціанометилімідазол формули (V) шляхом взаємодії альдегідної функціональної групи із аніоном TOSMIC, утвореному шляхом додавання трет-бутилату калію до безводного DME розчину TOSMIC при низькій температурі (-50°С), із подальшим розкриттям кільця утвореного аніонного похідного, 4тозил-2-оксазоліну, потім реакційну суміш нагрівають при температурі кипіння із зворотним холодильником у присутності метанолу, щоб допустити утворення ацетилнітрильної функціональної групи, додержуючись методики, описаної Van Leusen A. et al. (Synthetic Comm, 10(5) 1980, 399-403). Фторангідрид або імідазол формули (IV), отриманий в кінці стадії (ii), дуже реакційноздатний, але стабільний, піддають потім реакції на стадії (v) із ціанометилімідазолом формули (V), незаміщеним або заміщеним в положенні (4,5), в присутності одного еквівалента основи, такого як гідрид натрію або трет-бутоксид калію, в полярному апротонному розчиннику, такому як THF або DMF, при температурі від -5°С до кімнатної температури, потім додають другий еквівалент застосованої основи і сполуки формули (VI), яка при цьому утвориться, піддають циклізації in situ, при кімнатній температурі, даючи піримідино-піридинонову сполуку формули (VII), на наступній стадії (vi). Згідно із схемою 2, на стадії (vii) 2,4-дигалогентолуол формули (VIII) окисляють до відповідного похідного кислоти (IX) із використанням сильного окислювача, такого як перманганат калію, при кімнатній температурі або при температурі від 50°С до 100°С, із звичайним нагрівом або мікрохвильовим нагріванням і в протонному розчиннику, такому як вода, і в присутності основи, такої як піридин, або будь-якими іншими методами, відомими фахівцям в даній галузі, такими, як описані в наступному патенті: US 6187950. Кислоту (IX), отриману на стадії (vii), піддають монозаміщенню в положенні 2 аміном формули R 4-NH2 (де R4 має значення, як визначено раніше відносно сполук формули (I)), при кімнатній температурі або 7 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 при температурі від 50°С до 100°С, із звичайним нагрівом або мікрохвильовим нагріванням і в протонному розчиннику, такому як спирт, наприклад, етанол, н-бутанол, трет-бутанол або вода. Кислоту (Х), отриману на стадії (viii), потім циклізують в бензо-1,3-оксазин-2,4-діон (XI) під впливом карбонілдіімідазолу або трифосгена при кімнатній температурі або при температурі від 50°С до 120°С, із звичайним нагрівом або мікрохвильовим нагріванням і в апротонному розчиннику, такому як DMF, толуол, THF, діоксан. Бензо-1,3-оксазин-2,4-діон (ХI) потім обробляють малононітрилом при кімнатній температурі або при температурі від 50°С до 120°С, із звичайним нагрівом або мікрохвильовим нагріванням і в апротонному розчиннику, такому як DMF, толуол, діоксан, і в присутності основи, такої як триетиламін або піридин, або будь-якими іншими методами, відомими фахівцям в даній галузі, такими, як описано авторами Iminov et al. в Synthesis (2008), 1535, із отриманням нітрилу (XII). Даний нітрил (XII), отриманий на стадії (Х), взаємодіє із аміноацетальдегід діетилацеталем в присутності мідного каталізатора, такого як CuCl, при кімнатній температурі або при температурі від 50°С до 120°С із звичайним нагрівом або мікрохвильовим нагріванням і в апротонному розчиннику, такому як DME, DMF, толуол, діоксан. Ацеталь (XIII), отриманий на стадії (xi), піддавали потім циклізації в імідазол (XIV) із застосуванням умов сильної кислоти, такої як HCl (12 н.) при кімнатній температурі або при температурі від 50°С до 120°С, із звичайним нагрівом або мікрохвильовим нагріванням і в протонному розчиннику, такому як спирт, наприклад етанол, н-бутанол, трет-бутанол або вода. Для отримання сполук формули (I), згідно із даним винаходом, можуть застосовуватися два способи, описані на схемі 3, починаючи із галогенованих проміжних сполук формули (VII) або (XIV). Додержуючись першого способу, який веде до сполуки формули (I), яка є предметом даного винаходу, на стадії (xiii) застосовують галогеновану проміжну сполуку формули (VII) або (XIV), або в реакції поєднання Соногашира із придатним похідним пропаргілового спирту R1R2CH(OR3)С≡СН формули (XVa), де R1, R2 і R3 мають значення, як визначено раніше, або в реакції поєднання Сузукі із придатною арилбороновою кислотою формули (XVb). Реакцію Соногашира (xiii) проводять в присутності паладієвого комплексу (в мірі окиснення (0) або (II), наприклад, такій як Pd(PPh3)4, PdCl2(PPh3)2, в присутності йодиду міді, триетиламіну, в апротонному полярному розчиннику, такому як THF або DMF, із звичайним нагріванням від 80°С до 120°С або мікрохвильовим нагріванням. Реакцію Сузукі (xiii) проводять в присутності паладієвого комплексу (в мірі окислення (0) або (II)), наприклад, такій як Pd(PPh3)4, PdCl2(PPh3)2, Pd2dba3, Xphos або PdCl2(dppf), в протонному або апротонному полярному розчиннику, такому як DME, етанол, DMF, діоксан або суміші даних розчинників, в присутності основи, такої як карбонат цезію, водний розчин бікарбонату натрію або K3РО4, із звичайним нагріванням між 80°С і 120°С або мікрохвильовим нагріванням між 130°С і 170°С. На закінчення, продукт реакції Соногашира (XVIa) або Сузукі (XVIb) піддають реакції зняття захисту, згідно із загальноприйнятою стадією зняття захисту (xiv), наприклад, в присутності кислоти, такої як HCl (4 н.) в діоксані або трифтороцтова кислота в розчиннику, такому як етанол або дихлорметан, при температурі між -5°С і 60°С, отримуючи сполуки формули (I). Додержуючись другого способу отримання сполуки формули (I), яка є об'єктом даного винаходу, галогеновану проміжну сполуку формули (VII) або (XIV) спочатку піддають реакції зняття захисту (xv), згідно із тією ж загальноприйнятою процедурою, як для стадії (xiv). І отриману незахищену сполуку (XVII) застосовують або в реакції поєднання Соногашира із придатним похідним пропаргілового спирту R 1R2CH(OR3)С≡СН формули (XVa), де R1, R2 і R3 мають значення, як визначено раніше; або в реакції поєднання Сузукі із придатною арилбороновою кислотою формули (XVb), згідно із тими ж умовами, які описані раніше для стадії (xiii). Обидві реакції поєднання ведуть безпосередньо до сполуки (I).) Якщо необхідно, під час стадій реакції, представлених на схемі 1, гідроксильна група або деякі реакційноздатні функції, розташовані на групах R1, R2 і R3, можуть бути тимчасово захищені захисними групами, відомими фахівцям в даній галузі, як описано в "Protective Groups in Organic Synthesis", Green et al., 2-е видання (John Willey & Sons, Inc., New York). Згідно із іншим аспектом винаходу, об'єктом винаходу є також сполуки формули (VII), як представлено на Схемі 1. Дані сполуки можуть бути використані як проміжні сполуки синтезу для сполук формули (I). Згідно із іншим аспектом винаходу об'єктом винаходу є також спосіб отримання сполуки формули (I), який характеризується тим, що сполуки формули (VII): 8 UA 109942 C2 , в якій Х являє собою хлор або бром, і R4 і R5 мають значення, як визначено в загальній формулі (I), піддають реакції із сполуками загальної формули (XVa): 5 10 15 20 25 30 35 40 , в якій R1, R2 і R3 мають значення, як визначено в загальній формулі (I), або піддають реакції із сполуками загальної формули (XVb): , в якій R3 і R7 мають значення, як визначено в загальній формулі (I), загальноприйнята стадія зняття захисту проводиться до або після реакції сполуки формули (VII) із сполуками загальної формули (XVa) або із сполуками загальної формули (XVb). Приклади, які слідують далі, описують отримання деяких сполук згідно з винаходом. Ці приклади не є обмежуючими і служать тільки для ілюстрації даного винаходу. Представлені номери сполук стосуються номерів в Таблиці 1. Елементний мікроаналіз, аналіз LC/MS і ІЧ- або ЯМР-спектр підтверджують структури отриманих сполук. Приклад 1: (Сполука № 1) 2-Аміно-1-етил-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1H[1,8]нафтиридин-4-он 1.1: 6-Хлор-2-етиламінонікотинова кислота Розчин 18,0 г (84,4 ммоль) 2,6-дихлорнікотинової кислоти в 180 мл розчини етиламіну (70% у воді) перемішували при температурі навколишнього середовища протягом 72 годин. Надлишок аміну потім випарювали при пониженому тиску, і додавали 10% водний розчин оцтової кислоти доти, доки продукт не осаджувався. Бежеву тверду речовину сушили на відцентровому фільтрі, промивали холодною водою і сушили в сушильній шафі. Виходило 10,5 г очікуваного продукту. Точка плавлення = 158-160°C. Вихід = 62%. 1.2: 6-Хлор-2-етиламінонікотиноїлфторид 2 мл (24,8 ммоль) піридину і 4,2 мл (49,8 ммоль) 2,4,6-трифтортриазину додавали до суспензії 5,0 г (24,8 ммоль) 6-хлор-2-етиламінонікотинової кислоти в 125 мл дихлорметану. Суміш перемішували протягом 3 годин при температурі навколишнього середовища і потім фільтрували. Тверду речовину промивали 50 мл дихлорметану, і фільтрат двічі промивали 60 мл охолодженої льодом води. Органічну фазу сушили над Na 2SO4, і розчинник випарювали при пониженому тиску. Отримували 5,01 г продукту у вигляді оранжевого масла, яке використовували без подальшого очищення. Вихід = 99%. 1.3: 1-(2-Триметилсиланілетоксиметил)-1Н-імідазол-2-карбальдегід Маслянисту суспензію 20,8 г гідриду натрію в мінеральному маслі (50%, 0,52 моль) промивали від мінерального масла при перемішуванні із гексаном три рази і суспендували в 400 мл DMF. При перемішуванні при температурі навколишнього середовища до суспензії додавали 50,0 г (0,520 моль) імідазол-2-карбальдегіду. Через 1,5 години додавали 101,0 мл (0,572 моль) 9 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-(триметилсиланіл)етоксиметилхлориду, і реакційну суміш перемішували ще 1 годину. До суспензії із лишком додавали воду, і реакційну суміш екстрагували три рази етилацетатом. Органічну фазу сушили над Na2SO4, і розчинник випарювали при пониженому тиску. Сирий матеріал потім очищали за допомогою колонкової хроматографії (DCM), отримуючи 85,0 г (0,376 моль) SEM-захищеного імідазол-2-карбальдегіду. Вихід = 72%. MH+ = 227,1 (C10H18N2O2Si, Mr = 226,35). 1 H-ЯМР (ДМСО-d6, 500 МГц): 9,83 (с, 1H); 7,86 (с, 1H); 7,39 (с, 1H); 5,75 (с, 2H); 3,58 (т, 2H); 0,95 (т, 2H); 0,02 (с, 9H). 1.4: [1-(2-Триметилсиланілетоксиметил)-1Н-імідазол-2-іл]-ацетонітрил 1,73 г (8,84 ммоль) тозилметилізоціаніду розчиняли в 10 мл DME і охолоджували до -60°С. При даній температурі, спочатку додавали 1,98 г трет-бутоксиду калію, потім повільно додавали розчин 2,00 г (8,84 ммоль) 1-(2-триметилсиланілетоксиметил)-1Н-імідазол-2-карбальдегіду в 5 мл DME. Через 2 години перемішування при -60°С реакційної суміші давали нагрітися до 0°С і до розчину додавали 5 мл метанолу (123,60 ммоль). Реакційну суміш перемішували протягом наступних 24 годин при температурі навколишнього середовища і протягом 2 годин при 40°С. Із лишком додавали воду, і розчин екстрагували три рази дихлорметаном. Органічну фазу сушили над Na2SO4, після випаровування розчинника при пониженому тиску сирий матеріал очищали за допомогою колонкової хроматографії із оберненою фазою (вода 0,1% TFA/ацетонітрил = 80/20), отримуючи 0,87 г (0,367 моль) SEM-захищеного імідазолацетонітрилу. Вихід = 41%. MH+ = 238,1 (C11H19N3OSi, Mr = 237,38). 1 H-ЯМР (ДМСО-d6, 500 МГц): 7,66 (с, 1H); 7,39 (с, 1H); 5,53 (с, 2H); 4,52 (с, 2H); 3,55 (т, 2H); 0,92 (т, 2H); 0,02 (с, 9H). 1.5: 3-(6-Хлор-2-етиламінопіридин-3-іл)-3-гідрокси-2-[1-(2-триметилсиланілетоксиметил)-1Німідазол-2-іл]акрилонітрил 0,283 г (2,53 ммоль) трет-бутилату калію, в невеликих кількостях, додавали до охолодженого до 0°С розчину 0,600 г (2,53 ммоль) [1-(2-триметилсиланілетоксиметил)-1Німідазол-2-іл]ацетонітрилу в 10 мл безводного THF. Суміш перемішували протягом 45 хвилин при температурі навколишнього середовища, і потім знову охолоджували до 0°С. Потім додавали розчин 0,512 г (2,53 ммоль) 6-хлор-2-етиламінонікотиноїлфториду в 10 мл THF, і суміш перемішували при температурі навколишнього середовища протягом ночі, знову охолоджували до 0°С і додавали другий еквівалент трет-бутилату калію (0,283 г, 2,53 ммоль). Через 2 години перемішування при температурі навколишнього середовища додавали 50 мл насиченого водного розчину хлориду амонію, рН доводили до 7 за допомогою 2 н. HCl, потім екстрагували три рази етилацетатом. Об'єднані органічні фази сушили над MgSO 4, і розчинники випарювали при пониженому тиску. Сирий матеріал потім очищали за допомогою колонкової хроматографії (DCM/Метанол = 90:10), отримуючи 418 мг (вихід = 38%) вказаних в заголовку сполуки у вигляді проміжної речовини, які потім використовували на наступній стадії. MH+ = 421 (C19H26ClN5O2Si, Mr = 419,99). 1 H-ЯМР (ДМСО-d6, 500 МГц): 13,35 (с, 1H); 7,70 (д, 1H); 7,46 (с, 1H); 7,23 (с, 1H); 7,08 (т, 1H); 6,58 (д, 1H); 5,59 (с, 2H); 3,58 (т, 2H); 3,34 (д.кв, 2H); 1,13 (т, 3H); -0,03 (3с, 9H). 1.6: 2-Аміно-7-хлор-1-етил-3-[1-(2-триметилсиланілетоксиметил)-1Н-імідазол-2-іл]-1Н[1,8]нафтиридин-4-он 0,112 г (1 ммоль) трет-бутилату калію, в невеликих кількостях додавали до охолодженого до 0°С розчину 418 мг (1 ммоль) проміжної сполуки, отриманої в 1.5, 3-(6-хлор-2-етиламінопіридин3-іл)-3-гідрокси-2-[1-(2-триметилсиланіл-етоксиметил)-1Н-імідазол-2-іл]акрилонітрилу в 5 мл безводного THF. Суміш перемішували протягом 48 годин при температурі навколишнього середовища, після чого додавали 50 мл насиченого водного розчину хлориду амонію, рН доводили до 7 за допомогою 2 н. HCl, і реакційну суміш екстрагували три рази етилацетатом. Об'єднані органічні фази сушили над MgSO 4, і розчинники випарювали припониженому тиску, отримуючи 400 мг вказаної в заголовку сполуки. Вихід = 38%. MH+ = 421 (C19H26ClN5O2Si, Mr = 419,99). 1 H-ЯМР (ДМСО-d6, 500 МГц): 8,50 (д, 1H); 8,03 (с, 1H); 7,98 (с, 1H); 7,78 (с, 2H); 7,60 (с, 1H); 5,49 (с, 2H); 4,58 (кв, 2H); 3,57 (т, 2H); 1,42 (т, 3H); 0,85 (т, 2H); -0,03 (3с, 9H). 1.7: (±)-2-Метилбут-3-ин-1,2-діол Комерційно доступний 0,5 М розчин етинілмагнійхлориду в тетрагідрофурані розбавляли 200 мл тетрагідрофурану і охолоджували до 0°С. Потім додавали розчин гідроксіацетону в 200 мл тетрагідрофурану, і суміш перемішували при температурі навколишнього середовища 10 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 протягом 3 годин. Реакційну суміш охолоджували, і додавали водний розчин NH 4Cl. Суміш три рази екстрагували етилацетатом, і органічні фази об'єднували, сушили над сульфатом натрію, фільтрували і концентрували у вакуумі (приблизно 200 мбар). У результаті отримували 20 г очікуваного продукту у вигляді коричневого масла, яке використовували без подальшого очищення (кількісний сирий вихід) в рацемічної формі або яке могло бути розділено на чисті енантіомери за допомогою препаративної ВЕРХ на хіральних ВЕРХ-колонках. Для того, щоб отримати оптично чисті енантіомери, відповідну рацемічну суміш піддавали препаративній хроматографії на хіральній стаціонарній фазі (Chiralpak AD-H колонка, 250×21 мм, 5 мм) із застосуванням як пересувна фаза: або СО2/2-пропанолу (70%/30%) із швидкістю потоку 60 мл/хв. при тиску 100 бар або суміші ізогексан/етанол (70/30) із 0,3% TFA і швидкістю потоку 120 мл/хв. Після розбавлення і випаровування кожний енантіомер відділяли, і хімічну чистоту і енантіомерну чистоту кожного визначали за допомогою аналітичних методів, відомих фахівцям в даній галузі. 1.8: 2-Аміно-1-етил-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-[1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1H-[1,8]нафтиридин-4-он У заповнену аргоном мікрохвильову реакційну ємність вміщували 500 мг (1,2 ммоль) 2аміно-7-хлор-1-етил-3-[1-(2-триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1H[1,8]нафтиридин-4-ону, 204 мг (1,8 ммоль) (3R)-1-метокси-2-метилбут-3-ин-2-олу, 84 мг (0,120 ммоль) дихлориду біс(трифенілфосфін)паладію (II), 30 мг (0,16 ммоль) йодиду міді (I), 2 мл DMF (дегазованого), 2 мл триетиламіну (дегазованого) і піддавали опроміненню мікрохвилями таким чином, щоб реакційна суміш витримувалася при 120°С протягом 24 годин. Розчинники випарювали, і тверду речовину повторно суспендували в 30 мл DMF і фільтрували. Фільтрат потім очищали за допомогою ВЕРХ, отримуючи 430 мг (0,702 ммоль) TFA-солі сполуки, вказаної в заголовку. Вихід = 59%. MH+ = 498,2 (C25H35N5O4Si, Mr = 497,67). 1 H-ЯМР (ДМСО-d6, 500 МГц): 8,39 (д, 1H); 7,95 (с, 1H); 7,88 (с, 1H); 7,60 (с, 2H); 7,48 (д, 1H); 5,25 (с, 2H); 4,50 (уширений сигнал, 2H); 3,52-3,40 (уширений сигнал, пік води + 4H); 1,48 (с, 3H); 1,25 (т, 3H); -0,12 (3с, 9H). 1.9: 2-Аміно-1-етил-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1H[1,8]нафтиридин-4-он 240 мг (0,4 ммоль) SEM захищеного нафтиридинону 1.8 розчиняли при 0°С в 1,2 мл TFA і 1,2 мл DCM. Розчин витримували при 3-5°С протягом ночі доти, доки аналітична ВЕРХ не показувала завершення зняття захисту із нафтиридинону. Розчин нейтралізували шляхом додавання надлишку водного розчину NaHCO3. Суміш потім екстрагували три рази етилацетатом. Об'єднані органічні фази сушили над MgSO 4, і розчинники випарювали при пониженому тиску. Отриманий таким чином сирий матеріал очищали на силікагелі (DCM:МеОН = 4:1), отримуючи 143 мг (кількісний вихід) незахищеної сполуки, вказаної в заголовку. MH+ = 368,2 (C19H21N5O3, Mr = 367,41). 1 H-ЯМР (ДМСО-d6, 500 МГц): 13,15 (с, 1H); 11,55 (ушир. с, 1H); 8,59 (д, 1H); 8,10 (ушир. с, 1H); 7,47 (д, 1H); 7,25 (с, 1H); 7,02 (с, 1H); 5,85 (с, 1H); 4,58 (уширений сигнал, 2H); 3,51-3,370 (уширений сигнал, пік води + 4H); 1,48 (с, 3H); 1,25 (т, 3H). Час утримування (аналітична ВЕРХ): 4,806 хв. Приклад 2: (Сполука № 2) 2-Аміно-1-пропіл-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1H[1,8]нафтиридин-4-он Застосовуючи процедуру, описану до стадії 1.6, 2-аміно-7-хлор-1-пропіл-3-[1-(2триметилсиланілетоксиметил)-1Н-імідазол-2-іл]-1H-[1,8]нафтиридин-4-он синтезували із використанням н-пропіламіну замість етиламіну на стадії 1.1. Приєднуючи дану проміжну сполуку до (3R)-1-метокси-2-метилбут-3-ин-2-олу, додержуючись аналогічним чином докладної процедури, викладеної для прикладу 1, отримували сполуку, вказану в заголовку. MH+ = 382,48 (C20H23N5O3, Mr = 381,44). 1 H-ЯМР (ДМСО-d6, 500 МГц): уширений сигнал: 8,45 (м, 1H); 7,4 (м, 3H); 5,85 (с, 1H); 4,58 (м, 3H); 3,51-3,370 (пік води + 4H); 1,70 (м, 2H); чіткі сигнали: 1,48 (с, 3H); 0,95 (т, 3H). Час утримування (аналітична ВЕРХ): 4,98 хв. Приклад 3: (Сполуки № 3, № 27 і № 28) 2-Аміно-7-(3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1H-імідазол-2-іл)-1,8-нафтиридин4(1H)-он 11 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-Аміно-7-((3R)3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1Н)-он 2-Аміно-7-((3S)3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1Н)-он 3.1: 2-Аміно-1-етил-7-(3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-[1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1,8-нафтиридин-4(1Н)-он Отримували, додержуючись докладної процедури, викладеної для стадії 1.8, із використанням проміжної сполуки, описаної як 1.6 (2-аміно-7-хлор-1-етил-3-[1-(2триметилсиланілетоксиметил)-1Н-імідазол-2-іл]-1,8-нафтиридин-4(1Н)-он) і (±)-2-метилбут-3-ин1,2-діолу, отриманої раніше, як описано в процедурі на стадії 1.7. MH+ = 354,16 (C18H19N5O3, Mr = 353,38). Час утримування (аналітична ВЕРХ): 4,48 хв. 3.2: 2-Аміно-1-етил-7-((3R)3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-[1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1,8-нафтиридин-4(1Н)-он 2-Аміно-1-етил-7-((3S)3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-[1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1,8-нафтиридин-4(1Н)-он Рацемічна сполука, отримана на стадії 3.1, зазнавала очищення за допомогою препаративної хіральної SFC (надкритична флюїдна хроматографія), із застосуванням методів, Berger prep SFC, UV детекція при 230 нм, стаціонарна фаза Chiralpak IC 20×250 нм 5 мкм, рухома фаза 65%/35% СО2/(МеОН + 0,5% ізопропіламін), 50 мл/хв., 100 бар), приводячи до розділення двох енантіомерів. Хіральну чистоту для двох енантіомерів визначали із використанням методів хіральної SFC, Berger SFC, UV детекція при 210 нм, стаціонарна фаза Chiralpak AD-H (250 нм × 4,6) 5 мкм, рухома фаза 65%/35% СО2/(ізопропанол + 0,5% ізопропіламін), 2,4 мл/хв., 100 бар.). R-енантіомер (час утримування = 6,9 хв., енатіомерна чистота = 97,9%). S-енантіомер (час утримування = 5,9 хв., енатіомерна чистота = 96,8%). 3.3: 2-Аміно-7-(3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1Н)-он 2-Аміно-7-((3R)-3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1Н)-он 2-Аміно-7-((3S)-3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1Н)-он Після стадії зняття захисту, згідно із стадією 1.9, виділяли сполуки 3, 27 і 28 у вигляді жовтого порошку. MH+ = 354,16 (C18H19N5O3, Mr = 353,38). Час утримування = 0,77 хв. 1 H-ЯМР (ДМСО-d6, 400 МГц): 13,15 (с, 1H); 11,55 (ушир.с, 1H); 8,55 (д, 1H, J=6,4 Гц); 8,10 (ушир.с, 1H); 7,47 (д, 1H, J=6,4 Гц); 7,15 (с, 1H); 7,02 (с, 1H); 5,6 (с, 1H); 5,1 (т, 1H, J=6,4 Гц) 4,53 (ушир.д, 2H); 3,49 (дд, 1H, J=6,4; 10,4 Гц); 3,41 (дд, 1H, J=6,4; 10,4 Гц); 1,48 (с, 3H); 1,27 (т, 3H, J=7,2 Гц). Хіральну чистоту для двох енантіомерів визначали із використанням методів хіральної SFC, Berger SFC, UV детекція при 230 нм, стаціонарна фаза Chiralpak AD-H (250 нм (4,6) 5 мкм, рухома фаза 60%/40% СО2/(ізопропанол + 0,5% ізопропіламін), 2,4 мл/хв., 100 бар. R-енантіомер (час утримування = 8,37 хв., енатіомерна чистота = 99,2%). S-енантіомер (час утримування = 7,29 хв., енатіомерна чистота = 98,5%). Приклад 4: (Сполука № 4) 2-Аміно-1-етил-7-(3-гідрокси-3-піридин-2-илбут-1-иніл)-3-(1H-імідазол-2-іл)-1H[1,8]нафтиридин-4-он Застосовуючи проміжну сполуку, описану на стадії 1.6 (2-аміно-7-хлор-1-етил-3-[1-(2триметилсиланілетоксиметил)-1Н-імідазол-2-іл]-1H-[1,8]нафтиридин-4-он), і приєднуючи його до (±)-2-піридин-2-ілбут-3-ин-2-олу, Додержуючись докладної процедури, викладеної для прикладу 1 аналогічним чином, отримували сполуку, вказану в заголовку. MH+ = 401,21 (C22H20N6O2, Mr = 400,44). Час утримування (аналітична ВЕРХ): 4,49 хв. Приклад 5: (Сполука № 5) 2-Аміно-1-етил-7-[(3R)-3-гідрокси-4-метокси-3-метилбут-1-ин-1-іл]-3-(4-метил-1H-імідазол-2іл)-1Н-[1,8]-нафтиридин-4-он 5.1: 4-Метил-1-(2-триметилсиланілетоксиметил)-1Н-імідазол-2-карбальдегід Застосовуючи ту ж процедуру, що і для стадії 1.3 прикладу 1, починаючи із 4 г (36,3 ммоль) 4(5)-метил-1Н-імідазол-2-карбальдегіду, 1,5 г (38 ммоль) гідриду натрію і 6,7 г (40 ммоль) 2 12 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 (триметилсиланіл)етоксиметилхлориду в 73 мл DMF, отримували 8,7 г вказаної в заголовку сполуки у вигляді коричневого масла (кількісний вихід). MH+ = 241 (C11H20N2O2Si, 240,377). 5.2: [4-Метил-1-(2-триметилсиланілетоксиметил)-1Н-імідазол-2-іл]-ацетонітрил По тій же процедурі, яка описана на стадії 1.4 прикладу 1, починаючи із 8,7 г (32,7 ммоль) 4метил-1-(2-триметилсиланілетоксиметил)-1Н-імідазол-2-карбальдегіду, 6,7 г (34,3 ммоль) TOSMIC і 7,3 г (65 ммоль) трет-бутилату калію в безводному розчині DME (54 мл), отримували 6,6 г сполуки у вигляді жовтого масла у вигляді 70/30 суміші регіоізомерів Тau і Pi. Вихід = 80%. MH+ = 252 (C12H21N3OSi, 251,404). Час утримування = 6,38 і 6,55 хв. 5.3: 2-Аміно-7-хлор-1-етил-3-[4-метил-1-(2-триметилсиланілетоксиметил)-1H-імідазол-2-іл]1H-[1,8]нафтиридин-4-он По тій же процедурі, яка описана на стадії (1.5-1.6) прикладу 1, починаючи із 6,3 г (25 ммоль) сполуки, отриманої в кінці стадії 6.2, 5 г (25 ммоль) сполуки, отриманої в кінці стадії 1.2, і 7,2 г (62 ммоль) трет-бутилату калію в безводному розчині THF (83 мл), отримували 4 г продукти у вигляді бежевого порошку у вигляді суміші 80/20 2 ізомерів Tau і Pi, які використовуються у вигляді суміші на наступній стадії. Вихід = 38%. Точка плавлення = 120°С. MH+ = 435 (C20H28ClN5O2Si, 434,013). Час утримування = 10,5 і 10,6 хв. 1 H-ЯМР обох ізомерів (500 МГц, ДМСО-d6) м. ч. 8,45 (д, J=8,07 Гц, 2H), 7,70 (ушир.с, 2H), 7,56 (ушир.с,2H), 7,43 (д, J=8,07 Гц, 1H), 7,42 (д, J=8,07 Гц, 1H), 6,99 (м, 1H), 6,84 (м, 1H), 5,18 (с, 2H), 5,17 (с, 2H), 4,43 (кв, J=6,85 Гц, 4H), 3,19 (м, 2H), 3,12 (м, 2H), 2,25 (д, J=0,98 Гц, 3H), 2,16 (д, J=0,98 Гц, 3H), 1,24-1,29 (м, 6H), 0,57-0,64 (м, 4H), -0,22 (с, 9H), -0,22 (с, 9H). 5.4: 2-Аміно-1-етил-7-[(3R)-3-гідрокси-4-метокси-3-метилбут-1-ин-1-іл]-3-(4-метил-1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл)-1H-[1,8]нафтиридин-4-он У заповненій аргоном мікрохвильовій реакційній ємності 0,5 г (1,15 ммоль) сполуки, отриманої в кінці стадії 5.3, 0,26 г (2,3 ммоль) (R)-1-метокси-2-метилбут-3-ин-2-олу, 40 мг (0,06 ммоль) дихлориду біс(трифенілфосфін)паладію (II), 22 мг (0,12 ммоль) йодиду міді (I), 3 мл DMF (дегазованого), 3 мл триетиламіну (дегазованого) нагрівали при 80°С протягом 3 годин. Розчинники випарювали; тверду речовину розчиняли в етилацетаті і промивали послідовно водним насиченим розчином NaHCO3 і HCl (1н.). Органічну фазу потім сушили над Na2SO4, фільтрували і концентрували при пониженому тиску. Залишок потім очищали за допомогою флеш-хроматографії на силікагелі (DCM/THF 95/5: МеОН (1% NH 4OH) від 0% до 10%), отримуючи 0,19 г вказаної в заголовку сполуки. Вихід = 32%. MH+ = 512 (C26H37N5O4Si, 511,695). 1 H-ЯМР (400 M Гц, ДМСО-d6) м. ч. 8,43 (д, J=7,91 Гц, 2H), 7,69 (ушир.с, 2H), 7,55 (ушир.с, 2H), 7,41 (д, J=7,79 Гц, 2H), 6,99 (с, 1H), 6,84 (с, 1H), 5,81 (с, 2H), 5,18 (с, 4H), 4,40-4,58 (м, 4H), 3,47 (д, J=9,54 Гц, 2H), 3,37-3,43 (м, 8H), 3,19 (т, J=8,02 Гц, 2H), 3,12 (т, J=8,08 Гц, 2H), 2,26 (с, 3H), 2,17 (с, 3H), 1,47 (с, 6H), 1,26 (т, J=6,57 Гц, 6H), 0,54-0,67 (м, 4H), -0,23 (с, 18H). 5.5: 2-Аміно-1-етил-7-[(3R)-3-гідрокси-4-метокси-3-метилбут-1-ин-1-іл]-3-(4-метил-1Hімідазол-2-іл)-1H-[1,8]нафтиридин-4-он 0,18 г (0,36 ммоль) сполуки, отриманої в кінці стадії 5.4, розчиняли при 0°С в 1,7 мл TFA і 1,7 мл DCM. Розчин витримували при 3-5°С протягом ночі. Розчин нейтралізували шляхом додавання із лишком водного розчину NaHCO3. Суміш потім екстрагували три рази етилацетатом. Об'єднані органічні фази сушили над Na 2SO4 і розчинники випарювали при пониженому тиску. Сирий матеріал очищали за допомогою кристалізації в DCM, отримуючи 62 мг (вихід 46%) вказаної в заголовку незахищеної сполуки. MH+ = 382 (C20H23N5O3, 381,434). 1 H-ЯМР (ДМСО-d6, 500 МГц): (2 топоізомери на імідазолі визначаються як співвідношення 60/40) = 12,9-12,8 (2с, 1H), 11,6 (ушир.с, 1H), 8,52 (д, J=7,9 Гц, 1H), 8,0 (ушир.с, 1H), 7,42 (д, J=7,9 Гц, 1H), 6,84-6,70 (2с, 1H), 5,8 (с, 1H), 4,56 (м, 2H), 3,46 (д, J=9,5 Гц, 1H), 3,3 (с, 3H), 3,4 (д, J=9,5 Гц, 1H), 2,28-2,2 (2с, 3H), 1,47 (с, 3H) 1,28 (т, J=6,6 Гц, 3H). Приклад 6: (Сполука № 6) 2-Аміно-1-циклопропілметил-7-(3-гідроксипент-1-иніл)-3-(1H-імідазол-2-іл)-1H-[1,8]нафтиридин-4-он 6.1: 6-Хлор-2-(циклопропілметиламіно)нікотинова кислота 13 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 У герметичній колбі, 3 г (42 ммоль) циклопропілметиламіну додавали до 3 г (14 ммоль) 2,6дихлорнікотинової кислоти в розчині трет-бутанолу (14 мл), колбу закупорювали і нагрівали при 170°С протягом 30 хвилин в мікрохвильовій печі Biotage Initiator. Реакційну суміш охолоджували до кімнатної температури, розбавляли дихлорметаном (100 мл) і промивали 10% водним розчином оцтової кислоти (12 мл). Органічну фазу сушили над Na 2SO4, фільтрували, концентрували і сушили у вакуумі. Отримували 3,4 г продукти у вигляді оранжевого масла. Вихід є кількісним. МН+ = 227. Час утримування = 4,54 хв. 6.2: 6-Хлор-2-(циклопропілметиламіно)нікотиноїлфторид Та ж процедура, яка описана на стадії 1.2 прикладу 1, починаючи із 0,334 г (1,4 ммоль) сполуки, отриманої в кінці стадії 7.1, в розчині із 4 мл дихлорметану, 0,38 г (2,8 ммоль) фторангідриду ціанурової кислоти, і 0,28 г (2,8 ммоль) триетиламіну. Продукт, отриманий у вигляді зеленого масла, використовували на наступній стадії без очищення. 6.3: 2-Аміно-7-хлор-1(циклопропілметил)-3-[1-(2-триметилсиланілетоксиметил)-1H-імідазол2-іл]-1H-[1,8]нафтиридин-4-он Та ж процедура, яка описана на стадії (1.5-1.6) прикладу 1, починаючи із неочищеної сполуки отриманої в кінці стадії 6.2, 0,32 г (1,4 ммоль) сполуки, отриманої в кінці стадії 1.3, в розчині із 5 мл безводного THF і 0,4 г (0,35 ммоль) трет-бутилату калію. Отримували 0,56 г продукти у вигляді коричневого порошку. Вихід = 90%. Точка плавлення = 70°С. MH+ = 447 (C21H28ClN5O2Si). Час утримування = 6,68 хв. 1 H-ЯМР (400 М Гц, ДМСО-d6) м. ч. 8,46 (д, J=8,05 Гц, 1H), 7,67 (ушир.с, 2H), 7,43 (д, J=8,05 Гц, 1H), 7,35 (д, J=1,37 Гц, 1H), 7,12 (д, J=1,19 Гц, 1H), 5,27 (с, 2H), 4,38 (д, J=7,04 Гц, 2H), 3,193,25 (м, 2H), 1,21-1,32 (м, 1H), 0,59-0,68 (м, 2H), 0,45-0,57 (м, 4H), -0,21 (с, 9H). 6.4: 2-Аміно-1-(циклопропілметил)-7-(3-гідроксипент-1-иніл]-3-[1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1H-[1,8]нафтиридин-4-он Та ж процедура, яка описана на стадії 5.4 прикладу 5, починаючи із 0,5 г (1,2 ммоль) сполуки, отриманої в кінці стадії 6.3, 0,22 г (2,5 ммоль) пент-4-ин-3-олу, 43 мг (0,06 ммоль) дихлориду біс(трифенілфосфін)паладію (II), 23 мг (0,12 ммоль) йодиду міді (I), 3 мл DMF (дегазованого), 3 мл триетиламіну (дегазованого). Отримували 0,19 г вказаної в заголовку сполуки. Вихід = 30%. MH+ = 494 (C26H35N5O3Si 493,68). 1 H-ЯМР (400 М Гц, ДМСО-d6) м. ч. 8,44 (д, J=7,87 Гц, 1H), 7,65 (ушир.с, 2H), 7,42 (д, J=7,87 Гц, 1H), 7,33 (с, 1H), 7,10 (с, 1H), 5,63 (д, J=5,58 Гц, 1H), 5,28 (с, 2H), 4,38-4,52 (м, 3H), 3,17-3,25 (м, 2H), 1,67-1,76 (м, 2H), 1,22-1,31 (м, 1H), 1,01 (т, J=7,36 Гц, 3H), 0,59-0,66 (м, 2H), 0,44-0,57 (м, 4H), -0,24-0,20 (м, 9H). 6.5: 2-Аміно-1-циклопропілметил-7-(3-гідроксипент-1-иніл]-3-1H-імідазол-2-іл)-1H[1,8]нафтиридин-4-он По тій же процедурі, яка описана на стадії 5.5 прикладу 5, починаючи із 0,18 г (0,36 ммоль) сполуки, отриманої в кінці стадії 7.4, в 1,7 мл TFA і 1,7 мл DCM, отримували 19 мг вказаної в заголовку сполуки. Вихід = 15%. Точка плавлення = 252°С. MH+ = 364 (C20H21N5O2, 363,419). 1 H-ЯМР (400 М Гц, ДМСО-d6) м. ч. 13,15 (ушир.с, 1H), 11,5 (ушир.с, 1H), 8,56 (д, J=7,9 Гц, 1H), 8,0 (ушир.с, 1H), 7,45 (д, J=7,9 Гц, 1H), 7,15 (м, 2H), 5,62 (ушир.с, 1H), 4,62 (м, 2H+1H), 1,75 (м, 2H), 1,34 (м, 1H), 1,05 (т, J=7,36 Гц, 3H), 0,5 (м, 2H), 0,48 (м, 2H). Приклад 7: (Сполука № 7) 2-Аміно-1-етил-7-((R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1Hхінолін-4-он 7.1: 2-Фтор-4-йодбензойна кислота 13,39 г (84,74 ммоль) перманганату калію додавали до суспензії із 5 мг (21,18 ммоль) 2фтор-4-йодтолуолу і 25,13 г (317,77 ммоль) піридин у воді. Суміш нагрівали і перемішували при 70°С протягом 18 годин. Поки реакція не закінчувалася, до реакційної суміші при кімнатній температурі додавали 3,34 г (21,18 ммоль) перманганату калію, і суміш перемішували ще 6 годин при 70°С. Потім реакційну суміш фільтрували через подушку із целіту, яку потім 14 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 промивали водою і етилацетатом. Після декантування, водну фазу підкислювали 6 н. водним розчином HCl до рН=1. Білу тверду речовину спочатку фільтрували, і водну фазу екстрагували три рази етилацетатом. Об'єднані органічні фази сушили над MgSO 4 і розчинники випарювали при пониженому тиску. Відфільтровану білу тверду речовину і тверду речовину, екстраговану етилацетатом, об'єднували, отримуючи 4,1 г. Вихід = 73%. MH+ = 266,9 (C7H4FIO2). 1 H-ЯМР (ДМСО-d6, 400 МГц): 13,49 (ушир. с., 1H); 7,88 (д, 1H); 7,78 (д, 1H); 7,65 (д, 1H). 7.2: 2-Етиламіно-4-йодбензойна кислота У герметичній колбі 3,5 г (13,16 ммоль) 2-фтор-4-йодбензойної кислоти змішували із 16,11 мл розчину етиламіну (70% у воді). Реакційну ємність нагрівали, і суміш перемішували при 125°С протягом 24 годин. Через реакційну суміш барботували азот для видалення надлишку етиламіну. Потім реакційну суміш вливали в льодяний водний розчин, і суміш підкислювали до рН=3-4 оцтовою кислотою. Отриману білу тверду речовину потім відфільтровувати, промивали водою і сушили, отримуючи 2,2 г (7,55 ммоль). Вихід = 58%. MH+ = 291,8 (C9H10INO2). 1 H-ЯМР (ДМСО-d6, 400 МГц): 12,5 (ушир.с, 1H); 7,55 (д, 1H); 7,11 (с, 1H); 6,9 (д, 1H). 7.3: 1-Етил-7-йод-1Н-бензо[d][1,3]оксазин-2,4-діон При кімнатній температурі до 2,2 г (7,55 ммоль) 2-етиламіно-4-йодбензойної кислоти в 30 мл діоксану додавали 0,785 г (2,65 ммоль) трифосгена. Потім реакційну суміш нагрівали і перемішували при 110°С протягом 2 годин. Розчин випарювали досуха і знову двічі випарювали після двох додавань по 20 мл толуолу, отримуючи 2,39 г (7,5 ммоль) твердих речовини. Вихід = 100%. MH+ = 317,7 (C10H8INO3). 1 H-ЯМР (ДМСО-d6, 400 МГц): 7,87 (с, 1H); 7,68 (с, 2H); 4,04 (м, 2H); 1,19 (т, 3H). 7.4: 2-Аміно-1-етил-7-йод-4-оксо-1,4-дигідрохінолін-3-карбонітрил 0,32 г (6,31 ммоль) малононітрилу і 1,45 г (14,35 ммоль) триетиламіну додавали до 2 г (6,31 ммоль) 1-етил-7-йод-1Н-бензо[d][1,3]оксазин-2,4-діону, розчиненого в 25 мл DMF. Розчин перемішували протягом 2 годин при 120°С, і після додавання 0,73 г (7,17 ммоль) триетиламіну перемішували ще 1 годину при 110°С. DMF потім випарювали при пониженому тиску, і залишок додавали в суміш води і дихлорметану. Фільтрування даної суміші давало першу фракцію очікуваної сполуки: 0,55 г (1,62 ммоль). Вихід = 26%. MH+ = 339,7 (C10H8INO3). 1 H-ЯМР (ДМСО-d6, 400 МГц): 7,99 (с, 1H); 7,80 (д, 1H); 7,7 (м, 2H); 4,21 (м, 2H); 1,20 (т, 3H). 7.5: 2-Аміно-N-(2,2-діетоксіетил)-1-етил-7-йод-4-оксо-1,4-дигідрохінолін-3-карбоксамідин 0,38 г (2,86 ммоль) аміноацетальдегід діетилацеталю і 0,155 г (1,57 ммоль) CuCl додавали до 0,48 г (1,43 ммоль) 2-аміно-1-етил-7-йод-4-оксо-1,4-дигідрохінолін-3-карбонітрилу, розчиненого в 20 мл DMЕ. Розчин перемішували і опромінювали мікрохвилями протягом 0,5 години при 100°С. Розчин потім відфільтровувати і випарювали досуха. Сирий матеріал потім очищали за допомогою колонкової хроматографії (DCM/MeOH: 9/1), отримуючи 0,57 г (1,2 ммоль) твердих речовини. Вихід = 78%. MH+ = 473 (C18H25IN4O3). 7.6: 2-Аміно-1-етил-3-(1Н-імідазол-2-іл)-7-йод-1Н-хінолін-4-он 0,37 мл 12н. розчину HCl додавали при 0°С до суспензії із 0,13 г (0,28 ммоль) 2-аміно-N-(2,2діетоксіетил)-1-етил-7-йод-4-оксо-1,4-дигідрохінолін-3-карбоксамідину. Реакційну суміш перемішували при кімнатній температурі протягом 16 годин. Потім реакційну суміш розбавляли 0,55 мл води, підлуговували за допомогою 0,32 мл 1н. розчину NaOH і 0,134 мл розчини NH 4OH. Суміш потім фільтрували, і отриману тверду речовину промивали водою, ацетонітрилом і пентаном, отримуючи 0,08 г (0,21 ммоль) коричневих твердих речовини. Вихід = 76%. MH+ = 381 (C14H13IN4O). 7.7: 2-Аміно-1-етил-7-((R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1Hхінолін-4-он 0,43 мг (1,15 ммоль) 2-аміно-1-етил-3-(1Н-імідазол-2-іл)-7-йод-1Н-хінолін-4-ону,0,262 (23 ммоль) (R)-3-гідрокси-4-метокси-3-метилбут-1-ину і 0,397 г (3,45 ммоль) перемішували в 15 мл DMF. Через даний розчин, протягом 10 хвилин продували аргон. Після додавання 0,126 мг (0,17 15 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 ммоль) дихлориду 1,1'-біс(дифенілфосфіно)фероценпаладію і 0,033 мг (0,17 ммоль) йодиду міді, реакційну суміш перемішували при 80°С протягом 6 годин. Реакційну суміш потім випарювали досуха, і залишок вливали в суміш DCM і води. Чорну нерозчинну тверду речовину відфільтровували (100 мг). Водну фазу три рази екстрагували дихлорметаном. Об'єднані органічні фази сушили над MgSO4, і розчинники випарювали при пониженому тиску. Залишок потім очищали за допомогою колонкової хроматографії (DCM/МеОН/NH4OH водн.: 9/1/0,1), отримуючи 0,80 г (1,2 ммоль) жовтої твердої речовини. Дану тверду речовину перекристалізовували в дихлорметані, отримуючи 0,02 г бежеву тверду речовину. Вихід = 4,5%. MH+ = 367 (C20H22N4O3, 366,419). 1 H-ЯМР (ДМСО-d6, 400 МГц): 13,19 (с, 1H); 8,27 (д, 1H); 7,61 (с, 1H); 7,31 (д, 1H); 7,13 (с, 1H); 7,02 (с, 1H); 6,94 (ушир. с., 2H); 4,36-4,28 (ушир. с., 2H); 3,45-3,25 (ушир. с., пік води + 4H); 1,46 (с, 3H); 1,31 (т, 3H). Приклад 8: (Сполука № 8) 2-Аміно-7-(3-хлор-4-гідроксифеніл)-1-етил-3-(1H-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-он 8.1: 2-Аміно-7-(3-хлор-4-гідроксифеніл)-1-етил-3-[1-(2-триметилсиланілетоксиметил)-1Hімідазол-2-іл]-1Н-[1,8]нафтиридин-4-он У круглодонній колбі 0,3 г (0,71 ммоль) 2-аміно-7-хлор-1-етил-3-[1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1Н-[1,8]нафтиридин-4-ону, 0,185 г (1,07 ммоль) 3-хлор-4-гідроксифенілборонової кислоти, 0,098 г (0,11 ммоль) трис(дибензиліденацетон)дипаладію (0), 0,030 мг (0,011 ммоль) трициклогексилфосфіну, 0,303 г триосновного фосфату калію і 8 мл суміші діоксан/вода (50/50) (дегазованої) перемішували і нагрівали при 85°С протягом 8 годин. Розчинники випарювали, і залишок очищали за допомогою колонкової хроматографії (DCM/МеОН: 9/1), отримуючи 0,4 г коричневої твердої речовини. Дану тверду речовину використовували на наступній стадії без подальшого очищення. 8.2: 2-Аміно-7-(3-хлор-4-гідроксифеніл)-1-етил-3-(1H-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-он 400 мг (0,59 ммоль) неочищеного 2-аміно-7-(3-хлор-4-гідроксифеніл)-1-етил-3-[1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1Н-[1,8]нафтиридин-4-ону розчиняли в 20 мл DCM. При 0°С додавали 3,39 г TFA, і суміш перемішували при кімнатній температурі протягом 24 годин. Розчин нейтралізували шляхом додавання надлишку водного розчину NaHCO3. Суміш потім три рази екстрагували DCM. Об'єднані органічні фази сушили над MgSO 4, і розчинники випарювали при пониженому тиску. Отриманим таким чином неочищений матеріал очищали на силікагелі (DCM/МеОН/NH4OH = 4/10,1), отримуючи 0,035 г вказаної в заголовку незахищеної сполуки. Вихід за дві стадії = 13%. MH+ = 382 (C19H16ClN5O2, 381,821. 1 H-ЯМР (ДМСО-d6, 400 МГц): 13,19 (с, 1H); 8,55 (д, 1H); 8,2 (с, 1H); 8,04 (дд, 1H); 7,9 (с, 1H); 7,15 (с, 1H); 7,09 (д, 1H); 7,3 (с, 1H); 4,72-4,66 (м, 2H); 1,37 (т, 3H). Приклад 9: (Сполука № 9) 2-Аміно-1-етил-7-[3-(2-фторфеніл)-3-гідроксибут-1-иніл]-3-(1H-імідазол-2-іл)-1H-[1,8]нафтиридин-4-он 9.1: 2-Аміно-1-етил-7-хлор-3-(1H-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-он 2-Аміно-7-хлор-1-етил-3-[1-(2-триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1Н[1,8]нафтиридин-4-он (1,0 г, 2,38 ммоль) розчиняли в 30 мл дихлорметану. Додавали 30 мл трифтороцтової кислоти, і реакційну суміш перемішували при кімнатній температурі протягом 3 годин доти, доки ВЕРХ не показувала повне використання початкового матеріалу. Розчинники видаляли при пониженому тиску, і до залишку додавали етилацетат. Розчин промивали насиченим водним розчином бікарбонату натрію. Утворений осад збирали за допомогою фільтрування, потім піддавали сушінню протягом ночі при 40°С у вакуумі, отримуючи 574 мг бежевого порошку. Вихід = 83%. 1 H-ЯМР (ДМСО-d6, 600 МГц): (м. ч.) 13,09 (с, 1H); 8,57 (д, 1H); 7,47 (д, 1H); 7,15 (с, 1H); 7,03 (с, 1H); 4,51 (ушир.кв, 2H); 1,29 (т, 3H). 9.2: 2-Аміно-1-етил-7-[3-(2-фторфеніл)-3-гідроксибут-1-иніл]-3-(1H-імідазол-2-іл)-1H-[1,8]нафтиридин-4-он Йодид міді (I) (2,37 мг 0,12 ммоль), N-етилморфолін (130 мкл, 1,04 ммоль) і 2-(2фторфеніл)бут-3-ин-2-ол (0,76 мкл, 0,52 ммоль) додавали до 2,5 мл DMF. Суміш дегазували аргоном. Додавали комплекс хлориду [1'1-біс(дифенілфосфіно)фероцен]паладію (II) із дихлорметаном (5,6 мг, 0,01 ммоль) 1:1 і проміжну сполуку 20.1 (100 мг, 0,35 ммоль). Суміш 16 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 перемішували при 80°С в атмосфері аргону протягом 2 годин доти, доки не підтверджувалося даними LCMS, що не залишилося ніякого вихідного матеріалу. Додавали етилацетат. Органічний шар послідовно промивали водою, 1 н. водним розчином гідроксиду натрію, насиченим водним розчином хлориду натрію, потім сушили над сульфатом магнію. Розчинник випарювали при пониженому тиску. Залишок потім очищали за допомогою колонкової хроматографії (DCM/МеОН/NH4OH водний: 100/0/0→95/5/0,5), отримуючи 30 мг не зовсім білого порошку. Вихід = 21%. MH+ = 418. Час утримування = 0,57 хв. (C23H20FN5O2, 417,442). 1 H-ЯМР (ДМСО-d6, 600 МГц): 13,10 (ушир.с, 1H); 8,54 (д, 1H); 7,72 (дт, 1H); 7,44 (д, 1H); 7,38 (м, 1H); 7,25-7,19 (м, 2H); 7,13 (д, 1H); 7,02 (д, 1H); 6,62 (с, 1H); 4,54 (ушир.кв, 2H); 1,84 (с, 3H); 1,27 (т, 3H). Приклад 10: (Сполука № 12) 2-Аміно-7-(3-гідроксипент-1-иніл)-3-(1H-імідазол-2-іл)-1-(2-метоксіетил)-1Н-[1,8]-нафтиридин4-он По аналогічній процедурі, яка описана на стадії 1 і 2 приклади 6, починаючи стадію 1 із 2метоксіетиламіну замість циклопропілметиламіну і потім додержуючись тієї ж процедури, яка описана на стадії 2 прикладу 20, починаючи із пент-1-ин-3-олу замість 2-(2-фторфеніл)бут-3-ин2-олу, отримували 15 мг продукти у вигляді порошку. MH+ = 368. Час утримування = 0,46 хв. (C19H21N5O3 367,407). Приклад 11: (Сполука № 19) 2-Аміно-1-етил-3-(1Н-імідазол-2-іл)-7-(4,4,4-трифтор-3-гідрокси-3-фенілбут-1-иніл)-1Н-[1,8]нафтиридин-4-он 11.1: 2-Аміно-1-етил-7-(4,4,4-трифтор-3-гідрокси-3-фенілбут-1-иніл)-3-[1-(2триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1Н-[1,8]нафтиридин-4-он По тій же процедурі, яка описана на стадії 5.4 прикладу 5, починаючи із 0,4 г (0,95 ммоль) 2аміно-7-хлор-1-етил-3-[1-(2-триметилсиланілетоксиметил)-1H-імідазол-2-іл]-1Н[1,8]нафтиридин-4-ону, 0,4 г (1,9 ммоль) 1,1,1-трифтор-2-фенілбут-3-ин-2-олу, 33 мг (0,05 ммоль) дихлориду біс(трифенілфосфіно)паладію (II), 18 мг (0,1 ммоль) йодиду міді (I), 3 мл DMF (дегазованого), 3 мл триетиламіну (дегазованого) отримували 0,15 г вказаної в заголовку сполуки. Вихід = 30%. MH+ = 584 (C29H32N5O3Si). 1 H-ЯМР (250 М Гц, ДМСО-d6) м. ч. 8,52 (д, J=7,91 Гц, 1H), 8,21 (с, 1H), 7,76-7,84 (м, 2H), 7,72 (ушир.с, 2H), 7,64 (д, J=7,91 Гц, 1H), 7,46-7,57 (м, 3H), 7,33 (д, J=1,34 Гц, 1H), 7,10 (д, J=1,34 Гц, 1H), 5,28 (с, 2H), 4,44-4,57 (м, 2H), 3,16-3,27 (м, 2H), 1,28 (т, J=6,91 Гц, 3H), 0,57-0,69 (м, 2H), -0,22 (с, 9H). 11.2: 2-Аміно-1-етил-3-(1Н-імідазол-2-іл)-7-(4,4,4-трифтор-3-гідрокси-3-фенілбут-1-иніл)-1Н[1,8]-нафтиридин-4-он По тій же процедурі, яка описана на стадії 5.5 прикладу 5, починаючи із 0,145 г (0,25 ммоль) сполуки, отриманої в кінці стадії 21.1, в 1,2 мл TFA і 1,2 мл DCM отримували 97 мг вказаної в заголовку сполуки. Вихід = 86%. Точка плавлення = 260°С. MH+ = 454 (C23H18F3N5O2). Час утримування = 7,29 хв. 1 H-ЯМР (400 М Гц, ДМСО-d6), м. ч. 13,12 (ушир.с, 1H), 11,58 (ушир.с, 1H), 8,63 (д, J=7,87 Гц, 1H), 8,21 (с, 1H), 8,19 (ушир.с, 1H), 7,77-7,82 (м, 2H), 7,66 (д, J=7,87 Гц, 1H), 7,46-7,55 (м, 3H), 7,14 (ушир.с, 2H), 4,57 (кв, J=6,59 Гц, 2H), 1,30 (т, J=7,00 Гц, 3H). Сполуки 10 і 11 отримували по процедурі, аналогічній тій, яка описана в прикладі 6. Сполуки 13, 14, 15, 16, 17, 18, 20, 21, 25 отримували по процедурі, аналогічній тій, яка описана в прикладі 10. Сполуки 22, 23 і 24 отримували по процедурі, аналогічній тій, яка описана в прикладі 11. Сполуки 29 отримували по процедурі, аналогічній тій, яка описана в прикладі 1. Обладнання, яке використовується для Прикладів 5 і 6 Мікрохвильовий пристрій: Biotage, ініціатор Аналітичний метод LC/UV/MS, визначення часу утримування (Rt) Аналітичний метод LC/UV/MS, використовуваний для аналізу сполук (Rt) 1, 2, 3 і 4: 17 UA 109942 C2 5 10 15 20 25 30 35 40 45 Колонка: Merck Chromolith, характеристика RP18e, 100×4,6 мм, 3,5 мкм. Розчинник А: Н2О/TFA (99,9/0,1). Розчинник В: ACN/TFA (99,9/0,1). Швидкість потоку: 2 мл/хв. Градієнт (А/В): 98/2 (0 хв.) до 0/100 (8 хв.) до 98/2 (10 хв.). Визначення: 254,16 нМ. Аналітичний метод LC/UV/MS, використовуваний для аналізу сполук (Rt) 9, 12, 13, 14, 17, 18 і 20: UPLC SQD електророзпилювальна іонізація, позитивний режим (30 В). Колонка: Ascentis Express 50×2,1 мм, 2,7 мкм, Т=55°С. Розчинник А: Н2О+0,02% TFA. Розчинник В: СН3CN+0,014% TFA. Швидкість потоку: 1 мл/хв. Градієнт (А/В об'єм/об'єм): 98/2 (t=0 хв.), 2/98 (t=1 хв.), 2/98 (t=1,3 хв.), 98/2 (t=1,33 хв.), наступне уприскування (t=1,5 хв.). Визначення: 220 нМ. Аналітичний метод, використовуваний для аналізу сполук 5, 6, 10, 11, 19, 22, 23 і 24: ВЕРХ-ланцюг: Series 1100, мас-спектрометр MCD SL (Agilent). Програмне забезпечення: Chemstation версія В.01.03 від Agilent. Вид іонізації: Електророзпилення, позитивний режим ESI+. Межі маси: 90-1500 мкмайт (1 майт = 3,24 мг). Колонка: Symmetry C18 3,5 мкм (2,1×50 ммWaters) Т=25°С, рН:3). Елюенти: А: Н2О+0,005% TFA/В: СH3СN+0,005% TFA. Потік: 0,4 мл/хв. Градієнт: 0-10 хв. 0-100% В і від 10 до 15 хв. 100% В. Визначення: 220 нМ. Аналітичний метод LC/UV/MS, використовуваний для сполук (Rt) 7, 8, 15, 16, 21, 25, 26: UPLC LCT електророзпилювальна іонізація, позитивний режим (15 В, 30 В) Програмне забезпечення: Masslyx V4.1. Колонка: Acquity UPLC BEH С18 50×2,1 мм 2,7 мкм, Т=40°С. Розчинник А: Н2О+0,05% TFA. Розчинник В: СН3CN+0,035% TFA. Швидкість потоку: 1 мл/хв. Градієнт (А/В об'єм/об'єм): 98/2 (t=0 хв.), 0/100 (t=1,6 хв.), 0/100 (t=2,1 хв.), 98/2 (t=2,5 хв.), наступне уприскування (t=3 хв.). Визначення: при 220 нМ. ЯМР 1 Дані спектра Н-ЯМР отримували із використанням ЯМР-спектрометра Bruker 250, 300, 400 або 600 МГц в ДМСО-d6 із застосуванням піка ДМСО-d5 як внутрішній стандарт. Хімічні зсуви виражені в мільйонних частках (м. ч.). Спостережувані сигнали виражені так, як іде далі: с=синглет; д=дублет; т=триплет; кв=квадруплет; м=мультиплет або великий синглет; ушир.=уширений; Н=протон. Точки плавлення Точки плавлення нижче за 260°С вимірювали за допомогою приладу Кофлера, а точки плавлення вище за 260°С вимірювали за допомогою апарата Buchi В-545. Питоме обертання Питоме обертання вимірювали на поляриметрі типу: Polarimeter Perkin-Elmer, потужність 55 мкА. 18 UA 109942 C2 19 UA 109942 C2 Rac. - рацемат. 5 10 15 20 Сполуки згідно із винаходом піддавали фармакологічним аналізам для визначення їх інгібуючої дії на аутофосфорилування VEGFR-3, а також для оцінки їх ex vivo активності, описаних нижче. Дія сполук на аутофосфорилування VEGFR-3 в НЕК клітинах Дію сполук по блокуванню аутофосфорилування VEGFR-3 визначали за допомогою ELISA після надекспресії VEGFR-3 в клітинах НЕК. НЕК293Т клітини тримали в МЕМ, доповненої 10% фетальної телячої сироватки (FCS) і глютаміну. За день до трансфекції на 48-ямкові планшети висівали 104 клітини/ямку і здійснювали трансфекцію із використанням Fugene-6 (Rоche, Базель). Fugene-6 (18 мкл) заздалегідь інкубували протягом 5 хв. в 282 мкл Optimem. Потім додавали 3 мг ДНК, відповідної VFGR-3-Flag, і залишали при кімнатній температурі протягом 10 хв. перед розподілом 200 мкл на НЕК клітини. Через 24 години середовище видаляли і замінювали новим середовищем без сироватки і інкубували протягом 1 години із різними концентраціями (в межах від 3 до 1000 нМ) кожної сполуки. Після додаткових 30 хв. інкубування із Ортованадатом (0,4 мМ), клітини промивали холодним PBS, доповненим ортованадатом, а потім лізували із 300 мкл буфера RIPA. Лізати потім центрифугували протягом 10 хв. при 10000 g. Супернатанти (75 мкл) розподіляли із дворазовим повторенням на 96-ямковий планшет, заздалегідь покритий анти-Flag, і залишали протягом 1 години при кімнатній температурі. Після 3 промивань TBS буфером, який містить 0,5% Твін 20, додавали антифосфотирозин, кон'югований із HRP, і інкубували протягом 1 години при кімнатній температурі. Ямки потім 20 UA 109942 C2 5 10 промивали 3 рази TBS буфером, який містить Твін 20 (0,5%) і MgCl 2 (2 мМ). Реакцію припиняли за допомогою 50 мкл H2SO4 (2н.) і зчитували сигнал Envision при 485 і 530. Аналізували криві концентрації відповідної реакції за допомогою внутрішнього програмного забезпечення Biost@t-SPEED v2.0 із використанням 4-параметрової логістичної моделі згідно із Ratkovsky і Reedy (Ratkovsky DA., Reedy TJ. Сhoosing near-linear parameters in the four parameters logistic model radioligands and related assays. Biometrics 1986 Sep 42(3):575-82). Сполуки згідно із винаходом мають інгібуючу активність у відношенні аутофосфорилування VEGFR-3 і показують величини IC50 менше ніж 1 мкМ при аутофосфорилуванні в НЕК клітинах, особливо від 1 до 500 нМ, більш конкретно від 1 до 100 нМ. Як приклад величини IC50 деяких сполук таблиці 1 наводяться в таблиці 2 нижче. Таблиця 2 № сполуки 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 21 22 23 24 25 26 27 28 29 15 20 25 IC50 (нМ) 25 18 125 40 45 85 19 73 16 37 334 166 41 200 27 119 13 36 14 24 38 19 85 303 120 47 153 145 Інгібітори VEGFR-3 тирозинкінази згідно із винаходом показують хорошу ex vivo активність із використанням аналізу по вимірюванню інгібування аутофосфорилування VEGFR-3 навіть краще, ніж активність інгібіторів попереднього рівня техніки. Ex vivo аналіз Протокол введення продуктів мишам: Продукти отримують в ступці із 0,5% Твін 80 і 0,6% метилцелюлози із рівноважним набуханням в кінцевому об'ємі. Суспензії вводять за допомогою шлункового зонда (10 мл/кг) самцям мишей Balb/с у віці 8-15 тижнів. Через три або 6 годин після одноразових оральних введень 30 мг/кг, тварин анестезували пентобарбіталом, і брали проби крові (400 мкл) із порожнистої вени, і переносили в скляні пробірки, які містять літійгепарин. Після центрифугування (1550-2000 g протягом 10 хвилин) зразки плазми заморожували при температурі близькій до -20°С до проведення аналізу. Для того, щоб визначити ex vivo активність продуктів в плазмі, використовували аналіз аутофосфорилування в НЕК клітинах, описаний раніше. Для цієї мети трансфіковані клітини інкубували із плазмою (10%) замість сполук. Результати виражають як процент інгібування 21 UA 109942 C2 5 аутофосфорилування VEGFR-3 в порівнянні із необробленими клітинами (максимум аутофосфорилування) і із нетрансфікованими клітинами (основа). Ex vivo активність сполук винаходу наведена в наступній таблиці 3. Результати виражені у вигляді процентного інгібування VEGFR-3 аутофосфорилування НЕК клітин в присутності зразка плазми, взятого (за час), після введення через рот (р. о.) сполук. Для того, щоб оцінити збільшення даної активності відносно сполук за винаходом, порівняння із сполуками попереднього рівня техніки (WO 2009/007535) і підданими тому ж вимірюванню, наводять в таблиці 3. Таблиця 3 Порівняння ex vivo активності між сполуками даного винаходу і відповідною сполукою відомого рівня техніки після введення р. о. самцям мишей Balb/c Z Приклад W Y N C≡C 1 1' 3 N C≡C R1 R2 CH2OCH3 Me -CH2OH Me -3піридил Me CH2OCH3 Me R3 R4 R5 Хіральність H Et H R Імідазол Амід H Et H Rac. N C≡C 4' 5 N C≡C 5' H Et H Rac. H Et Me R Амід H C≡C H Et H Амід 13' Імідазол 16 N C≡C Me Et H EtH Rac. Амід 16' N C≡C феніл Me H Et H Rac. N C≡C H Me H Et H Rac. Амід Імідазол 22' 15 Імідазол Амід 17' 10 Імідазол Імідазол N 22 Імідазол Амід 13 17 Імідазол Амід 3' 4 A Ex vivo інгібування (%), за час 83%, 6 год. 40%, 6 год. 51%, 3 год. 0%, 3 год. 28%, 6 год. 0%, 6 год. 86%, 6 год. 40% 6 год. 23%, 6 год. 17%, 6 год. 48%, 3 год. 20%, 3 год. 37%, 6 год. 5%, 6 год. 26%, 6 год. 0%, 3 год. Виходить, імовірно, що сполуки згідно із винаходом мають інгібуючу активність стосовно аутофосфорилування VEGFR-3, отже, вони можуть бути використані в отриманні лікарських засобів, зокрема, лікарських засобів, які інгібують VEGFR-3. Збільшення проявлення сполуки, зокрема, біодоступності є одним із критеріїв збільшення інгібування ex vivo аутофосфорилування сполуки за винаходом. Інгібітори VEGFR-3 тирозинкінази, згідно із винаходом, показують хорошу біодоступність, навіть кращу, ніж біодоступність інгібіторів попереднього рівня техніки. 22 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 60 Біодоступність стосується міри і швидкості, при яких активний фрагмент (лікарський засіб або метаболіт), який входить у велике коло кровообігу, досягає тією самою ділянкою дії. Біодоступність лікарського засобу значною мірою визначається властивостями дозованої форми (які залежать частково від її дизайну і виробництва), швидше, ніж фізико-хімічними властивостями лікарського засобу, які визначають абсорбційний потенціал. Відмінності в біодоступності серед рецептурних форм заданого лікарського засобу можуть мати клінічне значення; знаючи, таким чином, чи є еквівалент рецептурних форм лікарського засобу суттєвим. Біодоступність використовується для опису фракції дози незмінного лікарського засобу, що вводиться, яка досягає великого кола кровообігу і яка є однією із головних фармакокінетичних властивостей лікарських засобів. За визначенням, коли лікарський засіб вводиться внутрішньовенно, його біодоступність становить 100%. Однак, коли лікарський засіб вводиться іншими шляхами (такими як пероральний), його біодоступність знижується (внаслідок неповного поглинання і пресистемного метаболізму) або може варіювати від пацієнта до пацієнта (внаслідок взаємоіндивідуального варіювання). Біодоступність є одним із суттєвих інструментів в фармакокінетиці, оскільки біодоступність повинна враховуватися при розрахунку дозування для невнутрішньовенних способів введення. Таким чином, згідно із одним із аспектів, об'єктом винаходу є лікарські засоби, які включають сполуки формули (I) або її адитивну сіль із фармакологічно прийнятною кислотою і основою, а також енантіомером або діастереоізомером, включаючи їх суміш, сполуки формули (I). Ще один аспект винаходу включає комбінацію щонайменше однієї сполуки згідно із винаходом і щонайменше одного терапевтичного агента. Зокрема, сполуки даного винаходу можуть бути використані окремо або в суміші із щонайменше одним терапевтичним агентом, який може бути вибраний із: - алкілуючих агентів, - інтеркалюючих агентів, - антимікротубулінових агентів, - антимітотичних агентів, - антиметаболітів, - антипроліферативних агентів, - антибіотиків, - імуномодулюючих речовин, - протизапальних агентів, - інгібіторів кінази, - антиангіогенних агентів, - антиваскулярних агентів, - естрогенних і андрогенних гормонів. Можна також комбінувати сполуки згідно із винаходом із променевою терапією. Комбінації сполук за винаходом із терапевтичними агентами, наведеними вище, і/або із радіаційним опроміненням складають ще один об'єкт даного винаходу. Терапевтичні агенти, згадані вище, і/або радіаційне опромінення можуть застосовуватися одночасно, окремо або послідовно. Лікування звичайно регулюється практикуючим лікарем відповідно до пацієнта, який піддається лікуванню. Дані лікарські засоби використовуються в терапії, зокрема, при лікуванні і/або запобіганні: - раку і його метастазів, таких як гліобластома, множинна мієлома, мієлодиспластичний синдром, саркома Капоші, шкірна ангіосаркома, солідні пухлини, лімфома, меланома, рак грудей, колоректальний рак, рак легень, включаючи недрібноклітинний рак, рак підшлункової залози, рак простати, рак нирок, рак голови і шиї, рак печінки, рак яєчників, рак дихального тракту і грудної клітки, інші пухлини, експресуючі VEGFR-3 або залучаючі процес ангіогенезу або лімфоангіогенезу, - неонкологічних проліферативних захворювань і патологічного ангіогенезу, пов'язаного із VEGFR-3, таких як артроз, рестеноз, псоріаз, гемангіома, лімфангіома, глаукома, гломерунефрит, діабетична нефропатія, нефросклероз, тромботичний мікроангіопатичний синдром, цироз печінки, атеросклероз, відторгнення трансплантованого органа, захворювання очей, включаючи процес ангіогенезу або лімфоангіогенезу, такі як діабетична ретинопатія або дегенерація жовтої плями, - або ще при лікуванні і профілактиці запалення (хронічного або нехронічного), інфікування мікроорганізмами і аутоімунних захворювань, таких як ревматоїдний артрит, - або ще в лікуванні рідкісних захворювань, таких як лімфангіолейоміоматоз. Згідно із ще одним із аспектів винахід стосується фармацевтичних композицій, які містять як активний інгредієнт сполуки згідно із винаходом. Дані фармацевтичні композиції містять 23 UA 109942 C2 5 10 15 20 ефективну дозу щонайменше однієї сполуки згідно із винаходом або її фармацевтично прийнятної солі, гідрату або сольвату, а також щонайменше одного фармацевтично прийнятного ексципієнта. Вказані ексципієнти вибирають згідно із фармацевтичною формою і способом бажаного введення із звичайних ексципієнтів, які відомі фахівцям в даній галузі. У фармацевтичних композиціях за винаходом для перорального, під'язичного, підшкірного, внутрішньом'язового, внутрішньовенного, топічного або місцевого, внутрішньотрахеального, внутрішньоназального, трансдермального або ректального введення активний інгредієнт формули (I), вказаної вище, або її можлива сіль, сольват або гідрат можуть бути введені в одиничній формі у вигляді суміші із загальноприйнятими фармацевтичними ексципієнтами тваринам або людині для лікування або профілактики вказаних вище розладів або захворювань. Відповідні одиничні форми для введення включають форми для перорального введення, такі як таблетки, м'які або тверді гелеві капсули, порошки, гранули і пероральні розчини або суспензії, форми для під'язичного, защічного, внутрішньотрахеального, внутрішньоочного і внутрішньоназального введення, форми для введення за допомогою інгаляції, форми для введення топічно, трансдермально, підшкірно, внутрішньом'язово або внутрішньовенно, форми для введення ректально і імплантанти. Для топічного введення сполуки згідно із винаходом можуть використовуватися у вигляді кремів, гелів, мазей або лосьйонів. Наприклад, одинична форма для введення сполуки згідно із винаходом у вигляді таблетки може включати наступні компоненти: Сполука згідно із винаходом 50,0 мг Маніт 223,75 мг Кроскармелоза натрію 6,0 мг Кукурудзяний крохмаль 15,0 мг Гідроксипропілметилцелюлоза 2,25 мг Стеарат магнію 3,0 мг Згідно із іншими аспектами даний винахід стосується також способу лікування патологічних станів, вказаних вище, який включає введення пацієнту ефективної дози сполуки згідно із винаходом або її фармацевтично прийнятної солі. 25 ФОРМУЛА ВИНАХОДУ 1. Сполука, яка відповідає формулі (І): O R5 HN N R3 O 30 35 40 45 z Y W N R4 NH2 , (I) в якій: - W являє собою атом азоту або групу СН; - Y являє собою С2-С3-алкінілен, 1,4-фенілен, необов'язково заміщений R7, який являє собою один або більше атомів галогену; - Z являє собою зв'язок або групу CR1R2; - R1 і R2, незалежно один від одного, являють собою групу, вибрану із атома водню, С 1-С6алкільної групи, трифторметильної групи, групи (CH2)nOR6, С3-С7-циклоалкілу, гетероарилу або арилу, необов'язково заміщеного одним або більше атомами галогену; - R1 і R2 можуть утворювати разом із атомом вуглецю, до якого вони приєднані, С 3-С7циклоалкіл; - R3 являє собою атом водню; - R4 являє собою групу, вибрану із С1-С6-алкільної групи, групи (CH2)nOR6, C3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом; - R5 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - n дорівнює 1, 2 або 3; 24 UA 109942 C2 5 10 15 20 25 30 35 40 45 50 55 у формі основи або кислотно-адитивної солі, або її енантіомер або діастереоізомер або їх суміш. 2. Сполука формули (І) за п. 1, в якій W являє собою атом азоту або групу СН, у формі основи або кислотно-адитивної солі. 3. Сполука формули (І) за п. 1 або 2, в якій W являє собою атом азоту, у формі основи або кислотно-адитивної солі. 4. Сполука формули (І) за будь-яким із пп. 1-3, в якій Y являє собою С2-С3-алкінілен, більш конкретно етинілен, у формі основи або кислотно-адитивної солі. 5. Сполука формули (І) за будь-яким із пп. 1-4, в якій: - Z являє собою зв'язок, групу CR1R2; - R1 являє собою групу, вибрану із атома водню, С 1-С6-алкільної групи, групи (СН2)nOR6, С3-С7циклоалкілу, арилу або 5- або 6-членного гетероарилу; - R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу; - R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - n дорівнює 1, 2 або 3; у формі основи або кислотно-адитивної солі. 6. Сполука формули (І) за будь-яким із пп. 1-5, в якій: - Z являє собою групу CR1R2; - R1 являє собою групу, вибрану із атома водню, С 1-С6-алкільної групи, групи (CH2)nOR6, С3-С7циклоалкілу, арилу або 5- або 6-членного гетероарилу; - R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу; - R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; і - n дорівнює 1, 2 або 3; у формі основи або кислотно-адитивної солі. 7. Сполука формули (І) за будь-яким із пп. 1-6, в якій R4 являє собою групу, вибрану із С1-С6алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом, у формі основи або кислотно-адитивної солі. 8. Сполука формули (І) за будь-яким із пп. 1-7, в якій R4 являє собою С1-С6-алкіл, більш конкретно етил, у формі основи або кислотно-адитивної солі. 9. Сполука формули (І) за будь-яким із пп. 1-8, в якій R5 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи, у формі основи або кислотно-адитивної солі. 10. Сполука формули (І) за будь-яким із пп. 1-9, в якій R5 являє собою атом водню, у формі основи або кислотно-адитивної солі. 11. Сполука формули (І) за будь-яким із пп. 1-10, в якій: - W являє собою атом азоту або групу СН; - Y являє собою С2-С3-алкілен, 1,4-фенілен, необов'язково заміщений R7, який являє собою атом галогену; - Z являє собою зв'язок або групу CR1R2; - R1 являє собою групу, вибрану із атома водню, С 1-С6-алкільної групи, групи (CH2)nOR6, С3-С7циклоалкілу, арилу або 5- або 6-членного гетероарилу, необов'язково заміщеного атомом галогену; - R2 являє собою групу, вибрану із атома водню, С1-С6-алкільної групи або трифторметилу; - R3 являє собою атом водню; - R4 являє собою групу, вибрану із С1-С6-алкільної групи, групи (CH2)nOR6, С3-С7-циклоалкілу або С1-С6-алкілу, необов'язково заміщеного С3-С7-циклоалкілом; - R5 являє собою групу, вибрану із атома водню або C1-С6-алкільної групи; - R6 являє собою групу, вибрану із атома водню або С1-С6-алкільної групи; - n дорівнює 1, 2 або 3; у формі основи або кислотно-адитивної солі. 12. Сполука формули (І) за будь-яким із пп. 1-11, в якій R1 і R2 разом із атомом вуглецю, до якого вони приєднані, утворюють С3-С7-циклоалкіл, у формі основи або кислотно-адитивної солі. 13. Сполука формули (І) за п. 1, вибрана з групи, що складається з: 2-аміно-1-етил-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1Н[1,8]нафтиридин-4-ону; 2-аміно-1-пропіл-7-((3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1Н[1,8]нафтиридин-4-ону; 2-аміно-7-(3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4ону; 25 UA 109942 C2 5 10 15 20 25 30 35 40 2-аміно-1-етил-7-(3-гідрокси-3-піридин-2-ілбут-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4ону; 2-аміно-1-етил-7-[(3R)-3-гідрокси-4-метокси-3-метилбут-1-иніл]-3-(4-метил-1Н-імідазол-2-іл)-1Н[1,8]нафтиридин-4-ону; 2-аміно-1-(циклопропілметил)-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин4-ону; 2-аміно-1-eтил-7-[(3R)-3-гiдpoкcи-4-мeтoкcи-3-мeтилбyт-1-иніл]-3-(1Н-імідазол-2-іл)-1Н-хінолін-4ону; 2-аміно-7-(3-хлор-4-гідроксифеніл)-1-етил-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-[3-(2-фторфеніл)-3-гідроксибут-1-иніл]-3-(1Н-імідазол-2-іл)-1Н[1,8]нафтиридин-4-ону; 2-аміно-1-циклопентил-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1-(3-метоксипропіл)-1Н-[1,8]нафтиридин-4ону; 2-аміно-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1-(2-метоксіетил)-1Н-[1,8]нафтиридин-4ону; 2-аміно-1-етил-7-[(1-гідроксициклобутил)етиніл]-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-[(1-гідроксициклопентил)етиніл]-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-(3-гідрокси-3-метилбут-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-(3-гідрокси-3-метилпент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-(3-гідрокси-3-фенілбут-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-[3-(3-фторфеніл)-3-гідроксибут-1-иніл]-3-(1Н-імідазол-2-іл)-1Н[1,8]нафтиридин-4-ону; 2-аміно-1-етил-3-(1Н-імідазол-2-іл)-7-(4,4,4-трифтор-3-гідрокси-3-фенілбут-1-иніл)-1Н[1,8]нафтиридин-4-ону; 2-аміно-7-(3-циклопропіл-3-гідроксибут-1-иніл)-1-етил-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин4-ону; 2-аміно-1-етил-7-[3-гідрокси-3-(тіофен-2-іл)бут-1-иніл]-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин4-ону; 2-аміно-1-етил-7-(3-гідроксибут-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-(3-гідроксипент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-(3-гідроксигекс-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-(3-гідрокси-4-метилпент-1-иніл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-1-етил-7-(3-гідрокси-3-фенілпроп-1-ініл)-3-(1Н-імідазол-2-іл)-1Н-[1,8]нафтиридин-4-ону; 2-аміно-7-((3R)-3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1Н-імідазол-2-іл)-1,8-нафтиридин4(1Н)-ону; 2-аміно-7-((3S)-3,4-дигідрокси-3-метилбут-1-иніл)-1-етил-3-(1Н-імідазол-2-іл)-1,8-нафтиридин4(1Н)-ону; 2-аміно-1-етил-7-((3S)-3-гідрокси-4-метокси-3-метилбут-1-иніл)-3-(1H-імідазол-2-іл)-1,8нафтиридин-4(1H)-ону. 14. Спосіб отримання сполуки формули (І) за будь-яким із пп. 1-13, який характеризується тим, що сполуку формули (VII): O R5 N N PG X N N R4 NH2 , (VII) 45 в якій X являє собою хлор або бром, a R4 і R5 мають значення, як визначено в загальній формулі (І) за будь-яким із пп. 1-14, піддають реакції із сполукою загальної формули (XVa): 26 UA 109942 C2 R3O R2 R1 , (XVa) в якій R1, R2 і R3 мають значення, як визначено в загальній формулі (І), за будь-яким із пп. 1-13, або піддають реакції із сполуками загальної формули (XVb): 5 R7 R3O 10 15 20 25 30 35 40 45 50 B(OH)2 , (XVb) в якій R3 і R7 мають значення, як визначено в загальній формулі (І), за будь-яким із пп. 1-13, загальноприйняту стадію зняття захисту проводять до або після реакції сполуки формули (VII) із сполукою загальної формули (XVa) або із сполукою загальної формули (XVb). 15. Лікарський засіб, який містить сполуку формули (І) за будь-яким із пп. 1-13 або її фармацевтично прийнятну сіль або енантіомер або діастереоізомер або їх суміш. 16. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-13 або її фармацевтично прийнятну сіль або енантіомер, або діастереоізомер або їх суміш, а також щонайменше один фармацевтично прийнятний ексципієнт. 17. Комбінація сполуки формули (І) за будь-яким із пп. 1-13 із щонайменше одним терапевтичним агентом, вибраним із: - алкілуючих агентів, - інтеркалюючих агентів, - антимікротубулінових агентів, - антимітотичних агентів, - антиметаболітів, - антипроліферативних агентів, - антибіотиків, - імуномодулюючих речовин, - протизапальних агентів, - інгібіторів кінази, - антиангіогенних агентів, - антиваскулярних агентів, - естрогенних і андрогенних гормонів. 18. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування захворювань, в які залучений VEGFR-3. 19. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування раку і метастазів. 20. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування захворювань, таких як гліобластома, множинна мієлома, мієлодиспластичний синдром, саркома Капоші, шкірна ангіосаркома, солідні пухлини, лімфома, меланома, рак грудей, колоректальний рак, рак легень, включаючи недрібноклітинний рак, рак підшлункової залози, рак простати, рак нирок, рак голови і шиї, рак печінки, рак яєчників, рак дихального тракту і грудної клітки або інші пухлини, які експресують VEGFR-3 або залучають процес ангіогенезу або лімфоангіогенезу. 21. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування неонкологічних проліферативних захворювань і патологічного ангіогенезу, пов'язаного із VEGFR-3. 22. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування захворювань, вибраних із групи, яка складається із артрозу, рестенозу, псоріазу, гемангіоми, лімфангіоми, глаукоми, гломерунефриту, діабетичної нефропатії, нефросклерозу, тромботичного мікроангіопатичного синдрому, цирозу печінки, атеросклерозу, відторгнення трансплантованого органа, захворювань очей, які включають процес ангіогенезу або лімфоангіогенезу. 23. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування хронічного або нехронічного запалення, інфікування мікроорганізмами і аутоімунних захворювань, таких як ревматоїдний артрит. 27 UA 109942 C2 24. Сполука формули (І) за будь-яким із пп. 1-13 для застосування в отриманні лікарського засобу для запобігання і/або лікування рідкісних захворювань, таких як лімфангіолейоміоматоз або хвороба Горхема. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;2-amino-3-(imidazol-2-yl)-pyridin-4-one derivatives and their use as vegf receptor kinase inhibitors
Автори англійськоюBraun, Alain, Duclos, Olivier, Lassalle, Gilbert, Lorge, Franz, Martin, Valerie, Ritzeler, Olaf, Strub, Aurelie
Назва патенту російськоюПроизводные 2-амино-3-(имидазол-2-ил)-пиридин-4-она и их применение как ингибиторов киназы рецептора vegf
Автори російськоюБрон Ален, Дюкло Оливье, Лассалль Жильбер, Лорж Франц, Мартен Валери, Ритцелер Олаф, Стрюб Орели
МПК / Мітки
МПК: A61P 35/00, C07D 471/04, A61K 31/4375, C07D 401/04, A61K 31/4709
Мітки: похідні, 2-аміно-3-(імідазол-2-іл)-піридин-4-ону, інгібіторів, кінази, рецептора, застосування
Код посилання
<a href="https://ua.patents.su/30-109942-pokhidni-2-amino-3-imidazol-2-il-piridin-4-onu-i-kh-zastosuvannya-yak-ingibitoriv-kinazi-receptora-vegf.html" target="_blank" rel="follow" title="База патентів України">Похідні 2-аміно-3-(імідазол-2-іл)-піридин-4-ону і їх застосування як інгібіторів кінази рецептора vegf</a>
Попередній патент: Дорожня система перетворення енергії й вібропоглинання
Наступний патент: Гіпертонія й гіперурикемія
Випадковий патент: Каркас ложного порога сталеплавильної печі