Заміщені піразолохіназолінові похідні, спосіб їх одержання і їх застосування як інгібіторів кінази
Номер патенту: 102219
Опубліковано: 25.06.2013
Автори: Бєрія Італо, Постері Елєна, Фергюсон Рон, КАРУЗО Мікелє, Вальсазіна Барбара, Браска Марія Габріелла
Формула / Реферат
1. Сполука формули (І):
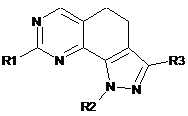 , (I)
, (I)
де
R1 має формулу:
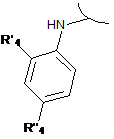 або
або 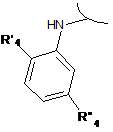 ,
,
де R'4 і R"4 незалежно вибрані з групи, що включає галоген, нітро, ціано, С1-С6-алкіл, поліфторований алкіл, поліфторований алкокси, алкеніл, алкініл, гідроксіалкіл, арил, арилалкіл, гетероцикліл, С3-С6-циклоалкіл, гідрокси, алкокси, арилокси, гетероциклілокси, метилендіокси, алкілкарбонілокси, арилкарбонілокси, циклоалкенілокси, гетероциклілкарбонілокси, алкіліденаміноокси, карбокси, алкоксикарбоніл, арилоксикарбоніл, циклоалкілоксикарбоніл, гетероциклілоксикарбоніл, аміно, уреїдо, алкіламіно, діалкіламіно, ариламіно, діариламіно, гетероцикліламіно, форміламіно, алкілкарбоніламіно, арилкарбоніламіно, гетероциклілкарбоніламіно, амінокарбоніл, алкіламінокарбоніл, діалкіламінокарбоніл, ариламінокарбоніл, гетероцикліламінокарбоніл, алкоксикарбоніламіно, гідроксіамінокарбоніл, алкоксііміно, алкілсульфоніламіно, арилсульфоніламіно, гетероциклілсульфоніламіно, форміл, алкілкарбоніл, арилкарбоніл, циклоалкілкарбоніл, гетероциклілкарбоніл, алкілсульфоніл, арилсульфоніл, аміносульфоніл, алкіламіносульфоніл, діалкіламіносульфоніл, ариламіносульфоніл, гетероцикліламіносульфоніл, арилтіо, алкілтіо, фосфонат і алкілфосфонат; і
R2 являє собою водень або необов'язково заміщену групу, вибрану з С1-С6-алкілу з лінійним або розгалуженим ланцюгом, С2-С6-алкенілу з лінійним або розгалуженим ланцюгом, С2-С6-алкінілу з лінійним або розгалуженим ланцюгом, С3-С6-циклоалкілу і гетероциклілу;
R3 являє собою CO-OR' або CO-NR'R", де R' і R" являють собою, кожен незалежно, водень або необов'язково заміщену групу, вибрану з С1-С6-алкілу з лінійним або розгалуженим ланцюгом, С3-С6-циклоалкілу і гетероциклілу, або R' і R" узяті разом з атомом азоту, з яким вони зв'язані, можуть утворювати необов'язково заміщену гетероциклільну групу, яка необов'язково містить один додатковий гетероатом, вибраний з N, О або S і її оптичні ізомери, таутомери, гідрати, сольвати, N-оксиди і фармацевтично прийнятні солі.
2. Сполука формули (І) за п. 1, де:
R3 являє собою СО-ОН або CO-NR'R", де R' і R" мають значення, визначені в п. 1.
3. Сполука формули (І) за п. 1 або 2, де R2 являє собою необов'язково заміщений С1-С6-алкіл або С2-С6-алкеніл з лінійним або розгалуженим ланцюгом.
4. Сполука формули (І) за будь-яким з пп. 1-3, де:
R3 являє собою CO-NR'R", де R' і R" мають значення, визначені в п. 1.
5. Сполука або її фармацевтично прийнятна сіль, яка вибрана з групи, що складається з:
8-[2-ацетил-5-(4-метилпіперазин-1-іл)-феніламіно]-1-метил-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (А39В1С1Z);
8-[2-ацетил-5-(4-метилпіперазин-1-іл)-феніламіно]-1-(2-фторетил)-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A39B2C1Z);
1-метил-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (А51В1С1Z);
етил-1-метил-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксилату (А51В1C2Z);
1-метил-8-[2-метокси-5-(4-метилпіперазин-1-іл)-феніламіно]-1-метил-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (А85В1С1Z);
8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-1-(2-фторетил)-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A51B2C1Z);
1-метил-8-[4-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (А48В1С1Z);
1-метил-8-(2-трифторметокси-5-піперазин-1-ілфеніламіно)-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A97B1C1Z);
1-метил-8-[2-метил-5-(4-метилпіперазин-1-іл)-феніламіно]-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксаміду (A98B1C1Z);
1-метил-8-[5-(4-піролідин-1-ілпіперидин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A99B1C1Z);
метиламід-1-метил-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбонової кислоти (А51B1C4Z);
метиламід-1-метил-8-[5-(4-метилпіперазин-1-іл)-2-метоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбонової кислоти (A85B1C4Z);
1-метил-8-[2-метил-5-(4-метилпіперазин-1-карбоніл)-феніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A87B1C1Z);
1-метил-8-[2-метил-4-(4-метилпіперазин-1-карбоніл)-феніламіно]-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксаміду (A86B1C1Z);
1-метил-8-{2-трифторметокси-5-[(1-метилпіперидин-4-карбоніл)-аміно]-феніламіно}-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A82B1C1Z);
8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-1-метил-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксилату калію (А51В1C3Z);
1-етил-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (А51B7C1Z);
(2,2,2-трифторетил)-амід-1-метил-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбонової кислоти (A51B1C7Z);
1-(2-гідроксіетил)-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A51B5C1Z);
8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-1-вініл-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A51B10C1Z);
1-(2-хлоретил)-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A51B9C1Z);
8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксаміду (A51B8C1Z);
1-(2-гідроксіетил)-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксилату калію (A51B5C3Z);
етил-1-(2-гідроксіетил)-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксилату (A51B5C2Z);
1-метил-8-[5-(1-метил-1,2,3,6-тетрагідропіридин-4-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (А113В1С1Z);
1-метил-8-[5-(1-метилпіперидин-4-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A114B1C1Z);
8-(5-бром-2-трифторметоксифеніламіно)-1-метил-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (A49B1C1Z) і
8-(5-бром-2-трифторметоксифеніламіно)-4,5-дигідро-1Н-піразоло[4,3-h]хіназолін-3-карбоксаміду (А49В8С1Z).
6. Спосіб одержання сполуки формули (І) за п. 1, який складається з:
стадія 1) взаємодія сполуки формули (II):
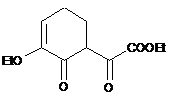 (II)
(II)
з гідразиновим похідним формули (III):
R2-NHNH2, (III)
де R2 має значення, визначене в п. 1, у присутності оцтової кислоти з одержанням сполуки формули (IV):
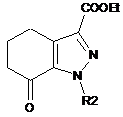 , (IV)
, (IV)
де R2 має значення, визначене вище;
необов'язково, алкілування сполуки формули (IV), де R2 являє собою водень, за допомогою сполук формули (V):
R2-Y, (V)
де Y являє собою придатну відщеплювану групу, таку як мезил, тозил, галоген, і R2 має значення, визначене вище, але відмінне від водню, з одержанням сполуки формули (IV), де R2 має значення, визначене вище, але відмінне від водню;
стадія 2) взаємодія сполуки формули (IV) з диметилформамід-ди-трет-бутилацеталем або диметилформамід-діізопропілацеталем з одержанням сполуки формули (VI):
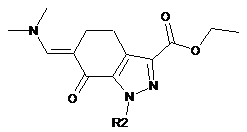 , (VI)
, (VI)
де R2 має значення, визначене вище; і
стадія 3) взаємодія сполуки формули (VI), відповідно до стадії (стадія 3а):
стадія 3а) з гуанідином з одержанням сполуки формули (VII), де R2 має значення, визначене вище;перетворення аміногрупи одержаної сполуки формули (VII) у йод і потім взаємодія одержаного йодопохідного формули (VIII) з ортозаміщеним ариламіном формули R1-H (IX), де R1 має значення, визначене в п. 1, з одержанням сполуки формули (І):

(VII)
(XIII)
, (I)
де R1 і R2 мають значення, визначені вище;
і
необов'язково, перетворення її в інші похідні формули (І) і/або в їх фармацевтично прийнятні солі.
7. Спосіб одержання сполуки формули (І) за п. 1, який складається з:
стадія 1) взаємодія сполуки формули (II):
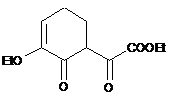 (II)
(II)
з гідразиновим похідним формули (III):
R2-NHNH2, (III)
де R2 має значення, визначене в п. 1, в присутності оцтової кислоти з одержанням сполуки формули (IV):
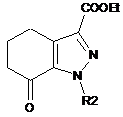 , (IV)
, (IV)
де R2 має значення, визначене вище;
необов'язково, алкілування сполуки формули (IV), де R2 являє собою водень, за допомогою сполук формули (V):
R2-Y (V),
де Y являє собою придатну відщеплювану групу, таку як мезил, тозил, галоген, і R2 має значення, визначене вище, але відмінне від водню, з одержанням сполуки формули (IV), де R2 має значення, визначене вище, але відмінне від водню;
стадія 2) взаємодія сполуки формули (IV) з диметилформамід-ди-трет-бутилацеталем або диметилформамід-діізопропілацеталем з одержанням сполуки формули (VI):
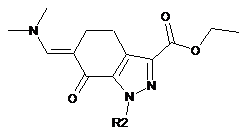 ,(VI)
,(VI)
де R2 має значення, визначене вище; і
стадія 3) взаємодія сполуки формули (VI), відповідно до стадії (стадія 3b):
стадія 3b) з гуанідиновим похідним формули (X):
R1-C(=NH)NH2, (X)
де R1 має значення, визначене вище, з одержанням сполуки формули (І)
 , (I)
, (I)
де R1 і R2 мають значення, визначені вище, і
необов'язково, перетворення її в інші похідні формули (І) і/або в їх фармацевтично прийнятні солі.
8. Спосіб одержання сполуки формули (І) за п. 6, який відрізняється тим, що сполуку формули (І) одержують згідно зі способом, який включає:
стадія 4) перетворення етоксикарбонільної групи сполуки формули (VIII), визначеної в п. 6, у сполуку формули (XIII) або відповідну сіль за допомогою кислотного або лужного гідролізу; перетворення одержаної сполуки формули (XIII) або відповідної солі в сполуку формули (XIV) за допомогою реакції в лужних умовах і в присутності придатного агента конденсації з аміном формули R'R"-NH (XI), де R' і R" мають значення, визначені в п. 1; взаємодія сполуки формули (XIV) з ортозаміщеним ариламіном формули R1-H (IX), де R1 має значення, визначене в п. 1, з одержанням сполуки формули (І):
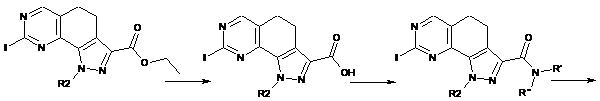
(VIII) (XIII)
(XIV)
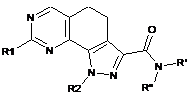 ,
,
(I)
де R1, R2, R" і R" мають значення, визначені вище, і, необов'язково, її перетворення в інші похідні формули (І) і/або в їх фармацевтично прийнятні солі.
9. Спосіб одержання сполуки формули (І) за будь-яким з пп. 6-8, який відрізняється тим, що необов'язкове перетворення сполуки формули (І) в інші сполуки формули (І) здійснюють за допомогою однієї або декількох з наступних реакцій:
a) перетворення сполуки формули (І), де R3 являє собою етоксикарбоніл, у сполуку формули (І), де R3 являє собою амінокарбоніл, шляхом обробки гідроксидом амонію:

(I)
; (I)
b) перетворення сполуки формули (І), де R3 являє собою етоксикарбоніл, у сполуку формули (І), де R3 являє собою групу CO-NR'R", шляхом обробки аміном формули R'R"-NH (XI), де R' і R" мають значення, визначені в п. 1:
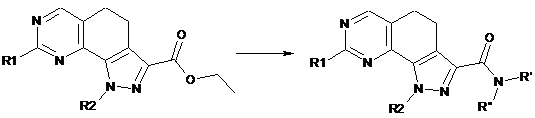
(I)
; (I)
c) перетворення сполуки формули (І), де R3 являє собою етоксикарбоніл, у сполуку формули (І), де R3 являє собою групу СО-ОН, або відповідну сіль за допомогою кислотного або лужного гідролізу:

(I)
; (I)
d) перетворення сполуки формули (І), де R3 являє собою СО-ОН або відповідну сіль, у сполуки формули (І), де R3 являє собою групу CO-NR'R", за допомогою реакції з аміном формули R'R"-NH (XI) у лужних умовах і в присутності придатного агента конденсації, де R' і R" мають значення, визначені вище:
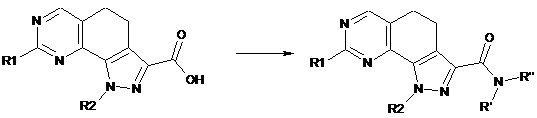
(I)
; (I)
e) перетворення сполуки формули (І), де R2 являє собою тритил, у сполуку формули (І), де R2 являє собою водень, у кислотних умовах:
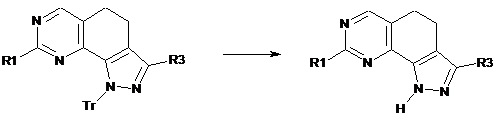
(I)
; (I)
f) перетворення сполуки формули (І), де R2 являє собою водень, у сполуку формули (І), де R2 має значення, визначене в п. 1, але відмінне від водню, за допомогою реакції зі спиртом формули R2-OH (XII), де R2 має значення, визначене вище, але відмінне від водню:
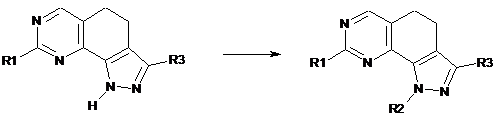
(I)
; (I)
g) перетворення сполуки формули (І), де R2 являє собою водень, у сполуку формули (І), де R2 має значення, визначене в п. 1, але відмінне від водню, за допомогою реакції зі сполукою формули R2-X (XV), де R2 має значення, визначене вище, але відмінне від водню, і X являє собою галоген:

(I)
; (I)
h) перетворення сполуки формули (І), де R2 являє собою галогенетил, у сполуку формули (І), де R2 являє собою вініл:
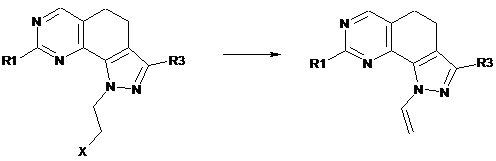
(I)
; (I)
і) перетворення сполуки формули (І), де R1 являє собою ортозаміщений ариламіно формули:
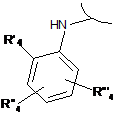 або
або 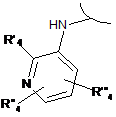 , або
, або 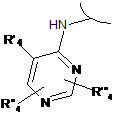 ,
,
де R'4 або R"4, або R'"4 являє собою бром, у сполуку формули (І), де R'4 або R"4, або R'"4 являє собою групу -NR'R", шляхом обробки аміном формули R'R"-NH (XI), де R' і R" мають значення, визначені в п. 1.
10. Бібліотека двох або більше сполук формули (І):
 , (I)
, (I)
де
R1 має формулу:
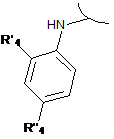 або
або  ,
,
де R'4 і R''4 незалежно вибрані з групи, яка включає галоген, нітро, ціано, С1-С6-алкіл, поліфторований алкіл, поліфторований алкокси, алкеніл, алкініл, гідроксіалкіл, арил, арилалкіл, гетероцикліл, С3-С6-циклоалкіл, гідрокси, алкокси, арилокси, гетероциклілокси, метилендіокси, алкілкарбонілокси, арилкарбонілокси, циклоалкенілокси, гетероциклілкарбонілокси, алкіліденаміноокси, карбокси, алкоксикарбоніл, арилоксикарбоніл, циклоалкілоксикарбоніл, гетероциклілоксикарбоніл, аміно, уреїдо, алкіламіно, діалкіламіно, ариламіно, діариламіно, гетероцикліламіно, форміламіно, алкілкарбоніламіно, арилкарбоніламіно, гетероциклілкарбоніламіно, амінокарбоніл, алкіламінокарбоніл, діалкіламінокарбоніл, ариламінокарбоніл, гетероцикліламінокарбоніл, алкоксикарбоніламіно, гідроксіамінокарбоніл, алкоксііміно, алкілсульфоніламіно, арилсульфоніламіно, гетероциклілсульфоніламіно, форміл, алкілкарбоніл, арилкарбоніл, циклоалкілкарбоніл, гетероциклілкарбоніл, алкілсульфоніл, арилсульфоніл, аміносульфоніл, алкіламіносульфоніл, діалкіламіносульфоніл, ариламіносульфоніл, гетероцикліламіносульфоніл, арилтіо, алкілтіо, фосфонат і алкілфосфонат;
R2 являє собою водень або необов'язково заміщену групу, вибрану з С1-С6-алкілу з лінійним або розгалуженим ланцюгом, С2-С6-алкенілу з лінійним або розгалуженим ланцюгом, С2-С6-алкінілу з лінійним або розгалуженим ланцюгом, С3-С6-циклоалкілу і гетероциклілу;
R3 являє собою CO-OR' або CO-NR'R", де R' і R" являють собою, кожен незалежно, водень або необов'язково заміщену групу, вибрану з С1-С6-алкілу з лінійним або розгалуженим ланцюгом, С3-С6-циклоалкілу і гетероциклілу, або R' і R" узяті разом з атомом азоту, з яким вони зв'язані, можуть утворювати необов'язково заміщену гетероциклільну групу, яка необов'язково містить один додатковий гетероатом, вибраний з N, О або S;
і їх оптичні ізомери, таутомери, гідрати, сольвати, N-оксиди і фармацевтично прийнятні солі.
11. Спосіб лікування захворювання, викликаного і/або пов'язаного з порушеною регуляцією активності протеїнкінази, який включає введення ссавцю, що потребує цього, ефективної кількості сполуки формули (І) за п. 1.
12. Фармацевтична композиція, яка включає терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі за п. 1 і щонайменше один фармацевтично прийнятний ексципієнт, носій і/або розріджувач.
13. Комбінований препарат, який включає щонайменше одну сполуку формули (І) або її фармацевтично прийнятну сіль за п. 1, або фармацевтичну композицію за п. 12 і один або декілька хіміотерапевтичних засобів, для одночасного, окремого або послідовного застосування в протираковій терапії.
14. Сполука формули (І) або її фармацевтично прийнятна сіль за п. 1 для використання як лікарського засобу.
15. Сполука формули (І) або її фармацевтично прийнятна сіль за п. 1 для використання в способі лікування раку.
16. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за п. 1 для одержання лікарського засобу, що має протиракову активність.
Текст
Реферат: Розкриті піразолохіназолінові похідні формули (І), як визначено в описі, і їх фармацевтично прийнятні солі, спосіб їх одержання й фармацевтичні композиції, які їх містять. Сполуки за даним винаходом можна застосовувати в терапії, при лікуванні захворювань, пов'язаних з порушеною регуляцією активності протеїнкінази, наприклад раку. UA 102219 C2 (12) UA 102219 C2 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується конкретних заміщених піразолохіназолінових сполук, які модулюють активність протеїнкіназ. Тому сполуки за даним винаходом використовують при лікуванні захворювань, викликаних порушеною регуляцією активності протеїнкінази. Даний винахід також забезпечує способи одержання цих сполук, фармацевтичні композиції, які містять ці сполуки, і способи лікування захворювань з використанням фармацевтичних композицій, які містять ці сполуки. Застосування мітотичних інгібіторів у терапії ракових захворювань є широко розповсюдженою клінічною стратегією для лікування широкого діапазону ракових захворювань у людини. Таксани (Паклітаксел і Доцетаксел) і алкалоїди барвінку (Вінкристин і Вінбластин) діють або шляхом стабілізації, або шляхом дестабілізації мікротрубочок з катастрофічними наслідками в клітинах, що проходять через мітоз. Вони являють собою першочергову терапію для деяких типів пухлин і терапію другої черги при цисплатин-резистентному раку яєчників, молочної залози, легені, сечового міхура і стравоходу (Таксани). Однак через роль мікротрубочок у таких процесах, як рух клітин, фагоцитоз і аксональний транспорт, часто при використанні таких засобів спостерігаються деякі токсичні ефекти, такі як периферична невропатія. Проходження через мітоз обов'язкове для всіх проліферуючих клітин, і, отже, терапевтичні методи лікування раку, які націлені на мішені в мітозі, як правило, є застосовними для широкого ряду різних пухлин. Деякі протеїнкінази грають ключові ролі в гармонічному функціонуванні клітинного циклу, і деякі з них вже є об'єктом для прицільно діючої терапії в онкології, включаючи Cdk-2 і Aurora-A. Правильність мітозу має величезне значення, і деякі "контрольні точки" існують у нормальних клітинах для підтримання цілісності хромосом протягом клітинного циклу. Ці контрольні точки часто зникають у процесі онкогенної трансформації, і це дозволяє раковим клітинам виносити анеуплоїдію і хромосомну нестабільність. Інгібування мітозу в пухлинних клітинах з "підданими ризику контрольними точками" повинно мати катастрофічні наслідки, тому що ракові клітки намагаються просувати аберантний мітоз. Сімейство Polo-подібних кіназ, що включає 4 серинових/треонінових кінази (Plk-1-4), переважно пов'язане з входженням у, проходженням через і виходом з мітозу. Ці кінази характеризуються тим, що мають N-кінцевий кіназний домен і унікальний С-кінцевий "Polo-Box" домен. Цей домен є відповідальним за націлювання кінази на різні мітотичні структури (центросоми, кінетохори, полюси веретен, група гранул у площині екватора веретена), і часова і просторова регуляція Plks мають важливе значення для проходження через мітоз (див. огляд van Vugt і Medema, Oncogene 2005, 24(17):2844-59; Barr et al., Nat Rev Mol Cell Biol. 2004, 5(6):429-40; Dai і Cogswell, Prog Cell Cycle Res. 2003, 5:327-34; Glover et al., Genes Dev. 1998, 12(24):3777-87). Найбільш охарактеризованим членом цього сімейства є Plk-1, і її активність пов'язана з деякими процесами в ході мітозу, включаючи G2/M перехід, за допомогою регуляції Cdk-1 активності різними шляхами (активація Cdc25c, ядерна транслокація цикліну B, інактивація Myt-1 і Wee-1) (Inoue et al., EMBO J. 2005, 24(5): 1057-67; van Vugt et al., J Biol Chem. 2004, 9(35):36841-54; Watanabe et al., Proc Natl Acad Sci U S A. 2004, 101(13):4419-24 2004; Nakajima et al., J Biol Chem. 2003, 278(28):25277-80; Toyoshima-Morimoto et al., J Biol Chem. 2002, 277(50):48884-8; Bartholomew et al., Mol Cell Biol, 2001 21(15):4949-59; КВ.ian et al., Mol Biol Cell. 2001, 12(6):1791-9; Roshak et al., Cell Signal. 2000, 12(6):405-l 1); дозрівання і розділення центросоми; регуляцію хромосомально-плечової когезії в профазі і відділення сестринської хроматиди при переході метафаза/анафаза; активацію Анафаза Промотуючого Комплексу, щоб дати початок мітотичному виходу; цитокінез. Plk-1 надмірно експресується в деяких пухлинних клітинах, включаючи карциному молочної залози, яєчників, недрібноклітинну карциному легені, карциному товстої кишки, голови і шиї, ендометріальні і езофагеальні карциноми, і її надмірну експресію часто співвідносять з поганим прогнозом. Порушення функції Plk-1 різними шляхами в пухлинних клітинах (sірнк і антисмислове видалення, домінантні негативні білки і імуновиснаження) приводить до аберантного мітозу з наступною мітотичною катастрофою, викликаючи при цьому "опосередковане контрольними точками" зупинення клітинного циклу в нормальних клітинах. Таким чином, фармакологічна атенуація функції Plk-1 може мати терапевтичну користь при лікуванні різних типів раку. Суть винаходу Конденсовані біциклічні піримідинові похідні для лікування гіперпроліферативних захворювань розкриті в WO 96/40042 на ім'я Pfizer Inc. Конденсовані поліциклічні піримідинові похідні як інгібітори протеїнкінази також розкриті в WO 98/58926 і WO 98/28281, обидва на ім'я Celltech Therapeutics Ltd. Конденсовані трициклічні піразольні сполуки, відомі з рівня техніки як інгібітори протеїнкінази, розкриті в WO 03/070236 і WO 03/070706, на ім'я Pharmacia Italia S.P.A. і Pharmacia Corp., відповідно. 1 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 Піразолохіназолінові похідні, які мають активність інгібування кінази, також розкриті в WO 04/104007, на ім'я самого заявника. Деякі специфічні сполуки зазначеного вище WO 04/104007 виключені з загальної формули, представленої в даній заявці. Незважаючи на ці розробки, усе ще залишається потреба в ефективних засобах для лікування зазначеного захворювання. До даного часу авторами даного винаходу виявлено, що сполуки формули (I), описані нижче, є інгібіторами кіназ і, таким чином, є корисними в терапії як протипухлинні засоби, і вони не мають зазначених вище недоліків у тому, що стосується токсичності і побічних ефектів, які пов'язані з існуючими в даний час протипухлинними засобами. Відповідно, першою метою даного винаходу є забезпечення заміщеної піразолохіназолінової сполуки, представленої формулою (I): , де R1 являє собою ортозаміщений ариламіно; R2 являє собою водень або необов'язково заміщену групу, вибрану з лінійного або розгалуженого C1-C6-алкілу, лінійного або розгалуженого C 2-C6-алкенілу, лінійного або розгалуженого C2-C6-алкінілу, C3-C6-циклоалкілу і гетероциклілу; R3 являє собою CO-OR' або CO-NR'R", де R' і R", кожен незалежно, являють собою водень або необов'язково заміщену групу, вибрану з лінійного або розгалуженого C 1-C6-алкілу, C3-C6циклоалкілу і гетероциклілу, або R' і R", узяті разом з атомом азоту, з яким вони зв'язані, можуть утворювати необов'язково заміщену гетероциклільну групу, яка необов'язково містить один додатковий гетероатом, вибраний з N, O або S, за умови, що: етил 1-метил-8-(2-метоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат і 1-метил-8-(2-метоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксамід виключаються; і її ізомерів, таутомерів, гідратів, сольватів, комплексів, метаболітів, проліків, носіїв, Nоксидів і фармацевтично прийнятних солей. Даний винахід також забезпечує способи синтезу заміщених піразолохіназолінових сполук, представлених формулою (I), які одержують з використанням способу, який складається зі стандартних синтетичних перетворень. Даний винахід також забезпечує спосіб лікування захворювань, викликаних і/або пов'язаних з порушеною регуляцією активності протеїнкінази, зокрема сімейства PLK, протеїнкінази C у різних ізоформах, Met, PAK-4, PAK-5, ZC-I, STLK-2, DDR-2, Aurora 1, Aurora 2, Bub-1, Chk1, Chk2, HER2, raf1, MEK1, MAPK, EGF-R, PDGF-R, FGF-R, IGF-R, PBK, weel кінази, Src, Abl, Akt, MAPK, ILK, MK-2, IKK-2, Cdc7, Nek, сімейства Cdk/циклінових кіназ, більш конкретно PLK-1 і PLK-3, який включає введення ссавцю, що потребує цього, ефективної кількості заміщеної піразолохіназолінової сполуки, представленої формулою (I), визначеної вище. Петеважний спосіб за даним винаходом призначений для лікування захворювання, викликаного і/або пов'язаного з порушеною регуляцією активності протеїнкінази, вибраного з групи, яка включає рак, клітинно-проліферативні розлади, вірусні інфекції, аутоімунні і нейродегенеративні розлади. Інший переважний спосіб за даним винаходом призначений для лікування специфічних типів раку, включаючи, але не обмежуючись цим: карциному, таку як карцинома сечового міхура, молочної залози, товстої кишки, нирки, печінки, легені, включаючи дрібноклітинний рак легені, стравоходу, жовчного міхура, яєчника, підшлункової залози, шлунка, цервікальну, щитовидної залози, передміхурової залози і шкіри, включаючи сквамозно-клітинну карциному; гематопоетичні пухлини лімфоїдної лінії, включаючи лейкоз, гострий лімфоцитарний лейкоз, гострий лімфобластний лейкоз, B-клітинну лімфому, T-клітинну лімфому, лімфому Ходжкіна, неходжкінську лімфому, волосисто-клітинну лімфому і лімфому Беркетта; гематопоетичні пухлини мієлоїдної лінії, включаючи гострі і хронічні мієлогенні лейкози, мієлодиспластичний синдром і промієлоцитарний лейкоз; пухлини мезенхімального походження, включаючи фібросаркому і рабдоміосаркому; пухлини центральної і периферичної нервової системи, включаючи астроцитому, нейробластому, гліому і шваноми; інші пухлини, включаючи меланому, семіному, тератокарциному, остеосаркому, xeroderma pigmentosum, кератоксантому, фолікулярний рак щитовидної залози і саркому Капоши. Ще один переважний спосіб за даним винаходом призначений для лікування специфічних клітинно-проліферативних розладів, таких як, наприклад, доброякісна гіперплазія 2 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 60 передміхурової залози, сімейний аденоматозний поліпоз, нейрофіброматоз, псоріаз, проліферація клітин гладких м'язів судин, пов'язана з атеросклерозом, фіброзом легень, артритом, гломерулонефритом і післяопераційним стенозом і рестенозом. Ще один переважний спосіб за даним винаходом призначений для лікування вірусних інфекцій, зокрема попередження розвитку СНІДу у ВІЛ-інфікованих пацієнтів. Крім того, спосіб за даним винаходом також забезпечує інгібування пухлинного ангіогенезу і метастазів, а також лікування відторгнення трансплантата органа і хвороби "хазяїн проти трансплантата". Даний винахід також забезпечує фармацевтичну композицію, яка включає одну або декілька сполук формули (I) або їх фармацевтично прийнятну сіль і фармацевтично прийнятний ексципієнт, носій або розріджувач. Даний винахід, крім того, забезпечує фармацевтичну композицію, яка включає сполуку формули (I), у сполученні з відомим протираковими лікуваннями, такими як режим радіаційної терапії або хіміотерапії, у сполученні з цитостатичними або цитотоксичними засобами, засобами типу антибіотиків, алкілуючими засобами, антиметаболітами, гормональними засобами, імунологічними засобами, засобами типу інтерферону, інгібіторами циклооксигенази (наприклад, інгібіторами COX-2), інгібіторами металопротеази матриксу, інгібіторами теломерази, інгібіторами тирозинових кіназ, засобами проти рецептора фактора росту, антиHER засобами, анти-EGFR засобами, засобами проти ангіогенезу (наприклад, інгібіторами ангіогенезу), інгібіторами фарнезилтрансферази, інгібіторами шляху сигнальної трансдукції rasraf, інгібіторами клітинного циклу, іншими інгібіторами cdk, засобами, що зв'язують тубулін, інгібіторами топоізомерази I, інгібіторами топоізомерази II і подібними засобами. Докладний опис винаходу Якщо не визначене інше, що стосується сполук формули (I) як таких, а також будь-якої фармацевтичної композиції, що їх містить, або будь-якого терапевтичного лікування з використанням таких сполук, даний винахід включає всі гідрати, сольвати, комплекси, метаболіти, проліки, носії, N-оксиди і фармацевтично прийнятні солі сполук за даним винаходом. Метаболіт сполуки формули (I) являє собою будь-яку сполуку, у яку ця сама сполука формули (I) перетворюється in vivo, наприклад, при введенні ссавцю, що потребує цього. Типово, але, не вважаючи, однак, це обмежуючим прикладом, при введенні сполуки формули (I) це саме похідне може бути перетворене в різні сполуки, наприклад, включаючи похідні, які мають кращою розчинність, такі як гідроксильовані похідні, які швидше виводяться з організму. Отже, залежно від виникаючого таким чином метаболічного шляху, будь-яке з цих гідроксильованих похідних можна розглядати як метаболіт сполуки формули (I). Проліки являють собою будь-які ковалентно зв'язані сполуки, що in vivo вивільняють активний вихідний лікарський засіб відповідно до формули (I). N-оксиди являють собою сполуки формули (I), у яких азот і кисень зв'язані через донорноакцепторний зв'язок. Якщо в сполуці за даним винаходом присутні хіральний центр або інша форма ізомерного центра, мається на увазі, що в цьому випадку усі форми такого ізомеру або ізомерів, включаючи енантіомери і діастереомери, включені в дану заявку. Сполуки, які містять хіральний центр, можна використовувати як рацемічну суміш, енантіомерно збагачену суміш, або рацемічну суміш можна розділити, застосовуючи добре відомі методики, і окремий енантіомер можна використовувати в чистому вигляді. У випадках, коли сполуки містять ненасичені вуглецьвуглецеві подвійні зв'язки, обидва ізомери, цис (Z) і транс (E), входять в обсяг даного винаходу. У випадках, коли сполуки можуть існувати в таутомерних формах, таких як кетоенольні таутомери, передбачається, що кожна таутомерна форма є включеною в даний винахід, незалежно від того, чи існують вони в рівновазі або переважно в одній формі. У даному описі, якщо не визначене інше, під терміном "ортозаміщений ариламіно", що представляє R1, мається на увазі будь-яка арильна група, зв'язана з іншою частиною молекули через групу -(NH)-, при цьому зазначений ариламіно є заміщеним в ортоположенні, а також необов'язково заміщеним в інших вільних положеннях. Під терміном "арил" маються на увазі карбоциклічні або гетероциклічні групи, що містять від 1 до 2 кільцевих груп, або конденсовані, або зв'язані одна з одною за допомогою простих зв'язків, у яких щонайменше одне з кілець є ароматичним; у випадку його присутності, будь-яке ароматичне гетероциклічне кільце, також зазначене як гетероарильна група, включає 5-6членне кільце, що містить від 1 до 3 гетероатомів, вибраних з N, NH, O або S. Прикладами арильних груп, відповідно до даного винаходу, є, наприклад, феніл, біфеніл, - або -нафтил, дигідронафтил, тієніл, бензотієніл, фурил, бензофураніл, піроліл, імідазоліл, піразоліл, тіазоліл, 3 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 ізотіазоліл, оксазоліл, ізоксазоліл, піридил, піразиніл, піримідиніл, піридазиніл, індоліл, ізоіндоліл, пуриніл, хіноліл, ізохіноліл, дигідрохінолініл, хіноксалініл, бензодіоксоліл, інданіл, інденіл, триазоліл і подібні. Термін "лінійний або розгалужений C1-C6-алкіл", який відповідно охоплює C1-C4-алкіл, має на увазі будь-яку з груп, таких як, наприклад, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, втор-бутил, н-пентил, н-гексил і подібні. Під терміном "лінійний або розгалужений C2-C6-алкеніл" мається на увазі будь-яка з груп, таких як, наприклад, вініл, аліл, 1-пропеніл, ізопропеніл, 1-бутеніл, 2-бутеніл, 3-бутеніл, 2пентеніл, 1-гексеніл і подібні. Під терміном "лінійний або розгалужений C2-C6-алкініл" мається на увазі будь-яка з груп, таких як, наприклад, етиніл, 2-пропініл, 4-пентиніл і подібні. Під терміном "C3-C6-циклоалкіл" мається на увазі, якщо не зазначене інше, 3-6-членне моноциклічне кільце, що складається тільки з вуглецевих атомів, яке може містити один або декілька подвійних зв'язків, але не має повністю сполученої -електронної системи. Прикладами циклоалкільних груп, без обмеження, є циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексен і циклогексадієн. Під терміном "гетероцикліл" (також відомим як "гетероциклоалкіл") мається на увазі 3-7членне насичене або частково ненасичене карбоциклічне кільце, в якому один або декілька вуглецевих атомів заміщені гетероатомами, такими як азот, кисень і сірка. Необмежуючими прикладами гетероциклільних груп є, наприклад, піран, піролідін, піролін, імідазолін, імідазолідин, піразолідин, піразолін, тіазолін, тіазолідин, дигідрофуран, тетрагідрофуран, 1,3діоксолан, піперидин, піперазин, морфолін і подібні. Відповідно до даного винаходу, якщо не зазначене інше, будь-яка з зазначених вище груп R1, R2, R3, R' і R", необов'язково, може бути заміщеною в будь-якому з вільних положень однією або декількома групами, наприклад, 1-6 групами, незалежно вибраними з наступних: галоген, нітро, оксогрупи (=О), ціано, C1-C6-алкіл, поліфторований алкіл, поліфторований алкокси, алкеніл, алкініл, гідроксіалкіл, арил, арилалкіл, гетероцикліл, C 3-C6-циклоалкіл, гідрокси, алкокси, арилокси, гетероциклілокси, метилендіокси, алкілкарбонілокси, арилкарбонілокси, циклоалкенілокси, гетероциклілкарбонілокси, алкіліденаміноокси, карбокси, алкоксикарбоніл, арилоксикарбоніл, циклоалкілоксикарбоніл, гетероциклілоксикарбоніл, аміно, уреїдо, алкіламіно, діалкіламіно, ариламіно, діариламіно, гетероцикліламіно, форміламіно, алкілкарбоніламіно, арилкарбоніламіно, гетероциклілкарбоніламіно, амінокарбоніл, алкіламінокарбоніл, діалкіламінокарбоніл, ариламінокарбоніл, гетероцикліламінокарбоніл, алкоксикарбоніламіно, гідроксіамінокарбоніл-алкоксііміно, алкілсульфоніламіно, арилсульфоніламіно, гетероциклілсульфоніламіно, форміл, алкілкарбоніл, арилкарбоніл, циклоалкілкарбоніл, гетероциклілкарбоніл, алкілсульфоніл, арилсульфоніл, аміносульфоніл, алкіламіносульфоніл, діалкіламіносульфоніл, ариламіносульфоніл, гетероцикліламіносульфоніл, арилтіо, алкілтіо, фосфонат і алкілфосфонат. У свою чергу, де це є придатним, кожен із зазначених вище замісників може бути додатково заміщений однією або декількома з зазначених вище груп. У зв'язку з цим, під терміном "атом галогену" мається на увазі атом фтору, хлору, брому або йоду. Під терміном "ціано" мається на увазі залишок -CN. Під терміном "нітро" мається на увазі група -NO2. Під терміном "алкеніл" або "алкініл" мається на увазі будь-яка з зазначених вище C2-C6алкільних груп з лінійним або розгалуженим ланцюгом, які містять також подвійний або потрійний зв'язок. Необмежуючими прикладами алкенільних або алкінільних груп за даним винаходом є, наприклад, вініл, аліл, 1-пропеніл, ізопропеніл, 1-бутеніл, 2-бутеніл, 3-бутеніл, 2пентеніл, 1-гексеніл, етиніл, 2-пропініл, 4-пентиніл і подібні. Під терміном "поліфторований алкіл" або "алкокси" мається на увазі будь-яка з зазначених вище C1-C6-алкільних або алкоксигруп із лінійним або розгалуженим ланцюгом, які заміщені більше ніж одним атомом фтору, такі як, наприклад, трифторметил, трифторетил, 1,1,1,3,3,3гексафторпропіл, трифторметокси і подібні. Під терміном "алкокси", "арилокси", "гетероциклілокси" і їх похідними мається на увазі будьяка з зазначених вище C1-C6-алкільних, арильних або гетероциклільних груп, зв'язаних з іншою частиною молекули через атом кисню (-O-). З усього вищесказаного фахівцям у даній галузі повинно бути зрозуміло, що будь-яку групу, яка має назву, що складається з декількох частин, таку як, наприклад, ариламіно, варто розглядати так, що назва групи стандартно складена з частин, з яких ця група утворена, 4 UA 102219 C2 5 10 15 20 25 30 35 40 45 наприклад, з аміногрупи, яка потім була заміщена арилом, де арил має значення, визначене вище. Подібним чином, будь-який з термінів, таких як, наприклад, алкілтіо, алкіламіно, діалкіламіно, алкоксикарбоніл, алкокси карбоніламіно, гетероциклілкарбоніл, гетероциклілкарбоніламіно, циклоалкілоксикарбоніл і подібні, включають групи, де алкільні, алкокси, арильні, C3-C6-циклоалкільні і гетероциклільні фрагменти мають значення, визначені вище. Фармацевтично прийнятні солі сполук формули (I) включають кислотно-адитивні солі з неорганічними або органічними кислотами, наприклад, азотною, хлористоводневою, бромистоводневою, сірчаною, перхлорною, фосфорною, оцтовою, трифтороцтовою, пропіоновою, гліколевою, молочною, щавлевою, малоновою, яблучною, малеїновою, винною, лимонною, бензойною, коричною, мигдальною, метансульфоновою, ізетіоновою і саліциловою кислотою. Переважно, кислотно-адитивну сіль сполук за даним винаходом вибирають з гідрохлориду або мезилату. Фармацевтично прийнятні солі сполук формули (I) також включають солі з неорганічними або органічними основами, наприклад, гідроксиди, карбонати або бікарбонати лужних або лужноземельних металів, зокрема натрію, калію, кальцію, амонію або магнію, ациклічні або циклічні аміни, переважно метиламін, етиламін, діетиламін, триетиламін, піперидин і подібні. Переважний клас сполук формули (I) являють собою сполуки, у яких: R3 являє собою CO-OH або CO-NR'R", де R' і R" мають значення, визначені вище. Інший переважний клас сполук формули (I) являють собою сполуки, у яких: R1 являє собою ортозаміщений ариламіно формули: , де R'4, R"4 і R'"4 незалежно вибрані з групи, яка включає: галоген, нітро, ціано, C 1-C6-алкіл, поліфторований алкіл, поліфторований алкокси, алкеніл, алкініл, гідроксіалкіл, арил, арилалкіл, гетероцикліл, C3-C6-циклоалкіл, гідрокси, алкокси, арилокси, гетероциклілокси, метилендіокси, алкілкарбонілокси, арилкарбонілокси, циклоалкенілокси, гетероциклілкарбонілокси, алкіліденаміноокси, карбокси, алкоксикарбоніл, арилоксикарбоніл, циклоалкілоксикарбоніл, гетероциклілоксикарбоніл, аміно, уреїдо, алкіламіно, діалкіламіно, ариламіно, діариламіно, гетероцикліламіно, форміламіно, алкілкарбоніламіно, арилкарбоніламіно, гетероциклілкарбоніламіно, амінокарбоніл, алкіламінокарбоніл, діалкіламінокарбоніл, ариламінокарбоніл, гетероцикліламінокарбоніл, алкоксикарбоніламіно, гідроксіамінокарбоніл, алкоксііміно, алкілсульфоніламіно, арилсульфоніламіно, гетероциклілсульфоніламіно, форміл, алкілкарбоніл, арилкарбоніл, циклоалкілкарбоніл, гетероциклілкарбоніл, алкілсульфоніл, арилсульфоніл, аміносульфоніл, алкіламіносульфоніл, діалкіламіносульфоніл, ариламіносульфоніл, гетероцикліламіносульфоніл, арилтіо, алкілтіо, фосфонат і алкілфосфонат. Наступний переважний клас сполук формули (I) являють собою сполуки, у яких: R1 являє собою ортозаміщений ариламіно формули: , де R'4, R"4 мають значення, визначені вище, і R2 являє собою необов'язково заміщений C1-C6-алкіл або C2-C6-алкеніл з лінійним або розгалуженим ланцюгом. Особливо переважний клас сполук формули (I) являють собою сполуки, у яких: R3 являє собою CO-NR'R", де R' і R" мають значення, визначені вище. Конкретні переважні сполуки формули (I) являють собою сполуки, перераховані нижче (значення кодів дивіться в розділі Приклади): 1) 1-метил-8-(2-метилфеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксамід (A4B1C1Z); 5 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 2) 1-метил-8-(2-метиламінофеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3карбоксамід (A27B1C1Z); 3) 8-(2-ацетилфеніламіно)-1-(2-фторетил)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3карбоксамід (A2B2C1Z); 4) 8-[2-ацетил-5-(4-метилпіперазин-1-іл)-феніламіно]-1-метил-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксамід (A39B1C1Z); 5) 8-[2-ацетил-5-(4-метилпіперазин-1-іл)-феніламіно]-1-(2-фторетил)-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксамід (A39B2C1Z); 6) 1-метил-8-(2-трифторметоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3карбоксамід (A45B1C1Z); 7) 1-метил-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксамід (A51B1C1Z); 8) етил 1-метил-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксилат (A51B1C2Z); 9) 1-метил-8-[2-метокси-5-(4-метилпіперазин-1-іл)-феніламіно]-1-метил-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксамід (A85B1C1Z); 10) 8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-1-(2-фторетил)-4,5-дигідро1H-піразоло[4,3-h]хіназолін-3-карбоксамід (A51B2C1Z); 11) 1-метил-8-[4-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксамід (A48B1C1Z); 12) 1-метил-8-(2-трифторметокси-5-піперазин-1-ілфеніламіно)-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксамід (A97B1C1Z); 13) 1-метил-8-[2-метил-5-(4-метилпіперазин-1-іл)-феніламіно]-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксамід (A98B1C1Z); 14) 1-метил-8-[5-(4-піролідин-1-ілпіперидин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро1H-1H-піразоло[4,3-h]хіназолін-3-карбоксамід (A99B1C1Z); 15) метиламід 1-метил-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5дигідро-1H-піразоло[4,3-h]хіназолін-3-карбонової кислоти (A51B1C4Z); 16) метиламід 1-метил-8-[5-(4-метилпіперазин-1-іл)-2-метоксифеніламіно]-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбонової кислоти (A85B1C4Z); 17) 1-метил-8-[2-метил-5-(4-метилпіперазин-1-карбоніл)-феніламіно]-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксамід (A87B1C1Z); 18) 1-метил-8-[2-метил-4-(4-метилпіперазин-1-карбоніл)-феніламіно]-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксамід (A86B1C1Z); 19) 1-метил-8-{2-трифторметокси-5-[(1-метилпіперидин-4-карбоніл)-аміно]-феніламіно}-4,5дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксамід (A82B1C1Z); 20) етил 1-метил-8-(2-трифторметоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3карбоксилат (A45B1C2Z); 21) 8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-1-метил-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксилат калію (A51B1C3Z); 22) 8-(2-трифторметоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат калію (A45B8C3Z); 23) 1-(2-гідроксіетил)-8-(2-трифторметоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксамід (A45B5C 1Z); 24) 1-етил-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксамід (A51B7C1Z); 25) (2,2,2-трифторетил)амід 1-метил-8-[5-(4-метилпіперазин-1-іл)-2трифторметоксифеніламіно]-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбонової кислоти (A51Bl7Z); 26) 1-(2-гідроксіетил)-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро1H-піразоло[4,3-h]хіназолін-3-карбоксамід (A51B5C1Z); 27) 8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-1-вініл-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксамід (A51B10C1Z); 28) 1-(2-хлоретил)-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро1H-піразоло[4,3-h]хіназолін-3-карбоксамід (A51B9C1Z); 29) 8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксамід (A51B8C1Z); 30) 1-(2-гідроксіетил)-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро1H-піразоло[4,3-h]хіназолін-3-карбоксилат калію (A51B5C3Z); 6 UA 102219 C2 5 10 15 31) етил 1-(2-гідроксіетил)-8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат (A51B5C2Z); 32) 1-метил-8-[5-(1-метил-1,2,3,6-тетрагідропіридин-4-іл)-2-трифторметоксифеніламіно]-4,5дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксамід (A113B1C1Z); 33) 1-метил-8-[5-(1-метилпіперидин-4-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксамід (A114B1C1Z); 34) 8-(5-бром-2-трифторметоксифеніламіно)-1-метил-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксамід (A49B1C1Z) і 35) 8-(5-бром-2-трифторметоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3карбоксамід (A49B8C1Z). Для посилання на будь-яку конкретну сполуку формули (I) за даним винаходом, необов'язково у формі фармацевтично прийнятної солі, дивіться експериментальний розділ і формулу винаходу. Даний винахід також забезпечує спосіб одержання сполук формули (I), визначених вище, де спосіб відрізняється тим, що включає: стадія 1) взаємодія сполуки формули (II): з гідразиновим похідним формули (III): R2-NHNH2 (III) 20 де R2 має значення, визначене вище, у присутності оцтової кислоти з одержанням сполуки формули (IV): 25 , де R2 має значення, визначене вище; або алкілування сполуки формули (IV), де R2 являє собою водень, з використанням сполук формули (V): R2-Y 30 35 40 (V) де Y являє собою придатну відщеплювану групу, таку як мезил, тозил, галоген, і R2 має значення, визначене вище, але відмінне від водню, з одержанням сполуки формули (IV), де R2 має значення, визначене вище, але відмінне від водню; стадія 2) взаємодія сполуки формули (IV) з диметилформамід-ди-трет-бутилацеталем або диметилформамід-діізопропілацеталем з одержанням сполуки формули (VI): , де R2 має значення, визначене вище; стадія 3) взаємодія сполуки формули (VI), відповідно до будь-якої з альтернативних стадій (стадія 3a) або (стадія 3b): стадія 3a) з гуанідином з одержанням сполуки формули (VII), де R2 має значення, визначене вище; перетворення аміногрупи одержаної сполуки формули (VII) у йод і потім взаємодія одержаного йодопохідного формули (VIII) з ортозаміщеним ариламіном формули R1-H (IX), де R1 має значення, визначене вище, з одержанням сполуки формули (I): , 7 UA 102219 C2 де R1 і R2 мають значення, визначені вище; стадія 3b) з гуанідиновим похідним формули (X): R1-C(=NH)NH2 5 10 15 20 25 30 (X) де R1 має значення, визначене вище, з одержанням сполуки формули (I) , де R1 і R2 мають значення, визначені вище, і, необов'язково, перетворення її в інші похідні формули (I) і/або в їх фармацевтично прийнятні солі. Даний винахід також забезпечує спосіб одержання сполуки формули (I), визначеної вище, де спосіб відрізняється тим, що включає: стадія 4) перетворення етоксикарбонільної групи сполуки формули (VIII), визначеної вище, у сполуку формули (XIII) або відповідну сіль за допомогою кислотного або лужного гідролізу; перетворення одержаної сполуки формули (XIII) або відповідної солі в сполуку формули (XIV) за допомогою реакції, яка проходить при лужних умовах, і в присутності придатного агента конденсації, з аміном формули R'R''-NH (XI), де R' і R'' мають значення, визначені вище; взаємодія сполуки формули (XIV) з ортозаміщеним ариламіном формули R1-H (IX), де R1 має значення, визначене вище, з одержанням сполуки формули (I): де R1 і R2 мають значення, визначені вище, і, необов'язково, її перетворення в інші похідні формули (I) і/або в їх фармацевтично прийнятні солі. Як визначено вище, сполуки формули (I), які одержують згідно зі способом, який є , предметом даного винаходу, можна зручним чином перетворити в інші сполуки формули (I), здійснюючи взаємодії відповідно до добре відомих умов синтезу, при цьому як приклади можливих перетворень можна вказати наступні: a) перетворення сполуки формули (I), де R3 являє собою етоксикарбоніл, у сполуку формули (I), де R3 являє собою амінокарбоніл, шляхом обробки гідроксидом амонію: ; b) перетворення сполуки формули (I), де R3 являє собою етоксикарбоніл, у сполуку формули (I), де R3 являє собою групу СО-NR'R'', шляхом обробки аміном формули R'R''-NH (XI), де R' і R'' мають значення, визначені вище: ; c) перетворення сполуки формули (I), де R3 являє собою етоксикарбоніл, у сполуку формули (I), де R3 являє собою групу CO-OH або відповідну сіль, за допомогою кислотного або лужного гідролізу: 8 UA 102219 C2 5 ; d) перетворення сполуки формули (I), де R3 являє собою CO-OH або відповідну сіль, у сполуки формули (I), де R3 являє собою групу СО-NR'R'', за допомогою реакції з аміном формули R'R''-NH (XI) у лужних умовах і в присутності придатного агента конденсації, де R' і R'' мають значення, визначені вище: ; e) перетворення сполуки формули (I), де R2 являє собою тритил, у сполуку формули (I), де R2 являє собою водень, у кислотних умовах: 10 15 20 ; f) перетворення сполуки формули (I), де R2 являє собою водень, у сполуку формули (I), де R2 має значення, визначене вище, але відмінне від водню, за допомогою реакції зі спиртом формули R2-ОН (XII), де R2 має значення, визначене вище, але відмінне від водню: ; g) перетворення сполуки формули (I), де R2 являє собою водень, у сполуку формули (I), де R2 має значення, визначене вище, але відмінне від водню, за допомогою реакції зі сполукою формули R2-X (XV), де R2 має значення, визначене вище, але відмінне від водню, і X являє собою галоген: ; h) перетворення сполуки формули (I), де R2 являє собою галогенетил, у сполуку формули (I), де R2 являє собою вініл: ; i) перетворення сполуки формули (I), де R1 являє собою ортозаміщений ариламіно формули: 9 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 , де R'4 або R''4, або R'''4 являє собою бром, у сполуку формули (I), де R'4 або R''4, або R'''4 являє собою групу -NR'R'', за допомогою обробки аміном формули R'R''-NH (XI), де R' і R'' мають значення, визначені вище. Описаний вище спосіб, у будь-якому із зазначених вище варіантів, є аналогічним способу, який можна здійснити відповідно до добре відомих в даній галузі способів. Відповідно до стадії (стадія 1) способу, сполуку формули (II) піддавали взаємодії з гідразиновим похідним формули (III) у присутності оцтової кислоти, таким чином, одержували сполуку формули (IV). Переважне здійснення реакції при кімнатній температурі. Необов'язково, сполуку формули (IV), де R2 являє собою водень, піддавали взаємодії з придатною сполукою формули (V) у присутності основи, такої як гідрид натрію або триетиламін, або карбонат цезію, у придатному розчиннику, наприклад, дихлорметані, тетрагідрофурані, діоксані або диметилформаміді, при температурі в діапазоні від кімнатної температури до 100 °C, так, щоб одержати сполуку (IV), де R2 має значення, визначене вище, але відмінне від водню. Відповідно до стадії (стадія 2) способу, сполуку формули (IV) піддавали взаємодії з диметилформамід-ди-трет-бутилацеталем або диметилформамід-діізопропілацеталем, у присутності придатного розчинника, такого як, наприклад, диметилформамід, так, щоб одержати сполуки формули (VI). Переважне здійснення реакції при температурі в діапазоні від кімнатної температури до близько 80 °C. Відповідно до стадії (стадія 3a) способу, сполуку формули (VI) піддавали взаємодії з гуанідином або солями гуанідину так, щоб одержати сполуку формули (VII) за допомогою утворення піримідинового кільця. Сполуки формули (I), де R1 представляє ортозаміщену ариламіногрупу, можна одержати за допомогою відповідних йодопохідних формули (VIII), які, у свою чергу, одержують за допомогою відповідних сполук формули (VII). Одержання йодопохідних формули (VIII) можна здійснити в придатному розчиннику, такому як тетрагідрофуран, діетиловий ефір або диметоксіетан, при температурі в діапазоні від кімнатної температури до близько 80 °C і протягом часу від близько 2 до близько 48 годин. Наступне перетворення йодопохідного формули (VIII) у сполуки формули (I) можна здійснити в присутності ортозаміщеного ариламіну формули R1-H (IX) у придатному розчиннику, такому як диметилформамід, диметоксіетан або ацетонітрил, і в присутності каталітичних кількостей ацетату паладію, (2,2'-біс(дифенілфосфіно)-1,1'-бінафталіну (BINAP) і основи, такої як карбонат калію, фосфат калію або карбонат цезію, при температурі в діапазоні від кімнатної температури до 110 °C і протягом часу від близько 2 до близько 24 годин. Відповідно до стадії (стадія 3b) способу, сполуку формули (VI) піддавали взаємодії з гуанідиновими похідними формули (X), так, щоб одержати відповідну сполуку формули (I) за допомогою утворення піримідинового кільця. Кожну з описаних вище реакцій проводять відповідно до загальноприйнятих способів. Як приклад, реакції з гуанідином або його солями, такими як гідрохлорид, карбонат або нітрат, або з гуанідиновим похідним формули (X), як зазначено в стадіях (стадія 3a) або (стадія 3b), здійснюють у диметилформаміді при температурі в діапазоні від 80 °C до температури кипіння зі зворотним холодильником звичайно в присутності карбонату калію. Відповідно до стадії (стадія 4) способу, сполуку формули (VIII) можна перетворити в карбоновокислотні похідні формули (XIII) або відповідну сіль в умовах лужного або кислотного гідролізу, добре відомих у даній галузі. Сполуки формули (XIII) можна перетворити в карбоксамідопохідні формули (XIV), де R' і R" мають значення, визначені вище. Реакцію здійснюють у присутності хлориду амонію або придатного первинного або вторинного аміну формули (XI), у лужних умовах, переважно з N, Nдіізопропіл-N-етиламіном або триетиламіном, у придатному розчиннику, такому як дихлорметан, диметилформамід, тетрагідрофуран або діоксан, і в присутності придатного агента конденсації, такого як N, N'-дициклогексилкарбодіімід (DCC), N-(3-диметиламінопропіл)-N'етилкарбодіімідгідрохлорид (EDCI) або тетрафторборат O-(бензотриазол-1-іл)-N, N,N',N'тетраметилізоуронію (TBTU); також можуть бути потрібні каталітичні кількості гексафторфосфату (бензотриазол-1-ілокси)трипіролідинофосфонію (PyBOP) або Nгідроксибензотриазолу. 10 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 60 Наступне перетворення сполуки формули (XIV) у сполуку формули (I) можна здійснити в придатному розчиннику, такому як диметилформамід, диметоксіетан або ацетонітрил, і в присутності ортозаміщеного ариламіну формули R1-H (IX), каталітичних кількостей ацетату паладію, (2,2'-біс(дифенілфосфіно)-1,1’-бінафталіну (BINAP) і основи, такої як карбонат калію, фосфат калію або карбонат цезію, при температурі у діапазоні від кімнатної температури до 110 °C і протягом часу від близько 2 до близько 24 годин. Як зазначено раніше, сполуки формули (I), одержані, як зазначено вище, можна легко перетворити в деякі інші сполуки формули (I) за даним винаходом. Як приклад, сполуки формули (I), що містять R3 як етоксикарбонільну групу або навіть як алкоксикарбонільну групу, можна перетворити в різні похідні згідно зі способами, добре відомими з рівня техніки, для перетворення карбоксіефірної групи (-COOR) у карбоксаміди (CONH2), N-заміщені карбоксаміди (-CONHR'), N, N-дизаміщені карбоксаміди (-CONR'R") і карбонові кислоти (-COOH), наприклад, як зазначено в перетворенні (a), (b) і (c). Робочі умови добре відомі з рівня техніки і можуть включати, наприклад, перетворення карбоксіефірної групи в карбоксамідну групу, взаємодію з аміаком або гідроксидом амонію в присутності придатного розчинника, такого як нижчий спирт, диметилформамід або їх суміші; переважно реакцію здійснюють з гідроксидом амонію в суміші метанол/диметилформамід, при температурі в межах від близько 50 °C до близько 100 °C. Аналогічні робочі умови застосовні для одержання N-заміщених карбоксамідів або N, Nдизаміщених карбоксамідів, де придатний первинний або вторинний амін використовують замість аміаку або гідроксиду амонію. Альтернативно, карбоксіефірні групи можна перетворити в карбоксамід або N-заміщені карбоксаміди, або N, N-дизаміщені карбоксаміди в лужних умовах, таких як бістриметилсиліламід літію, 1н розчин у ТГФ, використовуючи хлорид амонію або придатний первинний або вторинний амін; переважно реакцію здійснюють у тетрагідрофурані при температурі в межах від 20 °C до температури кипіння зі зворотним холодильником. Подібним чином, карбоксіефірні групи можна перетворити в карбоновокислотні похідні з використанням умов лужного або кислотного гідролізу, добре відомих з рівня техніки. Відповідно до перетворення (d) способу, сполуки формули (I), де R3 являє собою карбонову кислоту (-COOH), можна перетворити в карбоксамідопохідні (-СОNR'R"), де R' і R" мають значення, визначені вище. Реакцію здійснюють у присутності хлориду амонію або придатного первинного або вторинного аміну формули (XI), у лужних умовах, переважно з N, N-діізопропіл-N-етиламіном або триетиламіном, у придатному розчиннику, такому як дихлорметан, диметилформамід, тетрагідрофуран або діоксан, і в присутності придатного агента конденсації, такого як N, N'дициклогексилкарбодіімід (DCC), гідрохлорид N-(3-диметиламінопропіл)-N'-етилкарбодііміду (EDCI) або тетрафторборат O-(бензотриазол-1-іл)-N, N,N',N'-тетраметилізоуронію (TBTU); також можуть знадобитися каталітичні кількості гексафторфосфату (бензотриазол-1ілокси)трипіролідинoфосфонію (PyBOP) або N-гідроксибензотриазолу. Відповідно до перетворення (e), тритильну групу сполук формули (I) видаляють у кислотних умовах, наприклад, з використанням трифтороцтової кислоти й у присутності придатного розчинника, такого як дихлорметан, щоб одержати відповідну сполуку формули (I), де R2 являє собою водень. Відповідно до перетворення (f) способу, сполуки формули (I), де R2 являє собою водень, піддають взаємодії зі спиртом формули R2-ОН (XII), де R2 має значення, визначене вище, але відмінне від водню, у присутності ди-трет-бутилазадикарбоксилату і трифенілфосфіну або трифенілфосфіну на полімерному носії, у придатному розчиннику, такому як, наприклад, тетрагідрофуран, щоб одержати відповідні сполуки формули (I). Відповідно до перетворення (g) способу, сполуки формули (I), де R2 являє собою водень, піддають взаємодії зі сполукою формули R2-X (XV), де R2 має значення, визначене вище, але відмінне від водню, і X являє собою галоген, переважно хлор, бром або йод, у присутності основи, такої як карбонат цезію, у придатному розчиннику, такому як, наприклад, диметилформамід, щоб одержати відповідні сполуки формули (I). Відповідно до перетворення (h) способу, сполуки формули (I), де R2 являє собою галогенетил, переважно хлоретил, обробляють основою, переважно DBU, при температурі в межах від 20 °C до 80 °C, щоб одержати відповідні сполуки формули (I), де R2 являє собою вініл. Відповідно до перетворення (i) способу, перетворення сполуки формули (I), де R1 являє собою ортозаміщений ариламіно, що містить у якому-небудь положенні бром, у сполуку формули (I), де R1 являє собою ортозаміщений ариламіно, що містить у якому-небудь 11 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 положенні групу -NR'R", можна здійснити різними шляхами, відповідно до традиційних способів. Переважно, його здійснюють у придатному розчиннику, такому як тетрагідрофуран або діоксан, шляхом обробки аміном формули R'R"-NH (XI) і в присутності каталітичних кількостей трис(дибензиліденацетон)дипаладію, 2-дициклогексилфосфіно-2’-(N, N-диметиламіно)біфенілу і основи, такої як LiN(TMS)2, при температурі в діапазоні від кімнатної температури до температури кипіння зі зворотним холодильником і протягом часу в межах від 1 до близько 24 годин. З вищесказаного фахівцям у даній галузі повинно бути зрозуміло, що сполука формули (I), що містить функціональну групу, яку потім можна дериватизувати до іншої функціональної групи, здійснюючи обробку згідно зі способами, добре відомими з рівня техніки, що приводять, таким чином, до інших сполук формули (I), входить в обсяг даного винаходу. Відповідно до будь-якого варіанта способу одержання сполук формули (I), вихідні речовини і будь-які інші реагенти є відомими або їх можна легко одержати відповідно до відомих способів. Як приклад, коли вихідна речовина для одержання сполук формули (II) є комерційно доступною, сполуки формули (II) можна одержати, як описано в зазначеному вище WO 04/104007. Сполуки формули (III), (V), (XII) і (XV) є комерційно доступними. Деякі сполуки формули (IX), (X) і (XI) є комерційно доступними, інші були одержані, див. представлені нижче приклади 28-35 і 43-44. З вищесказаного фахівцям у даній галузі повинно бути зрозуміло, що при одержанні сполук формули (I) відповідно до кожного з зазначених вище варіантів способу, необов'язкові функціональні групи у вихідних речовинах або їх проміжних сполуках, які можуть викликати небажані побічні реакції, необхідно придатним чином захистити, відповідно до традиційних методів. Також, перетворення цих останніх у вільні незахищені сполуки можна здійснити відповідно до відомих процедур. Повинно бути зрозуміло, що, якщо сполуки формули (I), одержані згідно зі способом, описаним вище, одержують у вигляді суміші ізомерів, їх розділення з використанням традиційних методів на окремі ізомери формули (I) входить в обсяг даного винаходу. Традиційні методи розділення рацематів включають, наприклад, фракціоновану кристалізацію діастереізомерних сольових похідних або препаративну хіральну ВЕРХ. Крім того, сполуки формули (I) за даним винаходом також можуть бути одержані відповідно до методів комбінаторної хімії, добре відомих з рівня техніки, наприклад, шляхом здійснення зазначених вище взаємодій між деякими проміжними сполуками паралельним і/або послідовним чином і з використанням умов твердофазного синтезу (SPS). Загальні відомості по одержанню сполук формули (I) за даним винаходом відповідно до методів комбінаторної хімії дивіться в експериментальній частині. Які-небудь конкретні приклади, що стосуються одержання сполук формули (I) за даним винаходом і їх перетворення в інші сполуки формули (I), дивіться в експериментальній частині. Отже, наступним об'єктом даного винаходу є бібліотека двох або більше сполук формули (I) , де R1 являє собою ортозаміщений ариламіно; R2 являє собою водень або необов'язково заміщену групу, вибрану з лінійного або розгалуженого C1-C6-алкілу, лінійного або розгалуженого C 2-C6-алкенілу, лінійного або розгалуженого C2-C6-алкінілу, C3-C6-циклоалкілу і гетероциклілу; R3 являє собою CO-OR' або CO-NR'R", де R' і R", кожен незалежно, являють собою водень або необов'язково заміщену групу, вибрану з лінійного або розгалуженого C 1-C6-алкілу, C3-C6циклоалкілу і гетероциклілу, або R' і R", узяті разом з атомом азоту, з яким вони зв'язані, можуть утворювати необов'язково заміщену гетероциклільну групу, яка необов'язково містить один додатковий гетероатом, вибраний з N, O або S, за умови, що: етил 1-метил-8-(2-метоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат і 1-метил-8-(2-метоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксамід виключаються; і їх ізомери, таутомери, гідрати, сольвати, комплекси, метаболіти, проліки, носії, N-оксиди і фармацевтично прийнятні солі. Ще однією метою даного винаходу є забезпечення проміжної сполуки формули (X'): R1'-C(=NH)NH2 (X') 12 UA 102219 C2 або формули (IX'): R1'-H, (IX') де R1' являє собою 5 10 15 . Фармакологія Сполуки формули (I) є активними як інгібітори протеїнкінази і тому є корисними, наприклад, для обмеження нерегульованої проліферації пухлинних клітин. У терапії їх можна використовувати для лікування різних пухлин, таких як зазначені вище, а також для лікування інших клітинно-проліферативних розладів, таких як доброякісна гіперплазія передміхурової залози, сімейний аденоматозний поліпоз, нейрофіброматоз, псоріаз, проліферація клітин гладких м'язів судин, пов'язана з атеросклерозом, фіброз легень, артрит, гломерулонефрит і післяопераційний стеноз і рестеноз. Інгібуючу активність передбачуваних інгібіторів PLK-1 і активність вибраних сполук визначали з використанням аналізу, описаного нижче. Короткі форми й абревіатури, використовувані в даній заявці, мають наступні значення: Кі DMSO КДа мікроКі мг мкг нг л мл мкл М мМ мкМ нМ Et 20 25 30 35 Кюрі диметилсульфоксид кілоДальтон мікрокюрі міліграм мікрограм нанограм літр мілілітр мікролітр молярний мілімолярний мікромолярний наномолярний етил Клонування, експресія й очищення рекомбінантного PLK-1 кіназного домену PLK-1 кіназний домен (відповідний залишкам 2-345 повнорозмірної послідовності, див. Swiss-Prot номер доступу P53350) був ампліфікований з використанням ПЛР із повнорозмірного людського PLK-1 гена, закупленого в imaGenes у вигляді клону IRATp970A078D. Ампліфікацію здійснювали з використанням прямого олігонуклеотиду: 5'GGGGACAAGTTTGTACAAAAAAGCAGGCTTATTCGAAAACCTGTATTTTCAGGGCCCTAGT GCTGCAGTGACTGCAGGGAAG3' [SEQ ID NO: 1] і зворотного олігонуклеотиду: 5’GGGGACCACTTTGTACAAGAAAGCTGGGTTTCACTATTTATTGAGGACT GTGAGGGGCTT3' [SEQ ID NO: 2]. З метою клонування, олігонуклеотиди включали atВt сайти для одержання attBфланкованого ПЛР продукту, придатного для клонування, використовуючи Gateway® технологію (Invitrogen). Крім того, з метою очищення, прямий праймер включав TEV® сайт розщеплення (Amersham Biosciences). Одержаний ПЛР продукт клонували в pDONR221 плазміду і потім переносили в бакуловірусний експресуючий вектор pVL1393 (Invitrogen), Gateway®-модифікований. З метою експресії й очищення, His мітку додавали по N-кінцю PLK кіназного домену. Клонування здійснювали відповідно до протоколів, описаних в керівництві Gateway®. Бакуловіруси одержували шляхом котрансфекції клітин комахи Sf9 з вектором експресії і вірусною ДНК із використанням набору для трансфекції BaculoGold® (Pharmingen). Вірусний супернатант витягали через 5 днів і піддавали 3 циклам ампліфікації для збільшення титру 13 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 60 вірусу. Рекомбінантний білок одержували шляхом інфікування клітин комахи High5. Після інфікування протягом 48 годин клітки витягали, осаджували шляхом центрифугування і заморожували при -80 °C. Для очищення рекомбінантного білка осад після центрифугування розморожували, ресуспендували в лізисному буфері (PBS, NaCl 150 мМ, CHAPS 0,1 %, DTT 20 мМ, гліцерин 10 %, інгібітори протеази) і лізували шляхом обробки ультразвуком. Лізат очищали за допомогою центрифугування і завантажували на афінну колонку Nichel. Після ретельного промивання рекомбінантний білок розщеплювали і елюювали шляхом інкубації з TEV® протеазою. Біохімічний аналіз визначення активності інгібіторів PLK-1 кінази Інгібуючу активність передбачуваних інгібіторів PLK-1 і активність вибраних сполук визначали з використанням аналізу трансфосфорилування. Специфічні пептидні або білкові субстрати трансфосфорилували за допомогою їх специфічної серинової-треонінової або 33 тирозинової кінази, у присутності АТФ, що відслідковується за допомогою P--АТФ, і в присутності їх власного оптимального буфера і кофакторів. По закінченні реакції фосфорилування більше ніж 98 % холодного АТФ і радіоактивного АТФ була захоплено надлишковою кількістю іонообмінної смоли dowex; смола потім осаджувалася на дно реакційного планшета під дією сили тяжіння. Супернатант, що містить фосфорилований субстрат, потім витягали і переносили на рахункову пластинку, потім оцінювали за допомогою -лічильника. Реагенти/умови аналізу і. Підготовка смоли Dowex Відважували 500 г мокрої смоли (SIGMA, виготовлена по спеціальному замовленню смола DOWEX 1×8 200-400 меш, 2,5 кг) і розбавляли до 2 л у 150 мм форміату натрію, pН 3,00. Смолі давали осісти (кілька годин) і потім супернатант зливали. Після трьох промивань, як зазначено вище, протягом двох днів, смолі давали осісти, супернатант зливали і додавали два об'єми 150 мм натрійформіатного буфера на об'єм осаду. Потім вимірювали pН, який повинен бути близько 3,00. Промита смола є стабільною більше ніж протягом тижня; підготовлену для використання смолу зберігали при 4 °C до використання. ii. Кіназний буфер (KB) Кіназний буфер складався з 50 мМ HEPES pН 7,9, що містить 10 мМ MgCl 2, 1 мМ DTT, 3 мкM NaVO3 і 0,2 мг/мл BSA, 10 мМ -гліцерофосфату. iii Умови аналізу Кіназний аналіз здійснювали з кінцевою концентрацією ферменту PLK-1 3 нМ, у присутності 33 40 мкM АТФ, 3 нМ P--АТФ і 85 мкM субстрату альфа-казеїну, SIGMA, # C-3240. Автоматизований аналіз Dowex 1) 3x суміші ферменту (одержаної в кіназному буфері 3X), 5 мкл/ямку, 33 2) 3x суміші субстрату й АТФ (одержаної в ddН2O), разом з P-γ-АТФ, 5 мкл/ямку, 3) 3x випробовуваної сполуки (розведеної в ddН2O-3 % DMSO), 5 мкл/ямку. Розведення сполук і схема аналізу описані нижче i. Розведення сполук 10 мМ вихідних розчинів випробовуваних сполук у 100 % DMSO розподіляли в 96-ямкові мікротитрувальні планшети формату 128. Для дослідження % інгібування підготовляли планшети з окремими розведеннями при 1 мМ, 100 мкM і 10 мкM у 100 % DMSO, потім розбавляли при 3X концентрації (30, 3 і 0,3 мкM) у ddН2O, 3 % DMSO. Для розведень використовували Multimek 96 (Beckman) і сполуку додавали через піпетку в планшети для випробувань. Для визначення ІК50 сполуки одержували у вигляді 1 мМ, 100 % DMSO розчинів, додавали в першу колонку мікротитрувального планшета (A1-G1), 100 мкл. Biomek 2000 (Beckman) використовували для серійних 1:3 розведень у воді, 3 % DMSO, від колонки A1 до A10 і для всіх семи сполук у планшеті. У стандартному експерименті найвища концентрація всіх сполук складала 30 мкм, і потім розбавляли з одержанням кінцевої випробовуваної суміші до 10 мкм. ii. Схема аналізу 384-ямкові планшети з V-подібним дном (планшети для випробувань) підготовляли з розведенням сполуки 5 мкл (3X) і потім поміщали на роботизовану установку Plate Trаk 12 (Perkin Elmer; робот мав одну головку для піпетування з 384 наконечниками для початку аналізу плюс одну головку з 96 наконечниками для розподілу смоли) разом з одним резервуаром для суміші ферменту (3X) і одним для суміші АТФ (3X). На початку експерименту робот аспірував 5 мкл суміші АТФ, робив повітряний простір усередині наконечників (3 мкл) і аспірував 5 мкл 14 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 60 суміші PLK-1. Наступний розподіл у планшети давав початок кіназної реакції після 3 циклів змішування, здійснюваних за допомогою робота. У цей момент відновлювали потрібну концентрацію для всіх реагентів. Робот здійснював інкубацію планшетів протягом 60 хвилин при кімнатній температурі і потім зупиняв реакцію шляхом піпетування 70 мкл суспензії смоли dowex у реакційну суміш. Відразу після додавання смоли здійснювали три цикли змішування. Ще один цикл змішування здійснювали після зупинення всіх планшетів, цього разу з використанням нормальних наконечників: планшетам потім давали вистоятися протягом близько однієї години для максимального захоплення АТФ. У цей момент 20 мкл супернатанту переносили в 384-ямкові планшети Optiplates (Perkin-Elmer), з 70 мкл Microscint 40 (PerkinElmer); після 5 хвилин струшування на орбітальному шейкері планшети зчитували з використанням лічильника радіоактивності Perkin-Elmer Top Count. iii. Аналіз даних Дані аналізували з використанням адаптованого для цього пакета програм "Assay Explorer", який забезпечував або % інгібування для первинних аналізів, або сигмоїдальні припасування кривих десяти розведень для визначення ІК50 для вторинних аналізів/рутинних методів підтвердження успіху експерименту. Біохімічний аналіз визначення активності інгібіторів Aurora-2 кінази In vitro аналіз інгібування кінази здійснювали в такий же спосіб, як описано для ферменту PLK-1. i. Кіназний буфер (KB) для Aurora-2 Кіназний буфер складався з 50 мМ HEPES, pН 7,0, 10 мМ MgCl2, 1 мМ DTT, 3 мкM NaVO3 і 0,2 мг/мл BSA. ii. Умови аналізу для Aurora-2 (кінцеві концентрації) Кіназний аналіз здійснювали з використанням концентрації ферменту 2,5 нМ, 10 мкM АТФ, 1 33 нМ P--АТФ і 8 мкM субстрату, що складається з 4 LRRWSLG повторів. Аналіз інгібування активності Cdk2/Циклін A Кіназна реакція: 1,5 мкM субстрату гістон H1, 25 мкM АТФ (0,2 мкКі P33-АТФ), 30 нг бакуловірус-коекспресованого Cdk2/Циклін A, 10 мкM інгібітору в кінцевому об'ємі 100 мкл буфера (TRIS HCl 10 мМ pН 7,5, MgCl2 10 мМ, 7,5 мМ DTT) додавали в кожну ямку 96-ямкового планшета з U-подібним дном. Після інкубації протягом 10 хвилин при 37 °C реакцію зупиняли за допомогою 20 мкл EDTA 120 мм. Захоплення: 100 мкл переносили з кожної ямки в MultiScreen планшет для забезпечення можливості зв'язування субстрату з фосфоцелюлозним фільтром. Планшети потім промивали 3 ++ ++ рази за допомогою PBS, що не містить Ca /Mg , 150 мкл/ямку, і фільтрували з використанням системи фільтрації MultiScreen. In vitro аналіз клітинної проліферації Клітини A2780 раку яєчників людини і MCF7 раку молочної залози людини (1250 клітин/ямку) висівали в білі 384-ямкові планшети в повне середовище (RPMI 1640 або EMEM плюс 10 % фетальної бичачої сироватки) і обробляли сполуками, розчиненими в 0,1 % DMSO, через 24 години після висівання. Клітини інкубували при 37 °C і 5 % CO2 і через 72 години планшети обробляли з використанням набору для аналізу CellTiter-Glo (Promega), додержуючись інструкцій виготовлювача. CellTiter-Glo являє собою гомогенний метод, оснований на визначенні кількості присутнього АТФ, індикатора метаболічно активних клітин. Кількість АТФ визначають з використанням системи на основі люциферази і D-люциферину, які забезпечують генерацію світла. Люмінісцентний сигнал є пропорційним кількості клітин, присутніх у культурі. Коротко, 25 мкл/ямку розчину реагенту додавали в кожну ямку і після 5 хвилин струшування мікропланшети зчитували з використанням люмінометра. Люмінесцентний сигнал є пропорційним кількості клітин, присутніх у культурі. Беручи до уваги описані вище аналізи інгібування, в результаті було визначено, що сполуки формули (I) за даним винаходом мають чудову активність інгібування PLK, типово з ІК50 менше ніж 0,07 мкM. Дивіться, як приклад, представлену нижче Таблицю A, яка включає експериментальні дані для деяких репрезентативних сполук формули (I) за даним винаходом (значення кодів див. у розділі Приклади), які були випробувані в біохімічному аналізі як інгібітори PLK-1 і в аналізі проліферації клітин A2780 (ІК50 мкМ), у порівнянні зі сполукою, відомою з рівня техніки як найближчий аналог, що описаний у зазначеному вище WO 04/104007, стор. 105, Таблиця IX, сполука B08-X00-M00(C01)-D03. 15 UA 102219 C2 Таблиця A Код Посилальна сполука А85В1С1Z А97В1С1Z А51В5С1Z А4В1С1Z А51В2С1Z А51В10С1Z А45В2С1Z А98В1С3Z А51В1С1Z А51В1С3Z А51В9С1Z А85В1С4Z А113В1С1Z А101В1С1Z А47В1С1Z 5 10 15 20 25 30 35 40 PLK-1 ІК50 (мкМ) Біохімічний аналіз 0,070 0,010 0,002 0,003 0,014 0,005 0,001 0,026 0,005 0,001 0,010 0,013 0,026 0,008 0,046 0,007 A2780 ІК50 (мкМ) Аналіз клітинної проліферації 1,1 0,010 0,020 0,042 0,80 0,013 0,010 0,50 1,30 0,008 0,086 0,031 0,10 0,036 0,520 0,147 До подиву, інгібіторна активність сполук за даним винаходом відносно PLK-1 виявилася значно вище, ніж активність посилальної сполуки. Таким чином, несподівано виявилося, що нові сполуки за даним винаходом мають активність інгібування PLK-1, яка суттєво вище активності структурно близької сполуки попереднього рівня техніки, описаної в зазначеному вище WO 04/104007, і, таким чином, є особливо корисними для використання в терапії, проти проліферативних розладів, пов'язаних із залежною від зміненого клітинного циклу кіназною активністю. Сполуки за даним винаходом можна вводити або як окремий засіб, або, альтернативно, у сполученні з відомим протираковими лікуваннями, такими як режим радіаційної терапії або хіміотерапії, у сполученні з цитостатичними або цитотоксичними засобами, засобами типу антибіотиків, алкілуючими засобами, антиметаболітами, гормональними засобами, імунологічними засобами, засобами типу інтерферону, інгібіторами циклооксигенази (наприклад, інгібіторами COX-2), інгібіторами металопротеази матриксу, інгібіторами теломерази, інгібіторами тирозинових кіназ, засобами проти рецептора фактора росту, антиHER засобами, анти-EGFR засобами, засобами проти ангіогенезу (наприклад, інгібіторами ангіогенезу), інгібіторами фарнезилтрансферази, інгібіторами шляху сигнальної трансдукції rasraf, інгібіторами клітинного циклу, іншими інгібіторами cdk, засобами, що зв'язують тубулін, інгібіторами топоізомерази I, інгібіторами топоізомерази II і подібними засобами. Якщо їх формулюють у вигляді фіксованої дози, такі комбіновані продукти включають сполуки за даним винаходом в дозах, що знаходяться в межах, які описані нижче, і інший фармацевтично активний засіб у дозах, що знаходяться в межах, які вважаються прийнятними. Сполуки формули (I) можна використовувати послідовно з відомими протираковими засобами, коли комбінована композиція не є прийнятною. Сполуки формули (I) за даним винаходом, придатні для введення ссавцю, наприклад, людині, можна вводити з використанням звичайних шляхів введення, і рівень доз залежить від віку, маси тіла, стану пацієнта і шляху введення. Наприклад, придатна доза, прийнята для перорального введення сполуки формули (I), може знаходитися в межах від близько 10 до близько 500 мг у розрахунку на дозу, від 1 до 5 разів на день. Сполуки за даним винаходом можна вводити в різних лікарських формах, наприклад, перорально, у формі таблеток, капсул, таблеток з цукровим або плівковим покриттям, рідких розчинів або суспензій; ректально у формі супозиторіїв; парентерально, наприклад, внутрішньом'язово або через внутрішньовенну і/або інтратекальну, і/або інтраспінальну ін'єкцію або інфузію. Даний винахід також включає фармацевтичні композиції, що включають сполуку формули (I) або її фармацевтично прийнятну сіль в асоціації з фармацевтично прийнятним ексципієнтом, який може являти собою носій або розріджувач. Фармацевтичні композиції, що містять сполуки за даним винаходом, звичайно одержують, додержуючись традиційних способів, і вводять у придатній фармацевтичній формі. Наприклад, тверді пероральні форми можуть містити, разом з активною сполукою, розріджувачем, 16 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 наприклад, лактозу, декстрозу, сахарозу, целюлозу, кукурудзяний крохмаль або картопляний крохмаль; мастильні речовини, наприклад, діоксид кремнію, тальк, стеаринову кислоту, стеарат магнію або кальцію і/або поліетиленгліколі; сполучні, наприклад, крохмалі, аравійську камедь, желатин, метилцелюлозу, карбоксиметилцелюлозу або полівінілпіролідон; розпушувачі, наприклад, крохмаль, альгінову кислоту, альгінати або натрійкрохмальгліколят; шипучі суміші; барвники; підсолоджувачі; змочувальні речовини, такі як лецитин, полісорбати, лаурилсульфати; і, як правило, нетоксичні і фармакологічно неактивні речовини, використовувані у фармацевтичних композиціях. Ці фармацевтичні препарати можуть бути одержані відомим способом, наприклад, шляхом змішування, гранулювання, таблетування, способами нанесення цукрового покриття або нанесення плівкового покриття. Рідкі дисперсії для перорального введення можуть являти собою, наприклад, сиропи, емульсії і суспензії. Як приклад, сиропи можуть містити, як носій, сахарозу або сахарозу з гліцерином і/або манітом і сорбітом. Суспензії й емульсії можуть містити, як приклади носіїв, природну смолу, агар, альгінат натрію, пектин, метилцелюлозу, карбоксиметилцелюлозу або полівініловий спирт. Суспензія або розчини для внутрішньом'язових ін'єкцій містять, разом з активною сполукою, фармацевтично прийнятний носій, наприклад, стерильну воду, маслинову олію, етилолеат, гліколі, наприклад, пропіленгліколь, і, якщо це бажано, придатну кількість лідокаїнгідрохлориду. Розчини для внутрішньовенних ін'єкцій або інфузій можуть містити, як носій, стерильну воду або, переважно, вони можуть бути у формі стерильних водних ізотонічних фізіологічних розчинів, або вони можуть містити пропіленгліколь як носій. Супозиторії можуть містити, разом з активною сполукою, фармацевтично прийнятний носій, наприклад, масло какао, поліетиленгліколь, поверхнево-активну речовину на основі складного ефіру поліоксіетилену і жирних кислот сорбітану або лецитин. Для кращої ілюстрації даного винаходу, без якого-небудь його обмеження, представлені наступні приклади. Приклади Синтетичне одержання деяких сполук формули (I) за даним винаходом описане в наступних прикладах. Усі сполуки зручним чином і однозначно позначені з використанням кодової системи (див. таблицю IV нижче), деякі з них перераховані і зазначені також відповідно до їх хімічної назви, тоді як інші зручним чином і однозначно позначені з використанням кодової системи, 1 разом з їх даними H-ЯМР або даними ВЕРХ/Мас. (див. таблиці V-XX нижче). Кожен код, який однозначно визначає одну конкретну сполуку формули (I), складається з чотирьох одиниць A-BC-Z. Код A представляє будь-який R1 замісник, як у формулі (I), приєднаний до іншої частини молекули в положенні 8; кожна група A представлена за допомогою відповідної хімічної формули в таблиці I нижче, що також указує точку її приєднання до іншої частини молекули. Код B представляє R2 групу, приєднану до іншої частини молекули через атом азоту піразолу, як у формулі (I). Кожна група B представлена за допомогою відповідної хімічної формули в таблиці II нижче, що також указує точку її приєднання до іншої частини молекули. Код C представляє групу R3, приєднану до іншої частини молекули в положенні 3, як у формулі (I). Кожна група C представлена за допомогою відповідної хімічної формули в таблиці III нижче, що також указує точку її приєднання до іншої частини молекули. Кожна специфічна група A B і C представлена і послідовно пронумерована в представлених нижче таблицях I, II і III, відповідно. Нарешті, код Z стосується центрального ядра молекули (I). З вищесказаного фахівцям у даній галузі повинно бути зрозуміло, що Z заміщений групою R1 (код A), R2 (код B) і R3 (код C), як визначено у формулі (I), також указуючи положення інших замісників. Тому систему кодів, використовувану в даній заявці для деяких сполук формули (I), можна коротко представити в такий спосіб: . Тільки як приклад, який не призначений для обмеження обсягу даного винаходу, сполука A45B8C2Z (див. приклад) являє собою піразолохіназолінове похідне формули (I), де центральне ядро представлене фрагментом Z, R1 являє собою групу формули A45 з таблиці I, 17 UA 102219 C2 R2 являє собою групу формули B8 з таблиці II, R3 являє собою групу формули C2 з таблиці III, що має формулу: , Таблиця I 18 UA 102219 C2 19 UA 102219 C2 20 UA 102219 C2 Таблиця II Таблиця III 21 UA 102219 C2 Таблиця IV A1B1C1Z A2B1C1Z A3B1C1Z A4B1C1Z A5B1C1Z A6B1C1Z A7B1C2Z A8B1C2Z A8B1C3Z A8B1C1Z A7B1C1Z A9B1C1Z A10B1C1Z A11B1C1Z A12B1C2Z A13B1C1Z A14B1C1Z A15B1C1Z A16B1C1Z A17B1C1Z A18B1C1Z A19B1C1Z A20B1C1Z A21B1C2Z A22B1C1Z A23B1C2Z A24B1C1Z A25B1C1Z A21B1C3Z A21B1C1Z A26B1C1Z A27B1C1Z A28B1C1Z A29B1C1Z A30B1C1Z A31B1C1Z 5 10 15 20 A32B1C1Z A33B1C1Z A34B1C1Z A35B1C2Z A36B1C1Z A35B1C1Z A37B1C2Z A37B1C3Z A37B1C1Z A38B1C2Z A2B2C1Z A39B1C1Z A39B2C1Z A40B1C1Z A40B2C1Z A39B1C2Z A39B1C3Z A41B1C1Z A42B1C1Z A43B1C4Z A44B1C1Z A45B1C1Z A45B1C2Z A45B6C2Z A45B8C2Z A45B3C1Z A45B2C1Z A45B8C3Z A45B8C1Z A45B4C1Z A45B5C1Z A43B1C2Z A43B1C5Z A43B1C1Z A46B1C1Z A47B1C1Z A48B1C1Z A39B1C4Z A48B1C2Z A50B1C1Z A35B1C3Z A51B1C2Z A51B1C3Z A51B1C1Z A52B1C1Z A53B1C1Z A54B1C1Z A55B1C1Z A56B1C1Z A57B1C1Z A58B1C1Z A59B1C1Z A60B1C1Z A61B1C1Z A62B1C1Z A63B1C1Z A64B1C1Z A65B1C1Z A66B1C1Z A67B1C1Z A68B1C1Z A69B1C1Z A70B1C1Z A71B1C1Z A72B1C1Z A73B1C1Z A74B1C1Z A75B1C1Z A76B1C1Z A77B1C1Z A78B1C1Z A79B1C1Z A80B1C3Z A81B1C3Z A82B1C1Z A83B1C1Z A51B6C1Z A84B1C1Z A85B1C2Z A85B1C3Z A85B1C1Z A86B1C1Z A87B1C1Z A88B1C1Z A51B8C1Z A89B1C4Z A89B1C6Z A51B2C1Z A51B7C1Z A90B1C2Z A90B1C3Z A91B1C1Z A92B1C1Z A93B1C1Z A85B1C4Z A51B1C4Z A89B1C1Z A48B1C4Z A89B1C3Z A102B1C1Z A103B1C1Z A51B1C7Z A49B1C2Z A49B1C3Z A49B1C1Z A94B1C1Z A95B1C1Z A96B1C1Z A97B1C1Z A98B1C2Z A98B1C3Z A98B1C1Z A49B8C2Z A49B7C2Z A49B7C1Z A49B7C3Z A99B1C1Z A100B1C1Z A101B1C1Z A104B1C2Z A105B1C1Z A106B1C1Z A107B1C1Z A108B1C1Z A109B1C1Z A110B1C1Z A111B1C1Z A112B1C1Z A49B8C3Z A49B8C1Z A51B5C2Z A51B5C3Z A51B5C1Z A51B8C1Z A51B9C1Z A51B10C1Z A113B1C1Z A114B1C1Z A49B6C1Z A49B4C1Z A51B4C1Z A49B11C1Z A51B11C1Z A51B12C1Z A51B13C1Z A115B1C1Z A116B1C1Z A117B1C1Z A51B14C1Z A118B1C1Z A51B15C1Z A85B1C8Z A51B8C2Z A51B8C3Z A102B5C1Z A103B5C1Z Сполуки за даним винаходом, одержані згідно з наступними прикладами, також були 1 охарактеризовані за допомогою аналітичних даних H ЯМР або ВЕРХ/МС; дані ВЕРХ/МС одержували, додержуючись одного зі способів 1, 2, 3 і 4. ВЕРХ/МС Аналітичний спосіб 1 Устаткування для ВЕРХ складалося з системи ВЕРХ Waters Acкв.uity™, яка була оснащена детектором 2996 Waters PDA і одним квадрупольним мас-спектрометром Micromass мод. ZQ, оснащеним джерелом іонізації електроспреєм (ESI). Контроль устаткування, збір даних і обробку даних здійснювали за допомогою Empower і програми MassLynx 4.0. ВЕРХ здійснювали при 45 °C, при швидкості потоку 0,8 мл/хв., використовуючи колонку BEH C18 1,7 мкм Waters Acкв.uity HPLC (2,150 мм). Рухома фаза A являла собою буфер мурашиної кислоти 0,1 % pН=3,3 з ацетонітрилом (98:2), і рухома фаза B являла собою H 2О/ацетонітрил (5:95); використовували градієнт від 5 до 95 % B протягом 2 хвилин, потім утримування при 95 % B протягом 0,1 хвилини. Об'єм проби, що вводиться, був 2 мкл. Роботу мас-спектрометра здійснювали в режимі позитивної і негативної іонізації, капілярна напруга була встановлена при + 3,5 кв (ES ) і 28 В (ES ); температура джерела складала 120 °C; напруга на конусі була 14 В + (ES ) і 2,8 кв (ES ); був установлений режим повної розгортки, масовий діапазон від 100 до 800 amu (атомних одиниць маси). ВЕРХ/МС Аналітичний спосіб 2 22 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 55 60 Устаткування для ВЕРХ складалося з системи ВЕРХ Waters 2795 Alliance HT, яка була оснащена детектором 2996 Waters PDA і одним квадрупольним мас-спектрометром Micromass мод. ZQ, оснащеним джерелом іонізації електроспреєм (ESI). Контроль устаткування, збір даних і обробку даних здійснювали за допомогою Empower і програми MassLynx 4.0. ВЕРХ здійснювали при 30 °C при швидкості потоку 1,0 мл/хв., використовуючи колонку C18, 3 мкм Phenomenex (4,650 мМ). Рухома фаза A являла собою буфер ацетату амонію 5 мМ pН=5,2 з ацетонітрилом (95:5), і рухома фаза B являла собою H 2О/ацетонітрил (5:95); використовували градієнт від 10 до 90 % B протягом 8 хвилин, потім рівномірне підвищення до 100 % B протягом 1,0 хвилин. Об'єм проби, що вводиться, був 10 мкл. Роботу мас-спектрометра здійснювали в режимі позитивної і негативної іонізації, капілярна напруга була встановлена при + 3,5 кв (ES ) і 28 В (ES ); температура джерела складала 120 °C; напруга на конусі була 14 В + (ES ) і 2,8 кв (ES ); був установлений режим повної розгортки, масовий діапазон від 100 до 800 amu (атомних одиниць маси). ВЕРХ/МС Аналітичний спосіб 3 Устаткування для ВЕРХ складалося з системи ВЕРХ Waters Acкв.uity™, яка була оснащена детектором 2996 Waters PDA і одним квадрупольним мас-спектрометром Micromass мод. ZQ, оснащеним джерелом іонізації електроспреєм (ESI). Контроль устаткування, збір даних і обробку даних здійснювали за допомогою Empower і програми MassLynx 4.0. ВЕРХ здійснювали при 45 °C, при швидкості потоку 0,8 мл/хв., використовуючи колонку BEH C18 1,7 мкм Waters Acкв.uity HPLC (2,150 мм). Рухома фаза A являла собою буфер гідроксиду амонію 0,05 % pН=10 з ацетонітрилом (95:5), і рухома фаза B являла собою H2О/ацетонітрил (5:95); використовували градієнт від 5 до 95 % B протягом 2 хвилин, потім утримування при 95 % B протягом 0,1 хвилини. Об'єм проби, що вводиться, був 2 мкл. Роботу мас-спектрометра здійснювали в режимі позитивної і негативної іонізації, капілярна напруга була встановлена при + 3,5 кв (ES ) і 28 В (ES ); температура джерела складала 120 °C; напруга на конусі була 14 В + (ES ) і 2,8 кв (ES ); був установлений режим повної розгортки, масовий діапазон від 100 до 800 amu (атомних одиниць маси). ВЕРХ/МС Аналітичний спосіб 4 Устаткування для ВЕРХ складалося з системи ВЕРХ Waters 2790, яка була оснащена детектором 2996 Waters PDA і одним квадрупольним мас-спектрометром Micromass мод. ZQ, оснащеним джерелом іонізації електроспреєм (ESI). Контроль устаткування, збір даних і обробку даних здійснювали за допомогою Empower і програми MassLynx 4.0. ВЕРХ здійснювали при 25 °C, при швидкості потоку 1 мл/хв., використовуючи колонку RP 18 Waters X Terra (3,020 мм). Рухома фаза A являла собою буфер гідроксиду амонію 0,05 % pН=10 з ацетонітрилом (95:5), і рухома фаза B являла собою H 2О/ацетонітрил (5:95); використовували градієнт від 10 до 90 % B протягом 4 хвилин, потім утримування при 90 % B протягом 1 хвилини. Об'єм проби, що вводиться, був 10 мкл. Роботу мас-спектрометра здійснювали в режимі позитивної і негативної іонізації, капілярна напруга була встановлена при 2,5 кв; температура джерела складала 120 °C; напруга на конусі була 10 В; був установлений режим повної розгортки, масовий діапазон від 100 до 800 amu (атомних одиниць маси). Деякі сполуки формули (I) за даним винаходом, одержані відповідно до представлених нижче прикладів, були очищені за допомогою препаративної ВЕРХ. Робочі умови визначені нижче: ВЕРХ/МС Препаративний спосіб 1 Устаткування для ВЕРХ складалося з системи ВЕРХ Waters 2790, яка була оснащена детектором 2996 Waters PDA і одним квадрупольним мас-спектрометром Micromass мод. ZQ, оснащеним джерелом іонізації електроспреєм (ESI). Контроль устаткування, збір даних і обробку даних здійснювали за допомогою Empower і програми MassLynx 4.0. ВЕРХ здійснювали при 25 °C, при швидкості потоку 20 мл/хв., використовуючи колонку RP 18 Waters X Terra 10 мкм (19250 мм). Рухома фаза A являла собою буфер гідроксиду амонію 0,05 % pН=10 з ацетонітрилом (95:5), і рухома фаза B являла собою ацетонітрил; використовували градієнт від 10 до 90 % B протягом 15 хвилин, потім утримання при 90 % B протягом 3 хвилин. Об'єм проби, що вводиться, був 10 мкл. Роботу мас-спектрометра здійснювали в режимі позитивної і негативної іонізації, капілярна напруга була встановлена при 2,5 кв; температура джерела складала 120 °C; напруга на конусі була 10 В; був установлений режим повної розгортки, масовий діапазон від 100 до 800 amu (атомних одиниць маси). ВЕРХ/МС Препаративний спосіб 2 Устаткування для ВЕРХ складалося з системи ВЕРХ Waters 2790, яка була оснащена детектором 2996 Waters PDA і одним квадрупольним мас-спектрометром Micromass мод. ZQ, 23 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 оснащеним джерелом іонізації електроспреєм (ESI). Контроль устаткування, збір даних і обробку даних здійснювали за допомогою Empower і програми MassLynx 4.0. ВЕРХ здійснювали при 25 °C, при швидкості потоку 20 мл/хв., використовуючи колонку RP 18 Waters X Terra 10 мкм (19250 мм). Рухома фаза A являла собою 0,1 % трифтороцтової кислоти у воді/ацетонітрилі (95:5), і рухома фаза B являла собою ацетонітрил; використовували градієнт від 10 до 90 % B протягом 15 хвилин, потім утримування при 90 % B протягом 3 хвилин. Об'єм проби, що вводиться, був 10 мкл. Роботу мас-спектрометра здійснювали в режимі позитивної і негативної іонізації, капілярна напруга була встановлена при 2,5 кв; температура джерела складала 120 °C; напруга на конусі була 10 В; був установлений режим повної розгортки, масовий діапазон від 100 до 800 amu (атомних одиниць маси). Приклад 1 Етил 1-метил-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилат 30 г (0,125 моль) етил (3-етокси-2-оксоциклогекс-3-ен-1-іл)(оксо)ацетату розчиняли в 150 мл льодяної оцтової кислоти і додавали 6,5 мл метилгідразину (0,125 моль). Суміш перемішували при кімнатній температурі протягом 6 годин. Розчинник потім випарювали і неочищену речовину повторно розчиняли у воді, підлуговували за допомогою 30 % розчину NH4OH і екстрагували дихлорметаном. Органічний шар потім сушили над Na2SO4 і концентрували. Залишок кристалізували з діетилового ефіру з одержанням 19,2 г (вихід 68 %) зазначеної в заголовку сполуки. 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,12 (т, J=6,89 Гц, 3H) 1,51 (т, J=6,94 Гц, 3H) 2,06-2,58 (м, 4H) 3,57 (м, 1H) 3,86 (кв., J=6,83 Гц, 2H) 4,38 (кв., J=6,94 Гц, 2H) 6,09 (м, 1H). Згідно з тим же способом, але використовуючи придатним чином заміщене гідразинове похідне, одержували наступні сполуки: етил 1-(2-гідроксіетил)-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилат 1 H ЯМР (400 МГц), ДМСО-d6) м.ч.: 1,3 (т, J=7,20 Гц, 3H) 1,9-2,9 (3м, 6H) 3,7 (м, 2H) 4,3 (кв., J=7,20 Гц, 2H) 4,53 (т, J=5,85, 2H) 4,77 (т, J=5,73, OH); етил 1-(2-фторетил)-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилат; етил 1-етил-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилат 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,13 Гц, 3H) 1,38-1,42 (м, 3H) 2,73-2,79 (м, 2H) 2,90-2,96 (м, 2H) 4,30 (кв., J=7,07 Гц, 2H) 4,81 (кв., J=7,19 Гц, 2H) 6,59 (ушир.с, 2H) 8,19 (с, 1H); етил 1-ізопропіл-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилат. Приклад 2 Етил 7-оксо-1-тритил-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилат Стадія 1. Етил 7-оксо-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилат 10,0 г (42 ммоль) етил (3-етокси-2-оксоциклогекс-3-ен-1-іл)(оксо)ацетату розчиняли в 100 мл етанолу, додавали 2,1 мл гідразингідрату і розчин перемішували при кип'ятінні зі зворотним холодильником протягом одного дня. Розчинник потім випарювали і залишок повторно розчиняли з дихлорметаном. Органічний шар промивали водою, сушили над Na2SO4 і концентрували. Неочищену речовину розтирали в порошок з діетиловим ефіром і фільтрували з одержанням 6,0 г зазначеної в заголовку сполуки (вихід 70 %). 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,28 (т, J=7,07 Гц, 3H) 2,04 (м, 2H) 2,51 (м, 2H) 2,87 (т, J=6,10 Гц, 2H) 4,27 (кв., J=7,11 Гц, 2H) 14,39 (с, 1H). Стадія 2. Етил 7-оксо-1-тритил-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилат 2,08 г (10,0 ммоль) етил 7-оксо-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилату розчиняли в 100 мл дихлорметану і 0,76 мл триетиламіну і додавали 3,07 г (11,0 ммоль) трифенілметилхлориду. Розчин перемішували при кімнатній температурі протягом 6 годин. Потім розчин розбавляли дихлорметаном і промивали водою. Органічний шар обробляли за допомогою безводного Na2SO4 і упарювали досуха. Кінцевий продукт одержували за допомогою кристалізації з діетилового ефіру (3,24 г, вихід 72 %). 24 UA 102219 C2 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,25 (т, J=7,01 Гц, 3H) 2,16 (м, 2H) 2,48 (м, 2H) 2,98 (т, J=6,10 Гц, 2H) 4,25 (кв., J=7,01 Гц, 2H) 6,92-7,33 (2м, 15H). Приклад 3 Етил 6-[(диметиламіно)метилен]-1-метил-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3карбоксилат 1 5 10 15 20 25 30 35 40 45 50 16 г (72 ммоль) етил 1-метил-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилату розчиняли в 100 мл диметилформаміду і додавали 32 мл диметилформамід-ди-третбутилацеталю. Суміш перемішували при 60 °C протягом 8 годин. Розчинник потім випарювали у вакуумі і продукт кристалізували з етанолу з одержанням зазначеної в заголовку сполуки (17,96 г, вихід 90 %). 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,31 (т, J=7,07 Гц, 3H) 2,83 (м, 2H) 2,92 (м, 2H) 3,13 (с, 6H) 4,14 (с, 3H) 4,24 (кв., J=7,07 Гц, 2H) 7,49 і 7,52 (2с, 1H). Здійснюючи обробку відповідно до того ж способу, одержували наступні сполуки: етил 6-[(диметиламіно)метилен]-7-оксо-1-тритил-4,5,6,7-тетрагідро-1H-індазол-3карбоксилат 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,30 (т, J=7,07 Гц, 3H) 2,75 (м, 2H) 2,91 (м, 2H) 2,94 (с, 6H) 4,21 (кв., J=7,07 Гц, 2H) 6,90-7,30 (м, 15H) 7,47 і 7,54 (2с, 1H); етил 6-[(диметиламіно)метилен]-1-(2-гідроксіетил)-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3карбоксилат 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 2,80 (т, J=6,34 Гц, 2H) 2,88 (т, J=6,21, 2H) 3,70 (м, 2H) 4,24 (кв., J=7,07 Гц, 3H) 4,58 (т, J=5,97 Гц, 2H) 4,79 (ушир.с, OH) 7,47 (ушир.с, 1H); етил 6-[(диметиламіно)метилен]-1-(2-фторетил)-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3карбоксилат; етил 6-[(диметиламіно)метилен]-1-етил-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3-карбоксилат; етил 6-[(диметиламіно)метилен]-1-ізопропіл-7-оксо-4,5,6,7-тетрагідро-1H-індазол-3карбоксилат. Приклад 4 Етил 8-аміно-1-метил-1H-піразоло[4,3-h]хіназолін-3-карбоксилат До розчину 16,62 г (60 ммоль) етил 6-[(диметиламіно)метилен]-7-оксо-1-метил-4,5,6,7тетрагідро-1H-індазол-3-карбоксилату в 0,5 л ДМФА додавали 27 г (150 ммоль) гуанідинкарбонату. Суміш перемішували при 110 °C протягом ночі. Після охолодження суміш вливали у воду (2,5 л) і перемішували протягом 30 хвилин. Осад фільтрували, промивали водою і сушили з одержанням 26,83 г зазначеної в заголовку сполуки (91 %). 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,07 Гц, 3H) 2,76 (м, 2H) 2,93 (м, 2H) 4,25 (кв., J=7,07 Гц, 2H) 4,30 (с, 3H) 6,57 (ушир.с, 2H) 8,19 (м, 1H). Здійснюючи обробку відповідно до того ж способу, одержували наступні сполуки: етил 8-аміно-1-тритил-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,29 (т, J=7,07 Гц, 3H) 2,62 (м, 2H) 2,98 (м, 2H) 4,26 (кв., J=7,07 Гц, 2H) 6,45 (ушир.с, 2H) 7,06-7,45 (м, 15H) 7,94 (с, 1H); етил 8-аміно-1-(2-гідроксіетил)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,07 Гц, 3H) 2,76 (т, J=7,68 Гц, 2H) 2,94 (т, J=7,50 Гц, 2H) 3,79-3,88 (м, 2H) 4,30 (кв., J=7,07 Гц, 2H) 4,80 (т, J=5,79 Гц, 1H) 4,84 (т, J=5,97 Гц, 2H) 6,55 (с, 2H) 8,19 (с, 1H); етил 8-аміно-1-(2-фторетил)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат; етил 8-аміно-1-етил-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,13 Гц, 3H) 1,38-1,42 (м, 3H) 2,73-2,79 (м, 2H) 2,90-2,96 (м, 2H) 4,30 (кв., J=7,07 Гц, 2H) 4,81 (кв., J=7,19 Гц, 2H) 6,59 (ушир.с, 2H) 8,19 (с, 1H); етил 8-аміно-1-ізопропіл-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат; 25 UA 102219 C2 5 10 15 20 25 30 35 40 45 50 етил 8-(5-бром-2-трифторметоксифеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3карбоксилат (A49B8C2Z) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,34 (т, J=7,13 Гц, 3H) 2,89 (м, 2H) 2,99 (м, 2H) 4,33 (кв., J=7,13 Гц, 2H) 7,34 (м, 2H) 8,31 (с, 1H) 8,43 (м, 1H) 8,70 (с, 1H) 9,06 (с, 1H) 14,28 (ушир.с, 1H); етил 8-[5-(4-метилпіперазин-1-іл)-2-трифторметоксифеніламіно]-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксилат (A51B8C2Z) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,1 Гц, 3H) 2,25 (с, 3H) 2,46 (м, 4H) 2,84 (м, 2H) 2,98 (м, 2H) 3,15 (м, 4H) 4,19 (с, 3H) 4,31 (кв., J=7,1 Гц, 2H) 6,79 (м, 1H) 7,20 (м, 1H) 7,30 (м, 1H) 8,38 (ушир.с, 1H) 8,94 (с, 1H); етил 8-[2-метокси-5-бромфеніламіно]-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат (A118B1C2Z) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,07 Гц, 3H) 2,88 (д, J=7,93 Гц, 2H) 2,96-3,03 (м, 2H) 3,88 (с, 3H) 4,30 (кв., J=7,15 Гц, 2H) 4,34 (с, 3H) 7,03 (д, J=8,78 Гц, 1H) 7,19 (дд, J=8,66, 2,44 Гц, 1H) 8,26 (с, 1H) 8,37 (д, J=2,44 Гц, 1H) 8,47 (с, 1H). Приклад 5 Етил 8-йод-1-метил-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат До ретельно перемішуваної суспензії етил 8-аміно-1-метил-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксилату (9,0 г, 33 ммоль) у диметоксіетані (0,7 л), в атмосфері N 2, послідовно додавали йодид цезію (8,6 г, 33 ммоль), бісублімований йод (4,19 г, 16,5 ммоль), йодид міді (2,0 г, 10 ммоль) і ізопентилнітрит (6,62 мл, 49,5 ммоль). Реакційну суміш ретельно перемішували при 65-70 °C протягом 3 годин. Після охолодження в бані лід-вода тверду речовину відфільтровували. Фільтрат розбавляли дихлорметаном (2,0 л), промивали 30 % розчином гідроксиду амонію (150 мл), тіосульфатом натрію (300 мл), насиченим сольовим розчином, сушили над безводним Na2SO4 і концентрували з одержанням 5,69 г зазначеної в заголовку сполуки (вихід 46 %). 1 H ЯМР (400 МГц, ДМСО-d6), м.ч.: 1,28 (т, J=7,07 Гц, 3H) 2,81-3,07 (2т, J=8,90 Гц, 4H) 4,24 (с, 3H) 4,27 (кв., J=7,07 Гц, 2H) 8,5 (ушир.с, 1H). Здійснюючи обробку відповідно до цього способу, одержували наступні сполуки: етил 8-йод-1-тритил-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,28 (т, J=7,07 Гц, 3H) 2,77 (м, 2H) 3,06 (м, 2H) 4,28 (кв., J=7,07 Гц, 2H) 7,06-7,28 (м, 15H) 8,21 (с, 1H); етил 8-йод-1-(2-гідроксіетил)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат; етил 8-йод-1-(2-фторетил)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат; етил 8-йод-1-етил-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,28-1,35 (м, 3H) 1,42 (т, J=7,19 Гц, 3H) 2,89-2,97 (м, 2H) 2,99-3,05 (м, 2H) 4,26-4,34 (м, 2H) 4,69 (кв., J=7,19 Гц, 2H) 8,48 (с, 1H); етил 8-йод-1-ізопропіл-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилат. Приклад 6 Етил 1-метил-8-(2-трет-бутоксикарбоніламінофеніламіно)-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксилат (A12B1C2Z) Ацетат паладію [Pd(OAc)2] (101 мг, 0,45 ммоль), (+)-BINAP (280 мг, 0,45 ммоль) і диметилформамід (65 мл) завантажували в круглодонну колбу після її продування аргоном. З колби відкачували газ і знову заповнювали аргоном. Суміш перемішували в атмосфері аргону протягом 30 хвилин і додавали до суміші 2-(трет-бутоксикарбоніламіно)аніліну (2,6 г, 12,5 ммоль), етил 8-йод-1-метил-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3-карбоксилату (1,6 г, 4,16 ммоль) і карбонату калію (5,74 г, 41,6 ммоль) у диметилформаміді (50 мл). Одержану суміш перемішували при 70 °C протягом 6 годин в атмосфері аргону. Після охолодження до кімнатної температури реакційну суміш фільтрували на шарі целіту. Розчинник концентрували, неочищену тверду речовину очищали за допомогою флеш-хроматографії на силікагелі (елюент: гексан/етилацетат 60/40) з одержанням 1,18 г (61 % вихід) зазначеної в заголовку сполуки. 26 UA 102219 C2 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,1 Гц, 3H) 1,46 (с, 9H) 2,84 (м, 4H) 2,96 (м, 2H) 4,20 (с, 3H) 4,30 (кв., J=7,1 Гц, 2H) 7,12 (м, 2H) 7,51 (м, 1H) 7,71 (м, 1H) 8,38 (с, 1H) 8,65 (с, 1H) 8,60 (с, 1H). Здійснюючи обробку відповідно до описаного вище способу, одержували наступні сполуки: 1 5 Таблиця V Код Дані ЯМР H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,30 (т, J=7,1 Гц, 2,84 (м, 2H) 2,97 (м, 2H) 4,18 (с, 3H) 4,29 (кв., J=7,1 Гц, 2Н) 7,23 (м, 1H) 7,40 (м, 2H) 7,85 (м, 1H) 8,38 (с, 1H) 9,08 (с, 1Н) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,30 (т, J=7,07 Гц, 3H) 2,86 (м, 2H) 2,99 (м, 2H) 4,23 (с, 3H) 4,30 (кв., J=7,07 Гц, 2Н) 7,61 (м, 1H) 7,64 (м, 1H) 7,91 (м, 1H) 8,41 (с, 1H) 9,25 (с, 1Н) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,30 (т, J=7,1 Гц, 3H) 2,23 (с, 3H) 2,47 (м, 4H) 2,80 (м, 2H) 2,95 (м, 2H) 3,15 (м, 4H) 4,16 (с, 3H) 4,28 (кв., J=7,1 Гц, 2H) 6,87 (д, J=2,7 Гц, 1H) 6,96 (дд, J=9,1 і 2,7 Гц, 1H) 7,48 (д, J=9,1 1H) 8,30 (ушир.с, 1H) 8,79 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,1 Гц, 3H) 2,25 (с, 3H) 2,46 (м, 4H) 2,84 (м, 2H) 2,98 (м, 2H) 3,15 (м, 4H) 4,19 (с, 3H) 4,31 (кв., J=7,1 Гц, 2H) 6,79 (м, 1H) 7,20 (м, 1H) 7,30 (м, 1H) 8,38 (ушир.с, 1H) 8,94 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,31 (т, J=7,1 Гц, 3H) 2,25 (с, 3H) 2,47 (м, 4H) 2,54 (с, 3H) 2,90 (м, 2H) 2,99 (м, 2H) 3,37 (м, 4H) 4,30 (кв., J=7,1 Гц, 2H) 4,36 (с, 3H) 6,61 (дд, J=9,27 і 2,56 Гц, 1H) 7,86 (д, J=9,27 Гц, 1H) 8,28 (д, J=2,56 Гц, 1H) 8,53 (ушир.с, 1H) 12,12 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,31 (т, J=7,07 Гц, 3H) 2,23 (с, 3H) 2,44-2,48 (м, 4H) 2,83 (т, J=7,62 Гц, 2H) 2,97 (т, J=7,87 Гц, 2H) 2,99-3,02 (м, 4H) 3,78 (с, 3H) 4,29 (кв., J=7,07 Гц, 2H) 4,28 (с, 3H) 6,59 (дд, J=8,78, 2,93 Гц, 1H) 6,91 (д, J=8,90 Гц, 1H) 7,68 (д, J=2,80 Гц, 1H) 8,11 (с, 1H) 8,39 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,30 (т, J=7,07 Гц, 3H) 2,28 (ушир.с, 3H) 2,83 (т, J=7,68 Гц, 2H) 2,96 (т, J=7,38 Гц, 2H) 3,20 (ушир.с, 2 H) 4,17 (с, 3H) 4,28 (кв., J=7,15 Гц, 2H) 7,25-7,30 (м, 1H) 7,29 (ушир.с, 1H) 7,41 (д, J=9,75 Гц, 1H) 8,34 (с, 1H) 9,31 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) 5 м.ч.: 1,28 (т, J=7,07 Гц, 3H) 2,77 (м, 2H) 3,06 (м, 2H) 4,28 (кв., J=7,07 Гц, 2H) 7,06-7,28 (м, 16H) 7,40 (м, 2H) 7,85 (м, 1H) 8,38 (с, 1H) 9,08 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,31 (т, J=7,13 Гц, 3H) 2,83-2,89 (м, 2H) 2,943,01 (м, 2H) 4,26 (с, 3H) 4,30 (кв., J=7,13 Гц, 2H) 7,37 (д, J=0,85 Гц, 2H) 8,26 (т, J=1,28 Гц, 1H) 8,45 (с, 1H) 9,29 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,30 (т, J=7,07 Гц, 3H) 2,12 (с, 3H) 2,22 (с, 3H) 2,42-2,47 (м, 4H) 2,80 (т, J=7,68 Гц, 2H) 2,92-2,97 (м, 2H) 3,03-3,08 (м, 4H) 4,14 (с, 3H) 4,28 (кв., J=7,15 Гц, 1H) 6,67 (дд, J=8,29, 2,56 Гц, 1H) 7,01 (д, J=2,56 Гц, 1H) 7,05 (д, J=8,78 Гц, 1H) 8,30 (с, 1H) 8,68 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,25 (т, J=7,13 Гц, 3H) 1,32 (т, J=7,07 Гц, 3H) 2,84-2,89 (м, 2H) 2,95-3,01 (м, 2H) 4,30 (кв., J=7,15 Гц, 2H) 4,64 (кв., J=7,19 Гц, 2H) 7,37-7,41 (м, 1H) 7,41-7,45 (м, 1H) 8,07 (д, J=2,20 Гц, 1H) 8,45 (с, 1H) 9,29 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,29 (т, J=7,07 Гц, 3H) 2,77 (м, 2H) 3,06 (м, 2H) 4,28 (кв., J=7,07 Гц, 2H) 7,06-7,28 (м, 15H) 7,28-7,38 (м, 2H) 8,33 (с, 1H) 8,58 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,31 (т, J=7,07 Гц, 3H) 2,29 (с, 3H) 2,43-2,49 (м, 2H) 2,55-2,60 (м, 2H) 2,80-2,88 (м, 2H) 2,94-3,00 (м, 2H) 3,00-3,05 (м, 2H) 4,15 (с, 3H) 4,29 (кв., J=7,07 Гц, 2 H) 6,13-6,21 (м, 1H) 7,25-7,31 (м, 1H) 7,32-7,38 (м, 1H) 7,83 (д, J=2,19 Гц, 1H) 8,39 (с, 1H) 9,10 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,31 (т, J=7,13 Гц, 3H) 1,74-1,87 (м, 2H) 1,992,08 (м, 2H) 2,80-2,89 (м, 6H) 2,95-3,01 (м, 2H) 3,02-3,14 (м, 2H) 3,49-3,56 (м, 2H) 4,20 (с, 3H) 4,29 (кв., J=7,11 Гц, 2H) 7,10 (дд, J=8,29, 2,32 Гц, 1H) 7,36-7,41 (м, 1H) 7,71 (д, J=2,19 Гц, 1H) 8,40 (с, 1H) 9,12 (с, 1H) 1 A45B1C2Z A43B1C2Z A48B1C2Z A51B1C2Z A39B1C2Z A85B1C2Z A90B1C2Z A45B6C2Z A49B1C2Z A98B1C2Z A49B7C2Z A49B6C2Z A113B1C2Z A114B1C2Z 27 UA 102219 C2 Приклад 7 Гідрохлорид етил 1-метил-8-(2-амінофеніламіно)-4,5-дигідро-1H-піразоло[4,3-h]хіназолін-3карбоксилату (A7B1C2Z) 5 10 15 20 25 0,85 г (1,83 ммоль) етил 1-метил-8-(2-трет-бутоксикарбоніламінофеніламіно)-4,5-дигідро-1Hпіразоло[4,3-h]хіназолін-3-карбоксилату розчиняли в 50 мл дихлорметану, до розчину додавали 30 мл 4н розчину HCl у діоксані. Розчин перемішували при кімнатній температурі 2 години і розчинник видаляли у вакуумі. Залишок кристалізували з діетилового ефіру з одержанням 0,70 г зазначеної в заголовку сполуки (вихід 96 %). 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: (у вигляді вільної основи) 1,32 (т, J=7,1 Гц, 3H) 2,82 (м, 4H) 2,96 (м, 2H) 4,19 (с, 3H) 4,28 (кв., J=7,1 Гц, 2H) 4,85 (ушир.с, 2H) 6,58 (м, 1H) 6,76 (м, 1H) 6,90 (м, 1H) 7,32 (м, 1H) 8,32 (с, 1H) 8,52 (с, 1H). Приклад 8 Етил 1-метил-8-[2-(3-метилбутириламіно)-феніламіно]-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксилат (A35B1C2Z) До розчину гідрохлориду етил 1-метил-8-(2-амінофеніламіно)-4,5-дигідро-1H-піразоло[4,3h]хіназолін-3-карбоксилату (0,25 г, 0,62 ммоль) і DIPEA (0,44 мл, 2,56 ммоль) у метиленхлориді (25 мл) в атмосфері азоту додавали ізовалерилхлорид (0,076 мл, 0,62 ммоль), розчинений у метиленхлориді (1 мл). Через 1 годину реакційну суміш концентрували. Флеш-хроматографія на силікагелі (елюент: дихлорметан/метанол 98:2) давала 140 мг зазначеної в заголовку сполуки (вихід 44 %). 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 0,93 (д, J=6,6 Гц, 6H) 1,32 (т, J=7,07 Гц, 3H) 2,06 (м, 1H) 2,24 (д, J=12 Гц, 2H) 2,84 (м, 2H) 2,97 (м, 2H) 4,18 (с, 3H) 4,30 (кв., J=7,12 Гц, 1H) 7,21 (м, 1H) 7,23 (м, 1H) 7,43 (д, J=7,7 Гц, 1H) 7,80 (д, J=7,7 Гц, 1H) 8,37 (с, 1H) 8,47 (ушир.с, 1H) 9,68 (ушир.с, 1H). Здійснюючи обробку відповідно до описаного вище способу, після одержання хлорангідриду карбонової кислоти з відповідної карбонової кислоти, одержували наступні сполуки: Таблиця VI Код Дані ЯМР H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,30 (т, J=7,07 Гц, 3H) 2,07 (с, 3H) 2,83 (м, 2H) 2,95 (м, 2H) 4,18 (с, 3H) 4,28 (кв, J=7,07 Гц, 1H) 7,09 (м, 1H) 7,17 (м, 1H) 7,48 (д, J=7,7 Гц, 1H) 7,77 (д, J=1,1 Гц, 1H) 8,37 (с, 1H) 8,58 (ушир.с, 1H) 9,62 (ушир.с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,19 Гц, 3H) 2,07 (с, 3H) 2,85 (м, 2H) 2,97 (м, 2H) 3,55 (кв., J=1,22 Гц, 2H) 4,16 (с, 3H) 4,29 (кв., J=7,19 Гц, 1H) 7,15 (м, 1H) 7,22 (м, 1H) 7,60 (дд, J=7,93 1,46 Гц, 1H) 7,73 (дд, J=7,93 1,46 Гц, 1H) 8,39 (с, 1H) 8,59 (ушир.с, 1H) 9,82 (ушир.с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,07 Гц, 3H) 2,84 (м, 2H) 2,96 (м, 2H) 3,38 (с, 3H) 4,20 (с, 3H) 4,30 (кв., J=7,07 Гц, 1H) 6,09 (м, 1H) 6,89 (м, 1H) 7,02 (м, 1H) 7,16 (м, 1H) 7,23 (м, 1H) 7,53 (м, 1H) 7,80 (м, 1H) 8,38 (с, 1H) 8,70 (с, 1H) 9,56 (с, 1H) 1 H ЯМР (400 МГц, ДМСО-d6) м.ч.: 1,32 (т, J=7,07 Гц, 3H) 2,84 (м, 2H) 2,97 (м, 2H) 4,21 (с, 3H) 4,29 (кв., J=7,07 Гц, 1H) 6,17 (м, 1H) 6,89 (м, 1H) 6,98 (м, 1H) 7,17 (м, 1H) 7,25 (м, 1H) 7,52 (м, 1H) 7,83 (м, 1H) 8,37 (с, 1H) 8,72 (с, 1H) 9,68 (с, 1H) 11,78 (с, 1H) 1 A21B1C2Z A38B1C2Z A37B1C2Z A8B1C2Z 30 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstotuted pyrazolo-quinazoline derivatives, process for the preparation and use thereof as kinase inhibitors
Автори англійськоюCaruso, Michele, Beria, Italo, Brasca, Maria Gabriella, Ferguson, Ron, Posteri, Helena, Valsasina, Barbara
Назва патенту російськоюЗамещенные пиразолохиназолиновые производные, способ их получения и их применения как ингибиторов киназы
Автори російськоюКарузо Микеле, Берия Итало, Браска Мария Габриэлла, Фергюсон Рон, Постери Елена, Вальсазина Барбара
МПК / Мітки
МПК: C07D 295/135, A61P 35/00, C07D 295/155, C40B 40/04, A61K 31/519, C07D 487/04
Мітки: кінази, застосування, піразолохіназолінові, одержання, інгібіторів, спосіб, похідні, заміщені
Код посилання
<a href="https://ua.patents.su/65-102219-zamishheni-pirazolokhinazolinovi-pokhidni-sposib-kh-oderzhannya-i-kh-zastosuvannya-yak-ingibitoriv-kinazi.html" target="_blank" rel="follow" title="База патентів України">Заміщені піразолохіназолінові похідні, спосіб їх одержання і їх застосування як інгібіторів кінази</a>
Попередній патент: Спосіб визначення критичного зниження частоти обертання вала у робочій машині та робоча машина
Наступний патент: Спосіб синтезу агомелатину
Випадковий патент: Індукторний трифазний різнополюсний вентильний генератор












